Ablación por radiofrecuencia percutánea en un feocromocitoma adrenal con invasión de la vena cava caudal
Ablación por radiofrecuencia percutánea en un feocromocitoma adrenal con invasión de la vena cava caudal
Introducción
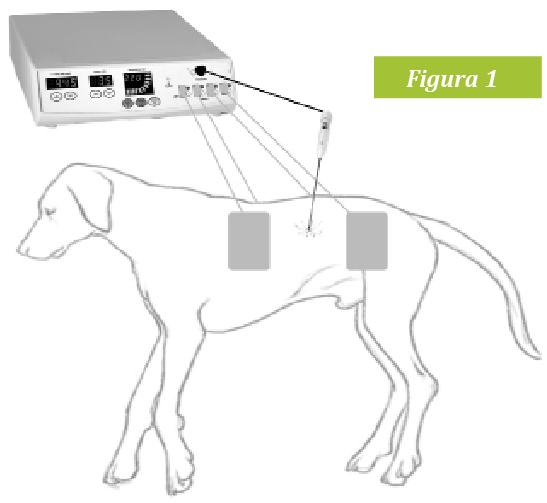
La ablación por radiofrecuencia percutánea (ARF) es un tipo de tratamiento local antitumoral muy usado en medicina humana. El uso del calor para la coagulación de tejidos vivos se menciona por primera vez en papiros egipcios cerca del año 3000 AC. La aplicación de la radiofrecuencia para calentar el tejido la realizó por primera vez d’Arsonval en 1891 comprobando como una corriente alterna de alta frecuencia no causaba contracciones musculares o dolor pero sí elevaba la temperatura a su paso por los tejidos. El daño celular comienza por encima de los 42ºC; el tejido debe ser expuesto a esa temperatura durante largos períodos de tiempo, (de 3 a 50 horas dependiendo del tejido). Conforme se aumenta la temperatura hay una bajada exponencial del tiempo que se necesita para una respuesta citodestructiva. Por ejemplo, temperaturas superiores a 51ºC destruyen células con sólo 2 minutos de exposición y subiendo por encima de 60ºC empiezan a desnaturalizarse proteínas intracelulares, las bicapas lipídicas se funden y la muerte celular es inevitable. Curiosamente, las células neoplásicas son más resistentes al frío que las normales, sin embargo, presentan mayor sensibilidad al daño térmico por calor. Para conseguir este daño térmico se introduce una aguja o electrodo en forma de aguja en la zona elegida y se conecta a un generador de radiofrecuencia. Este produce una corriente alterna de alta frecuencia y como los tejidos conducen relativamente mal la corriente ejercen resistencia al paso de la misma. Los iones y las móleculas de agua se mueven y agitan intentando adaptarse al sentido de la corriente eléctrica, generando fricción y calor. Esta agitación iónica y el aumento de temperatura es proporcional a la intensidad de la corriente. La electricidad sigue su camino hasta unos dispersores colocados en la superficie del paciente. Estos, al tener gran superficie, disipan la energía sin generarse un aumento de temperatura significativo (Fig 1).
 En la bibliografía de medicina humana hay multitud de referencias de este procedimiento para gran variedad de tumores. Desde carcinomas hepatocelulares, masas pulmonares, adrenales, renales, intestinales, sarcomas, tumores productores de osteoide, etc. En medicina veterinaria éste es el primer artículo que describe su uso en un feocromocitoma adrenal.
En la bibliografía de medicina humana hay multitud de referencias de este procedimiento para gran variedad de tumores. Desde carcinomas hepatocelulares, masas pulmonares, adrenales, renales, intestinales, sarcomas, tumores productores de osteoide, etc. En medicina veterinaria éste es el primer artículo que describe su uso en un feocromocitoma adrenal.
Nuestro equipo ha empleado con éxito esta tecnología desde hace dos años en 116 casos de diversa índole. Entre las neoplasias tratadas se encuentran tumores adrenales corticales (Cushing adrenal) y medulares, masas hepáticas, insulinomas pancreáticos, masas perianales, masas de base cardiaca (quimiodectomas), metástasis hepáticas, metástasis en linfonodos periportales e iliacos, sarcomas superficiales, melanomas y carcinomas prostáticos.
Los objetivos que se persiguen con esta técnica son diferentes en función de la localización y tamaño de la neoplasia. Los candidatos ideales son tumores menores de 3,5 cm que no estén cerca de grandes vasos. En éstos se puede conseguir una ablación completa con márgenes. Si el tumor excede estas dimensiones es complicado conseguir una ablación completa, considerándose una técnica paliativa para reducir el tamaño y hacerlo más abordable quirúrgicamente, disminuir el efecto compresivo que esté generando o conseguir un control de la actividad biológica del tumor . En el caso de que la neoplasia esté cerca de vasos sanguíneos éstos actuarán como disipadores del calor, haciendo que las células cercanas al vaso estén refrigeradas y no mueran.
La ARF no es una técnica excluyente y debe unirse a un abordaje oncológico médico y quirúrgico. En medicina humana esta técnica se realiza en muchas ocasiones junto a embolizaciones vasculares o con quimioterapia adyuvante. En nuestro caso, dado que se trata de una terapia nueva en veterinaria, decidimos emplear los siguiente criterios de inclusión:
- Todos los casos presentaban clínica asociada a la neoplasia: compresión o invasión de estructuras (grandes vasos, colon, estómago).
- En todos los casos se evaluó previamente la posibilidad de resección quirúrgica: siendo rechazada por el propietario o por el cirujano.
- En el caso descrito a continuación la masa presentaba un gran tamaño e invadía la vena cava caudal. Debido al papel refrigerador del flujo de la vena cava sobre el trombo oncogénico se acordó con los propietarios únicamente ablacionar la glándula adrenal e ir reevaluando el tamaño del trombo.
Caso Clínico
Se presenta Spike, un perro de 12 años cruce de Setter inglés entero de 22kg y con historia clínica de epixtasis y hematuria. Tanto el análisis hematológico como la bioquímica y las serologías realizadas eran normales. Se registró una presión arterial elevada (220 mmHg-100 mmHg) a la que se achacaron las hemorragias. A continuación se realizaron radiografías de tórax, en las que no se encontraron alteraciones, y una ecografía abdominal. En ésta se apreció la glándula adrenal izquierda incrementada de tamaño (3cm), redondeada, sin calcificaciones y muy vascularizada. El crecimiento adrenal invadía la vena cava caudal desde la vena frenicoabdominal, ocupando prácticamente la totalidad del diámetro de la cava. Para una mejor caracterización de la invasión vascular se utilizó ecografía 3D. En el momento de la exploración no se apreciaba líquido libre en abdomen.
Para el diagnóstico se tomó una muestra citológica mediante punción ecoguiada primero de la masa adrenal y posteriormente del trombo oncogénico usando una aguja 27G. Además, se extrajo sangre para la determinación de metanefrinas.
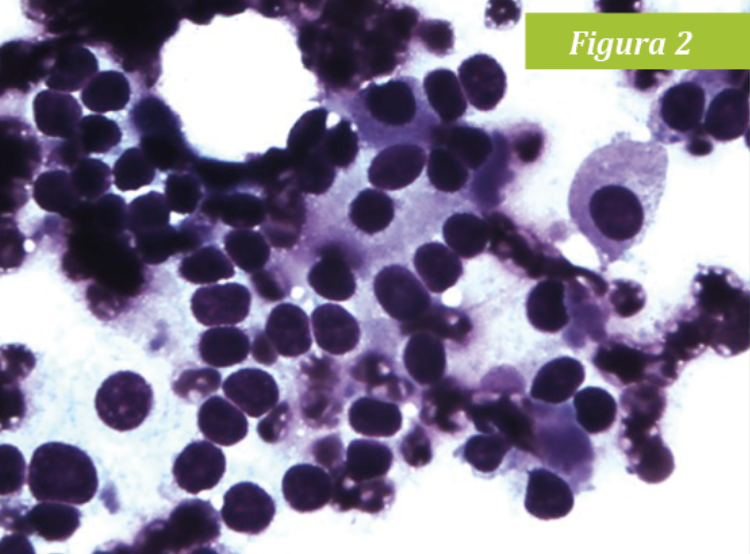
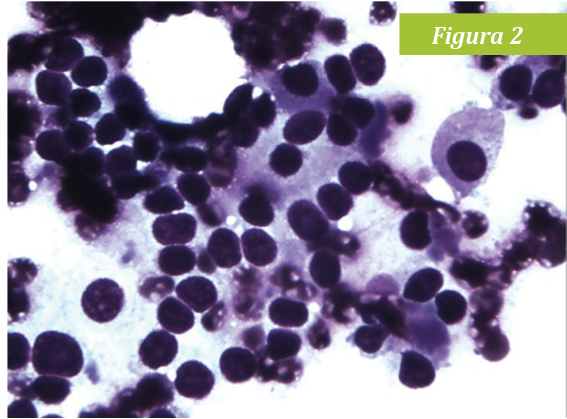 En ambas citologías se observaron abundantes núcleos desnudos con patrón neuroendocrino. Las células intactas presentaban bordes redondeados y un citoplasma azul claro con núcleos redondos a ovales con nucleolo. La anisocitosis y anisocariosis eran leves y el ratio núcleo:citoplasma moderado. Estos hallazgos son compatibles, con una neoplasia de origen medular, feocromocitoma (Fig 2). Los niveles de catecolaminas fraccionadas en plasma estaban muy elevados: metanefrina libre en plasma 9,15 nmol/l(0,68-3,08) y normetanefrina libre en plasma 15,28 nmol/l(1,59-4,17).
En ambas citologías se observaron abundantes núcleos desnudos con patrón neuroendocrino. Las células intactas presentaban bordes redondeados y un citoplasma azul claro con núcleos redondos a ovales con nucleolo. La anisocitosis y anisocariosis eran leves y el ratio núcleo:citoplasma moderado. Estos hallazgos son compatibles, con una neoplasia de origen medular, feocromocitoma (Fig 2). Los niveles de catecolaminas fraccionadas en plasma estaban muy elevados: metanefrina libre en plasma 9,15 nmol/l(0,68-3,08) y normetanefrina libre en plasma 15,28 nmol/l(1,59-4,17).
Tras la confirmación diagnóstica, se medicó al paciente con prazosina durante las dos semanas previas a la ablación. Para la ARF se utilizó un electrodo de LeVeen de 4 cm englobando la masa y el pedículo de la vena frenicoabdominal. El paciente se encontraba bajo anestesia general y con monitorización completa, no apareciendo complicaciones. Una de las ventajas de la ARF es que se trata de una técnica ambulatoria en la mayoría de los casos. Por tanto tras finalizar el procedimiento y recuperarse de la anestesia Spike recibió el alta.
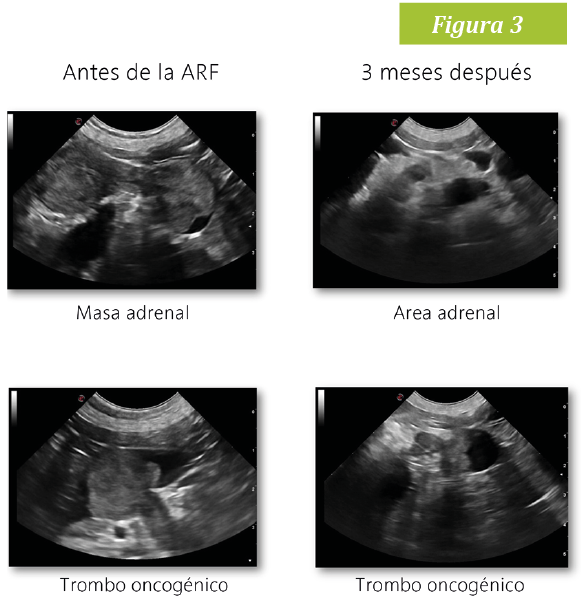
Se realizó un seguimiento mensual del paciente durante 3 meses en los que no recibió medicación alguna. A los 30 días de la ablación la masa presentaba un cambio notable en tamaño y ecogenicidad: había reducido su tamaño de 3 cm a 7 mm, además presentaba áreas hiperecogénicas y una retracción del 20% en el diámetro del trombo. Al tercer mes no pudo identificarse la masa, sin embargo, en el espacio que ocupaba la adrenal había un área hiperecogénica de 3mm. La invasión de la cava había quedado reducida a la entrada de la vena frenicoabdominal (Fig 3). En las tres revisiones el paciente presentó unos valores de presión arteriales normales y ausencia de signos clínicos. Un año después Spike sigue sin signos clínicos.
 Discusión
Discusión
En medicina humana la ablación por radiofrecuencia (ARF) es una técnica utilizada en neoplasias adrenales, consiguiendo mejorías tanto en el efecto masa, como en el control de la actividad biológica y en la supervivencia.
El feocromocitoma es un tumor de células cromafines de escasa prevalencia con un manejo clínico complejo. En el caso expuesto se ha utilizado ARF para paliar el efecto masa sobre la vena cava caudal y minimizar la actividad biológica del tumor. Los propietarios y el equipo quirúrgico consultado rechazaron un abordaje quirúrgico. Dado el tamaño de la masa con la invasión en la vena cava caudal la ARF no puede considerarse un método curativo ya que el flujo de la vena hace que las células tumorales cercanas se refrigeren y no mueran durante el proceso. Apreciamos una desaparición de la masa adrenal y una gran reducción del trombo oncogénico, que puede deberse a una muerte celular secundaria a la ablación del pedículo al suprimir parte de la vascularización del trombo. La ARF produce una primera necrosis por coagulación del diámetro del electrodo empleado (si el algoritmo de subida de potencia se realiza correctamente) y una necrosis secundaria por isquemia en los tejidos circundantes dependientes de los pequeños vasos que se consigan necrosar.
En medicina humana se describen picos de hipertensión sistémica por liberación de catecolaminas como una complicación frecuente durante el procedimiento. Para minimizar esta posibilidad se premedicó al paciente con prazosina durante 2 semanas y se dispuso durante la ARF de hidralazina y esmolol para el control de posibles elevaciones de la presión o de la frecuencia cardiaca. Para la punción con aguja fina no se realizó ningún tratamiento previo. En nuestra experiencia, usando agujas de 27G y realizando una punción cuidadosa no hemos observado variaciones de presión pre y post punción en ninguno de los pacientes puncionados.
Conclusión
En medicina humana la ablación por radiofrecuencia (ARF) es una técnica utilizada en neoplasias adrenales, consiguiendo mejorías tanto en el efecto masa, como en el control de la actividad biológica y en la supervivencia. En este caso la ARF resultó de gran utilidad para paliar, en un acto ambulatorio, los signos clínicos secundarios al feocromocitoma, obteniéndose una reduccion significativa de la neoplasia y del trombo oncogénico.
Autores
Gómez Ochoa P, Barbero Fernández A, Alférez Reyes MD, Zoco Herrero G, Sanmartin Arroita U, Melendez Lazo A.
VetCorner
email: vetcornerzaragoza@gmail.com
Av. Rodríguez Ayuso 44. 50012 Zaragoza
Material multimedia
Bibliografía
- Image-guided ablation of adrenal lesions.
- Yamakado K.
- Semin Intervent Radiol. 2014 Jun;31(2):149-56. doi: 10.1055/s-0034-1373797. Review.
- Imaging-guided adrenal tumor ablation.
- Uppot RN, Gervais DA.
- AJR Am J Roentgenol. 2013 Jun;200(6):1226-33. doi: 10.2214/AJR.12.10328. Review.
- Percutaneous ablation of functioning adrenal adenoma: a report on 11 cases and a review of the literature.
- Nunes TF, Szejnfeld D, Xavier AC, Kater CE, Freire F, Ribeiro CA, Goldman SM.
- Abdom Imaging. 2013 Oct;38(5):1130-5. doi: 10.1007/s00261-013-9995-6. Review.
- Cushing syndrome treated by radiofrequency ablation of adrenal gland adenoma.
- Nishi N, Tanaka J, Minagawa A.
- Jpn J Radiol. 2012 Apr;30(3):274-6. doi: 10.1007/s11604-011-0017-8. Epub 2012 Jan 25.
- Radiofrequency ablation: a novel approach for treatment of metastatic pheochromocytoma.
- Pacak K, Fojo T, Goldstein DS, Eisenhofer G, Walther MM, Linehan WM, Bachenheimer L, Abraham J, Wood BJ.
- J Natl Cancer Inst. 2001 Apr 18;93(8):648-9. No abstract available.
- Radiofrequency ablation of metastatic pheochromocytoma.
- Venkatesan AM, Locklin J, Lai EW, Adams KT, Fojo AT, Pacak K, Wood BJ.
- J Vasc Interv Radiol. 2009 Nov;20(11):1483-90. doi: 10.1016/j.jvir.2009.07.031.
- Unresectable Adrenal Metastases: Clinical Outcomes of Radiofrequency Ablation.
- Hasegawa T, Yamakado K, Nakatsuka A, Uraki J, Yamanaka T, Fujimori M, Miki M, Sasaki T, Sakuma H, Sugimura Y.
- Radiology. 2015 Nov;277(2):584-93. doi: 10.1148/radiol.2015142029. Epub 2015 May 21.
- Percutaneous Image-Guided Thermal Ablation for Multif Percutaneous radiofrequency ablation of lung metastases from colorectal carcinoma under C-arm cone beam CT guidance.
- Amouyal G, Pernot S, Déan C, Cholley B, Scotté F, Sapoval M, Pellerin O.
- Diagn Interv Imaging. 2017 May 29. pii: S2211-5684(17)30124-9. doi: 10.1016/j.diii.2017.05.002.
- Local Renal Cell Carcinoma: 10-Year Experience at a Single Center.
- Zhou W, Uppot RN, Feldman AS, Arellano RS.
- AJR Am J Roentgenol. 2017 Jul 5:1-7. doi: 10.2214/AJR.17.18290.
- Image-Guided Percutaneous Radiofrequency Ablation of Central Renal Cell Carcinoma: Assessment of Clinical Efficacy and Safety in 31 Tumors.
- Dai Y, Covarrubias D, Uppot R, Arellano RS.
- J Vasc Interv Radiol. 2017 Jul 1. pii: S1051-0443(17)30480-3. doi: 10.1016/j.jvir.2017. 05.006.
- Long-term survival of hepatocellular carcinoma after percutaneous radiofrequency ablation guided by ultrasound.
- Zhang W, Luo E, Gan J, Song X, Bao Z, Zhang H, Chen M.
- World J Surg Oncol. 2017 Jul 5;15(1):122. doi: 10.1186/s12957-017-1189-1.
- Effects of radiofrequency ablation versus other ablating techniques on hepatocellular carcinomas: a systematic review and meta-analysis.
- Luo W, Zhang Y, He G, Yu M, Zheng M, Liu L, Zhou X.
- World J Surg Oncol. 2017 Jul 10;15(1):126. doi: 10.1186/s12957-017-1196-2.
- Osteoid osteoma – radiofrequency ablation treatment guided by computed tomography: a case series.
- Endo RR, Gama NF, Nakagawa SA, Tyng CJ, Chung WT, Pinto FFE.
- Rev Bras Ortop. 2017 Apr 28;52(3):337-343. doi: 10.1016/j.rboe.2017.04.005. eCollection 2017 May-Jun.
- Clinical outcomes of percutaneous radiofrequency ablation for small renal cancer.
- Ito K, Soga S, Seguchi K, Shinchi Y, Masunaga A, Tasaki S, Kuroda K, Sato A, Asakuma J, Horiguchi A, Shinmoto H, Kaji T, Asano T.
- Oncol Lett. 2017 Jul;14(1):918-924. doi: 10.3892/ol.2017.6262. Epub 2017 May 26.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía