Carcinoma prostático canino tratado con TOCERANIB Y FIROCOXIB
Resumen
El carcinoma de próstata es poco frecuente en la especie canina afectando tanto a machos enteros como esterilizados. El diagnóstico en la mayoría de los casos se realiza cuando la enfermedad está avanzada. La prostatectomía como tratamiento no proporciona buenos resultados y tiene efectos adversos indeseables. Se describe el caso de un paciente de 12 años, raza Basset Hound, con carcinoma de próstata, su diagnóstico mediante biopsia ecoguiada, el tratamiento con toceranib y firocoxib y evaluación de su respuesta al mismo mediante un seguimiento ecográfico y sintomatología. Se ha demostrado que la angiogénesis juega un papel importante en el desarrollo de estos tumores, por lo que el tratamiento con medicamentos antiangiogénicos nos proporciona nuevas opciones terapéuticas. Actualmente hay distintas líneas de investigación para el diagnóstico precoz de cáncer prostático canino mediante técnicas no invasivas utilizando distintos marcadores, al igual que se hace con cáncer de próstata en hombres y que nos ayudará en un futuro a distinguir entre hiperplasias benignas y neoplasias.
Introducción
La glándula prostática es la única glándula sexual de los machos caninos. Está localizada en el espacio retroperitoneal caudal a vejiga, en el área del cuello y uretra proximal, cubierta cráneo-dorsalmente por el peritoneo y ventralmente por tejido adiposo. Dorsalmente se encuentra unida al recto por una banda fibrosa. Tiene forma bilobulada con un septo en la superficie dorsal.
Las patologías que afectan a la próstata canina son frecuentes en pacientes a partir de los 10 años7. El cáncer prostático es infrecuente, teniendo una prevalencia del 0,2 al 0,6 % basándose en estudios de necropsia1 y un 5% del total de patologías prostáticas2. La mayoría de los tumores prostáticos son localmente invasivos y metastáticos siendo las localizaciones más frecuentes ganglios linfáticos, pulmones y esqueleto axial.
Caso clínico
 Se presentó a consulta Indy (fig 1), Basset Hound macho esterilizado de doce años, con historia de constipación y heces aplastadas desde hace una semana. En la anamnesis la propietaria indica que se comió un pájaro y desde entonces comenzó con los problemas. Está correctamente vacunado y desparasitado, alimentación con pienso alta gama. Orina con normalidad, no refiere poliuria/polidipsia. El paciente es hipotiroideo controlado, tratado con Levotiroxina (Leventa, MSD®) dosis de 12 mcgr/Kg/24 horas desde hace dos años y condriotin sulfato y glucosamina (Cosequin, Bioibérica®) desde hace un año. También presenta edema corneal leve bilateral desde hace un año de curso crónico por distrofia endotelial senil.
Se presentó a consulta Indy (fig 1), Basset Hound macho esterilizado de doce años, con historia de constipación y heces aplastadas desde hace una semana. En la anamnesis la propietaria indica que se comió un pájaro y desde entonces comenzó con los problemas. Está correctamente vacunado y desparasitado, alimentación con pienso alta gama. Orina con normalidad, no refiere poliuria/polidipsia. El paciente es hipotiroideo controlado, tratado con Levotiroxina (Leventa, MSD®) dosis de 12 mcgr/Kg/24 horas desde hace dos años y condriotin sulfato y glucosamina (Cosequin, Bioibérica®) desde hace un año. También presenta edema corneal leve bilateral desde hace un año de curso crónico por distrofia endotelial senil.
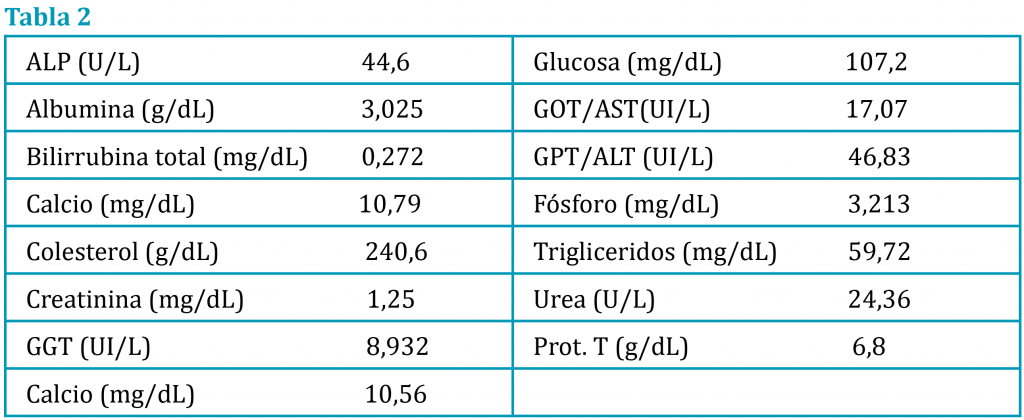
 A la exploración su peso era 26 kg, condición corporal 5/9, temperatura rectal 38,3, abdomen blando y depresible con molestia dorso caudal, no se palpan heces y la vejiga vacía. Se realiza diagnóstico diferencial de posibles causas constipación y heces aplanadas, entre patologías que afectan a la luz del colon y recto (cuerpos extraños, neoplasias, granulomas o divertículos) y patologías extraluminales (próstata, masa perirrectal o perianal o hernia perineal). Realizamos una palpación rectal (fig. 2), encontrando el recto vacío de contenido, sin masas ni divertículos evidentes, y sacos anales con algo de contenido que se vacía sin dificultad. La palpación columna no dolorosa, la exploración neurológica de miembros pélvicos es adecuada y el reflejo anal normal y con buen tono, no siendo sospechosa las disfunciones neuromusculares como causa probable. Se realiza hemograma (tabla 1), bioquímica (tabla 2), urianálisis (tabla 3) y niveles de tiroxina en sangre (0,91 ng/dl), por si hubiera una descompensación de la enfermedad tiroidea y un examen fecal para descartar parásitos o visualizar restos de material ingerido. En la analítica de orina se observa una orina isostenúrica con hematuria y sedimento con abundante celularidad.
A la exploración su peso era 26 kg, condición corporal 5/9, temperatura rectal 38,3, abdomen blando y depresible con molestia dorso caudal, no se palpan heces y la vejiga vacía. Se realiza diagnóstico diferencial de posibles causas constipación y heces aplanadas, entre patologías que afectan a la luz del colon y recto (cuerpos extraños, neoplasias, granulomas o divertículos) y patologías extraluminales (próstata, masa perirrectal o perianal o hernia perineal). Realizamos una palpación rectal (fig. 2), encontrando el recto vacío de contenido, sin masas ni divertículos evidentes, y sacos anales con algo de contenido que se vacía sin dificultad. La palpación columna no dolorosa, la exploración neurológica de miembros pélvicos es adecuada y el reflejo anal normal y con buen tono, no siendo sospechosa las disfunciones neuromusculares como causa probable. Se realiza hemograma (tabla 1), bioquímica (tabla 2), urianálisis (tabla 3) y niveles de tiroxina en sangre (0,91 ng/dl), por si hubiera una descompensación de la enfermedad tiroidea y un examen fecal para descartar parásitos o visualizar restos de material ingerido. En la analítica de orina se observa una orina isostenúrica con hematuria y sedimento con abundante celularidad.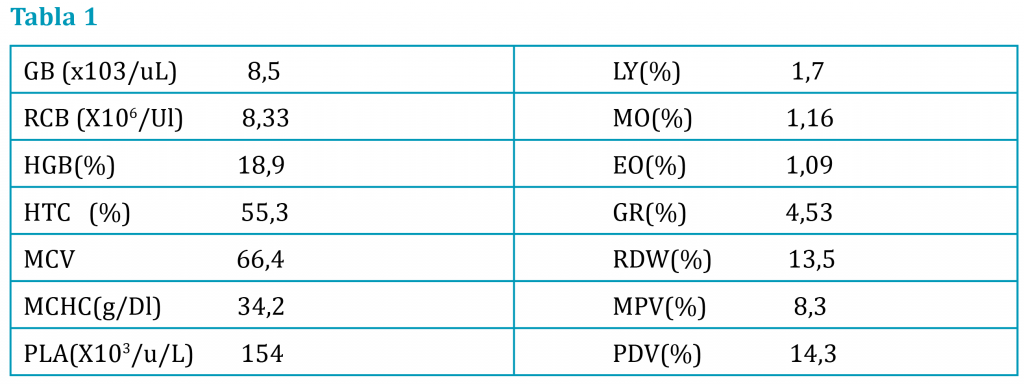
 Realizamos radiografía abdominal apreciándose aumento de la silueta prostática, por lo que se decide completar el estudio de imagen mediante ecografía abdominal observando una próstata de 3.5×2.8 con mineralización y focos anecoicos de 1.7×1.9 cm, quiste prostático de 2 cm. de diámetro y la uretra peneana engrosada y con contenido luminal.
Realizamos radiografía abdominal apreciándose aumento de la silueta prostática, por lo que se decide completar el estudio de imagen mediante ecografía abdominal observando una próstata de 3.5×2.8 con mineralización y focos anecoicos de 1.7×1.9 cm, quiste prostático de 2 cm. de diámetro y la uretra peneana engrosada y con contenido luminal.
Siendo el diagnóstico diferencial una prostatitis mineralizada o neoplasia prostática, realizamos una punción/aspirado con aguja fina (PAAF), observando en la citología células epiteliales agrupadas con anisocitosis moderada y vacuolización en citoplasmas. Decidimos realizar una biopsia ecoguiada de próstata bajo sedación intravenosa con dexmedetomidina (Dexdomitor® Lab. Ecupharm Veterinaria, Barcelona) y buprenorfina (Bupaq® Lab. Ritcher Pharma. Austria) para confirmar la sospecha de neoplasia prostática siendo el diagnóstico definitivo un carcinoma prostático de estirpe epitelial. Se completo el estudio realizando radiografías de columna y torácicas dado la alta tasa metastásica de estos tumores, no apreciándose lesiones.
 Descartamos la opción quirúrgica de prostatectomia cómo tratamiento no solo por los malos resultados sino también por los efectos adversos y se decidió un tratamiento combinado de medicación antiangiogénica y AINEs. Se pautó Toceranib (Palladia, Lab. Zoetis. Gerona) 2,5 mg/Kg, lunes, miércoles y viernes, alternando con Firocoxib (Previcox, Lab. Merial, Lyon. Francia) martes, jueves y sábado.
Descartamos la opción quirúrgica de prostatectomia cómo tratamiento no solo por los malos resultados sino también por los efectos adversos y se decidió un tratamiento combinado de medicación antiangiogénica y AINEs. Se pautó Toceranib (Palladia, Lab. Zoetis. Gerona) 2,5 mg/Kg, lunes, miércoles y viernes, alternando con Firocoxib (Previcox, Lab. Merial, Lyon. Francia) martes, jueves y sábado.
Realizamos seguimiento del paciente basándonos en su sintomatología, y ecografía abdominal. Los efectos secundarios observados asociados al tratamiento fueron: diarrea la primera semana, e hiporexia los primeros 3 días. Durante el tratamiento se le trató también de una saculitis bilateral donde realizamos un lavado de ambos sacos bajo sedación sin que se asociara a la patología ni al tratamiento aplicado.
A los 33 días de tratamiento el paciente comenzó con polaquiuria, disuria y heces aplanadas. Ecograficamente observamos aumento de tamaño del quiste prostático extrayendo mediante punción 12 ml de líquido color ambar y linfoadenopatía sublumbar de 1,8 cm hipoecogénico. El tamaño de la próstata era de 5,4×3,9 cm y el quiste una vez vacío era de 1,9×3,1 cm. La citología del aspirado extraído tenía escasa celularidad, pH6.5, proteínas y sangre. Se le añadió al tratamiento enrofloxacina (Zobuxa® Laboratorio Novartis. Paises Bajos) y diacepan (Valium® Lab Roche,Basilea. Suiza) siendo la evolución favorable.
Durante los siguientes 90 días se mantuvo estable, orinando con normalidad y sin efectos secundarios reseñables, no observado aumento de la próstata en las ecografías de revisión realizadas cada 15 días.
A los 93 días de tratamiento comenzó con diarrea y disuria. La ecografía reveló una próstata de 4×4,6 cm con cavidades anecóicas de 2.2×2,2 y áreas de mineralización. El riñón izquierdo presentaba imagen compatible con hidronefrosis de 0,9 cm con hidroureter y en vejiga se apreciaba crecimiento invasivo de cuello. Pautamos un tratamiento con diacepan (Valium® Laboratorio Roche. Basilea. Suiza) y buprenorfina (Bupaq. Laboratorio Ritcher Pharma. Austria) Laboratorio® con respuesta parcial al mismo.
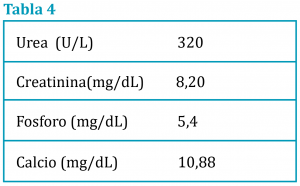
A los 15 días el paciente presento un cuadro de anuria de 24 horas de evolución. La ecografía mostraba ambos riñones con imagen compatible con hidronefrosis. Los niveles de creatinina y urea estaban aumentados respecto a las analíticas anteriore (tabla 4) Al no mostrar mejoría se optó por la eutanasia.
Discusión
La mayoría de los tumores prostáticos son de origen epitelial, siendo el adenocarcinoma el más común. Actualmente existen diferentes clasificaciones en función del patrón de crecimiento, sugiriendo la existencia de distintos patrones y diferentes tipos celulares que inician el desarrollo del tumor. En el caso de nuestro paciente resultó ser un carcinoma epitelial acinar8. En personas, el cáncer prostático emplea el Sistema de clasificación de Gleason, basándose en dichos patrones, siendo este sistema el utilizado cómo factor pronóstico. En el 2015, un estudio adaptó este sistema en 45 perros con carcinoma prostático concluyendo que podía ser aceptado como sistema de clasificación histopatológica con el fin de completar el estudio clínico para el mejor manejo de estos pacientes9.
El perro es la única especie conocida a parte de los humanos en que se produce el cáncer de próstata de manera espontánea, por lo que en muchas ocasiones se utiliza como modelo de estudio de los factores que regulan la progresión de este tumor en medicina humana20. En concreto un estudio del antígeno de membrana especifico de la próstata (PSMA) que se encuentra sobrexpresado en estos tumores y tiene características enzimáticas similares al humano.1
El carcinoma prostático afecta tanto a machos enteros como esterilizados. El que los andrógenos tengan un efecto protector en la formación de los carcinomas prostáticos caninos está aún por determinar. Se conoce que la mayoría de ellos, no responden a la terapia androgénica, comportándose de manera similar al estadio terminal del cáncer prostático andrógeno-independiente humano. En este tipo de cáncer en hombres, el marcador SGTA esta sobreexpresado y recientemente se demostró que ocurre lo mismo en los tumores prostáticos caninos lo que parece confirmar la teoría del escaso papel de los andrógenos en este tipo de tumores10.
Actualmente se están investigando distintos marcadores que en un futuro ayuden en el diagnóstico precoz y diferenciación entre hiperplasias y carcinomas prostáticos tal y como se hace en medicina humana11. La mutación del BRAF V595 E canino en pacientes con tumores uroteliales de vías bajas y carcinoma prostático y la detección de esta mutación mediante la técnica de PCR digital en gotas (ddPCR) en muestras de orina, demostrando la utilidad y sensibilidad de esta técnica de diagnóstico molecular con la gran ventaja de ser una prueba no invasiva12. Otro marcador, el β catenina, también puede ser de utilidad en el diagnóstico13 ya igual que ocurre en el hombre, la reducción de E-caderina y el incremento de la expresión Ki67 en lesiones neoplásicas de la próstata puede estar relacionado con el proceso carcinogenético de esta glándula16. Otro marcado S100A8/A9 y S100A12 se detecta en orina sin que se vea afectado su resultado por la presencia de sangre al obtenerla por cistopuncíón14. El marcador HSP90 que se detecta mediante pruebas de inmunohistoquimica está aumentado en perros con lesiones preneoplasicas, lo que sugiere, que está involucrado en la carcinogénesis del carcinoma de próstata15. Todas estas líneas de investigación de distintos marcadores que se utilizan en medicina humana para la detección y seguimiento de la evolución del cáncer prostático sugieren que en un futuro próximo podamos tener a nuestra disposición alguno de ellos que nos facilite el diagnóstico precoz de estos tumores sin la necesidad de tener que realizar técnicas invasivas, así como el tener la posibilidad de incluirlo en chequeos de rutina en pacientes de edades avanzadas7.
La mayoría de los tumores prostáticos son localmente invasivos y metastáticos siendo las localizaciones más frecuentes ganglios linfáticos, pulmones y esqueleto axial. La transición epitelial-mesenquimal (EMT) es un programa de desarrollo de las células biológicas que se caracteriza por la pérdida de adhesión celular y es parte responsable de la invasión y metástasis de los tumores epiteliales. La EMT ha sido descrita en muchos canceres humanos pero hay pocas referencias de este fenómeno en oncología veterinaria. Un estudio del 2015 evalúa la expresión de marcadores proteicos mesenquimales y epitelialiales en lesiones prostáticas caninas y concluye que la EMT ocurre durante los procesos metastáticos del carcinoma prostático canino18. Una nueva línea celular (Probasco) proveniente de perros de raza mestiza que sufrieron cáncer prostático espontáneo, fue analizada in vitro y el crecimiento tumoral estudiado in vivo en ratones y ha servido de modelo de investigación del mecanismo de la patogénesis del cáncer de próstata y la metástasis osteoblástica a huesos19.
En cuanto al tratamiento de nuestro paciente, la opción quirúrgica se desestimó debido a que la prostatectomia completa está asociada a incontinencia, alta probabilidad de recurrencia y tiempos de supervivencia cortos5. Dado el mal pronóstico, a la afectación de la uretra peneana y a la negación de la propietaria de realizar un tratamiento de quimioterapia más agresivo que implicara la administración intravenosa, se decidió un tratamiento con Toceranib (Palladia® Zoetis) y Firocoxib (Previcox® Merial) basándose en distintos estudios que combinan AINEs y Toceranib en tumores sólidos de estirpe epitelial.
La angiogénesis es un mecanismo importante en el desarrollo y proliferación de distintos tipos de tumores incluido el prostático. Para demostrar la importancia de la neovascularización de las células epiteliales en el cáncer prostático, Palmieri realizó en el año 2015 un estudio determinando mediante técnicas de inmunohistoquimica distintos factores angiogénicos: el factor de crecimiento endotelial vascular (VEGP), la molécula de adhesión plaqueto-endotelial 1 (PECAM-1), Tie-2 y factor de crecimiento de fibroblastos-2 (FGF-2), obervando que el número de células positivas era significativamente mayor en carcinomas prostáticos comparándolo con próstatas hiperplásicas y normales, demostrando que el efecto angiogénico tiene un papel importante en el desarrollo de estos tumores20. A nivel terapéutico esta línea de investigación tiene gran importancia ya que abre la posibilidad de poder aplicar nuevos tratamientos con fármacos con efectos antiangiogénicos.
El toceranib es un inhibidor de los receptores de tirosin Kinasa (RTK). Estos receptores de membrana son importantes para el ciclo celular, apoptosis y angiogénesis, mecanismos importantes en la carcinogénesis22 En el año 2012, London et al realizaron el primer estudio preliminar utilizando toceranib (Palladia®Zoetis) en tumores sólidos, señalando que se necesitan más estudios para determinar su verdadera actividad21. La mejor respuesta se obtuvo en adenocarcinomas de saco anal (de origen neuroendocrino). Otro estudio del año 2014 donde se evaluaron 19 pacientes con tumores de base cardiaca tratados con toceranib, se demostró que el 69% tuvieron mejoría del cuadro clínico (BC) y la tasa de respuesta incluyendo enfermedad estable (EE) fue de un 52%. Esta respuesta favorable se cree que se debe a la inhibición del gen RET y los RTK que se encuentran sobreexpresados en tumores de origen neuroendocrino28. Esto ha llevado a que en la actualidad el toceranib sea ampliamente utilizado como una de las primeras opciones en este tipo de tumores29.
Un estudio del año 20163 sobre el receptor Ephrin A3 (EPHA3) que pertenece a la familia de RTK concluye que los perros con carcinoma prostático tiene una sobrexpresión de este receptor en comparación con perros con próstatas normales o hiperplasicas, sugiriendo su participación en la carcinogénesis prostática y abriendo la posibilidad de nuevas estrategias terapéuticas.
En humanos existen evidencias epidemiológicas y experimentales de que el uso de AINEs previenen el desarrollo de estos carcinomas. Hay distintos artículos publicados sobre la influencia de la ciclooxigenasa 2 (COX-2) en la angiogénesis tumoral. Su inhibición puede controlar el crecimiento tumoral, por lo que lleva tiempo formando parte de los protocolos antiangiogénicos. La inhibición del crecimiento tumoral es dependiente de la dosis y cuando se disminuye por debajo del umbral deja de observarse este efecto27. En cuanto a su utilización terapéutica en carcinoma prostático canino hay un estudio publicado en el año 2004 utilizando piroxican y/o carprofeno concluyendo que lo pacientes tratados viven más tiempo que los no tratados30.
En cuanto al uso tratamientos multimodales hay varios estudios y publicaciones recientes apoyando su utilización. Una publicación del año 2012 de 3 perros con carcinoma de células escamosas del seno frontal, tratados con piroxicam combinado inicialmente con carboplatino y posterirmente con toceranib, con tiempos de supervivencia muy prolongados (uno de ellos superior a 3 años con remisión completa)24. En el año 2015 se publicó un estudio de 50 perros con carcinoma de células de transición urogenital, tratados con mitoxantrona o carboplatino combinado con piroxicam. El estudio concluyó que los perros con afectación prostática tenían tiempos más cortos de supervivencia independientemente del fármaco empleado, con una media de 109 días23O . Otras combinaciones utilizadas recientemente son Toceranib y Lomustina en un estudio clínico en fase I del año 2016 en el que entre otros canceres se trató un perro con carcinoma prostático con una respuesta parcial de más de 6 semanas y buena tolerancia. Se necesita continuar el estudio fase II y III para ver la eficacia de esta combinación25.
Se están investigando otros tratamientos en fase experimental a base de vacunas con virus oncolíticos en distintos tumores caninos que incluyen los carcinomas prostáticos, con buenos resultados sobre el crecimiento de dichos tumores31-,32.
Nuestro paciente se mantuvo con enfermedad estable (EE) 33 días, y enfermedad progresiva pero buena calidad de vida 93 días. El hecho de que también presentara un quiste prostático en el momento de su diagnóstico complicó el cuadro clínico, mejorando al vaciar su contenido. Los efectos secundarios asociados a la medicación fueron mínimos y remitieron en los primeros días. El objetivo del tratamiento no fue curar al paciente, ya que las posibilidades de hacerlo eran prácticamente inexistentes, sino mantenerlo con enfermedad estable o con buena calidad de vida y poder ofrecer al propietario una opción terapéutica.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
Bibliografía
Withrow SJ. Vail DM, Oncología Clínica de Pequeños Animales. 2009. 4ª Ed.Pag 627-631.
Ettinger SJ, Feldman EC.2007. 6º Ed. Pag. 786
Hood G, Laufer-Amorim R, Fonseca-Alves CE, Palmieri C. Overexpresion of Ephrin A3 Receptor in Canine Prostatic Carcinoma. J Comp Pathology Feb-Apr; 2016. 154 (2-3):180-5.
Cain DT, Battersby I, Doyle R. Response of dogs with urinary tract obstructions secondary to prostatic carcinomas to the α 1 anntagonist prazosin. Vet Rec 2016 Jan 23,178 (4).
Vlasin M, Rauser P, Fichel T, Necas A. Subtotal intracapsular prostatectomy as a useful treatment for advanced stage prostatic malignancies. J. Small Anim Pract. 2006 Sep;47(9):512-6
Palmieri C, Lean FZ, Akter SH, Romussi S, Grieco V. A retrospective analysis of 111 canine prostatic samples: histopathological findings and classification. (2014). Res Vet Sci. 2014 Dec; 97 (3): 568-739.
Cannon CN, Allstadt S. Lower Urinarytract cáncer. Vet Clin North Small Pract. 2015. Jul; 45 (4): 807-24.
Akter SH, Lean FZ, Lu J, Grieco V, Palmieri C. Different Growth Patterns Of Canine Prostatic Carcnoma Suggest Different Models of Ttmor-initiating Cells. Vet. Pathol. 2015 Nov; 52 (6): 1027-33.
Palmieri C, Grievo V. Proposal of Gleasol-like grading system of canine prostate carcinoma in veterinary pathology practice. Res Vet Sci. 2015 Dec; 103: 11-5
Kato Y, Ochiai K, Michistia M, Azakami D, Nakahira R, Morimattsu M, Ishiquro-oonuma T, Yoshikawa Y, Kobayashi M, Bonkobara M, Kobayashi M, Takahashi K, Watanabe M, Omi T. Molecular Cloning of canine co-chaperone small glutamine-rich tetratricopeptide repeat-containing protein α (SGTA) and investigation of its ability to suppress androgen-independent prostate cáncer.(2015) Vet Jour. 2015 Nov;206(2):143-8.
Romanucci M, Frattone L, Ciccarelli A, Bongiovanni L, Makatesta D, Benazzi C, Brachelente C, Della Salda L. Inmunohistochemical expression of heat shock proteins, p63 and androgen receptor in beging prostatic hyperplasa and prostatic carcioma in the dog. 2014. Vet Comp Oncol.. 2014 Jul 25. doi: 10.1111/vco.12113.
Mochizuki H, Shapiro SG, Breen M. Detection of BRAF Mutation in Urinari DNA as a Molecular Diagnostic for Canine Urothelial and Prostatic Carcinoma. PLoS One. 2015 Dec 9;10(12)
Lean FZ, Kontos S, Palmieri C. Expression of β-catenin and mesenchymal markers in canine prostatic hiperplasia and carcinoma. J Comp Pathol. 2014 May; 150(4):373-8.
Heilmann RM, Wright ZM, Lanerie DJ, Suchodolski JS, Steiner JM. Measurement of urinary canine S100A8/A9 and S100A12 concentrations as candidate biomarkers of lower urinary tract neoplasia in dogs. J Vet Diagn Invest. 2014 Jan;26(1):104-12.
Palmieri C. Mancini M, Benazzi C, Della Salda. Heat shock protein 90 is associated with hiperplasia and neoplastic transformation of canine prostatic epitelial cells. J Comp Pathol. 2014 May;150(4):393-8.
Rodrigues MM, rema A, Garter MF, Laufer-Amorim R. Role of adhesión molecules and proliferation hyperplasic, pre neoplastic and neoplastic lesions in canine prostate. Pak J Biol Sci. 2013 Nov 1;16(21):1324-9.
Wu LY, Johnson JM, Simmons, JK, mendes DE, Geruntho JJ, Liu T, Dirksen WP, Rosol TJ, Davis WC, Berkman CE. Biochemical characterization of prostate-specific membrane antigen from canine prostate carcinoma cells.. Prostate. 2014 May;74(5):451-7.
Fonseca-Alves CE, Kobayashi PE, Rivera-Calderon LG, Laufer-Amorim R. Evidence of epitelial-mesenchymal transition in canine prostate cáncer metástasis. Res Vet Sci. 2015 Jun;100:176-81.
Simmons JK, Dirksen Wp, Hidreth BE 3rd, Dorr C, Williams C, Thomas R, Breen M, Toribio RE, Rosol TJ. Canine Prostate cáncer cell line (Probasco) produces osteoblastic metastases in vivo. Prostate. 2014 Sep;74(13):1251-65.
Palmieri C. Inmunohistochemical Expression of Angiogenic Factors by Neoplastic Epithelial Cells is Associated with Canine Prostatic Carcinogenesis. Vet Pathol. 2015 Jul;52(4):607-13.
London C, Mathie T, Stingle N, Clifford C, Haney S, Klein MK, Beaver L, Vickery K, Vail DM, Hershey B, Ettinger S, Vaughan A, Alvarez F, Hillman L, kiselow M, Thamm D, Higginbotham ML, Gauthier M, Krick E, Phillips B, Laude T, Jones p, Bryan J, Gill V, Novasad A, Fulton L, Carreras J, Mcneill C, Henry C, gillings S. Preliminary evidence for biologic activity of toceranib (Palladia®) in solid tumours. Vet Comp Oncol. 2012 Sep;10(3):194-205.
Brown RJ, Newman SJ, Durtschi DC, leblanc AK. Expression of PDGFR-β and Kit in canine anal sac apocrine gland adenocarcinoma using tissue inmunohistochemistry. Vet Comp Oncol. 2012 Mar;10(1):74-9.
Allstadt SD, Rodriguez CO Jr, Boostrom B, Rebhun RB, Skoupski KA. Randomized phase III trial of piroxicam in combination with motoxantrona or carboplatin for first-line treatment of urogenital tract transitional cell carcinoma in dogs. J Vet Intern Med. 2015 Jan;29(1):261-7.
De Vos J, Ramos Vega S, Noorman E, de Vos P. Primary frontal sinus squamos cell carcinoma in three dogs treated with piroxicam combines with carboplatin or toceranib. 2012. Vet Comp Oncol. Sept 10(3): 206-13.
Pan X, Tsimbas K, Kurzman ID, Vail DM. Safety evaluation of combination CCNU and continous toceranib (Palladia®) in tumor-bearing dogs: a phase I dose-finding study.Vet Comp Oncol. 2016 Jun;14(2):202-9.
Lara A. Uso de Inhibidores de Tirosin kinasa en Oncologia Veterinaria. 2012. Procedings GTA. 2012.
Masferrer JL, Leahy KM, Koki AT, Zweifel BS, Settle SL, Woerner BM, Edwards DA, Flickinger AG, Moore RJ, Seibert K. Antiangiogenic and antitumoralactivities of cyclooxigenase-2 inhibitors. Cancer Res. 2000 Mar 1;60(5):1306-11
McQuown B, Arteaga T, Cunningham S, Burgess K. Palladia®(toceranib phosphate) in the treatment of heart base tumors. Annual Conference Proceedingss VCS.2014
Balaña B, Borrego J.F.,Clemente P. . Proceedings Avepa Oncologia Formación Continuada. 2017
Sorenmo KU, Goldschidt MH, Shofer FS, Goldkamp C, Ferracone J. Evaluation of cyclooxygenase-1 and cyclooxygenase-2 expression and the effect of cyclooxygenase inhibitors in canine prostatic carcinoma. Veterinary and Comparative Oncology2004, 2, 13-23.
Cecil A, Gentschev I, Adelfinger M, Nolte I, Dandekar T, Szalay AA. Antigen profiling analysis of vaccinia virus injected canine tumors: oncolytic virus efficiency predicted by boolean models. Bioengineered. 2014 Sep-Oct;5(5):319-25.
Adelfinger M, Bessler S, Frenten A, Cecil A, Langbein-Laugwitz J, Gentschev I, Szalay AA. Preclinical Testing Oncolytic Vaccinia Virus Strain GLV-5b451 Expressing an Anti-VEGF Single-Chain Antibody for Canine Cancer Therapy.Viruses. 2015 Jul 20;7(7):4075-92.
Autor
A. Cascallar Pasqual del Pobil1, B. Verdugo2 L Carrascosa de Lome1, B. Varela Garrido1
1. Av Ramón y Cajal 69. Centros veterinarios Vets&company
2. Sinergia Diagnóstico por Imagen
Publicado en Centro Veterinario

