Diagnóstico etiológico de efusión pleural a través de los Criterios de Light adaptados. Revisión de cinco casos clínicos
Diagnóstico etiológico de efusión pleural a través de los Criterios de Light adaptados. Revisión de cinco casos clínicos
Resumen
El derrame o efusión pleural (DP) es una acumulación anormal de líquido entre ambas pleuras parietal y visceral, que puede ser de naturaleza diversa y que debe ser clasificado con el fin de orientar el diagnóstico etiológico. En este artículo hemos aplicado algunos de los parámetros de los criterios de Light de medicina humana para clasificación de DP. Describimos cinco casos clínicos de DP, cada uno de ellos de diferente etiología, en los que se ha valorado el aspecto macroscópico, estudio citológico, las proteínas totales del líquido pleural (PTp) y la densidad del líquido pleural (LP), criterios de clasificación utilizados tradicionalmente en veterinaria para su clasificación en trasudados, trasudados modificados y exudados, y se han añadido dos parámetros utilizados en la práctica clínica de medicina humana: la lactato deshidrogenasa del líquido pleural (LDHp) y el cociente de proteínas del suero (PT suero) y PTp. Todos estos valores han ayudado en cada caso a orientar las pruebas diagnósticas a realizar llegando al diagnóstico correcto.
Palabras clave
Derrame pleural, criterios de Light, trasudado, exudado, lactato deshidrogenasa.
Introducción
La pleura es una membrana serosa de origen mesodérmico que recubre el parénquima pulmonar (pleura visceral) y el mediastino, diafragma y superficie interna de la pared torácica (pleura parietal).
Entre ambas pleuras queda un espacio virtual cerrado, el espacio pleural, cuyo interior contiene una pequeña cantidad de líquido que permanece constante en virtud del continuo equilibrio existente entre su producción y absorción. Cualquier problema que altere este equilibrio provocará una anormal acumulación de líquido que, en función de la etiología subyacente del proceso, puede ser de naturaleza diversa (trasudado, trasudado modificado, exudado, sangre y líquido linfático) y al cual denominamos derrame (DP) o efusión pleural.
En la evaluación del paciente con DP, siempre que sea posible y este se encuentre estable, se debe realizar una anamnesis y exploración física completa. De las técnicas de imagen, la radiografía lateral de tórax y la ecografía torácica son las dos técnicas más accesibles y sencillas por encima de la tomografía computerizada (TM).1
Los criterios de Light fueron descritos en 1972 por Light RW et al. y tenían por objetivo clasificar los derrames pleurales en trasudados o exudados. Esta diferenciación se considera el paso inicial en el diagnóstico etiológico de cualquier DP. Los primeros resultan de un desequilibrio entre las fuerzas hidrostáticas y oncóticas en la circulación pulmonar o sistémica, mientras que los segundos se producen por un aumento de la permeabilidad vascular.1
En la práctica clínica de medicina humana, se diferencian los trasudados de los exudados mediante los criterios de Light según los cuales un DP es un exudado cuando cumple una o más de las siguientes condiciones:
- Cociente de proteínas entre líquido pleural (LP) y el suero superior a 0,5.
- Cociente de lactato deshidrogenasa (LDH) entre LP y suero superior a 0,6.
- LDH del LP superior 2/3 del límite superior de la normalidad de LDH sérica.
En medicina humana, estos criterios identifican correctamente la practica totalidad de los exudados (98%), pero clasifican erróneamente como exudados alrededor del 30% de los DP cardiacos y el 20% de los hepáticos. En estos casos, si existe la sospecha clínica de insuficiencia cardiaca pero el DP está, según los criterios anteriores clasificados como exudado limítrofe, recomiendan calcular el gradiente (resta) entre la albúmina del suero y del LP. Si dicha diferencia es superior a 1,2 g/dl, se considera un trasudado1. Se puede utilizar también la concentración en LP del péptido natriurético NT-proBNP, si es superior a 1500 pg/ml la probabilidad del origen cardiaco es muy alta y existe buena correlación con las determinaciones de NT-proBNP en sangre.
Los DP de origen hepático etiquetados como exudados por los criterios Ligth muestran en el 77% de las ocasiones un cociente entre la albúmina del LP y la albúmina sérica inferior a 0,6.1
En medicina veterinaria la diferenciación tradicional entre trasudados, trasudados modificados y exudados en función de la cantidad de proteína total y el recuento celular en LP se considera el paso inicial en el estudio de cualquier DP, pero al igual que ocurre en medicina humana existen superposición de valores, sobre todo en lo referente a diferenciar un trasudado modificado y un exudado.
El presente artículo pretende a través de los parámetros clínicos de Light, establecer una clasificación del LP para poder hacer una buena aproximación diagnóstica que oriente correctamente acerca de las pruebas a realizar para llegar al origen del DP.
En los cinco casos clínicos se realizó un hemograma y bioquímica sérica, se obtuvo LP por toracocentesis y se tuvo en cuenta su aspecto macroscópico, se midió densidad y las proteínas totales (mediante refractrómetro), la LDHp y se realizó una estudio citologico En uno de los casos se realizó un cultivo para aerobios y anaerobios y en otro una medición de triglicéridos, glucosa y colesterol.
En todos ellos se llegó a diagnosticar la causa del DP sin necesidad de pruebas complicadas ni excesivamente costosas para los propietarios.
Caso clínico 1
Se presentó a consulta un gato Europeo Común, macho esterilizado de 13 años, con un cuadro de hiporexia de varios días de evolución y disminución de actividad. En la exploración presenta una temperatura (Tª) de 39,3ºC, peso 3,380 Kg, condición corporal (CC) de 3/9, manto mate, deshidratación leve, respiración con refuerzo abdominal marcado, sin patrón claro, frecuencia respiratoria de 64 respiraciones por minuto (RPM) y una frecuencia cardíaca de 220 latidos por minuto (LPM) y presiones arteriales sistólica y diastólica de 20mmHg y 9mmHg reepectivamente. (Petmap graphic II. Ramsey medical Inc). A la auscultación los sonidos cardiacos se encuentran atenuados.
Previa estabilización, se realizó en hemograma, bioquímica sanguínea, y radiografía torácica lateral con una imagen compatible con efusión pleural.
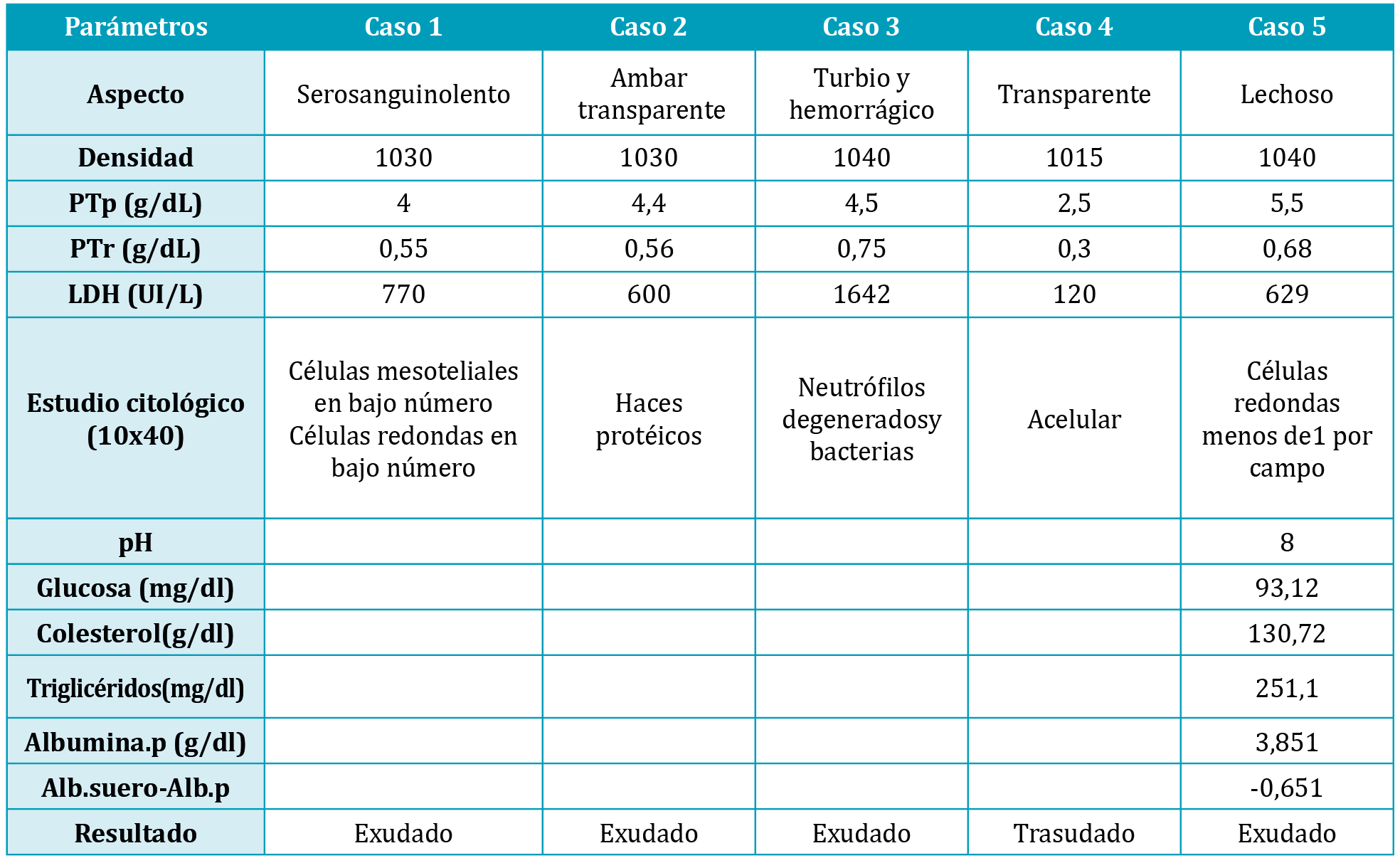
Mediante toracocentesis se obtuvo un líquido de aspecto serosanguinoliento. Los resultados del DP (tabla 1) lo hacían compatible con un exudado por lo que se decide realizar una ecografía torácica en la que se observaron múltiples nódulos en mediastino caudal, con infiltración de lóbulos pulmonares compatibles con lesiones neoplásicas. Se extrajeron 160 ml de líquido pleural para mejorar la condición física del paciente y se realizó una punción con aguja fina (PAF) de los nódulos mediastínicos observando en el estudio citológico “cluster” de células redondas con atipias compatible con carcinoma bien diferenciado. El paciente fue eutanasiado en otro centro por lo que no se pudo confirmar por biopsia estos resultados.
Caso clínico 2
Gato, Azul Ruso de 9 años, con enfermedad renal crónica en estadio II según la clasificación IRIS, acudió a consulta porque le notaban más decaído. En la exploración presentaba un peso de 5,750Kg (CC 5/9) pero con una pérdida del 9% con respecto al peso anterior de dos meses antes. Tª 38,5ºC, mucosas rosas, bien hidratado, abdomen ligeramente distendido, respiración con algo de refuerzo abdominal y frecuencias respiratorias y cardíaca de 50 RPM y 150 LPM respectivamente. La presión arterial sistólica y diastólica fue de 15mmgHg y 11mmHg respectivamente. Se realizó hemograma, bioquímica sanguínea, urianálisis, con resultados similares a analíticas previas, exceptuando una bilirrubinemia y bilirrubinura, y radiografía abdominal y torácica y ecografía abdominal encontrando efusión pleural y líquido libre en abdomen. Se realizó una abdominocentesis extrayendo 70 ml de líquido color ámbar, y toracocentesis obteniendo un fluido de características similares. Los resultados obtenidos (Tabla 1.) lo hacen compatible con un exudado. En la citología del LP se encontraron haces proteicos y escasa celularidad.
Se realizó un test de Rivalta del líquido ascítico con resultado positivo siendo la principal sospecha diagnóstica la Peritonitis Infecciosa Felina (PIF), realizando una reacción en cadena de la polimerasa (PCR) para Coronavirus felino siendo el resultado positivo, aunque las mutaciones M1058L y S1060A fueron negativos.
Caso clínico 3
Perro, Bulldog francés de 10 años, que se presentó en consulta por un episodio de vómitos y diarrea de dos días de evolución. Hace veinte días le realizaron una orquiectomía y desde entonces le habían notado disminución de apetito y actividad, y toses esporádicas.
En la exploración se encontraba muy agitado, peso de 21,600Kgs (CC5/9), Tª de 39,5ºC, mucosas congestivas, frecuencia respiratoria mayor de 80 RPM, y frecuencia cardíaca de 180LPM, con respiración con refuerzo abdominal severo. Se le trató inicialmente con butorfanol (Butomidor®, Lab. Richter Pharma ag. Wels. Austria), maropitant (Cerenia®. Lab. Zoetis.Belgica), ampicilina (Gobemicina® LAb. Normon S.A. Madrid), y oxigenoterapia y posteriormente se le realizó hemograma, bioquímica sanguínea y radiografía torácica presentando imagen de efusión pleural.
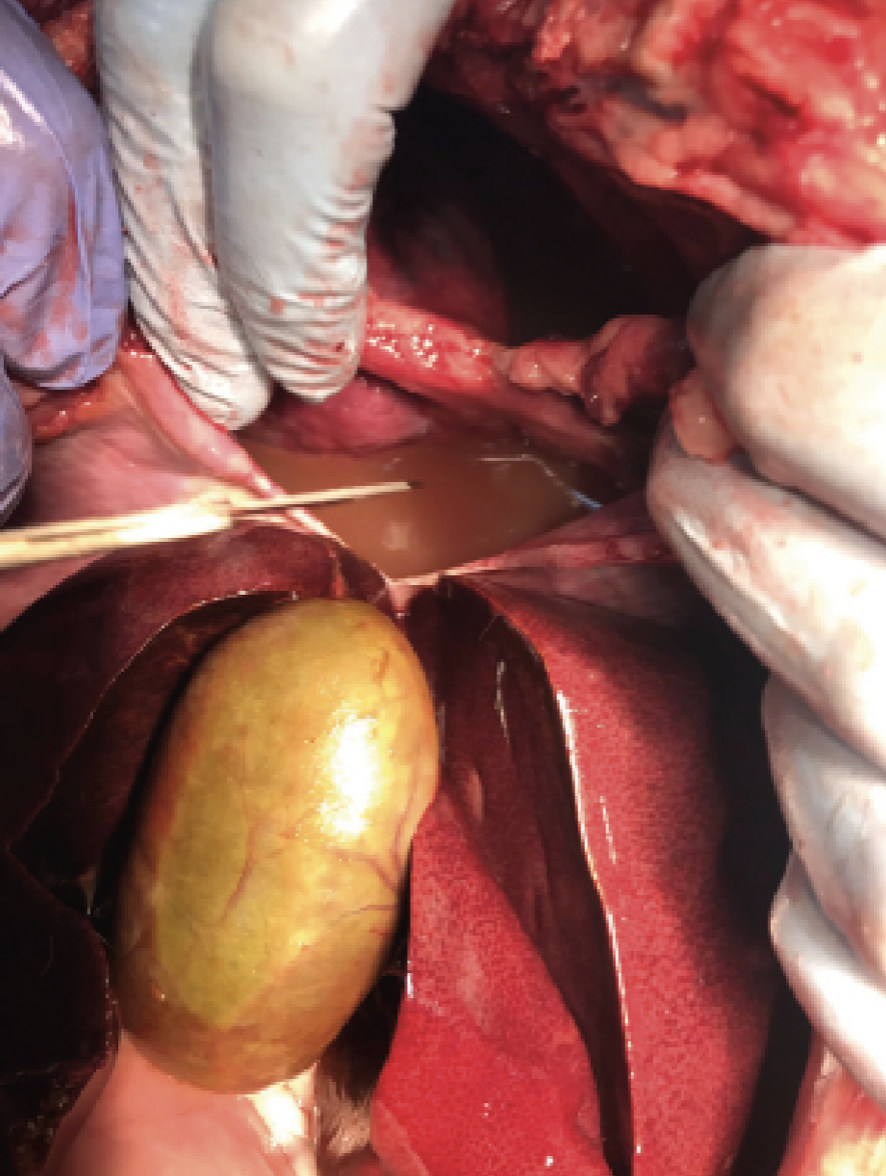
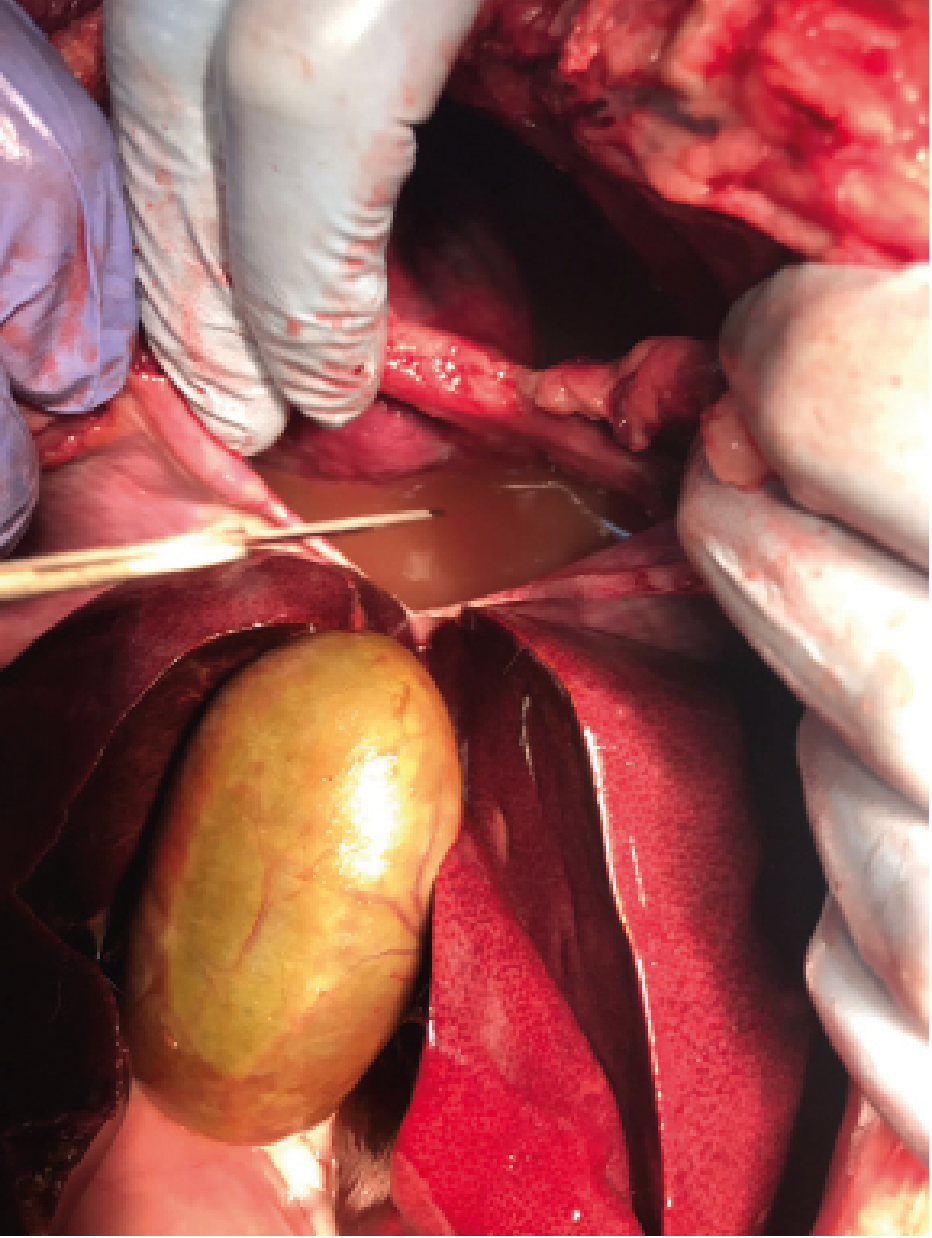
Se extrajeron 350 ml de líquido de aspecto turbio, rojizo y maloliente (imagen 1) realizando dos toracocentesis, una en cada hemitórax, para aliviar la condición física del paciente. Los resultados del LP y la citología donde aparecián abundantes neutrófilos y bacterias (tabla 1.) lo hacían compatible con exudado séptico.
Se hospitalizó con un tratamiento antibiótico empírico: ampicilina (Gobemicina® LAb. Normon S.A. Madrid), para ajustarlo luego al resultado de los cultivos y colocación de tubos de drenaje torácico, falleciendo durante la intervención.
Se realizó necropsia (imagen 3) encontrando una severa fibrosis pleural, los lóbulos pulmonares del hemitórax derecho presentaban áreas de necrosis con exudado purulento y no se encontró presencia de cuerpo extraño. Se enviaron muestras de pulmón y pleura a anatomía patológica, siendo el diagnóstico una severa pleuro-neumonia fibrinopurulenta. Los resultados del cultivo realizado para aerobios y anaerobios dieron como resultado Pasteurella spp y Echerichia coli.
Caso clínico 4
Gato E.C. de 16 años acude a consulta con un cuadro de distrés respiratorio agudo. En la exploración presenta un peso de 2,5Kg (CC 3/9), mucosas pálidas, frecuencia respiratoria superior a 80 RPM, patrón restrictivo y frecuencia cardíaca de 180 LPM con una auscultación que revelaba sonidos cardiacos atenuados.
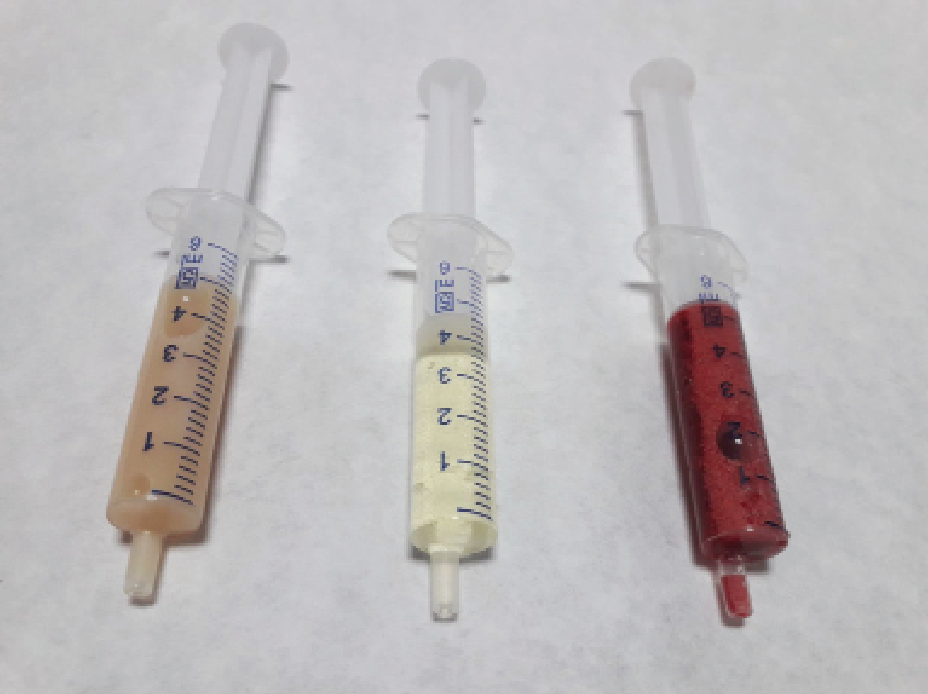
Se hospitalizó con butorfanol (Butomidor®, Lab. Richter Pharma ag. Wels. Austria) y oxigenoterapia y una vez estable se realizó una radiografía lateral de tórax (imagen 2) observando presencia de DP.
Se realizó toracocentesis extrayendo 170 ml de líquido trasparente (imagen 1) compatible con un trasudado modificado (tabla 1.). En vista de los resultados obtenidos, que señalaban a un posible origen cardiaco, se decide realizar un test del péptido N-terminal inactivo (NT-ProBNP) (Snap® Felino ProBNP Lab. Idexx S.L. Barcelona), siendo el resultado positivo, confirmando mediante ecocardiografía una cardiomiopatía restrictiva severa descompensada con DP.
Caso clínico 5
Gato, EC macho esterilizado de 13 años acudió a consulta de segunda opinión diagnosticado de efusión pleural mediante radiografía torácica en otro centro, pero sin realizar analítica del LP, con un tratamiento con diuréticos, antibióticos y corticoides sin buenos resultados.
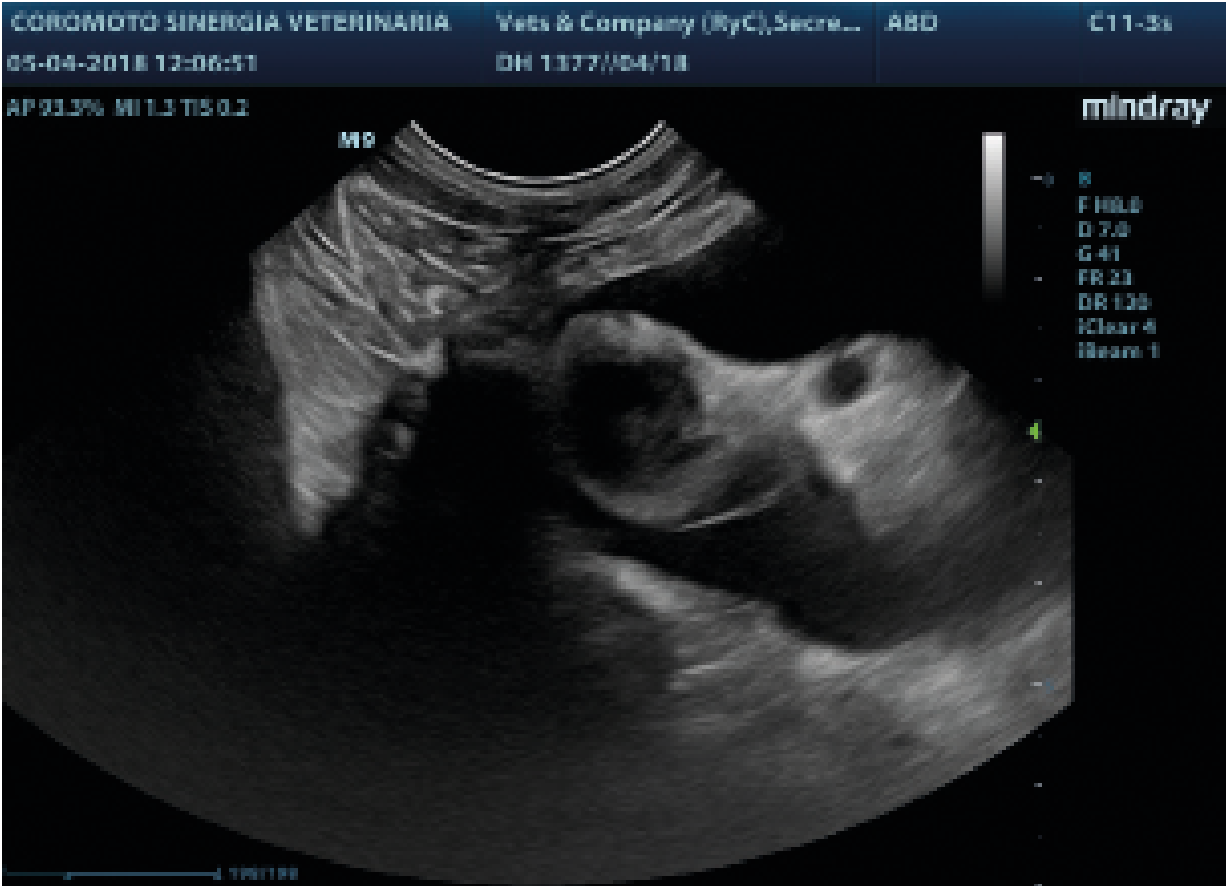
En la exploración su peso era de 3,5kg (CC 3/9), frecuencia respiratoria mayor a 50 RPM y frecuencia cardíaca de 150 LMP. Se realizó la toracocentesis extrayendo 60 ml de líquido de aspecto lechoso compatible con quilo (imagen 1). En este caso se decidió ampliar los parámetros a realizar en LP y en vista de los resultados (tabla 1.) se realizó una ecografía torácica observando una masa de grandes dimensiones (4,1×3,5) en mediastino caudal (imagen 4) y líquido libre en espacio pleural decidiendo entonces realizar una ecografía de abdomen encontrando linfonodos en abdomen craneal e hilio hepático muy aumentados.
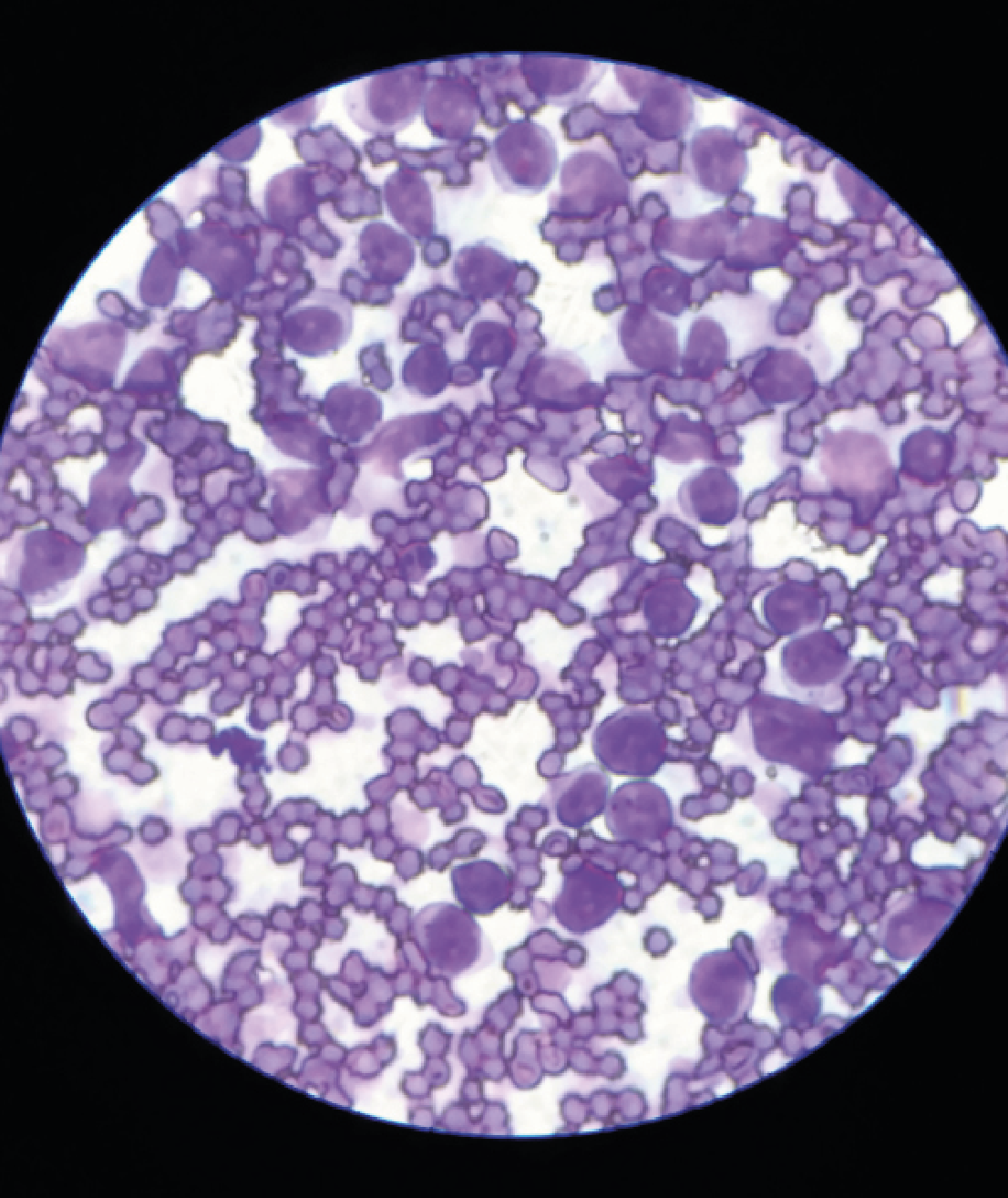
Se realizó punción con aguja fina (PAF) de la masa mediastínica y de los linfonodos de abdomen observando en la citología una mayoría de linfoblastos (imagen 5) siendo compatible con un linfoma multicéntrico.
Discusión y conclusiones
La radiografía torácica se considera la primera aproximación para evaluar un posible DP. A diferencia de otras especies, el perro y el gato poseen un mediastino fenestrado que permite la comunicación libre entre ambos hemitórax de forma que los derrames suelen ser bilaterales2. Sin embargo, un estudio del 2014 indica que esta característica no siempre se cumple, y aunque la causa se desconoce podría atribuirse a la existencia de patologías causantes del derrame3. En nuestra experiencia siempre hemos realizado una toracentesis terapéutica unilateral con buenos resultados, excepto en el caso nº3 de exudado séptico en el que tuvimos que realizar toracocentesis bilateral posiblemente debido a la cantidad de fibrina existente en el derrame.
La obtención del líquido pleural es por tanto fundamental para orientar el diagnóstico del DP.
Tradicionalmente en medicina veterinaria los DP se clasifican en función de la naturaleza del líquido en: trasudado, trasudado modificado y exudado. Las características de este líquido vienen dadas por su aspecto macroscópico, sus características citológicas y microbiológicas y su contenido proteico2. Sin embargo, en medicina humana este derrame se ha clasificado únicamente en dos categorías: trasudado y exudado4. Para esta clasificación se utilizan los parámetros de Light que identifican correctamente el 98% de los exudados, pero dejan un margen de error en DP de origen cardiaco y hepático1.
Este problema también lo observamos en medicina veterinaria especialmente a la hora de diferenciar un trasudado modificado de un exudado. Así, en un estudio publicado en el 2009 se evaluaron en el suero y líquido pleural de 20 gatos con DP los siguientes criterios de Light: concentración de lactato deshidrogenasas de líquido pleural (LDHp), ratio LDHp/LDH suero, ratio proteínas líquido pleural /proteínas séricas totales (PTr), proteínas totales líquido pleural, concentración de colesterol del LP, ratio colesterol LP/colesterol suero (CHOLr), gradiente colesterol suero/DP, recuento total células nucleadas y glucosa del LP, concluyendo que los parámetros LDHp y PTr eran los más fiables para discriminar entre trasudado y exudados con una sensiblidad del 100% y del 91% respectivamente y ambos con una especificidad del 100%5.
Este mismo autor en el año 2016 realizó un estudio en gatos con DP utilizando los criterios de Light de clasificación concluyendo que existe una diferencia significativa entre la precisión de los criterios Light en la correcta clasificación del DP comparada con la clasificación tradicional veterinaria (84%vs53%) y que en aquellos casos en que los criterios de Light clasifican como exudados ciertos trasudados, el gradiente de albumina sería el parámetro de elección para identificarlos4 tal y cómo ya se había demostrado previamente en medicina humana1.
Debido a todo lo descrito anteriormente, se decidió incluir en nuestro protocolo de actuación de DP algunos de estos criterios con el fin de llegar a una clasificación más precisa. Los parámetros utilizados fueron: el aspecto macroscópico del líquido, la densidad, las proteínas totales del suero y líquido pleural mediante refractometría (siendo esta técnica el método de elección frente a la reacción de Biuret resultando mucho más rápido y económico según un estudio del año 2016 6) y el PTr. En todos los casos se midió también la LDHp, siendo uno de los parámetros utilizados como punto de corte para determinar un trasudado. Así, un valor de LDHp inferior o igual a 200 UI/l confirma la presencia de un trasudado y no serían necesarios prácticamente más determinaciones ya que en su mayoría están causados por fallo cardiaco congestivo, hipoproteinemia o exceso de fluidos intravenosos. Sin embargo, en el caso de que la LDHp sea superior a 200 UI/l el fluido sería clasificado como exudado y necesitaríamos otras determinaciones adicionales si tenemos la sospecha clínica de que esta clasificación no es la correcta2. En todos los casos realizamos también una citología de LP, con un contaje del número y tipo de células por campo.
Así, en el caso nº 4, la historia clínica del paciente y los parámetros evaluados( LDH por debajo de 200 U/L, PTP 2,5 g/dL, PTr 0,3 g/dL) eran compatibles con un trasudado. El trasudado en gatos no siempre indica un origen cardiaco, en ocasiones si aparecen linfocitos en la citología pueden ser debidos a un linfoma u otra neoplasia intratorácica como carcinoma o timoma. En nuestro caso se observó escasa celularidad y valor de LDH por debajo de 200 no compatible con ninguna de estas patologías y se decidió realizar el marcador NT-proBNP (Snap® Feline Por BNP.Lab. Idexx. S.L. Barcelona) del suero, dando un resultado positivo que hacía sospechar de un posible origen cardiaco. Varios estudios del año 2013 recomendaban el empleo de este marcador en suero7 y en LP8 para orientar el diagnóstico a un posible origen cardiaco del DP. Un estudio posterior del 2015 concluyó una mayor sensibilidad utilizando este marcador en suero9, y posteriormente en el 2016 un nuevo estudio señaló que la sensibilidad de este marcador en LP aumenta si este es diluido previamente 10.
En los otros cuatro casos, los parámetros de Light aplicados confirmaron la presencia de exudado. Todos ellos presentaban densidades por encima de 1030, PTp por encima de de 4, PTr por encima de 0,5 y LDHp superiores a 600 UI/L.
En el caso nº2, la historia clínica del paciente y las características del líquido pleural, en especial los haces proteicos observados en la citología, eran compatibles con PIF por lo que se decidió realizar un test de Rivalta puesto que tiene valor predictivo positivo de un 58,4% y un valor predictivo negativo de un 93,4%.11 Dado que, en nuestro caso, esta prueba dio un resultado positivo, se realizó un PCR para Coronavirus felino siendo el resultado positivo, aunque las mutaciones fueran negativas. Recientemente se han evaluado las proteínas de fase aguda para diagnóstico de PIF en DP felino, siendo la alfa 1.glicoproteina ácida (AGP, de sus siglas en inglés) con la que se ha observado mayor sensibilidad y especificidad12.
En cuanto a los exudados sépticos al que corresponde el caso nº 3, aunque el aspecto del líquido pleural orienta al diagnóstico, es fundamental realizar un examen citológico y un cultivo frente a aerobios/anaerobios y antibiograma9 en todas las muestras que contengan neutrófilos degenerados incluso aunque no se detecten bacterias en la citología2.
A diferencia del resto de los DP descritos, en el caso nº 5, el aspecto del líquido extraído era compatible con quilo. Decidimos ampliar los criterios Ligth con nuevos parámetros descritos que confirmaran la sospecha de quilotórax. Por ello, valoramos los triglicéridos, el colesterol, que confirmaron la presencia de quilo, la glucosa, la albumina y el pH, además de los parámetros habituales. El pH del líquido pleural del paciente era de 8, glucosa de 93,12 mg/dL y se ha visto que un pH igual a superior de 7,4 junto con unos niveles de LDHp compatibles con exudado suele asociarse con malignidad. En casos de piotórax en los que el aspecto del líquido pueda originar confusión con quilotórax el pH suele ser igual o menor a 6,9 y la glucosa inferior a 30 mg /dL2.
Los primeros estudios realizados sobre quilotórax parecían indicar que la mayoría se producían por traumatismos sobre el conducto torácico, aunque actualmente se sabe que puede estar asociado con linfangiectasia generalizada, inflamación, obstrucción del flujo linfático, enfermedad cardiaca y neoplasia. Con frecuencia no se puede demostrar el origen y se consideran idiopáticos.
Aunque en la mayoría de las citologías de los DP en casos de linfomas se observan linfoblastos, siendo este un método sensible para su diagnóstico, en nuestro caso, no se vieron y fue la ecografía torácica la que confirmo la presencia de una masa mediastínica que probablemente provocaba la obstrucción del conducto torácico, confirmando por citología de esta masa y de los linfonodos abdominales la presencia de linfoblastos (imagen 5).
Como conclusión, el DP es una manifestación clínica frecuente en la que es necesario una investigación etiológica exhaustiva para instaurar un tratamiento específico para cada caso. Una vez determinado la existencia de DP por clínica e imagen, está siempre indicado la toma de muestras de LP mediante toracocentesis, ya que aporta información fundamental para orientar el diagnóstico y mejora la condición física del paciente, siendo además una prueba sencilla de realizar y de bajo coste económico para el propietario.
Incluir los criterios de Light, fundamentalmente PTr y LDHr en el estudio del DP nos ayuda a una correcta clasificación del LP que orientará hacia las pruebas a realizar para llegar al diagnóstico etiológico correcto y son más precisos comparándolos con los criterios tradicionales empleados en medicina veterinaria.
Autora
Arantxa Cascallar
Centros Veterinarios Vets & Company
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
Bibliografia
- Villena Garrido V, Cases Viedma E, Fernández Villar A, et al. Normativa Sepa sobre el diagnóstico y tratamiento del derrame pleural. Actualización. Arcc Bronconeumol 2014; 14;50:235-49-Vol50.
- Suarez M, Gonzalez-Martinez A, Vila M, González-Cantalapiedra A, Santamarina G. Efusiones Pleurales en pequeños animales. Clínica veterinaria Pequeños Animales, 2012,32 (2): 65-78.
- Epstein SE. Exudative pleural diseases in small animals.Vet Clin North Am Small Anim Pract. 2014 Jan;44(1):161-80.
- Zoia A, Drigo M. Diagnostic value of Light,s criteria and albumin gradient in classifying the pathophysiology of pleural effusion formation in cats. J Feline med Surg. 2016 Aug; 18:666-72.
- Zoia A, Slater LA, HellerJ, Connolly DJ, Church DB. A new aproach to pleural effusion in cats: markers for distinguishing transudates from exudates. J. Feline Med Surg.2009 Oct;11(10):847-55.
- Rose A, Funk D, Neiger R. Comparison of refractometry and biuet assay for measurement of total protein concentration in canine abdominal and pleural fluid specimens. J Am Vet Med Assoc 2016 Apr 1;248 (7):789-94.
- Hassdenteufel E, Henrich E, Hildebrandt N, Stosic A, Schneider M. Assessment of circulating N-terminal proB-type natriuretic peptide concentration to differentiate between cardiac from noncardiac causes of pleural effusion in cats. J. Vet. Emerg Crit. Care (San Antonio). 2013 Jul-Aug;23(4):416-22.
- Humm K, Hezzel M, Sargent J, Connolly DJ, Boswood A. Differentiating between feline pleural effusions of cardiac and non-cardiac origin using pleuralfluid NT-proBNP concentrations. J Small Anim Pract. 2013. Dec;54(12):656-61.
- Stillion JR, Letendre JA. A clinical review of the pathophysiology, diagnosis, and treatment of pyothorax in dogs and cats. J Vet Emerg Crt Care (San Antonio). 2015 Jan-feb;25(1):113-29.
- Wurtinger G, Henrich E, Hildebrandt N, Wiedeman N, Scneider M, Hassdenteufel E. Asessment of bedside test for N-terminal pro B type natriuretic peptide (NT-proBNP) to differentiate cardiac from non-cardiac causes of pleural effusion in cats. BMC Vet Res.2017 Dec 20;13(1):394.
- Fischer Y, Weber K, Sauter-Louis K, Hartmann K. The Rivalta´s test as a diagnostic variable in feline effusions-evaluation of optimum reaction and storage conditions. Tierarztl Prax Ausg K Kleintiere Heimtiere. 2013;41(5):297-303
- Hazuchova K, Held S, Neiger R. Usefulness of acute phase proteins in differentiating between feline infectious peritonitis and other diseases in cats with body cavity effusions. J Feline med. Surg.2017 Aug;19(8):809-816.
- Li J, Zhang W, Wang W, Jiang Y, Zhao S, Liu W, Li G, Liu N, Li Q, Su X. Forty-nine cases of acute lymphoblastic leukaemia/lymphoma in pleural and pericardial effusions: A cytological-histological correlation. Arch Bronconeumol.2018 Feb 26. Pii:S0300-2896(18)30029-2.doi:10.1016/j.arbres.2018.01.014.
- Bielsa S, García-Zamalloa A, Monteagudo P, Gonzalez-Sans D, et al. Detection of Pleural Fluid Biochemistry Changes in Two Consecutive Thoracentesis for Differentiating Malignant from Benign Effusions. 2018 SEPAR Elsevier España.
- Probo M, Valenti V, Venco L, et al Pleural lymphocyte-rich transudates in cats. J Feline med Surg 2017 Sep
- Wurtinger G, Henrich E, Hildebrandt N, Wiedeman N, Scneider M, Hassdenteufel E. Asessment of bedside test for N-terminal pro B type natriuretic peptide (NT-proBNP) to differentiate cardiac from non-cardiac causes of pleural effusion in cats. BMC Vet Res.2017 Dec 20;13(1):394.
- Hezzel MJ, Rush JE, Humm K, et al. Differentiation of Cardiac from Noncardiac Pleural effusions in Cats using Second-Generation Quantitative and Point-of-Care NT-proBNP Measurements. J. Vet Intern Med. 2016 Mar.Apr;30(2):536-42.
- Johns SM, Nelson OL, Gay JM. Left atrial function in cats with left-sided cardiac disease and pleural effusion or pulmonary edema. J.Vet Inter Med. 2012 Sep-Oct;26(5):1134-9.
- Hung GC, Gaunt MC, Rubin JE, Starrak GS, Sakals SA. Quantification and characterization of pleural fluid in healthy dogs with thoracostomy tubes. Am J. Vet Res. 2016 dec;77(12):1387-1391.
- Fischer Y, Sauter-Louis C, Hartmann K. Diagnostic accuracy of the Rivalta test for feline infectious peritonitis. 2012. Vet. Clin. Pathol. 41 (4):558-67
- Chandler EA, Gaskel CJ, Gaskell RM. Medicina y Terapeútica felina. Multimédica ediciones (3ª Ed.) 2007. Capítulo12. A.M. Kerins y r: Breathnach. Pag. 303-311.
- Nelson RW, Couto CG. Medicina Interna de animales pequeños. 2005. Ed. Intermédica. (3ª Ed). Vol.1 Capitulo 23. Eleonor c: Hawkins. Pag 336-342.
Publicado en la revista Centro Veterinario
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía