El panorama de desarrollo de la vacuna COVID-19
 La secuencia genética del SARS-CoV-2, el coronavirus que causa COVID-19, se publicó el 11 de enero de 2020, lo que desencadenó una intensa actividad global de I + D para desarrollar una vacuna contra la enfermedad. La escala del impacto humanitario y económico de la pandemia de COVID-19 está impulsando la evaluación de las plataformas de tecnología de vacunas de próxima generación a través de nuevos paradigmas para acelerar el desarrollo, y el primer candidato a la vacuna de COVID-19 ingresó a pruebas clínicas en humanos con una rapidez sin precedentes el 16 de marzo de 2020 .
La secuencia genética del SARS-CoV-2, el coronavirus que causa COVID-19, se publicó el 11 de enero de 2020, lo que desencadenó una intensa actividad global de I + D para desarrollar una vacuna contra la enfermedad. La escala del impacto humanitario y económico de la pandemia de COVID-19 está impulsando la evaluación de las plataformas de tecnología de vacunas de próxima generación a través de nuevos paradigmas para acelerar el desarrollo, y el primer candidato a la vacuna de COVID-19 ingresó a pruebas clínicas en humanos con una rapidez sin precedentes el 16 de marzo de 2020 .
La Coalition for Epidemic Preparedness Innovations (CEPI) está trabajando con las autoridades sanitarias mundiales y los desarrolladores de vacunas para apoyar el desarrollo de vacunas contra COVID-19. Para facilitar este esfuerzo, hemos desarrollado y mantenemos continuamente una visión general del panorama global de la actividad de desarrollo de la vacuna COVID-19. Nuestra base de datos paisajística incluye programas de desarrollo de vacunas informados a través de la lista autorizada y continuamente actualizada de la OMS, junto con otros proyectos identificados de fuentes públicas y privadas (ver Recuadro complementario 1). El panorama proporciona información sobre las características clave de la I + D de la vacuna COVID-19 y sirve como un recurso para la gestión continua de la cartera en CEPI. También hemos compartido nuestra información sobre el paisaje con otros en el ecosistema de salud global para ayudar a mejorar la coordinación en la respuesta al brote de COVID-19 y permitir que los recursos y capacidades globales se dirijan hacia los candidatos a vacunas más prometedores.
Paisaje de I + D de la vacuna COVID-19
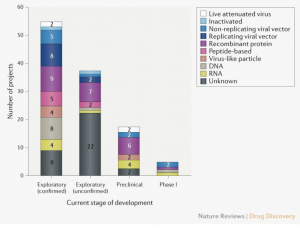
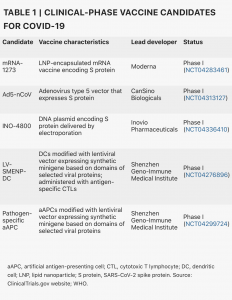
A partir del 8 de abril de 2020, el panorama global de I + D de la vacuna COVID-19 incluye 115 vacunas candidatas (Fig.1), de las cuales 78 están confirmadas como activas y 37 no están confirmadas (el estado de desarrollo no puede determinarse a partir de fuentes de información privadas o de propiedad pública). De los 78 proyectos activos confirmados, 73 se encuentran actualmente en etapas exploratorias o preclínicas. Los candidatos más avanzados se han movido recientemente al desarrollo clínico, incluidos mRNA-1273 de Moderna, Ad5-nCoV de CanSino Biologicals, INO-4800 de Inovio y LV-SMENP-DC y aAPC específico de patógeno del Instituto Médico Geno-Inmune de Shenzhen ( Tabla 1). Muchos otros desarrolladores de vacunas han indicado planes para iniciar pruebas en humanos en 2020.
Diversidad de plataformas tecnológicas. Una característica sorprendente del panorama de desarrollo de vacunas para COVID-19 es la gama de plataformas tecnológicas que se evalúan, que incluyen ácido nucleico (ADN y ARN), partículas similares a virus, péptidos, vectores virales (replicantes y no replicantes), proteínas recombinantes, virus vivos atenuados y virus inactivados (Fig. 1). Muchas de estas plataformas no son actualmente la base de las vacunas autorizadas, pero la experiencia en campos como la oncología está alentando a los desarrolladores a aprovechar las oportunidades que ofrecen los enfoques de próxima generación para una mayor velocidad de desarrollo y fabricación. Es concebible que algunas plataformas de vacunas se adapten mejor a subtipos de población específicos (como ancianos, niños, mujeres embarazadas o pacientes inmunocomprometidos).
Teniendo en cuenta los candidatos en la Tabla 1, las nuevas plataformas basadas en ADN o ARNm ofrecen una gran flexibilidad en términos de manipulación de antígenos y potencial de velocidad. De hecho, Moderna comenzó las pruebas clínicas de su vacuna basada en ARNm mRNA-1273 solo 2 meses después de la identificación de la secuencia. Las vacunas basadas en vectores virales ofrecen un alto nivel de expresión de proteínas y estabilidad a largo plazo, e inducen fuertes respuestas inmunes. Finalmente, ya existen vacunas autorizadas basadas en proteínas recombinantes para otras enfermedades, por lo que dichos candidatos podrían aprovechar la capacidad de producción a gran escala existente.
Para algunas plataformas, los adyuvantes podrían mejorar la inmunogenicidad y hacer que las dosis más bajas sean viables, permitiendo así la vacunación de más personas sin comprometer la protección. Hasta ahora, al menos 10 desarrolladores han indicado planes para desarrollar vacunas adyuvantes contra COVID-19, y los desarrolladores de vacunas que incluyen GlaxoSmithKline, Seqirus y Dynavax se han comprometido a poner a disposición adyuvantes con licencia (AS03, MF59 y CpG 1018, respectivamente) para usar con COVID nuevo -19 vacunas desarrolladas por otros.
La información pública sobre los antígenos específicos de SARS-CoV-2 utilizados en el desarrollo de vacunas es limitada. La mayoría de los candidatos para los que hay información disponible apuntan a inducir anticuerpos neutralizantes contra la proteína del pico viral (S), evitando la absorción a través del receptor ACE2 humano. Sin embargo, no está claro cómo las diferentes formas y / o variantes de la proteína S utilizada en diferentes candidatos se relacionan entre sí o con la epidemiología genómica de la enfermedad. La experiencia con el desarrollo de la vacuna contra el SARS indica el potencial de efectos de mejora inmunológica de diferentes antígenos, lo cual es un tema de debate y podría ser relevante para el avance de la vacuna.
Perfil de los desarrolladores de vacunas. De los candidatos a vacunas activas confirmadas, 56 (72%) están siendo desarrollados por desarrolladores privados / industriales, y los 22 (28%) proyectos restantes están dirigidos por organizaciones académicas, del sector público y otras organizaciones sin fines de lucro (Fig. 2). Aunque varios grandes desarrolladores de vacunas multinacionales (como Janssen, Sanofi, Pfizer y GlaxoSmithKline) se han involucrado en el desarrollo de la vacuna COVID-19, muchos de los principales desarrolladores son pequeños y / o no tienen experiencia en la fabricación de vacunas a gran escala. Por lo tanto, será importante garantizar la coordinación de la fabricación de vacunas y la capacidad de suministro y la capacidad para satisfacer la demanda.
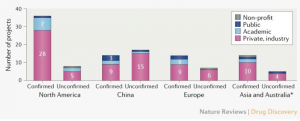
La mayor actividad de desarrollo de la vacuna COVID-19 se encuentra en América del Norte, con 36 (46%) desarrolladores de los candidatos de vacuna activa confirmados en comparación con 14 (18%) en China, 14 (18%) en Asia (excluyendo China) y Australia, y 14 (18%) en Europa (Fig. 2). Se han informado esfuerzos adicionales de desarrollo de vacunas para China, y CEPI está en diálogo con el Ministerio de Ciencia y Tecnología de China para confirmar su estado.
Los desarrolladores principales de candidatos activos a la vacuna COVID-19 se distribuyen en 19 países, que en conjunto representan más de las tres cuartas partes de la población mundial. Sin embargo, actualmente no hay información pública sobre la actividad de desarrollo de vacunas en África o América Latina, aunque en estas regiones existen marcos regulatorios y de capacidad de fabricación de vacunas. La epidemiología de COVID-19 puede diferir según la geografía, y es probable que el control efectivo de la pandemia requiera una mayor coordinación y participación del hemisferio sur en los esfuerzos de investigación y desarrollo de vacunas.
Panorama
El esfuerzo global de I + D de vacunas en respuesta a la pandemia de COVID-19 no tiene precedentes en términos de escala y velocidad. Dado el imperativo de la velocidad, hay una indicación de que las vacunas podrían estar disponibles bajo uso de emergencia o protocolos similares a principios de 2021. Esto representaría un cambio fundamental de la vía tradicional de desarrollo de vacunas, que toma en promedio más de 10 años, incluso en comparación con El plazo acelerado de 5 años para el desarrollo de la primera vacuna contra el Ébola, y necesitará nuevos paradigmas de desarrollo de vacunas que involucren fases de desarrollo paralelas y adaptativas, procesos reguladores innovadores y escalar la capacidad de fabricación.
Los puntos de referencia de la industria para los paradigmas tradicionales de desarrollo de vacunas citan tasas de deserción para vacunas autorizadas de más del 90%. Es probable que los enfoques que se aplican para el desarrollo de COVID-19, que involucran un nuevo objetivo de virus y, a menudo, nuevas plataformas tecnológicas de vacunas y nuevos paradigmas de desarrollo, probablemente aumenten los riesgos asociados con la administración de una vacuna autorizada, y requerirán una evaluación cuidadosa de la efectividad y seguridad en cada paso. Con el fin de evaluar la eficacia de la vacuna, se están desarrollando modelos animales específicos de COVID-19, incluidos ratones transgénicos ACE2, hámsters, hurones y primates no humanos. Se necesitan medidas de contención de nivel de bioseguridad 3 para estudios en animales que involucren desafíos de virus vivos, y es probable que la demanda de estas capacidades requiera coordinación internacional para asegurar que haya suficiente capacidad de laboratorio disponible.
Finalmente, se necesitará una fuerte coordinación y cooperación internacional entre los desarrolladores de vacunas, los reguladores, los encargados de la formulación de políticas, los financiadores, los organismos de salud pública y los gobiernos para garantizar que los candidatos prometedores de vacunas en etapa tardía puedan fabricarse en cantidades suficientes y suministrarse de manera equitativa a todas las áreas afectadas, especialmente a niveles bajos. -recursos de regiones. El CEPI ha emitido recientemente una solicitud de fondos para apoyar los esfuerzos mundiales de desarrollo de vacunas COVID-19 guiados por tres imperativos: velocidad, fabricación y despliegue a escala y acceso global. Mantenemos un enfoque dinámico de gestión de cartera y haremos que nuestros recursos científicos habilitantes estén disponibles a nivel mundial. Instamos a la comunidad mundial de vacunas a movilizar colectivamente el apoyo técnico y financiero necesario para abordar con éxito la pandemia de COVID-19 a través de un programa de vacunación global, y proporcionar una base sólida para enfrentar futuras pandemias.
Agradecimientos
Los autores agradecen a F. Kristensen, N. Lurie y M. Christodoulou de CEPI y D. Vaughn de BMGF por su orientación y aportes. Agradecemos a la OMS por poner a disposición los datos del paisaje COVID-19.
Por Tung Thanh Le, Zacharias Andreadakis, Arun Kumar, Raúl Gómez Román, Stig Tollefsen, Melanie Saville&Stephen Mayhew

