β-defensina-4 como biomarcador endógeno en vacas con mastitis
β-defensina-4 como biomarcador endógeno en vacas con mastitis
- Instituto de Medicina Veterinaria, Georg-August-Universidad de Gotinga, Gotinga, Alemania
Introducción: Las defensinas son péptidos con efectos antimicrobianos e inmunomoduladores. Su concentración podría alterarse durante las infecciones y, por lo tanto, proporcionar información sobre el pronóstico y el curso de la enfermedad. El objetivo del presente estudio fue investigar la concentración de defensina en vacas con mastitis con el fin de encontrar correlaciones entre la expresión clínica y el curso de la enfermedad y la concentración de defensina en la leche y la sangre.
Métodos: Se examinaron un total de 85 vacas lecheras. De estos, 30 animales sufrieron mastitis clínica aguda, 25 animales fueron diagnosticados con mastitis subclínica y 30 animales se consideraron un grupo de comparación saludable. La beta-defensina-4 (DEFB-4) se determinó mediante un ensayo de inmunoabsorción enzima específica de la especie (ELISA) (Bovine Defensin Beta 4 ELISA Kit, MyBioSource).
Resultados: Se detectaron las concentraciones más altas de DEFB-4 en los animales con mastitis clínica aguda. Se midieron valores de 0 a 895 pg/mL (mediana: 115 pg/mL) en la leche y de 40 a 016 pg/mL (mediana: 245 pg/mL) en suero. Las concentraciones de este grupo diferían significativamente de las de los animales con mastitis subclínica (p < 0,0001 suero; p = 0,015 leche). En este grupo, se registraron concentraciones de 15-211 pg/mL (mediana: 46 pg/mL) en la leche y 20-271 pg/mL (mediana: 85 pg/mL) en el suero.
Discusión: Nuestros resultados también muestran que en los casos de mastitis aguda después de 12 días de tratamiento todavía hay un proceso inflamatorio activo en el tejido, porque no se pudo encontrar una reducción significativa de las células somáticas y la defensina después del nuevo examen. Dado que las concentraciones de DEFB-4 de animales con mastitis clínica que tuvieron que ser tratados con antibióticos diferían significativamente de las de los animales con mastitis subclínica que no requerían tratamiento con antibióticos, se puede suponer que el DEFB-4 bovino es un parámetro endógeno importante para la defensa contra las infecciones bacterianas de la ubre.
1. Introducción
La interacción entre los patógenos y el huésped en una inflamación relacionada con la infección es un proceso complejo. Aunque la comprensión de este proceso está progresando, solo se han establecido unos pocos marcadores (leucocitos, proteínas de fase aguda, globulinas) para evaluar su extensión y curso, así como el pronóstico. El aumento del conocimiento de los mecanismos de la inflamación relacionada con la infección podría generar nuevos marcadores y abrir más opciones terapéuticas en enfermedades infecciosas.
Las defensinas son péptidos antimicrobianos (AMP), que forman parte del sistema inmunitario activo (1-3). En función de su estructura molecular, se pueden distinguir alfa, beta y thetadefensinas (1, 4). La liberación local de defensinas es inducida por una reacción mediada por un receptor de tipo Toll (TLR) en la que el receptor de la célula huésped interactúa con patrones moleculares asociados a patógenos (PAMP), como los lipopolisacáridos. La consecuencia de la unión a los receptores es el aumento de la expresión de defensinas (5, 6). En consecuencia, Goldammer et al. (7) podrían demostrar una expresión de DEFB-5 bovino inducida por TLR-2 y TLR-4.
Los efectos de las defensinas son antimicrobianos e inmunomoduladores. El primer efecto se basa en la carga molecular positiva, que permite una interacción dependiente de la carga con la pared celular bacteriana cargada negativamente, especialmente los lipopolisacáridos (8). Por lo tanto, las defensinas pueden causar despolarización de la membrana celular y, por lo tanto, una desestabilización del potencial de la membrana y la lisis de la célula (8, 9). Además, las defensinas muestran funciones inmunomoduladoras. Algunas defensinas tienen un efecto quimiotáctico en los monocitos y macrófagos (10, 11) e inducen la activación y degranulación de los mastocitos (12, 13). Posteriormente, se liberan histamina y prostaglandina D2, que promueven el reclutamiento de granulocitos de neutrófilos (14, 15). La degranulación de los granulocitos de neutrófilos reclutados vuelve a liberar defensinas, lo que resulta en un bucle de retroalimentación positiva (11). Además, actúan quimiotácticamente sobre las células dendríticas y las células de memoria T y, por lo tanto, representan un vínculo entre la respuesta inmune innata y adaptativa (16).
La investigación de las defensinas parece ser interesante para identificar nuevos biomarcadores endógenos para la detección de procesos inflamatorios relacionados con la infección, el pronóstico de enfermedades y, posiblemente, para evaluar las opciones terapéuticas. Aquí, la mastitis ha sido elegida como una enfermedad infecciosa, ya que es una de las enfermedades más comunes de las vacas (17-19). Conduce a graves pérdidas financieras y causa un uso masivo de antibióticos en la industria láctea en todo el mundo (20). La mastitis suele ser causada por infecciones bacterianas (21). Los principales patógenos de la mastitis son los estafilococos, especialmente el Staphylococcus aureus (S. aureus), los estreptococos, como el Streptococcus uberis (S. uberis), así como los enterococos y Escherichia coli (E. coli) (22).
En el presente estudio, se ha investigado el DEFB-4 en vacas con mastitis. DeFB-4 se eligió porque esta molécula ya se ha detectado en vacas (23-26). Younis et al. (21) han demostrado que en las vacas la expresión de los genes DEFB-4 es inducida por la infección por E. coli de la glándula mamaria. Por lo tanto, el objetivo era determinar los niveles de proteína DEFB-4 en la leche y el suero sanguíneo con el fin de investigar posibles correlaciones con la mastitis aguda vs. subclínica en vacas.
2. Material y métodos
2.1. animales
En el estudio se examinó un total de 85 vacas de la raza Holstein-Friesian.
Los animales se dividieron en tres grupos. El grupo 1 es el grupo de control que consistía en vacas clínicamente sanas cuyo recuento de células somáticas de la leche era ≤ 100.000 células/ml. Ninguno de los cuartos de la ubre mostró signos clínicos de inflamación y la secreción fue macroscópicamente normal.
El grupo 2 consistía en animales con mastitis aguda. Se utilizaron los siguientes criterios: el recuento de células somáticas en la leche fue de >100.000 células/ml y mostraron síntomas clínicos de inflamación en al menos un cuarto de ubre. Además, la leche se alteró macroscópicamente.
El grupo 3 incluyó animales con mastitis subclínica. En comparación con el grupo de control, el recuento de células somáticas en la leche fue de >100.000 células/ml. En estos animales, ninguno de los cuartos de la ubre mostró signos clínicos de inflamación y la leche no se alteró macroscópicamente.
Se tomaron muestras de leche y sangre de cada animal el primer día de tratamiento y nuevamente después de 12 días en los grupos 2 y 3. En un estudio cinético de tiempo adicional, se monitorearon cuatro vacas con mastitis aguda durante siete semanas. Se volvieron a examinar después de tres, cinco y siete semanas, y cada vez se recogieron una muestra de leche y otra de sangre. Una de estas vacas mostró cambios en dos cuartos de ubre y por lo tanto se tomaron dos muestras de leche en este caso. Todos los exámenes fueron aprobados por la Oficina Estatal de Protección al Consumidor y Seguridad Alimentaria de Baja Sajonia (Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit, LAVES) (número de expediente: 33.9-42502-05-16A089), llevados a cabo de conformidad con la Ley de Bienestar Animal y supervisados por el Oficial de Bienestar Animal de la Universidad Georg-August en Göttingen.
2.2. Muestras
2.2.1. Muestras de leche: Preparación para la medición DEFB-4, recuento de células somáticas, bacteriología
Las muestras de leche se tomaron después de una limpieza a fondo de los pezones con paños de limpieza húmedos neutros en la piel con pH. En el grupo 2 se tomó una muestra de leche del cuarto inflamado. En el grupo 3 se tomó muestras del cuarto con el mayor recuento de células somáticas de acuerdo con la prueba de mastitis de California, mientras que en el grupo 1 se recogieron muestras de leche de todos los trimestres. Una parte de la muestra de leche se utilizó para el análisis DEFB-4. Para este propósito, la leche se centrifugó a 1.000 x g durante 20 minutos. Después de eliminar la capa de grasa, se pipeteó el sobrenadante, se alícuolió en tubos de Eppendorf y se congeló a -80 °C.
Otra parte de la muestra de leche se utilizó para medir el recuento de células somáticas utilizando el recuento óptico de fluorescencia automatizado (Fossomatic). Para este propósito, se llenaron unos cinco ml de leche en tubos especiales para el diagnóstico de mastitis (IfM, Verden, Alemania) y se enviaron al Instituto de Pruebas de Leche (Institut für Milchuntersuchung, IfM, Verden, Alemania). Una tercera parte de la muestra de leche se utilizó para el examen microbiológico en el Instituto de Microbiología de la Universidad de Medicina Veterinaria de Hannover extendiendo la leche en diferentes medios, como el agar de Columbia, el agar de Gassner, el agar selectivo para estafilococos y estreptococos, respectivamente, y añadiendo alrededor de 200 μL a un caldo de Después de una incubación específica, los niveles de colonización se dividieron en bajos (1,0 x 103 bacterias/ml de leche), medios (1,0 × 104 – 105 bacterias/ml de leche) y altos (≥0 × 106 bacterias/mL de leche).
2.2.2. Muestras de sangre: Preparación para la medición de DEFB-4, hematología, química clínica
Se tomaron muestras de sangre de la vena caudal media utilizando una cánula de inyección estéril (20G 0,9 × 40 mm) y se transfirieron a tubos de suero y EDTA (Sarstedt AG & Co, Nümbrecht, Alemania). Para el análisis DEFB-4, uno de los tubos de suero se centrifugó a 1.000 × g durante 20 minutos, se pipeteó, alícuol y se congeló a -80 °C hasta el análisis.
Además, se utilizaron análisis de sangre para detectar leucocitos, su diferenciación y para medir los parámetros clínico-químicos para determinar el estado de salud de los animales. Se realizaron exámenes hematológicos en sangre EDTA utilizando la máquina de análisis IDEXX ProCyte DxTM (IDEXX Laboratories Inc., Westbrook, Maine, EE. UU.). Para los parámetros clínico-químicos, el suero se centrifugó a 1.000 × g durante 6 minutos y se midió fotométricamente por Konelab 20i (Thermo Fischer Scientific Inc., Dreieich, Alemania).
2.3. Detección de DEFB-4 mediante un ensayo de inmunoabsorción enzimática
Se utilizó un kit ELISA de sándwich cuantitativo específico de la especie con una sensibilidad reportada de 2,0 pg/ml para medir los niveles de DEFB-4 en suero y leche (MyBioSource, San Diego, EE. UU.; Cat. No.: MBS9353192). El inmunógeno del anticuerpo de captura es la proteína recombinante de longitud completa del bovino DEFB-4. El inmunógeno del anticuerpo de detección es un fragmento recombinante de acuerdo con aa 23-63 de Bovino DEFB-4. El estándar es la proteína bovina recombinante de longitud completa de E.coli.
Según el fabricante, el coeficiente de variación intra e inter-ensayado es <15 %, que pudimos confirmar con valores incluso <10 %. Todas las muestras y estándares se añadieron por triplicado a la placa precubierta con un anticuerpo monoclonal específico DEFB-4. Posteriormente, se añadió un segundo anticuerpo conjugado a la peroxidasa de rábano picante y se incubó la placa durante 1 h a 37 °C. El plato se lavó 4 veces con solución de lavado y se eliminó todo el líquido. Se añadieron peróxido de hidrógeno y tetrametilbencidina, lo que resultó en un cambio de color a azul durante un segundo período de incubación durante 15 minutos a 37 °C. La reacción se detuvo añadiendo ácido sulfúrico, visible por el cambio de color a amarillo. La densidad óptica se determinó fotométricamente a una longitud de onda de 450 nm utilizando un lector de microplacas TECAN (TECAN Austria GmBH, Grödig, Austria). La serie estándar se expresó como una función lineal, que luego se utilizó para calcular las concentraciones de DEFB-4.
2.4. Estudio in vitro
Para un estudio in vitro, se recogió leche de vaca fresca y no tratada de cuatro animales clínicamente sanos y se alícuolé en tres partes. Una muestra quedó sin tratamiento, una muestra fue inoculada con E. coli (1,0 x 103 UFC) y una muestra con Streptococcus (Sc.) agalactiae (1,0 × 103 UFC). Las muestras se incubaron a 37 °C y se analizaron las submuestras para DEFB-4 después de 24, 36, 48 y 72 h. La concentración de DEFB-4 utilizada para la comparación dependiendo del tiempo fue la media de las cuatro muestras de leche. Además, se midió el recuento de células somáticas de las muestras (IfM, Verden, Alemania).
2.5. Estadísticas
Todos los datos se analizaron estadísticamente y se presentaron gráficamente con el programa Prism 8 (GraphPad Software, San Diego, EE. UU.).
Los valores se examinaron para la distribución normal mediante la prueba Shapiro-Wilk. La mediana, el cuartil inferior y superior, así como los valores máximo y mínimo, se visualizaron utilizando gráficos de caja y dispersión.
A excepción del grupo de control saludable, todos los valores de los grupos individuales no se distribuyeron normalmente, por lo que se utilizaron procedimientos de prueba no paramétricos. Para la comparación de dos grupos independientes (por ejemplo, sanos/enfermetos) se utilizó la prueba Mann-Whitney-U, para dos grupos interdependientes (por ejemplo, el examen inicial y el reexamen del mismo animal) se utilizó la prueba de rango firmado de Wilcoxon. Para probar las correlaciones, se realizó la correlación de rango de Spearman. A P < 0,05 se consideró estadísticamente significativo. Además, se realizó un análisis de ROC para determinar el límite para distinguir entre la mastitis subclínica y las vacas sanas.
3. Resultados
3.1. Comparación de las concentraciones de DEFB-4 de vacas sanas frente a vacas con mastitis clínica aguda
Las concentraciones de DEFB-4 en vacas sanas se compararon con las de vacas enfermas. Por lo tanto, se examinaron y muestrearon 30 vacas clínicamente sanas (grupo 1) cuyo recuento de células somáticas de leche fue de 44.000 células/ml (7.000 a 100.000 células/ml) (Figura 1). Como era de esperar, los animales de este grupo mostraron leucocitos dentro del rango normal y no mostraron signos de enfermedad. En unas pocas muestras se detectaron Staphylococcus aureus (n = 5), Streptococcus parauberis (n = 5), Streptococcus uberis (n = 3) y Escherichia coli (n = 3). En este grupo, las concentraciones de DEFB-4 oscilaron entre 48 y 344 pg/mL (mediana: 153 pg/mL) en suero y 83-120 pg/mL (mediana: 97 pg/mL) en la leche (Figuras 1, 2). Se tomaron muestras de 30 vacas con mastitis clínica aguda (grupo 2). Antes del muestreo, se supo, debido a la información del agricultor respectivo, que se aumentó el recuento combinado de células somáticas de los cuatro cuartos de la ubre juntos. Sin embargo, debido a problemas técnicos, solo fue posible medir el recuento de células somáticas del cuarto de ubre afectado aislado de 14 vacas. Por lo tanto, las evaluaciones estadísticas se basaron solo en 14 animales. El recuento promedio de células somáticas fue de 8.890.000 células/ml (155.000-21.142.000 células/ml) (Figura 1). Todas las vacas del grupo 2 mostraron síntomas clínicos típicos de mastitis. En consecuencia, en la mayoría de las muestras se detectaron patógenos típicos de mastitis, incluidos S. uberis (n = 12) y E. coli (n = 6) que se identificaron como los principales patógenos. Se muestran más detalles en la Tabla Suplementaria 1. En el grupo 2 se encontraron las concentraciones más altas de DEFB-4. En suero, las concentraciones oscilaron entre 40 y 1.016 pg/mL (mediana: 245 pg/mL), en la leche de 0 a 895 pg/mL (mediana: 115 pg/mL). En comparación con las concentraciones de DEFB-4 del grupo de control sano, encontramos que las concentraciones séricas de DEFB-4 del grupo 2 fueron significativamente más altas (p = 0,02), pero no se pudo detectar ninguna significación en la leche (p = 0,61) (Figura 1).
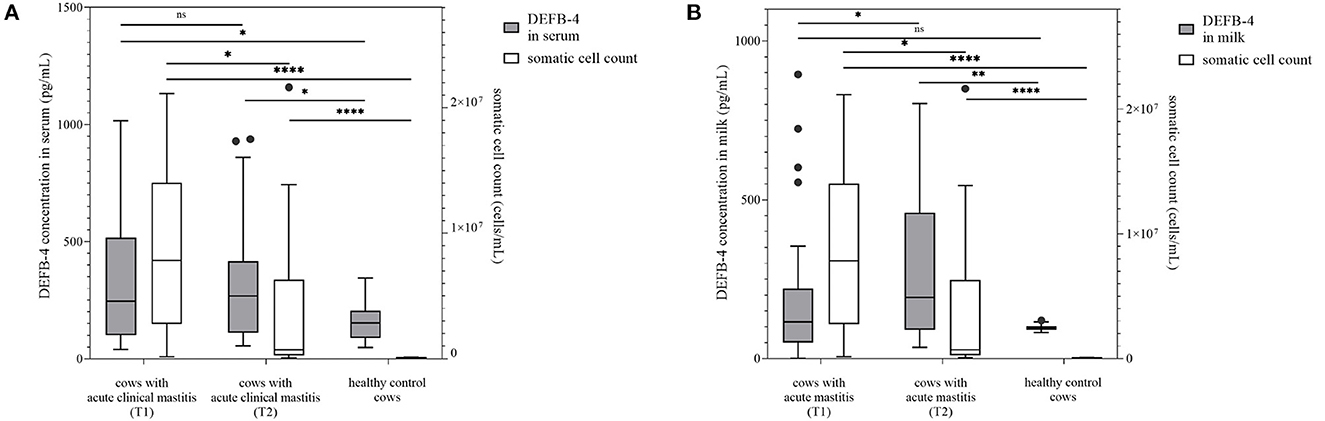 Figura 1. La concentración de DEFB-4 se agrupó con el recuento de células somáticas, que actualmente es el parámetro estándar para la detección de mastitis. Se probaron 30 vacas con mastitis clínica aguda en dos momentos diferentes y se compararon con un grupo de control saludable. T1 marca el momento del muestreo inicial y T2 el tiempo del segundo muestreo 12 días después. (A) muestra las concentraciones de DEFB-4 en suero y (B) muestra las concentraciones de DEFB-4 en la leche. Los cambios significativos están marcados con asteriscos (*), mientras que «ns» significa «no significativo». El nivel de significación se establece en p < 0,05.
Figura 1. La concentración de DEFB-4 se agrupó con el recuento de células somáticas, que actualmente es el parámetro estándar para la detección de mastitis. Se probaron 30 vacas con mastitis clínica aguda en dos momentos diferentes y se compararon con un grupo de control saludable. T1 marca el momento del muestreo inicial y T2 el tiempo del segundo muestreo 12 días después. (A) muestra las concentraciones de DEFB-4 en suero y (B) muestra las concentraciones de DEFB-4 en la leche. Los cambios significativos están marcados con asteriscos (*), mientras que «ns» significa «no significativo». El nivel de significación se establece en p < 0,05.
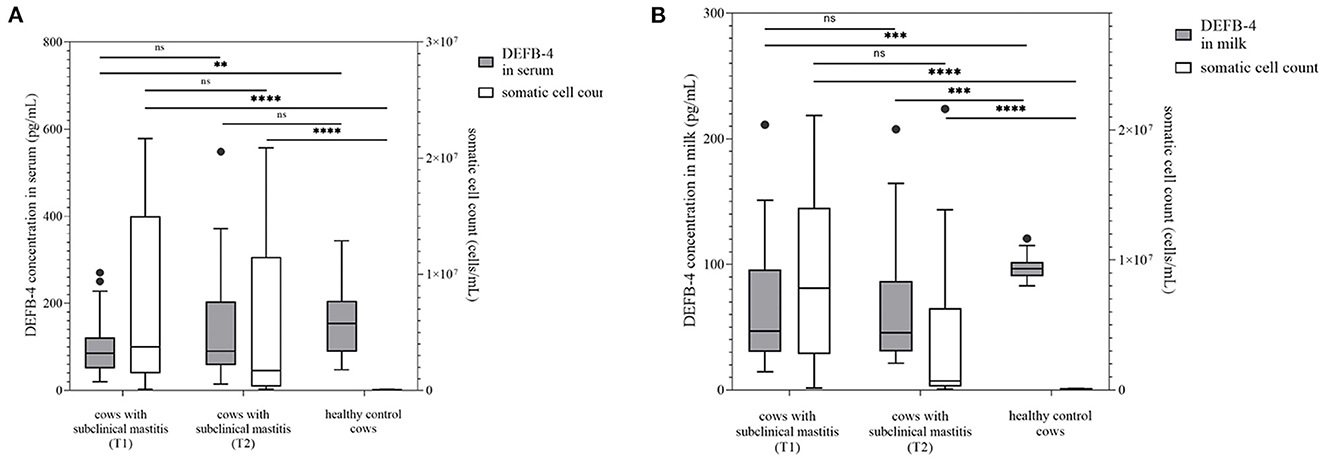 Figura 2. La concentración de DEFB-4 se agrupó con el recuento de células somáticas, que es actualmente el parámetro estándar para la detección de mastitis. Se probaron 25 vacas con mastitis subclínica en dos momentos diferentes y se compararon con un grupo de control sano. T1 marca el momento del muestreo inicial y T2 el tiempo del segundo muestreo 12 días después. (A) muestra las concentraciones de DEFB-4 en suero y (B) muestra las concentraciones de DEFB-4 en la leche. Los cambios significativos están marcados con asteriscos (*), mientras que «ns» significa «no significativo». El nivel de significación se establece en p < 0,05.
Figura 2. La concentración de DEFB-4 se agrupó con el recuento de células somáticas, que es actualmente el parámetro estándar para la detección de mastitis. Se probaron 25 vacas con mastitis subclínica en dos momentos diferentes y se compararon con un grupo de control sano. T1 marca el momento del muestreo inicial y T2 el tiempo del segundo muestreo 12 días después. (A) muestra las concentraciones de DEFB-4 en suero y (B) muestra las concentraciones de DEFB-4 en la leche. Los cambios significativos están marcados con asteriscos (*), mientras que «ns» significa «no significativo». El nivel de significación se establece en p < 0,05.
Después de 12 días, se volvió a examinar a todas las vacas del grupo 2. Una disminución significativa del recuento de células en el grupo 2 fue evidente (p = 0,0105), si solo se tenían en cuenta los recuentos de células somáticas medibles. El recuento promedio de células en la leche de 28 muestras medibles fue de 3.300 000 células/ml (56.000-21.628.000 células/ml) (Figura 1).Todavía se podían detectar S. uberis (n = 7) y E. coli (n = 7.
Las concentraciones séricas de DEFB-4 oscilaron entre 54 y 938 pg/ml (mediana: 268 pg/ml) y en la leche de 35 a 803 pg/mL (mediana: 192 pg/mL). No se pudo detectar una diferencia significativa en las concentraciones séricas de DEFB-4 desde la inicial hasta el reexamen, sin embargo, en la leche, las concentraciones de DEFB-4 aumentaron significativamente (p = 0,022) y ahora eran significativamente diferentes de la concentración de DEFB-4 de vacas sanas (p = 0,0051) (Figura 1). En resumen, las concentraciones séricas de DEFB-4 difirieron significativamente entre las vacas sanas y las vacas con mastitis aguda al inicio de los síntomas clínicos, mientras que las diferencias en las concentraciones de DEFB-4 en la leche entre estos grupos solo fueron detectables en el momento posterior (12 días).
3.2. Comparación de las concentraciones de DEFB-4 de vacas sanas frente a vacas con mastitis subclínica
Además, se compararon las concentraciones de DEFB-4 de vacas sanas (grupo 1) con 25 vacas diagnosticadas con mastitis subclínica (grupo 3). Estas vacas no mostraron signos clínicos de mastitis, pero sí un aumento en el recuento de células somáticas con un valor promedio de 7.375.000 células/ml (117.000-21.673.000 células/mL) (Figura 2), que no fue significativamente inferior al valor promedio del grupo 2. Se pueden encontrar bacterias patógenas en la leche como S. uberis (n = 11), S. aureus (n = 6) y Streptococcus dysgalactiae (S. dysgalactiae) (n = 3). En el grupo 3 se detectaron las concentraciones más bajas de DEFB-4. En suero, los valores de DEFB-4 oscilaron entre 20 y 271 pg/mL (mediana: 85 pg/mL), y en la leche entre 15 y 211 pg/mL (mediana: 46 pg/mL). Las concentraciones séricas y de leche de DEFB-4 del grupo 1 fueron significativamente más altas que las del grupo 3 (suero: p = 0,0025; leche: p = 0,0007) (Figura 2).En comparación con el grupo 2, en el suero y la leche, las concentraciones de DEFB-4 del grupo 3 fueron significativamente más bajas que las del grupo 2 (suero: p < 0,0001; leche: p = 0,015). Después de 12 días, todos los animales fueron reexaminados. Ninguno mostró ningún signo de mastitis clínica. No se detectó ninguna diferencia significativa entre el recuento de células somáticas en el recuento inicial y el reexamen (p = 0,2522). El recuento promedio de células de 24 muestras medibles fue de 5.2238.000 células/ml (101.000-20.880 000 células/ml) (Figura 2) y todavía se pudo detectar S. uberis (n = 5), S. aureus (n = 6), S. dysgalactiae (n = 2). Los valores de DEFB-4 en suero oscilaron entre 15 y 548 pg/mL (mediana: 90 pg/mL) y 21 y 208 pg/mL (mediana: 46 pg/mL) en la leche. No se pudo detectar una diferencia significativa en las concentraciones de DEFB-4 desde el inicial hasta el reexamen en el suero o la leche (Figura 2).
En conjunto, los niveles de DEFB-4 en vacas sanas difirieron significativamente no solo de las vacas con mastitis aguda, sino también de las vacas con mastitis subclínica, donde la diferencia fue detectable tanto en el suero como en la leche.
Se construyó una curva de ROC para distinguir a las vacas con mastitis subclínica y controles sanos. Para el DEFB-4 sérico, se calculó una sensibilidad de 0,76 y una especificidad de 0,62 en un límite de 122.4 pg/mL, con un AUC de 0,73 y para la leche DEFB-4, se calculó una sensibilidad de 0,83 y una especificidad de 0,72 en un límite de 89,9 pg/mL (Figura 3).
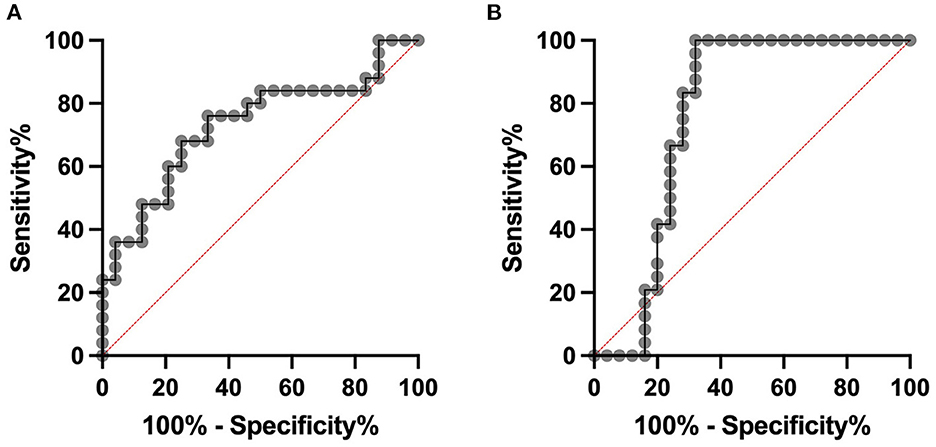 Figura 3. Análisis de ROC. Las vacas con mastitis subclínica se pueden distinguir de los controles sanos con una sensibilidad de 0,76 y una especificidad de 0,62 en un corte de 122,4 pg/ml en suero (A). El área bajo la curva es de 0,73. En la leche se calculó una sensibilidad de 89,9 pg/mL de 0,83 y una especificidad de 0,72. El área bajo la curva es de 0,76 (B).
Figura 3. Análisis de ROC. Las vacas con mastitis subclínica se pueden distinguir de los controles sanos con una sensibilidad de 0,76 y una especificidad de 0,62 en un corte de 122,4 pg/ml en suero (A). El área bajo la curva es de 0,73. En la leche se calculó una sensibilidad de 89,9 pg/mL de 0,83 y una especificidad de 0,72. El área bajo la curva es de 0,76 (B).
3.3. Cinética temporal de DEFB-4 en cuatro vacas seleccionadas durante 7 semanas
Dado que los niveles de DEFB-4 en vacas con mastitis se mantuvieron altos durante al menos 12 días, fue interesante seguir las concentraciones de DEFB-4 durante un período de tiempo más largo. Por lo tanto, se seleccionaron cuatro vacas con mastitis aguda, que fueron muestreadas directamente después de la aparición de los síntomas clínicos y de nuevo después de las 3, 5 y 7 semanas. El recuento promedio de células disminuyó del valor inicial de 5.832.000 células/ml a 248.000 células/mL durante 7 semanas, mientras que no hubo un cambio significativo en las concentraciones de DEFB-4 en suero y leche en 3 semanas, cuando DEFB-4 alcanzó los niveles más altos. Posteriormente, los niveles disminuyeron, pero incluso después de siete semanas no alcanzaron los de las vacas sanas (Figura 4). Se muestran más detalles en la Tabla Suplementaria 2.
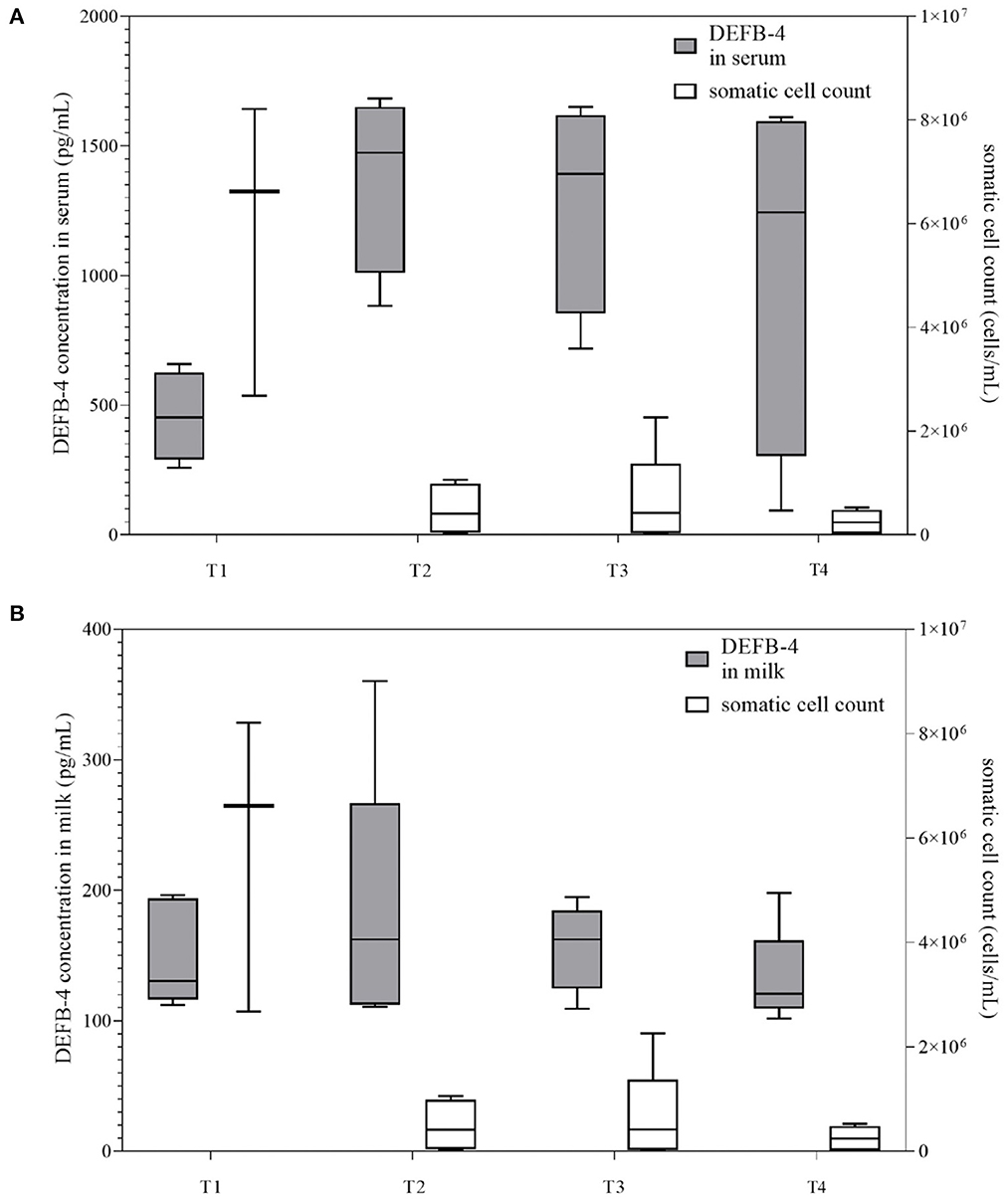 Figura 4. Concentraciones de DEFB-4 del estudio de cinética temporal agrupadas con el recuento de células somáticas, que es actualmente el parámetro estándar para la detección de mastitis. Se tomaron muestras de cuatro vacas con mastitis clínica aguda directamente después de la aparición de los síntomas clínicos y de nuevo después de las 3, 5 y 7 semanas. T1 marca el momento inicial del muestreo. T2, T3 y T4 marcan el tiempo de muestreo después de 3, 5 y 7 semanas. (A) muestra concentraciones de DEFB-4 en suero y (B) muestra concentraciones de DEFB-4 en la leche.
Figura 4. Concentraciones de DEFB-4 del estudio de cinética temporal agrupadas con el recuento de células somáticas, que es actualmente el parámetro estándar para la detección de mastitis. Se tomaron muestras de cuatro vacas con mastitis clínica aguda directamente después de la aparición de los síntomas clínicos y de nuevo después de las 3, 5 y 7 semanas. T1 marca el momento inicial del muestreo. T2, T3 y T4 marcan el tiempo de muestreo después de 3, 5 y 7 semanas. (A) muestra concentraciones de DEFB-4 en suero y (B) muestra concentraciones de DEFB-4 en la leche.
3.4. Estudio in vitro
Junto con la primera medición de DEFB-4, se comparó el recuento de células somáticas en las cuatro muestras. Fueron 117 000 células/ml en la leche no tratada, 115 000 células/ml en la leche incubada con E. coli y 131.000 células/ml en la leche con Sc. agalactiae. Los resultados del estudio in vitro mostraron que en la leche de vaca no tratada, hubo una caída significativa en las concentraciones de DEFB-4 36 horas después del inicio de la serie de pruebas. En la leche de vaca incubada con bacterias (E. coli y Sc. agalactiae), las concentraciones de DEFB-4 también cayeron después de 36 horas, pero mucho más lentamente. El valor más bajo se alcanzó en todos los grupos después de 48 horas. A partir de entonces, las concentraciones de DEFB-4 aumentaron de nuevo, tendiendo a ser algo más planas en la leche no tratada (Figura 5).
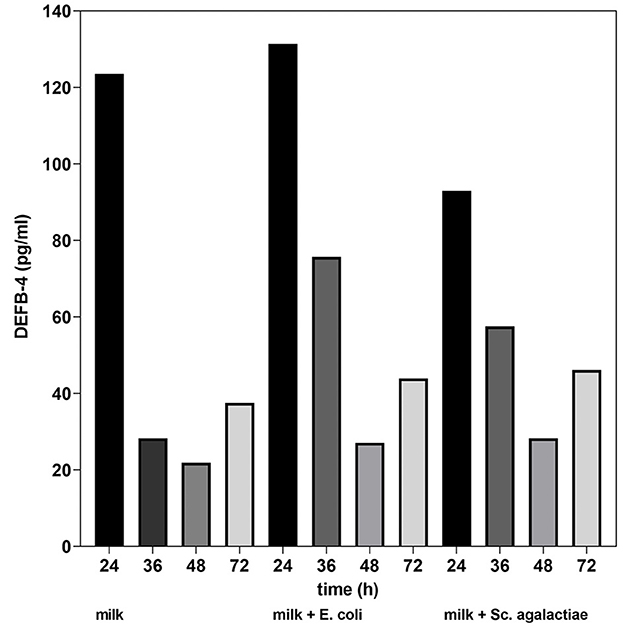 Figura 5. Concentración de DEFB-4 en la leche como parte del estudio in vitro. Comparación de leche sin tratar, leche + E. coli y leche + Sc. agalactiae.
Figura 5. Concentración de DEFB-4 en la leche como parte del estudio in vitro. Comparación de leche sin tratar, leche + E. coli y leche + Sc. agalactiae.
4. Discusión
La mastitis bacteriana conduce a una reacción del sistema inmunitario local y sistémico. Esta reacción inflamatoria se asocia con un aumento del recuento de células somáticas en la leche, que se utiliza más ampliamente como método de diagnóstico estándar. Además de la barrera física primaria de la teta, las defensinas son parte de los mecanismos de defensa secundarios para contrarrestar las infecciones intramammarias (27). La expresión de las defensinas puede ser constitutiva o inducible (28). Tetens et al. (29) demostraron en su estudio que el DEFB-4 se expresa constitutivamente en la ubre sana, especialmente en los ganglios linfáticos, aunque también se detectó una cantidad menor en el epitelio glandular de la cisterna y en el parénquima de la ubre. En humanos, Tunzi et al. (30) fueron capaces de detectar β-defensina-1 (hBD-1) en las células epiteliales mamarias de mujeres sanas y no lactantes y Jia et al. (31) detectaron hBD-1 en la leche materna humana. En caso de infección, Goldammer et al. (7) encontraron que el ARNm de DEFB-5 bovino se expresa en las células epiteliales mamarias del tejido glandular afectado en vacas con mastitis. Los resultados de nuestro estudio también muestran que los niveles de DEFB-4 se pueden detectar en vacas sanas en leche y suero, lo que indica una expresión constitutiva a niveles bajos. En vacas con mastitis aguda se detectaron niveles mucho más altos de DEFB-4, lo que es una indicación de la expresión inducida. En la mayoría de los estudios, las defensinas se detectan a nivel genético y se podría demostrar que los genes de defensina están fuertemente regulados en caso de mastitis. Solo un estudio (32) detectó un péptido antimicrobiano lingual (LAP) mediante ELISA, que también es una defensina en vacas. Un método para la detección de DEFB-4 a nivel de proteínas podría contribuir al desarrollo de una prueba rápida. Como esto es muy importante para la práctica diaria, se tomó la decisión de utilizar este método de medición para nuestro estudio. Los resultados de nuestro estudio muestran que los niveles de proteína DEFB-4 bovina se pueden medir localmente en la leche, así como sistémicamente en el suero con ELISA y que existe una correlación entre la concentración de DEFB-4 y la gravedad de la mastitis. Se compararon los niveles de DEFB-4 en la leche y el suero de vacas de control sanas, de vacas con mastitis clínica aguda y de vacas con mastitis subclínica. Los valores DEFB-4 de un examen inicial también se compararon con los de un nuevo examen 12 días después.
Al comparar las concentraciones de DEFB-4 dentro de los tres grupos, es evidente que en vacas con mastitis clínica aguda la concentración de DEFB-4 fue significativamente más alta en el suero. Sin embargo, en la leche, la concentración local de defensina de las vacas con mastitis aguda no fue significativamente mayor que la del grupo de control saludable. Nuestra hipótesis es que esto podría deberse a un retraso en la expresión de la defensa local. Las vacas con mastitis aguda se tomaron muestras inmediatamente después de la aparición de los síntomas clínicos, que presumiblemente podría ser un tiempo antes del aumento de la producción local de defensina. Sin embargo, el aumento de las concentraciones de defensina ya era detectable en el suero en este momento. Concluye que la respuesta a los patógenos de la mastitis conduce inicialmente a una liberación sistémica de defensina y, posteriormente, a un aumento local en la producción de defensina. No está claro si el aumento local también es causado por la defensina sistémica o si la defensina sistémica debe evitar que la bacteria migre. Las vacas con mastitis subclínica mostraron concentraciones más bajas de defensina en el suero y la leche que las vacas de control sanas y las vacas con mastitis aguda. Por lo tanto, suponemos que la mastitis subclínica conduce inicialmente a un consumo de defensinas expresadas constitutivamente antes de que se produzca una inducción de la expresión de defensina. Hasta donde sabemos, esto no pudo ser confirmado por otros estudios.
Los resultados de nuestro estudio in vitro muestran que la concentración de DEFB-4 en la leche disminuye con el tiempo, lo que creemos que se debe a la muerte celular. Por ejemplo, la vida útil de los granulocitos de neutrófilos en el tejido es de aproximadamente 1-2 días antes de que se sometan a una apoptosis espontánea (33). La adición de patógenos de mastitis redujo significativamente la disminución de los niveles de DEFB-4, lo que creemos que confirma la inducción de la expresión de defensina por los patógenos. Después de 48 horas, la concentración de defensina aumentó de nuevo en cada muestra. Dado que la mayoría de los granulocitos neutrófilos deben haber muerto en este momento, concluimos que no solo los granulocitos neutrófilos, sino también otras células somáticas expresan defensina.
Los resultados de los reexámenes después de 12 días muestran que los animales de ambos grupos de mastitis no se han recuperado completamente. El 10% de los animales de los animales gravemente enfermos todavía muestran un mal estado general. El recuento de células somáticas disminuyó, pero todavía está significativamente por encima de la referencia de 100.000 células/ml. Las concentraciones de leche DEFB-4 en vacas con mastitis aguda aumentan aún más en el momento del nuevo examen después de 12 días, lo que nos lleva a concluir que la defensa local todavía estaba activa. Aunque el tiempo de reexamen fue consistente con el curso de la mastitis aguda reportado en la literatura, según el cual la mastitis aguda se trata durante ~3-8 días (34, 35), los resultados de nuestro estudio muestran que el sistema inmunitario reaccionó a la infección durante mucho más tiempo. Incluso los resultados de los niveles de DEFB-4 durante un período de 7 semanas de cuatro animales con mastitis clínica aguda no indicaron una recuperación completa. Los niveles de DEFB-4 seguían siendo más altos que los de las vacas de control sanas, lo que podría significar que el sistema inmunitario todavía está reaccionando a la infección. Nuestros resultados reflejan que el proceso activo de la enfermedad en la mastitis aguda y subclínica dura más de lo que se pensaba anteriormente. Fogsgaard et al. (36) también concluyen que las vacas que sufren de una mastitis clínica aguda no se han recuperado completamente ni siquiera 8 semanas después del tratamiento con antibióticos. Dado que el recuento de células somáticas, que actualmente es el parámetro estándar para la detección y el monitoreo del curso de la mastitis, ha disminuido mucho más rápido que las concentraciones de DEFB-4, se supone que DEFB-4 es mucho más apropiado para hacer una predicción sobre el estado inmunitario de los animales.
Además de las correlaciones de los niveles de DEFB-4 estudiados dentro de los grupos y en diferentes puntos del tiempo, también se investiga si hay correlaciones de los niveles de DEFB-4 con el recuento de células somáticas, la temperatura corporal interna y los leucocitos. En ninguna de las investigaciones se pudo encontrar una correlación significativa. La clasificación en los tres grupos de este estudio no se puede reconstruir y confirmar mediante el recuento de células somáticas, la temperatura corporal interna o los leucocitos, porque los resultados de estos parámetros no se correlacionan con los resultados del examen clínico. Por lo general, el recuento de células somáticas se utiliza de forma estándar para detectar la mastitis en las vacas, pero a veces no es técnicamente medible debido a valores de pH alterados o proteínas precipitadas y, por lo tanto, no siempre es fiable. Además, el recuento de células somáticas no se puede utilizar para distinguir la mastitis aguda de la mastitis subclínica. Además, los patógenos que causaron la mastitis se examinan y se comparan con los niveles de DEFB-4. En este estudio, se detectan principalmente S. uberis y E. coli como mastitis que causa patógenos en vacas con mastitis aguda. Esta distribución corresponde a los resultados de otros estudios científicos (22). Los patógenos de la mastitis también se detectan esporádicamente en el grupo de animales sanos. Se consideran contaminantes, ya que los animales no desarrollan mastitis y el recuento de células somáticas se mantuvo <100.000 células/ml. Petzl et al. (37) encontraron que la especie patógena afecta el curso de la mastitis y que E. coli es responsable de un aumento temprano de las β-defensinas. Günther et al. (38) y Younis et al. (21) describen hallazgos similares. En el presente estudio solo se pudo demostrar una tendencia a concentraciones elevadas de DEFB-4 en las infecciones por E. coli, pero no se ha observado ninguna correlación significativa con el tipo de patógenos. Este tema tendría que abordarse de nuevo en un estudio futuro con números de muestra estadísticamente relevantes. Una de las razones del aumento de la cantidad de DEFB-4 en las infecciones por E. coli podría ser que, debido a la estructura molecular de E. coli, la despolarización de la membrana y, por lo tanto, la lisis del patógeno es más difícil para el DEFB-4 y, por lo tanto, el cuerpo reacciona con una mayor cantidad de parámetros de defensa. El problema no está en la detección del patógeno E. coli, ya que el aumento de DEFB-4 es extremadamente rápido.
La mayoría de los pacientes con mastitis hoy en día son tratados con antibióticos (39). Según el examen clínico, que es muy subjetivo, todos los animales gravemente enfermos de nuestro estudio se tratan con antibióticos, mientras que los animales subclínicamente enfermos no se trataron. Esta decisión puede ser apoyada por el parámetro más objetivo DEFB-4, ya que sus concentraciones permiten comprender la clasificación de los animales en los tres grupos de nuestro estudio. Basándonos en el análisis de ROC, podemos calcular los valores de corte para la diferenciación de los grupos. Una sensibilidad de 0,83 en la leche muestra que una decisión sobre el tratamiento de la mastitis es posible en función de la concentración de DEFB-4. Si los estudios futuros de los niveles de DEFB-4 con números de muestra más altos confirman nuestros resultados, podría ser posible que las concentraciones de DEFB-4 se puedan utilizar para estimar la estrategia de tratamiento necesaria. Sin embargo, dado que los grupos a veces se superponen considerablemente, debe recordarse que un examen clínico nunca puede ser reemplazado.
Dado que la resistencia de los patógenos a los antibióticos está empeorando constantemente (40), es aún más importante confiar en los mecanismos de defensa inmune endógenos. Tunzi et al. (30) plantearon la hipótesis de que las mujeres que expresan menos hBD-1 de forma hereditaria tienen un mayor riesgo de colonización bacteriana. Un enfoque en el futuro podría ser influir en la cantidad de DEFB-4 mediante la cría y la cría o la producción in vitro de DEFB-4 para usarlo como antibiótico natural.
Como limitaciones de este estudio, hay que tener en cuenta los efectos de un solo animal. El estudio de la cinética del tiempo también tendría que continuar con un mayor número de muestras de vacas para su finalización a fin de determinar el tiempo de recuperación completa.
5. Conclusión
Las defensinas se conocen como péptidos multifuncionales, que tienen un efecto antibacteriano e inmunomodulador y, por lo tanto, se puede suponer que desempeñan un papel importante en la defensa inmunitaria de la mastitis. El presente estudio apoya esta afirmación, ya que se podría mostrar una correlación entre la gravedad y el curso de la mastitis y la concentración medida de DEFB-4. Con respecto a los niveles de DEFB-4, los resultados de este estudio muestran una diferencia significativa entre la mastitis clínica aguda y la mastitis subclínica, tanto a nivel local como sistémica. Por lo tanto, la mastitis clínicamente manifiesta podría identificarse con DEFB-4 y tratarse si los estudios futuros pueden confirmar nuestros resultados. Dado que los animales afectados por la clínica podrían diferenciarse significativamente del grupo de control sano en suero y leche, el DEFB-4 también podría utilizarse como marcador para la detección de animales afectados por la clínicamente. Podría ser posible detectar DEFB-4 rápidamente en el futuro utilizando una prueba rápida para determinar la mastitis aguda y subclínica en vacas y tal vez sea posible reducir la cantidad de antibióticos en el futuro, ya que muchas vacas con mastitis subclínica son tratadas innecesariamente hoy en día con antibióticos solo porque el recuento de células somáticas es demasiado alto.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, se pueden dirigir más consultas al autor correspondiente.
Declaración ética
El estudio con animales fue revisado y aprobado por la Oficina Estatal de Protección del Consumidor y Seguridad Alimentaria de Baja Sajonia (Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit, LAVES) (Número de archivo: 33.9-42502-05-16A089).
Contribuciones del autor
Conceptualización, análisis formal, escritura: preparación del borrador original, supervisión y administración del proyecto: SN. Metodología: SN y AF. Investigación: AF. Escritura: revisión y edición: SS. Visualización: SN y SS. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Agradecimientos
Estamos agradecidos al Dr. Jens Kopp y su equipo (Gieboldehausen, Alemania) por la cooperación profesional y por ayudarnos a conectar con varios productores lácteos alrededor de Göttingen (Alemania). También damos las gracias a Nachtwey GbR (Seulingen, Alemania) por proporcionar la mayoría de los animales incluidos en este estudio y por brindar asistencia durante el muestreo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1154386/full#supplementary-material
Referencias
1. Lehrer RI, Ganz T. Defensins de animales vertebrados. Curr Opin Immunol. (2002) 14:96–102. doi: 10.1016/S0952-7915(01)00303-X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
2. Zasloff M. Péptidos antimicrobianos de organismos multicelulares. Naturaleza. (2002) 415:389-95. doi: 10.1038/415389a
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Ganz T. Defensins: péptidos antimicrobianos de inmunidad innata. Nat Rev Immunol. (2003) 3:710-20. doi: 10.1038/nri1180
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. Ganz T. Defensins: péptidos antimicrobianos de vertebrados. C R Biol. (2004) 327:539–49. doi: 10.1016/j.crvi.2003.12.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
5. Birchler T, Seibl R, Buchner K, Loeliger S, Seger R, Hossle JP, et al. El receptor humano tipo Toll 2 media la inducción del péptido antimicrobiano beta-defensina 2 humano en respuesta a la lipoproteína bacteriana.Eur J Immunol. (2001) 31:3131–7. doi: 10.1002/1521-4141(200111)31:11<3131::AID-IMMU3131>3.0. CO;2-G
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
6. Vora P, Youdim A, Thomas LS, Fukata M, Tesfay SY, Lukasek K, et al. La expresión de beta-defensina-2 está regulada por la señalización TLR en las células epiteliales intestinales. J Immunol. (2004) 173:5398-405. doi: 10.4049/jimmunol.173.9.5398
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Goldammer T, Zerbe H, Molenaar A, Schuberth HJ, Brunner RM, Kata SR, et al. La mastitis aumenta la abundancia de ARNm mamario de beta-defensina 5, receptor de peaje 2 (TLR2) y TLR4, pero no TLR9 en el ganado. Clin Diagn Lab Immunol. (2004) 11:174–85. doi: 10.1128/CDLI.11.1.174-185.2004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Hancock RE, Scott MG. El papel de los péptidos antimicrobianos en las defensas de los animales. Proc Natl Acad Sci USA. (2000) 97:8856–61. doi: 10.1073/pnas.97.16.8856
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. Sahl HG, Pag U, Bonness S, Wagner S, Antcheva N, Tossi A, et al. Defensinas de mamíferos: estructuras y mecanismo de la actividad antibiótica. J Leukoc Biol. (2005) 77:466–75. doi: 10.1189/jlb.0804452
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
10. Garcia JR, Jaumann F, Schulz S, Krause A, Rodriguez-Jimenez J, Forssmann U, et al. Identificación de una nueva beta-defensina multifuncional (beta-defensina humana 3) con actividad antimicrobiana específica. Su interacción con las membranas plasmáticas de los ovocitos de Xenopus y la inducción de la quimioatracción de los macrófagos. Res. de tejido celular (2001) 306:257–64. doi: 10.1007/s004410100433
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Yang D, Biragyn A, Kwak LW, Oppenheim JJ. Defensinas de mamíferos en la inmunidad: más que solo microbicida. Tendencias Inmunológicos. (2002) 23:291–6. doi: 10.1016/S1471-4906(02)02246-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Befus AD, Mowat C, Gilchrist M, Hu J, Solomon S, Bateman A, et al. Las defensinas de neutrófilos inducen la secreción de histamina de los mastocitos: mecanismos de acción. J Immunol. (1999) 163:947–53. doi: 10.4049/jimmunol.163.2.947
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
13. Niyonsaba F, Someya A, Hirata M, Ogawa H, Nagaoka I. Evaluación de los efectos de los antibióticos peptídicos beta-defensinas-1/-2 y LL-37 humanos sobre la liberación de histamina y la producción de prostaglandina D(2) a partir de mastocitos. Eur J Immunol. (2001) 31:1066–75. doi: 10.1002/1521-4141(200104)31:4<1066::AID-IMMU1066>3.0. CO;2-#
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. Echtenacher B, Mannel DN, Hultner L. Papel protector crítico de los mastocitos en un modelo de peritonitis séptica aguda. Naturaleza. (1996) 381:75–7. doi: 10.1038/381075a0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Malaviya R, Ikeda T, Ross E, Abraham SN. Modulación de mastocitos de la afluencia de neutrófilos y aclaramiento bacteriano en los sitios de infección a través de TNF-alfa. Naturaleza. (1996) 381:77–80. doi: 10.1038/381077a0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Yang D, Chertov O, Bykovskaia SN, Chen Q, Buffo MJ, Shogan J, et al. Beta-defensinas: vincula la inmunidad innata y adaptativa a través de la célula dendrítica y de células T CCR6. Ciencia. (1999) 286:525–8. doi: 10.1126/science.286.5439.525
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
17. Sordillo LM, Streicher KL. Inmunidad de la glándula mamaria y susceptibilidad a la mastitis. Neoplasia Biol De La Glándula Mamásica. (2002) 7:135–46. doi: 10.1023/A:1020347818725
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
18. Seegers H, Fourichon C, Beaudeau F. Efectos de la producción relacionados con la mastitis y la economía de la mastitis en rebaños de ganado lechero. Res. Vet. (2003) 34:475–91. doi: 10.1051/vetres:2003027
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Thompson-Crispi K, Atalla H, Miglior F, Mallard BA. Mastitis bovina: fronteras en inmunogenética. Inmunol delantero. (2014) 5:493. doi: 10.3389/fimmu.2014.00493
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Deb R, Kumar A, Chakraborty S, Verma AK, Tiwari R, Dhama K, et al. Tendencias en el diagnóstico y control de la mastitis bovina: una revisión. Pak J Biol Sci. (2013) 16:1653–61. doi: 10.3923/pjbs.2013.1653.1661
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Younis S, Javed Q, Blumenberg M. Metaanálisis de las respuestas transcripcionales a la mastitis Escherichia coli. PLoS One. (2016) 11:e0148562. doi: 10.1371/journal.pone.0148562
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Euterkrankheiten KV. Kurzes Lehrbuch Milchkunde und Milchhygiene. Krömker V, Bruckmaier RM, editores. Stuttgart: Parey. (2007). p. 47-74.
23. Diamond G, Zasloff M, Eck H, Brasseur M, Maloy WL, Bevins CL, et al. Péptido antimicrobiano traqueal, un péptido rico en cisteína de la mucosa traqueal de los mamíferos: aislamiento peptídico y clonación de un ADNc. Proc Natl Acad Sci USA. (1991) 88:3952–6. doi: 10.1073/pnas.88.9.3952
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Selsted ME, Tang YQ, Morris WL, McGuire PA, Novotny MJ, Smith W, et al. Purificación, estructuras primarias y actividades antibacterianas de las beta-defensinas, una nueva familia de péptidos antimicrobianos de neutrófilos bovinos. J Biol Chem. (1993) 268:6641–8. doi: 10.1016/S0021-9258(18)53298-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Fjell CD, Jenssen H, Fries P, Aich P, Griebel P, Hilpert K, et al. Identificación de nuevos péptidos de defensa del huésped y la ausencia de alfa-defensinas en el genoma bovino. Proteínas. (2008) 73:420–30. doi: 10.1002/prot.22059
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
26. Bagnicka E, Strzalkowska N, Jozwik A, Krzyzewski J, Horbanczuk J, Zwierzchowski L, et al. Expresión y polimorfismo de defensinas en animales de granja. Acta Biochim Pol. (2010) 57:487–97. doi: 10.18388/abp.2010_2434
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
27. Gurao A, Kashyap SK, Singh R. Beta-defensinas: una defensa innata para la mastitis bovina. Mundo veterinario. (2017) 10:990–8. doi: 10.14202/vetworld.2017.990-998
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
28. Yang D, Biragyn A, Hoover DM, Lubkowski J, Oppenheim JJ. Múltiples funciones de las defensinas antimicrobianas, las catelicidinas y la neurotoxina derivado de eosinófilos en la defensa del huésped. Annu Rev Immunol. (2004) 22:181–215. doi: 10.1146/annurev.immunol.22.012703.104603
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. Tetens J, Friedrich JJ, Hartmann A, Schwerin M, Kalm E, Thaller G, et al. El patrón de expresión espacial de los péptidos antimicrobianos a través de la ubre bovina sana. J Ciencia láctea. (2010) 93:775–83. doi: 10.3168/jds.2009-2729
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
30. Tunzi CR, Harper PA, Bar-Oz B, Valore EV, Semple JL, Watson-MacDonell J, et al. Expresión de beta-defensina en el epitelio de la glándula mamaria humana. Pediatr Res. (2000) 48:30–5. doi: 10.1203/00006450-200007000-00008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Jia HP, Starner T, Ackermann M, Kirby P, Tack BF, McCray PB Jr, et al. Abundante expresión humana de beta-defensina-1 en la leche y el epitelio de las glándulas mamarias. J Pediatr. (2001) 138:109–12. doi: 10.1067/mpd.2001.109375
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
32. Kawai K, Akamatsu H, Obayashi T, Nagahata H, Higuchi H, Iwano H, et al. Relación entre la concentración de péptido antimicrobiano lingual y el recuento de células somáticas en la leche de vacas lecheras. Vet Immunol Immunopathol. (2013) 153:298–301. doi: 10.1016/j.vetimm.2013.03.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
33. Kobayashi SD, Malachowa N, DeLeo FR. Influencia de los microbios en la vida y la muerte de los neutrófilos. Frente. Celda. Infectar. Microbiol. (2017) 1:159. doi: 10.3389/fcimb.2017.00159
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Barlow J. Terapia de mastitis y susceptibilidad antimicrobiana: una revisión multiespecie centrada en el tratamiento antibiótico de la mastitis en ganado lechero. Neoplasia Biol De La Glándula Mamásica. (2011) 16:383–407. doi: 10.1007/s10911-011-9235-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
35. Roy JP, Keefe G. (2012). Revisión sistemática: ¿cuál es el mejor tratamiento antibiótico para la infección intramammaria por Staphylococcus aureus de vacas lactantes en América del Norte? Veterinario. Clin. Norte Am. Comida Anim. Practica. 28, 39-50. viii. doi: 10.1016/j.cvfa.2011.12.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. Fogsgaard KK, Lovendahl P, Bennedsgaard TW, Ostergaard S. Los cambios en el rendimiento de la leche, la lactato deshidrogenasa, la frecuencia de ordeño y la relación de rendimiento entre trimestres persisten hasta 8 semanas después del tratamiento antibiótico de la mastitis. J Ciencia láctea. (2015) 98:7686–98. doi: 10.3168/jds.2014-9204
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Petzl W, Zerbe H, Gunther J, Yang W, Seyfert HM, Nurnberg G, et al. Escherichia coli, pero no Staphylococcus aureus desencadena un aumento temprano de la expresión de factores que contribuyen a la defensa inmune innata en la ubre de la vaca. Res. Vet. (2008) 39:18. doi: 10.1051/vetres:2007057
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Günther J, Koczan D, Yang W, Nurnberg G, Repsilber D, Schuberth HJ, et al. Evaluación de la capacidad inmunitaria de las células epiteliales mamarias: comparación con el tejido mamario después del desafío con Escherichia coli. Res. Vet. (2009) 40:31. doi: 10.1051/vetres/2009014
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Swinkels JM, Hilkens A, Zoche-Golob V, Kromker V, Buddiger M, Jansen J, et al. Influencias sociales en la duración del tratamiento antibiótico de la mastitis clínica en vacas lecheras. J Ciencia láctea. (2015) 98:2369–80. doi: 10.3168/jds.2014-8488
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Teuber M. Uso veterinario y resistencia a los antibióticos. Curr Opin Microbiol. (2001) 4:493–9. doi: 10.1016/S1369-5274(00)00241-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: defensina, mastitis, vaca lechera, péptido antimicrobiano, biomarcador
Cita: Neumann S, Siegert S y Fischer A (2023) β-defensina-4 como biomarcador endógeno en vacas con mastitis. Frente. Veterinario. Ciencia. 10:1154386. doi: 10.3389/fvets.2023.1154386
Recibido: 30 de enero de 2023; Aceptado: 09 de marzo de 2023;
Publicado: 24 de marzo de 2023.
Editado por:
Josipa Kuleš, Universidad de Zagreb, Croacia
Revisado por:
David Eckersall, Universidad de Glasgow, Reino Unido
Wuren Ma, Universidad Northwest A&F, China
Copyright © 2023 Neumann, Siegert y Fischer. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución de Creative Commons (CC BY).
*Correspondencia: Stephan Neumann, sneuman@gwdg.de
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser hecha por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

