β-hidroxibutirato perjudica la maduración de los ovocitos bovinos

β-hidroxibutirato perjudica la maduración de los ovocitos bovinos a través de la anomalía del metabolismo energético asociada a la piruvato deshidrogenasa (PDH)
 Kai-Yan Zhang1,2,3†
Kai-Yan Zhang1,2,3†  Jing Guo1,2,3†
Jing Guo1,2,3†  Cheng-Lin Zhan1,2,3
Cheng-Lin Zhan1,2,3  Chong-Shan Yuan1,2,3
Chong-Shan Yuan1,2,3  Chang-Guo Min1,2,3
Chang-Guo Min1,2,3  Zhi-Qiang Li1,2,3
Zhi-Qiang Li1,2,3  Hong-Yu Liu1,2,3
Hong-Yu Liu1,2,3  Jun Wang1,2,3
Jun Wang1,2,3  Jing Zhao1,2,3
Jing Zhao1,2,3  Wen-Fa Lu1,2,3*
Wen-Fa Lu1,2,3*  Xi Ma1,2,3*
Xi Ma1,2,3*- 1Laboratorio clave de producción animal, calidad y seguridad de productos, Ministerio de Educación, Universidad Agrícola de Jilin, Changchun, Jilin, China
- 2Centro Internacional Provincial de Investigación Conjunta de Tecnología de Reproducción y Reproducción Animal, Universidad Agrícola de Jilin, Changchun, Jilin, China
- 3Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de Jilin, Changchun, Jilin, China
Fondo: La cetosis es uno de los trastornos metabólicos más frecuentes y costosos en vacas lecheras de alta producción, y se asocia negativamente con la salud y el rendimiento reproductivo de los bovinos. La cetosis es causada principalmente por la acumulación de ácido β-hidroxibutírico de cuerpos cetónicos y su diagnóstico se basa en la concentración de β-hidroxibutirato (βHB) en sangre.
Métodos: En este estudio, investigamos los efectos de βHB sobre la maduración de ovocitos bovinos en la concentración de βHB subclínica (1,2 mM) y clínica (3,6 mM).
Resultados: Los resultados mostraron que βHB interrumpió la maduración y la capacidad de desarrollo de los ovocitos bovinos. Un análisis posterior mostró que βHB indujo estrés oxidativo y disfunción mitocondrial, como lo indica el aumento del nivel de especies reactivas de oxígeno (ROS), la estructura y distribución mitocondrial alterada y el potencial de membrana despolarizado. Además, el estrés oxidativo desencadenó una apoptosis temprana, como lo demuestran los niveles mejorados de Caspasa-3 y Annexin-V. Además, 3,6 mM βHB indujo la interrupción de la actividad de la piruvato deshidrogenasa (PDH), mostrándose con la disminución de la modificación global de la acetilación y el aumento de la velocidad anormal del huso.
Conclusión: Nuestro estudio mostró que la βHB en concentración subclínica/clínica tenía efectos tóxicos sobre la función mitocondrial y la actividad de PDH, lo que podría afectar el metabolismo energético y la modificación epigenética de ovocitos y embriones bovinos.
1 Introducción
La cetosis es una de las enfermedades metabólicas más perjudiciales en las vacas lecheras, causada por el balance energético negativo (NEB), se ha asociado con una reducción de la fertilidad en las vacas (Bernabucci et al., 2005). El cuerpo cetónico, que incluye acetoacetato, acetona y β-hidroxibutirato (βHB), se genera en el hígado a partir de grasas por oxidación β y circula a través del torrente sanguíneo, sirviendo como fuente de energía (Newman y Verdin, 2014; Sangalli et al., 2018). βHB representa aproximadamente el 70% del cuerpo cetónico total. Se informa que existe una fuerte correlación entre los niveles de βHB en el líquido folicular y el suero (Leroy et al., 2004). Por lo tanto, la βHB sérica se refleja en el líquido folicular, en el que madura el ovocito. El aumento de las concentraciones intrafoliculares de βHB compromete el crecimiento folicular bovino (Missio et al., 2022). Además, βHB induce la reducción de la maduración de los ovocitos, la escisión y las tasas de producción de blastocisto en los ovinos, lo que podría atribuirse a la calidad deficiente de los ovocitos (Nandi et al., 2018). Sin embargo, aún se desconocen los efectos de βHB sobre la maduración de los ovocitos bovinos y el metabolismo energético.
La competencia en el desarrollo de ovocitos es importante para la fertilización y la eficiencia reproductiva. Se cree que las mitocondrias desempeñan funciones esenciales durante la maduración de los ovocitos, la fertilización y el desarrollo embrionario, y actúan como un centro en la señalización celular, la energía y los equilibrios redox (Lonergan et al., 2001). Las mitocondrias tienen un papel crucial en la producción de energía para la maduración de los ovocitos y el desarrollo embrionario a través de funciones celulares precisas que comprenden Ca2+ regulación de la homeostasis, glucólisis, metabolismo de aminoácidos y ácidos grasos, y regulación de la apoptosis (Belli et al., 2021). La calidad del ovocito está directamente determinada por la funcionalidad normal de las mitocondrias. Los estudios han demostrado que las funciones mitocondriales son un determinante clave del potencial de desarrollo de los ovocitos (Cecchino et al., 2018; Labarta et al., 2019) y que la disfunción mitocondrial conduce a defectos meióticos en los ovocitos (Grindler y Moley, 2013; Zhang et al., 2019; Lentscher et al., 2021) y la detención de embriones preimplantacionales in vitro (Belli et al., 2021).
Mientras tanto, la matriz mitocondrial es el sitio principal del ciclo del ácido tricarboxílico (TCA), y también es el punto de control clave del vínculo entre la fosforilación oxidativa y el ciclo de TCA. Los ovocitos de mamíferos carecen de la capacidad de absorber glucosa (Sui et al., 2020), el piruvato es el principal sustrato metabólico utilizado por las mitocondrias de los ovocitos y también puede ser importante en la activación del genoma cigótico (Nagaraj et al., 2017). El piruvato es suministrado a los ovocitos por las células cúmulas, fácilmente absorbido por el ovocito y la matriz mitocondrial a través de transportadores de monocarboxilato (MCT), y convertido en ATP y acetil-CoA por activación de piruvato deshidrogenasa (PDH) (Nandi et al., 2017; Liu et al., 2019). Por lo tanto, la PDH mitocondrial es una enzima metabólica esencial para la maduración de los ovocitos. PDH es un complejo multienzimático, la primera enzima del ciclo de TCA y actúa como mediador entre la glucólisis y el ciclo de TCA (Nie et al., 2020). Durante la maduración de los ovocitos, la actividad del complejo PDH aumenta y produce suficiente ATP, acetil-CoA y metabolitos para la maduración meiótica (Johnson et al., 2007; Hou et al., 2015). Los cuerpos cetónicos son pequeñas moléculas derivadas de lípidos que actúan como una fuente de energía circulante para los tejidos durante el ayuno o el ejercicio prolongado (Newman y Verdin, 2014). Además, BHB también influye en el ciclo de TCA para producir ATP (Youm et al., 2015; Hwang et al., 2022). El piruvato no solo es el sustrato directo del ciclo de TCA, sino también el sustrato energético de la maduración de los ovocitos (Herta et al., 2022; Imanaka et al., 2022). Planteamos la hipótesis de que BHB afecta la producción de ATP a través de la regulación del metabolismo del piruvato durante la maduración de los ovocitos.
En el presente estudio, exploramos los efectos de βHB sobre las funciones mitocondriales y el metabolismo energético durante la maduración de los ovocitos bovinos. Los resultados ilustraron que los posibles efectos negativos de βHB estaban mediados por el estrés oxidativo, la apoptosis, la inhibición de la actividad de PDH y la reducción global de la acetilación, proporcionando nuevos conocimientos sobre los efectos negativos de la cetosis en la eficiencia reproductiva bovina.
2 Materiales y métodos
2.1 Anticuerpos y sustancias químicas
El kit de detección de ROS se compró a Beyotime Biotechnology (S0033S, Beyotime, China), el potencial de membrana mitocondrial y el kit de detección de apoptosis se compraron a Beyotime Biotechnology (C1071, Beyotime, China), el kit de ensayo de ATP se compró a Thermo Fisher Scientific (A12410; BODIPY- ATP; Estados Unidos), sal sódica de ácido DL-β-hidroxibutírico (H6501-5G, Oakville, ON, Canadá). A menos que se indique lo contrario, los reactivos relacionados del sistema de cultivo de maduración de ovocitos se compraron a Sigma aldrich o Life Technologies Corporation.
2.2 Recolección y maduración de ovocitos
Como estudio anterior (Halstead et al., 2020), los ovarios se obtuvieron de un matadero local y se transportaron al laboratorio en solución salina durante 4 horas, cumpliendo con la regulación ética relevante de la Universidad Agrícola de Jilin para las pruebas e investigaciones con animales. Se aspiraron folículos de 3 a 8 mm para obtener complejos de ovocitos cúmulos (AOC). Solo se seleccionaron AOC con más de 3 capas de células de la granulosa para la maduración. Estos fueron lavados en colección Medium 199 (2230823, Life, Estados Unidos de América) con 3% de Suero Bovino Fetal (FBS, Sangon Biotech, China) y transferidos a Maduración Medium 199 (11150059, Life, Estados Unidos) suplementados con ALA-glutamina (0.1 mM), Estradiol (10 ng/mL), cisteamina (0.1 mM), piruvato de sodio (0.2 mM), EGF (50 ng/mL), FSH (0.5 μg/mL), LH (0,5 μg/ml), cisteamina (0,1 mM) y FBS al 10% (C04002, Gemini Bio, Estados Unidos). Los AOC estaban en el medio de maduración (con/sin βHB) a 38,5°C, 5% de CO2, y 100% de humedad durante 22 h. 360 mM βHB en TCM199 se diluyó a concentración de 1,2 y 3,6 mM con medio de maduración. Los ovocitos se dividieron aleatoriamente en los siguientes tres grupos: 0, 1,2 y 3,6 mM βHB. Y una solución de 100 mM DCA en TCM199 se diluyó a una concentración de 2 mM con medio de maduración. El DCA se complementó en medio de maduración junto con ovocitos, βHB se complementó 2 horas después. Y los ovocitos se dividieron aleatoriamente en los siguientes dos grupos: 3,6 mM βHB y 2 mM DCA+3,6 mM βHB.
2.3 Fecundación in vitro y cultivo embrionario
La fertilización in vitro y el cultivo de embriones se realizan como estudio previo (Halstead et al., 2020). Después de madurar los AOC durante 22 h, los ovocitos MII se lavaron en medio SOF-FIV (107,7 mM NaCl, 7,16 mM KCl, 1,19 mM KH2PO4, 0,49 mM, MgCl2, 1,17 mM CaCl2, 5.3 mM de lactato de sodio, 25.07 mM de NaHCO3, 0,20 mM de piruvato de sodio, 0,5 mM de fructosa, 1X aminoácidos no esenciales, 5 μg/ml de gentamicina, 10 μg/ml de heparina, 6 mg/ml de BSA libre de ácidos grasos) y transferidos a gotas de medio SOF-FIV bajo aceite mineral. Se descongeló el semen congelado, luego se realizó la separación percoll de los espermatozoides. Los espermatozoides congelados obtenidos de un toro se descongelaron en un baño de agua a 37 °C durante 30 s, se colocaron en capas en el gradiente de densidad del percoll (45% y 90%) y se centrifugaron a 700 g durante 15 min. El sobrenadante se descartó y el pellet de esperma se resuspendió con medio SOF-FIV para obtener una concentración de 106 espermatozoides / ml se agregaron a gotas con ovocitos MII, que se incubaron a 38.5 ° C durante 12-18 h. Los cigotos se eliminaron del medio de fertilización, y las células del cúmulo se eliminaron por vórtice 3 min en el medio SOF-HEPES (107.7 mM NaCl, 7.16 mM KCl, 1.19 mM KH2PO4, 0,5 mM de fructosa, 4 mM de NaHCO3, 0,33 mM de piruvato de sodio, 21 mM de HEPES, 1 mg/ml de BSA sin ácidos grasos, 0,49 mM, MgCl2, 1,17 mM CaCl2, 5,3 mM de lactato de sodio, aminoácidos esenciales (EAA, 50×), aminoácidos esenciales, (NEAA, 100×)). Los cigotos se transfirieron a medios SOF-aa (0,3147 g NaCl, 0,02667 g KCl, 0,0081 g KH2PO4, 0,0023 g MgCl2, 0,0235 g de solución de DL-lactato de sodio (60%), 0,0216 g D-(+)-glucosa, 0,13035 g de NaHCO3, CaCl2·2H2O, 0,0018 g de piruvato de sodio, 1 ml de EAA (50×), 0,5 ml de NEAA (100×), 0,2 g de BSA, 0,0075 g de glutamina/50 ml) bajo aceite mineral, e incubado a 38,5 °C en 5% de CO2.
2.4 Tinción por inmunofluorescencia de ovocitos
Los ovocitos se lavaron tres veces en PBS que contenía 1% de PVP, se fijaron en paraformaldehído al 4% durante 1 h y se permeabilizaron con Triton X-0 al 2,100% en solución de PBS-PVP durante 30 min. Después de lavar tres veces, los ovocitos se bloquearon en PBS-PVP que contenía 3% de BSA durante 1,5 h a 38,5 ° C. Los ovocitos se incubaron con anticuerpo anti-Caspasa-3 (1:50, Affinity, A11953, Estados Unidos), anticuerpo anti-Phospho-PDHA1/2(Ser293/Ser291) (1:100, Affinity, AF8502, Estados Unidos), PDHA1 Ab (1:100, Affinity, AF6680, Estados Unidos), Anti-Acetyllysine Rabbit mAb (1:50, PTM BioLab, PTM-105RM, China), Anticuerpo anti-α-Tubulin-FITCH, OXCT1 Anticuerpo policlonal (1:300, proteintech, 12175-1-AP, China). Ratón monoclonal (1:150, Sigma, F2168, Estados Unidos). Alexa Fluor™ 488 cabra anti-conejo lgG (H+L) (1:400, Invitrogen, 2256692, Estados Unidos). Después de la tinción del núcleo celular con Hoechst33342, los ovocitos se montaron en portaobjetos de vidrio con una gota de medio de montaje antidecoloración (Beyotime, P0126, China) y se analizaron utilizando un microscopio Nikon Eclipse Ti-S equipado con una cámara digital Nikon DS-Ri198 de 1 (Nikon, Tokio, Japón).
2.5 Western blot
Después de 22 h de cultivo, se recolectaron 100 AOC, luego se eliminaron las células del cúmulo en hialuronidasa al 0,1% (Sigma-Aldrich, Estados Unidos). Los ovocitos se trataron con pronasa (10 mg/ml) para eliminar completamente la zona pelúcida y se lavaron con SOF-Hepes en una placa de calentamiento. El lisado desnaturalizado se preparó con inhibidor de proteasa e inhibidor de fosfatasa en una proporción de 44:1:5. Se agregó una mezcla de 24 μM a cada grupo de células para el agrietamiento. Después del agrietamiento celular completo, las células se centrifugaron a 12.000 g durante 5 min. Mezclar bien, y finalmente tomar un baño de metal durante 10 minutos para desnaturalizar la proteína, y almacenar en un refrigerador de -80 ° C. Las muestras de proteínas de 100 ovocitos bovinos se resolvieron mediante SDS-PAGE al 12% y se transfirieron electro a membranas de transferencia que se bloquearon con BSA al 5% (V900933, VETEC, China) durante 1 h a temperatura ambiente (RT). Los blots se incubaron durante la noche a 4°C con anticuerpos de PDHA (1:500, Affinity, AF6680, Estados Unidos), mAb de conejo de β actina (1:1000, Cell Signaling Technology, 4970) y anti-Phospho-PDHA1/2(Ser293/Ser291) (Affinity, AF8502, Estados Unidos). Después de lavar cuatro veces con TBS-T (0,1% Tween-20 en solución salina tamponada con Tris, TBS), los coágulos se incubaron con anticuerpos IgG anti-conejo marcados con peroxidasa de rábano picante, luego las membranas se lavaron nuevamente cuatro veces con TBS-T. Los inmunoblots se visualizaron utilizando un kit de detección de quimioluminiscencia potenciador (ECL Prime; GE Healthcare) y las imágenes obtenidas con un Amersham Imager 600 Todas las imágenes Western blot son representativas de 3 experimentos diferentes o repeticiones biológicas.
2.6 Niveles intracelulares de ROS y GSH
Para determinar los niveles intracelulares de ROS, se incubaron ovocitos durante 20 min en un medio PBS-PVP que contenía 10 μM de diacetato de 2′,7′-diclorodihidrofluoresceína. El dihidroetidio (DHE) y el diacetato de 2′,7′-diclorodihidrofluoresceína se tiñeron para observar el nivel de ROS. La sonda fluorescente ROS dihydroethidium (DHE) fue un método clásico para probar el nivel de ROS en tejidos o células. La DHE podía entrar libremente en las células a través de la membrana celular viva, luego era oxidada por ROS para formar etidio oxidado que podía mezclarse con ADN cromosómico para producir fluorescencia roja. Para determinar los niveles intracelulares de DHE, se incubaron 15 ovocitos por grupo durante 25 min en un medio PBS-PVP que contenía 10 μM de Dihidroetidio (S0063; Beyotime, China). Para determinar los niveles intracelulares de GSH, se incubaron 15 ovocitos por grupo durante 30 min en un medio PBS-PVP que contenía 10 μM de 4-clorometil-6,8-difluoro-7-hidroxicumarina (CMF2HC) (Invitrogen). Las señales fluorescentes se capturaron como un formato de archivo de imagen etiquetado (TIFF) utilizando una cámara digital (DP72; Olympus, Tokio, Japón) conectado al microscopio de fluorescencia (IX70, Olympus, Tokio, Japón). Se siguieron los mismos procedimientos, incluyendo incubación, enjuague, montaje e imagen, para todos los grupos de 15 ovocitos por grupo. Los tiempos de exposición se mantuvieron constantes durante toda la medición. Se capturaron imágenes de fluorescencia de ovocitos, se utilizó el software ImageJ para analizar las intensidades fluorescentes de los ovocitos.
Ensayo de 2.7 ΔΨm y ensayo Annexin V-FITC
La sonda JC-1 se utilizó para detectar el potencial de membrana mitocondrial de acuerdo con métodos publicados anteriormente (Elefantova et al., 2018). Brevemente, después del lavado con medio SOF-HEPES durante 3 veces, los ovocitos se colocaron en un medio de cultivo, que contenía 0,5 μmol/L JC-1 (C2003S, Beyotime, China) en un 37°C, 5% de CO2 incubadora durante 30 min. JC-1 forma agregados J y produce fluorescencia roja bajo potencial de membrana mitocondrial normal. Cuando hay apoptosis celular, el potencial de la membrana mitocondrial disminuiría o incluso se perdería, y JC-1 existe en los monómeros J y produce fluorescencia verde. La proporción de intensidades de fluorescencia roja y verde de los ovocitos reflejó el potencial de la membrana mitocondrial. Se analizaron un total de 15 ovocitos de cada grupo. Los datos se presentaron como porcentaje medio (media ± SEM) de al menos tres experimentos independientes. Contenido mitocondrial activo realizado utilizando el potencial de mem-brana mitocondrial y el kit de detección de apoptosis comprado a Beyotime Biotechnology (C1071, Beyotime, China). Brevemente, los ovocitos se incubaron en 188 μM Annexin V-FITC líquido que contenía 2 μM Mito-Tracker Red CMXRos, 5 μM Annexin V-FITC, 5 μM Hoechst 33342 durante 30 min. La anexina V es uno de los indicadores sensibles para la detección de la apoptosis. Es una proteína de unión a fosfolípidos que puede unirse a la membrana de las células apoptóticas tempranas, y el cambio de la membrana plasmática es uno de los primeros cambios en la apoptosis celular. Durante la apoptosis, la fosfatidilserina de membrana (PS) gira desde el interior de la membrana plasmática hacia el exterior. Se formó un anillo fluorescente en la parte más externa de los ovocitos apoptóticos. La fluorescencia se visualizó utilizando la cámara digital conectada al microscopio de fluorescencia. Las imágenes fueron procesadas usando el software ImageJ. La intensidad de fluorescencia por píxel fue calculada automáticamente por ImageJ.
2.8 Contenido ATP
Los métodos de tinción se refieren a un estudio publicado (Jin et al., 2017). Brevemente, los ovocitos desnudos se lavaron tres veces en PBS-PVP al 1% y se fijaron con paraformaldehído-PBS-PVP al 4% durante 1 h, se lavaron tres veces y se incubaron en PBS-PVP al 1% suplementado con 500 nM BODIPY FL ATP durante 1 h a temperatura ambiente en la oscuridad. Los ovocitos se lavaron tres veces en PBS-PVP al 5% y se montaron en cubreobjetos. Las imágenes de cada ovocito fueron capturadas utilizando un microscopio de epifluorescencia (TE 2000- S; Nikon).
2.9 Análisis de la reacción en cadena de la polimerasa cuantitativa con transcripción inversa (RT-qPCR)
El ARN total se extrajo de una mezcla de 50 ovocitos, utilizando el kit de separación de ARN PicoPure™ (KIT0204, Applied Biosystems™, Sigma), de acuerdo con las instrucciones del fabricante. Los datos se presentaron como porcentaje medio (media ± SEM) de al menos tres experimentos independientes. El ADNc de primera cadena se sintetizó mediante la eliminación de ADNg de un paso y la síntesis de ADNc SuperMix (TransGen). La RT-qPCR se realizó utilizando SYBR Green, un fluoróforo que se une al ADN bicatenario, en un volumen de reacción final de 20 μL utilizando el sistema de detección RT-PCR táctil CFX96 (Bio-Rad, Hercules, CA, Estados Unidos). La expresión génica fue cuantificada por el 2−ΔΔCT método, con normalización a los niveles de expresión de 18SrRNA. Los cebadores de PCR utilizados para amplificar cada gen se enumeran en la Tabla 1.
2.10 Ensayo de acetilación in vitro
Agregamos acetil-CoA para rescatar la reducción de los niveles de acetilación. El acetil-CoA es un cofactor necesario para la acetilación, y agregarlo con acetil-CoA de 0,1 mM al medio de cultivo celular podría revertir los efectos de βHB en los niveles de acetilación.
2.11 Análisis estadístico
Todos los datos se analizaron con GraphPad mediante ANOVA unidireccional, y las imágenes de tinción de inmunofluorescencia se analizaron con ImageJ. Los resultados se consideraron significativamente diferentes a p < 0,05 y extremadamente significativos a p < 0,01.
3 Resultado
3.1 La exposición a βHB afecta a la maduración de los ovocitos bovinos y a la competencia para el desarrollo
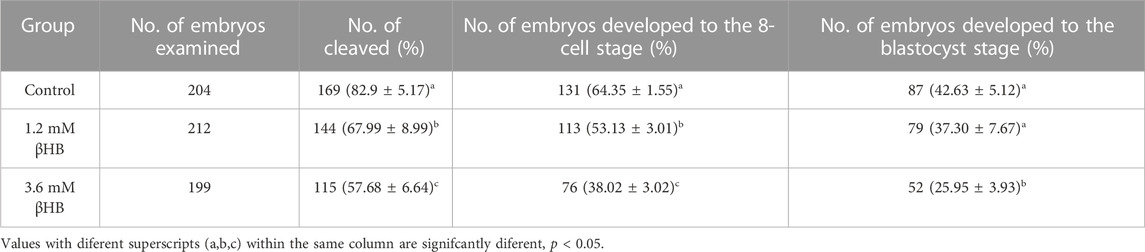
Para evaluar el impacto de βHB en la maduración de los ovocitos bovinos, expusimos los ovocitos a concentraciones clínicas (3,6 mM) y subclínicas (1,2 mM) de βHB y evaluamos la tasa de maduración. Los resultados mostraron que el grupo βHB de 3,6 mM tuvo una tasa de maduración significativamente menor (n = 413, 58,66% ± 4,627%), en comparación con el grupo control (n = 406, 83,7% ± 3,772%, p < 0,0001), mientras que el grupo βHB de 1,2 mM exhibió una tasa de maduración similar de aproximadamente 78%-80% (n = 396, 79% ± 4,396%, p > 0,05). El factor de diferenciación de crecimiento 9 (GDF-9) y la proteína morfogenética ósea 15 (BMP-15), que desempeñan un papel crucial en la regulación del crecimiento, la diferenciación y la función de las células granulosas y tecales durante el desarrollo folicular, se midieron (Figura 1C) para recopilar más información sobre los efectos de βHB en la maduración de los ovocitos bovinos. En comparación con el grupo control, los niveles de expresión de ARNm de BMP-15 y GDF-9 se redujeron significativamente en el grupo de βHB de 3,6 mM (p < 0,05), mientras que el grupo de βHB de 1,2 mM exhibió niveles similares de expresión de ARNm. En particular, tanto la tasa de escisión como la tasa de blastocisto disminuyeron significativamente en los grupos de βHB de 3,6 mM y βHB de 1,2 mM en comparación con el grupo control (Tabla 2). Nuestros hallazgos indican que βHB tiene un efecto inhibitorio prominente sobre la maduración y el potencial de desarrollo de los ovocitos bovinos.
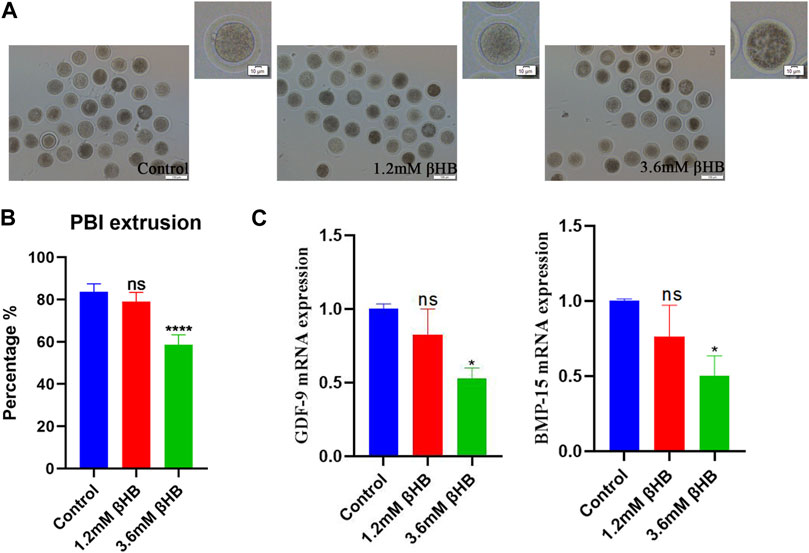 FIGURA 1. La exposición a βHB afecta a la maduración de los ovocitos bovinos. (A) Morfología representativa de la maduración de los ovocitos después de una exposición a βHB de 1,2 mM y 3,6 mM. Bar = 100 μm. La esquina superior derecha es la imagen ampliada. (B) Tasa de extrusión del cuerpo polar en control y diferentes concentraciones de los grupos expuestos a βHB (1,2 y 3,6 mM). (C) Se detectó expresión de genes en grupos control, 1,2 y 3,6 mM βHB. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
FIGURA 1. La exposición a βHB afecta a la maduración de los ovocitos bovinos. (A) Morfología representativa de la maduración de los ovocitos después de una exposición a βHB de 1,2 mM y 3,6 mM. Bar = 100 μm. La esquina superior derecha es la imagen ampliada. (B) Tasa de extrusión del cuerpo polar en control y diferentes concentraciones de los grupos expuestos a βHB (1,2 y 3,6 mM). (C) Se detectó expresión de genes en grupos control, 1,2 y 3,6 mM βHB. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
3.2 βHB reduce la función mitocondrial e induce estrés oxidativo y apoptosis en ovocitos bovinos
Las mitocondrias juegan un papel clave en la respiración aeróbica de los eucariotas, proporcionando la energía muy necesaria en forma de ATP. Para investigar sus funciones, evaluamos el potencial de membrana mitocondrial (ΔΨm) utilizando tinción JC-1. Las mitocondrias con alto potencial de membrana emitieron una fluorescencia roja, mientras que aquellas con bajo potencial de membrana emitieron una fluorescencia verde (Figura 2A). El análisis cuantitativo indicó que la proporción de fluorescencia roja a verde se redujo significativamente en los ovocitos tratados con βHB en comparación con el grupo control (Figura 2B) (p < 0,05). Evaluamos el contenido mitocondrial a través de la tinción Mito-Tracker y nuestros resultados, como se muestra en las Figuras 2C, D, mostraron una reducción significativa en el contenido mitocondrial en los grupos tratados con βHB de 1,2 mM y 3,6 mM en comparación con el grupo control (p < 0,001). Además, como se muestra en la Figura 2E, el contenido de ATP de los ovocitos tratados con βHB fue menor que el del grupo control (p < 0,01). Por lo tanto, inferimos que la disminución en la calidad de los ovocitos podría atribuirse a causas primarias como la disfunción mitocondrial y la reducción de los niveles de ATP.
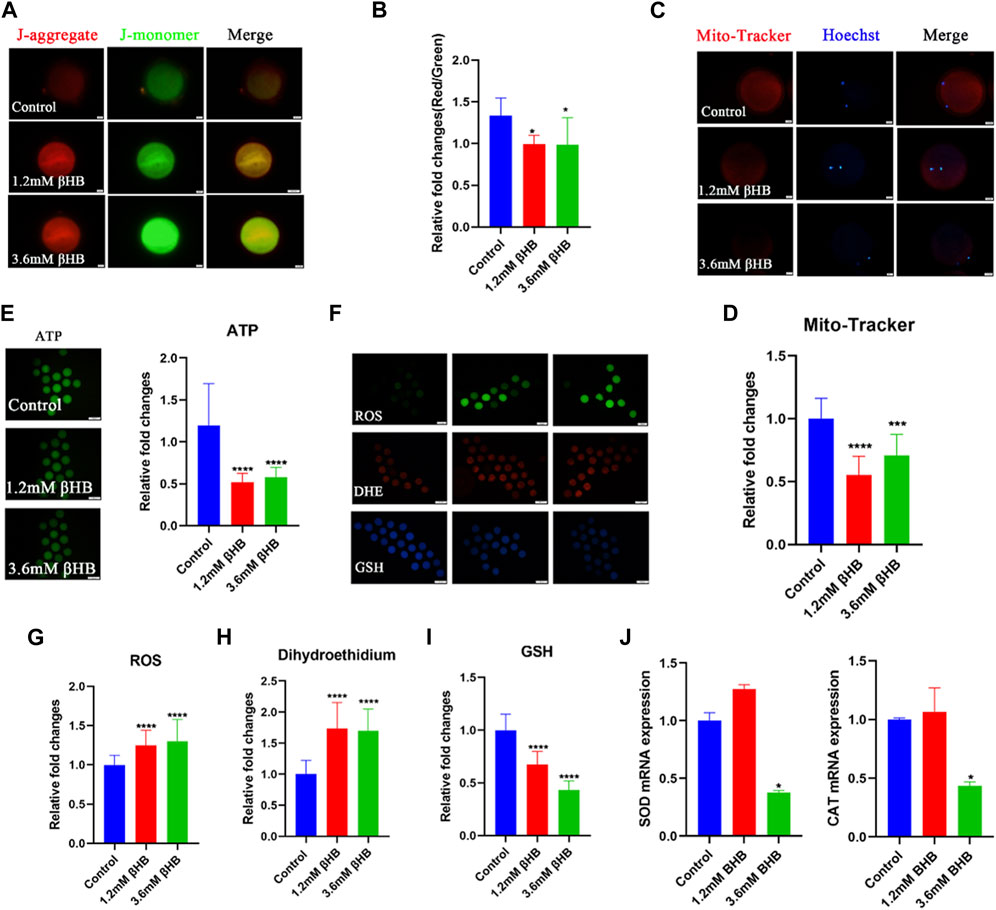 FIGURA 2. La exposición a βHB altera las funciones mitocondriales inducidas por el estrés oxidativo en ovocitos bovinos. (A) El potencial de membrana mitocondrial (ΔΨm) se detectó mediante tinción JC-1 en ovocitos control, 1,2 mM y 3,6 mM expuestos a βHB. Las imágenes combinadas representaban el agregado JC-1 y el monómero JC-1. Barra de escala = 20 μm. (B) La relación entre la intensidad de fluorescencia roja y verde se calculó en el grupo control y el grupo de exposición a βHB. (C) Imágenes representativas de mitocondrias en control, ovocitos expuestos a βHB de 1,2 mM y 3,6 mM. Las mitocondrias activas teñidas de Mito-Tracker y los núcleos teñidos de Hoechst están representados en fusión. Bar = 20 μm. (D) Intensidad fluorescente media de Mito-Tracker en control, exposición a βHB de 1,2 mM y 3,6 mM. (E) Imágenes representativas de ATP, la intensidad relativa de fluorescencia de ATP se analizó en control de 1,2 mM y 3,6 mM de ovocito expuesto a βHB. (F). Imágenes representativas de señales GSH, DHE, ROS en control, 1,2 mM y 3,6 mM de ovocitos expuestos a βHB. Bar = 100 μm. La intensidad relativa de fluorescencia de (G) ROS, (H) DHE, (I) GSH se analizaron en el control de 1,2 mM y 3,6 mM de ovocito expuesto a βHB. (J) Se detectó la expresión de genes relacionados con el estrés oxidativo en los grupos control, 1,2 y 3,6 mM βHB. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
FIGURA 2. La exposición a βHB altera las funciones mitocondriales inducidas por el estrés oxidativo en ovocitos bovinos. (A) El potencial de membrana mitocondrial (ΔΨm) se detectó mediante tinción JC-1 en ovocitos control, 1,2 mM y 3,6 mM expuestos a βHB. Las imágenes combinadas representaban el agregado JC-1 y el monómero JC-1. Barra de escala = 20 μm. (B) La relación entre la intensidad de fluorescencia roja y verde se calculó en el grupo control y el grupo de exposición a βHB. (C) Imágenes representativas de mitocondrias en control, ovocitos expuestos a βHB de 1,2 mM y 3,6 mM. Las mitocondrias activas teñidas de Mito-Tracker y los núcleos teñidos de Hoechst están representados en fusión. Bar = 20 μm. (D) Intensidad fluorescente media de Mito-Tracker en control, exposición a βHB de 1,2 mM y 3,6 mM. (E) Imágenes representativas de ATP, la intensidad relativa de fluorescencia de ATP se analizó en control de 1,2 mM y 3,6 mM de ovocito expuesto a βHB. (F). Imágenes representativas de señales GSH, DHE, ROS en control, 1,2 mM y 3,6 mM de ovocitos expuestos a βHB. Bar = 100 μm. La intensidad relativa de fluorescencia de (G) ROS, (H) DHE, (I) GSH se analizaron en el control de 1,2 mM y 3,6 mM de ovocito expuesto a βHB. (J) Se detectó la expresión de genes relacionados con el estrés oxidativo en los grupos control, 1,2 y 3,6 mM βHB. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
La disfunción mitocondrial está estrechamente asociada con un proceso de fosforilación oxidativa anormal, que conduce a la generación excesiva de ROS, que a su vez induce estrés oxidativo. Para investigar esto, detectamos GSH y ROS. Como se muestra en las Figuras 2F-I, los niveles de GSH fueron significativamente más bajos en los ovocitos tratados con βHB, especialmente en aquellos tratados con βHB de 3,6 mM, mientras que los ovocitos tratados con βHB mostraron señales de fluorescencia significativamente mayores para ROS y DHE. Además, los niveles de expresión de superóxido dismutasa (SOD1) y catalasa (CAT) se interrumpieron notablemente en los ovocitos tratados con βHB (p < 0,05) (Figura 2J), en comparación con el grupo control. Por lo tanto, inferimos que la disfunción mitocondrial indujo estrés oxidativo.
El estrés oxidativo se considera comúnmente como una indicación crucial de apoptosis. Como era de esperar, la exposición a βHB aumentó la incidencia de apoptosis, como lo indican las señales positivas de la anexina-V (Figura 3A). En comparación con el grupo control (31,46% ± 7,725%, n = 97), el porcentaje de ovocitos positivos para apoptosis aumentó significativamente en el grupo βHB de 3,6 mM (57,76% ± 4,870%, n = 93, p < 0,001) (Figura 3B). Para confirmar esto aún más, evaluamos los niveles de proteína de la caspasa-3. La expresión proteica de la caspasa-3 (Figuras 3C, D) fue evidentemente regulada al alza en los grupos expuestos a βHB de 1,2 mM y 3,6 mM (n = 15, p < 0,05). En conclusión, los resultados indican que la exposición a βHB deteriora la función mitocondrial, induce estrés oxidativo y desencadena la apoptosis en ovocitos bovinos.
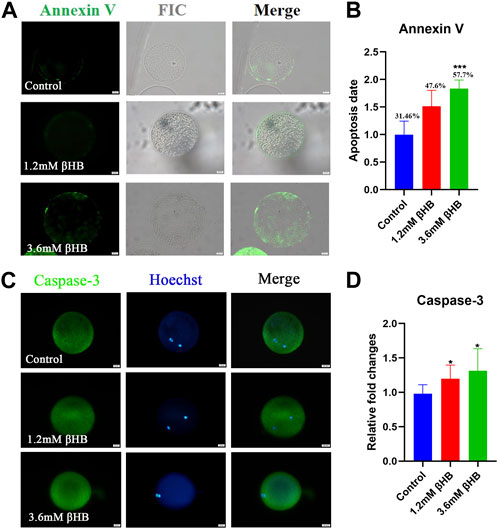 FIGURA 3. La exposición a βHB desencadenó una apoptosis temprana en ovocitos bovinos. (A) Imagen representativa del estado apoptótico, evaluado mediante tinción de Annexin-V en ovocitos de βHB control. Verde, Annexin-V-FITC. La anexina V. se une a las membranas celulares en la fusión. Bar = 20 μm. (B) La intensidad de fluorescencia de las señales de An-nexina-V se cuantificó en los grupos control y βHB. (C) Imágenes representativas de Caspasa-3. Verde, Caspasa-3; azul, Hoechst. La proteína caspasa-3 y los núcleos teñidos de hoechst están representados en fusión. Bar = 20 μm. (D) Intensidad relativa de fluorescencia de la Caspasa-3 de ovocitos con o sin exposición a βHB. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
FIGURA 3. La exposición a βHB desencadenó una apoptosis temprana en ovocitos bovinos. (A) Imagen representativa del estado apoptótico, evaluado mediante tinción de Annexin-V en ovocitos de βHB control. Verde, Annexin-V-FITC. La anexina V. se une a las membranas celulares en la fusión. Bar = 20 μm. (B) La intensidad de fluorescencia de las señales de An-nexina-V se cuantificó en los grupos control y βHB. (C) Imágenes representativas de Caspasa-3. Verde, Caspasa-3; azul, Hoechst. La proteína caspasa-3 y los núcleos teñidos de hoechst están representados en fusión. Bar = 20 μm. (D) Intensidad relativa de fluorescencia de la Caspasa-3 de ovocitos con o sin exposición a βHB. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
3.3 βHB afecta a la maduración de los ovocitos bovinos y al potencial de desarrollo embrionario mediante la regulación de la actividad de PDH
El piruvato sirve como sustrato de energía directa para la vía de fosforilación oxidativa en los ovocitos, por lo que examinamos la actividad de la piruvato deshidrogenasa (PDH), que es la primera enzima que limita la tasa de la vía metabólica del piruvato. Como se muestra en las Figuras 4A, B, la exposición a 3,6 mM βHB aumentó significativamente el nivel de PDH fosforilada (p-PDH) e inhibió significativamente su actividad (p < 0,01), mientras que el nivel de PDHA1 se mantuvo sin cambios (Figuras 4C, D). El análisis de Western blot reveló que, en comparación con el grupo control, el nivel de p-PDH/PDH fue significativamente mayor en el grupo βHB (Figuras 4E, F), lo que es consistente con hallazgos anteriores (Liu et al., 2019; Cenigaonandia-Campillo et al., 2021; Yang et al., 2021). Estos resultados sugieren que la disfunción mitocondrial inducida por βHB puede ocurrir al inhibir la actividad de la PDH. Además, la disminución significativa de la enzima clave SCOT en el metabolismo de los cuerpos cetónicos observada en el grupo βHB (Figuras 4G, H) sugiere una utilización anormal de los cuerpos cetónicos.
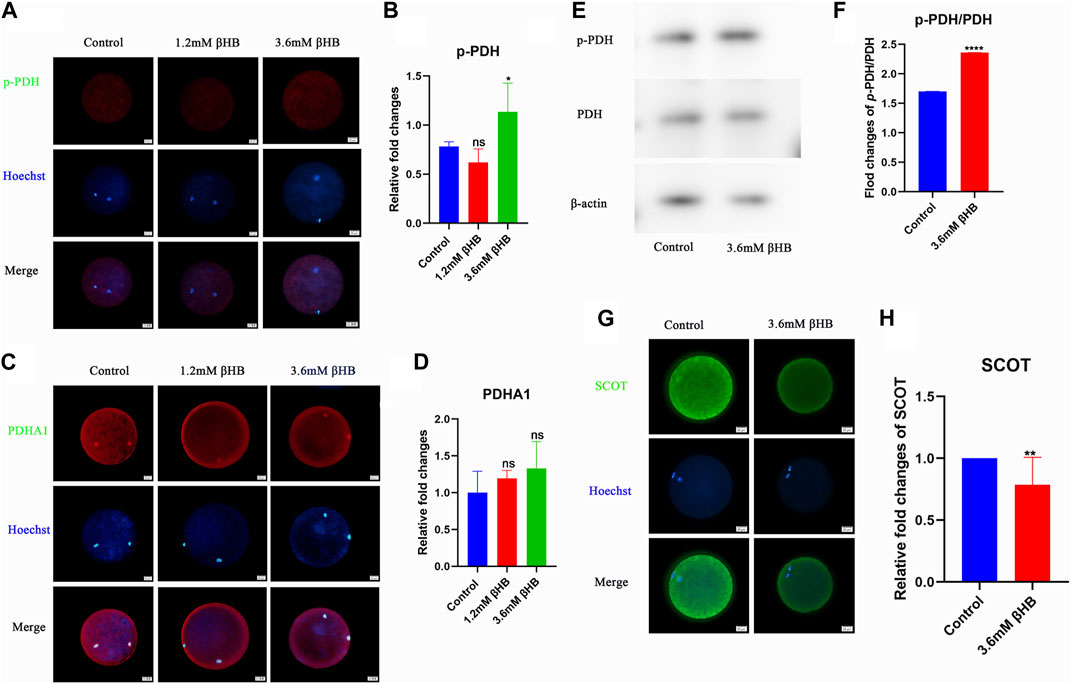 FIGURA 4. La exposición a βHB puede reducir la actividad de PDH en la maduración de los ovocitos bovinos. (A) Imágenes representativas de Phospho-PDH (p-PDH). Verde, p-PDH; azul, Hoechst. La proteína p-PDH y los núcleos teñidos de Hoechst están representados en fusión. Bar = 20 μm. (B) Intensidad relativa de fluorescencia de p-PDH de ovocitos con o sin exposición a βHB. (C) Imágenes representativas de PDHA1. Verde, PDHA1; azul, Hoechst. La proteína PDHA1 y los núcleos teñidos de Hoechst se representan en fusión. Bar = 20 μm. (D) Intensidad relativa de fluorescencia de PDHA1 de ovocitos con o sin exposición a βHB. (E) expresión de p-PDH y PDH en ovocitos bovinos tratados con βHB (0mM; 3,6 mM. La beta-actina se empleó como control de carga de proteínas. (F) Western blot representativo de p-PDH/PDH en ovocitos bovinos estimulados con βHB de 3,6 mM. (G) Imágenes representativas de SCOT. Verde, ESCOCÉS; azul, Hoechst. La proteína SCOT y los núcleos teñidos de Hoechst están representados en la fusión. Bar = 20 μm. (H) Intensidad relativa de fluorescencia de SCOT de ovocitos con o sin exposición a βHB. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
FIGURA 4. La exposición a βHB puede reducir la actividad de PDH en la maduración de los ovocitos bovinos. (A) Imágenes representativas de Phospho-PDH (p-PDH). Verde, p-PDH; azul, Hoechst. La proteína p-PDH y los núcleos teñidos de Hoechst están representados en fusión. Bar = 20 μm. (B) Intensidad relativa de fluorescencia de p-PDH de ovocitos con o sin exposición a βHB. (C) Imágenes representativas de PDHA1. Verde, PDHA1; azul, Hoechst. La proteína PDHA1 y los núcleos teñidos de Hoechst se representan en fusión. Bar = 20 μm. (D) Intensidad relativa de fluorescencia de PDHA1 de ovocitos con o sin exposición a βHB. (E) expresión de p-PDH y PDH en ovocitos bovinos tratados con βHB (0mM; 3,6 mM. La beta-actina se empleó como control de carga de proteínas. (F) Western blot representativo de p-PDH/PDH en ovocitos bovinos estimulados con βHB de 3,6 mM. (G) Imágenes representativas de SCOT. Verde, ESCOCÉS; azul, Hoechst. La proteína SCOT y los núcleos teñidos de Hoechst están representados en la fusión. Bar = 20 μm. (H) Intensidad relativa de fluorescencia de SCOT de ovocitos con o sin exposición a βHB. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
Con el fin de investigar más a fondo el papel crucial de la PDH, los ovocitos fueron tratados con βHB y/o DCA (un activador de PDH). Los hallazgos indicaron que la actividad de PDH podría ser estimulada por la suplementación con DCA de 2 mM (Figuras 5A, B). La tasa de escisión y la tasa de blastocisto aumentaron significativamente en el grupo de 2 mM DCA+3,6 mM âHB en comparación con el grupo de 3,6 mM âHB (Tabla 3). Y además, como se muestra en las Figuras 5C-K, en comparación con el grupo βHB de 3,6 mM, la suplementación de 2 mM DCA mejoró significativamente el potencial de membrana mitocondrial (ΔΨm) (p < 0,05), el contenido mitocondrial (p < 0,05), los niveles de GSH y ATP (p < 0,01), ROS reducidas (p < 0,001) y DHE (p < 0,001). Por lo tanto, elevar la actividad de PDH a través de DCA puede aliviar la disfunción mitocondrial inducida por βHB y el estrés oxidativo.
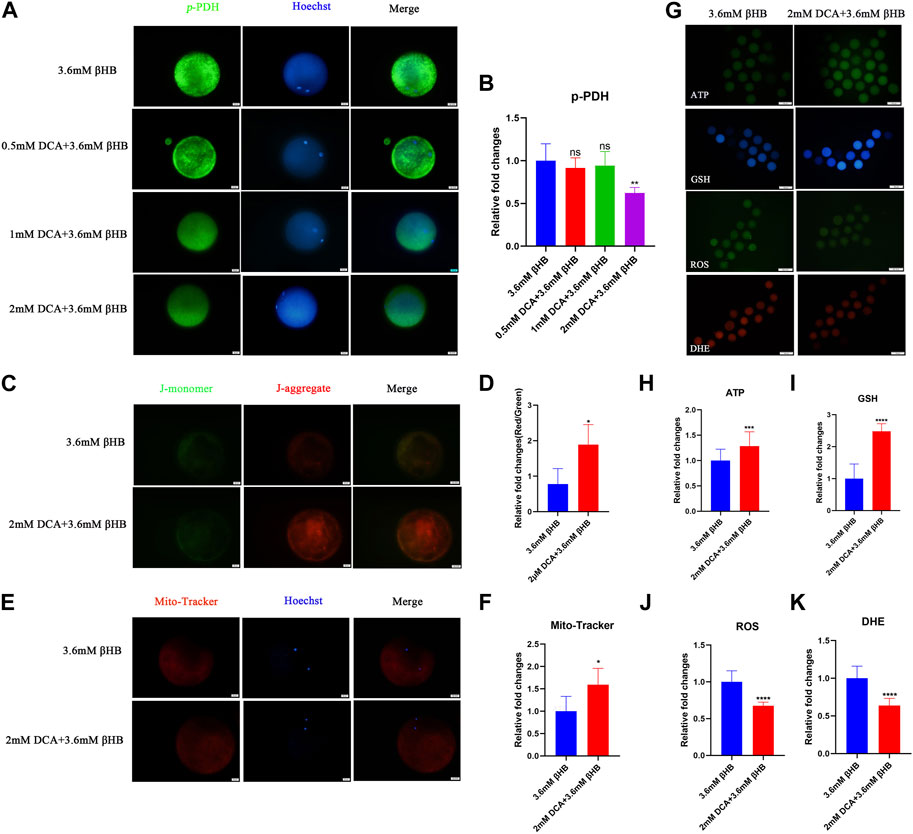 FIGURA 5. βHB afecta la maduración de los ovocitos bovinos y el potencial de desarrollo embrionario mediante la regulación de la actividad de PDH. (A) Imágenes representativas de Phospho-PDH. Verde, p-PDH; azul, Hoechst. La proteína p-PDH y los núcleos teñidos de Hoechst están representados en fusión. Bar = 20 μm. (B) Intensidad relativa de fluorescencia de p-PDH de ovocitos con diferentes concentraciones de DCA en ovocitos expuestos a βHB. (C) El potencial de la membrana mitocondrial (ΔΨm) se detectó mediante tinción JC-1 en el grupo βHB y DCA+βHB. Las imágenes combinadas representaban el agregado JC-1 y el monómero JC-1. Bar = 20 μm. (D) La relación de intensidad de fluorescencia roja y verde se calculó en el grupo βHB y DCA+βHB. (E) Imágenes representativas de mitocondrias en el grupo βHB y DCA+βHB. Las mitocondrias activas teñidas de Mito-Tracker y los núcleos teñidos de Hoechst están representados en fusión. Bar = 20 μm. (F) Intensidad fluorescente media de Mito-Tracker en el grupo βHB y DCA+βHB. (G) Imágenes representativas de señales ATP, GSH, DHE y ROS en ovocitos del grupo βHB y DCA+βHB. Bar = 100 μm. La intensidad relativa de fluorescencia de (H) ATP, (I) GSH, (J) ROS, (K) DHE se analizaron en ovocitos control, 1,2 mM y 3,6 mM expuestos a βHB. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
FIGURA 5. βHB afecta la maduración de los ovocitos bovinos y el potencial de desarrollo embrionario mediante la regulación de la actividad de PDH. (A) Imágenes representativas de Phospho-PDH. Verde, p-PDH; azul, Hoechst. La proteína p-PDH y los núcleos teñidos de Hoechst están representados en fusión. Bar = 20 μm. (B) Intensidad relativa de fluorescencia de p-PDH de ovocitos con diferentes concentraciones de DCA en ovocitos expuestos a βHB. (C) El potencial de la membrana mitocondrial (ΔΨm) se detectó mediante tinción JC-1 en el grupo βHB y DCA+βHB. Las imágenes combinadas representaban el agregado JC-1 y el monómero JC-1. Bar = 20 μm. (D) La relación de intensidad de fluorescencia roja y verde se calculó en el grupo βHB y DCA+βHB. (E) Imágenes representativas de mitocondrias en el grupo βHB y DCA+βHB. Las mitocondrias activas teñidas de Mito-Tracker y los núcleos teñidos de Hoechst están representados en fusión. Bar = 20 μm. (F) Intensidad fluorescente media de Mito-Tracker en el grupo βHB y DCA+βHB. (G) Imágenes representativas de señales ATP, GSH, DHE y ROS en ovocitos del grupo βHB y DCA+βHB. Bar = 100 μm. La intensidad relativa de fluorescencia de (H) ATP, (I) GSH, (J) ROS, (K) DHE se analizaron en ovocitos control, 1,2 mM y 3,6 mM expuestos a βHB. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
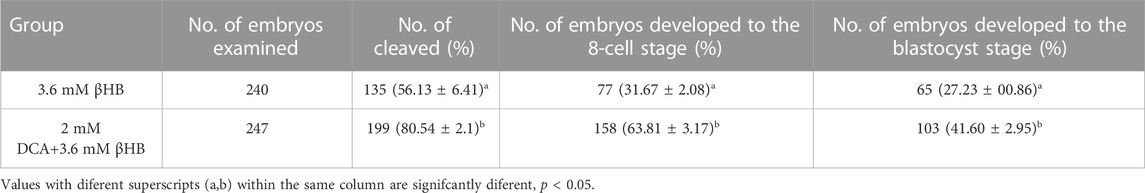 TABLA 3. Tasas de escisión embrionaria de fecundación y tasas de blastocisto tratadas con 2 mM DCA + 3,6 mM βHB.
TABLA 3. Tasas de escisión embrionaria de fecundación y tasas de blastocisto tratadas con 2 mM DCA + 3,6 mM βHB.
3.4 La exposición a βHB impide los niveles globales de acetilación y el ensamblaje del husillo
PDH tiene un papel vital en catalizar la conversión de piruvatos a acetil-CoA, que proporciona grupos acetilo para modificaciones de proteínas. En base a esto, realizamos un estudio para investigar los niveles de modificación de la acetilación en ovocitos bovinos después del tratamiento con βHB. Los hallazgos demostraron que la modificación de la acetilación intracelular disminuyó significativamente después del tratamiento con βHB de 3,6 mM (Figuras 6A-B) (p < 0,001). Además, la tasa de anomalías morfológicas del huso fue significativamente elevada después del tratamiento con βHB (Figuras 6C-D).
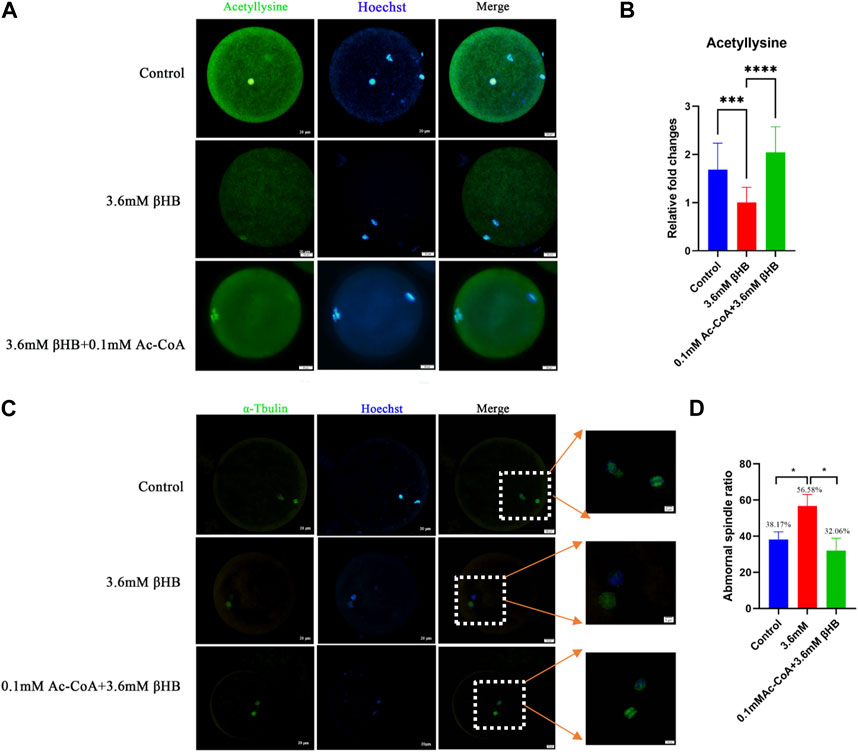 FIGURA 6. La exposición a βHB impide los niveles de acetilación y el conjunto del husillo, que pueden ser rescatados por Ac-CoA. (A) Imágenes representativas de acetillisina. Verde, acetillisina; azul, Hoechst. La proteína acetillisina y los núcleos teñidos de Hoechst están representados en la fusión. Bar = 20 μm. (B) La intensidad relativa de fluorescencia de la acetillisina de los ovocitos en control, grupo βHB de 3,6 mM y 0,1 mM Ac-CoA+3,6 mM βHB. (C) Control, grupo βHB de 3,6 mM, y 0,1 mM Ac-CoA+3,6 mM βHB se tiñeron con anticuerpos α-tubulina para visualizar el huso (verde) y se contratiñeron con Hoechst a célula nuclear (azul). Los ovocitos de control muestran un huso representativo en forma de barra. Husos alargados y desorganizados (flechas) en ovocitos βHB. El huso y el ADN están representados en fusión. Barra = 20 μm. (Ampliar imagen, Barra de escala: 5 μm). (D) Cuantificación del grupo control (106), βHB de 3,6 mM (98) y 0,1 mM Ac-CoA+3,6 mM βHB (127) con defectos del huso. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
FIGURA 6. La exposición a βHB impide los niveles de acetilación y el conjunto del husillo, que pueden ser rescatados por Ac-CoA. (A) Imágenes representativas de acetillisina. Verde, acetillisina; azul, Hoechst. La proteína acetillisina y los núcleos teñidos de Hoechst están representados en la fusión. Bar = 20 μm. (B) La intensidad relativa de fluorescencia de la acetillisina de los ovocitos en control, grupo βHB de 3,6 mM y 0,1 mM Ac-CoA+3,6 mM βHB. (C) Control, grupo βHB de 3,6 mM, y 0,1 mM Ac-CoA+3,6 mM βHB se tiñeron con anticuerpos α-tubulina para visualizar el huso (verde) y se contratiñeron con Hoechst a célula nuclear (azul). Los ovocitos de control muestran un huso representativo en forma de barra. Husos alargados y desorganizados (flechas) en ovocitos βHB. El huso y el ADN están representados en fusión. Barra = 20 μm. (Ampliar imagen, Barra de escala: 5 μm). (D) Cuantificación del grupo control (106), βHB de 3,6 mM (98) y 0,1 mM Ac-CoA+3,6 mM βHB (127) con defectos del huso. Diferencia significativa (****, p < 0,000; ***, p < 0,001; **, p < 0,01; *, p < 0,05).
Para validar nuestros hallazgos, exploramos la posibilidad de restaurar la reducción de los niveles de acetilación causada por βHB en ovocitos bovinos mediante la adición de acetil-CoA. Los ovocitos fueron sometidos a tratamiento con βHB y/o 0,1 mM de acetil-CoA. Los resultados mostraron que, en comparación con el grupo βHB, hubo una restauración significativa de la modificación de la acetilación intracelular en el grupo Ac-CoA (Figuras 6A-B) (p < 0,0001), y una disminución en la tasa de anomalías morfológicas del huso (Control, n = 106, 38,17 ± 4,26; 3,6 mM grupo βHB, n = 98, 56,68 ± 6,40; 0,1 mM Ac-CoA+3,6 mM βHB, n = 127,32,06% ± 6,89%, Figuras 6C–D). Por lo tanto, inferimos que la inhibición de la actividad de PDH inducida por βHB puede conducir a una producción distorsionada de acetil-CoA, afectando negativamente los niveles de acetilación intracelular y la morfología del huso en ovocitos bovinos.
4 Discusión
La cetosis es común en las vacas lecheras de alto rendimiento. Es causada por la acumulación de cetona sérica βHB. Tanto la cetosis subclínica como la cetosis clínica pueden comprometer el rendimiento reproductivo y causar efectos negativos duraderos en la eficiencia reproductiva (Gong et al., 2022). En este estudio, detectamos los efectos de βHB sobre las funciones mitocondriales y el metabolismo energético durante la maduración de los ovocitos bovinos. Nuestros resultados indicaron que βHB disminuyó la calidad de los ovocitos bovinos a través del estrés oxidativo inducido por la disfunción mitocondrial y la regulación a la baja de la actividad de PDH.
La calidad de la maduración de los ovocitos es vital para la fertilización exitosa y el desarrollo embrionario durante la reproducción bovina (Dai et al., 2021). La extrusión del cuerpo polar y el potencial de desarrollo embrionario se consideran dos indicadores críticos para la maduración de los ovocitos. Por lo tanto, probamos los efectos de βHB en estos dos procesos. Nuestro estudio encontró que la tasa de extrusión de PBI disminuyó obviamente cuando los ovocitos fueron tratados con 1.2 y 3.6 mM βHB, lo que indica una disminución en la maduración de los ovocitos. Un estudio sobre los efectos de la anomalía hepática en los ovocitos bovinos también confirmó la correlación negativa entre las tasas de formación de blastocisto y las concentraciones de βHB en el líquido folicular (Sarentonglaga et al., 2013). βHB en el líquido folicular causó una reducción dependiente de la concentración en la frecuencia de ovocitos fertilizados (Sarentonglaga et al., 2013). Estudios similares en otras especies también informaron que la tasa de maduración de los ovocitos ovinos comenzó a disminuir significativamente con la exposición a una concentración de βHB de 1 μM (Nandi et al., 2017; Nandi et al., 2018), consistente con nuestros resultados. Por lo tanto, exploramos más a fondo los mecanismos detallados de βHB en la maduración de los ovocitos bovinos en este estudio.
Las funciones adecuadas de las mitocondrias son críticas para la maduración de los ovocitos. Muchos estudios han demostrado que la disfunción mitocondrial es una de las principales causas de la disminución de la calidad de los ovocitos (Labarta et al., 2019; Boguenet et al., 2021; Kirillova et al., 2021). Los resultados del presente estudio revelaron que el contenido mitocondrial, el número y el potencial de membrana fueron alterados en ovocitos tratados con βHB. Por lo tanto, la disfunción mitocondrial podría ser el incentivo potencial que conduce a la disminución de la calidad de los ovocitos tratados con βHB. Las mitocondrias de ovocitos son la principal fuente de producción de ROS, y la disfunción mitocondrial podría conducir a la acumulación de ROS, lo que inducirá estrés oxidativo (Yousefian et al., 2021). Nuestros resultados indicaron que los niveles de ROS aumentaron significativamente, luego, como se esperaba, los niveles de GSH también disminuyeron observablemente, lo que sugiere estrés oxidativo de los ovocitos tratados con βHB. Además, el estrés oxidativo desencadenó una apoptosis temprana, como lo demuestran los niveles mejorados de Caspasa-3 y Annexin-V. El estudio anterior informó que el aumento de los niveles de βHB (de 1,2 mM) indujo estrés oxidativo de las células del músculo liso abomaso bovino y apoptosis por ROS excesivas y la expresión promovida de Bax y Caspasa-12, 9, 3 (Tian et al., 2014). βHB también es capaz de inducir estrés oxidativo en cardiomiocitos adultos (Pelletier y Coderre, 2007). Sin embargo, βHB muestra efectos protectores sobre las células HEK293 (Shimazu et al., 2013) y las células PC12 (Cheng et al., 2013). Estos resultados contrastantes pueden ser causados por los diferentes tipos de células y dosis. En conjunto, estos resultados indicaron que βHB causó disfunción mitocondria, induciendo aún más estrés oxidativo y apoptosis en ovocitos bovinos.
El deterioro de la actividad de PDH puede causar disminución de la maduración en ovocitos tratados con βHB. En nuestro estudio, observamos que los niveles de ATP y la enzima clave SCOT, que está implicada en la utilización de cuerpos cetónicos, fueron inhibidos en ovocitos bovinos tratados con βHB. Una alta concentración de βHB puede suprimir los procesos de producción de energía, lo que lleva a una condición de escasez de energía que disminuye la competencia de los ovocitos. La PDH desempeña un papel crucial en el suministro de ATP de ovocitos, el metabolismo (Leese y Barton, 1984; Gardner y Leese, 1990; Harris et al., 2005), y la eliminación de ROS (O’Donnell-Tormey et al., 1987), ya que cataliza el paso limitante de la velocidad del ciclo del ácido tricarboxílico (TCA). En mamíferos, la actividad de PDH está regulada conjuntamente por la piruvato deshidrogenasa quinasa (PDK) y la piruvato deshidrogenasa fosfatasa (PDP) a través de un ciclo reversible de fosforilación y desfosforilación (Gao et al., 2022). Hemos comprobado que βHB aumenta significativamente la p-PDH, inhibiendo así su actividad. De acuerdo con un estudio previo que sugirió que la fosforilación mediada por PDK3 de Ser293-PDHE1α interrumpe la morfología del huso meiótico del ratón y la alineación cromosómica y reduce los niveles totales de ATP al inhibir la actividad de PDH (Hou et al., 2015). Otro estudio también mostró que la competencia de los ovocitos de ratón está influenciada por un entorno diabético (una enfermedad relacionada con la energía) y está mediada a través de la vía de fosforilación PDHE1α controlada por PDK1 (Ge et al., 2021). La interrupción de la actividad de PDH puede ser una causa potencial para la disminución de la maduración de los ovocitos tratados con βHB. Sin embargo, se necesita más investigación para determinar si la fosforilación de PDH está involucrada en el ensamblaje meiótico de ovocitos bovinos y qué sitios reguladores específicos se ven afectados.
El DCA mostró un efecto promotor sobre la actividad de PDH al inhibir la fosforilación e inactivación del complejo piruvato deshidrogenasa en estudios previos. Otros estudios también demostraron que la suplementación con DCA mostró una influencia beneficiosa en el desarrollo embrionario a través de la regulación de la disfunción mitocondrial o la producción de ATP (Penzias et al., 1993; McPherson et al., 2014). Nuestros resultados también mostraron que el DCA puede rescatar los efectos nocivos inducidos por βHB mediante la promoción de la actividad de PDH durante la maduración de los ovocitos. Estos resultados demostraron que βHB causó la detención de la maduración de los ovocitos debido a la disminución de la actividad de PDH.
El complejo PDH juega un papel fundamental en la maduración meiótica de ovocitos a través de sus funciones en la catalización de piruvatos para convertir en acetil-CoA. El estudio anterior informó que la PDH está altamente expresada y translocada al núcleo del embrión porcino para mantener los niveles de acetilación de histonas al producir cantidades suficientes de acetil-CoA durante ZGA (Zhou et al., 2020). Por lo tanto, el acetil-CoA puede proporcionar grupos acetilo y regular el proceso de acetilación de proteínas, lo que nos promovió a investigar los cambios globales de acetilación después del tratamiento con βHB. Demostramos que 3.6 mM βHB obviamente redujo el nivel de acetilación intracelular en ovocitos bovinos, lo que sugiere que βHB puede inducir la reducción de la acetilación, lo cual es importante para muchos procesos celulares clave (He et al., 2021). Al igual que nuestro estudio, la investigación anterior informó que βHB redujo la acetilación y activación de p53 (Liu et al., 2019). La acetilación de histonas (He et al., 2021) y no histonas (Reichmann et al., 2020) tienen funciones esenciales en el desarrollo del folículo y la maduración de los ovocitos. Por lo tanto, la reducción de la calidad de los ovocitos y la detención del desarrollo embrionario pueden ser causadas por la actividad reprimida de PDH que regula a la baja la acetilación global a través de la producción de acetil-CoA.
5 Conclusión
Nuestro estudio actual tiene como objetivo investigar el impacto de βHB en concentraciones subclínicas y clínicas en ovocitos bovinos. Como se muestra en nuestros resultados, se encontró que βHB impide la maduración de los ovocitos y la capacidad de desarrollo a través de la disfunción mitocondrial y la anomalía del metabolismo energético asociada a la piruvato deshidrogenasa (PDH), como la modificación de la acetilación intracelular. Estos efectos pueden contribuir a la disminución de la calidad de los ovocitos y potencialmente resultar en trastornos reproductivos tanto en futuros embriones como en descendientes. Nuestros hallazgos ofrecen nuevos conocimientos sobre los efectos perjudiciales de la cetosis en la eficiencia reproductiva bovina.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / Material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Contribuciones del autor
Conceptualización, W-FL y XM; Metodología, C-SY, K-YZ y JG; Software, C-GM, Z-QL y H-YL; Validación, C-LZ, K-YZ, JG y H-YL; Análisis Formal, K-YZ; Investigación, JG; Curación de datos, K-YZ; Redacción – preparación del borrador original, K-YZ; Redacción-revisión y edición, W-FL y XM; Supervisión, JZ, W-FL y XM; Administración de proyectos, W-FL; Adquisición de fondos, JW, W-FL. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Esta investigación fue apoyada por el Programa Nacional Clave de Investigación y Desarrollo de China (2021YFD1200401); Proyecto de Talento Emprendedor Innovador de la Provincia de Jilin (2022QN13); Fundación Nacional de Ciencias Naturales del Programa Internacional de Investigación e Intercambio Cooperativo de China (31861143014); Sistema de Investigación Agrícola de China de MOF y MARA (CARS-37).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fphar.2023.1243243/full#supplementary-material
Referencias
Belli, M., Palmerini, M. G., Bianchi, S., Bernardi, S., Khalili, M. A., Nottola, S. A., et al. (2021). Ultraestructura de mitocondrias de ovocitos humanos en diferentes condiciones clínicas durante la reproducción asistida. Arq. Bioquímica. Biophys. 703, 108854. doi:10.1016/j.abb.2021.108854
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bernabucci, U., Ronchi, B., Lacetera, N., y Nardone, A. (2005). Influencia de la puntuación de la condición corporal en las relaciones entre el estado metabólico y el estrés oxidativo en vacas lecheras periparto. J. Dairy Sci. 88, 2017–2026. doi:10.3168/jds. S0022-0302(05)72878-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Boguenet, M., Bouet, P. E., Spiers, A., Reynier, P. y May-Panloup, P. (2021). Mitocondrias: su papel en los espermatozoides y en la infertilidad masculina. Hum. Reprod. Actualización 27, 697–719. doi:10.1093/humupd/dmab001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cecchino, G. N., Seli, E., Alves Da Motta, E. L. y GarcíA-Velasco, J. A. (2018). El papel de la actividad mitocondrial en la fertilidad femenina y las tecnologías de reproducción asistida: visión general y perspectivas actuales. Reprod. Biomed. En línea 36, 686–697. doi:10.1016/j.rbmo.2018.02.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cenigaonandia-Campillo, A., Serna-Blasco, R., GóMEZ-Ocabo, L., Solanes-Casado, S., BañOS-Herraiz, N., Puerto-Nevado, L. D., et al. (2021). La vitamina C activa la piruvato deshidrogenasa (PDH) dirigida al ciclo del ácido tricarboxílico mitocondrial (TCA) en el cáncer de colon hipóxico KRAS mutante. Teranósticos 11, 3595–3606. doi:10.7150/thno.51265
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cheng, B., Lu, H., Bai, B. y Chen, J. (2013). El d-β-hidroxibutirato inhibió la apoptosis de las células PC12 inducida por H2O2 a través de la inhibición del estrés oxidativo. Neuroquímica. Int. 62, 620–625. doi:10.1016/j.neuint.2012.09.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Dai, J. G., Huang, X. M., Zhang, C. y Gao, J. M. (2021). Mecanismos del metabolismo lipídico promovido por berberina vía peroxisomas proliferator-activated receptor gamma durante la maduración in vitro de ovocitos porcinos. Anim. Sci. J. 92, e13582. doi:10.1111/asj.13582
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Elefantova, K., Lakatos, B., Kubickova, J., Sulova, Z. y Breier, A. (2018). Detección del potencial de membrana mitocondrial mediante el colorante catiónico JC-1 en células L1210 con sobreexpresión masiva del transportador de fármacos ABCB1 de la membrana plasmática. Int. J. Mol. 19, 1985. doi:10.3390/ijms19071985
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gao, X., Gao, Y. Y., Yan, H. Y., Liu, G. J., Zhou, Y., Tao, T., et al. (2022). PDK4 disminuye la apoptosis neuronal mediante la inhibición de la vía ROS-ASK1/P38 en la lesión cerebral temprana después de una hemorragia subaracnoidea. Antioxidante. Señal redox 36, 505–524. doi:10.1089/ars.2021.0083
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gardner, D. K., y Leese, H. J. (1990). Concentraciones de nutrientes en el líquido del oviducto del ratón y sus efectos sobre el desarrollo embrionario y el metabolismo in vitro. J. Reprod. Fertil. 88, 361–368. doi:10.1530/jrf.0.0880361
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ge, J., Zhang, N., Tang, S., Hu, F., Hou, X., Sun, H., et al. (2021). La pérdida de PDK1 induce defectos meióticos en ovocitos de ratones diabéticos. Frente. Cell Dev. Biol. 9, 793389. doi:10.3389/fcell.2021.793389
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gong, J., Zhao, S., Heng, N., Wang, Y., Hu, Z., Wang, H., et al. (2022). Los perfiles de transcripción dinámica de la granulosa ovárica bovina proliferante cuando se exponen a niveles elevados de ácido β-hidroxibutírico. Frente. Vet. Sci. 9, 915956. doi:10.3389/fvets.2022.915956
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Grindler, N. M., y Moley, K. H. (2013). Obesidad materna, infertilidad y disfunción mitocondrial: mecanismos potenciales que surgen de los sistemas modelo de ratón. Mol. Hum. Reprod. 19, 486–494. doi:10.1093/molehr/gat026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Halstead, M. M., Ma, X., Zhou, C., Schultz, R. M. y Ross, P. J. (2020). La remodelación de la cromatina en embriones bovinos indica una regulación específica de la especie de la activación del genoma. Nat. Commun. 11, 4654. doi:10.1038/s41467-020-18508-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Harris, S. E., Gopichandran, N., Picton, H. M., Leese, H. J. y Orsi, N. M. (2005). Concentraciones de nutrientes en el líquido folicular murino y el tracto reproductor femenino. Theriogenology 64, 992–1006. doi:10.1016/j.theriogenology.2005.01.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
He, M., Zhang, T., Yang, Y. y Wang, C. (2021). Mecanismos de maduración de ovocitos y regulación epigenética relacionada. Frente. Cell Dev. Biol. 9, 654028. doi:10.3389/fcell.2021.654028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Herta, A. C., von Mengden, L., Akin, N., Billooye, K., Coucke, W., van Leersum, J., et al. (2022). Caracterización del metabolismo de carbohidratos en folículos antrales de ratón cultivados e in vitro cultivados y madurados. Biol. Reprod. 107, 998–1013. doi:10.1093/biolre/ioac124
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hou, X., Zhang, L., Han, L., Ge, J., Ma, R., Zhang, X., et al. (2015). Diferentes funciones de las quinasas de piruvato deshidrogenasa durante la maduración de los ovocitos de ratón. J. Cell Sci. 128, 2319–2329. doi:10.1242/jcs.167049
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hwang, C. Y., Choe, W., Yoon, K. S., Ha, J., Kim, S. S., Yeo, E. J., et al. (2022). Mecanismos moleculares para el metabolismo del cuerpo cetónico, funciones de señalización y potencial terapéutico en el cáncer. Nutrientes 14, 4932. doi:10.3390/nu14224932
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Imanaka, S., Shigetomi, H. y Kobayashi, H. (2022). Reprogramación del metabolismo de la glucosa de células cúmulos y ovocitos y su importancia terapéutica. Reprod. 29, 653–667. doi:10.1007/s43032-021-00505-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Jin, J. X., Lee, S., Taweechaipaisankul, A., Kim, G. A. y Lee, B. C. (2017). La melatonina regula el metabolismo lipídico en ovocitos porcinos. J. Pineal Res. 62, E12388. doi:10.1111/jpi.12388
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Johnson, M. T., Freeman, E. A., Gardner, D. K. y Hunt, P. A. (2007). El metabolismo oxidativo del piruvato es necesario para la maduración meiótica de ovocitos murinos in vivo. Biol. Reprod. 77, 2–8. doi:10.1095/biolreprod.106.059899
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kirillova, A., Smitz, J. E. J., Sukhikh, G. T. y Mazunin, I. (2021). El papel de las mitocondrias en la maduración de los ovocitos. Celdas 10, 2484. doi:10.3390/cells10092484
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Labarta, E., de Los Santos, M. J., Escribá, M. J., Pellicer, A. y Herraiz, S. (2019). Las mitocondrias como herramienta para el rejuvenecimiento de los ovocitos. Fértil. Esterilidad. 111, 219–226. doi:10.1016/j.fertnstert.2018.10.036
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Leese, H. J., y Barton, A. M. (1984). Captación de piruvato y glucosa por óvulos de ratón y embriones preimplantacionales. J. Reprod. Fertil. 72, 9–13. doi:10.1530/jrf.0.0720009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Lentscher, J. A., Slocu, B. y Torrealday, S. (2021). Síndrome de ovario poliquístico y fertilidad. Clin. Obstet. Gynecol. 64, 65–75. doi:10.1097/GRF.0000000000000595
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Leroy, J. L., Vanholder, T., Delanghe, J. R., Opsomer, G., van Soom, A., Bols, P. E., et al. (2004). Composición de metabolitos e iones del líquido folicular de folículos de diferentes tamaños y su relación con las concentraciones séricas en vacas lecheras. Anim. Reprod. 80, 201–211. doi:10.1016/S0378-4320(03)00173-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Liu, K., Li, F., Sun, Q., Lin, N., Han, H., You, K., et al. (2019). p53 β-hidroxibutirilación atenúa la actividad de p53. Muerte celular Dis. 10, 243. doi:10.1038/s41419-019-1463-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Lonergan, P., Rizos, D., Ward, F. y Boland, M. P. (2001). Factores que influyen en la calidad de ovocitos y embriones en bovinos. Reprod. Nutr. Dev. 41, 427–437. doi:10.1051/rnd:2001142
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Mcpherson, N. O., Zander-Fox, D. y Lane, M. (2014). La estimulación del metabolismo embrionario mitocondrial por ácido dicloroacético en un modelo de ratón envejecido mejora el desarrollo embrionario y la viabilidad. Fértil. Esterilidad. 101, 1458–1466. doi:10.1016/j.fertnstert.2013.12.057
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Missio, D., Fritzen, A., Cupper Vieira, C., Germano Ferst, J., Farias Fiorenza, M., Guedes de Andrade, L., et al. (2022). El aumento de la concentración de β-hidroxibutirato (BHBA) afecta el crecimiento folicular en el ganado. Anim. Reprod. 243, 107033. doi:10.1016/j.anireprosci.2022.107033
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Nagaraj, R., Sharpley, M. S., Chi, F., Braas, D., Zhou, Y., Kim, R., et al. (2017). Localización nuclear de las enzimas del ciclo del TCA mitocondrial como un paso crítico en la activación del genoma cigótico de mamíferos. Celda 168, 210–223.e11. doi:10.1016/j.cell.2016.12.026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Nandi, S., Tripathi, S. K., Gupta, P. S. P. y Mondal, S. (2017). Efecto de los estresores metabólicos sobre la supervivencia y el crecimiento de folículos preantrales ovinos cultivados in vitro y ovocitos cerrados. Theriogenology 104, 80–86. doi:10.1016/j.theriogenology.2017.07.024
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Nandi, S., Tripathi, S. K., Gupta, P. S. P. y Mondal, S. (2018). Estresores nutricionales y metabólicos en el desarrollo de ovocitos ovinos y funciones celulares de la granulosa in vitro. Chaperonas de estrés celular 23, 357–371. doi:10.1007/s12192-017-0846-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Newman, J. C. y Verdin, E. (2014). Cuerpos cetónicos como metabolitos de señalización. Tendencias Endocrinol. Metab. 25, 42–52. doi:10.1016/j.tem.2013.09.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Nie, H., Ju, H., Fan, J., Shi, X., Cheng, Y., Cang, X., et al. (2020). O-GlcNAcilación de PGK1 coordina la glucólisis y el ciclo de TCA para promover el crecimiento tumoral. Nat. Commun. 11, 36. doi:10.1038/s41467-019-13601-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
O’Donnell-Tormey, J., Nathan, C. F., Lanks, K., Deboer, C. J., y de la Harpe, J. (1987). Secreción de piruvato. Una defensa antioxidante de las células de mamíferos. J. Exp. Med. 165, 500–514. doi:10.1084/jem.165.2.500
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Pelletier, A., y Coderre, L. (2007). Los cuerpos cetónicos alteran la absorción de glucosa inducida por dinitrofenoles a través de la inhibición de AMPK y la generación de estrés oxidativo en cardiomiocitos adultos. Am. J. Physiol. Endocrinol. Metab. 292, E1325–E1332. doi:10.1152/ajpendo.00186.2006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Penzias, A. S., Rossi, G., Gutmann, J. N., Haj-Hassan, L., Leykin, L. y Diamond, M. P. (1993). El ácido dicloroacético acelera el desarrollo inicial de embriones murinos de 2 células in vitro. Metabolismo 42, 1077–1080. doi:10.1016/0026-0495(93)90260-u
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Reichmann, J., Dobie, K., Lister, L. M., Crichton, J. H., Best, D., Maclennan, M., et al. (2020). Tex19.1 inhibe la vía de la regla del extremo N y mantiene la cohesión de la cohesina SMC3 acetilada y la cromátida hermana en los ovocitos. J. Cell Biol. 219, e201702123. doi:10.1083/jcb.201702123
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sangalli, J. R., Sampaio, R. V., Del Collado, M., Da Silveira, J. C., de Bem, T. H. C., Perecin, F., et al. (2018). Expresión génica metabólica y efectos epigenéticos del cuerpo cetónico β-hidroxibutirato sobre H3K9ac en células bovinas, ovocitos y embriones. 8, 13766. doi:10.1038/s41598-018-31822-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sarentonglaga, B., Ogata, K., Taguchi, Y., Kato, Y. y Nagao, Y. (2013). El potencial de desarrollo de los ovocitos se ve afectado en el ganado con anomalías hepáticas. J. Reprod. 59, 168–173. doi:10.1262/jrd.2012-163
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Shimazu, T., Hirschey, M. D., Newman, J., He, W., Shirakawa, K., Le Moan, N., et al. (2013). Supresión del estrés oxidativo por β-hidroxibutirato, un inhibidor endógeno de la histona desacetilasa. Science 339, 211–214. doi:10.1126/science.1227166
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sui, L., Zhang, S., Huang, R. y Li, Z. (2020). HDAC11 promueve el ensamblaje del aparato meiótico durante la maduración de los ovocitos de ratón a través de la disminución de H4K16 y la acetilación de α-tubulina. Ciclo celular 19, 354–362. doi:10.1080/15384101.2019.1711315
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Tian, W., Wei, T., Li, B., Wang, Z., Zhang, N. y Xie, G. (2014). Vía de muerte celular programada y estrés oxidativo inducido por β-hidroxibutirato en células del músculo liso abomaso de vaca lechera y en músculo liso gástrico de ratón. PLoS One 9, e96775. doi:10.1371/journal.pone.0096775
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Yang, W., Pang, D., Chen, M., Du, C., Jia, L., Wang, L., et al. (2021). Rheb media la energía mitocondrial inducida por la actividad neuronal a través de la activación de PDH independiente de mTORC1. Celda de desarrollo 56, 811–825.e6. doi:10.1016/j.devcel.2021.02.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Youm, Y. H., Nguyen, K. Y., Grant, R. W., Goldberg, E. L., Bodogai, M., Kim, D., et al. (2015). El metabolito de la cetona β-hidroxibutirato bloquea la enfermedad inflamatoria mediada por inflamasoma NLRP3. Nat. Med. 21, 263–269. doi:10.1038/nm.3804
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Yousefian, I., Zare-Shahneh, A., Goodarzi, A., Baghshahi, H. y Fouladi-Nashta, A. A. (2021). El efecto de Tempo y MitoTEMPO en la maduración de los ovocitos y el posterior desarrollo embrionario en el modelo bovino. Theriogenology 176, 128–136. doi:10.1016/j.theriogenology.2021.09.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhang, J., Bao, Y., Zhou, X. y Zheng, L. (2019). Síndrome de ovario poliquístico y disfunción mitocondrial. Reprod. Biol. Endocrinol. 17, 67. doi:10.1186/s12958-019-0509-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhou, W., Niu, Y. J., Nie, Z. W., Kim, J. Y., Xu, Y. N., Yan, C. G., et al. (2020). La acumulación nuclear de piruvato deshidrogenasa alfa 1 promueve la acetilación de histonas y es esencial para la activación del genoma cigótico en embriones porcinos. Biochim. Biophys. Acta Mol. Cell Res. 1867, 118648. doi:10.1016/j.bbamcr.2020.118648
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: β-hidroxibutirato (βHB), PDH, modificación de la acetilación, maduración de ovocitos, rendimiento reproductivo bovino
Cita: Zhang K-Y, Guo J, Zhan C-L, Yuan C-S, Min C-G, Li Z-Q, Liu H-Y, Wang J, Zhao J, Lu W-F y Ma X (2023) β-hidroxibutirato perjudica la maduración de los ovocitos bovinos a través de la anomalía del metabolismo energético asociada a la piruvato deshidrogenasa (PDH). Frente. Pharmacol. 14:1243243. doi: 10.3389/fphar.2023.1243243
Recibido: 20 de junio de 2023; Aprobado: 03 Agosto 2023;
Publicado: 11 agosto 2023.
Editado por:
Eleonore Fröhlich, Universidad Médica de Graz, Austria
Revisado por:
Xingwei Liang, Universidad de Guangxi, China Qingrui Zhuan, Hospital General de la Fuerza Aérea PLA, China Xiangwei Fu, Universidad Agrícola de China, China
Derechos de autor © 2023 Zhang, Guo, Zhan, Yuan, Min, Li, Liu, Wang, Zhao, Lu y Ma. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Wen-Fa Lu, wenfa2004@163.com; Xin Ma, maxin3202@163.com
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía