Eficacia antihelmíntica del aceite esencial de menta contra nematodos de ovejas

Eficacia antihelmíntica in vitro e in vivo del aceite esencial de menta (Mentha x piperita L.) contra nematodos gastrointestinales de ovejas
 Filip Štrbac1*
Filip Štrbac1*  Slobodan Krnjajić1
Slobodan Krnjajić1  Dragica Stojanović2
Dragica Stojanović2  Radomir Ratajac3
Radomir Ratajac3  Nataša Simin4
Nataša Simin4  Dejan Orčić4
Dejan Orčić4  Laura Rinaldi5
Laura Rinaldi5  Elena Ciccone5
Elena Ciccone5  María Paola Maurelli5
María Paola Maurelli5  Giuseppe Cringoli5
Giuseppe Cringoli5  Antonio Bosco5*
Antonio Bosco5*- 1Instituto de Investigación Multidisciplinaria, Universidad de Belgrado, Belgrado, Serbia
- 2Departamento de Medicina Veterinaria, Facultad de Agricultura, Universidad de Novi Sad, Novi Sad, Serbia
- 3Instituto Científico Veterinario Novi Sad, Novi Sad, Serbia
- 4Departamento de Química, Bioquímica y Protección del Medio Ambiente, Facultad de Ciencias, Universidad de Novi Sad, Novi Sad, Serbia
- 5Departamento de Medicina Veterinaria y Producción Animal, Universidad de Nápoles Federico II, CREMOPAR, Nápoles, Italia
Hoy en día, el uso exclusivo de antihelmínticos comerciales para el tratamiento de infecciones por nematodos gastrointestinales en rumiantes es menos sostenible debido a la resistencia a los antihelmínticos, así como al problema de los residuos de medicamentos en los productos animales y el medio ambiente. Por lo tanto, se necesita un enfoque terapéutico integrado, incluida la búsqueda de alternativas a los fármacos antihelmínticos sintéticos. El objetivo de este estudio fue evaluar la posibilidad de utilizar el aceite esencial de menta (Mentha x piperita L.) en el control de nematodos gastrointestinales en ovinos. Para ello, se examinó la eficacia antihelmíntica in vitro e in vivo de este aceite y los efectos tóxicos en los huéspedes. En la prueba de eclosión de huevos in vitro, la actividad ovicida varió de 21.0 a 90.3% dependiendo de la concentración de aceite esencial utilizado (0.0125, 0.025, 0.049, 0.195, 0.781, 3.125, 12.5 y 50 mg / ml). Hasta cierto punto, la eficacia antihelmíntica se confirmó en la prueba de reducción del recuento de huevos fecales in vivo a una dosis media de 150 mg / kg, con una reducción promedio de los huevos de nematodos de 26.9 y 46.0% en los días 7 y 14 después del tratamiento, respectivamente. Además, no se observaron efectos tóxicos del aceite aplicado en el comportamiento de las ovejas, el riñón o la función hepática. Los principales compuestos identificados por cromatografía de gases-espectrometría de masas fueron mentol (32,6%), mentona (22,0%), mentil-acetato (10,0%) e isomentona (9,39%). Debido a sus complejas composiciones químicas, numerosos ingredientes bioactivos y origen natural, las formulaciones a base de hierbas representan una alternativa potencialmente valiosa para el control de nematodos gastrointestinales en ovejas. En este contexto, los resultados del presente estudio mostraron que el aceite esencial de menta es uno de los candidatos prometedores. Se deben realizar estudios adicionales para recopilar más datos sobre el perfil de seguridad de M. piperita EO en animales tratados para encontrar la formulación más apropiada para su uso en condiciones de campo y para probarla contra poblaciones de nematodos gastrointestinales resistentes.
1. Introducción
Los nematodos gastrointestinales (GIN) son uno de los endoparásitos más importantes en los animales de pastoreo, especialmente los rumiantes (1). En las ovejas, estos parásitos pueden causar diversos efectos negativos, incluyendo enfermedades subclínicas con pérdida de peso y reducción de la producción animal, o enfermedades clínicamente manifestadas con signos de anemia, diarrea, pérdida de proteínas, anorexia, disminución de la inmunidad y fertilidad (2-4). En el caso de una carga alta de gusanos, puede ocurrir un desenlace posiblemente fatal (5). Por lo tanto, debido a la disminución de la productividad, los altos costos de tratamiento y la posible muerte de los animales, el parasitismo GIN puede tener un gran impacto económico (6). Los antihelmínticos disponibles comercialmente se han utilizado con éxito durante décadas para controlar estos parásitos (7). Sin embargo, como resultado de su uso irracional, se ha desarrollado resistencia a los antihelmínticos (RA), por lo que se consideran factores de alto riesgo los siguientes: subdosificación, tratamientos demasiado frecuentes, tratamiento masivo y regímenes de un solo fármaco (8, 9).
Por lo tanto, se ha informado un aumento de la resistencia de los nematodos al conocido grupo de antihelmínticos como los benzimidazoles, las lactonas macrocíclicas y los imidazotiazoles, a veces simultáneamente a varias clases diferentes (10, 11). El problema también está presente en nuevos grupos antihelmínticos como el monepantel, un derivado del aminoacetonitrilo (12). Las pérdidas económicas anuales resultantes del desarrollo de la RA se estiman en 38 millones de euros en Europa, con un crecimiento esperado en el futuro (10). Otros problemas asociados con el uso de antihelmínticos comerciales son los residuos presentes en productos animales como la carne y la leche o en el ecosistema y la biodiversidad. Esto representa un grave problema asociado con muchos medicamentos quimioterapéuticos disponibles actualmente, junto con el aumento del precio (13, 14). Todas las cuestiones mencionadas sugieren la necesidad urgente de desarrollar estrategias novedosas para futuros tratamientos (4).
Como posible solución para lograr un control sostenible de los GIN de ovejas, muchos investigadores han propuesto un enfoque integrado (1, 15-19). Esto se refiere al uso racional de antihelmínticos comerciales, junto con el uso de alternativas. Por un lado, el uso racional de los antihelmínticos debe basarse en estrategias de refugios como los tratamientos dirigidos (TT) o los tratamientos selectivos dirigidos (TST), que implican solo el tratamiento de rebaños o animales que lo requieren por razones clínicas o económicas (19-21). Además, el uso racional de medicamentos comerciales puede referirse a la combinación o rotación de antihelmínticos de diferentes clases químicas para evitar el uso excesivo de un solo medicamento (5, 7). Por otro lado, el control integrado implica la incorporación de diversas estrategias alternativas en la práctica, como la selección genética de ovejas naturalmente resistentes a los GIN, el manejo de pastos, la manipulación dietética, el desarrollo de vacunas, el control biológico (uso directo de hongos nematófagos, bacterias y nematodos depredadores o uso indirecto de lombrices de tierra o escarabajos peloteros), o el uso de antihelmínticos de origen vegetal (taninos condensados, varios extractos, o aceites esenciales) (6, 15, 19, 22, 23).
Como mezclas aromáticas, complejas y concentradas de compuestos volátiles no polares, los aceites esenciales (OE) pertenecen al grupo de metabolitos secundarios de las plantas que son responsables de permitir que las plantas sean competitivas en su propio entorno (24, 25). Por lo tanto, estas mezclas contienen varios compuestos como terpenos, terpenoides y fenilpropanoides que pueden usarse para diversos fines farmacológicos (26, 27). Los AE y sus compuestos se pueden obtener de las plantas mediante diversos métodos de extracción y, junto con sus extractos, se utilizan cada vez más en medicina veterinaria en los últimos tiempos. Entre otros, las indicaciones para su aplicación incluyen el uso como coccidiostáticos para aumentar la inmunidad y mejorar el rendimiento de las aves de corral, para prevenir la diarrea en lechones (debido a sus propiedades antimicrobianas), como suplementación dietética de peces, para usar contra Varroa destructor en apicultura o contra Malassezia pachydermatis y garrapatas en mascotas, etc. (28–31). En rumiantes, los posibles beneficios de la OE, entre otros, incluyen la mejora de la fermentación y digestión ruminal y la reducción de la metanogénesis y la excreción de nitrógeno (29). Además, diversos estudios han demostrado la eficacia de las OE frente a los GIN en ovejas. La lista es amplia e incluye orégano, tomillo, cilantro, árbol de té y lavanda, así como varias especies de hierba de limón, eucalipto, lippia, menta, etc. (32, 33).
La menta (Mentha x piperita L.) representa una hierba aromática y medicinal bien conocida derivada del cruce entre la menta verde (Mentha spicata L.) y la menta de agua (Mentha aquatica L.). Pertenece a la familia Lamiaceae y es originaria de la región mediterránea, pero ahora se cultiva en varias partes del mundo (34). La menta es una de las especies vegetales más importantes en las industrias farmacéutica y cosmética, cuya OE es ampliamente producida y utilizada. Muchas propiedades farmacológicas de la menta se han demostrado previamente e incluyen efectos analgésicos, antivirales, antibacterianos, antifúngicos y antiparasitarios (35, 36). Además, el efecto de M. piperita EO contra los GIN de ovejas también se demostró en varios estudios, por lo que mostró resultados prometedores contra diferentes etapas del parásito (37-39). Sin embargo, hasta ahora solo se ha demostrado la eficacia en condiciones de laboratorio, lo que requiere la confirmación de estos resultados en ensayos de campo. Por lo tanto, junto con in vitro, el objetivo del presente estudio fue examinar el efecto in vivo de M. piperita EO contra GIN de ovejas, así como evaluar la seguridad de su uso en los huéspedes.
2. Materiales y métodos
2.1. Análisis químicos
Mentha piperita La OE se obtuvo del Instituto de Cultivos de Campo y Hortalizas, Novi Sad, Serbia, por lo que la composición química (caracterización cualitativa y semicuantitativa) de la OE probada se determinó mediante cromatografía de gases-espectrometría de masas (GC-MS) en el Departamento de Química, Bioquímica y Protección del Medio Ambiente, Facultad de Ciencias, Universidad de Novi Sad, Serbia. Los parámetros exactos relativos a las condiciones técnicas para el análisis se describen en Knežević et al. (40) y Štrbac et al. (41) como sigue: volumen de inyección de EO 1 μL; temperatura del inyector 250°C; relación de división 1:10; gas portador helio; caudal: 1 mL/min; columna capilar: HP-5 (30 m × 0,25 mm, 0,25 μm); programa de temperatura 50–270°C; temperatura de la fuente de iones 230°C; energía del electrón 70 eV; temperatura cuadrupolo 150°C. Los compuestos se identificaron mediante la comparación de espectros de masas con bibliotecas de datos (Wiley Registry of Mass Spectral Data, 7th ed., y NIST / EPA / NIH Mass Spectral Library 05) y se confirmaron por comparación con índices de retención aritmética (IA) con datos de literatura (42). El gasóleo, que contiene n-alcanos C8-C28, se utilizó como estándar para la determinación de los índices de retención. Las cantidades relativas de los componentes, expresadas en porcentajes, se calcularon mediante el procedimiento de normalización de acuerdo con el área pico en el cromatograma iónico total.
2.2. Ensayo in vitro–ensayo de eclosión de huevos
Los análisis restantes se realizaron en el Centro Regional de Monitoreo de Parasitosis (CREMOPAR) ubicado en Eboli (SA), Italia, en 2021. Para el examen in vitro del potencial antihelmíntico de M. piperita EO, se eligió la prueba de eclosión de huevos (EHT). Los huevos de EST se recolectaron de muestras fecales tomadas directamente de la ampolla rectal de ovejas (n = 40) con infección natural-mixta, y se procesaron dentro de las 2 h posteriores a la recolección por el método de recuperación (43). Para separar los huevos de las heces, las muestras primero se agruparon, homogeneizaron y filtraron bajo agua corriente a través de mallas de diferentes tamaños (1 mm, 250 μm, 212 μm y 38 μm). Los huevos de GIN que se retuvieron en la malla más pequeña se lavaron con agua destilada y se centrifugaron a 1500 rpm durante 3 minutos, después de lo cual se desechó el sobrenadante. Luego, la centrifugación se realizó utilizando una solución de azúcar al 40% para flotar los huevos, que luego se aislaron en nuevos tubos y se mezclaron con agua destilada. Finalmente, se realizaron algunas centrifugaciones más para retirar los pellets y obtener una solución acuosa que contenía huevos GIN.
Similar a nuestro estudio anterior (41), el EHT se realizó a ocho concentraciones diferentes (50, 12.5, 3.125, 0.781, 0.195, 0.049, 0.025 y 0.0125 mg / ml) de la EO probada obtenida por la dilución. Para ello, se utilizaron placas de 24 pocillos en las que cada concentración de EO se emulsionó con Tween 3% al 80%. Se agregó una solución acuosa (40 mL) que contenía aproximadamente 150 huevos GIN a cada pozo, que luego se completó con agua destilada para alcanzar un volumen final de 0.5 mL en los pozos. El control positivo fue tiabendazol en las dos concentraciones más bajas utilizadas para EO, y los controles negativos fueron 3% Tween 80 en la cantidad utilizada para la emulsión, así como agua destilada. Tras un período de incubación de 48 h a 27 °C, los huevos GIN y la primera fase eclosionada (L1) las larvas se contaron bajo un microscopio invertido y se calculó la inhibición de la incubabilidad. El experimento se realizó en tres réplicas, y los valores obtenidos se expresaron como media aritmética ± desviación estándar.
2.3. Ensayo in vivo: ensayo de reducción del recuento fecal de huevos
El ensayo in vivo se realizó en dos granjas diferentes en el sur de Italia (región de Campania), donde la prevalencia de GIN es alta (3). En la granja 1, los animales estaban en libertad, y en la granja 2, los animales se mantuvieron en cajas durante el tratamiento. Se utilizaron ovejas con infección natural-mixta y diferentes cargas de lombrices, principalmente la raza lechera mixta Lacaune/Bagnolese, homogénea en cuanto a edad (2 años ±0,5) y época de pastoreo, con un peso corporal promedio (p.v.) de 50 kg ± 5. Los animales probados fueron alimentados con pastos y forraje (cebada y granos de maíz), y la dieta no se modificó durante el experimento. Ninguno de los tratamientos comerciales se aplicó al menos 6 meses antes del ensayo, y los animales ayunaron y permanecieron en ayunas hasta 2 h después de la administración de OE. En ambas granjas estudiadas, las ovejas se dividieron en tres grupos de tratamiento diferentes:
G1: 150 mg/kg de M. piperita EO (n = 12 animales/grupo/granja).
G2: 3,8 mg/kg de albendazol, control positivo (n = 12 animales/grupo/granja).
G3: 50 mL de aceite de girasol por animal, control negativo (n = 12 animales/grupo/granja).
La formulación de AE se preparó diluyendo M. piperita EO en aceite de girasol (1,4.5) para evitar el efecto del aceite puro sobre las membranas mucosas del tracto gastrointestinal. En un intento de garantizar que el mayor número posible de ingredientes activos de AE lleguen a los sitios objetivo (abomaso e intestino), la formulación (así como los controles) se aplicaron directamente en el rumen de los animales. Las muestras fecales individuales se recogieron por vía rectal antes del tratamiento (D0) y 7 y 14 días después del tratamiento (D7 y D14) y se almacenaron a 4 ° C antes del procesamiento. Las muestras recogidas se analizaron mediante la novedosa técnica Mini-FLOTAC (44) con un límite de detección de cinco huevos por gramo (EPG) de heces, utilizando una solución de flotación de cloruro de sodio (gravedad específica = 1,200). Los porcentajes de reducción de EPG se evaluaron en D7 y D14 mediante el cálculo de medias dentro de cada grupo, por lo que los resultados finales para cada grupo se presentaron como medias aritméticas de las dos granjas examinadas.
2.4. Coprocultura
El estudio de coprocultura se realizó de acuerdo con el protocolo desarrollado por el Ministerio de Agricultura, Pesca y Alimentación del Reino Unido (45) con el fin de identificar los géneros de GIN en las granjas muestreadas y los cambios en su población después del tratamiento. Antes del almacenamiento a 4 ° C, se recolectó una cantidad igual de heces de cada muestra para formar un grupo formado para la prueba in vivo (M. piperita EO, albendazol y aceite de girasol) en diferentes puntos de tiempo (D0, D7 y D14). Las larvas desarrolladas en la tercera etapa (L3) fueron identificados a partir de las claves morfológicas propuestas por van Wyk y Mayhew (46). La identificación y porcentaje de cada género de nematodos se realizó en 100 L3, por lo que se identificaron todas las larvas si una muestra contenía 100 L o menos3. De esta manera, el porcentaje de cada género podría determinarse a partir del número total de larvas identificadas (41).
2.5. Estudios de toxicidad
Todos los animales tratados fueron observados clínicamente por la presencia de posibles efectos adversos, con especial atención a su alimentación, defecación y comportamiento. Además, se recogieron muestras de sangre de la vena yugular en D0 y D14 para evaluar los efectos de la OE utilizada sobre los parámetros sanguíneos. Para los parámetros hematológicos, las muestras de sangre se recogieron en tubos de vacío que contenían EDTA y se procesaron poco después (dentro de 2-4 h), mientras que, para los parámetros bioquímicos, la sangre se recogió en tubos de vacío sin coagulante y posteriormente se analizó. Para este último, se prestó especial atención a la urea, creatinina y AST y GGT, que representan parámetros de función renal y hepática, respectivamente.
2.6. Análisis estadísticos
La inhibición de la incubabilidad (IH) en el EHT se calculó utilizando la siguiente fórmula propuesta por Coles et al. (47) y Pinto et al. (22):
IH (%) = número de huevos/(número de huevos + número de larvas L1) × 100.
Para la comparación mutua del efecto ovicida de diferentes concentraciones, así como con los controles, se realizó un análisis de varianza unidireccional (ANOVA) con la prueba de Tukey post hoc con un valor de p umbral de 0,05. Se utilizó regresión no lineal/distribución logarítmica para evaluar la presencia de un efecto dependiente de la dosis y calcular la concentración inhibitoria semimáxima (IC50) (48).
En el FECRT, la reducción de la EPG media en cada grupo de tratamiento en cada punto temporal se calculó utilizando la siguiente fórmula (48, 49):
FECR (%) = (1 − (T2/t1 × C1/C2)) × 100.
En esta fórmula, T2 representa la EPG después del tratamiento (D7 o D14); T1 representa la EPG antes del tratamiento (D0), C1 representa la EPG antes del tratamiento en el grupo control negativo y C2 representa la EPG después del tratamiento (D7 o D14) en el grupo control negativo. Los valores obtenidos se compararon utilizando el ANOVA bidireccional seguido de la prueba de Tukey para evaluar las diferencias en el efecto dentro de un grupo y ubicación para diferentes días, así como dentro del mismo día y ubicación para diferentes grupos (valor del umbral p de 0,05).
Finalmente, para el análisis de los resultados de los análisis hematológicos y bioquímicos de sangre, también se realizó un ANOVA bidireccional. Para la comparación de los valores en el mismo grupo en D0 y D14 después del tratamiento, se utilizó la prueba de Sidak post hoc (p < 0,05), mientras que para la comparación de los valores obtenidos para diferentes grupos en el mismo día, se utilizó la prueba de Tukey post hoc (p < 0,05).
3. Resultados
3.1. Análisis químicos
Los análisis químicos revelaron una composición compleja de M. piperita EO con un total de 31 compuestos diferentes, de los cuales se identificaron 27 (Gráfico 1; Tabla 1). Los compuestos pertenecen a diferentes clases químicas, donde predominaron los monoterpenos: alcohol (mentol, 32,6%), cetonas (mentona, 22,0%; isomentona, 9,39%), éster (acetato de mentilo, 10,0%) y éter (eucaliptol, 5,22%) (Gráfico 1).
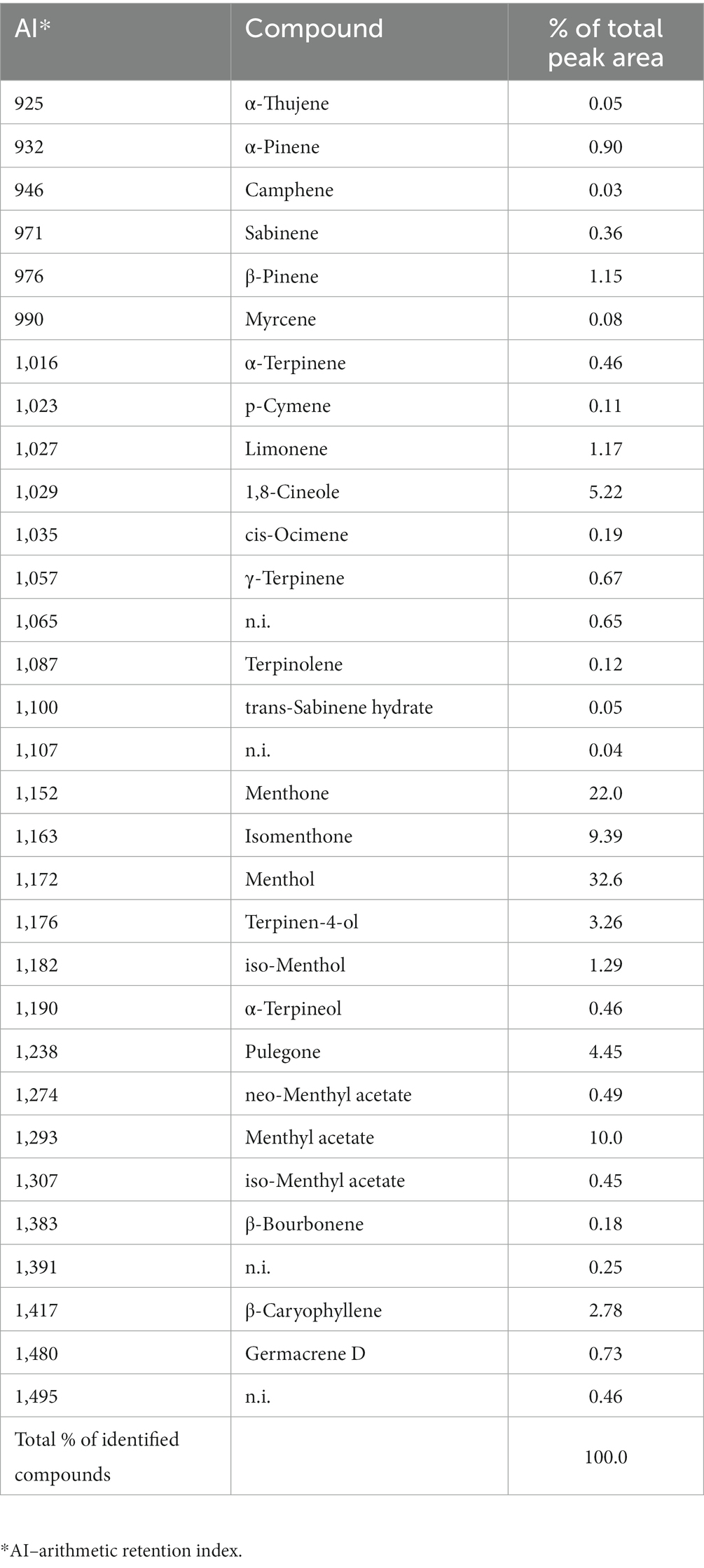 Tabla 1. Composición química (% del área pico total) del aceite esencial de Mentha x piperita L. determinada por cromatografía de gases-espectrometría de masas.
Tabla 1. Composición química (% del área pico total) del aceite esencial de Mentha x piperita L. determinada por cromatografía de gases-espectrometría de masas.
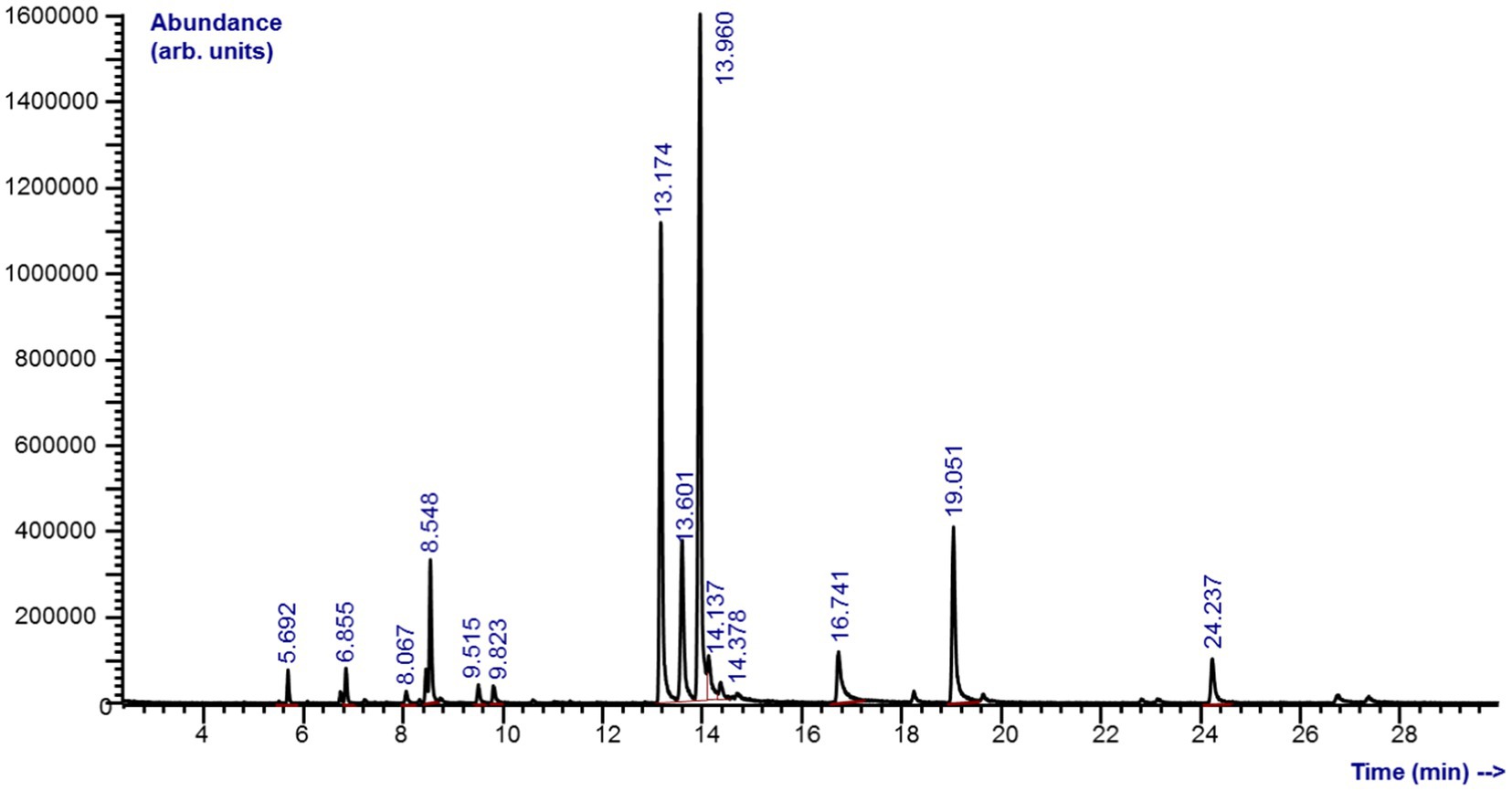 Gráfico 1. Mentha x piperita L. aceite esencial por cromatografía de gases-análisis de espectrometría de masas.
Gráfico 1. Mentha x piperita L. aceite esencial por cromatografía de gases-análisis de espectrometría de masas.
3.2. Ensayo in vitro–ensayo de eclosión de huevos
En el ensayo in vitro, M. piperita EO mostró actividad ovicida con inhibición de la incubabilidad que varió de 20,0 a 90,3% dependiendo de la concentración utilizada (Tabla 2). La concentración más alta mostró actividad similar con tiabendazol en ambas concentraciones probadas (p > 0,05), mientras que todas las concentraciones de EO probadas mostraron una actividad significativamente mayor que los controles negativos (p < 0,05). La R calculada2 fue 0,96, lo que sugiere una actividad dosisdependiente con un CI determinado50 valor de 0,43 mg/ml (Gráfico 2).
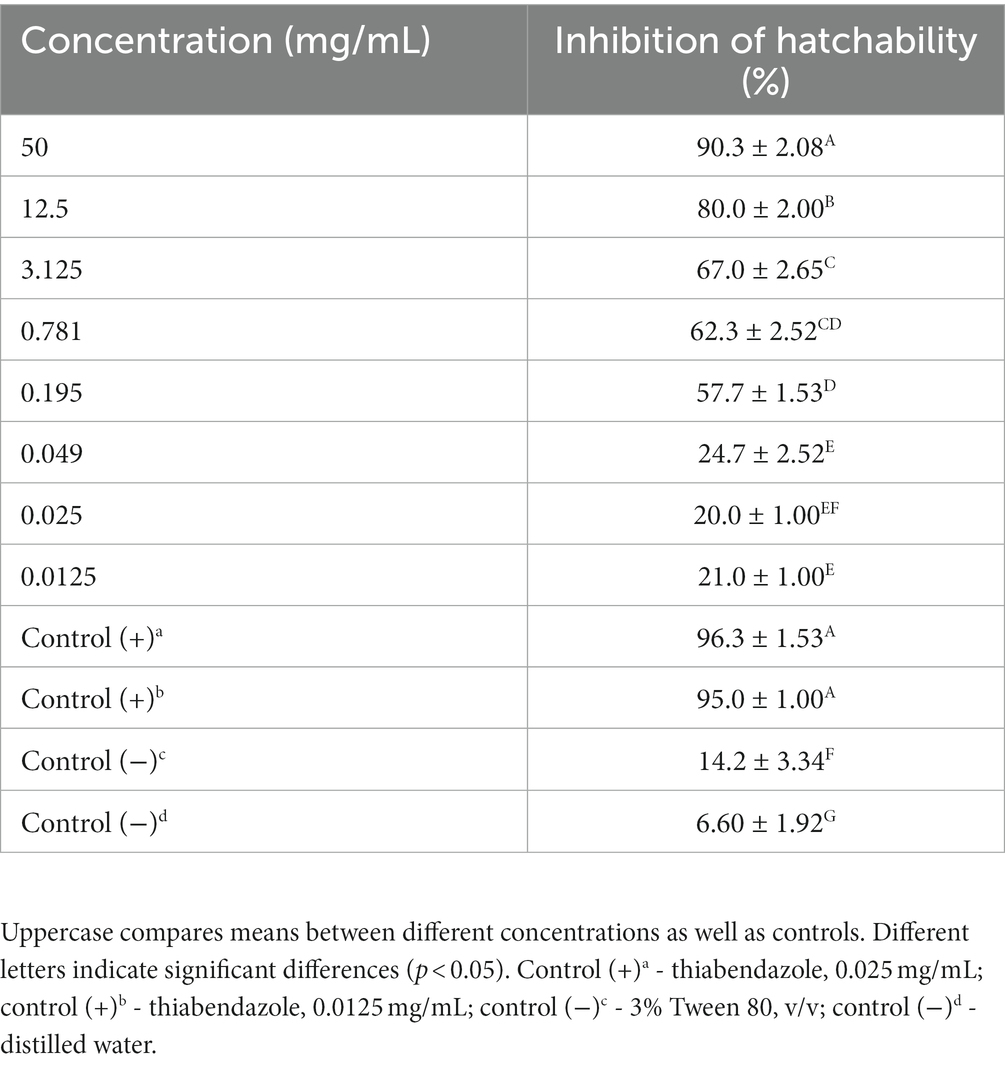 Tabla 2. Actividad ovicida del aceite esencial de Mentha x piperita L. contra huevos de nematodos gastrointestinales (prueba de eclosión de huevos in vitro).
Tabla 2. Actividad ovicida del aceite esencial de Mentha x piperita L. contra huevos de nematodos gastrointestinales (prueba de eclosión de huevos in vitro).
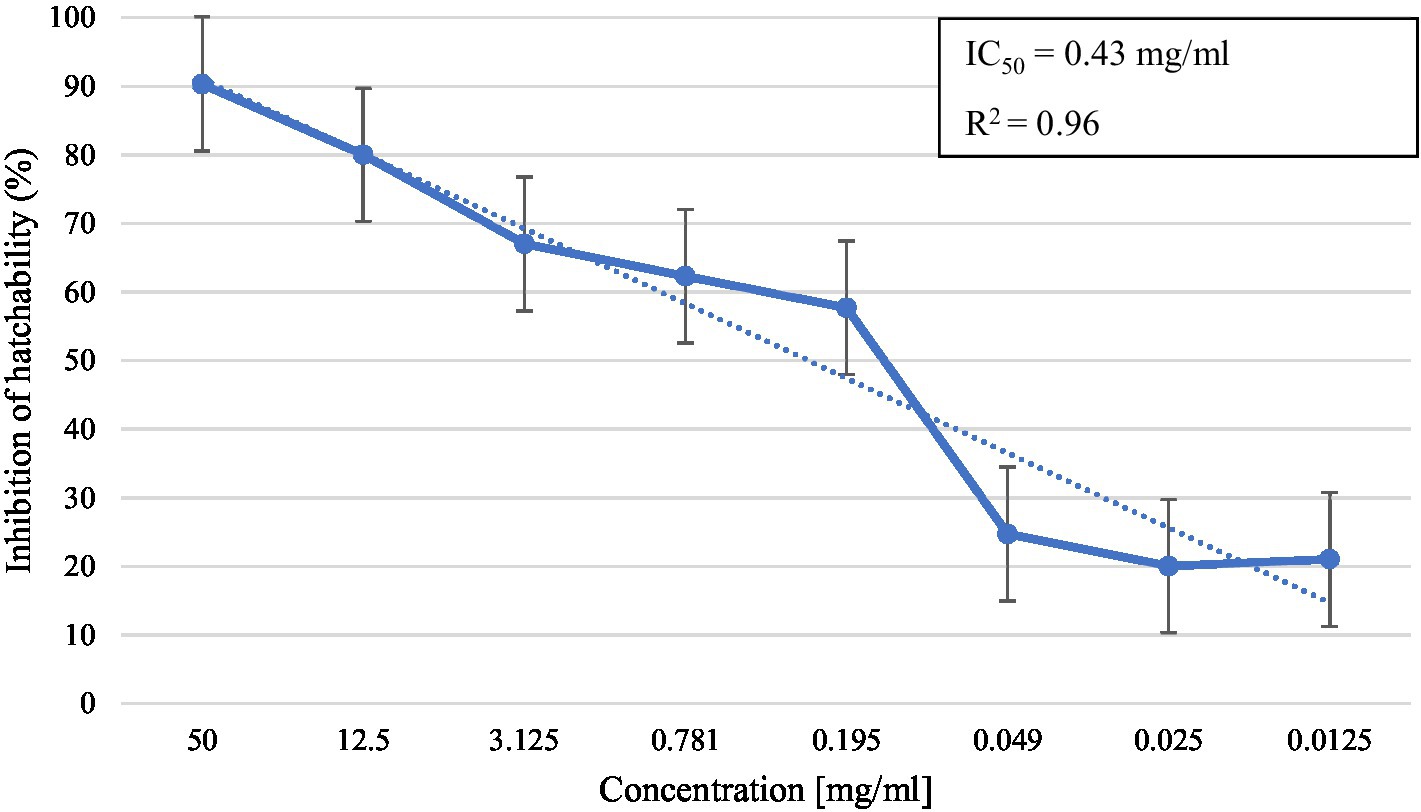 Gráfico 2. Inhibición de la incubabilidad del huevo a diferentes concentraciones de aceite esencial de Mentha x piperita L.
Gráfico 2. Inhibición de la incubabilidad del huevo a diferentes concentraciones de aceite esencial de Mentha x piperita L.
3.3. Prueba in vivo: prueba de reducción del recuento fecal de huevos
Los resultados del ensayo in vivo también mostraron el potencial antihelmíntico de M. piperita EO con una eficacia media del 26,86% (Día 7) y del 46,04% (Día 14) (Tabla 3). El aceite aplicado redujo significativamente el número de EPG en comparación con un valor obtenido antes del tratamiento (p < 0,05) en la granja 2, así como en total. En general, el efecto de la OE fue mejor en la granja 2 (gráfico 3) y alcanzó una eficacia del 33,63 y 63,35% en los días 7 y 14, respectivamente. Sin embargo, los valores de EPG en dos fincas diferentes no fueron significativamente diferentes (p > 0,05) en el grupo de M. piperita, en contraste con los grupos control donde las EPG fueron significativamente mayores en la granja 1 (p < 0,05).
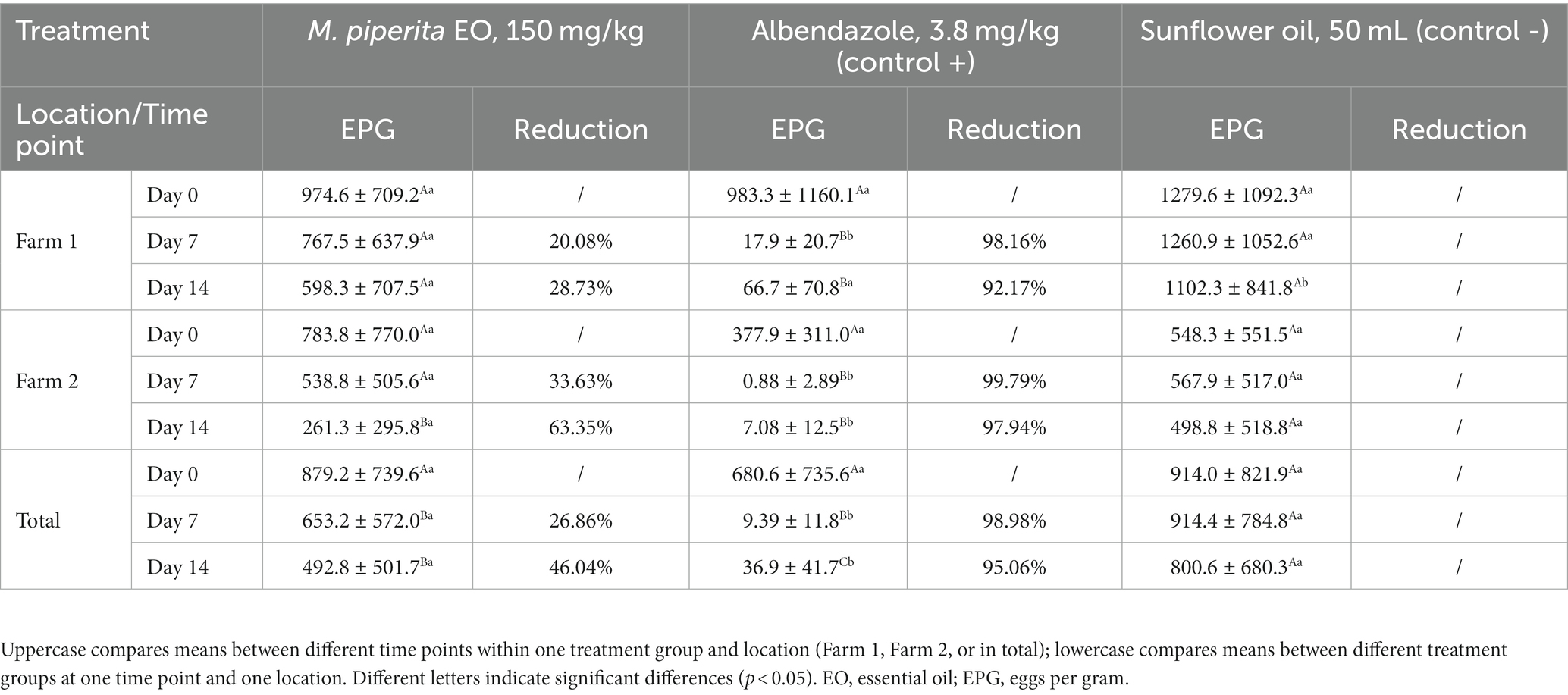 Tabla 3. Valores de huevos por gramo (media ± desviación estándar) y eficacia (%) del aceite esencial de Mentha x piperita L. contra nematodos gastrointestinales de ovejas (prueba de reducción del recuento de huevos fecales in vivo).
Tabla 3. Valores de huevos por gramo (media ± desviación estándar) y eficacia (%) del aceite esencial de Mentha x piperita L. contra nematodos gastrointestinales de ovejas (prueba de reducción del recuento de huevos fecales in vivo).
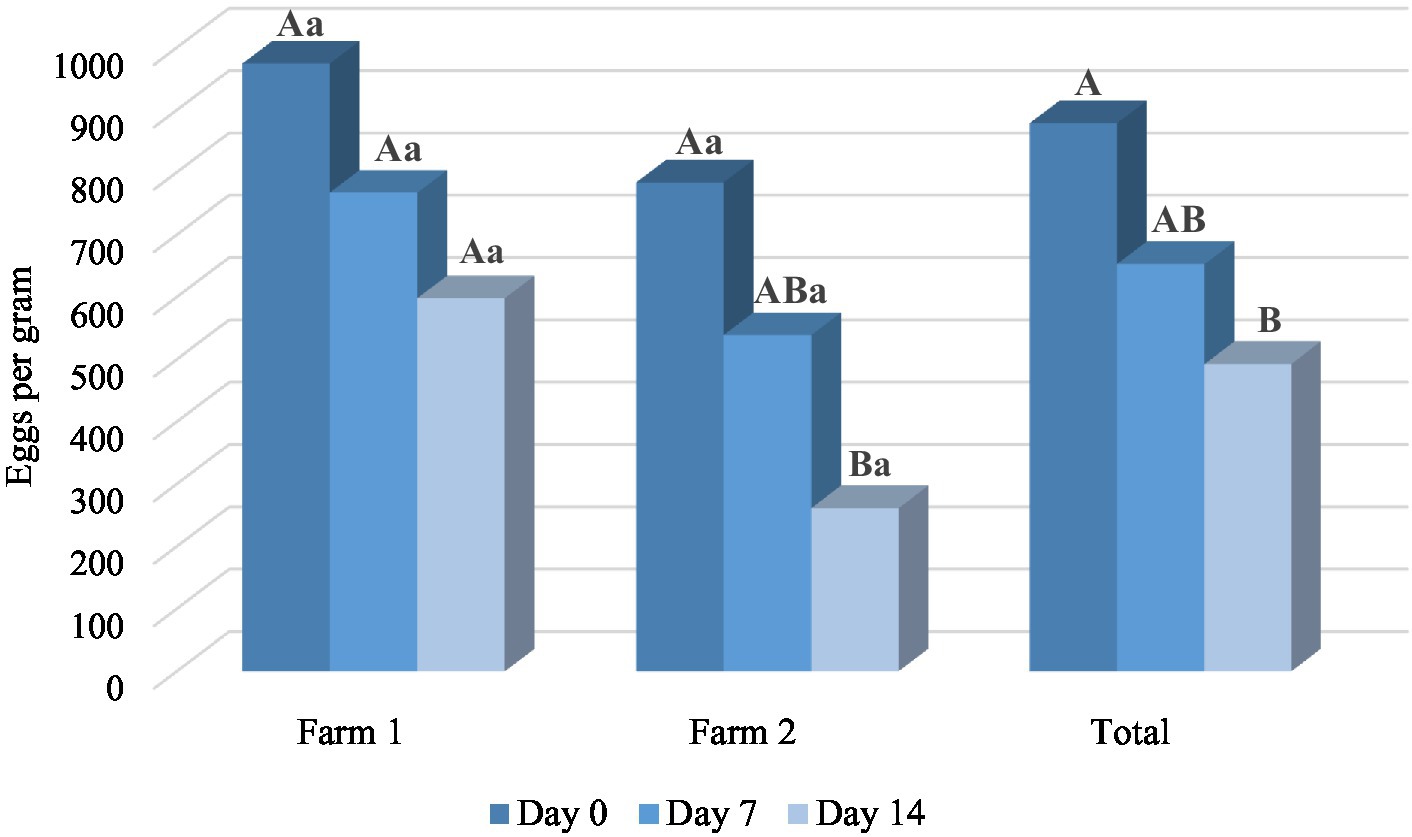 Gráfico 3. El número medio de huevos por gramo en diferentes puntos de tiempo en Mentha x piperita L. grupos de tratamiento de aceites esenciales. Las mayúsculas comparan las medias entre diferentes puntos de tiempo dentro de una ubicación y minúsculas entre dos granjas de servidores en el mismo punto de tiempo. Diferentes letras indican diferencias significativas (p < 0,05).
Gráfico 3. El número medio de huevos por gramo en diferentes puntos de tiempo en Mentha x piperita L. grupos de tratamiento de aceites esenciales. Las mayúsculas comparan las medias entre diferentes puntos de tiempo dentro de una ubicación y minúsculas entre dos granjas de servidores en el mismo punto de tiempo. Diferentes letras indican diferencias significativas (p < 0,05).
3.4. Estudios de toxicidad
No se observaron efectos secundarios durante la observación clínica de los animales probados en los días 7 y 14 después del tratamiento. Del mismo modo, los valores de los parámetros hematológicos no cambiaron significativamente (p > 0,05) después de la administración de OE (Tabla Suplementaria S1). En los análisis bioquímicos de sangre, los valores de urea y creatinina también fueron similares en el día 14 en comparación con el día 0, mientras que las enzimas hepáticas mostraron una actividad significativamente menor después del tratamiento con M. piperita EO y albendazol (Tabla 4).
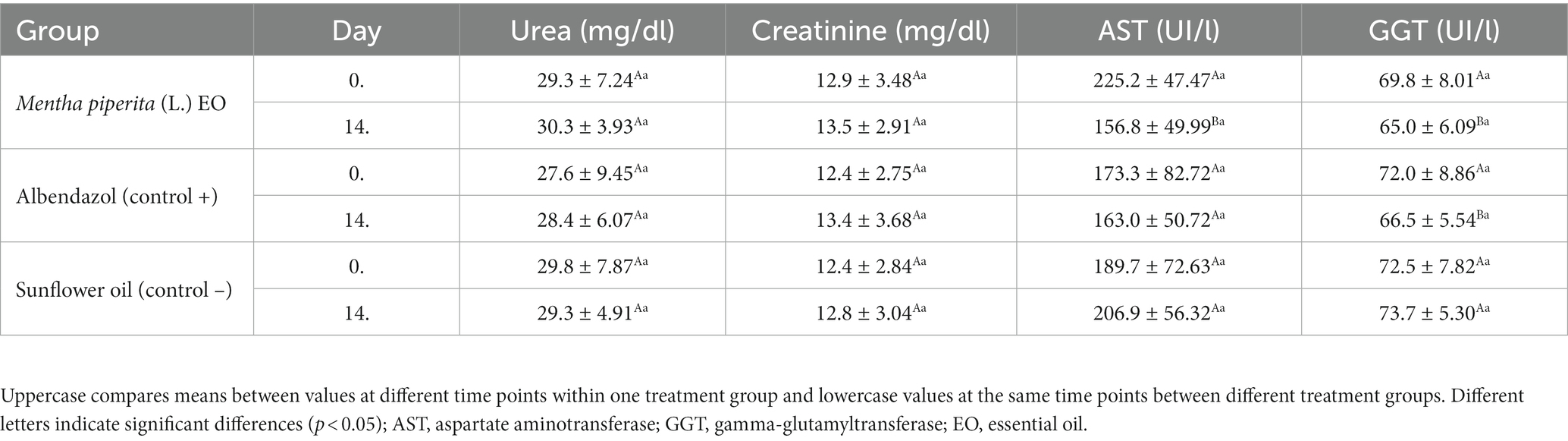 Tabla 4. El efecto del aceite esencial de Mentha x piperita (L.) sobre los parámetros serológicos que evalúan la función renal y hepática en animales tratados, en total de ambas granjas examinadas.
Tabla 4. El efecto del aceite esencial de Mentha x piperita (L.) sobre los parámetros serológicos que evalúan la función renal y hepática en animales tratados, en total de ambas granjas examinadas.
3.5. Coprocultura
Como se muestra en las Tablas 5, 6, se identificaron cuatro géneros de GIN de ovejas en proporciones variables en las dos granjas examinadas: Trichostrongylus, Teladorsagia, Haemonchus y Chabertia. En total, su representación antes del tratamiento fue de 43.67, 39, 11 y 6.33% en la Granja 1 y 44.33, 43.67, 10 y 2% en la Granja 2. Estos porcentajes no cambiaron significativamente después del tratamiento en ninguno de los grupos probados (p > 0,05).
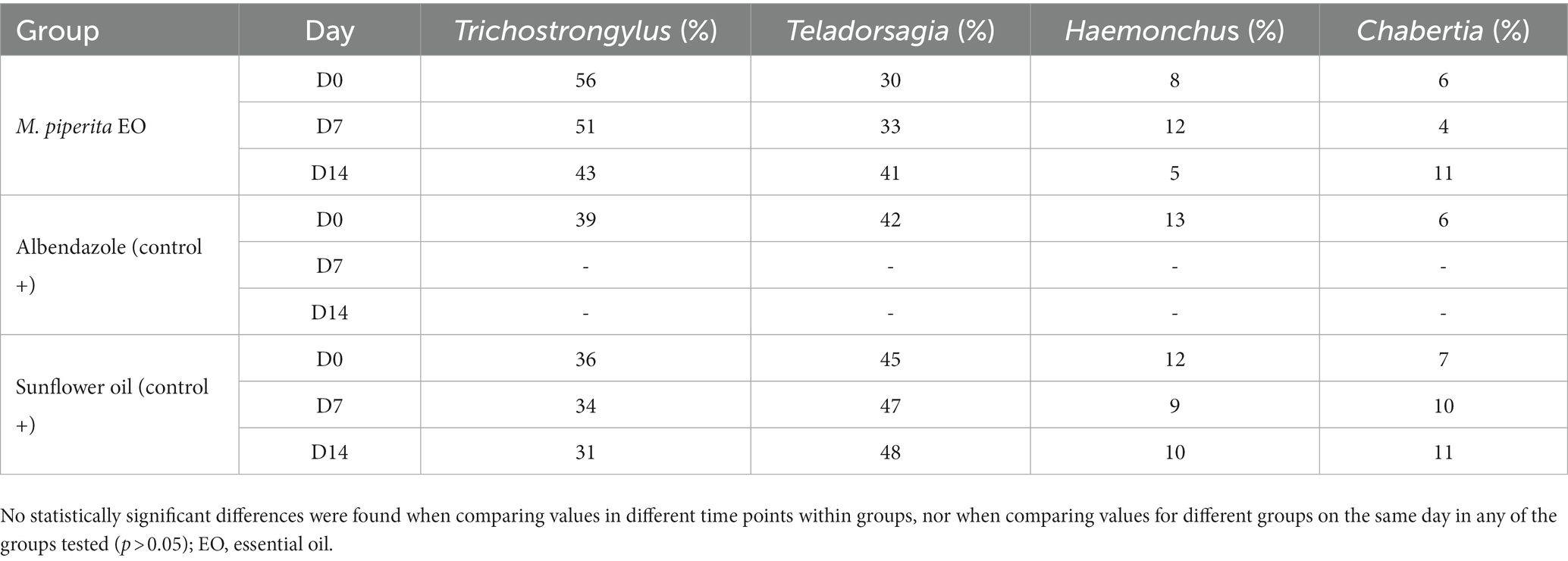 Tabla 5. Porcentaje de larvas de nematodos ovinos en tercera etapa (L3) para cada grupo de tratamiento en D0, D7 y D14–Granja 1.
Tabla 5. Porcentaje de larvas de nematodos ovinos en tercera etapa (L3) para cada grupo de tratamiento en D0, D7 y D14–Granja 1.
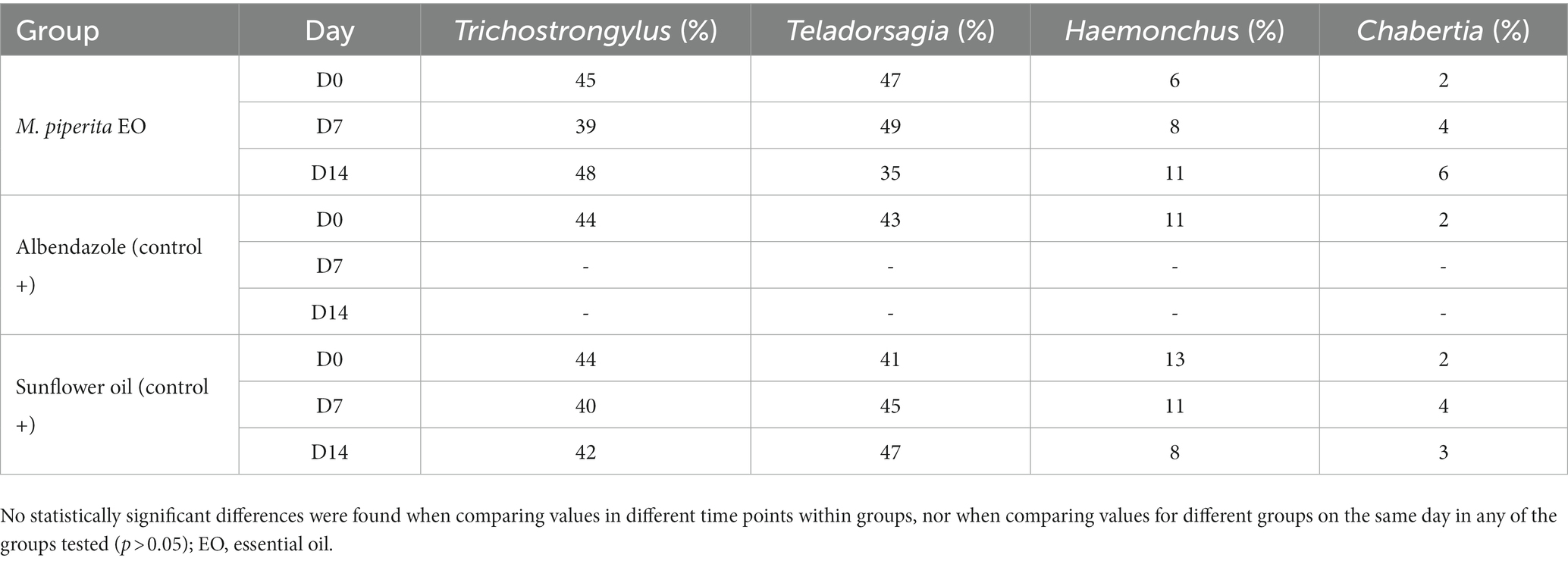 Tabla 6. Porcentaje de larvas de nematodos ovinos en tercera etapa (L3) para cada grupo de tratamiento en D0, D7 y D14–Granja 2.
Tabla 6. Porcentaje de larvas de nematodos ovinos en tercera etapa (L3) para cada grupo de tratamiento en D0, D7 y D14–Granja 2.
4. Discusión
El problema urgente asociado con el desarrollo y la propagación de AR en GIN de ovejas requiere la búsqueda activa de estrategias alternativas, por lo que los antihelmínticos botánicos se consideran una de las opciones más prometedoras (50). Sin embargo, encontrar la formulación vegetal más adecuada entre el gran número de especies, tanto desde el punto de vista de la eficacia y la seguridad, como desde el punto de vista del precio, es una tarea difícil. Por lo tanto, las OE y los extractos de un gran número de plantas se han probado hasta ahora en la eficacia contra los GIN de oveja, como se discutió anteriormente (32, 33). Como se puede observar, la mayoría de estos estudios se refieren a pruebas in vitro. Aunque estas pruebas son apropiadas para la evaluación inicial del potencial antihelmíntico debido a su velocidad, reproducibilidad, fácil aplicación, ausencia de animales y precio (48), las pruebas in vivo y la evaluación de la seguridad también son partes cruciales del proceso de desarrollo de un nuevo fármaco antihelmíntico y son necesarias antes de que la formulación se introduzca en la práctica (51). La elección de los ensayos también es importante, ya que el EHT y el FECRT se recomiendan debido a su precisión y fiabilidad. De hecho, estas pruebas son las más utilizadas para tales estudios (23, 52).
Teniendo en cuenta el número de estudios realizados hasta el momento y sus resultados, la OE de M. piperita puede considerarse uno de los candidatos potenciales para el desarrollo de un nuevo agente antihelmíntico. Así, en un estudio de Katiki et al. (37), mostró actividad significativa contra Haemonchus contortus en el EHT con un CI obtenido50 valor de 0,26 mg/ml. Junto con la actividad ovicida, la OE también mostró un efecto sobre el desarrollo larvario y la alimentación con CI50 valores de 0,26 y 0,07 mg/ml, respectivamente. A continuación, un estudio de Chagas et al. (38) ha demostrado ovicida moderada (CI50 = 1,44 mg/ml) pero larvicida alto (CI50 = 0,10 mg/mL) actividad de la OE antes mencionada, también contra H. contortus. En nuestro último estudio (39), M. piperita EO mostró una fuerte dosis-dependiente (R2 = 0,98) actividad contra una mezcla de géneros GIN de ovejas (Hemonchus, Trichostrongylus, Teladorsagia, y Chabertia) con una inhibición de la incubabilidad de huevos que varía de 72,5 a 99,8% (IC50 = 0,28 mg/ml) en el rango de concentración de 0,049–50 mg/ml. Desde esa perspectiva, los resultados del EHT en el presente estudio mostraron un menor efecto ovicida de M. piperita EO, lo que puede atribuirse al uso de diferentes muestras de EO en comparación con ese estudio. Además, en el presente estudio, utilizamos un método diferente para obtener las concentraciones (método de dilución en comparación con micropipetas en el último estudio).
En el FECRT, la formulación ensayada (EO diluido en aceite de girasol) exhibió una actividad antihelmíntica del 46,04% en total el día 14 a la dosis probada de 150 mg/kg (Tabla 3). Al igual que en nuestro estudio realizado con orégano EO (41), la eficacia fue mejor en la Granja 2 en comparación con la Granja 1 (63,35 y 28,73%, respectivamente, en D14) (Gráfico 3), lo que puede explicarse por las diferencias en la cría de animales. Es decir, en la segunda granja, las ovejas se mantuvieron en cajas durante el tratamiento, lo que facilitó la manipulación de los animales y la aplicación de formulaciones. En contraste, en la primera granja, las ovejas se mantuvieron completamente en libertad. Otros factores, como las diferencias en la alimentación (debido a las diferencias en la cría de animales) y, en consecuencia, la composición y el volumen del contenido ruminal, también pueden afectar los resultados. Por otro lado, el albendazol mostró un alto efecto (>95%) en ambas granjas en los días 7 y 14, lo que indica que no se desarrolló resistencia a los antihelmínticos en las granjas probadas. La menor eficacia de la muestra analizada en comparación con el control positivo puede explicarse por las interacciones de fitoquímicos a lo largo del tracto gastrointestinal y, por lo tanto, su inactivación parcial y su biodisponibilidad limitada consecutiva (29). A continuación, los altos valores de desviación estándar de EPG en ambas granjas en todos los grupos de tratamiento sugieren una gran variación en el grado de carga parasitaria de los animales individuales. Esta suele ser una característica de los GIN, donde el mayor número de parásitos se acumula en un número menor de animales en cierto rebaño (3). Por otro lado, esto sugiere la importancia de las estrategias de TST durante los tratamientos (19-21).
De acuerdo con los análisis GC-MS, el mentol y la mentona fueron los principales responsables del efecto antihelmíntico mostrado, ya que sus representaciones porcentuales fueron de 32,6 y 22,0%, respectivamente. De hecho, estos dos compuestos se consideran los más importantes para diversas propiedades farmacológicas de M. piperita EO y su amplio uso (35). Sin embargo, el mentol puro no logró reducir la EPG de H. contortus durante las pruebas in vivo. En contraste, toda la OE de M. arvensis, cuyo componente principal fue el mentol (86,7%), mostró una eficacia de aproximadamente el 50% en los días 1, 14 y 21 (38). En otros estudios similares, los OE completos también fueron generalmente más efectivos que sus componentes principales aislados, como se muestra para Croton Zehtneri – anetol (53) y Thymus vulgaris-timol (54). Esto sugiere la importancia de todos los compuestos de EO para su actividad, potencialmente debido a su efecto sinérgico. La ausencia de un efecto del mentol puro en la investigación mencionada se explica por su limitada biodisponibilidad y por el hecho de que el mentol se excreta en forma de glucurónidos a través de la orina (38).
En comparación con la composición de M. piperita EO en nuestro estudio previo (39), se pueden observar diferencias en los compuestos presentes y sus porcentajes. Es decir, los principales compuestos de esa muestra fueron piperiota (25,4%) y trans-dihidrocarvona (14,6%). En otros estudios mencionados, la composición química de M. piperita EO corresponde más a la muestra del presente estudio. Así, el mentol (42,5%) seguido de la mentona (27,4%) fueron los principales compuestos de la muestra en un estudio de Katiki et al. (37), y el mentol (30,5%) también fue el compuesto principal de la muestra en un estudio de Chagas et al. (38). Esto sugiere que la composición de la OE puede variar considerablemente, incluso entre las obtenidas de la misma especie vegetal. Desde ese aspecto, pueden estar involucrados diversos factores como la edad y parte de la planta, el origen geográfico, la precipitación, la luz y las propiedades del suelo que se refieren al pH, la estructura y la salinidad, así como la presencia de diversos organismos y microorganismos en un entorno vegetal. Además, los métodos utilizados para la extracción de aceites, los productores de los que se obtienen los aceites y la forma en que se almacenaron antes de su uso también pueden afectar la composición química (55, 56). En consecuencia, estos factores también pueden conducir a diferencias menores o mayores en la eficacia, como se puede observar si se comparan los resultados de los estudios mencionados, incluido el presente. La pregunta que se plantea es hasta qué punto estas variaciones pueden obstaculizar el desarrollo de la preparación comercial, y si las formas de estandarizar la composición de ciertas OE deberían ser un tema de estudios adicionales.
A pesar de su creciente popularidad, uno de los principales problemas asociados con el uso más amplio de OE en la práctica parece ser la falta de estudios de toxicidad (33). Los posibles efectos tóxicos y secundarios de los OE y sus componentes generalmente se prueban en animales de experimentación como roedores, mientras que las pruebas de toxicidad aguda realizadas hasta ahora en ratas mostraron que la mayoría de los OE tienen una LD50 de 1 a 20 g/kg, lo que indica su baja toxicidad (57). Sin embargo, rara vez se realizan estudios que evalúan los efectos sobre el huésped. En el presente estudio, los resultados de las pruebas preliminares de toxicidad mostraron la ausencia de efectos secundarios y tóxicos de M. piperita EO en ovejas, es decir, su comportamiento, parámetros hematológicos, así como funciones renales y hepáticas. Esto sugiere la seguridad del uso de la formulación aplicada en ovejas, al menos cuando se trata de efectos a corto plazo. Los mismos resultados se obtuvieron para la OE de hierba limón (Cymbopogon schoenanthus L.) aplicada a ovejas (180 y 360 mg/kg, p.o.), y para la combinación encapsulada de anetol y carvona aplicada a corderos (20 y 50 mg/kg, p.o.), con la ausencia de efectos tóxicos sobre el comportamiento animal, así como las funciones hepáticas y renales, sugiriendo su seguridad (58, 59).
En un estudio de Chagas et al. (38), no se observaron síntomas de toxicidad en ovejas tratadas con M. arvensis EO. Esto y los resultados del presente estudio pueden considerarse esperados, ya que el compuesto principal de estos dos OE, el mentol, tiene una toxicidad oral aguda muy baja (LD50 > 2000 mg/kg p.v.) y, por lo tanto, es generalmente reconocido como seguro por la FDA (Administración de Alimentos y Medicamentos de los Estados Unidos). Además, la FDA ha aprobado el uso de mentol en los alimentos (38, 60). Según el informe de evaluación de Mentha x piperita L., folium y aetheroleum (61) pueden utilizarse con seguridad en humanos a las dosis recomendadas (oral, cutánea e inhalación) para el tratamiento de diversos trastornos gastrointestinales o el alivio sintomático de dolores de cabeza leves de tipo tensional. Sin embargo, aunque las especies de Mentha se consideran seguras, se debe prestar especial atención al contenido de pulegona y mentofurano en la formulación debido a su hepatotoxicidad reportada (62, 63). Así, según la Declaración pública sobre el uso de medicamentos a base de plantas que contienen pulegona y mentofurano (64), la ingesta de su combinación en 37,5 mg/persona/día en seres humanos se considera aceptable para los medicamentos a base de plantas, que se establece como límite para una exposición a lo largo de toda la vida. Dichos estudios deben facilitarse para los animales, incluidas las ovejas.
Los resultados del examen de coprocultivo mostraron la presencia de cuatro géneros de GIN antes del tratamiento en las granjas analizadas: Trichostrongylus (44%), Teladorsagia (41,33%), Haemonchus (10,5%) y Chabertia (4,17%). Dado que su representación porcentual no cambió significativamente (p > 0,05) después del tratamiento, se puede concluir que el tratamiento con M. piperita EO no es específico para un solo género. Sin embargo, los resultados de algunos otros estudios mostraron una mayor actividad de AE contra H. contortus en comparación con Trichostrongylus spp. después de la administración oral de las formulaciones (65-67), lo que sugiere que puede haber diferencias en la sensibilidad de los OE dentro de los géneros GIN (por ejemplo, debido a su posición en el tracto gastrointestinal). De todos modos, el mecanismo de actividad nematicida de los compuestos de M. piperita EO aún no está completamente dilucidado. En un estudio de Choudhary et al. (68), se demostró que el mentol potencia las respuestas de acetilcolina y levamisol en el receptor sensible al levamisol pero no a la nicotina. El mismo estudio también mostró que el mentol puede potenciar significativamente la contracción de las tiras de músculo somático Ascaris suum en cada concentración de acetilcolina. Un estudio de Khan et al. (69) mostró que el metanol y el extracto de M. arvensis causan un alto efecto apoptótico en los músculos, las gónadas y el útero (huevos) del nematodo de vida libre Caenorhabditis elegans, que se utilizó como organismo modelo. Los resultados también mostraron que los genes de estrés (gst-4 y hsp-16.2) estaban altamente expresados en los nematodos afectados en comparación con C. elegans normales.
Aunque el aceite aplicado redujo significativamente el número de EPG después del tratamiento, siendo la eficacia in vivo alcanzada una de las más altas obtenidas para EO contra GIN (32, 33), sigue siendo insuficiente para su uso independiente. Sin embargo, los estudios realizados hasta ahora mostraron que ninguno de los posibles métodos de control antes mencionados parece ser sostenible cuando se aplica solo (6). Por lo tanto, como se discutió anteriormente, generalmente se acepta que una combinación de diferentes estrategias en forma de manejo integrado de parásitos es la única solución sostenible para el control de parásitos a largo plazo (6, 16-19, 70). Un ejemplo son los resultados obtenidos en un estudio mencionado por Choudhary et al. (68), donde se probaron las propiedades moduladoras alostéricas positivas del mentol, que podrían usarse en terapia combinada con antihelmínticos colinérgicos.
De todo lo anterior, los resultados obtenidos en el presente estudio sugieren que M. piperita EO puede desempeñar un papel valioso en un enfoque integrado para el control de parásitos. En general, el uso de antihelmínticos botánicos ofrece muchas ventajas, como su rica composición química con una gran cantidad de compuestos pertenecientes a diferentes grupos químicos (menor susceptibilidad al desarrollo de resistencia), su origen natural (menor cantidad de residuos en los productos animales y el medio ambiente), precio adecuado, etc. (13, 14, 48, 50). Además, la eficacia in vivo de M. piperita EO podría mejorarse aún más con el uso de una técnica de encapsulación que pueda proteger sus ingredientes activos de la degradación y, por lo tanto, permitir su mayor biodisponibilidad (71, 72). Por otro lado, también se pueden lograr mejores resultados aumentando la dosis o utilizando múltiples aplicaciones durante varios días consecutivos en lugar de una sola administración, aunque el uso de una dosis más alta o administración múltiple también debe evaluarse desde el punto de vista tóxico. La eficacia también puede mejorarse, así como controlar la liberación habilitada por otras formas de aplicación, como los bloques de lamido que contienen compuestos de origen vegetal, y pueden proporcionar un uso a largo plazo (73).
5. Conclusión
El desarrollo y la propagación de la resistencia a los antihelmínticos en los nematodos requieren una búsqueda urgente de alternativas. Los resultados del presente estudio sugieren que M. piperita EO es adecuado para su uso contra GIN en ovejas en base a las pruebas de eficacia y toxicidad preliminares realizadas. Por lo tanto, en combinación con otras estrategias (uso racional de antihelmínticos u otras alternativas), la formulación probada podría desempeñar un papel valioso en un control integrado y respetuoso con el medio ambiente de estos parásitos. Se deben realizar estudios adicionales para confirmar la seguridad después del uso a largo plazo del aceite de menta en la práctica para lograr una eficacia aún mayor en los ensayos de campo, así como para probar su eficacia contra GIN resistentes a los medicamentos comerciales.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / Material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
El estudio se realizó de acuerdo con las directrices de la Declaración de Helsinki y fue aprobado por el Comité de Ética de la Universidad de Nápoles (PG/2021/0130480, 16 de diciembre de 2021). Los estudios se realizaron de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
FŠ: conceptualización, metodología, análisis formal, investigación, curación de datos y redacción de borradores originales. SK: conceptualización, recursos y revisión y edición de la escritura. DS: conceptualización, validación y supervisión. RR: conceptualización, metodología y recursos. NS: investigación, recursos y revisión y edición de escritos. DO: investigación y recursos. LR: metodología, validación, revisión y edición de redacción, y supervisión. CE: metodología e investigación. MM: metodología y validación. GC: validación y supervisión. AB: conceptualización, metodología, investigación, curación de datos y revisión y edición de escritos. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Esta investigación fue cofundada por el Ministerio de Educación, Ciencia y Desarrollo Tecnológico de la República de Serbia, rescripto No. 451-03-1183/2021-14.
Reconocimientos
Agradecemos profundamente a Mario Parrilla de CREMOPAR, Eboli (SA), Italia, por el apoyo técnico en el laboratorio, así como a Katarina Hočevar del Instituto de Investigación Biológica, Siniša Stanković, Universidad de Belgrado, Serbia, por el apoyo técnico durante la producción del manuscrito.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1232570/full#supplementary-material
Referencias
1. Wang, T , Redman, EM , Morosetti, A , Chen, R , Kulle, S , Morden, N, et al. Epidemiología estacional de nematodos gastrointestinales del ganado en la zona climática continental del norte del oeste de Canadá según lo revelado por el código de barras interno transcrito del nemabioma del ADN ribosómico del espaciador-2. Vectores parásitos. (2021) 14:604. DOI: 10.1186/S13071-021-05101-W
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Abebe, T , Yobsan, T , y Debela, A . Prevalencia de nematodos gastrointestinales mayores y grado de infestación de parásitos en ovejas del proyecto del programa de cría basado en la comunidad del centro de investigación agrícola de Bako, en granjas de pequeños propietarios en el distrito de Horro. Veterinario Lácteo Sci J. (2018) 8:555740. doi: 10.19080/JDVS.2018.08.555740
3. Bosco, A , Kießler, J , Amadesi, A , Varady, M , Hinney, B , Ianniello, D, et al. La amenaza de una eficacia reducida de los antihelmínticos contra los nematodos gastrointestinales en ovejas de un área considerada libre de resistencia a los antihelmínticos. Vectores parásitos. (2020) 13:457. DOI: 10.1186/S13071-020-04329-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Castagna, F , Bava, R , Musolino, V , Piras, C , Cardamone, A , Carresi, C, et al. Posibles nuevos enfoques terapéuticos basados en frutos de Punica granatum comparados con antihelmínticos sintéticos para el control sostenible de nematodos gastrointestinales en ovinos. Animales. (2022) 12:2883. DOI: 10.3390/ANI12202883
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Beleckė, A , Kupčinskas, T , Stadalienė, I , Höglund, J , Thamsborg, SM , y Stuen, S . Resistencia a los antihelmínticos en pequeños rumiantes de la región nórdico-báltica. Acta Vet Scand. (2021) 63:18. DOI: 10.1186/S13028-021-00583-1
6. Szewc, M , De Waal, T , y Zintl, A . Métodos biológicos para el control de nematodos gastrointestinales. Veterinario J. (2021) 268:105602. doi: 10.1016/j.tvjl.2020.105602
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Kaplan, RM . Biología, epidemiología, diagnóstico y manejo de la resistencia antihelmíntica en nematodos gastrointestinales del ganado. Veterinario Clin N am Food Anim Pract. (2020) 36:17–30. doi: 10.1016/j.cvfa.2019.12.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Kaplan, RM , Denwood, MJ , Nielsen, MK , Thamsborg, SM , Torgerson, PR , Gilleard, JS, et al. World Association for the Advancement of veterinary parasitology (W.a.a.V.P.) guideline for diagnosting antihelmintic resistance using the fecal egg count reduction test in rumiants, horses and swine. Veterinario Parasitol. (2023) 318:109936. doi: 10.1016/j.vetpar.2023.109936
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Vinner, RRHH , Morgan, ER , Hertzberg, H , Bartley, DJ , Bosco, A , Charlier, J, et al. Creciente importancia de la resistencia a los antihelmínticos en la ganadería europea: creación y metaanálisis de una base de datos abierta. Parásito. (2020) 27:69. DOI: 10.5167/UZH-193329
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Fissiha, W , y Kinde, MZ . Resistencia antihelmíntica y su mecanismo: una revisión. Infectar la resistencia a la droga. (2021) 14:5403–10. doi: 10.2147/IDR. S332378
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Mederos, AE , Ramos, Z , y Banchero, GE . Primer reporte de resistencia de monepantel Haemonchus contortus en granjas ovinas en Uruguay. Vectores parásitos. (2014) 7:598. doi: 10.1186/PREACCEPT-1982759817140038
14. Prakash, P , Kumar, M , Pundir, A , Puri, S , Prakash, S , Kumari, N, et al. Documentación de medicamentos etnoveterinarios de uso común de plantas silvestres de las altas montañas en el distrito de Shimla, Himachal Pradesh. India Horticulturae. (2021) 7:351. doi: 10.3390/horticulturae7100351
15. Werne, S , Isensee, A , Maurer, V , Perler, E , Drewek, A , y Heckendorn, F . Control integrado de nematodos gastrointestinales en corderos utilizando un enfoque bioactivo de piensos × raza. Veterinario Parasitol. (2013) 198:298–304. doi: 10.1016/j.vetpar.2013.09.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Maqbool, I , Wani, ZA , Shahardar, RA , Allaie, IM , y Shah, MM . Manejo integrado de parásitos con especial referencia a los nematodos gastrointestinales. J Parásito Dis. (2017) 41:1–8. DOI: 10.1007/S12639-016-0765-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Velde, FW , Charlier, J , y Claerebout, E . Comportamiento del agricultor y nematodos gastrointestinales en ganado rumiante: adopción de enfoques de control sostenibles. Front Vet Sci. (2018) 5:255. DOI: 10.3389/fvets.2018.00255
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Bricarello, PA , Longo, C , da Rocha, RA , y Hötzel, MJ . Comprender las interacciones animal-planta-parásito para mejorar el manejo de los nematodos gastrointestinales en rumiantes de pastoreo. Pahogens. (2023) 12:531. doi: 10.3390/patógenos12040531
19. Maurizio, A , Perrucci, S , Tamponi, C , Scala, A , Cassini, R , Rinaldi, L, et al. Control de helmintos gastrointestinales en pequeños rumiantes para prevenir la resistencia a los antihelmínticos: la experiencia italiana. Parasitología. (2023) 2023:1–14. doi: 10.1017/S0031182023000343
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Hodgkinson, J , Kaplan, RM , Kenyon, F , Morgan, ER , Parque, AW , Paterson, S, et al. Refugios y resistencias antihelmínticas: conceptos y desafíos. Int J Parasitol Drugs Drug Resist. (2019) 10:51–7. doi: 10.1016/j.ijpddr.2019.05.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Calvete, C , González, JM , Ferrer, LM , Ramos, JL , Lacasta, D , Delgado, I, et al. Evaluación de criterios de tratamiento selectivo dirigido para controlar las infecciones subclínicas por nematodos gastrointestinales en explotaciones ovinas. Veterinario Parasitol. (2020) 277:109018. doi: 10.1016/j.vetpar.2019.109018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Pinto, NB , de Castro, LM , Azambuja, RHM , Capella, GDA , de Moura, MQ , Terto, WD, et al. Potencial ovicida y larvicida de Rosmarinus officinalis para controlar nematodos gastrointestinales de ovejas. Rev Bras Parasitol Vet. (2019) 28:807–11. doi: 10.1590/S1984-29612019060
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Castagna, F , Piras, C , Palma, E , Musolino, V , Lupia, C , Bosco, A, et al. Farmacología veterinaria verde aplicada al control de parásitos: evaluación de Punica granatum, Artemisia campestris, Macerados acuosos de Salix caprea contra nematodos gastrointestinales de ovejas. Veterinario Sci. (2021) 8:237. DOI: 10.3390/VETSci8100237
24. Teoh, ES . Metabolitos secundarios de plantas. Med Orquídeas Asia. (2015) 5:59–73. DOI: 10.1007/978-3-319-24274-3_5
25. Štrbac, F , Krnjajić, S , Stojanović, D , Novakov, N , Bosco, A , y Simin, N . Control botánico de parásitos en medicina veterinaria En: LA Marcelino, RZ Abbas, A Khan, M Younus, y NM Saeed, editores. Una tríada de salud, vol. 3. Faisalabad, Pakistán: Editores científicos únicos (2023). 215–22.
26. Castagna, F , Palma, E , Cringoli, G , Bosco, A , Nisticò, N , y Caligiuri, G . Uso de piensos naturales complementarios para el control de nematodos gastrointestinales en ovejas: eficacia y beneficios para los animales. Animales. (2019) 9:1037. DOI: 10.3390/ANI9121037
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Bhatti, MZ , Ismail, H , y Kayani, WK . Metabolitos secundarios de plantas: potencial terapéutico y propiedades farmacológicas En: R Vijayakumar y SSS Raja, editores. Metabolitos secundarios. Reino Unido: Intechopen (2022)
28. Mutinelli, F . Medicamentos veterinarios para controlar Varroa destructor en colonias de abejas melíferas (Apis mellifera) y legislación conexa de la UE: actualización. J Apic Res. (2016) 55:78–8. doi: 10.1080/00218839.2016.1172694
29. Mucha, W , y Witkowska, D . La aplicabilidad de los aceites esenciales en diferentes etapas de producción de alimentos de origen animal. Moléculas. (2021) 26:3798. doi: 10.3390/moléculas26133798
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Štrbac, F , Petrović, K , Stojanović, D , y Ratajac, R . Posibilidades y limitaciones del uso de aceites esenciales en perros y gatos. Veterinario J Rep Srp. (2021) 21:238–65. doi: 10.7251/VETJEN2101238S31
31. Bava, R , Castagna, F , Palma, E , Musolino, V , Carresi, C , Cardamone, A, et al. Perfil fitoquímico de aceites esenciales de Foeniculum vulgare subsp. piperitum y evaluación de la eficacia acaricida frente a Varroa destructor en Apis mellifera mediante ensayos de fumigación in vitro y semicampo. Veterinario Sci. (2022) 9:684. doi: 10.3390/vetsci9120684
32. André, WPP , Ribeiro, WLC , de Oliveira, LMB , Macedo, ITF , Rondón, FCR , y Bevilaqua, CML . Aceites esenciales y sus compuestos bioactivos en el control de nematodos gastrointestinales de pequeños rumiantes. Acta Sci Vet. (2018) 46:14. doi: 10.22456/1679-9216.81804
33. Štrbac, F , Bosco, A , Pušić, I , Stojanović, D , Simin, N , Cringoli, G, et al. El uso de aceites esenciales contra los nematodos gastrointestinales de las ovejas en: RZ Abbas, A Khan, P Liu y MK Saleemi, editores. Perspectivas de la salud animal. Volumen I. Faisalabad, Pakistán: Editores científicos únicos (2022). 86–94.
34. Shabih, S , Hajdari, A , Mustafa, B , y Quave, QL . Plantas medicinales en los Balcanes con propiedades antimicrobianas En: F Chassagne editor. Plantas medicinales como antiinfecciosos. Estados Unidos: Academic Press (2022). 103–38.
35. Zaia, MG , Cagnazzo, TDO , Feitosa, KA , Soares, EG , Faccioli, LH , y Allegretti, SM . Propiedades antiinflamatorias del mentol y mentona en la infección por Schistosoma mansoni. Frente Pharmacol. (2016) 7:170. DOI: 10.3389/FPHAR.2016.00170
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Ostadi, A , Javanmard, A , Machiani, MA , Morshedloo, MR , Nouraein, M , Rasouli, F, et al. Efecto de diferentes fuentes de fertilizantes y tiempo de cosecha en las características de crecimiento, absorción de nutrientes, productividad de aceites esenciales y composición de Mentha x piperita L. Ind Crop Prod. (2020) 148:112290. doi: 10.1016/j.indcrop.2020.112290
37. Katiki, LM , Bizzo, RRHH , Ferreira, JFS , y Amarantee, AFT . Actividad antihelmíntica de los aceites esenciales Cymbopogon martinii, Cymbopogon schoenanthus y Mentha piperita evaluada en cuatro pruebas in vitro diferentes. Veterinario Parasitol. (2011) 183:103–8. doi: 10.1016/j.vetpar.2011.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Chagas, ACC , Figueiredo, A , Politi, FAS , Moro, IJ , Esteves, SN , Bizzo, HR, et al. Eficacia de los aceites esenciales de plantas cultivadas en el bioma amazónico contra nematodos gastrointestinales en ovejas. J Parásito Dis. (2018) 42:357–64. DOI: 10.1007/S12639-018-1007-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Štrbac, F , Bosco, A , Maurelli, diputado , Ratajac, R , Stojanović, D , Simin, N, et al. Propiedades antihelmínticas de los aceites esenciales para controlar los nematodos gastrointestinales en ovejas, estudios in vitro e in vivo. Veterinario Sci. (2022) 9:93. DOI: 10.3390/ANI13010045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Knežević, P , Aleksić, V , Simin, N , Svirčev, E , Petrović, A , y Mimica-Dukić, N . Actividad antimicrobiana de los aceites esenciales de Eucalyptus camaldulensis y sus interacciones con agentes antimicrobianos convencionales contra Acinetobacter baumannii resistente a múltiples fármacos. J Etnofarmacol. (2016) 178:125–36. doi: 10.1016/j.jep.2015.12.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Štrbac, F , Krnjajić, S , Maurelli, MPM , Stojanović, D , Simin, N , Orčić, D, et al. Una fuente fitofarmacológica antihelmíntica potencial de aceite esencial de Origanum vulgare (L.) contra nematodos gastrointestinales de ovejas. Animales. (2022) 13:45. DOI: 10.3390/ANI13010045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Adams, RP . Identificación de componentes de aceites esenciales por cromatografía de gases/espectrometría de masas. 4ª ed. Carol Stream, IL: Allured Business Media (2012).
43. Bosco, A , Maurelli, diputado , Ianniello, D , Morgoglione, ME , Amadesi, A , Coles, GC, et al. La recuperación de huevos de nematodos añadidos de heces de caballos y ovejas por tres métodos. BMC Vet Res. (2018) 14:7. DOI: 10.1186/S12917-017-1326-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Cringoli, G , Maurelli, diputado , Levecke, B , Bosco, A , Vercruysse, J , Utzinger, J, et al. La técnica Mini-FLOTAC para el diagnóstico de infecciones por helmintos y protozoos en humanos y animales. Nat Protoc. (2017) 12:1723–32. DOI: 10.1038/NPROT.2009.235
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Ministerio de Agricultura . Pesca y alimentación (MAFF). Grande-Bretagne, manual de técnicas de laboratorio parasitológico veterinario. Londres, Reino Unido: HM Stationery Off (1986).
46. Van Wyk, JA , y Mayhew, E . Identificación morfológica de larvas infecciosas de nematodos parásitos de pequeños rumiantes y bovinos: una guía práctica de laboratorio. Onderstepoort J Vet Res. (2013) 80:539. DOI: 10.4102/ojvr.v80i1.539
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Coles, GC , Bauer, C , Borgsteede, FH , Geerts, S , Klei, TR , Taylor, MA, et al. Asociación mundial para la promoción de métodos de parasitología veterinaria (W.a.a.V.P.) para la detección de resistencia a los antihelmínticos en nematodos de importancia veterinaria. Veterinario Parasitol. (1992) 44:35–44. doi: 10.1016/0304-4017(92)90141-U
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Ferreira, LE , Benincasa, BI , Fachin, AL , Contini, SHT , França, SC , y Chagas, ACS . Aceites esenciales de Citrus aurantifola, Anthemis nobile y Lavandula officinalis: actividades antihelmínticas in vitro contra Haemonchus contortus. Vectores parásitos. (2018) 11:269. DOI: 10.1186/S13071-018-2849-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Dobson, RJ , Sangster, Carolina del Norte , Besier, RB , y Woodgate, RG . Los medios geométricos proporcionan un resultado de eficacia sesgado cuando se realiza una prueba de reducción del recuento de huevos fecales (FECRT). Veterinario Parasitol. (2009) 161:162–7. doi: 10.1016/j.vetpar.2008.12.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Borges, DGL , y Borges, FDA . Plantas y su potencial medicinal para controlar nematodos gastrointestinales en rumiantes. Nematodos. (2016) 3:E92016. doi: 10.4322/nematoda.00916
51. Soren, AD , y Yadav, AK . Evaluación de la eficacia antihelmíntica in vitro e in vivo de Cyperus compressus Linn., una planta antihelmíntica utilizada tradicionalmente en modelos parásitos-animales. Futuro. J Pharm Sci. (2020) 6:126. DOI: 10.1186/S43094-020-00148-552
52. Panda, SK , Daemen, M , Sahoo, G , y Luyten, W . Aceites esenciales como nuevos candidatos a fármacos antihelmínticos. Moléculas. (2020) 27:8327. doi: 10.3390/moléculas27238327
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Camurça-Vasconcelos, ALF , Bevilaqua, CML , Morais, SM , Maciel, MV , Costa, CTC , Macedo, ITF, et al. Actividad antihelmíntica de los aceites esenciales Croton zehtneri y Lippia sidoides. Veterinario Parasitol. (2007) 148:288–94. doi: 10.1016/j.vetpar.2007.06.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Ferreira, LE , Benincasa, BI , Fachin, AL , França, SC , Contini, SSHT , Chagas, ACS, et al. Thymus vulgaris L. essential oil and its main component thymol: antihelmintic effects against Haemonchus contortus from sheep. Veterinario Parasitol. (2016) 228:70–6. doi: 10.1016/j.vetpar.2016.08.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Barra, A . Factores que afectan la variabilidad química de los aceites esenciales: una revisión de los desarrollos recientes. Nat Prod Commun. (2009) 4:1147–54. doi: 10.1177/1934578X0900400827
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Fokou, JBH , Dongmo, PMJ , y Boyom, FF . Composición química y propiedades farmacológicas del aceite esencial En: E El-Shemy editor. Aceites esenciales: aceites de la naturaleza. Londres, Reino Unido: IntechOpen (2020)
57. Vostinaru, O , Heghes, Carolina del Sur , y Filip, L . «Perfil de seguridad de los aceites esenciales» en MS Oliveirade, WA Costada y SG Silva. Aceites esenciales – compuestos bioactivos, nuevas perspectivas y aplicaciones. Londres, Reino Unido: IntechOpen. (2020).
58. Katiki, LM , Chagas, ACS , Takahira, RK , Juliani, RRHH , Ferreira, JFS , y Amarante, AFT . Evaluación del aceite esencial de Cymbopogon schoenanthus en corderos infectados experimentalmente con Haemonchus contortus. Veterinario Parasitol. (2012) 186:312–8. doi: 10.1016/j.vetpar.2011.12.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Katiki, LM , Araujo, RC , Ziegelmeyer, L , Gomes, ACP , Gutmanis, G , Rodrigues, L, et al. Evaluación de anetol encapsulado y carvona en corderos infectados artificial y naturalmente con Haemonchus contortus. Exp Parasitol. (2019) 197:36–42. doi: 10.1016/j.exppara.2019.01.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Administración de Alimentos y Medicamentos de la FDA . Lista de estado de aditivos alimentarios. (2014). Disponible en: http://www.fda.gov/Food/IngredientsPackagingLabeling/FoodAdditivesIngredients/ucm091048.htm. (Consultado el 15 de mayo de 2023).
61. Agencia Europea de Medicamentos . Informe de evaluación sobre Mentha x piperita L., folium y aetheroleum. (2020). Disponible en: https://www.ema.europa.eu/en/documents/herbal-report/assessment-report-mentha-x-piperita-l-folium-aetheroleum-revision-1_en.pdf (consultado el 15 de mayo de 2023).
62. Moorthy, B , Madyastha, P , y Madyastha, KM . Hepatotoxicidad de la pulegona en ratas: sus efectos sobre las enzimas microsomales, in vivo. Toxicología. (1989) 55:327–37. doi: 10.1016/0300-483X(89)90022-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Khojasteh, SC , Oishi, S , y Nelson, SD . El metabolismo y la toxicidad del mentofurano en rodajas de hígado de rata y en ratas. Chem Res Toxicol. (2010) 23:1824–32. DOI: 10.1021/TX100268G
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Agencia Europea de Medicamentos . Declaración pública sobre el uso de medicamentos a base de plantas que contienen pulegona y mentofurano. (2016). Disponible en: https://www.ema.europa.eu/en/documents/scientific-guideline/public-statement-use-herbal-medicinal-products-containing-pulegone-menthofuran-revision-1_en.pdf [consultado el 15 de mayo de 2023].
65. Camurça-Vasconcelos, ALF , Bevilaqua, CML , Morais, SM , Maciel, MV , Costa, CTC , Macedo, ITF, et al. Actividad antihelmíntica del aceite esencial de Lippia sidoides en nematodos gastrointestinales de ovejas. Veterinario Parasitol. (2008) 154:167–70. doi: 10.1016/j.vetpar.2008.02.023
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. André, WPP , Ribeiro, WLC , Cavalcante, GS , dos Santos, JML , Macedo, ITF , de Paula, HCB, et al. Eficacia comparativa y efectos tóxicos del acetato de carvacril y carvacrol en nematodos gastrointestinales ovinos y ratones. Veterinario Parasitol. (2016) 218:52–8. doi: 10.1016/j.vetpar.2016.01.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Macedo, ITF , de Oliveira, LMB , Andre, WBP , Filho, JVA , dos Santos, JML , Rondon, FCM, et al. Efecto antihelmíntico del aceite esencial Cymbopogon citratus y su nanoemulsión sobre nematodos gastrointestinales de ovejas. Rev Bras Parasitol Vet. (2019) 28:522–7. doi: 10.1590/S1984-29612019065
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Choudhary, S , Marijanović, ĐS , Wong, CR , Zhang, X , Abongwa, M , Coats, JR, et al. El mentol actúa como un modulador alostérico positivo en los receptores nicotínicos de acetilcolina sensibles al levamisol nematodo. Int J Parasitol Drugs Drug Resist. (2019):44–53. doi: 10.1016/j.ijpddr.2018.12.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Khan, NU , Sajid, M , Bibi, S , Rehman, W , Alanazi, MM , y Abdellatif, MH . Caracterización nematicida de extractos de hojas de Solanum nigrum y Mentha arvensis utilizando Caenorhabditis elegans como organismo modelo. ACS Omega. (2023) 8:9454–63. DOI: 10.1021/ACSOMEGA.2C08124
70. Hoste, H , y Torres-Acosta, JFJ . Control no químico de helmintos en rumiantes: adaptación de soluciones para gusanos cambiantes en un mundo cambiante. Veterinario Parasitol. (2011) 180:144–54. doi: 10.1016/j.vetpar.2011.05.035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Mesquita, MDA , Júnior, JBES , Panassol, AM , de Oliveira, EF , Vasconcelos, ALCF , de Paula, HCB, et al. Actividad antihelmíntica del aceite encapsulado de Eucalyptus staigeriana en nematodos gastrointestinales de ovejas. Parasitol Res. (2013) 112:3161–5. DOI: 10.1007/S00436-013-3492-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Maes, C , Bouquillion, S , y Fauconnier, ML . Encapsulación de aceites esenciales para el desarrollo de pesticidas de origen biológico con liberación controlada: una revisión. Moléculas. (2019) 24:2539. doi: 10.3390/moléculas24142539
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Mentha x piperita , aceite esencial, nematodos gastrointestinales, ovejas, eficacia antihelmíntica
Cita: Štrbac F, Krnjajić S, Stojanović D, Ratajac R, Simin N, Orčić D, Rinaldi L, Ciccone E, Maurelli MP, Cringoli G y Bosco A (2023) Invitro and in vivo anthelmintic efficacy of peppermint (Mentha x piperita L.) essential oil against gastrointestinal nematodes of sheep. Frente. Vet. Sci. 10:1232570. doi: 10.3389/fvets.2023.1232570
Recibido: 31 de mayo de 2023; Aprobado: 25 de julio de 2023;
Publicado: 10 de agosto de 2023.
Editado por:
Marianna Pauletto, Universidad de Padua, Italia
Revisado por:
Ian Sutherland, AgResearch Ltd., Nueva Zelanda
Giulia Simonato, Universidad de Padua, Italia
Copyright © 2023 Štrbac, Krnjajić, Stojanović, Ratajac, Simin, Orčić, Rinaldi, Ciccone, Maurelli, Cringoli y Bosco. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Filip Štrbac, filip.strbac@imsi.bg.ac.rs; Antonio Bosco, antonio.bosco@unina.it
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía
