Concentraciones de biomarcadores inflamatorios en perros con vólvulo de dilatación
Concentraciones de biomarcadores inflamatorios en perros con vólvulo de dilatación gástrica con y sin lidocaína intravenosa de 24 h
 Anna Brunner1
Anna Brunner1  Anna Lehmann2
Anna Lehmann2  Bianca Hettlich3
Bianca Hettlich3  Laureen M. Peters4
Laureen M. Peters4  Camille Julie Doras5
Camille Julie Doras5  Katja-Nicole Adamik1*
Katja-Nicole Adamik1*- 1División de Urgencias y Cuidados Críticos de Pequeños Animales, Departamento de Medicina Veterinaria Clínica, Facultad de Veterinaria, Universidad de Berna, Berna, Suiza
- 2División de Medicina Interna de Pequeños Animales, Departamento de Medicina Veterinaria Clínica, Facultad de Vetsuisse, Universidad de Berna, Berna, Suiza
- 3División de Cirugía de Pequeños Animales, Departamento de Medicina Veterinaria Clínica, Facultad de Vetsuisse, Universidad de Berna, Berna, Suiza
- 4Laboratorio de Diagnóstico Clínico, Departamento de Medicina Veterinaria Clínica, Facultad Vetsuisse, Universidad de Berna, Berna, Suiza
- 5Instituto de Salud Pública Veterinaria, Facultad Vetsuisse, Universidad de Berna, Berna, Suiza
Fondo: El vólvulo de dilatación gástrica canina (GDV) se caracteriza por isquemia tisular, reperfusión e inflamación sistémica. Existe evidencia de que la lidocaína ejerce propiedades antiinflamatorias y potencialmente mejora el resultado.
Diseño y ambientación: Estudio de cohorte observacional prospectivo, aleatorizado y en perros con GDV.
Objetivo: El objetivo principal del estudio fue la determinación de las concentraciones de biomarcadores proinflamatorios y antiinflamatorios en perros con GDV con y sin tratamiento con lidocaína intravenosa (IV). El segundo objetivo fue la evaluación de los efectos secundarios de la lidocaína.
Métodos: De los 35 perros incluidos en el estudio, 20 perros fueron asignados a recibir lidocaína (LIDO) (2 mg/kg inicialmente, seguido de una infusión continua a razón de 50 μg/kg/min durante 24 h) y 15 perros a no recibir lidocaína (NO-LIDO). Se midieron las concentraciones plasmáticas de citocinas interleucina (IL)-6, IL-7, IL-8, IL-10, IL-15, IL-18, interferón gamma, queratinocitos quimiotácticos, proteína quimiotáctica monocitaria y proteína C reactiva (PCR) al ingreso (antes de cualquier intervención terapéutica, T0), inmediatamente después de la cirugía (T1), a las 24 h (T24) y a las 48 h (T48) postoperatoria.
Resultados: No se encontraron diferencias significativas en las concentraciones de citocinas entre el grupo LIDO- y el NO-LIDO. Se encontraron concentraciones significativamente más bajas de PCR (mediana [rango]) en perros con lidocaína en comparación con perros sin at T24 (97,5 pg/ml [46,3-161,7] frente a 127,9 pg/ml [26,9-182,0]; p = 0,046) y T48 (73,7 pg/ml [18,4–169,4] vs. 116,3 pg/ml [71,4–176,8]; p = 0,002). Los perros que recibieron lidocaína mostraron un deterioro significativo de la mentalidad, un período prolongado de anorexia y una hospitalización más prolongada en comparación con los perros sin lidocaína.
Conclusión: La administración de lidocaína no tuvo ningún impacto en los niveles plasmáticos de citocinas durante el período de estudio de 48 horas, pero se encontraron concentraciones de PCR significativamente más bajas en T24 y T48. Los posibles efectos secundarios de la lidocaína requieren una cuidadosa toma de decisiones con respecto a su uso.
1 Introducción
La dilatación y vólvulo gástrico (GDV) es una afección grave y se caracteriza por desplazamiento gástrico, rápida acumulación de gases intragástricos y aumento de la presión intragástrica, lo que conduce a la isquemia de la pared gástrica con la consiguiente necrosis de la pared estomacal. Además, la GDV puede provocar una disminución del retorno venoso y un deterioro de la circulación sistémica, lo que provoca un shock obstructivo y daños en múltiples órganos. El objetivo de la terapia es mejorar la circulación sistémica y el flujo sanguíneo gástrico, mediante la reanimación con líquidos por vía intravenosa (IV), la descompresión gástrica y el reposicionamiento quirúrgico del estómago (1-3).
Muchas de las complicaciones asociadas con la GDV están relacionadas con la reperfusión de áreas previamente isquémicas, lo que conduce a una lesión por isquemia-reperfusión (IRI) caracterizada por la producción de especies reactivas de oxígeno (1, 4). Los mecanismos detrás de la generación de especies reactivas de oxígeno han sido bien descritos en la literatura (5, 6).
Estudios previos han evaluado marcadores de inflamación y lesión celular o necrosis en perros con GDV. Estos estudios encontraron que la caja 1 del grupo plasmático de alta movilidad, el ADN libre de células, la procalcitonina y la proteína C reactiva (PCR) estaban aumentadas en los perros con GDV, siendo la procalcitonina al ingreso un predictor de no supervivencia (7). Además, las concentraciones más altas de PCR se relacionaron significativamente con un resultado negativo (8). En un estudio realizado entre un subconjunto de perros con GDV incluidos en la investigación actual, se detectó un espectro diverso de patrones inflamatorios. En concreto, la interleucina (IL)-6, el interferón (IFN)-γ, la proteína quimiotáctica de monocitos (MCP)-1, la IL-10 y la PCR se relacionaron predominantemente con la respuesta inflamatoria, y el pico de esta respuesta se produjo en el periodo entre la cirugía y las 24 h postoperatorias (9).
La lidocaína es reconocida principalmente por sus acciones como anestésico local, un fármaco antiarrítmico intravenoso y por su posible efecto analgésico cuando se administra por vía intravenosa (10-12). Además, la lidocaína se ha recomendado como eliminador de radicales libres y para la prevención de la IRI (13, 14), incluso en perros con GDV (1, 4, 15). Además, la lidocaína tiene varios efectos antiinflamatorios, cuyos mecanismos moleculares son poco conocidos (13). Ningún estudio publicado evaluó el efecto de la lidocaína IV sobre las concentraciones de diferentes marcadores inflamatorios en perros con GDV.
El objetivo principal del presente estudio fue comparar las concentraciones de diferentes citoquinas plasmáticas y PCR durante un período de 48 h y evaluar el potencial efecto antiinflamatorio en perros con GDV que recibieron una terapia con lidocaína IV de 24 h en comparación con aquellos que no la recibieron. La hipótesis era que la terapia con lidocaína intravenosa conduce a concentraciones más bajas de citocinas y PCR. Como objetivo secundario, el estudio también evaluó los posibles efectos secundarios asociados a la administración de lidocaína.
2 Materiales y métodos
2.1 Diseño del ensayo
Este estudio fue un estudio de cohorte prospectivo, aleatorizado, de grupos paralelos y no ciego realizado en un solo centro, con perros propiedad de clientes con GDV. Los perros con GDV presentados entre junio de 2017 y septiembre de 2018 en el hospital veterinario de la Universidad de Berna, Suiza, fueron elegibles para la inclusión. El ensayo fue aprobado por el Comité de Experimentación Animal de la Oficina Federal Veterinaria de Suiza (número de registro BE 69/17), y se obtuvo el consentimiento informado del propietario para todos los perros. El estudio se adhiere a las pautas descritas en la declaración de estándares de notificación de ensayos en mascotas (PetSORT) (16).
2.2 Sujetos
Los datos de algunos perros de la cohorte de este estudio se publicaron previamente en otros dos estudios de la misma institución (9, 17). Específicamente, los datos de citoquinas de 15 perros, denominados el grupo NO-LIDO en este estudio, se informaron en un estudio anterior centrado en las concentraciones y la cinética (9, 17). Como se ha descrito (9), el diagnóstico de GDV se estableció por la presencia de signos clínicos compatibles y se confirmó posteriormente mediante distintos hallazgos radiográficos, junto con la intervención quirúrgica. Se excluyeron del estudio todos los perros que presentaban bloqueos graves de conducción cardíaca, que pesaban menos de 15 kg, o aquellos que fueron sometidos a eutanasia por razones financieras.
2.3 Aleatorización
Los perros incluidos fueron asignados aleatoriamente para recibir o no lidocaína intravenosa durante 24 h, utilizando la técnica de bloqueo permutado con un tamaño de bloque de seis sujetos, compuesto por tres perros que recibieron lidocaína y tres perros que no recibieron lidocaína. El orden de asignación se asignó al azar mediante el uso de hojas selladas en un sobre.
2.4 Recopilación de datos
2.4.1 Muestras de sangre
El procesamiento de las muestras de sangre siguió el mismo protocolo descrito previamente en un estudio realizado en la misma institución (9). Brevemente, se recogieron muestras de sangre de los perros afectados en cuatro momentos: al ingreso (antes de cualquier medida terapéutica, T0), inmediatamente después de la cirugía (aproximadamente 5 minutos después de la finalización de la última sutura cutánea) (T1), 24 ± 4 h después de la cirugía (T24) y 48 ± 4 h después de la cirugía (T48). Se utilizaron tubos de K2-EDTA de 1,3 ml y tubos de heparina de 9 ml (K2-EDTA y heparina de litio LH/1,3, Sarstedt AG, Suiza) para el almacenamiento de sangre en T0, T24 y T48 para análisis hematológicos (Advia 2120i, Siemens Healthcare Diagnostics AG, Suiza) y bioquímicos (Cobas c501, Roche Diagnostics, Suiza) que incluían PCR (PCR canina Randox, CP2798, Cobas c501, Roche Diagnostics, Suiza) y lactato (RAPIDPoint 500; Siemens Healthcare AG, Suiza). Como se describió en el estudio anterior, en T1 solo se recolectaron 9 mL de sangre heparinizada, que se utilizó para el análisis de lactato y luego se centrifugó, y de la cual se utilizó una alícuota de 0,5 mL de plasma para análisis bioquímico y de PCR (9). El plasma restante de todos los puntos temporales se alícuota y se almacenó a -80 °C en 1 h de la extracción de sangre, para ser utilizado posteriormente para análisis por lotes de citocinas. En caso de eutanasia intraoperatoria, se recogió una muestra de sangre T1 después del reposicionamiento gástrico previo a la eutanasia.®®®®
Como se describió en el estudio anterior, las citoquinas se analizaron utilizando un panel de citoquinas caninas Milliplex, kit CCYTOMAG-90 K (analizador Luminex MAGPIX, EMD Millipore, Estados Unidos). El análisis se realizó por duplicado de las siguientes citocinas: IL-6, IL-7, IL-8, IL-10, IL-15, IL-18 (IFN-γ), queratinocitos quimiotácticos (KC-like) y (MCP-1), con muestras aleatorizadas en cada placa. Se calcularon los coeficientes de variación (CV%) para las mediciones replicadas de cada muestra. Para las muestras que excedían los límites de detección, no repetimos las mediciones con diluciones variables; en su lugar, se empleó el valor máximo medible. Cuando las concentraciones de citocinas cayeron por debajo de los niveles detectables, se registró un resultado de «0». Todas las muestras se sometieron a incubación refrigerada durante la noche. Las concentraciones de citocinas se reportan en pg./mL (9).
2.4.2 Puntuaciones de gravedad de la enfermedad
Se realizó una evaluación fisiológica y de laboratorio del paciente agudo (APPLErápido) (18) (incluyendo albúmina, glucosa, recuento de plaquetas, lactato sanguíneo y puntuación de mentación) para cada perro del estudio al ingreso.
Se evaluó la presencia o ausencia de SRIS en el momento del ingreso, y los perros se clasificaron como portadores de SRIS si cumplían ≥2 de los siguientes criterios de SRIS definidos por Hauptmann et al. (19): hipo o hipertermia (<38,1 °C [100,6 °F] o > 39,2 °C [102,6 °F]), taquicardia (frecuencia cardíaca > 120/min), taquipnea (frecuencia respiratoria > 20/min), leucocitosis (recuento de glóbulos blancos [WBC] >16 × 109 células/L [16 × 103 células/μL]) o leucopenia (recuento de leucocitos <6 × 109 células/L [<6 × 103 células/μL]), y > 3% de neutrófilos en banda en el recuento de leucocitos.
Los perros dados de alta del hospital se definieron como sobrevivientes, mientras que los perros que murieron naturalmente o fueron sacrificados debido a un pronóstico grave se clasificaron como no sobrevivientes. Para la eutanasia intraoperatoria, pentobarbital intravenoso (400 mg/kg administrados al efecto; Euthasol 40% ad us. Vet, Virbac, Switzerland AG, 8152 Opfikon).®
2.4.3 Evaluación de los efectos secundarios de la lidocaína
A lo largo del período de estudio de 48 h, se evaluaron parámetros para evaluar los posibles efectos adversos de la lidocaína. Estos abarcaron parámetros cardiovasculares como la frecuencia cardíaca, la presión arterial sistólica (monitor de presión arterial SunTech Vet20™, Morrisville, Carolina del Norte, Estados Unidos) y la temperatura rectal. Además, la mentación, basada en la MANZANA®rápido puntuación, con puntuaciones que oscilaron entre 0 y 4 (18). Una puntuación de 0 representaba una mentalidad normal y la capacidad de pararse sin ayuda, mientras que una puntuación de 4 indicaba un perro incapaz de pararse y reaccionar. Los problemas de micción, como la micción infructuosa a pesar de la asistencia y el agrandamiento de la vejiga urinaria que requirió cateterismo, se controlaron durante el período posquirúrgico. Además, se evaluó la duración de la anorexia midiendo el tiempo (horas) hasta que los perros reanudaron la alimentación dentro del período de tiempo postquirúrgico de 48 horas. La reanudación de la alimentación se definió como comer al menos 2-3 cucharadas de comida al menos 2 veces al día.
2.5 Intervenciones
2.5.1 Protocolo general de tratamiento
Se implementó un protocolo de tratamiento estándar para todos los perros GDV, como se detalló previamente en un estudio previo realizado por los mismos autores (9). Para garantizar la estabilidad cardiovascular, se proporcionó suplementación con oxígeno y fluidoterapia intravenosa (Plasma-Lyte A, Baxter AG, Suiza) a discreción del médico. El manejo del dolor se logró mediante metadona intravenosa (0,2 mg/kg; Methadon Streuli, Streuli Pharma AG, Suiza) o un bolo de fentanilo (5 μg/kg; Fentanyl Curamed, Actavis Switzerland AG, Suiza) con la posterior infusión de fentanilo (5 μg/kg/h). En perros con distensión gástrica severa, la gastrocentesis percutánea se realizó con una aguja de calibre 14 o 16 una vez iniciada la fluidoterapia. La presión arterial se evaluó mediante medición oscilométrica de la presión arterial. Se documentaron los volúmenes de líquido administrados durante la estabilización inicial, así como en el período intraoperatorio y postoperatorio.®®®
2.5.2 Protocolo de tratamiento con lidocaína
El protocolo de tratamiento con lidocaína siguió el mismo protocolo descrito previamente en un estudio realizado en la misma institución (17). Brevemente: los perros del grupo LIDO recibieron 2 mg/kg de lidocaína (Lidokain 2% Streuli, Streuli Pharma AG, 8730 Uznach, Suiza) por vía intravenosa durante 15 minutos junto con fluidoterapia intravenosa, pero antes de cualquier otro tratamiento. A esto le siguió una IRC de lidocaína (50 μg/kg/min) durante 24 h, a menos que hubiera indicación de interrupción (p. ej., bloqueo auriculoventricular) o prolongación del tratamiento (p. ej., taquicardia ventricular sostenida). Los perros en el grupo de NO-LIDO no recibieron lidocaína durante el período de estudio, a menos que se desarrollara una razón médica que requiriera la administración de lidocaína (p. ej., taquicardia ventricular con compromiso cardiovascular posterior). Estos perros fueron excluidos del estudio.®
2.5.3 Anestesia, cirugía y monitorización postoperatoria
La anestesia, la cirugía y el seguimiento postoperatorio siguieron el mismo protocolo descrito anteriormente (9). Para la premedicación se utilizó metadona (0,2 mg/kg, IV, Methadon Streuli, Streuli Pharma AG, Suiza) y midazolam (0,2 mg/kg, IV; Dormicum, Roche Pharma SA, Suiza) y propofol (al efecto; Propofol-Lipuro, B. Braun Medical AG, Suiza) para inducir la anestesia. Después de la intubación endotraqueal, la anestesia se mantuvo con isoflurano (ajustado al efecto; Isoflo nos anuncia. veterinario, Zoetis GmbH, Suiza) y oxígeno (60-100%). La analgesia fue proporcionada por fentanilo intravenoso (CRI a razón de 5 μg/kg/h, Fentanyl Curamed, Actavis Switzerland AG, Suiza). Se monitorizaron electrocardiograma (ECG), capnografía, pulsoximetría, PA arterial y temperatura esofágica durante toda la cirugía.®®®®®
La laparotomía exploratoria fue realizada por un cirujano certificado por la junta o un residente de cirugía sénior e incluyó descompresión y reposicionamiento del estómago, seguido de gastropexia. Los cambios en la pared gástrica se clasificaron como se describió anteriormente y se basaron en la apariencia macroscópica del estómago después de la reposición. Los cambios se dividieron en leves (nula o ligera coloración roja de la pared del estómago), moderados (pared gástrica púrpura o hemorragia) y severos (color verde, gris o negro de la pared gástrica y una pared gástrica friable y palpablemente delgada) (9). En el postoperatorio se monitorizaron la frecuencia cardíaca y el ritmo cardíaco, el color de la mucosa y el tiempo de llenado capilar, la mentación, la frecuencia respiratoria, la temperatura rectal y la PA oscilométrica. Durante las primeras 12-24 h postoperatorias, se observó ECG continuo seguido de ECG intermitente cada 8 h hasta 48 ± 4 h postoperatorio. Para la analgesia, los perros recibieron fentanilo intravenoso (IRC a una tasa de 5 μg/kg/h, Fentanyl Curamed, Actavis Switzerland AG, Suiza) hasta 24 h después de la cirugía, seguido de buprenorfina intravenosa (0,01-0,02 mg/kg cada 8 h; Temgesic, Indivior Schweiz AG). El tratamiento adicional incluyó cristaloides isotónicos intravenosos y omeprazol (1 mg/kg IV cada 12 h; Omeprazol Streuli, Streuli Pharma AG, Suiza).®®®
2.6 Análisis estadístico
Los análisis estadísticos se realizaron con el software MedCalc (MedCalc Statistical Software versión 22.007,®1 2023, Ostende, Bélgica) y la significación se fijó en p < 0,05 en todo momento. Algunas cifras se realizaron con el software estadístico NCSS 2023 [NCSS 2023 Statistical Software (2023); NCSS, LLC., Kaysville, Utah, Estados Unidos].2 Se utilizaron pruebas de Shapiro-Wilk para evaluar la distribución normal. Como la mayoría de los datos no se distribuyeron normalmente, todos los datos se informan como mediana con rango. Las diferencias estadísticas de las variables cuantitativas entre los grupos (p. ej., LIDO vs. NO-LIDO) se examinaron con pruebas de suma de rangos de Mann-Whitney. Para cada uno de los marcadores inflamatorios estudiados, se analizó la relación entre la concentración plasmática, el tratamiento (LIDO vs. NO-LIDO) y la cinética (tiempo de muestreo de sangre), ajustados por factores de confusión, con un modelo lineal de efectos mixtos en R y el paquete lme4 (20). El tiempo transcurrido desde el ingreso a la cirugía, la duración de la anestesia y la duración de la cirugía se incluyeron como factores de confusión. También se añadió al modelo un término de interacción entre el tiempo de muestreo y el grupo de tratamiento para tener en cuenta la cinética de la respuesta inflamatoria. Los datos de los resultados (es decir, las concentraciones plasmáticas de marcadores inflamatorios) se transformaron en raíz cuadrada y se evaluaron y cumplieron los supuestos de homocedasticidad y normalidad de los residuos. Se utilizó el Criterio de Información de Akaike (AIC) para seleccionar el modelo que mejor se ajustaba a nuestros datos (21). Las variables categóricas entre los grupos se evaluaron mediante pruebas de Chi-cuadrado o pruebas exactas de Fisher, según correspondiera. Los no sobrevivientes se resumieron en un grupo para el análisis estadístico.
3 Resultados
3.1 Características de la cohorte y resultado
Entre junio de 2017 y septiembre de 2018, un total de 44 perros con GDV fueron evaluados para determinar su elegibilidad para ser incluidos en el estudio. De estos, dos perros fueron sacrificados antes de la cirugía debido a preocupaciones financieras y cuatro perros no fueron incluidos debido a la falta de consentimiento del dueño. De los 35 perros incluidos, 20 fueron asignados aleatoriamente al grupo LIDO y 18 al grupo NO-LIDO. Posteriormente, tres perros del grupo NO-LIDO necesitaron ser excluidos por arritmia ventricular que requirió tratamiento con lidocaína, quedando un total de 15 perros en el grupo NO-LIDO (Figura 1). En la Tabla 1 se presentan los datos demográficos, basales y de resultados en perros aleatorizados al grupo LIDO o SIN LIDO. Había un total de 19 razas. Las siguientes razas estuvieron representadas en el grupo LIDO: Gran Danés (n = 5), Pastor Alemán (n = 3), Boyero de Berna (n = 2) y una de cada una de las razas de Border Collie, Briard, Dobermann, Dálmata, Euroasiática, Golden Retriever, Grifón Pointero de Pelo Duro, Setter Irlandés, Labrador Retriever y Boyero Suizo. En el grupo NO-LIDO, estuvieron representadas las siguientes razas: perro mestizo (n = 5), Weimaraner (n = 2), San Bernardo (n = 2) y uno de Gran Danés, Golden Retriever, Labrador Retriever, Mastín Español, Perro de Terranova y Caniche.
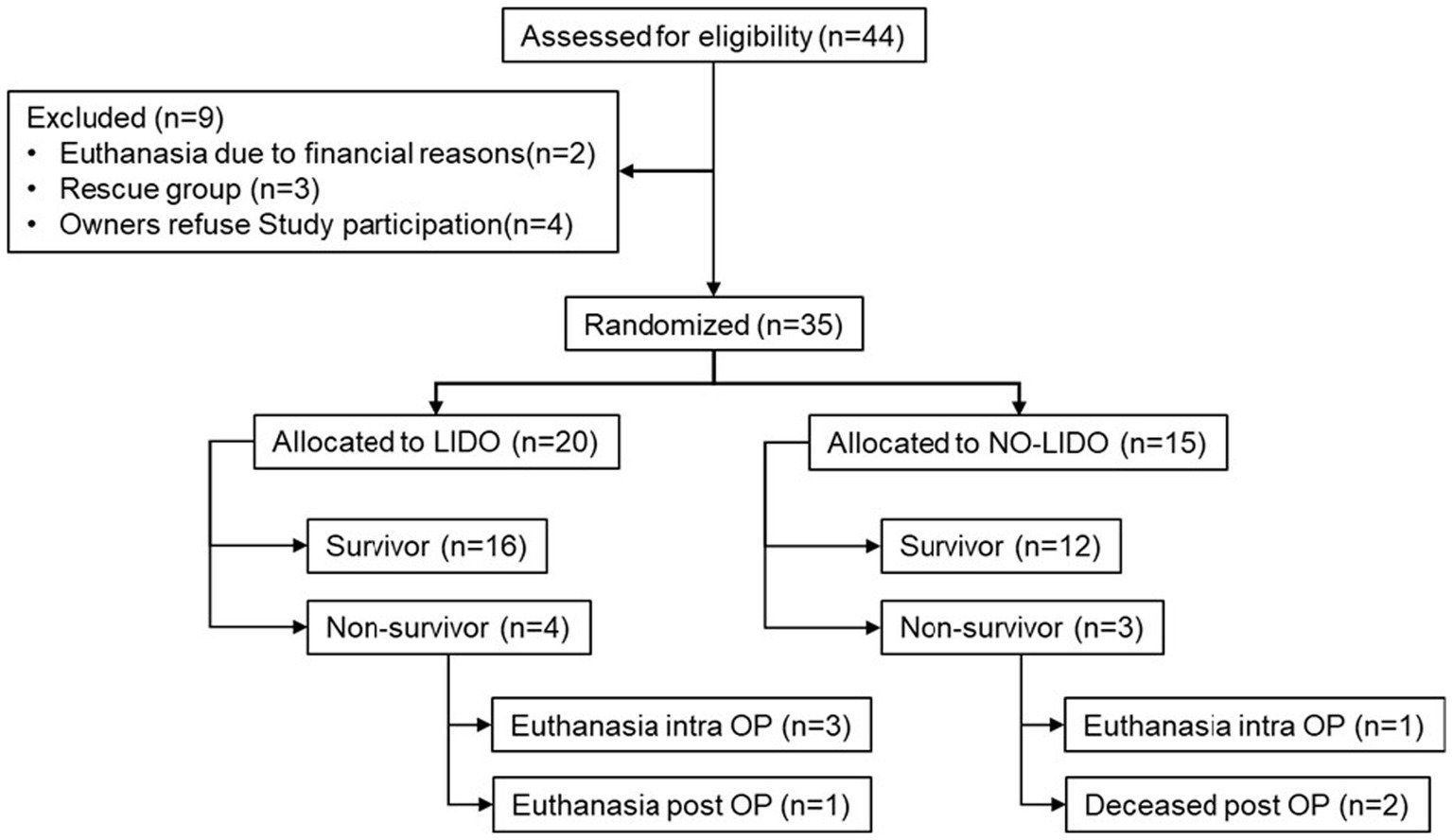 Figura 1. Inclusión y exclusión de 44 perros con GDV en la cohorte de estudio. LIDO, perros GDV tratados con lidocaína; Perros NO-LIDO, GDV tratados sin lidocaína; grupo de rescate, perros inicialmente incluidos en el grupo NO-LIDO, pero que requirieron lidocaína intravenosa debido al desarrollo de arritmia ventricular clínicamente relevante; intraoperatorio, intraoperatorio, postoperatorio, postoperatorio.
Figura 1. Inclusión y exclusión de 44 perros con GDV en la cohorte de estudio. LIDO, perros GDV tratados con lidocaína; Perros NO-LIDO, GDV tratados sin lidocaína; grupo de rescate, perros inicialmente incluidos en el grupo NO-LIDO, pero que requirieron lidocaína intravenosa debido al desarrollo de arritmia ventricular clínicamente relevante; intraoperatorio, intraoperatorio, postoperatorio, postoperatorio.
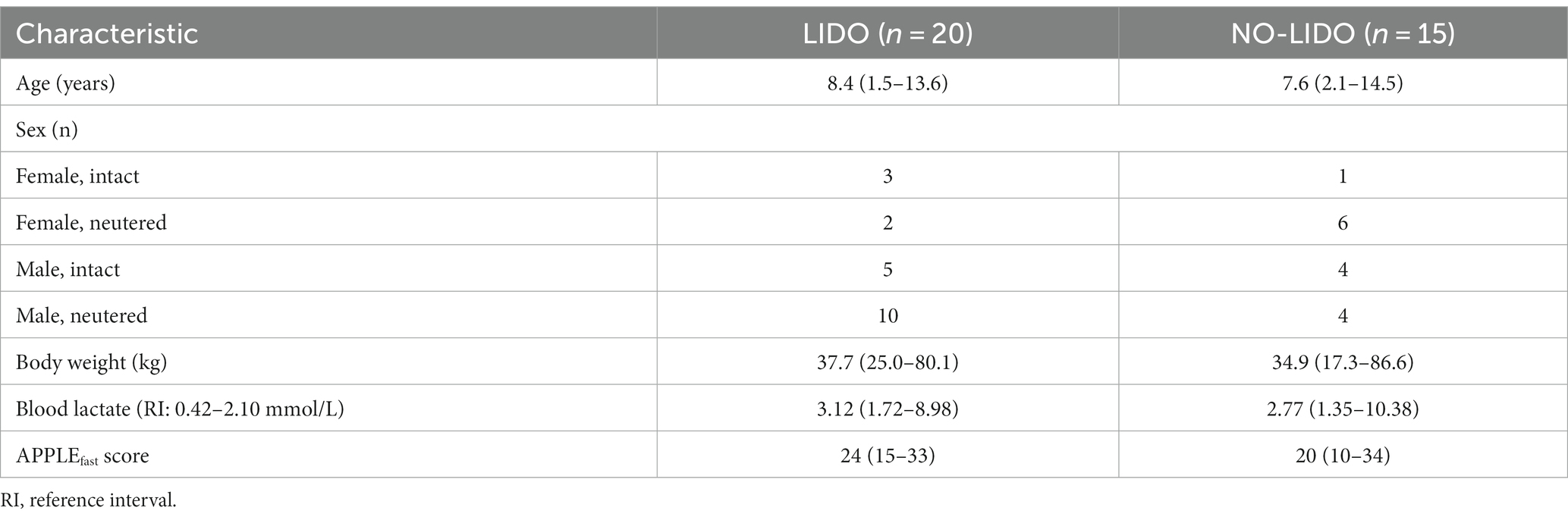 Tabla 1. Datos demográficos y basales (mediana, mín.-máx.) en perros aleatorizados al grupo LIDO o NO LIDO.
Tabla 1. Datos demográficos y basales (mediana, mín.-máx.) en perros aleatorizados al grupo LIDO o NO LIDO.
En la Tabla 2 se presentan los datos y procedimientos asociados a GDV en perros aleatorizados al grupo LIDO o NO LIDO. No se observaron diferencias significativas entre los dos grupos en cuanto a la duración de los síntomas clínicos antes del ingreso, los volúmenes de líquido administrados desde el ingreso hasta el final de la cirugía y el tiempo entre el ingreso y el inicio de la cirugía. La duración de la anestesia y la cirugía fue significativamente mayor en el grupo LIDO. Durante el transcurso del estudio, dos perros del grupo LIDO y un perro del grupo NO-LIDO desarrollaron arritmias ventriculares, pero no fue necesario ningún tratamiento adicional. La mortalidad global fue del 20% y no se encontraron diferencias significativas entre el grupo LIDO y NO-LIDO (p = 1,0). En el grupo LIDO, 4/20 perros no sobrevivieron (Figura 1). De estos, la eutanasia se realizó intraoperatoriamente en 3 perros debido a cambios severos en la pared gástrica, y en el postoperatorio temprano en 1 perro debido a hemoperitoneo y shock hipovolémico (los propietarios rechazaron la terapia adicional). En el grupo de NO-LIDO, 3/15 perros no sobrevivieron. Un perro fue sacrificado durante la cirugía debido a cambios severos en la pared del estómago, y dos perros (cambios estomacales moderados y severos cada uno) sufrieron un paro cardíaco (a las 3 y 6 h después de la cirugía, respectivamente), que no respondieron a la reanimación cardiopulmonar (Figura 1).
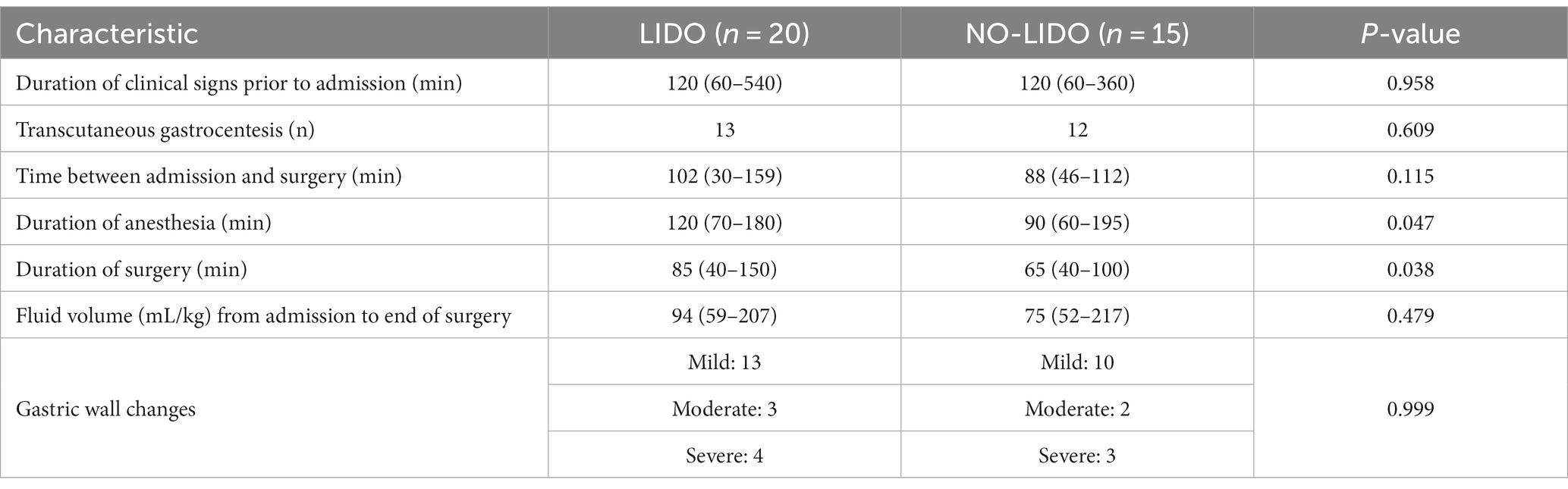 Tabla 2. Datos y procedimientos asociados al GDV (mediana, mín.-máx.) en perros aleatorizados al grupo LIDO o SIN LIDO.
Tabla 2. Datos y procedimientos asociados al GDV (mediana, mín.-máx.) en perros aleatorizados al grupo LIDO o SIN LIDO.
3.2 Concentraciones plasmáticas de citocinas y PCR
El coeficiente medio de variación (CV) de las mediciones duplicadas fue del 13%, con un 11% de duplicados que superaban un CV del 25%, cumpliendo con las directrices de calidad del fabricante. Ningún valor superó el límite de detección.
3.2.1 LIDO vs. grupo NO-LIDO
No se observaron diferencias significativas en las concentraciones de citocinas entre los grupos en ningún momento (Tabla Suplementaria S1). Las concentraciones plasmáticas [mediana (rango)] de PCR fueron significativamente más bajas en el grupo LIDO en comparación con el grupo NO-LIDO en T24 [97,5 pg/ml (46,3-161,7) frente a 127,9 pg/ml (26,9-182,0); p = 0,046] y T48 [73,7 pg/mL (18,4-169,4) vs. 116,3 pg/mL (71,4-176,8); p = 0,002] (Tabla complementaria S1). En la Figura 2 se ilustra la cinética de las citocinas y la PCR en el grupo LIDO y NO-LIDO durante el período de tiempo de T0 a T48.
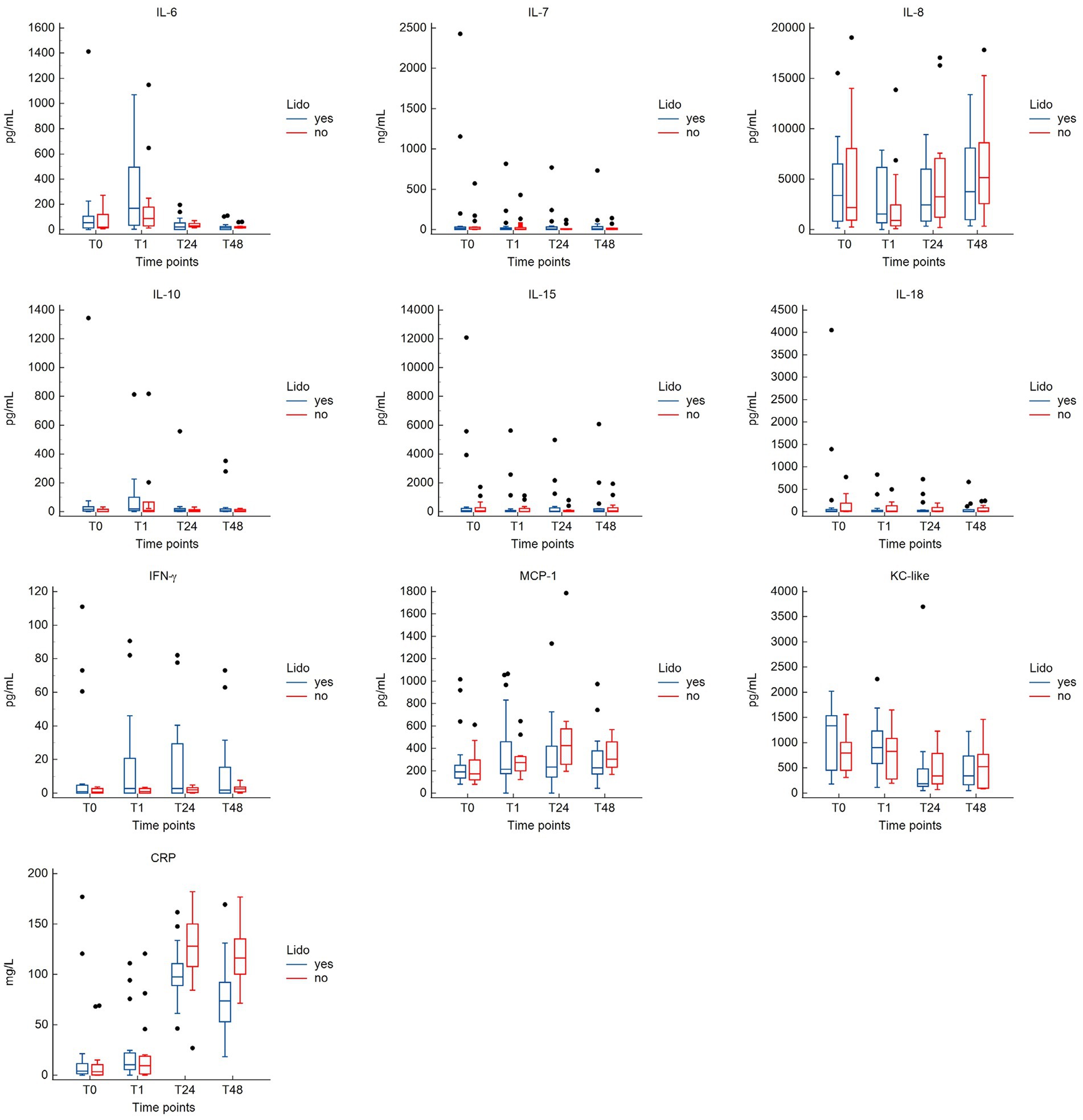 Figura 2. Diagramas de caja y bigotes que comparan las concentraciones de citocinas y PCR entre los grupos LIDO y NO-LIDO en cuatro puntos de tiempo de medición (T0, T1, T24, T48). Los analitos incluyen interleucina (IL)-6, IL-7, IL-8, IL-10, IL-15, IL-18, IFN-γ, KC-like, MCP-1 y PCR. El grupo LIDO está representado por barras azules (izquierda) y el grupo NO-LIDO por barras rojas (derecha). El cuadro central indica el rango intercuartílico (percentil 25 a 75) con la mediana representada por la línea media. Los valores atípicos se representan como puntos individuales.
Figura 2. Diagramas de caja y bigotes que comparan las concentraciones de citocinas y PCR entre los grupos LIDO y NO-LIDO en cuatro puntos de tiempo de medición (T0, T1, T24, T48). Los analitos incluyen interleucina (IL)-6, IL-7, IL-8, IL-10, IL-15, IL-18, IFN-γ, KC-like, MCP-1 y PCR. El grupo LIDO está representado por barras azules (izquierda) y el grupo NO-LIDO por barras rojas (derecha). El cuadro central indica el rango intercuartílico (percentil 25 a 75) con la mediana representada por la línea media. Los valores atípicos se representan como puntos individuales.
Los resultados del modelo lineal de efectos mixtos se muestran en la Tabla 3. En el caso de algunos marcadores inflamatorios, el tiempo de muestreo afectó significativamente a la concentración plasmática medida. En comparación con T0, T24 y T48 se asociaron con concentraciones más altas de PCR y MCP-1, pero en menor medida en el grupo LIDO. Por el contrario, T24 y T48 se asociaron con una menor concentración de KC-like en comparación con la línea de base. T1 se asoció con mayores concentraciones de IL6. Para IL10, la concentración plasmática aumenta en T1 en ambos grupos, pero la magnitud del aumento es menor en el grupo LIDO. Sin embargo, la concentración plasmática de IL10 es en general más alta en el grupo LIDO que en el grupo no tratado. Encontramos el mismo resultado para la concentración plasmática de KC-like, que es en general más alta en el grupo LIDO, independientemente del tiempo de muestreo. La concentración de IL8 disminuyó significativamente en T1 y aumentó en T48, en comparación con T0. Observamos que el tiempo transcurrido entre el ingreso y la cirugía afectó significativamente la concentración plasmática de PCR, IL6 y MCP-1 hacia una disminución y la IL8 hacia un aumento (Tabla 3).
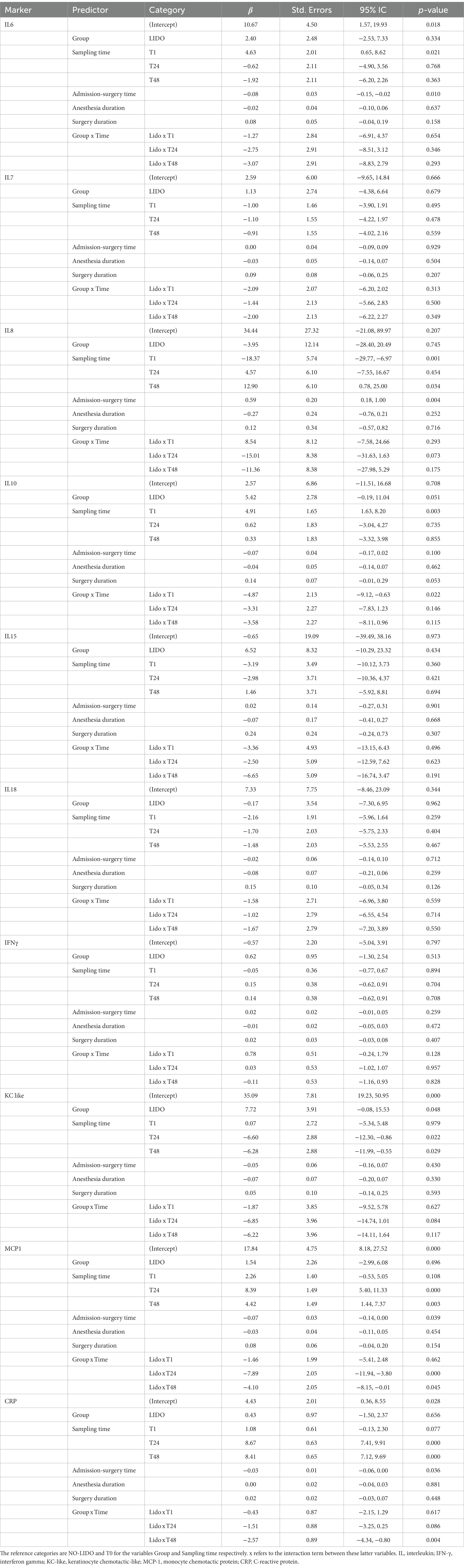 Tabla 3. Resultados del modelo de regresión lineal de efectos mixtos analizando la relación entre la concentración plasmática de marcadores inflamatorios, el tratamiento (LIDO vs. NO-LIDO) y la cinética (tiempo de muestreo de sangre), ajustado por factores de confusión.
Tabla 3. Resultados del modelo de regresión lineal de efectos mixtos analizando la relación entre la concentración plasmática de marcadores inflamatorios, el tratamiento (LIDO vs. NO-LIDO) y la cinética (tiempo de muestreo de sangre), ajustado por factores de confusión.
3.2.2 Supervivencia vs. no supervivencia
La comparación de las concentraciones plasmáticas de citocinas al ingreso entre sobrevivientes y no sobrevivientes reveló concentraciones significativamente más altas de IL-6 en los no sobrevivientes. Los sobrevivientes tuvieron una mediana de concentración de IL-6 de 23 pg./mL (rango, 0–1413,8 pg/mL) y los no sobrevivientes tuvieron una mediana de concentración de IL-6 de 102 pg/mL (rango, 15,8–210,7 pg/mL; p = 0,043) (Figura 3).
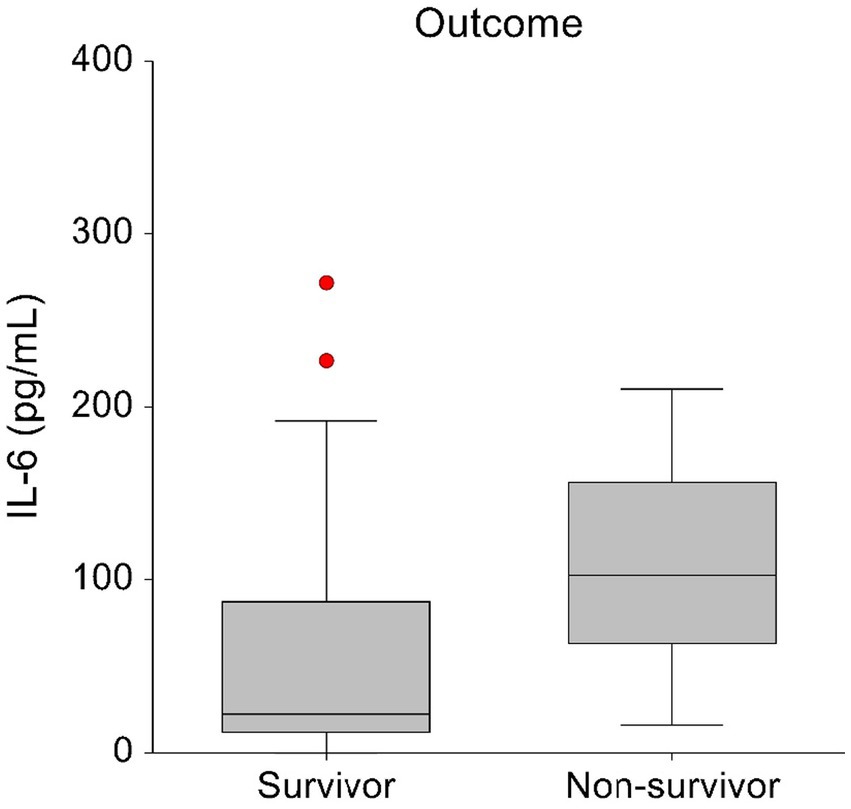 Figura 3. Diagramas de caja y bigotes que muestran las concentraciones iniciales de IL-6 en sangre en sobrevivientes (n = 28) y no sobrevivientes (n = 7). El cuadro central representa los valores dentro del rango del cuartil inferior al superior (percentil 25 a 75). Para mejorar la claridad visual, se ha excluido de este gráfico a un superviviente con una concentración de IL-6 T0 de 1413,84 pg/ml.
Figura 3. Diagramas de caja y bigotes que muestran las concentraciones iniciales de IL-6 en sangre en sobrevivientes (n = 28) y no sobrevivientes (n = 7). El cuadro central representa los valores dentro del rango del cuartil inferior al superior (percentil 25 a 75). Para mejorar la claridad visual, se ha excluido de este gráfico a un superviviente con una concentración de IL-6 T0 de 1413,84 pg/ml.
3.3 Concentraciones de lactato en sangre
Las concentraciones de lactato sanguíneo al ingreso entre el grupo LIDO y el grupo NO-LIDO no revelaron diferencias significativas en ningún momento (Tabla 1).
3.4 MANZANArápido puntuación y SIRS
En T0, el 89% de los perros (31/35) fueron clasificados como portadores de SRIS. No se encontraron diferencias significativas entre el grupo LIDO y el grupo NO-LIDO. No hay diferencias significativas en el ingreso de APPLErápido entre el grupo LIDO y el grupo NO-LIDO (Tabla 1).
3.5 Efectos adversos de la lidocaína
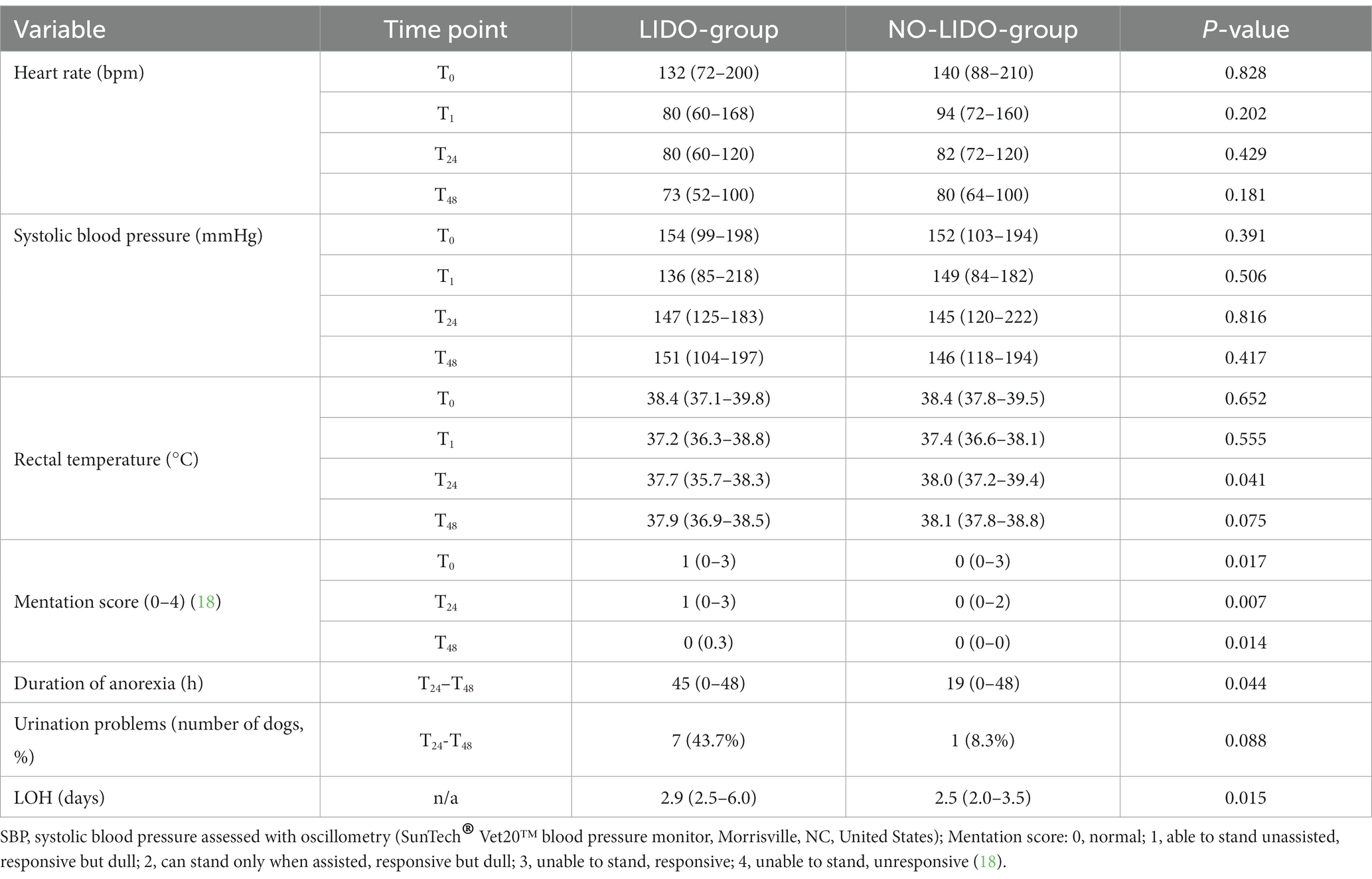
En la Tabla 4 se presentan los parámetros evaluados para detectar posibles efectos adversos de la lidocaína. No se encontraron efectos sobre la frecuencia cardíaca y la presión arterial sistólica. La lidocaína se asoció con una temperatura corporal significativamente más baja en T24 (p = 0,041). Además, los perros del grupo LIDO revelaron una duración prolongada significativa de la anorexia (p = 0,043) y una LOH significativamente más larga (p = 0,013) (Figura 3). La puntuación de la mentación en el grupo LIDO fue consistentemente más alta que en el grupo NO-LIDO en todos los puntos de tiempo evaluados En cuanto a la micción, el 36,8% de los perros machos (7/19) y el 11,1% de las perras (1/9) demostraron problemas para orinar durante el período postquirúrgico. En concreto, el 43,7% de los perros (7/16) del grupo LIDO (6 machos y 1 hembra) y el 8,3% de los perros (1/12) del grupo NO-LIDO (1 macho) tuvieron dificultad para orinar (p = 0,088) (Figura 4).
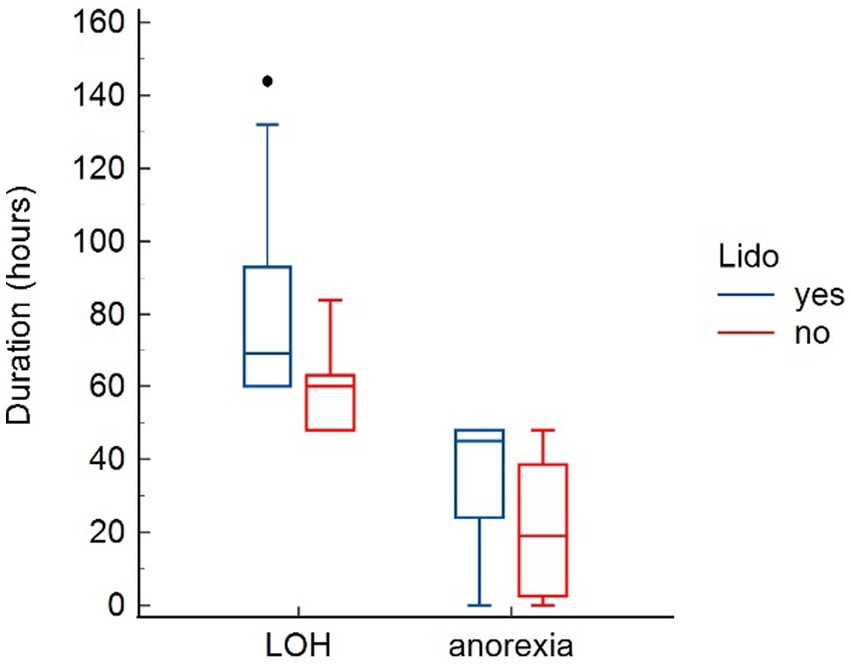 Figura 4. Diagramas de caja y bigotes que comparan la duración de la hospitalización (LOH) y la duración de la anorexia entre el grupo LIDO y NO-LIDO. El grupo LIDO está representado por barras azules (izquierda) y el grupo NO-LIDO por barras rojas (derecha). El cuadro central indica el rango intercuartílico (percentil 25 a 75) con la mediana representada por la línea media. Los valores atípicos se representan como puntos individuales.
Figura 4. Diagramas de caja y bigotes que comparan la duración de la hospitalización (LOH) y la duración de la anorexia entre el grupo LIDO y NO-LIDO. El grupo LIDO está representado por barras azules (izquierda) y el grupo NO-LIDO por barras rojas (derecha). El cuadro central indica el rango intercuartílico (percentil 25 a 75) con la mediana representada por la línea media. Los valores atípicos se representan como puntos individuales.
4 Discusión
El vólvulo de dilatación gástrica se considera un ejemplo clásico de inflamación sistémica no infecciosa, con IRI y presunta «hipercitocinemia» como factores principales que conducen al cuadro clínico de SRIS, daño e insuficiencia orgánica (3). En perros con GDV, se encontró que los marcadores de daño celular e inflamación, como el ADN libre de células, el grupo de alta movilidad box-1 y la procalcitonina, eran significativamente más altos en comparación con los perros sanos (7). Las concentraciones más altas de procalcitonina en el momento de la presentación se asociaron con la no supervivencia (7) y se encontró una diferencia significativa en la caja 1 del grupo de alta movilidad entre sobrevivientes y no sobrevivientes a lo largo del tiempo (8). En un estudio previo en perros GDV realizado en la misma institución que este, contrariamente a las expectativas iniciales, observamos un aumento en un número limitado de citoquinas proinflamatorias (por ejemplo, IL-6, IFN-γ, MCP-1) e IL-10 (9). El enfoque principal del presente estudio fue la determinación de las concentraciones plasmáticas de varias citocinas inflamatorias y PCR en perros con GDV con y sin IRC de lidocaína IV de 24 h. El estudio tuvo como objetivo investigar el posible efecto antiinflamatorio de la lidocaína en este contexto. Los resultados de los análisis comparativos indican que la administración de lidocaína no tuvo ningún impacto en los niveles plasmáticos de citocinas durante el período de estudio de 48 horas. Sin embargo, los perros que recibieron lidocaína tenían niveles plasmáticos significativamente más bajos de PCR a las 24 y 48 h después de la cirugía. En el modelo de regresión, encontramos una interacción significativa entre el efecto tiempo del muestreo y el tratamiento con lidocaína, en el sentido de un efecto antiinflamatorio, lo que significa que el aumento observado a lo largo del tiempo para PCR, IL10 y MCP-1 fue disminuido en el grupo LIDO. Esto es consistente con los resultados de los análisis comparativos para la PCR. Sin embargo, el modelo de regresión mostró un efecto adverso de la infusión de lidocaína sobre las concentraciones globales de IL10 y KC-like.
Las complicaciones más graves asociadas con el GDV surgen de la IRI y el SIRS, lo que conduce a la posterior insuficiencia orgánica múltiple. La lesión por isquemia-reperfusión es un proceso fisiopatológico complejo que involucra varias vías y sistemas corporales (5, 6). Estudios previos que involucraron dilatación gástrica experimental y GDV en perros e isquemia cardíaca en ratas revelaron la aparición de gastritis necrotizante, disfunción cardíaca y necrosis hepatocelular como consecuencias de la RII. Se evaluó la efectividad de diversos tratamientos para combatir la IRI, incluida la lidocaína (22-25). Además del efecto sobre la IRI, la lidocaína también exhibe efectos antiinflamatorios al inhibir la activación, adhesión, migración y producción de aniones superóxido de leucocitos, lo que podría atribuirse a su influencia directa en las funciones de los macrófagos y los granulocitos polimorfonucleares (26). Sus efectos antiinflamatorios pueden atribuirse además a la inhibición de la liberación de interleucinas, un componente de la cascada inflamatoria (26). En un metaanálisis reciente, que abarcó 21 estudios en los que participaron 1.254 pacientes y que comparó la eficacia de la lidocaína intravenosa perioperatoria con un placebo en individuos sometidos a cirugía electiva, la lidocaína intravenosa demostró una reducción significativa en los niveles de varias citocinas inflamatorias postoperatorias y PCR (27). Varios estudios en el campo de las cirugías abdominales y colorrectales en humanos han demostrado que la administración perioperatoria de lidocaína ha sido eficaz para reducir la liberación de citoquinas proinflamatorias inducidas por la cirugía, incluidas la IL-6 y la IL-8 (27, 28). En animales, se demostró una inhibición de la producción de citocinas inflamatorias después de la administración de lidocaína en caballos (29), ratones (30) y conejos (31) con endotoxemia o peritonitis séptica, respectivamente. Se han realizado pocos estudios clínicos en perros para evaluar los efectos antiinflamatorios y protectores de órganos de la lidocaína IV (4, 15, 17, 32). En una serie de casos retrospectiva de 75 perros diagnosticados de peritonitis séptica, se encontró que la administración de lidocaína (2 mg/kg, bolo intravenoso, seguido de un IRC de 50 μg/kg/min) durante la cirugía aumentó significativamente la probabilidad de supervivencia a corto plazo después del procedimiento quirúrgico. Esta mejora en la supervivencia se atribuyó a los efectos antiinflamatorios de la lidocaína (32). Bruchim et al. encontraron que en perros con GDV, la lidocaína IV (2 mg/kg, bolo IV, seguido de un IRC de 50 μg/kg/min) durante 24 h reduce el riesgo de arritmias cardíacas y lesión renal, lo que se atribuyó a la disminución de la IRI relacionada con el GDV y sus efectos antiinflamatorios (4). Por el contrario, la evaluación reciente de biomarcadores renales (p. ej., lipocalina asociada a gelatinasa de neutrófilos) en perros con GDV, realizada en la misma cohorte de GDV que este estudio, no mostró evidencia de renoprotección asociada a lidocaína (17). Los hallazgos del presente estudio también demuestran que la administración de lidocaína no resultó en una atenuación significativa de la expresión de citocinas, y no hubo diferencias en las tasas de mortalidad entre el grupo de lidocaína y el grupo control. Es importante mencionar que, dado que ambos estudios se realizaron en casi la misma cohorte de perros, no se puede descartar un mecanismo subyacente común. La diferencia observada en las concentraciones de inflamadorLas citocinas después de la lidocaína intravenosa entre humanos y perros con GDV podrían atribuirse a diferencias de especies o variaciones específicas de la enfermedad, o ambas. Los perros y los humanos pueden tener diferentes características fisiológicas e inmunológicas, lo que posiblemente afecte la eficacia de la lidocaína como fármaco antiinflamatorio. Además, el GDV tiene vías inflamatorias únicas que pueden no responder a la lidocaína como en otras afecciones. Además, el estudio actual solo midió el efecto sobre los marcadores inflamatorios, no sobre la IRI. Sin embargo, observamos concentraciones significativamente más bajas de PCR postquirúrgica en perros que recibieron lidocaína (9). Se reconoce que la proteína C reactiva, una de las principales proteínas de fase aguda en perros, se eleva después de la cirugía y su producción es desencadenada por citoquinas proinflamatorias, como la IL-6 (33). Los datos previos indican que en condiciones hiperagudas la PCR sérica es normal (p. ej., perros con GDV y traumatismos) pero aumenta durante las primeras horas de hospitalización (9, 34). Sobre la base de la diferencia en las concentraciones de PCR entre los dos grupos de nuestro estudio, se puede suponer un efecto antiinflamatorio de la lidocaína. Es necesario realizar más investigaciones para dilucidar los mecanismos específicos y las posibles citocinas alternativas implicadas en la acción antiinflamatoria de la lidocaína en el GDV.
En el estudio de Bruchim et al., se descubrió que los perros a los que se les administró un IRC de lidocaína de 24 h tuvieron una incidencia notablemente menor de arritmias cardíacas en comparación con los que no lo hicieron (12% vs. 38%) (4). En la presente investigación, la prevalencia global de arritmia ventricular fue del 16%, lo cual es comparativamente bajo (p. ej., hasta el 42% en estudios previos) (35, 36). Tres perros asignados inicialmente al grupo NO-LIDO tuvieron que ser excluidos debido a una arritmia ventricular que requirió tratamiento con lidocaína. Los autores del presente estudio no pudieron probar estadísticamente un efecto cardioprotector de la lidocaína-IRC, que se debe al bajo número total de arritmias ventriculares, pero la lidocaína probablemente previno las arritmias ventriculares en el grupo LIDO.
Un objetivo secundario del estudio fue la evaluación de los efectos secundarios de la lidocaína. El uso de lidocaína como parte de estrategias analgésicas multimodales en el entorno perioperatorio es controvertido en términos de eficacia y seguridad (12, 37). En las personas, las náuseas, la somnolencia, el mareo, el tinnitus y la bradicardia se describieron como efectos secundarios después de las dosis clínicas (37). En perros, se describen depresión, ataxia, temblores musculares, náuseas, vómitos (generalmente transitorios) y efectos cardíacos (14, 38). En el presente estudio, los perros del grupo LIDO tuvieron una duración significativamente más larga de anorexia, alteración mental, temperatura corporal más baja en T24 y una LOH más larga. Las náuseas y la anorexia son efectos secundarios reconocidos de la lidocaína en perros, y su aparición depende de la dosis administrada (39, 40). Lo más probable es que este efecto secundario indeseable se resuelva mediante la reducción de la dosis. Además, se debe considerar la administración concomitante de antieméticos en perros que reciben ICR de lidocaína. En el presente estudio, no se administraron antieméticos durante el período de estudio. La puntuación inicial de mentación más alta observada en el grupo LIDO antes del inicio de la terapia con lidocaína hace que la interpretación de las puntuaciones de mentación en T24 y T48 sea un desafío. Es posible que el grupo LIDO fuera casualmente más sensible al efecto sedante. Sin embargo, en T24, se observó un letargo significativo en el grupo LIDO. Un efecto sedante leve a moderado dependiente de la dosis de lidocaína en perros está bien descrito en la literatura (38, 39, 41). Los autores del presente estudio creen que el deterioro observado en la mentación probablemente estuvo relacionado con la lidocaína. Este efecto sedante puede suponer un inconveniente, especialmente durante la fase postoperatoria de la cirugía gastrointestinal, ya que puede limitar la movilidad de los pacientes, comprometer su capacidad para proteger sus vías respiratorias y aumentar el riesgo de neumonía por aspiración. Los autores no tienen una explicación para la hipotermia observada en T24 y no se encontró una explicación plausible en la literatura (42). La hipotermia puede atribuirse al efecto depresivo, aunque otros parámetros cardiovasculares como la frecuencia cardíaca y la presión arterial se mantienen dentro de los límites normales. Aunque no fue significativo, más perros (principalmente machos) en el grupo LIDO tuvieron problemas con la micción (p. ej., micción infructuosa a pesar de la ayuda y, posteriormente, agrandamiento de la vejiga urinaria que requirió cateterismo urinario). Los autores especulan que la depresión y la debilidad asociadas con el tratamiento con lidocaína podrían ser responsables de la incapacidad de levantarse y salir a orinar. Para garantizar la comodidad de los perros que reciben lidocaína intravenosa continua, es esencial implementar un control regular de la vejiga urinaria y realizar un cateterismo urinario cuando sea necesario. La LOH fue mayor en el grupo LIDO, que se describió anteriormente (15). Lo más probable es que esto se deba a los efectos secundarios descritos de la lidocaína en nuestro estudio (anorexia, retención de orina y alteración de la mentalidad), que podrían haber provocado un retraso en el alta de los animales.
El estudio actual tiene limitaciones. En primer lugar, la falta de un diseño ciego y controlado con placebo en nuestro estudio podría introducir sesgos en varios aspectos, sobre todo porque ciertos resultados, como los efectos adversos, son algo subjetivos. A pesar de que la lidocaína se utiliza de forma rutinaria en el protocolo de tratamiento de la GDV de la institución del autor, su inclusión puede haber prolongado la duración de la anestesia en el grupo LIDO y puede tener una evaluación sesgada de los efectos adversos. La utilización de un control con placebo habría permitido la uniformidad en todos los procedimientos. Además, también observamos el tiempo transcurrido entre el ingreso y la cirugía, y la duración de la cirugía como los factores de confusión más importantes que influyen en el ajuste de los modelos de regresión. De hecho, el tiempo total necesario para el manejo clínico puede afectar sustancialmente los lapsos entre el punto de tiempo de muestreo T0 (ingreso) y T1 (inmediatamente después de la cirugía), así como la cinética de la respuesta inflamatoria. Por lo tanto, es posible que los puntos de tiempo de muestreo no sean completamente comparables entre perros, especialmente T1. Esta diferencia debería desvanecerse con el tiempo y afecta en menor medida a la interpretación de T24 y T48. La duración prolongada de la anestesia en el grupo tratado podría haber disminuido los posibles efectos beneficiosos de la lidocaína. El efecto del tiempo de la anestesia no fue tan importante como los otros tiempos. En tercer lugar, la exclusión de 3 perros del grupo NO-LIDO (debido a una arritmia ventricular clínicamente relevante) puede introducir un sesgo potencial que no se puede descartar por completo. La causa precisa de la arritmia en estos perros no se comprende bien, pero es plausible que los perros más gravemente afectados hayan sido excluidos del análisis. En cuarto lugar, aunque la eutanasia intraoperatoria en cuatro perros se realizó únicamente debido a cambios severos en la pared gástrica y necrosis, no podemos descartar por completo la posibilidad de que la eutanasia pueda haber introducido un sesgo en el análisis de resultados de nuestro estudio. Existe la posibilidad teórica de que algunos de estos perros podrían haber sobrevivido si no hubieran sido sacrificados. Por último, dado el tamaño limitado de la muestra, es importante reconocer que no se puede descartar la posibilidad de errores de tipo I y II.
En conclusión, la administración de lidocaína no tuvo ningún impacto en los niveles plasmáticos de citocinas durante el período de estudio de 48 h, pero se encontraron concentraciones de PCR significativamente más bajas en T24 y T48. Se necesitan más datos sobre este tema para aclarar definitivamente si la lidocaína tiene realmente un efecto antiinflamatorio específico. Los perros que recibieron lidocaína mostraron un deterioro significativo de la mentalidad, un período prolongado de anorexia y una hospitalización más prolongada en comparación con los perros sin lidocaína. El efecto secundario potencial debe sopesarse cuidadosamente con los presuntos efectos positivos de la lidocaína.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Experimentación con Animales de la Oficina Federal Veterinaria de Suiza (número de registro BE 69/17). Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
AB: Análisis formal, Investigación, Escritura – borrador original. AL: Escritura, revisión y edición. BH: Escritura, revisión y edición. LP: Escritura – revisión y edición. K-NA: Redacción – revisión y edición, Conceptualización, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Supervisión, Validación, Visualización, Redacción – borrador original. CD: Análisis formal, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo financiero de la Asociación Suiza de Medicina de Pequeños Animales, Lucretia Watkins, Hostig 6, CH-8132 Hinteregg y la Fundación Albert Heim, sekretariat@albert-heim-stiftung.ch (Número de proyecto: 133).
Reconocimientos
Los autores agradecen a Jelena Mirkovitch (Departamento de Investigación Clínica y Salud Pública Veterinaria, Facultad de Vetsuisse, Universidad de Berna, Berna, Suiza) por su ayuda con los análisis ELISA de citocinas y a Beatriz Vidondo (Instituto de Salud Pública Veterinaria, Facultad de Vetsuisse, Universidad de Berna) por su ayuda con los análisis estadísticos.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1287844/full#supplementary-material
Abreviaturas
APPLE, Evaluación fisiológica y de laboratorio del paciente agudo; CRI: Infusión de velocidad constante; PCR: proteína C reactiva; GDV: dilatación gástrica-vólvulo; IFN-γ, Interferón gamma; IL-6: Interleucina 6; IL-7, interleucina 7; IL-8, interleucina 8; IL-10, interleucina 10; IL-15, interleucina 15; IL-18, interleucina 18; IRI: lesión por isquemia-reperfusión; Similar a KC, similar a quimiotáctica de queratinocitos; MCP-1: Proteína quimiotáctica 1 de monocitos; SIRS, Síndrome de respuesta inflamatoria sistémica.
Notas
Referencias
1. Bruchim, Y, y Kelmer, E. Manejo postoperatorio de perros con dilatación gástrica y vólvulo. El mejor compañero Anim Med. (2014) 29:81–5. doi: 10.1053/j.tcam.2014.09.003
2. Rosselli, D. Información actualizada sobre dilatación gástrica y vólvulo y gastropexia en perros. Vet Clin North Am Small Anim Pract. (2022) 52:317–37. doi: 10.1016/j.cvsm.2021.11.004
3. Sharp, CR y Rozanski, EA. Efectos cardiovasculares y sistémicos de la dilatación gástrica y el vólvulo en perros. El mejor compañero Anim Med. (2014) 29:67–70. doi: 10.1053/j.tcam.2014.09.007
4. Bruchim, Y, Itay, S, Shira, BH, Kelmer, E, Sigal, Y, Itamar, A, et al. Evaluación del tratamiento con lidocaína sobre la frecuencia de arritmias cardíacas, lesión renal aguda y tiempo de hospitalización en perros con vólvulo de dilatación gástrica. J Vet Emerg Crit Care. (2012) 22:419–27. doi: 10.1111/j.1476-4431.2012.00779.x
5. McMichael, M. Isquemia-lesión por reperfusión: evaluación y tratamiento, parte II. J Vet Emerg Crit Care. (2004) 14:242–52. doi: 10.1111/j.1476-4431.2004.04005.x
6. McMichael, M, y Moore, R. Fisiopatología de la lesión por isquemia-reperfusión, parte I. J Vet Emerg Crit Care. (2004) 14:231–41. doi: 10.1111/j.1476-4431.2004.04004.x
7. Troia, R, Giunti, M, Calipa, S y Goggs, R. ADN libre de células, grupo de alta movilidad Box-1 y concentraciones de procalcitonina en perros con síndrome de dilatación gástrica-vólvulo. Front Vet Sci. (2018) 5:67. doi: 10.1371/journal.pone.0204216
8. Uhrikova, I, Rauserova-Lexmaulova, L, Rehakova, K, Scheer, P, y Doubek, J. Proteína C reactiva y grupo de alta movilidad caja 1 en perros con dilatación gástrica y vólvulo. J Vet Emerg Crit Care. (2015) 25:488–94. doi: 10.1111/vec.12324
9. Brunner, A, Schuller, S, Hettlich, B, Marti, E, Lehmann, A, Peters, LM, et al. Cinética de citocinas plasmáticas, angiopoyetina-2 y proteína C reactiva en perros con vólvulo de dilatación gástrica. Front Vet Sci. (2021) 8:652479. doi: 10.3389/fvets.2021.652479
10. Vaughan Williams, EM. La relevancia de la electrofisiología celular para la clínica en la clasificación de las acciones antiarrítmicas. J Cardiovasc Pharmacol. (1992) 20:S1-7. doi: 10.1097/00005344-199220002-00002
11. Barletta, M, y Reed, R. Anestésicos locales: farmacología y preparaciones especiales. Vet Clin North Am Small Anim Pract. (2019) 49:1109–25. doi: 10.1016/j.cvsm.2019.07.004
12. Foo, I, Macfarlane, AJR, Srivastava, D, Bhaskar, A, Barker, H, Knaggs, R, et al. El uso de lidocaína intravenosa para el dolor postoperatorio y la recuperación: declaración de consenso internacional sobre eficacia y seguridad. Anestesia. (2021) 76:238–50. doi: 10.1111/anae.15270
13. Cassuto, J, Sinclair, R, y Bonderovic, M. Propiedades antiinflamatorias de los anestésicos locales y sus implicaciones clínicas actuales y potenciales. Acta Anaesthesiol Scand. (2006) 50:265–82. doi: 10.1111/j.1399-6576.2006.00936.x
14. Cassutto, B, y Gfeller, R. Uso de lidocaína intravenosa para prevenir la lesión por reperfusión y el posterior síndrome de disfunción orgánica múltiple. J Vet Emerg Crit Care. (2003) 13:137–48. doi: 10.1046/j.1435-6935.2003.00080.x
15. Buber, T, Saragusty, J, Ranen, E, Epstein, A, Bdolah-Abram, T, y Bruchim, Y. Evaluación del tratamiento con lidocaína y los factores de riesgo de muerte asociados con la dilatación gástrica y el vólvulo en perros: 112 casos (1997-2005). J Am Vet Med Assoc. (2007) 230:1334–9. doi: 10.2460/javma.230.9.1334
16. Sargeant, JM, Ruple, A, Selmic, LE, y O’Connor, AM. Los estándares de notificación de ensayos en mascotas (PetSORT): explicación y elaboración. Front Vet Sci. (2023) 10:1137781. doi: 10.3389/fvets.2023.1137781
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Lehmann, A, Brunner, A, Marti, E, Francey, T, Steinbach, S, Peters, LM, et al. Concentraciones y cinética de biomarcadores renales en perros con dilatación-vólvulo gástrico con y sin lidocaína intravenosa de 24 h. Front Vet Sci. (2023) 10:1115783. doi: 10.3389/fvets.2023.1115783
18. Hayes, G, Mathews, K, Doig, G, Kruth, S, Boston, S, Nykamp, S, et al. La puntuación de evaluación fisiológica y de laboratorio del paciente agudo (APPLE): un sistema de estratificación de la gravedad de la enfermedad para perros hospitalizados. J Veterinario Pasante Med. (2010) 24:1034–47. doi: 10.1111/j.1939-1676.2010.0552.x
19. Hauptman, JG, Walshaw, R, y Olivier, NB. Evaluación de la sensibilidad y especificidad de los criterios diagnósticos de sepsis en perros. Cirugía veterinaria. (1997) 67:393–397. doi: 10.1111/j.1532-950x.1997.tb01699.x
20. Bates, D, Mächler, M, y Bolker, B. Ajuste de modelos lineales de efectos mixtos utilizando lme4. J Stat Software. (2015) 67:1–48. doi: 10.18637/jss.v067.i01
21. Akaike, H. Teoría de la información y una extensión del principio de máxima verosimilitud En: E Parzen, K Tanabe y G Kitagawa, editores. Artículos seleccionados de Hirotugu Akaike. Springer Nueva York: Nueva York, NY (1998). 199–213.
22. Badylak, SF, Lantz, GC y Jeffries, M. Prevención de la lesión por reperfusión en vólvulo-vólvulo de dilatación gástrica inducida quirúrgicamente en perros. Am J Vet Res. (1990) 51:294–9.
23. Lantz, GC, Badylak, SF, Hiles, MC y Arkin, TE. Tratamiento de la lesión por reperfusión en perros con dilatación-vólvulo gástrico inducida experimentalmente. Am J Vet Res. (1992) 53:1594–8.
24. Pfeiffer, CJ, Keith, JC Jr y April, M. Localización topográfica de lesiones gástricas y papel clave de la concentración plasmática de bicarbonato en perros con dilatación gástrica inducida experimentalmente. Am J Vet Res. (1987) 48:262–7.
25. Pfeiffer, CJ, Keith, JC, Cho, CH, DeRolf, S, Pfeiffer, DC, y Misra, HP. Organoprotección gástrica y cardíaca por lidocaína. Acta Physiol colgado. (1989) 73:129–36.
26. Lee, IW, y Schraag, S. El uso de lidocaína intravenosa en medicina perioperatoria: aspectos anestésicos, analgésicos e inmunomoduladores. J Clin Med. (2022) 11:3543. doi: 10.3390/jcm11123543
27. Castro, I, Carvalho, P, Vale, N, Monjardino, T, y Mourão, J. Efectos antiinflamatorios sistémicos de la lidocaína intravenosa en pacientes quirúrgicos: una revisión sistemática y metaanálisis. J Clin Med. (2023) 12:3772. doi: 10.3390/jcm12113772
28. Herroeder, S, Pecher, S, Schonherr, ME, Kaulitz, G, Hahnenkamp, K, Friess, H, et al. La lidocaína sistémica acorta la duración de la estancia hospitalaria después de la cirugía colorrectal: un ensayo doble ciego, aleatorizado y controlado con placebo. Ann Surg. (2007) 246:192–200. doi: 10.1097/SLA.0b013e31805dac11
29. Peiro, JR, Barnabe, PA, Cadioli, FA, Cunha, FQ, Lima, VMF, Mendonça, VH, et al. Efectos de la infusión de lidocaína durante la endotoxemia experimental en caballos. J Veterinario Pasante Med. (2010) 24:940–8. doi: 10.1111/j.1939-1676.2010.0555.x
30. Gallos, G, Jones, DR, Nasr, SH, Emala, CW y Lee, HT. Los anestésicos locales reducen la mortalidad y protegen contra la disfunción renal y hepática en la peritonitis séptica murina. Anestesiología. (2004) 101:902–11. doi: 10.1097/00000542-200410000-00015
31. Taniguchi, T, Shibata, K, Yamamoto, K, Mizukoshi, Y y Kobayashi, T. Efectos de la administración de lidocaína sobre la hemodinámica y las respuestas de citoquinas a la endotoxemia en conejos. Crit Care Med. (2000) 28:755–9. doi: 10.1097/00003246-200003000-00025
32. Bellini, L, y Seymour, CJ. Efecto de la infusión intraoperatoria de lidocaína a tasa constante sobre la supervivencia a corto plazo de perros con peritonitis séptica: 75 casos (2007-2011). J Am Vet Med Assoc. (2016) 248:422–9. doi: 10.2460/javma.248.4.422
33. Christensen, MB, Eriksen, T y Kjelgaard-Hansen, M. Proteína C reactiva: marcador cuantitativo de trauma quirúrgico y complicaciones postquirúrgicas en perros: una revisión sistemática. Acta Vet Scand. (2015) 57:71. doi: 10.1186/s13028-015-0164-5
34. Gommeren, K, Desmas, I, García, A, Bauer, N, Moritz, A, Roth, J, et al. Concentraciones de citoquinas inflamatorias y proteína C reactiva en perros con síndrome de respuesta inflamatoria sistémica. J Vet Emerg Crit Care. (2018) 28:9–19. doi: 10.1111/vec.12685
35. Aona, BD, Rush, JE, Rozanski, EA, Cunningham, SM, Sharp, CR y Freeman, LM. Evaluación de las concentraciones de ecocardiografía y biomarcadores cardíacos en perros con vólvulo de dilatación gástrica. J Vet Emerg Crit Care. (2017) 27:631–7. doi: 10.1111/vec.12667
36. Muir, WW. Dilatación-vólvulo gástrico en el perro, con énfasis en arritmias cardíacas. J Am Vet Med Assoc. (1982) 180:739–42.
37. Weibel, S, Jelting, Y, Pace, NL, Helf, A, Eberhart, LHJ, Hahnenkamp, K, et al. Infusión perioperatoria continua de lidocaína intravenosa para el dolor postoperatorio y la recuperación en adultos. Sistema de la Base de Datos Cochrane Rev. (2018) 2018:CD009642. doi: 10.1002/14651858.CD009642.pub3
38. MacDougall, LM, Hethey, JA, Livingston, A, Clark, C, Shmon, CL y Duke-Novakovski, T. Efectos antinociceptivos, cardiopulmonares y sedantes de cinco tasas de infusión intravenosa de lidocaína en perros conscientes. Veterinario Anaesth Analg. (2009) 36:512–22. doi: 10.1111/j.1467-2995.2009.00480.x
39. Johnson, V, Burgess, B, Morley, P, Bragg, R, Avery, A y Dow, S. Comparación de las respuestas de citoquinas entre perros con sepsis y perros con anemia hemolítica mediada por el sistema inmunitario. Veterinario Inmunol Inmunopatíaco. (2016) 180:15–20. doi: 10.1016/j.vetimm.2016.08.010
40. Mackenzie, G, Barnhart, M, Kennedy, S, DeHoff, W, y Schertel, E. Estudio retrospectivo de los factores que influyen en la supervivencia tras la cirugía del síndrome de dilatación gástrica-vólvulo en 306 perros. J Am Anim Hosp Assoc. (2010) 46:97–102. doi: 10.5326/0460097
41. Tsai, TY, Chang, SK, Chou, PY y Yeh, LS. Comparación de los efectos postoperatorios entre la infusión de lidocaína, meloxicam y su combinación en perras sometidas a ovariohisterectomía. Veterinario Anaesth Analg. (2013) 40:615–22. doi: 10.1111/vaa.12064
Palabras clave: canino, torsión gástrica, citoquinas, inflamación sistémica, lidocaína
Cita: Brunner A, Lehmann A, Hettlich B, Peters LM, Doras CJ y Adamik K-N (2024) Concentraciones de biomarcadores inflamatorios en perros con vólvulo de dilatación gástrica con y sin lidocaína intravenosa de 24 horas. Frente. Vet. Sci. 10:1287844. doi: 10.3389/fvets.2023.1287844
Recibido: 02 de septiembre de 2023; Aceptado: 20 de noviembre de 2023;
Publicado: 04 Enero 2024.
Editado por:
Massimo Giunti, Universidad de Bolonia, Italia
Revisado por:
Rene Doerfelt, Universidad Ludwig-Maximilians de Múnich, Alemania
Corrin John Boyd, Universidad Murdoch, Australia
Derechos de autor © 2024 Brunner, Lehmann, Hettlich, Peters, Doras y Adamik. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Katja-Nicole Adamik, katja.adamik@unibe.ch
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía