El escenario de la patología pulmonar durante la infección por PRRSV-1
El escenario de la patología pulmonar durante la infección por PRRSV-1
 Inés Ruedas-Torres1,2*†
Inés Ruedas-Torres1,2*†  José María Sánchez-Carvajal2*†
José María Sánchez-Carvajal2*†  Francisco Javier Saguero1
Francisco Javier Saguero1  Francisco José Pallarés2
Francisco José Pallarés2  Librado Carrasco2
Librado Carrasco2  Enric Mateu3
Enric Mateu3  Jaime Gómez-Laguna2
Jaime Gómez-Laguna2  Irene Magdalena Rodríguez-Gómez2
Irene Magdalena Rodríguez-Gómez2- 1Agencia de Seguridad Sanitaria del Reino Unido (UKHSA Porton Down), Salisbury, Reino Unido
- 2Departamento de Anatomía y Patología Comparada y Toxicología, Grupo de Patología e Inmunología (UCO-PIG), UIC Zoonosis y Enfermedades Emergentes ENZOEM, Campus de Excelencia Agroalimentario Internacional (CeiA3), Facultad de Veterinaria, Universidad de Córdoba, Córdoba, España
- 3Departamento de Sanidad y Anatomía Animal, Universidad Autónoma de Barcelona, Barcelona, España
El síndrome respiratorio y reproductivo porcino (PRRS) es una de las enfermedades infecciosas económicamente más importantes para la industria porcina en todo el mundo. La enfermedad se notificó por primera vez en 1987 y se volvió endémica en muchos países. Desde entonces, se han notificado varias veces brotes provocados por cepas de alta virulencia en Asia, América y Europa. La neumonía intersticial, caracterizada microscópicamente por el engrosamiento de los tabiques alveolares, es la lesión distintiva del PRRS. Sin embargo, también se observan bronconeumonía supurativa y neumonía proliferativa y necrotizante, especialmente cuando se trata de una cepa virulenta. Esto plantea la cuestión de si la infección por ciertas cepas da lugar a una sobreestimulación de la respuesta proinflamatoria y si existe algún grado de correlación entre la cepa implicada y un patrón particular de lesión pulmonar. Por lo tanto, es de interés conocer cómo se modula la respuesta inflamatoria en estos casos debido a la interacción entre los factores virus y huésped. Esta revisión proporciona una visión general de la patología macroscópica, microscópica y molecular de las cepas de PRRSV-1 en el pulmón, haciendo hincapié en las diferencias entre cepas de diferente virulencia.
1 Introducción
Más de 30 años después de su primera descripción (1, 2), el síndrome reproductivo y respiratorio porcino (PRRS) sigue siendo una de las mayores amenazas para la industria porcina en todo el mundo (3-6). Recientemente se ha estimado que las pérdidas económicas atribuibles al PRRS en Europa son de 74.181 € por explotación y año, lo que corresponde a una media de 255 € por cerda y año (5). Para la industria porcina estadounidense, la enfermedad cuesta alrededor de 664 millones de dólares anuales según el estudio realizado por Holtkamp et al. (6). A pesar de los muchos intentos de la comunidad científica por desarrollar una vacuna eficaz en las últimas décadas, las vacunas disponibles actualmente no son totalmente protectoras y solo inducen una protección parcial contra cepas heterólogas (7).
El agente etiológico de esta enfermedad son los virus del PRRS (PRRSV-1 y PRRSV-2), virus de ARN monocatenario positivos clasificados dentro del género Betaarterivirus (8, 9). Las primeras cepas europeas y americanas aisladas a principios de los años 90, la cepa Lelystad (LV) y la cepa VR-2332, respectivamente (2, 10), que mostraban solo alrededor del 60% de similitud nucleotídica, llevaron a considerar dos genotipos diferentes del virus, denominados europeo o genotipo-1 (también conocido como PRRSV-1) y americano o genotipo-2 (también conocido como PRRSV-2) (11). Recientemente, el Comité Internacional de Taxonomía de Virus los reclasificó como dos especies virales diferentes, Betaarterivirus suid-1 (PRRSV-1) y Betaarterivirus suid-2 (PRRSV-2) (9). Hasta ahora se han identificado cuatro subtipos de PRRSV-1: el subtipo 1 paneuropeo, los subtipos 2 y 3 de Europa del Este y el subtipo 4 con cepas de Letonia y Bielorrusia (12-15). El PRRSV-2 es prevalente principalmente en América y Asia con al menos nueve linajes bien definidos (16). Tras el aislamiento de las cepas Lena y SU1-bel, el aumento de la virulencia de las cepas de PRRSV-1 se asoció rápidamente a las incluidas en el subtipo 3 (17, 18). Sin embargo, otras cepas pertenecientes al subtipo-1, como PR40, AUT15-33 y Rosalía, o al subtipo-2, como la cepa BOR59, mostraron también una alta virulencia (19-23).
Las manifestaciones clínicas dependen principalmente de la virulencia de la cepa PRRSV-1, aunque otros factores, como las prácticas de manejo, el estado inmunológico del rebaño, la genética de los cerdos o las coinfecciones son importantes. Recientemente se han revisado las principales características y diferencias en signos clínicos, lesiones, tropismo y parámetros inmunológicos entre cepas clásicas (moderadamente virulentas) y altamente virulentas del PRRSV (24). Las cepas moderadamente virulentas de PRRSV-1 a menudo están involucradas en brotes de fallas reproductivas en cerdas y enfermedades respiratorias en cerdos en crecimiento (2, 10). Las manifestaciones del fracaso reproductivo pueden variar desde abortos esporádicos hasta tormentas abortivas, principalmente en el tercer trimestre de gestación, junto con partos prematuros, partos de lechones muertos, lechones momificados o lechones débiles (2, 10, 18). En lechones de todas las edades, el virus ataca a los macrófagos alveolares, produciendo cierto grado de neumonía intersticial e impactando secundariamente en el aumento de peso corporal (19, 25, 26). Las infecciones experimentales han demostrado que los animales moderadamente virulentos infectados por PRRSV-1 suelen mostrar letargo, fiebre leve y signos respiratorios de leves a moderados, como disnea leve, pero suelen recuperarse por completo al cabo de unos días (17-19, 21, 26, 27).
Cuando una cepa virulenta de PRRSV-1 está causando la infección, el patrón clínico cambia sustancialmente. La alta mortalidad (>20%), la fiebre alta prolongada (≥41 °C) y la enfermedad respiratoria grave son hallazgos comunes de todas las infecciones por cepas virulentas del PRRSV-1 (17, 19-21, 24, 25, 27-30). La cianosis en las orejas y la cola, la hiperemia conjuntival y la diarrea también son manifestaciones clínicas observadas en cerdos infectados con cepas virulentas de PRRSV-1 (19-21, 30). Además, las manifestaciones clínicas de las cepas virulentas de PRRSV-1 aparecen precozmente después de la infección, incluso después de 1 día, con un inicio rápido de la enfermedad (18, 19, 21, 27).
La aparición de estas virulentas cepas de PRRSV-1 durante las últimas dos décadas en Europa, como las cepas Lena y SU1-bel en Bielorrusia (18), la cepa PR40 en Italia (19) o Rosalía en España (22, 23), ha suscitado especial preocupación en la industria porcina y en la comunidad investigadora, debido a las elevadas tasas de morbilidad y mortalidad, así como a la gravedad de las lesiones. principalmente en el pulmón (18, 19). Además, se ha prestado especial atención a la potencial tasa de mutación y recombinación entre cepas endémicas y emergentes, lo que puede dar lugar a un escenario con la aparición de brotes potencialmente devastadores, como el provocado por la cepa Rosalía en España en 2020, que resultó de la recombinación de diferentes aislamientos de PRRSV-1 (22, 23).
El PRRSV posee un tropismo celular restringido para las células CD163 (31, 32). CD163 se expresa principalmente en células del linaje monocitos/macrófagos, especialmente en el macrófago alveolar pulmonar (PAM), lo que convierte al pulmón en su principal órgano diana (33). Esta revisión analiza en profundidad la patología del PRRS en el pulmón, haciendo hincapié en los diferentes patrones de lesión pulmonar observados entre las cepas de PRRSV-1 y la posible interacción entre el virus y los factores del huésped.+
2 lesiones pulmonares por PRRSV-1
2.1 Lesiones pulmonares macroscópicas tras infección por PRRSV-1
2.1.1 Neumonía intersticial como lesión pulmonar macroscópica inducida por PRRSV
Los cerdos de engorde moderadamente virulentos infectados por PRRSV-1 suelen mostrar lesiones leves en el pulmón que a menudo pasan desapercibidas, pero en el peor de los casos, los cerdos desarrollan neumonía intersticial de leve a moderada (2, 10, 29).
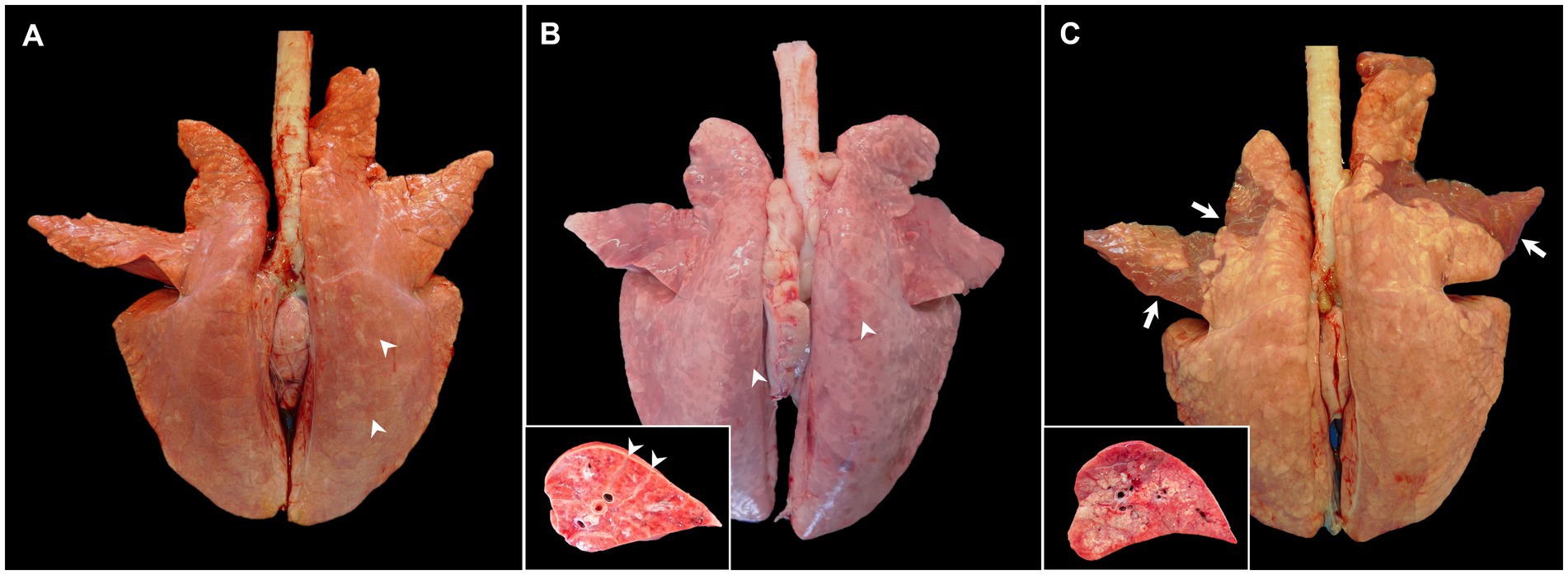
El hallazgo macroscópico clave en animales moderadamente virulentos infectados por PRRSV-1 es la neumonía intersticial que, macroscópicamente, se caracteriza por un parénquima pulmonar moteado de color canela a rojo y gomoso que no colapsa después de abrir la cavidad torácica, visible principalmente en el lóbulo caudal (Figura 1A, puntas de flecha), que puede ser particularmente grave en casos de cepas virulentas, como la cepa Rosalía (Figura 1B, puntas de flecha) (2, 10, 17, 19, 25–28, 34, 35). El sistema de puntuación macroscópica desarrollado por Halbur et al. (36) se ha utilizado con frecuencia para evaluar la gravedad y distribución de las lesiones pulmonares en el PRRS, que considera cada lóbulo pulmonar en la vista dorsal y ventral dentro de todo el parénquima pulmonar (17, 25-28, 34, 37). Según el estudio realizado por Morgan et al. (17) en cerdos infectados con la cepa prototípica LV de PRRSV-1, la neumonía intersticial es visible a partir del día 7 post-infección (pi); Sin embargo, no se suelen detectar lesiones macroscópicas a 1 mes PI en estos animales infectados (17, 28, 34, 38). Se ha descrito un aumento gradual de la consistencia pulmonar en los lóbulos craneales y medios con la progresión de la enfermedad a lo largo del tiempo, lo que indica focos de consolidación debido a infecciones bacterianas secundarias (27, 37). Macroscópicamente, las áreas consolidadas estaban hinchadas, firmes y rojizas, y claramente delimitadas del resto del pulmón. En el momento de la sección, a veces se podía observar exudado mucopurulento en las vías respiratorias, todo ello indicativo de bronconeumonía supurativa (39).
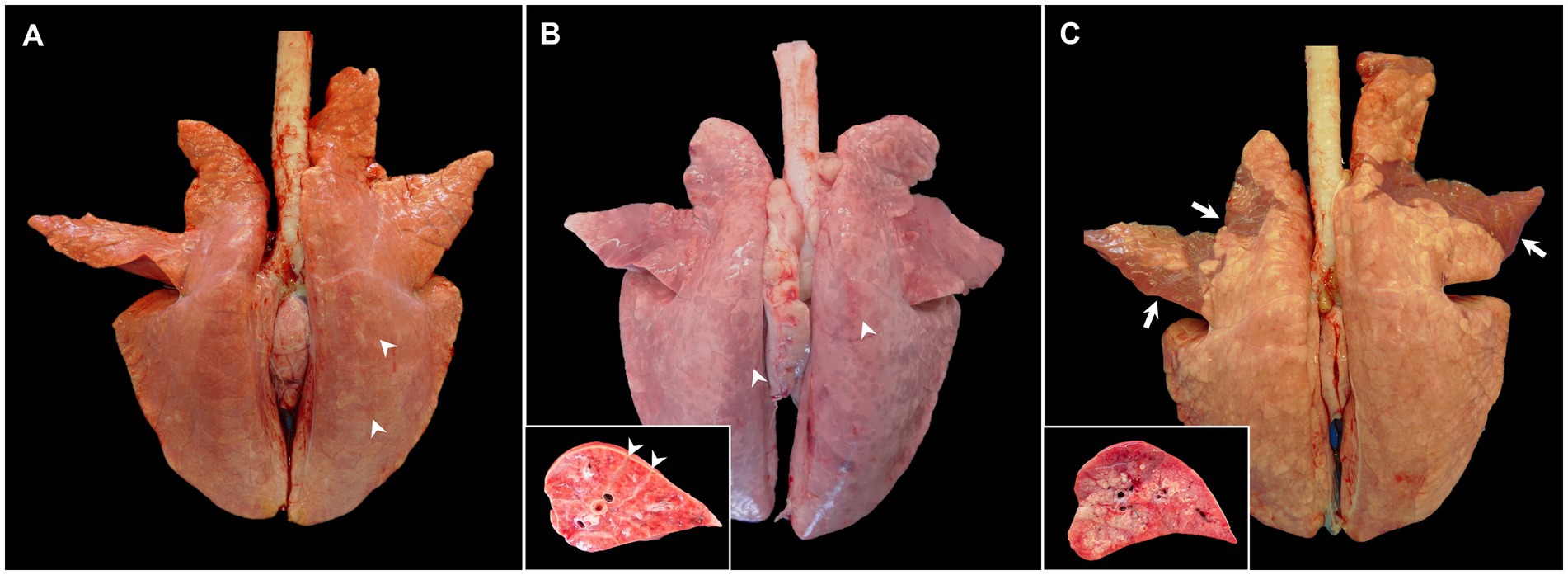 Figura 1. Imágenes macroscópicas de pulmones de cerdos infectados experimentalmente con cepas de PRRSV-1 de diferente virulencia y sacrificados a 8-10 dpi. (A) Pulmón de un cerdo infectado con la cepa 3249 que muestra áreas moteadas de color canela (puntas de flecha) y que no colapsa después de la extracción de la cavidad torácica. (B) Pulmón de un cerdo infectado con la cepa Rosalía altamente virulenta que muestra un marcado patrón moteado rojizo y firmeza difusa, especialmente en la cara dorsal del pulmón (puntas de flecha). El recuadro muestra un mayor aumento y sección de uno de los lóbulos afectados. Las puntas de flecha muestran edema intersticial. (C) Pulmón de un cerdo infectado con Lena que presenta áreas bronceadas y textura gomosa, pero también áreas ventrales irregulares de consolidación de los lóbulos craneales y medios del pulmón (flechas). El recuadro muestra un mayor aumento y sección del área de consolidación de uno de los lóbulos afectados.
Figura 1. Imágenes macroscópicas de pulmones de cerdos infectados experimentalmente con cepas de PRRSV-1 de diferente virulencia y sacrificados a 8-10 dpi. (A) Pulmón de un cerdo infectado con la cepa 3249 que muestra áreas moteadas de color canela (puntas de flecha) y que no colapsa después de la extracción de la cavidad torácica. (B) Pulmón de un cerdo infectado con la cepa Rosalía altamente virulenta que muestra un marcado patrón moteado rojizo y firmeza difusa, especialmente en la cara dorsal del pulmón (puntas de flecha). El recuadro muestra un mayor aumento y sección de uno de los lóbulos afectados. Las puntas de flecha muestran edema intersticial. (C) Pulmón de un cerdo infectado con Lena que presenta áreas bronceadas y textura gomosa, pero también áreas ventrales irregulares de consolidación de los lóbulos craneales y medios del pulmón (flechas). El recuadro muestra un mayor aumento y sección del área de consolidación de uno de los lóbulos afectados.
2.1.2 Bronconeumonía supurativa como lesión acompañante de neumonía intersticial en animales virulentos infectados por PRRSV-1
En general, las infecciones por PRRSV de campo suelen ir acompañadas de complicaciones bacterianas secundarias, que se transmiten a bronconeumonía supurativa. Sin embargo, cuando una cepa virulenta de PRRSV-1 infecta al cerdo en condiciones experimentales, las lesiones pulmonares macroscópicas son más marcadas, mostrando una neumonía intersticial difusa grave que, a diferencia de las cepas moderadamente virulentas de PRRSV-1, se acompaña más comúnmente de focos de consolidación desde etapas muy tempranas de la infección, como resultado de una bronconeumonía supurativa en áreas craneoventrales (Figura 1C, flechas y recuadro) (18-20, 25, 27, 28, 30, 34, 37). Según diferentes estudios experimentales, en las infecciones causadas por cepas virulentas, la bronconeumonía supurativa ya está presente en momentos muy tempranos (3 días pi, dpi) y suele culminar entre la primera y la segunda semana pi (wpi), exhibiendo puntuaciones de patología bruta más altas que los pulmones de animales moderadamente virulentos infectados por PRRSV-1 según el sistema de puntuación desarrollado por Halbur et al. (17, 27, 34 y 38). Por ejemplo, en el estudio realizado por Morgan et al. (17), los pulmones de animales infectados con la virulenta cepa SU1-bel mostraron más de 20 puntos de diferencia con respecto a los infectados con la cepa LV a 7 dpi, debido a bronconeumonía secundaria (17). Curiosamente, las lesiones macroscópicas no fueron visibles en los pulmones de los lechones infectados con SU1-bel a 1 mes pi (17) y tampoco se observaron en el pulmón de los lechones infectados con Lena (38). Por el contrario, Frydas et al. (37) mostraron un porcentaje de lesión macroscópica similar entre la cepa PRRSV-1 07V063 de baja virulencia y la cepa 13V091, considerada como cepa virulenta de PRRSV-1 (subtipo-1) (37). Las discrepancias entre estos y otros estudios podrían estar asociadas a las diferencias entre cada configuración experimental, incluyendo la dosis y la vía de infección, el paso y el volumen del inóculo, la edad de los cerdos y sus antecedentes genéticos. El peso pulmonar en relación con el peso corporal es un indicador potencial de inflamación pulmonar y fue utilizado por Weesendorp et al. (40) para evidenciar diferencias entre los pulmones de animales infectados con Lena y LV. Los pulmones de los cerdos infectados con Lena mostraron un mayor peso pulmonar relativo en comparación con los de los cerdos infectados con LV y los animales de control no infectados a 1 wpi (40). Este peso pulmonar relativo disminuyó drásticamente a los 46 dpi en el grupo infectado por Lena (40), lo que podría indicar una resolución parcial de la lesión pulmonar inducida.
Aunque la bronconeumonía se asocia con la presencia de bacterias patógenas, no siempre se ha demostrado su aislamiento cuando está presente en animales infectados por PRRSV. Se reportó consolidación pulmonar severa en animales infectados con cepas 07 V063 y 13 V091, sin embargo, no se aislaron patógenos bacterianos específicos (37). Por otro lado, la participación de Staphylococcus hyicus fue demostrada por cultivo bacteriano convencional en un brote que tuvo lugar en Austria en 2015, causado por la cepa virulenta AUT15-33, en animales que mostraron bronconeumonía supurativa así como coinfección por circovirus porcino tipo 2 (PCV2) (20). Se han descrito otras lesiones pulmonares macroscópicas en el pulmón de animales virulentos infectados por PRRSV-1. Por ejemplo, Karniychuk et al. (18) informaron de pleuroneumonía fibrinosa en 7 de cada 10 cerdos infectados con la virulenta cepa PRRSV-1 Lena. Se aislaron Arcanobacterium pyogenes (actualmente Trueperella pyogenes) y Streptococcus suis en 2 de estos animales, mientras que no se detectaron virus, incluidos PCV2 o virus de la influenza porcina (VIS) (18). También se observó pleuresía en 2 de los 8 lechones infectados con Lena en el estudio publicado por Renson et al. (29). También se han descrito lesiones macroscópicas secundarias a neumonía intersticial y bronconeumonía, como áreas multifocales a coalescentes de atelectasia, congestión y edema intersticial y alveolar en otras infecciones virulentas por PRRSV-1 (19). La alteración de las barreras físicas y de la respuesta inmune por parte de varios virus, como PRRSV, PCV2 o SIV, y Mycoplasma hyopneumoniae, entre otros, que son agentes primarios del complejo de enfermedades respiratorias porcinas (PRDC), es plausible para desempeñar un papel en la coinfección con bacterias endémicas secundarias (Pasteurella multocida, Bordetella bronchiseptica, Gläesserella parasuis, etc.) (41, 42) o la proliferación de microorganismos comensales pulmonares. Por lo tanto, los estudios posteriores deben abordar una caracterización adecuada de las bacterias patógenas implicadas en la patogénesis de la bronconeumonía que se observa con frecuencia de forma concomitante en las infecciones virulentas por PRRSV-1 en condiciones experimentales y de campo.
2.2 Lesiones microscópicas inducidas por cepas de PRRSV-1
2.2.1 Características histopatológicas de la neumonía intersticial inducida por PRRSV
Microscópicamente, la neumonía intersticial ha sido reportada como la lesión distintiva durante el PRRS, caracterizada por hipertrofia e hiperplasia multifocal de neumocitos tipo II y engrosamiento de los tabiques alveolares con infiltración de células mononucleares, principalmente linfocitos y macrófagos (36, 39, 43). La exudación alveolar de los macrófagos suele estar presente y los neumocitos hiperplásicos pueden formar una capa continua de epitelio cuboidal que recubre el alvéolo (39, 44). Por lo general, el epitelio bronquiolar de los animales infectados con PRRSV no se ve afectado, un hallazgo que podría apuntar en la dirección de otras infecciones virales, como el VIS (39). La neumonía intersticial inducida por PCV2 muestra un patrón granulomatoso con células sincitiales, linfocitos y células polimorfonucleares infiltradas en los septos alveolares (39, 44). Sin embargo, estos hallazgos no siempre son evidentes y puede ser difícil encontrar una distinción clara entre la infección por PCV2 y PRRSV. En los casos no complicados de PRRSV-1, suele observarse una neumonía intersticial multifocal a extensa de leve a moderada (Figura 2A), que aumenta en gravedad junto con la virulencia de la cepa, y ocasionalmente encontrando sincitia también en esos casos (Figura 2B, recuadro) (17, 19, 21, 27, 38). Halbur et al. (36) describieron un sistema de puntuación para evaluar la neumonía intersticial que se utiliza ampliamente en estudios de patología porcina y para ambas especies de PRRSV (27, 28, 34). Brevemente, ninguna lesión microscópica se puntúa como 0, la neumonía intersticial leve se puntúa como 1 (Figura 3A), la neumonía intersticial multifocal moderada se puntúa como 2 (Figura 3B), la neumonía intersticial difusa moderada se puntúa como 3 (Figura 3C) y la neumonía intersticial grave se puntúa como 4 (Figura 3D) (36). Se recomienda encarecidamente realizar una evaluación separada de cada lóbulo pulmonar, craneal, medio y caudal para evaluar la distribución de las lesiones, así como para evitar interpretaciones erróneas de los lóbulos pulmonares afectados por la bronconeumonía. De acuerdo con este sistema de puntuación, los pulmones de animales infectados con cepas virulentas de PRRSV-1, como las cepas SU1-bel o Lena, mostraron las lesiones más graves en comparación con las cepas de baja virulencia utilizadas en diferentes ensayos experimentales después de 1 wpi (27, 28, 34).
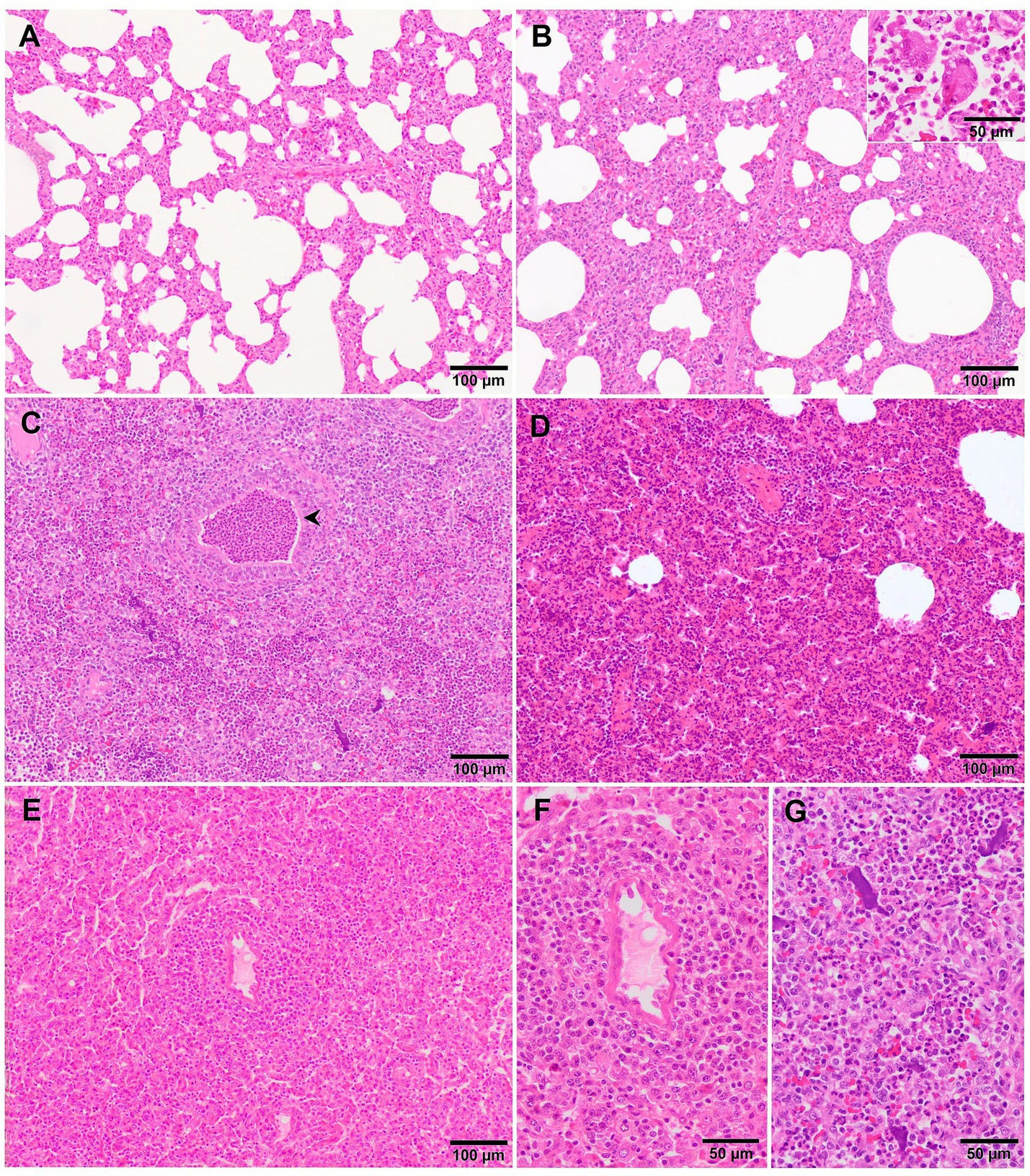 Figura 2. Imágenes microscópicas del pulmón de cerdos representativos infectados experimentalmente con cepas de PRRSV-1 de diferente virulencia y sacrificados a 8-10 dpi. (A) Engrosamiento leve de los tabiques alveolares debido a la mínima infiltración de macrófagos y linfocitos en el tejido pulmonar de un lechón infectado con la cepa 3249. (B) Engrosamiento moderado a severo de los tabiques alveolares debido a una marcada infiltración de células mononucleares con la presencia de un sincitio (recuadro) en el pulmón de un cerdo infectado por Lena. (C) Tejido pulmonar de un cerdo infectado por Lena que muestra, junto con el engrosamiento de los tabiques alveolares, neutrófilos degenerados dentro de la luz de los bronquiolos (punta de flecha) y alvéolos, así como restos celulares y agregados de cromatina libre (ver detalles «G«). (D) Engrosamiento moderado de los tabiques alveolares con infiltrado linfocítico e histiocítico perivascular característico junto con áreas de atelectasia moderada en el pulmón del cerdo infectado con SU1-bel. (E) Lesiones similares a las reportadas en «D» con marcada infiltración de macrófagos en los septos alveolares y atelectasia en el pulmón de un cerdo infectado con la cepa Rosalía. Ver «F» para detalles del infiltrado periarteriolar.
Figura 2. Imágenes microscópicas del pulmón de cerdos representativos infectados experimentalmente con cepas de PRRSV-1 de diferente virulencia y sacrificados a 8-10 dpi. (A) Engrosamiento leve de los tabiques alveolares debido a la mínima infiltración de macrófagos y linfocitos en el tejido pulmonar de un lechón infectado con la cepa 3249. (B) Engrosamiento moderado a severo de los tabiques alveolares debido a una marcada infiltración de células mononucleares con la presencia de un sincitio (recuadro) en el pulmón de un cerdo infectado por Lena. (C) Tejido pulmonar de un cerdo infectado por Lena que muestra, junto con el engrosamiento de los tabiques alveolares, neutrófilos degenerados dentro de la luz de los bronquiolos (punta de flecha) y alvéolos, así como restos celulares y agregados de cromatina libre (ver detalles «G«). (D) Engrosamiento moderado de los tabiques alveolares con infiltrado linfocítico e histiocítico perivascular característico junto con áreas de atelectasia moderada en el pulmón del cerdo infectado con SU1-bel. (E) Lesiones similares a las reportadas en «D» con marcada infiltración de macrófagos en los septos alveolares y atelectasia en el pulmón de un cerdo infectado con la cepa Rosalía. Ver «F» para detalles del infiltrado periarteriolar.
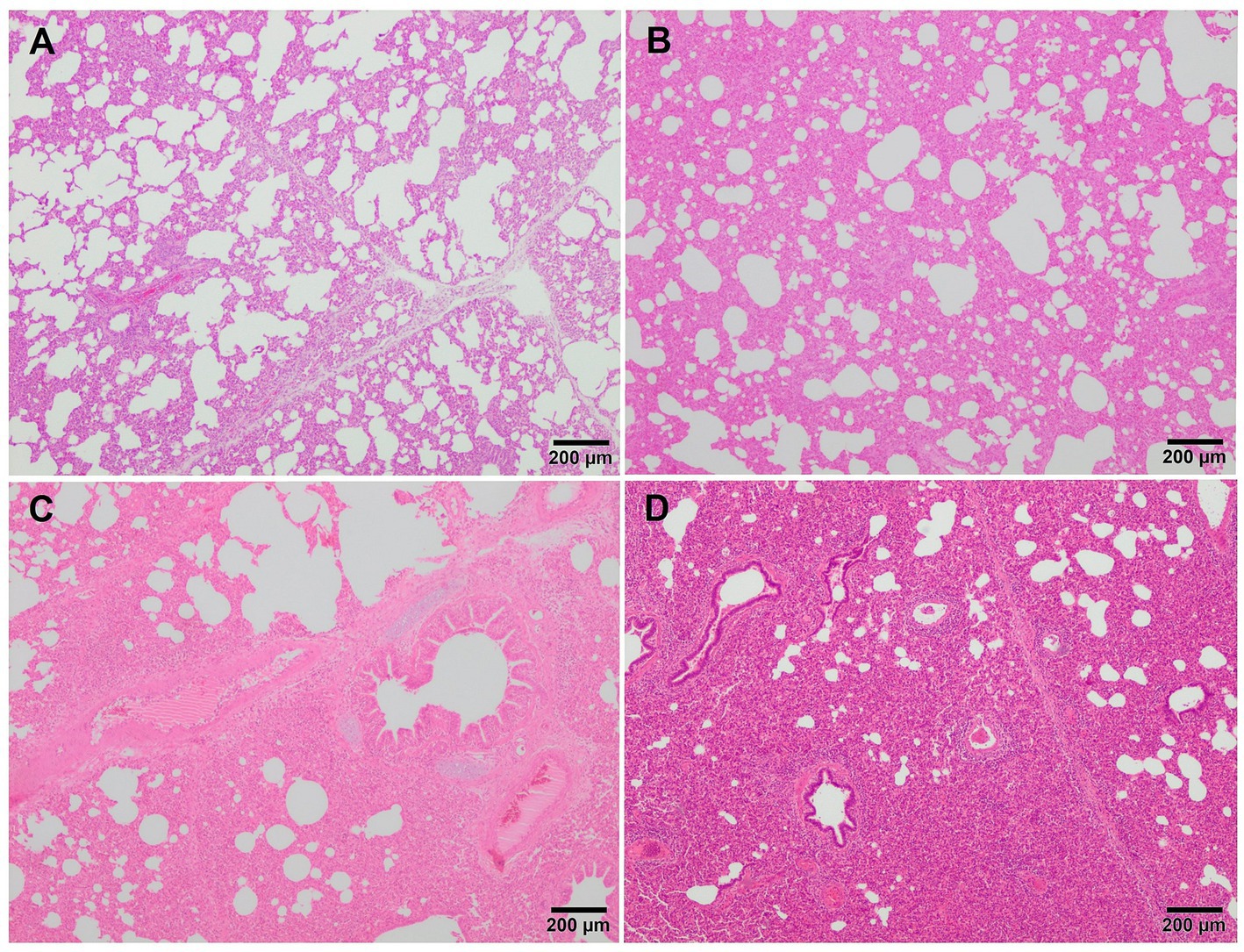 Figura 3. Imágenes microscópicas de una puntuación representativa de neumonía intersticial en cerdos infectados con PRRSV-1. (A) Puntuación 1, neumonía intersticial leve. Engrosamiento leve de los tabiques alveolares debido a la mínima infiltración de macrófagos y linfocitos en el tejido pulmonar de un lechón infectado con la cepa 3249. (B) Puntuación 2, neumonía intersticial moderada. Engrosamiento de las paredes alveolares debido a la infiltración moderada de macrófagos y linfocitos en el tejido pulmonar de un lechón infectado con la virulenta cepa Lena. (C) Puntuación 3, neumonía intersticial difusa moderada. Infiltración de macrófagos y linfocitos dispersos en el tejido pulmonar de un lechón infectado con la virulenta cepa Lena. (D) Puntuación 4, neumonía intersticial difusa grave en el tejido pulmonar de un lechón infectado con la virulenta cepa Lena.
Figura 3. Imágenes microscópicas de una puntuación representativa de neumonía intersticial en cerdos infectados con PRRSV-1. (A) Puntuación 1, neumonía intersticial leve. Engrosamiento leve de los tabiques alveolares debido a la mínima infiltración de macrófagos y linfocitos en el tejido pulmonar de un lechón infectado con la cepa 3249. (B) Puntuación 2, neumonía intersticial moderada. Engrosamiento de las paredes alveolares debido a la infiltración moderada de macrófagos y linfocitos en el tejido pulmonar de un lechón infectado con la virulenta cepa Lena. (C) Puntuación 3, neumonía intersticial difusa moderada. Infiltración de macrófagos y linfocitos dispersos en el tejido pulmonar de un lechón infectado con la virulenta cepa Lena. (D) Puntuación 4, neumonía intersticial difusa grave en el tejido pulmonar de un lechón infectado con la virulenta cepa Lena.
2.2.2 Características histopatológicas de la bronconeumonía supurativa en cepas virulentas de PRRSV-1
Aunque la neumonía intersticial es el sello distintivo de la infección por PRRSV, la presencia y proliferación de patógenos comensales específicos del microbioma pulmonar junto con infecciones bacterianas secundarias causan bronconeumonía supurativa, que se encuentra con frecuencia en animales virulentos infectados por PRRSV (Figura 2C) (20, 25, 27). La bronconeumonía supurativa se caracteriza por la presencia de abundantes granulocitos, macrófagos y restos celulares dentro de la luz de los bronquios, bronquiolos y alvéolos (39). Esto hizo necesaria la creación de un sistema de puntuación para evaluar esta lesión, si estaba presente (27). El sistema de puntuación estima la gravedad y distribución de la bronconeumonía supurativa de la siguiente manera: 0, sin lesiones microscópicas; 1, bronconeumonía leve (Figura 4A); 2, bronconeumonía multifocal moderada (Figura 4B); 3, bronconeumonía difusa moderada (Figura 4C); y 4, bronconeumonía grave (Figura 4D). Con este sistema de puntuación, las secciones pulmonares de los cerdos infectados con la virulenta cepa PRRSV-1 Lena mostraron una puntuación de 1 o 2 a los 6 dpi, mientras que los animales infectados con la cepa moderadamente virulenta 3249 alcanzaron estas puntuaciones 1 semana después (13 dpi) (27). Esta bronconeumonía supurativa suele ir acompañada de atelectasia secundaria, edema de los tabiques interlobulillares y dilatación de los vasos linfáticos (20, 27). La presencia de material fibrinoso en la pleura también se ha descrito como un hallazgo relacionado con la infección de los animales con la virulenta cepa PRRSV-1 Lena (Figura 5A) (18, 27).
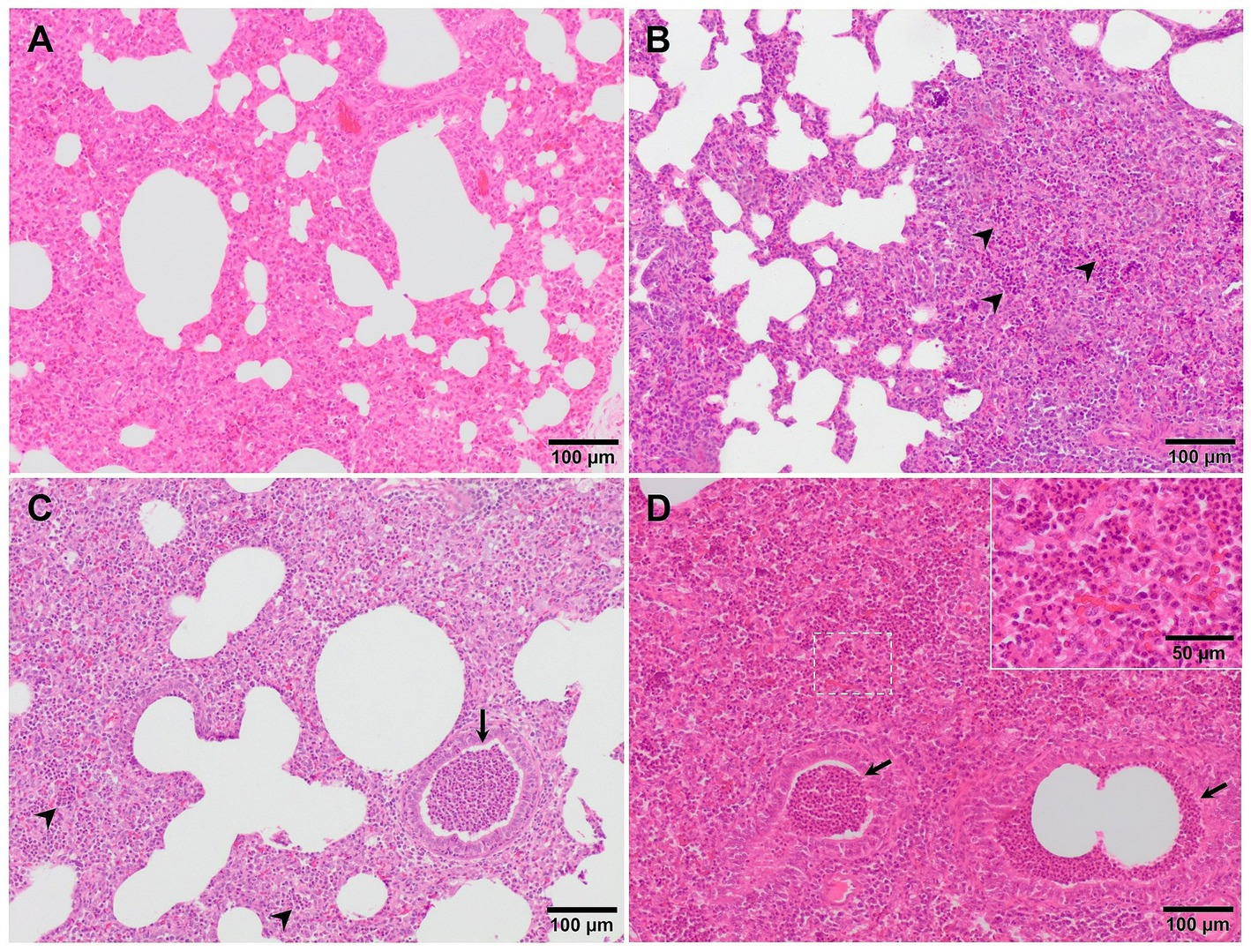 Figura 4. Imágenes microscópicas de una puntuación representativa de bronconeumonía supurativa en cerdos infectados con PRRSV-1. (A) Puntuación 1, bronconeumonía leve en el pulmón de 3249 animales infectados. Los granulocitos y macrófagos están presentes en los tabiques alveolares. (B) Puntuación 2, bronconeumonía multifocal moderada en el pulmón de un animal infectado con la cepa virulenta Lena. Un gran número de granulocitos (puntas de flecha) y macrófagos, junto con restos celulares se infiltran en las paredes alveolares. (C) Puntuación 3, bronconeumonía difusa moderada en el pulmón de un animal infectado con la cepa Lena. Granulocitos (puntas de flecha), macrófagos y restos celulares dentro de la luz de los bronquios, bronquiolos (flecha) y alvéolos. El recuadro muestra la infiltración de macrófagos y linfocitos y granulocitos dispersos. (D) Puntuación 4, bronconeumonía grave en el pulmón de un animal infectado con la cepa Lena. Las puntas de flecha y el recuadro muestran la infiltración de granulocitos dentro de los bronquiolos y los alvéolos, respectivamente.
Figura 4. Imágenes microscópicas de una puntuación representativa de bronconeumonía supurativa en cerdos infectados con PRRSV-1. (A) Puntuación 1, bronconeumonía leve en el pulmón de 3249 animales infectados. Los granulocitos y macrófagos están presentes en los tabiques alveolares. (B) Puntuación 2, bronconeumonía multifocal moderada en el pulmón de un animal infectado con la cepa virulenta Lena. Un gran número de granulocitos (puntas de flecha) y macrófagos, junto con restos celulares se infiltran en las paredes alveolares. (C) Puntuación 3, bronconeumonía difusa moderada en el pulmón de un animal infectado con la cepa Lena. Granulocitos (puntas de flecha), macrófagos y restos celulares dentro de la luz de los bronquios, bronquiolos (flecha) y alvéolos. El recuadro muestra la infiltración de macrófagos y linfocitos y granulocitos dispersos. (D) Puntuación 4, bronconeumonía grave en el pulmón de un animal infectado con la cepa Lena. Las puntas de flecha y el recuadro muestran la infiltración de granulocitos dentro de los bronquiolos y los alvéolos, respectivamente.
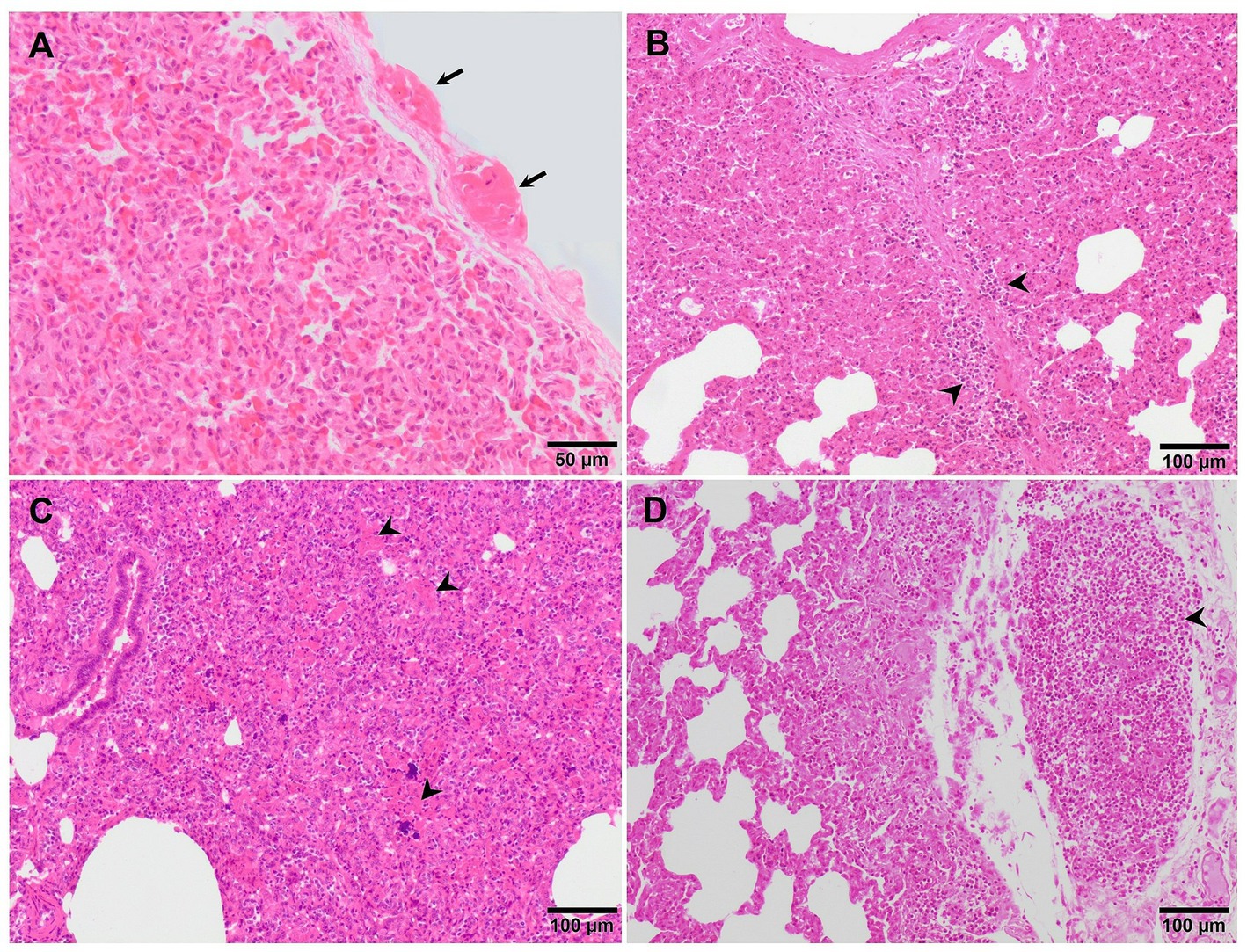 Figura 5. Imágenes microscópicas del pulmón de cerdos representativos infectados experimentalmente con la virulenta cepa Lena sacrificados a 8 dpi (A) y con la cepa Rosalía altamente virulenta y sacrificados a 10 (B,C) y 35 dpi (D). (A) Engrosamiento de la pleura debido a la presencia de fibrina (pleuritis fibrinosa). (B) Los tabiques alveolares están engrosados por macrófagos y linfocitos que también infiltran predominantemente los tabiques interlobulillares (puntas de flecha). (C) El pulmón es moderadamente atelectático, con hiperplasia de neumocitos tipo II y alvéolos rellenos por restos celulares necróticos (puntas de flecha), incluidos grupos basófilos de cromatina, compatibles con áreas proliferativas y necrosantes de neumonía. (D) Acumulación subpleural bien delimitada de linfocitos consistente con un órgano linfoide terciario.
Figura 5. Imágenes microscópicas del pulmón de cerdos representativos infectados experimentalmente con la virulenta cepa Lena sacrificados a 8 dpi (A) y con la cepa Rosalía altamente virulenta y sacrificados a 10 (B,C) y 35 dpi (D). (A) Engrosamiento de la pleura debido a la presencia de fibrina (pleuritis fibrinosa). (B) Los tabiques alveolares están engrosados por macrófagos y linfocitos que también infiltran predominantemente los tabiques interlobulillares (puntas de flecha). (C) El pulmón es moderadamente atelectático, con hiperplasia de neumocitos tipo II y alvéolos rellenos por restos celulares necróticos (puntas de flecha), incluidos grupos basófilos de cromatina, compatibles con áreas proliferativas y necrosantes de neumonía. (D) Acumulación subpleural bien delimitada de linfocitos consistente con un órgano linfoide terciario.
Se ha descrito picnosis multifocal y presencia de restos celulares en el intersticio septal y dentro de los alvéolos en lechones infectados con algunas cepas virulentas de PRRSV-1 (25, 27, 28) en asociación con muerte celular regulada (28). La presencia de grumos de cromatina libre (Figuras 2C,G) demostrada mediante tinción de Feulgen (Feulgen) se observó con frecuencia en animales infectados por Lelena y Rosalía con las puntuaciones más altas de bronconeumonía (27) (Figura 6A). Además, este material amorfo fue identificado como TUNEL+−, una técnica para detectar la fragmentación del ADN (Figura 6B) y la caspasa-3 escindida− (Caspasa verdugo, principal marcador de apoptosis) (Figura 6C), lo que sugiere que estos grupos pueden estar asociados con trampas extracelulares de neutrófilos (TNE) activadas dentro de focos de bronconeumonía supurativa (45). La formación de NETs en el contexto de cepas virulentas de PRRSV podría desempeñar un papel en la prevención de la propagación de microorganismos o en el crecimiento bacteriano (45).
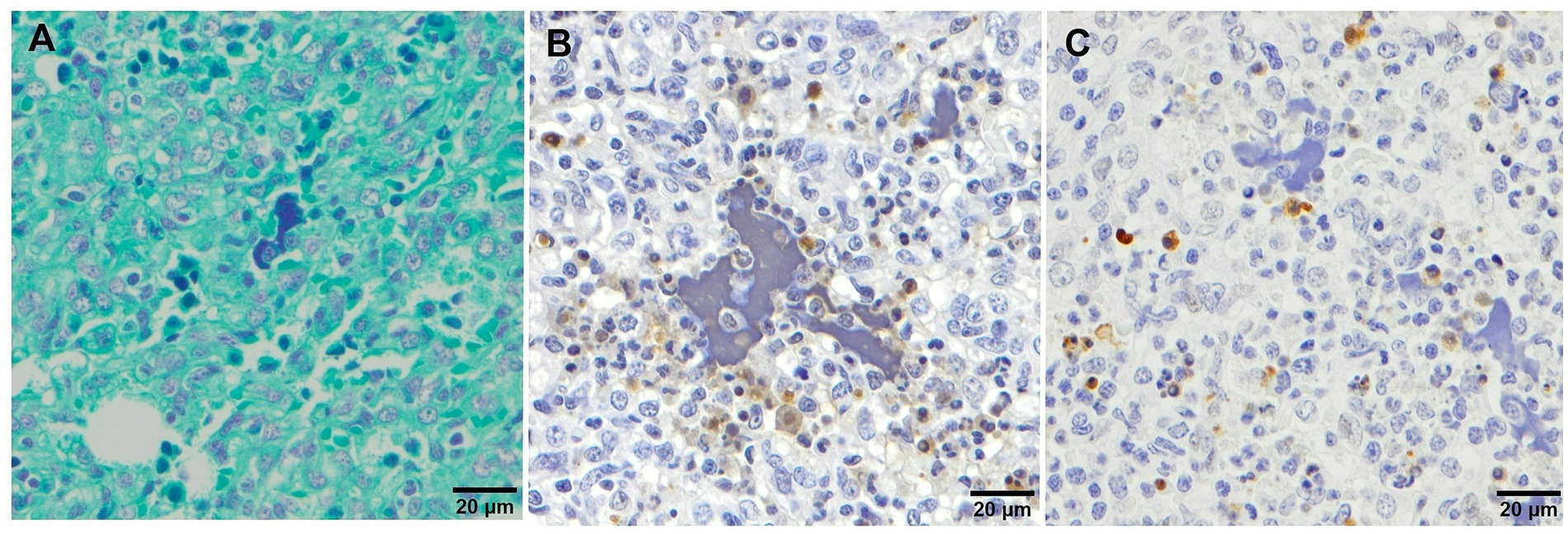 Figura 6. Imágenes microscópicas de cúmulos de cromatina libre demostradas mediante tinción inmunohistoquímica de Feulgen (A), TUNEL (B) y caspasa-3 (C) escindida en el tejido pulmonar de animales virulentos infectados con Lena con bronconeumonía grave. (A) Tinción de Feulgen que demuestra la presencia de grumos de cromatina libre. (B) tinciones de TUNEL y (C) caspasa-3 escindida que muestran la negatividad de los grumos de cromatina libre.+
Figura 6. Imágenes microscópicas de cúmulos de cromatina libre demostradas mediante tinción inmunohistoquímica de Feulgen (A), TUNEL (B) y caspasa-3 (C) escindida en el tejido pulmonar de animales virulentos infectados con Lena con bronconeumonía grave. (A) Tinción de Feulgen que demuestra la presencia de grumos de cromatina libre. (B) tinciones de TUNEL y (C) caspasa-3 escindida que muestran la negatividad de los grumos de cromatina libre.+
2.2.3 Cinética de los cambios microscópicos en el pulmón de animales infectados por el PRRSV-1
Mientras que en los animales infectados experimentalmente con cepas moderadamente virulentas del PRRSV las lesiones son notables alrededor del primer wpi (27, 28, 34), en los infectados con cepas virulentas del PRRSV-1 las lesiones microscópicas se desarrollan a partir de los 3 dpi, alcanzando las puntuaciones máximas entre el primer y el segundo wpi (27, 28, 34, 38). A 1 mes de la infección, la neumonía intersticial solo está presente ocasionalmente y es de intensidad leve (28, 34, 38). Balka et al. (25) observaron una disminución significativa en la presencia de restos celulares intraalveolares y en el número de neutrófilos intraalveolares a lo largo del curso de la infección (de 10 a 21 dpi) con la virulenta cepa de 205817 alemán junto con una extensa proliferación de neumocitos tipo II, que se asoció con la resolución de la lesión (25). En este sentido, los neumocitos de tipo II han sido pobremente caracterizados a lo largo de la infección por PRRSV y podrían representar una célula diana para entender la progresión de la patogenia de esta enfermedad.
2.2.4 Otros patrones microscópicos de lesiones pulmonares asociados a la infección por PRRSV-1
Dependiendo de la intensidad del proceso patológico, pueden observarse otras lesiones prominentes, como neumonía proliferativa y necrotizante (PNP), extensas áreas de hemorragia y diversos grados de vasculitis, caracterizadas por un prominente infiltrado mononuclear perivascular (19, 34, 46, 47). La PNP es una forma grave de neumonía intersticial, caracterizada por dos características histológicas principales: (i) inflamación intersticial linfohistiocítica con hipertrofia y proliferación de neumocitos tipo II y (ii) presencia de grupos de células inflamatorias necróticas dentro de los espacios alveolares (44, 46, 48, 49). En un estudio experimental reciente, varios lechones infectados con la cepa Rosalía desarrollaron lesiones de PNP tan pronto como 10 dpi (Figuras 5B, C) (50). Sin embargo, además del PRRSV, otros agentes etiológicos como la PCV2 o el VIS suelen estar implicados en este patrón lesional (44, 46, 48, 49).
Además, se han descrito otros patrones lesionales en estudios experimentales realizados con cepas virulentas de PRRSV-1. Por ejemplo, Stadejek et al. (21) describieron un patrón de «panal» principalmente en animales infectados con la virulenta cepa BOR59 del PRRSV-1, aislada en Bielorrusia en 2009. Esta lesión, observada en animales sacrificados a 17 y 22 dpi, consistía en áreas de proliferación de fibroblastos y fibrosis del parénquima pulmonar, lo que daba al pulmón una apariencia de pérdida de su estructura (21). Además, en estos animales infectados, se observó un alto número de eosinófilos, que a veces estaban desgranulados, principalmente en áreas de fibrosis pulmonar severa y alrededor de los vasos sanguíneos (21). Asociada a estas lesiones, también se describió hiperplasia de folículos linfoides, siendo especialmente notable en aquellos animales infectados con la cepa virulenta PRRSV-1 BOR59 en comparación con las cepas moderadamente virulentas evaluadas: 18794 e ILI6 (21). Del mismo modo, Weesendorp et al. (38), describieron una mayor puntuación de infiltrado de células peribronquiolares, formadas principalmente por macrófagos y monocitos a 7 dpi en pulmones de animales infectados con la cepa virulenta de PRRSV-1 Lena en comparación con las otras dos cepas moderadamente virulentas utilizadas en su estudio. Sin embargo, esta lesión no fue tan patente en el estudio realizado con la misma cepa por Rodríguez-Gómez et al. (27), lo que podría deberse a las diferencias en el diseño experimental entre ambos estudios, como la dosis infecciosa o la edad de los animales. Se observó un patrón perivascular de células inflamatorias, principalmente linfohistiocíticas, en pulmones de animales infectados con otras cepas virulentas de PRRSV-1 como Lena, SU1-bel y Rosalía (Figuras 2D-F) a partir de los 3 dpi, siendo especialmente marcado y evidente en los pulmones de cerdos infectados por Rosalía. Sin embargo, este hallazgo también se ha observado a partir de los 8 ppp en cepas moderadamente virulentas, como la cepa 3249 (25, 34, 45, 50). Curiosamente, y a diferencia de lo descrito previamente para cepas virulentas, se observaron con frecuencia órganos linfoides terciarios en los pulmones de lechones infectados por Rosalía a 35 dpi (Figura 5D) (50). Estas estructuras se han relacionado con respuestas inmunes robustas a la inflamación local en sitios de lesión tisular (51), lo que indica un proceso pulmonar en curso, lejos de lo descrito para otras cepas virulentas de PRRSV-1 en las que después de 1 mes pi, se estaba produciendo la resolución de la neumonía (25, 40).
3 Mecanismos patogénicos de la lesión pulmonar en el PRRS
3.1 Papel de los macrófagos
El sistema fagocítico mononuclear pulmonar comprende PAMs, macrófagos pulmonares intersticiales y, en varias especies, incluyendo cerdos, macrófagos pulmonares intravasculares (PIMs) (52). Mientras que la función principal de los PAM es establecer una primera línea de defensa fagocítica contra las infecciones microbianas, los macrófagos septales (macrófagos intersticiales y PIM) están más especializados en la liberación de citoquinas proinflamatorias que contribuyen a regular la homeostasis pulmonar (26, 53-55). Las PAM son las principales células diana del PRRSV, aunque las PIM y los macrófagos intersticiales también son susceptibles a la infección (26, 33, 56). En este sentido, el inmunomarcaje de la proteína PRRSV-N se observa principalmente en las PAMs y en menor medida en las PIMs y macrófagos intersticiales (Figura 7A), con grupos de macrófagos de la proteína PRRSV-N rodeados de cuerpos apoptóticos dentro de áreas de bronconeumonía en lechones infectados con cepas virulentas (Figura 7B). Los PAM expresan altos niveles del receptor eliminador CD163 (56, 57), que desempeña un papel crucial en la internalización y desensamblaje del PRRSV al interactuar con las proteínas virales GP2 y GP4 (32, 58, 59). La replicación del PRRSV en PAMs, PIMs y macrófagos intersticiales conduce a un deterioro en sus funciones fundamentales, incluyendo: (a) la fagocitosis, que está influenciada por la interacción entre el virus y el receptor CD169, (b) la presentación de antígenos y (c) la producción de citoquinas proinflamatorias (54, 60-64).+
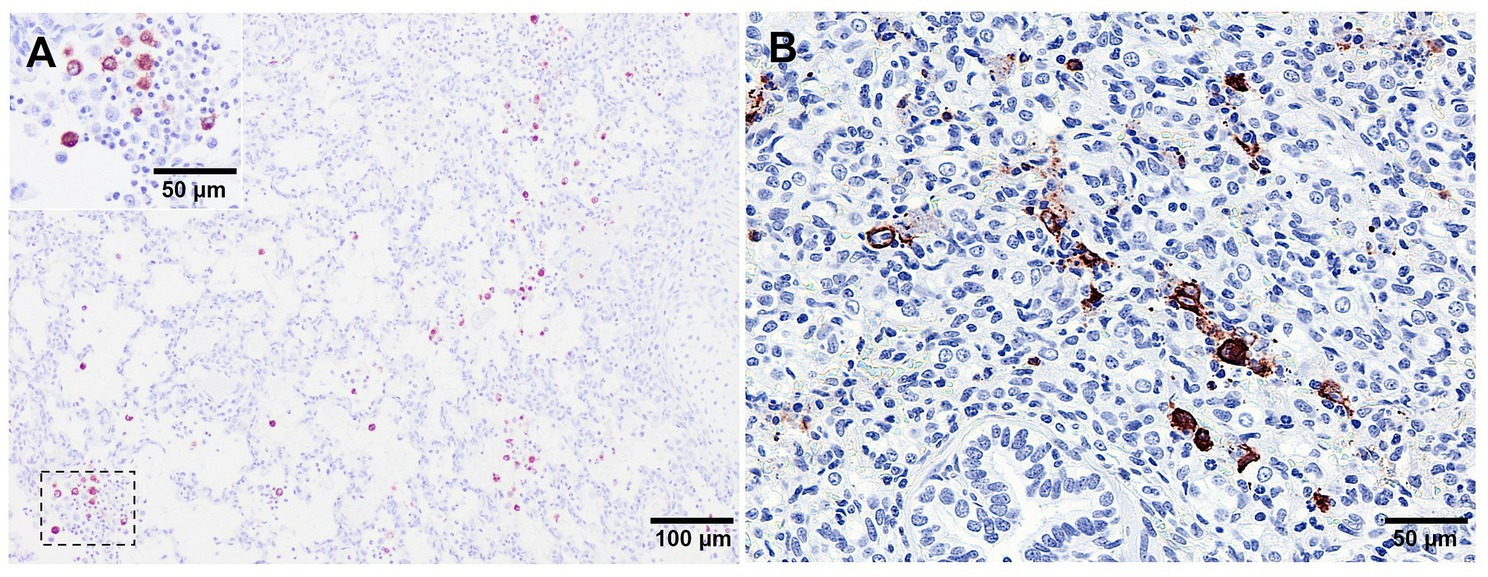 Figura 7. Imágenes microscópicas de tinción inmunohistoquímica de la proteína N del PRRSV en el tejido pulmonar de animales virulentos infectados con Lena sacrificados a 8 dpi. (A) Macrófagos alveolares de proteína PRRSV-N en un campo de neumonía intersticial representativa. El recuadro muestra un mayor aumento de los macrófagos alveolares de la proteína PRRSV-N. (B) Grupos de macrófagos de la proteína PRRSV-N rodeados de cuerpos apoptóticos.+++
Figura 7. Imágenes microscópicas de tinción inmunohistoquímica de la proteína N del PRRSV en el tejido pulmonar de animales virulentos infectados con Lena sacrificados a 8 dpi. (A) Macrófagos alveolares de proteína PRRSV-N en un campo de neumonía intersticial representativa. El recuadro muestra un mayor aumento de los macrófagos alveolares de la proteína PRRSV-N. (B) Grupos de macrófagos de la proteína PRRSV-N rodeados de cuerpos apoptóticos.+++
Además, durante la infección, también se produce la muerte celular temprana de los PAM infectados, así como necrosis y apoptosis de otros macrófagos y linfocitos en los órganos pulmonares y linfoides (45, 65-68). Estos cambios contribuyen a inducir un desequilibrio en la homeostasis inmunitaria pulmonar de los lechones infectados con PRRSV-1, haciéndolos más susceptibles a una amplia gama de patógenos respiratorios, tanto virales como bacterianos (69), lo que conduce a una mayor gravedad de los signos clínicos y lesiones pulmonares en lechones coinfectados (61).
En este sentido, se ha descrito una depleción significativa en la frecuencia de células CD163 pulmonares en PAMs y secciones de tejido pulmonar de lechones infectados con cepas virulentas como Lena o SU1-bel alrededor de 7-10 dpi (27, 29, 45, 70, 71). Los macrófagos CD163 desempeñan un papel crucial en la lucha contra las infecciones bacterianas debido a la función sensorial de esta molécula (72). Por lo tanto, una reducción en la población de células CD163 pulmonares podría comprometer la función fagocítica pulmonar, complicando la eliminación de restos celulares (29). Este escenario podría crear un entorno favorable para la coinfección con microorganismos comensales secundarios, lo que contribuiría al desarrollo de bronconeumonía supurativa. Este fenómeno, resultante del efecto citopático directo del virus sobre sus células diana y la inducción de la muerte celular regulada tanto en células infectadas como no infectadas, se ha observado ampliamente en los pulmones y órganos linfoides de lechones infectados con cepas virulentas de PRRSV-1 (17, 45, 67).+++
Por otro lado, se ha observado una reposición de células CD163 en el pulmón de cerdos infectados con SU1-bel 1 mes después de la infección o a 2 wpi de lechones infectados con Lena. Esta recuperación de los PAM CD163 se ha descrito en paralelo a un aumento de los macrófagos arginasa1 (Arg1) (45), una característica común de los macrófagos M2 (73), lo que sugiere un papel en la reparación de los tejidos, acelerando la resolución de la inflamación (57, 74), lo que estará de acuerdo con lo observado durante el examen macroscópico del pulmón en otros estudios (25, 40).+++
Teniendo en cuenta los estudios in vitro que utilizan macrófagos derivados de monocitos (MDM) y apoyados por la alta plasticidad funcional de los macrófagos pulmonares y su capacidad para adaptarse a diferentes microambientes (75, 76), es plausible plantear la hipótesis de que durante la infección por PRRSV-1, los macrófagos pulmonares experimentan distintas fases de activación. En la fase inicial, los macrófagos experimentan una activación clásica, también conocida como polarización M1, que se caracteriza por una fuerte actividad antimicrobiana (77-79). Después de la replicación del PRRSV-1 y la muerte celular de PAMs, hay una afluencia de monocitos y macrófagos que reponen los macrófagos residentes en los pulmones. Estas células reclutadas pasarían por una transición a una fase de activación alternativa, denominada polarización M2, como consecuencia del microambiente proinflamatorio inducido por cepas virulentas de PRRSV-1 en el pulmón. Aunque los macrófagos M2 son más susceptibles a la infección por PRRSV (74, 80), estos macrófagos también exhiben propiedades antiinflamatorias y desempeñan un papel en la reparación de tejidos y la resolución de la inflamación (77-79).
3.2 Mecanismos implicados en la regulación de la inflamación pulmonar
3.2.1 Interferón tipo I, una interacción entre la respuesta antiviral del IFN y la replicación del PRRSV
Los interferones de tipo I (IFN), que incluyen IFN-α, IFN-β, IFN-ε, IFN-ω, IFN-k, IFN-δ e IFN-τ, son esenciales para orquestar respuestas inmunitarias innatas y adaptativas antivirales efectivas, restringiendo la replicación viral y la propagación viral (81, 82). Aunque el PRRSV es muy sensible al IFN-α tanto in vitro (62, 83, 84) como in vivo (85), induce una producción débil o insignificante de IFN tipo I en las PAM y en las células dendríticas derivadas de monocitos (MoDC) in vitro. Sin embargo, se ha detectado IFN-α sistémico después de la infección con varias cepas aisladas de PRRSV (26, 30, 85-89).
Este hallazgo sugiere que tipos específicos de células están involucradas en la detección de la infección, y la variación en la producción de IFN-α podría atribuirse a diferencias específicas de la cepa en la inducción de IFN-α (30, 74). En particular, la virulenta cepa Lena, y probablemente otras cepas no estudiadas en profundidad, aumentan el ARNm de IFN-α en sangre en paralelo a la carga viral (30). Un cribado de genes estimulados por IFN (ISG), un potente instrumento que interfiere con la replicación viral, mostró una regulación positiva de estos genes en las células de lavado broncoalveolar (BAL) de lechones virulentos infectados con Lena y moderadamente virulentos con 3249 a 3 y 6 ppp (35). También se ha encontrado que los factores reguladores del interferón están sobreexpresados en las PAM infectadas in vitro con cepas de Lena y LV (90). Estos hallazgos añaden complejidad a la inmunopatogénesis de las infecciones por PRRSV, ya que el IFN-α debería servir como una señal desencadenante para el sistema inmunitario e iniciar la inducción de respuestas inmunitarias adaptativas, un proceso que se sabe que es ineficiente durante la infección por PRRSV en cerdos (74, 91).
3.2.2 Mecanismos de la respuesta proinflamatoria a nivel pulmonar y su reflejo a nivel sistémico
La respuesta inflamatoria aguda desempeña un papel crucial en la respuesta inmunitaria innata del huésped. En lechones infectados experimentalmente con cepas moderadamente virulentas de PRRSV-1, hay un aumento local en la expresión de IL-1α/β, IL-6 y TNF-α, lo que se correlaciona con el desarrollo de neumonía intersticial (Figura 8). A diferencia de otros virus porcinos, como el virus de la peste porcina africana (PPA), el VIS o el PRCV, que inducen una respuesta inflamatoria sistémica robusta, los niveles séricos de citocinas proinflamatorias en la infección por PRRSV son limitados (26, 53, 92, 93). Además, los niveles de estas citocinas pueden variar dependiendo de la cepa de PRRSV (94, 95). Un modelo in vitro reciente ha informado de que el PRRSV-2 estableció paisajes de infección similares en los PIM y los AMP, pero indujo respuestas inflamatorias más agudas y graves y daños asociados a la barrera endotelial en los PIM que en los PAM. Además, el TNF-α y la IL-1β inducidos por la infección por PRRSV alteraron la integridad de la barrera endotelial al desregular las proteínas de unión estrecha ocludina, claudina-1 y claudina-8, lo que podría mejorar la permeabilidad de los capilares pulmonares para mejorar aún más el intercambio de sustancias inflamatorias y células, lo que en última instancia promueve el desarrollo de neumonía intersticial (96). Estos hallazgos podrían extrapolarse al PRRSV-1 y sugieren que, si bien el tejido pulmonar exhibe una respuesta inflamatoria mediada principalmente por PIM y macrófagos intersticiales, existe una falta de respuesta sistémica. Este fenómeno se ha asociado con una estrategia de PRRSV para evadir la respuesta inmune del huésped y promover la persistencia viral (61, 97).
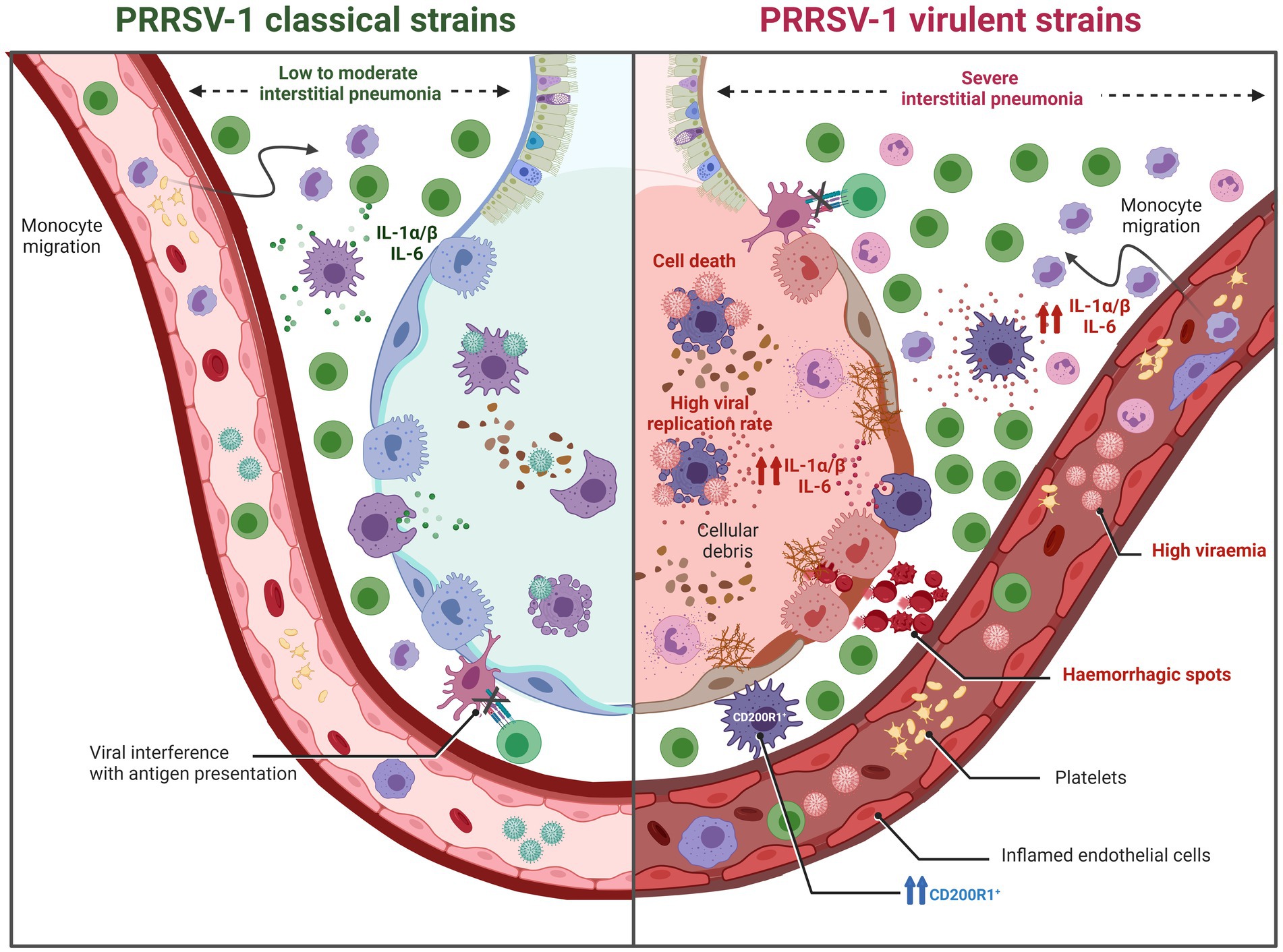 Figura 8. Representación gráfica de las lesiones pulmonares inducidas por cepas de PRRSV-1 de diferente virulencia (creadas con BioRender.com). Las cepas clásicas del PRRSV-1 (moderadamente virulentas) suelen inducir una neumonía intersticial de baja a moderada. Por el contrario, las cepas virulentas de PRRSV-1 exhiben una mayor replicación viral, lo que lleva a una reducción significativa de los macrófagos alveolares pulmonares (AMP) acompañada de la muerte celular temprana de los PAM infectados. Además, estas cepas desencadenan necrosis y apoptosis en otros macrófagos y linfocitos, lo que resulta no solo en neumonía intersticial grave, sino también, en algunos casos, en bronquitis, bronquiolitis y bronconeumonía. Estas alteraciones contribuyen a un desequilibrio en la homeostasis inmune pulmonar, lo que hace que el huésped sea más susceptible a un amplio espectro de patógenos respiratorios. La inmunopatogenia de estas lesiones se atribuye en parte a una respuesta inflamatoria más fuerte mediada por IL-1α/β en comparación con cepas de baja a moderadamente virulentas.
Figura 8. Representación gráfica de las lesiones pulmonares inducidas por cepas de PRRSV-1 de diferente virulencia (creadas con BioRender.com). Las cepas clásicas del PRRSV-1 (moderadamente virulentas) suelen inducir una neumonía intersticial de baja a moderada. Por el contrario, las cepas virulentas de PRRSV-1 exhiben una mayor replicación viral, lo que lleva a una reducción significativa de los macrófagos alveolares pulmonares (AMP) acompañada de la muerte celular temprana de los PAM infectados. Además, estas cepas desencadenan necrosis y apoptosis en otros macrófagos y linfocitos, lo que resulta no solo en neumonía intersticial grave, sino también, en algunos casos, en bronquitis, bronquiolitis y bronconeumonía. Estas alteraciones contribuyen a un desequilibrio en la homeostasis inmune pulmonar, lo que hace que el huésped sea más susceptible a un amplio espectro de patógenos respiratorios. La inmunopatogenia de estas lesiones se atribuye en parte a una respuesta inflamatoria más fuerte mediada por IL-1α/β en comparación con cepas de baja a moderadamente virulentas.
Sin embargo, las cepas virulentas de PRRSV-1 son capaces de inducir una fuerte activación del sistema inmunitario provocando una respuesta inflamatoria sistémica robusta (Figura 8). Esta respuesta se caracteriza por niveles elevados de citoquinas proinflamatorias como IL-1α/β, IL-6, TNF-α o IFN-γ en el torrente sanguíneo, lo que provoca una temperatura corporal elevada (que oscila entre 40,5 °C y 42 °C) y signos y lesiones respiratorias más graves y agudas. Las cepas virulentas de PRRSV-1 han demostrado una mayor replicación viral, lo que resulta en una reducción significativa de las PAM y una respuesta inflamatoria intensificada, lo que conduce no solo a una neumonía intersticial grave, sino también en algunos casos a bronquitis, bronquiolitis y bronconeumonía. La patogenia de estas lesiones se atribuye en parte a la respuesta inflamatoria mediada por IL-1α/β. Se ha reportado que cepas virulentas, como Lena o SU1-bel, indujeron una mayor expresión de estas citoquinas proinflamatorias en comparación con cepas moderadamente virulentas como LV o Belgium A (34, 38). Además, es importante destacar el efecto sinérgico de las coinfecciones entre el PRRSV-1 y las bacterias, que desencadena una cascada de citoquinas proinflamatorias que intensifican significativamente el daño pulmonar (98). En particular, no solo el PRRSV-1 virulento puede regular al alza la producción de IL-1α/β sino también algunas bacterias, como Glaesserella parasuis o Mycoplasma hyopneumoniae (99, 100). Esta interacción entre patógenos conduce a complicaciones respiratorias más graves y exacerba el resultado general de la enfermedad, particularmente en condiciones de campo (naturales) donde múltiples patógenos pueden estar presentes simultáneamente.
Se han propuesto varios mecanismos que contribuyen al aumento de la gravedad de los signos clínicos y las lesiones pulmonares en animales coinfectados por PRRSV-1/bacteria. En primer lugar, la regulación positiva de CD14, el principal receptor del complejo LBP (proteína de unión a lipopolisacáridos). Por ejemplo, las cepas virulentas del PRRSV-1, como Lena y Rosalía, junto con otras cepas moderadamente virulentas del PRRSV-1, inducen la infiltración de monocitos CD14 en los pulmones, así como de PIM y macrófagos intersticiales, que infiltran extensas áreas del intersticio (71, 98, 99). Si bien la afluencia de macrófagos y monocitos inmaduros CD14 puede representar un intento de reponer la pérdida de macrófagos CD163 y restaurar la función pulmonar normal, el aumento de las células CD14 también implica una mayor disponibilidad del receptor del complejo LPS (lipopolisacárido)-LBP. Esta mayor disponibilidad predispondría al pulmón a una mayor producción de citoquinas proinflamatorias tras la exposición a LPS bacterianas (98, 100-102).++++
La influencia de la microbiota respiratoria en la respuesta inmunitaria frente al PRRSV-1 sería otro mecanismo implicado en el aumento de la gravedad de los signos clínicos y las lesiones pulmonares. Entre las bacterias secundarias aisladas de cerdos infectados con PRRSV-1 se encuentran cepas poco virulentas de Actinobacillus pleuropneumoniae, Actinobacillus suis, Glaesserella parasuis, Pasteurella multocida y Streptococcus suis. Estos aislados se asocian comúnmente con bronconeumonía supurativa. El daño causado por el PRRSV en el pulmón puede crear un desequilibrio en la microbiota respiratoria, facilitando el crecimiento y la proliferación de estas infecciones bacterianas secundarias, y conduciendo al desarrollo de procesos de neumonía más complejos, especialmente en el caso de cepas virulentas (69, 103, 104).
3.2.3 Modulación y equilibrio de la respuesta inflamatoria a nivel pulmonar
Las citoquinas antiinflamatorias desempeñan un papel importante en la homeostasis inmunitaria. De hecho, después de una cascada de reacciones proinflamatorias y apoptosis en el pulmón, el huésped debería ser capaz de desencadenar la liberación de mediadores antiinflamatorios y/o reguladores para limitar el alcance de la lesión pulmonar. Durante la fase aguda de la infección por PRRSV-1, un aumento de CD200R1 macrófagos intravasculares e intersticiales y células FoxP3 se ha asociado con la gravedad de la lesión pulmonar, particularmente dentro o alrededor de los focos de bronconeumonía en lechones infectados con la virulenta cepas Lena o 3249 PRRSV-1 (71). CD200R1 es conocida por su papel en la reducción de la expresión de citoquinas proinflamatorias en diversas enfermedades inflamatorias (105). Por otro lado, FoxP3 es un marcador de células T reguladoras (Tregs), que puede actuar como inhibidor de la respuesta inmunitaria mediada por células en cerdos tras la infección por PRRSV (106-109). Por lo tanto, la regulación positiva de las células CD200R1 y FoxP3 representan mecanismos potenciales implicados en la restricción y recuperación de la lesión pulmonar durante la infección aguda por PRRSV-1 junto con la migración y reposición de macrófagos M2 al pulmón.++++
Además, recientemente se ha publicado que el PRRSV-1 puede inducir un desequilibrio entre los puntos de control inmunitario coestimuladores y coinhibidores a nivel pulmonar durante la fase aguda de la infección (110). Por lo tanto, se informó que un aumento modesto en las moléculas coestimuladoras se acompañó de una regulación positiva más temprana y robusta de las moléculas coinhibidoras, particularmente en los pulmones de los infectados con la virulenta cepa Lena (110). La expresión concurrente de estos puntos de control inmune coinhibitorios, como lo demuestran las fuertes correlaciones observadas entre ellos, implica una acción sinérgica de estas moléculas, probablemente dirigida a modular la respuesta inflamatoria aumentada y mitigar el daño al tejido pulmonar asociado.
La producción de IL-10 sería otro mecanismo descrito implicado en la resolución de la inflamación durante la infección por PRRSV. La IL-10, una potente citoquina antiinflamatoria, puede ser inducida por ciertas cepas de PRRSV, incluidas las más virulentas. La IL-10 no solo controla el daño tisular causado por la respuesta inflamatoria, sino también la respuesta inmunitaria Th1. La inducción de IL-10 puede contrarrestar los efectos del IFN-γ y potencialmente estimular la proliferación de Tregs. Algunos estudios indican que la infección por PRRSV conduce a un aumento en los niveles de IL-10, mientras que otros no han reportado cambios en la expresión de esta citocina (107, 111-113). La falta de consenso entre los estudios puede atribuirse al hecho de que no todas las cepas de PRRSV inducen la liberación de IL-10 (94, 95, 109, 112, 113).
4 Conclusión
Esta revisión profundiza en la patología macroscópica, microscópica y molecular inducida por cepas de PRRSV-1 de diferente virulencia en el pulmón, relacionando las diferentes lesiones y los patrones moleculares. Aunque la lesión distintiva de la neumonía intersticial siempre está presente en las infecciones por PRRSV, su desarrollo temporal, su gravedad y la posible aparición de PNP y bronconeumonía concurrente están influenciadas por la virulencia de la cepa y las interacciones huésped-virus. Además, la forma en que la supervivencia y funcionalidad de la población de macrófagos se ve afectada por la infección, y los mecanismos de activación y control de la inflamación que se producen, juegan un papel crítico en la manifestación de la enfermedad. Las diferencias en los escenarios experimentales y la aparición de nuevas cepas virulentas dificultan la obtención de una imagen definitiva de la inmunopatogenia de esta enfermedad, lo que requiere el desarrollo de experimentos comparativos con la inclusión de cepas de referencia.
Contribuciones de los autores
IR-T: Escritura – revisión y edición, Escritura – borrador original. JS-C: Escritura – revisión y edición, Escritura – borrador original. FS: Redacción – revisión y edición, Redacción – borrador original, Conceptualización. FP: Escritura – revisión y edición. LC: Escritura – revisión y edición. EM: Escritura – revisión y edición. JG-L: Redacción – revisión y edición, Redacción – borrador original, Conceptualización. IMR-G: Redacción – revisión y edición, Redacción – borrador original, Conceptualización.
Financiación
El/los autor/es declaran/n que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. IR-T y JS-C contaron con el apoyo de un contrato de Margarita Salas del Ministerio de Universidades de España. Este trabajo ha contado con el apoyo del Ministerio de Economía y Competitividad (PID2019-109718GB-I00) y de la Junta de Andalucía (ProyExcel_00997).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Keffaber, KK . Fallo reproductivo de etiología desconocida. Am Assoc Swine Pract News. (1989) 1:1–10.
2. Wensvoort, G, Terpstra, C, Pol, JM, ter Laak, EA, Bloemraad, M, de Kluyver, EP, et al. Misteriosa enfermedad porcina en los Países Bajos: el aislamiento del virus Lelystad. Veterinario Q. (1991) 13:121–30. doi: 10.1080/01652176.1991.9694296
3. Corzo, CA, Mondaca, E, Wayne, S, Torremorell, M, Dee, S, Davies, P, et al. Control y eliminación del virus del síndrome respiratorio y reproductivo porcino. Virus Res. (2010) 154:185–92. doi: 10.1016/j.virusres.2010.08.016
4. Neumann, EJ, Kliebenstein, JB, Johnson, CD, Mabry, JW, Bush, EJ, Seitzinger, AH, et al. Evaluación del impacto económico del síndrome reproductivo y respiratorio porcino en la producción porcina en los Estados Unidos. J Am Vet Med Assoc. (2005) 227:385–92. doi: 10.2460/javma.2005.227.385
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Renken, C, Nathues, C, Swam, H, Fiebig, K, Weiss, C, Eddicks, M, et al. Aplicación de una calculadora económica para determinar el coste del síndrome reproductivo y respiratorio porcino a nivel de granja en 21 piaras porcinas en Alemania. Manejo de la salud de Porc. (2021) 7:3. doi: 10.1186/s40813-020-00183-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Holtkamp, DJ, Kliebenstein, JB, Neumann, EJ, Zimmerman, JJ, Rotto, HF, Yoder, TK, et al. Evaluación del impacto económico del virus del síndrome respiratorio y reproductivo porcino en los productores de carne de cerdo de los Estados Unidos. J Salud Porcina Prod. (2013) 21:72–84.
7. Nan, Y, Wu, C, Gu, G, Sun, W, Zhang, Y-J y Zhou, E-M. Mejora de la vacuna contra el PRRSV: avances actuales y perspectivas de futuro. Microbiol frontal. (2017) 8:1635. doi: 10.3389/fmicb.2017.01635
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Brinton, MA, Gulyaeva, AA, Balasuriya, UBR, Dunowska, M, Faaberg, KS, Goldberg, T, et al. Perfil de taxonomía de virus ICTV: Arteriviridae 2021. J Gen Virol. (2021) 102:001632. doi: 10.1099/jgv.0.001632
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Collins, JE, Benfield, DA, Christianson, WT, Harris, L, Hennings, JC, Shaw, DP, et al. Aislamiento del virus de la infertilidad porcina y del síndrome respiratorio (aislado ATCC VR-2332) en Norteamérica y reproducción experimental de la enfermedad en cerdos gnotobióticos. J Vet Diagn Invest. (1992) 4:117–26. doi: 10.1177/104063879200400201
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Murtaugh, MP, Elam, MR y Kakach, LT. Comparación de las secuencias codificantes de proteínas estructurales de las cepas de virus VR-2332 y Lelystad del virus PRRS. Arch Virol. (1995) 140:1451–60. doi: 10.1007/BF01322671
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Stadejek, T, Oleksiewicz, MB, Potapchuk, D, y Podgórska, K. Las cepas del virus del síndrome respiratorio y reproductivo porcino de excepcional diversidad en Europa del Este apoyan la definición de nuevos subtipos genéticos. J Gen Virol. (2006) 87:1835–41. doi: 10.1099/vir.0.81782-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Stadejek, T, Oleksiewicz, MB, Scherbakov, AV, Timina, AM, Krabbe, JS, Chabros, K, et al. Definición de subtipos en el genotipo europeo del virus del síndrome respiratorio y reproductivo porcino: características de la nucleocápside y distribución geográfica en Europa. Arch Virol. (2008) 153:1479–88. doi: 10.1007/s00705-008-0146-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Stadejek, T, Stankevicius, A, Murtaugh, MP, y Oleksiewicz, MB. Evolución molecular del PRRSV en Europa: estado actual de la cuestión. Microbiol veterinario. (2013) 165:21–8. doi: 10.1016/j.vetmic.2013.02.029
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Balka, G, Podgórska, K, Brar, MS, Bálint, Á, Cadar, D, Celer, V, et al. Diversidad genética del PRRSV 1 en Europa Central y Oriental en 1994-2014: origen y evolución del virus en la región. Sci Rep. (2018) 8:7811. DOI: 10.1038/s41598-018-26036-w
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Shi, M, Lam, TT-Y, Hon, C-C, Murtaugh, MP, Davies, PR, Hui, RK-H, et al. Disección evolutiva, demográfica y geográfica basada en la filogenia de los virus del síndrome respiratorio y reproductivo porcino tipo 2 de América del Norte. J Virol. (2010) 84:8700–11. doi: 10.1128/JVI.02551-09
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Morgan, SB, Graham, SP, Salguero, FJ, Sánchez Cordón, PJ, Mokhtar, H, Rebel, JMJ, et al. El aumento de la patogenicidad del virus del síndrome respiratorio y reproductivo porcino europeo se asocia con una mayor respuesta adaptativa y eliminación viral. Microbiol veterinario. (2013) 163:13–22. doi: 10.1016/j.vetmic.2012.11.024
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Karniychuk, UU, Geldhof, M, Vanhee, M, Van Doorsselaere, J, Saveleva, TA, y Nauwynck, HJ. Patogenia y caracterización antigénica de un nuevo aislado del virus del síndrome respiratorio y reproductivo porcino subtipo 3 de Europa del Este. BMC Vet Res. (2010) 6:30. doi: 10.1186/1746-6148-6-30
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Canelli, E, Catella, A, Borghetti, P, Ferrari, L, Ogno, G, De Angelis, E, et al. Caracterización fenotípica de un aislado altamente patógeno del virus del síndrome respiratorio y reproductivo porcino italiano (PRRSV) tipo 1 subtipo 1 en cerdos infectados experimentalmente. Microbiol veterinario. (2017) 210:124–33. doi: 10.1016/j.vetmic.2017.09.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Sinn, LJ, Klingler, E, Lamp, B, Brunthaler, R, Weissenböck, H, Rümenapf, T, et al. Aparición de una cepa virulenta del virus del síndrome respiratorio y reproductivo porcino (PRRSV) 1 en Baja Austria. Manejo de la salud de Porc. (2016) 2:28. doi: 10.1186/s40813-016-0044-z
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Stadejek, T, Larsen, LE, Podgórska, K, Bøtner, A, Botti, S, Dolka, I, et al. Patogenicidad de tres cepas genéticamente diversas de PRRSV tipo 1 en cerdos libres de patógenos específicos. Microbiol veterinario. (2017) 209:13–9. doi: 10.1016/j.vetmic.2017.05.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Martín-Valls, GE, Cortey, M, Allepuz, A, Illas, F, Tello, M, y Mateu, E. Descripción de un nuevo clado dentro del subtipo 1 de Betaarterivirus suid 1 causante de brotes graves en España. Anuncio de Microbiol Resour. (2022) 11:E00304–22. doi: 10.1128/mra.00304-22
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Martín-Valls, GE, Cortey, M, Allepuz, A, Illas, F, Tello, M, y Mateu, E. Introducción de una cepa de PRRSV-1 de mayor virulencia en una estructura de producción porcina en España: evolución del virus e impacto en la producción. Manejo de la salud de Porc. (2023) 9:1. doi: 10.1186/s40813-022-00298-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Ruedas-Torres, I, Rodríguez-Gómez, IM, Sánchez-Carvajal, JM, Larenas-Muñoz, F, Pallarés, FJ, Carrasco, L, et al. El rompecabezas de la virulencia del PRRSV. Microbiol veterinario. (2021) 260:109168. doi: 10.1016/j.vetmic.2021.109168
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Balka, G, Ladinig, A, Ritzmann, M, Saalmüller, A, Gerner, W, Käser, T, et al. Caracterización inmunohistoquímica de la proliferación de neumocitos tipo II después de la provocación con el virus del síndrome respiratorio y reproductivo porcino tipo I. J Comp Pathol. (2013) 149:322–30. doi: 10.1016/j.jcpa.2012.12.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Gómez-Laguna, J, Salguero, FJ, Barranco, I, Pallarés, FJ, Rodríguez-Gómez, IM, Bernabé, A, et al. Expresión de citoquinas por macrófagos en el pulmón de cerdos infectados con el virus del síndrome respiratorio y reproductivo porcino. J Comp Pathol. (2010) 142:51–60. doi: 10.1016/j.jcpa.2009.07.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Rodríguez-Gómez, IM, Sánchez-Carvajal, JM, Pallarés, FJ, Mateu, E, Carrasco, L, y Gómez-Laguna, J. La cepa virulenta de Lena indujo una regulación negativa más temprana y más fuerte de CD163 en las células de lavado broncoalveolar. Microbiol veterinario. (2019) 235:101–9. doi: 10.1016/j.vetmic.2019.06.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Morgan, SB, Frossard, JP, Pallares, FJ, Gough, J, Stadejek, T, Graham, SP, et al. Patología y distribución del virus en los tejidos pulmonares y linfoides de cerdos inoculados experimentalmente con tres aislados distintos del virus del PRRS tipo 1 de patogenicidad variable. Transbound Emerg Dis. (2016) 63:285–95. doi: 10.1111/tbed.12272
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Renson, P, Rose, N, le Dimna, M, Mahé, S, Keranflec’h, A, Paboeuf, F, et al. Cambios dinámicos en macrófagos broncoalveolares y citocinas durante la infección de cerdos con una cepa de PRRSV de genotipo 1 de alta o baja patogenicidad. Res. Veterinaria. (2017) 48:15. doi: 10.1186/s13567-017-0420-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Weesendorp, E, Morgan, S, Stockhofe-Zurwieden, N, Graaf, DJP-D, Graham, SP, y Rebel, JMJ. Análisis comparativo de las respuestas inmunitarias tras la infección experimental de cerdos con cepas del virus del síndrome respiratorio y reproductivo porcino europeo de diferente virulencia. Microbiol veterinario. (2013) 163:1–12. doi: 10.1016/j.vetmic.2012.09.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Calvert, JG, Slade, DE, Shields, SL, Jolie, R, Mannan, RM, Ankenbauer, RG, et al. La expresión de CD163 confiere susceptibilidad a los virus del síndrome respiratorio y reproductivo porcino. J Virol. (2007) 81:7371–9. doi: 10.1128/JVI.00513-07
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Whitworth, KM, Rowland, RRR, Ewen, CL, Trible, BR, Kerrigan, MA, Cino-Ozuna, AG, et al. Los cerdos editados genéticamente están protegidos contra el virus del síndrome respiratorio y reproductivo porcino. Nat Biotechnol. (2016) 34:20–2. doi: 10.1038/nbt.3434
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Duan, X, Nauwynck, HJ, y Pensaert, MB. Cuantificación del virus e identificación de dianas celulares en los pulmones y tejidos linfoides de cerdos en diferentes intervalos de tiempo después de la inoculación con el virus del síndrome respiratorio y reproductivo porcino (PRRSV). Microbiol veterinario. (1997) 56:9–19. doi: 10.1016/S0378-1135(96)01347-8
34. Amarilla, SP, Gómez-Laguna, J, Carrasco, L, Rodríguez-Gómez, IM, Caridad y Ocerín, JM, Morgan, SB, et al. Estudio comparativo de la respuesta local de citoquinas en los pulmones de cerdos infectados experimentalmente con diferentes cepas de PRRSV-1: regulación positiva de IL-1α en lesiones inducidas por cepas altamente patógenas. Veterinario Inmunol Inmunopatíaco. (2015) 164:137–47. doi: 10.1016/j.vetimm.2015.02.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Sánchez-Carvajal, JM, Rodríguez-Gómez, IM, Ruedas-Torres, I, Zaldívar-López, S, Larenas-Muñoz, F, Bautista-Moreno, R, et al. Análisis transcriptómico de series temporales de células de lavado broncoalveolar de lechones infectados con virus del síndrome respiratorio y reproductivo porcino virulento o de baja virulencia 1. J Virol. (2022) 96:e0114021. doi: 10.1128/JVI.01140-21
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Halbur, PG, Paul, PS, Meng, X-J, Lum, MA, Andrews, JJ y Rathje, JA. Patogenicidad comparativa de nueve aislamientos del virus del síndrome respiratorio y reproductivo porcino de los Estados Unidos (PRRSV) en un modelo de cerdo de cinco semanas de edad derivado de cesárea y privado de calostro. J Vet Diagn Invest. (1996) 8:11–20. doi: 10.1177/104063879600800103
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Frydas, IS, Trus, I, Kvisgaard, LK, Bonckaert, C, Reddy, VR, Li, Y, et al. Diferentes resultados clínicos, virológicos, serológicos y de tropismo tisular de dos aislamientos nuevos y uno antiguo del virus respiratorio y reproductivo porcino (PRRSV) del subtipo 1 belga. Res. Veterinaria. (2015) 46:37. doi: 10.1186/s13567-015-0166-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Weesendorp, E, Rebel, JMJ, Popma-De Graaf, DJ, Fijten, HPD y Stockhofe-Zurwieden, N. La patogenicidad pulmonar de la cepa europea de genotipo 3 del virus del síndrome respiratorio y reproductivo porcino (PRRSV) difiere de la de las cepas del subtipo 1. Microbiol veterinario. (2014) 174:127–38. doi: 10.1016/j.vetmic.2014.09.010
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Caswell, JL, y Williams, KJ. Sistema respiratorio en: M Grant editor. Patología de animales domésticos. St. Louis, MO: Elsevier (2016). 465.
40. Weesendorp, E, Stockhofe-Zurwieden, N, Nauwynck, HJ, Popma-De Graaf, DJ, y Rebel, JMJ. Caracterización de las respuestas inmunitarias tras la reinfección homóloga de cerdos con cepas del virus del síndrome respiratorio y reproductivo porcino de los subtipos 1 y 3 europeos que difieren en virulencia. Microbiol veterinario. (2016) 182:64–74. doi: 10.1016/j.vetmic.2015.10.033
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Assavacheep, P, y Thanawongnuwech, R. Complejo de enfermedades respiratorias porcinas: dinámica de las infecciones polimicrobianas y estrategias de manejo después de la introducción de la peste porcina africana. Front Vet Sci. (2022) 9:1048861. doi: 10.3389/fvets.2022.1048861
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Zhao, D, Yang, B, Yuan, X, Shen, C, Zhang, D, Shi, X, et al. Investigación avanzada en la coinfección del virus del síndrome respiratorio y reproductivo porcino con otros patógenos en cerdos. Front Vet Sci. (2021) 8:699561. doi: 10.3389/fvets.2021.699561
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Janke, BH . Diagnóstico de virus respiratorios en cerdos. J Salud Porcina Prod. (1995) 3:116–20.
44. Sarli, G, D’Annunzio, G, Gobbo, F, Benazzi, C, y Ostanello, F. El papel de la patología en el diagnóstico de la enfermedad respiratoria porcina. Veterinaria Sci. (2021) 8:256. doi: 10.3390/vetsci8110256
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Sánchez-Carvajal, JM, Ruedas-Torres, I, Carrasco, L, Pallarés, FJ, Mateu, E, Rodríguez-Gómez, IM, et al. La activación de la muerte celular regulada en el pulmón de lechones infectados con la virulenta cepa de PRRSV-1 Lena ocurre antes y mediada por la caspasa-8 escindida. Res. Veterinaria. (2021) 52:12. doi: 10.1186/s13567-020-00882-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Grau-Roma, L, y Segalés, J. Detección del virus del síndrome respiratorio y reproductivo porcino, circovirus porcino tipo 2, virus de la gripe porcina y virus de la enfermedad de Aujeszky en casos de neumonía proliferativa y necrotizante porcina (PNP) en España. Microbiol veterinario. (2007) 119:144–51. doi: 10.1016/j.vetmic.2006.09.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Han, J, Zhou, L, Ge, X, Guo, X y Yang, H. Patogénesis y control del virus del síndrome respiratorio y reproductivo porcino altamente patógeno chino. Microbiol veterinario. (2017) 209:30–47. doi: 10.1016/j.vetmic.2017.02.020
48. Drolet, R, Larochelle, R, Morin, M, Delisle, B y Magar, R. Tasas de detección del virus del síndrome respiratorio y reproductivo porcino, circovirus porcino tipo 2 y virus de la influenza porcina en neumonía proliferativa y necrotizante porcina. Veterinario Pathol. (2003) 40:143–8. doi: 10.1354/vp.40-2-143
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Magar, R, Larochelle, R, Carman, S, y Thomson, G. Identificación del virus del síndrome respiratorio y reproductivo porcino en casos de neumonía proliferativa y necrotizante de Ontario. ¿Puede Vet J. (1994) 35:523–4.
50. Sánchez-Carvajal, JM, Gómez-Laguna, J, Fristikova, K, Álvarez-Delgado, C, Ruedas-Torres, I, Larenas Muñoz, F, et al. (2020). Caracterización de una nueva cepa virulenta del PRRSV-1 circulante en España desde. Actas de la XXXIV Reunión de la Sociedad Española de Anatomía Patológica Veterinaria. Disponible en: https://www.uchceu.es/actividades_culturales/2023/jornadas/documentos/Libro%20abstracts.pdf?p=3
51. Bery, AI, Shepherd, HM, Li, W, Krupnick, AS, Gelman, AE y Kreisel, D. Papel de los órganos linfoides terciarios en la regulación de las respuestas inmunitarias en la periferia. Cell Mol Life Sci. (2022) 79:359. doi: 10.1007/s00018-022-04388-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Longworth, KE . Biología comparada de los macrófagos intravasculares pulmonares. Biosci delantero. (1997) 2:D232-41. doi: 10.2741/a186
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Carrasco, L, Núñez, A, Salguero, FJ, Díaz San Segundo, F, Sánchez-Cordón, P, Gómez-Villamandos, JC, et al. Peste porcina africana: expresión de interleucina-1 alfa y factor de necrosis tumoral alfa por macrófagos intravasculares pulmonares. J Comp Pathol. (2002) 126:194–201. doi: 10.1053/jcpa.2001.0543
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. De Baere, MI, Van Gorp, H, Delputte, PL, y Nauwynck, HJ. La interacción del genotipo europeo del virus del síndrome respiratorio y reproductivo porcino (PRRSV) con sialoadhesina (CD169/Siglec-1) inhibe la fagocitosis de los macrófagos alveolares. Res. Veterinaria. (2012) 43:47. doi: 10.1186/1297-9716-43-47
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Sierra, MA, Carrasco, L, Gómez-Villamandos, JC, Martin de las Mulas, J, Méndez, A, y Jover, A. Macrófagos intravasculares pulmonares en pulmones de cerdos inoculados con el virus de la peste porcina africana de diferente virulencia. J Comp Pathol. (1990) 102:323–34. doi: 10.1016/s0021-9975(08)80021-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Sánchez, C, Doménech, N, Vázquez, J, Alonso, F, Ezquerra, A, y Domínguez, J. El antígeno porcino 2A10 es homólogo al CD163 humano y está relacionado con la diferenciación de macrófagos. J Immunol. (1999) 162:5230–7. doi: 10.4049/jimmunol.162.9.5230
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Van Gorp, H, Delputte, PL, y Nauwynck, HJ. Receptor carroñero CD163, un objetivo potencial para la terapia dirigida a las células. Mol Immunol. (2010) 47:1650–60. doi: 10.1016/j.molimm.2010.02.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
58. Burkard, C, Lillico, SG, Reid, E, Jackson, B, Mileham, AJ, Ait-Ali, T, et al. Ingeniería de precisión para la resistencia al PRRSV en cerdos: los macrófagos de cerdos con genoma editado que carecen del dominio CD163 SRCR5 son totalmente resistentes a ambos genotipos de PRRSV mientras mantienen la función biológica. PLoS Pathog. (2017) 13:e1006206. doi: 10.1371/journal.ppat.1006206
Resumen de PubMed | Texto completo de Crossref | Google Académico
59. Das, PB, Dinh, PX, Ansari, IH, de Lima, M, Osorio, FA, y Pattnaik, AK. Las glicoproteínas menores de la envoltura GP2a y GP4 del virus del síndrome respiratorio y reproductivo porcino interactúan con el receptor CD163. J Virol. (2010) 84:1731–40. doi: 10.1128/JVI.01774-09
Resumen de PubMed | Texto completo de Crossref | Google Académico
60. Darwich, L, Díaz, I, y Mateu, E. Certezas, dudas e hipótesis en la inmunobiología del virus del síndrome respiratorio y reproductivo porcino. Virus Res. (2010) 154:123–32. doi: 10.1016/j.virusres.2010.07.017
Resumen de PubMed | Texto completo de Crossref | Google Académico
61. Gómez-Laguna, J, Salguero, FJ, Pallarés, FJ, y Carrasco, L. Inmunopatogenia del síndrome reproductivo y respiratorio porcino en el tracto respiratorio de cerdos. Veterinario J. (2013) 195:148–55. doi: 10.1016/j.tvjl.2012.11.012
Resumen de PubMed | Texto completo de Crossref | Google Académico
62. Sang, Y, Rowland, RRR y Blecha, F. Interacción entre la inmunidad innata y el virus del síndrome respiratorio y reproductivo porcino. Anim Health Res Rev. (2011) 12:149–67. doi: 10.1017/S1466252311000144
63. Thanawongnuwech, R, Halbur, PG, y Thacker, EL. El papel de los macrófagos intravasculares pulmonares en la infección por el virus del síndrome respiratorio y reproductivo porcino. Anim Health Res Rev. (2000) 1:95–102. doi: 10.1017/S1466252300000086
Resumen de PubMed | Texto completo de Crossref | Google Académico
64. Thanawongnuwech, R, Young, TF, Thacker, BJ y Thacker, EL. Producción diferencial de citoquinas proinflamatorias: modelo de coinfección in vitro por PRRSV y Mycoplasma hyopneumoniae. Veterinario Inmunol Inmunopatíaco. (2001) 79:115–27. doi: 10.1016/s0165-2427(01)00243-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
65. Amarilla, SP, Gómez-Laguna, J, Carrasco, L, Rodríguez-Gómez, IM, Caridad y Ocerín, JM, Graham, SP, et al. La depleción tímica de los linfocitos se asocia con la virulencia de las cepas de PRRSV-1. Microbiol veterinario. (2016) 188:47–58. doi: 10.1016/j.vetmic.2016.04.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
66. Rodríguez-Gómez, IM, Barranco, I, Amarilla, SP, García-Nicolás, O, Salguero, FJ, Carrasco, L, et al. Activación de vías extrínsecas y mediadas por Daxx en tejido linfoide de cerdos infectados por PRRSV. Microbiol veterinario. (2014) 172:186–94. doi: 10.1016/j.vetmic.2014.05.025
67. Ruedas-Torres, I, Rodríguez-Gómez, IM, Sánchez-Carvajal, JM, Pallares, FJ, Barranco, I, Carrasco, L, et al. Activación de la vía apoptótica extrínseca en el timo de lechones infectados con cepas de PRRSV-1 de diferente virulencia. Microbiol veterinario. (2020) 243:108639. doi: 10.1016/j.vetmic.2020.108639
Resumen de PubMed | Texto completo de Crossref | Google Académico
68. Gómez-Laguna, J, Salguero, FJ, Fernández de Marco, M, Barranco, I, Rodríguez-Gómez, IM, Quezada, M, et al. La infección por el virus del síndrome respiratorio y reproductivo porcino tipo 2 mediada por la apoptosis en áreas de células B y T en órganos linfoides de cerdos infectados experimentalmente. Transbound Emerg Dis. (2013) 60:273–8. doi: 10.1111/j.1865-1682.2012.01338.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
69. Saade, G, Deblanc, C, Bougon, J, Marois-Créhan, C, Fablet, C, Auray, G, et al. Las coinfecciones y sus consecuencias moleculares en el tracto respiratorio porcino. Res. Veterinaria. (2020) 51:80. doi: 10.1186/s13567-020-00807-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
70. Sánchez-Carvajal, JM, Rodríguez-Gómez, IM, Carrasco, L, Barranco, I, Álvarez, B, Domínguez, J, et al. Cinética de la expresión de CD163 y CD107a en el pulmón y las amígdalas de cerdos después de la infección con cepas de PRRSV-1 de diferente virulencia. Vet Res Commun. (2019) 43:187–95. doi: 10.1007/s11259-019-09755-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
71. Sánchez-Carvajal, JM, Rodríguez-Gómez, IM, Ruedas-Torres, I, Larenas-Muñoz, F, Díaz, I, Revilla, C, et al. Activación de respuestas proinflamatorias y antiinflamatorias en la lesión del tejido pulmonar durante la fase aguda de la infección por PRRSV-1 con la cepa virulenta Lena. Microbiol veterinario. (2020) 246:108744. doi: 10.1016/j.vetmic.2020.108744
Resumen de PubMed | Texto completo de Crossref | Google Académico
72. Fabriek, BO, van Bruggen, R, Deng, DM, Ligtenberg, AJM, Nazmi, K, Schornagel, K, et al. El receptor CD163 de los macrófagos funciona como un sensor inmunitario innato para las bacterias. Sangre. (2009) 113:887–92. doi: 10.1182/blood-2008-07-167064
Resumen de PubMed | Texto completo de Crossref | Google Académico
73. Sautter, CA, Auray, G, Python, S, Liniger, M y Summerfield, A. Modulaciones fenotípicas y funcionales de macrófagos porcinos por interferones e interleucina-4. Dev Comp Immunol. (2018) 84:181–92. doi: 10.1016/j.dci.2018.01.018
Resumen de PubMed | Texto completo de Crossref | Google Académico
74. García-Nicolás, O, Baumann, A, Vielle, NJ, Gómez-Laguna, J, Quereda, JJ, Pallarés, FJ, et al. Virulencia e infectividad asociada al genotipo de macrófagos tratados con interferón por virus del síndrome respiratorio y reproductivo porcino. Virus Res. (2014) 179:204–11. doi: 10.1016/j.virusres.2013.08.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
75. Guth, AM, Janssen, WJ, Bosio, CM, Crouch, EC, Henson, PM y Dow, SW. El entorno pulmonar determina el fenotipo único de los macrófagos alveolares. Am J Physiol Pulmón Célula Mol Physiol. (2009) 296:L936-46. doi: 10.1152/ajplung.90625.2008
Resumen de PubMed | Texto completo de Crossref | Google Académico
76. Hussell, T, y Bell, TJ. Macrófagos alveolares: plasticidad en un contexto tisular específico. Nat Rev Immunol. (2014) 14:81–93. doi: 10.1038/nri3600
Resumen de PubMed | Texto completo de Crossref | Google Académico
77. Gordon, S, y Martínez, FO. Activación alternativa de macrófagos: mecanismo y funciones. Inmunidad. (2010) 32:593–604. doi: 10.1016/j.immuni.2010.05.007
78. Mosser, DM . Las múltiples caras de la activación de los macrófagos. J Leukoc Biol. (2003) 73:209–12. doi: 10.1189/jlb.0602325
Resumen de PubMed | Texto completo de Crossref | Google Académico
79. Mosser, DM, y Edwards, JP. Explorando el espectro completo de la activación de los macrófagos. Nat Rev Immunol. (2008) 8:958–69. doi: 10.1038/nri2448
Resumen de PubMed | Texto completo de Crossref | Google Académico
80. Wang, L, Hu, S, Liu, Q, Li, Y, Xu, L, Zhang, Z, et al. La polarización de los macrófagos alveolares porcinos está implicada en la inhibición de la replicación del virus del síndrome respiratorio y reproductivo porcino (PRRSV). J Vet Med Sci. (2017) 79:1906–15. doi: 10.1292/jvms.17-0258
Resumen de PubMed | Texto completo de Crossref | Google Académico
81. Perry, AK, Chen, G, Zheng, D, Tang, H y Cheng, G. Respuesta del huésped al interferón tipo I a las infecciones virales y bacterianas. Cell Res. (2005) 15:407–22. doi: 10.1038/sj.cr.7290309
82. Sadler, AJ, y Williams, BRG. Efectores antivirales inducidos por interferón. Nat Rev Immunol. (2008) 8:559–68. doi: 10.1038/nri2314
Resumen de PubMed | Texto completo de Crossref | Google Académico
83. Loving, CL, Brockmeier, SL, y Sacco, RE. Activación diferencial del interferón tipo I y susceptibilidad de las poblaciones de células dendríticas al arterivirus porcino. Inmunología. (2007) 120:217–29. doi: 10.1111/j.1365-2567.2006.02493.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
84. Luo, R, Fang, L, Jin, H, Jiang, Y, Wang, D, Chen, H, et al. Actividad antiviral de los interferones tipo I y tipo III contra el virus del síndrome respiratorio y reproductivo porcino (PRRSV). Antivir Res. (2011) 91:99–101. doi: 10.1016/j.antiviral.2011.04.017
Resumen de PubMed | Texto completo de Crossref | Google Académico
85. Brockmeier, SL, Loving, CL, Nelson, EA, Miller, LC, Nicholson, TL, Register, KB, et al. La presencia de interferón alfa en el momento de la infección altera las respuestas inmunes innatas y adaptativas al virus del síndrome respiratorio y reproductivo porcino. Clin Vacuna Immunol. (2012) 19:508–14. doi: 10.1128/CVI.05490-11
86. Albina, E, Piriou, L, Hutet, E, Cariolet, R, y L’Hospitalier, R. Respuestas inmunitarias en cerdos infectados con el virus del síndrome respiratorio y reproductivo porcino (PRRSV). Veterinario Inmunol Inmunopatíaco. (1998) 61:49–66. doi: 10.1016/S0165-2427(97)00134-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
87. Gómez-Laguna, J, Salguero, FJ, De Marco, MF, Pallarés, FJ, Bernabé, A, y Carrasco, L. Cambios en los subconjuntos de linfocitos y citoquinas durante el síndrome reproductivo y respiratorio porcino europeo: aumento de la expresión de IL-12 e IL-10 y proliferación de CD4−CD8Alto. Inmunología Viral. (2009) 22:261–71. doi: 10.1089/vim.2009.0003
Resumen de PubMed | Texto completo de Crossref | Google Académico
88. Liu, X, Bai, J, Wang, H, Fan, B, Li, Y y Jiang, P. Efecto de los residuos de aminoácidos 323-433 y 628-747 en Nsp2 de cepas representativas del virus del síndrome respiratorio y reproductivo porcino sobre la respuesta inflamatoria in vitro. Virus Res. (2015) 208:13–21. doi: 10.1016/j.virusres.2015.05.016
Resumen de PubMed | Texto completo de Crossref | Google Académico
89. Dwivedi, V, Manickam, C, Binjawadagi, B, Linhares, D, Murtaugh, MP, y Renukaradhya, GJ. Evaluación de las respuestas inmunitarias al virus del síndrome respiratorio y reproductivo porcino en cerdos durante la etapa temprana de la infección en condiciones de granja. Virol J. (2012) 9:45. doi: 10.1186/1743-422X-9-45
Resumen de PubMed | Texto completo de Crossref | Google Académico
90. Badaoui, B, Rutigliano, T, Anselmo, A, Vanhee, M, Nauwynck, H, Giuffra, E, et al. Análisis de secuencia de ARN de macrófagos alveolares primarios después de la infección in vitro con cepas de virus del síndrome respiratorio y reproductivo porcino de diferente virulencia. PLoS Uno. (2014) 9:e91918. doi: 10.1371/journal.pone.0091918
Resumen de PubMed | Texto completo de Crossref | Google Académico
91. Baumann, A, Mateu, E, Murtaugh, MP y Summerfield, A. Impacto de los genotipos 1 y 2 de los virus del síndrome respiratorio y reproductivo porcino en las respuestas al α de interferón de las células dendríticas plasmocitoides. Res. Veterinaria. (2013) 44:33. doi: 10.1186/1297-9716-44-33
Resumen de PubMed | Texto completo de Crossref | Google Académico
92. Khatri, M, Dwivedi, V, Krakowka, S, Manickam, C, Ali, A, Wang, L, et al. El virus de la influenza porcina H1N1 induce respuestas inmunitarias inflamatorias agudas en los pulmones de los cerdos: un posible modelo animal para el virus de la influenza H1N1 humana. J Virol. (2010) 84:11210–8. doi: 10.1128/JVI.01211-10
93. Van Reeth, K, Labarque, G, Nauwynck, H y Pensaert, M. Producción diferencial de citoquinas proinflamatorias en el pulmón de cerdo durante diferentes infecciones por virus respiratorios: correlaciones con la patogenicidad. Res Vet Sci. (1999) 67:47–52. doi: 10.1053/rvsc.1998.0277
Resumen de PubMed | Texto completo de Crossref | Google Académico
94. Darwich, L, Gimeno, M, Sibila, M, Díaz, I, de la Torre, E, Dotti, S, et al. Diversidades genéticas e inmunobiológicas de cepas del genotipo I del síndrome reproductivo y respiratorio porcino. Microbiol veterinario. (2011) 150:49–62. doi: 10.1016/j.vetmic.2011.01.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
95. Gimeno, M, Darwich, L, Díaz, I, de la Torre, E, Pujols, J, Martín, M, et al. Perfiles de citocinas y regulación fenotípica de células presentadoras de antígenos por aislados del virus del síndrome respiratorio y reproductivo porcino genotipo-I. Res. Veterinaria. (2011) 42:9. doi: 10.1186/1297-9716-42-9
96. Sun, W, Wu, W, Jiang, N, Ge, X, Zhang, Y, Han, J, et al. Los macrófagos alveolares altamente patógenos infectados por PRRSV deterioran la función de las células endoteliales microvasculares pulmonares. Virus. (2022) 14:452. doi: 10.3390/v14030452
Resumen de PubMed | Texto completo de Crossref | Google Académico
97. Lunney, JK, Fang, Y, Ladinig, A, Chen, N, Li, Y, Rowland, B, et al. Virus del síndrome respiratorio y reproductivo porcino (PRRSV): patogenia e interacción con el sistema inmune. Annu Rev Anim Biosci. (2016) 4:129–54. doi: 10.1146/annurev-animal-022114-111025
98. Van Gucht, S, Labarque, G, y Van Reeth, K. La combinación del virus del PRRS y la endotoxina bacteriana como modelo de enfermedad respiratoria multifactorial en cerdos. Veterinario Inmunol Inmunopatíaco. (2004) 102:165–78. doi: 10.1016/j.vetimm.2004.09.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
99. Kavanová, L, Prodělalová, J, Nedbalcová, K, Matiašovic, J, Volf, J, Faldyna, M, et al. Respuesta inmune de macrófagos alveolares porcinos a una infección concurrente con el virus del síndrome respiratorio y reproductivo porcino y Haemophilus parasuis in vitro. Microbiol veterinario. (2015) 180:28–35. doi: 10.1016/j.vetmic.2015.08.026
Resumen de PubMed | Texto completo de Crossref | Google Académico
100. Thanawongnuwech, R, Thacker, B, Halbur, P y Thacker, EL. Aumento de la producción de citoquinas proinflamatorias después de la infección por el virus del síndrome respiratorio y reproductivo porcino y Mycoplasma hyopneumoniae. Clin Diagn Lab Immunol. (2004) 11:901–8. doi: 10.1128/CDLI.11.5.901-908.2004
Resumen de PubMed | Texto completo de Crossref | Google Académico
101. Qiao, S, Jiang, Z, Tian, X, Wang, R, Xing, G, Wan, B, et al. Porcine FcγRIIb media la mejora de la infección porcina por el virus del síndrome respiratorio y reproductivo porcino (PRRSV). PLoS Uno. (2011) 6:E28721. doi: 10.1371/journal.pone.0028721
Resumen de PubMed | Texto completo de Crossref | Google Académico
102. Van Gucht, S, Van Reeth, K, Nauwynck, H y Pensaert, M. La infección por el virus del síndrome respiratorio y reproductivo porcino aumenta la expresión de CD14 y la proteína de unión a lipopolisacáridos en los pulmones de los cerdos. Inmunología Viral. (2005) 18:116–26. doi: 10.1089/vim.2005.18.116
Resumen de PubMed | Texto completo de Crossref | Google Académico
103. Brockmeier, SL, Loving, CL, Palmer, MV, Spear, A, Nicholson, TL, Faaberg, KS, et al. Comparación de aislados de la enfermedad de fiebre alta porcina asiática del virus del síndrome respiratorio y reproductivo porcino con aislados de los Estados Unidos por su capacidad para causar enfermedad e infección bacteriana secundaria en cerdos. Microbiol veterinario. (2017) 203:6–17. doi: 10.1016/j.vetmic.2017.02.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
104. Karst, SM . Influencia de las bacterias comensales en la infección por virus entéricos. Nat Rev Microbiol. (2016) 14:197–204. doi: 10.1038/nrmicro.2015.25
Resumen de PubMed | Texto completo de Crossref | Google Académico
105. Vaine, CA, y Soberman, RJ. La vía de señalización inhibitoria CD200-CD200R1: regulación inmune e interacciones huésped-patógeno. Adv Immunol. (2014) 121:191–211. doi: 10.1016/B978-0-12-800100-4.00005-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
106. Ferrarini, G, Borghetti, P, De Angelis, E, Ferrari, L, Canelli, E, Catella, A, et al. Señal inmunorreguladora FoxP3, expresión génica de citoquinas y respuesta de las células IFN-γ ante la infección natural por el virus del síndrome respiratorio y reproductivo porcino (PRRSV). Res Vet Sci. (2015) 103:96–102. doi: 10.1016/j.rvsc.2015.09.018
Resumen de PubMed | Texto completo de Crossref | Google Académico
107. Nedumpun, T, Sirisereewan, C, Thanmuan, C, Techapongtada, P, Puntarotairung, R, Naraprasertkul, S, et al. Inducción de linfocitos T reguladores (Treg) específicos del virus del síndrome respiratorio y reproductivo porcino (PRRSV) en los pulmones y los ganglios linfáticos traqueobronquiales de cerdos infectados por PRRSV. Microbiol veterinario. (2018) 216:13–9. doi: 10.1016/j.vetmic.2018.01.014
Resumen de PubMed | Texto completo de Crossref | Google Académico
108. Silva-Campa, E, Flores-Mendoza, L, Reséndiz, M, Pinelli-Saavedra, A, Mata-Haro, V, Mwangi, W, et al. Inducción de células reguladoras T helper 3 por células dendríticas infectadas con el virus del síndrome respiratorio y reproductivo porcino. Virología. (2009) 387:373–9. doi: 10.1016/j.virol.2009.02.033
109. Silva-Campa, E, Córdoba, L, Fraile, L, Flores-Mendoza, L, Montoya, M, y Hernández, J. El genotipo europeo del síndrome reproductivo y respiratorio porcino (PRRSV) infecta las células dendríticas derivadas de monocitos pero no induce células Treg. Virología. (2010) 396:264–71. doi: 10.1016/j.virol.2009.10.024
Resumen de PubMed | Texto completo de Crossref | Google Académico
110. Ruedas-Torres, I, Sánchez-Carvajal, JM, Carrasco, L, Pallarés, FJ, Larenas-Muñoz, F, Rodríguez-Gómez, IM, et al. La lesión pulmonar inducida por PRRSV-1 se asocia con un desequilibrio entre los puntos de control inmune coestimuladores y coinhibidores. Microbiol frontal. (2022) 13:1007523. doi: 10.3389/fmicb.2022.1007523
Resumen de PubMed | Texto completo de Crossref | Google Académico
111. Ruedas-Torres, I, Gómez-Laguna, J, Sánchez-Carvajal, JM, Larenas-Muñoz, F, Barranco, I, Pallarés, FJ, et al. Activación de T-bet, FOXP3 y EOMES en órganos diana de lechones infectados con la virulenta cepa PRRSV-1 Lena. Frente Immunol. (2021) 12:773146. doi: 10.3389/fimmu.2021.773146
Resumen de PubMed | Texto completo de Crossref | Google Académico
112. Wongyanin, P, Buranapraditkun, S, Chokeshai-Usaha, K, Thanawonguwech, R, y Suradhat, S. Inducción de linfocitos T reguladores CD4 CD25 Foxp3 inducibles por el virus del síndrome respiratorio y reproductivo porcino (PRRSV). Veterinario Inmunol Inmunopatíaco. (2010) 133:170–82. doi: 10.1016/j.vetimm.2009.07.012 +++
Resumen de PubMed | Texto completo de Crossref | Google Académico
113. Wongyanin, P, Buranapraditkul, S, Yoo, D, Thanawongnuwech, R, Roth, JA y Suradhat, S. Papel de la proteína de la nucleocápside del virus del síndrome respiratorio y reproductivo porcino en la inducción de interleucina-10 y linfocitos T reguladores (Treg). J Gen Virol. (2012) 93:1236–46. doi: 10.1099/vir.0.040287-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
Glosario
Palabras clave: PRRSV-1, patología pulmonar, neumonía intersticial, bronconeumonía, inflamación, virulencia
Cita: Ruedas-Torres I, Sánchez-Carvajal JM, Salguero FJ, Pallarés FJ, Carrasco L, Mateu E, Gómez-Laguna J y Rodríguez-Gómez IM (2024) La escena de la patología pulmonar durante la infección por PRRSV-1. Frente. Vet. Sci. 11:1330990. doi: 10.3389/fvets.2024.1330990
Recibido: 31 de octubre de 2023; Aceptado: 22 de febrero de 2024;
Publicado: 19 marzo 2024.
Editado por:
Vassilis Papatsiros, Universidad de Tesalia, Grecia
Revisado por:
Giuseppe Marruchella, Universidad de Teramo, Italia
Jean-Pierre Frossard, Agencia de Sanidad Animal y Vegetal (Reino Unido), Reino Unido
Copyright © 2024 Ruedas-Torres, Sánchez-Carvajal, Salguero, Pallarés, Carrasco, Mateu, Gómez-Laguna y Rodríguez-Gómez. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Inés Ruedas-Torres, de iruedas@uco.es; José María Sánchez-Carvajal, v42sancj@uco.es
†Estos autores han contribuido igualmente a este trabajo y comparten la primera autoría
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.