Análisis biomicroscópico ecográfico de la dinámica del músculo ciliar y su relación con la presión intraocular tras facoemulsificación en perros
Análisis biomicroscópico ecográfico de la dinámica del músculo ciliar y su relación con la presión intraocular tras facoemulsificación en perros
 Donghee Kim
Donghee Kim  Sang-Eun Park
Sang-Eun Park  Jiyi Hwang
Jiyi Hwang  Nanyoung Kang
Nanyoung Kang  Ji Seung Jung
Ji Seung Jung  Parque Kyung-me*
Parque Kyung-me*- Laboratorio de Cirugía Veterinaria y Oftalmología, Facultad de Medicina Veterinaria, Universidad Nacional de Chungbuk, Cheongju (República de Corea)
Introducción: Este estudio investiga la relación entre la dinámica del músculo ciliar, el grosor y la regulación de la presión intraocular (PIO), centrándose en la progresión de las cataratas y los cambios post-facoemulsificación. Explora cómo estos factores afectan la salud ocular canina, particularmente en el contexto del desarrollo de cataratas y la posterior intervención quirúrgica.
Materiales y métodos: Los datos se recogieron mediante biomicroscopía ultrasónica (UBM) de perros del Hospital Docente de Medicina Veterinaria de la Universidad Nacional de Chungbuk, Corea. En el estudio participaron 57 ojos de 35 perros, categorizados en cinco grupos: 13 ojos normales, 14 con cataratas incipientes, 12 con cataratas inmaduras, 6 con cataratas maduras y 12 post-facoemulsificación. Las mediciones de UBM evaluaron varios parámetros del músculo ciliar, incluida la longitud axial del cuerpo ciliar (CBAXL), el ángulo de la esclera de la apófisis ciliar (CPSA), las fibras longitudinales del grosor del músculo ciliar (Lf-CMT) y las fibras longitudinales y radiales del grosor del músculo ciliar (LRf-CMT).
Resultados: Los resultados indicaron una disminución de CBAXL y un aumento de Lf-CMT a medida que las cataratas progresaban en gravedad. Después de la facoemulsificación, hubo un aumento notable de CBAXL y una disminución de CPSA, Lf-CMT y LRf-CMT, en comparación con los ojos cataratosos y normales. El análisis de regresión reveló una asociación positiva significativa entre CBAXL y PIO, junto con una asociación negativa entre Lf-CMT y PIO. Estos hallazgos sugieren que las variaciones en la dinámica y el grosor del músculo ciliar, influenciadas por la progresión de la catarata y la facoemulsificación, tienen un impacto distinto en la presión intraocular.
Discusión: El estudio propone que la facoemulsificación conduce a la contracción del músculo ciliar, provocando un movimiento hacia adentro y hacia delante del músculo ciliar. Este movimiento da como resultado el estrechamiento de la hendidura ciliar y la constricción de la vía de salida no convencional, lo que puede causar un mayor riesgo de glaucoma después de la cirugía. Nuestra investigación contribuye a comprender los cambios anatómicos y fisiológicos en el ojo canino después de la cirugía de cataratas y subraya la importancia de monitorear la PIO y la dinámica del músculo ciliar en estos pacientes.
1 Introducción
El músculo ciliar desempeña un papel crucial en la regulación del flujo del humor acuoso (AH). Se han llevado a cabo extensas investigaciones en medicina humana para examinar el impacto de la contracción y relajación del músculo ciliar en el flujo de AH (1). Está bien establecido que el tono del músculo ciliar influye en las vías de salida no convencionales (2, 3). El músculo ciliar sirve como un punto de entrada común para las rutas uveoescleral y uveovortex, que se consideran significativas en la vía de salida no convencional (2). El músculo ciliar actúa como un paso limitante de la frecuencia en estas vías (4).
Además, los tendones anteriores del músculo ciliar están conectados a la malla trabecular, que es esencial para la vía de salida convencional. Tras la contracción del músculo ciliar, los tendones anteriores se mueven hacia delante y hacia dentro, lo que provoca el ensanchamiento de la malla trabecular y la dilatación del canal de Schlemm en humanos. En última instancia, estas acciones reducen la resistencia a la salida de AH (4, 5).
El glaucoma es un resultado adverso común que ocurre después de la cirugía de cataratas en perros. En un estudio reciente, 88 de los 505 ojos del estudio desarrollaron glaucoma durante su período de seguimiento después de la facoemulsificación en perros (6). En nuestro estudio previo, se encontró que el colapso de la hendidura ciliar (CC) es un factor que contribuye al desarrollo de glaucoma después de la facoemulsificación (7). El CC es una estructura dinámica que se contrae o se expande dependiendo de la PIO, y sirve como una entrada común para las vías de salida convencionales y no convencionales (8). El colapso del CC después de la facoemulsificación puede dificultar la salida suave de AH (9). Si bien los mecanismos exactos detrás de este fenómeno siguen siendo inciertos, la investigación en medicina humana proporciona hipótesis plausibles sobre sus causas. En estudios sobre presbicia en humanos, se reconoce que después de la facoemulsificación, la restauración de la fuerza contráctil del músculo ciliar conduce al movimiento hacia adentro del cuerpo ciliar (10). Extendiendo esta comprensión a los caninos, se postula que el rejuvenecimiento de la contractilidad en el músculo ciliar después de la facoemulsificación ejerce posteriormente presión sobre la hendidura ciliar. Como resultado, se cree que esta contracción hacia adentro del músculo ciliar desempeña un papel importante en el colapso de la hendidura ciliar.
La investigación en medicina humana ha arrojado luz sobre los efectos biomecánicos de la formación de cataratas y la posterior cirugía de facoemulsificación sobre la estructura del ojo. El proceso de formación de cataratas conduce al endurecimiento del cristalino, lo que a su vez aumenta la tensión dentro de las zonulas. Este aumento de la tensión es responsable de la relajación del músculo ciliar entre los pacientes con cataratas. Por el contrario, se ha demostrado que la extirpación quirúrgica de las cataratas mediante facoemulsificación reduce la tensión zonular. Esta reducción facilita la restauración de la contractilidad en el músculo ciliar (10, 11). La contracción del músculo ciliar después de la facoemulsificación da como resultado un movimiento anterior y hacia adentro del músculo. Este movimiento también conduce al adelgazamiento de las fibras del haz longitudinal del músculo ciliar (12, 13). El impacto de estos cambios dinámicos en la morfología del músculo ciliar en la vía de la AH está bien documentado en la medicina humana (14, 15). Sin embargo, debido a las diferencias anatómicas en el ángulo iridocorneal entre perros y humanos, es difícil aplicar directamente estos hallazgos a los perros.
El objetivo de este estudio fue evaluar los cambios estructurales que impactan en el flujo de AH mediante el examen del músculo ciliar antes y después de la facoemulsificación en perros. El objetivo final es identificar la posible causa subyacente del glaucoma que se produce tras la facoemulsificación. Para ello, se examinó la morfología y el grosor del músculo ciliar antes y después de la facoemulsificación. También investigamos la influencia de la morfología en el colapso del CC y el impacto del grosor del músculo ciliar en la vía de salida no convencional, considerando la PIO.
2 Materiales y métodos
2.1 Información clínica
Los datos clínicos de los perros incluidos en este estudio se recopilaron en el Hospital Docente de Medicina Veterinaria de la Universidad Nacional de Chungbuk en Corea, desde el 29 de agosto de 2018 hasta el 20 de septiembre de 2022. Se examinaron un total de 57 ojos (35 perros). El Comité Institucional de Cuidado y Uso de Animales (CBNUA-1700-22-02) otorgó la aprobación para esta investigación. Los exámenes oftalmológicos fueron realizados por un miembro de la facultad de veterinaria llamado KMP y otros veterinarios especializados en oftalmología. Durante el examen se realizaron varias pruebas, incluida la biomicroscopía con lámpara de hendidura (MW50D, SHIGIYA, Hiroshima, Japón), la prueba de lágrima de Schirmer (Schirmer Tear Flow Strips, GuldenOphthalmics, PA), la respuesta a la amenaza, el reflejo pupilar a la luz, el reflejo de deslumbramiento, la tonometría de rebote (TonoVet plus, icare, Vantaa, Finlandia), la gonioscopia (Ocular Koeppe Diagnostic Lenses, Ocular Instruments.inc, Bellevue, WA), la oftalmoscopia indirecta (Pan Retinal 2.2, VOLK, OH), el electrorretinograma (RETevet, LKC technologies, MD) y UBM (VuPAD, Sonomed Escalon, Lake Success, NY). El estadio de catarata se clasificó en base a estudios previos como incipiente, inmaduro, maduro o hipermaduro.®®®®
2.1.1 Grupos de pacientes
Los perros de este estudio se clasificaron en tres grupos: (a) ojos normales (n = 13), (b) cataratas (n = 32) y (c) post-facoemulsificación (post-faco; n = 12). En este estudio, cuando los ojos de un paciente pertenecían a diferentes grupos, se seleccionó aleatoriamente un ojo para su inclusión para evitar errores estadísticos (16). Para facilitar un análisis adicional, los grupos de ojo normal y cataratas se dividieron en dos subgrupos: (a) grupo de candidatos a tratamiento quirúrgico (STC) (n = 18) y (b) grupo de manejo no quirúrgico (NSM) (n = 27) (17-22). El grupo STC incluyó perros con cataratas inmaduras y maduras, mientras que el grupo NSM comprendió ojos normales y perros con cataratas incipientes.
2.1.2 Criterios de inclusión
Los pacientes con cataratas hereditarias o seniles fueron elegibles para su inclusión en este estudio. Solo se incluyeron en el análisis de los resultados post-facoemulsificación los pacientes que tuvieron un período de seguimiento de al menos 2 meses (con una duración media de 662 ± 465,14 días y un rango de 61 a 1.365 días) después de someterse a facoemulsificación.
2.1.3 Criterios de exclusión
En este estudio, se excluyeron sujetos con enfermedades sistémicas. Además, los pacientes que presentaban anomalías como uveítis, glaucoma o hemorragia antes de la cirugía no se incluyeron en este estudio, con la excepción de los afectados por cataratas. Además, también se excluyeron de esta investigación los casos que mostraron resultados anormales en el electrorretinograma (ERG). Los pacientes con cataratas secundarias causadas por diabetes o traumatismos no fueron considerados para su inclusión. Además, se excluyeron del análisis los ojos que presentaban un ángulo iridocorneal cerrado (ICA), detectado durante la gonioscopia, y los pacientes que habían recibido un anillo de tensión capsular (an-CTR-12, An-vision, Hennigsdorf, Alemania).
2.2 Examen UBM
La UBM se realizó durante el examen oftálmico tanto en ojos normales como cataratosos en este estudio. En los ojos post-faco, la UBM se realizó al menos 2 meses después de la cirugía de cataratas. Los perros se colocaron en una postura sentada y sus pupilas se dilataron mediante la aplicación tópica de tropicamida al 0,5% (Mydriacyl; Alcon, Ginebra, Suiza). Además, se administró anestesia tópica con una gota de clorhidrato de proparacaína al 0,5% (Alcaine; Alcón). La fisura palpebral se abrió manualmente y se examinó el ojo colocando un transductor perpendicularmente al limbo corneoescleral en el cuadrante dorsal.®®
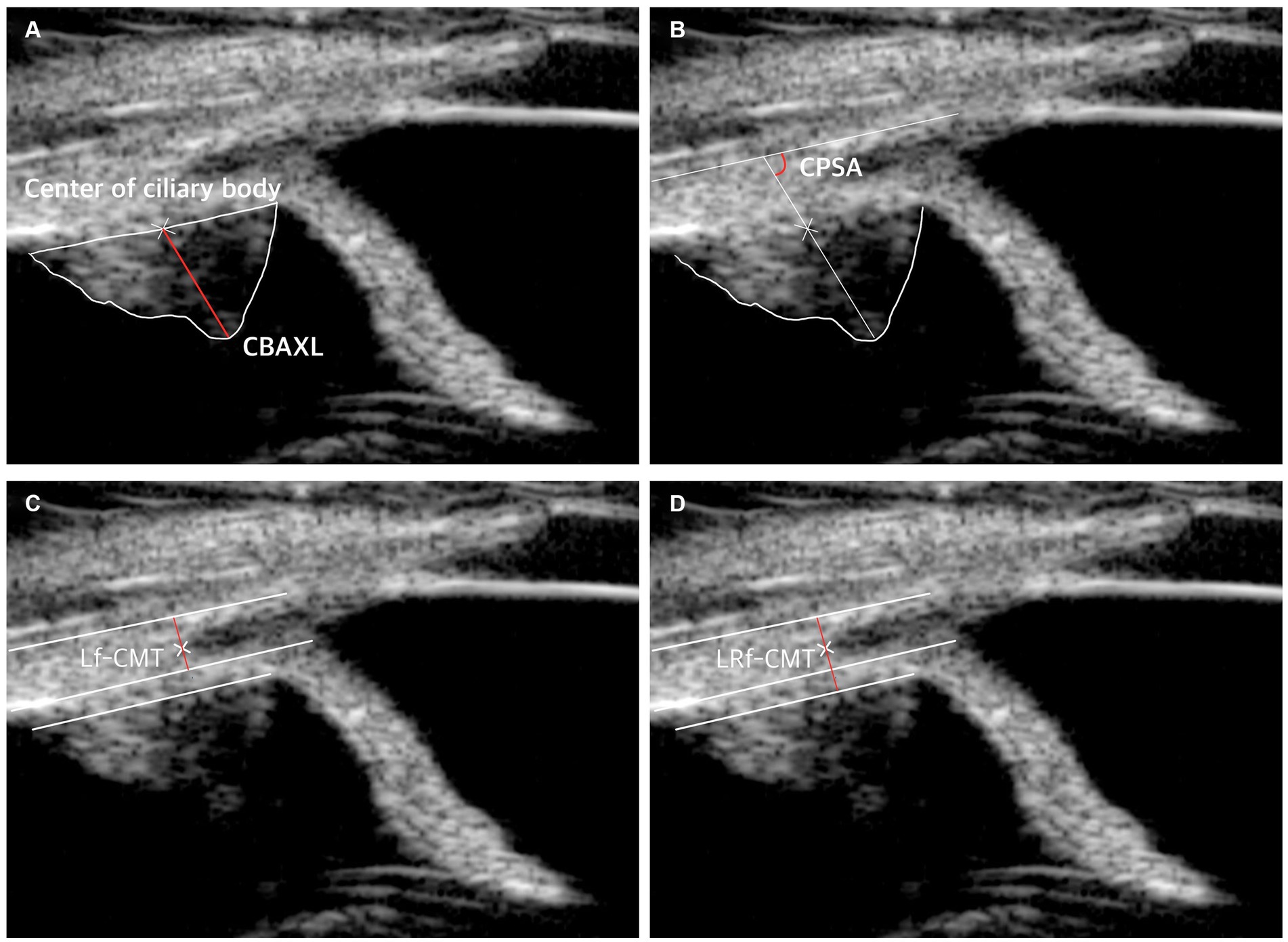
El estudio incluyó la medición de los siguientes parámetros: longitud axial del cuerpo ciliar (CBAXL), ángulo de la apófisis ciliar-esclerótica (CPSA), fibra longitudinal del grosor del músculo ciliar (Lf-CMT) y fibra longitudinal y radial del espesor del músculo ciliar-coroides (LRf-CMT) según un informe previo (8, 10, 11, 13, 23-25).
Para determinar el CBAXL, se trazó una línea a través del vértice del cuerpo ciliar en forma de cúpula y el centro del cuerpo ciliar. Esta medición se realizó manualmente utilizando el software incorporado de UBM. El CBAXL se calculó como la distancia entre el ápice del cuerpo ciliar y la interfase uveoescleral a lo largo del eje longitudinal del cuerpo ciliar (Figura 1A). El CPSA se definió como el ángulo entre el eje largo del cuerpo ciliar y la esclerótica (Figura 1B). Para la medición de Lf-CMT, se trazó una línea a través de la capa interna de la esclerótica, el receso angular, y una línea paralela a la capa interna de la esclerótica a partir del punto donde la capa interna de la raíz del iris se encuentra con el ligamento pectinado (Figura 1C). La medición de LRf-CMT implicó trazar una línea a través de la capa interna de la esclerótica, el ángulo de rebeso, y una línea paralela a la capa interna de la esclerótica a partir del punto donde la capa externa de la raíz del iris se encuentra con el cuerpo ciliar en forma de cúpula (Figura 1D) (8, 13, 23-25).
 Figura 1. Método de medición UBM. (A) Medición de la longitud axial del cuerpo ciliar (CBAXL). Se trazó una línea a través del vértice del cuerpo ciliar en forma de cúpula y el centro del cuerpo ciliar para calcular el CBAXL. (B) Medición del ángulo de la apófisis ciliar y la esclerótica (CPSA). El CPSA se definió como el ángulo entre el eje longitudinal del cuerpo ciliar y la esclerótica. (C) Medición del espesor longitudinal de la fibra del músculo ciliar (Lf-CMT). Se trazó una línea a través de puntos específicos para determinar Lf-CMT, incluida la capa interna de la esclerótica, el ángulo de rebeso y una línea paralela a la capa interna de la esclerótica a partir del punto donde la capa interna de la raíz del iris se encuentra con el ligamento pectinado. (D) Medición de la fibra longitudinal y radial del espesor músculo-coroides ciliar (LRf-CMT). LRf-CMT implicó dibujar una línea a través de la capa interna de la esclerótica, el ángulo rebaje, y una línea paralela a la capa interna de la esclerótica a partir del punto donde la capa externa de la raíz del iris se encuentra con el cuerpo ciliar en forma de cúpula.
Figura 1. Método de medición UBM. (A) Medición de la longitud axial del cuerpo ciliar (CBAXL). Se trazó una línea a través del vértice del cuerpo ciliar en forma de cúpula y el centro del cuerpo ciliar para calcular el CBAXL. (B) Medición del ángulo de la apófisis ciliar y la esclerótica (CPSA). El CPSA se definió como el ángulo entre el eje longitudinal del cuerpo ciliar y la esclerótica. (C) Medición del espesor longitudinal de la fibra del músculo ciliar (Lf-CMT). Se trazó una línea a través de puntos específicos para determinar Lf-CMT, incluida la capa interna de la esclerótica, el ángulo de rebeso y una línea paralela a la capa interna de la esclerótica a partir del punto donde la capa interna de la raíz del iris se encuentra con el ligamento pectinado. (D) Medición de la fibra longitudinal y radial del espesor músculo-coroides ciliar (LRf-CMT). LRf-CMT implicó dibujar una línea a través de la capa interna de la esclerótica, el ángulo rebaje, y una línea paralela a la capa interna de la esclerótica a partir del punto donde la capa externa de la raíz del iris se encuentra con el cuerpo ciliar en forma de cúpula.
2.3 Cirugía de cataratas: manejo pre y postquirúrgico
Antes de la cirugía, los perros recibieron tratamiento preoperatorio con medicamentos específicos. Se les administraron antibióticos oftálmicos tópicos (moxifloxacina, Vigamox, NOVARTIS, East Hanover, NJ u ofloxacina, OcuFlox, Samil, Seúl, Corea), antiinflamatorios no esteroideos (flurbiprofeno, flurbiprofeno, Bausch & Lomb, Bridgewater, NJ, o bromfenaco, Bronuck, TAEJOON PHARM, Seúl, Corea) y esteroides (neomicina-polimixina B sulfato-dexametasona Maxitrol, NOVARTIS, East Hanover, NJ o acetato de prednisolona al 1%, Pred-Forte, Allergan, North Chicago, IL) según un programa específico: Q8h, Q12-24 h y Q8H, respectivamente, con una duración de 5 días. Además, antes de la cirugía, los perros recibieron un tratamiento preoperatorio diferente que incluía amoxicilina-clavulanato (AMOCLA, KUHNIL PHARM, Cheonan, Corea), famotidina (Famotidina, Nelson, Eumsung, Corea) y carprofeno (ASHICARP, ALS, Mumbai, India) durante un período de 5 días. Además, solo 3 a 4 horas antes del procedimiento quirúrgico, los perros recibieron una solución oftálmica especializada en tres o cuatro ciclos, con intervalos de 5 a 10 minutos entre ciclos. Esta solución incluía moxifloxacina u ofloxacina, flurbiprofeno o bromfenaco, neomicina-polimixina B sulfato-dexametasona o prednisolona, tropicamida y atropina (Atropina, Alcon) para cada ojo.®®®®®®®®®
El procedimiento de facoemulsificación fue llevado a cabo por un miembro de la facultad de veterinaria (KMP) y dos veterinarios especializados en oftalmología (JHA y JWP) utilizando tres máquinas diferentes: Stellaris PC (Bausch & Lomb Inc.), Pulsar Minimal Stress (OPTIKON, Roma, Italia) o Sovereign Compact Phaco Machine (AMO, Andrew Place Santa Ana, CA). Se implantaron cuidadosamente LIO acrílicas plegables (Loki, CRISTALENS, Lannion, Francia) con una potencia de +41,0 dioptrías y un diámetro que oscilaba entre 12,00 y 14,00 mm a través de una incisión corneal transparente escalonada de 3,0 mm. Previo al procedimiento quirúrgico, el líquido de irrigación se preparó mediante la adición de aditivos de epinefrina (1 mg/mL; DAIHAN, Seúl, Corea) y heparina (5.000 unidades/mL; JW, Seúl, Corea) a una solución salina equilibrada (BSS Plus; Solución Alcon u Opticosol; Reyon Pharm, Seúl, Corea). A lo largo de la cirugía, el material viscoelástico oftálmico (15 mg/mL, Hialuronato-I Inj de Kukje; KUKJE, Geonggi, Corea) y posteriormente se eliminó mediante irrigación/aspiración (I/A) al final del procedimiento. Para asegurar la eliminación completa de las sustancias viscoelásticas, el ojo se irrigaba a fondo por vía I/A durante 30 s.®
Para asegurar el cierre de la incisión corneal, se utilizaron suturas de poliglactina 8-0 (Vicryl, Ethicon, Somerville, NJ) o nailon 8-0 (Usiol, Lexington, KY) en un patrón interrumpido simple con una aguja de espátula. Al final de la cirugía, dexametasona (2 mg/ojo; JEIL, Seúl, Corea) y cefazolina (50 mg/ojo; Chongkundang) se administraron por vía subconjuntival. Con el fin de monitorizar la PIO postoperatoria, se realizaron mediciones inmediatamente después de la cirugía y a intervalos de 4 h durante 48 h.
Como parte del régimen postoperatorio, se prescribieron esteroides tópicos, incluyendo acetato de prednisolona al 1% (aplicado cada 6 h durante 2 semanas, seguido de una reducción gradual durante 2 a 4 semanas) o neomicina-polimixina B sulfato-dexametasona (aplicado cada 6 h durante 2 semanas, seguido de una reducción gradual durante 4 semanas). Además, se utilizaron antibióticos tópicos como moxifloxacina u ofloxacina (aplicados cada 6 h durante 2 semanas, y luego cada 8-12 h durante 2 a 3 semanas). Para la administración sistémica, se administraron antibióticos en forma de amoxicilina-clavulanato por vía oral cada 12 h durante una duración de 2 a 3 semanas. Además, se administraron esteroides sistémicos en forma de prednisolona por vía oral a una dosis de 0,5 mg/kg cada 12 h durante 1 a 2 semanas, disminuyendo gradualmente a lo largo de 2 a 4 semanas.
2.4 Análisis estadístico
El análisis estadístico se realizó con el programa SPSS (versión 17.0; SPSS Inc., Chicago, Illinois, Estados Unidos). Para tener en cuenta las covariables como la raza y el sexo, se utilizó el Chi-cuadrado (χ2) para demostrar que no hubo diferencias significativas entre los grupos para estas categorías. Para la edad y el peso corporal, se empleó una prueba t para demostrar que no había diferencias significativas entre los grupos, lo que garantizó un análisis sólido al tener en cuenta estas importantes variables. A continuación, se empleó ANOVA para comparar los grupos de ojo normal, cataratas y postoperatorio, con análisis post-hoc realizados utilizando la prueba exacta de Fisher para comparaciones específicas. Los grupos NSM y STC se compararon mediante una prueba t. Se realizó un único análisis de regresión lineal para todos los ojos de prueba para investigar la relación entre la presión intraocular (PIO), medida simultáneamente con el examen oftálmico y la prueba de UBM, y cada parámetro.
Este enfoque meticuloso en el control de posibles factores de confusión como la raza, el sexo, la edad y el peso corporal mejora la integridad de nuestros hallazgos. El nivel de significación estadística se estableció en p < 0,05, p < 0,01, p < 0,001 y p < 0,0001, denotados por *, **, *** y ****, respectivamente. Para mayor comodidad en las figuras, se utilizan asteriscos, mientras que los valores p reales se informan en el texto.
3 Resultados
3.1 Características caninas
3.1.1 Grupo de ojos normales
En el grupo de ojos normales, se incluyeron en el estudio un total de 13 ojos de 7 perros. De estos, 6 perros eran de raza pura y 1 perro era mestizo. Las razas más comunes fueron el Caniche, el Shih Tzu y el Maltés. El grupo estaba formado por 4 perros machos y 3 hembras. La edad media de los perros de este grupo fue de 8,50 ± 4,87 años (oscilando entre 1,5 y 15 años), con un peso medio de 5,46 ± 2,46 kg (oscilando entre 2,85 y 9,80 kg).
3.1.2 Grupo de las cataratas
El grupo de cataratas consistió en 32 ojos de 20 perros. Entre estos ojos, 14 fueron clasificados como incipientes, 12 como inmaduros y 6 como cataratas maduras. La mayoría de los perros de este grupo eran de raza pura, siendo las razas más comunes el caniche, el bichón frisé y el maltés. En el estudio se incluyeron 8 machos y 12 hembras. La edad media de los perros de este grupo fue de 8,25 ± 3,00 años (oscilando entre 2,2 y 13,0 años), y el peso medio fue de 5,01 ± 2,40 kg (oscilando entre 1,80 y 9,80 kg).
3.1.3 Grupo post-faco
El grupo post-faco incluyó 12 ojos de 10 perros, excluyendo a los pacientes con ojos glaucomatosos. Antes de la cirugía, los estadios de cataratas de los ojos incluidos se clasificaron en cinco inmaduros y siete maduros. Entre los perros de este grupo, 10 eran de raza pura, siendo el maltés, el bichón frisé y el caniche las razas más comunes. El grupo estaba formado por 3 perros machos y 7 hembras. La edad media de los perros de este grupo fue de 9,59 ± 2,71 años (con un rango de 5,28 a 12,4 años), y su peso promedio fue de 4,50 ± 1,94 kg (con un rango de 2,4 a 8,1 kg). No hubo diferencias significativas en la distribución por edad, peso o raza entre los grupos.
3.2 Cambios en los parámetros del músculo ciliar según la maduración de la catarata
Los resultados del estudio mostraron que a medida que avanzaba la etapa de cataratas, el CBAXL tendía a disminuir en general. Se observaron diferencias estadísticamente significativas entre los grupos de ojo normal y ojo inmaduro, ojo normal y ojo maduro, y ojo incipiente y ojo maduro (1,65 ± 0,17 mm vs. 1,46 ± 0,24 mm, 1,65 ± 0,17 mm vs. 1,30 ± 0,05 mm, y 1,62 ± 0,12 mm vs. 1,46 ± 0,24 mm, respectivamente; p < 0,05, p < 0,001 y p < 0,01, respectivamente; Figura 2A). Esto indica que a medida que avanza la catarata, la forma del cuerpo ciliar tiende a cambiar hacia la relajación. En cuanto a la CPSA, hubo una tendencia general a aumentar a medida que avanzaba el estadio de la catarata (Figura 2B). Sin embargo, no se observaron diferencias significativas entre los diferentes estadios de la catarata. Esto sugiere que los cambios en CPSA no se asociaron significativamente con la progresión de la catarata.
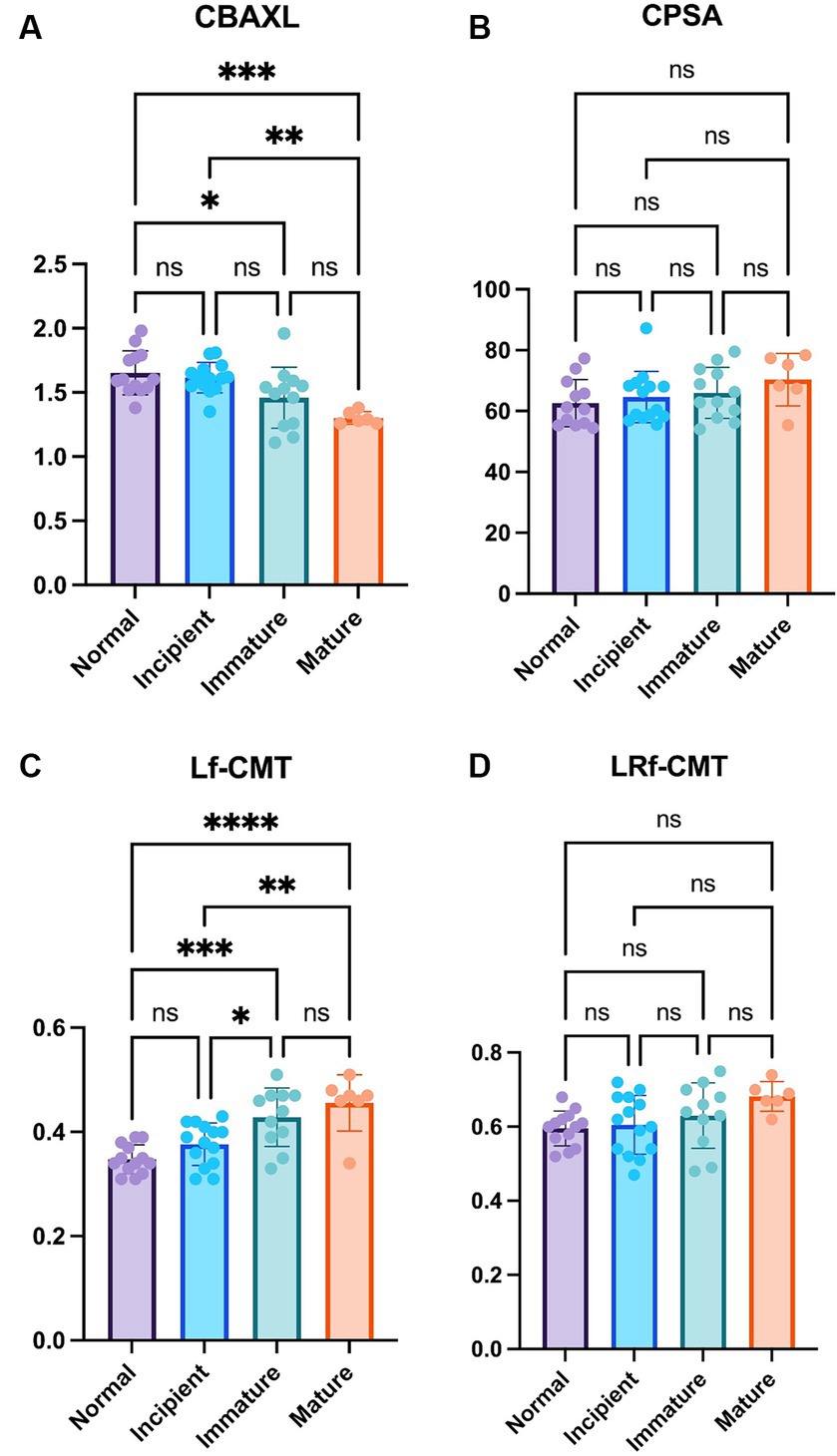 Figura 2. Comparación del ojo normal, catarata incipiente, inmadura y madura (A) Longitud axial del cuerpo ciliar (CBAXL), (B) ángulo de la apófisis ciliar-esclerótica (CPSA), (C) fibra longitudinal del grosor del músculo ciliar (Lf-CMT) y (D) fibra longitudinal y radial del espesor del músculo ciliar-coroides (LRf-CMT) en el ojo normal (n = 13), catarata incipiente (n = 14), catarata inmadura (n = 12), y catarata madura (n = 6). Los resultados mostraron que el CBAXL tendía a disminuir a medida que avanzaba la catarata, observándose diferencias significativas entre los grupos de ojo normal y ojo inmaduro, ojo normal y ojo maduro, y ojo incipiente y ojo maduro. La CPSA mostró un aumento general, pero no se encontraron diferencias significativas entre los estadios de cataratas. Lf-CMT mostró un aumento progresivo con el avance de la catarata, observándose diferencias significativas entre los grupos de ojo normal y ojo inmaduro, ojo normal y ojo maduro, ojo incipiente y ojo inmaduro, y ojo incipiente y ojo maduro. La LRf-CMT también mostró una tendencia al aumento, pero no se observaron diferencias significativas entre los estadios de catarata. El nivel de significación estadística se estableció en p < 0,05, p < 0,01, p < 0,001 y p < 0,0001, denotado por *, **, *** y ****.
Figura 2. Comparación del ojo normal, catarata incipiente, inmadura y madura (A) Longitud axial del cuerpo ciliar (CBAXL), (B) ángulo de la apófisis ciliar-esclerótica (CPSA), (C) fibra longitudinal del grosor del músculo ciliar (Lf-CMT) y (D) fibra longitudinal y radial del espesor del músculo ciliar-coroides (LRf-CMT) en el ojo normal (n = 13), catarata incipiente (n = 14), catarata inmadura (n = 12), y catarata madura (n = 6). Los resultados mostraron que el CBAXL tendía a disminuir a medida que avanzaba la catarata, observándose diferencias significativas entre los grupos de ojo normal y ojo inmaduro, ojo normal y ojo maduro, y ojo incipiente y ojo maduro. La CPSA mostró un aumento general, pero no se encontraron diferencias significativas entre los estadios de cataratas. Lf-CMT mostró un aumento progresivo con el avance de la catarata, observándose diferencias significativas entre los grupos de ojo normal y ojo inmaduro, ojo normal y ojo maduro, ojo incipiente y ojo inmaduro, y ojo incipiente y ojo maduro. La LRf-CMT también mostró una tendencia al aumento, pero no se observaron diferencias significativas entre los estadios de catarata. El nivel de significación estadística se estableció en p < 0,05, p < 0,01, p < 0,001 y p < 0,0001, denotado por *, **, *** y ****.
En cuanto a la Lf-CMT, mostró una tendencia general a aumentar a medida que avanzaba el estadio de la catarata. Se encontraron diferencias estadísticamente significativas entre los grupos de ojo normal y ojo inmaduro, ojo normal y ojo maduro, ojo incipiente y ojo inmaduro, y ojo incipiente y ojo maduro (0,35 ± 0,03 mm vs. 0,43 ± 0,06 mm, 0,35 ± 0,03 mm vs. 0,46 ± 0,05 mm, 0,38 ± 0,04 mm vs. 0,43 ± 0,06 mm y 0,38 ± 0,04 mm vs. 0,46 ± 0,05 mm, respectivamente; p < 0,001, p < 0,0001, p < 0,05 y p < 0,01, respectivamente; Figura 2C). Estos hallazgos indican que las fibras longitudinales del músculo ciliar se engrosaron a medida que avanzaba la catarata. LRf-CMT, hubo una tendencia general a aumentar con la progresión de la catarata (Figura 2D). Sin embargo, no se observaron diferencias significativas entre los diferentes estadios de la catarata, lo que sugiere que los cambios en LRf-CMT no se relacionaron significativamente con el estadio de la catarata.
En general, el estudio reveló que el cuerpo ciliar sufre cambios en términos de longitud axial y grosor del músculo ciliar a medida que avanza la catarata. Estos hallazgos contribuyen a comprender las alteraciones estructurales que ocurren en el cuerpo ciliar durante el desarrollo y la progresión de la catarata.
3.3 Cambios en el músculo ciliar en los grupos de facoemulsificación, STC y NSM
El estudio no reveló diferencias significativas tanto en CBAXL como en CPSA entre los grupos con STC y aquellos con NSM (Figuras 3A, B). Estos hallazgos sugieren que la forma general del cuerpo ciliar permanece consistente entre los dos grupos.
En cuanto a la Lf-CMT, el estudio reveló que este valor fue significativamente mayor en el grupo STC en comparación con el grupo NSM (0,44 ± 0,05 mm vs. 0,36 ± 0,04 mm, respectivamente; p < 0,0001; Figura 3C). Esto sugiere que el grosor de las fibras longitudinales experimenta cambios más notables en el grupo STC, probablemente como resultado de la progresión de las cataratas. De manera similar, para el LRf-CMT, se encontró que el valor fue significativamente mayor en el grupo STC en comparación con el grupo NSM (0,65 ± 0,08 mm vs. 0,60 ± 0,06 mm; p < 0,05; Figura 3D).
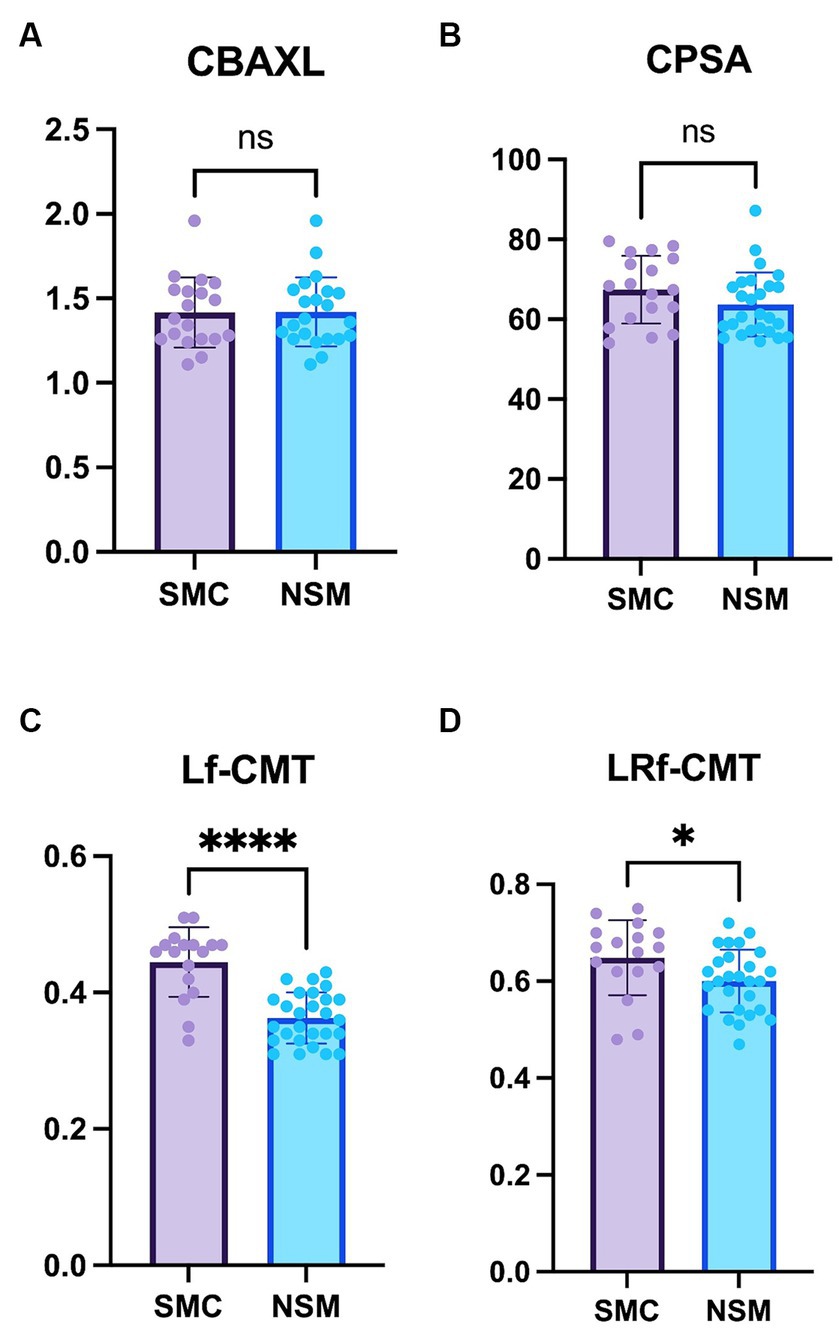 Figura 3. Comparación de los grupos de tratamiento no quirúrgico y candidatos para tratamiento quirúrgico (A) Longitud axial del cuerpo ciliar (CBAXL), (B) Ángulo de la esclótica de la apófisis ciliar (CPSA), (C) Fibra longitudinal del grosor del músculo ciliar (Lf-CMT) y (D) Fibra longitudinal y radial del grosor del músculo ciliar-coroides (LRf-CMT) en los grupos de Manejo no quirúrgico (NSM) (n = 27) y Candidato al tratamiento quirúrgico (STC) (n = 18) sometidas a facoemulsificación. El estudio no reveló diferencias significativas entre los dos grupos en CBAXL y CPSA. Con respecto a Lf-CMT, el grupo STC presentó valores más altos en comparación con el grupo NSM. Además, se observaron diferencias significativas en LRf-CMT entre los dos grupos. El nivel de significación estadística se estableció en p < 0,05, p < 0,01, p < 0,001 y p < 0,0001, denotado por *, **, *** y ****.
Figura 3. Comparación de los grupos de tratamiento no quirúrgico y candidatos para tratamiento quirúrgico (A) Longitud axial del cuerpo ciliar (CBAXL), (B) Ángulo de la esclótica de la apófisis ciliar (CPSA), (C) Fibra longitudinal del grosor del músculo ciliar (Lf-CMT) y (D) Fibra longitudinal y radial del grosor del músculo ciliar-coroides (LRf-CMT) en los grupos de Manejo no quirúrgico (NSM) (n = 27) y Candidato al tratamiento quirúrgico (STC) (n = 18) sometidas a facoemulsificación. El estudio no reveló diferencias significativas entre los dos grupos en CBAXL y CPSA. Con respecto a Lf-CMT, el grupo STC presentó valores más altos en comparación con el grupo NSM. Además, se observaron diferencias significativas en LRf-CMT entre los dos grupos. El nivel de significación estadística se estableció en p < 0,05, p < 0,01, p < 0,001 y p < 0,0001, denotado por *, **, *** y ****.
En general, los hallazgos indican diferencias significativas en el grosor del cuerpo ciliar entre los grupos STC y NSM. Estas observaciones contribuyen a nuestra comprensión de los cambios estructurales que ocurren en el cuerpo ciliar en relación con la progresión de la catarata.
3.4 Cambios en el músculo ciliar en el ojo normal, cataratas y grupo post-faco
En cuanto al CBAXL, el grupo de catarata presentó un valor significativamente menor en comparación con el grupo ojo normal (1,50 ± 0,20 mm vs. 1,65 ± 0,17 mm; p < 0,05). Además, el grupo post-faco mostró un aumento significativo de CBAXL en comparación con el grupo de catarata (1,86 ± 0,23 mm vs. 1,50 ± 0,20 mm; p < 0,0001). Además, el valor de CBAXL fue significativamente mayor en el grupo post-faco que en el grupo de ojo normal (1,86 ± 0,23 mm vs. 1,65 ± 0,17 mm; p < 0,05; Figura 4A). En cuanto a la CPSA, se encontró que fue significativamente menor en el grupo post-faco en comparación con el grupo de catarata (59,89 ± 8,04 vs. 66,20 ± 8,44; p < 0,05; Figura 4B).
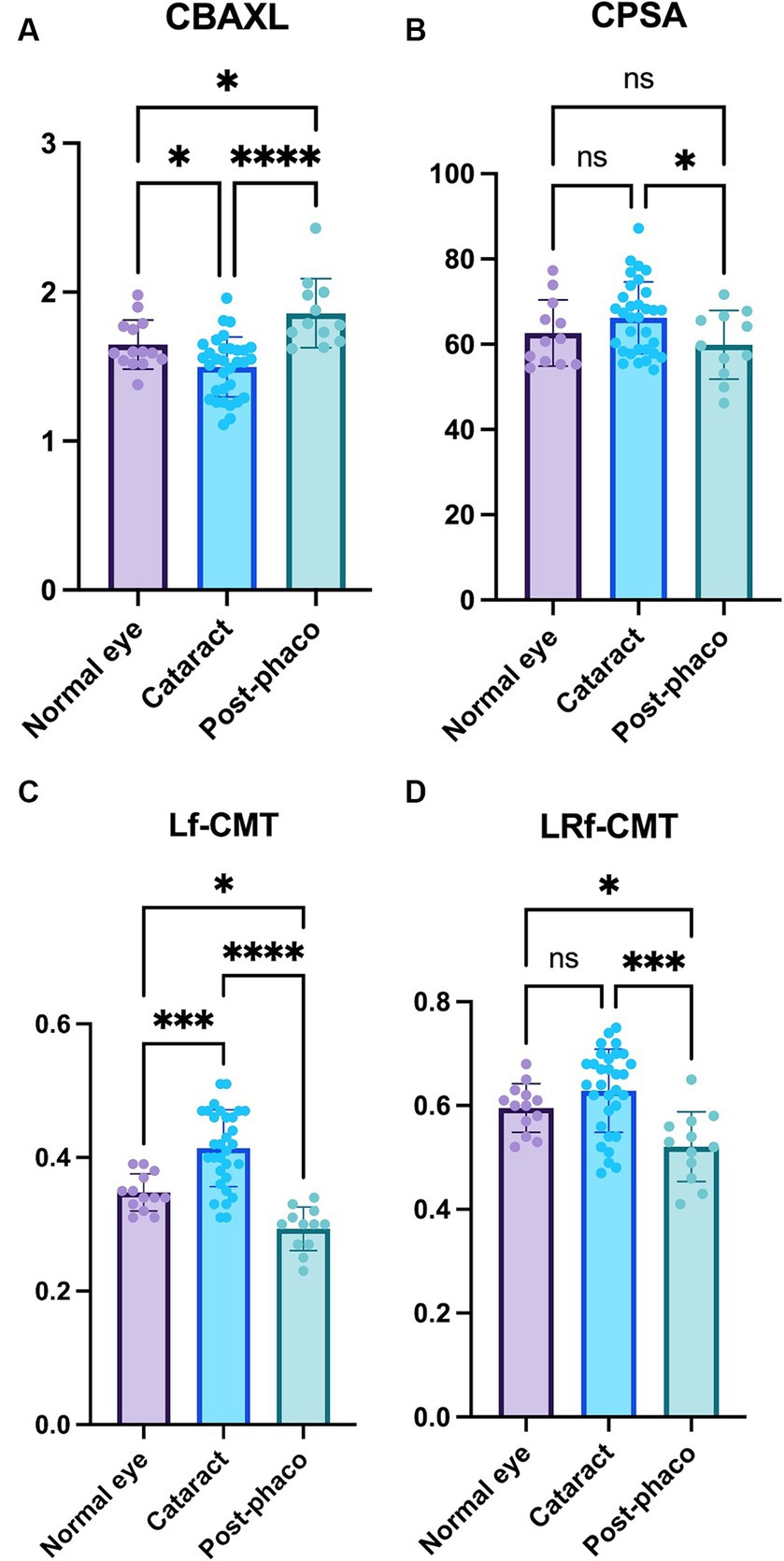 Figura 4. Comparación de los grupos normal, catarata y postfaco (A) Longitud axial del cuerpo ciliar (CBAXL), (B) ángulo de la esclemática de la apófisis ciliar (CPSA), (C) fibra longitudinal del grosor del músculo ciliar (Lf-CMT) y (D) fibra longitudinal y radial del grosor del músculo ciliar-coroideo (LRf-CMT) en el ojo normal (n = 13), catarata (n = 32) y grupos post-faco (n = 12). El estudio reveló diferencias significativas entre los grupos de CBAXL, CPSA, Lf-CMT y LRf-CMT. El grupo de cataratas mostró un valor de CBAXL más pequeño en comparación con el grupo de ojos normales, mientras que el grupo de post-faco mostró un aumento significativo de CBAXL en comparación con el grupo de cataratas. Además, el valor de CBAXL fue mayor en el grupo post-faco que en el grupo de ojo normal. En cuanto a la CPSA, se encontró que era significativamente menor en el grupo post-faco en comparación con el grupo de cataratas. Con respecto a Lf-CMT, el grupo de cataratas mostró un aumento en comparación con el grupo de ojos normales, mientras que el grupo de post-faco mostró una disminución significativa en comparación con el grupo de cataratas. Además, el grupo post-faco mostró una disminución significativa de Lf-CMT en comparación con el grupo de ojos normales. En el caso de la LRf-CMT, se observó que era significativamente menor en el grupo post-faco en comparación con los grupos de cataratas y de ojos normales. El nivel de significación estadística se estableció en p < 0,05, p < 0,01, p < 0,001 y p < 0,0001, denotado por *, **, *** y ****.
Figura 4. Comparación de los grupos normal, catarata y postfaco (A) Longitud axial del cuerpo ciliar (CBAXL), (B) ángulo de la esclemática de la apófisis ciliar (CPSA), (C) fibra longitudinal del grosor del músculo ciliar (Lf-CMT) y (D) fibra longitudinal y radial del grosor del músculo ciliar-coroideo (LRf-CMT) en el ojo normal (n = 13), catarata (n = 32) y grupos post-faco (n = 12). El estudio reveló diferencias significativas entre los grupos de CBAXL, CPSA, Lf-CMT y LRf-CMT. El grupo de cataratas mostró un valor de CBAXL más pequeño en comparación con el grupo de ojos normales, mientras que el grupo de post-faco mostró un aumento significativo de CBAXL en comparación con el grupo de cataratas. Además, el valor de CBAXL fue mayor en el grupo post-faco que en el grupo de ojo normal. En cuanto a la CPSA, se encontró que era significativamente menor en el grupo post-faco en comparación con el grupo de cataratas. Con respecto a Lf-CMT, el grupo de cataratas mostró un aumento en comparación con el grupo de ojos normales, mientras que el grupo de post-faco mostró una disminución significativa en comparación con el grupo de cataratas. Además, el grupo post-faco mostró una disminución significativa de Lf-CMT en comparación con el grupo de ojos normales. En el caso de la LRf-CMT, se observó que era significativamente menor en el grupo post-faco en comparación con los grupos de cataratas y de ojos normales. El nivel de significación estadística se estableció en p < 0,05, p < 0,01, p < 0,001 y p < 0,0001, denotado por *, **, *** y ****.
Con respecto a la Lf-CMT, el grupo de catarata demostró un aumento significativo en comparación con el grupo de ojo normal (0,41 ± 0,06 mm vs. 0,35 ± 0,03 mm; p < 0,001), mientras que el grupo post-faco presentó una disminución significativa en comparación con el grupo de catarata (0,29 ± 0,03 mm vs. 0,41 ± 0,06 mm; p < 0,0001). Además, el grupo post-faco mostró una disminución significativa de Lf-CMT en comparación con el grupo ojo normal (0,29 ± 0,03 mm vs. 0,35 ± 0,03 mm; p < 0,05; Figura 4C). Para LRf-CMT, se observó que fue significativamente menor en el grupo post-faco en comparación con el grupo de catarata (0,52 ± 0,07 mm vs. 0,63 ± 0,08 mm; p < 0,001) y significativamente menor en el grupo post-faco en comparación con el grupo ojo normal (0,52 ± 0,07 mm vs. 0,60 ± 0,05 mm; p < 0,05; Figura 4D).
En general, los resultados indican que los valores de CBAXL y CPSA difieren significativamente entre los grupos de cataratas y post-faco. Además, Lf-CMT y LRf-CMT muestran cambios significativos entre los grupos de ojo normal, catarata y post-faco. Estos hallazgos sugieren que las alteraciones en los valores de los parámetros observadas durante la transición del ojo normal a la formación de cataratas se revierten después de la facoemulsificación.
3.5 Asociaciones entre la PIO y los parámetros medidos
Los resultados del análisis de regresión revelaron asociaciones significativas entre la PIO y los parámetros medidos. En concreto, se observó una asociación positiva entre la PIO y el CBAXL (Figura 5A). El modelo de regresión representó el 7,3% de la varianza de la PIO y la asociación fue estadísticamente significativa (p < 0,05). Por el contrario, se observó una asociación negativa entre la PIO y la CPSA (Figura 5B). Sin embargo, el modelo de regresión explicó solo el 0,1% de la varianza de la PIO y la asociación no fue estadísticamente significativa (p = 0,45).
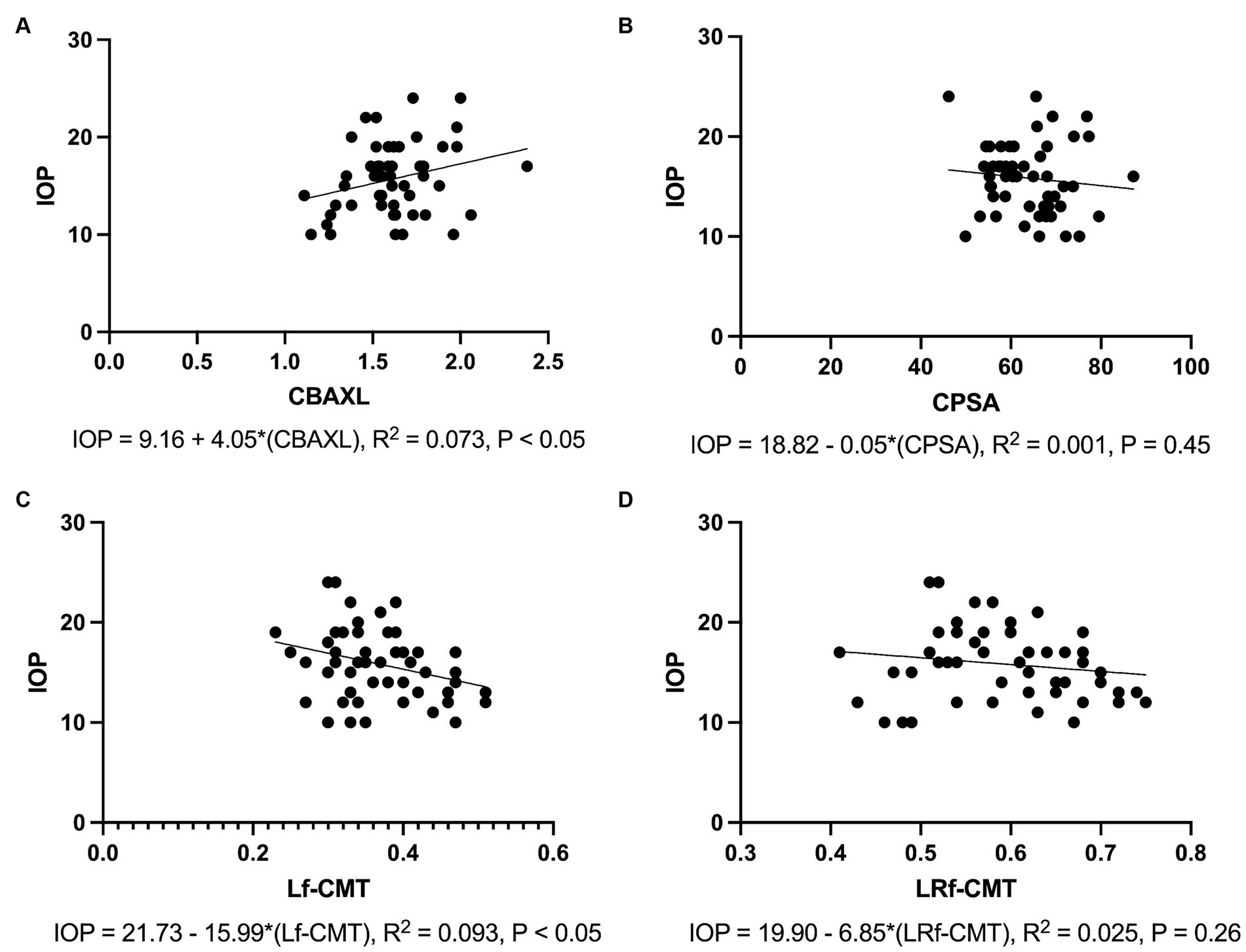 Figura 5. Asociaciones entre la presión intraocular y los parámetros medidos (A) Se observa una asociación positiva entre la PIO y la longitud axial del cuerpo ciliar (CBAXL), siendo el modelo de regresión el 7,3% de la varianza de la PIO (p < 0,05). (B) No se encuentra asociación significativa entre la PIO y el ángulo de la apófisis ciliar-esclerótica (CPSA), y el modelo de regresión explica solo el 0,1% de la varianza de la PIO (p = 0,45). (C) Se observa una asociación negativa entre la PIO y la fibra longitudinal del grosor del músculo ciliar (Lf-CMT), siendo el modelo de regresión el 9,3% de la varianza de la PIO (p < 0,05). (D) No se detecta asociación significativa entre la PIO y la fibra longitudinal y radial del grosor músculo-coroides ciliar (LRf-CMT), explicando el modelo de regresión solo el 2,5% de la varianza de la PIO (p = 0,26).
Figura 5. Asociaciones entre la presión intraocular y los parámetros medidos (A) Se observa una asociación positiva entre la PIO y la longitud axial del cuerpo ciliar (CBAXL), siendo el modelo de regresión el 7,3% de la varianza de la PIO (p < 0,05). (B) No se encuentra asociación significativa entre la PIO y el ángulo de la apófisis ciliar-esclerótica (CPSA), y el modelo de regresión explica solo el 0,1% de la varianza de la PIO (p = 0,45). (C) Se observa una asociación negativa entre la PIO y la fibra longitudinal del grosor del músculo ciliar (Lf-CMT), siendo el modelo de regresión el 9,3% de la varianza de la PIO (p < 0,05). (D) No se detecta asociación significativa entre la PIO y la fibra longitudinal y radial del grosor músculo-coroides ciliar (LRf-CMT), explicando el modelo de regresión solo el 2,5% de la varianza de la PIO (p = 0,26).
En cuanto a la diferencia entre Lf-CMT, se encontró una asociación negativa con la PIO. El modelo de regresión explicó el 9,2% de la varianza de la PIO y la asociación fue estadísticamente significativa (p < 0,05; Figura 5C). Por otro lado, la diferencia entre LRf-CMT mostró una asociación negativa con la PIO. Sin embargo, el modelo de regresión explicó solo el 2,5% de la varianza de la PIO y la asociación no fue estadísticamente significativa (p = 0,26; Figura 5D).
En general, estos resultados indican que CBAXL y Lf-CMT tienen asociaciones significativas con la PIO, lo que sugiere su relevancia potencial en la comprensión de los cambios en la PIO.
4 Discusión
El propósito de este estudio fue investigar los cambios morfológicos del músculo ciliar antes y después de la facoemulsificación, con el objetivo de comprender mejor las causas subyacentes del glaucoma postoperatorio. El músculo ciliar consta de tres capas: fibras longitudinales, fibras radiales y fibras circulares (26). Para examinar estos cambios morfológicos desde diferentes perspectivas, clasificamos los parámetros en dos grupos distintos. El primer grupo incluyó CBAXL y CPSA, que indican la función de las fibras circulares y proporcionan información sobre el movimiento general del cuerpo ciliar (11, 14). El segundo grupo estuvo constituido por Lf-CMT y LRf-CMT, representando la función de las fibras longitudinales y su asociación con la facilidad de salida no convencional (3, 14). Al analizar estos dos grupos de parámetros en perros sometidos a cirugía de cataratas, específicamente después de la facoemulsificación, obtuvimos una comprensión integral de los cambios morfológicos en el músculo ciliar y sus posibles contribuciones al desarrollo del glaucoma.
Este estudio sirve como continuación de nuestra investigación anterior, incorporando algunos de los mismos pacientes. Nuestro objetivo en esta investigación fue realizar un análisis más detallado del cuerpo ciliar, con un enfoque particular en el músculo ciliar. A través de este enfoque, nuestra investigación ha analizado, por primera vez, los efectos del cuerpo ciliar en la expansión y contracción de la hendidura ciliar. Para lograr esto, seleccionamos cuidadosamente imágenes del conjunto de datos anterior que representaban claramente la forma de la cúpula del cuerpo ciliar. Aunque este estudio incluye a algunos de los mismos pacientes de nuestra investigación anterior, es importante tener en cuenta que esta vez utilizamos fotografías diferentes. A diferencia del estudio anterior, que utilizó principalmente imágenes centradas en la hendidura ciliar, la investigación actual seleccionó fotografías que enfatizaban el cuerpo ciliar, incluso cuando involucraban a los mismos pacientes. Esta selección deliberada tenía como objetivo garantizar un examen exhaustivo de las características anatómicas específicas de interés. Al utilizar imágenes con representaciones claras de estas estructuras, buscamos mejorar nuestra comprensión de las complejidades del cuerpo ciliar.
En este estudio, nuestro objetivo fue diversificar nuestras categorizaciones de grupos para mejorar el análisis multifacético de nuestros datos. Inicialmente, analizamos cada parámetro en función de la madurez de la catarata para determinar si existían diferencias significativas en la relajación del cuerpo ciliar en varias etapas. Para superar las limitaciones de las comparaciones entre estos primeros grupos finamente divididos, categorizamos los grupos normales e incipientes como grupos NSM y los grupos inmaduros y maduros como grupos STC para cirugía de cataratas. Esto nos permitió investigar si había cambios significativos en el cuerpo ciliar entre los grupos elegibles para la cirugía de cataratas. Finalmente, dividiendo a los sujetos en grupos normales, de cataratas y post-faco, nos propusimos determinar el grado de diferencia en el cuerpo ciliar postoperatorio en comparación con el de los ojos afectados por cataratas, y cómo se comparan con el grupo normal. Este enfoque estratificado para agrupar fue diseñado para evaluar meticulosamente el impacto de la madurez de las cataratas y la intervención quirúrgica en el comportamiento del cuerpo ciliar.
Estudios previos en humanos han investigado ampliamente los cambios en el músculo ciliar en relación con la acomodación. Los resultados de un estudio realizado en monos rhesus han demostrado que el músculo ciliar experimenta un movimiento anterointerno tras la contracción, mediado principalmente por la acción de fibras circulares. Además, se produce compactación en las fibras longitudinales, lo que resulta en una reducción general del espesor (13, 24, 27). Estos cambios morfológicos en el músculo ciliar pueden observarse como un aumento del CBAXL, que indica un movimiento hacia adentro de los músculos ciliares, y una disminución del CPSA, que refleja el movimiento anterior de los músculos ciliares (10, 11). Del mismo modo, la contracción del músculo ciliar se asocia con una disminución en el valor de Lf-CMT y LRf-CMT.
En nuestro estudio, se observaron varios hallazgos clave relacionados con el movimiento del cuerpo ciliar. En primer lugar, hubo un patrón consistente de disminución del CBAXL a medida que avanzaba la etapa de cataratas en los perros. El grupo de cataratas mostró valores de CBAXL significativamente más bajos en comparación con los del grupo de ojos normales. Si bien la diferencia en CPSA entre los estadios de catarata no fue estadísticamente significativa, se observó una tendencia a que los valores de CPSA aumentaran con la progresión de las cataratas. Estas observaciones implican que a medida que se desarrollan las cataratas, el músculo ciliar tiende a relajarse, lo que lleva al movimiento hacia afuera del cuerpo ciliar. Tales hallazgos se alinean con investigaciones previas realizadas en humanos y respaldan las hipótesis planteadas en nuestro estudio (10, 28). A medida que avanzan las cataratas, se produce un aumento en el grosor del cristalino y un aumento correspondiente en la tensión de las fibras zonales, lo que resulta en un estado biológicamente relajado del cuerpo ciliar (10, 11, 29, 30).
Los resultados después de la facoemulsificación revelaron patrones contrastantes de movimiento del cuerpo ciliar en comparación con los observados en presencia de cataratas. En el grupo post-faco, el valor de CBAXL fue mayor que el del grupo de cataratas, que, a su vez, fue mayor que el del grupo normal. Del mismo modo, para CPSA, el grupo post-faco presentó valores más pequeños en comparación con el grupo de cataratas. Estos hallazgos indican que el músculo ciliar sufre una contracción después de la facoemulsificación, lo que resulta en movimientos hacia adentro y hacia arriba del cuerpo ciliar. Estas observaciones se alinean con estudios previos realizados en humanos, donde la extracción de cataratas condujo a una disminución en el grosor del cristalino, lo que podría reducir la tensión zonular y facilitar un mejor movimiento del cuerpo ciliar (10). Además, cabe destacar que el grado de contracción del músculo ciliar en el grupo post-faco fue mayor que el del ojo normal, probablemente debido a la eliminación completa del material del cristalino. En el caso de CPSA, la magnitud del cambio fue comparativamente menor que la de CBAXL. Esto puede atribuirse al movimiento posterior de la apófisis ciliar causado por la caída posterior de la cápsula del cristalino en el espacio potencial creado por la extracción del cristalino (31).
Con base en los hallazgos de nuestras investigaciones previas, es evidente que el movimiento del cuerpo ciliar ejerce una influencia significativa en el CC. El CC, que asume una forma triangular, existe entre las dos «hojas» distintas del músculo ciliar (8, 32-34). Esta estructura, que reside dentro del músculo ciliar, sufre alteraciones en respuesta al movimiento del cuerpo ciliar. Específicamente, en el caso de la catarata, el CC se expande cuando el músculo ciliar se relaja y el cuerpo ciliar se mueve hacia afuera y hacia atrás. Por el contrario, durante la facoemulsificación, la contracción del músculo ciliar hace que el cuerpo ciliar se desplace hacia adentro y hacia atrás, lo que resulta en el estrechamiento del CC.
Estos hallazgos presentan una contradicción con los estudios en humanos, que demuestran que la contracción del músculo ciliar conduce al ensanchamiento de la malla trabecular (14). Se postula que estas discrepancias surgen debido a variaciones en la posición de la malla trabecular entre humanos y perros. En los seres humanos, la malla trabecular está situada dentro del surco escleral, con los tendones anteriores del músculo ciliar insertándose en la porción externa de la malla corneoescleral y la malla yuxtacanal (5, 35). Por el contrario, en los perros, el músculo ciliar influye directamente en el movimiento del cuerpo ciliar, lo que resulta en la presencia de un CC entre las «hojas» del músculo ciliar (33, 34). En consecuencia, estas distinciones anatómicas contribuyen a los resultados contradictorios observados en humanos y perros.
El CC desempeña un papel fundamental en la salida de AH y tiene un impacto significativo en la regulación de la PIO (36). La expansión y relajación del CC están influenciadas por el músculo ciliar. En este estudio, se realizó un análisis de regresión para explorar la relación entre la PIO y el CBAXL. Los resultados revelaron una correlación positiva entre las dos variables, lo que sugiere que el movimiento del músculo ciliar tiene cierta influencia en la PIO. Sin embargo, es importante señalar que esta correlación, aunque estadísticamente significativa, solo representó el 7,3% de la varianza en la PIO. Esto implica que el control de la PIO no se logra únicamente a través de la manipulación del CC a través de la contracción y relajación del músculo ciliar. Se sabe que la contracción del músculo ciliar facilita la apertura de los canales colectores radiales y aumenta la vía de salida convencional en estudios en humanos. (8 y 37). Además, es crucial reconocer que varios factores, como la producción de AH, la presión arterial y la edad, también pueden influir en la PIO (38). A pesar de estas complejidades, todavía se considera que el movimiento del músculo ciliar tiene un efecto significativo en la PIO, destacando su relevancia en la regulación general de la dinámica ocular.
En segundo lugar, examinamos el grosor del músculo ciliar. A medida que avanzaba la etapa de catarata, hubo un aumento notable en los valores de Lf-CMT. De hecho, la mayoría de las etapas mostraron diferencias estadísticamente significativas, con solo unas pocas excepciones. Al comparar el grupo STC con el grupo NSM, el grupo STC exhibió valores significativamente más altos de Lf-CMT. También se observaron diferencias significativas similares entre el grupo de ojo normal y el grupo de cataratas. Sin embargo, no se encontraron diferencias significativas en LRf-CMT cuando se compararon los grupos en función de la progresión de la catarata. Estos hallazgos apoyan la idea de que el músculo ciliar tiende a relajarse a medida que avanza la catarata, lo que es consistente con los resultados obtenidos para CBAXL y CPSA. En concreto, es destacable el notable aumento de grosor observado en las fibras longitudinales durante la relajación en comparación con las fibras radiales.
Después de la facoemulsificación, los cambios en el grosor del músculo ciliar mostraron un patrón contrastante en comparación con la enfermedad de cataratas. En el grupo post-faco, los valores de Lf-CMT y LRf-CMT fueron menores en comparación con el grupo de cataratas, que, a su vez, fueron menores que los del grupo normal. Como se mencionó anteriormente, esto se puede atribuir a la contracción del músculo ciliar después de la eliminación del material del cristalino a través de la facoemulsificación, lo que lleva a una disminución de la tensión en las zonulas. A diferencia de la comparación con los pacientes con catarata, la diferencia en los valores de LRf-CMT fue estadísticamente significativa. Esto sugiere que el músculo radial exhibe una relajación mínima en presencia de cataratas, mientras que el efecto de contracción debido a la facoemulsificación es más pronunciado.
El músculo ciliar sirve como el sitio principal de resistencia para las vías de salida no convencionales (39-41). Estas vías, incluidas las uveoesclerales, uveovórtices y uveolinfáticas, atraviesan los espacios intersticiales del músculo ciliar (2). Otras vías, como la iridal y la corneal, se consideran insignificantes en términos de flujo de salida no convencional (42). Entre estas salidas, el camino a través del músculo ciliar es particularmente crucial, ya que actúa como un paso limitante de la frecuencia (4). A medida que la AH pasa a través de los espacios intersticiales entre los músculos ciliares, la contracción y relajación de los músculos ciliares, es decir, su tono, ejercen la mayor influencia sobre el flujo de la AH (3). La contracción del músculo ciliar hace que las fibras musculares individuales se hinchen y se compacten, reduciendo el espacio intersticial y aumentando la resistencia a la AH (41). Por ejemplo, en el estudio de Bill et al. sobre medicina humana, se observó que en los ojos que no recibieron ningún medicamento durante un período de 48 h, el flujo uveoescleral constituyó el 4 y el 14% del flujo total de salida. Cuando se administra atropina, que induce la relajación del músculo ciliar, el flujo uveoescleral representa aproximadamente del 4 al 27% del flujo total de salida del humor acuoso. Esto contrasta marcadamente con los efectos de la administración de pilocarpina, que provoca la contracción del músculo ciliar y conduce a una reducción significativa del flujo uveoescleral, que oscila entre el 0 y el 3%. Esta investigación subraya cómo los cambios en el tono del músculo ciliar pueden alterar significativamente el flujo de salida uveoescleral (43, 44).
Con base en esta perspectiva, en este estudio, la rápida disminución de Lf-CMT y LRf-CMT observada después de la facoemulsificación indica una reducción en el espacio intersticial del músculo ciliar, lo que resulta en una inhibición significativa del flujo de AH. Además, los pacientes con catarata exhibieron una Lf-CMT relativamente mayor, lo que indica un espacio intersticial más amplio del músculo ciliar y una menor resistencia al flujo de AH. En cuanto a la diferencia en Lf-CMT, se observó una asociación negativa con la PIO. El modelo de regresión representó el 9,3% de la varianza de la PIO y la asociación fue estadísticamente significativa. Teniendo en cuenta que la salida no convencional contribuye a aproximadamente el 15% de la salida total en perros, la contribución del 9,3% de Lf-CMT se considera sustancial. Por el contrario, el análisis de regresión de LRf-CMT y PIO no arrojó resultados estadísticamente significativos. Esto puede deberse a que el flujo de AH ocurre predominantemente a través de las fibras longitudinales en lugar de las fibras radiales (39). En estudios previos que utilizan técnicas de perfusión convencionales, se ha demostrado que el flujo de AH desde el músculo ciliar se produce a través de los espacios intersticiales entre los haces longitudinales del músculo ciliar y hacia los espacios supraciliares y supracoroides (45-47).
La simple medición del grosor del músculo ciliar no proporciona una comprensión completa del paso de la AH a través del músculo ciliar. Se sabe que el tejido conectivo presente en el espacio intersticial del músculo ciliar impide el flujo de la AH (8, 40, 48). Los estudios realizados en humanos han reportado un aumento en la proporción de tejido conectivo en esta área, de aproximadamente el 20% en individuos de 30 a 40 años a más del 50% en individuos de 60 años o más (12, 49). Es probable que este aumento reduzca la cantidad de HA que pasa por la vía uveoescleral. Estudios similares en medicina veterinaria han revelado que los beagles con glaucoma avanzado tienden a acumular melanóforos y desarrollan una matriz extracelular abundante en fibras elásticas dentro de su cuerpo ciliar. Estos depósitos pueden contribuir a una elevada resistencia a la salida no convencional y, posteriormente, reducir la salida no convencional en estos animales (50). Sin embargo, dado que no hubo diferencias de edad estadísticamente significativas entre los grupos de este estudio, se supone que la escala de tejido conectivo no difirió significativamente. Por lo tanto, el grosor del músculo ciliar se considera un factor importante que influye en el flujo de salida no convencional.
En nuestro artículo anterior, propusimos que los medicamentos profilácticos dirigidos a la producción de AH, como los betabloqueantes y los inhibidores de la anhidrasa carbónica, pueden ser útiles para reducir la elevación de la PIO causada por el estrechamiento del CC después de la facoemulsificación (28). Además, en base a los hallazgos de este estudio, se estima que fármacos como la fenilefrina, que relajan el músculo ciliar al actuar sobre el sistema nervioso parasimpático, podrían ser potencialmente beneficiosos en este contexto (51). Se necesitarán más investigaciones relacionadas con este tema para investigar y validar la eficacia potencial de estos medicamentos.
Este estudio reconoce ciertas limitaciones. La distinción precisa de las fibras musculares ciliares individuales utilizando UBM es un desafío (24). Por lo tanto, la ubicación de cada fibra se estimó en base al conocimiento anatómico. Las mediciones se realizaron asumiendo que las fibras longitudinales se colocan justo debajo de la esclerótica y corren paralelas al iris, las fibras radiales se sitúan entre las fibras longitudinales y circulares, y las fibras circulares se originan en el iris posterior (8, 26, 52). A pesar de que estos parámetros se obtuvieron a través de la estimación, este estudio es significativo como la primera investigación veterinaria que clasifica anatómicamente los músculos ciliares y explica sus funciones individuales. Además, es de gran importancia establecer correlaciones entre estos componentes anatómicos y el flujo de la AH, así como identificar las posibles causas de glaucoma tras la facoemulsificación.
Otra limitación de este estudio es la exclusión de las cataratas hipermaduras. En las cataratas hipermaduras, el cristalino comienza a encogerse y la cápsula del cristalino aparece arrugada. En esta etapa, a menudo se produce uveítis inducida por el cristalino (LIU) (53). Esta investigación se centró en el endurecimiento y engrosamiento del cristalino, junto con los cambios resultantes en la tensión zonular y los efectos en el cuerpo ciliar. Por lo tanto, se plantea la hipótesis de que en los casos de cataratas hipermaduras, el nivel de tensión zonular podría ser menor que en las cataratas maduras, y la contracción del cuerpo ciliar podría ser más pronunciada. Además, la LIU podría conducir a la relajación del músculo ciliar y una consiguiente disminución de la PIO (54). Para evitar confusiones en los resultados de la investigación debido a estos múltiples factores interferentes, se excluyeron de este estudio las cataratas hipermaduras.
Otra limitación de esta investigación es la utilización de tropicamida al 0,5%. Conocida por su potencial para elevar la PIO al inducir la contracción de la hendidura ciliar, la tropicamida también sirve como agente ciclopléjico, paralizando el músculo ciliar (35, 55). A pesar de esto, la aplicación consistente de tropicamida en todos los participantes en este estudio probablemente ayudó a minimizar el impacto de las diferentes respuestas del esfínter del iris debido a los niveles de luz, contribuyendo así a la uniformidad de las mediciones de UBM. También se observa que la concentración del 0,5% de tropicamida utilizada no se considera lo suficientemente potente como para lograr una cicloplejia completa (56).
Con base en los hallazgos de este estudio, se pueden considerar dos perspectivas clave: el movimiento del músculo ciliar y el grosor del músculo ciliar (Figura 6). En primer lugar, en pacientes con cataratas, la relajación del músculo ciliar conduce a la expansión del CC y a un aumento del grosor del músculo ciliar. Por el contrario, después de la facoemulsificación, el músculo ciliar se contrae, lo que hace que el CC colapse y el grosor del músculo ciliar disminuya. Estos cambios sugieren un aumento en la resistencia al flujo de salida convencional y no convencional después de la facoemulsificación, lo que podría contribuir potencialmente al desarrollo del glaucoma.
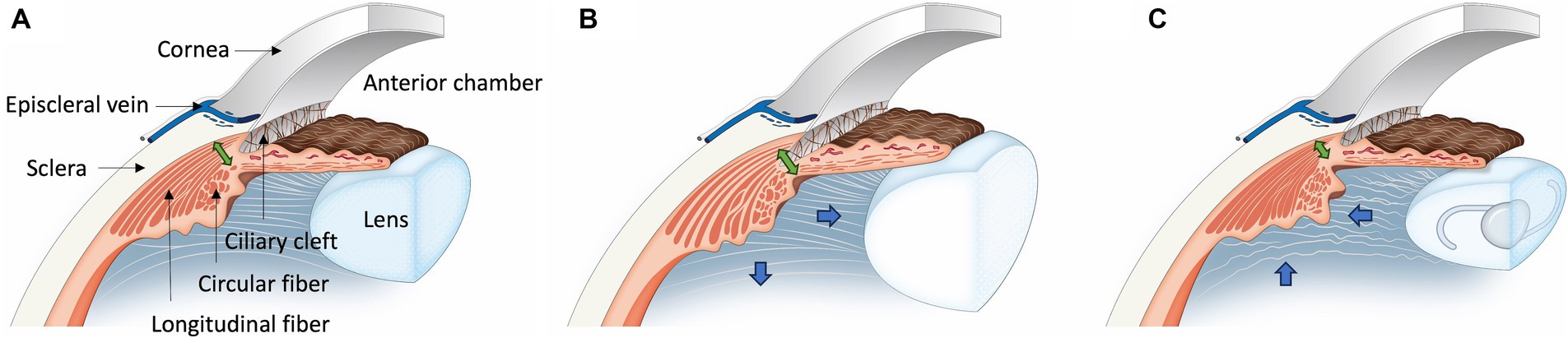 Figura 6. Ilustración de los cambios en el músculo ciliar después de la facoemulsificación en perros con cataratas. (A) En el Grupo Normal de Ojos, el músculo ciliar mantiene su posición normal. (B) Para el ojo de cataratas, hay un movimiento hacia afuera y hacia atrás (flecha azul) del músculo ciliar en comparación con el ojo normal, lo que lleva a una expansión de la hendidura ciliar y un aumento en el grosor de la fibra longitudinal (flecha doble verde). Además, hay un aumento en el espacio intersticial entre las fibras musculares ciliares longitudinales. (C) En el grupo Post-Phaco Eye, el músculo ciliar se desplaza hacia adentro y hacia delante (flecha azul), más pronunciado que en el ojo de cataratas, lo que resulta en un estrechamiento de la hendidura ciliar. En comparación con el grupo de cataratas y el ojo normal, el grosor de la fibra longitudinal es más delgado (flecha doble verde). Además, se produce una disminución del espacio intersticial entre las fibras musculares ciliares longitudinales.
Figura 6. Ilustración de los cambios en el músculo ciliar después de la facoemulsificación en perros con cataratas. (A) En el Grupo Normal de Ojos, el músculo ciliar mantiene su posición normal. (B) Para el ojo de cataratas, hay un movimiento hacia afuera y hacia atrás (flecha azul) del músculo ciliar en comparación con el ojo normal, lo que lleva a una expansión de la hendidura ciliar y un aumento en el grosor de la fibra longitudinal (flecha doble verde). Además, hay un aumento en el espacio intersticial entre las fibras musculares ciliares longitudinales. (C) En el grupo Post-Phaco Eye, el músculo ciliar se desplaza hacia adentro y hacia delante (flecha azul), más pronunciado que en el ojo de cataratas, lo que resulta en un estrechamiento de la hendidura ciliar. En comparación con el grupo de cataratas y el ojo normal, el grosor de la fibra longitudinal es más delgado (flecha doble verde). Además, se produce una disminución del espacio intersticial entre las fibras musculares ciliares longitudinales.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
Los estudios en animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Nacional de Chungbuk. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
DK: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición. S-EP: Investigación, Recursos, Escritura – borrador original. JH: Investigación, Recursos, Escritura – borrador original. NK: Investigación, Recursos, Escritura – borrador original. JJ: Investigación, Recursos, Escritura – borrador original. K-MP: Supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo de la «Estrategia Regional de Innovación (RIS)» a través de la Fundación Nacional de Investigación de Corea (NRF) financiada por el Ministerio de Educación (MOE) (2021 RIS-001). Este trabajo también contó con el apoyo del Programa de Laboratorio de Investigación Básica (2022R1A4A1025557) financiado por el Ministerio de Ciencia y TIC y la subvención del Fondo Coreano de Medicina Regenerativa (KFRM) (Ministerio de Ciencia y TIC, Ministerio de Salud y Bienestar) No. 22A0101L1-11.
Reconocimientos
El Centro Médico Clear Eye Animal en Daejeon, JW Park, proporcionó los datos del paciente. Además, JH Ahn también contribuyó con los datos de los pacientes, y les expresamos nuestra gratitud.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Bárány, EH. El modo de acción de los mióticos sobre la resistencia al flujo de salida. Un estudio de pilocarpina en el mono vervet Cercopithecus ethiops. Trans Ophthalmol Soc U K. (1962) 1966:539–78.
2. Johnson, M, McLaren, JW, y Overby, DR. Flujo de humor acuoso no convencional: una revisión. Exp Eye Res. (2017) 158:94–111. doi: 10.1016/j.exer.2016.01.017
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Lütjen-Drecoll, E, y Tamm, E. Estudio morfológico del segmento anterior de los ojos de mono cynomolgus después del tratamiento con prostaglandina F2 alfa. Exp Eye Res. (1988) 47:761–9. doi: 10.1016/0014-4835(88)90043-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Alm, A, y Nilsson, SFE. Flujo de salida uveoescleral: una revisión. Exp Eye Res. (2009) 88:760–8. doi: 10.1016/j.exer.2008.12.012
5. Rohen, JW, Lütjen, E, y Bárány, E. Relación entre el músculo ciliar y la malla trabecular y su importancia para el efecto de los mióticos sobre la resistencia al flujo acuoso. Un estudio en dos especies de monos contrastantes, Macaca irus y Cercopithecus aethiops. Albrecht Von Graefes Arch Klin Exp Ophthalmol. (1967) 172:23–47. doi: 10.1007/BF00577152
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Sanders, MT, Morton, JM, Kaese, HJ, Ford, M, y Stanley, RG. Asociación entre el estado gonioscópico preoperatorio y el glaucoma postoperatorio después de la facoemulsificación en perros: un estudio de cohorte retrospectivo de 505 ojos. Veterinario Oftalmológico. (2021) 24:39–49. doi: 10.1111/vop.12818
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Miller, PE, Stanz, KM, Dubielzig, RR, y Murphy, CJ. Mecanismos de aumento de la presión intraocular aguda después de la extracción de lentes de facoemulsificación en perros. Am J Vet Res. (1997) 58:1159–65. doi: 10.2460/ajvr.1997.58.10.1159
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Pizzirani, S, y Gong, H. Anatomía funcional de las instalaciones de salida. Vet Clin North Am Small Anim Pract. (2015) 45:1101–26. doi: 10.1016/j.cvsm.2015.06.005
9. Miller, PE y Bentley, E. Signos clínicos y diagnóstico de los glaucomas primarios caninos. Vet Clin North Am Small Anim Pract. (2015) 45:1183–212. doi: 10.1016/j.cvsm.2015.06.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Park, KA, Yun, JH y Kee, C. Efecto de la extracción de cataratas sobre la contractilidad del músculo ciliar. Am J Ophthalmol. (2008) 146:8–14.e2. doi: 10.1016/j.ajo.2008.02.026
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Fayed, AAE. Valor de la biomicroscopía ecográfica en la evaluación de la restauración de la contractilidad de los músculos ciliares tras la extracción de cataratas. Clin Ophthalmol. (2017) 11:855–9. doi: 10.2147/OPTH. S131399
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Tamm, S, Tamm, E y Rohen, JW. Cambios relacionados con la edad del músculo ciliar humano. Estudio morfométrico cuantitativo. Dev. Mech Ageing. (1992) 62:209–21. doi: 10.1016/0047-6374(92)90057-K
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Lütjen-Drecoll, E, Tamm, E y Kaufman, PL. Pérdida relacionada con la edad de las respuestas morfológicas a la pilocarpina en el músculo ciliar del mono rhesus. Arch Ophthalmol. (1988) 106:1591–8. doi: 10.1001/archopht.1988.01060140759051
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Goel, M, Picciani, RG, Lee, RK y Bhattacharya, SK. Dinámica del humor acuoso: una revisión. Abrir Ophthalmol J. (2010) 4:52–9. doi: 10.2174/1874364101004010052
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Bill, A. Efectos de la atropina y la pilocarpina en la dinámica del humor acuoso en monos cynomolgus (Macaca irus). Exp Eye Res. (1967) 6:120. doi: 10.1016/S0014-4835(67)80062-9
16. Fan, Q, Teo, Y-Y, y Saw, S-M. Aplicación de la estadística avanzada en oftalmología. Invertir Ophthalmol Vis Sci. (2011) 52:6059–65. doi: 10.1167/iovs.10-7108
17. Dziezyc, J, Wolf, ED, y Barrie, KP. Reparación quirúrgica de desprendimientos de retina regmatógenos en perros. J Am Vet Med Assoc. (1986) 189:902–4.
18. Miller, TR, Whitley, RD, Meek, LA, García, GA, Wilson, MC y Rawls, BH Jr. Facofragmentación y aspiración para la extracción de cataratas en perros: 56 casos (1980-1984). J Am Vet Med Assoc. (1987) 190:1577–80.
19. Davidson, MG, Nasisse, MP, Breitschwerdt, EB, Thrall, DE, Page, RL, Jamieson, VE, et al. Ceguera aguda asociada a tumores intracraneales en perros y gatos: ocho casos (1984-1989). J Am Vet Med Assoc. (1991) 199:755–8. doi: 10.2460/javma.1991.199.06.755
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Sigle, KJ, y Nasisse, MP. Complicaciones a largo plazo tras la facoemulsificación para la eliminación de cataratas en perros: 172 casos (1995-2002). J Am Vet Med Assoc. (2006) 228:74–9. doi: 10.2460/javma.228.1.74
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Yi, NY, Park, SA, Jeong, MB, Kim, WT, Kim, SE, Chae, JM, et al. Facoemulsificación e implante de lentes intraoculares plegables de acrílico en perros: 32 casos. J Vet Sci. (2006) 7:281–5. doi: 10.4142/jvs.2006.7.3.281
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Lim, CC, Bakker, SC, Waldner, CL, Sandmeyer, LS, y Grahn, BH. Cataratas en 44 perros (77 ojos): comparación de los resultados de ningún tratamiento, manejo médico tópico o facoemulsificación con implante de lentes intraoculares. ¿Puede Vet J. (2011) 52:283–8.
23. Erdoğan, S, Akbalık, M, Sağsöz, H, y Saruhan, B. Estudio morfológico del ángulo iridocorneal y del cuerpo ciliar de los perros pastores de Anatolia (Canis familiaris). Kafkas üniversitesi veteriner fakültesi dergisi. (2015), 21:677–684. doi: 10.9775/kvfd.2015.13060
24. Fernández-Vigo, JI, Kudsieh, B, Shi, H, De-Pablo-Gómez-de-Liaño, L, Fernández-Vigo, J, y García-Feijóo, J. Diagnóstico por imagen del cuerpo ciliar: tecnologías, resultados y perspectivas de futuro. Eur J Ophthalmol. (2022) 32:75–88. doi: 10.1177/11206721211031409
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Wagner, S, Zrenner, E y Strasser, T. Perfiles de grosor del músculo ciliar derivados de imágenes de tomografía de coherencia óptica. Biomed Opt Express. (2018) 9:5100–14. doi: 10.1364/BOE.9.005100
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Tamm, ER, y Lütjen-Drecoll, E. Cuerpo ciliar. Microsc Res Tech. (1996) 33:390–439. doi: 10.1002/(SICI)1097-0029(19960401)33:5<390::AID-JEMT2>3.0.CO; 2-S
27. Kaufman, PL, Lütjen Drecoll, E, y Croft, MA. Presbicia y glaucoma: ¿dos enfermedades, una fisiopatología? La conferencia Friedenwald de 2017. Invertir Ophthalmol Vis Sci. (2019) 60:1801–12. doi: 10.1167/iovs.19-26899
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Kim, D, Goh, Y-S, Kim, H, Park, S-E, Hwang, J, Kang, N, et al. Evaluación de los cambios en la hendidura ciliar tras facoemulsificación mediante biomicroscopía ecográfica en perros con cataratas. Fronteras en veterinaria. Ciencia. (2023) 10:10. doi: 10.3389/fvets.2023.1247127
29. Croft, MA, Heatley, G, McDonald, JP, Katz, A, y Kaufman, PL. Movimientos acomodativos del cristalino/cápsula y la hebra que se extiende entre la zona de inserción de la zonula vítrea posterior y el ecuador del cristalino, en relación con la cara vítrea y el envejecimiento. Fisiol Oftálmico Opt. (2016) 36:21–32. doi: 10.1111/opo.12256
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Glasser, A. Restauración de la acomodación: opciones quirúrgicas para la corrección de la presbicia. Clin Exp Optom. (2008) 91:279–95. doi: 10.1111/j.1444-0938.2008.00260.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Yang, K, Liang, Z, Lv, K, Ma, Y, Hou, X y Wu, H. Cambios en los parámetros del segmento anterior después de la cirugía de cataratas en ojos de ángulo abierto y ángulo cerrado: un estudio prospectivo. J Clin Med. (2022) 12. doi: 10.3390/jcm12010327
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Kawata, M, Tsukizawa, H, Nakayama, M y Hasegawa, T. Rectificación de la anchura y el área de la hendidura ciliar en perros. J Vet Med Sci. (2010) 72:533–7. doi: 10.1292/jvms.09-0507
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Boillot, T, Rosolen, SG, Dulaurent, T, Goulle, F, Thomas, P, Isard, PF, et al. Determinación de susceptibilidades morfológicas, biométricas y bioquímicas en perros Eurasier sanos con sospecha de glaucoma hereditario. PLoS Uno. (2014) 9:e111873. doi: 10.1371/journal.pone.0111873
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Dulaurent, T, Goulle, F, Dulaurent, A, Mentek, M, Peiffer, RL, e Isard, P-F. Efecto de la midriasis inducida por instilaciones tópicas de tropicamida al 0,5% sobre el segmento anterior en perros normotensos mediante biomicroscopía ecográfica. Veterinario Oftalmológico. (2012) 15:8–13. doi: 10.1111/j.1463-5224.2011.00898.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Dubin, AJ, Bentley, E, Buhr, KA y Miller, PE. Evaluación de los posibles factores de riesgo para el desarrollo de glaucoma primario de ángulo cerrado en Bouviers des Flandres. J Am Vet Med Assoc. (2017) 250:60–7. doi: 10.2460/javma.250.1.60
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Jay, JL. Organización funcional del ojo humano. Hno. J Anaesth. (1980) 52:649–54. doi: 10.1093/bja/52.7.649
38. Murgatroyd, H, y Bembridge, J. Presión intraocular. Educación continua: Anestesia, cuidados intensivos y dolor. (2008) 8:100–3. doi: 10.1093/bjaceaccp/mkn015
39. Lindsey, JD, y Weinreb, RN. Identificación de la vía de salida uveoescleral del ratón mediante dextrano fluorescente. Invertir Ophthalmol Vis Sci. (2002) 43:2201–5.
40. Johnson, MP, y Kw, E. El humor acuoso y la dinámica de su flujo: mecanismos y rutas del drenaje del humor acuoso. en los Principios y la práctica de la oftalmología de Albert y Jakobiec. Eds. Albert, D.M., Miller, J.W., Azar, D.T., Young, L.H. Springer, Cham. (2000).
41. Bill, A, y Hellsing, K. Producción y drenaje del humor acuoso en el mono cynomolgus (Macaca irus). Investig Ophthalmol. (1965) 4:920–6.
42. Observaciones sobre el ángulo de drenaje en el hombre y el mono RHESUS: un concepto de la patogénesis del GLAUCOMA simple crónico. Un estudio microscópico de luz y electrones. Investig Ophthalmol. (1964) 3:609–46.
43. Crawford, K, y Kaufman, PL. La pilocarpina antagoniza la hipotensión ocular inducida por la prostaglandina F2α en monos: evidencia de la mejora del flujo de salida uveoescleral por la prostaglandina F2α. Arch Ophthalmol. (1987) 105:1112–6. doi: 10.1001/archopht.1987.01060080114039
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Bill, A, y Phillips, CI. Drenaje uveoescleral del humor acuoso en ojos humanos. Exp Eye Res. (1971) 12:275–81. doi: 10.1016/0014-4835(71)90149-7
45. Inomata, H, Bill, A y Smelser, GK. Rutas no convencionales de salida de humor acuoso en mono Cynomolgus (Macaca irus). Am J Ophthalmol. (1972) 73:893–907. doi: 10.1016/0002-9394(72)90459-X
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Aihara, M, Lindsey, JD, y Weinreb, RN. Reducción de la presión intraocular en ojos de ratón tratados con latanoprost. Invertir Ophthalmol Vis Sci. (2002) 43:146–50.
47. Toris, CB, Gregerson, DS, y Pederson, JE. Flujo de salida uveoescleral mediante trazadores fluorescentes de diferentes tamaños en ojos normales e inflamados. Exp Eye Res. (1987) 45:525–32. doi: 10.1016/S0014-4835(87)80063-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Weinreb, RN, Lindsey, JD, Luo, XX, y Wang, TH. Matriz extracelular del músculo ciliar humano. J Glaucoma. (1994) 3:70–8. doi: 10.1097/00061198-199400310-00012
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Strenk, S.A., Semmlow, J.L., Strenk, L.M., Muñoz, P., Gronlund-Jacob, J., y DeMarco, J.K. Cambios relacionados con la edad en el músculo ciliar humano y el cristalino: un estudio de imágenes por resonancia magnética. Invertir Ophthalmol Vis Sci. (1999) 40:1162–9.
50. Samuelson, D, y Streit, A. Microanatomía de la vía de salida uveoescleral anterior en perros glaucomatosos normales y primarios de ángulo abierto. Veterinario Oftalmológico. (2012) 15:47–53. doi: 10.1111/j.1463-5224.2011.00943.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Richdale, K, Bailey, MD, Sinnott, LT, Kao, CY, Zadnik, K, y Bullimore, MA. El efecto de la fenilefrina sobre el músculo ciliar y la acomodación. Optom Vis Sci. (2012) 89:1507–11. doi: 10.1097/OPX.0b013e318269c8d0
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Adriana Silva Borges, G, y Jair, GJ. Anatomía del cuerpo ciliar, procesos ciliares, ángulo de la cámara anterior y vasos colectores En: R Shimon, editor. Glaucoma. Rijeka: IntechOpen (2013). 1.
53. Fischer, MC y Meyer-Lindenberg, A. Progresión y complicaciones de las cataratas caninas para diferentes etapas de desarrollo y etiologías. J Pequeña Anim Pract. (2018) 59:616–24. doi: 10.1111/jsap.12910
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Townsend, WM. Uveítis canina y felina. Vet Clin North Am Small Anim Pract. (2008) 38:323–46. doi: 10.1016/j.cvsm.2007.12.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Kovalcuka, L, Ilgazs, A, Bandere, D, y Williams, DL. Cambios en la presión intraocular y en el diámetro horizontal de la pupila durante el uso de midriáticos tópicos en el ojo canino. Open Vet J. (2017) 7:16–22. doi: 10.4314/ovj.v7i1.3
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Yoo, SG, Cho, MJ, Kim, US y Baek, SH. Refracción ciclopléjica en niños hipermétropes: efectividad de una adición de tropicamida al 0,5% y fenilefrina al 0,5% al régimen de ciclopentolato al 1%. Coreano J Ophthalmol. (2017) 31:249–56. doi: 10.3341/kjo.2016.0007
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: hendidura ciliar, cuerpo ciliar, músculo ciliar, facoemulsificación, glaucoma, biomicroscopía ecográfica, humor acuoso, catarata
Cita: Kim D, Park S-E, Hwang J, Kang N, Jung JS y Park K-M (2024) Análisis de biomicroscopía ultrasónica de la dinámica del músculo ciliar y su relación con la presión intraocular después de la facoemulsificación en perros. Frente. Vet. Sci. 11:1366997. doi: 10.3389/fvets.2024.1366997
Recibido: 08 de enero de 2024; Aceptado: 30 de abril de 2024;
Publicado: 09 Mayo 2024.
Editado por:
Soohyun Kim, Universidad de California, Davis, Estados Unidos
Revisado por:
Lauren Charnock, Universidad de California, Davis, Estados
Unidos Shin Ae Park, Universidad de Purdue, Estados Unidos
Derechos de autor © 2024 Kim, Park, Hwang, Kang, Jung y Park. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Parque Kyung-mee, parkkm@cbu.ac.kr
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía