Evaluación de un sistema de biopsia con núcleo congelado guiado por ultrasonido para tumores cerebrales caninos y felinos
Evaluación de un sistema de biopsia con núcleo congelado guiado por ultrasonido para tumores cerebrales caninos y felinos
 Brian S. Adams1
Brian S. Adams1  Domingo J. Marino1*
Domingo J. Marino1*  Catherine A. Loughin1
Catherine A. Loughin1  Leonard J. Marino1
Leonard J. Marino1  Teresa Southard2
Teresa Southard2  Martín L. Menor3
Martín L. Menor3  Meredith Akerman3
Meredith Akerman3  Patricio Roynard1,4
Patricio Roynard1,4- 1Departamento de Cirugía, Especialistas Veterinarios de Long Island, Plainview, NY, Estados Unidos
- 2Sección de Anatomía Patológica, Departamento de Ciencias Biomédicas, Universidad de Cornell, Ithaca, NY, Estados Unidos
- 3Unidad de Bioestadística, North Shore—LIJ Health System Feinstein Institute for Medical Research, Manhasset, NY, Estados Unidos
- 4Centro Médico Veterinario, Departamento de Neurología y Neurocirugía, Universidad Estatal de Ohio, Columbus, OH, Estados Unidos
Objetivo: Para determinar si una sola biopsia cerebral que utiliza un sistema de recolección de agujas con núcleo congelado Cassi II bajo guía de ultrasonido proporciona una muestra de diagnóstico; evaluar la eficacia de la técnica en la obtención de muestras diagnósticas en comparación con las biopsias quirúrgicas «abiertas»; y describir las complicaciones intraoperatorias asociadas a la técnica.
Diseño del estudio: Estudio clínico experimental.
Animales: Diecisiete perros y cuatro gatos con imágenes por resonancia magnética (IRM) diagnosticaron masas intracraneales fácilmente accesibles quirúrgicamente.
Métodos: Inmediatamente antes de la biopsia quirúrgica (SB), se obtuvo una muestra de biopsia con núcleo congelado (FCB) de cada paciente bajo guía ecográfica.
Resultados: Se encontró que los resultados histopatológicos de las muestras individuales de FCB estaban en un 100% de acuerdo con las muestras de SB. El artefacto de congelación fue mínimo y no interfirió con la interpretación histopatológica. No hubo complicaciones intraoperatorias específicamente atribuibles al uso del sistema FCB.
Conclusión: Sobre la base de los resultados de este pequeño estudio experimental, se espera que el sistema FCB produzca de forma segura muestras de biopsia de masas intracraneales de calidad diagnóstica.
Importancia clínica: Este sistema tiene el potencial de obtener biopsias diagnósticas de lesiones cerebrales más profundas (es decir, tumores intraaxiales considerados inaccesibles o con grandes riesgos/dificultades por medios quirúrgicos estándar) que proporcionarían un diagnóstico definitivo para guiar la terapia adecuada.
Introducción
En pacientes con sospecha de enfermedad intracraneal, es posible proporcionar una presunta localización neuroanatómica basada en la anamnesis, la señalización y el examen neurológico completo. Se necesitan imágenes transversales avanzadas (p. ej., tomografía computarizada [TC] o resonancia magnética [RM]) para confirmar y delinear con precisión la localización (1, 2). Aunque estas modalidades avanzadas de imagen han mejorado en gran medida la capacidad de tratar enfermedades intracraneales de pequeños animales (lesiones cerebrales neoplásicas, inflamatorias y cerebrovasculares), son lo suficientemente poco fiables como para proporcionar un diagnóstico definitivo (3, 4), pero el examen combinado del análisis del líquido cefalorraquídeo (LCR) puede ayudar a descartar procesos inflamatorios y apoyar un diagnóstico de neoplasia (5). Aunque tanto la TC como la RM proporcionan detalles valiosos sobre la presencia, la ubicación y el tamaño de las masas intracraneales, junto con el efecto sobre las estructuras intracraneales adyacentes (p. ej., el sistema ventricular), el detalle superior que ofrece la RM la convierte en la opción preferida para obtener imágenes del cerebro (6). Varios estudios han demostrado que la resonancia magnética puede dar un diagnóstico presuntivo para algunos tumores cerebrales caninos; Sin embargo, al igual que en los pacientes humanos, la precisión varía sustancialmente (3, 4, 7-14).
La evaluación histopatológica sigue siendo el «estándar de oro» para hacer un diagnóstico definitivo con una lesión intracraneal y, a menudo, es un componente necesario para la planificación precisa del tratamiento (12-15). Desafortunadamente, el permiso para la biopsia no siempre es otorgado por los propietarios debido a las limitaciones financieras y el riesgo de morbilidad. Se han descrito varias técnicas de biopsia cerebral junto con imágenes en pacientes humanos y veterinarios. Estos incluyen sistemas a mano alzada vs. sistemas estereotácticos, sistemas basados en marcos vs. sistemas sin marco, y el uso de diversas modalidades de imagen, como guiadas por ultrasonido, guiadas por TC (12, 16-23) y guiadas por resonancia magnética (21, 24-26). Con cada una de las técnicas antes mencionadas, la recomendación actual es recolectar múltiples muestras de tejido para mejorar el éxito; sin embargo, esto puede resultar en un aumento de la morbilidad (21, 24, 27-29). La morbilidad y la mortalidad asociadas con cada uno de los métodos de biopsia asistida por imágenes antes mencionados son difíciles de comparar, ya que algunos perros también se sometieron a la extirpación quirúrgica de la masa cerebral inmediatamente después del procedimiento de biopsia. Moissonnier (19) reportó un 27% de morbilidad y un 8% de mortalidad, mientras que Koblick (16) reportó un 12% de morbilidad y un 7% de mortalidad.
Una ventaja teórica de la técnica de biopsia con aguja helada (FCB) es que una sola muestra de biopsia produciría resultados diagnósticos debido a la mayor adherencia del tejido del tumor a la aguja de muestreo congelada, lo que reduce el riesgo de morbilidad del paciente (28, 29). La indicación principal para el uso de un instrumento de biopsia pequeño con guía ecográfica para los tumores cerebrales es para lesiones que no son fácilmente accesibles quirúrgicamente (por ejemplo, tumores profundos). Estas lesiones menos accesibles a menudo no se biopsian debido al temor a una morbilidad y mortalidad inaceptables asociadas con la biopsia quirúrgica (SB) convencional. Para validar tanto la nueva técnica de biopsia propuesta como el instrumento de biopsia FCB, los autores llevaron a cabo este estudio inicial en masas intracraneales fácilmente accesibles, de modo que el material de biopsia obtenido a través de la RL convencional pudiera utilizarse como comparación o «estándar de oro». En este estudio se describe una nueva técnica de biopsia con guía ecográfica de un sistema FCB, Cassi II1, para obtener muestras de tumores cerebrales, junto con cualquier complicación intraoperatoria inmediata. Se planteó la hipótesis de que la técnica proporcionaría muestras diagnósticas y que el diagnóstico histológico sería similar al obtenido con la RL.
Materiales y métodos
Inclusión de pacientes y recogida de datos
Fueron admitidos en el estudio perros y gatos con diagnóstico de resonancia magnética de una masa intracraneal tratados con craneotomía y extirpación de masa en nuestro hospital durante tres años consecutivos. Solo se incluyeron pacientes con masas que se consideraron fácilmente accesibles a través de una craniectomía transfrontal estándar o una craneectomía lateral (rostrotentorial) estándar/modificada. Se registró la siguiente información: señalización, análisis de sangre (p. ej., hemograma completo y perfil bioquímico sérico), hallazgos del examen neurológico, resultados de la resonancia magnética, histopatología de la biopsia con aguja gruesa (FCB) de 10 g de Cassi II y de la biopsia quirúrgica (SB), complicaciones intraoperatorias, complicaciones postoperatorias y tratamiento médico pre y postoperatorio.
Anestesia y preparación preoperatoria
Cada paciente fue anestesiado para la cirugía de manera similar. Los pacientes fueron premedicados con atropina (0,022-0,044 mg/kg por vía subcutánea), Maropitant 1 mg/kg IV e hidromorfona (0,1 mg/kg por vía subcutánea) e inducidos con propofol (3-6 mg/kg por vía intravenosa). La anestesia se mantuvo con isoflurano. Se administró cefazolina intravenosa (22 mg/kg) al inicio de la cirugía y cada 90 min durante la cirugía. Se administró manitol (0,5 g/kg IV durante 10-15 min) y succinato sódico de metilprednisolona (30 mg/kg IV) antes de la operación. Las resonancias magnéticas se realizaron con un escáner de 3,0 Tesla2 dentro de los 7 días previos a la cirugía en todos los pacientes. Se obtuvieron imágenes sagitales y transversales ponderadas en T2 (eco de espín rápido), imágenes sagitales y transversales ponderadas en T1 con y sin administración intravenosa de gadolinio (Magnevist, gadopentato dimeglumina, Bayer Healthcare Pharmaceuticals; 0,1 mmol/kg). La cabeza del paciente fue recortada desde el nivel de C1 hasta aproximadamente el nivel de los agujeros infraorbitarios. A continuación, se colocó al animal en decúbito esternal, con la cabeza ligeramente elevada y la cabeza y el cuello en un ángulo de ~90° entre sí, y se preparó asépticamente para la cirugía. Se tuvo cuidado de no comprimir las venas yugulares externas.®
La instrumentación del sistema de biopsia con núcleo congelado Cassi II
El sistema de biopsia por núcleo congelado Cassi II (Figura 1) utiliza una aguja de sujeción guiada por ultrasonido de calibre 19 x 2 cm de longitud y una cánula de corte dentada de calibre 10. Un CO2 La «congelación rápida» localiza el tejido objetivo alrededor de la aguja de sujeción, seguido del avance de la cánula de corte giratoria. La aguja de sujeción estabiliza la muestra mediante congelación por contacto, mientras que la cánula de corte giratoria minimiza el desplazamiento distal de la muestra de biopsia durante la cosecha, lo que da como resultado la muestra de núcleo congelada (Figura 2). La muestra de biopsia obtenida mide ~1,5-2 cm de largo y 3-4 mm de ancho.
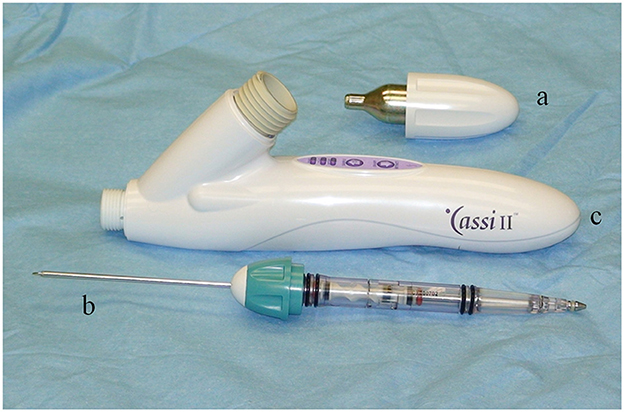 Figura 1. El sistema de biopsia por núcleo congelado Sanarus Cassi II utiliza un CO2 Cartucho (A) para proporcionar enfriamiento para la rápida «congelación de la barra» y una aguja de sujeción combinada y una cánula de corte giratoria (B). La pieza de mano contiene los botones de control operativo (c).
Figura 1. El sistema de biopsia por núcleo congelado Sanarus Cassi II utiliza un CO2 Cartucho (A) para proporcionar enfriamiento para la rápida «congelación de la barra» y una aguja de sujeción combinada y una cánula de corte giratoria (B). La pieza de mano contiene los botones de control operativo (c).
 Figura 2. La aguja de sujeción (a) estabiliza la muestra mediante congelación por contacto (b) mientras que la cánula de corte giratoria avanza y se retrae revelando la muestra de biopsia (c). Configuración quirúrgica típica y posicionamiento para la biopsia (d).
Figura 2. La aguja de sujeción (a) estabiliza la muestra mediante congelación por contacto (b) mientras que la cánula de corte giratoria avanza y se retrae revelando la muestra de biopsia (c). Configuración quirúrgica típica y posicionamiento para la biopsia (d).
Técnica quirúrgica
El procedimiento quirúrgico fue realizado en todos los pacientes por el mismo cirujano primario (DJM). Se realizó una craniectomía rostrotentorial transfrontal o lateral y se accedió a la región apropiada del cerebro según los hallazgos de la resonancia magnética como se describió anteriormente (1, 21, 30, 31). La craniectomía se amplió utilizando un rongeur para permitir la huella de la sonda de ultrasonido (1,75 cm), así como un «espacio de trabajo» adicional de 0,5 cm para acomodar la instrumentación del FCB. Un ecógrafo intraoperatorio dedicado, Afia, E-Technologies3, que incluye sondas microconvexas esterilizadas de 12 y 20 MHz se utilizó para la técnica FCB. Después de la identificación exitosa de la masa con ecografía intraoperatoria, se realizaron incisiones en las meninges subyacentes. Se tuvo cuidado de evitar la laceración del seno sagital dorsal dentro de la falx cerebri. El sangrado fue mínimo y se controló con cauterización bipolar y esponja de espuma en gel (Baxter Healthcare Corp, Hayward CA). La aguja de estabilización del FCB se colocó intralesionalmente mediante ecografía intraoperatoria (véase la nota 3), se activó el sistema de biopsia con aguja helada, se giró el instrumento 90° y se retiró. Se realizó una biopsia de FCB por cada tumor (Figura 3). A continuación, se logró la eliminación de masa como se describió anteriormente con un aumento de 3X utilizando un telescopio de campo expandido4. Se extirparon todos los tumores visibles y el tejido sospechoso de ser anormal según la resonancia magnética mediante manipulación y aspiración manuales, y la cavidad vacía se enjuagó con solución salina (31, 32). No se hizo ningún intento de cerrar completamente el defecto dural y el sitio de la craniectomía se cubrió con material hemostático (Gelfoam). La placa ósea no fue reemplazada. El músculo temporal y los tejidos subcutáneos se colocaron con suturas interrumpidas simples utilizando material de sutura de polidioxanona (PDS) 3-0 o 4-0. Los especímenes de biopsia se etiquetaron de acuerdo con el método de recolección, SB vs. FCB, y se enviaron para análisis histopatológico.
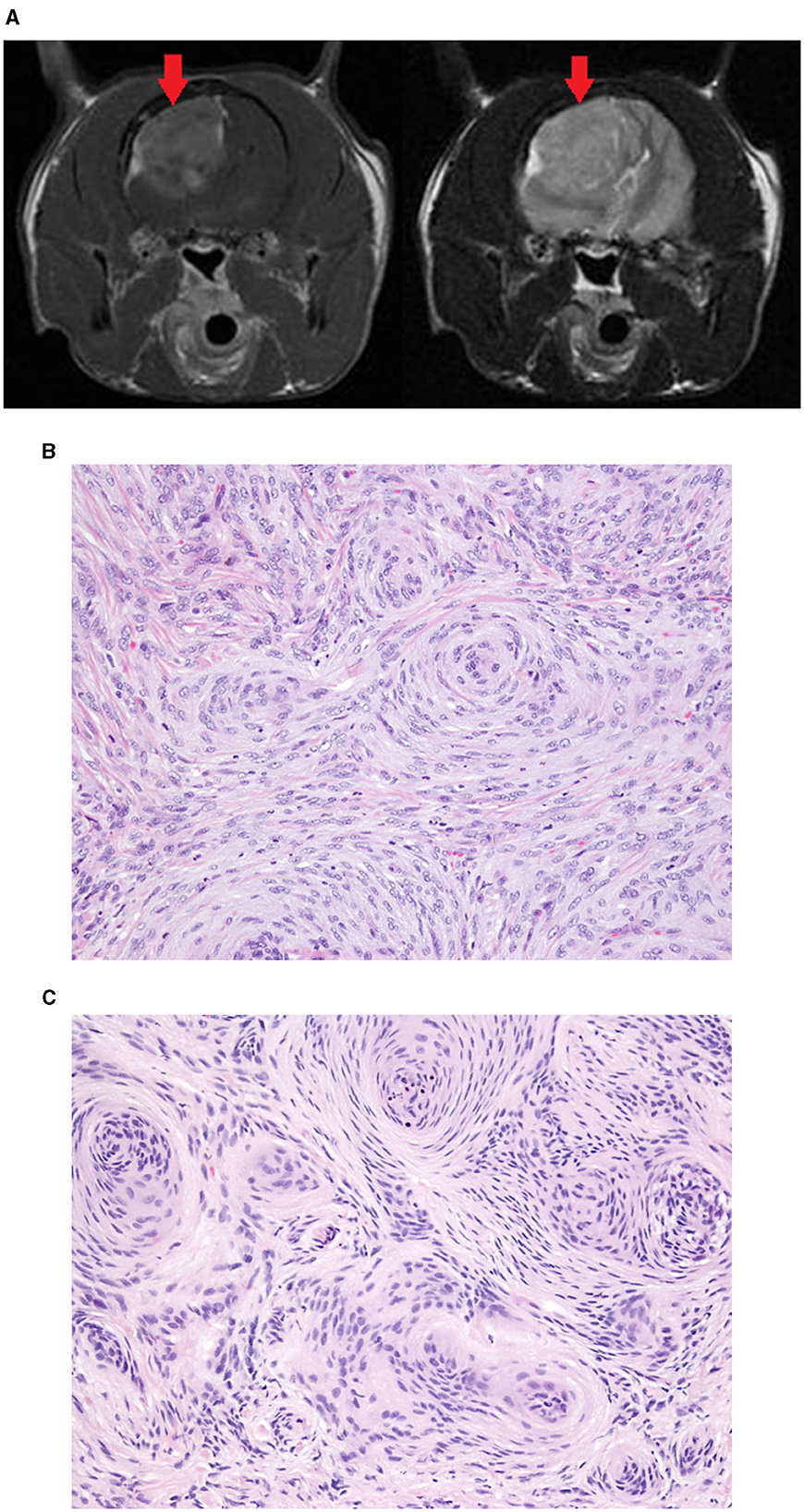 Figura 3. Meningioma extirpado del lóbulo parietal de un niño de 9 años de edad. Imágenes de RM transversales T1W post-contraste (izquierda) y T2W (derecha) (A) que muestran la gran masa (flecha roja). Tanto en la biopsia quirúrgica (B) como en la biopsia de Cassi (C) la masa se diagnosticó como meningioma. Las muestras de biopsia de Cassi tienen núcleos reducidos con cromatina de tinción más oscura y una pérdida leve de detalles nucleares y citoplasmáticos en comparación con las muestras de biopsia quirúrgica.
Figura 3. Meningioma extirpado del lóbulo parietal de un niño de 9 años de edad. Imágenes de RM transversales T1W post-contraste (izquierda) y T2W (derecha) (A) que muestran la gran masa (flecha roja). Tanto en la biopsia quirúrgica (B) como en la biopsia de Cassi (C) la masa se diagnosticó como meningioma. Las muestras de biopsia de Cassi tienen núcleos reducidos con cromatina de tinción más oscura y una pérdida leve de detalles nucleares y citoplasmáticos en comparación con las muestras de biopsia quirúrgica.
Análisis histopatológico
Tanto las muestras de tejido SB como FCB se fijaron en formol tamponado al 10%, se procesaron de forma rutinaria y se tiñeron con hematoxilina y eosina. En la evaluación de las muestras histológicas, el evaluador no conocía el origen del paciente de las muestras de tejido SB y FCB. El diagnóstico se basó en el examen histológico de los tejidos. No se pudo utilizar un sistema de puntuación publicado porque se evaluaron varios tipos de tumores. Cada biopsia se evaluó en cuatro componentes: (1) tasa mitótica, (2) atipia celular, (3) necrosis y (4) inflamación. Se utilizó un sistema de puntuación para evaluar cada uno de los componentes en una escala de 1 a 3. Para la tasa mitótica: 1 = < 2 mitosis/10 campos de alta potencia (HPF), 2 = 3-10 mitosis/10 HPF y 3 = >10 mitosis/10 HPF. Para la necrosis, la atipia celular y la inflamación, la puntuación fue la siguiente: 1 = leve, 2 = moderada y 3 = grave.
Métodos estadísticos
Se calculó estadística descriptiva para los n = 21 animales. Se calcularon frecuencias y porcentajes para los datos categóricos y la media ± la desviación estándar; Se calcularon la mediana, el mínimo y el máximo para los datos continuos. Para los resultados continuos (es decir, la tasa mitótica y la puntuación de inflamación), se utilizó el método de Bland y Altman para examinar las correlaciones entre los pares, FCB y SB (33). Este método utiliza técnicas de análisis de covarianza para calcular las correlaciones entre pares de variables recogidas como mediciones repetidas, es decir, si la tasa mitótica de FCB se correlaciona con la tasa mitótica de SB. Se construyeron diagramas de Bland-Altman, pero no influyeron en el análisis de ninguna manera y, por lo tanto, no se informaron. Los «límites de concordancia» del 95% se calcularon de tal manera que si tanto el límite inferior como el superior son pequeños (en valor absoluto), entonces las dos mediciones pueden considerarse equivalentes. Por otro lado, si alguno de los límites es grande, entonces las dos medidas no son equivalentes. El hecho de que un límite se considere pequeño o grande depende, en parte, del juicio clínico y del tamaño del límite en relación con la estructura o, en este caso, la distancia que se mide.
De manera similar, se utilizó el coeficiente kappa (κ) como medida de concordancia entre el FCB y el SB por separado para resultados categóricos como puntaje mitótico, atipia celular, necrosis e inflamación. El intervalo de confianza del 95% correspondiente para cada uno de estos kappas se calculó e interpretó de manera análoga a la de los límites de acuerdo de Bland-Altman. Es decir, si el límite inferior del intervalo de confianza kappa era inaceptablemente bajo, ello era motivo suficiente para afirmar que no se había establecido un acuerdo. Landis y Koch (34-36) utilizaron las siguientes pautas descritas para caracterizar la fuerza de concordancia del coeficiente kappa: ≤ 0,20 = pobre, 0,21-0,40 = regular, 0,41-0,60 = moderado, 0,61-0,80 = bueno y 0,81-1 = muy bueno (34-36). Estos descriptores también se utilizaron para describir el intervalo de confianza inferior del 95%.
Cuidados postoperatorios y seguimiento
Después de la recuperación, los pacientes fueron monitoreados en cuidados intensivos durante 48 h y se les administraron líquidos isotónicos intravenosos (IV) (0,45% NaCl/2,5% dextrosa, 66 mL/kg/día) suplementados con cloruro de potasio 10 mEq/500 mL, hasta que cada paciente bebió y comió por su cuenta. En este estudio no se utilizó ningún sistema de monitorización de la presión intracraneal. El tiempo de recuperación se monitorizó prospectivamente, pero no se pudo recuperar con precisión en el momento de escribir este manuscrito (debido a un cambio en el software del hospital).
En el postoperatorio, se administró buprenorfina intravenosa (0,3 ug/kg, cada 8 h) y cefalexina intravenosa (22 mg/kg, cada 8 h) durante 24 h. La temperatura se controló cada hora hasta que fue normal durante 3 o más lecturas. Los análisis electrolíticos se realizaron a discreción del cirujano. Se administró succinato sódico de metilprednisolona (30 mg/kg IV) 6 h después de la dosis preoperatoria y se inició la administración de prednisona (0,5 mg/kg) cada 12 h por vía subcutánea si el paciente no estaba comiendo y por vía oral cuando el paciente estaba comiendo.
Resultados
Diecisiete perros y cuatro gatos se sometieron a biopsia masiva de FCB asistida por ultrasonido y posterior extirpación masiva de la SB, cumpliendo así los criterios de inclusión en el estudio. Los 17 perros incluían las siguientes razas: tres Labradores Retriever, tres Golden Retrievers y uno de Pitbull, Cocker spaniel, mestizo, Schnauzer miniatura, Dachshund, Pastor Australiano, Pastor Shetland, Cacatúa, Perro Pastor Alemán, Boston Terrier y Maltés. Los cuatro gatos eran gatos domésticos de pelo corto. La edad media de los perros en el momento de la cirugía fue de 9,4 años (rango: 4-14), mientras que la edad media de los gatos fue de 15,3 años (rango: 14-18). Había 10 machos castrados, siete hembras esterilizadas y dos machos castrados, y dos hembras esterilizadas. El peso medio de los perros fue de 23,2 kg (rango: 8,6-36,8 kg) y de 5,1 kg (rango: 2,7-9,0 kg) para los gatos.
Se resume la localización neuroanatómica basada en imágenes de RM, dimensiones de masa y resultados histopatológicos de FCB y SB (Tabla 1). No se observaron muertes ni complicaciones intraoperatorias o postoperatorias.
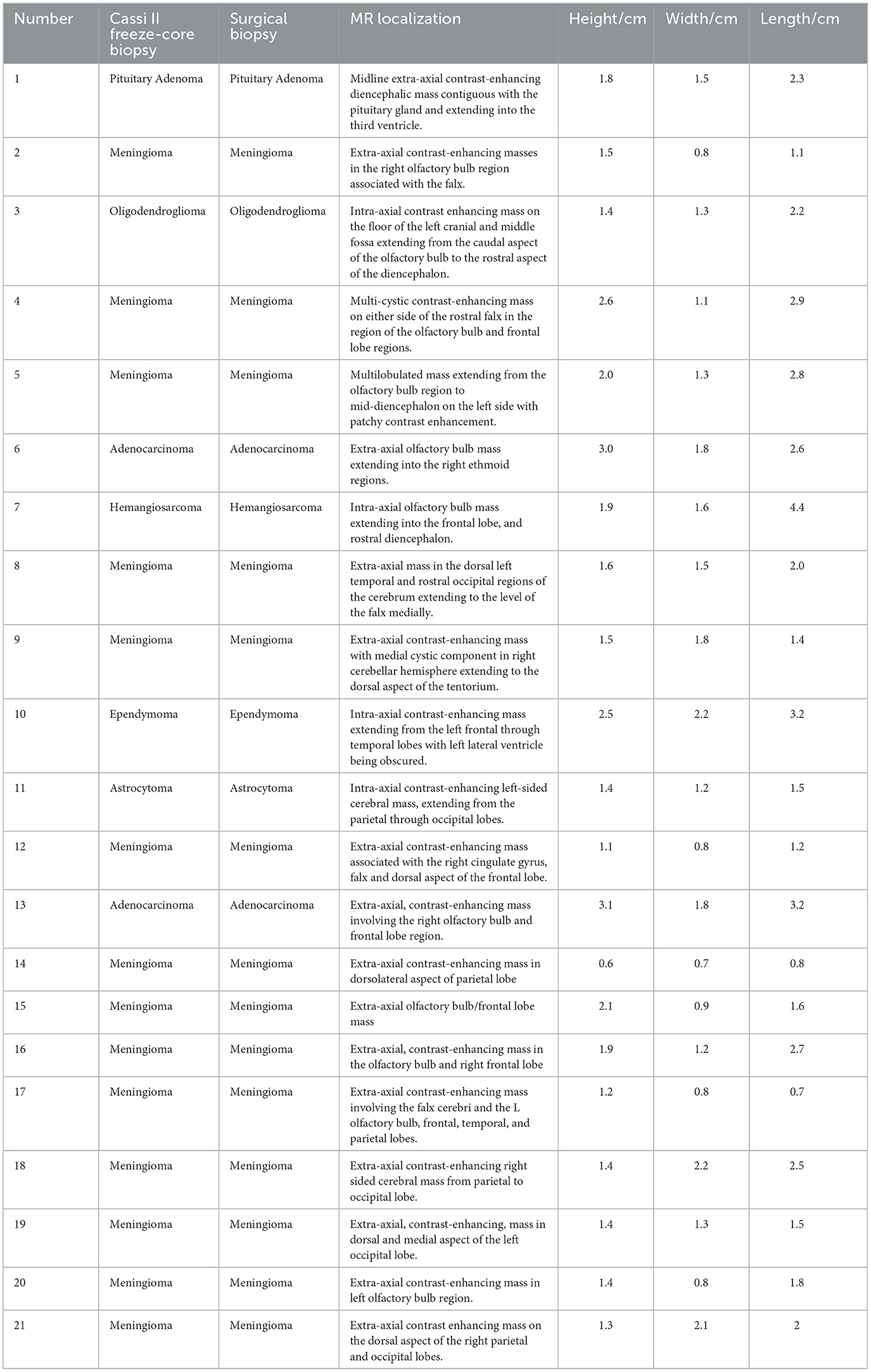 Tabla 1. Se resumen los resultados histopatológicos de la biopsia con aguja helada y la biopsia quirúrgica de Cassi II, la localización neuroanatómica basada en imágenes de RM y las dimensiones de la masa.
Tabla 1. Se resumen los resultados histopatológicos de la biopsia con aguja helada y la biopsia quirúrgica de Cassi II, la localización neuroanatómica basada en imágenes de RM y las dimensiones de la masa.
Una sola muestra de FCB de una masa intracraneal es de calidad diagnóstica. Los resultados histopatológicos del sistema FCB coincidieron con los resultados histopatológicos de la RL en el 100% de las 21 muestras. La arquitectura tisular en las muestras de Cassi fue muy similar a la de las muestras de biopsia tradicionales. No había hendiduras en los tejidos, lo que sugiere la formación de cristales de hielo. Las células en las muestras de Cassi a menudo tenían núcleos ligeramente reducidos con cromatina de tinción más oscura y una leve pérdida de detalles nucleares y citoplasmáticos en comparación con las muestras tradicionales. Estos cambios fueron sutiles y no interfirieron con el diagnóstico. Las biopsias de Cassi fueron biopsias incisionales y, por lo tanto, no permitieron una evaluación completa de la invasividad y los márgenes quirúrgicos. La concordancia de la puntuación mitótica para el FCB y el SB fue muy buena [κ = 0,87 (IC 95%: 0,61, 1,00)]. Para la atipia celular, la concordancia entre el FCB y la RL fue buena [κ = 0,61 (IC 95%: 0,29, 0,93)]. Para la necrosis celular entre el BCF y la SB, la concordancia fue buena [κ = 0,72 (IC 95%: 0,44, 1,00)] y para la inflamación, la concordancia para la BCF y la SB fue buena [κ = 0,68 (IC 95%: 0,37, 0,98)]. La diferencia media de la tasa mitótica fue de −0,89 (IC del 95%: −6,27, 4,48). Los límites de concordancia para la tasa mitótica oscilaron entre -6,27 y 4,48 en una medición que promedió -0,89. La diferencia media en la puntuación de inflamación fue de -0,37 (IC del 95%: -1,89, 1,15). Los límites de concordancia para la puntuación de inflamación oscilaron entre -1,89 y 1,15 en una medida que promedió -0,37.
Discusión
Todas las técnicas de biopsia cerebral asistida por imagen reportadas en la literatura y mencionadas en la introducción de este manuscrito utilizaron agujas de biopsia por aspiración de corte lateral, con una precisión diagnóstica que osciló entre el 73 y el 97% (27). Se han reportado tasas de precisión variables con diferentes métodos de biopsia asistida por imagen en casos clínicos que oscilan entre el 91 y el 95% (16, 19). En el estudio publicado por Koblick (16), hubo una amplia variación en el rendimiento diagnóstico para subgrupos histológicos particulares, que osciló entre el 50% para las lesiones sin contraste y el 100% para los meningiomas, sin embargo, se informó un bajo número de casos. El sistema de biopsia con núcleo congelado Cassi II tuvo éxito en la producción de muestras de biopsia cerebral que tenían el tamaño y la calidad diagnóstica suficientes para ser evaluadas histológicamente en los 21 casos (100%). Este sistema demostró la obtención de una muestra diagnóstica con una sola biopsia.
Dado que se esperaba que nuestro estudio incluyera múltiples tipos de tumores, teniendo en cuenta la variabilidad interobservador informada en la evaluación de los grados de los tumores cerebrales (p. ej., gliomas) (37), y para poder comparar la muestra de FCB frente a la muestra de SB en este rango de tumores diferentes, los grados específicos de tumor no fueron un criterio inicialmente retenido (los criterios fueron tasa mitótica, atipia celular, necrosis, e inflamación). Por lo tanto, el rendimiento diagnóstico evaluado en nuestro estudio fue el tipo de tumor y los cuatro criterios especificados, no el grado tumoral. Aunque es común a los estudios previos de biopsia cerebral (16, 17), esto es una limitación de nuestro estudio y los estudios futuros sobre la evaluación de la FCB en tumores profundos y de fácil acceso deberían incluir idealmente los grados tumorales en su informe. Utilizando nuestro sistema de puntuación, encontramos una muy buena concordancia entre el FCB y la RL para la puntuación mitótica, y una buena concordancia para la atipia celular, la necrosis y la inflamación [κ = 0,68 (IC 95%: 0,37, 0,98)]. En el examen histopatológico de las muestras de «congelación en barra», el artefacto de congelación fue mínimo y no comprometió la interpretación. Los resultados histopatológicos son un componente esencial para diseñar planes de tratamiento en pacientes humanos y veterinarios con tumores cerebrales (6, 10, 32). Es posible que una biopsia quirúrgica no sea posible por muchas razones, incluidas las financieras, el riesgo de morbilidad o las ubicaciones «profundas» del tumor.
La RM fue inicialmente responsable de la localización neuroanatómica y la planificación quirúrgica, sin embargo, no se requirieron equipos costosos o raros, como la RM o el sistema estereotáctico guiado por TC para el procedimiento. Los sistemas estereotácticos utilizan coordenadas tridimensionales para identificar los objetivos de la biopsia dentro del cerebro. Se ha descrito el uso de marcos estereotácticos tanto en pacientes humanos como veterinarios (18-21, 25, 26). Debido al costo y las demandas técnicas de los sistemas de armazón estereotáctico, se han desarrollado técnicas a mano alzada sin armazón y asistidas por ultrasonido y se ha comprobado que tienen éxito tanto en medicina humana como veterinaria (38-40). La ecografía cerebral intraoperatoria es una modalidad de diagnóstico por imágenes menos costosa, no requiere un blindaje sofisticado para el quirófano, ofrece visualización del tejido cerebral en tiempo real (incluidos los cambios perioperatorios como el desplazamiento cerebral y la reducción del tamaño del tumor) y puede ser más fácil de lograr en los hospitales veterinarios especializados. Se requieren imágenes ultrasonográficas y habilidades interpretativas para utilizar con éxito esta modalidad, así como una familiaridad con la anatomía ultrasonográfica intracraneal (38). Nuestros resultados son consistentes con los hallazgos exitosos de un informe previo de una técnica de biopsia cerebral a mano libre asistida por ultrasonido (39).
La técnica descrita en este documento requiere dos habilidades distintas para completar la recolección de muestras de FCB. Una vez que se crea el portal operatorio, se obtienen imágenes de la masa cerebral mediante el ultrasonido intraoperatorio y se mantiene en tiempo real mientras se coloca intralesionalmente la aguja de seguridad del sistema de biopsia con núcleo congelado Cassi II. Aunque un cirujano puede realizar ambas tareas, es preferible que un cirujano o asistente genere la imagen mientras el otro opera el sistema de biopsia (véase la figura 2d).
No se observaron complicaciones intraoperatorias con el sistema de biopsia con núcleo congelado Cassi II que se utilizó en el tejido cerebral; La hemorragia se consideró mínima.
Otra limitación de nuestro estudio, concretamente si se intenta comparar la morbimortalidad con otras técnicas de biopsia, es el hecho de que la extirpación/citorreducción quirúrgica del tumor se realizó durante el mismo procedimiento, siguiendo el FCB. Las craneectomías realizadas, que tuvieron que adaptarse tanto a la colocación de la sonda de ultrasonido como a la manipulación suficiente del tejido cerebral para permitir la citorreducción macroscópica, fueron, por lo tanto, más grandes que los enfoques de orificio de fresa utilizados clásicamente para la biopsia. Aunque esto puede haber resultado en un mayor tiempo de anestesia y procedimiento, los neurocirujanos veterinarios experimentados han recomendado craneectomías subjetivamente grandes para permitir una mejor visualización, hemostasia y, en general, una extirpación quirúrgica más fácil de los tumores (41, 42). La ecografía intraoperatoria también permite obtener imágenes en tiempo real sin preocuparse por el desplazamiento cerebral intraoperatorio y la detección de hemorragias, lo que posiblemente mejore la seguridad del paciente (43). Aunque nuestro estudio no incluyó monitorización directa de la PIC postoperatoria ni RM postoperatoria (debido al coste asociado), la recuperación de todos los pacientes transcurrió sin complicaciones y todos sobrevivieron al alta hospitalaria.
Con base en los resultados de este estudio, el sistema de biopsia por núcleo congelado Cassi II produce de manera segura muestras de biopsia cerebral de calidad diagnóstica. La utilidad clínica y la seguridad de este sistema en la obtención de biopsias de lesiones cerebrales más profundas (es decir, tumores intraaxiales considerados inaccesibles o con grandes riesgos/dificultades por medios quirúrgicos estándar) está siendo investigada actualmente por los autores. La mayoría de los tumores en esta investigación (14/21) fueron meningiomas. Teniendo en cuenta tanto los desafíos quirúrgicos como la naturaleza histológica más variable de los tumores gliales intracraneales, estamos específicamente interesados en la utilidad de este sistema de biopsia para el diagnóstico de gliomas.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Ética de Especialistas Veterinarios de Long Island. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
BA: Escritura, borrador original. DM: Supervisión, Redacción, borrador original. CL: Redacción: borrador original, supervisión. LM: Escritura, borrador original. TS: Escritura, borrador original. ML: Curación de datos, redacción, borrador original. MA: Redacción, borrador original. PR: Redacción, revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Notas
1. ^Cassi II, Scion Medical Technologies, Newton, MA 02458, EE. UU.
2. ^Achieva, Philips, Andover, MA 01810, Estados Unidos.
3. ^Afia, E-Technologies, Bettendorf, IA 52722, EE. UU.
4. ^Diseños para Visión, Inc., Ronkonkoma, NY, EE. UU.
Referencias
1. Dewey CW. Encefalopatías: trastornos del cerebro. En: Dewey CW, y Da Costa, RC, , editores. Guía Práctica de Neurología Canina y Felina. Ames, IA: Wiley Blackwell (2016). págs. 141-236.
2. LeCouteur R. Biopsia cerebral en perros y gatos. En: Actas del Congreso Mundial de la Asociación Mundial de Veterinarios de Pequeños Animales. Disponible en línea en: https://www.vin.com/doc/?id=5124410 (consultado el 6 de agosto de 2023).
3. Wolff CA, Holmes SP, Young BD, Chen AV, Kent M, Platt SR, et al. Resonancia magnética para la diferenciación de enfermedades cerebrales neoplásicas, inflamatorias y cerebrovasculares en perros. J Veterinario Pasante Med. (2012) 26:589–97. doi: 10.1111/j.1939-1676.2012.00899.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Cervera V, Mai W, Vite C, Johnson V, Dayrell-Hart B, Seiler G. Hallazgos comparativos de resonancia magnética entre gliomas y presuntos accidentes cerebrovasculares en perros. Veterinario Radiol Ultras. (2010) 52:33–40. doi: 10.1111/j.1740-8261.2010.01749.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Di Terlizzi R, Platt SR. Función, composición y análisis del líquido cefalorraquídeo en animales de compañía: parte II: análisis. Veterinario J. (2009) 180:15–32. doi: 10.1016/j.tvjl.2007.11.024
6. Hecht S, Adams WH. Resonancia magnética de enfermedades cerebrales en pacientes veterinarios parte 1: principios básicos y trastornos cerebrales congénitos. Veterinario Clin. (2010) 40:21–38. doi: 10.1016/j.cvsm.2009.09.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Westworth DR, Dickinson PJ, Vernau W, Johnson EG, Bollen AW, Kass PH, et al. Tumores del plexo coroideo en 56 perros (1985-2007). J Veterinario Pasante Med. (2008) 22:1157–65. doi: 10.1111/j.1939-1676.2008.0170.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Carloni A, Bernardini M, Mattei C, De Magistris AV, Llabres-Díaz F, Williams J, et al. ¿Puede la RMN diferenciar entre los gliomas con realce de anillo y los abscesos intraaxiales? Veterinario Radiol Ultras. (2022) 63:563–72. doi: 10.1111/vru.13098
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Young BD, Levine JM, Porter BF, Chen-Allen AV, Rossmeisl JH, Platt SR, et al. Características de la resonancia magnética de los astrocitomas y oligodendrogliomas intracraneales en perros. Veterinario Radiol Ultras. (2010) 52:132–41. doi: 10.1111/j.1740-8261.2010.01758.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Sturges BK, Dickinson PJ, Bollen AW, Koblik PD, Kass PH, Kortz GD, et al. Resonancia magnética y clasificación histológica de meningiomas intracraneales en 112 perros. J Veterinario Pasante Med. (2008) 22:586–95. doi: 10.1111/j.1939-1676.2008.00042.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Cherubini GB, Mantis P, Martinez TA, Lamb CR, Cappello R. Utilidad de la resonancia magnética para distinguir las lesiones cerebrales neoplásicas de las no neoplásicas en perros y gatos. Veterinario Radiol Ultras. (2005) 46:384–7. doi: 10.1111/j.1740-8261.2005.00069.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Troxel MT, Vite CH. Biopsia cerebral estereotáctica guiada por TC mediante el sistema estereotáxico de Kopf. Veterinario Radiol Ultras. (2008) 49:438–43. doi: 10.1111/j.1740-8261.2008.00403.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Troxel MT, Vite CH, Massicotte C, McLear RC, Van TJ, Kent M, et al. Características de la resonancia magnética de la neoplasia intracraneal felina: análisis retrospectivo de 46 gatos. J Veterinario Pasante Med. (2004) 18:176–89. doi: 10.1111/j.1939-1676.2004.tb00158.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Troxel MT, Vite CH, Van TJ, Newton AL, Tiches D, Dayrell-Hart B, et al. Neoplasia intracraneal felina: revisión retrospectiva de 160 casos (1985-2001). J Veterinario Pasante Med. (2003) 17:850–9. doi: 10.1111/j.1939-1676.2003.tb02525.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Cordero CR, Croson PJ, Cappello R, Cherubini GB. Hallazgos de resonancia magnética en 25 perros con líquido cefalorraquídeo inflamatorio. Veterinario Radiol Ultras. (2005) 46:17–22. doi: 10.1111/j.1740-8261.2005.00003.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Koblik PD, Lecouteur RA, Higgins R, Bollen AW, Vernau KM, Kortz GD, et al. Biopsia cerebral guiada por TC utilizando un sistema estereotáctico pelorus mark III modificado: experiencia con 50 perros. Veterinario Radiol Ultras. (1999) 40:434–40. doi: 10.1111/j.1740-8261.1999.tb00371.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Koblik PD, Lecouteur RA, Higgins R, Fick J, Kortz GD, Sturges BK, et al. Modificación y aplicación de un sistema estereotáctico pelorus mark III para biopsia cerebral guiada por TC en 50 perros. Veterinario Radiol Ultras. (1999) 40:424–33. doi: 10.1111/j.1740-8261.1999.tb00370.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Giroux A, Jones JC, Bohn JH, Duncan RB, Waldron DR, Inzana KR, et al. Nuevo dispositivo para la biopsia estereotáctica guiada por TC del cerebro canino: diseño, construcción y precisión en la colocación de la aguja. Veterinario Radiol Ultras. (2002) 43:229–36. doi: 10.1111/j.1740-8261.2002.tb00995.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. P. Moissonnier, Blot S, Devauchelle P, Delisle F, Beuvon F, Boulha L, et al. Biopsia cerebral estereotáctica guiada por TC en el perro. J Pequeña Anim Pract. (2002) 43:115–23. doi: 10.1111/j.1748-5827.2002.tb00041.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Moissonnier P, Bordeau W, Delisle F, Devauchelle P. Pruebas de precisión de un nuevo dispositivo de biopsia cerebral guiada por TC estereotáctica en el perro. Res Vet Sci. (2000) 68:243–7. doi: 10.1053/rvsc.1999.0370
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Rossmeisl JH, Andriani RT, Cecere TE, Lahmers K, LeRoith T, Zimmerman KL, et al. Biopsia estereotáctica basada en marcos de masas cerebrales caninas: técnica y resultados clínicos en 26 casos. Front Vet Sci. (2015) 2:20. doi: 10.3389/fvets.2015.00020
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Adamo F. Resúmenes de ACVIM. J Veterinario Pasante Med. (2005) 19:386–488. doi: 10.1111/j.1939-1676.2005.tb02714.x
23. Taylor AR, Cohen ND, Fletcher S, Griffin JF, Levine JM. Aplicación y precisión de la máquina de un nuevo sistema de biopsia cerebral estereotáctica guiada por tomografía computarizada sin marco en perros. Veterinario Radiol Ultras. (2013) 54:332–42. doi: 10.1111/vru.12025
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Flegel T, Oevermann A, Oechtering G, Matiasek K. Rendimiento diagnóstico y efectos adversos de las biopsias cerebrales a mano alzada guiadas por resonancia magnética a través de un mini orificio de fresa en perros con encefalitis. J Veterinario Pasante Med. (2012) 26:969–76. doi: 10.1111/j.1939-1676.2012.00961.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Chen AV, Wininger FA, Frey S, Comeau RM, Bagley RS, Tucker RL, et al. Descripción y validación de un dispositivo de biopsia cerebral estereotáctica guiada por resonancia magnética en el perro. Veterinario Radiol Ultras. (2011) 53:150–6. doi: 10.1111/j.1740-8261.2011.01889.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Escuderos AD, Gao Y, Taylor SF, Kent M, Tse ZTH. Un marco de guía estereotáctica simple y económico para la biopsia cerebral guiada por resonancia magnética en caninos. J Med Ing. (2014) 2014:1–7. doi: 10.1155/2014/139535
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Trojanowski P, Jarosz B, Szczepanek D. Calidad diagnóstica de las muestras de biopsia cerebral con aguja obtenidas con diferentes métodos de muestreo: estudio experimental. Sci Rep. (2019) 9:4. doi: 10.1038/s41598-019-44622-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Soo TM, Bernstein M, Provias J, Tasker R, Lozano A, Guha A. Biopsia estereotáctica fallida en una serie de 518 casos. Stereotact Funct Neurosurg. (1995) 64:183–96.
29. McGirt MJ, Woodworth GF, Coon AL, Frazier JM, Amundson E, Garonzik IM, et al. Predictores independientes de morbilidad después de la biopsia cerebral estereotáctica guiada por imágenes: una evaluación de riesgo de 270 casos. J Neurosurg. (2005) 102:897–901. doi: 10.3171/jns.2005.102.5.0897
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Dewey C, Coates J. Cómo trato los tumores cerebrales primarios en perros y gatos. Compend Contin Educ Pract Veterinar. (2000) 22:756–722.
31. Gordon LE, Thacher C, Matthiesen DT, Joseph RJ. Resultados de la craneotomía para el tratamiento del meningioma cerebral en 42 gatos. Cirugía veterinaria. (1994) 23:94–100. doi: 10.1111/j.1532-950X.1994.tb00452.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Sessums K, Mariani C. Meningioma intracraneal en perros y gatos: una revisión comparativa. Compend Contin Educ Pract Veterinar. (2009) 31:330–9.
33. Altman DG, Bland JM. Medición en medicina: el análisis de estudios comparativos de métodos. Estadístico. (1983) 32:307. doi: 10.2307/2987937
34. Koch GG, Landis JR, Freeman JL, Freeman DH, Lehnen RG. Una metodología general para el análisis de experimentos con medición repetida de datos categóricos. Biometría. (1977) 33:133. doi: 10.2307/2529309
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Landis JR, Koch GG. Una aplicación de la estadística jerárquica de tipo kappa en la evaluación del acuerdo mayoritario entre múltiples observadores. Biometría. (1977) 33:363. doi: 10.2307/2529786
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Richard LJ, Koch GG. La medida de la concordancia del observador para los datos categóricos. Biometría. (1977) 33:159–74. doi: 10.2307/2529310
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. van den Bent MJ. Variación interobservador del diagnóstico histopatológico en ensayos clínicos sobre glioma: la perspectiva de un clínico. Acta Neuropathol. (2010) 120:297–304. doi: 10.1007/s00401-010-0725-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Šteno A, Buvala J, Babková V, Kiss A, Toma D, Lysak A. Limitaciones actuales de la ecografía intraoperatoria en la cirugía de tumores cerebrales. Frente Oncol. (2021) 11:659048. doi: 10.3389/fonc.2021.659048
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Wb T, Sorjonen D, Ja H, Cox N. Biopsia cerebral guiada por ultrasonido en perros. Am J Vet Res. (1993) 54:1942–7. doi: 10.2460/ajvr.1993.54.11.1942
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Meneses F, Maiolini A, Forterre F, Oevermann A, Schweizer-Gorgas D. Viabilidad de un sistema de biopsia cerebral sin marco para animales de compañía mediante el registro automatizado basado en TC de haz cónico. Front Vet Sci. (2022) 8:779845. doi: 10.3389/fvets.2021.779845
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Pluhar GE. Principios de la cirugía craneal. En: Técnicas Avanzadas en Neurocirugía 2016 (Actas de Educación Avanzada ACVIM), 34–38.
42. Sturges BK. Capítulo 35: cirugía craneal. En:Johnston SA, Tobias KM, , editores. Veterinary Surgery Small Animal, 2ª ed. St Louis, MO: Elsevier (2018). págs. 1628-76.
43. Shores A, Lee AM, Kornberg ST, Tollefson C, Seitz MA, Wills RW, et al. Aplicaciones ecográficas intraoperatorias en cirugía intracraneal. Front Vet Sci. (2021) 8:725867. doi: 10.3389/fvets.2021.725867
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: tumor cerebral, resonancia magnética, veterinaria, ecoguiada, biopsia por congelación
Cita: Adams BS, Marino DJ, Loughin CA, Marino LJ, Southard T, Lesser ML, Akerman M y Roynard P (2024) Evaluación de un sistema de biopsia de núcleo congelado guiado por ultrasonido para tumores cerebrales caninos y felinos. Frente. Vet. Sci. 11:1284097. doi: 10.3389/fvets.2024.1284097
Recibido: 27 de agosto de 2023; Aceptado: 18 de marzo de 2024;
Publicado: 09 Abril 2024.
Editado por:
Giovanni Mogicato, Ecole Nationale Vétérinaire de Toulouse (ENVT), Francia
Revisado por:
Viktor Palus, Neurovet, Eslovaquia
Daniela Schweizer, Universidad de Berna, Suiza
Derechos de autor © 2024 Adams, Marino, Loughin, Marino, Southard, Lesser, Akerman y Roynard. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Dominic J. Marino, DrDominicMarino@gmail.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

