Detección microscópica y molecular de piroplasmas en ovejas
Detección microscópica y molecular de piroplasmas en ovejas
 Ahmed Kamal Dyab1,2†
Ahmed Kamal Dyab1,2†  Sara Abdel-Aal Mohamed3†
Sara Abdel-Aal Mohamed3†  Fatma Mohamed Abdel-Aziz3
Fatma Mohamed Abdel-Aziz3  Ahmed Gare4
Ahmed Gare4  Fathy Osman5
Fathy Osman5  Fatma A. Elgohary6
Fatma A. Elgohary6  Ehssan Ahmed Hassan7,8
Ehssan Ahmed Hassan7,8  Noorah Alsowayeh9
Noorah Alsowayeh9  Alzaylaee de cierva10
Alzaylaee de cierva10  Abd Al-Rahman S. Ahmed11
Abd Al-Rahman S. Ahmed11  Daniel Bravo-Barriga12
Daniel Bravo-Barriga12  Ehab otb Elmahallawy12,13*
Ehab otb Elmahallawy12,13*- 1Departamento de Parasitología, Facultad de Medicina, Universidad de Assiut, Assiut, Egipto
- 2Departamento de Parasitología, Facultad de Medicina Veterinaria, Universidad Badr en Assiut, Ciudad de New Nasser, Assiut, Egipto
- 3Departamento de Parasitología, Facultad de Medicina Veterinaria, Universidad de Assiut, Assiut, Egipto
- 4Departamento de Parasitología, Facultad de Medicina Veterinaria, Universidad de Asuán, Asuán, Egipto
- 5Laboratorio de New Valley, Departamento de Parasitología, Instituto de Investigación de Salud Animal, Centro de Investigación Agrícola (ARC), provincia de New Valley, Egipto
- 6Departamento de Higiene y Zoonosis, Facultad de Medicina Veterinaria, Universidad de Mansoura, Mansoura, Egipto
- 7Departamento de Biología, Facultad de Ciencias y Humanidades de Alkharj, Universidad Príncipe Sattam Bin Abdulaziz, Alkharj, Arabia Saudita
- 8Departamento de Zoología, Facultad de Ciencias, Universidad del Canal de Suez, El-Sheikh Zayed, Ismailia, Egipto
- 9Departamento de Biología, Facultad de Ciencias de Al-Zulfi, Universidad de Majmaah, Al-Majmaah, Arabia Saudita
- 10Departamento de Biología, Facultad de Ciencias, Universidad Princesa Nourah Bint Abdulrahman, Riad, Arabia Saudita
- 11Departamento de Recursos Naturales, Facultad de Estudios Africanos de Posgrado, Universidad de El Cairo, Giza, Egipto
- 12Departamento de Sanidad Animal, Grupo de Investigación en Sanidad Animal y Zoonosis (GISAZ), Universidad de Córdoba, Córdoba, España
- 13Departamento de Zoonosis, Facultad de Medicina Veterinaria, Universidad de Sohag, Sohag, Egipto
Introducción: Los parásitos de la sangre representan una amenaza significativa para la producción ganadera en el sur de Egipto, sin embargo, hay escasez de información sobre su circulación y epidemiología en las ovejas en esta región. El objetivo de este estudio fue investigar la seroprevalencia de las infecciones por parásitos de la sangre en ovejas de la gobernación de Assiut, Alto Egipto.
Métodos: Se recogieron un total de 400 muestras de sangre de ovejas de diferentes edades y sexos. El cribado preliminar de la presencia de piroplasmas, principalmente Babesia y Theileria spp., mediante examen microscópico, seguido de la investigación de los posibles factores de riesgo relacionados con la exposición a la infección. Además, la identificación molecular de ambos parásitos en algunas de las muestras positivas se realizó mediante PCR dirigida al ARNr de Babesia 18S y al gen Tams1 de Theileria anula.
Resultados: El examen microscópico reveló que entre las ovejas examinadas, había una prevalencia general de parásitos de la sangre del 44% (176 de 400), con Babesia spp. observada en el 14% (56 de 400) y Theileria spp. en el 30% (120 de 400). Además, la tasa de infección no fue significativamente mayor en los animales jóvenes (50%) en comparación con los adultos (38,5%) (P = 0,246). Los machos mostraron una vulnerabilidad significativamente mayor a la infección por ambos parásitos (63,3%) en comparación con las hembras (35,7%) (P = 0,011). Curiosamente, la prevalencia de ambos parásitos sanguíneos fue significativamente mayor durante la estación fría (66,1%) en comparación con la estación cálida (15,9%) (P = <0,001). El análisis molecular identificó la presencia de Babesia ovis y Theileria annulata entre una submuestra de las películas positivas de sangre de oveja. Las especies identificadas se registraron en las bases de datos del GenBank™ y se les asignaron números de acceso específicos (OQ360720 y OQ360719 para B. ovis) y (OP991838 para T. annulata).
Conclusiones: En conjunto, este estudio confirma una alta prevalencia de piroplasmosis y ofrece información epidemiológica y molecular sobre los parásitos de la sangre en ovejas del Alto Egipto, destacando la importancia de detectar estos parásitos en varios huéspedes y sus vectores competentes (garrapatas).
1 Introducción
La industria ovina es un activo económico importante debido a la resistencia de los animales a la escasez de alimentos y a las fluctuaciones climáticas (1). En Egipto, las ovejas y las cabras desempeñan un papel vital en el suministro de carne a los seres humanos, además de servir como fuentes para la producción de lana y utilizar su estiércol como fertilizante para el suelo (2). Sin embargo, las ovejas son vulnerables a numerosas enfermedades hemoprotozoarias que pueden afectar a su salud y productividad. Entre otras, Theileria spp. y Babesia spp., responsables de la teileriosis y la babesiosis, respectivamente, se destacan como enfermedades transmitidas por garrapatas de gran importancia económica transmitidas a las ovejas (3). Estos hemoprotozoos forman parte de la clasificación más amplia perteneciente a la clase Sporozoa, orden Piroplasmida, y familias Babesiidae y Theileriidae (4). En términos de transmisión, Theileria y Babesia son transmitidas biológicamente por garrapatas duras en regiones tropicales y subtropicales a nivel mundial (5). Ambas enfermedades se presentan con frecuencia entre mayo y septiembre, coincidiendo con el movimiento periódico de las garrapatas (6). En cuanto al ciclo de vida de Babesia (7), el organismo sufre una división asexual dentro de un glóbulo rojo (RBC) de mamífero, tras lo cual los merozoítos hijos rompen la célula huésped para infectar nuevos eritrocitos. Las garrapatas se infectan al consumir eritrocitos que contienen merozoítos. La reproducción sexual (gametogonía) tiene lugar en el intestino de la garrapata, seguida de la esporogía asexual en sus glándulas salivales. Posteriormente, se produce el desarrollo de estadios infecciosos (esporozoítos) en las glándulas salivales de las garrapatas infectadas. Este ciclo puede persistir durante toda la vida del animal, dependiendo de la inmunidad del huésped. En cuanto a su transmisión, se trata de dos vías de transmisión distintas: la transmisión transestadial de una etapa del ciclo de vida de la garrapata a la siguiente y la transmisión transovárica (8-10). El ciclo de vida de Theileria se parece mucho al de Babesia, involucrando gametogonía sexual seguida de esporogonia asexual en el intestino de la garrapata. En última instancia, los esporozoítos inoculados invaden los linfocitos del huésped infectado, lo que provoca una división continua en forma de linfoblastos a través de un proceso conocido como transformación celular. Esto da lugar a la replicación del parásito y las células infectadas se distribuyen ampliamente por todo el sistema linfoide del huésped. Después de 2 a 3 semanas, las células T citotóxicas dañan los linfoblastos parasitados. Simultáneamente, los parásitos inician un ataque a los eritrocitos, reproduciéndose asexualmente dentro de ellos. Las garrapatas se infectan a través de la ingestión de estos eritrocitos infectados. La transmisión transestadial es el único modo de transmisión establecido en Theileria spp., sin evidencia de transmisión transovárica discernible (11). Entre otras, Rhipicephalus (Boophilus) annulatus y otros miembros del género Hyalomma, como H. marginatum y H. excavatum, se consideran las garrapatas más predominantes responsables de la transmisión de piroplasmosis a las ovejas en Egipto (12, 13).
La babesiosis ovina es una importante enfermedad transmitida por garrapatas que afecta a los pequeños rumiantes, causada por varias especies como B. ovis, B. motasi, B. crassa, B. taylori y B. aktasi, entre otras (6, 7, 10-12, 14-16). Teniendo en cuenta, la especie más patógena en ovino es B. ovis que causa babesiosis ovina maligna con fiebre, anemia hemolítica, hemoglobinuria, ictericia y posible muerte otros (6, 7, 10-12, 17, 18). La hemoglobinuria es poco común, pero puede ocurrir en las etapas avanzadas de la enfermedad, lo que lleva a un posible aborto en animales preñados. Los rebaños en riesgo pueden experimentar una tasa de mortalidad significativa (19). Las ovejas con infecciones crónicas no suelen mostrar síntomas, excepto la presencia de parasitemia y la falta de ahorro. Los animales recuperados con infecciones latentes suelen poseer inmunidad durante un período específico, y no hay inmunidad cruzada entre los parásitos (20). La teileriosis en pequeños rumiantes es causada por parásitos protozoarios de la Theileria, incluyendo específicamente especies como Theileria lestoquardi, T. ovis, T. recondita, T. annulata, T. separata, T. luwenshuni, T. uilenbergi, Theileria sp. OT1 y Theileria sp. OT3 (7, 21). Los síntomas comunes de la teileriosis en las ovejas incluyen tos, fiebre, linfadenopatía, fatiga y pérdida de peso (22). Entre otras, T. lestoquardi es considerada la especie más patógena, dando lugar a una teileriosis ovina maligna con una gran proporción de morbilidad y mortalidad en ovinos (23). Además, varias investigaciones previas revelaron que la infección por Theileria puede provocar un aborto (24, 25). El diagnóstico de babesiosis y teileriosis ovina puede lograrse a través de la observación de los síntomas clínicos y el examen microscópico de los frotis linfáticos o de sangre fina teñidos con Giemsa, que sigue siendo el estándar de oro para el diagnóstico de la infección. Sin embargo, debe tenerse en cuenta que se basa únicamente en las características morfológicas para la detección del parásito de la sangre (26, 27). Por otro lado, la identificación molecular de estos parásitos ofrece una mayor sensibilidad y especificidad en comparación con los métodos diagnósticos alternativos (15). Sin embargo, el costo de estas últimas técnicas plantea un desafío importante, particularmente en países con recursos limitados.
Cabe destacar que los parásitos de la sangre plantean un importante reto económico en la producción ovina en Egipto, ya que provocan pérdidas en la producción de carne y leche debido a las altas tasas de parasitemia y mortalidad de los animales infectados (28, 29). Es evidente que la vigilancia sistemática de estos parásitos entre los pequeños rumiantes de una zona determinada es esencial para comprender la prevalencia de estas enfermedades y aplicar medidas de control eficaces. Si bien se han realizado algunos estudios previos sobre la babesiosis y la teileriosis ovina en Egipto [Tabla 1; referencias (4, 30-32, 34-39)], existe una notable escasez de investigación, especialmente el trabajo molecular en la región sur del país, es decir, el Alto Egipto. Teniendo en cuenta la importancia de comprender los factores que afectan la exposición a la infección dentro de las poblaciones naturales, es crucial para comprender la dinámica huésped-parásito, predecir la susceptibilidad a la infección y mantener el equilibrio biológico (40). Si bien varios factores dilucidaron las diferencias en la ocurrencia del parásito y la exposición a la infección entre las especies hospederas, la relación entre hospedadores, garrapatas y patógenos sufre cambios continuos, impulsados en gran medida por alteraciones ecológicas, climáticas y antropogénicas. Varios factores, como el sexo del animal, la edad, las prácticas de manejo del rebaño, las variaciones estacionales, la infestación por garrapatas y el tamaño del rebaño, se han asociado con la infección por parásitos de la sangre en los animales. Además, los factores espacio-temporales, como los hábitats de los vectores, los sistemas de alimentación animal, las medidas de saneamiento y las prácticas de manejo, influyen significativamente en la epidemiología de estas infecciones (41). Como se mencionó anteriormente, la teileriosis y la babesiosis son enfermedades parasitarias de gran importancia comercial, por lo que desempeñan un papel crucial en el comercio mundial de animales y productos de origen animal. La documentación precisa de estos parásitos en Egipto es esencial para comprender su epidemiología y clasificación, lo que permite adoptar medidas de control eficaces para mitigar los daños causados por sus infecciones. Teniendo en cuenta los detalles antes mencionados, el presente estudio tiene como objetivo investigar la prevalencia y la epidemiología de la babesiosis y la teileriosis ovina en la gobernación de Assiut, Alto Egipto, al tiempo que se consideran los posibles factores de riesgo asociados. Esta evaluación utiliza una combinación de métodos microscópicos, seguidos de la identificación molecular de los parásitos.
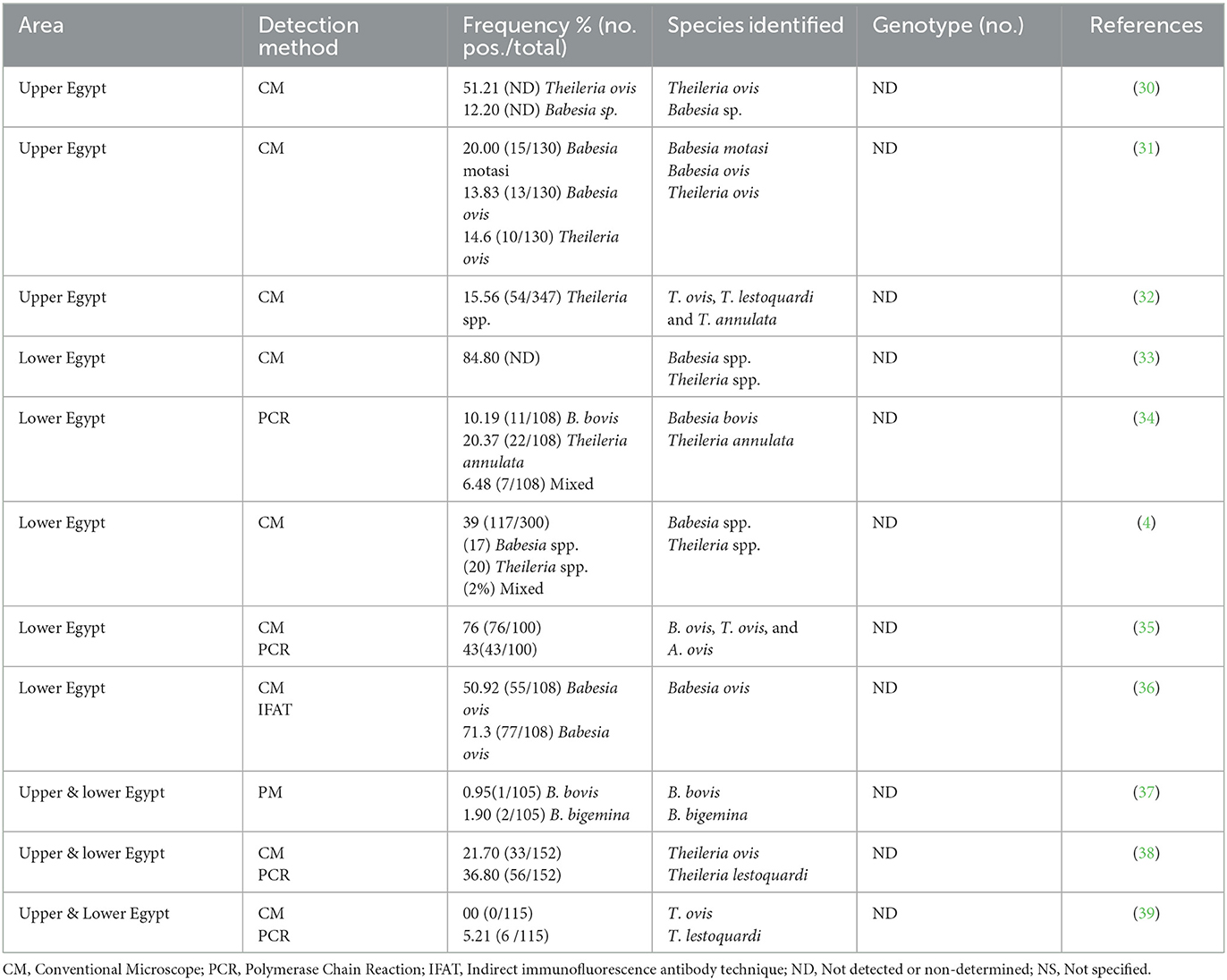 Tabla 1. Presencia y diversidad genética de Babesia y Theileria spp. reportadas en ovejas en Egipto.
Tabla 1. Presencia y diversidad genética de Babesia y Theileria spp. reportadas en ovejas en Egipto.
2 Materiales y métodos
2.1 Área de estudio y recogida de muestras
La investigación consistió en el muestreo aleatorio de 400 muestras de sangre de ovejas de pequeñas partes interesadas que participaron en campañas veterinarias realizadas entre febrero de 2022 y enero de 2023 en diferentes localidades de la gobernación de Assiut, Alto Egipto (Figura 1). El clima de la zona estudiada presenta notables temperaturas extremas, siendo en junio el promedio mensual más alto con 37,1 °C, mientras que en enero se experimenta el más bajo con 4,7 °C. Además, los niveles de humedad fluctúan considerablemente, desde un mínimo del 25% en mayo hasta un máximo del 52% en enero. El tamaño de la muestra se determinó con base en un nivel de confianza del 95% para detectar la exposición a los parásitos, asumiendo una prevalencia individual máxima del 52% en Egipto (30, 42). Las ovejas muestreadas abarcaron ambos sexos y varios grupos de edad. Se extrajo una muestra de sangre de 5 ml de la vena yugular de cada animal en un tubo vacutainer estéril con ácido etilendiamino tetraacético (EDTA) (BD Vacutainer, Franklin Lakes, NJ, EE. UU., EUA). Todas las muestras se refrigeraron a 4-8 °C. Una vez en el laboratorio, se procedió a la preparación de las muestras de sangre para su examen bajo un microscopio ordinario.®
2.2 Examen microscópico
Para preparar películas de sangre delgadas, se colocó una gota de sangre en un extremo de un portaobjetos limpio y se deslizó un esparcidor en un ángulo de 45° para tocar la muestra de sangre. A continuación, el esparcidor se movía suave y firmemente, permitiendo que la sangre siguiera y formara un borde emplumado. Posteriormente, la película delgada se secó al aire, se fijó en metanol durante 5 min y se tiñó con una tinción Giemsa al 10% recién preparada durante 30 min. Después de teñir, la película se lavó con agua y se dejó secar. Finalmente, el frotis sanguíneo se examinó bajo un microscopio óptico a × 100 (inmersión en aceite) para detectar parásitos sanguíneos (43). Los eritrocitos infectados que contenían piroplasmas o esquizontes se identificaron como se describe en la literatura (44, 45).
2.3 Detección molecular
2.3.1 Extracción de ADN
La extracción genómica de ADN se realizó a partir de algunas muestras de sangre (n = 40), que resultaron positivas para cada parásito durante el examen microscópico, lo que indica una mayor concentración de parásitos por campo, utilizando un kit comercial de aislamiento de ADN (QIAamp DNA Mini Kit, 51304) siguiendo las instrucciones del fabricante.
2.3.2 Amplificación por PCR y análisis filogenético
La amplificación de Babesia a través del gen 18S rRNA y de las especies Theileria (gen Tams1) se llevó a cabo siguiendo los protocolos establecidos en estudios previos (34, 46, 47). Preparación de la mezcla maestra de PCR para la cPCR según la mezcla maestra de PCR Emerald Amp GT (Takara), Código No. RR310Akit. La mezcla de reacción (25 μL) incluía 12,5 μL de mezcla maestra de PCR Emerald Amp GT (2x premezcla) (Código No. RR310A), se añadieron 0,2 μM de cada cebador, 5 μL de molde de ADN y agua Millipore para conseguir un volumen final de 25 μL. El conjunto de cebadores y las condiciones de temperatura y tiempo durante la PCR se muestran en las Tablas Suplementarias 1, 2 (48, 49), respectivamente. Los amplicones de PCR se examinaron mediante electroforesis en gel de agarosa al 1,5% y, por cada 100 ml de gel, se aplicaron 6 μL de tinción GreenSafe (10 mg/mL). Además, se utilizó una escalera de 100 pb como referencia para identificar los tamaños de los amplicones objetivo. El sistema de documentación del gel capturó imágenes del gel y los datos se analizaron posteriormente mediante un programa informático. Los productos de PCR de algunas de las muestras positivas exhibieron bandas distintas y nítidas se purificaron utilizando el kit de extracción de productos de PCR QIAquick (ID: 51304) de Qiagen, Valencia. Para la reacción de secuenciación, se empleó el kit de secuenciación de ciclo BigDye Terminator V3.1 de Perkinelmer, seguido de la purificación utilizando una columna de centrispación Centrisep. Los productos de PCR con amplificaciones positivas se purificaron y secuenciaron utilizando el analizador genético 3130 de Applied Biosystems. Para lograr la identidad a nivel de especie, se consideró una puntuación de identidad del >99% utilizando BLASTn (https://blast.ncbi.nlm.nih.gov/Blast.cgi; Mega-BLASTn) (34, 50). Se realizaron múltiples alineaciones con MAFFT versión 7 (51). Para los análisis filogenéticos de máxima verosimilitud (ML), la elección del modelo evolutivo que mejor se ajustaba se basó en los definidos mediante JModeltest2 sobre la base del criterio de información de Akaike (51). La reconstrucción de árboles se llevó a cabo con Mega 11 (52). La historia evolutiva se dedujo utilizando el método de máxima verosimilitud y el modelo de 3 parámetros de Tamura (53). El porcentaje de árboles en los que se agruparon los taxones asociados se muestra junto a las ramas. El árbol se dibuja a escala, con longitudes de ramas medidas en el número de sustituciones por sitio. Los árboles filogenéticos fueron manipulados para su exhibición usando FigTree v.1.4.2 (54).
2.4 Análisis estadístico
Los datos recolectados en este estudio fueron analizados con el programa estadístico Statistical Package for Social Sciences (SPSS), versión 26. Se empleó la prueba de chi-cuadrado para examinar y comparar variables cualitativas. Las medidas cuantitativas se expresaron como medias ± desviación estándar (DE) y mediana (rango intercuartílico). Las prevalencias se estimaron como el cociente de positivos del total de muestras analizadas, con los intervalos de confianza binomiales exactos del 95% (IC del 95%) según el método de puntuación (55). Se realizaron análisis de regresión logística para evaluar los odds ratios (OR) ajustados y no ajustados junto con sus correspondientes intervalos de confianza del 95% (IC del 95%) para identificar los factores asociados a la infección. Un nivel de significancia de P < 0,05 se consideró significativo, mientras que P < 0,01 se consideró altamente significativo.
3 Resultados
3.1 Prevalencia de parásitos sanguíneos en ovejas encuestadas y factores de riesgo asociados
En el presente trabajo, de las 400 muestras de sangre examinadas por examen microscópico, 176 dieron positivo para parásitos de la sangre, lo que resultó en una prevalencia global del 44%. Las tasas de infección individual para Babesia spp. y Theileria spp. fueron del 14% y 30%, respectivamente. Clínicamente, las ovejas positivas estaban anémicas, demacradas, con lagrimeo, disminución del apetito y la temperatura puede ser normal o ligeramente aumentada. Además, en algunos casos se registró opacidad corneal, agrandamiento de los ganglios linfáticos y hemoglobinuria. En cuanto a la edad como factor de riesgo potencial, que se muestra en la Tabla 2, la prevalencia global de parásitos sanguíneos detectados fue mayor en animales jóvenes (50%) en comparación con adultos (38,5%), aunque no se encontró una asociación significativa (OR: 160; Valor p: 0,246). Como se muestra en la Tabla 2, la tasa de infección por Babesia spp. fue del 14% (16,7% en animales menores de 2 años y 11,5% en animales mayores de 2 años), mientras que para Theileria spp. fue del 30% (33,3% en animales menores de 2 años y 26,9% en animales mayores de 2 años). En cuanto al sexo (Tabla 2), la prevalencia global de parásitos sanguíneos en el sexo masculino fue de 63,3% (OR: 3,11, P = 0,01), superior a la de las mujeres (35,7%). La importancia de estos hallazgos se destaca por los resultados observados en Babesia, revelando una odds ratio (OR) de 8,25 entre hombres y mujeres (Tabla 2). En contraste, la Tabla 2 mostró que Theileria tuvo una OR de 0,46, lo que indica un patrón diferente de asociación entre el sexo y las tasas de infección en estos dos parásitos. La Tabla 2 también muestra una relación significativa entre la infección parasitaria de la sangre en relación con el sexo (P = 0,011). En cuanto a la estacionalidad, se identificó una asociación significativa entre las infecciones parasitarias de la sangre y las estaciones del año (P < 0.01) (OR: 10.29; P < 0,001) (Tabla 2). Este patrón fue notablemente consistente durante la estación fría tanto para Babesia spp. como para Theileria spp., con odds ratios de 5,73 y 6,29, respectivamente (Tabla 2).
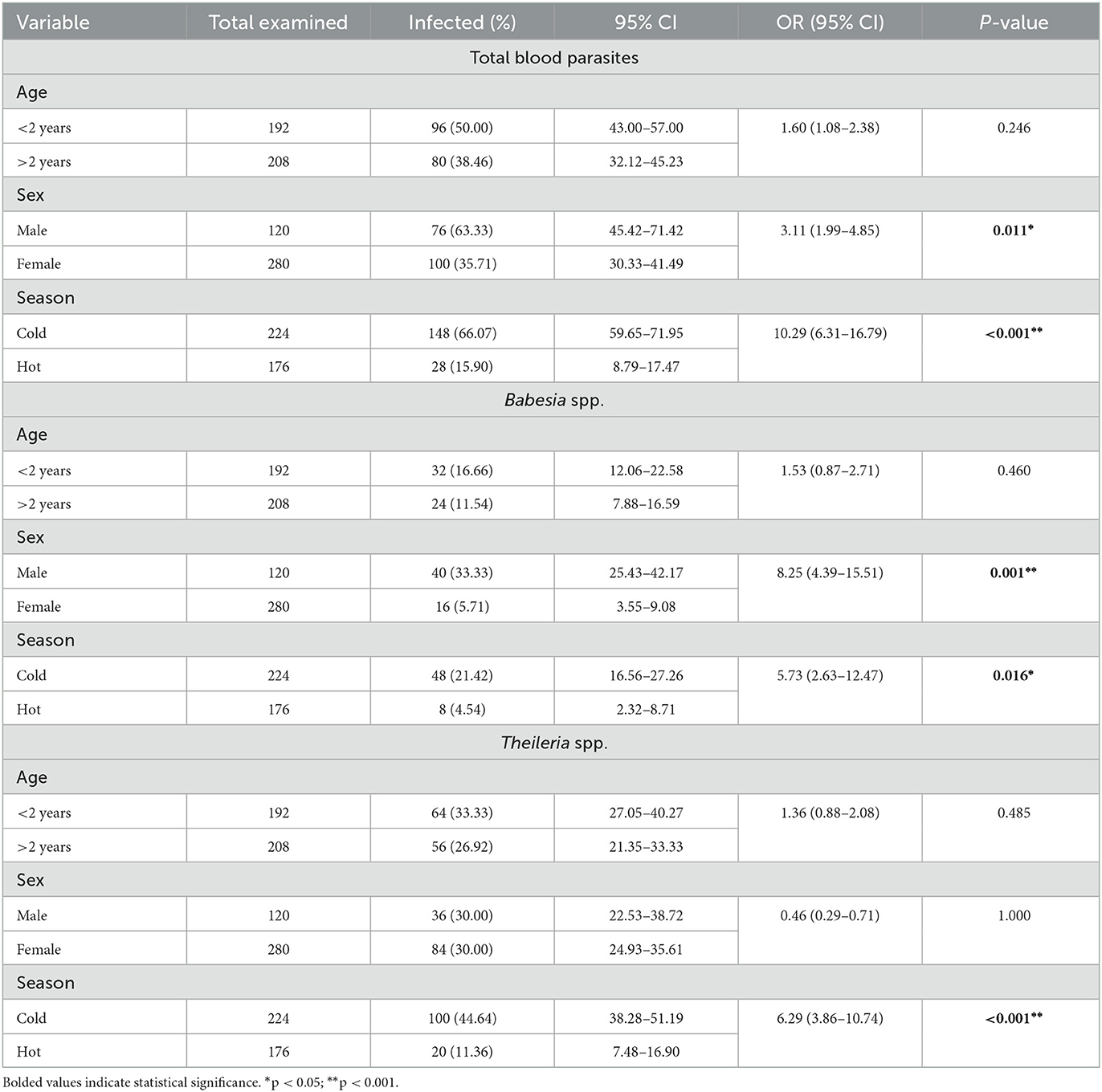 Tabla 2. Distribución de la prevalencia global de parásitos de la sangre, incluyendo Babesia y Theileria, infecciones según el grupo de edad, sexo y temporada de muestreo de la población ovina encuestada (n = 400).
Tabla 2. Distribución de la prevalencia global de parásitos de la sangre, incluyendo Babesia y Theileria, infecciones según el grupo de edad, sexo y temporada de muestreo de la población ovina encuestada (n = 400).
3.2 Características morfológicas de los parásitos sanguíneos detectados en ovinos
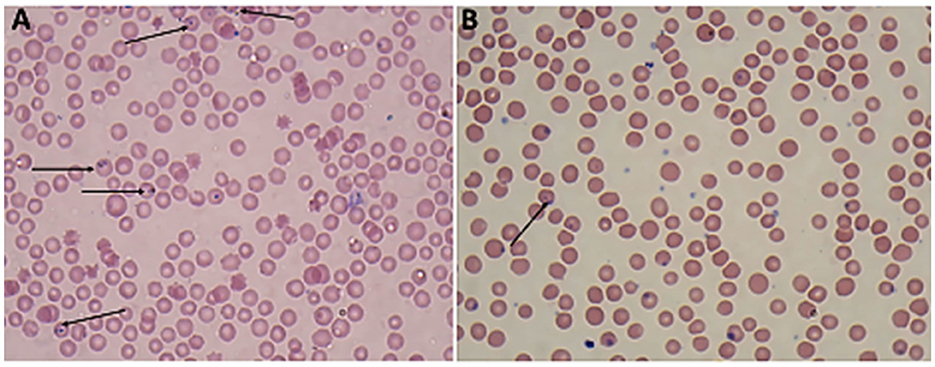
Los frotis de sangre teñidos con Giemsa de Babesia spp. mostraron estadios eritrocíticos en los que los piroplasmas intraeritrocíticos son redondeados o en forma de pera doble, típicamente ubicados en la periferia de los eritrocitos del huésped infectado (Figura 2). Mientras tanto, los frotis de sangre teñidos con Giemsa de Theileria spp. muestran estadios eritrocíticos, merozoítos, esquizontes y microrizontes múltiples, que eran piroplasmas intraeritrocitarios de las formas pequeñas en forma de bastoncillo, anillo y redondeado presentes dentro de los linfocitos (Figura 3). Los glóbulos rojos infectados (RBC) también mostraron protuberancias similares a equinocitos en su superficie, una característica común observada durante la infección por Theileria.
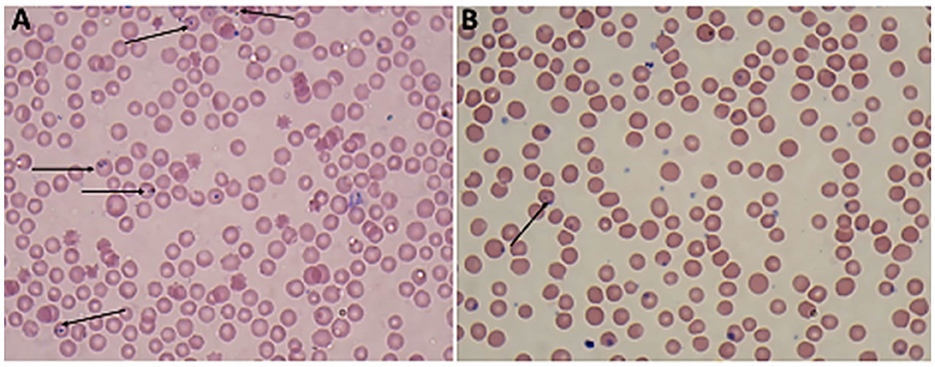 Figura 2. Película de sangre delgada teñida con Giemsa aumentada × 100 (lente de inmersión en aceite) que muestra los parásitos protozoarios de la sangre encontrados en ovejas (A, B): trofozoítos pareados de Babesia spp. (flecha).
Figura 2. Película de sangre delgada teñida con Giemsa aumentada × 100 (lente de inmersión en aceite) que muestra los parásitos protozoarios de la sangre encontrados en ovejas (A, B): trofozoítos pareados de Babesia spp. (flecha).
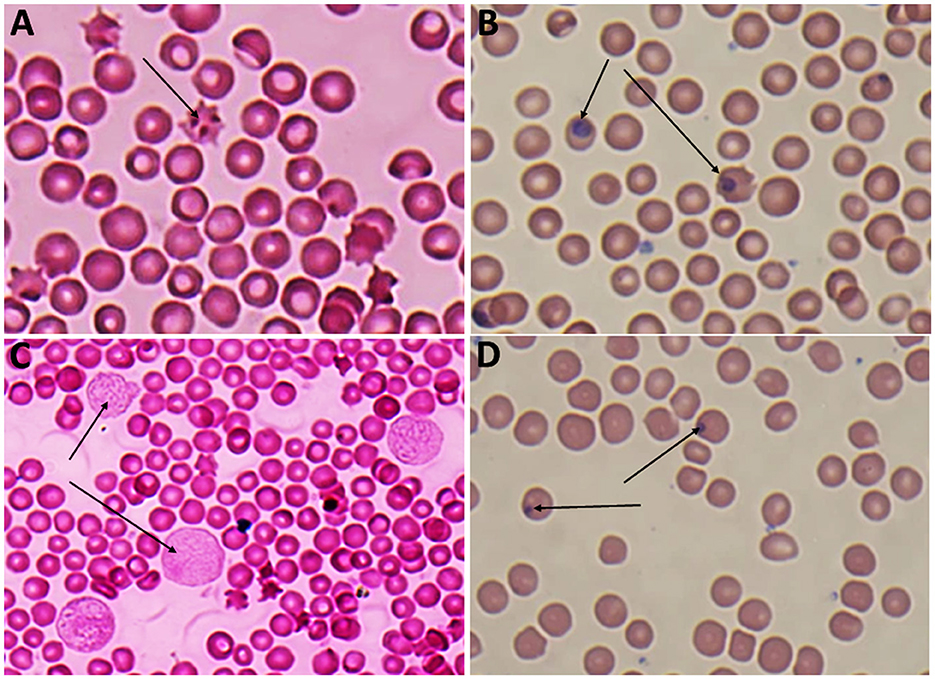 Figura 3. (A) Equiciclo que contiene trofozoítos de Theileria spp., x100 (lente de inmersión en aceite), (B) etapa anular de Theileria spp., x100 (lente de inmersión en aceite), (C) múltiples microrizonts de Theileria spp. x100 (lente de inmersión en aceite) (flecha), (D) trofozoíto en forma de varilla pequeña de Theileria spp., x100 (lente de inmersión en aceite) (flecha delgada), trofozoíto de forma redondeada de Theileria spp., x 100 (lente de inmersión en aceite) (flecha gruesa).
Figura 3. (A) Equiciclo que contiene trofozoítos de Theileria spp., x100 (lente de inmersión en aceite), (B) etapa anular de Theileria spp., x100 (lente de inmersión en aceite), (C) múltiples microrizonts de Theileria spp. x100 (lente de inmersión en aceite) (flecha), (D) trofozoíto en forma de varilla pequeña de Theileria spp., x100 (lente de inmersión en aceite) (flecha delgada), trofozoíto de forma redondeada de Theileria spp., x 100 (lente de inmersión en aceite) (flecha gruesa).
3.3 Análisis de PCR
El análisis molecular del gen 18S rRNA confirmó la presencia de B. ovis (OQ360720 y OQ360719) con una homología del 100% con otras secuencias disponibles en GenBank™. Utilizando el gen Tams1 para Theileria, también se confirmó la presencia de T. annulata (OP991838) con una homología del 100% con otras secuencias accesibles en GenBank™. Además, los resultados filogenéticos de este estudio mostraron que la presencia de secuencias de B. ovis formaba claramente un solo grupo monofilético con otras secuencias de la misma especie, como se muestra en las Figuras 4. Por otro lado, la secuencia obtenida OP991838 en la presente investigación se diferencia claramente del resto de las especies finalizadas (T. parva, T. yokoyama y T. lestoquardi) y se integra en el grupo de T. annulata (Figura 5). El análisis de la diversidad genética intraespecie reveló hallazgos intrigantes. En el caso de B. ovis, el gen 18S rRNA mostró un nivel relativamente bajo de divergencia entre las secuencias (Figura 6). Sin embargo, el gen Tams1 para las especies de T. annulata exhibió una notable variabilidad intergenética, superando las secuencias encontradas en todo el mundo, como se muestra en la Figura 7.
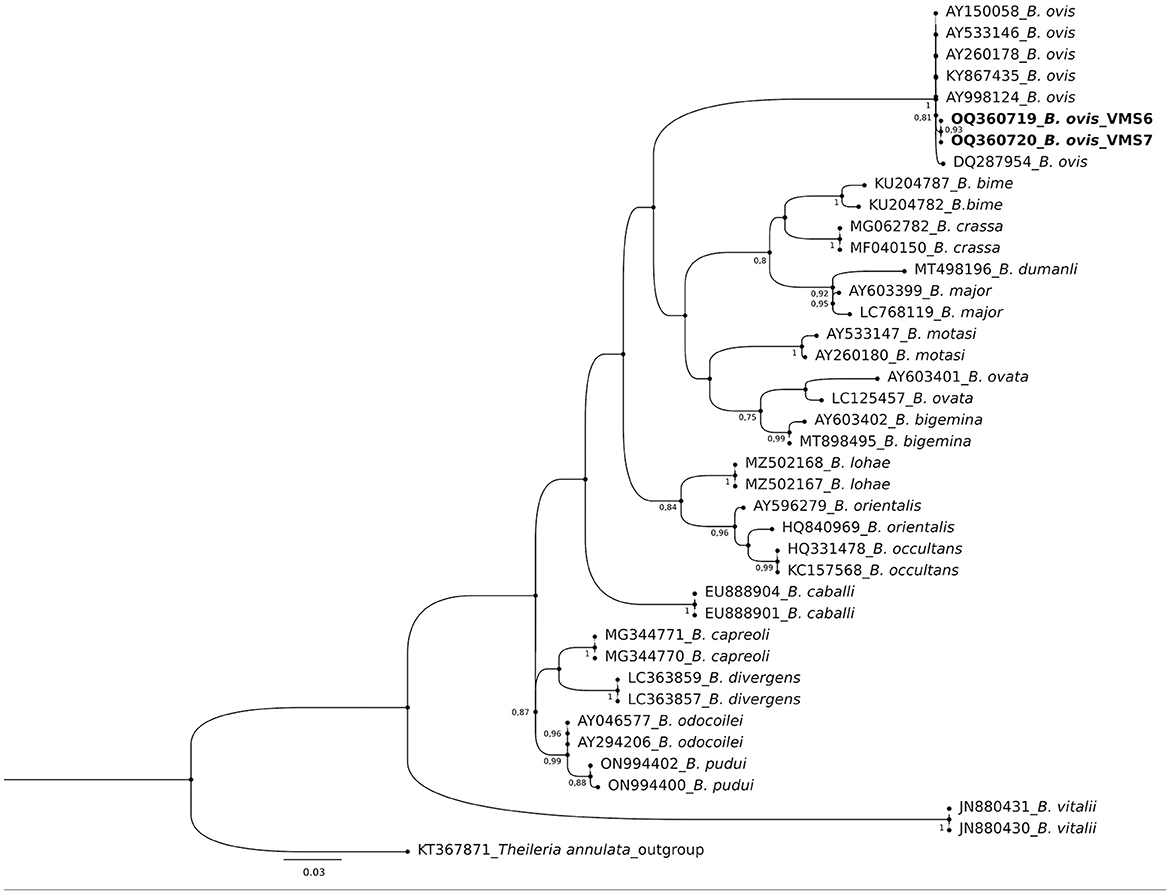 Figura 4. Las relaciones filogenéticas de Babesia ovis se inferieron a partir del análisis de secuencias de genes de ARNr de 40 nucleótidos 18S utilizando el método de máxima verosimilitud y el modelo de 2 parámetros de Kimura. Se muestra el árbol con la mayor probabilidad logarítmica (−1656,70). Se utilizó una distribución Gamma discreta para modelar las diferencias de tasas evolutivas entre los sitios [5 categorías (+G, parámetro = 0.3354)]. El modelo de variación de tasas permitió que algunos sitios fueran evolutivamente invariables ([+I], 51,51% sitios). Los valores de arranque >75% en 1000 repeticiones se indican en nodos de rama específicos. La barra indica el número promedio de sustituciones por sitio. El árbol se enraizó utilizando Theileria annulata (KT367871) como grupo externo. Las secuencias obtenidas durante este estudio se muestran en negrita.
Figura 4. Las relaciones filogenéticas de Babesia ovis se inferieron a partir del análisis de secuencias de genes de ARNr de 40 nucleótidos 18S utilizando el método de máxima verosimilitud y el modelo de 2 parámetros de Kimura. Se muestra el árbol con la mayor probabilidad logarítmica (−1656,70). Se utilizó una distribución Gamma discreta para modelar las diferencias de tasas evolutivas entre los sitios [5 categorías (+G, parámetro = 0.3354)]. El modelo de variación de tasas permitió que algunos sitios fueran evolutivamente invariables ([+I], 51,51% sitios). Los valores de arranque >75% en 1000 repeticiones se indican en nodos de rama específicos. La barra indica el número promedio de sustituciones por sitio. El árbol se enraizó utilizando Theileria annulata (KT367871) como grupo externo. Las secuencias obtenidas durante este estudio se muestran en negrita.
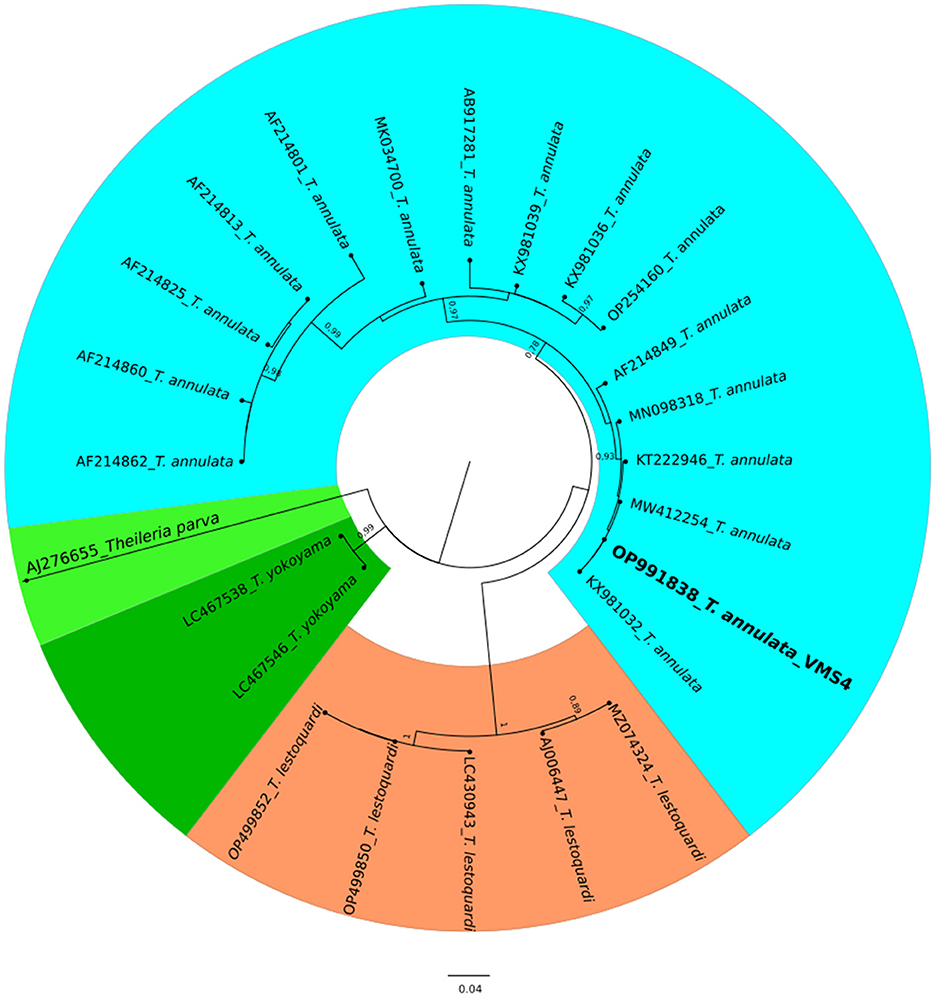 Figura 5. Un árbol filogenético circular de Theileria annulata basado en el análisis de secuencias de genes tams1 de nucleótidos utilizando el método de máxima verosimilitud y el modelo de 3 parámetros de Tamura. El árbol representa la probabilidad logarítmica más alta (−10113.12). Las diferencias de tasa evolutiva entre los sitios se modelaron utilizando una distribución Gamma discreta con 5 categorías (+G, parámetro = 0.4271). Los valores de arranque superiores al 75 % en 1000 repeticiones se indican en nodos de rama específicos. La barra representa el número promedio de sustituciones por sitio. Las secuencias obtenidas durante este estudio están resaltadas en negrita.
Figura 5. Un árbol filogenético circular de Theileria annulata basado en el análisis de secuencias de genes tams1 de nucleótidos utilizando el método de máxima verosimilitud y el modelo de 3 parámetros de Tamura. El árbol representa la probabilidad logarítmica más alta (−10113.12). Las diferencias de tasa evolutiva entre los sitios se modelaron utilizando una distribución Gamma discreta con 5 categorías (+G, parámetro = 0.4271). Los valores de arranque superiores al 75 % en 1000 repeticiones se indican en nodos de rama específicos. La barra representa el número promedio de sustituciones por sitio. Las secuencias obtenidas durante este estudio están resaltadas en negrita.
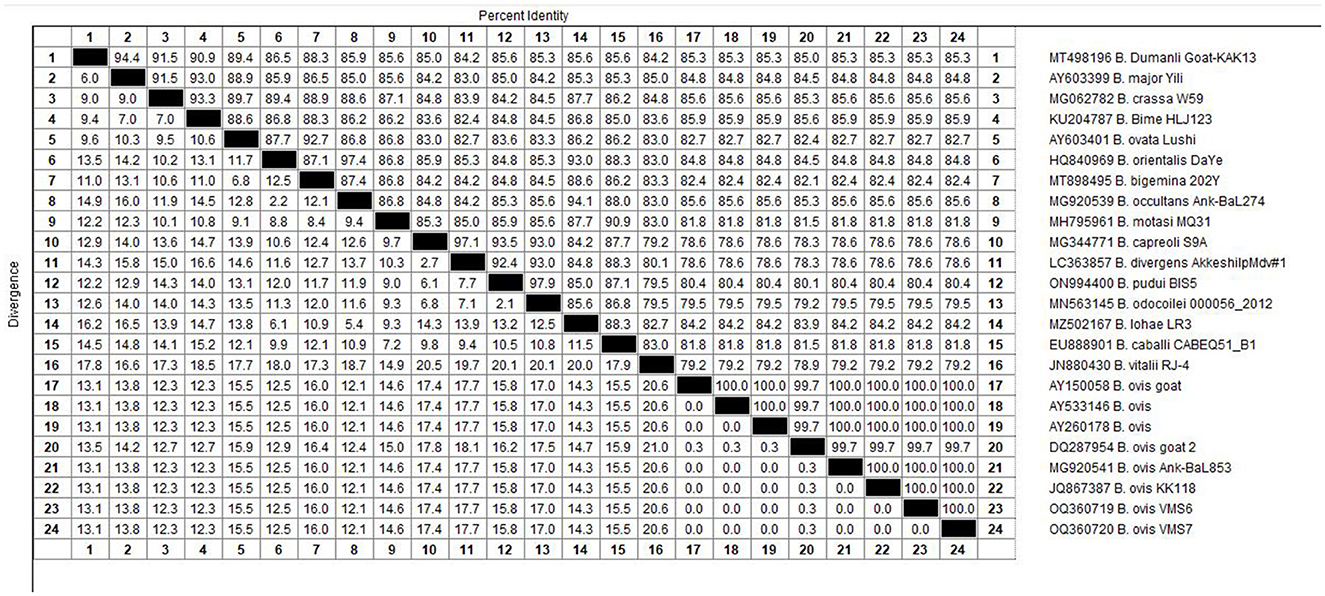 Figura 6. Los porcentajes de identidad de los aislados estudiados de B. ovis en ovejas relacionados con otros aislados en todo el mundo dependen del gen 18S rRNA de B. ovis.
Figura 6. Los porcentajes de identidad de los aislados estudiados de B. ovis en ovejas relacionados con otros aislados en todo el mundo dependen del gen 18S rRNA de B. ovis.
 Figura 7. Los porcentajes de identidad de los aislados estudiados de Theileria annulata en ovejas relacionados con otros aislados a nivel mundial dependen del gen Tams1 de Theileria annulata.
Figura 7. Los porcentajes de identidad de los aislados estudiados de Theileria annulata en ovejas relacionados con otros aislados a nivel mundial dependen del gen Tams1 de Theileria annulata.
4 Discusión
La infección por piroplásmidos representa una amenaza significativa para las poblaciones de ovejas en todo el mundo. Teniendo en cuenta su importancia veterinaria y sus importantes implicaciones económicas, comprender el patrón epidemiológico de la infección por piroplasma es esencial para implementar estrategias de control específicas, incluidas medidas de control de garrapatas, programas de vacunación y mejores prácticas de manejo para reducir la carga de la enfermedad en las poblaciones ovinas. El presente estudio profundiza en la exposición y epidemiología de estos parásitos específicamente entre las poblaciones ovinas del Alto Egipto, junto con la caracterización molecular de ambos parásitos. Además, el estudio revisó los datos de prevalencia de Babesia spp. y Theileria spp. entre las ovejas en Egipto (Tabla 1). Como se ilustra, el estudio actual reveló que 176 de las muestras analizadas dieron positivo para piroplasmosis utilizando métodos de detección microscópica, lo que resultó en una prevalencia general del 44%. A nivel nacional, un estudio previo realizado por Hussein et al. (31) en la gobernación de Qena, Alto Egipto, informó de una prevalencia global de parásitos sanguíneos del 38,46%, ligeramente inferior a los resultados actuales. Por el contrario, otra investigación previa (33) en la costa norte de Egipto mostró una mayor tasa de prevalencia de parásitos sanguíneos (84,80%), superando los hallazgos reportados actualmente. En cuanto a las tasas de prevalencia individual reportadas, las tasas de infección detectadas para Babesia spp. y Theileria spp. fueron de 14% y 30%, respectivamente. Un estudio previo realizado (4) en la gobernación de Behera (Bajo Egipto) informó de tasas de prevalencia del 17% para Babesia y del 20% para Theileria, respectivamente. Otro estudio previo (29) documentó la presencia de Babesia spp., con tasas de prevalencia de 23,7%, 23,1%, 21,2% y 20,6% en las gobernaciones de Beni Suef, Kafr Elsheikh, El-Fayum y El-Sharkia, respectivamente, lo que supera las tasas de prevalencia observadas en el presente estudio. Por el contrario, otro estudio realizado en ovejas de la gobernación de Kalubyia (Bajo Egipto) reveló una incidencia menor del 8,5% para Babesia spp. (28). Una investigación previa (56) realizada en ovejas de Egipto reportó una tasa de prevalencia más alta del 50,7% para Theileria spp. por frotis de sangre teñido de Giemsa (24-26, 38, 46, 48, 49). Las variaciones en las tasas de prevalencia de infecciones pueden deberse a las intrincadas interacciones de factores como la presencia de garrapatas infectadas, las prácticas sanitarias e higiénicas, las técnicas de procedimiento, el estado inmunológico de los animales infectados y la ausencia de supervisión veterinaria (34, 57, 58). Los factores abióticos, en particular la temperatura y la humedad, tienen un impacto significativo en la epidemiología de estas infecciones (59). Las condiciones climáticas en el área estudiada se caracterizan por temperaturas medias durante todo el año que oscilan entre 18°C y 40°C, estableciendo un hábitat óptimo para la presencia duradera de garrapatas duras. Este entorno no solo facilita la proliferación de sus huéspedes y la propagación de los parásitos sanguíneos asociados, sino que también es probable que contribuya a las elevadas tasas de prevalencia (60, 61). En cuanto a los signos clínicos reportados, las ovejas infectadas presentaron síntomas como anorexia, anemia y emaciación. Además, se registró hemoglobinuria en ovejas infectadas con Babesia spp. Los infectados con Theileria spp. mostraron signos clínicos adicionales como lagrimeo, opacidad corneal y agrandamiento de los ganglios linfáticos, lo que coincide con las observaciones reportadas en la literatura (22).
En cuanto a la edad, que se exploró como un factor de riesgo potencial asociado a la exposición a esos parásitos, este estudio reveló que la prevalencia general de parásitos sanguíneos en ovejas no fue significativamente mayor en animales jóvenes menores de 2 años, en comparación con adultos mayores de 2 años. En este sentido, el estudio encontró que las tasas de infección por Babesia spp. eran más altas en los animales menores de 2 años en comparación con los mayores de 2 años, mientras que las tasas de infección por Theileria spp. también eran más prevalentes en el grupo de edad más joven. Sin embargo, la diferencia estadística no fue significativa. En un estudio previo realizado por Fadly, 2012 (4) en Behera, Alto Egipto, una mayor prevalencia tanto de Babesia spp. como de Theileria spp. fue mayor en ovejas mayores de 3 años de edad, lo que contrasta con nuestros hallazgos. Además, Elsayed et al. (33) en la costa norte de Egipto concluyeron que la infección por parásitos sanguíneos era mayor en ovejas de más de 3 años. Otro estudio (62) en Egipto registró una mayor tasa de infección en animales de ≤ 1 año. Las discrepancias observadas entre los hallazgos actuales y otros estudios podrían atribuirse a las variaciones en las prácticas sanitarias e higiénicas, el número de animales examinados, las variaciones en la resistencia inmunológica y el impacto de las condiciones climáticas locales, que pueden influir en la propagación de las garrapatas (32).
Con respecto al sexo como factor de variable individual estudiado, este estudio encontró que la prevalencia general de parásitos sanguíneos en ovejas macho fue significativamente mayor en comparación con hembras, lo que se alinea con estudios previos realizados a nivel nacional o internacional (63-66). Sin embargo, los hallazgos actuales contrastan con otros informes en Egipto (31, 33, 62). Esta variación puede deberse a una notable diferencia en el tamaño de la muestra de hombres y mujeres incluidos en nuestro estudio, lo que podría influir en las tasas de prevalencia (67). Otro factor que contribuye son las prácticas de manejo en Egipto, donde las granjas suelen tener pocos machos reproductores pero un alto porcentaje de corderos machos jóvenes (68) y la mayor susceptibilidad a la infección entre las hembras que pastan juntas al aire libre (31). Se ha demostrado que el contacto de ganado sano con ganado infectado durante el pastoreo libre es un factor de riesgo crítico para aumentar la carga y la propagación de la infección por Theileria (69-71). Además, otros informes anteriores revelaron una mayor incidencia de parásitos sanguíneos en las mujeres en comparación con los hombres debido a diversos factores fisiológicos como el embarazo, el parto y la producción de leche, que pueden experimentar un mayor estrés, lo que los hace más susceptibles a la infección que los hombres (72). Además, el manejo de las granjas, los patrones microclimáticos, la distribución de las garrapatas, la raza huésped y las condiciones de muestreo pueden explicar la variación en las tasas de prevalencia de patógenos transmitidos por garrapatas (73, 74). En este estudio, la prevalencia de parásitos sanguíneos fue significativamente mayor en la estación fría 66,1% que en la estación cálida 15,9%. La tasa de infección de Theileria spp. y Babesia spp. fue mayor en la estación fría (44,6% y 21,4%, respectivamente) que en la estación cálida (11,4% y 4,5% respectivamente). Del mismo modo, otro estudio previo detectó una mayor prevalencia de parásitos sanguíneos en invierno en comparación con el verano (63). El resultado obtenido no concuerda con los datos registrados (4) en la gobernación de Behera (Bajo Egipto), que notificó una mayor tasa de infección en los meses de verano en comparación con la temporada de invierno. Otros estudios han documentado que no hubo diferencias en la tasa de prevalencia de parásitos sanguíneos a lo largo de las temporadas analizadas (36). Esto puede atribuirse a la presencia de garrapatas y puede explicarse por la hipótesis de que las temperaturas medias de la zona estudiada durante los meses fríos, que se sabe que proporcionan condiciones favorables para la rápida proliferación de garrapatas y facilitan su fácil transmisión entre los animales susceptibles (75). Estas variaciones pueden atribuirse a las condiciones geográficas y climáticas, la actividad de los vectores, el estado parasitario de la zona investigada y el estado inmunológico de los animales examinados (4, 76). En este sentido, el área estudiada proporciona un ambiente propicio para el desarrollo de garrapatas duras (39). Específicamente, las temperaturas promedio en esta región durante el invierno pueden alcanzar los 21 °C (77, 78), lo que proporciona condiciones óptimas para la propagación durante todo el año de los vectores huéspedes y los parásitos sanguíneos que los acompañan (60, 61).
En cuanto al análisis filogenético, este estudio identificó inequívocamente dos especies de parásitos de la sangre, B. ovis a través del gen 18S rRNA y T. annulata por el gen tams1. Según estudios previos, un gen conservado del ARNr 18S es una diana específica para la detección de especies de Babesia y Theileria mediante el ensayo de PCR (12, 79, 80), siendo una herramienta diagnóstica sensible para los piroplásmidos ovinos. Por otro lado, el gen Tams1 ha demostrado ser una herramienta para detectar nuevas especies relacionadas con Theileria (81). Con respecto a Theileria, si bien el frotis de sangre sigue siendo el método principal para el diagnóstico, se queda corto en la diferenciación de especies debido a las similitudes morfológicas (82). En este trabajo, la técnica de PCR permitió identificar T. annulata en este estudio. Del mismo modo, un trabajo anterior (32) en Egipto detectó varias especies de Theilaria (T. ovis, T. annulata y T. lestoquardi). Se ha documentado que las infecciones experimentales de ovejas y cabras con T. annulata, el agente causante de la teileriosis tropical en el ganado bovino, inducen síntomas leves sin desarrollo de piroplasma. Sin embargo, hallazgos previos sugieren que T. annulata puede causar síntomas clínicos leves en la infección post-experimental en ovejas, y T. lestoquardi puede afectar de manera similar al ganado vacuno (83). Precisamente, T. lestoquardi es considerada la principal especie patógena responsable de la teileriosis ovina maligna (84, 85), siendo probable que muchas muestras positivas se atribuyan a esta especie teniendo en cuenta su detección de mezcla con otras especies en diferentes estudios (9, 76, 86). Sin embargo, otro estudio (87) también identificó infecciones naturales de ovejas con varias especies de Theileria, conocidas como T. lestoquardi, T. ovis y T. annulate, mediante PCR-RFLP anidada. Ambas infecciones son transmitidas por el mismo vector, H. anatolicum, que se encuentra en Egipto (76) y en muchas áreas, el ganado vacuno y ovino se crían juntos, lo que puede conducir a una infestación cruzada (88, 89). Debido a limitaciones logísticas, nuestro estudio no pudo realizar determinaciones moleculares en todas las muestras. Los hallazgos reportados aquí plantean la posibilidad de que las ovejas actúen como reservorios de T. annulata, siempre que ambos parásitos y un vector competente coexistan en la misma área. A pesar de este desafío, este estudio se considera uno de los pocos informes moleculares en Egipto que confirman B. ovis, aunque no se pudo lograr la confirmación en todas las muestras, lo que destaca la necesidad de realizar más estudios en esta área para determinar con precisión la prevalencia de esta especie en Egipto.
El presente estudio se enfrenta a varias limitaciones metodológicas que requieren una cuidadosa consideración a la hora de interpretar los hallazgos. Inicialmente, el cribado de ambos parásitos sanguíneos consistía en examinar una sola muestra de sangre por animal mediante microscopía. Si bien este método sigue siendo la técnica de referencia para el cribado a gran escala de la piroplasmosis, especialmente en entornos con recursos limitados, su precisión en la detección puede verse comprometida, lo que puede llevar a una subestimación de la verdadera tasa de infección. En segundo lugar, el diseño transversal del estudio es inadecuado para monitorizar la progresión de la piroplasmosis y para captar las variaciones estacionales de las tasas de infección. En tercer lugar, los resultados obtenidos pueden no ser generalizables a otros contextos epidemiológicos o regiones geográficas dentro de un mismo país. Por último, el número relativamente limitado de muestras sometidas a caracterización molecular puede haber influido en la precisión de la estimación de la verdadera diversidad genética y la frecuencia de las especies de parásitos que circulan entre las ovejas examinadas.
5 Conclusiones
El estudio actual ha proporcionado información significativa sobre la prevalencia y el impacto de Babesia y Theileria, reafirmando su importancia actual como parásitos de la sangre que afectan a las ovejas egipcias en el Alto Egipto. Esta investigación enfatiza el papel crítico de la utilización de la microscopía tradicional y los métodos moleculares de vanguardia para la detección y caracterización precisas de la piroplasmosis. Teniendo en cuenta los hallazgos mencionados, cabe destacar el aparente aumento de la circulación de la piroplasmosis, una tendencia probablemente empeorada por la expansión de las poblaciones de garrapatas vectoras. Además, el estudio arroja luz sobre el panorama epidemiológico actual de la piroplasmosis en el entorno egipcio. Al abordar la propagación de estos parásitos, se pueden tomar medidas informadas para mitigar las enfermedades asociadas, salvaguardando la salud y el bienestar tanto del ganado como de la población en general. Estos hallazgos sirven como un llamado a la acción, enfatizando la importancia de la vigilancia continua y las intervenciones estratégicas para manejar y minimizar el impacto de las infecciones por Babesia y Theileria en Egipto. Esto subraya la necesidad urgente de investigaciones adicionales centradas en estos vectores, lo que indica un dominio crítico para futuros esfuerzos de investigación e iniciativas de intervención. También se necesitan más estudios con tamaños de muestra más grandes, pequeños rumiantes diversos y datos epidemiológicos adicionales para evaluar de manera integral los factores de riesgo asociados a la infección. Esos conocimientos serían útiles para que las autoridades gubernamentales elaboraran y aplicaran medidas de control eficaces.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están a disposición del público. Estos datos se pueden encontrar en: https://www.ncbi.nlm.nih.gov/nuccore/; OP984151.1.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Ética de la Investigación de la Facultad de Medicina Veterinaria de la Universidad de Assiut, bajo la designación 06/2023/0130. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
AD: Investigación, Metodología, Administración de Proyectos, Supervisión, Validación, Visualización, Redacción-borrador original, Redacción-revisión y edición. FA-A: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Software, Validación, Redacción: borrador original, Redacción: revisión y edición. SM: Conceptualización, Metodología, Software, Supervisión, Validación, Visualización, Redacción, Redacción del borrador original, Redacción, revisión y edición. AG: Conceptualización, Curación de datos, Análisis formal, Investigación, Software, Supervisión, Validación, Visualización, Redacción: borrador original, Redacción: revisión y edición. FO: Conceptualización, Curación de datos, Investigación, Metodología, Software, Supervisión, Validación, Visualización, Redacción, borrador original, Redacción, revisión y edición. FE: Curación de datos, Análisis formal, Investigación, Software, Validación, Redacción, revisión y edición. EH: Curación de datos, Análisis formal, Software, Validación, Visualización, Redacción, revisión y edición. NA: Conceptualización, Curación de datos, Análisis formal, Software, Validación, Redacción, revisión y edición. HA: Curación de datos, análisis formal, adquisición de fondos, investigación, software, validación, redacción, revisión y edición. AA: Curación de datos, análisis formal, software, validación, redacción, revisión y edición. DB-B: Curación de datos, Análisis formal, Software, Redacción, revisión y edición. EE: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Recursos, Validación, Redacción: borrador original, Redacción: revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio fue apoyado por los investigadores de la Universidad Princesa Nourah Bint Abdulrahman que apoyan el Proyecto No. (PNURSP2024R401), Universidad Princesa Nourah Bint Abdulrahman, Riad, Arabia Saudita. EE recibió apoyo a través de una beca postdoctoral del Programa María Zambrano de la Universidad de Córdoba, financiada por el Programa de Recalificación del Sistema Universitario Español, patrocinado por el Ministerio de Universidades de España y financiado por la Unión Europea-NextGenerationEU.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El revisor MR declaró una afiliación compartida con el autor FE al editor encargado en el momento de la revisión.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1373842/full#supplementary-material
Referencias
1. Tanveer M, Farooq M, Amjad M, Asif M, Kashif M, Latif M, et al. Prevalencia molecular, factores de riesgo asociados y filogenia de Anaplasma marginale, Theileria ovis y T. lestoquardi en ovejas de Pakistán. Comp Immunol Microbiol Infect Dis. (2022) 86:101822. doi: 10.1016/j.cimid.2022.101822
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Abdelazeem AG, Dyab AK, Mohamed YM. Infección helmíntica en el sistema digestivo de cabras en matadero, Manfalout, gobernación de Assiut, Egipto. J Egipto Soc Parasitol. (2020) 50:649–55. doi: 10.21608/jesp.2020.131101
3. Aouadi A, Leulmi H, Boucheikhchoukh M, Benakhla A, Raoult D, Parola P. Evidencia molecular de parásitos hemoprotozoarios transmitidos por garrapatas (Theileria ovis y Babesia ovis) y bacterias en garrapatas y sangre de pequeños rumiantes en el norte de Argelia. Comp Immunol Microbiol Infect Dis. (2017) 50:34–9. doi: 10.1016/j.cimid.2016.11.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Fadly SR. Prevalencia de parásitos sanguíneos de algunos animales de granja en la provincia de Behera. Assiut Vet Med J. (2012) 58:1–7. doi: 10.21608/avmj.2012.173780
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Uilenberg G. Babesia: una visión histórica. Parasitol veterinario. (2006) 138:3–10. doi: 10.1016/j.vetpar.2006.01.035
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Decir F, Karaer Z, Dincer S, Cakmak A, Inci A, Yukari BA, et al. Comparación de las susceptibilidades a la infección de cuatro especies de garrapatas Hyalomma con Theileria annulata. Parasitol veterinario. (2003) 113:115–21. doi: 10.1016/S0304-4017(03)00045-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Schnittger L, Ganzinelli S, Bhoora R, Omondi D, Nijhof AM, Florin-Christensen M. Piroplasmida Babesia, Cytauxzoon y Theileria en animales de granja y de compañía: compilación de especies, filogenia molecular y conocimientos evolutivos. Parasitol Res. (2022) 121:1207–45. doi: 10.1007/s00436-022-07424-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Scott I. Principios de parasitología veterinaria, Dennis Jacobs, Mark Fox, Lynda Gibbons, Carlos Hermosilla. Parasitol veterinario. (2016) 220:12. doi: 10.1016/j.vetpar.2016.02.012
9. Villanueva-Saz S, Borobia M, Fernández A, Jiménez C, Yzuel A, Verde MT, et al. Anemia en ovejas causada por hemoparásitos de Babesia y Theileria. Animales (Basilea). (2022) 12:341. doi: 10.3390/ani12233341
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Ravindran R, Hembram PK, Kumar GS, Kumar KGA, Deepa CK, Varghese A. Transmisión transovárica de protozoos patógenos y organismos rickettsiales en garrapatas. Parasitol Res. (2023) 122:691–704. doi: 10.1007/s00436-023-07792-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Almazán C, Scimeca RC, Reichard M V, Mosqueda J. Babesiosis y Theileriosis en América del Norte. Patógenos. (2022) 11:168. doi: 10.3390/pathogens11020168
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. El Imam AH, Hassan SM, Gameel AA, El Hussein AM, Taha KM, Oosthuizen MC. Identificación molecular de diferentes especies de Theileria y Babesia que infectan a ovejas en Sudán. Ann Parasitol. (2016) 62:47–54. doi: 10.17420/ap6201.31
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Friedhoff KT. Enfermedades transmitidas por garrapatas de ovejas y cabras causadas por Babesia, Theileria o Anaplasma spp. Parassitologia. (1997) 39:99-109.
14. Kirman R, Guven E. Detección molecular de especies/genotipos de Babesia y Theileria en ovejas y garrapatas ixódidas en Erzurum, noreste de Turquía: primer informe de Babesia canis en ovejas. Res Vet Sci. (2023) 157:40–9. doi: 10.1016/j.rvsc.2023.02.012
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Schnittger L, Yin H, Qi B, Gubbels MJ, Beyer D, Niemann S, et al. Detección y diferenciación simultánea de parásitos Theileria y Babesia que infectan a pequeños rumiantes mediante transferencia inversa. Parasitol Res. (2004) 92:189–96. doi: 10.1007/s00436-003-0980-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Schnittger L, Yin H, Gubbels MJ, Beyer D, Niemann S, Jongejan F, et al. Filogenia de los parásitos Theileria y Babesia de ovejas y cabras. Parasitol Res. (2003) 91:398–406. doi: 10.1007/s00436-003-0979-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Stevanović O, Radalj A, Subić I, Jovanović NM, Sladojević Ž, Amović M, et al. La presencia de babesiosis ovina maligna en Bosnia y Herzegovina indica un posible riesgo emergente para la región de los Balcanes. Comp Immunol Microbiol Infect Dis. (2022) 90–91:101893. doi: 10.1016/j.cimid.2022.101893
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Zhou M, Cao S, Sevinc F, Sevinc M, Ceylan O, Ekici S, et al. Detección molecular y caracterización genética de Babesia, Theileria y Anaplasma en ovejas y cabras aparentemente sanas de la región central de Turquía. Garrapatas transmitidas por garrapatas. (2017) 8:246–52. doi: 10.1016/j.ttbdis.2016.11.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Zangana IK, Naqid IA. Prevalencia de piroplasmosis (teileriosis y babesiosis) en cabras de la gobernación de Duhok. Al-Anbar J Vet Sci. (2011) 4:50–7.
20. Ijaz M, Rehman A, Ali MM, Umair M, Khalid S, Mehmood K, et al. Ensayos clínico-epidemiológicos y terapéuticos sobre babesiosis en ovejas y cabras en Lahore, Pakistán. La planta J Anim Sci. (2013) 23:666–9.
21. Stuen S. Hemoparásitos: infecciones desafiantes y emaciantes en pequeños rumiantes: una revisión. Animales. (2020) 10:2179. doi: 10.3390/ani10112179
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Hassan MA, Raoofi A, Lotfollahzadeh S, Javanbakht J. Características clínicas y citológicas e implicaciones pronósticas en la infección por Theileria en ovejas y cabras en el norte de Irán. J Parásito Dis. (2015) 39:190–3. doi: 10.1007/s12639-013-0318-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Naz S, Maqbool A, Ahmed S, Ashraf K, Ahmed N, Saeed K, et al. Prevalencia de teileriosis en pequeños rumiantes en Lahore-Pakistán. J Vet Anim Sci. (2012) 2:16–20.
24. Harfoush MA. Estudios sobre algunas enfermedades parasitarias en ovinos (Tesis doctoral). Tanta: Universidad de Tanta, Facultad de Medicina Veterinaria, Departamento de Enfermedades Animales (1998).
25. Forshaw D, Alex SM, Palmer DG, Cotter J, Roberts WD, Jenkins C, et al. Infección por el genotipo Theileria orientalis Ikeda asociada con anemia, aborto y muerte en ganado vacuno de carne en Australia Occidental. Aust Vet J. (2020) 98:290–7. doi: 10.1111/avj.12937
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Criado-Fornelio A, Buling A, Pingret JL, Etievant M, Boucraut-Baralon C, Alongi A, et al. Hemoprotozoos de animales domésticos en Francia: prevalencia y caracterización molecular. Parasitol veterinario. (2009) 159:73–6. doi: 10.1016/j.vetpar.2008.10.012
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Hassan S, Skilton RA, Pelle R, Odongo D, Bishop RP, Ahmed J, et al. Evaluación de la prevalencia de Theileria lestoquardi en ovejas del Sudán mediante métodos serológicos y moleculares. Prev Vet Med. (2019) 169:104697. doi: 10.1016/j.prevetmed.2019.104697
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Ramadán MY, El-Akabawy ML. Estudios sobre la babesiosis ovina en la gobernación de Kalubyia, Egipto. Minufiya Vet J. (2000) 1:147–55.
29. Mahmoud MS. Algunos estudios serológicos sobre especies de Babesia que infectan ovejas en Egipto (tesis de maestría en ciencias de la ciencia). Giza: Universidad de El Cairo (1992).
30. El-Seify MA, Mahran OM ABD EL AAL AMI. Estudios epidemiológicos sobre garrapatas duras y parásitos transmitidos por garrapatas, en la ciudad de Shalatin, gobernación del Mar Rojo, Egipto. Assiut Vet Med J. (2011) 57:1–28. doi: 10.21608/avmj.2011.176883
31. Hussein NM, Mohammed ES, Hassan AA, El-Dakhly KM. Patrón de distribución de las especies de Babesia y Theileria en ovejas en la provincia de Qena, Alto Egipto. Arch Parasitol. (2017) 1:1–4.
32. Hegab AA, Fahmy MM, Mahdy OA, Wahba A. Identificación parasitológica y molecular de especies de Theileria mediante el método PCR-RFLP en ovejas, Egipto. Int J Adv Res Biol Sci. (2016) 3:48–55. Disponible en línea en: http://s-o-i.org/1.15/ijarbs-2016-3-7-7
33. Elsayed M-AA, Bessat MN, Ezzat SF, Felefel WI. La prevalencia y los factores de riesgo de infección asociados a los parásitos protozoarios de la sangre entre los pequeños rumiantes de la costa norte de Egipto. Matrouh J Vet Med. (2021) 1:19–23. doi: 10.21608/mjvm.2021.231054
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Barghash SM. Prevalencia molecular y filogenia de algunos parásitos transmitidos por garrapatas en rumiantes en la península del Sinaí, Egipto. Eur J Biomed Pharm Sci. (2022) 9:15–25.
35. Abdelsalam MA, Felefel W, Fadl S, Bessat M. Prevalencia molecular y factores de riesgo de infección asociados a protozoos transmitidos por garrapatas y patógenos sanguíneos rickettsiales en pequeños rumiantes. BMC Vet Res. (2023) 19:138. doi: 10.1186/s12917-023-03702-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Hosein HI, Ahmed SA, Ibrahim FA, Abou-Elnaga TR, Gebely MA, Mahmoud MA. Seroprevalencia de Babesia ovis en pequeños rumiantes en el oasis de Siwa, Egipto. Revista de Investigación Médica Veterinaria. (2007) 17:19–24. doi: 10.21608/jvmr.2007.77888
37. Elsify A, Sivakumar T, Nayel M, Salama A, Elkhtam A, Rizk M, et al. Estudio epidemiológico de los parásitos bovinos Babesia y Theileria en bovinos, búfalos y ovinos en Egipto. Parasitol Int. (2015) 64:79–85. doi: 10.1016/j.parint.2014.10.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Eliwa M, Mahran KMA, Mousa WA, Hagag N, Shaalan MI, Bashandy MM. Teileriosis ovina: investigaciones clínicas, patológicas y moleculares. Adv Anim Vet Sci. (2021) 9:462–72. doi: 10.17582/journal.aavs/2021/9.4.462.472
39. Al-Hosary AA, ElSify A, Salama AA, Nayel M, Elkhtam A, Elmajdoub LO, et al. Estudio filogenético de Theileria ovis y Theileria lestoquardi en ovejas de Egipto: Evidencia molecular y caracterización genética. Mundo Veterinario. (2021) 14:634–9. doi: 10.14202/vetworld.2021.634-639
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Smith KF, Acevedo-Whitehouse K, Pedersen AB. El papel de las enfermedades infecciosas en la conservación biológica. Conserva de Anim. (2009) 12:1–12. doi: 10.1111/j.1469-1795.2008.00228.x
41. Kocan KM, Busby AT, Allison RW, Breshears MA, Coburn L, Galindo RC, et al. Las ovejas infectadas experimentalmente con un aislado humano de Anaplasma phagocytophilum sirven como huésped para la infección de las garrapatas Ixodes scapularis. Garrapatas transmitidas por garrapatas. (2012) 3:147–53. doi: 10.1016/j.ttbdis.2012.01.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Abdullah DA, Ali MS, Omer SG, Ola-Fadunsin SD, Ali FF, Gimba FI. Prevalencia e influencia climática en los hemoparásitos de bovinos y ovinos en Mosul, Iraq. J Adv Vet Anim Res. (2019) 6:492. doi: 10.5455/javar.2019.f373
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Levine ND. Parásitos protozoarios de animales domésticos y del hombre, 1ª ed. Iowa: Iowa State University Press (1985). Pág. 414.
45. Bell-Sakyi L, Koney EBM, Dogbey O, Walker AR. Incidencia y prevalencia de hemoparásitos transmitidos por garrapatas en rumiantes domésticos en Ghana. Parasitol veterinario. (2004) 124:25–42. doi: 10.1016/j.vetpar.2004.05.027
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Aydin MF, Aktas M, Dumanli N. Identificación molecular de Theileria y Babesia en garrapatas recolectadas de ovejas y cabras en la región del Mar Negro de Turquía. Parasitol Res. (2015) 114:65–9. doi: 10.1007/s00436-014-4160-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Kumar B, Maharana BR, Thakre B, Brahmbhatt NN, Joseph JP. PCR de piroplásmidos basada en el gen ARNr 18S: un ensayo para el cribado molecular rápido y preciso de las especies de Theileria y Babesia en animales. Acta Parasitol. (2022) 67:1697–707. doi: 10.1007/s11686-022-00625-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Nourollahi-Fard SR, Khalili M, Ghalekhani N. Detección de Theileria annulata en muestras de sangre de ganado nativo mediante PCR y método de frotis en el sureste de Irán. J Parásito Dis. (2015) 39:249–52. doi: 10.1007/s12639-013-0333-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Benson DA, Karsch-Mizrachi I, Lipman DJ, Ostell J, Rapp BA, Wheeler DL. GenBank. Ácidos nucleicos Res. (2002) 30:17–20. doi: 10.1093/nar/30.1.17
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ. Herramienta básica de búsqueda de alineaciones locales. J Mol Biol. (1990) 215:403–10. doi: 10.1016/S0022-2836(05)80360-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Katoh K, Standley DM. Software de alineación de secuencia múltiple MAFFT versión 7: mejoras en el rendimiento y la facilidad de uso. Mol Biol Evol. (2013) 30:772–80. DOI: 10.1093/molbev/mst010
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Tamura K, Stecher G, Kumar S. MEGA11: análisis de genética evolutiva molecular versión 11. Mol Biol Evol. (2021) 38:3022–7. DOI: 10.1093/Molbev/MSAB120
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Nei M, Kumar S. Evolución molecular y filogenética. Nueva York, NY: Oxford University Press (2000).
54. Rambaut, A., Higuera, v1.4.4. (2018). Disponible en línea en: http://tree.bio.ed.ac.uk/software/figtree/ (consultado el 10 de abril de 2024).
55. Wilson EB. La inferencia probable, la ley de sucesión y la inferencia estadística. J Am Stat Assoc. (1927) 22:209–12. doi: 10.1080/01621459.1927.10502953
56. Ibrahim MS, El Seify MA, Hafez AM, Deghidy NS, Harfoush MA. Estudios sobre parásitos sanguíneos en ovejas. En: 1er Congreso Científico de Laboramenismos Provinciales. (2000). págs. 15-17.
57. Ferrer D, Castellà J, Gutiérrez JF. Seroprevalencia de Babesia ovis en ovino en Cataluña, noreste de España. Parasitol veterinario. (1998) 79:275–81. doi: 10.1016/S0304-4017(98)00175-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
58. Ziapour SP, Esfandiari B, Youssefi MR. Estudio de la prevalencia de babesiosis en animales domésticos con signos sospechosos en la provincia de Mazandaran, norte de Irán, durante 2008. J Anim Vet Adv. (2011) 10:712–4. doi: 10.3923/javaa.2011.712.714
59. Foughali AA, Jedidi M, Dhibi M, Mhadhbi M, Sassi L, Berber A, et al. Infección por hemopatógenos e infestación por garrapatas de ovejas durante la temporada de verano en la región de Constantina, noreste de Argelia. Vet Med Sci. (2021) 7:1769–77. doi: 10.1002/vms3.551
Resumen de PubMed | Texto completo de Crossref | Google Académico
60. Fieler AM, Rosendale AJ, Farrow DW, Dunlevy MD, Davies B, Oyen K, et al. Características térmicas de las larvas de múltiples garrapatas ixódidas, HHS, acceso público, manuscrito del autor. Comp Biochem Physiol A Mol Integr Physiol. (2021) 257:110939. doi: 10.1016/j.cbpa.2021.110939
Resumen de PubMed | Texto completo de Crossref | Google Académico
61. Cable J, Barber I, Boag B, Ellison AR, Morgan ER, Murray K, et al. Cambio global, transmisión de parásitos y control de enfermedades: lecciones de la ecología. Philos Trans R Soc Lond B Biol Sci. (2017) 372:88. doi: 10.1098/rstb.2016.0088
Resumen de PubMed | Texto completo de Crossref | Google Académico
62. Abdel-Shafy S, Abdullah HHAM, Elbayoumy MK, Elsawy BSM, Hassan MR, Mahmoud MS, et al. Investigación epidemiológica molecular de las bacterias Piroplasms y Anaplasmataceae en animales domésticos egipcios y garrapatas asociadas. Patógenos. (2022) 11:1194. doi: 10.3390/pathogens11101194
Resumen de PubMed | Texto completo de Crossref | Google Académico
63. Magzoub A, El Ghali A, Hussien MO, Juma Y, Mohammed SB. Prevalencia de garrapatas (Acari: Ixodidae) y Theileria lestoquardi en ovejas en las estaciones de investigación de producción animal de El Huda y El Nuhud, Sudán. J Parásito Dis. (2021) 45:146. doi: 10.1007/s12639-020-01284-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
64. Osman T, Ali A, Hussein M, Ghali E, Salih D. Investigación sobre la infección por Theileria lestoquardi entre ovejas y cabras en Nyala, estado de Darfur del Sur, Sudán. Insights Vet Sci. (2017) 1:17–23. doi: 10.29328/journal.hvsr.1001002
65. Taha HA, Shoman SA, Alhadlag NM. Estudio molecular y serológico de algunas enfermedades hemoprotozoarias, rickettsiales y virales de pequeños rumiantes de Al-Madinah Al Munawarah, Arabia Saudita. Trop Biomed. (2015) 32:511–23.
66. Iqbal F, Khattak R, Ozubek S, Khattak M, Rasul A, Aktas M. Aplicación del ensayo de transferencia de línea inversa para la detección molecular de Theileria y Babesia sp. en muestras de sangre de ovejas y cabras de Pakistán, Irán. J Parasitol. (2013) 8:289–95.
67. Miller IF, Schneider-Crease I, Nunn CL, Muehlenbein MP. Estimación de la prevalencia de infecciones: mejores prácticas y sus fundamentos teóricos. Ecol Evol. (2018) 8:6738. doi: 10.1002/ece3.4179
Resumen de PubMed | Texto completo de Crossref | Google Académico
68. Abd-Allah S. Evaluación de los sistemas de producción de ovejas de las aldeas bajo las prácticas de gestión predominantes en el delta del Nilo de Egipto. Egipto J Vet Sci. (2024) 55:517–30. doi: 10.21608/ejvs.2023.230657.1570
69. Swai ES, Karimuribo ED, Kambarage DM, Moshy WE, Mbise AN. Comparación de la seroprevalencia y los factores de riesgo para Theileria parva y T. mutans en ganado lechero de pequeños productores en las regiones de Tanga e Iringa de Tanzania. Veterinario J. (2007) 174:390–6. doi: 10.1016/j.tvjl.2006.08.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
70. El-Ashker M, Hotzel H, Gwida M, El-Beskawy M, Silaghi C, Tomaso H. Identificación biológica molecular de especies de Babesia, Theileria y Anaplasma en ganado bovino en Egipto mediante ensayos de PCR, análisis de secuencia génica y una nueva micromatriz de ADN. Parasitol veterinario. (2015) 207:329–34. doi: 10.1016/j.vetpar.2014.12.025
Resumen de PubMed | Texto completo de Crossref | Google Académico
71. Ullah K, Numan M, Alouffi A, Almutairi MM, Zahid H, Khan M, et al. Caracterización molecular y evaluación de los factores de riesgo asociados a la infección por Theileria anulata. Microorganismos. (2022) 10:1614. doi: 10.3390/microorganismos10081614
Resumen de PubMed | Texto completo de Crossref | Google Académico
72. Fereig RM, Mohamed SGA, Mahmoud H, AbouLaila MR, Guswanto A, Nguyen TT, et al. Seroprevalencia de anticuerpos contra Babesia bovis, B. bigemina, Trypanosoma evansi y Anaplasma marginale en bovinos del sur de Egipto Garrapatas. Borne Dis. (2017) 8:125–31. doi: 10.1016/j.ttbdis.2016.10.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
73. Cuervo PF, Artigas P, Lorenzo-Morales J, Bargues MD, Mas-Coma S. Enfoques de modelización de nichos ecológicos: desafíos y aplicaciones en enfermedades transmitidas por vectores. Trop Med Infect Dis. (2023) 8:187. doi: 10.3390/tropicalmed8040187
Resumen de PubMed | Texto completo de Crossref | Google Académico
74. Lihou K, Rose Vineer H, Wall R. Distribución y prevalencia de garrapatas y enfermedades transmitidas por garrapatas en granjas ovinas y bovinas en Gran Bretaña. Vectores parásitos. (2020) 13:406. doi: 10.1186/s13071-020-04287-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
75. Voyiatzaki C, Papailia SI, Venetikou MS, Pouris J, Tsoumani ME, Papageorgiou EG. Los cambios climáticos exacerban la propagación de Ixodes ricinus y la aparición de borreliosis de Lyme y encefalitis transmitida por garrapatas en Europa: cómo se utilizan los modelos climáticos como enfoque de evaluación de riesgos para las enfermedades transmitidas por garrapatas. Int J Environ Res Salud Pública. (2022) 19:6516. doi: 10.3390/ijerph19116516
Resumen de PubMed | Texto completo de Crossref | Google Académico
76. Yakhchali M, Hosseine A. Prevalencia y fauna de ectoparásitos de rebaños de ovejas y cabras en el suburbio de Urmia, Irán. Veterinario Arhiv. (2006) 76:431–42.
77. Gelaro R, McCarty W, Suárez MJ, Todling R, Molod A, Takacs L, et al. El análisis retrospectivo de la era moderna para la investigación y las aplicaciones, versión 2 (MERRA-2). J Clim. (2017) 30:5419–54. doi: 10.1175/JCLI-D-16-0758.1
Resumen de PubMed | Texto completo de Crossref | Google Académico
78. San Francisco US Cedar LV Clima promedio para TNorwayA. (2024). Disponible en línea en: https://weatherspark.com/y/84211/Average-W-T-N-Y-RoundAA, Weatherspark.com (consultado el 10 de abril de 2024).
79. Mans BJ, Pienaar R, Latif AA. Una revisión del diagnóstico y la epidemiología de Theileria. Int J Parasitol Parásitos Wildl. (2015) 4:104–18. doi: 10.1016/j.ijppaw.2014.12.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
80. Tuli A, Singla L, Sharma A, Bal M, Filia G. Epidemiología molecular, factores de riesgo y alteraciones hematoquímicas inducidas por Theileria annulata en bovinos de Punjab (India). Acta Parasitol. (2015) 60:378–90. doi: 10.1515/ap-2015-0053
Resumen de PubMed | Texto completo de Crossref | Google Académico
81. Sivakumar T, Fujita S, Tuvshintulga B, Kothalawala H, Silva SSP, Yokoyama N. Descubrimiento de una nueva Theileria sp. estrechamente relacionada con Theileria annulata en el ganado de Sri Lanka. Sci Rep. (2019) 9:1–10. doi: 10.1038/s41598-019-52512-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
82. Salih DA, El Hussein AM, Singla LD. Enfoques diagnósticos para las enfermedades hemoparasitarias transmitidas por garrapatas en el ganado. J Vet Med Anim Salud. (2015) 7:45–56. doi: 10.5897/JVMAH2014.0345
Resumen de PubMed | Texto completo de Crossref | Google Académico
83. Taha KM, Salih DA, Ali AM, Omer RA, El Hussein AM. Infecciones naturales del ganado bovino con Theileria lestoquardi y de las ovejas con Theileria annulata en el Sudán. Parasitol veterinario. (2013) 191:143–5. doi: 10.1016/j.vetpar.2012.08.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
84. Luo J, Yin H. Theileriosis de ovejas y cabras en China. Trop Anim Salud Prod. (1997) 29:2907. doi: 10.1007/BF02632907
Resumen de PubMed | Texto completo de Crossref | Google Académico
86. Hashemi-Fesharki R. Enfermedades transmitidas por garrapatas de ovejas y cabras y sus vectores relacionados en Irán. Parassitología. (1997) 39:115–7.
87. Zaeemi M, Haddadzadeh H, Khazraiinia P, Kazemi B, Bandehpour M. Identificación de diferentes especies de Theileria (Theileria lestoquardi, Theileria ovis y Theileria annulata) en ovejas infectadas naturalmente mediante PCR-RFLP anidada. Parasitol Res. (2011) 108:837–43. doi: 10.1007/s00436-010-2119-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
88. Leemans I, Brown D, Hooshmand-Rad P, Kirvar E, Uggla A. Estudios de infectividad e inmunidad cruzada de Theileria lestoquardi y Theileria annulata en ovejas y bovinos: I Respuestas in vivo. Parasitol veterinario. (1999) 82:179–92. doi: 10.1016/S0304-4017(99)00013-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
89. Taha K, Mohammad A, Ebrahim N, Hag L, Elsheikh F, Hussien M, et al. Infectividad cruzada de Theileria annulata y Theileria lestoquardi entre bovinos y ovinos en el campo de Sudán. Notas de Vet Res. (2022) 2:43. doi: 10.5455/vrn.2022.b12
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: ovejas, piroplasma, Babesia, Theileria, microscópica, molecular, prevalencia, Egipto
Cita: Dyab AK, Mohamed SA-A, Abdel-Aziz FM, Gareh A, Osman F, Elgohary FA, Hassan EA, Alsowayeh N, Alzaylaee H, Ahmed AA-RS, Bravo-Barriga D y Elmahallawy EK (2024) Detección microscópica y molecular de piroplasmas entre ovejas en el Alto Egipto. Frente. Vet. Sci. 11:1373842. doi: 10.3389/fvets.2024.1373842
Recibido: 20 de enero de 2024; Aceptado: 07 de mayo de 2024;
Publicado: 27 mayo 2024.
Editado por:
Vikrant Sudan, Universidad de Ciencias Veterinarias y Animales Guru Angad Dev, India
Revisado por:
Mohamed Abdo Rizk, Universidad de Mansoura, Egipto
Kashif Hussain, Universidad de Agricultura, Faisalabad, Pakistán
Derechos de autor © 2024 Dyab, Mohamed, Abdel-Aziz, Gareh, Osman, Elgohary, Hassan, Alsowayeh, Alzaylaee, Ahmed, Bravo-Barriga y Elmahallawy. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Ehab Kotb Elmahallawy, sa2elele@uco.es
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía