Efectos del embarazo temprano sobre la expresión del receptor tipo NOD en el endometrio ovino
Efectos del embarazo temprano sobre la expresión del receptor tipo NOD en el endometrio ovino
 Leying Zhang†
Leying Zhang†  Jiabao Cai†
Jiabao Cai†  Xinxin Wang†
Xinxin Wang†  Zhen Yang
Zhen Yang  Haiquan Ding
Haiquan Ding  Ling Yang*
Ling Yang*- Facultad de Ciencias de la Vida e Ingeniería de Alimentos, Universidad de Ingeniería de Hebei, Handan, China
Introducción: Los receptores similares al dominio de unión a nucleótidos (NOD) (NLR) se expresan en el endometrio y participan en la modulación de las respuestas inmunitarias innatas femeninas. Durante el embarazo existen interacciones conceptus-endometrio que aseguran la homeostasis inmunitaria de la interfase materno-fetal. El propósito de este estudio fue explorar los efectos del embarazo temprano sobre la expresión de NLR en el endometrio ovino.
Métodos: Se recolectaron tejidos endometriales en el día 16 del ciclo estral, y en los días 13, 16 y 25 de embarazo (n = 6 para cada grupo), y se utilizaron RT-qPCR, western blot y análisis inmunohistoquímico para analizar la expresión de NLR, incluyendo NOD1, NOD2, transactivador mayor de clase II del complejo de histocompatibilidad (CIITA), proteína inhibidora de la apoptosis neuronal (NAIP), familia NLR, que contiene el dominio de pirina 1 (NLRP1), NLRP3 y NLRP7.
Resultados: Los niveles de expresión de NOD1, NOD2, NAIP, CIITA, NLRP1 y NLRP3 disminuyeron, pero el nivel de expresión de NLRP7 aumentó en la endometria durante el embarazo temprano en comparación con las ovejas no preñadas. Además, las proteínas NOD2 y CIITA se localizaron en el endometrio de una manera específica para el tipo de proteína, el tipo de célula y el estado del embarazo.
Discusión: Al principio del embarazo se moduló la expresión de la familia NLR en el endometrio ovino, lo que puede ser esencial para las interacciones conceptus-endometrio y la homeostasis inmunitaria de la interfaz materno-fetal.
1 Introducción
Durante el embarazo, la placenta interactúa con el sistema inmunitario materno, que no evoca las robustas respuestas inmunitarias celulares y humorales de la madre (1). El conceptus evolutivo del desarrollo expresa antígenos paternos, que se cruzan con el sistema inmunitario materno, y crea una homeostasis inmunitaria de la interfaz materno-fetal. Los endometrios son modulados por los sistemas endocrino e inmunológico materno para preparar la implantación y el mantenimiento del embarazo (2). El reconocimiento del embarazo involucra hormonas específicas, como la gonadotropina coriónica en primates, la prolactina en roedores y el interferón tau (IFNT) en rumiantes, por lo que el mecanismo para señalar el reconocimiento del embarazo es muy variable entre las especies de mamíferos (3). IFNT regula la expresión del factor regulador del interferón 2 y la diana mecanicista de la rapamicina en la endometria para asegurar la proliferación, migración y expresión génica en las células del trofoectodermo (4).
El IFNT estimula la expresión de genes estimulados por interferón (ISG) en los tejidos endometriales, así como en los tejidos u órganos extrauterinos, incluidas las células sanguíneas, el tejido lúteo y los órganos inmunitarios [como la médula ósea (5), el timo (6), el bazo (7) y los ganglios linfáticos (8)] durante el embarazo, lo que modula el entorno uterino y las respuestas inmunitarias maternas durante la implantación normal (9). El conceptus evita la detección inmune materna al modular la interacción inmune entre el feto y la madre en la interfase de la placenta y el endometrio, lo que se relaciona con altas concentraciones de progesterona circulante (P4) y la señal de concepción (IFNT) en rumiantes domésticos (10).
Los dominios de oligomerización de unión a nucleótidos 1 (NOD1) y NOD2 están presentes en el endometrio humano, que desempeñan un papel en la protección inmunitaria innata en el útero (11). La familia de receptores similares a NOD (NLR) incluye principalmente el transactivador del complejo de histocompatibilidad (MHC) de clase II (CIITA), la proteína inhibidora de la apoptosis neuronal (NAIP), NOD1, NOD2, dominio de oligomerización de unión a nucleótidos, repetición rica en leucina y dominio que contiene pirina (NLRP) (12). La señalización de NOD1 y NOD2 modula las enfermedades metabólicas, autoinmunes e inflamatorias, lo que está mediado por la señalización del factor nuclear-κB (NF-κB), la señalización de la proteína quinasa asociada al mitógeno interferón y la activación del inflamasoma (13). Nuestros estudios previos han reportado que el embarazo temprano reguló la expresión de la familia NLR en el bazo, el hígado, el timo y los ganglios linfáticos de las ovejas de una manera específica para cada tejido, que estaban involucrados en la modulación de las respuestas inmunes maternas (14-17). Se planteó la hipótesis de que la expresión de la familia NLR en el endometrio ovino se modificó al inicio del embarazo a través de IFNT y P4, que puede estar implicado en la regulación de las respuestas inmunitarias endometriales maternas y contribuir al establecimiento del embarazo. Este estudio tuvo como objetivo analizar la expresión de NOD1, NOD2, CIITA, NAIP, NLRP1, NLRP3 y NLRP7 en el endometrio de ovejas durante la preñez temprana, lo que será beneficioso para explorar la homeostasis inmune de la interfaz materno-fetal durante la gestación temprana.
2 Materiales y métodos
2.1 Animales y diseño experimental
Para este estudio se seleccionaron ovejas chinas de cola pequeña Han con ciclos estrales normales y aproximadamente de la misma edad (18 meses). Veinticuatro ovejas fueron divididas aleatoriamente en cuatro grupos (n = 6 para cada grupo). Las ovejas se emparejaron con carneros vasectomizados para determinar el día del celo (día 0) y corrieron con carneros intactos (lo que resultó en ovejas preñadas) o no (lo que resultó en ovejas no preñadas). Todas las ovejas fueron sacrificadas en los días 13, 16 y 25 después de la cría o el día 16 del ciclo estral para tomar muestras de tejidos endometriales después de que el conceptus había sido desconectado, y la preñez se confirmó mediante la observación de un conceptus en el útero junto con un cuerpo lúteo en los ovarios. Los niveles de progesterona en el plasma fueron significativamente más altos en los días 12-13 y más bajos en los días 15-16 durante el ciclo estral ovino (18). Entre los días 14 y 21 se detectaron IFNT y proteínas adicionales secretadas por los trofoblastos de blastocistos en el útero (19). Por lo tanto, se obtuvieron muestras de endometría de las ovejas en los días 13, 16 y 25 después de la cría o el día 16 del ciclo estral. Piezas de sección endometrial (0,5 cm3) se fijaron en paraformaldehído fresco al 4% (p/v) en solución salina tamponada con fosfato (pH 7,4) para su posterior análisis inmunohistoquímico, y las porciones restantes se congelaron en nitrógeno líquido y se almacenaron a -80 °C para los siguientes análisis de ARNm y proteínas.
2.2 Extracción de ARN y ensayo RT-qPCR
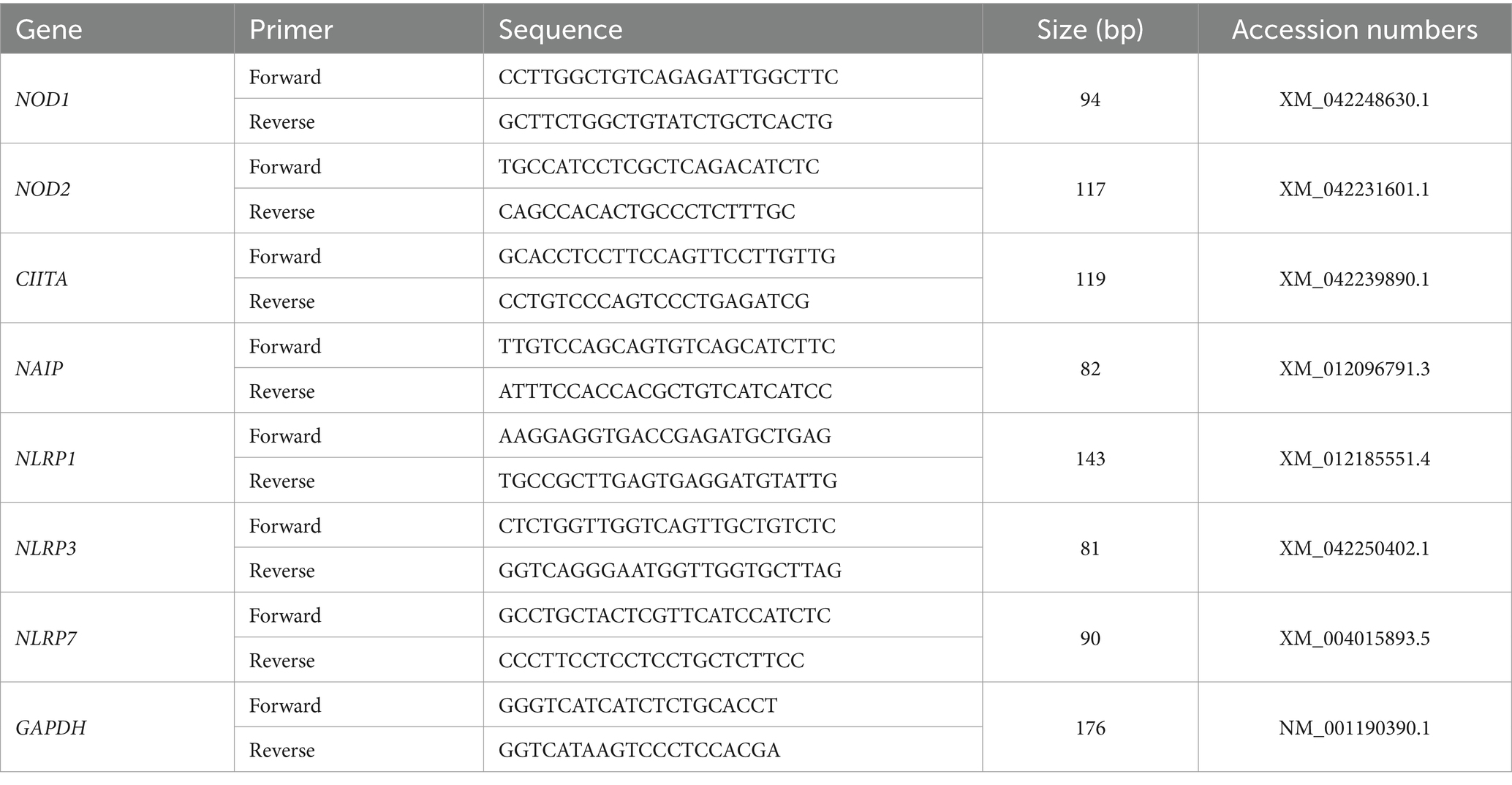
El ARN total se extrajo de las muestras endometriales utilizando el reactivo TRIzol (Tiangen Biotech Co., Ltd., Beijing), y se utilizó un kit FastQuant RT con DNasa (Tiangen Biotech) para transcribir inversamente una cantidad igual de ARN a ADNc de cada muestra. Se utilizó un control que contenía todos los componentes de la reacción, excepto la transcriptasa inversa, para comprobar la presencia de ADN contaminante. Sangon Biotech Co., Ltd. (Shanghái, China) diseñó y sintetizó secuencias de cebadores de genes de la familia NLR y GAPDH (Tabla 1), y se realizó una PCR en tiempo real utilizando un kit SuperReal PreMix Plus (Tiangen Biotech) en un sistema de PCR en tiempo real Bio-Rad CFX96 (Bio-Rad Laboratories, Inc., CA, Estados Unidos) utilizando solo H2O como sin control de plantilla. Las condiciones de amplificación de los genes fueron las siguientes: desnaturalización a 95 °C durante 10 min, 40 ciclos de desnaturalización (95 °C durante 10 s), recocido (59 °C a 62 °C durante 20 s) y extensión (72 °C durante 25 s), seguida de una extensión final (72 °C durante 7 min). Las temperaturas de recocido fueron de 60,5 °C para NOD1 y CIITA, o 62 °C para NOD2, 59,5 °C para NAIP, 60 °C para NLRP1, 59 °C para NLRP3 y 61 °C para NLRP7. Las eficiencias de amplificación de las secuencias de cebadores se evaluaron antes de la cuantificación y se situaron en un rango aceptable (entre 0,9 y 1,0). Los valores medios del ciclo umbral (Ct) para los genes diana y los valores de Ct para el gen de referencia (GAPDH) de cada muestra se calcularon a partir de pocillos triplicados, y la cuantificación de los niveles relativos de ARNm se llevó a cabo mediante la comparativa 2−ΔΔCt método (20). Los valores medios de TC de las muestras en el día 16 del ciclo estral se utilizaron como puntos de referencia para determinar los niveles relativos de los transcritos de ARNm.
2.3 Análisis de Western blot
Se utilizó tampón de lisis RIPA que contenía fluoruro de fenilmetanosulfonilo para preparar las proteínas totales de las muestras endometriales en hielo, y se utilizó el método de Bradford para detectar la concentración de proteínas. Se utilizó SDS-PAGE (5% de apilamiento y 12% de geles de separación) para separar las proteínas totales (10 μg por pocillo), y las proteínas separadas se electrotransfirieron a la superficie de membranas de fluoruro de polivinilideno activadas con metanol (Millipore, Bedford, MA, Estados Unidos). Las membranas se bloquearon con leche desnatada al 5% y luego se expusieron a anticuerpos primarios en una dilución de 1:1.000 a 4 °C durante la noche. Los anticuerpos primarios incluyen un anticuerpo monoclonal anti-NOD1 de ratón (Santa Cruz Biotechnology, Santa Cruz, CA, Estados Unidos, sc-398696), un anticuerpo monoclonal anti-NOD2 de ratón (Santa Cruz Biotechnology, sc-56168), un anticuerpo monoclonal anti-CIITA de ratón (Santa Cruz Biotechnology, sc-13556), un anticuerpo policlonal anti-NAIP de conejo (Abcam, Cambridge, Reino Unido, ab25968), un anticuerpo monoclonal anti-NLRP1 de ratón (Santa Cruz Biotechnology, sc-390133), un anticuerpo monoclonal anti-NLRP3 de ratón (Santa Cruz Biotechnology, sc-390133), un anticuerpo monoclonal anti-NLRP3 de ratón (Santa Cruz Biotechnology, Cambridge, Reino Unido, ab25968). Cruz Biotechnology, sc-134306) y un anticuerpo monoclonal anti-NLRP7 de ratón (Santa Cruz Biotechnology, sc-377190). Los anticuerpos primarios fueron validados y considerados como especies de reacción cruzada por la unión específica a proteínas nativas ovinas altamente expresadas en el timo y los ganglios linfáticos. No se observó ningún marcaje con anticuerpos de control emparejados con isotipos (21, 22) y fue adecuado para ovejas. Se utilizaron anticuerpos secundarios conjugados con peroxidasa de rábano picante (HRP) (1:2.000 para IgG-HRP anti-ratón, BL001A, o IgG-HRP anti-conejo, BL003A) para detectar las proteínas diana. Se utilizó un reactivo de detección de quimioluminiscencia HRP pro-light (Tiangen Biotech) para detectar señales proteicas, y las bandas inmunoespecíficas se cuantificaron utilizando Quantity One V452 (Bio-Rad Laboratories, Hercules, CA, Estados Unidos). Por su parte, la proteína de limpieza (GAPDH) se detectó utilizando un anticuerpo anti-GAPDH (Santa Cruz Biotechnology, Inc., sc-20357, 1:1.000) para normalizar los niveles de expresión de las proteínas diana.
2.4 Análisis inmunohistoquímico
La inmunotinción para el tejido endometrial se realizó de acuerdo con los protocolos estándar, que incluyen la desparafinación, la rehidratación, la recuperación de epítopos, la inhibición de la actividad de la peroxidasa endógena y el bloqueo de sitios de unión no específicos (16). Algunas secciones estaban teñidas con hematoxilina y eosina. El anticuerpo monoclonal anti-NOD2 de ratón (Santa Cruz Biotechnology, sc-56168) o el anticuerpo monoclonal anti-CIITA de ratón (Santa Cruz Biotechnology, sc-13556) se diluyeron en una proporción de 1:200. Para los controles negativos, los anticuerpos primarios fueron reemplazados por isotipos específicos de antisuero a la misma concentración de proteína. Se utilizó un anticuerpo secundario conjugado con HRP apropiado (1:500 para IgG-HRP anti-ratón, BL001A) y los núcleos se tiñeron con hematoxilina. Las señales de inmunotinción se detectaron utilizando un kit DAB (Tiangen Biotech) y se obtuvieron imágenes con un microscopio óptico (Nikon Eclipse E800, Japón) con una cámara digital (DP12). El análisis de los datos se realizó asignando de forma independiente una puntuación de intensidad inmunorreactiva que osciló entre 0 y 3 a las imágenes por parte de cuatro observadores, como se describió anteriormente (23).
2.5 Análisis estadístico
Los datos para los niveles de expresión relativa de los NLRs se analizaron como un diseño completamente aleatorizado con seis animales por grupo utilizando los modelos Proc Mixed de SAS (Versión 9.1; Instituto SAS, Cary, Carolina del Norte). Para la endometría de diferentes etapas de gestación o estado de gestación, el modelo incluyó efectos aleatorios para cada oveja y efectos fijos para la etapa de gestación, el estado de gestación y la interacción entre la etapa de gestación y el estado de gestación. Los niveles de expresión relativa de los diferentes grupos se compararon utilizando el método de Duncan, con el tipo de error ± experimental controlado a 0,05. Los datos se presentan como medias de mínimos cuadrados. Para el análisis de los datos inmunohistoquímicos se utilizó la prueba de Kruskal-Wallis. Se consideró estadísticamente significativo un valor de p de <0,05.
3 Resultados
3.1 Niveles relativos de expresión de NOD1, NOD2, CIITA, NAIP, NLRP1, NLRP3 y NLRP7 mRNA en el endometrio
Se muestra en la Figura 1 que hubo disminuciones en los valores de ARNm de NOD1 y CIITA durante la gestación temprana en comparación con las ovejas no gestantes (p < 0,01), y los valores de NOD1 y CIITA en el día 13 de gestación fueron mayores que los de los días 16 y 25 de gestación (p < 0,01). Además, el embarazo precoz inhibió la expresión de ARNm de NOD2 y NAIP, y los valores de NOD2 y NAIP en el día 25 de embarazo fueron inferiores a los de los días 13 y 16 y de embarazo (p < 0,05). Además, los valores de ARNm de NLRP1 fueron mayores en el día 16 del ciclo estral y el día 13 de embarazo que en los días 16 y 25 de embarazo (p < 0,01). Además, los valores de ARNm de NLRP3 durante la gestación temprana fueron menores en comparación con las ovejas no gestantes (p < 0,01), y el valor de NLRP3 en el día 13 de gestación fue menor que el de los días 16 y 25 y de preñez (p < 0,05). Sin embargo, el valor de expresión del ARNm de NLRP7 fue el más bajo en el día 16 del ciclo estral entre los cuatro grupos, y el valor de NLRP7 en los días 13 y 16 de embarazo fue menor que el del día 25 y del embarazo (p < 0,05).
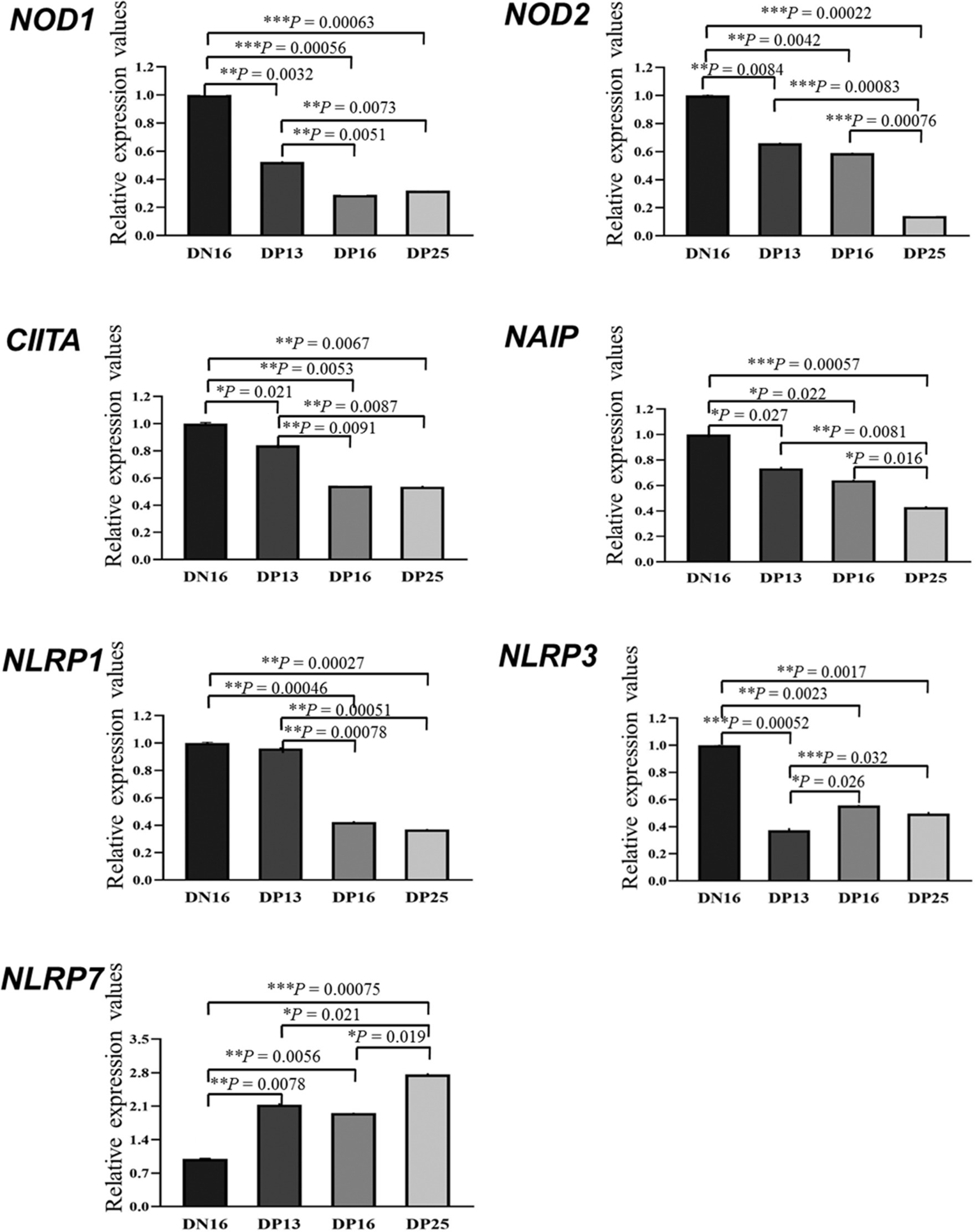 Figura 1. Valores relativos de expresión del ARNm del receptor similar al dominio de unión a nucleótidos (NOD) (NLR) en el endometrio medidos por PCR cuantitativa en tiempo real en ovejas. La familia NLR incluye principalmente NOD1, NOD2, transactivador del complejo de histocompatibilidad (MHC) de clase II (CIITA), proteína inhibidora de la apoptosis neuronal (NAIP), dominio de oligomerización de unión a nucleótidos, repetición rica en leucina y contenedora de dominio de pirina (NLRP). Los niveles relativos de ARNm se calculan utilizando el gen de referencia (GAPDH) y el día 16 de no embarazo como controles de normalización. DN16 = Día 16 de no embarazo; DP13 = Día 13 de embarazo; DP16 = Día 16 de embarazo; DP25 = Día 25 de embarazo. Los valores p entre 0,01 y 0,05 se muestran con un (*) asterisco, los valores p entre 0,001 y 0,01 se muestran con dos (**) asteriscos y los valores p inferiores a 0,001 se designan con tres (***) asteriscos.
Figura 1. Valores relativos de expresión del ARNm del receptor similar al dominio de unión a nucleótidos (NOD) (NLR) en el endometrio medidos por PCR cuantitativa en tiempo real en ovejas. La familia NLR incluye principalmente NOD1, NOD2, transactivador del complejo de histocompatibilidad (MHC) de clase II (CIITA), proteína inhibidora de la apoptosis neuronal (NAIP), dominio de oligomerización de unión a nucleótidos, repetición rica en leucina y contenedora de dominio de pirina (NLRP). Los niveles relativos de ARNm se calculan utilizando el gen de referencia (GAPDH) y el día 16 de no embarazo como controles de normalización. DN16 = Día 16 de no embarazo; DP13 = Día 13 de embarazo; DP16 = Día 16 de embarazo; DP25 = Día 25 de embarazo. Los valores p entre 0,01 y 0,05 se muestran con un (*) asterisco, los valores p entre 0,001 y 0,01 se muestran con dos (**) asteriscos y los valores p inferiores a 0,001 se designan con tres (***) asteriscos.
3.2 Expresión de las proteínas NOD1, NOD2, CIITA, NAIP, NLRP1, NLRP3 y NLRP7 en el endometrio
La Figura 2 muestra que la expresión de las proteínas NOD1 y NLRP3 está suprimida al principio de la gestación en comparación con el día 16 del ciclo estral (p < 0,05), y no hubo diferencia significativa entre las ovejas gestantes en la expresión de las proteínas NOD1 y NLRP3 (p > 0,05). La proteína NOD2 fue regulada a la baja durante el embarazo temprano, y hubo una disminución de la expresión de la proteína NOD2 desde el día 13 hasta el día 25 del embarazo (p < 0,05). Los niveles de expresión de las proteínas CIITA y NLRP1 durante el embarazo temprano fueron menores en comparación con los del día 16 del ciclo estral (p < 0,05), y los niveles de expresión fueron mayores en el día 13 de embarazo que en los días 16 y 25 de embarazo (p < 0,05). Además, los niveles de expresión de la proteína NAIP fueron mayores en el día 16 del ciclo estral que en los días 16 y 25 de embarazo (p < 0,05), y el valor de expresión de NAIP en el día 25 de embarazo fue el más bajo entre los cuatro grupos (p < 0,05). Sin embargo, los niveles de expresión de NLRP7 fueron menores en el día 16 del ciclo estral y el día 16 de embarazo en comparación con los días 13 y 25 de embarazo (p < 0,05) (Figura 2).
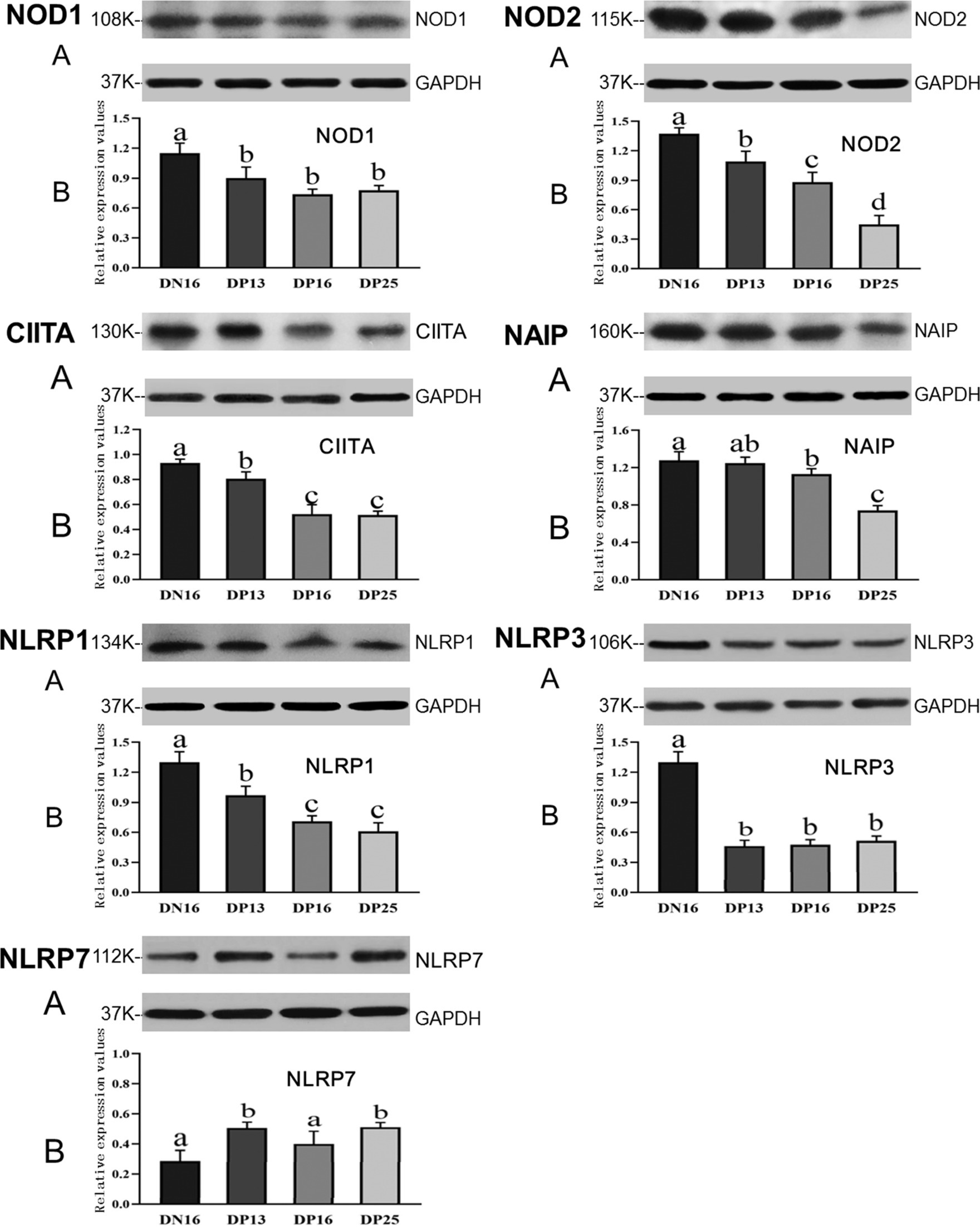 Figura 2. Expresión de las proteínas NOD1, NOD2, CIITA, NAIP, NLRP1, NLRP3 y NLRP7 en el endometrio analizado por Western blot en ovejas. A: Representación de la mancha occidental; B: Datos de la Western blot; DN16 = Día 16 de no embarazo; DP13 = Día 13 de embarazo; DP16 = Día 16 de embarazo; DP25 = Día 25 de embarazo. Las diferencias significativas (p < 0,05) se indican con letras diferentes.
Figura 2. Expresión de las proteínas NOD1, NOD2, CIITA, NAIP, NLRP1, NLRP3 y NLRP7 en el endometrio analizado por Western blot en ovejas. A: Representación de la mancha occidental; B: Datos de la Western blot; DN16 = Día 16 de no embarazo; DP13 = Día 13 de embarazo; DP16 = Día 16 de embarazo; DP25 = Día 25 de embarazo. Las diferencias significativas (p < 0,05) se indican con letras diferentes.
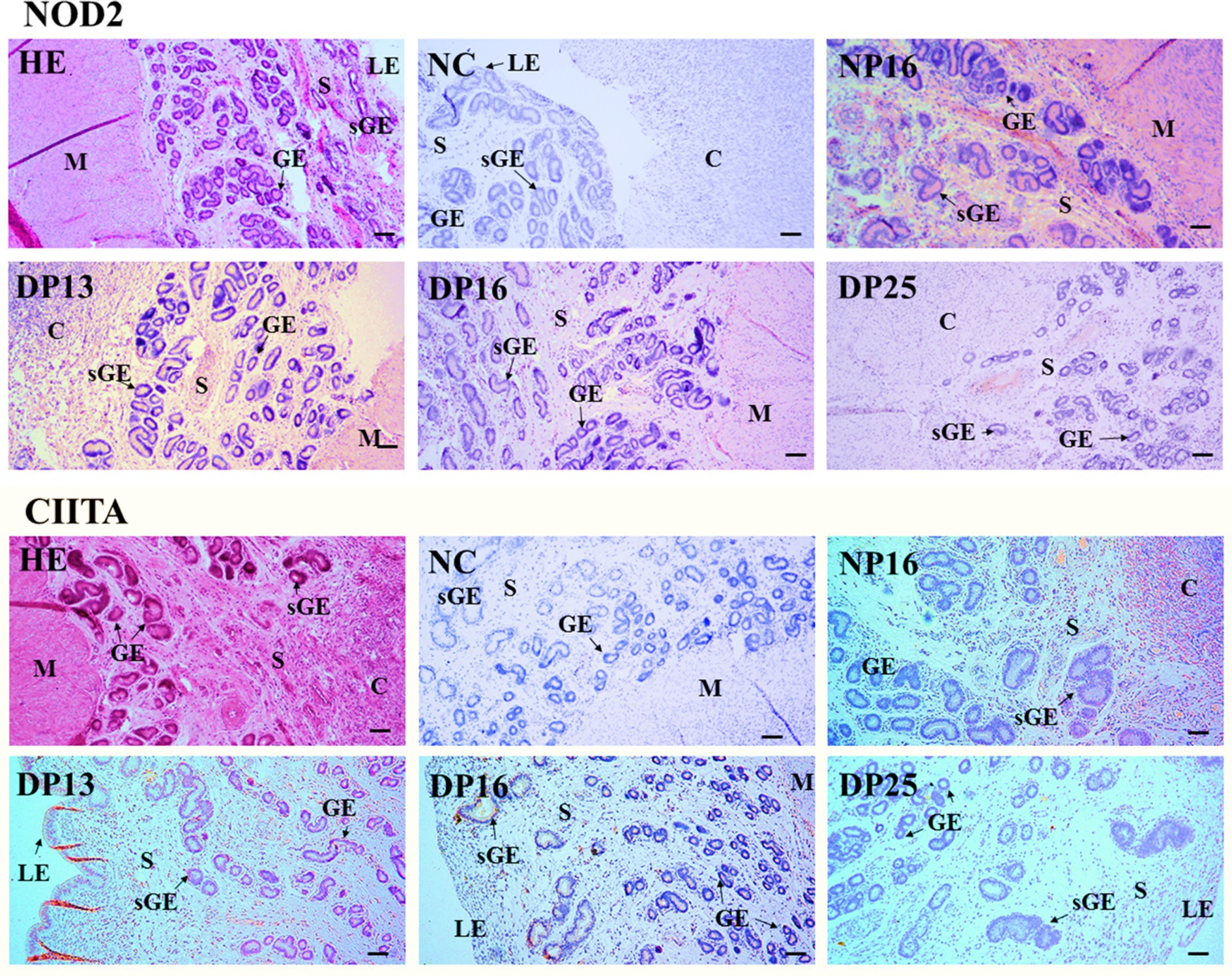
3.3 Inmunohistoquímica de las proteínas NOD2 y CIITA en el endometrio
La proteína NOD2 se encontró principalmente en el estroma, la carúncula y el miometrio, pero la proteína CIITA se limitó en gran medida al epitelio luminal, el epitelio glandular superficial, la carúncula y el estroma (Figura 3). Las intensidades de tinción para la proteína NOD2 fueron 0, 3, 2, 1 y 1, para el control negativo, la endometría a partir del día 16 del ciclo estral y la endometria a partir de los días 13, 16 y 25 de gestación, respectivamente. Del mismo modo, las intensidades de tinción para la proteína CIITA fueron 0, 2, 3, 2 y 1, siguiendo el mismo orden (Figura 3). La escala para la intensidad de la tinción es la siguiente: 0 = negativa; 1 = débil; 2 = fuerte; 3 = más fuerte.
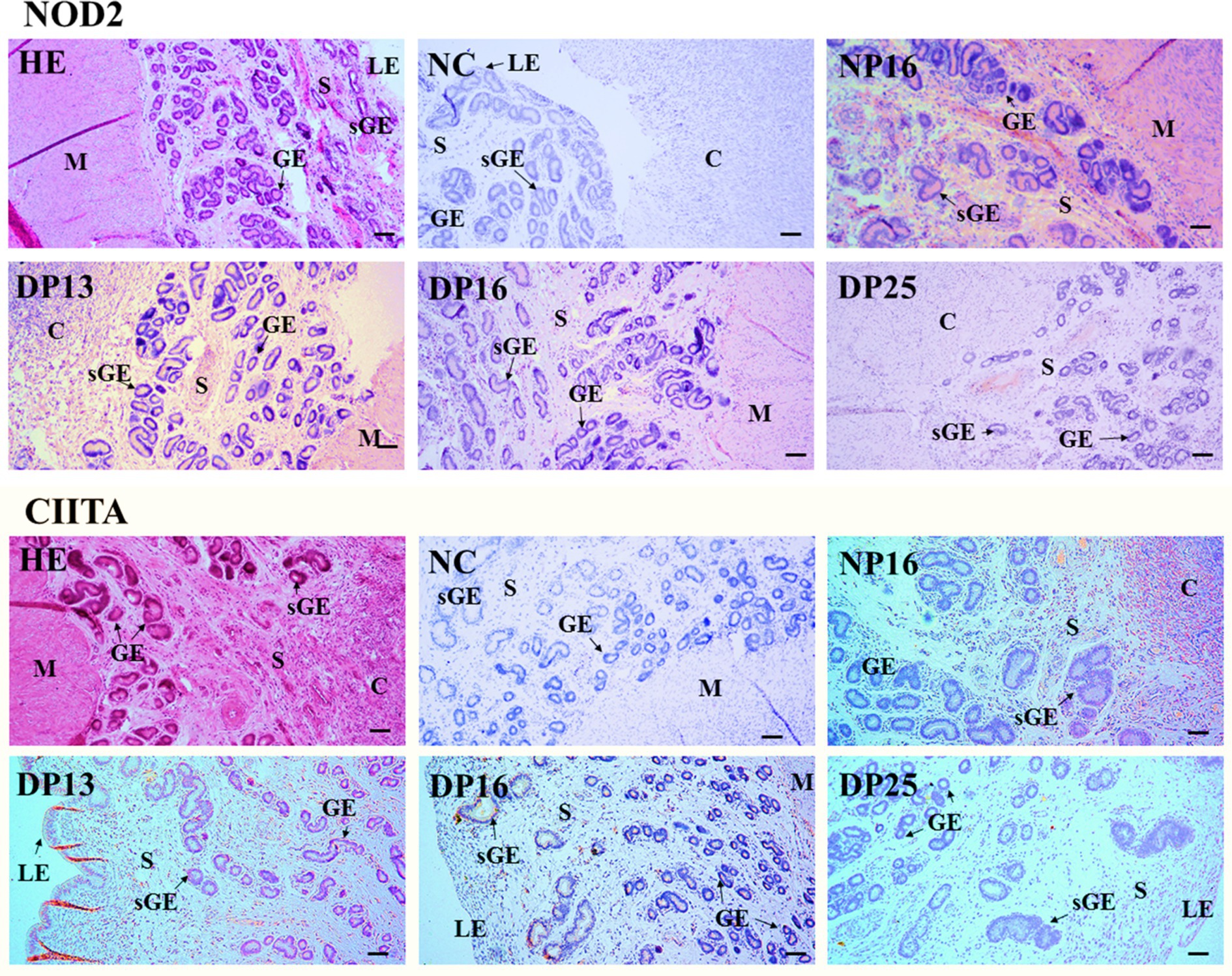 Figura 3. Localización inmunohistoquímica de las proteínas NOD2 y CIITA en el endometrio. La proteína NOD2 se localizó principalmente en el estroma (S), la carúncula (C) y el miometrio (M), pero la proteína CIITA se limitó principalmente al epitelio luminal (LE), el epitelio glandular superficial (sGE), la carúncula (C) y el estroma (S). Las intensidades de tinción para la proteína NOD2 fueron más fuertes, fuertes, débiles y débiles, mientras que las de la proteína CIITA fueron fuertes, más fuertes, fuertes y débiles para la endometria a partir del día 16 del ciclo estral, y la endometria a partir de los días 13, 16 y 25 de embarazo, respectivamente. HE, teñido por hematoxilina y eosina; NC: control negativo; GE: epitelio glandular; DN16, Día 16 de no embarazo; DP13, Día 13 de embarazo; DP16, Día 16 de embarazo; DP25, Día 25 de embarazo. Barra = 100 μm.
Figura 3. Localización inmunohistoquímica de las proteínas NOD2 y CIITA en el endometrio. La proteína NOD2 se localizó principalmente en el estroma (S), la carúncula (C) y el miometrio (M), pero la proteína CIITA se limitó principalmente al epitelio luminal (LE), el epitelio glandular superficial (sGE), la carúncula (C) y el estroma (S). Las intensidades de tinción para la proteína NOD2 fueron más fuertes, fuertes, débiles y débiles, mientras que las de la proteína CIITA fueron fuertes, más fuertes, fuertes y débiles para la endometria a partir del día 16 del ciclo estral, y la endometria a partir de los días 13, 16 y 25 de embarazo, respectivamente. HE, teñido por hematoxilina y eosina; NC: control negativo; GE: epitelio glandular; DN16, Día 16 de no embarazo; DP13, Día 13 de embarazo; DP16, Día 16 de embarazo; DP25, Día 25 de embarazo. Barra = 100 μm.
4 Discusión
NOD1 desempeña un papel clave en la regulación tanto de la inmunidad innata como de la inmunidad adaptativa mediante el reconocimiento y la unión de patrones moleculares endógenos asociados al daño, lo que conduce a la activación de NF-κB y las vías de señalización de la proteína quinasa activada por mitógenos (24). Los tejidos placentarios y los trofoblastos expresan NOD1, pero los agonistas de NOD1 estimulan un perfil de citoquinas proinflamatorias, lo que desencadena el parto prematuro en ratones (25). Existe una regulación positiva significativa de NOD1 y citoquinas inflamatorias en el endometrio ectópico, lo que sugiere que NOD1 está asociada con la endometriosis (18). La transcripción de NOD1 en el endometrio disminuye desde el primer hasta el tercer trimestre de la gestación en las vacas (19). Se ha reportado que las concentraciones de P4 en plasma son mayores durante el embarazo temprano que en el día 16 del ciclo estral ovino (26). En este estudio, los niveles de ARNm y proteínas de NOD1 se regularon a la baja en el endometrio durante el embarazo temprano, lo que puede atenuar las respuestas inflamatorias uterinas y ser moduladas por IFNT a partir del conceptus y P4.
NOD2 puede mantener la homeostasis inmune mediante la activación del programa transcripcional proinflamatorio, la autofagia y el estrés del retículo endoplásmico; sin embargo, un nivel alto de NOD2 se relaciona con varias enfermedades inflamatorias (27). NOD2 mejora la expresión de mediadores prolaborales en las membranas fetales humanas y el miometrio mediante la regulación de la activación y transcripción de NF-κB (28). El nivel de expresión del ARNm de NOD2 fue mayor en las membranas corioamnióticas de las mujeres con trabajo de parto prematuro espontáneo y corioamnionitis histológica aguda en comparación con aquellas sin corioamnionitis histológica aguda (29). Nuestros resultados mostraron que los niveles de ARNm y proteína NOD2 disminuyeron en el epitelio endometrial durante el embarazo temprano, y la proteína NOD2 se localizó principalmente en el estroma, la carúncula y el miometrio. Por lo tanto, la regulación a la baja de NOD2 puede ser útil para la implantación embrionaria y estar relacionada con las señales tempranas del embarazo y los altos niveles de P4.
CIITA es un transactivador maestro de los genes MHC de clase II, y las proteínas MHC de clase II desempeñan un papel esencial en las respuestas inmunitarias (30). Existe una supresión de la expresión de la molécula MHC clase II en trofoblastos fetales, que se asocia con una inhibición específica del gen CIITA (31). CIITA reduce la expresión de citocinas de tipo 2 auxiliar (Th2), pero no tiene efectos sobre la diferenciación de Th1 (32). Existe un patrón de citoquinas Th2 dominante durante el embarazo humano normal, que está mediado por P4 (33). La placentación ovina tiene un requerimiento limitado de inmunorregulación local en comparación con la placentación de primates y roedores (34); sin embargo, los patrones de células T helper/Treg en la placenta tienen efectos en los resultados del embarazo ovino (35). Se ha reportado que las respuestas inmunes periféricas específicas del antígeno no se alteran durante la preñez normal en ovejas. Sin embargo, se necesitan más estudios sobre las interacciones materno-fetales y la regulación inmunitaria durante el embarazo (36). En este estudio, el nivel de expresión de CIITA en el endometrio fue menor durante el embarazo temprano en comparación con el no embarazo, y la proteína CIITA se limitó principalmente al epitelio luminal, epitelio glandular superficial, carúncula y estroma. Por lo tanto, la regulación a la baja de CIITA puede estar asociada con un alto nivel de P4 y ser beneficioso para el establecimiento del embarazo.
Las proteínas NAIP son esenciales para el sentido inmune innato, y el factor regulador del interferón 8 modula su expresión génica (37). La expresión de la proteína NAIP es mayor en las placentas del primer trimestre que en el término placentas, y la proteína NAIP se limita al citoplasma de las células vellosas citotrofoblásticas, sincitiotrofoblastos, células mesenquimales vellosas y células endoteliales vellosas en humanos (38). Además, la inflamación endometrial inducida altera la composición histotrófica y reduce el crecimiento del embrión, lo que aumenta la pérdida de preñez en las vacas (39). La alteración de la expresión génica inmune endometrial tiene efectos perjudiciales en la supervivencia del embrión en el día 7 después del celo en novillas de carne (40). En esta investigación se encontró que el nivel de expresión del ARNm y la proteína NAIP disminuyó gradualmente durante el embarazo. Por lo tanto, la regulación a la baja de la NAIP puede atenuar el sentido inmunitario innato para disminuir las respuestas inmunitarias y ser necesaria para lograr la tolerancia inmunitaria endometrial y el establecimiento del embarazo.
El inflamasoma NLRP1 convierte la pro-caspasa-1 en caspasa-1 por autoescisión después de la estimulación, lo que resulta en la secreción de citoquinas proinflamatorias innatas, incluidas IL-1β e IL-18, para contribuir a la inmunidad innata (41). La preeclampsia es la principal causa de alta morbilidad y mortalidad materna y fetal en humanos, y existe una mayor activación endógena de los inflamasomas NLRP1/NLRP3 y la expresión proteica de IL-1β, IL-18 y factor de necrosis tumoral α en los monocitos de sangre periférica de las embarazadas preeclámpticas en comparación con los controles normales (42). El estrés oxidativo disminuye los niveles de expresión de glutatión y glutatión peroxidasa 4 y aumenta la expresión del inflamasoma NLRP1 tanto en el modelo de rata como en el modelo de células del trofoblasto placentario, lo que está implicado en complicaciones graves del embarazo (43). Nuestros datos mostraron que el embarazo temprano inhibió la expresión del ARNm y la proteína NLRP1 en el endometrio. Por lo tanto, la regulación a la baja de NLRP1 puede modular las respuestas inmunitarias innatas uterinas y ser necesaria para un embarazo exitoso.
La inflamación provocada por el estrés da lugar a una disfunción de los orgánulos, que es activada por el complejo NLRP3-inflamasoma (44). Existe un alto nivel de expresión de NLRP3 en las células de la granulosa de pacientes con insuficiencia ovárica, y el inflamasoma NLRP3 tiene efectos negativos sobre la fertilidad femenina (45). La activación del inflamasoma NLRP3 altera el microambiente inflamatorio en el útero, lo que conduce a una inflamación excesiva en la interfaz materno-fetal en la preeclampsia de rata (46). El inflamasoma NLRP3 se activa en los tejidos del miometrio y en el amnios y el corion deciduas, que se asocian con el inicio del trabajo de parto a término y prematuro en humanos y ratones (47). Nuestros resultados revelaron que el nivel de expresión de NLRP3 se reguló a la baja durante el embarazo temprano. Por lo tanto, la regulación a la baja de NLRP3 puede estar involucrada en el establecimiento del embarazo y está regulada por IFNT y P4 en ovejas.
Como sensor del inflamasoma, NLRP7 tiene efectos sobre la remodelación endometrial y el desarrollo de la placenta, que juegan un papel clave durante el embarazo temprano (48). La expresión de NLRP7 es abundante en macrófagos deciduales durante el primer trimestre del embarazo. Estos macrófagos están involucrados en la decidualización y diferenciación de macrófagos para mantener la hemostasia endometrial y el éxito reproductivo en humanos (49). NLRP7 desempeña un papel clave en la adquisición de tolerancia inmunitaria en las células trofoblásticas mediante la regulación de factores clave asociados a la tolerancia inmunitaria, la mejora de la proliferación del trofoblasto y la disminución de su diferenciación durante el embarazo normal (50). En este estudio, el ARNm y la proteína NLRP7 aumentaron durante el embarazo temprano. Por lo tanto, la regulación positiva de NLRP7 durante el embarazo temprano puede contribuir a la remodelación endometrial y a la implantación embrionaria y ser modulada por la señal del embarazo temprano y P4.
Se sugiere que durante la preñez temprana en las ovejas, la señal de preñez temprana (IFNT) del conceptus, así como P4 y estradiol (E2) del ovario, ejerce efectos sobre el endometrio, que modulan la expresión de NLRs. Hay una regulación positiva de la expresión de NLRP7, pero la expresión de CIITA, NAIP, NOD1, NOD2, NLRP1 y NLRP3 está regulada a la baja durante el embarazo temprano. Así, durante el embarazo temprano, la señal de embarazo (IFNT), junto con un alto nivel de P4 y una baja concentración de E2, cambian la expresión de NLRs en el endometrio, lo que modula las respuestas inmunitarias endometriales y contribuye al establecimiento del embarazo (Figura 4).
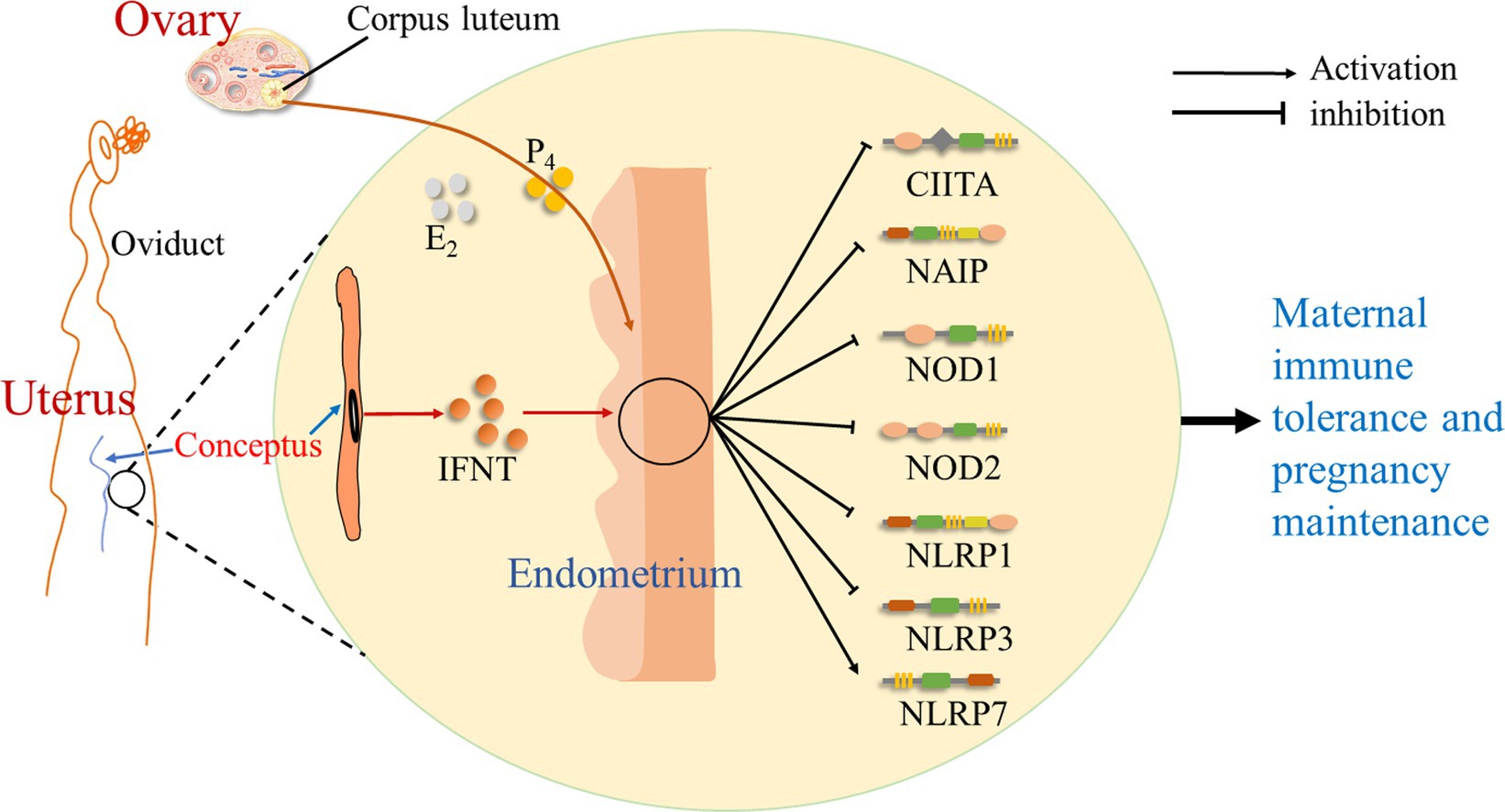 Figura 4. Bosquejo de los receptores tipo NOD en el endometrio durante la preñez temprana en ovejas. Se sugiere en este estudio que la señal de embarazo precoz (IFNT) del conceptus, así como la progesterona (P4) y estradiol (E2) del ovario, ejerce efectos sobre el endometrio, que cambian la expresión de receptores similares a NOD, incluidos CIITA, NAIP, NOD1, NOD2, NLRP1, NLRP3 y NLRP7, y modula las respuestas inmunitarias endometriales para contribuir a la tolerancia inmunitaria materna y al establecimiento del embarazo.
Figura 4. Bosquejo de los receptores tipo NOD en el endometrio durante la preñez temprana en ovejas. Se sugiere en este estudio que la señal de embarazo precoz (IFNT) del conceptus, así como la progesterona (P4) y estradiol (E2) del ovario, ejerce efectos sobre el endometrio, que cambian la expresión de receptores similares a NOD, incluidos CIITA, NAIP, NOD1, NOD2, NLRP1, NLRP3 y NLRP7, y modula las respuestas inmunitarias endometriales para contribuir a la tolerancia inmunitaria materna y al establecimiento del embarazo.
5 Conclusión
El embarazo temprano inhibió la expresión de NOD1, NOD2, NAIP, CIITA, NLRP1 y NLRP3 en el endometrio, pero el nivel de expresión de NLRP7 aumentó durante el embarazo temprano. Además, las proteínas NOD2 y CIITA se localizaron en el endometrio de una manera específica para el tipo de proteína, el tipo de célula y el estado del embarazo. Por lo tanto, el embarazo temprano cambió la expresión de la familia NLR en el endometrio ovino, que puede estar involucrado en la regulación de la tolerancia inmune endometrial y está regulado por IFNT y P4 en ovejas.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité de Cuidado y Uso de Animales de la Universidad de Ingeniería de Hebei (número de solicitud 2019-017). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
LZ: Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición. JC: Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición. XW: Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición. ZY: Validación, Redacción – borrador original, Redacción – revisión y edición. HD: Análisis formal, Redacción – borrador original, Escritura – revisión y edición. LY: Conceptualización, Administración de proyectos, Supervisión, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo de la Fundación de Ciencias Naturales de la Provincia de Hebei, China (C2022402038) y la Agencia de Ciencia y Tecnología de Hebei, China (22326602D).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Rizzuto, G, Brooks, JF, Tuomivaara, ST, McIntyre, TI, Ma, S, Rideaux, D, et al. Establecimiento de tolerancia fetomaterna a través de la supresión de células B mediada por glicanos. Naturaleza. (2022) 603:497–502. doi: 10.1038/s41586-022-04471-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Critchley, HOD, Maybin, JA, Armstrong, GM, y Williams, ARW. Fisiología del endometrio y regulación de la menstruación. Physiol Rev. (2020) 100:1149–79. doi: 10.1152/physrev.00031.2019
3. Bazer, delantero . Antecedentes de reconocimiento materno del embarazo. Adv Anat Embryol Cell Biol. (2015) 216:5–25. doi: 10.1007/978-3-319-15856-3_2
4. Bazer, FW, Burghardt, RC, Johnson, GA, Spencer, TE, y Wu, G. Mecanismos para el establecimiento y mantenimiento del embarazo: sinergias a partir de colaboraciones científicas. Biol Reprod. (2018) 99:225–41. doi: 10.1093/biolre/ioy047
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Yang, L, Liu, B, Yan, X, Zhang, L, Gao, F y Liu, Z. Expresión de ISG15 en la médula ósea durante la gestación temprana en ovejas. Veterinario de la Universidad de Kafkas Fak Derg. (2017) 23:767–72. doi: 10.9775/kvfd.2017.17726
6. Zhang, L, Xue, J, Wang, Q, Lv, W, Mi, H, Liu, Y, et al. Cambios en la expresión de ISG15, receptor de progesterona y factor de bloqueo inducido por progesterona en timo ovino durante el embarazo temprano. Teriogenología. (2018) 121:153–9. doi: 10.1016/j.theriogenology.2018.08.018
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Yang, L, Liu, Y, Lv, W, Wang, P, Wang, B, Xue, J, et al. Expresión de la proteína 15-kDa del gen estimulado por interferón, la ciclooxigenasa (COX) 1, la COX-2, la familia 1 de la aldo-ceto reductasa, el miembro B1 y la prostaglandina E sintasa en el bazo durante la gestación temprana en ovejas. Anim Sci J. (2018) 89:1540–8. doi: 10.1111/asj.13101
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Yang, L, Wang, Q, Liu, Y, Zhang, L, Lv, W y Liu, B. Perfiles de expresión del gen 15 estimulado por interferón y prostaglandinas sintasas en los ganglios linfáticos ovinos durante el embarazo temprano. Mol Reprod Dev. (2019) 86:100–8. doi: 10.1002/mrd.23085
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Bai, H, Kawahara, M, Takahashi, M, e Imakawa, K. Progreso reciente de la investigación sobre el interferón-tau y la posible dirección más allá del reconocimiento del embarazo. J Reprod Dev. (2022) 68:299–306. doi: 10.1262/jrd.2022-061
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Ott, TL . Detección inmunológica del embarazo: evidencia de modulación inmune sistémica durante el embarazo temprano en rumiantes. Teriogenología. (2020) 150:498–503. doi: 10.1016/j.theriogenology.2020.04.010
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. King, AE, Horne, AW, Hombach-Klonisch, S, Mason, JI y Critchley, HO. Expresión diferencial y regulación de las proteínas de dominio de oligomerización nuclear NOD1 y NOD2 en el endometrio humano: un papel potencial en la protección inmunitaria innata y la menstruación. Mol Hum Reprod. (2009) 15:311–9. doi: 10.1093/molehr/gap020
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Wicherska-Pawłowska, K, Wróbel, T y Rybka, J. Receptores tipo Toll (TLR), receptores similares a NOD (NLR) y receptores similares a RIG-I (RRL) en la inmunidad innata. Ligandos TLRs, NLRs y RLRs como agentes inmunoterapéuticos para enfermedades hematopoyéticas. Int J Mol Sci. (2021) 22:13397. doi: 10.3390/ijms222413397
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Almeida-da-Silva, CLC, Savio, LEB, Coutinho-Silva, R, y Ojcius, DM. El papel de los receptores similares a NOD en la inmunidad innata. Frente Immunol. (2023) 14:1122586. doi: 10.3389/fimmu.2023.1122586
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Wu, J, Fang, S, Feng, P, Cai, C, Zhang, L y Yang, L. Cambios en los niveles de expresión de los receptores en forma de asentimiento en el bazo de las ovejas. Anim Reprod. (2023) 20:e20220093. doi: 10.1590/1984-3143-AR2022-0093
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Zhang, L, Ren, Y, Li, Y, Meng, Y, Fang, H y Yang, L. Regulación de la expresión del receptor en forma de nodo en el hígado de las ovejas durante la gestación temprana. J Anim Feed Sci. (2023) 32:267–79. doi: 10.22358/jafs/161622/2023
16. Zhang, L, Li, Y, Zhao, Z, Cai, J, Zhao, S y Yang, L. Modulación de la expresión del receptor tipo nod en el timo durante la preñez temprana en ovejas. Vacuna. (2022) 10:2128. doi: 10.3390/vacunas10122128
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Zhao, Z, Li, Y, Cao, J, Fang, H, Zhang, L, y Yang, L. La gestación temprana modula la expresión de la familia de receptores en forma de nodo en los ganglios linfáticos de las ovejas. Animales. (2022) 12:3285. doi: 10.3390/ani12233285
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Wei, X, Liu, Y, Li, W y Shao, X. La proteína 1 que contiene el dominio de oligomerización de unión a nucleótidos regula la respuesta inflamatoria en la endometriosis. Curr Protein Pept Sci. (2022) 23:121–8. doi: 10.2174/1389203723666220322125031
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Silva, AP, Costa, EA, Macêdo, AA, Martins Tda, M, Borges, AM, Paixão, TA, et al. La transcripción de receptores de reconocimiento de patrones y agentes abortivos indujo quimiocinas en el útero preñado bovino. Veterinario Inmunol Inmunopatíaco. (2012) 145:248–56. doi: 10.1016/j.vetimm.2011.11.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Livak, KJ, y Schmittgen, TD. Análisis de datos relativos de expresión génica mediante PCR cuantitativa en tiempo real y el método 2(-Delta Delta C(T)). Métodos. (2001) 25:402–8. doi: 10.1006/meth.2001.1262
21. McNatty, KP, Revefeim, KJ y Young, A. Concentraciones plasmáticas periféricas de progesterona en ovejas durante el ciclo estral. J Endocrinol. (1973) 58:219–25. doi: 10.1677/joe.0.0580219
22. Godkin, JD, Bazer, FW, Moffatt, J, Sessions, F y Roberts, RM. Purificación y propiedades de una proteína importante de bajo peso molecular liberada por el trofoblasto de blastocistos de ovejas en el día 13-21. J Reprod Fértil. (1982) 65:141–50. doi: 10.1530/jrf.0.0650141
23. Kandil, D, Leiman, G, Allegretta, M, Trotman, W, Pantanowitz, L, Goulart, R, et al. Inmunocitoquímica de glipicano-3 en aspirados hepáticos con aguja fina: una nueva tinción para ayudar en la diferenciación de lesiones hepáticas benignas y malignas. Cáncer. (2007) 111:316–22. doi: 10.1002/cncr.22954
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Wang, D . NOD1 y NOD2 son posibles dianas terapéuticas para la inmunoterapia contra el cáncer. Comput Intell Neurosci. (2022) 2022:2271788. doi: 10.1155/2022/2271788
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Cárdenas, I, Mulla, MJ, Myrtolli, K, Sfakianaki, AK, Norwitz, ER, Tadesse, S, et al. La activación de Nod1 por iE-DAP bacteriana induce inflamación materno-fetal y parto prematuro. J Immunol. (2011) 187:980–6. doi: 10.4049/jimmunol.1100578
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. deNicolo, G, Parkinson, TJ, Kenyon, PR, Morel, PC, and Morris, ST. Plasma progesterone concentrations during early pregnancy in spring- and autumn-bred ewes. Anim Reprod Sci. (2009) 111:279–88. doi: 10.1016/j.anireprosci.2008.03.017
27. Negroni, A, Pierdomenico, M, Cucchiara, S, and Stronati, L. NOD2 and inflammation: current insights. J Inflamm Res. (2018) 11:49–60. doi: 10.2147/JIR.S137606
28. Lappas, M . NOD1 and NOD2 regulate proinflammatory and prolabor mediators in human fetal membranes and myometrium via nuclear factor-kappa B. Biol Reprod. (2013) 89:14. doi: 10.1095/biolreprod.113.110056
29. Gómez-López, N, Romero, R, Xu, Y, Plazyo, O, Unkel, R, Leng, Y, et al. Función del inflamasoma en el trabajo de parto prematuro espontáneo con corioamnionitis histológica aguda. Reprod Sci. (2017) 24:1382–401. doi: 10.1177/1933719116687656
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Wright, KL, Chin, KC, Linhoff, M, Skinner, C, Brown, JA, Boss, JM, et al. Estimulación CIITA de la unión del factor de transcripción al complejo mayor de histocompatibilidad clase II y promotores asociados in vivo. Proc Natl Acad Sci USA. (1998) 95:6267–72. doi: 10.1073/pnas.95.11.6267
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Morris, AC, Riley, JL, Fleming, WH, y Boss, JM. El silenciamiento del gen MHC de clase II en las células trofoblásticas es causado por la inhibición de la expresión de CIITA. Am J Reprod Immunol. (1998) 40:385–94. doi: 10.1111/j.1600-0897.1998.tb00423.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Patel, DR, Kaplan, MH y Chang, CH. Programación alterada de la diferenciación de las células Th1 por deficiencia de CIITA. J Immunol. (2004) 173:5501–8. doi: 10.4049/jimmunol.173.9.5501
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Piccinni, MP, Raghupathy, R, Saito, S, y Szekeres-Bartho, J. Citoquinas, hormonas y mecanismos reguladores celulares que favorecen la reproducción exitosa. Frente Immunol. (2021) 12:717808. doi: 10.3389/fimmu.2021.717808
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Wattegedera, SR, Doull, LE, Goncheva, MI, Wheelhouse, NM, Watson, DM, Pearce, J, et al. La homeostasis inmunológica en la placenta ovina puede reflejar el grado de interacción materno-fetal. Frente Immunol. (2019) 9:3025. doi: 10.3389/fimmu.2018.03025
35. Caspe, SG, Ewing, DA, Livingstone, M, Underwood, C, Milne, E, Sargison, ND, et al. La respuesta inmunitaria en el útero y la placenta de ovejas infectadas por Chlamydia abortus y su asociación con los resultados de la gestación. Patógenos. (2023) 12:846. doi: 10.3390/pathogens12060846
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Wattegedera, S, Rocchi, M, Sales, J, Howard, CJ, Hope, JC y Entrican, G. Las respuestas inmunitarias periféricas específicas del antígeno no se alteran durante la preñez normal en las ovejas. J Reprod Immunol. (2008) 77:171–8. doi: 10.1016/j.jri.2007.07.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Vanaja, SK, y Rathinam, VAK. (IR)para la expresión NAIP. Célula. (2018) 173:817–9. doi: 10.1016/j.cell.2018.04.022
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Ka, H, y Hunt, JS. Patrones temporales y espaciales de expresión de inhibidores de la apoptosis en placentas humanas. Am J Pathol. (2003) 163:413–22. doi: 10.1016/S0002-9440(10)63671-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Husnain, A, Arshad, U, Zimpel, R, Schmitt, E, Dickson, MJ, Perdomo, MC, et al. La inflamación endometrial inducida compromete el desarrollo del conceptus en el ganado lechero. Biol Reprod. (2023) 109:415–31. doi: 10.1093/biolre/ioad088
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Beltman, ME, Forde, N, Lonergan, P, y Crowe, MA. Alteración de la expresión génica inmune endometrial en novillas de carne con embriones retardados. Reprod Fertil Dev. (2013) 25:966–70. doi: 10.1071/RD12232
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Mi, L, Min, X, Chai, Y, Zhang, J y Chen, X. Inflamasomas NLRP1: un objetivo potencial para el tratamiento de varios tipos de lesiones cerebrales. Frente Immunol. (2022) 13:863774. doi: 10.3389/fimmu.2022.863774
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Matias, ML, Gomes, VJ, Romao-Veiga, M, Ribeiro, VR, Nunes, PR, Romagnoli, GG, et al. La silibinina regula a la baja la vía NF-κB y los inflamasomas NLRP1/NLRP3 en monocitos de mujeres embarazadas con preeclampsia. Moléculas. (2019) 24:1548. doi: 10.3390/moléculas24081548
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Meihe, L, Shan, G, Minchao, K, Xiaoling, W, Peng, A, Xili, W, et al. El inflamasoma ferroptosis-NLRP1: el círculo vicioso de un embarazo adverso. Front Cell Dev Biol. (2021) 9:707959. doi: 10.3389/fcell.2021.707959
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Seoane, PI, Lee, B, Hoyle, C, Yu, S, López-Castejón, G, Lowe, M, et al. El inflamasoma NLRP3 como sensor de disfunción de orgánulos. J Cell Biol. (2020) 219:e202006194. doi: 10.1083/jcb.202006194
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Navarro-Pando, JM, Alcocer-Gómez, E, Castejón-Vega, B, Navarro-Villarán, E, Condés-Hervás, M, Mundi-Roldan, M, et al. La inhibición del inflamasoma NLRP3 previene el envejecimiento ovárico. Sci Adv. (2021) 7:EABC7409. doi: 10.1126/sciadv.abc7409
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Zeng, H, Han, X, Zhu, Z, Yu, S, Mei, S, Cheng, X, et al. Aumento del inflamasoma uterino NLRP3 y de la infiltración de leucocitos en un modelo de preeclampsia en ratas. Am J Reprod Immunol. (2021) 86:E13493. doi: 10.1111/aji.13493
47. Chen, Z, Shan, Y, You, X, Gu, H, Xu, C, Long, J, et al. El inflamasoma NLRP3 está involucrado en la activación uterina para el trabajo de parto a término y prematuro. Reproducción. (2021) 162:449–60. doi: 10.1530/REP-21-0047
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Carriere, J, Dorfleutner, A, y Stehlik, C. NLRP7: de la regulación del inflamasoma a la enfermedad humana. Inmunología. (2021) 163:363–76. doi: 10.1111/imm.13372
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Tsai, PY, Chen, KR, Li, YC y Kuo, PL. NLRP7 está involucrado en la diferenciación de los macrófagos deciduales. Int J Mol Sci. (2019) 20:5994. doi: 10.3390/ijms20235994
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Abi Nahed, R, Elkhoury Mikhael, M, Reynaud, D, Collet, C, Lemaitre, N, Michy, T, et al. Papel de NLRP7 en células trofoblásticas normales y malignas. Biomedicinas. (2022) 10:252. doi: 10.3390/biomedicines10020252
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: endometrio, inmunología, receptor tipo NOD, gestación, ovejas
Cita: Zhang L, Cai J, Wang X, Yang Z, Ding H y Yang L (2024) Efectos del embarazo temprano en la expresión del receptor similar a NOD en el endometrio ovino. Frente. Vet. Sci. 11:1384386. doi: 10.3389/fvets.2024.1384386
Recibido: 09 de febrero de 2024; Aceptado: 20 de mayo de 2024;
Publicado: 05 Junio 2024.
Editado por:
Ali A. Fouladi-Nashta, Royal Veterinary College (RVC), Reino Unido
Revisado por:
Sean Ranjan Wattegedera, Instituto de Investigación Moredun, Reino Unido
Mehmet Kose, Universidad Dicle, Türkiye
Derechos de autor © 2024 Zhang, Cai, Wang, Yang, Ding y Yang. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Ling Yang, yangling@hebeu.edu.cn
†Estos autores han contribuido igualmente a este trabajo y comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía