Producción y evaluación de anticuerpos monoclonales anti-BP26 para la detección serológica de la brucelosis animal
Producción y evaluación de anticuerpos monoclonales anti-BP26 para la detección serológica de la brucelosis animal
 Xiaohan Guo1†
Xiaohan Guo1†  MingjunSun2†
MingjunSun2†  Yu Guo3†
Yu Guo3†  Yao Wu4
Yao Wu4  Xin Yan2
Xin Yan2  Mengda Liu2
Mengda Liu2  Jiaqi Li2
Jiaqi Li2  Xiangxiang Sun2
Xiangxiang Sun2  VentiladorXiaoxu2
VentiladorXiaoxu2  Haobo Zhang2
Haobo Zhang2  Sol Shufang2*
Sol Shufang2*  Jianlong Wang3*
Jianlong Wang3*  Dehui Yin1*
Dehui Yin1*- 1Laboratorio Clave de Genética Humana y Medicina Ambiental, Facultad de Salud Pública, Universidad Médica de Xuzhou, Xuzhou, China
- 2Laboratorio de Zoonosis, Centro de Sanidad Animal y Epidemiología de China, Qingdao, China
- 3Laboratorio de Pruebas, Centro de Control de Enfermedades Animales de Mongolia Interior, Hohhot, China
- 4Facultad de Ciencia y Tecnología Animal, Universidad de Agricultura de Shandong, Taian, China
Brucella BP26 demuestra ser un antígeno altamente inmunogénico con una excelente especificidad en la detección de la brucelosis. En China, el uso autorizado de la vacuna con supresión de Bp26 M5ΔBP26 para prevenir la brucelosis de pequeños rumiantes pone de relieve la importancia de desarrollar métodos de detección precisos dirigidos a BP26, en particular para el diagnóstico de la diferenciación entre animales infectados y vacunados (DIVA). Utilizando la técnica tradicional de hibridoma de ratón, obtuvimos con éxito 12 anticuerpos monoclonales (mAbs) dirigidos a BP26. Se evaluó la eficacia de estos anticuerpos monoclonales en la detección de diversos casos de brucelosis animal mediante el método ELISA competitivo. Entre ellos, solo el mAb E10 mostró una eficiencia significativa, siendo inhibido por el 100, 97,62 y 100% de los sueros positivos para brucelosis de bovinos, pequeños rumiantes y caninos, respectivamente. El ensayo de inmunoadsorción enzimática competitiva (cELISA) basado en E10 superó al ensayo de inmunoadsorción enzimática indirecta (iELISA) basado en BP26 en cuanto a precisión, especialmente para la brucelosis bovina y de pequeños rumiantes, con una sensibilidad de cELISA que alcanzó el 97,62 % en comparación con el 64,29 % de iELISA para pequeños rumiantes. Aunque el cELISA mostró una especificidad ligeramente menor que el iELISA, mantuvo una alta precisión en la detección de la brucelosis canina. El epítopo del mAb E10 se identificó en la secuencia de aminoácidos QPIYVYPDDKNNLKEPTITGY, lo que sugiere su potencial como antígeno diagnóstico para la brucelosis. En conclusión, el cELISA basado en E10 presenta un medio eficaz para detectar la brucelosis animal, particularmente importante para el diagnóstico de DIVA en China, donde la vacuna contra la mutación BP26 es ampliamente utilizada.
1 Introducción
La proteína periplásmica de 26 kDa de Brucella, BP26, sirve como un antígeno inmunogénico robusto capaz de provocar una respuesta de anticuerpos en animales infectados con Brucella (1-8). A pesar de una respuesta de anticuerpos tardía y más débil en comparación con el antígeno O-polisacárido de Brucella (OPS) (3), BP26 exhibe una mayor especificidad en la detección de brucelosis (9), con una reactividad cruzada mínima con sueros infectados con otros patógenos bacterianos. Además, BP26 presenta una ventaja en la detección de brucelosis causada por cepas rugosas de Brucella, que carecen de antígeno OPS en su superficie (4, 10).
Además, los estudios han demostrado que las vacunas con deleción genética BP26 mantienen su eficacia protectora contra las cepas salvajes de Brucella, lo que hace que las vacunas deficientes en BP26, como la S19 y la Rev1, sean preferibles para lograr la diferenciación serológica entre animales infectados y vacunados (DIVA) (11-14). En China, la autorización de la vacuna M5ΔBP26 con mutación BP26 para la prevención de la brucelosis de pequeños rumiantes pone de relieve la importancia de desarrollar métodos de detección dirigidos a BP26 para facilitar las estrategias DIVA con el uso generalizado de las vacunas M5ΔBP26 (15).
Nosotros y otros investigadores hemos evaluado la eficacia del ensayo inmunoenzimático indirecto basado en BP26 (iELISA) en la detección serológica de diversas formas de brucelosis animal (7, 16). Pocos estudios han explorado el ensayo competitivo de inmunoabsorción ligado a enzimas (cELISA) utilizando anticuerpos monoclonales anti-BP26 (mAbs) para la detección de brucelosis (17, 18). En este estudio, utilizamos la técnica tradicional de hibridoma de ratón para generar un panel de mAbs dirigidos a BP26. Utilizando una colección de sueros positivos para brucelosis, evaluamos la capacidad de estos anticuerpos monoclonales para detectar diferentes formas de brucelosis animal, identificando un AcM con alta eficiencia en cELISA para este propósito. Anticipamos que nuestros hallazgos contribuirán al desarrollo de nuevos métodos de diagnóstico para la brucelosis.
2 Materiales y métodos
2.1 Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Ética de Animales Experimentales de la Universidad Médica de Xuzhou (número de aprobación: 202208W051).
2.2 Producción de anticuerpos monoclonales anti-BP26
La proteína BP26 (cepa de referencia: 16M/ATCC 23456/NCTC 10094) se expresó mediante un sistema de expresión procariota establecido en nuestro laboratorio (16). La inmunización de ratones BALB/c y los procedimientos de cribado de hibridomas siguieron los métodos descritos en un estudio publicado anteriormente (18). Los anticuerpos monoclonales anti-BP26 se generaron mediante la inoculación intraperitoneal de ratones con células de hibridoma. La ascitis de ratón que contenía anticuerpos monoclonales se recolectó y purificó utilizando una columna comercial de proteína G (Sangon Biotech, Shanghai, China). La pureza de los anticuerpos monoclonales se evaluó mediante SDS-PAGE.
2.3 Sueros
Todos los sueros utilizados en este experimento se archivaron en el Centro Chino de Epidemiología y Salud Animal (CAHEC) con antecedentes bien documentados. Los sueros positivos procedían de animales de los que se había aislado Brucella de tipo salvaje, mientras que los sueros negativos procedían de animales criados en zonas libres de brucelosis. Se incluyeron en el estudio un total de 245 sueros, de los cuales 96 procedían de pequeños rumiantes (infectados de forma natural: 42; negativos: 54), 96 de ganado lechero (infectados de forma natural: 44; negativos: 52) y 53 de caninos (infectados de forma natural: 7; negativos: 46). Además, se recogieron 231 sueros de rumiantes inmunizados con la vacuna M5ΔBP26. Estos sueros se utilizaron para evaluar la eficacia de los métodos iELISA y cELISA.
Además, se utilizaron sueros de conejo (comprados a Tianjin Biochip Corporation, Tianjin, China) infectados artificialmente con Y. enterocolitica O9, E. coli (O157:H7, O116), Salmonella urban, Ochrobactrum anthropi y Vibrio cholerae para evaluar la especificidad de los métodos iELISA y cELISA. Los sueros de conejo se sometieron a los mismos procedimientos de prueba similares a los de los pequeños rumiantes, el ganado y los caninos, incluidas las diluciones. Se utilizó como anticuerpo secundario la IgG anti-conejo de cabra conjugada con HRP (diluida a 1:10.000, Bioworld, MN, Estados Unidos).
2.4 Caracterización de los epítopos BP26 reconocidos por mAbs
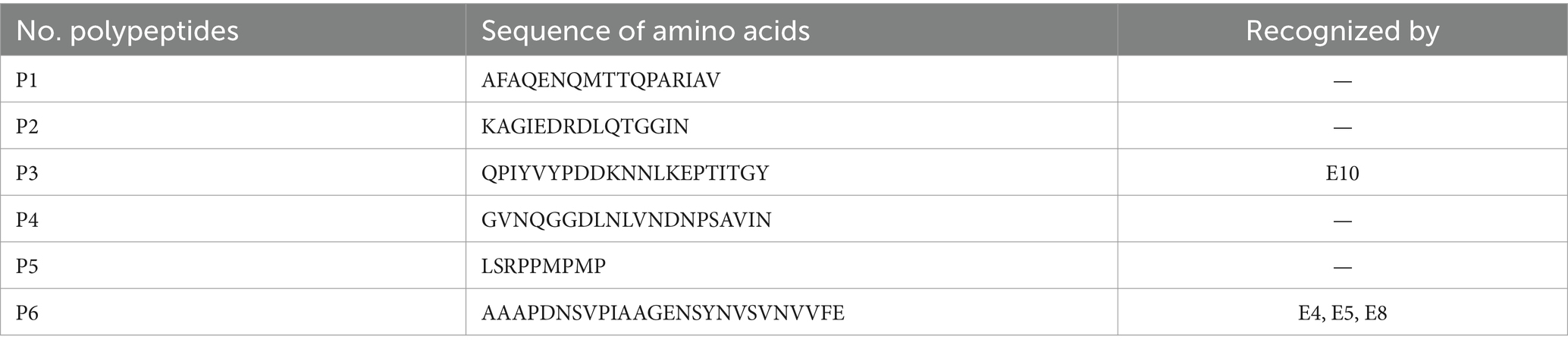
Se sintetizaron seis polipéptidos lineales de BP26 y se realizó iELISA como se describió anteriormente (19). En resumen, 100 μL de conjugado péptido-KLH (10 μg/mL) se recubrieron en microplacas (Corning, NY, Estados Unidos) en 0,1 M de tampón de carbonato (pH 9,6) y se incubaron durante la noche a 4 °C. A continuación, las placas se lavaron tres veces con solución salina tamponada con fosfato que contenía 0,05% de Tween-20 (PBST) y se bloquearon con leche desnatada al 5% durante 2 h a 37 °C. Después de lavar tres veces con PBST, se añadieron 100 μL de mAb purificado a 1 μg/mL a cada pocillo y se incubaron a 37 °C durante 1 h con el mismo volumen de suero normal de ratón utilizado como control negativo. Las placas se lavaron de nuevo tres veces y luego se incubaron con 100 μL de proteína G recombinante conjugada con peroxidasa de rábano picante (HRP) (diluida a 1:10.000) (Bersee, Pekín, China) durante 45 min a 37 °C. Se utilizó TMB como sustrato colorimétrico y la densidad óptica se midió a 450 nm (OD450) utilizando un lector de placas ELISA (BioTek, Estados Unidos). Un cociente entre el valor de OD450 de mAb y sueros normales de ratón superior a 1,5 se consideró un resultado positivo.
2.5 iELISA y cELISA
El iELISA se llevó a cabo siguiendo procedimientos previamente establecidos con ligeras modificaciones (16). Uno de los cambios fue la concentración de la proteína BP26 utilizada para recubrir las microplacas, que se ajustó a 1 μg/mL. Además, se sustituyó el tampón de bloqueo comercial (BioFX, Estados Unidos) por leche desnatada al 5%.
En el caso de cELISA, las condiciones críticas, como la concentración de BP26 en el recubrimiento y el volumen de suero y mAbs, se optimizaron mediante la valoración en tablero de ajedrez. La IgG antiratón de conejo conjugada con HRP (diluida a 1:10.000) (Sangon, China) sirvió como anticuerpo secundario para detectar el mAb. El resto de los pasos fueron idénticos a los del iELISA. Todas las muestras se repitieron tres veces.
2.6 Análisis estadístico
La sensibilidad general y la especificidad de iELISA y cELISA en la detección de la brucelosis animal se calcularon utilizando curvas de características operativas del receptor (ROC). Los valores de corte óptimos se definieron utilizando la suma más alta de sensibilidad y especificidad. Para cada valor de corte óptimo, se calcularon los principales parámetros, como sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN). El diagrama de puntos se realizó utilizando GraphPad Prism versión 6.05.
3 Resultados
3.1 Producción de anticuerpos monoclonales anti-BP26 y análisis de reconocimiento de epítopos
Después de la detección, se encontró que un total de 12 líneas celulares de hibridoma secretaban mAbs, que eran reactivos a BP26. A continuación, se prepararon anticuerpos monoclonales a partir de ascitis de ratón y se codificaron como E1-E12. Con base en los resultados de los polipéptidos BP26 iELISA, el mAb E10 reaccionó al polipéptido de QPIYVYPDDKNNLKEPTITGY y tres mAbs codificados como E4, E5 y E8 reaccionaron al polipéptido AAAPDNSVPIAAGENSYNVSVNVVFE, mientras que los ocho mAbs restantes no reaccionaron a ninguno de estos polipéptidos (Tabla 1).
3.2 Inhibición de sueros positivos para brucelosis animal a anticuerpos monoclonales
El cELISA se realizó individualmente para bovinos, pequeños rumiantes y sueros caninos positivos para brucelosis canina utilizando estos mAb. El porcentaje de inhibición (IP) para cada AcM se calculó como [100 − (valor de OD450 del suero positivo/valor de OD450 del suero negativo) × 100] %. Sobre la base de los valores de IP, los sueros positivos se clasificaron en cinco grupos: <20%, 20-39%, 40-59%, 60-79% y ≥80%.
Si un suero con un valor de IP superior al 20% era positivo, E10 inhibía el 100% de los sueros de brucelosis bovina, el 97,62% de los sueros de pequeños rumiantes y el 100% de los sueros caninos (Tabla 2). Con los mismos sueros positivos para brucelosis, los otros anticuerpos monoclonales exhibieron IP significativamente más bajos en comparación con E10. Del mismo modo, cuando el valor umbral de IP se elevó al 40%, E10 siguió mostrando los IP más altos para el ganado bovino, los pequeños rumiantes y los sueros positivos para la brucelosis canina, con valores de 38,64, 57,14 y 100%, respectivamente. Sobre la base de estos resultados, se seleccionó E10 como la opción preferida para ensamblar un kit cELISA basado en BP26.
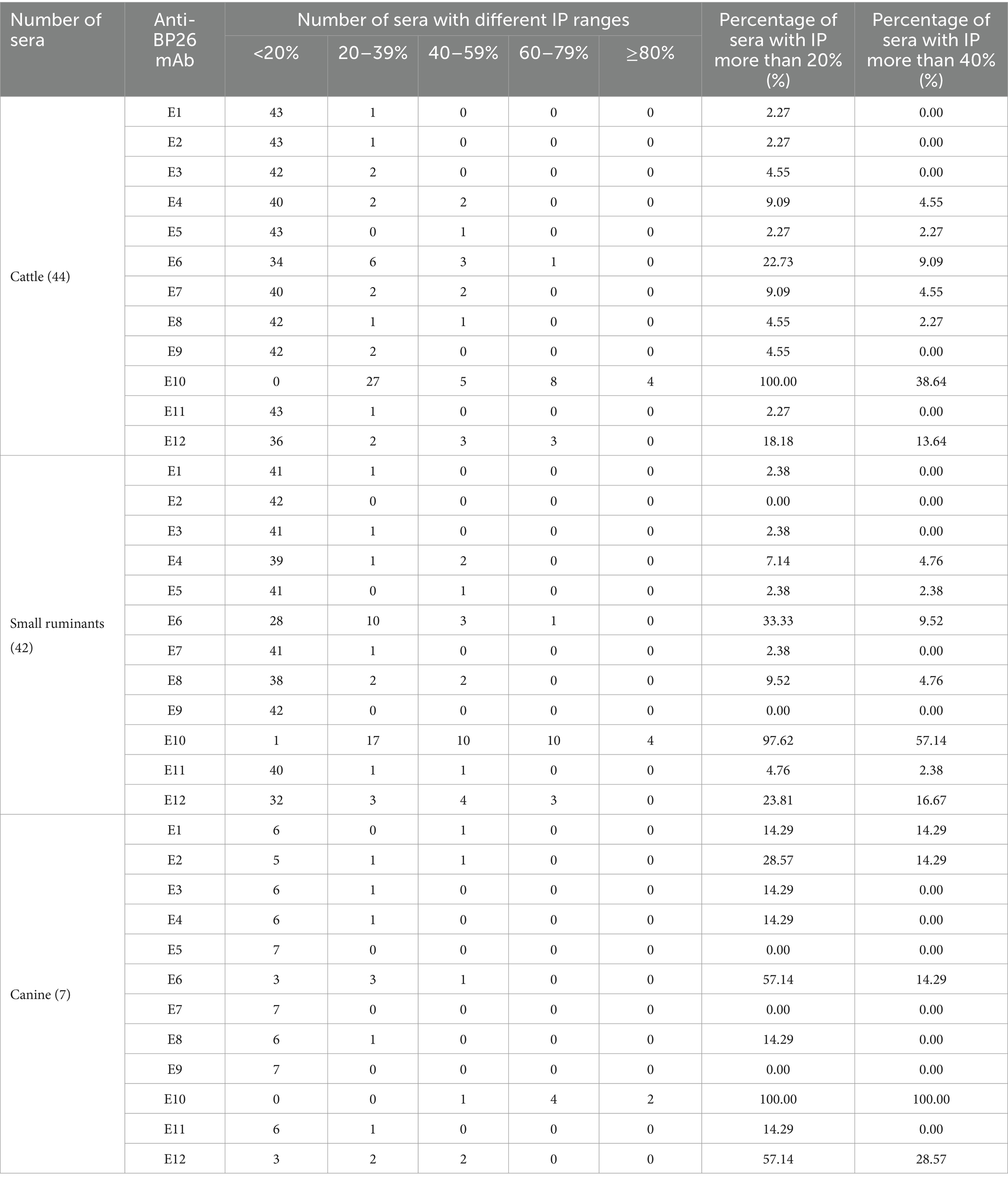 Tabla 2. Número de sueros detectados por anticuerpos monoclonales anti-BP26 en diferentes rangos de IP.
Tabla 2. Número de sueros detectados por anticuerpos monoclonales anti-BP26 en diferentes rangos de IP.
3.3 Eficacia del cELISA basado en E10 en la detección de la brucelosis animal
Para evaluar la eficacia del mAb E10 en la detección de la brucelosis animal, se realizó un cELISA utilizando sueros positivos y negativos de varios animales domésticos, incluidos bovinos, pequeños rumiantes y caninos. La concentración óptima de recubrimiento de la proteína BP26 se fijó en 10 μg/mL, y el volumen sérico óptimo utilizado fue de 30 μL, que se mezcló con 70 μL de mAb prediluido (0,875 μg/mL) antes de transferirlo a cada pocillo de la microplaca.
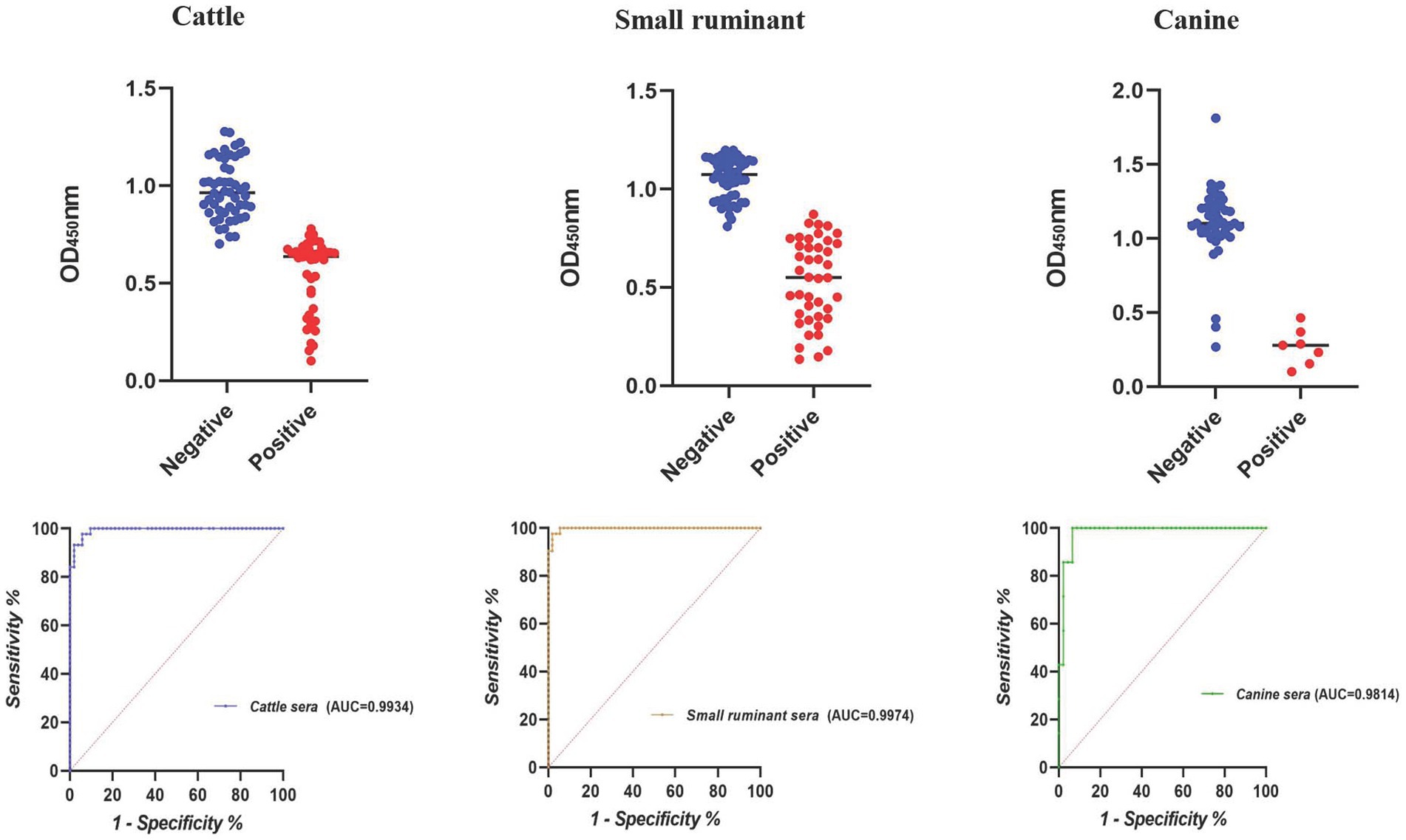
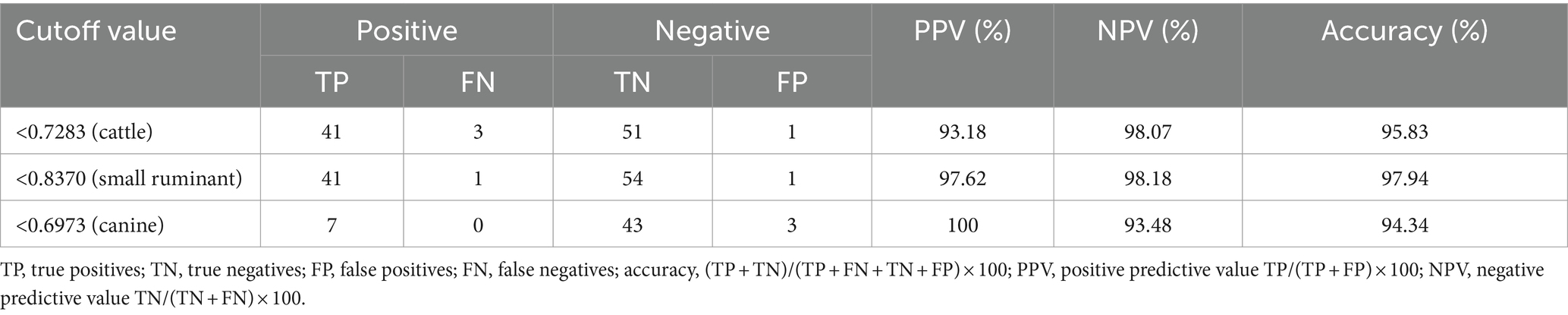
El área más grande bajo la curva ROC se observó para los sueros de pequeños rumiantes (AUC = 0,9974), seguidos por los bovinos (AUC = 0,9934) y los sueros caninos (AUC = 0,9814) (Figura 1). Utilizando los valores de corte óptimos, la precisión de cELISA para pequeños rumiantes fue la más alta (97,94%), con VPP y VPN registrados como 97,62 y 98,18%, respectivamente (Tabla 3). Los sueros bovinos mostraron una precisión similar, aunque el VPP fue ligeramente inferior al de los sueros de pequeños rumiantes. Los sueros caninos exhibieron el VPP más alto (100%), pero debido al número limitado de muestras, el VPN fue el más bajo, lo que resultó en la precisión general más baja entre los tres grupos de sueros.
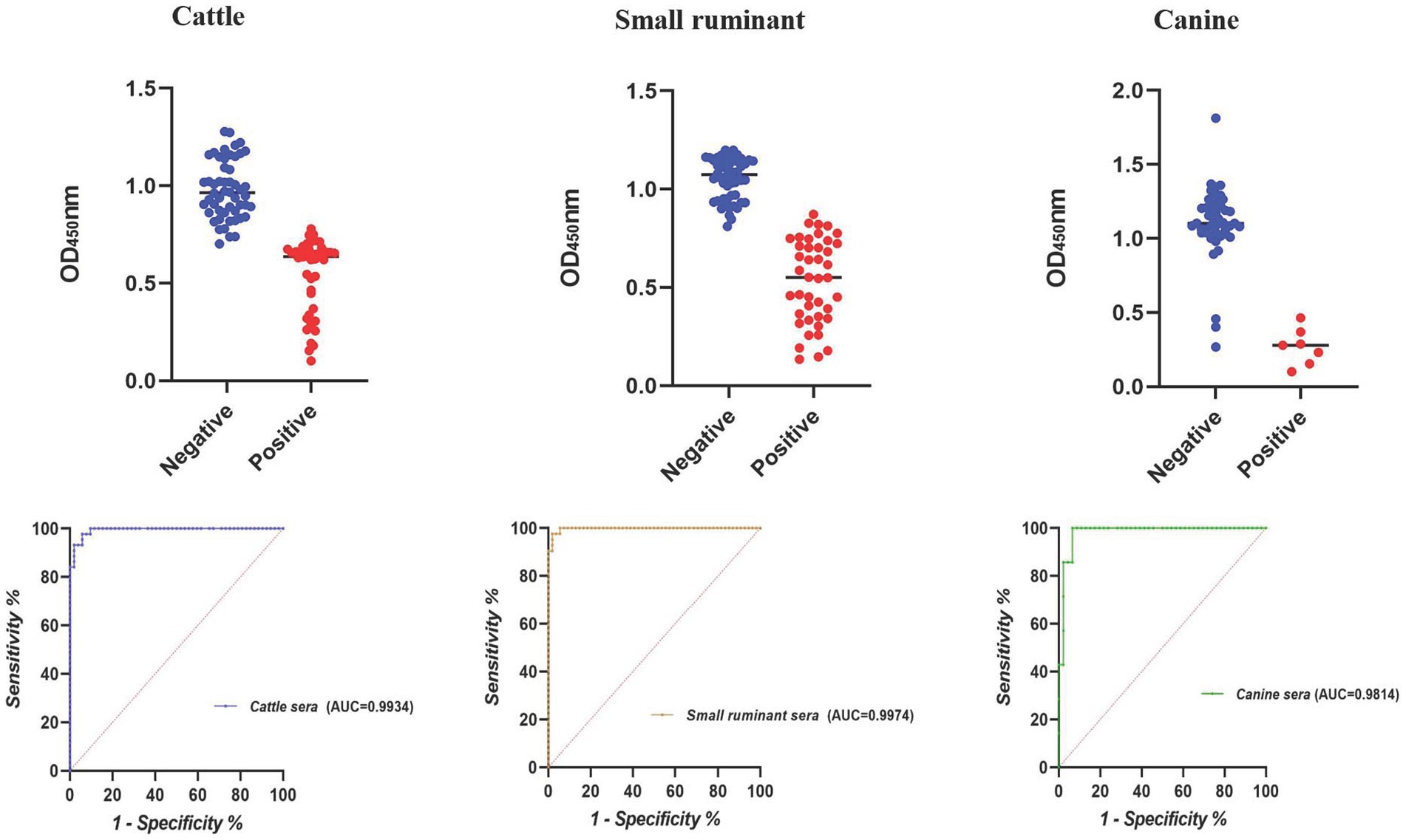 Figura 1. Diagrama de puntos y ROC del cELISA basado en E10 en la detección de sueros de brucelosis animal.
Figura 1. Diagrama de puntos y ROC del cELISA basado en E10 en la detección de sueros de brucelosis animal.
3.4 Eficacia del iELISA basado en BP26 en la detección de la brucelosis animal
En comparación con cELISA, las mismas colecciones de sueros positivos y negativos para brucelosis también fueron analizadas por el iELISA basado en BP26. La concentración óptima de recubrimiento de la proteína BP26 para iELISA fue de 0,3 μg/mL, mucho más baja que la de cELISA.
De acuerdo con el resultado de iELISA, la mayor área bajo la curva ROC se obtuvo para sueros caninos (AUC = 1,0000), seguidos por bovinos (AUC = 0,9578) y pequeños sueros de rumiantes (AUC = 0,8126) (Figura 2). Utilizando los valores de corte óptimos, la precisión de cELISA para sueros caninos fue la más alta (100%), lo que significa que todos los sueros positivos y negativos se distinguieron correctamente. Se obtuvieron valores de precisión más bajos para el ganado bovino y los sueros de pequeños rumiantes (89,58 y 82,30%, respectivamente) (Tabla 4).
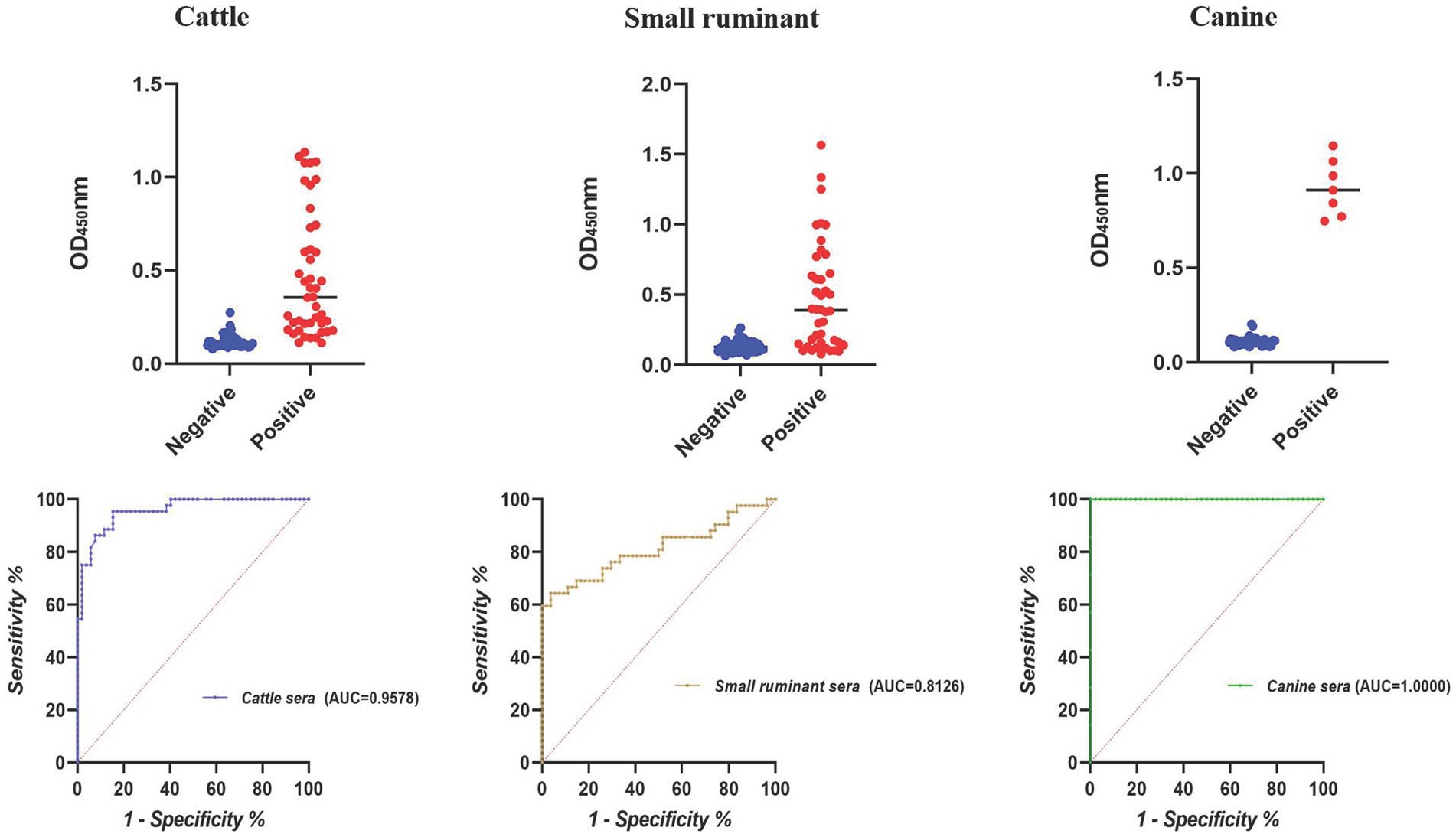 Figura 2. Diagrama de puntos y ROC del iELISA basado en BP26 en la detección de sueros de brucelosis animal.
Figura 2. Diagrama de puntos y ROC del iELISA basado en BP26 en la detección de sueros de brucelosis animal.
3.5 Reacción cruzada a otros sueros
Si una relación S/N (OD450, muestra/negativo) >2,0 en iELISA o N/S >2,0 en cELISA se consideraron positivos, ni el cELISA basado en E10 ni el iELISA basado en BP26 identificaron los sueros de conejo infectados por Y. enterocolitica O9, E. coli (O157:H7, O116), Salmonella urban, Ochrobactrum anthropi y Vibrio cholerae.
4 Discusión
Entre los antígenos proteicos utilizados para la detección de la brucelosis, BP26 ha sido ampliamente estudiado. Investigaciones anteriores han demostrado que el iELISA basado en BP26 puede detectar eficazmente varios casos de brucelosis animal. Sin embargo, nuestro experimento sugiere que el uso de cELISA con anticuerpos monoclonales anti-BP26 puede ser más eficiente. En general, el método cELISA establecido en este estudio superó al iELISA, especialmente en términos de precisión para la detección de sueros bovinos y pequeños rumiantes (Tablas 3, 4). Cabe destacar que hubo una diferencia significativa en la detección de pequeños rumiantes entre cELISA (97,62%) e iELISA (64,29%). Por el contrario, iELISA mostró una mayor precisión en la detección de la brucelosis canina, logrando una precisión del 100% en comparación con el 94,34% de cELISA. Esta diferencia se debió principalmente a una especificidad ligeramente menor en cELISA, aunque la sensibilidad siguió siendo comparable a la iELISA. Desafortunadamente, la disponibilidad limitada de sueros positivos para brucelosis en caninos en nuestro experimento refleja la insuficiente atención prestada a la brucelosis canina en China, lo que resulta en una escasez de muestras de suero calificadas. Por lo tanto, es necesaria una evaluación adicional para evaluar la eficacia del cELISA basado en mAb anti-BP26 en la detección de la brucelosis rugosa inducida por Brucella.
BP26 es una proteína inmunogénica capaz de estimular varios anticuerpos monoclonales dirigidos a diferentes epítopos dentro del modelo de ratón (17, 18). En nuestro experimento, los anticuerpos monoclonales E10 demostraron un potencial significativo en la detección de la brucelosis animal, mientras que los anticuerpos monoclonales E6 y E12 mostraron cierta capacidad, pero no cumplieron con los requisitos de sensibilidad y especificidad necesarios para el diagnóstico. Los nueve anticuerpos monoclonales restantes fueron en gran medida ineficaces como reactivos de diagnóstico. Como el mAb E10 reaccionó al polipéptido QPIYVYPDDKNNLKEPTITGY, es probable que su epítopo reconocido se encuentre dentro de esta secuencia. Curiosamente, Qiu et al. (18) reportaron dos epítopos reconocidos por mAbs anti-BP26, uno de los cuales, con la secuencia QPIYVYPD, se superpone con el polipéptido utilizado en nuestro experimento. Aunque no podemos confirmar su identidad exacta, la antigenicidad de la secuencia QPIYVYPDDKNNLKEPTITGY sugiere que puede ser un antígeno diagnóstico útil para la brucelosis. Además, este epítopo propuesto se encuentra dentro de la región BP26 descrita por Seco-Mediavilla et al. (20), entre los aminoácidos 55 y 152, que mostraron una especificidad superior en la detección de sueros de pequeños rumiantes. Este hallazgo se alinea con nuestros datos, lo que indica que el cELISA basado en E10 también exhibe una alta especificidad para la brucelosis en pequeños rumiantes.
En la actualidad, la vacunación generalizada con vacunas vivas atenuadas de Brucella es una estrategia clave para el control de la brucelosis animal en zonas de alta prevalencia, siendo las vacunas que poseen competencia DIVA las más favorecidas por las autoridades. En China, es notable la comercialización y el aumento de la utilización de la vacuna M5ΔBP26, que contiene una deleción Bp26, para inmunizar a pequeños rumiantes. Se ha propuesto el correspondiente iELISA que utiliza BP26 como antígeno para diferenciar entre los sueros vacunados con M5ΔBP26 y los infectados de forma natural (21). Dado que el cELISA basado en mAb E10 establecido en este estudio demostró una mejor sensibilidad y especificidad que el iELISA, nuestros datos no publicados mostraron que todos los sueros de pequeños rumiantes recolectados entre 7 y 207 días después de la vacunación por M5ΔBP26 no fueron reconocidos por este método de cELISA, lo que demuestra que el cELISA podría ser más adecuado para el diagnóstico de DIVA.
En conclusión, la brucelosis sigue siendo una enfermedad zoonótica importante, especialmente en China, donde es altamente endémica en ciertas regiones. Los métodos cELISA e iELISA descritos en este estudio no solo facilitan la detección de brucelosis en bovinos, pequeños rumiantes y caninos, sino que también sirven como pruebas DIVA cuando se administra la vacuna con deleción de Bp26. Se espera que la estrategia de vacunación y pruebas DIVA acelere la erradicación de la brucelosis animal en China.
4.1 Limitaciones
Aunque nuestro cELISA construido distingue eficazmente los sueros de brucelosis animal de los sueros que no lo son y puede diferenciar entre sueros inmunes y sueros infectados naturalmente en rumiantes, nuestro estudio tiene ciertas limitaciones. En primer lugar, el tamaño de la muestra es limitado, y ampliarlo requerirá verificar la sensibilidad y especificidad del método construido. En segundo lugar, la cepa de la vacuna M5ΔBP26 es específica de China, lo que limita la aplicabilidad de nuestro método para distinguir los sueros inmunes a las vacunas, que se utiliza en todo el mundo. Por último, nuestro estudio solo incluyó sueros inmunizados de pequeños rumiantes, y se necesita más investigación para evaluar su capacidad para diferenciar entre sueros inmunizados e infectados naturalmente en otros animales.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética de Animales Experimentales de la Universidad Médica de Xuzhou. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
XG: Conceptualización, Curación de datos, Redacción – borrador original. MS: Conceptualización, Escritura – borrador original. YG: Conceptualización, Escritura – borrador original. YW: Escritura – revisión y edición. XY: Escritura – revisión y edición. ML: Escritura – revisión y edición. JL: Escritura – revisión y edición. XS: Escritura – revisión y edición. XF: Escritura – revisión y edición. HZ: Adquisición de fondos, redacción, revisión y edición. SS: Conceptualización, Redacción – revisión y edición. JW: Conceptualización, Escritura – revisión y edición. DY: Obtención de fondos, Metodología, Redacción, revisión y edición.
Financiación
El/los autor/es declaran/n que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo de la Oficina de Ciencia y Tecnología de Xuzhou (subvención número KC23306), el Programa de Investigación Médica de la Comisión de Salud de Jiangsu (subvención número Z2023080), el Programa Nacional de Investigación y Desarrollo Clave de China (subvención número 2021YFD1800402) y el Programa de Investigación de Posgrado e Innovación Práctica de la provincia de Jiangsu (subvención número KYCX23-2963).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1389728/full#supplementary-material
CUADRO COMPLEMENTARIO 1 Datos brutos de la Figura 1.
CUADRO 2 COMPLEMENTARIO Datos brutos de la Figura 2.
CUADRO 3 COMPLEMENTARIO Detalles de la producción del antígeno BP26 (epítopo) y anticuerpos monoclonales.
Referencias
1. Rossetti, OL, Arese, AI, Boschiroli, ML y Cravero, SL. Clonación del gen Brucella abortus y caracterización de la proteína periplásmica de 26 kilodalton expresada: uso potencial para el diagnóstico. J Clin Microbiol. (1996) 34:165–9. doi: 10.1128/jcm.34.1.165-169.1996
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Cloeckaert, A, Debbarh, HS, Vizcaíno, N, Saman, E, Dubray, G y Zygmunt, MS. Clonación, secuencia de nucleótidos y expresión del gen Brucella melitensis bp26 que codifica para una proteína inmunogénica en ovejas infectadas. FEMS Microbiol Lett. (1996) 140:139–44. doi: 10.1111/j.1574-6968.1996.tb08327.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Cloeckaert, A, Baucheron, S, Vizcaíno, N y Zygmunt, MS. Uso de la proteína recombinante BP26 en el diagnóstico serológico de la infección por Brucella melitensis en ovejas. Clin Diagn Lab Immunol. (2001) 8:772–5. doi: 10.1128/CDLI.8.4.772-775.2001
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Zygmunt, MS, Baucheron, S, Vizcaíno, N, Bowden, RA, y Cloeckaert, A. Purificación y evaluación en un solo paso de la proteína BP26 recombinante para el diagnóstico serológico de la infección por Brucella ovis en carneros. Microbiol veterinario. (2002) 87:213–20. doi: 10.1016/S0378-1135(02)00052-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Kumar, S, Tuteja, U, Kumar, A, y Batra, HV. Expresión y purificación de la proteína periplásmica de 26 kDa de Brucella abortus: un reactivo para el diagnóstico de brucelosis bovina. Biotechnol Appl Biochem. (2008) 49:213–8. doi: 10.1042/BA20070111
6. Tiwari, AK, Kumar, S, Pal, V, Bhardwaj, B, y Rai, GP. Evaluación de la región inmunodominante recombinante de 10 kilodalton de la proteína BP26 de Brucella abortus para el diagnóstico específico de brucelosis bovina. Clin Vacuna Immunol. (2011) 18:1760–4. doi: 10.1128/CVI.05159-11
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Tian, M, Song, M, Yin, Y, Lian, Z, Li, Z, Hu, H, et al. Caracterización de las principales proteínas inmunogénicas en Brucella infecciosa para su aplicación en el diagnóstico de brucelosis. Comp Immunol Microbiol Infect Dis. (2020) 70:101462. doi: 10.1016/j.cimid.2020.101462
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Nagalingam, M, Basheer, TJ, Balamurugan, V, Shome, R, Kumari, SS, Reddy, GBM, et al. Evaluación comparativa de las proteínas inmunodominantes de Brucella abortus para el diagnóstico de brucelosis bovina. Mundo Veterinario. (2021) 14:803–12. doi: 10.14202/vetworld.2021.803-812
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Chart, H, Okubadejo, OA, y Rowe, B. Relación serológica entre Escherichia coli O157 y Yersinia enterocolitica O9 utilizando sueros de pacientes con brucelosis. Epidemiol Infect. (1992) 108:77–85. doi: 10.1017/S0950268800049529
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Yao, M, Liu, M, Chen, X, Li, J, Li, Y, Wei, YR, et al. Comparación de BP26, Omp25 y Omp31 y una proteína de fusión basada en multiepítopos en la detección serológica de la brucelosis canina. Infectar la resistencia a los medicamentos. (2022) 15:5301–8. doi: 10.2147/IDR. S374432
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Boschiroli, ML, Cravero, SL, Arese, AI, Campos, E, y Rossetti, OL. Protección contra la infección en ratones vacunados con un mutante de Brucella abortus. Infectar a Immun. (1997) 65:798–800. DOI: 10.1128/iai.65.2.798-800.1997
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Guilloteau, LA, Laroucau, K, Olivier, M, Grillo, MJ, Marin, CM, Verger, J-M, et al. La virulencia residual y la inmunogenicidad de CGV26 y CGV2631 B. melitens es Rev. 1 deleción de cepas mutantes en ovejas después de la vacunación subcutánea o conyugival. Vacuna. (2006) 24:3461–8. doi: 10.1016/j.vaccine.2006.02.007
13. Jacques, I, Verger, JM, Laroucau, K, Grayon, M, Vizcaíno, N, Peix, A, et al. Respuestas inmunológicas y eficacia protectora frente a Brucella melitensis inducidas por mutantes de deleción bp26 y omp31 de B. melitensis Rev. 1 en ovejas. Vacuna. (2007) 25:794–805. doi: 10.1016/j.vaccine.2006.09.051
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Grilló, MJ, Marín, CM, Barberán, M, de Miguel, MJ, Laroucau, K, Jacques, I, et al. Eficacia de los mutantes de deleción bp26 y bp26/omp31 de B. melitensis Rev. 1 contra Brucella ovis en carneros. Vacuna. (2009) 27:187–91. doi: 10.1016/j.vaccine.2008.10.065
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Li, T, Tong, Z, Huang, M, Tang, L, Zhang, H y Chen, C. Brucella melitensis M5-90Δbp26 como una posible vacuna viva que permite distinguir entre infección natural e inmunización. Can J Microbiol. (2017) 63:719–29. doi: 10.1139/cjm-2017-0179
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Bai, Q, Li, H, Wu, X, Shao, J, Sun, M y Yin, D. Análisis comparativo de las principales proteínas de la membrana externa de Brucella en el diagnóstico de brucelosis. Biochem Biophys Res Commun. (2021) 560:126–31. doi: 10.1016/j.bbrc.2021.04.127
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Debbarh, HS, Zygmunt, MS, Dubray, G y Cloeckaert, A. Ensayo competitivo de inmunoadsorción ligado a enzimas que utiliza anticuerpos monoclonales contra la proteína Brucella melitensis BP26 para evaluar las respuestas de anticuerpos en ovejas infectadas y vacunadas contra B. melitensis Rev. 1. Microbiol veterinario. (1996) 53:325–37. doi: 10.1016/S0378-1135(96)01265-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Qiu, J, Wang, W, Wu, J, Zhang, H, Wang, Y, Qiao, J, et al. Caracterización de los epítopos de la proteína periplásmica BP26 de Brucella melitensis que reaccionan con anticuerpos monoclonales murinos y ovinos. PLoS Uno. (2012) 7:e34246. doi: 10.1371/journal.pone.0034246
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Yin, D, Bai, Q, Wu, X, Li, H, Shao, J, Sun, M, et al. Corrección: tecnología de diagnóstico ELISA en papel para la brucelosis humana basada en una proteína de fusión multiepítopo. PLoS negl trop dis. (2021) 17:E0011079. doi: 10.1371/journal.pntd.0011079
20. Seco-Mediavilla, P, Verger, JM, Grayon, M, Cloeckaert, A, Marín, CM, Zygmunt, MS, et al. Mapeo de epítopos de la proteína inmunogénica Brucella melitensis BP26: utilidad para el diagnóstico de brucelosis ovina. Clin Diagn Lab Immunol. (2003) 10:647–51. doi: 10.1128/CDLI.10.4.647-651.2003
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Liu, WX, Hu, S, Qiao, ZJ, Chen, WY, Liu, LT, Wang, FK, et al. Expresión, purificación y mejora de la especificidad antigénica de una proteína bp26 recombinante truncada de Brucella melitensis M5-90: un antígeno potencial para el serodiagnóstico diferencial de brucelosis en ovinos y caprinos. Biotechnol Appl Biochem. (2011) 58:32–8. doi: 10.1002/bab.11
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: brucelosis, ELISA competitivo, BP26, diagnóstico, anticuerpos monoclonales
Cita: Guo X, Sun M, Guo Y, Wu Y, Yan X, Liu M, Li J, Sun X, Fan X, Zhang H, Sun S, Wang J y Yin D (2024) Producción y evaluación de anticuerpos monoclonales anti-BP26 para la detección serológica de la brucelosis animal. Frente. Vet. Sci. 11:1389728. doi: 10.3389/fvets.2024.1389728
Recibido: 22 de febrero de 2024; Aceptado: 31 de mayo de 2024;
Publicado: 18 de junio de 2024.
Editado por:
Nitin Vasantrao Kurkure, Universidad de Ciencias Animales y Pesqueras de Maharashtra, India
Revisado por:
Jeanni Fehrsen, Instituto Veterinario de Onderstepoort (ARC-SA), Sudáfrica
Laxmi Narayan Sarangi, Junta Nacional de Desarrollo de Productos Lácteos, India
Derechos de autor © 2024 Guo, Sun, Guo, Wu, Yan, Liu, Li, Sun, Fan, Zhang, Sun, Wang y Yin. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Shufang Sun, sunshufang@cahec.cn; Jianlong Wang, nmgxmcwjl@163.com; Dehui Yin, yindh16@xzhmu.edu.cn
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía