Eficacia transitoria de buparvacuona contra el aislado US del genotipo Theileria orientalis Ikeda
 Reginaldo G. Bastos1,2*
Reginaldo G. Bastos1,2* Amany Hassan2,3
Amany Hassan2,3 Cynthia K. Onzere2
Cynthia K. Onzere2 David R. Herndon1
David R. Herndon1 Nicolás F. Villarino4
Nicolás F. Villarino4 Jacob M. Risa2
Jacob M. Risa2 Lindsay M. Fry2
Lindsay M. Fry2- 1Unidad de Investigación de Enfermedades Animales, USDA-ARS, Pullman, WA, Estados Unidos
- número arábigoDepartamento de Microbiología y Patología Veterinaria, Universidad Estatal de Washington, Pullman, WA, Estados Unidos
- 3Departamento de Medicina Animal, Facultad de Medicina Veterinaria, Universidad de Alejandría, Alejandría, Egipto
- 4Departamento de Ciencias Clínicas Veterinarias, Facultad de Medicina Veterinaria, Universidad Estatal de Washington, Pullman, WA, Estados Unidos
Introducción: Theileria orientalis, un hemoparásito transmitido por garrapatas de importancia económica, infecta al ganado bovino a nivel mundial. El genotipo de T. orientalis Ikeda, transmitido por las garrapatas Haemaphysalis longicornis, se asocia a manifestaciones clínicas caracterizadas por anemia, abortos y mortalidad, aunque predominan las infecciones subclínicas. A pesar de la frecuencia de las infecciones subclínicas, actualmente no existen intervenciones terapéuticas dirigidas a T. orientalis Ikeda en estos casos, lo que impide la adopción de medidas eficaces de control del parásito. Para abordar esta brecha crítica de conocimiento, evaluamos la eficacia de la buparvacuona (BPQ) en la eliminación de T. orientalis Ikeda, aislado de EE. UU., en bovinos infectados subclínicamente.
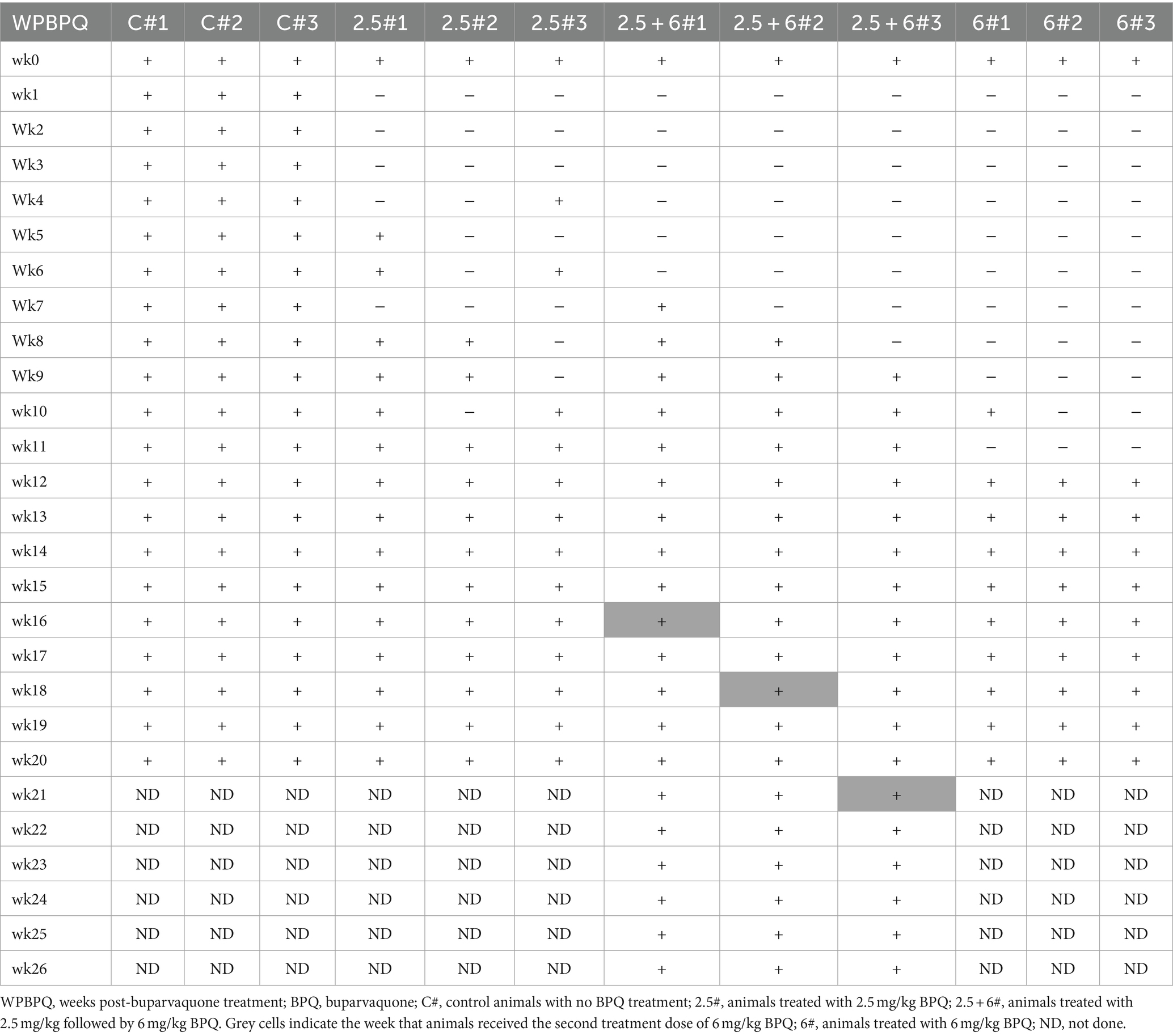
Métodos: Se incluyeron en el estudio doce terneros infectados subclínicamente, identificados por la presencia de T. orientalis en sangre periférica junto con la ausencia de fiebre y anemia. Seis terneros recibieron dos tratamientos de la dosis de la etiqueta BPQ (2,5 mg/kg) en un intervalo de 48 horas, mientras que otros tres terneros recibieron el fármaco a una dosis de 6 mg/kg siguiendo el mismo régimen. Tres terneros no tratados sirvieron como controles.
Resultados y discusión: Los análisis de PCR cuantitativos y de punto final revelaron que la BPQ ejerció un efecto transitorio sobre la parasitemia por T. orientalis. Los parásitos permanecieron indetectables en sangre periférica hasta las semanas 4 y 11 post-tratamiento en animales a los que se les administraron 2,5 mg/kg y 6 mg/kg de BPQ, respectivamente. Curiosamente, después de la recrudescencia, la administración de 6 mg/kg a los animales previamente tratados con 2,5 mg/kg no resultó en una reducción de la carga parasitaria. Los datos del análisis farmacocinético sugirieron que el aumento de la dosis condujo a un aumento menos que proporcional en las concentraciones séricas de BPQ. Además, se observó una disminución significativa pero reversible (p < 0,05) del nitrógeno ureico en sangre en los animales tratados con el fármaco, independientemente de la dosis. A pesar de la recaída de la parasitemia, los animales tratados con 6 mg/kg de BPQ mostraron una disminución notable (p < 0,05) en los niveles de IgG específicos de la proteína de superficie del piroplasma de T. orientalis major en comparación con los controles y los animales tratados con 2,5 mg/kg del fármaco.
Conclusión: La BPQ no demostró eficacia en la eliminación de la infección subclínica por T. orientalis Ikeda. Se justifican futuras investigaciones para explorar modalidades terapéuticas innovadoras que, en sinergia con las vacunas y los ensayos de diagnóstico, puedan facilitar el desarrollo de programas integrales destinados a controlar y erradicar este parásito.
1 Introducción
Theileria orientalis es un parásito hemoprotozoario transmitido por garrapatas que causa una enfermedad económicamente importante en el ganado a nivel mundial (1-4). Los estudios filogenéticos basados en la proteína de superficie del piroplasma principal (MPSP) de T. orientalis y los genes de ARNr de subunidades pequeñas han identificado 11 genotipos diferentes. Entre estos genotipos, Ikeda, Chitose y Buffeli son los más prevalentes en Japón, Australia y Nueva Zelanda (1, 5, 6). Se ha demostrado que la infección por el genotipo Ikeda, también conocido como genotipo 2, generalmente se asocia con una enfermedad clínica caracterizada por anemia hemolítica, fiebre, ictericia, postración, aborto y muerte (7–9). Recientemente se han notificado brotes de T. orientalis causados por Ikeda en los Estados Unidos, lo que supone una grave amenaza para la industria ganadera del país (3). Los brotes de Ikeda en Estados Unidos han coincidido con la aparición de la garrapata Haemaphysalis longicornis en el país. H. longicornis es el principal vector de la transmisión de T. orientalis en todo el mundo (10), y nuestro grupo demostró recientemente la competencia de esta especie de garrapata como vector biológico en la transmisión del genotipo T. orientalis Ikeda, aislado en EE. UU. (11).
A diferencia de Theileria parva y Theileria annulata, los agentes causantes de la fiebre de la Costa Oriental y la teileriosis tropical, respectivamente, la reproducción asexual de los esquizontes de T. orientalis en leucocitos del huésped mamífero no induce la proliferación celular descontrolada (1, 12, 13). En este sentido, T. orientalis es similar a Theileria equi, una especie de Theileria no transformante y uno de los parásitos responsables de la piroplasmosis equina (14, 15). La enfermedad clínica causada por T. orientalis Ikeda se asocia con la replicación asexual de los estadios de merozoíto/piroplasma del parásito en los glóbulos rojos del huésped, lo que provoca anemia hemolítica y disminución del volumen de células empaquetadas (PCV) (1). Aunque la infección por T. orientalis Ikeda a menudo causa anemia leve, la enfermedad puede volverse grave y, en ocasiones, mortal debido a las coininfecciones y el estrés asociados con el manejo de los animales (16, 17). A pesar de los síntomas clínicos leves asociados con la infección aguda por T. orientalis Ikeda, se han reportado pérdidas significativas en la producción en animales infectados (1, 18–21). Teniendo en cuenta todos estos factores, se necesitan urgentemente medidas de control efectivas contra T. orientalis Ikeda.
En general, el control de los hemoparásitos transmitidos por garrapatas se basa en estrategias para disminuir la infestación de garrapatas y en el uso de vacunas y terapias antiparasitarias. El uso de acaricidas es insostenible, ya que puede seleccionar poblaciones de garrapatas resistentes y causar toxicidad para los animales y el medio ambiente (22). Actualmente no se dispone de vacunas ni terapias para el control de T. orientalis. En conjunto, estas brechas representan una seria amenaza para la industria ganadera en las áreas afectadas, particularmente en países como los EE. UU., donde el parásito está emergiendo y refleja la distribución de su principal vector de garrapatas, H. longicornis (3). Por lo tanto, el desarrollo de vacunas y la identificación de terapias efectivas contra T. orientalis Ikeda son esenciales para el control del parásito y su posterior erradicación.
La buparvacuona (BPQ) es un fármaco antiprotozoario de hidroxinaftoquinona, como la parvacuona y la atovacuona, desarrollado originalmente para controlar las especies de Plasmodium, que tiene un efecto de amplio espectro contra los parásitos apicomplejos (23, 24). El fármaco se ha utilizado ampliamente, en la dosis indicada en la etiqueta de 2,5 mg/kg, para controlar T. annulata y T. parva. La administración de BPQ reduce eficazmente la carga de T. annulata y T. parva durante la infección aguda, lo que permite que el ganado infectado gane tiempo para montar una respuesta inmunitaria protectora y sobrevivir a la enfermedad aguda (23, 25-28). También se ha demostrado que la BPQ es efectiva contra T. orientalis si el tratamiento se implementa durante las primeras etapas de la infección (29, 30). Sin embargo, aún se desconocen pruebas concluyentes de la eficacia de la BPQ, utilizada en la etiqueta y en dosis más altas, para eliminar T. orientalis Ikeda en bovinos con infección crónica. Por lo tanto, este estudio tuvo como objetivo evaluar la eficacia de BPQ en el aclaramiento de T. orientalis Ikeda, cepa de EE. UU., en bovinos infectados subclínicamente. Los resultados demuestran que la BPQ tiene un efecto teilericida sobre Ikeda; Sin embargo, se observó recaída de la parasitemia en la sangre periférica de todos los animales de experimentación. En este estudio también se evaluaron los datos sobre la farmacocinética de la BPQ, así como el efecto del fármaco sobre el recuento de células sanguíneas y la química, y la serología de T. orientalis MPSP.
2 Materiales y métodos
2.1 Ganado vacuno
En este estudio se utilizaron un total de 12 terneros cruzados Jersey-Charolais con el bazo intacto, de 6 a 12 meses de edad. Todos los procedimientos de estudio en animales descritos en esta investigación fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Washington (IACUC # 6981).
2.2 Infección subclínica de Theileria orientalis Ikeda, aislado en EE. UU., en bovinos
Los terneros fueron inoculados con estabilizador sanguíneo o con glándula salival (SG) de H. longicornis infectada con T. orientalis Ikeda, aislado de EE. UU. La estabilización de la sangre se produjo como se describió anteriormente (11). La producción de SG stabilate se realizó siguiendo un protocolo similar al descrito previamente para T. parva (31). La carga parasitaria en sangre y SG estabilizada se evaluó mediante qPCR, como se describe a continuación, y osciló entre 5,5×106 y 3,8×105 parásitos por mL, respectivamente. Los animales fueron inoculados por vía intravenosa con estabilizado sanguíneo (5-10 mL de inóculo) o subcutáneamente con estabilizado SG (1 mL de inóculo). Después de la infección, los animales fueron monitoreados para detectar alteraciones en la temperatura, PCV, número de leucocitos en sangre y glóbulos rojos. Para este estudio, la infección subclínica de T. orientalis Ikeda, aislado en EE. UU., se definió por la presencia de ADN del parásito en sangre periférica con la ausencia concomitante de fiebre y anemia.
2.3 Detección de ADN de Theileria orientalis Ikeda en sangre periférica bovina
La detección y cuantificación del ADN de T. orientalis Ikeda en sangre periférica de terneros infectados se realizó mediante PCR de punto final y PCR cuantitativa en tiempo real (qPCR), respectivamente, dirigidas al gen MPSP (AP011946.1). El ADN genómico (ADNg) se extrajo de 100 uL de sangre entera que contenía EDTA de los animales infectados utilizando el QIAamp DNA Mini Kit (Qiagen), de acuerdo con el protocolo del fabricante. Se realizaron las siguientes modificaciones menores: las muestras se incubaron en tampón de lisis y proteinasa K durante 30 min a 56 °C; y la elución se realizó con 50 uL de AE tampón precalentado (56 °C) y se repitió hasta un volumen de extracción final de 100 uL. T. orientalis se detectó en el ADN de la sangre total mediante PCR de punto final dirigida a un segmento de 776 pb del gen MPSP utilizando cebadores específicos (forward 5’ctttgcctaggatacttcct 3′ y reverse 5′ acggcaagtggtgagaact 3′) (3, 11). Las reacciones consistieron en 22,5 uL de Accuprime Pfx Supermix (Thermo Fisher Scientific, Waltham, MA, EE. UU.), 140 nM de concentración final de cada cebador y 2 uL de plantilla de ADN. La amplificación se llevó a cabo en el termociclador C1000 (Bio-Rad, Hercules, CA, USA) con una desnaturalización inicial de 95°C durante 5 min y 35 ciclos de 95°C durante 15 s, 57°C durante 15 s y 68°C durante 1 min. Los amplicones se visualizaron mediante electroforesis en gel de agarosa. Se llevó a cabo la secuenciación del ADN de los productos de PCR para la confirmación del amplicón. La qPCR se realizó en ADNg extraído de la sangre total como se describió anteriormente, dirigiéndose a una porción de 113 pb del gen MPSP de T. orientalis Ikeda. Las reacciones consistieron en 1x SsoFast Evagreen™ Supermix (Bio-Rad), una concentración final de 200 nM de cebadores específicos (5′ ccttcggactacaagcctc 3′ y 5′ tgtgagactcaatgcgccta 3′) y 2 uL de ADN plantilla. El amplicón de T. orientalis se clonó en pCR™4Blunt-TOPO™ (Thermo Fisher Scientific) para construir una curva estándar utilizando diluciones seriadas de 10 veces (10,6 a 101) de ADN plasmídico para su cuantificación absoluta. La qPCR se realizó utilizando el sistema de PCR en tiempo real CFX Opus (Bio-Rad) con una desnaturalización inicial de 98 °C durante 2 min, seguida de 40 ciclos de 95 °C durante 5 s y 58 °C durante 5 s. Se realizaron análisis de la eficiencia de la amplificación y de la curva de fusión para evaluar la sensibilidad analítica y la especificidad, respectivamente, de la qPCR MPSP. La cuantificación se informó como el número de copias de MPSP por 1 μL de sangre.
2.4 Tratamiento BPQ
En este estudio se utilizó BPQ (Buparvex Injection, Biomeda Inc., Dublín, Irlanda). El fármaco se administró por vía intramuscular (IM), siguiendo las recomendaciones del fabricante. Doce terneros infectados subclínicamente con T. orientalis se distribuyeron aleatoriamente en tres grupos. En el grupo 1, seis terneros fueron tratados con la dosis recomendada de BPQ en la etiqueta de 2,5 mg/kg. En el grupo 2, tres terneros fueron tratados con 6 mg/kg de BPQ. En los grupos 1 y 2, el tratamiento con BPQ ocurrió aproximadamente a las 6-8 semanas después de la infección por T. orientalis (fase subclínica de la infección) con dos inyecciones, con 48 h de diferencia. El grupo 3 (tres terneros) permaneció sin tratamiento y sirvió como control.
2.5 Método analítico para la farmacocinética de BPQ
La evaluación de la concentración de BPQ en muestras de suero se realizó mediante análisis farmacocinético en dos y tres terneros tratados con 2,5 mg/kg o 6 mg/kg, respectivamente. Brevemente, el análisis de suero de BPQ se llevó a cabo utilizando el método de cromatografía líquida de alta resolución en fase reversa, como se describió anteriormente (32, 33). El análisis se realizó con un módulo de 2.695 separaciones y un detector de absorbancia UV de 2.487 (Waters, Milford, MA, USA). Para la separación se utilizó una columna XBridge C18 (4,6 × 100 mm, 3,5 μm). Se utilizó acetato de amonio (0,02 M, pH 3,6) y acetonitrilo como fase móvil. La absorbancia se midió a 251 nm y el caudal fue de 1 mL/min. Las muestras que se congelaron previamente se descongelaron a temperatura ambiente, se mezclaron y se transfirieron 100 μL de suero a un tubo de rosca de 13 × 100 mm, seguido de 15 μL de lovastatina (estándar interno, 100 μg/mL) y 1 mL de éter. La mezcla se agitó en vórtice durante 60 s y luego se centrifugó durante 20 min a 1000 xg. La capa orgánica se transfirió a un tubo de vidrio y se evaporó hasta la sequedad con gas nitrógeno. Las muestras se reconstituyeron en 250 μL de fase móvil y se analizaron 100 μL. Se preparó una curva estándar típica para el análisis fortificando suero combinado sin tratar con BPQ, que produjo un rango de concentración lineal de 0,025 a 100 μg/mL. La recuperación promedio tanto para BPQ como para el estándar interno fue del 100%. La variabilidad intra e interensayo osciló entre 1,5 y 8,8%, y el límite inferior de cuantificación fue de 0,01 μg/mL.
2.6 Análisis hematológico
El hemograma celular se evaluó con el analizador de hematología ProCyte One™ (IDEXX Laboratories, Inc., Westbrook, ME, EE. UU.), siguiendo el protocolo del fabricante. La sangre periférica se recolectó en tubos Vacutainer® que contenían EDTA (BD Company, Franklin Lakes, NJ, EE. UU.) en varios puntos de tiempo después del tratamiento con BPQ. Después de la recolección, las muestras de sangre total se homogeneizaron durante 5 min y se midió el número de leucocitos, linfocitos, monocitos, neutrófilos y glóbulos rojos totales. Las poblaciones de glóbulos blancos se contaron como 1.000 células/mL de sangre, y los glóbulos rojos se contaron como 1.000.000 de células/mL de sangre. La química sanguínea se evaluó utilizando el analizador de química sanguínea veterinaria Catalyst One (IDEXX Laboratories), siguiendo el protocolo del fabricante. En el panel químico se analizaron los siguientes parámetros: glucosa, creatinina, nitrógeno ureico en sangre (BUN), relación BUN-creatinina, fósforo, calcio, proteína total, albúmina, globulina, relación albúmina-globulina, alanina transaminasa (ALT), fosfatasa alcalina (ALP), gamma-glutamil transferasa (GGT), bilirrubina total y colesterol. Se utilizó el software IDEXX VetConnect PLUS (IDEXX Laboratories) para la visualización de los datos del ProCyte DX™ y del analizador de química sanguínea veterinaria Catalyst One.
2.7 MPSP ELISA
El nivel de anticuerpos contra el MPSP de T. orientalis Ikeda en terneros tratados con BPQ y control se evaluó mediante ELISA indirecto (iELISA), utilizando MPSP recombinante (recMPSP) como antígeno. En resumen, para la producción de antígenos, el gen MPSP (AP011946.1) de T. orientalis Ikeda fue un codón optimizado para su expresión en células procariotas, sintetizado como un gen de fusión de etiquetas 6-His y clonado en pET30a (GenScript, Piscataway, NJ, EE. UU.). Escherichia coli BL21 Star™ (DE3) (GenScript) se transformaron con el plásmido recombinante y se seleccionaron en medio LB que contenía kanamicina (50 ug/ml). El cultivo se incubó a 37 °C a 200 rpm, y una vez que la densidad celular alcanzó OD = 0,6-0,8 a 600 nm, se añadieron 0,5 mM de IPTG para inducir la expresión. La expresión de proteínas se monitorizó mediante inmunotransferencia utilizando un anticuerpo monoclonal anti-6-His tag (GenScript). La proteína recombinante se purificó mediante columna de níquel, utilizando protocolos estándar. Las muestras de suero de animales de experimentación se obtuvieron mediante protocolos estándar en varios momentos después del tratamiento con BPQ. Para el MPSP iELISA, se recubrieron placas de microtitulación Immulon™ 2HB de 96 pocillos (Thermo Fisher Scientific) durante la noche a 4 °C con 50 μL de recMPSP (2 μg/mL) en tampón de recubrimiento 1× (BioLegend, San Diego, CA, EE. UU.). Después de eso, se eliminó el exceso de antígeno y las placas se bloquearon con 200 μL/pocillo de caseína bloqueante™ en PBS (Thermo Fisher Scientific) a temperatura ambiente (RT) durante 1 h. Después de la etapa de bloqueo, las muestras de suero se diluyeron 1/50 en Tween-20 al 0,05% (v/v) en PBS (PBS-T) y se agregaron 50 μL para duplicar pocillos individuales. Las placas se incubaron en RT durante 1 h y, después de tres lavados en PBS-T, se añadieron 50 μL de una dilución 1/1000 de anticuerpos secundarios marcados con peroxidasa IgG antibovina (SeraCare, Milford, MA, EE. UU.) a pocillos individuales. A continuación, las placas se incubaron en RT durante 1 h. Después de eso, las placas se lavaron tres veces en PBS-T, dos veces en PBS y se desarrollaron con 55 μL de solución de sustrato Ultra TMB-ELISA de 1 paso™ (Thermo Fisher Scientific). Después de 10 minutos de incubación en la oscuridad, la reacción enzimática se detuvo añadiendo 55 μL de TMB Stop Solution (0,2 M H2SO4) (SeraCare) a cada pocillo. Las placas se leyeron a una densidad óptica (OD) de 450 nm utilizando el lector de placas Synergy HTX ELISA (BioTek, Winooski, VT, EE. UU.). Los resultados se presentan como el promedio de los valores de OD 450 nm. El punto de corte se determinó mediante el promedio de muestras negativas (sueros de bovinos no infectados; n = 10) más tres desviaciones estándar.
2.8 Análisis estadístico
Las comparaciones de la temperatura, el número de glóbulos rojos y leucocitos, los valores de PCV, los valores de química sanguínea y los niveles de IgG anti-MPSP entre los animales tratados con BPQ y los controles se realizaron mediante la prueba de Mann-Whitney, y se consideró un valor de p <0,05 estadísticamente significativo. Para todos los análisis estadísticos se utilizó el software GraphPad Prism versión 9 (GraphPad Software, San Diego, CA). Para el análisis farmacocinético, el área bajo el perfil de concentración sérica versus tiempo (AUC) de BPQ se calculó utilizando la regla trapezoidal, como se describió anteriormente (34). Se evaluó la proporcionalidad de la dosis para ambos niveles de dosis calculando el AUC normalizado por dosis de 0 a 48 h después de la primera administración del fármaco (AUC0-48 h) y de 0 a 168 h (después de la segunda administración del fármaco) (AUC0-168 h) y el pico de concentración del fármaco (Cmax) (Cmax/dosis) (35).
3 Resultados
3.1 La BPQ tiene un efecto teilericida transitorio contra Theileria orientalis Ikeda, aislado de EE. UU., en terneros infectados subclínicamente
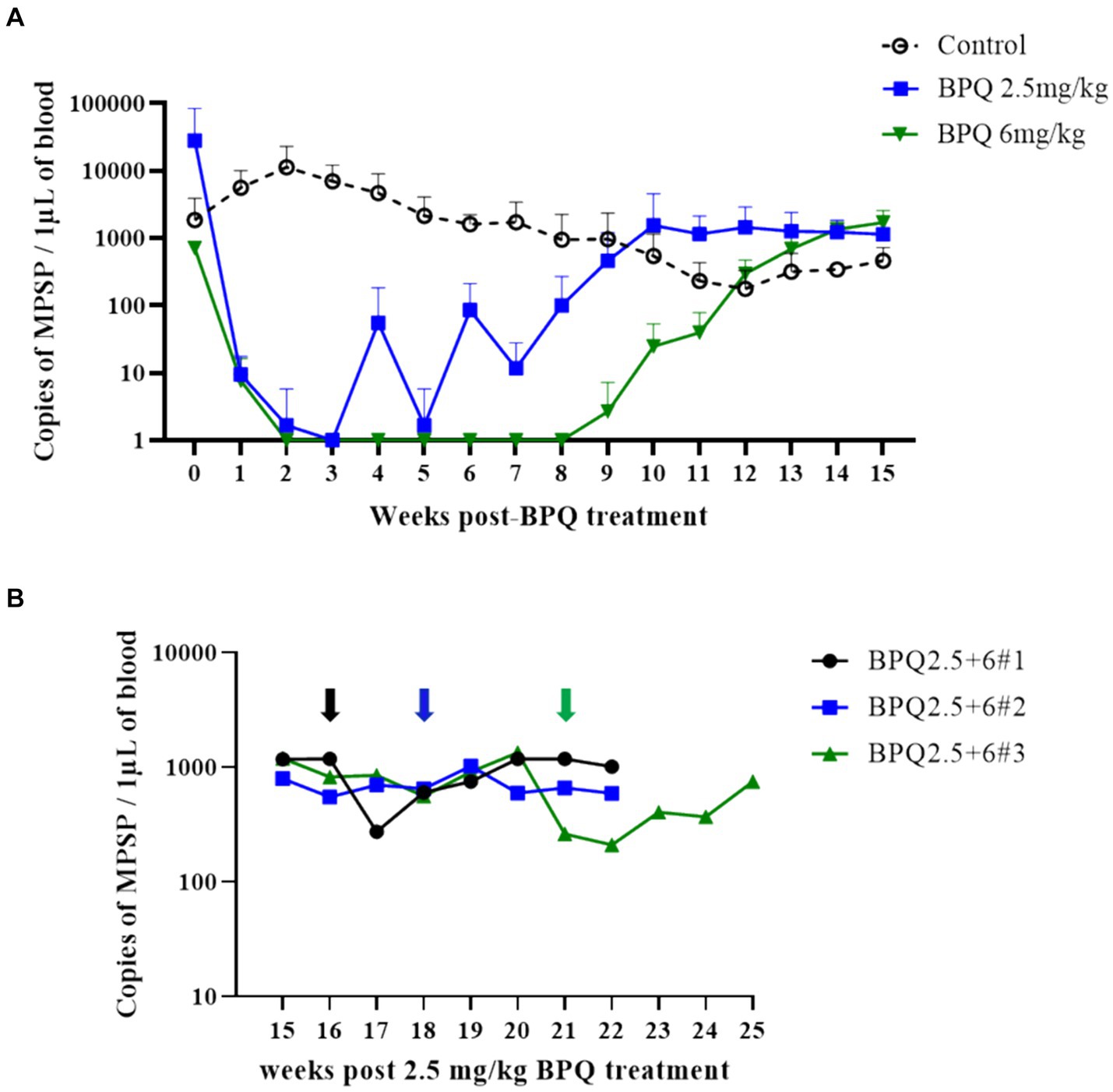
Para evaluar el efecto de BPQ sobre la parasitemia del genotipo de T. orientalis Ikeda, aislado de EE. UU., en bovinos infectados subclínicamente, los animales fueron tratados con 2,5 mg/kg o 6 mg/kg del fármaco, y la carga parasitaria después del tratamiento se monitorizó mediante PCR de punto final y qPCR. Los resultados de la PCR de punto final demostraron que T. orientalis era indetectable en la sangre periférica de los terneros que recibieron 2,5 mg/kg de BPQ entre 3 y 8 semanas después del tratamiento. Después de ese período, el parásito se detectó de manera consistente (Tabla 1). Teniendo en cuenta el resurgimiento de parásitos en estos animales tratados, se realizó una segunda ronda de dos tratamientos con un intervalo de 48 h y que comprendieron 6 mg/kg de BPQ. Curiosamente, los datos de PCR mostraron que este segundo tratamiento de dosis más alta no tuvo ningún efecto sobre el parásito, que se detectó continuamente en la sangre de los animales retratados (Tabla 1). Los resultados de la PCR de punto final demostraron niveles indetectables de parásito en la sangre periférica de los animales que recibieron 6 mg/kg de BPQ durante 9 a 11 semanas después del tratamiento (Tabla 1). Sin embargo, también se observó recrudescencia del parásito en este grupo tratado con dosis altas de BPQ (Tabla 1). T. orientalis El ADN se detectó de forma continua mediante PCR de punto final en los terneros control no tratados durante todo el experimento (20 semanas) (Tabla 1). Los resultados de la qPCR demostraron una disminución de >100 veces en la carga parasitaria en la semana 1 después del tratamiento en los grupos de tratamiento de 2,5 mg/kg y 6 mg/kg (Figura 1A). La carga parasitaria cayó por debajo de los niveles detectables o se detectó marginalmente por qPCR en ambos grupos de tratamiento dos semanas después de la administración de BPQ. Se observó una recaída inicial del parásito (aprox. 100 parásitos/1 μL de sangre) en los animales tratados con 2,5 mg/kg entre 4 y 6 semanas después del tratamiento con BPQ. A continuación, se detectaron parásitos de forma sistemática en este grupo de animales a lo largo del experimento. Curiosamente, no se detectaron parásitos cuantificables entre las semanas 2 y 8 en los animales tratados con 6 mg/kg del fármaco. Sin embargo, la recaída del parásito en estos animales se observó inicialmente mediante qPCR 9 semanas después del tratamiento, después de lo cual se detectaron de manera consistente durante todo el experimento (Figura 1A). El pico de recrudescencia del parásito (>1.000 parásitos/1 μL de sangre) en los animales que recibieron 2,5 mg/kg o 6 mg/kg se produjo en las semanas 10 y 15, respectivamente (Figura 1A). Para abordar el efecto de la dosis y el retratamiento sobre la carga parasitaria, realizamos qPCR en muestras de sangre de los tres terneros que fueron retratados con 6 mg/kg de BPQ después del tratamiento inicial con 2,5 mg/kg del fármaco. Curiosamente, la segunda ronda de tratamiento con una dosis más alta de BPQ no tuvo ningún efecto observable sobre el nivel de parásitos en sangre periférica de los animales tratados previamente, lo que confirma los datos de PCR del punto final (Tabla 1; Figura 1B). En conjunto, los resultados demostraron que la BPQ tuvo un efecto transitorio sobre la carga de T. orientalis Ikeda, aislado de EE. UU., en terneros infectados subclínicamente (Tabla 1; Figura 1). Se observó recrudescimiento del parásito en todos los animales de experimentación, y la administración de 6 mg/kg a los animales que habían recibido previamente la dosis de BPQ en la etiqueta no disminuyó significativamente la carga de T. orientalis en sangre periférica. Además, no se observaron diferencias significativas en la carga parasitaria después de la recrudescencia al comparar los terneros tratados con BPQ y los controles (Figura 1).
3.2 La recaída de Theileria orientalis Ikeda, aislado de EE. UU., en bovinos tratados con BPQ se asocia con un aumento de la temperatura y una disminución de los glóbulos rojos y el PCV
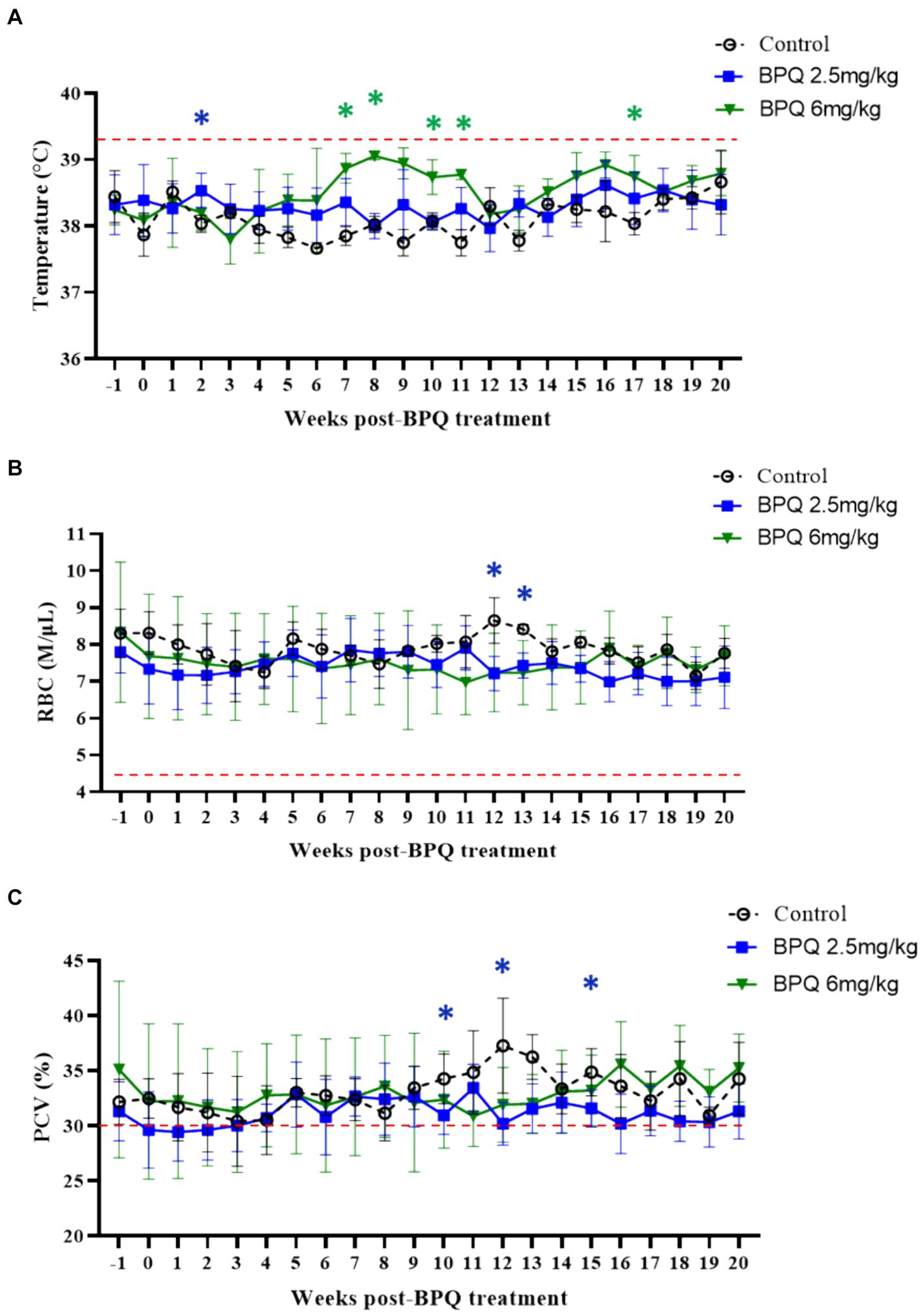
A continuación, examinamos la temperatura, el número de glóbulos rojos, el PCV y el número de leucocitos en sangre durante el tratamiento seguido de una recaída del parásito. A pesar de la presencia de ADN de T. orientalis Ikeda en la sangre periférica de todos los terneros utilizados en este experimento en el tratamiento inicial con BPQ, los animales no presentaron fiebre ni alteraciones en el número de glóbulos rojos y PCV (Figura 2). Estos resultados proporcionan evidencia de que los terneros experimentales se encontraban en la fase subclínica de la infección durante el tratamiento farmacológico. Aunque técnicamente no se consideró fiebre (≥39,4 °C), los datos mostraron un aumento significativo (p < 0,05) de la temperatura en los animales que recibieron 2,5 mg/kg de BPQ dos semanas después del tratamiento inicial. Del mismo modo, los animales tratados con 6 mg/kg de BPQ mostraron una elevación significativa (p < 0,05) de la temperatura entre 6 y 11 semanas después del tratamiento (Figura 2A). Curiosamente, en ambos grupos experimentales, el aumento de la temperatura precedió a la recaída de parásitos en sangre periférica (Tabla 1; Figura 1A). También se observó una disminución significativa (p < 0,05) en el número de glóbulos rojos en los terneros tratados con 2,5 mg/kg de BPQ a las 12 y 13 semanas después del tratamiento (Figura 2B). No se detectaron alteraciones significativas en los glóbulos rojos en los animales tratados con 6 mg/kg de BPQ. Se observaron descensos significativos (p < 0,05) de PCV en las semanas 10, 12 y 16 post-tratamiento con BPQ en animales que recibieron 2,5 mg/kg del fármaco (Figura 2C). Por el contrario, no se detectaron alteraciones significativas en los glóbulos rojos en los animales tratados con 6 mg/kg de BPQ. Además, no se observaron alteraciones significativas en el número de leucocitos, linfocitos, monocitos y neutrófilos totales en sangre periférica de los animales infectados subclínicamente por T. orientalis tratados con BPQ (Tabla suplementaria S1). Estos resultados demostraron que la recaída de T. orientalis Ikeda, aislado de EE. UU., después del tratamiento con BPQ ocurre concomitantemente con un aumento leve pero significativo de la temperatura y una disminución de los glóbulos rojos y el PCV en bovinos infectados subclínicamente.
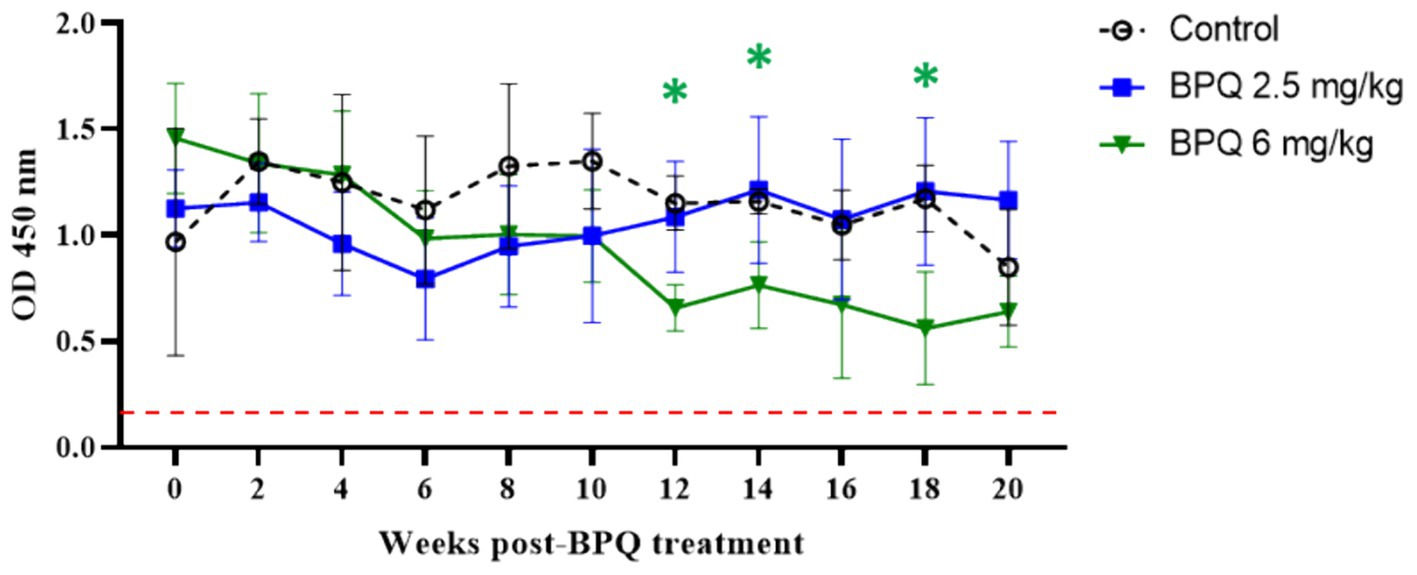
3.3 Efecto del tratamiento con BPQ en la respuesta de anticuerpos frente a Theileria orientalis Ikeda MPSP
Después de mostrar un efecto parasiticida robusto, pero transitorio, de BPQ contra T. orientalis Ikeda en bovinos infectados subclínicamente, investigamos si la reducción de la carga parasitaria inducida por el tratamiento farmacológico tenía algún impacto en el nivel de anticuerpos contra T. orientalis MPSP. No se observaron diferencias significativas entre los animales que recibieron 2,5 mg/kg del fármaco y el grupo control, a pesar de la tendencia a la disminución de los niveles de anticuerpos MPSP alrededor del día 6 después del tratamiento (Figura 3). Por el contrario, los datos indicaron una disminución significativa (p < 0,05) en los niveles de IgG anti-MPSP a las 12, 14 y 16 semanas después del tratamiento con BPQ en los animales que recibieron 6 mg/kg del fármaco en comparación con los controles (Figura 3). Independientemente de las fluctuaciones de los anticuerpos anti-MPSP, todos los terneros, incluidos los tratados con BPQ y los animales de control, mostraron niveles significativos de IgG anti-MPSP durante todo el experimento. En conjunto, a pesar del efecto teilericida transitorio del tratamiento con BPQ en bovinos infectados, que resultó en niveles indetectables de parásitos en sangre periférica y una disminución significativa en los niveles de MPSP anti-IgG en animales tratados con 6 mg/kg del medicamento, todos los animales en este experimento fueron consistentemente positivos para la serología de MPSP durante todo el estudio (Figura 3).
3.4 Farmacocinética y análisis químico de la sangre de BPQ
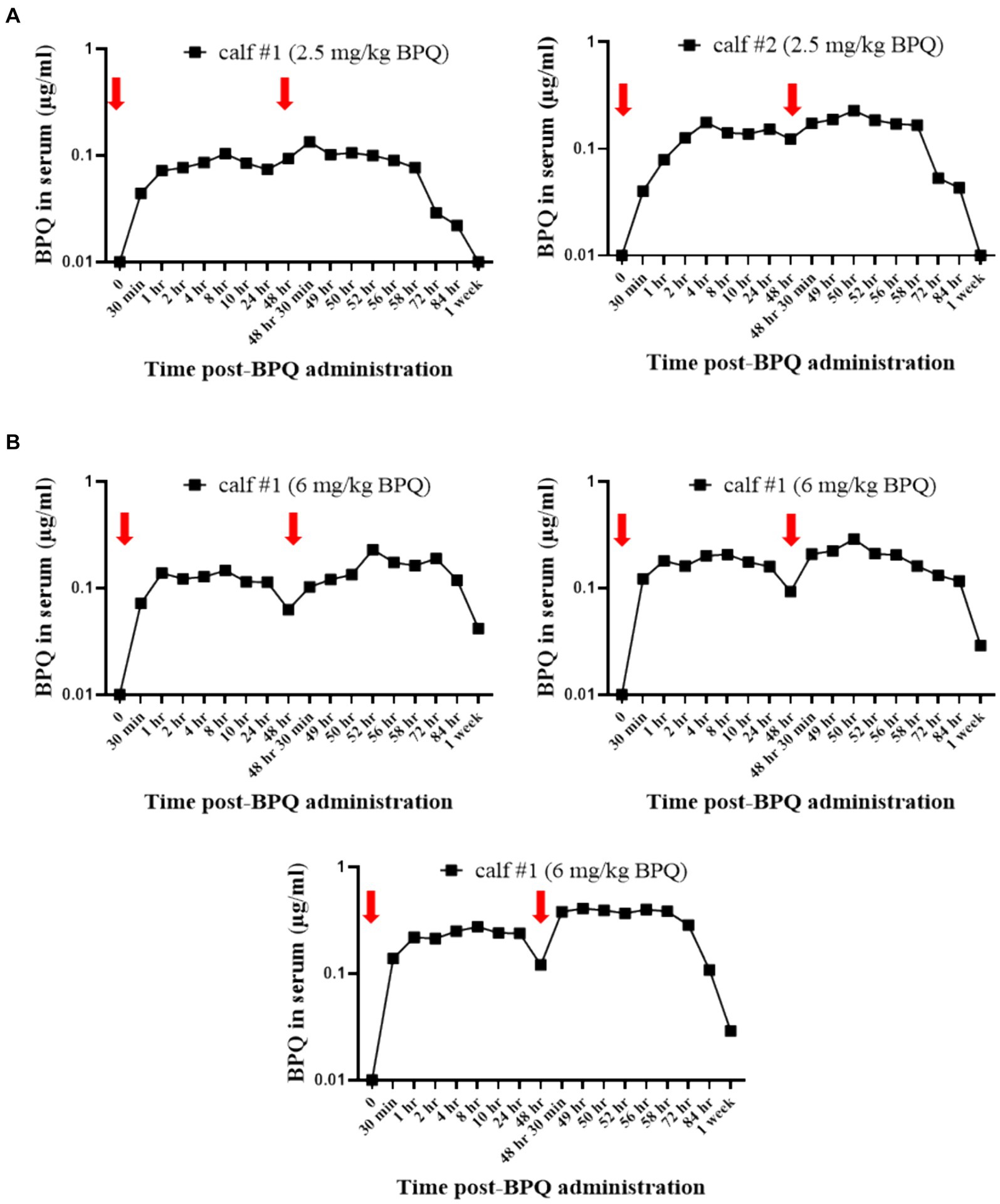
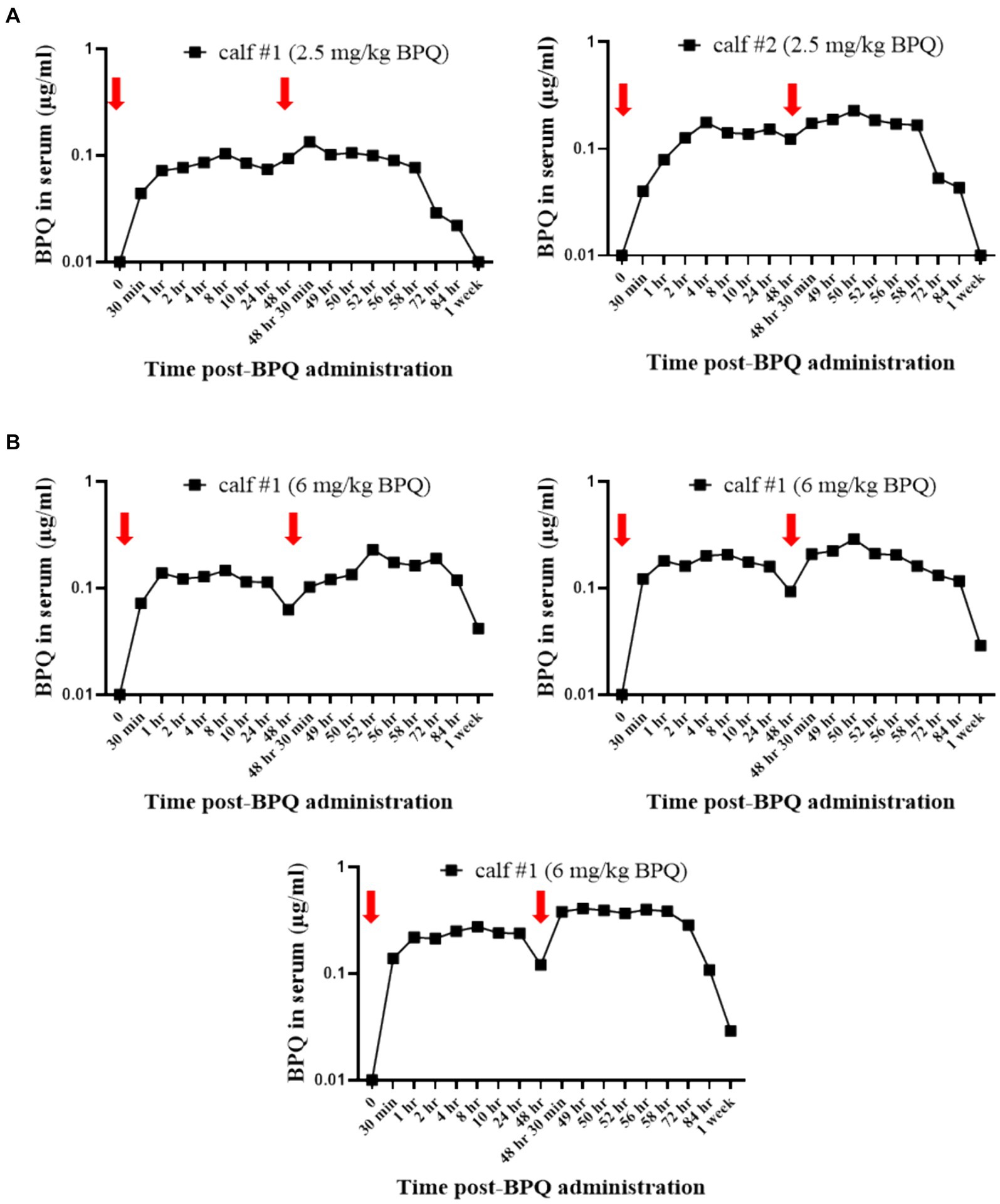
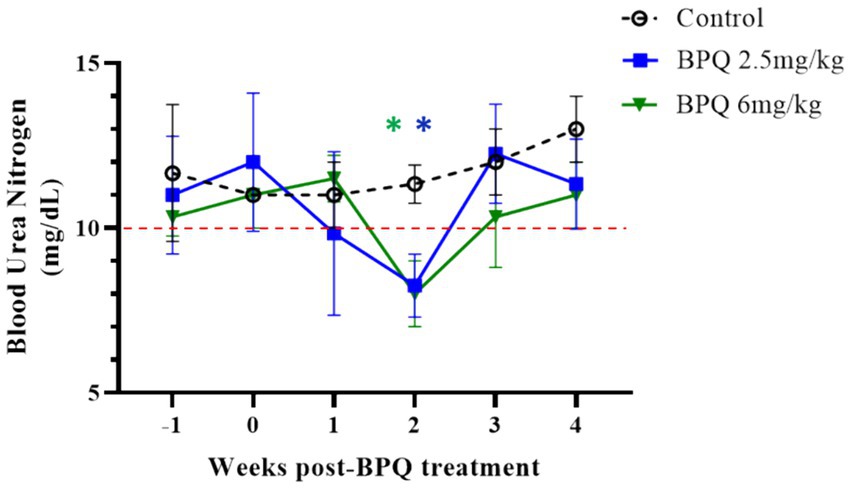
Teniendo en cuenta el efecto de la BPQ en la parasitemia de T. orientalis Ikeda en bovinos infectados subclínicamente, fue de interés investigar la cinética del fármaco después de la administración IM de 2,5 mg/kg o 6 mg/kg (Figura 4). Los resultados del análisis farmacocinético mostraron que la BPQ se detectó en muestras de suero tan pronto como 30 minutos después de la primera administración del fármaco, con niveles medios de 0,040 (±0) μg/mL y 0,112 (±0,034) μg/mL en terneros que recibieron 2,5 mg/kg o 6 mg/kg, respectivamente. Las concentraciones máximas se observaron entre 1 y 8 h después de la administración del fármaco. El perfil de concentración versus tiempo reveló que una vez alcanzada la concentración sérica máxima, la concentración del fármaco se mantuvo durante aproximadamente 48 h, momento en el que comenzó a disminuir. Después de la primera dosis, el AUC0-48 h osciló entre 4 y 6,7 μg *h/mL y 7,5 a 16 μg*h/mL para los grupos de dosis de 2,5 mg/kg y 6 mg/kg, respectivamente. Después de la segunda dosis, el AUC0-168 h osciló entre 3,9 y 7,4 μg*h/mL y 5,1 a 21 μg*h/mL para los grupos de dosis de 2,5 mg/kg y 6 mg/kg, respectivamente. La Cmax después de la primera y segunda dosis osciló entre 0,11 y 0,13 μg/mL y entre 0,17 y 0,22 μg/mL para el grupo de dosis de 2,5 mg/kg. La Cmax después de la primera y segunda dosis osciló entre 0,21 y 0,27 μg/mL y 0,13 a 0,39 μg/mL para el grupo de dosis de 6 mg/Kg, respectivamente. Se observó una tendencia a concentraciones más altas en los animales que recibieron 6 mg/kg a partir de las 2 h después de la primera administración en comparación con los administrados con 2,5 mg/kg. Sin embargo, no se realizó ningún análisis estadístico considerando que solo se examinaron dos y tres animales tratados con 2,5 mg/kg o 6 mg/Kg BPQ, respectivamente. La media (AUC0-48 h /6 mg/kg)/(AUC0-48 h /2,5 mg/kg) fue de 0,59. La media (AUC0-168 h/6 mg/kg)/(AUC0-168 h/2,5 mg/kg) fue de 1,31 μg/mL. La media (Cmax/6 mg/kg)/(Cmax/2,5 mg/kg) fue de 1,48 y 1,43 μg/mL después de la primera y segunda dosis, respectivamente. Teniendo en cuenta que 6 mg/kg corresponde a 2,4 veces más compuesto que 2,5 mg/kg, los resultados sugieren una desviación de la proporcionalidad de la dosis (Figura 4). A continuación, examinamos un panel de metabolitos químicos en sangre periférica para investigar la posible toxicidad asociada con la administración de BPQ. Los niveles de BUN disminuyeron significativamente (p < 0,05) en los animales que recibieron 2,5 mg/kg o 6 mg/kg de BPQ dos semanas después de la administración del fármaco en comparación con los animales control (Figura 5). De hecho, los niveles de BUN a las 2 semanas después del tratamiento con BPQ fueron inferiores al intervalo de referencia normal. Por el contrario, considerando los animales tratados con BPQ y los controles, no se observaron alteraciones significativas en los niveles de glucosa, creatinina, relación BUN-creatinina, fósforo, calcio, proteína total, albúmina, globulina, relación albúmina-globulina, ALT, ALP, bilirrubina total y colesterol (datos no mostrados). En conjunto, los datos demostraron que la administración IM de BPQ resultó en una liberación lenta del fármaco a la sangre periférica de los terneros, con una tendencia a concentraciones más altas en el suero de los animales que recibieron 6 mg/kg que los terneros tratados con 2,5 mg/kg. Además, los niveles de BUN mostraron una disminución significativa pero reversible en todos los animales tratados, independientemente de la dosis del fármaco (Figuras 4, 5).
4 Discusión
La disponibilidad de terapias que sean capaces de eliminar la infección en huéspedes mamíferos infectados subclínicamente es fundamental para el control y la erradicación de enfermedades infecciosas transmitidas por artrópodos, como la malaria, la babesiosis y la teileriosis. T. orientalis es un parásito apicomplejo transmitido por garrapatas de importancia económica que plantea desafíos significativos para la industria ganadera en varios países (1-4). La infección por el genotipo Ikeda de T. orientalis generalmente se asocia con el desarrollo de fiebre y anemia durante la fase inicial de la replicación del parásito, y esto puede tener un impacto tanto a corto como a largo plazo en la producción animal (18). El genotipo Ikeda es endémico en Japón, Australia y Nueva Zelanda, y actualmente se considera un parásito emergente transmitido por garrapatas en los Estados Unidos (3). La ausencia de vacunas y tratamientos eficaces contra T. orientalis Ikeda plantea amenazas adicionales para la industria ganadera, y esto es especialmente preocupante en áreas donde el parásito ha surgido recientemente, como los Estados Unidos, y aún no se ha establecido un equilibrio endémico. En la actualidad, no hay medicamentos registrados para tratar al ganado infectado con T. orientalis Ikeda en los Estados Unidos, y solo hay terapia de apoyo disponible. Por lo tanto, el objetivo de este estudio fue evaluar la eficacia de BPQ, como monoterapéutico, para eliminar el parásito en bovinos infectados subclínicamente con T. orientalis Ikeda, aislado de EE. UU. Nuestros resultados generales demostraron que BPQ tiene un fuerte efecto teilericida contra el parásito. Al evaluar la dosis de 2,5 mg/kg en la etiqueta y una dosis mayor de 6 mg/kg, demostramos que la carga parasitaria disminuyó a niveles indetectables o marginales ya 1 semana después de iniciar el tratamiento, lo que corrobora una observación previa (36). Los enfoques de punto final y qPCR demostraron que el parásito permaneció indetectable hasta 4 y 11 semanas después del tratamiento con 2,5 mg/kg y 6 mg/kg del fármaco, respectivamente. Después de ese período, se observó una recaída del parásito en todos los animales tratados, lo que indica que, a pesar del notable efecto de BPQ en la reducción de la carga parasitaria, el fármaco no fue eficaz en la eliminación del aislado de T. orientalis Ikeda, en EE. UU., en bovinos infectados subclínicamente.
El genotipo de T. orientalis Ikeda es motivo de preocupación principal, ya que se asocia con brotes de enfermedad clínica e infección subclínica de portadores. Tras la infección por Ikeda, el ganado bovino desarrolla un pico de parasitemia que puede ir acompañado de fiebre, anemia hemolítica, PCV reducida, ictericia e incluso la muerte. Sin embargo, la mayoría de los animales superan esta fase aguda de la infección y se convierten en asintomáticos, portadores del parásito de por vida (1, 4, 37). Por lo tanto, la presencia de animales infectados subclínicamente es común en áreas endémicas (2, 4, 38). La reaparición de signos clínicos en bovinos infectados crónicamente puede ocurrir con recrudecimiento de la parasitemia debido al estrés asociado con el manejo del animal (1, 2, 39). Además, la presencia de animales infectados subclínicamente en áreas donde hay vectores de garrapatas T. orientalis, especialmente H. longicornis, representa un riesgo adicional de propagación de la enfermedad a los rebaños de ganado ingenuo (11). En este estudio, los animales se encontraban en la fase subclínica de la infección (aproximadamente 6 a 8 semanas después de la inoculación del parásito), como lo demuestra la ausencia de fiebre y anemia, y la presencia concomitante de parásitos en sangre periférica (7,1×102 a 2,8×104 parásitos por μL de sangre). En conjunto, los resultados del presente artículo concuerdan con los datos previos sobre los aspectos de cronicidad asociados a T. orientalis Ikeda (4). Curiosamente, demostramos una elevación de la temperatura y una disminución en el recuento de glóbulos rojos y PCV después de la recaída de la parasitemia en animales tratados con BPQ, lo que apoya la observación previa sobre el potencial recrudecimiento de la enfermedad clínica en animales infectados crónicamente (2). Además, los resultados aportan información relevante sobre el patrón de respuesta de anticuerpos contra el MPSP de T. orientalis Ikeda en bovinos infectados subclínicamente, que complementa estudios previos (40). Observamos una disminución significativa en los niveles de IgG anti-MPSP en los animales tratados con 6 mg/kg de BPQ, a pesar de la notable recaída del parásito. Investigar la correlación entre la carga parasitaria y la respuesta de anticuerpos a T. orientalis Ikeda MPSP estaba fuera del alcance de este estudio, por lo que se necesitan investigaciones adicionales. Por lo tanto, se necesitan más estudios para definir esta correlación y otros aspectos, como la utilidad de los ensayos serológicos basados en el MPSP de T. orientalis Ikeda para identificar bovinos con infección aguda y crónica.
Las hidroxinaftoquinas, como la atovacuona y la parvacuona, son compuestos derivados de las quinolonas que inhiben la cadena de transporte de electrones en las mitocondrias de los parásitos apicomplejos. Estos fármacos se desarrollaron originalmente como terapéuticos contra la malaria, y luego demostraron tener un amplio efecto contra numerosos parásitos protozoarios (23). Como una próxima generación de hidronaftoquina, BPQ ha demostrado ser varias veces más efectiva que la atovacuona y la parvacuona contra los parásitos Theileria, Eimeria y Plasmodium (23, 41). Por lo tanto, se recomienda el uso de BPQ en dosis más bajas que la atovacuona y la parvacuona para inducir resultados similares con toxicidad reducida (42). BPQ es actualmente el fármaco de elección para el control de especies linfoproliferativas de Theileria, como T. parva y T. annulata. Se ha demostrado que la administración de BPQ durante las primeras etapas de la infección por T. parva y T. annulata reduce significativamente los niveles de parasitemia, mitigando la linfoproliferación, lo que permite a los animales infectados montar una respuesta inmune protectora y sobrevivir a la infección aguda (41, 43-47). Los estudios también han demostrado que la BPQ es eficaz contra Theileria spp. no transformante (48-51). Los estudios de eficacia con BPQ en terneros esplenectomizados demostraron que el fármaco es eficaz contra el genotipo T. orientalis Ikeda (30). La administración de la dosis de 2,5 mg/kg en la etiqueta precozmente durante la infección aguda indujo una reducción significativa de la parasitemia por T. orientalis. De hecho, este estudio previo mostró que no se detectaron parásitos en los animales tratados con BPQ a los 6-7 días después de la administración del fármaco (30). Nuestros resultados respaldan estos datos previos, mostrando que la BPQ fue efectiva para reducir rápidamente la parasitemia a niveles indetectables en los animales tratados tan pronto como una semana después del tratamiento (50, 51). En este estudio, investigamos más a fondo si BPQ era capaz de eliminar T. orientalis Ikeda en bovinos infectados subclínicamente. A pesar del evidente efecto teilericida, la BPQ solo mostró una eficacia transitoria contra T. orientalis Ikeda y se observó una recaída del parásito en todos los animales tratados. Este resultado se observó independientemente de la dosis del fármaco. Por lo tanto, los resultados indican que BPQ no eliminó completamente los parásitos de los terneros infectados, a pesar de su efecto teilericida observable. Se administró una dosis de 6 mg/Kg en un intento de aumentar la eficacia y duración del fármaco en el que el parásito permanecía indetectable. Sin embargo, el incremento de la dosis de 2,5 a 6 mg/kg (2,4 veces) no se reflejó necesariamente en un mayor efecto teilericida.
Teniendo en cuenta que solo se evaluaron dos y tres animales tratados con 2,5 mg/kg o 6 mg/Kg de BPQ, respectivamente, no se realizó un análisis estadístico de los resultados farmacocinéticos; Sin embargo, los resultados mostraron patrones similares a los descritos anteriormente para la parvacuona y la atovacuona (52). En particular, los parámetros de proporcionalidad de la dosis revelaron que las concentraciones séricas aumentaron menos que proporcionalmente al incremento de la dosis, lo que explicaría por qué no hubo un aumento evidente en el efecto farmacológico cuando los animales recibieron dosis de 6 mg/kg. Las razones de la falta de proporcionalidad de la dosis de BPQ (2,5-6 mg/kg) no están claras, pero merecen ser estudiadas en un estudio farmacocinético más amplio y cuestionar el valor terapéutico de administrar 6 mg/kg sobre 2,5 mg/kg del fármaco. Teniendo en cuenta todo esto, aún no se ha determinado la eficacia de la BPQ combinada con terapias antiprotozoarias adicionales y regímenes de dosificación alternativos para eliminar T. orientalis Ikeda en bovinos infectados subclínicamente.
Los compuestos de hidronaftoquina se dirigen al gen del citocromo b (cytb) de los protozoos apicomplejos (24, 53, 54). Numerosos informes han demostrado que las mutaciones puntuales en el gen cytb están asociadas con la resistencia de los parásitos a las hidronaftoquinas (26, 27, 55-57). Teniendo en cuenta los datos aquí presentados, es razonable afirmar que el nivel del parásito estuvo por debajo del límite de detección de los ensayos moleculares utilizados en este estudio; Sin embargo, el tratamiento no fue 100% efectivo para eliminar la infección, independientemente de la dosis del fármaco. Proponemos al menos tres posibilidades para explicar estas observaciones. En primer lugar, existe una subpoblación menor de parásitos resistentes. En segundo lugar, los niveles del fármaco no eran lo suficientemente altos, o no persistían durante suficiente tiempo en la sangre, para eliminar todos los parásitos. En tercer lugar, una determinada subpoblación de parásitos era inaccesible al fármaco y, por lo tanto, no era atacada debido a su ubicación o secuestro en los órganos del animal. Se necesitan estudios adicionales para investigar estas hipótesis. Curiosamente, una dosis de 6 mg/kg no mostró ningún efecto sobre la parasitemia en animales que habían sido tratados previamente con la dosis de 2,5 mg/kg en la etiqueta BPQ. Esta falta de efecto sobre la parasitemia después del segundo tratamiento con una dosis más alta de BPQ sugiere la aparición de una subpoblación de parásitos que pueden haberse vuelto resistentes al fármaco. Se necesitan más investigaciones mecanicistas para examinar la posible selección in vivo de T. orientalis Ikeda después del tratamiento con BPQ.
El tratamiento con BPQ no tuvo ningún efecto sobre el número total de leucocitos, incluidos linfocitos, monocitos y neutrófilos, en sangre periférica, lo que coincide con observaciones previas (46). Curiosamente, en el presente estudio, los terneros tratados con una dosis de 2,5 mg/kg en la etiqueta o 6 mg/kg de BPQ mostraron una disminución significativa en el BUN dos semanas después del tratamiento. A pesar de que el efecto sobre el BUN fue reversible y ocurrió sin alteraciones en ALT, ALP y GGT, se puede considerar una posible insuficiencia hepática asociada con el tratamiento con BPQ, como se describió previamente después de la administración de atovacuona en humanos (58). Alternativamente, la disminución de BUN puede haber sido causada por otros factores además del tratamiento farmacológico, como alteraciones del estado de nitrógeno en la dieta (59); Sin embargo, no se produjeron cambios en la dieta de los animales a lo largo del experimento. Los estudios futuros sobre la BPQ, sola o combinada con otros compuestos, pueden tener en cuenta el posible desarrollo de daño hepático, además de la detección a largo plazo previamente demostrada de residuos del fármaco en los animales tratados (29).
En conjunto, teniendo en cuenta los datos actuales y el impacto económico que T. orientalis Ikeda puede tener en la industria ganadera, es necesario realizar investigaciones futuras para evaluar nuevos medicamentos y regímenes para tratar y eliminar el parásito. Este tipo de terapias, combinadas con vacunas y pruebas diagnósticas, se necesitan con urgencia para diseñar estrategias integradas que permitan controlar y erradicar el T. orientalis Ikeda de las zonas endémicas y en riesgo emergentes.
5 Conclusión
Aquí demostramos que la BPQ es eficaz para reducir rápidamente la carga parasitaria de T. orientalis Ikeda, aislado de EE. UU., a niveles indetectables en sangre periférica, poco después del tratamiento, con los ensayos moleculares utilizados en este estudio. Sin embargo, la BPQ, como monoterapia, no fue eficaz para eliminar el parásito en bovinos infectados asintomáticos subclínicamente. El fármaco se utilizó en dos dosis diferentes, la dosis indicada en la etiqueta de 2,5 mg/kg y 6 mg/kg, y a pesar de su evidente efecto en la disminución de la parasitemia, se observó una recaída del parásito en todos los animales tratados.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración de ética
El estudio en animales fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Washington. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
RB: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. AH: Metodología, Redacción – revisión y edición. CO: Análisis formal, Investigación, Metodología, Visualización, Redacción – revisión y edición. DH: Conceptualización, Análisis formal, Investigación, Metodología, Visualización, Escritura – revisión y edición. NV: Conceptualización, Análisis formal, Investigación, Metodología, Validación, Visualización, Escritura – revisión y edición. JL: Investigación, Metodología, Redacción – revisión y edición. LF: Conceptualización, Curación de datos, Análisis formal, Adquisición de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Validación, Visualización, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. La investigación fue financiada por el USDA-ARS CRIS# 2090-32000-044-000-D.
Reconocimientos
Agradecemos a Shelby Beckner, Sarah Therrian, Elizabeth Hart, Emma Karel y Kristin Erickson por su excelente asistencia técnica y cuidado de los animales. Además, los autores desean agradecer a Bimeda Animal Health Ltd. por su donación de buparvacuona (Buparvex) para su uso en este estudio.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El autor o autores declararon ser miembros del consejo editorial de Frontiers, en el momento de la presentación. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1421710/full#supplementary-material
Referencias
1. Watts, JG, Playford, MC, y Hickey, KL. Theileria orientalis: una revisión. N Z Vet J. (2016) 64:3–9. doi: 10.1080/00480169.2015.1064792
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Emery, DL . Enfoques para el manejo integrado de parásitos (MIP) para Theileria orientalis con énfasis en la inmunidad. Patógenos. (2021) 10. doi: 10.3390/pathogens10091153
3. Oakes, VJ, Yabsley, MJ, Schwartz, D, LeRoith, T, Bissett, C, Broaddus, C, et al. Genotipo de Theileria orientalis Ikeda en ganado, Virginia, EE. UU. Emerg Infect Dis. (2019) 25:1653–9. doi: 10.3201/eid2509.190088
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Lawrence, K, Gedye, K, McFadden, A, Pulford, D, Heath, A, and Pomroy, W. Review of the New Zealand Theileria orientalis Ikeda type epidemic and epidemiological research since 2012. Pathogens. (2021) 10:1346. doi: 10.3390/pathogens10101346
5. Sivakumar, T, Hayashida, K, Sugimoto, C, y Yokoyama, N. Evolución y diversidad genética de Theileria. Infectar Genet Evol. (2014) 27:250–63. doi: 10.1016/j.meegid.2014.07.013
6. Kim, S, Yu, DH, Chae, JB, Choi, KS, Kim, HC, Park, BK, et al. Genotipo patogénico de la principal proteína de superficie del piroplasma asociada con anemia en la infección por Theileria orientalis en bovinos. Acta Vet Scand. (2017) 59:51. doi: 10.1186/s13028-017-0318-8
7. Minami, T, Fujinaga, T, Furuya, K e Ishihara, T. Comparación clínico-hematológica y serológica de cepas japonesas y rusas de Theileria sergenti. Natl Inst Anim Health Q (Tokio). (1980) 20:44–52.
8. Ota, N, Mizuno, D, Kuboki, N, Igarashi, I, Nakamura, Y, Yamashina, H, et al. Estudio epidemiológico de la infección por Theileria orientalis en ganado de pastoreo en la parte oriental de Hokkaido, Japón. J Vet Med Sci. (2009) 71:937–44. doi: 10.1292/jvms.71.937
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Kamau, J, de Vos, AJ, Playford, M, Salim, B, Kinyanjui, P y Sugimoto, C. Aparición de nuevos tipos de Theileria orientalis en el ganado australiano y posible causa de los brotes de theileriosis. Vectores parásitos. (2011) 4:22. doi: 10.1186/1756-3305-4-22
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Beard, CB, Occi, J, Bonilla, DL, Egizi, AM, Fonseca, DM, Mertins, JW, et al. Infestación multiestatal con la garrapata vector de enfermedades exóticas Haemaphysalis longicornis – Estados Unidos, agosto de 2017-septiembre de 2018. Informe Semanal de Morbilidad y Mortalidad (MMWR) (2018) 67:1310–3. doi: 10.15585/mmwr.mm6747a3
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Dinkel, KD, Herndon, DR, Noh, SM, Lahmers, KK, Todd, SM, Ueti, MW, et al. Un aislado estadounidense de Theileria orientalis, genotipo Ikeda, se transmite al ganado por la garrapata invasora asiática de cuernos largos, Haemaphysalis longicornis. Vectores parásitos. (2021) 14:157. doi: 10.1186/s13071-021-04659-9
12. Palmer, GH, Machado, J Jr, Fernandez, P, Heussler, V, Perinat, T, y Dobbelaere, DA. Regulación del factor nuclear kappa B mediada por parásitos en la linfoproliferación causada por la infección por Theileria parva. Proc Natl Acad Sci USA. (1997) 94:12527–32. doi: 10.1073/pnas.94.23.12527
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Dyer, M, y Tait, A. Control de la linfoproliferación por Theileria annulata. Parasitol en la actualidad. (1987) 3:309–11. doi: 10.1016/0169-4758(87)90189-X
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Ramsay, JD, Ueti, MW, Johnson, WC, Scoles, GA, Knowles, DP y Mealey, RH. Los linfocitos y macrófagos están infectados por Theileria equi, pero las células T y las células B no son necesarias para establecer la infección in vivo. PLoS Uno. (2013) 8:e76996. doi: 10.1371/journal.pone.0076996
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Kappmeyer, LS, Thiagarajan, M, Herndon, DR, Ramsay, JD, Caler, E, Djikeng, A, et al. Análisis genómico comparativo y posición filogenética de Theileria equi. BMC Genómica. (2012) 13:603. doi: 10.1186/1471-2164-13-603
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Fukushima, Y, Minamino, T, Mikurino, Y, Honkawa, K, Horii, Y, Taniguchi, T, et al. Efectos de la infección por Theileria orientalis sobre el estado de salud y la productividad de las vacas lecheras criadas dentro de los establos. Patógenos. (2021) 10:650. doi: 10.3390/patógenos10060650
17. Lakew, BT, Eastwood, S, y Walkden-Brown, SW. Epidemiología y transmisión de Theileria orientalis en Australasia. Patógenos. (2023) 12:1187. doi: 10.3390/patógenos12101187
18. Perera, PK, Gasser, RB, Firestone, SM, Anderson, GA, Malmo, J, Davis, G, et al. La teileriosis oriental en vacas lecheras provoca una importante pérdida de producción de leche. Vectores parásitos. (2014) 7:73. doi: 10.1186/1756-3305-7-73
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Perera, PK, Gasser, RB, Anderson, GA, Jeffers, M, Bell, CM y Jabbar, A. Encuesta epidemiológica tras los brotes de teileriosis oriental en Victoria, Australia, en granjas ganaderas seleccionadas. Parasitol veterinario. (2013) 197:509–21. doi: 10.1016/j.vetpar.2013.06.023
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Lawrence, KE, Forsyth, SF, Vaatstra, BL, McFadden, A, Pulford, DJ, Govindaraju, K, et al. Perfiles clínicos de hematología y bioquímica de bovinos infectados de forma natural con Theileria orientalis tipo Ikeda en Nueva Zelanda. N Z Vet J. (2018) 66:21–9. doi: 10.1080/00480169.2017.1391142
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Lawrence, KE, Gedye, K, y Pomroy, WE. Un estudio longitudinal del efecto de la infección por el tipo de Theileria orientalis Ikeda en tres granjas lecheras de Nueva Zelanda infectadas naturalmente en los pastos. Parasitol veterinario. (2019) 276:108977. doi: 10.1016/j.vetpar.2019.108977
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. George, JE, Pound, JM y Davey, RB. Control químico de garrapatas en ganado y la resistencia de estos parásitos a acaricidas. Parasitología. (2004) 129:S353-66. doi: 10.1017/S0031182003004682
23. Hudson, AT, Randall, AW, Fry, M, Ginger, CD, Hill, B, Latter, VS, et al. Novedosas hidroxinaftoquinonas antipalúdicas con potente actividad antiprotozoaria de amplio espectro. Parasitología. (1985) 90:45–55. doi: 10.1017/S0031182000049003
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Fry, M, y Pudney, M. Sitio de acción de la hidroxinaftoquinona antipalúdica, 2-[trans-4-(4′-clorofenil) ciclohexilo]-3-hidroxi-1,4-naftoquinona (566C80). Biochem Pharmacol. (1992) 43:1545–53. doi: 10.1016/0006-2952(92)90213-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. McHardy, N, Wekesa, LS, Hudson, AT, y Randall, AW. Actividad antitelileial de BW720C (buparvaquona): una comparación con la parvaquona. Res Vet Sci. (1985) 39:29–33. doi: 10.1016/S0034-5288(18)31765-X
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Sharifiyazdi, H, Namazi, F, Oryan, A, Shahriari, R y Razavi, M. Las mutaciones puntuales en el gen del citocromo b de Theileria annulata se asocian con el fracaso del tratamiento con buparvaquona. Parasitol veterinario. (2012) 187:431–5. doi: 10.1016/j.vetpar.2012.01.016
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Mhadhbi, M, Chaouch, M, Ajroud, K, Darghouth, MA y BenAbderrazak, S. Polimorfismo de secuencia del gen del citocromo b en aislados tunecinos de Theileria annulata y su asociación con el fracaso del tratamiento con buparvaquona. PLoS Uno. (2015) 10:e0129678. doi: 10.1371/journal.pone.0129678
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. McHardy, N, Hudson, AT, Morgan, DW, Rae, DG y Dolan, TT. Actividad de 10 naftoquinonas, incluyendo parvacuona (993C) y menoctone, en bovinos infectados artificialmente con Theileria parva. Res Vet Sci. (1983) 35:347–52. doi: 10.1016/S0034-5288(18)32031-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Bailey, G . Estudio de residuos tisulares de buparvaquona. North Sydney: Meat & Livestock Australia (2013).
30. Carter, P . Evaluación de la eficacia de Buparvacuona para el tratamiento de la teileriosis bovina «benigna». North Sydney: Meat & Livestock Australia (2011).
31. Patel, E, Mwaura, S, Kiara, H, Morzaria, S, Peters, A, y Toye, P. Producción y determinación de la dosis de la vacuna contra el cóctel Muguga del método de infección y tratamiento (ITM) utilizada para controlar la fiebre de la costa este en el ganado. Garrapatas y enfermedades transmitidas por garrapatas. (2016) 7:306–14. doi: 10.1016/j.ttbdis.2015.11.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Ebner, L, Odette, O, Simon, B, Lizarraga, I, Smith, J y Cox, S. Farmacocinética del butorfanol después de la administración intravenosa e intramuscular en burros: un estudio preliminar. Veterinario delantero Sci. (2022) 9:979794. doi: 10.3389/fvets.2022.979794
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Olivarez, JD, Mulon, PY, Ebner, LS, Cremerius, H, Cantrell, C, Rahn, R, et al. Propiedades farmacocinéticas y farmacodinámicas del pantoprazol en terneros. Veterinario delantero Sci. (2022) 9:1101461. doi: 10.3389/fvets.2022.1101461
34. Matthews, JN, Altman, DG, Campbell, MJ y Royston, P. Análisis de mediciones en serie en la investigación médica. BMJ. (1990) 300:230–5. doi: 10.1136/bmj.300.6719.230
35. Hummel, J, McKendrick, S, Brindley, C, y French, R. Evaluación exploratoria de la proporcionalidad de la dosis: revisión de los enfoques actuales y propuesta de un criterio práctico. Estadista de Farmacia. (2009) 8:38–49. DOI: 10.1002/PST.326
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Emery, D . Profilaxix y tratamiento de Theileria orientalis. North Sydney: Meat & Livestock Australia (2020).
37. Emery, D, Zhang, S, Loo, C, y Shirley, C. Un estudio longitudinal de la infección con genotipos de Theileria orientalis en terneros y ganado introducido en Dorrigo, Nueva Gales del Sur, y el efecto sobre las ganancias de peso. Parasitol veterinario. (2021) 296:109487. doi: 10.1016/j.vetpar.2021.109487
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Iduu, N, Barua, S, Falkenberg, S, Armstrong, C, Stockler, JW, Moye, A, et al. Theileria orientalis Ikeda en el ganado, Alabama, EE.UU. Veterinario Sci. (2023) 10:638. doi: 10.3390/vetsci10110638
39. Musoke, AJ, Nantulya, VM, Rurangirwa, FR y Buscher, G. Evidencia de un determinante antigénico protector común en esporozoítos de varias cepas de Theileria parva. Inmunología. (1984) 52:231–8.
40. Jenkins, C, y Bogema, DR. Factores asociados con la seroconversión a la principal proteína de superficie del piroplasma del hemoparásito bovino Theileria orientalis. Vectores parásitos. (2016) 9:106. doi: 10.1186/s13071-016-1395-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Muraguri, GR, Kiara, HK y McHardy, N. Tratamiento de la fiebre de la costa este: una comparación de parvacuona y buparvacuona. Parasitol veterinario. (1999) 87:25–37. doi: 10.1016/S0304-4017(99)00154-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Checa, R, Montoya, A, Ortega, N, González-Fraga, JL, Bartolomé, A, Gálvez, R, et al. Eficacia, seguridad y tolerancia del dipropionato de imidocarb frente a atovacuona o buparvacuona más azitromicina utilizado para tratar a perros enfermos infectados de forma natural con piroplasma similar a Babesia microti. Vectores parásitos. (2017) 10:145. doi: 10.1186/s13071-017-2049-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Mbwambo, HA, Magwisha, HB, y Mfinanga, JM. Evaluación de buparvacuona (BUTA-Kel KELA, Bélgica) como tratamiento de la fiebre de la Costa Este en el ganado bovino, en el centro periurbano de la ciudad de Dar Es Salaam. Tanzania Parasitol veterinario. (2006) 139:67–73. doi: 10.1016/j.vetpar.2006.02.024
44. Muraguri, GR, Ngumi, PN, Wesonga, D, Ndungu, SG, Wanjohi, JM, Bang, K, et al. Eficacia clínica y concentraciones plasmáticas de dos formulaciones de buparvacuona en bovinos infectados con fiebre de la Costa Este (infección por Theileria parva). Res Vet Sci. (2006) 81:119–26. doi: 10.1016/j.rvsc.2005.09.012
45. Wilkie, GM, Brown, CG, Kirvar, BE, Thomas, M, Williamson, SM, Bell-Sakyi, LJ, et al. Quimioprofilaxis de las infecciones por Theileria annulata y Theileria parva en terneros con buparvacuona. Parasitol veterinario. (1998) 78:1–12. doi: 10.1016/S0304-4017(98)00126-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Hashemi-Fesharki, R . Valor quimioterapéutico de la parvacuona y la buparvacuona frente a la infección por Theileria annulata en el ganado bovino. Res Vet Sci. (1991) 50:204–7. doi: 10.1016/0034-5288(91)90107-Y
47. Morrison, Wisconsin, y McKeever, DJ. Estado actual del desarrollo de vacunas contra los parásitos Theileria. Parasitología. (2006) 133:S169-87. doi: 10.1017/S0031182006001867
48. Zaugg, JLL . Evaluaciones de buparvacuona como tratamiento para la babesiosis equina (Babesia equi). Am J Vet Res. (1989) 50:782–5.
49. Zaugg, JLL . Eficacia de la buparvacuona como agente terapéutico y aclarante de Babesia equi de origen europeo en caballos. Am J Vet Res. (1992) 53:1396–9. doi: 10.2460/ajvr.1992.53.08.1396
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Stewart, NP, de Vos, AJ, McHardy, N, y Standfast, NF. Eliminación de infecciones por Theileria buffeli en bovinos mediante tratamiento concurrente con buparvacuona y fosfato de primaquina. Trop Anim Salud Prod. (1990) 22:116–22. doi: 10.1007/BF02239836
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Minami, T, Nakano, T, Shimizu, S, Shimura, K, Fujinaga, T e Ito, S. Eficacia de las naftoquinonas y el dipropionato de imidocarb en las infecciones por Theileria sergenti en terneros esplenectomizados. Nihon Juigaku Zasshi. (1985) 47:297–300. doi: 10.1292/jvms1939.47.297
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Kinabo, LD, y Bogan, JA. Parvacuona y buparvaquona: análisis de HPLC y farmacocinética comparativa en bovinos. Acta Trop. (1988) 45:87–94.
53. Birth, D, Kao, WC y Hunte, C. El análisis estructural del complejo del citocromo bc1 inhibido por atovacuona revela la base molecular de la acción de los medicamentos antipalúdicos. Nat Commun. (2014) 5:4029. doi: 10.1038/ncomms5029
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Siregar, JE, Kurisu, G, Kobayashi, T, Matsuzaki, M, Sakamoto, K, Mi-ichi, F, et al. Evidencia directa de la acción de atovacuona sobre el complejo plasmodium citocromo bc1. Parasitol Int. (2015) 64:295–300. doi: 10.1016/j.parint.2014.09.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Mhadhbi, M, Naouach, A, Boumiza, A, Chaabani, MF, BenAbderazzak, S, y Darghouth, MA. Evidencia in vivo de la resistencia de Theileria annulata a la buparvacuona. Parasitol veterinario. (2010) 169:241–7. doi: 10.1016/j.vetpar.2010.01.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Hacılarlıoglu, S, Bilgic, HB, Bakırcı, S, Tait, A, Weir, W, Shiels, B, et al. La selección de genotipos que albergan mutaciones en el gen del citocromo b de Theileria annulata se asocia con la resistencia a la buparvacuona. PLoS Uno. (2023) 18:e0279925. doi: 10.1371/journal.pone.0279925
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Tajeri, S, Chattopadhyay, D, Langsley, G y Nijhof, AM. Un parásito Theileria annulata con una sola mutación, metionina 128 a isoleucina (M128I), en el citocromo B, es resistente a la buparvacuona. PLoS Uno. (2024) 19:e0299002. doi: 10.1371/journal.pone.0299002
Resumen de PubMed | Texto completo de Crossref | Google Académico
58. Grieshaber, M, Lämmli, J y Marcus, L. Hepatitis aguda y atovacuona/proguanil. J Travel Med. (2005) 12:289–90. doi: 10.2310/7060.2005.12510
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: Theileria orientalis, genotipo Ikeda, buparvacuona, bovinos, anti-Theileria terapéutico, infección subclínica por Theileria
Cita: Bastos RG, Hassan A, Onzere CK, Herndon DR, Villarino NF, Laughery JM y Fry LM (2024) Eficacia transitoria de la buparvacuona contra el aislado de EE. UU. del genotipo Theileria orientalis Ikeda en ganado infectado subclínicamente. Frente. Vet. Sci. 11:1421710. doi: 10.3389/fvets.2024.1421710
Recibido: 22 de abril de 2024; Aceptado: 18 de julio de 2024;
Publicado: 26 de julio de 2024.
Editado por:
Camila Hamond, Servicio de Inspección de Sanidad Agropecuaria (USDA), Estados Unidos
Revisado por:
Juan Mosqueda, Universidad Autónoma de Querétaro, México
Exequiel Oscar Jesús Porta, University College London, Reino Unido
Derechos de autor © 2024 Bastos, Hassan, Onzere, Herndon, Villarino, Laughery y Fry. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Reginaldo G. Bastos, reginaldo.bastos@usda.gov
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía