Tumor de células gigantes de hueso en la mandíbula de una cabra
 Nora M. Biermann1*
Nora M. Biermann1* Susanna Piechl2
Susanna Piechl2 Nora Dinhopl3
Nora Dinhopl3 Andrea Fuchs-Baumgartinger3
Andrea Fuchs-Baumgartinger3 Christiane Weissenbacher-Lang3
Christiane Weissenbacher-Lang3 Christof A. Bertram3
Christof A. Bertram3- 1Departamento Clínico de Pequeños Animales y Caballos, Universidad de Medicina Veterinaria de Viena, Viena, Austria
- número arábigoDepartamento de Animales de Granja y Ciencias del Sistema Alimentario, Universidad de Medicina Veterinaria de Viena, Viena, Austria
- 3Departamento de Ciencias Biológicas y Patobiología, Universidad de Medicina Veterinaria de Viena, Viena, Austria
Los procesos neoplásicos de la mandíbula y su tratamiento son raramente reportados en especies animales grandes. Específicamente, el tumor óseo de células gigantes es un tumor poco común en animales y se ha asociado en humanos con un comportamiento localmente invasivo y una alta tasa de recurrencia. La resección en bloque es el tratamiento de elección, pero dependiendo de la localización del tumor, esto puede resultar en déficits funcionales. Este informe detalla la evaluación diagnóstica, el tratamiento y el resultado a largo plazo de un tumor óseo de células gigantes que afecta la mandíbula rostral y la sínfisis mandibular de una cabra. Se realizó una mandibulectomía rostral extensa que abarcó toda la sínfisis mandibular sin fijación quirúrgica de los hemimandibles. Los hallazgos histológicos y de microscopía electrónica del tumor fueron consistentes con un tumor óseo de células gigantes. Aunque se considera que una mutación del gen H3F3A es el impulsor del desarrollo tumoral en los tumores de células gigantes humanas, mediante análisis molecular, esta mutación genética no pudo confirmarse en este caso. Los exámenes de seguimiento revelaron fusión secundaria espontánea de ambos hemimandibles y sin signos de recidiva tumoral. Casi 1 año después de la cirugía, los propietarios no informaron signos de recrecimiento del tumor.
1 Introducción
La principal indicación de intervención quirúrgica a nivel de la mandíbula rostral en animales grandes es traumatismos, trastornos del desarrollo y procesos neoplásicos (1). El traumatismo parece ser el más común, pero la neoplasia también ha dado lugar a un tratamiento mediante mandibulectomía tanto en caballos como en grandes rumiantes (1-4). En cabras, solo existen unos pocos reportes, que detallan varios procesos neoplásicos de las mandíbulas, como linfosarcoma, fibrosarcoma, fibroma no osificante y osteoma, con tratamiento no intentado o infructuoso (5-9). Previamente se ha descrito un caso de una cabra con un tumor óseo de células gigantes (10), pero no se intentó ningún tratamiento y el animal fue sacrificado debido a un presunto mal pronóstico.
Los tumores óseos de células gigantes se desarrollan dentro del hueso y se caracterizan histológicamente por células gigantes multinucleadas similares a osteoclastos y células fusiformes similares a fibroblastos, estas últimas consideradas la población de células neoplásicas probablemente derivada del linaje osteoblástico (11). El examen histológico de este tumor requiere diferenciar el osteosarcoma rico en células gigantes y el granuloma gingival periférico de células gigantes. Los tumores óseos de células gigantes representan hasta el 20% de los tumores óseos en humanos, pero rara vez se informan en animales (12, 13). En los animales domésticos, estos tumores se reportan con mayor frecuencia en gatos (14–16), con menos frecuencia en perros (13) e infrecuentemente en caballos (17) y cabras (10). Muestran principalmente un comportamiento agresivo local, con una alta tasa de recurrencia en humanos (18). En raras ocasiones, se han descrito casos de metástasis extraesqueléticas tanto en humanos como en animales (15, 19). En los tumores óseos de células gigantes humanas, una mutación del gen H3F3A se considera el impulsor del desarrollo tumoral (20); En animales, esta mutación, hasta donde sabe el autor, no ha sido evaluada hasta la fecha.
El tratamiento quirúrgico de los tumores mandibulares generalmente implica la resección en bloque del tejido neoplásico con o sin fijación interna y se considera el tratamiento de elección (3, 21, 22). Sin embargo, las descripciones de las respuestas al tratamiento y los resultados a largo plazo en animales productores de alimentos y fibra son escasas (3, 4).
Este reporte de caso tiene como objetivo describir el diagnóstico, tratamiento quirúrgico y seguimiento de un tumor de células gigantes de hueso en la mandíbula de una cabra joven.
2 Descripción del caso
2.1 Presentación del caso
Una cabra pigmea de 2 años de edad (23 kg) presentó una masa en la mandíbula rostral, inicialmente se sospechó que era un absceso. A pesar del tratamiento conservador y el intento de drenaje por parte del veterinario remitente, la masa aumentó lentamente de tamaño en los 2 meses anteriores a la derivación sin afectar la aprehensión de alimentos o la masticación.
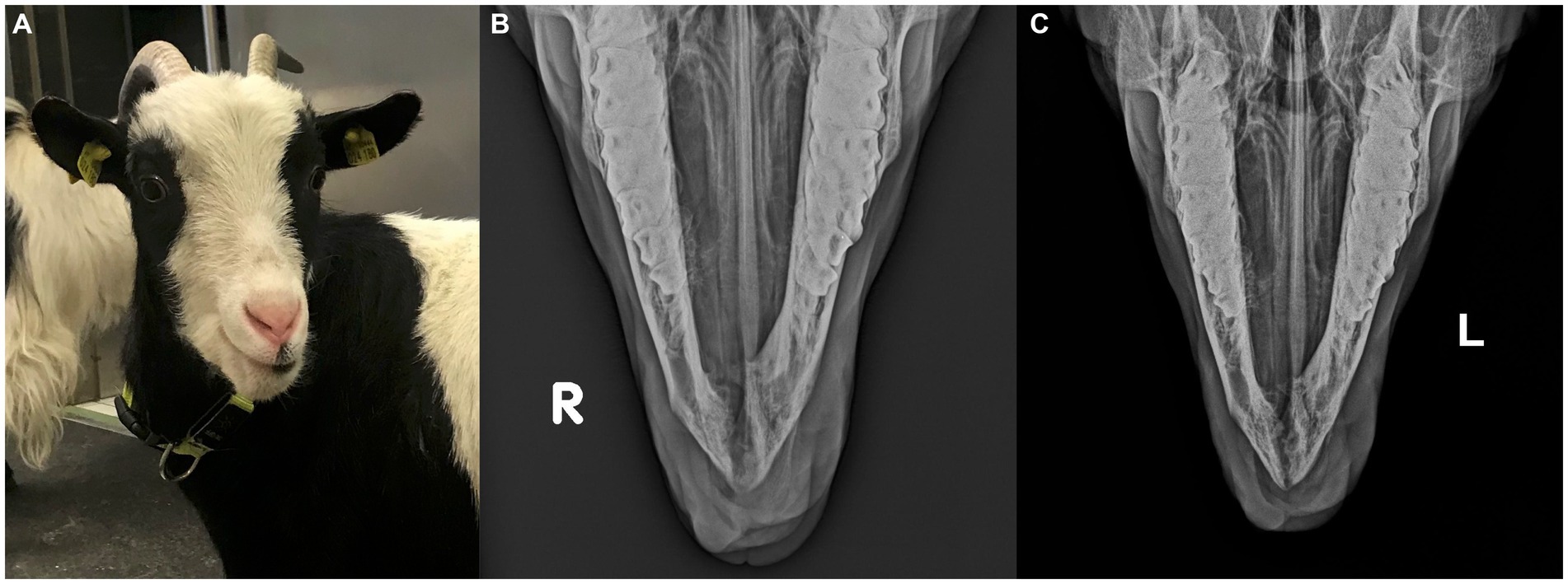
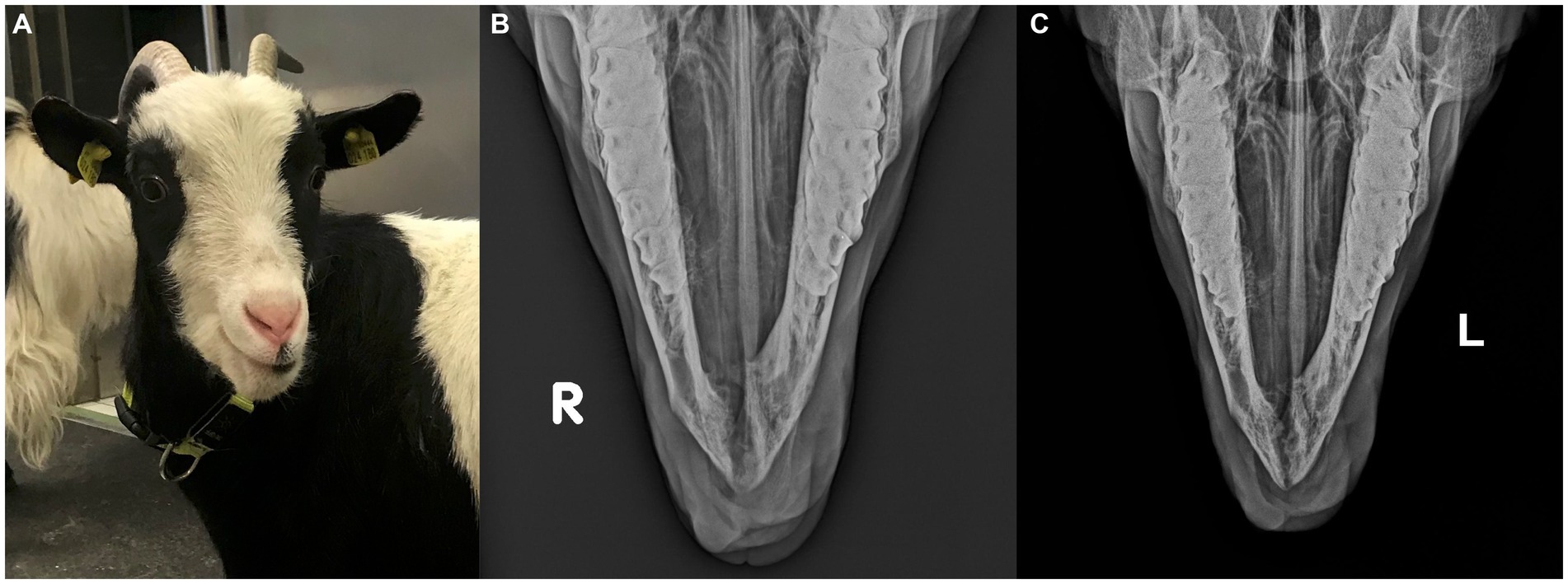
En el momento de la presentación, los parámetros del examen físico estaban dentro de los límites normales y la cabra estaba en buenas condiciones corporales. Una masa firme y no dolorosa de aproximadamente 30 mm × 25 mm × 30 mm desplazó los dientes incisivos mandibulares izquierdos, siendo el tercer diente incisivo mandibular izquierdo muy móvil. La masa estaba cubierta en su mayor parte por mucosa oral parcialmente ulcerada y firmemente adherida a la mandíbula (Figura 1A). Un aspirado con aguja fina, tomado después de anestesia local, no fue diagnóstico.
Las radiografías mostraron una masa expansiva y multicavitada dentro de la corteza mandibular rostral, incluida la sínfisis, que se extendía caudalmente aproximadamente a la mitad de ambos dientes premolares mandibulares. Observaron signos marcados de reabsorción ósea alveolar con desplazamiento lateral de los dientes incisivos mandibulares izquierdos, que estaban parcialmente cubiertos por tejido blando protuberante (Figuras 1B,C).
Los ganglios linfáticos mandibulares y cervicales no estaban agrandados, y las radiografías torácicas no mostraron evidencia de lesiones metastásicas en ese momento. Los perfiles bioquímicos hematológicos y séricos se consideraron normales, excepto por una hipoproteinemia leve (5,6 g/dL; intervalo de referencia: 6,0-7,8 g/dL). Se recomendó la resección en bloque del tumor, incluyendo la sínfisis mandibular. La estabilización de la mandíbula con un implante (21) fue discutida con los propietarios. Sin embargo, debido al alto riesgo de infección, la necesidad de una segunda cirugía para retirar el implante y las limitaciones financieras, se tomó la decisión de no fijarlo.
2.2 Tratamiento quirúrgico y cuidados postoperatorios
En el preoperatorio, la cabra recibió carprofeno (1,5 mg/kg, SC) y amoxicilina (15 mg/kg, IM). Después de la sedación con xilacina (0,1 mg/kg, IV) y butorfanol (0,2 mg/kg, IV), se indujo anestesia general con ketamina (5 mg/kg, IV) y se mantuvo con isoflurano en oxígeno y ventilación con presión positiva a través de un tubo orotraqueal. La cabra se colocó en decúbito esternal, y la mandíbula rostral se preparó para la cirugía aséptica. Se realizaron bloqueos intraorales bilaterales del nervio mandibular con 1,5 mL de Procaína (2%) cada uno, tal y como se describió en pequeños animales y caballos (23, 24). Se realizó una incisión circunferencial alrededor de la mandíbula rostral, 0,5 cm caudal a la masa. El tejido inciso se separó bruscamente del hueso mandibular y se retrajo caudalmente para exponer ambos ramos mandibulares. El sangrado durante la disección subcutánea se controló con electrocauterización y presión manual. Se realizó una osteotomía rostral-mandibular con sierra oscilante, rostral de 2 cm a cada segundo premolar mandibular. De nuevo, se encontró sangrado de ambos muñones mandibulares, que sólo pudo controlarse con el uso repetido de electrocauterio y presión manual. La cabra perdió aproximadamente el 15% (aproximadamente 300 mL) de su volumen total de sangre estimado hasta que se controló el sangrado. Las mediciones repetidas del volumen de células empaquetadas y de sólidos totales (PCV/TP) durante el perioperatorio continuaron dentro de los límites normales, y la cabra permaneció cardiovascular estable bajo anestesia general, con fluidoterapia intravenosa adicional.
El tejido subcutáneo y la mucosa oral se colocaron para cubrir los muñones mandibulares mediante suturas interrumpidas simples y Monosyn 2-0 (Monofilamento absorbible por gliconato, Braun Surgical, Rubin, España) en dos capas. Durante la recuperación de la anestesia general, la cabra comenzó a vocalizar repetidamente y volvió a producirse el sangrado. Esto dio lugar inicialmente a un aumento de la hinchazón subcutánea y a la posterior goteo de sangre. La cabra fue sedada de nuevo (xilacina; 0,07 mg/kg, IV) y la presión manual en la zona dio lugar a una hemostasia, tras la cual la recuperación continuó con éxito sin necesidad de transfusión sanguínea.
La mandíbula rostral, incluyendo el tejido tumoral, se sometió a histopatología en formol al 4%.
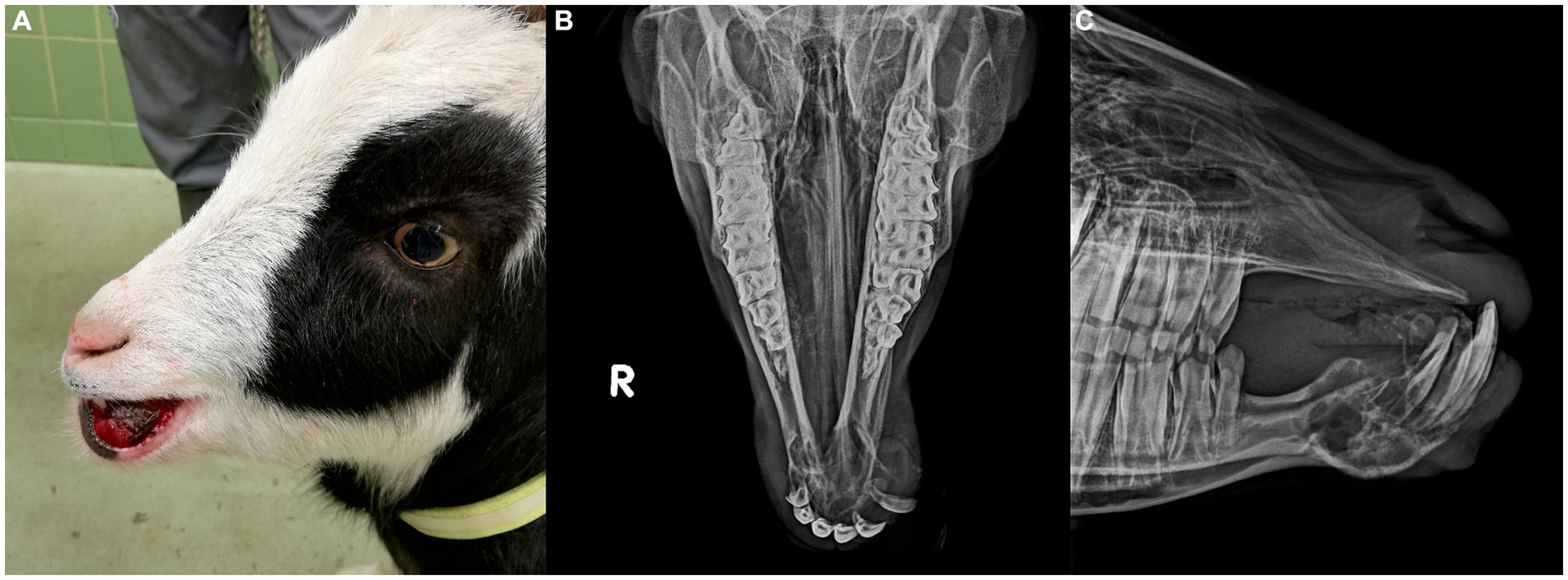
En el postoperatorio, la cabra continuó recibiendo medicación antiinflamatoria (Carprofeno 1,5 mg/kg, SC) durante 8 días y antimicrobianos (Amoxicilina, 15 mg/kg, IM) durante 3 días. Se proporcionó un control adicional del dolor con una infusión de tasa constante de ketamina (3 mcg/kg/min) y bolos de butorfanol (0,1 mg/kg, IV cada 4 h) durante las 48 h iniciales, momento en el que la cabra comenzó a comer tanto alimento granulado como heno de tallo corto. El butorfanol (0,1 mg/kg, SC cada 6 h) se continuó durante 48 h adicionales, seguido de una disminución gradual y se suspendió 7 días después de la cirugía. En este punto, la cabra mostró una ingesta normal de alimento a pesar del movimiento independiente de ambas mandíbulas. No se produjo sangrado activo en el postoperatorio y la hinchazón del sitio quirúrgico permaneció estable. Las radiografías 10 días después de la cirugía no fueron notables, excepto por una estructura ósea ligeramente irregular del muñón mandibular derecho, probablemente causada por los repetidos intentos de lograr la hemostasia durante la cirugía (Figuras 2A, B). El sitio quirúrgico estaba cicatrizando bien, con suturas colocadas y sin signos de infección. La cabra fue dada de alta con instrucciones de controlar la ingesta normal de alimentos y agua, revisar el sitio quirúrgico para ver si había aumento de hinchazón o secreción, e intentar evitar saltos y cabezazos con otras cabras siempre que fuera posible.
2.3 Examen macroscópico e histológico
El espécimen óseo recibido de la cirugía se seccionó longitudinalmente con una sierra de cinta. Macroscópicamente, la cavidad ósea se extendió focalmente en una masa de aproximadamente 4 cm de diámetro (Figura 3). La corteza del hueso mandibular estaba atenuada y focalmente perforada por la masa infiltrante, que formaba una extensión lingual de 15 mm hacia la cavidad oral. Las masas eran firmes, bronceadas y lobuladas.

Se seccionaron trozos delgados de tejido (de aproximadamente 2 mm de grosor) con la sierra de cinta y, después de una fijación adicional en formalina al 4% durante 24 h, se procesaron de forma rutinaria para crear secciones histológicas teñidas con hematoxilina y eosina. Las secciones que contenían hueso cortical se descalcificaron durante 24 h en un fluido comercial (Decal®, Quartett GmbH, Berlín, Alemania) que contenía agua desionizada (90%), ácido clorhídrico (<10%) y ácido etilendiaminotetraacético (<0,1%). Desde el punto de vista histológico, el tumor altamente celular se caracterizó por la presencia de haces de células fusiformes similares a fibroblastos intercaladas regularmente con numerosas células gigantes multinucleadas que suelen contener entre 5 y 15 núcleos. El estroma fibroso era mínimo. La extensión del tumor oral contenía hemorragias crónicas multifocales con múltiples hemosiderófagos. No hubo evidencia de producción de osteoide, excepto por las espículas de hueso reactivo que surgen de la corteza. Las células fusiformes similares a fibroblastos tenían núcleos solitarios alargados y romos y citoplasma eosinófilo moderado con bordes celulares indistintos. Este tipo de célula tenía criterios de malignidad bajos, incluyendo un pleomorfismo nuclear bajo, baja actividad mitótica (el recuento mitótico máximo en 2,37mm2 fue 3) y sin figuras mitóticas atípicas. Las células gigantes tenían núcleos uniformes y redondos distribuidos aleatoriamente dentro del abundante citoplasma eosinófilo. La distancia histológica libre de tumor entre el tumor y los márgenes quirúrgicos caudales fue de 3 mm.
Los hallazgos histológicos del presente tumor fueron consistentes con un tumor óseo de células gigantes. El primer diagnóstico diferencial fue un osteosarcoma rico en células gigantes, que, sin embargo, parecía poco probable ya que no había evidencia de producción osteoide a partir de las células tumorales y había criterios mínimos de malignidad, es decir, sin figuras mitóticas, particularmente sin figuras mitóticas atípicas, y un pleomorfismo nuclear mínimo de las células mononucleares (11). El segundo diagnóstico diferencial fue un granuloma periférico de células gigantes, que se origina en la encía y generalmente no compromete el hueso subyacente (25). En el presente caso, la masa tumoral principal se encontraba dentro de la médula ósea, lo que indica que había surgido del hueso y no de la encía.
2.4 Examen de microscopía electrónica
Para el examen de microscopía electrónica, las muestras de tejido del tumor se fijaron en glutaraldehído al 5% (Merck, Darmstadt, Alemania) diluido en tampón de fosfato 0,1 M (Sigma-Aldrich, Viena, Austria; pH 7,2) a 4 °C durante 4 h. Posteriormente, las muestras se fijaron posteriormente en tetróxido de osmio al 1% (Merck) diluido en el mismo tampón a 4 °C durante 2 h. Después de la deshidratación en una serie de gradientes de alcohol y óxido de propileno (Merck), las muestras de tejido se incrustaron en éter glicídico 100 (Serva, Heidelberg, Alemania). Las secciones ultrafinas se cortaron en un ultramicrótomo Leica (Leica Ultracut S, Viena, Austria), se tiñeron con acetato de uranilo (Sigma-Aldrich) y citrato de plomo (Merck). Las secciones ultrafinas se examinaron con un microscopio electrónico Zeiss TEM 900 (Carl Zeiss, Oberkochen, Alemania) operado a 60 kV.
De acuerdo con los hallazgos histológicos, la investigación ultraestructural del tumor mostró predominantemente células gigantes multinucleadas reactivas similares a osteoclastos, así como células estromales mononucleares proliferativas (Figura 3). Las células estromales mostraban núcleos con una membrana irregular, un nucléolo prominente, así como grupos marginales de heterocromatina condensados en contacto con la envoltura nuclear. El citoplasma de las células estromales tenía perfiles prominentes de retículo endoplasmático rugoso en el que había material floculante.
2.5 Examen molecular
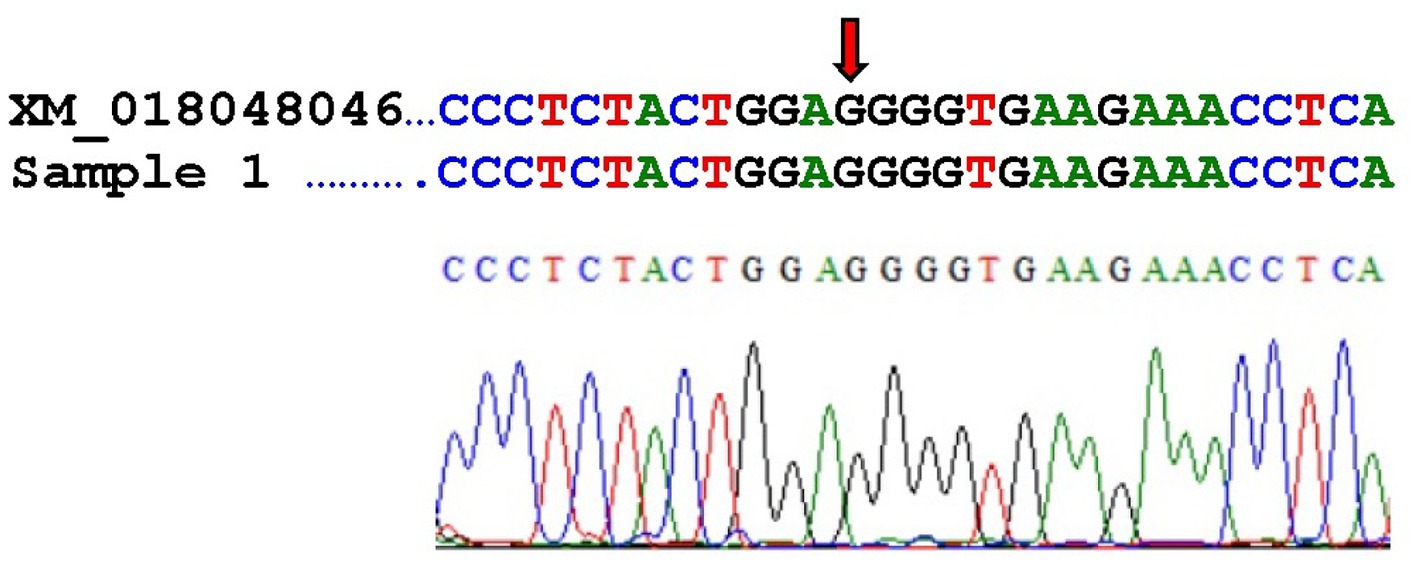
Investigamos si una mutación del gen H3F3A, la mutación conductora en los humanos, está presente en esta cabra. Diez secciones de tejido FFPE de 10 μm de espesor de corte cada una fueron desparafinadas de acuerdo con el protocolo modificado de Weissenbacher-Lang et al. (26). La modificación consistió en utilizar (R) (+) limoneno (SAV Liquid Production, Flintsbach am Inn, Alemania) en lugar de xileno como disolvente. Los pellets se almacenaron a 6°C durante un máximo de 1 día hasta la extracción del ácido nucleico. El ADN se extrajo utilizando el kit QIAamp DNA Micro (Qiagen, Viena, Austria) de acuerdo con las instrucciones del fabricante. La mezcla de PCR para la amplificación del gen H3F3A consistió en 12,5 μL de Kapa 2G Fast HotStart ReadyMix (Merck, Viena, Austria), 0,4 mM de cada cebador (fw: 5′-TGGCTCGTACAAAGCAGACT-3′, rv: 5′-ACGGAGTGCCACAGTACCAG-3′), 1 μL de MgCl2 (Peqlab, VWR, Viena, Austria), 1 μL de ADN molde (dilución 1:100) y agua destilada hasta un volumen total de 25 μL por reacción. El programa del ciclador comenzó con una etapa de desnaturalización por calor a 95 °C durante 3 minutos, seguida de 40 ciclos a 95 °C durante 15 s, 60 °C durante 15 s y 72 °C durante 25 s, y terminó con un paso de extensión a 72 °C durante 1 min. La electroforesis en gel se realizó como se describió anteriormente (20). El producto de PCR positivo con una longitud de amplicón de 149 pb se purificó utilizando el kit de purificación de PCR MinElute (Qiagen, Viena, Austria) y se presentó para la secuenciación de ADN de Sanger (Microsynth, Viena, Austria). Las secuencias se ensamblaron con el software BioEdit Sequence Alignment Editor 7.1.3.0 (27). Las secuencias se enviaron a la Herramienta de Búsqueda Básica de Alineamiento Local (BLAST) del NCBI y se alinearon con la secuencia de ARNm publicada de una histona similar a Capra hircus H3.3 (número de acceso XM_018048046) para investigar una sospecha de transversión G > T del gen H3F3A.
La transversión G > T del gen H3F3A no pudo confirmarse en el presente caso. La Figura 4 muestra la alineación de la secuencia de ARNm publicada de una histona similar a Capra hircus H3.3 (número de acceso XM_018048046) con nuestra secuencia. El sitio de transversión de la mutación en los tumores óseos de células gigantes humanas está marcado con una flecha, y nuestra secuencia corresponde al tipo salvaje.
2.6 Seguimiento y resultados
Seis días después del alta, la cabra fue readmitida con signos neurológicos agudos, incluyendo mentación sorda y opistótono. Se sospechó de un traumatismo, ya que la cabra estaba alojada con otra cabra pigmea. La exploración física y los análisis de sangre fueron normales, a excepción de un opistótono intermitente leve que presentó la cabra en las primeras horas de hospitalización, el sitio quirúrgico estaba bien cicatrizado. La cabra fue tratada por un presunto traumatismo craneal con carprofeno (1,5 mg/kg, SC) y permaneció en observación en el hospital durante los dos días siguientes, sin mostrar más signos neurológicos.
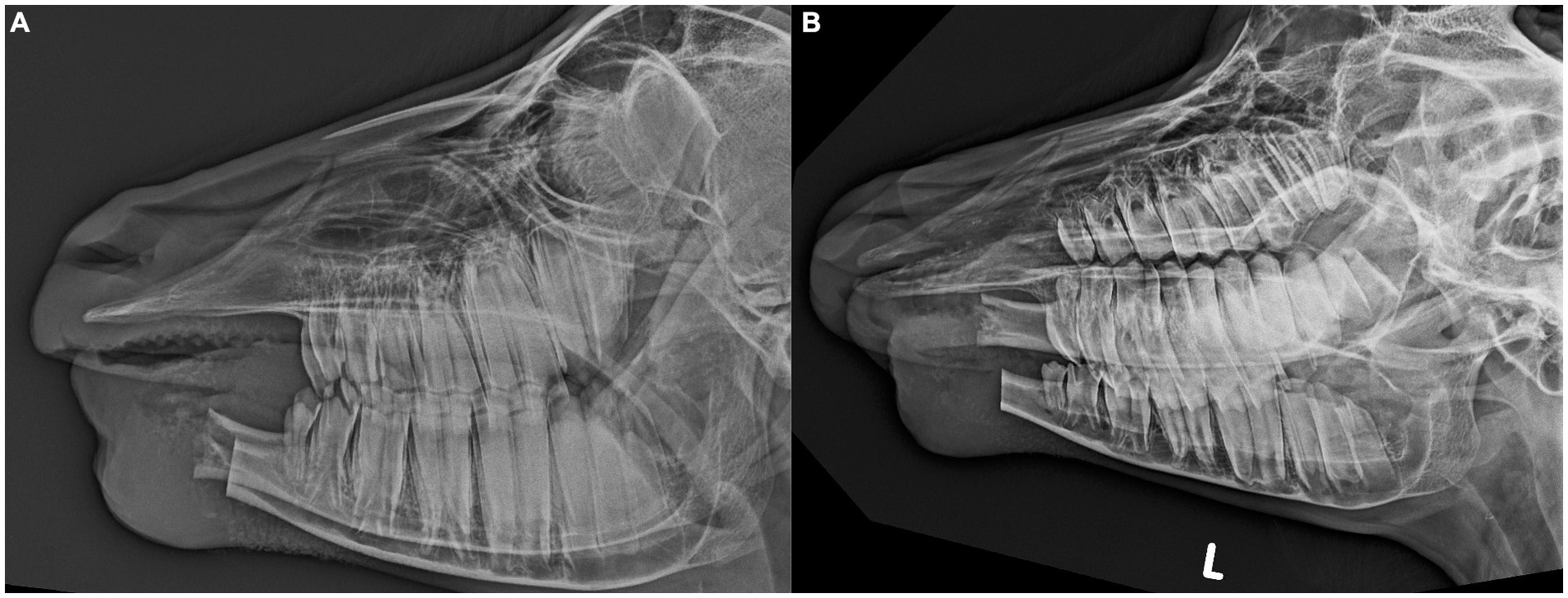
A los 3 meses, la cabra comía normalmente, con estabilidad de ambas mandíbulas y un callo óseo firme y prominente en el sitio quirúrgico (Figura 5A). Las radiografías mostraron fusión avanzada de ambas mandíbulas con estructura ósea moderadamente irregular (Figura 5B).
Un segundo examen de revisión 1 mes después reveló que el tamaño del callo había disminuido y la estructura ósea parecía más regular (Figura 5C). La cabra fue dada de alta con la recomendación de regresar para un nuevo examen en 6 meses y un monitoreo frecuente del área por parte de los propietarios para detectar cualquier signo de recurrencia del tumor mientras tanto.
Tras el seguimiento telefónico 10 meses después de la cirugía, se informó que la cabra estaba bien sin signos de recrecimiento del tumor, y los propietarios estaban satisfechos con el resultado.
3 Discusión
Este informe de caso describe el tratamiento exitoso y el resultado a largo plazo de un tumor de células gigantes de la mandíbula rostral en una cabra. En la literatura actual, hay un reporte de un tumor de células gigantes que también afecta la mandíbula; sin embargo, no se siguió ningún tratamiento (10). En el presente caso, la resección en bloque sin fijación resultó en una fusión espontánea de las mandíbulas 3 meses después de la cirugía, sin recrecimiento del tumor. Ni el tratamiento mediante mandibulectomía rostral extensa ni la respuesta a corto y largo plazo de la resección en bloque de este tipo de tumor se han reportado previamente en animales productores de alimentos.
Los tumores óseos de células gigantes con frecuencia se originan en la epífisis de los huesos largos de los seres humanos, particularmente el fémur distal, la tibia proximal, el radio distal y el sacro (12, 28, 29), pero también pueden afectar la mandíbula (29-31). Estos tumores representan hasta el 20% de los tumores óseos en humanos (12), pero son raros en las especies veterinarias (13-16). En animales grandes, los informes son escasos y la información sobre el tratamiento y los resultados es limitada (10, 17).
En este caso, el tumor afectaba a la sínfisis mandibular, que posiblemente era el punto de origen en este joven animal y, por lo tanto, presenta similitudes con casos previamente descritos en humanos (12, 28). Sin embargo, la mutación conductora de las características del gen H3F3A para los tumores óseos de células gigantes humanas no se detectó en esta cabra. Se necesitan más estudios para evaluar si los tumores óseos de células gigantes animales comparten una oncogénesis similar a la de los seres humanos. Se justifica una comparación molecular e inmunohistoquímica más profunda de los tumores de células gigantes humanos y animales, ya que la literatura veterinaria ha extrapolado información de los seres humanos debido a la escasez de informes en animales (11).
Estos tumores, aunque localmente agresivos, rara vez hacen metástasis (15, 18, 19). Debido a su comportamiento localmente agresivo y su alta tasa de recurrencia con manejo conservador, la resección en bloque es el tratamiento preferido en humanos (32). La afectación de la sínfisis requirió una mandibulectomía rostral extensa para lograr márgenes libres de tumor y prevenir una mayor diseminación en este caso.
Se han reportado casos de mandibulectomía rostral extensa en animales pequeños, vacas y caballos (20, 21, 33, 34). Aunque se han utilizado cabras para estudiar la reconstrucción mandibular y la osteogénesis (35, 36), esta técnica quirúrgica específica, sus complicaciones y resultados en cabras no han sido documentados.
Dado que la extirpación de toda la sínfisis da lugar a la inestabilidad de las mandíbulas y al movimiento independiente de la mandíbula ya que la fijación disminuyó. Se informó a los propietarios que esta técnica quirúrgica puede dar lugar con el tiempo a cambios degenerativos de las articulaciones temporomandibulares (ATM) como se ha reportado en perros (37). Además, dado que esta técnica no se había descrito previamente en cabras, no se pudieron excluir por completo otras complicaciones a corto y largo plazo.
La principal complicación intraoperatoria fue una hemorragia moderada a grave desde el sitio quirúrgico. El tumor bien vascularizado recibía sangre principalmente a través de la vasculatura intracortical dentro de la cavidad medular de la mandíbula. Esto se hizo evidente inmediatamente después de la primera incisión y se intensificó con la disección de las mandíbulas.
Debido a que la cabra estaba clasificada como un animal productor de alimentos, ciertos agentes hemostáticos, como esponjas de colágeno y fármacos antifibrinolíticos (por ejemplo, ácido tranexámico), no podían utilizarse, lo que limitaba la hemostasia a la electrocauterización y la presión manual. Esto resultó en una pérdida significativa de sangre al final de la recuperación (aproximadamente el 20-25% del volumen sanguíneo del paciente). Se consideró una transfusión de sangre intraoperatoria, pero dado que en ese momento el sangrado estaba controlado, no se extrajo sangre del compañero de la cabra. Probablemente, habría sido útil durante la recuperación, que fue prolongada, porque cada vez que la cabra comenzaba a despertarse, vocalizaba continuamente, lo que aumentaba la presión arterial craneal y resultaba en la recurrencia de la hemorragia. El reingreso de la cabra 6 días después del alta debido a signos de traumatismo craneal subraya el punto de que la cirugía de cabeza en cabras conlleva desafíos específicos de cada especie. Finalmente, esta cabra se recuperó bien del procedimiento, aunque hay que tener en cuenta que el manejo del dolor multimodal en el postoperatorio temprano fue crucial para promover una ingesta adecuada de alimentos.
La enfermedad de la articulación temporomandibular, reportada en humanos y animales pequeños con maloclusión crónica o inestabilidad mandibular (36, 37), es una posible complicación a largo plazo para esta cabra. En la última revisión, 4 meses después de la cirugía, no se evaluó la evidencia radiográfica de enfermedad de la ATM. En un estudio en perros con inestabilidad de la ATM inducida experimentalmente, las radiografías no mostraron artrosis a los 3 y 6 meses, aunque la histopatología lo confirmó (37). La osteoartritis de la ATM rara vez se informa en animales productores de alimentos, y el impacto a largo plazo de la alineación mandibular alterada en la función de la ATM sigue siendo desconocido.
Otra posible complicación a largo plazo podría ser la recurrencia del tumor, con una tasa de recurrencia desconocida debido al número limitado de informes en especies veterinarias. El examen de revisión y las radiografías no indicaron recurrencia del tumor en ese momento, y en el seguimiento telefónico casi 1 año después de la cirugía, la cabra estaba sana sin signos de rebrote. A pesar de la recomendación de una cita de seguimiento con radiografías de control, los propietarios se negaron debido a la buena salud general de la cabra.
La mandibulectomía rostral extensa, incluida la sínfisis mandibular, parece ser una opción de tratamiento viable, sin embargo, las complicaciones a corto plazo incluyeron sangrado clínicamente significativo y características específicas de la especie que aumentan el riesgo de traumatismo en el sitio quirúrgico. Podemos concluir que la resección en bloque de un tumor de células gigantes de hueso en una cabra se puede realizar con éxito, lo que resulta en una fusión secundaria de ambas mandíbulas con un resultado cosmético y funcional aceptable.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración de ética
No se requirió revisión ética y aprobación para el animal con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito del propietario de la cabra para la publicación de este informe de caso y las imágenes que lo acompañan.
Contribuciones de los autores
NB: Conceptualización, Curación de datos, Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición, Recursos, Visualización. SP: Recursos, Redacción – borrador original, Redacción – revisión y edición. ND: Investigación, Visualización, Redacción – borrador original, Redacción – revisión y edición, Curación de datos, Metodología. AF-B: Curación de datos, Metodología, Visualización, Redacción – borrador original, Redacción – revisión y edición, Investigación. CW-L: Curación de datos, Metodología, Visualización, Redacción – borrador original, Redacción – revisión y edición, Investigación. CB: Conceptualización, Curación de datos, Investigación, Metodología, Recursos, Visualización, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Auer, JA. Trastornos craneomaxilofaciales En: J.A. Auer, J.A. Stick, J.M. Kümmerle y T. Prange, editores. Cirugía Equina. 5ª ed. St. Louis, MO: Elsevier Saunders (2019). 1818.
2. Carmalt, JL, y Linn, KA. Mandibulectomía segmentaria grande para el tratamiento de un sarcoma indiferenciado en un caballo. Cirugía veterinaria. (2013) 42:433–9. doi: 10.1111/j.1532-950X.2013.01086.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Tetens, J, Ross, MW, y Sweeney, RW. Mandibulectomía rostral para el tratamiento de un fibroodontoma ameloblástico en una vaca. J am vet med assoc. (1995) 207:1616–7. doi: 10.2460/javma.1995.207.12.1616
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Tsuka, T, Okamoto, Y, Yamamoto, N, Hayashi, K, Morita, T, Sunden, Y, et al. Mandibulectomía rostral unilateral por hamartoma vascular gingival en dos pantorrillas. J Vet Sci. (2018) 19:582–4. doi: 10.4142/jvs.2018.19.4.582
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Guedes, RM, Facury Filho, EJ, y Lago, LA. Linfosarcoma mandibular en una cabra. Rec. Veterinario. (1998) 143:51–2. doi: 10.1136/vr.143.2.51
6. De Silva, LN, Winter, MH, Jackson, PG, y Bostock, DE. Linfosarcoma que afecta la mandíbula de dos cabras. Rec. Veterinario. (1985) 117:276. doi: 10.1136/vr.117.11.276
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Eibach, R, Puff, C, Dühlmeier, R, Jokiel, J y Kleinschmidt, S. Hallazgos tumorales poco frecuentes en la cavidad oral de dos cabras estrechamente relacionadas. Representante de casos de Vet Rec. (2015) 3:E000230. doi: 10.1136/vetreccr-2015-000230
8. Steinberg, H, y George, C. Sarcoma osteogénico asociado a fractura y un osteoma mandibular en dos cabras. J Comp Pathol. (1989) 100:453–7. doi: 10.1016/0021-9975(89)90012-1
9. Murphy, B, Gasper, D, y Pool, R. Fibroma nonosificante en la mandíbula de una cabra. Veterinario Pathol. (2011) 48:1161–4. doi: 10.1177/0300985810396514
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Dixon, J, Smith, K, Perkins, J, Sherlock, C, Mair, T y Weller, R. Diagnóstico por imágenes: la apariencia tomográfica computarizada de un tumor de células gigantes que afecta la mandíbula de una cabra pigmea. Ecografía Radiol Veterinaria. (2016) 57:E51-3. doi: 10.1111/vru.12319
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Dittmer, KE, y Pemberton, SA. Abordaje holístico de los tumores óseos en perros y gatos: correlación radiográfica e histológica. Veterinario Pathol. (2021) 58:841–57. doi: 10.1177/0300985821999832
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Skubitz, KM. Tumor óseo de células gigantes: opciones de tratamiento actuales. Opciones de curr treat en Oncol. (2014) 15:507–18. doi: 10.1007/s11864-014-0289-1
13. Blondel, M, Gros, L, Semin, MO, Delverdier, M, Palierne, S, y Autefage, A. Un caso de tumor óseo de células gigantes en un perro. VCOT abierto. (2019) 2:e64-9. doi: 10.1055/s-0039-3400513
14. Caldero Carrete, J, Tabáñez, J, Civello, A, y Rusbridge, C. Tumor vertebral de células gigantes de hueso en un gato doméstico de pelo corto. FMS Rep. Abierto (2023) 9:20551169231160227. doi: 10.1177/20551169231160227
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Ferreras, MC, Fuertes, M, y Pérez, V. Tumor de células gigantes óseas en un gato con metástasis extraesqueléticas: estudio patológico e inmunohistoquímico. J Vet Med A Physiol Pathol Clin Med. (2005) 52:225–9. doi: 10.1111/j.1439-0442.2005.00720.x
16. Thornburg, LP. Tumor óseo de células gigantes en un gato. Veterinario Pathol. (1979) 16:255–7. doi: 10.1177/030098587901600211
17. May, SA, y Baker, JR. Tumor de células gigantes (osteoclastoma) de la tibia en un caballo. Veterinario Equino J. (1985) 17:477–9. doi: 10.1111/j.2042-3306.1985.tb02562.x
18. Flanagan, AM, Larousserie, F, y O’Donnell, PG. Tumor de células gigantes de hueso en: Consejo editorial de la clasificación de tumores de la OMS, editor. Tumores de tejidos blandos y huesos. Lyon: Agencia Internacional para la Investigación sobre el Cáncer Press (2020). 440–6.
19. Dominkus, M, Ruggieri, P y Bertoni, F. Metástasis pulmonares verificadas histológicamente en tumores benignos de células gigantes: 14 casos de una sola institución. Int Orthop. (2006) 30:499–504. doi: 10.1007/s00264-006-0204-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Wagrodzki, M, Tysarowski, A, Seliga, K, Wojnowska, A, Stepaniuk, M, Castañeda Wysocka, P, et al. Utilidad diagnóstica del análisis genético e inmunohistoquímico de la mutación H3-3A en el tumor de células gigantes de hueso. Int J Mol Sci. (2022) 23:969. doi: 10.3390/ijms23020969
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Arzi, B, Cissell, DD, Pollard, RE, y Verstraete, FJM. Abordaje regenerativo de la reconstrucción mandibular rostral bilateral en una serie de casos de perros. Veterinario delantero Sci. (2015) 2:4. doi: 10.3389/fvets.2015.00004
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. French, DA, Fretz, PB y Davis, GD. Adamantinoma mandibular en un tratamiento quirúrgico radical con caballos. Cirugía veterinaria. (1984) 13:165–71. doi: 10.1111/j.1532-950X.1984.tb00783.x
23. Pusterla, THN, Guedes, AGP, y Verstraete, FJM. Evaluación y uso clínico de un bloqueo intraoral del nervio alveolar inferior en el caballo. Veterinario Equino J. (2014) 46:706–10. doi: 10.1111/evj.12219
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. O’Morrow, C. Anestesia dental avanzada con bloqueo nervioso local. ¿Puede Vet J. (2010) 51:1411–5.
25. Murphy, BG, Bell, CM y Soukup, JW. Patología Oral y Maxilofacial Veterinaria. 1ª ed. Hoboken, NJ: John Wiley & Sons (2020).
26. Weissenbacher-Lang, C, Blasi, B, Bauer, P, Binanti, D, Bittermann, K, Ergin, L, et al. Detección de pneumocystis y descripción morfológica de la distribución fúngica y severidad de la infección en treinta y seis especies de mamíferos. J Hongos. (2023) 9:220. doi: 10.3390/jof9020220
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Salón, TA. Un editor de alineación de secuencias biológicas y un programa de análisis fácil de usar para Windows 95/98/NT. Ácidos nucleicos. (1999) 41:95–8.
28. Sobti, A, Agrawal, P, Agarwala, S y Agarwal, M. Tumor óseo de células gigantes: una descripción general. Arco Hueso Jt Surg. (2016) 4:2–9.
29. Montgomery, C, Couch, C, Emory, CL y Nicholas, R. Tumor óseo de células gigantes: revisión de la literatura actual, evaluación y opciones de tratamiento. J Cirugía de rodilla. (2019) 32:331–6. doi: 10.1055/s-0038-1675815
30. Kumar, SK, Agarwal, J, Gupta, A, y Bhushan, DV. Tumor de células gigantes de la mandíbula: reporte de un caso. Indio J Otolaryngol Cabeza Cuello Surg. (2024) 76:2113–6. doi: 10.1007/s12070-023-04431-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Klienkoff, P, Weingertner, N, Geyer, L, Gros, CI, Kurtz, JE y Bornert, F. Tratamiento de un raro tumor de células gigantes mandibulares de hueso mediante terapia y cirugía neoadyuvante con denosumab: un informe de caso de seguimiento de 4 años. Int J Surg Case Rep. (2023) 112:108980. doi: 10.1016/j.ijscr.2023.108980
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Giri, GVV, Sukumaran, G, Ravindran, C y Narasimman, M. Tumor de células gigantes de la mandíbula. J Oral Maxillofac Pathol. (2015) 19:108. doi: 10.4103/0973-029X.157217
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Mikiewicz, M, Paździor-Czapula, K, Gesek, M, Lemishevskyi, V, y Otrocka-Domagała, I. Tumores de la cavidad oral canina y felina y lesiones similares a tumores: un estudio retrospectivo de 486 casos (2015-2017). J Comp Pathol. (2019) 172:80–7. doi: 10.1016/j.jcpa.2019.09.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Naik, MV, Nishikawa, G, Kirino, Y, Inoue, Y, Iwamoto, K, Yamabe, R, et al. Mandibulectomía rostral bilateral para el tratamiento de las fracturas abiertas necróticas mandibulares en dos bovinos negros japoneses. J Vet Med Sci. (2020) 82:204–8. doi: 10.1292/jvms.19-0160
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Cai, M, Shen, G, Hua-an Cheng, A, Lin, Y, Yu, D y Ye, M. Osteogénesis de distracción corporal mandibular asistida por navegación: un estudio preliminar en cabras. J Cirugía Oral Maxilofác. (2014) 72:168.e1–7. doi: 10.1016/j.joms.2013.09.016
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Lin, X, Zhou, L, Shang, H, Liu, Y y Bo, B. Uso de un distractor bidireccional interno para alargar las mandíbulas de las cabras. Br J Cirugía Maxilofac Oral. (2012) 50:e49-52. doi: 10.1016/j.bjoms.2011.09.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Umphlet, RC, Johnson, AL, Eurell, JC y Losonsky, J. El efecto de la hemimandibulectomía rostral parcial sobre la movilidad mandibular y la morfología de la articulación temporomandibular en el perro. Cirugía veterinaria. (1988) 17:186–93. doi: 10.1111/j.1532-950x.1988.tb00996.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: mandibulectomía, neoplasia, animal grande, cirugía, cáncer oral, tumor de células gigantes (TCG), cirugía de cabeza
Cita: Biermann NM, Piechl S, Dinhopl N, Fuchs-Baumgartinger A, Weissenbacher-Lang C y Bertram CA (2024) Informe de caso: Tumor de células gigantes de hueso en la mandíbula de una cabra: diagnóstico, tratamiento quirúrgico y resultado. Frente. Vet. Sci. 11:1457223. doi: 10.3389/fvets.2024.1457223
Recibido: 30 de junio de 2024; Aceptado: 22 de julio de 2024;
Publicado: 08 de agosto de 2024.
Editado por:
Boaz Arzi, Universidad de California, Davis, Estados Unidos
Revisado por:
Scott Katzman, Universidad de California, Davis, Estados
Unidos Brian Murphy, UC Davis Health, Estados Unidos
Derechos de autor © 2024 Biermann, Piechl, Dinhopl, Fuchs-Baumgartinger, Weissenbacher-Lang y Bertram. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Nora M. Biermann, nora.biermann@vetmeduni.ac.at
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía