Remisión clínica completa de la histiocitosis progresiva felina tras tratamiento multimodal
 Bruna Voltolin de Sena1
Bruna Voltolin de Sena1 Paula Baêta da Silva Ríos Turquete1
Paula Baêta da Silva Ríos Turquete1 Pedro Antônio Bronhara Pimentel1
Pedro Antônio Bronhara Pimentel1 Isabella Oliveira Almeida1
Isabella Oliveira Almeida1 Gleidice Eunice Lavalle1
Gleidice Eunice Lavalle1 Karen Yumi Ribeiro Nakagaki2
Karen Yumi Ribeiro Nakagaki2 Antonio Giuliano3*
Antonio Giuliano3* Paulo Ricardo de Oliveira Paes1
Paulo Ricardo de Oliveira Paes1 Rodrigo dos Santos Horta1
Rodrigo dos Santos Horta1- 1Departamento de Medicina y Cirugía Veterinaria, Facultad de Veterinaria, Universidade Federal de Minas Gerais, Belo Horizonte, Minas Gerais, Brasil
- número arábigoDirector y Responsable Técnico en CELULAVET, Belo Horizonte, Brasil
- 3Departamento de Ciencias Clínicas Veterinarias, Facultad de Medicina Veterinaria del Jockey Club, Universidad de la Ciudad de Hong Kong, Hong Kong, RAE de Hong Kong, China
Las enfermedades histiocíticas felinas son poco frecuentes y rara vez se notifican. La histiocitosis progresiva felina (HPF) es la enfermedad histiocítica más común en gatos, afectando predominantemente a animales de mediana edad. La presentación más común es la forma cutánea con nódulos cutáneos solitarios o múltiples. Una gata mestiza de 6 años de edad se presentó con una historia de 9 meses de un nódulo en el plano nasal y se le diagnosticó proliferación histiocítica mediante histopatología. En el momento del diagnóstico, se descubrieron nuevos nódulos en el labio inferior, el dedo, y dos lesiones en la región de la cola, la mayor de las cuales medía 1,5 cm. La inmunohistoquímica suplementaria mostró un inmunomarcaje para Iba-1 que, en combinación con el curso clínico de la enfermedad, confirmó el diagnóstico de HPF. No se logró ninguna respuesta al tratamiento quimioterápico con lomustina alternado con doxorrubicina. El fosfato de toceranib produjo una respuesta transitoria y una enfermedad estable durante un corto período (6 semanas). Se inició electroquimioterapia con bleomicina y resultó en remisión parcial. Más tarde, también se inició el tratamiento con clorambucilo. En última instancia, la combinación de los tres tratamientos condujo a una respuesta completa y a la desaparición de todas las lesiones. La FPH se considera una enfermedad resistente a diversos tratamientos, y no se han reportado tratamientos efectivos. En este reporte de caso, describimos un abordaje terapéutico multimodal exitoso que resultó en la resolución completa de la FPH y la supervivencia a largo plazo (460 días sin lesiones externas en el momento de la muerte). Son necesarios más estudios para confirmar la eficacia de este enfoque terapéutico.
Fondo
Los histiocitos derivan de precursores de células madre CD34+, que se diferencian en macrófagos y linaje de células dendríticas. Este último incluye las células dendríticas intersticiales (CI) ubicadas en áreas perivasculares locales y varios órganos, así como las células de Langerhans (LC) que se encuentran dentro de los epitelios de la piel, el tracto gastrointestinal, respiratorio y reproductivo (1). Las células dendríticas son las células presentadoras de antígenos más potentes para inducir respuestas inmunitarias en las células T vírgenes. Una interacción defectuosa entre las células dendríticas y las células T puede provocar trastornos en la regulación inmunitaria y contribuir al desarrollo de trastornos histiocíticos (2). La mayoría de las enfermedades histiocíticas en perros y gatos implican proliferaciones de CI, pero otros linajes pueden estar implicados alternativamente (3).
Los trastornos histiocíticos están documentados en humanos, perros y gatos; Sin embargo, su etiología y patogenia siguen siendo desconocidas, y el curso suele ser mortal (4-6). En medicina humana, hay muchos subtipos de trastornos histiocíticos. La última publicación de la Histiocyte Society clasificó las histiocitosis en función de las características radiológicas, histopatológicas, fenotípicas y moleculares en los siguientes grupos: relacionadas con células de Langerhans (grupo L), cutáneas y mucocutáneas (grupo C), histiocitosis maligna (grupo M), enfermedad de Rosai-Dorfman (grupo R), linfohistiocitosis hemofagocítica y síndrome de activación de macrófagos (grupo H) (7). En perros, las manifestaciones histiocíticas incluyen histiocitosis reactiva, histiocitoma, histiocitosis cutánea de células de Langerhans y formas más graves como el sarcoma histiocítico y el sarcoma histiocítico hemofagocítico, todas las cuales pueden presentarse como enfermedad localizada y/o sistémica (2).
Las enfermedades histiocíticas felinas son poco frecuentes y rara vez se notifican. Estos trastornos incluyen el sarcoma histiocítico (HS) (originado por los IC), el sarcoma histiocítico hemofagocítico (originado por los macrófagos), la histiocitosis progresiva felina (FPH) (originada por los IC), la histiocitosis pulmonar de células de Langerhans y, el histiocitoma felino reportado esporádicamente (originado por los LC) (6).
La FPH es la enfermedad histiocítica más común en los gatos, que suele manifestarse con la forma cutánea. Sin embargo, sigue siendo una enfermedad rara que afecta a la mayoría de las hembras, normalmente a los gatos de mediana edad a los ancianos, sin ninguna predilección de raza (8). La etiología de la FPH no se conoce bien, pero la estimulación antigénica crónica se ha considerado un factor desencadenante en su desarrollo. Clínicamente, se comporta como una HS de bajo grado que se origina a partir de células dendríticas residentes dentro de la piel (3). Inicialmente aparecen nódulos cutáneos solitarios o múltiples no pruriginosos e indoloros, localizados principalmente en cabeza, extremidades inferiores y tronco. La superficie suele ser alopécica y puede ulcerarse (9). Las lesiones pueden aumentar de tamaño, fusionarse en placas o disminuir espontáneamente de tamaño, pero no se produce una regresión completa (3). Aunque inicialmente se limitan a la piel, en un plazo de un mes a 3 años, pueden progresar a una neoplasia histiocítica maligna con metástasis en los ganglios linfáticos, el hígado, el bazo, los riñones, los pulmones y la médula ósea, que finalmente culmina en la muerte espontánea o la eutanasia. La confirmación diagnóstica concluyente se basa en evaluaciones histopatológicas e inmunohistoquímicas en combinación con la presentación clínica (3, 9).
Histológicamente, las lesiones consisten en infiltrados difusos y densos de células histiocíticas en la dermis y el tejido subcutáneo, mal delimitados (3, 10). En las primeras etapas, están bien diferenciados con un recuento mitótico bajo, pero con la progresión, puede ocurrir pleomorfismo celular, aumento del recuento mitótico y multinucleación, similar a la HS (9). La distinción entre los subtipos histiocíticos no es posible con la histopatología de rutina y requiere inmunohistoquímica. Entre los trastornos histiocíticos, el perfil inmunofenotípico del sarcoma histiocítico hemofagocítico es IBA-1+, CD204+, MHC-II-, E-cadherina-; para HS, histiocitosis reactiva y FPH, es IBA-1+, CD204±, MHC-II+, E-cadherina-; y en el histiocitoma y la histiocitosis cutánea de células de Langerhans (incluida la pulmonar felina) es IBA-1+, CD204±, MHC-II+, E-cadherina+. En FPH se han observado variaciones como CD5+ y E-cadherina+ en el 50% y 10% de los casos, respectivamente (2, 9, 11).
El abordaje de la neoplasia histiocítica presenta desafíos no solo en el diagnóstico sino también en el tratamiento. Se han descrito terapias con corticoides, antibióticos, interferón, L-asparaginasa, mostaza nitrogenada, vincristina y vinblastina, pero no han mostrado resultados satisfactorios (3, 12). La resección quirúrgica es cuestionable una vez que la recidiva local o a distancia es común (2). Sin embargo, los pacientes en la presentación inicial sin signos de metástasis (como el agrandamiento de los ganglios linfáticos) pueden beneficiarse de una resección quirúrgica amplia que muestre un mayor intervalo libre de enfermedad (10). Si bien el tratamiento en medicina humana está estandarizado, según el tipo de histiocitosis, la extensión de la enfermedad, el fenotipo y las características moleculares, no existen tratamientos efectivos ni estándares de atención para la enfermedad histoicítica felina. Por ejemplo, en histiocitosis comunes en adultos, como la histiocitosis de células de Langerhans, la enfermedad de Erdheim-Chester y la enfermedad de Rosai-Dorfman, cuando presentan mutaciones en la vía MAPK/ERK, el tratamiento incluye cobimetinib/trametinib. Sin embargo, se utilizan una serie de fármacos como la prednisolona, la vinblastina, la hidroxiurea, la talidomida, la citarabina, el metotrexato y el interferón alfa-2a, adaptados a la enfermedad específica (7).
La electroquimioterapia (TEC) es un tratamiento local que combina la acción de un fármaco citotóxico con la electroporación de la membrana celular a través de pulsos eléctricos, permitiendo una mayor penetración y potenciación de moléculas hidrofílicas como la bleomicina o el cisplatino. Se ha utilizado como terapia única o adyuvante para varios tipos de tumores cutáneos solitarios superficiales, mostrando altas tasas de respuesta con efectos secundarios mínimos y respuestas notables. Sin embargo, existe una variabilidad en la tasa de respuesta dependiendo de los tipos de tumor. Los tumores que muestran una alta tasa de respuesta, especialmente para las masas pequeñas, son: melanoma canino oral (alrededor del 90%), carcinoma cutáneo de células escamosas felino (alrededor del 80%), sarcoides equinos (alrededor del 97%), alrededor del 100% para tumores menores de 2cm3 (13, 14).
Este estudio tuvo como objetivo reportar el primer caso de FPH con respuesta completa documentada de las lesiones cutáneas utilizando un abordaje terapéutico multimodal, incluyendo TEC.
Descripción del caso
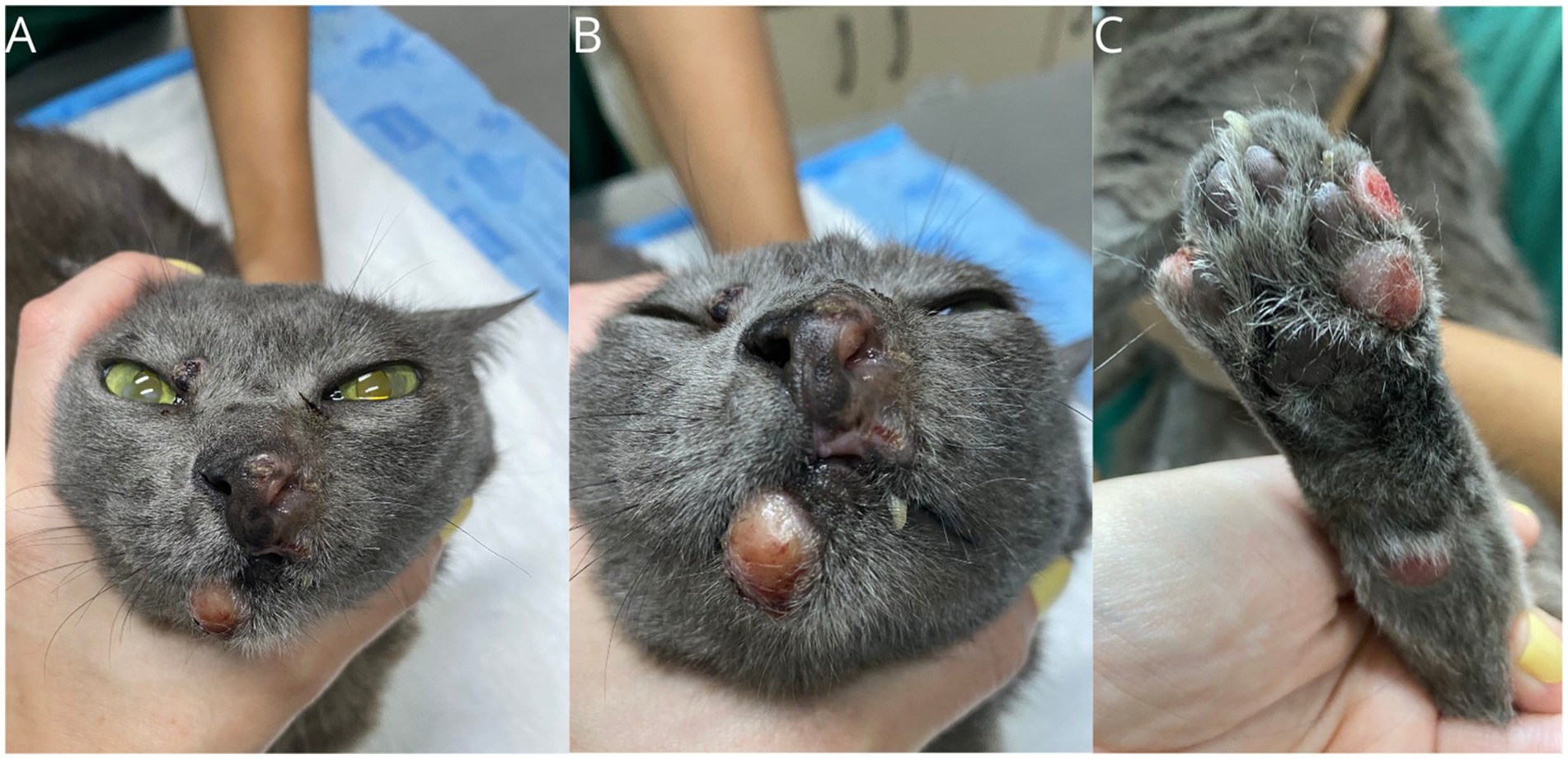
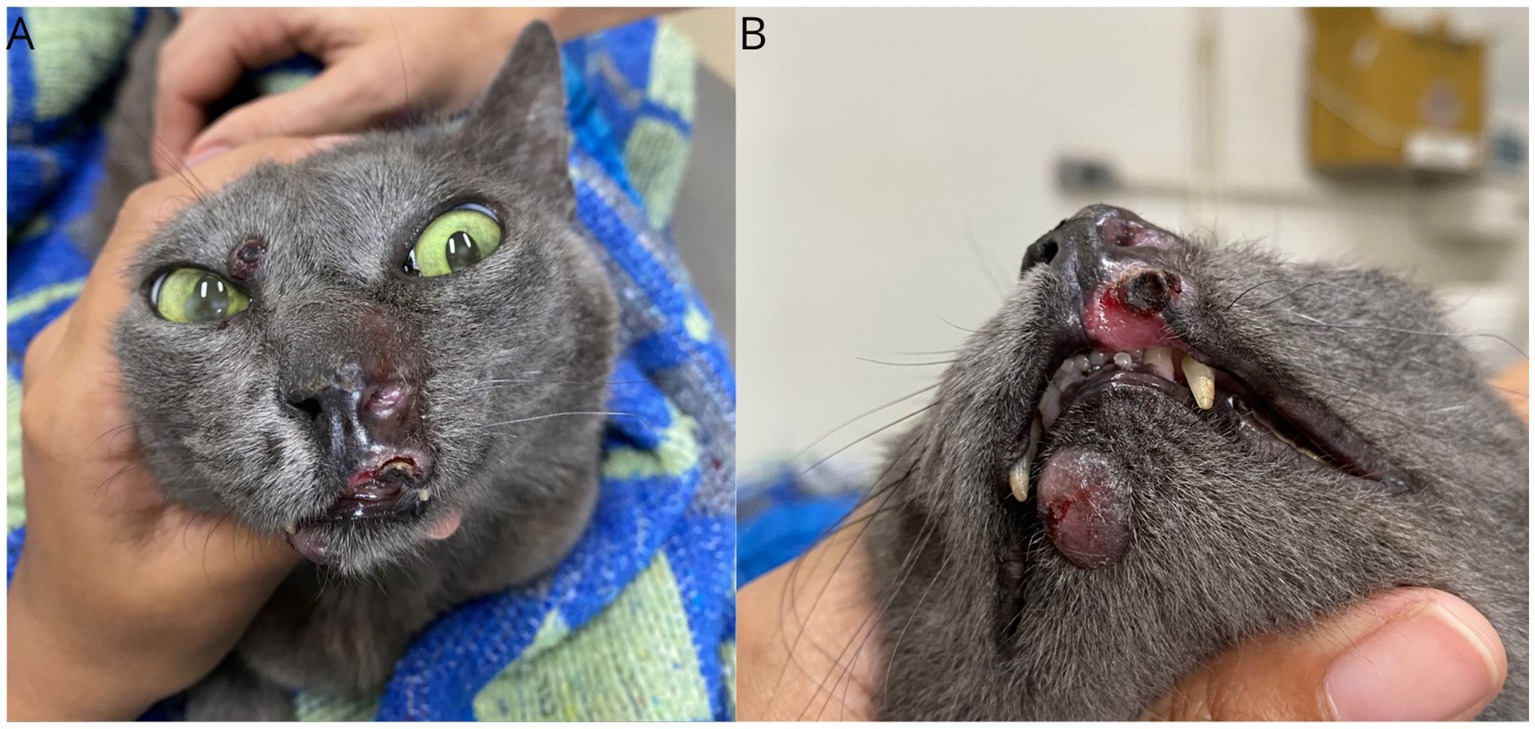
Una gata doméstica mestiza, esterilizada y de 6 años de edad, con un peso de 3,6 kg, fue remitida con antecedentes de una lesión nodular en el plano nasal que había persistido durante los últimos 9 meses. A la exploración física, los parámetros vitales se encontraban dentro de la normalidad y el gato se encontraba sano, excepto por la presencia de lesiones nodulares, alopecicas, no ulceradas en la región nasal, labio inferior, dedo y dos lesiones en la cola, la mayor de 1,5 cm (Figura 1). El paciente dio negativo en el SNAP Combo FIV/FeLV (Alere®) y una biopsia incisional realizada en otro centro veterinario fue diagnóstica de proceso proliferativo histiocítico. La biopsia reveló una marcada presencia de infiltrados histiocíticos en la dermis superficial y profunda. Las células tenían un citoplasma ancho, ligeramente eosinófilo, y núcleos centrales, grandes y redondeados, que ocasionalmente mostraban una ligera hendidura, cromatina con márgenes y nucléolos evidentes. Había 12 figuras mitóticas en 2,37mm2, pleomorfismo moderado con cariomegalia ocasional y un discreto infiltrado linfoplasmocítico.
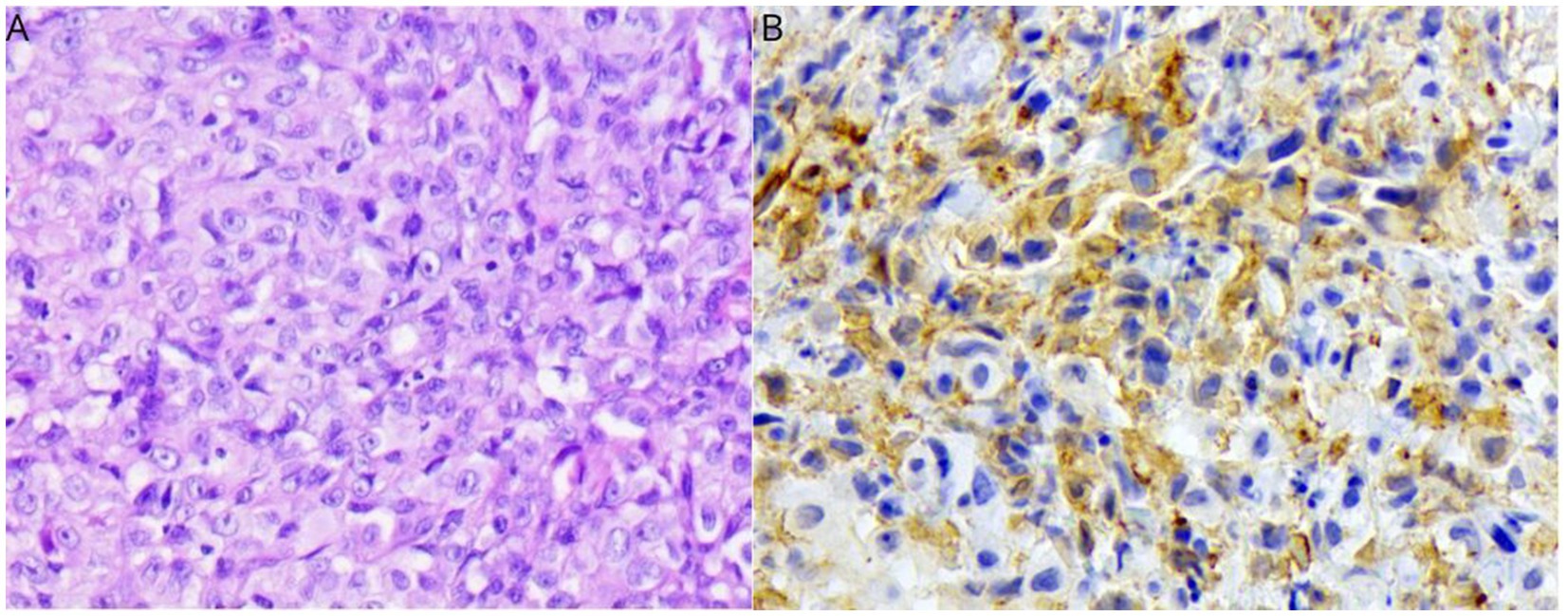
Se solicitó un panel de inmunohistoquímica en la muestra recolectada previamente que incluía marcadores de citoqueratina Iba-1, CD3, Granzima B, CD20, CD117, MUM1, Pax-5 y Pan. Solo Iba-1 fue positivo, confirmando el origen histiocítico (Figura 2). El procedimiento incluyó cortes de 4 μm, desparafinados en xileno e hidratados en concentraciones decrecientes de etanol, seguidos de enjuague en agua destilada. Para la recuperación de antígenos, se utilizó una solución de pH alto (Target Retrieval Solution High pH-DM828, K800221-2 EnV FLEX+, High pH Link, DAKO) en una olla a presión (PascalR, Dako), a excepción de CD20 (Polyclonal, Thermo Fisher Scientific) que no se sometió a recuperación de antígenos. A continuación, los portaobjetos se enfriaron a temperatura ambiente durante 20 minutos y se enjuagaron con agua desionizada. Para bloquear la peroxidasa, los portaobjetos se sumergieron en peróxido de hidrógeno listo para usar (EnVisionTM FLEX PEROXIDASA REACTIVO BLOQUEANTE SM801, K800221-2 EnV FLEX+, High pH Link, DAKO). A continuación, las secciones se lavaron con solución de tris (pH 7,4) y posteriormente se bloquearon para reacciones proteicas inespecíficas (bloque de proteínas sin suero– DAKO, X0909). A continuación, se incubó con el anticuerpo primario durante 18 h a 4 °C. Finalmente, se realizó la amplificación y detección con EnVision FLEX/HRP, SM802 (Dako) y el cromógeno diaminobenzidina (EnVision FLEX DAB+CHROMOGEN, DM827, DAKO), seguido de contratinción con hematoxilina de Harris. Se puede encontrar información adicional en la Tabla 1. La investigación adicional y la evaluación general incluyeron ecografía abdominal, radiografía torácica de tres vistas, hemograma completo y bioquímica sérica (urea, creatinina, ALT, AST, GGT, fosfatasa alcalina, proteínas y fracciones, calcio y fósforo), pero todas fueron normales.
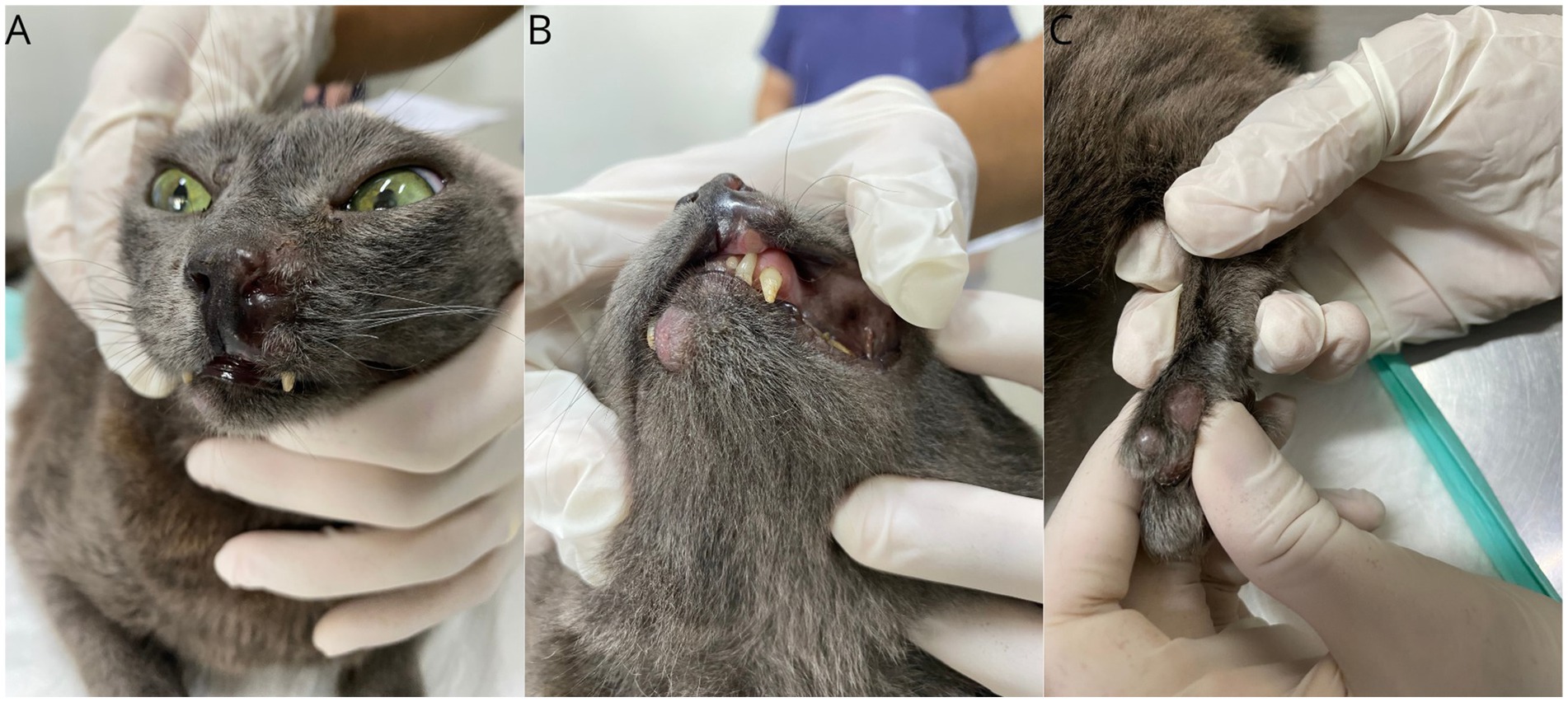
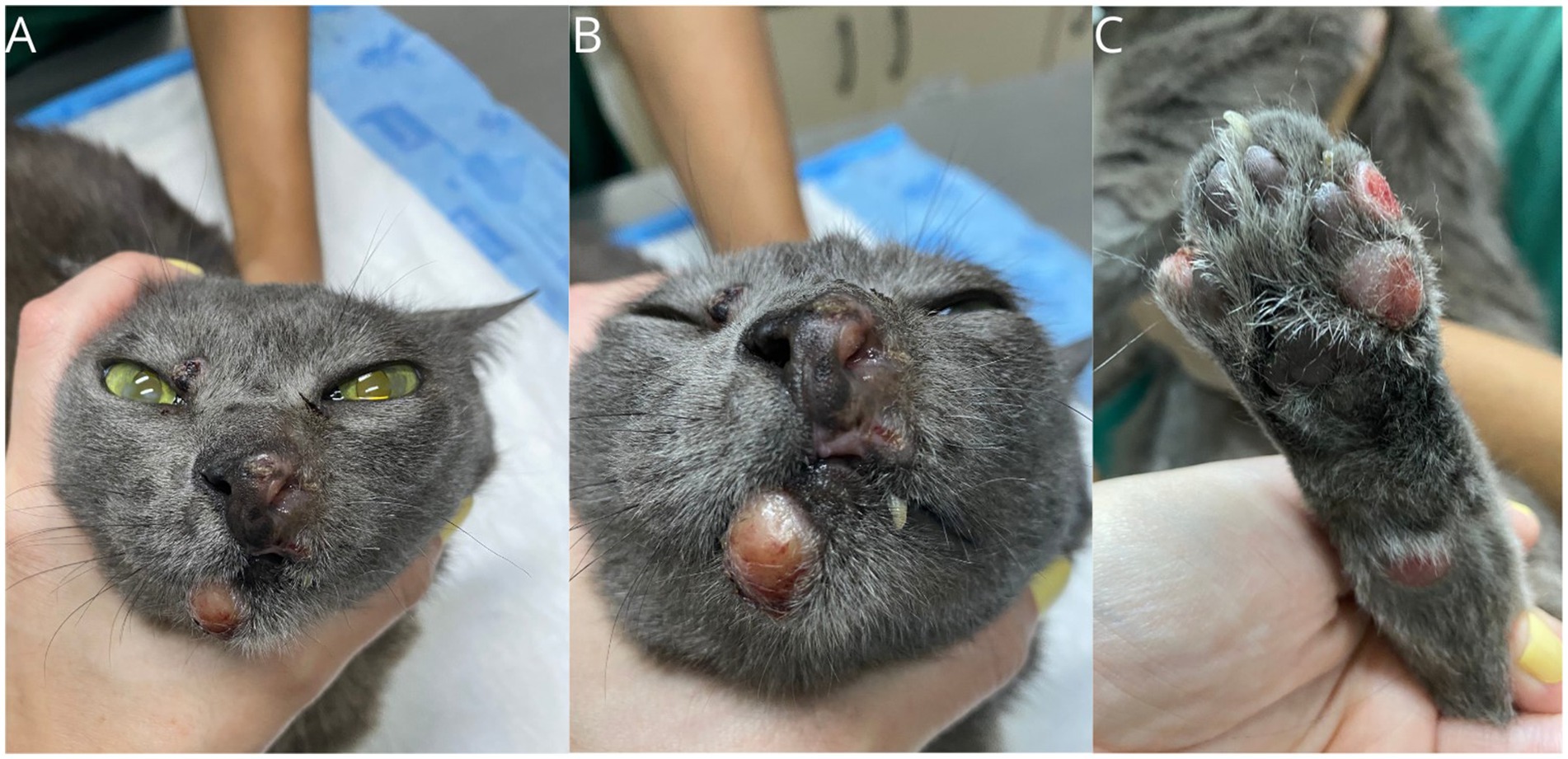
Tras el diagnóstico de FPH, se inició tratamiento quimioterápico con lomustina oral (Compounding pharmacy, Brasil) a dosis de 35 mg/m2 y doxorrubicina intravenosa (Rubidox-Bergamo®, Brasil) a dosis de 1 mg/kg, alternados con un intervalo de 14 días entre medicamentos. También se prescribieron prednisolona (Prediderm-Ourofino®, Brasil-0,7 mg/kg, PO, BID) y omega-3 (Omega TOP 3-Agener® União, Brasil-500 mg, PO, SID, uso continuo). No hubo respuesta objetiva a los 14 días de una dosis única de cada quimioterápico, y la enfermedad progresó, con aumento del tamaño y número de lesiones, algunos nódulos también se ulceraron (Figura 3). En la misma visita, se observó neutropenia de grado III (630/μL, referencia 3.000-11.000) y trombocitopenia de grado I (126.000/μL, referencia 175.000-500.000), lo que resultó en una dosis subcutánea única de filgrastim (5 mcg/kg). Se cambió el tratamiento, se suspendieron prednisolona, lomustina y doxorrubicina y se inició tratamiento con toceranib fosfato a dosis de 10 mg/gato los días lunes, miércoles y viernes, manteniendo la suplementación con omega-3.
Después de 21 días de uso de fosfato de toceranib, el paciente fue reevaluado y las lesiones aparecieron de tamaño similar pero menos edematosas, eritematosas y exudativas (Figura 4). Se repitieron los análisis de sangre, incluido el hemograma completo y la bioquímica sérica, y se encontró que estaban dentro de los valores normales. Se continuó con el tratamiento, seguido de un nuevo intento con una dosis oral única de lomustina (30 mg/m2) 33 días después del inicio de toceranib. Esta decisión se tomó debido a la potencial sensibilización de la lomustina por un inhibidor de la tirosina quinasa, aunque no existe una descripción de dicho beneficio para la FPH (15).
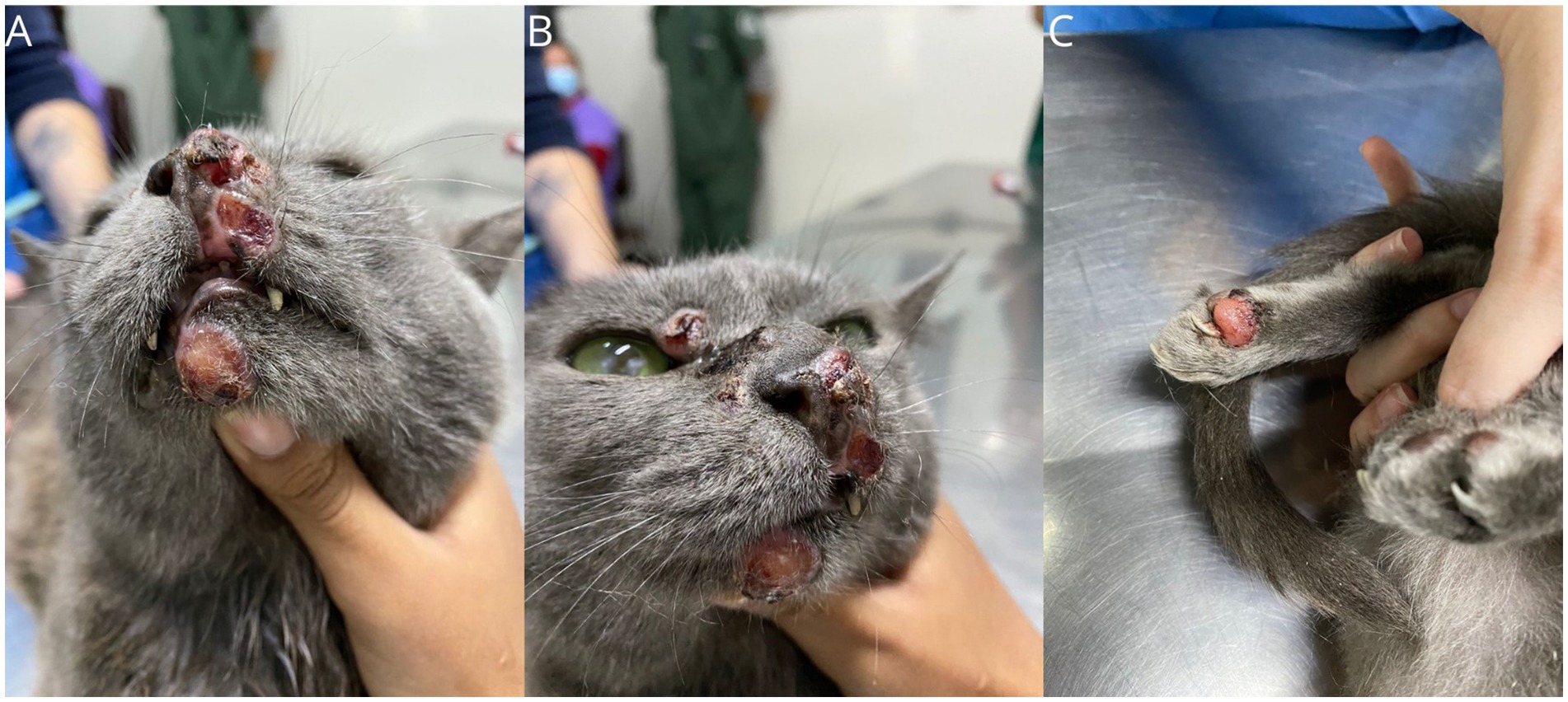
En el seguimiento posterior, tras casi 6 semanas de enfermedad estable, se observó una progresión significativa de las lesiones en la región nasal, junto con ulceración de las lesiones cutáneas (Figura 5) y un aumento del tamaño del ganglio linfático poplíteo izquierdo. El ganglio linfático se sometió a citología aspirativa con aguja fina (PAAF), confirmando la afectación de la FPH del ganglio linfático poplíteo (Figura 6D). El propietario informó que el animal experimentaba picazón y dolor en las lesiones de las extremidades debido al lamido excesivo, junto con letargo e hiporexia. También se prescribió tratamiento de soporte, incluyendo gabapentina (Compounding pharmacy, Brasil – 6 mg/kg, BID, uso continuo), mirtazapina (Mirtz® – Agener União, Brasil-2 mg/gato, cada 48 h, durante 14 días) y meloxicam (Flamavet® – Agener União, Brasil-0,02 mg/kg, SID, durante 14 días). Debido a la falta de éxito con los tratamientos instituidos, la electroquimioterapia (TEC) se realizó con ocho pulsos de onda cuadrada, de 100 microsegundos cada uno, con una amplitud de 1.000-1.300 V/cm y una frecuencia de 5 kHz. La bleomicina (Bonar® – IMA S.A.I.C., Argentina) se administró por vía intravenosa a una dosis de 15 UI/m2, 8 minutos antes de la electroporación. Se realizó electroporación en todas las lesiones, con un margen de 1-2 cm alrededor de cada lesión. Las primeras 4 aplicaciones se realizaron utilizando el dispositivo electroporador VETCP 125, que posteriormente fue sustituido por el ePORE, del mismo fabricante, utilizándolo en las dos últimas aplicaciones. El protocolo anestésico utilizado para las sesiones de TEC incluyó metadona (0,3 mg/kg IM) combinada con dexmedetomidina (5 mg/kg IM) (Dexdomitor® – Zoetis, Brasil) y ketamina (1 mg/kg IM) (Cetamin® – Syntec, Brasil) como medicación preanestésica; propofol (2 mg/kg IV) (Propovan® – Cristália, Brasil), ketamina (1 mg/kg IV) (Cetamin® – Syntec, Brasil) y fentanilo (2,5 μg/kg IV) (Fentanest® – Cristália, Brasil) para la inducción anestésica. Se utilizó sevoflurano como anestésico inhalatorio para el mantenimiento, junto con fentanilo (5 μg/kg IV) (Fentanest® – Cristália, Brasil).
Se realizaron un total de seis sesiones con intervalos de 22, 22, 32, 50 y 134 días, respectivamente (mediana de 32 días). Los exámenes preanestésicos hematológicos y de bioquímica sérica se realizaron dentro de los límites normales antes de cada tratamiento. Desde la primera sesión se obtuvo una respuesta parcial seguida de una reducción progresiva del tamaño de los nódulos. A los 18 días de la tercera sesión, hubo una reducción del 80% en el tamaño de los nódulos (Figura 7). Durante el seguimiento se realizaron radiografías torácicas y ecografía abdominal, sin signos de metástasis.
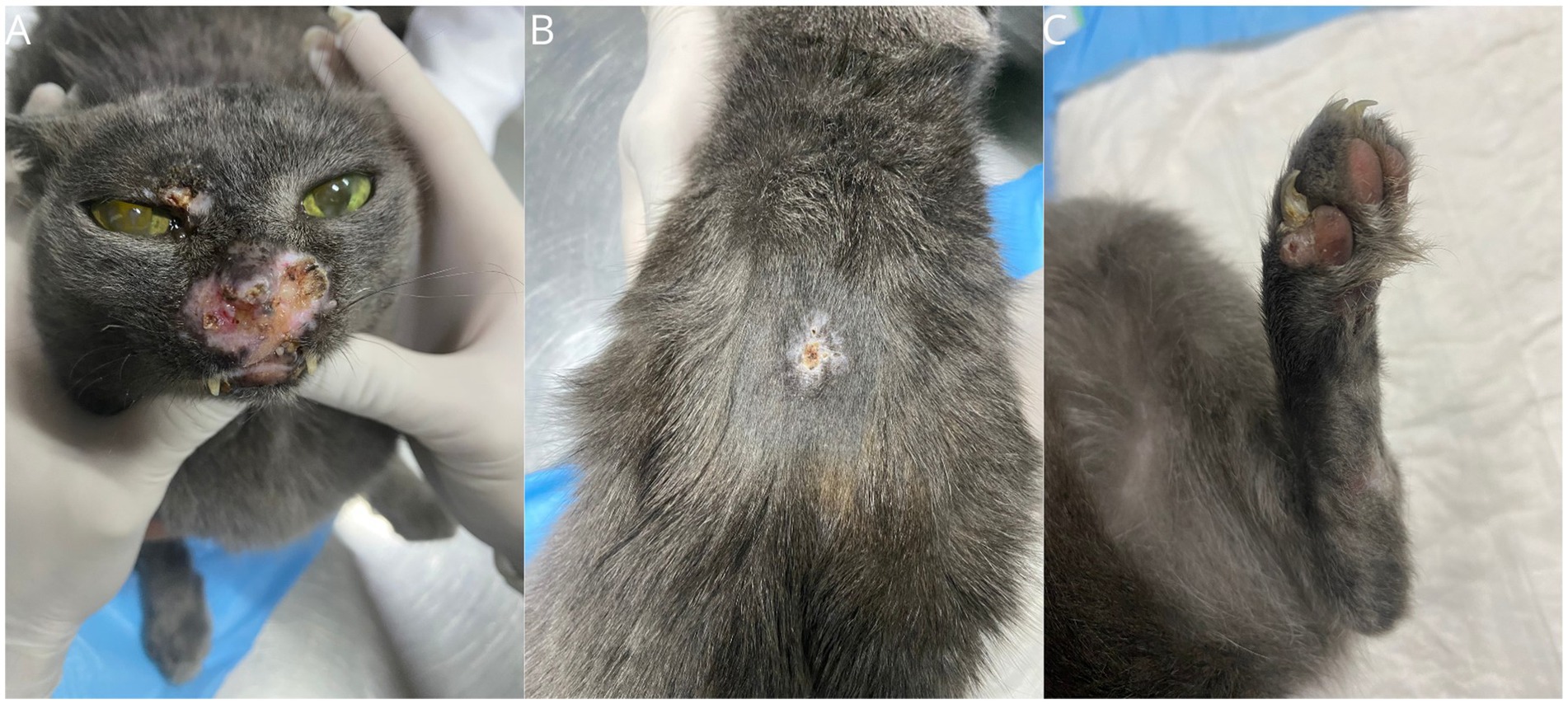
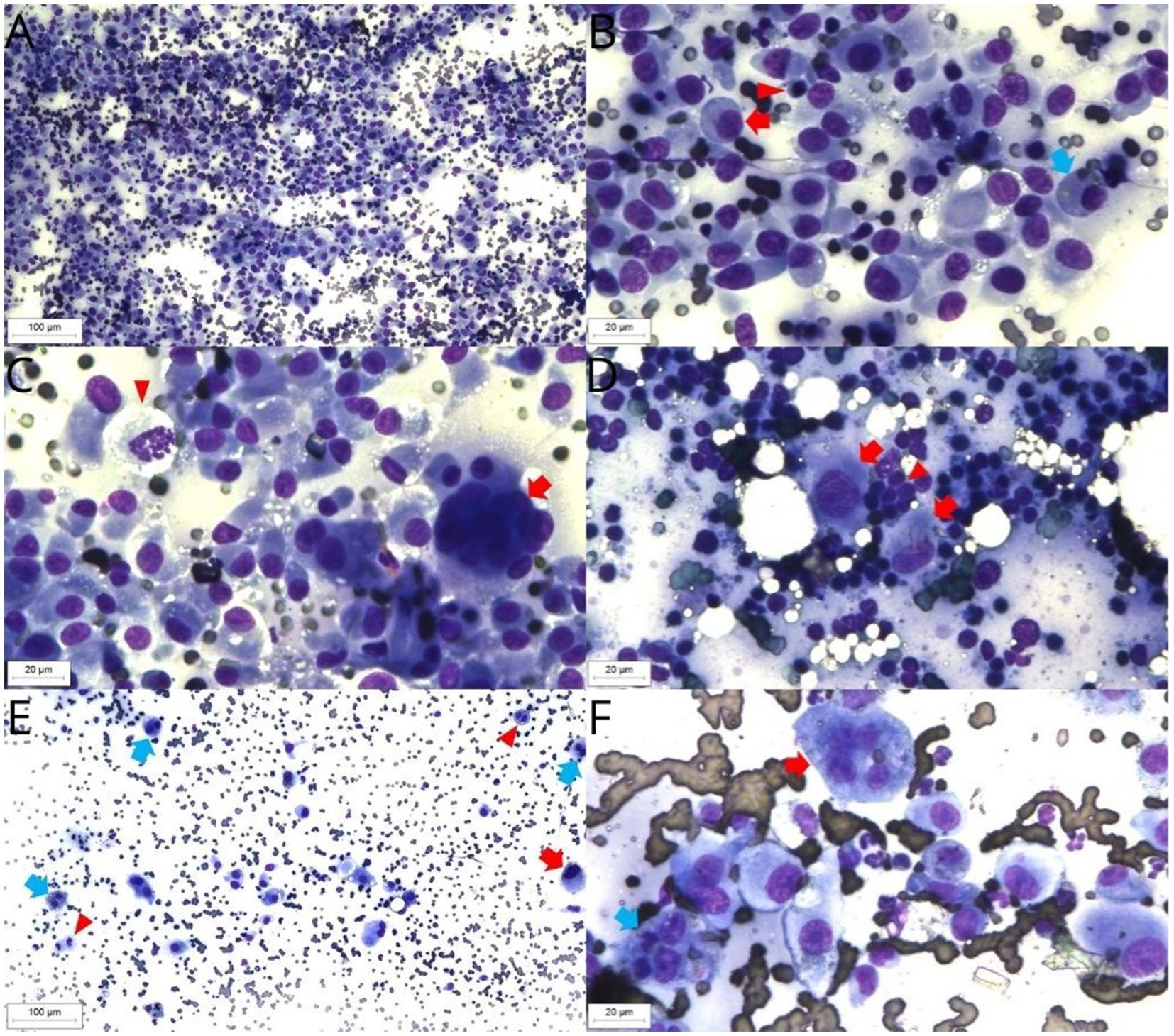
A los 21 días de la cuarta sesión de TEC, se observaron nuevas lesiones durante la exploración física, incluyendo los párpados superior e inferior, la región dorsal interescapular y la recidiva en la región nasal, la almohadilla digital de la extremidad posterior izquierda, la región tarsiana de la extremidad posterior derecha y dos nódulos en la cola. Además, había otro nódulo de 3 cm, firme, adherente y profundo en la región cervical central. La ecografía cervical sospechó un aumento de tamaño de la glándula tiroides izquierda o del ganglio linfático retrofaríngeo medial izquierdo, y se realizó citología aspirativa guiada con aguja fina para su evaluación. La citología describió la presencia abundante de histiocitos, ovalados a fusiformes, con relación núcleo/citoplasma baja a variable, núcleos ovalados, anisocitosis intensa, patrón de cromatina gruesa, nucléolos únicos y poco conspicuos, citoplasma discretamente basófilo y pobremente demarcado, presencia leve a moderada de células binucleadas y células grandes, así como citofagocitosis y eritrofagocitosis, con más de 5 figuras mitóticas por campo (Figuras 6A-C). El paciente fue remitido a tomografía computarizada, que reveló aumento de tamaño del ganglio linfático retrofaríngeo medial (3,5 cm × 1,8 cm × 1,8 cm), ganglio linfático retrofaríngeo medial derecho (2,1 cm × 0,8 cm × 0,3 cm) y ganglio linfático cervical superficial izquierdo con ligero aumento de volumen, así como ganglio linfático mandibular izquierdo con aumento moderado de volumen. No había anomalías en las glándulas tiroides. A la luz de estos hallazgos, se intensificó el tratamiento con la adición de clorambucilo a una dosis de 2 mg/gato los lunes, miércoles y viernes.
El paciente fue evaluado 21 días después de la terapia combinada con toceranib fosfato y clorambucilo. El ganglio linfático retrofaríngeo ya no era palpable y las lesiones cutáneas eran más pequeñas.
Para el control del resto de lesiones cutáneas, se continuó el tratamiento con TEC. Sin embargo, se instituyó un intervalo más largo entre sesiones para reducir los costos y mejorar el bienestar de los pacientes. Tras completar 6 sesiones de TEC, a los 200 días del inicio del tratamiento con toceranib fosfato y a los 114 días de la combinación de toceranib fosfato y clorambucilo, se observó una remisión completa de las lesiones cutáneas (Figura 8) y no se observaron alteraciones en la exploración física, la ecografía abdominal y las radiografías torácicas. El letargo y la hiporexia se observaron hasta 2 días después de la TEC durante las sesiones 1, 2, 4 y 6. Además, el paciente presentó molestias respiratorias tras la formación de costras en la región nasal después de las dos primeras sesiones, observándose una mejoría inmediata tras la retirada de la costra. Se observó y monitorizó neutropenia asintomática de grado I durante el tratamiento combinado continuo.
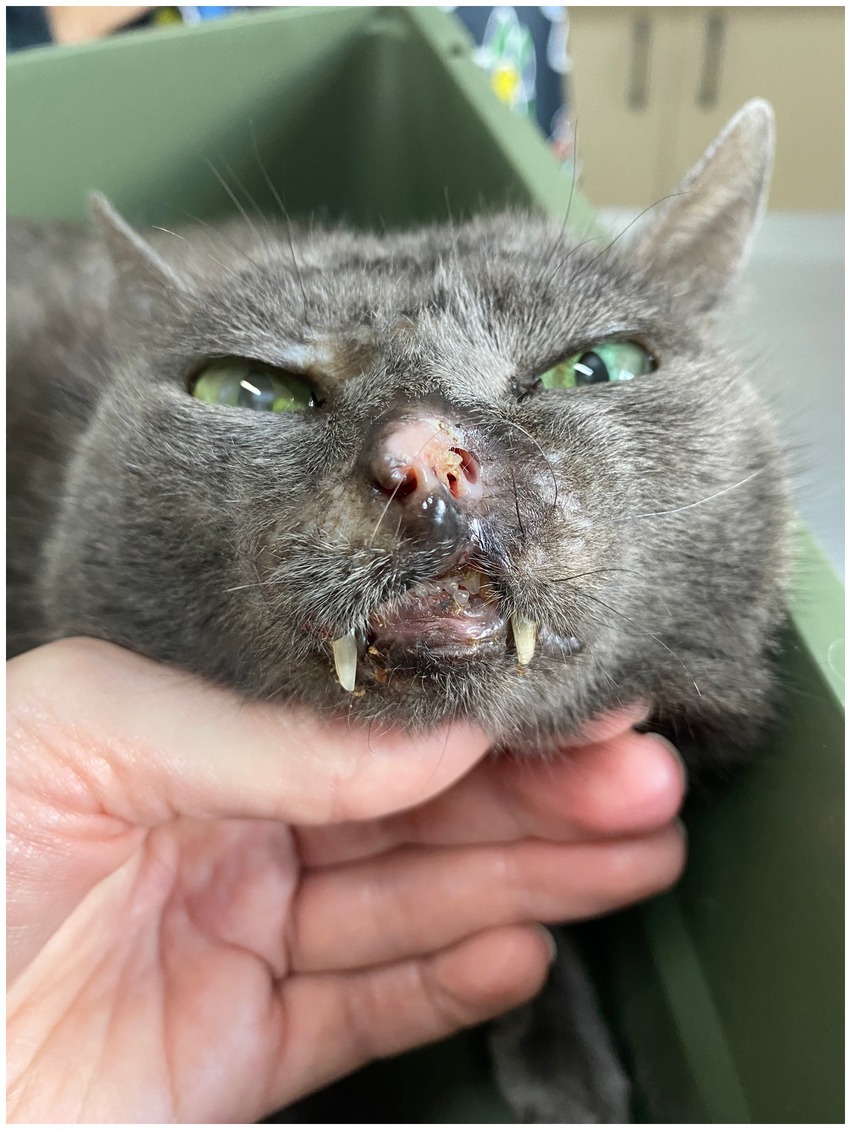
Tres meses después de la última sesión de TEC, el paciente presentó síntomas de hiporexia, letargo y pérdida de peso. Se observó un aumento del volumen del ganglio cervical superficial derecho y se recogió una muestra mediante citología aspirativa con aguja fina. Los resultados de la citología mostraron un aumento de la atipia celular en comparación con el examen previo. Además de las características observadas anteriormente, se observaron núcleos redondos, nucleolos prominentes, simples y ocasionalmente múltiples. Se observaron núcleos multivacuolados, figuras de citofagocitosis y multinucleación, así como figuras mitóticas atípicas, lo que favoreció un diagnóstico sugestivo de HS (Figuras 6E,F). Se solicitó ecografía abdominal, radiografías torácicas de tres proyecciones y análisis de sangre, pero el animal falleció en su casa, probablemente debido a la progresión de la enfermedad, 460 días después del diagnóstico. La autopsia fue rechazada por el propietario.
Discusión
Dado que tanto la FPH como la HS se originan a partir de CI, son inmunofenotípicamente idénticas y la diferenciación entre estas dos condiciones radica en la atipia celular más marcada en la HS en comparación con la FPH (9). Sin embargo, el aspecto clínico típico de la FPH y la HS es diferente, lo que puede ayudar en el diagnóstico. La HPH inicialmente tiene un comportamiento indolente, generalmente confinado a lesiones nodulares cutáneas únicas o múltiples, mientras que la HS comúnmente exhibe una rápida diseminación a múltiples órganos con lesiones en el bazo, los ganglios linfáticos, los pulmones y la piel (16). Como se describió anteriormente, en nuestro reporte de caso la FPH mostró una progresión lenta, comenzando con un solo nódulo en la cara, seguido por el desarrollo de múltiples nódulos en todo el cuerpo y la afectación de los ganglios linfáticos regionales. La diferenciación de la FPH de la HS en nuestro caso fue sencilla teniendo en cuenta el diagnóstico en una etapa más temprana. Sin embargo, en las etapas avanzadas de la HPF, podría ser clínica e histológicamente difícil diferenciar la HPF de la HS.
En un estudio en el que participaron 5 gatos con FPH confirmada por inmunohistoquímica, las características microscópicas de la histopatología incluyeron células neoplásicas grandes, redondas a poligonales, con una proporción baja de núcleo a citoplasma. Además, el citoplasma era levemente eosinófilo y, en ocasiones, las células neoplásicas exhibían numerosas vacuolas citoplasmáticas y binucleación ocasional. Los núcleos eran redondos a ovalados, a menudo con un pequeño nucléolo único, y se observaron de 0 a 3 figuras mitóticas por campo (9). Esta descripción se asemeja mucho a los hallazgos en el presente caso, excepto por la ausencia de vacuolas y binucleación.
Durante el curso de la enfermedad, al menos, tres ganglios linfáticos resultaron afectados, y la infiltración histiocítica se confirmó mediante examen citológico. Se observó que la atipia celular empeoraba a medida que la enfermedad progresaba en el tiempo y el último ganglio linfático muestreado presentó la mayor cantidad de atipia en la evaluación citológica (10).
Se recomienda la técnica inmunohistoquímica para confirmar la naturaleza histiocítica. Para excluir diagnósticos diferenciales y establecer un diagnóstico definitivo, se realizó un examen inmunohistoquímico de la muestra tumoral. No hubo inmunorreactividad para CD117, MUM1, CD3, CD20, descartando diagnósticos de tumor de mastocitos, plasmocitoma, linfomas de células T y B, respectivamente. El inmunomarcaje positivo para Iba-1, junto con las características histomorfológicas y la progresión clínica, permitieron el diagnóstico de FPH. La inmunotinción con Iba-1 ha demostrado ser eficaz para la identificación de histiocitos en gatos, aunque no permite diferenciar subtipos de histiocitos (11, 17).
No hay datos sólidos en la literatura sobre el tratamiento de la FPH. En un estudio se informó el uso de corticosteroides, ciclosporina A, interferón gamma, vincristina, vinblastina y L-asparaginasa en casos aislados, pero no se describió la respuesta clínica detallada de cada fármaco individualmente. En general, los pacientes no respondieron bien a estos tratamientos (3). En otro estudio de investigación se describió un caso de HPF tratada con esteroides que permaneció libre de enfermedad durante 473 días con un seguimiento de 665 días, y otro caso en el que se utilizó lomustina y ciclofosfamida metronómica con un seguimiento de 365 días, pero no se detalló la respuesta de las lesiones cutáneas a las terapias (8). La información sobre la respuesta a la lomustina en la FPH es escasa; En el presente estudio, se observó progresión de la enfermedad a pesar del tratamiento con lomustina. La doxorrubicina tampoco mostró beneficios para el paciente, y su uso en casos de FPH no está documentado en la literatura.
La patogenia de la FPH no se comprende bien, lo que dificulta las opciones terapéuticas. El resultado de este caso sugiere la necesidad de un enfoque de terapia multimodal que se dirija a varias vías e incluso pueda estimular una respuesta inmunitaria (2). Los factores de crecimiento que influyen en las células dendríticas incluyen la tirosina quinasa 3 similar a fms (FLT3), el factor estimulante de colonias de granulocitos y macrófagos (GM-CSF), el factor de necrosis tumoral alfa (TNF-α), la interleucina 4 (IL-4), el factor de crecimiento transformante beta 1 (TGF-β1) y el factor de células madre (SCF) (18).
Un estudio evaluó posibles dianas terapéuticas, el receptor beta del factor de crecimiento derivado de plaquetas (PDGFRβ) y KIT, en muestras de 15 gatos con trastornos histiocíticos, incluidos 5 diagnosticados con FPH. Se observó inmunotinción para PDGFRβ en 4 de estos gatos, mientras que KIT no se expresó. Tres pacientes con FPH se sometieron a tratamiento con inhibidores de la tirosina cinasa (ITC) (masitinib o toceranib), siendo el que tuvo la supervivencia más larga (223 días) con inmunotinción débil de PDGFRβ, mientras que los otros dos casos que mostraron una fuerte inmunotinción con PDGFRβ sobrevivieron solo 110 y 45 días (8). El controvertido resultado podría deberse al pequeño número de casos y a la inclusión de la enfermedad en fase temprana y tardía con pronósticos muy diferentes: PDGFRβ u otros, el TK podría ser un objetivo potencial para esta enfermedad y el toceranib podría ser un tratamiento potencial para los trastornos histiocíticos en gatos. El fosfato de toceranib se dirige al PDGFR, así como a otros receptores como FLT3 y el receptor del factor de crecimiento endotelial vascular (VEGFR). Sin embargo, estos objetivos adicionales no se han investigado a fondo en el contexto de FPH. El uso de toceranib en el paciente de este caso clínico dio lugar a una enfermedad estable durante solo 6 semanas.
Los linfocitos T reguladores (Treg) participan en la inmunosupresión inducida por tumores y pueden ser atacados por toceranib. En un estudio en perros con varios tumores malignos, hubo una reducción significativa y selectiva en el Treg de los pacientes después de 14 días de tratamiento con toceranib, que fue sinérgico con la quimioterapia metronómica. Este resultado demuestra la potencial inmunomodulación de los ITC y la quimioterapia metronómica en pacientes oncológicos, otro mecanismo que puede haber ocurrido en el paciente en este reporte; sin embargo, se necesitan más estudios para comprender el papel de los TKI en la inmunosupresión inducida por el cáncer (19).
También hay evidencia de sinergia entre el ITC y el TCE. En un estudio se evaluó la citotoxicidad de esta combinación en una línea celular de carcinoma de páncreas humano con bleomicina y cisplatino. A través del análisis del proceso de muerte celular, se detectó un efecto sinérgico entre el sunitinib, un ITC similar al toceranib, y la TEC con bleomicina (20). En el presente reporte se observó una buena respuesta al tratamiento que combina ITC, quimioterapia metronómica y TEC con una reducción progresiva significativa de las lesiones hasta lograr la remisión completa.
La efectividad de la TEC en medicina veterinaria está bien establecida, y actualmente se recomienda como tratamiento neoadyuvante y adyuvante para varios tumores sólidos (13). Además de los efectos citotóxicos directos, la TEC también puede desencadenar efectos antitumorales indirectos al activar el sistema inmunitario a través de la liberación de antígenos tumorales y la muerte celular inmunogénica (DAI). Representa cualquier forma de muerte celular que estimula eficazmente una respuesta inmunitaria adaptativa contra los antígenos liberados por las células moribundas y libera sustancias que promueven la fagocitosis por parte de las células dendríticas y los macrófagos (21). La bleomicina administrada por vía intravenosa da como resultado una menor concentración de bleomicina dentro de las células tumorales, en comparación con la administración intratumoral, lo que resulta en un daño progresivo al ADN en cada ciclo celular, hasta que ocurre una mitosis catastrófica, que conduce a la muerte celular, similar a la necrosis, que es un DCI altamente desfibriladizo. A concentraciones más altas o inyecciones intratumorales, puede ocurrir pseudoapoptosis, que es menos inmunogénica (22, 23). Los estudios con modelos de cáncer en ratones inmunocompetentes e inmunocomprometidos han demostrado variaciones en la eficacia de la TEC, enfatizando la importancia del sistema inmunológico. Se demostró que la activación inmune inducida por la TEC en ratones inmunocompetentes era esencial para una respuesta eficiente contra el tumor, mientras que los ratones inmunodeficientes exhibieron respuestas considerablemente reducidas o ausentes al tratamiento (24).
El clorambucilo es un agente alquilante ampliamente utilizado en medicina felina, asociado a una baja incidencia de efectos adversos, y es bien tolerado, incluso cuando se combina con otros fármacos como los corticoides. El clorambucilo también se utiliza como fármaco inmunosupresor e inmunomodulador, y podría ser beneficioso en enfermedades sostenidas por una función inmunitaria excesiva, como la FPH (25). En un estudio, se identificó el clorambucilo como un agente quimioterapéutico clave que agota la PD-L1 en las células tumorales. En una línea celular de carcinoma de ovario, se observó que el clorambucilo mediaba una reducción de 5 veces en PD-L1 a través de mecanismos transcripcionales o post-transduccionales, incluida la promoción de la ubiquitinación de PD-L1 mediada por la vía de señalización GSK3β/β-TRCP. Además, demostraron que la depleción de PD-L1 de las células neoplásicas era responsable de inhibir el crecimiento de células malignas (26). La información sobre PD-L1 en el cáncer felino es limitada; sin embargo, un estudio en gatos encontró expresión de PD-L1 en el 100% de las muestras de CCE felino y un 80% de positividad en el fibrosarcoma (27). Sin embargo, para una mejor comprensión de la interacción del efecto del clorambucilo sobre el microambiente tumoral, sería necesario incluir marcadores para PD-L1, linfocitos Treg (FOXP3) y linfocitos T CD8, lo que no se realizó.
En nuestro caso, la FPH no respondió a la dosis máxima tolerada de quimioterapia con lomustina o doxorrubicina, ni al inhibidor de la tirosina cinasa toceranib fosfato. Sin embargo, se demostró una respuesta objetiva con el uso de electroquimioterapia y luego con la adición de clorambucilo, mientras aún se seguía usando toceranib. Una respuesta inmunitaria tardía podría estar implicada, al menos parcialmente, en la respuesta clínica y en la larga supervivencia observada. Sin embargo, se necesitan más estudios para comprender el papel de estas opciones terapéuticas en la FPH.
En la literatura se reportan solo 30 casos de HPF, de los cuales solo 10 se sometieron a seguimiento oncológico por períodos que oscilaron entre 1 mes y 3 años. Estos casos muestran tiempos de supervivencia variables, con una mediana de supervivencia de 407 días. En el presente caso, el paciente sobrevivió aproximadamente 2 meses más, manteniendo una buena calidad de vida, lo cual es crucial en esta enfermedad, ya que la mayoría de los casos suelen ser eutanasiados debido a la falta de respuesta y a la mala calidad de vida (3).
En conclusión, la FPH demuestra ser resistente a varios tratamientos, pero la implementación de una terapia multimodal destinada a restaurar la inmunidad antitumoral puede aumentar las posibilidades de una respuesta. La TEC podría ser una herramienta útil para el control de las lesiones cutáneas de la FPH, que pueden tener un impacto significativo en la calidad de vida del paciente. El uso repetido de la TEC para el tratamiento de las lesiones cutáneas en la FPH podría ofrecer beneficios clínicos significativos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración de ética
No se requirió aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales, ya que se obtuvo a través de un formulario de consentimiento informado (ICF) del tutor legal, la autorización para la publicación o divulgación de los datos clínicos e imágenes del paciente. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
BS: Conceptualización, Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición. PT: Escritura – borrador original, Escritura – revisión y edición, Conceptualización, Metodología. PB: Redacción – borrador original, Investigación. IA: Redacción – borrador original, Investigación. GL: Investigación, Escritura – borrador original. KN: Redacción – borrador original, Metodología, Recursos, Validación. AG: Metodología, Redacción – borrador original, Conceptualización, Supervisión, Redacción – revisión y edición. PP: Investigación, Metodología, Administración de proyectos, Supervisión, Redacción – borrador original, Redacción – revisión y edición, Recursos, Validación. RH: Investigación, Metodología, Administración de proyectos, Supervisión, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) no haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El autor o autores declararon ser miembros del consejo editorial de Frontiers, en el momento de la presentación. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Merad, M, Ginhoux, F y Collin, M. Origen, homeostasis y función de las células de Langerhans y otras células dendríticas que expresan langerina. Nat Rev Immunol. (2008) 8:935–47. doi: 10.1038/nri2455
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Moore, PF. Enfermedades histiocíticas. Vet Clin North Am Small Anim Pract. (2023) 53:121–40. doi: 10.1016/j.cvsm.2022.07.010
3. Affolter, VK, y Moore, PF. Histiocitosis progresiva felina. Veterinario Pathol. (2006) 43:646–55. doi: 10.1354/vp.43-5-646
4. Affolter, VK, y Moore, PF. Sarcoma histiocítico localizado y diseminado de origen de células dendríticas en el perro. Veterinario Pathol. (2002) 39:74–83. doi: 10.1354/vp.39-1-74
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Arico, M, y Egeler, RM. Aspectos clínicos de la histiocitosis de células de Langerhans. Hematol Oncol Clin North Am. (1998) 12:247–58. doi: 10.1016/s0889-8588(05)70508-6
6. Day, MJ, Lopatkin, I, Lucke, VM y Withbread, TJ. Histiocitomas cutáneos múltiples en un gato. Veterinario Dermatol. (2000) 11:305–10. doi: 10.1046/j.1365-3164.2000.00206.x
7. Rocamora-Blanch, G, Climent, F y Solanich, X. Histiocitosis. Med Clin. (2023) 161:166–75. doi: 10.1016/j.medcli.2023.05.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Treggiari, E, Ressel, L, Polton, GA, Benoit, J, Desmas, I y Blackwood, L. Resultado clínico, expresión de PDGFRβ y KIT en trastornos histiocíticos felinos: un estudio multicéntrico. Veterinario Comp Oncol. (2017) 15:65–77. doi: 10.1111/vco.12142
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Cunha, NP, Ghisleni, G, Scarampella, F, Fabbrini, F, Sforna, M, Cornegliani, L, et al. Caracterización citológica e inmunocitoquímica de la histiocitosis progresiva felina. Veterinario Clínico Pathol. (2014) 43:428–36. doi: 10.1111/vcp.12152
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Coste, M, Prata, D, Castiglioni, V, Minoli, L, Etienne-Raffestin, CL, Boulouha, L, et al. Histiocitosis progresiva felina: una investigación retrospectiva de 26 casos y un estudio preliminar de Ki67 como marcador pronóstico. J Vet Diagn Invertir. (2019) 31:801–8. doi: 10.1177/1040638719884950
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Pierezan, F, Mansell, J, Ambrus, A, y Hoffmann, AR. Expresión inmunohistoquímica de la molécula adaptadora de unión al calcio ionizado 1 en trastornos histiocíticos proliferativos, neoplásicos e inflamatorios cutáneos de perros y gatos. J Comp Pathol. (2014) 151:347–51. doi: 10.1016/j.jcpa.2014.07.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Solc, M, Jazic, E, Crandell, J y Loeffler, D. Histiocitosis progresiva de células dendríticas felinas en un felino doméstico de pelo largo. Representante de casos de Vet Rec. (2017) 5:1–4. doi: 10.1136/vetreccr-2017-000428
13. Spugnini, EP y Baldi, A. Electroquimioterapia en oncología veterinaria: estado del arte y perspectivas. Veterinario Clin Pequeño Anim. (2019) 49:967–79. doi: 10.1016/j.cvsm.2019.04.006
14. Tellado, M, Mir, LM y Maglietti, F. Directrices veterinarias para la electroquimioterapia de tumores superficiales. Veterinario delantero Sci. (2022) 9:868989. doi: 10.3389/fvets.2022.868989
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Souza, LMS, Gorza, LL, Merísio, ACR, Sena, BV, Almeida, IO, Flecher, MC, et al. Tumor de mastocitos caninos: sensibilización de lomustina mediante inhibidores de la tirosina quinasa. Acta Sci Vet. (2022) 50:839. doi: 10.22456/1679-9216.125648
16. Clifford, CA, Skorupski, KA, y Moore, PF. Tumor misceláneo En: DM Vail, DH Thamm y MJ Liptak, editores. Oncología clínica de pequeños animales de Withrow & MacEwen. San Luis: Elsevier (2020). 773–810.
17. Hirabayashi, M, Chambers, JK, Sumi, A, Harada, K, Haritani, M, Omachi, T, et al. Immunophenotyping of nonneoplastic and neoplastic histiocytes in cats and characterization of a novel cell line derived from feline progressive histiocytosis. Vet Pathol. (2020) 57:758–73. doi: 10.1177/0300985820953538
18. Shortman, K, and Naik, SH. Steady-state and inflammatory dendritic-cell development. Nat Rev Immunol. (2007) 7:19–30. doi: 10.1038/nri1996
19. Mitchell, L, Thamm, DH, y Biller, BJ. Efectos clínicos e inmunomoduladores de toceranib combinado con ciclofosfamida en dosis bajas en perros con cáncer. J Veterinario Pasante Med. (2012) 26:355–62. doi: 10.1111/j.1939-1676.2011.00883.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Bosnjak, M, Jesenko, T, Markelc, B, Cerovsek, A, Sersa, G y Cemazar, M. Sunitinib potencia el efecto citotóxico de la electroquimioterapia en células de carcinoma de páncreas. Radiol Oncol. (2022) 56:164–72. doi: 10.2478/raon-2022-0009
21. Galluzzi, L, Vitale, I, Warren, S, Adjemian, S, Agostinis, P, Martínez, AB, et al. Guías consensuadas para la definición, detección e interpretación de la muerte celular inmunogénica. J Inmunoterapia Cáncer. (2020) 8:337–57. doi: 10.1136/jitc-2019-000337
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Mir, L. Bases y fundamentos de la electroquimioterapia. Ejc suppl. (2006) 4:38–44. doi: 10.1016/j.ejcsup.2006.08.005
23. Tounekti, O, Pron, G, Belehradek, J Jr y Mir, LM. La bleomicina, un fármaco mimético de la apoptosis que induce dos tipos de muerte celular en función del número de moléculas internalizadas. Cáncer Res. (1993) 53:5462–9.
24. Bendix, MB, Houston, A, Forde, PF y Brint, E. Electroquimioterapia e interacciones inmunitarias; ¿Un impulso para el sistema? Eur J Surg Oncol. (2022) 48:1895–900. doi: 10.1016/j.ejso.2022.05.023
25. Viviano, KR. Glucocorticoides, ciclosporina, azatioprina, clorambucilo y micofenolato en perros y gatos: usos clínicos, farmacología y efectos secundarios. Vet Clin North Am Small Anim Pract. (2022) 52:797–817. doi: 10.1016/j.cvsm.2022.01.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Bai, H, Padrón, AS, Deng, Y, Liao, YJ, Murray, CJ, Ontiveros, C, et al. La depleción farmacológica de PDL1 tumoral con clorambucilo trata el cáncer de ovario y el melanoma: mejora la inmunidad antitumoral y hace que los tumores resistentes a PDL1 sean sensibles a las células NK a través de los efectos de las células NK. J Inmunoterapia Cáncer. (2023) 11:E004871. doi: 10.1136/jitc-2022-004871
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Maekawa, N, Konnai, S, Asano, Y, Otsuka, T, Aoki, E, Takeuchi, H, et al. Caracterización molecular de moléculas de puntos de control inmune felino y establecimiento de inmunohistoquímica PD-L1 para tumores felinos. PLoS Uno. (2023) 18:e0281143. doi: 10.1371/journal.pone.0281143
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: gato, histiocito, Iba-1, electroporación, bleomicina
Cita: Sena BV, Turquete PBSR, Pimentel PAB, Almeida IO, Lavalle GE, Nakagaki KYR, Giuliano A, Paes PRO y Horta RS (2024) Reporte de caso: Remisión clínica completa de la histiocitosis progresiva felina después de un tratamiento multimodal que incluye electroquimioterapia. Frente. Vet. Sci. 11:1397592. doi: 10.3389/fvets.2024.1397592
Recibido: 07 de marzo de 2024; Aceptado: 30 de julio de 2024;
Publicado: 22 de agosto de 2024.
Editado por:
Sungin Lee, Universidad Nacional de Chungbuk, República de Corea
Revisado por:
Andras-Laszlo Nagy, Facultad de Medicina Veterinaria de la Universidad Ross, San Cristóbal y Nieves
Vittoria Castiglioni, Laboratorios IDEXX, Alemania
Derechos de autor © 2024 Sena, Turquete, Pimentel, Almeida, Lavalle, Nakagaki, Giuliano, Paes y Horta. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Antonio Giuliano, agiulian@cityu.edu.hk
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía