Efecto del ácido benzoico recubierto sobre el rendimiento del crecimiento, la inmunidad y las funciones intestinales en cerdos
 Jiawen Qi1,2*
Jiawen Qi1,2* Bing Yu1,2
Bing Yu1,2 Youjun Hu3
Youjun Hu3 Yuheng Luo1,2
Yuheng Luo1,2 Ping Zheng1,2
Ping Zheng1,2 Xiangbing Mao1,2
Xiangbing Mao1,2 Jie Yu1,2
Jie Yu1,2 Xiaonan Zhao3
Xiaonan Zhao3 Taiqian He3
Taiqian He3 Hui Yan1,2
Hui Yan1,2 Aimin Wu1,2
Aimin Wu1,2 Jun He1,2*
Jun He1,2*- 1Instituto de Nutrición Animal, Universidad Agrícola de Sichuan, Chengdu, China
- número arábigoLaboratorio Clave de Nutrición Resistente a Enfermedades Animales, Chengdu, China
- 3Nuacid Nutrition Co., Ltd, Qingyuan, China
Introducción: El ácido benzoico (BA) podría añadirse a las dietas de los cerdos destetados para prevenir la diarrea debido a su función antibacteriana. Sin embargo, el BA puede ser absorbido o descompuesto antes de que pueda llegar al intestino posterior. Este estudio se llevó a cabo para explorar el efecto de un nuevo ácido benzoico recubierto (CBA) sobre el rendimiento del crecimiento, la inmunidad y las funciones de barrera intestinal en cerdos destetados tras el desafío enterotoxigénico con Escherichia coli (ETEC).
Métodos: En un experimento de 21 días, 32 lechones fueron asignados aleatoriamente a 4 tratamientos: (1) una dieta basal (CON), (2) CON añadido con CBA a 3 g/kg (CBA); (3) CON e impugnado por ETEC (ECON); (4) CON añadido con CBA a 3 g/kg e impugnado por ETEC (ECON). El día 22, todos los lechones fueron sacrificados para obtener muestras.
Resultados: La suplementación dietética con CBA elevó la ganancia diaria promedio (GMD) de los cerdos desafiados con ETEC (p < 0,05). El CBA también mejoró la digestibilidad de la materia seca, la energía bruta y las cenizas (p < 0.05). Además, el CBA elevó la proporción de basófilos sanguíneos y la concentración sérica de colesterol total de los cerdos desafiados con ETEC (p < 0,05). Es importante destacar que el CBA aumentó las concentraciones séricas de inmunoglobulina A (IgA), IgG e IgM (p < 0,05). El CBA no solo disminuyó la profundidad de la cripta, sino que también aumentó la relación entre la altura de las vellosidades y la profundidad de la cripta (V:C) en el yeyuno y el íleon (p < 0,05). Además, el CBA incrementó las actividades de la sacarasa yeyunal e ileal, y las actividades de la maltasa duodenal e ileal (p < 0,05). Es importante destacar que el CBA elevó los niveles de expresión de genes funcionales críticos como la claudina-1, ocluyente, el transportador de glucosa-2 (GLUT2) y el cotransportador de sodio/glucosa-1 (SGLT-1) en el epitelio yeyunal tras el desafío ETEC (p < 0,05). Además, el CBA aumentó la abundancia de bacterias totales y Bacillus, e incrementó las concentraciones de ácidos grasos volátiles (ácido acético, ácido propanoico y ácido butírico) en ciego (p < 0,05).
Discusión: Estos resultados sugirieron un papel beneficioso del CBA en el alivio de la lesión intestinal en cerdos destetados después del desafío con ETEC. Estos efectos pueden estar estrechamente asociados con una inmunidad elevada y una mejora de las funciones del epitelio intestinal y la microbiota.
1 Introducción
El destete es un reto crítico para los lechones, ya que provoca cambios bruscos en su tracto gastrointestinal, alterando su microbiota intestinal y la función inmunitaria de las mucosas. Esta alteración puede conducir a una reducción en la ingesta de alimento y el crecimiento y el desarrollo de diarrea post-destete (DPP) (1). La Escherichia coli enterotoxigénica (ETEC), una cepa bacteriana patógena altamente proliferativa, es una de las principales causas bacterianas de la PWD (2). Los principales atributos de virulencia de ETEC son las adhesinas y las enterotoxinas (3, 4). Se ha demostrado que la ETEC puede adherirse a las células epiteliales intestinales y causar lesiones intestinales (5). En las últimas décadas, se han complementado varios antibióticos en la dieta de cerdos destetados para aliviar la diarrea y las lesiones intestinales asociadas con la infección por ETEC (6). Sin embargo, numerosos países y regiones han prohibido el uso de antibióticos en la alimentación de los cerdos, ya que se ha sugerido que el uso continuado de antibióticos puede dar lugar al desarrollo de cepas de patógenos resistentes y residuos de medicamentos en los productos animales (7). Por lo tanto, existe una necesidad urgente de alternativas a los antibióticos utilizados tradicionalmente, y varias alternativas como acidificantes, probióticos, prebióticos y extractos de plantas han atraído un considerable interés de investigación en todo el mundo (8).
Como alternativa potencialmente atractiva a los antibióticos convencionales, los acidificantes se han utilizado ampliamente en la producción agrícola durante mucho tiempo. El ácido benzoico (BA) es un ácido carboxílico aromático que se encuentra naturalmente en tejidos vegetales y animales y también puede ser producido por microorganismos (9), y posee una amplia gama de actividades biológicas. Para la producción industrial, el BA se produce mediante oxidación de tolueno con aire a alta temperatura y presión con el uso de catalizadores de metales pesados como el cobalto o el naftenato de manganeso (10). Se ha demostrado que el BA podría mejorar el rendimiento del crecimiento y la salud intestinal, y ejercer actividad antibacteriana al disminuir los niveles de pH del estómago y la digesta intestinal (11). Sin embargo, existen algunos problemas con la administración oral de varios acidificantes. Uno de los mayores desafíos es el ambiente ácido del estómago, que puede degradar los ácidos orgánicos libres, incluido el BA, antes de que lleguen al intestino delgado (12). La tecnología de pulverización en frío es un poderoso proceso de consolidación de polvo para el desarrollo de recubrimientos y se ha utilizado ampliamente para la fabricación de varios gránulos cargados de medicamentos para administración oral (13). Una mezcla de ácidos grasos de cadena media y larga es estable y se ha utilizado ampliamente para recubrir diversas sustancias inestables, lo que puede permitir que los acidificantes ejerzan sus efectos en el intestino delgado distal y el intestino posterior (14). Aunque numerosos estudios sobre el BA mostraron un efecto beneficioso sobre la producción animal (15-17), solo hay unos pocos informes de ácido benzoico recubierto (CBA) sobre el rendimiento del crecimiento, la inmunidad y las funciones intestinales en cerdos destetados tras una infección bacteriana (11). El objetivo de este estudio fue evaluar si la suplementación con CBA podría aliviar la inflamación intestinal inducida por ETEC y el daño epitelial en cerdos destetados. Este estudio puede ayudarnos a comprender mejor el mecanismo a través del cual el CBA mejora el rendimiento de los cerdos y proporcionar la base científica para los efectos beneficiosos del CBA.
2 Materiales y métodos
2.1 Declaración de cuidado y uso de los animales
Los procedimientos experimentales de la presente investigación fueron evaluados y autorizados por el Comité Experimental Animal de la Universidad Agrícola de Sichuan (número de autorización SICAU-2022-014). Todos los procedimientos experimentales se llevaron a cabo siguiendo las pautas para el cuidado y uso de animales de laboratorio.
2.2 Cepas bacterianas y cultivo
La cepa patógena ETEC se compró en el centro de recolección de cultivos veterinarios de China (CVCC, Beijing, China). El inóculo bacteriano utilizado se preparó a partir de la cepa K88+ de E. coli (serotipo O149:K91, K88ac). La cepa liofilizada se cultivó en medio de cultivo en caldo Luria-Bertani (LB) durante la noche con agitación a 250 × g a 37°C. Después de la incubación durante la noche, ETEC K88+ se inoculó en medio LB fresco a 1:100 y se cultivó hasta que se alcanzó la etapa de crecimiento logarítmico medio, se peletizó por centrifugación y el gránulo se lavó secuencialmente tres veces en solución salina tamponada con fosfato (PBS) y se resuspendió a una concentración de bacterias de 10a 6 UFC/ml (18).
2.3 Diseño experimental y dieta
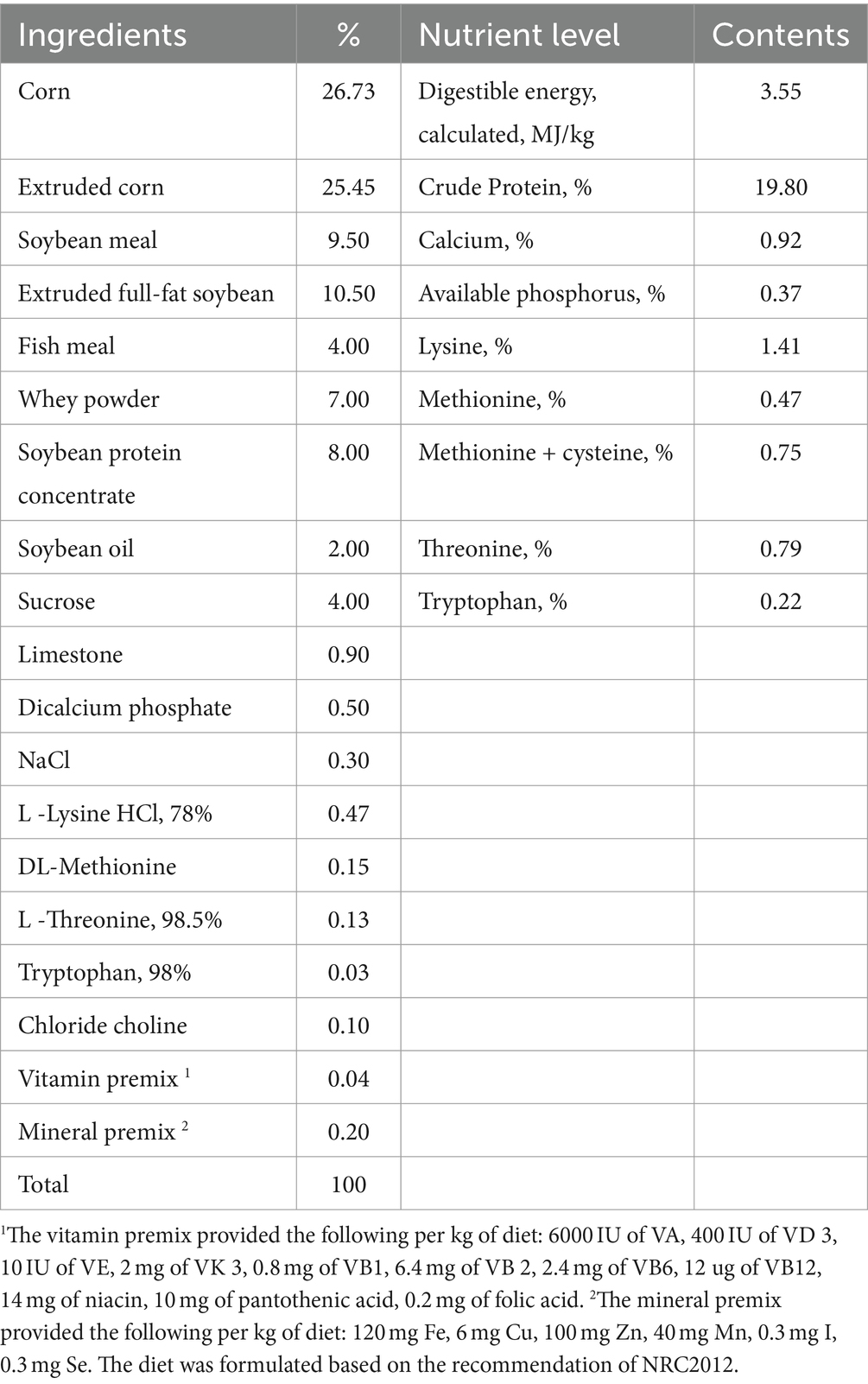
En el experimento se utilizaron treinta y dos túmulos sanos (Duroc × Landrace × Yorkshire) destetados en su día 21 y con un peso corporal medio (PC) de 7,84 ± 0,14 kg, que se compraron a la granja de Sichuan Vanguard Food Co. Los cerdos se asignaron aleatoriamente en un arreglo factorial de 2 × 2 a cuatro tratamientos (n = 8) compuestos por CON (la dieta basal), CBA (CON añadido con ácido benzoico recubierto a 3 g/kg), ECON (CON y desafiado por ETEC), ECBA (añadido con ácido benzoico recubierto a 3 g/kg y desafiado por ETEC). El CBA fue amablemente proporcionado por Guangzhou Nuacid Co., Ltd. (Guangzhou, China). El BA es seguro para los lechones destetados con 3 g/kg de alimento completo (19). El período experimental duró 21 días. Los cerdos se estratificaron en jaulas individuales de metabolismo de 1,5 × 0,7m2, las cuales se ubicaron en una sala controlada, de acuerdo con la temperatura (27 ± 1°C) y la humedad relativa (65 ± 5%). De acuerdo con el tratamiento y el peso vivo y se les ofrecieron sus respectivas dietas. Las dietas (Tabla 1) se formularon para cumplir con los requisitos de nutrientes recomendados por el Consejo Nacional de Investigación para los cerdos (20). Se proporcionó agua y alimento ad libitum a los lechones. Los grupos desafiados con ETEC fueron tratados por vía oral con 200 mL de medio Luria-Bertani (LB) que contenía 1 × 106 UFC/mL de ETEC el día 19, y los grupos no desafiados fueron infundidos con un volumen igual de medio LB.
2.4 Evaluación del desempeño del crecimiento
El peso corporal (PC) individual del cerdo se registró en d 1, d 19 y d 22 después de que todos los cerdos fueron privados de alimento durante 12 h. El consumo de alimento se registró como la cantidad de alimento ofrecida diariamente menos la cantidad restante a la mañana siguiente durante el experimento. Estos valores se utilizaron para calcular la ganancia media diaria (GMD), la ingesta diaria media de alimento (ADFI) y la eficiencia alimenticia (F/G).
2.5 Recogida de muestras
Las dietas experimentales se muestrearon y se almacenaron a -20 °C hasta el análisis. Se recogieron muestras fecales frescas de d 15 a d 18 durante el ensayo, se pesaron y se añadió ácido clorhídrico al 10% para la fijación del nitrógeno excretado. Los cuatro alimentos y las muestras fecales se secaron a 65 °C hasta un peso constante, después de lo cual se molieron para pasar a través de una pantalla de 1 mm y luego se almacenaron a -20 °C hasta el análisis del contenido de nutrientes clave. Las muestras de sangre se recogieron el día 22 mediante punción de la vena yugular en dos tubos de vacío no heparinizados de 10 mL y un tubo de vacío de 5 mL que contenía ácido etilendiaminotetraacético y sus sales. La muestra de sangre de 5 mL se utilizó para el análisis de sangre de rutina, y las otras muestras de sangre se colocaron en hielo, se llevaron al laboratorio y se centrifugaron a 3500 × g durante 15 min a 4 °C para recuperar el suero, que se almacenó a -20 °C hasta el análisis de los índices séricos. Tras la extracción de sangre, todos los cerdos fueron sacrificados por inyección intravenosa de pentobarbital sódico (200 mg/kg de peso corporal). Se aislaron rápidamente segmentos de aproximadamente 4 cm de la mitad del duodeno, yeyuno e íleon, se lavaron con PBS frío y luego se fijaron en una solución de paraformaldehído al 4% para el análisis morfológico. Los segmentos restantes del duodeno, yeyuno e íleon se abrieron longitudinalmente, se lavaron con PBS helado y se rasparon suavemente con un portaobjetos de microscopio de vidrio estéril a 4 °C para obtener muestras de mucosa. Las muestras de mucosa se congelaron inmediatamente en nitrógeno líquido y se almacenaron a -80 °C hasta un análisis adicional de las actividades enzimáticas relacionadas y la reacción en cadena de la polimerasa en tiempo real (RT-PCR). Además, se recogieron los contenidos intestinales del colon y el ciego y se almacenaron a -80 °C para su posterior análisis.
2.6 Análisis de la digestibilidad aparente de los nutrientes del tracto total
Se utilizaron muestras de alimento y heces para el análisis de la digestibilidad aparente del tracto total (ATTD) utilizando cenizas insolubles en ácido (AIA) como indicador endógeno (GB/T 23742-2009). La materia seca (930.15; AOAC), proteína bruta (930,15; AOAC), grasa bruta (920,39; AOAC) y cenizas brutas (942.05, AOAC) se determinaron de acuerdo con los métodos oficiales de análisis de AOAC International (21). La concentración de energía bruta se determinó utilizando una calorimetría automática de bomba de oxígeno (parr6400-1101-22141). La ATTD de los nutrientes se calculó como (100 – A1/A2 × F2/F1 × 100) (22), A1: nutriente digesta; A2: digesta AIA; F1: dieta AIA; F2: digesta AIA.
2.7 Medición de los parámetros hematológicos
El análisis de sangre de rutina se implementó utilizando un analizador bioquímico automático aproximadamente 3 h después del sacrificio. Se estimaron los siguientes parámetros hematológicos: recuento de glóbulos rojos (RBC), concentración de hemoglobina (HBC), volumen de células empaquetadas (PCV), recuento de glóbulos blancos (WBC), recuento de neutrófilos (Neu), porcentaje de recuento de neutrófilos, recuento de monocitos (Mono), porcentaje de recuento de monocitos, recuento de linfocitos (Lym), porcentaje de recuento de linfocitos, recuento de eosinófilos (Eos), porcentaje de recuento de eosinófilos, recuento de basófilos (Baso), porcentaje de recuento de basófilos, recuento de glóbulos rojos (RBC), hematocrito (HCT), hemoglobina (HGB), hemoglobina corpuscular media (MCH), concentración media de hemoglobina corpuscular (MCHC), volumen corpuscular medio (MCV), coeficiente de variación en el ancho de distribución del volumen de glóbulos rojos (RDW-CV), desviación estándar del ancho de distribución del volumen de glóbulos rojos (RDW-SD), recuento de plaquetas (PLT).
2.8 Bioquímica sérica y detección de inmunoglobulinas
El analizador bioquímico automático detectó proteínas totales (TP), albúmina (ALB), fosfatasa alcalina (AKP), transaminasa oxaloacética glutámica (GOT), transaminasa glutámica pirúvica (GPT), colesterol total (TC), glucosa (GLU), triglicéridos (TG) y urea (UREA). Las concentraciones séricas totales de inmunoglobulina A (IgA, MM-0905O1), inmunoglobulina M (IgM, MM-0402O1) e inmunoglobulina G (IgG, MM-0403O1) se determinaron con kits comerciales de ensayo de inmunoabsorción enzimática (ELISA) (Shanghai Meimian Biotechnology Co., Ltd., Shanghai, China) de acuerdo con las recomendaciones del fabricante. Los estándares proporcionados en los kits se utilizaron para generar curvas estándar para la cuantificación.
2.9 Mediciones histomorfológicas de segmentos intestinales
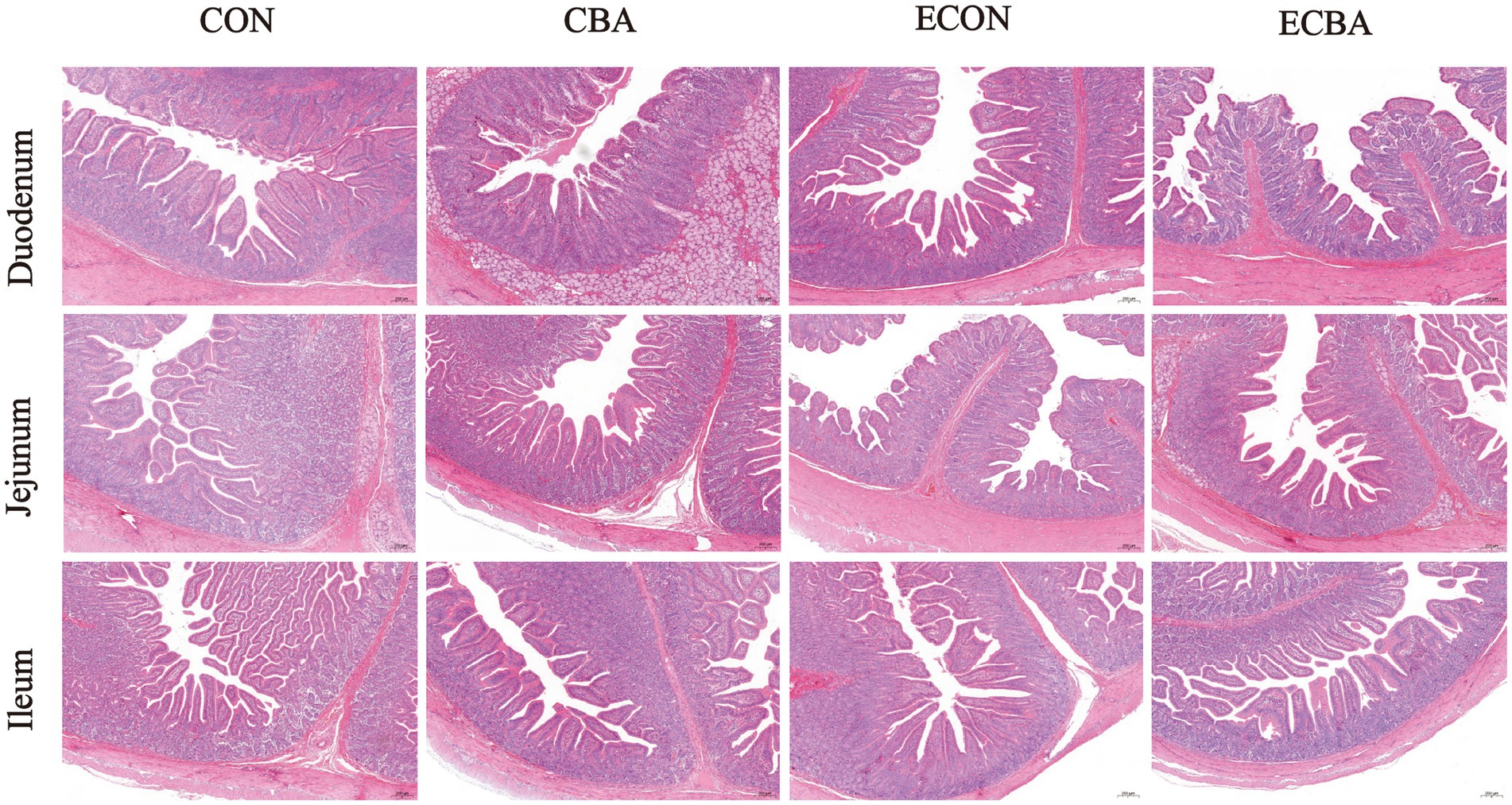
Los segmentos intestinales fijados con paraformaldehído al 4% se deshidrataron a través de una serie graduada de etanol y luego se incrustaron en parafina (23). Se prepararon secciones transversales de cada muestra, se tiñeron con hematoxilina y eosina (H&E) y luego se sellaron con resina neutra. Se examinaron secciones ultrafinas de las muestras duodenal, yeyunal e ileal para determinar la profundidad de la cripta (CD) y la altura de las vellosidades (VH) con un sistema de procesamiento y análisis de imágenes (Image-Pro Plus 6.0), y se calculó su relación V/C (24). Se obtuvieron al menos 20 alturas de vellosidades intactas y bien orientadas y las correspondientes profundidades de cripta por sección para la medición.
2.10 Actividad enzimática
Los tejidos mucosos de las muestras duodenal, yeyunal e ileal se homogeneizaron en solución salina helada utilizando un homogeneizador de tejidos, se convirtieron en homogeneizado al 10%, luego todas las muestras se centrifugaron a 3500 × g a 4 °C durante 10 min. Se utilizaron kits de diagnóstico colorimétrico disponibles en el mercado (Instituto de Bioingeniería de Nanjing Jiancheng, Nanjing, China) para medir las actividades de la fosfatasa alcalina intestinal (AKP). Se utilizaron kits ELISA (Shanghai Enzyme-linked Biotechnology Co., Ltd., Shanghai, China) para la detección de lactasa (Porcine Lactasa ELISA Kit ml712060), sacarasa (Porcine Sucrase ELISA Kit ml712026) y maltasa (Porcine Maltase ELISA Kit ml712030). Todos los procedimientos se llevaron a cabo siguiendo las instrucciones del fabricante. Una unidad de actividad enzimática se definió como la hidrólisis de 1 mol de sustrato en 1 min a 37°C y un pH de 6,0. Se utilizó un espectrofotómetro (UV-VIS Spectrophotometer, Leng Guang SFZ1606017568, Shanghai, China) a una longitud de onda de 450 nm para determinar la absorbancia de cada reacción.
2.11 Análisis microbiológico del intestino posterior
El ADN genómico total para PCR cuantitativa se aisló de aproximadamente 0,2 g de digesta cecal y colónica utilizando el kit de extracción de ADN en heces disponible comercialmente, de acuerdo con las instrucciones del fabricante (Omega Bio-Tek, Doraville, CA, EE. UU.), que se realizó por PCR convencional en el sistema de detección de PCR en tiempo real CFX96 (Bio-Rad Laboratories, Hercules, CA, EE. UU.). Las PCR de bacterias totales se llevaron a cabo por triplicado utilizando reacciones de 10 μL con 5 μL de SYBR Premix Ex Taq (2× concentrado), 0,4 μL de cebadores directos e inversos respectivos (100 nM), 1 μL de ADN, 0,2 μL 50 × ROX Reference Dye*3 y 3 μL de ddH2O libre de RNasa. El programa de amplificación consistió en d 95°C durante 25 s; seguido de 40 ciclos de 95 °C durante 5 s y 64,5 °C durante 25 s; y luego una curva de fusión final para las pruebas SYBR Green. Lactobacillus, E. coli, Bacillus y Bifidobacterium fueron detectados por el kit SuperReal PreMix (Probe) (Tiangen Biotech Co., Ltd., Beijing, China). En la Tabla Suplementaria S1 se muestran los cebadores y las sondas de oligonucleótidos fluorescentes. Cada reacción se ejecutó con tres repeticiones en un volumen de 20 μL con 10 μL 2 × Super Real PreMix (sonda), 0,6 μL de cebadores directos e inversos (100 nM) respectivos, 0,4 μL de sonda (100 nM), 2 μL de ADN y 6,4 μL de ddH2O libre de RNasa. Todo el protocolo de reacción se compuso de un ciclo de pre-desnaturalización a 95°C durante 15 min; 49 ciclos de desnaturalización a 95°C durante 3 s; recocido y extensión a 53°C durante 25 s. Los valores del umbral de ciclo (Ct) y la configuración de la línea de base se determinaron mediante la configuración de análisis automático, y los números de copia del grupo objetivo para cada reacción se calcularon a partir de las curvas estándar, que se generaron mediante la construcción de Los valores del umbral del ciclo (Ct) y la configuración de la línea de base se determinaron mediante la configuración de análisis automático, y los números de copia del grupo objetivo para cada reacción se calcularon a partir de las curvas estándar, los cuales se generaron mediante la construcción de plásmidos estándar mediante una dilución serial de 10 veces de ADN plasmídico (1 × 101 a 1 × 109 copias/μL).
2.12 Análisis de ácidos grasos volátiles en la digesta del intestino posterior
Las concentraciones de ácidos grasos volátiles (AGV; ácido acético, ácido propanoico, ácido butírico) en ciego y colon se analizaron mediante un sistema de cromatografía de gases (VARIAN CP-3800, Varian, Palo Alto, CA, USA; columna capilar de 30 m × 0,32 mm × 0,25 μm de espesor de película) según estudio previo (25). El sobrenadante (1 μL) se analizó mediante cromatógrafo de gases. La columna de polietilenglicol se operó con N2 altamente purificado como gas portador a 1 mL/min.
2.13 Aislamiento y transcripción inversa de ARN y qPCR
Aproximadamente 0,1 g de cada muestra congelada aislada de duodeno, yeyuno e íleon se homogeneizaron rápidamente en 1 mL de RNAiso Plus (Takara Biotechnology Co., Ltd., Dalian, China). El ARN se extrajo de las muestras homogeneizadas de acuerdo con las instrucciones del fabricante. La concentración y la pureza del ARN se evaluaron utilizando un espectrofotómetro (NanoDrop 2000, Thermo Fisher Scientific, Inc., Waltham, MA, EE. UU.). Las muestras que tenían una relación 260/280 de 1,8 a 2,0 se consideraron apropiadas. Posteriormente, se utilizaron alrededor de 1 μg de ARN total de cada muestra duodenal, yeyunal e ileal para la síntesis de ADNc utilizando el protocolo del kit de reactivos PrimeScript™ RT con gDNA Eraser (Takara Biotechnology Co., Ltd., Dalian, China). Este proceso fue el siguiente: I: 37°C durante 15 min, II: 85°C durante 5 s. El nivel de expresión del gen diana en la mucosa intestinal se determinó mediante qPCR, las secuencias de cebadores de oligonucleótidos utilizadas en la qPCR se presentan en la Tabla Suplementaria S1, la qPCR se realizó con los reactivos SYBR® Green PCR I PCR (Takara Bio Inc., Dalian, China) utilizando un sistema de detección de PCR en tiempo real CFX96 (BioRad Laboratories, Hercules, CA, USA). Todas las muestras de ADNc se analizaron por triplicado. La mezcla de reacción (10 μL) estaba compuesta por 5 μL de SYBR Premix Ex Taq II (Tli RNaseH Plus), 0,4 μL de cebador directo y cebador inverso, 1 μL de ADNc, 0,2 μL 50 × ROX Reference Dye*3 y 3 μL de ddH2O sin RNasa. El procedimiento utilizado en la qPCR cuantitativa en tiempo real fue el siguiente: 95 °C durante 25 s, seguido de 40 ciclos: a 95 °C durante 5 s y a 64,5 °C durante 25 s. Después de cada ensayo de PCR cuantitativo en tiempo real, se incluyó un análisis de la curva de fusión para confirmar que solo se estaba generando un amplicón. El nivel relativo de expresión del ARNm de los genes diana se estandarizó mediante el gen de mantenimiento β-actina y se calculó según el método 2-∆∆Ct (26).
2.14 Análisis estadístico
Antes del reto ETEC, los datos se analizaban mediante ANOVA de un factor. Después del desafío, los datos se analizaron mediante ANOVA de dos vías con el procedimiento General Linear Model (GLM) de SPSS as a 2 (CBA) × 2 (ETEC) diseño factorial. Un p < 0,05 se consideró significativo y un valor de p de 0,05 a 0,1 se consideró una tendencia significativa. Los supuestos de normalidad y homogeneidad de la varianza se confirmaron utilizando las pruebas de Shapiro-Wilk y Levene, respectivamente. Se utilizó la prueba de rangos múltiples de Duncan basada en el análisis de ANOVA, que mostró una diferencia significativa. Todos los datos fueron analizados por los programas SPSS 27.0 (IBM, Chicago, IL, EE.UU.) y GraphPad (versión 9) (GraphPad Software Inc., CA, EE.UU.). Los resultados se expresan como medias con sus errores estándar.
3 Resultados
3.1 Efecto del CBA sobre el rendimiento del crecimiento y la digestibilidad de los nutrientes en cerdos destetados tras el reto con ETEC
La suplementación con CBA tendió a un aumento del 21,89% de la GMD en los lechones destetados antes del desafío con ETEC (p < 0,1; Tabla 2). El desafío ETEC mostró una disminución del 54,59% de la GMD en los lechones, pero este efecto fue evitado por el tratamiento con CBA (p < 0,05). El CBA incrementó las digestibilidades de MS (2,59%), PC (4,20%), Cenizas (10,34%) y GE (2,40%) en lechones destetados antes del desafío ETEC (p < 0,05; Tabla 3).
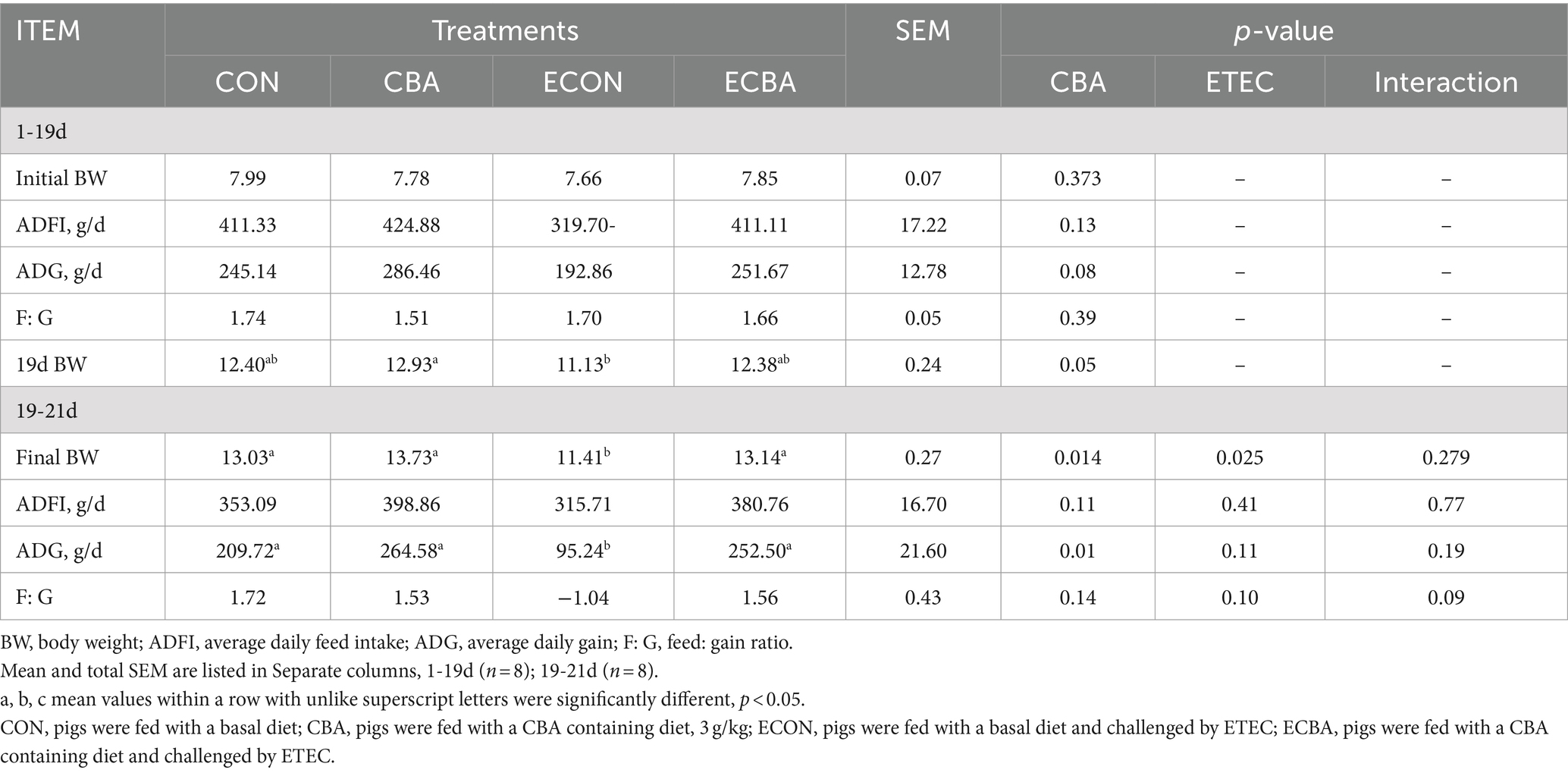
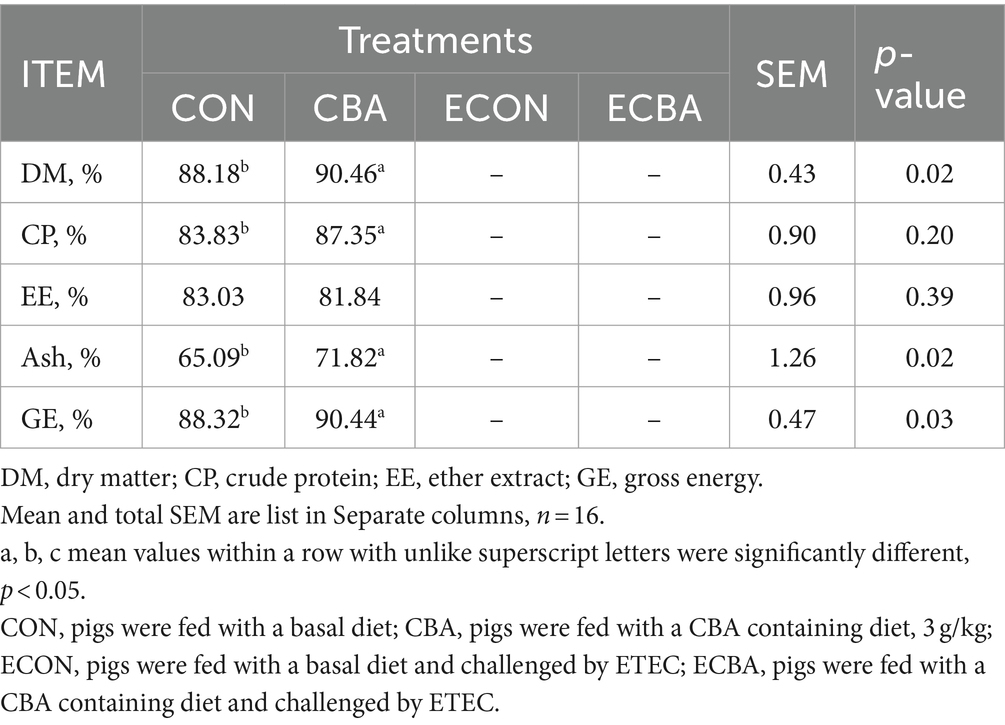
Tabla 3. Efecto de la suplementación con CBA sobre la digestibilidad de nutrientes en cerdos destetados antes del desafío ETEC.
3.2 Efecto del CBA sobre los parámetros sanguíneos y séricos en cerdos destetados tras el desafío con ETEC
Se observó una tendencia hacia un efecto de interacción entre el CBA y el ETEC, que el aumento del recuento de leucocitos tras la provocación con ETEC se evitó con el tratamiento con CBA (p < 0,1; Tabla 4). La suplementación con CBA mostró un porcentaje de aumento de basófilos del 64,29% en el grupo ECBA en comparación con el grupo ECON (p < 0,05).

La suplementación con CBA tendió a aumentar la albúmina sérica tanto en los cerdos no desafiados (7,08%) como en los provocados con ETEC (7,59%) (p < 0,1; Tabla 5). La suplementación con CBA aumentó el colesterol total sérico (26,83%) y disminuyó la urea sérica (48,60%) en cerdos no desafiados (p < 0,05). La suplementación con CBA redujo significativamente los niveles séricos de urea (48,60%) en lechones en condiciones no desafiadas (p < 0,05) y también tendió a reducir los niveles séricos de urea en condiciones desafiadas por ETEC (p < 0,1).

Tabla 5. Efecto de la suplementación con CBA sobre la bioquímica sérica en cerdos destetados después del desafío ETEC.
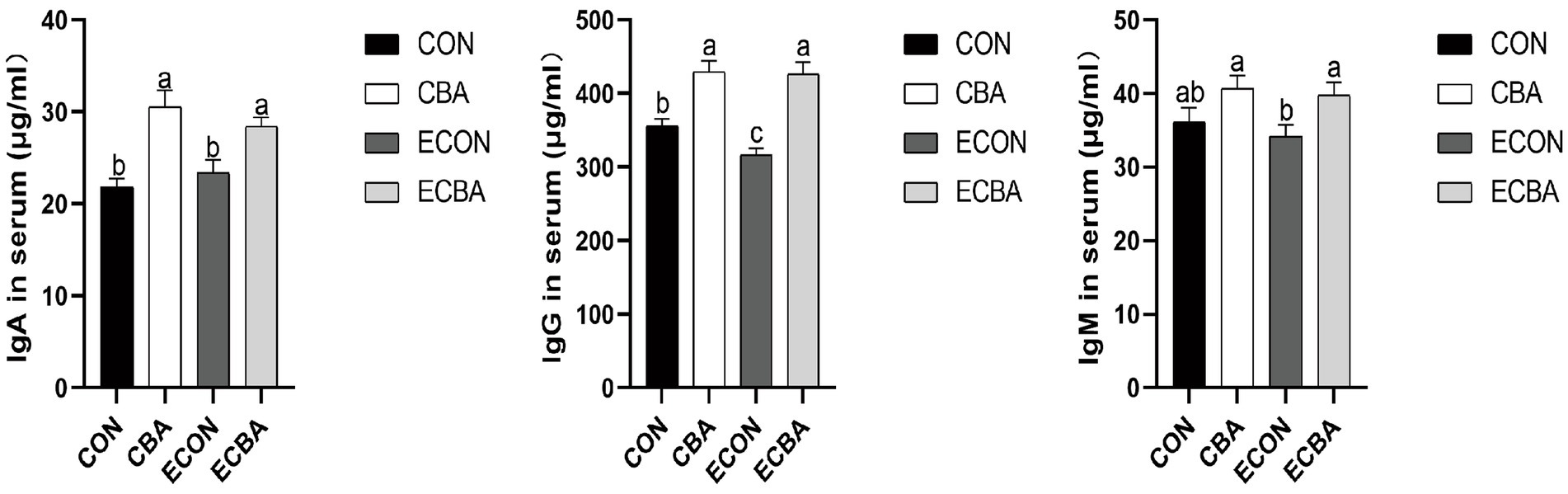
La suplementación con CBA aumentó significativamente las concentraciones séricas de IgG tanto en los grupos no desafiados como en los desafiados con ETEC (p < 0,05; Figura 1). Se observó una tendencia hacia un efecto de interacción de CBA y ETEC en el sentido de que la disminución de IgG tras la provocación con ETEC se evitó con el tratamiento con CBA. La suplementación con CBA aumentó las concentraciones de IgA e IgG en condiciones no desafiadas (p < 0.05) y aumentó la concentración de IgA e IgG, ya que tendió a aumentar la concentración de IgM en condiciones desafiadas por ETEC (p < 0.05).
Figura 1. Efecto de la suplementación con CBA sobre las concentraciones séricas de inmunoglobulinas en cerdos destetados después del desafío con ETEC. IgA, inmunoglobulinas A; IgG, inmunoglobulinas G; Los valores medios de IgM, inmunoglobulinas M. a, b, c dentro de una fila con letras superíndice diferentes fueron significativamente diferentes (p < 0,05). CON, los cerdos fueron alimentados con una dieta basal; CBA, los cerdos fueron alimentados con una dieta que contenía CBA, 3 g/kg; ECON, los cerdos fueron alimentados con una dieta basal y desafiados por ETEC; ECBA, los cerdos fueron alimentados con una dieta que contenía CBA y desafiados por ETEC.
3.3 Efecto de la suplementación con CBA sobre la morfología intestinal y la actividad enzimática de la mucosa en cerdos destetados después del desafío con ETEC
Se observaron dos efectos de interacción de CBA y ETEC en duodeno, cuando se investigaron estas interacciones hacia un efecto con una prueba post-hoc, observamos que mientras el desafío ETEC mostró un aumento de 22.54% en la profundidad de la cripta y una disminución de V:C en 20.30%, estos efectos fueron prevenidos por el tratamiento con CBA (p < 0.05; Tabla 6, Figura 2). La suplementación con CBA mostró un aumento del 24,01% en la altura de las vellosidades del íleon (p < 0,05), así como en el V:C yeyuno (10,98%) e ileal (32,53%) de los cerdos no desafiados (p < 0,05). El desafío con ETEC mostró una reducción de la altura de las vellosidades ileales del 14,38% y un aumento del 13,20% en la profundidad de la cripta yeyunal en los cerdos desafiados con ETEC (p < 0,05). Sin embargo, los cerdos alimentados con una dieta suplementada con CBA presentaron mayor altura de vellosidades ileales y profundidad de la cripta yeyunal, luego mejoraron el V:C yeyunal (16,00%) e ileal (12,96%) después del desafío ETEC (p < 0,05). El desafío ETEC disminuyó las actividades de maltasa en el duodeno (42,03%) y sacarosa en el yeyuno (27,90%). Sin embargo, la suplementación con CBA alivió la reducción de las actividades ante el desafío ETEC (p < 0,05; Tabla 7). La suplementación con CBA también mejoró la actividad ileal de la lactasa (30,45 %), la sacarasa (54,04 %) y la maltasa (32,87 %) tras el desafío ETEC (p < 0,05), y de la fosfatasa alcalina (61,83 %) sin el desafío ETEC (p < 0,05).
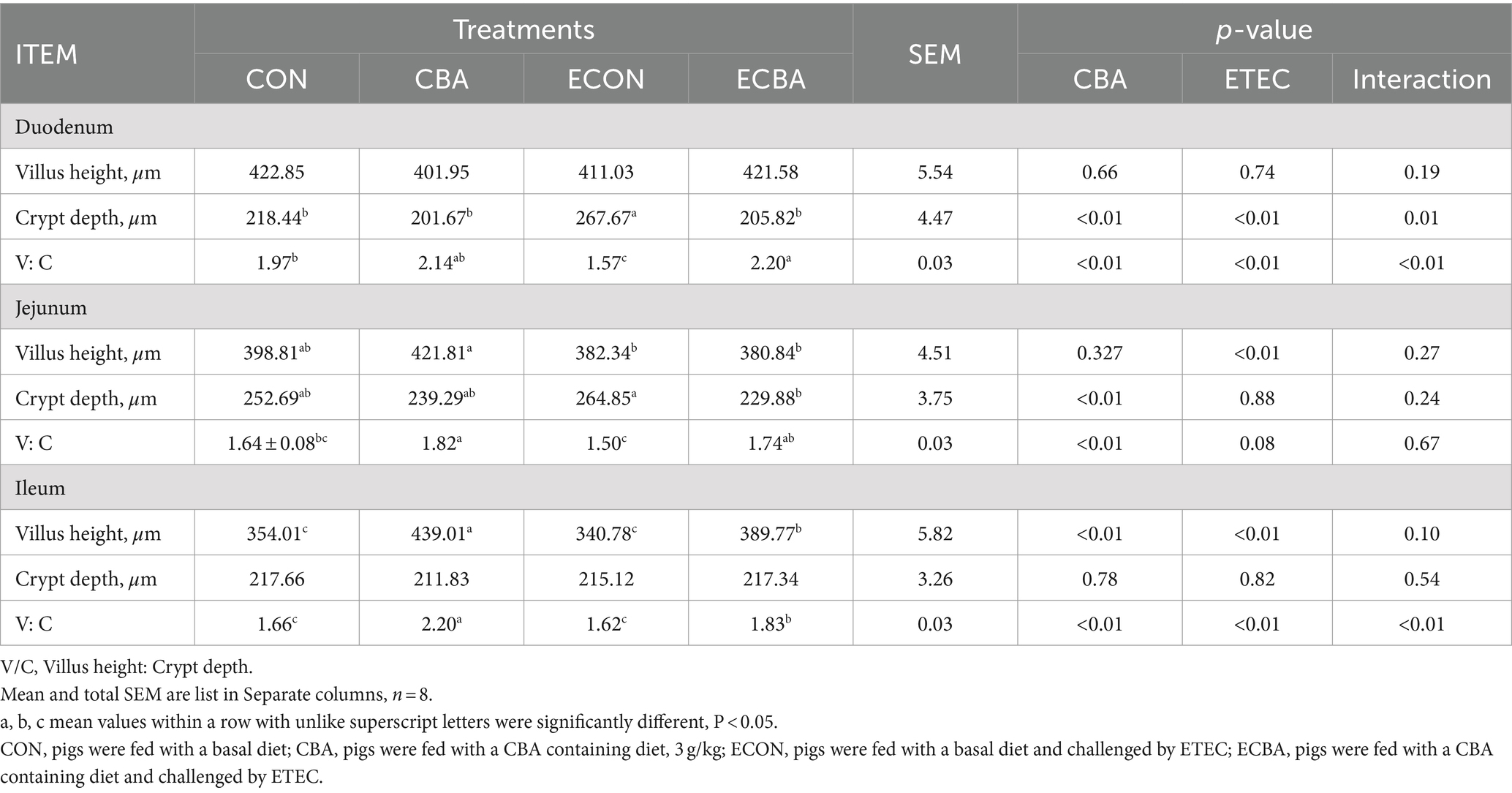
Tabla 6. Efecto de la suplementación con CBA sobre la morfología intestinal en cerdos destetados después del desafío ETEC.
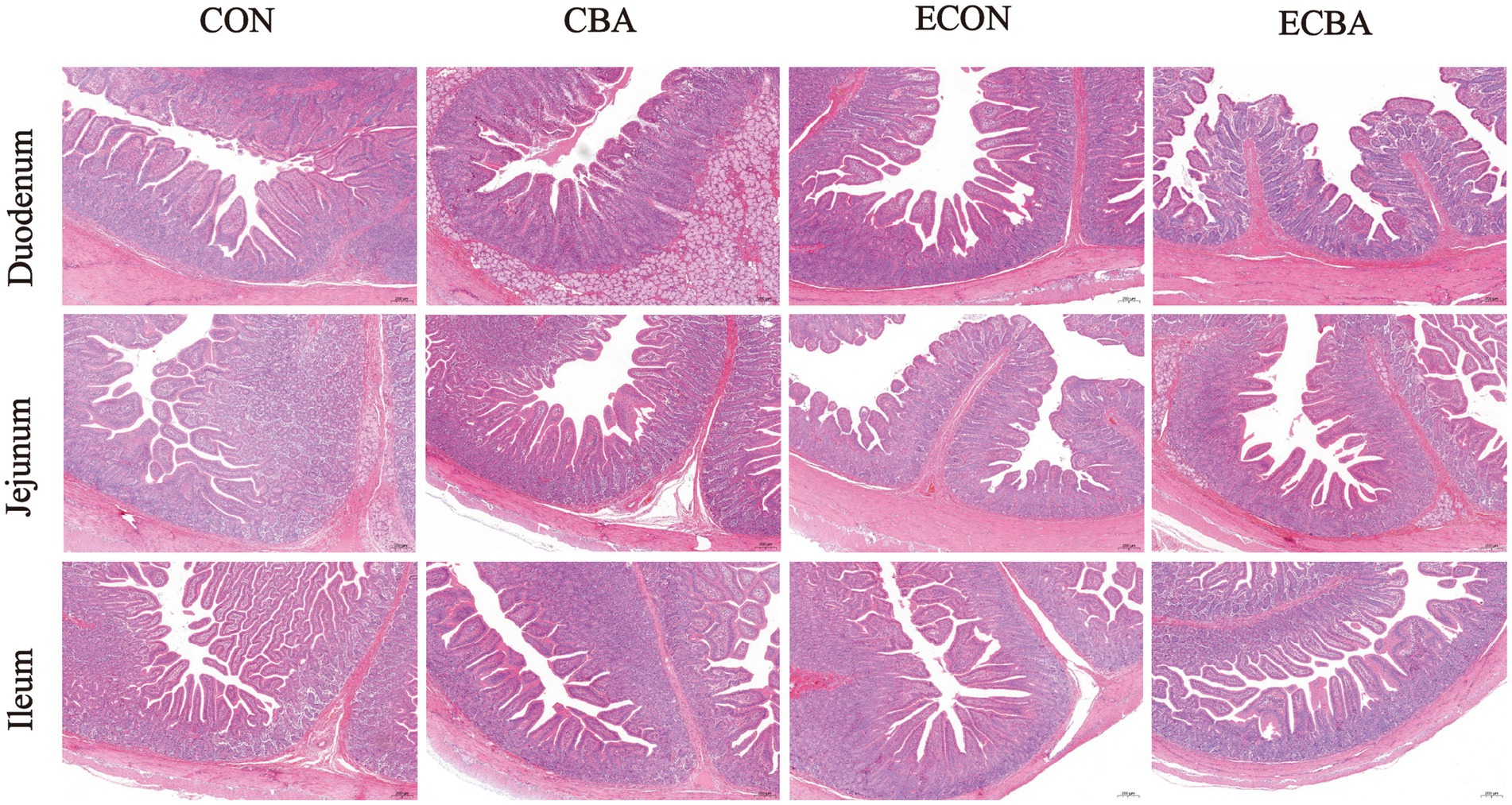
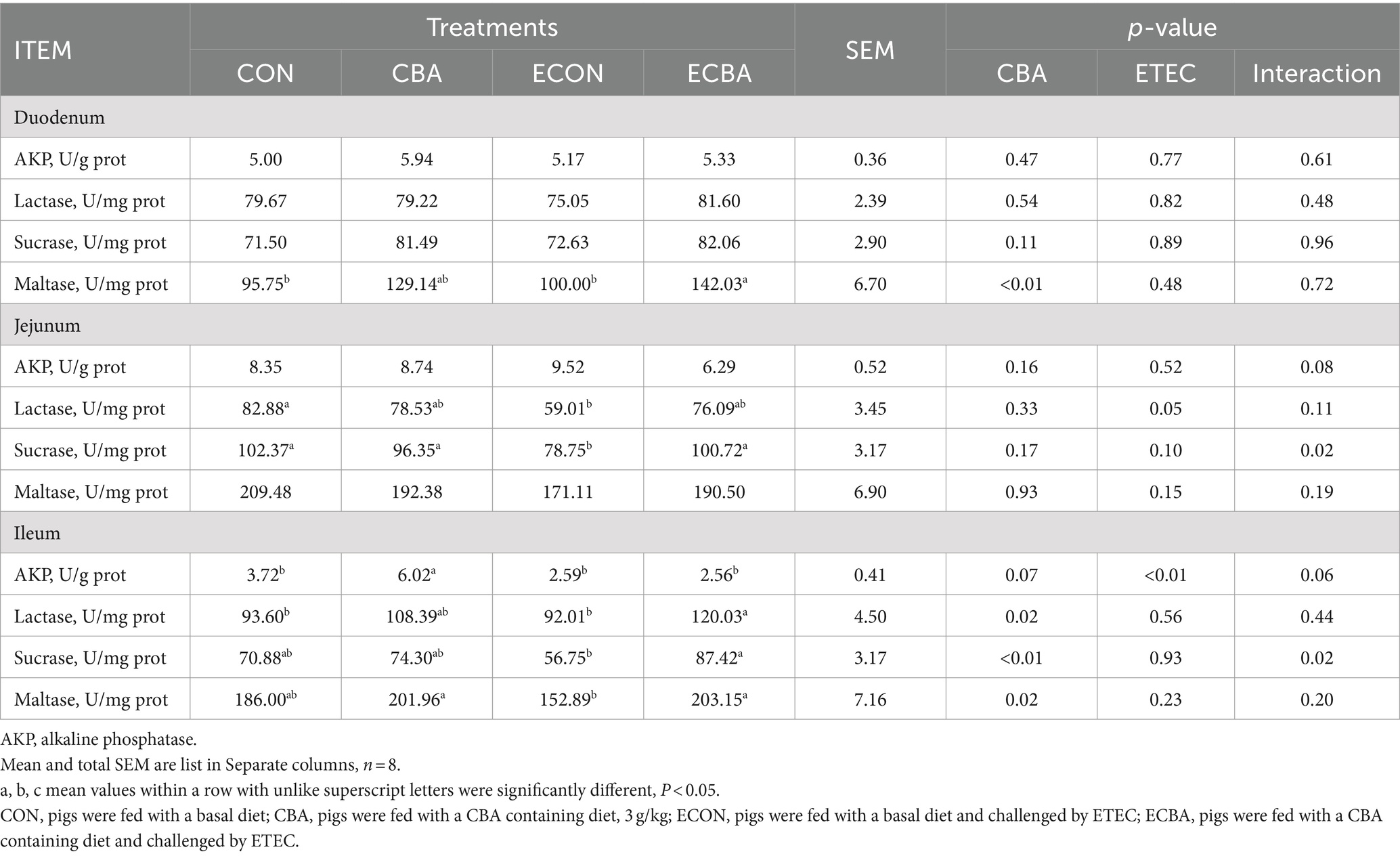
Tabla 7. Efecto de la suplementación con CBA sobre la actividad enzimática de la mucosa en cerdos destetados después del desafío con ETEC.
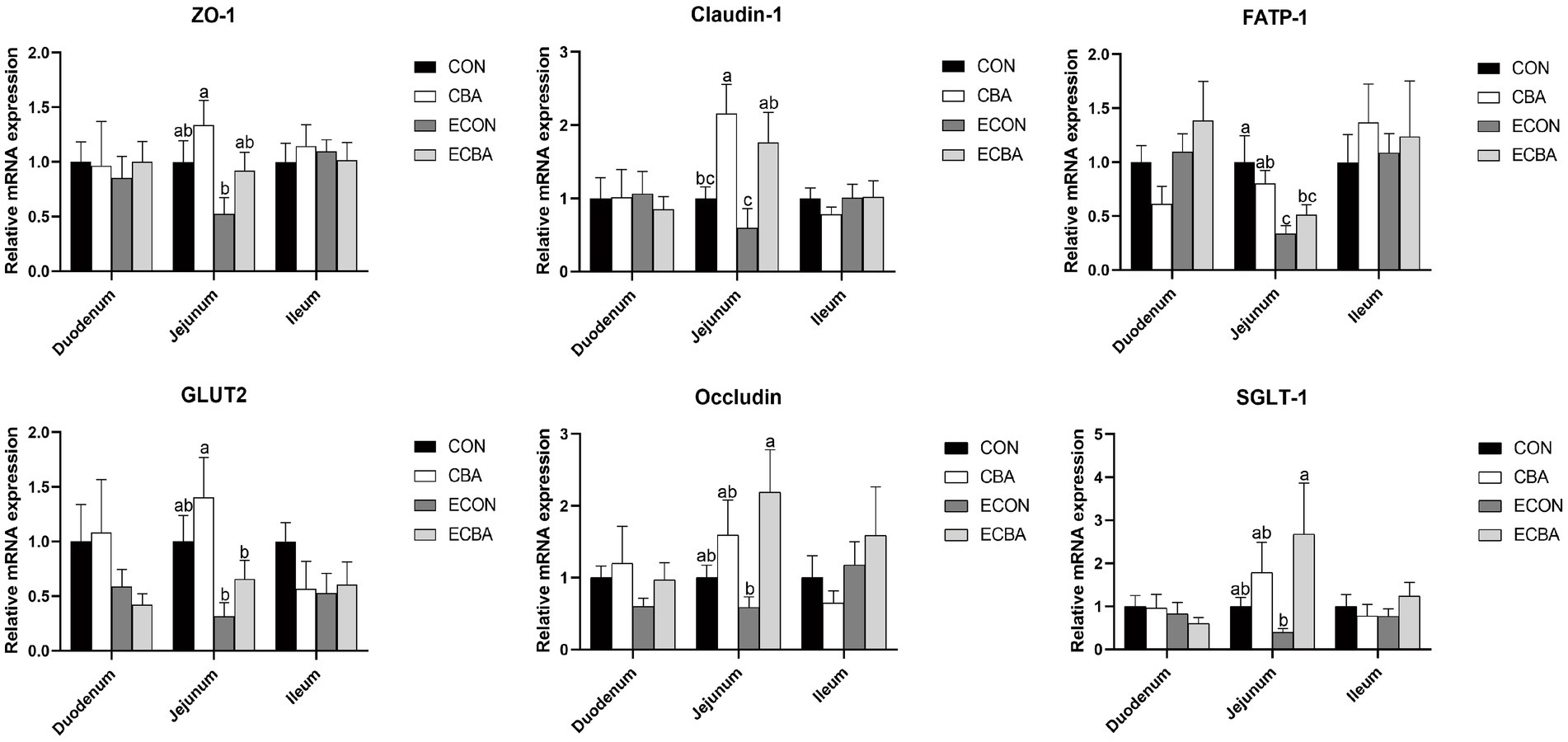
3.4 Efecto de la suplementación con CBA sobre la expresión de genes de barrera intestinal y absorción de nutrientes en cerdos destetados después del desafío con ETEC
La suplementación con CBA tendió a aumentar los niveles de expresión de los genes zonula occludens-1 (ZO-1) y transportador de glucosa-2 (GLUT2) en la mucosa yeyunal de los cerdos no desafiados (p < 0,1; Figura 3). La suplementación con CBA tendió a aumentar los niveles de expresión de los genes ZO-1 y de la proteína transportadora de ácidos grasos 1 (FATP-1) en la mucosa yeyunal del grupo desafiado por ETEC (p < 0,1). Además, el desafío ETEC redujo significativamente los niveles de expresión de FATP-1 en la mucosa yeyunal de los lechones (p < 0,05). Los niveles de expresión de los genes Ocludina y cotransportador de sodio/glucosa-1 (SGLT-1) fueron significativamente más altos en el grupo ECBA en comparación con el grupo ECON (p < 0,05). La suplementación con CBA elevó significativamente los niveles de expresión de claudina-1 en el epitelio yeyunal de los cerdos no desafiados, así como en los cerdos desafiados con ETEC (p < 0,05).
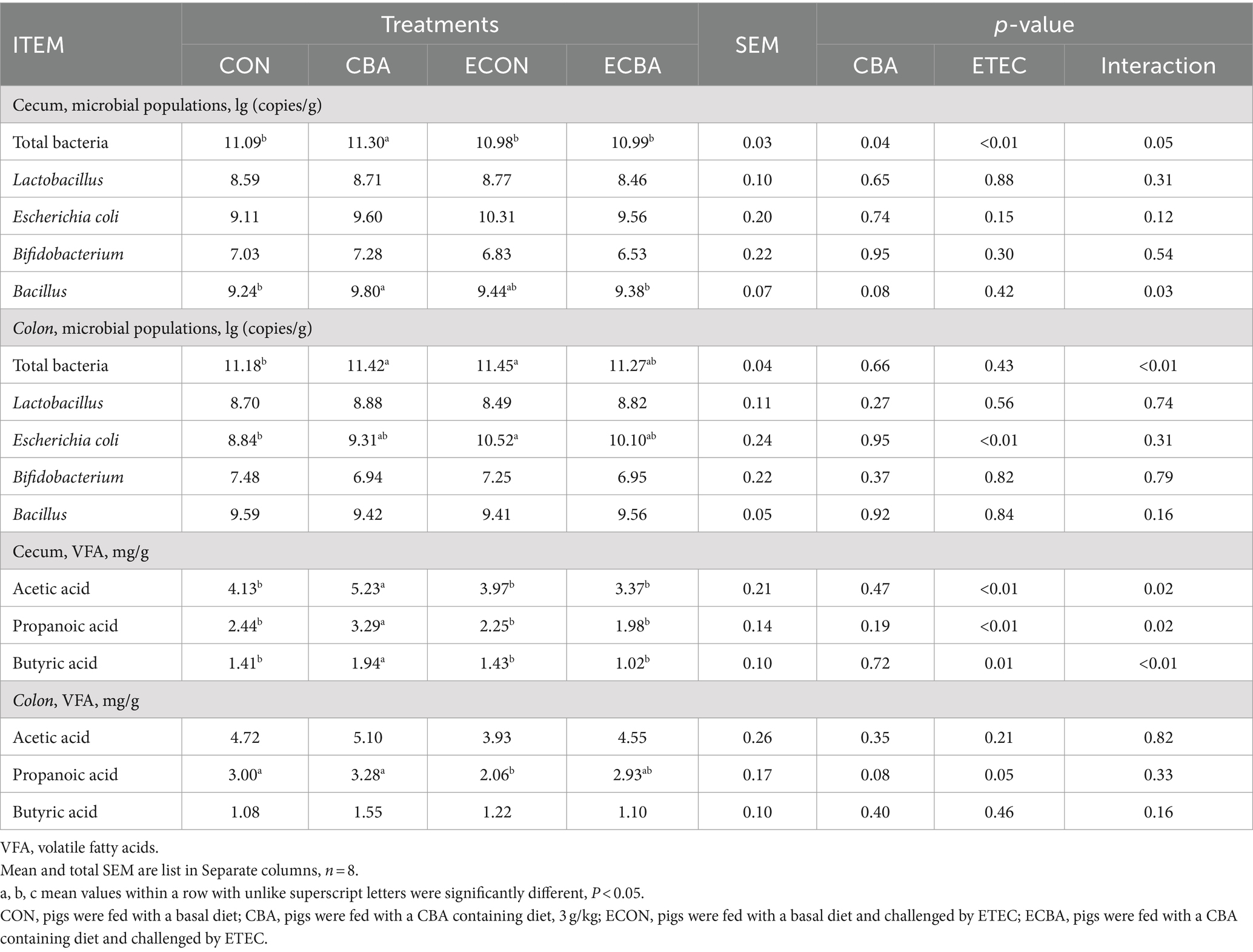
3.5 Efecto de la suplementación con CBA sobre las poblaciones microbianas intestinales y los metabolitos en cerdos destetados después del desafío ETEC
La suplementación con CBA mostró una abundancia de 6,06% de elevación de Bacillus en el ciego de los cerdos no desafiados (p < 0,05; Tabla 8) y un aumento del contenido bacteriano total de 1,89% en el ciego (p < 0,05). La suplementación con CBA mejoró la abundancia de los niveles de ácido acético (26,63%), propiónico (34,84%) y butírico (37,59%) en el ciego de los cerdos no desafiados (p < 0,05). El desafío ETEC aumentó el recuento de E. coli en el colon (19,00%) y el total de bacterias (2,42%) en comparación con el grupo CON, pero la suplementación con CBA tendió a disminuir el recuento de E. coli en el colon y el total de bacterias. El desafío ETEC mostró una disminución del 31,33% del ácido propiónico en el colon en comparación con el grupo CON, pero la suplementación con CBA tendió a aumentar el ácido propiónico colónico.
4 Discusión
El BA es un agente antimicrobiano con un amplio espectro de actividad contra bacterias patógenas (27). Estudios previos han encontrado que el BA tuvo un efecto positivo en el rendimiento del crecimiento en lechones, lo que se relacionó con la actividad antibacteriana, la mejora de la digestión y absorción de nutrientes (28), el mantenimiento del ambiente del tracto gastrointestinal (29) y la promoción de la producción y activación de enzimas digestivas (30). Sin embargo, el BA suele añadirse a las dietas animales en forma libre, y su rápida absorción limita su capacidad para ejercer sus posibles efectos antimicrobianos e inmunomoduladores fuera del estómago y del intestino delgado proximal (31). En este caso, el CBA se suplementó con las dietas de los lechones destetados para que pudiera actuar en todo el tracto gastrointestinal. En este estudio, encontramos que el CBA no solo aumentó la GMD de los cerdos desafiados con ETEC, sino que también aumentó la digestibilidad de MS, PC, Cenizas y GE en lechones destetados antes del desafío ETEC, lo cual es consistente con estudios previos (32). Ambos resultados muestran un efecto beneficioso de la suplementación con CBA sobre el rendimiento del crecimiento de los cerdos destetados.
Los cambios en los leucocitos sanguíneos son indicadores importantes del estado del sistema inmunitario (33). Los basófilos son células efectoras de la inmunidad innata, como el principal proveedor de histamina en la sangre, y desempeñan un papel central en la patogénesis de la inmunidad protectora (34). La suplementación con CBA aumentó significativamente el porcentaje de basófilos de los cerdos desafiados con ETEC, lo que indica una mejora inmunológica en los cerdos después del desafío con ETEC. La bioquímica sérica son análisis de sangre de rutina que están estrechamente relacionados con el estado nutricional, el metabolismo de las proteínas y las enfermedades. La fluctuación de los índices bioquímicos séricos puede reflejar el metabolismo y la salud del cuerpo (35).
Los niveles séricos de albúmina y urea están estrechamente relacionados con la digestión y absorción de proteínas. En particular, la urea sérica es el principal producto final del metabolismo de las proteínas en los mamíferos (36). Este estudio encontró que la adición de CBA a la dieta aumentó el contenido de albúmina sérica mientras que disminuyó el contenido de urea sérica. Esto sugiere que la utilización de proteínas mejoró en los tratamientos dietéticos de CBA, lo que respalda la mejora mencionada anteriormente en ADG. El colesterol total refleja la tasa de metabolismo de los lípidos y la salud del hígado (37). En este estudio, la suplementación con CBA aumentó el contenido de colesterol total sérico de los cerdos no desafiados, lo que sugiere que el CBA puede afectar el metabolismo de los lípidos. Las inmunoglobulinas, también conocidas como anticuerpos, son una clase de glicoproteínas producidas por las células plasmáticas (38). Existen principalmente en el suero y la mucosa intestinal, proporcionando protección celular contra virus patógenos y microorganismos (39). Como uno de los constituyentes del sistema inmunológico animal, la IgA es la segunda inmunoglobulina más abundante en el suero (40), la IgG mata principalmente las bacterias en el suero, mientras que la IgM ayuda a prevenir infecciones bacterianas y fúngicas, ya que desempeña un papel importante en la promoción de la tolerancia de la mucosa y la creación de un entorno microecológico saludable dentro del intestino (41). El CBA elevó significativamente las concentraciones séricas de IgA e IgG y demostró una tendencia a aumentar la concentración de IgM de los cerdos desafiados con ETEC, lo que indica una mayor inmunidad con la suplementación con CBA.
El intestino delgado desempeña un papel fundamental en la digestión, absorción y transporte de nutrientes, y sus vellosidades son indispensables para estas funciones. Por lo tanto, la evaluación de la digestión intestinal se llevó a cabo midiendo la relación entre la altura de las vellosidades y la profundidad de las criptas (42). Las vellosidades superiores favorecen una mayor absorción de nutrientes por parte del sistema digestivo. Un valor de CD más bajo indica una mayor población de células epiteliales maduras, mientras que una relación VH:CD más alta sugiere una estructura mucosa más favorable con una mayor capacidad digestiva y de absorción (43). Sin embargo, la morfología intestinal puede verse alterada después de la infección por ETEC (44). Investigaciones anteriores encontraron que el valor del pH afectaría el crecimiento celular, y la división celular mejoraría a medida que aumentara la acidez (45). Otras investigaciones encontraron que la reducción de la altura de las vellosidades intestinales y el aumento de la profundidad de las criptas de los lechones se relacionó con la disminución de las actividades de la sacarasa y la lactasa en el borde estriado (46). La suplementación con CBA aumentó significativamente las actividades de la maltasa en el duodeno y de la sacarosa en el yeyuno. La suplementación con CBA también mejoró la actividad ileal de la lactasa, la sacarosa y la maltasa de los cerdos desafiados con ETEC, y de la fosfatasa alcalina de los cerdos no desafiados, lo que sugiere que la suplementación con CBA puede aliviar el estrés intestinal en los lechones al reducir el valor del pH del intestino, aumentar la actividad de las enzimas digestivas en el intestino delgado y mejorar la morfología intestinal. y mantener la salud de la mucosa intestinal tras el destete. Las uniones estrechas desempeñan un papel crucial en la integridad de la barrera intestinal y protegen la colonización de bacterias patógenas y la transmisión macromolecular de la difusión paracelular (47), compuestas por proteínas de barrera transmembrana (p. ej., claudinas y ocludina), proteínas de andamio citoplasmático (p. ej., familia ZO) y moléculas de adhesión. Las claudinas son proteínas de membrana integral que se encuentran principalmente en uniones estrechas. Desempeñan un papel fundamental en la adhesión apical de célula a célula, el mantenimiento de la polaridad epitelial y la formación de barreras impermeables entre las células epiteliales (48). En este estudio, encontramos que la suplementación con CBA elevó significativamente los niveles de expresión de claudina-1 en el epitelio yeyunal de los cerdos no desafiados, así como de los cerdos desafiados con ETEC, y elevó significativamente los niveles de expresión de Ocludina y SGLT-1 en el epitelio yeyunal de los cerdos desafiados con ETEC. La suplementación con CBA también tendió a aumentar los niveles de expresión de ZO-1. Además, el CBA también elevó los niveles de expresión de GLUT2 y FATP-1 en el epitelio yeyunal. En el intestino de cerdo, SGLT1 es la principal ruta para la absorción de glucosa en la dieta desde la luz del intestino hacia los enterocitos (49). La FATP-1 desempeña un papel importante en la regulación del metabolismo de los ácidos grasos y la acumulación de lípidos (50), y la GLUT-2 es uno de los principales transportadores de la absorción de glucosa. Estos resultados sugieren que la administración de CBA puede mejorar los mecanismos de barrera inespecíficos y epiteliales en el intestino.
Las poblaciones microbianas intestinales están asociadas con la digestión, absorción y salud intestinal de nutrientes (51). Los microbios intestinales desempeñan un papel crucial en el mantenimiento de la salud intestinal. El equilibrio de bacterias beneficiosas como Lactobacillus, Bifidobacterium y Bacillus, y la reducción de bacterias dañinas como Escherichia coli, están asociados con la morfología intestinal y pueden ayudar a prevenir la diarrea (52). En este estudio, encontramos que la suplementación con CBA elevó significativamente la abundancia de bacterias beneficiosas, Bacillus en el ciego de los cerdos no desafiados, y tuvo una tendencia a disminuir los recuentos colónicos de Escherichia coli. Las bacterias beneficiosas suprimen la colonización de Escherichia coli bloqueando los sitios de adhesión y produciendo metabolitos ácidos (17), lo que podría ser la explicación parcial de por qué el CBA podría regular la microbiota intestinal. El cambio en la composición microbiana intestinal conduce a la variación de los metabolitos microbianos. Como metabolitos microbianos, los AGV tienen una función similar a la inhibición de las bacterias (53), y no solo son positivos para proporcionar energía a las células epiteliales intestinales, sino que promueven la formación de células mediante la estabilización del ADN y la reparación del daño, promoviendo así la proliferación de células epiteliales (54). Además, los AGV pueden aumentar la acidez de las sustancias intercelulares en las bacterias dañinas para inhibir las bacterias, destruir el equilibrio de la presión osmótica en las bacterias dañinas y, por lo tanto, desempeñar un papel en la regulación de la microflora (53). La suplementación con CBA mejoró excelentemente la abundancia de los niveles de ácido acético, propiónico y butírico en el ciego de los cerdos no desafiados, y tuvo una tendencia a disminuir los recuentos colónicos de Escherichia coli de los cerdos desafiados con ETEC. El CBA no solo modula la microflora intestinal, sino que también aumenta la concentración de AGV. Esto proporciona nuevas explicaciones para los efectos positivos del CBA en la salud intestinal.
En el presente estudio, encontramos que el CBA tiene efectos beneficiosos sobre la morfología intestinal, la expresión de genes de unión estrecha y genes de absorción de nutrientes, la colonización de probióticos y la producción de AGV (55). Estudios anteriores han demostrado que los probióticos como el Bacillus tienen un efecto protector sobre la barrera intestinal. Por lo tanto, nuestra hipótesis de que el CBA podría mejorar la función intestinal al estimular el crecimiento de bacterias beneficiosas y suprimir el crecimiento de bacterias patógenas potenciales, aumentar la fermentación microbiana y la descomposición de carbohidratos complejos, y aumentar la producción de AGV era correcta.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité Experimental Animal de la Universidad Agrícola de Sichuan (número de autorización SICAU-2022-014). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
JQ: Curación de datos, Redacción – borrador original. POR: Investigación, Escritura – revisión y edición. YH: Escritura – revisión y edición, conceptualización. YL: Redacción – revisión y edición, Software. PZ: Redacción – revisión y edición, supervisión. XM: Supervisión, Redacción – revisión y edición. JY: Escritura – revisión y edición, análisis formal. XZ: Análisis formal, Redacción – revisión y edición. TH: Supervisión, redacción, revisión y edición. HY: Supervisión, Redacción – revisión y edición. AW: Supervisión, Redacción – revisión y edición. JH: Obtención de fondos, Administración de proyectos, Redacción, revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. El Programa Nacional Clave de Investigación y Desarrollo de China (2023YFD1301200) y el Equipo de Innovación de la Provincia de Sichuan (SCCXTD-2024-8) apoyaron este trabajo.
Conflicto de intereses
YH, XZ y TH fueron empleados por Nuacid Nutrition Co., Ltd.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1430696/full#supplementary-material
Referencias
1. Upadhaya, S-D, y Kim, I-H. El impacto del estrés del destete en la salud intestinal y los aspectos mecanicistas de varios aditivos alimentarios que contribuyen a mejorar la función de la salud intestinal en lechones destetados: una revisión. Animales. (2021) 11:2418. doi: 10.3390/ani11082418
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Peluche, JR . Aspectos relacionados con los piensos y los aditivos alimentarios de la salud intestinal y el desarrollo de los cerdos destetados. J Anim Sci Biotechnol. (2013) 4:1. doi: 10.1186/2049-1891-4-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Nagy, B, y Fekete, PZ. Escherichia coli enterotoxigénica en medicina veterinaria. Int J Med Microbiol. (2005) 295:443–54. doi: 10.1016/j.ijmm.2005.07.003
4. Rhouma, M, Fairbrother, JM, Beaudry, F y Letellier, A. Diarrea post-destete en cerdos: factores de riesgo y estrategias de control no basadas en colistina. Acta Vet Scand. (2017) 59:31. doi: 10.1186/s13028-017-0299-7
5. Kaper, JB, Nataro, JP y Mobley, HL. Escherichia coli patógena. Nat Rev Microbiol. (2004) 2:123–40. doi: 10.1038/nrmicro818
6. Li, J . Estado actual y perspectivas de los antibióticos en los piensos en las diferentes etapas de la producción porcina: una revisión. Australas Asiáticas J Anim Sci. (2017) 30:1667–73. doi: 10.5713/ajas.17.0418
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Su, W, Gong, T, Jiang, Z, Lu, Z y Wang, Y. El papel de los probióticos en el alivio de la diarrea post-destete en lechones desde la perspectiva de las barreras intestinales. La célula frontal infecta el microbiol. (2022) 12:883107. doi: 10.3389/fcimb.2022.883107
8. Thacker, Pensilvania . Alternativas a los antibióticos como promotores del crecimiento para su uso en la producción porcina: una revisión. J Anim Sci Biotechnol. (2013) 4:35. doi: 10.1186/2049-1891-4-35
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Del Olmo, A, Calzada, J, y Nuñez, M. El ácido benzoico y sus derivados como compuestos naturales en los alimentos y como aditivos: usos, exposición y controversia. Crit Rev Ciencia Alimenticia Nutr. (2017) 57:3084–103. doi: 10.1080/10408398.2015.1087964
10. Maki, T, y Takeda, K. Ácido benzoico y derivados En: SS Chadwick editor. Enciclopedia de química industrial de Ullmann. Nueva York, NY: Wiley (2000). 133.
11. Pu, J, Chen, D, Tian, G, He, J, Zheng, P, Mao, X, et al. Efectos protectores del ácido benzoico, Bacillus Coagulans y aceite de orégano sobre la lesión intestinal causada por Escherichia coli enterotoxigénica en lechones destetados. Biomed Res Int. (2018) 2018:1–12. doi: 10.1155/2018/1829632
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Davitt, CJ y Lavelle, EC. Estrategias de administración para mejorar la vacunación oral contra las infecciones entéricas. Adv Droga Deliv Rev. (2015) 91:52–69. doi: 10.1016/j.addr.2015.03.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Saha, DC, Boegel, SJ, Tanvir, S, Nogueira, CL, Aucoin, MG, Anderson, WA, et al. Aplicación de recubrimiento de pulverización en frío antiviral y antibacteriano sobre sustrato de caucho, interrupción de la cadena de transmisión de enfermedades. J Therm spray Technol. (2023) 32:818–30. doi: 10.1007/s11666-023-01553-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Forajido, A, Gachman, A, Kim, H, Xu, X, Tan, Z, Qin, Z, et al. Evaluación del ácido benzoico protegido sobre el rendimiento del crecimiento, la digestibilidad de los nutrientes y los índices de salud intestinal en cerdos principiantes. Transl Anim Sci. (2023) 7:txad111. doi: 10.1093/tas/txad111
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Kluge, H, Broz, J y Eder, K. Efecto del ácido benzoico sobre el rendimiento del crecimiento, la digestibilidad de los nutrientes, el equilibrio de nitrógeno, la microflora gastrointestinal y los parámetros del metabolismo microbiano en lechones. J Anim Physiol Anim Nutr (Berl). (2006) 90:316–24. doi: 10.1111/j.1439-0396.2005.00604.x
16. Humphrey, DC, Bergstrom, JR, Calvo, EP, Trabue, SL, Scoggin, KD y Greiner, LL. El efecto del ácido benzoico con o sin un microbio de alimentación directa sobre el metabolismo de nutrientes y las emisiones de gases de los cerdos en crecimiento. J Anim Sci. (2022) 100:skac296. doi: 10.1093/jas/skac296
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Papatsiros, VG, Tassis, PD, Tzika, ED, Papaioannou, DS, Petridou, E, Alexopoulos, C, et al. Efecto del ácido benzoico y combinación de ácido benzoico con un probiótico que contiene Bacillus cereus var. Toyoi en la nutrición de cerdos destetados. Pol J Vet Sci. (2011) 14:117–25. doi: 10.2478/v10181-011-0017-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Gao, Y, Han, F, Huang, X, Rong, Y, Yi, H y Wang, Y. Cambios en las poblaciones microbianas intestinales, la morfología intestinal, la expresión de proteínas de unión estrecha y la producción de citocinas entre dos razas de cerdos después del desafío con Escherichia coli K88: un estudio comparativo. J Anim Sci. (2013) 91:5614–25. doi: 10.2527/jas.2013-6528
19. Rychen, G, Aquilina, G, Azimonti, G, Bampidis, V, Bastos, M, Bories, G, et al. Seguridad y eficacia del ácido benzoico para cerdos y aves de corral. EFSA J. (2018) 16:e05210. doi: 10.2903/j.efsa.2018.5210
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Consejo Nacional de Investigación (EE. UU.) . Requerimientos de nutrientes de los cerdos. 11ª ed. Washington, DC: National Academies Press (2012).
21. Latimer, GW Jr . Métodos oficiales de análisis de AOAC internacional. 20ª ed. Rockville, MD: AOAC Internacional (2016).
22. van Leeuwen, P, Veldman, A, Boisen, S, Deuring, K, van Kempen, GJ, Derksen, GB, et al. Digestibilidad aparente de la materia seca ileal y de la proteína bruta de las raciones suministradas a los cerdos y determinada con el uso de óxido crómico (Cr2O3) y cenizas insolubles en ácido como marcadores digestivos. Hno. J Nutr. (1996) 76:551–62. doi: 10.1079/BJN19960062
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Yang, Y, Iji, PA, Kocher, A, Mikkelsen, LL y Choct, M. Efectos de los mananoligosacáridos dietéticos en el rendimiento del crecimiento, la digestibilidad de los nutrientes y el desarrollo intestinal de los pollos de engorde con diferentes dietas basadas en cereales. J Anim Physiol Anim Nutr. (2008) 92:650–9. doi: 10.1111/j.1439-0396.2007.00761.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Chen, C, Wang, Z, Li, J, Li, Y, Huang, P, Ding, X, et al. La vitamina E dietética afecta la histomorfología del intestino delgado, la actividad de las enzimas digestivas y la expresión de transportadores de nutrientes al inhibir la proliferación de células epiteliales intestinales dentro del yeyuno en lechones destetados1. J Anim Sci. (2019) 97:1212–21. doi: 10.1093/jas/skz023
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Franklin, MA, Mathew, AG, Vickers, JR y Clift, RA. Caracterización de poblaciones microbianas y concentraciones de ácidos grasos volátiles en yeyuno, íleon y ciego de cerdos destetados a los 17 vs 24 días de edad. J Anim Sci. (2002) 80:2904–10. doi: 10.2527/2002.80112904x
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Fleige, S, Walf, V, Huch, S, Prgomet, C, Sehm, J y Pfaffl, MW. Comparación de modelos de cuantificación de ARNm relativo y el impacto de la integridad del ARN en la RT-PCR cuantitativa en tiempo real. Biotechnol Lett. (2006) 28:1601–13. doi: 10.1007/s10529-006-9127-2
27. Krátký, M, Vinšová, J, y Buchta, V. Actividad antibacteriana y antifúngica in vitro de los benzoatos de salicilanida. Sci World J. (2012) 2012:290628. doi: 10.1100/2012/290628
28. Torrallardona, D, Badiola, I, y Broz, J. Efectos del ácido benzoico en el rendimiento y la ecología de la microbiota gastrointestinal en lechones destetados, ciencia ganadera. Problemas. (2007) 108:210–3. doi: 10.1016/j.livsci.2007.01.062
29. Karlsson, FH, Tremaroli, V, Nookaew, I, Bergström, G, Behre, CJ, Fagerberg, B, et al. Metagenoma intestinal en mujeres europeas con control glucémico normal, alterado y diabético. Naturaleza. (2013) 498:99–103. doi: 10.1038/nature12198
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Mao, X, Yang, Q, Chen, D, Yu, B y He, J. El ácido benzoico utilizado como aditivos para alimentos y piensos puede regular las funciones intestinales. Biomed Res Int. (2019) 2019:5721585. doi: 10.1155/2019/5721585
31. Kristensen, NB, Nørgaard, JV, Wamberg, S, Engbaek, M, Fernández, JA, Zacho, HD, et al. Absorción y metabolismo del ácido benzoico en cerdos en crecimiento. J Anim Sci. (2009) 87:2815–22. DOI: 10.2527/jas.2009-2003
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Diao, H, Zheng, P, Yu, B, He, J, Mao, XB, Yu, J, et al. Efectos del ácido benzoico sobre el rendimiento del crecimiento, los parámetros bioquímicos séricos, la digestibilidad de los nutrientes y las actividades de las enzimas digestivas de la jejuna digesta en lechones destetados. Chin J Anim Nutr. (2013) 25:768–77. doi: 10.3969/j.issn.1006-267x.2013.04.014
33. Chaussabel, D . Evaluación del estado inmunitario mediante transcriptómica sanguínea y posibles implicaciones para la salud global. Semin Immunol. (2015) 27:58–66. doi: 10.1016/j.smim.2015.03.002
34. Ding, S, Cheng, Y, Azad, MA, Zhu, Q, Huang, P y Kong, X. Cambios en el desarrollo de la inmunidad y diferentes respuestas al estrés al destete de lechones indígenas chinos y lechones Duroc durante los períodos de lactancia y destete. Int J Mol Sci. (2022) 23:23. doi: 10.3390/ijms232415781
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Gradela, A, Souza, VN, Queiroz, MM, Constantino, AC, Faria, MD, Pires, IC, et al. Bioquímica sérica de Trachemys scripta elegans y Trachemys dorbignyi (Testudines: Emydidae) criados en cautiverio en la región semiárida del noreste de Brasil. Mundo Veterinario. (2020) 13:1083–90. doi: 10.14202/vetworld.2020.1083-1090
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Hou, G, Peng, W, Wei, L, Li, R, Huang, X y Yin, Y. Los probióticos y los polisacáridos de Achyranthes bidentata mejoran el rendimiento del crecimiento al promover la utilización de nutrientes intestinales y mejorar la función inmunológica de los cerdos destetados. Animales. (2021) 11::2617. doi: 10.3390/ani11092617
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Wei, Z, Yu, B, Huang, Z, Luo, Y, Zheng, P, Mao, X, et al. Efecto del ácido 3-cafeoilquínico sobre el rendimiento del crecimiento, la digestibilidad de los nutrientes y las funciones intestinales en cerdos destetados. J Anim Sci. (2023) 101:skad234. doi: 10.1093/jas/skad234
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Duan, Q, Chen, D, Yu, B, Huang, Z, Luo, Y, Zheng, P, et al. Efecto de la sialilactosa sobre el rendimiento del crecimiento y las funciones del epitelio intestinal en cerdos destetados desafiados por Escherichia coli enterotoxigénica. J Anim Sci Biotechnol. (2022) 13:30. doi: 10.1186/s40104-022-00673-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Li, P, Yin, Y-L, Li, D, Kim, SW y Wu, G. Aminoácidos y función inmune. Hno. J Nutr. (2007) 98:237–52. doi: 10.1017/S000711450769936X
40. Zhou, Y, Luo, Y, Yu, B, Zheng, P, Yu, J, Huang, Z, et al. Efecto de la suplementación con β-glucano sobre el rendimiento del crecimiento y las funciones del epitelio intestinal en cerdos destetados desafiados por Escherichia coli enterotoxigénica. Antibióticos. (2022) 11:519. doi: 10.3390/antibióticos11040519
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Turula, H, y Wobus, CE. El papel del receptor de inmunoglobulinas poliméricas y las inmunoglobulinas secretoras durante la infección de la mucosa y la inmunidad. Virus. (2018) 10:237. doi: 10.3390/v10050237
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Bajo, AG . Estudios sobre la digestión y absorción en los intestinos de cerdos en crecimiento. 6. Mediciones del flujo de aminoácidos. Hno. J Nutr. (1979) 41:147–56. doi: 10.1079/BJN19790021
43. Pluske, JR, Thompson, MJ, Atwood, CS, Bird, PH, Williams, IH y Hartmann, PE. Mantenimiento de la altura de las vellosidades y la profundidad de las criptas, y mejora de la digestión de disacáridos y la absorción de monosacáridos, en lechones alimentados con leche entera de vaca después del destete. Hno. J Nutr. (1996) 76:409–22. doi: 10.1079/bjn19960046
44. Pluske, JR, Hampson, DJ y Williams, IH. Factores que influyen en la estructura y función del intestino delgado en el cerdo destetado: una revisión. Livest Prod Sci. (1997) 51:215–36. doi: 10.1016/S0301-6226(97)00057-2
45. Lupton, JR, y Jacobs, LR. La suplementación con fibra da lugar a zonas proliferativas expandidas en la mucosa gástrica de rata. Am J Clin Nutr. (1987) 46:980–4. doi: 10.1093/ajcn/46.6.980
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Hampson, DJ, y Kidder, DE. Influencia de la alimentación y el destete en las actividades enzimáticas del borde del cepillo en el intestino delgado del lechón. Res Vet Sci. (1986) 40:24–31.
47. Chen, JL, Zheng, P, Zhang, C, Yu, B, He, J, Yu, J, et al. El ácido benzoico afecta beneficiosamente el rendimiento del crecimiento de los cerdos destetados, lo que se asoció con cambios en las poblaciones bacterianas intestinales, los índices de morfología y la expresión génica del factor de crecimiento. J Anim Physiol Anim Nutr (Berl). (2017) 101:1137–46. doi: 10.1111/jpn.12627
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Liu, H, Jiang, F, Jia, X, Lan, J, Guo, H, Li, E, et al. La hipoxia cíclica afecta a la invasión y proliferación celular a través de la regulación directa de la expresión de claudina1/claudina7, y a la regulación indirecta de P18 a través de la claudina7. Oncotarget. (2017) 8:10298–311. doi: 10.18632/oncotarget.14397
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Moran, AW, Al-Rammahi, MA, Arora, DK, Batchelor, DJ, Coulter, EA, Ionescu, C, et al. Expresión de Na+/cotransportador de glucosa 1 (SGLT1) en el intestino de lechones destetados a diferentes concentraciones de carbohidratos en la dieta. Hno. J Nutr. (2010) 104:647–55. DOI: 10.1017/S0007114510000954
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Arif, A, Terenzi, F, Potdar, AA, Jia, J, Sacks, J, China, A, et al. EPRS es un efector crítico de mTORC1-S6K1 que influye en la adiposidad en ratones. Naturaleza. (2017) 542:357–61. doi: 10.1038/nature21380
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Salvaje, DC . Microflora gastrointestinal en la nutrición de mamíferos. Annu Rev Nutr. (1986) 6:155–78. doi: 10.1146/annurev.nu.06.070186.001103
52. Mikkelsen, LL, Bendixen, C, Jakobsen, M, y Jensen, BB. Enumeración de bifidobacterias en muestras gastrointestinales de lechones. Appl Environ Microbiol. (2003) 69:654–8. doi: 10.1128/AEM.69.1.654-658.2003
53. Corrier, DE, Hinton, A, Ziprin, RL y DeLoach, JR. Efecto de la lactosa dietética en la colonización por Salmonella de pollos de engorde en edad comercial. Aviar Dis. (1990) 34:668–76.
54. Burns, CP y Rozengurt, E. Na+ extracelular e inicio de la síntesis de ADN: papel del pH intracelular y K+. J Cell Biol. (1984) 98:1082–9. doi: 10.1083/jcb.98.3.1082
Palabras clave: inmunidad, epitelio intestinal, ácido benzoico recubierto, cerdos destetados, Escherichia coli enterotoxigénica
Cita: Qi J, Yu B, Hu Y, Luo Y, Zheng P, Mao X, Yu J, Zhao X, He T, Yan H, Wu A y He J (2024) Efecto del ácido benzoico recubierto en el rendimiento del crecimiento, la inmunidad y las funciones intestinales en cerdos destetados desafiados por Escherichia coli enterotoxigénica. Frente. Vet. Sci. 11:1430696. doi: 10.3389/fvets.2024.1430696
Recibido: 10 de mayo de 2024; Aceptado: 30 de agosto de 2024;
Publicado: 16 de septiembre de 2024.
Editado por:
Shourong Shi, Academia China de Ciencias Agrícolas, China
Revisado por:
Sarah C. Pearce, Departamento de Agricultura de los Estados Unidos, Estados
Unidos Tsungcheng Tsai, Universidad de Arkansas, Estados
Unidos Hongbin Pan, Universidad Agrícola de Yunnan, China
Derechos de autor © 2024 Qi, Yu, Hu, Luo, Zheng, Mao, Yu, Zhao, He, Yan, Wu y He. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondencia: Jiawen Qi, hejun8067@163.com; Jun He, hejun8067@163.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía