Los andamios de ingeniería de tejidos con células madre del ligamento periodontal
 Pengxiu Dai
Pengxiu Dai Guixiang Qi
Guixiang Qi Mingde Zhu
Mingde Zhu Qingjie Du
Qingjie Du Keyi Wang
Keyi Wang Yaxin Gao
Yaxin Gao Mengnan Li
Mengnan Li Xiancheng Feng
Xiancheng Feng XinkeZhang*
XinkeZhang*- Facultad de Medicina Veterinaria, Universidad de Agricultura y Silvicultura del Noroeste, Yangling, China
Fondo: La inmunogenicidad de las células madre mesenquimales alogénicas (MSC) mejora significativamente después del trasplante o la diferenciación, y estas células pueden ser reconocidas y eliminadas por las células inmunitarias receptoras. El rechazo del injerto se ha convertido en un obstáculo importante para mejorar el efecto terapéutico de las MSC alogénicas o, tras su diferenciación, el trasplante en el tratamiento de la diabetes y otras enfermedades. Resolver este problema es útil para prolongar el tiempo que las células desempeñan un papel en el cuerpo receptor y para mejorar significativamente el efecto terapéutico clínico.
Métodos: En este estudio, se utilizaron células madre mesenquimales (ADSC) derivadas del tejido adiposo canino como células semilla, y se utilizó tecnología de edición génica para eliminar el gen B2M en estas células y cooperar con la sobreexpresión del gen PD-L1. Se han obtenido ADSCs editadas genéticamente (GeADSCs), cuyas características biológicas y seguridad no difieren de las de las ADSCs caninas normales.
Resultados: La inmunogenicidad de las GeADSC se reduce, la capacidad de escape inmunológico de las GeADSC mejora y las GeADSC pueden permanecer en el cuerpo durante más tiempo. Utilizando el programa de inducción optimizado, se aumentó la eficiencia de la diferenciación de las GeADSC en nuevas células de β de islotes y se aumentó la madurez de las nuevas células de β de islotes. La inmunogenicidad de las nuevas células β de los islotes disminuyó y su capacidad de escape inmunológico mejoró después de que las células se trasplantaron a perros diabéticos (el sitio del injerto se prevascularizó mediante la implantación de un andamio para formar una bolsa vascularizada). El número de células inmunitarias infiltrantes y el contenido de factores inmunitarios disminuyeron en el sitio del injerto.
Conclusiones: El trasplante de células β de los nuevos islotes, que tiene una inmunogenicidad baja, puede revertir la diabetes en los perros y el efecto terapéutico del trasplante de células mejora significativamente. Este estudio proporciona un nuevo método para prolongar la supervivencia y el tiempo funcional de las células en receptores de trasplantes y mejorar significativamente el efecto terapéutico clínico.
Introducción
La enfermedad periodontal es la enfermedad bucal más común en los perros. Los perros adultos de todas las edades pueden sufrir enfermedad periodontal en diversos grados. Según las estadísticas, el 80% de los perros mayores de 2 años padecen enfermedad periodontal (1, 2). A medida que la enfermedad avanza, la enfermedad periodontal puede causar síntomas como dolor, dificultad para comer, mal aliento y salivación, y en casos graves, otras enfermedades sistémicas como el tracto gastrointestinal, cardiovascular y renal pueden ser secundarias, aumentando la carga inflamatoria general del cuerpo (3). Al mismo tiempo, el ligamento periodontal, el hueso alveolar y otros tejidos de soporte serán dañados por la enfermedad periodontal y se perderán gradualmente.
En la actualidad, los métodos básicos de tratamiento aplicados en la clínica pueden destruir la placa dental, alisar la superficie radicular y reducir la inflamación local, pero es difícil regenerar y reconstruir completamente los complejos tejidos periodontales tridimensionales (4, 5). Durante el proceso de curación después del tratamiento básico, el epitelio conjuntivo se adhiere a la superficie de la raíz y migra a lo largo de la raíz hasta el ápice. El epitelio conjuntivo largo resultante bloquea el contacto entre las fibras de la membrana periodontal y la superficie de la raíz. En este momento, el surco gingival se profundiza, los microorganismos patógenos se vuelven a unir y acumulan, y la enfermedad reaparece fácilmente (5, 6). El método ideal de reparación periodontal debe restaurar la estructura y la función periodontal dañadas; reconstruir la estructura tridimensional del hueso alveolar, el cemento y la membrana periodontal; mantener la posición espacial del tejido periodontal durante la reparación y la regeneración; promover nuevas inserciones periodontales; y, en última instancia, restaurar la estructura y función del tejido periodontal normal (7). La regeneración tisular guiada (RTG) se propuso con base en la teoría de la regeneración periodontal para ayudar a completar la regeneración y reconstrucción funcional del tejido periodontal y para prevenir la unión del epitelio de la unión neonatal a la superficie radicular del diente. GTR repara y regenera la estructura del tejido periodontal guiando células específicas al lugar correcto. En este enfoque, se coloca una membrana de barrera física sobre el defecto periodontal entre el colgajo de tejido blando y la superficie de la raíz, manteniendo el epitelio gingival alejado de la superficie de la raíz y creando un espacio protegido por encima del defecto que permite que las células de la membrana periodontal vuelvan a llenar la herida (8).
En los últimos años, el rápido desarrollo de la ingeniería tisular periodontal ha llevado al desarrollo de nuevos métodos para el tratamiento de las enfermedades periodontales. Las células madre del ligamento periodontal (PDLSC) son células semilla clave en la ingeniería de tejidos periodontal. Las PDLSC pueden proliferar, diferenciarse y secretar una variedad de citocinas durante la reparación del tejido periodontal, proporcionando un fuerte apoyo para la regeneración de tejidos (9). Un andamio de ingeniería construido a partir de biomateriales proporciona un espacio tridimensional para el crecimiento y la función de las células semilla y puede formar un complejo de ingeniería de tejidos con las células semilla para reparar el tejido periodontal. Además, la regeneración periodontal guiada puede evitar que el epitelio conjuntivo se adhiera a la superficie de la raíz, mantener la posición espacial del tejido periodontal durante la regeneración y, en consecuencia, permitir una verdadera regeneración tridimensional de la estructura periodontal y la restauración funcional (10).
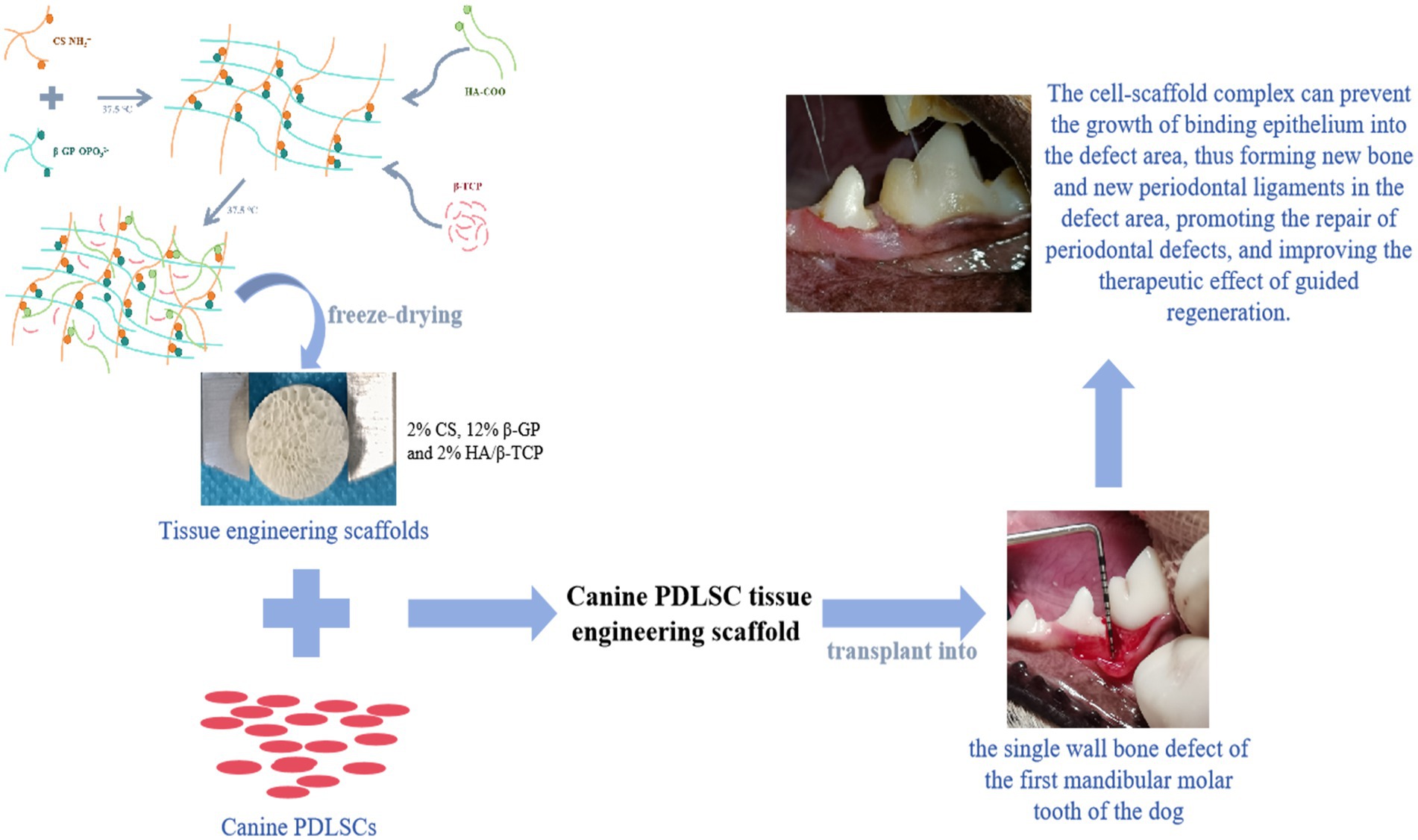
En este estudio, se aislaron y cultivaron PDLSCs caninas in vitro, y se evaluó su diferenciación, capacidad de proliferación y características biológicas para establecer una forma efectiva de aislar y cultivar PDLSCs caninos para obtener suficientes células semilla para la ingeniería de tejidos periodontal. Además, el quitosano (CS), el fosfato de β-glicerol (β-GP) y el material de reemplazo óseo de fosfato de calcio bifásico (HA/β-TCP) se utilizaron como materias primas para preparar andamios con diferentes proporciones mediante el método de liofilización. Se compararon las propiedades físicas de los diferentes andamios, como la morfología, el tamaño de los poros, la porosidad, la resistencia a la compresión, la tasa de hinchamiento y la tasa de degradación. Las PDLSC caninas se cocultivaron con andamios para explorar su biocompatibilidad in vivo e in vitro. Sobre esta base, se preparó un modelo de defecto óseo de pared simple en el primer molar mandibular de un perro, y se implantó un andamio canino de ingeniería de tejidos PDLSC en el defecto periodontal para evaluar su efecto en la guía de la regeneración periodontal, proporcionando una referencia y base para la reparación y regeneración del tejido periodontal en la enfermedad periodontal.
Método
Segregación celular
Se colectaron dientes deciduos retenidos caninos y se aisló tejido periodontal por métodos quirúrgicos. Toda la operación se realizó con estricto apego a los principios y procedimientos asépticos para la extracción dental. Los tejidos de la membrana periodontal recolectados se cortaron y se colocaron en un tubo de centrífuga en un banco de trabajo superlimpio, y se agregaron una solución de colagenasa tipo I (3 mg/mL) (Merck KGaA, SCR103, Darmstadt, Alemania) y una solución de proteasa neutra (4 mg/mL) (Merck KGaA, COLLDISP-RO, Darmstadt, Alemania) en una proporción de 1:1 (relación de volumen). La muestra se digirió a 180 rpm a 37°C durante 1,5 h en un agitador. A continuación, se añadió al tubo de centrífuga una solución completa de cultivo celular (medio de cultivo α-MEM (Thermo Fisher Scientific, 12.571.063, Massachusetts, Estados Unidos) que contenía un 10% de suero fetal bovino (Thermo Fisher Scientific, A5256701, Massachusetts, Estados Unidos), una solución de 100× penicilina-estreptomicina al 100% y un 0,25% de reactivo eliminador de micoplasmas anti-Myc) para finalizar la digestión, y la mezcla se centrifugó a 1000 rpm durante 5 min. Se desechó el sobrenadante, se añadió un medio de cultivo celular completo fresco para resuspender el pellet celular, y la suspensión se mezcló por aspiración varias veces y se inoculó en la placa de cultivo. La densidad y el estado celular se observaron bajo un microscopio, y las células se cultivaron en una incubadora a 37 °C y 5% de CO2 y se observaron cada dos días. Cuando se alcanzó el 90% de confluencia, las células fueron conducidas en una proporción de 1:3 por la digestión con tripsina.
Identificación de células
Las células del tercer pasaje se inocularon en placas de 24 pocillos. El medio se cambió cada dos días y los recuentos celulares se realizaron cada 24 h. Las células de 3 pocillos se extrajeron a la vez, y las células de cada pocillo se contaron 6 veces. De acuerdo con los resultados del conteo, se trazó una curva de crecimiento celular con el número promedio de células como ordenada y el tiempo de cultivo como abscisa.
Las células del tercer pasaje se cultivaron en condiciones estándar. Cuando se observó una confluencia del 90% bajo el microscopio, las células se tiñeron con hematoxilina-eosina, Giemsa y fosfatasa alcalina. Las células se tiñeron por inmunofluorescencia con vimentina, anticuerpo primario de queratina (Abcam, ab20346, ab8068, Cambridge, Reino Unido) y el anticuerpo secundario correspondiente (Abcam, Inglaterra).
Utilizando anticuerpos CD31, CD44, CD45, CD73, CD90, CD105, CD166, CD11a y STRO-1 (Abcam, ab28364, ab189524, ab40763, ab317462, ab92574, ab206419, ab235957, ab25383 y ab214086, Cambridge, Reino Unido) y anticuerpos control con marcadores fluorescentes FITC y PE, se midió la expresión de marcadores moleculares en la superficie celular mediante citometría de flujo (Agilent, NovoCyte Penteon, California, Estados Unidos).
El kit de diferenciación por inducción de tres líneas (OriCell® Mesenchymal Stem Cell Osteogenic Induction Differentiation Kit, HUXMX-90021, OriCell® Mesenquimal Stem Cell Chondrogenic Induction Differentiation Kit, HUXMD-90041, OriCell® Mesenquimal Stem Cell Adipogenic Induction Differentiation, HUXMX-90031, Cyagen Biosciences (Guangzhou) Co., Ltd., China) se utilizó de acuerdo con las instrucciones del fabricante para realizar la diferenciación por inducción de tres líneas de las células.
Preparación de andamios
El quitosano (CS) (Merck KGaA, 419.419, Darmstadt, Alemania) se disolvió en ácido acético 0,1 M para preparar la solución de CS. El fosfato de sodio β-glicerol (β-GP) (Merck KGaA, 50.020, Darmstadt, Alemania) se disolvió en agua ultrapura para preparar β-GP solución.
La solución β-GP se añadió gota a gota a la solución CS para preparar soluciones con proporciones de masa CS:β-GP de 1:2, 1:3, 1:4, 1:5, 1:6 y 1:7. El p/v de quitosano (CS) fue del 2% y el p/v del β-GP fue del 4, 6, 8, 10, 12 y 14%, respectivamente. Después de agitar bien a temperatura ambiente durante 15 min, se tomaron 2 mL de cada muestra y se colocaron en un tubo de centrífuga y se incubaron en un baño de agua a 37,5 °C. La muestra se retiró cada 1 min y se invirtió para observar la fluidez del gel. El tiempo de no flujo invertido de 30 s se registró como tiempo de formación del gel.
Después de preparar el gel CS/β-GP, se dispersaron diferentes cantidades de HA/β-TCP (0, 2, 4%) (Merck KGaA, 677.418, 693.898, Darmstadt, Alemania) en el sistema de gel. Después de agitar magnéticamente a temperatura constante durante 2 h, se extrajeron 1,5 mL de cada muestra y se colocaron en un baño de agua a 37,5 °C para formar un gel. El tiempo de formación del gel se midió mediante el método de rotación de la botella. Las muestras en estado de gel estable se precongelaron a -80 °C durante 24 h y se liofilizaron al vacío durante 12 h.
Detección física de los andamios
El soporte preparado se cortó en cilindros de igual tamaño (diámetro de 7 mm y altura de 15 mm) con superficies superior e inferior planas. La resistencia a la compresión del soporte se probó con una máquina de ensayos universal electrónica Zwick 250 (ZwickRoell, Universal Materials Testing Machine, ZWICK Z250, Alemania). La fórmula de cálculo es σ=4Fπd2 , donde σ es la resistencia a la compresión (MPa) del soporte de ensayo, F es la fuerza de compresión máxima (N) soportada por el soporte de ensayo y d es el diámetro del soporte de ensayo (mm). Se analizaron en paralelo cuatro muestras de andamios de cada grupo.
Los andamios preparados se cortaron en láminas redondas (7 mm de diámetro). Se utilizó microscopía electrónica de barrido (Carl Zeiss AG, Sigma300, Oberkochen, Alemania) para observar la morfología de la superficie y la estructura interna del material del andamio, y el tamaño de la abertura y la porosidad se calcularon con ImageJ. El peso inicial del soporte se determinó con precisión y se registró como W0. Posteriormente, el andamio de ingeniería de tejidos se sumergió en un tubo de ensayo lleno de solución salina normal, que se selló y se colocó en un baño de agua a 37,5 °C. El andamio se retiró a las 24 h, el peso se registró como WS. Se analizaron cuatro muestras de cada grupo en paralelo y se calculó la tasa de hinchazón del andamio de ingeniería de tejidos. La fórmula es Relación de hinchazón=WS−W0W0 . El peso inicial del soporte se determinó con precisión y se registró como W1. Posteriormente, el andamio de ingeniería de tejidos se sumergió en un tubo de ensayo que contenía solución salina normal, que se selló y se colocó en un baño de agua a 37,5 °C. Las muestras se retiraron a los 4, 7, 14 y 21 días y se secaron durante 10 h, y el peso se registró como W2. Se probaron cuatro muestras paralelas para cada grupo, después de lo cual se calculó la tasa de degradación de los andamios en diferentes puntos temporales. La fórmula de cálculo es
degradacióntasa=W1-W2W1×100%
Biocompatibilidad in vitro de los andamios
Los andamios preparados se cortaron en cuboides (4 × 4 × 2 mm), se colocaron en un espacio cerrado y se irradiaron con una lámpara de desinfección ultravioleta con alto contenido de ozono (185 nm/UVD) para su desinfección y esterilización durante 24 h. Después de remojar en PBS de alta resistencia durante 3 h, los andamios se colocaron en medio de cultivo celular durante 24 h.
Se inoculó una suspensión de 1,25 × 106 células/mL en un andamio en una placa de 96 pocillos. El volumen de cada pocillo fue de 100 μL, las células se cultivaron en una incubadora de células y el medio se cambió cada dos días. Los andamios se retiraron los días 1, 3 y 5 y se transfirieron a una nueva placa de 96 pocillos. El número de células adheridas al andamio y el número de células adheridas al fondo de la placa se determinaron mediante un kit CCK-8 (MedChemExpress, HY-K0301, Nueva Jersey, Estados Unidos), y se evaluaron la adhesión y proliferación de las células en el andamio.
Se utilizó el colorante fluorescente de membrana celular CM-Dil (MedChemExpress, HY-D1028, Nueva Jersey, Estados Unidos) para marcar PDLSC caninos, y se preparó una suspensión de PDLSC canina marcada con CM-Dil. Una muestra de 200 μL de suspensión celular fue tomada por una microjeringa e inyectada en el andamio. Doce horas después, se añadieron 800 μL de medio celular para observar la adhesión y crecimiento de las células marcadas en el andamio en el 1º, 3º y 5º día.
Se añadió medio de cultivo celular fresco al andamio a 0,05 g/10 mL, y la mezcla se incubó en la incubadora de células durante 24 h. Luego, el extracto se recolectó y almacenó para su uso posterior. Se inocularon un total de 1,5 × 105 células/mL en una placa de 6 pocillos. Después del crecimiento celular hasta el 100% de confluencia, se trazó una línea paralela en la placa de Petri con una pipeta de 10 μL, los restos celulares se enjuagaron suavemente con PBS y se agregó extracto de andamio. La migración celular se observó a las 24 h y a las 48 h, y el área de migración se midió y analizó mediante ImageJ.
Evaluación de la biocompatibilidad de andamios in vivo
Todos los perros (Beagle, 2-3 años, 8-12 kg, macho o hembra) fueron criados, obtenidos y alojados de acuerdo con los requisitos de animales de laboratorio de nuestro instituto, los perros fueron mantenidos en jaulas en una sala de alimentación sin equipo de purificación a una temperatura de 18-25 °C, humedad de 40-60%, valor de flujo de aire de 0,13-0,18 m/s, velocidad de ventilación de 10 a 20 veces por hora, luz normal, ruido inferior a 60 dB.
Los perros experimentales fueron inyectados por vía intravenosa con propofol (3 ~ 6 mg/kg) (Xi ‘an Libon Pharmaceutical Co., Ltd., China) para inducir la anestesia antes de la cirugía, se realizó una intubación endotraqueal para proteger las vías respiratorias y se conectó una máquina de anestesia respiratoria. Se ajustaron los flujos de isoflurano (Shenzhen Reward Life Technology Co., Ltd., China) y oxígeno, y cuando la anestesia se mantuvo estable, los fluidos corporales se complementaron con una infusión intravenosa de glucosa al 5%. El perro estaba boca abajo, desde los omóplatos hasta las costillas finales, a menos de 8 cm a ambos lados de la columna vertebral, para la preparación rutinaria de la piel. A cuatro centímetros de la columna vertebral, se realizó una incisión en la piel de 2 cm de largo paralela a la columna para separar sin rodeos el tejido subcutáneo. En las incisiones de ambos lados de la columna vertebral se implantaron andamios caninos de ingeniería de tejidos PDLSC (grupo experimental, n = 5) y andamios libres de células (grupo control, n = 5), y se eligió el lado al azar. Se suturó la piel y se cubrió la incisión con gasa estéril. Se inyectaron amoxicilina y clavulanato potásico diariamente durante 3 días consecutivos para prevenir la infección postoperatoria, y los puntos se retiraron al 7º día después de la cirugía.
Se recolectó sangre de los perros de prueba 1 día antes de la implantación subcutánea y 21 días después de la implantación para la detección bioquímica. Se registraron las complicaciones y eventos adversos durante la cicatrización postoperatoria en todos los perros. Se evaluó la cicatrización de la herida a los 7, 14 y 21 días tras el implante subcutáneo según la Escala de Cicatriz de Vancouver (11). El tejido subcutáneo que contenía el complejo (muestra al menos 0,5 cm más grande que el límite del andamio) se extrajo a los 21 días después de la cirugía, y se prepararon secciones de parafina y se tiñeron con hematoxilina-eosina (HE). Se evaluó la biocompatibilidad del andamio canino de ingeniería tisular PDLSC.
Evaluación de la eficacia de la reparación y regeneración de defectos periodontales
Todos los perros (Beagle, 2-3 años, 8-12 kg, macho o hembra) fueron criados, obtenidos y alojados de acuerdo con los requisitos de animales de laboratorio de nuestro instituto, los perros fueron mantenidos en jaulas en una sala de alimentación sin equipo de purificación a una temperatura de 18-25 °C, humedad de 40-60%, valor de flujo de aire de 0,13-0,18 m/s, velocidad de ventilación de 10 a 20 veces por hora, luz normal, ruido inferior a 60 dB.
Los perros experimentales fueron inyectados por vía intravenosa con propofol (3 ~ 6 mg/kg) (Xi ‘an Libon Pharmaceutical Co., Ltd., China) para inducir la anestesia antes de la cirugía, se realizó una intubación endotraqueal para proteger las vías respiratorias y se conectó una máquina de anestesia respiratoria. Se ajustaron los flujos de isoflurano (Shenzhen Reward Life Technology Co., Ltd., China) y oxígeno, y cuando la anestesia se mantuvo estable, los fluidos corporales se complementaron con una infusión intravenosa de glucosa al 5%. La anestesia por conducción del nervio alveolar inferior fue inducida por una inyección de lidocaína (4 mg/kg). Posteriormente, la intervención se llevó a cabo en estricto cumplimiento del protocolo quirúrgico establecido y de las normas de asepsia. Durante la operación, se monitoreó el sistema nervioso central, el sistema cardiovascular y el sistema respiratorio, y se registraron los cambios de temperatura para monitorear el estado del animal. Antes del inicio del tratamiento, se enjuagó la cavidad bucal con una solución de gluconato de clorhexidina al 0,12% y se tomaron radiografías orales para registrar el estado del diente.
Se realizó una incisión horizontal paralela al margen gingival a lo largo del lado lingual del primer molar y el margen gingival bucal, y una incisión vertical a lo largo del cuarto premolar para cortar la encía, levantar el colgajo de tejido periodontal y exponer completamente el hueso alveolar y el espacio periodontal. Se utilizó un taladro de alta velocidad para extraer el hueso alveolar entre el cuarto premolar y el primer molar. El ligamento periodontal, el hueso alveolar y el cemento se destruyeron completamente para formar una bolsa ósea de pared simple (6 mm × 2 mm, profundidad × ancho proximal y distal) para establecer un modelo de defecto óseo de pared simple en el primer diente mandibular. De acuerdo con el protocolo para el grupo aleatorio, los materiales de cada grupo [grupo de andamio de ingeniería de tejidos PDLSC canino (n = 8) y grupo de andamio (n = 8)] se trasplantaron al sitio del defecto periodontal cerca de los tejidos circundantes para una regeneración guiada. En el grupo control (n = 8), el colgajo de tejido gingival se suturó sin ningún tratamiento de trasplante. Durante 3 días consecutivos después de la operación, se inyectaron amoxicilina y clavulanato de potasio por vía subcutánea, y se utilizó una solución de gluconato de clorhexidina al 0,12% para enjuagar la boca y prevenir la infección intraoperatoria. Los procedimientos orales fueron limitados para evitar ejercer presión o tensión sobre las suturas. La cicatrización de la herida se observó a las 2, 4 y 8 semanas después de la operación. A la 4ª semana después de la cirugía, se recogió el tejido injertado, se añadió un tampón de extracción preenfriado a 4 °C y se homogeneizó la muestra de tejido, se sometió a un ciclo de congelación-descongelación, se ultrasonizó durante 10 min, se incubó a 4 °C durante 1 h y se centrifugó a 120.000 × g durante 10 min. Los factores relevantes en el sobrenadante se detectaron a través de un kit ELISA. A la 8ª semana después de la operación, se recolectó el tejido del sitio de trasplante del perro, se fijaron y deshidrataron muestras de tejido fresco no descalcificado, se impregnaron con resina de curado ligero y luego se aserraron, y se obtuvieron secciones de tejido duro de 8 ~ 10 μm de espesor moliendo las rodajas (sistema de corte y molienda de tejido duro EXAKT). La tinción con hematoxilina y eosina (HE) se utilizó para observar la reparación y regeneración del tejido periodontal, la tinción de Masson para observar la unión de la fibra de la membrana periodontal y la tinción con azul de toluidina para observar la formación de hueso nuevo. Se evaluaron el JE (epitelio juncional), NBH (nueva altura ósea), NBA (nueva área ósea) y PDL (regeneración del ligamento periodontal).
Análisis estadístico
Para las comparaciones estadísticas entre los grupos se utilizó el análisis de varianza de una vía (ANOVA) y el análisis de varianza de dos factores (ANOVA de dos vías). Las pruebas se realizaron utilizando el software IBM SPSS Statistics 25 (SPSS Inc., Chicago, IL, Estados Unidos).
Resultados
Resultados del aislamiento y cultivo celular
Después de 3 a 5 días de cultivo, las células comenzaron a adherirse a la pared y hubo una migración hacia afuera y crecimiento alrededor de los bloques de tejido. Con el aumento del tiempo de cultivo, el número de células adherentes aumentó continuamente y las células adherentes cubrieron todo el fondo de la placa (Figura 1A). Las células primarias cultivadas se pasaron dos veces, las células de la generación P3 se seleccionaron para construir la curva de crecimiento celular y las células entraron en la fase de crecimiento exponencial al tercer día (Figura 1B). Después de la tinción con hematoxilina-eosina, las células tenían forma de huso y se adherían a la pared. Después de la tinción de Giemsa, se observaron las colonias. Los límites entre las células centrales de las colonias no estaban claros, y las células circundantes estaban estrechamente dispuestas radialmente. Después de la tinción con fosfatasa alcalina, se observaron partículas marrones y grises entre las células compactas, y se encontraron más partículas en las colonias clonales, lo que indica una expresión positiva de fosfatasa alcalina (Figura 1C).
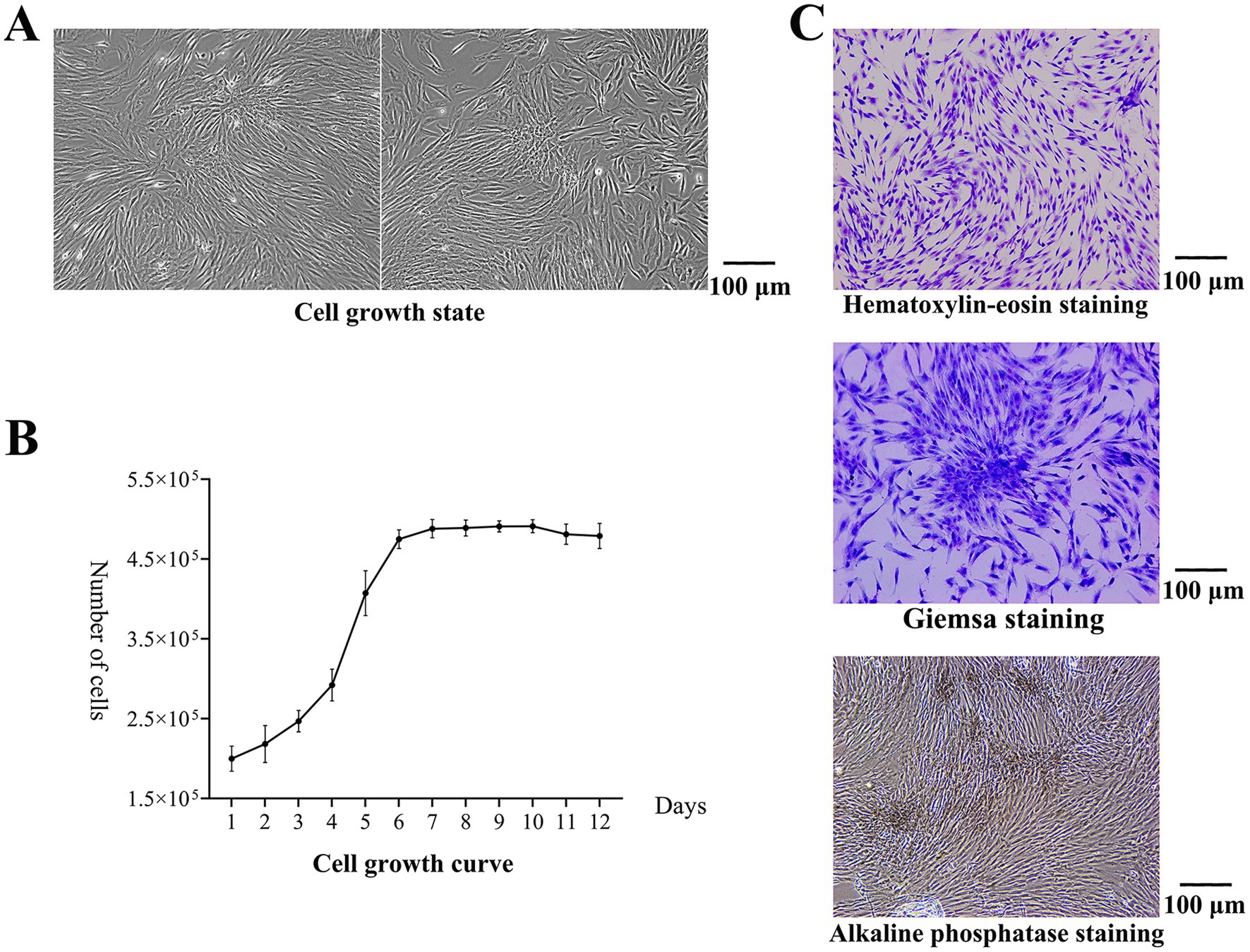
Figura 1. Resultados del aislamiento y cultivo celular. (A) Estado de crecimiento celular. Las células adherentes cubrían todo el fondo del plato. (B) La curva de crecimiento celular. Las células entraron en la fase de crecimiento exponencial al tercer día. (C) Después de la tinción con hematoxilina-eosina, las células tenían forma de huso y se adherían a la pared. Después de la tinción de Giemsa, se observaron las colonias. Los límites entre las células centrales de las colonias no estaban claros, y las células circundantes estaban estrechamente dispuestas radialmente. Después de la tinción con fosfatasa alcalina, se observaron partículas marrones y grises entre las células muy compactas, y se encontraron más partículas en las colonias clonales.
Identificación de células
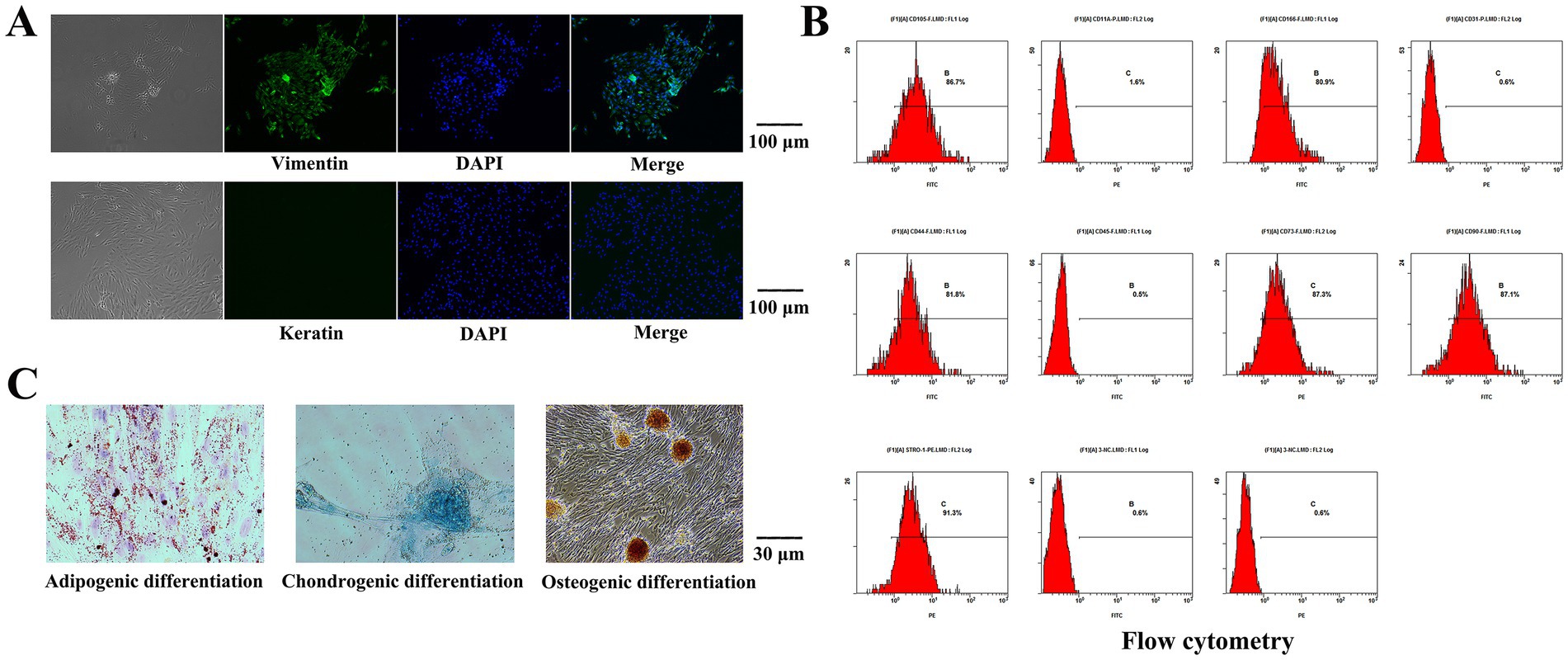
Las células aisladas se sometieron a tinción con inmunofluorescencia de vimentina. Bajo un microscopio invertido, la vimentina se marcó con fluorescencia verde y el núcleo era azul, mientras que no se observó fluorescencia roja que indicara queratina (Figura 2A). Las células aisladas fueron positivas para la expresión de vimentina y negativas para la expresión de queratina, lo que demostró que las células eran de origen mesodérmico sin contaminación de células epiteliales.
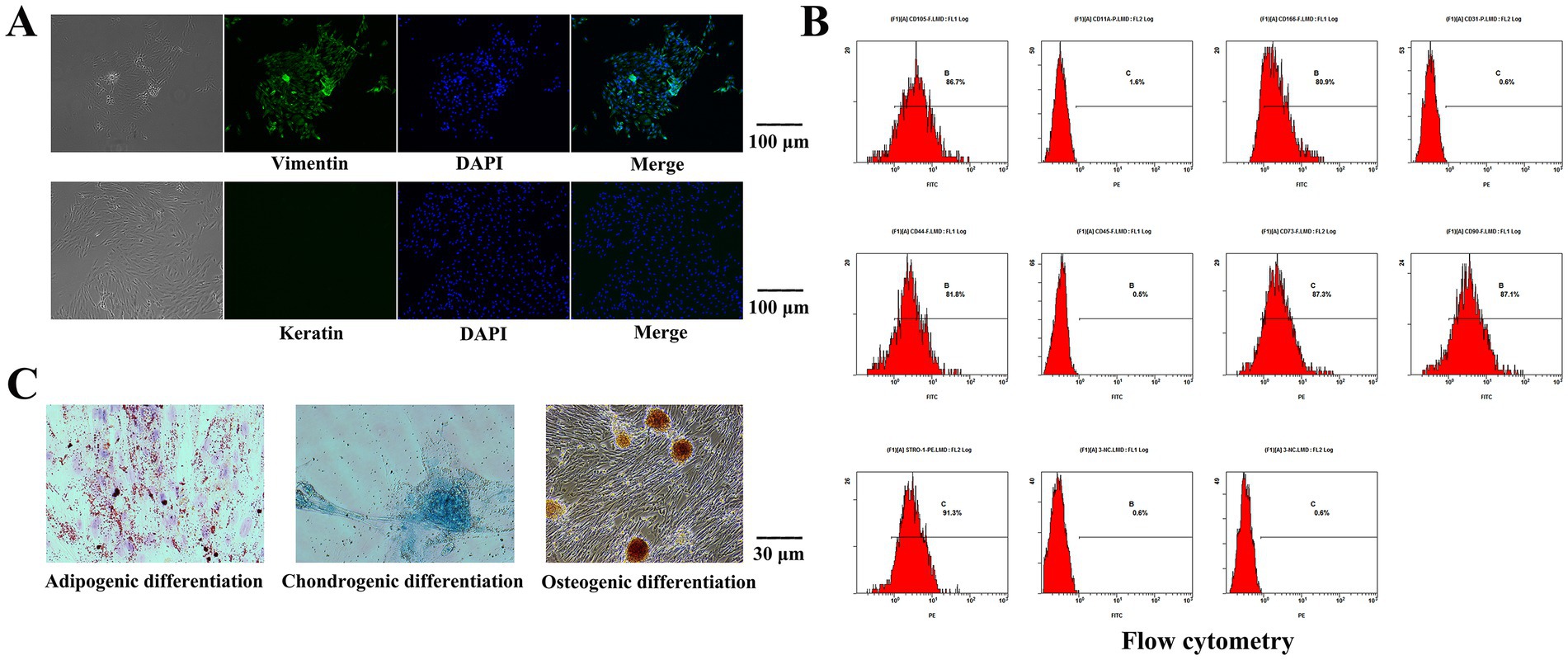
Los niveles de expresión de STRO-1, CD73, CD90, CD105, CD44 y CD166 fueron 91,3, 87,3, 87,1, 86,7, 81,8 y 80,9%, respectivamente, según citometría de flujo. Los números CD11a, CD31 y CD45 no se expresaron (Figura 2B). La diferenciación inducida por lípidos se realizó en las células aisladas. Se observaron partículas de gotas de lípidos de color rojo brillante o en forma de adoquín al teñirse con aceite rojo O, y algunas de las partículas de gotas de lípidos se fusionaron entre sí. Las células aisladas se diferenciaron por inducción osteogénica y la tinción con rojo de alizarina reveló una gran área de nódulos mineralizados con mandarina. Las células aisladas se sometieron a inducción de diferenciación de condroblastos y las células se tiñeron con azul alcián (Figura 2C).
Características morfológicas de los andamios
Durante las pruebas de la matriz de gel CS, la mezcla de 2% CS/4% β-GP no formó una matriz de gel a 37,5 °C, y 2% de CS/6% de β-GP formó una matriz de gel aproximadamente a los 50 min; Sin embargo, el estado del gel era inestable y el flujo se produjo después de la inversión durante 1 min. Las soluciones que contenían 2% de CS/8, 10, 12 y 14% de β-GP formaron una matriz de gel en 3 a 10 min a 37,5 °C, y el estado del gel fue estable sin fluidez después de la inversión. Las partículas de HA/β-TCP se dispersaron uniformemente en la matriz de gel de CS y se añadieron diferentes cantidades de HA/β-TCP al 2% de CS/8, 10, 12 y 14% de β-GP. Se prepararon doce grupos de andamios después de la liofilización al vacío, todos ellos cilíndricos con una micromorfología externa regular (Figuras 3A,B). La estructura de la sección transversal de los andamios se observó posteriormente mediante microscopía electrónica de barrido por emisión de campo. Los 12 grupos de andamios tenían una estructura espacial tridimensional con poros interconectados. Con el aumento del contenido de β-GP, los poros cambiaron de una estructura laminar suelta a una estructura estable en forma de panal, y la rugosidad de la superficie aumentó después de la adición de HA/β-TCP (Figura 3C).
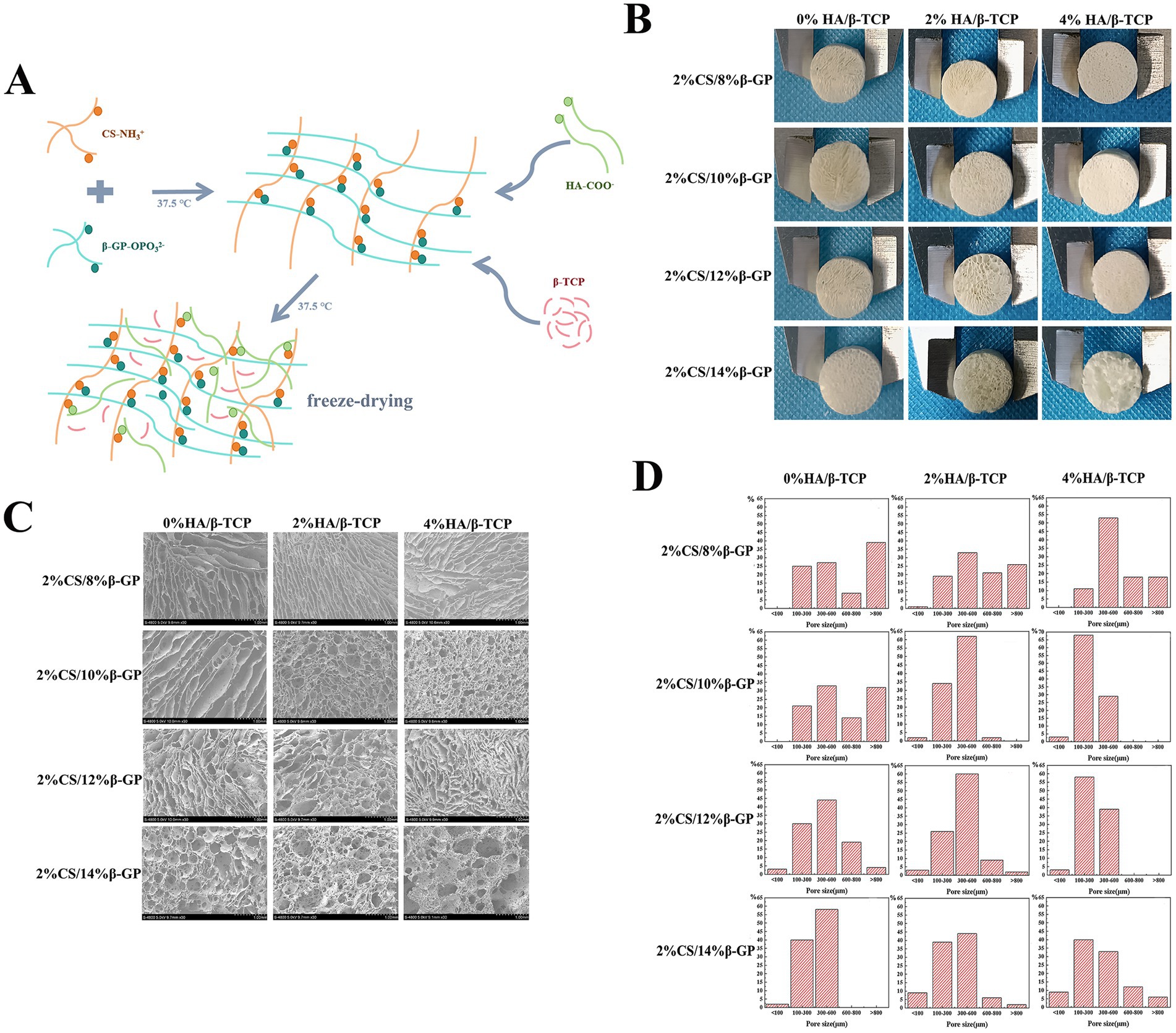
Figura 3. Características morfológicas de los andamios. (A) Utilizando quitosano (CS), fosfato de β-glicerol (β-GP) y sustituto óseo de fosfato de calcio bifásico (HA/β-TCP) como materias primas, se preparó un andamio de ingeniería de tejidos mediante el método de liofilización. (B) Se prepararon doce grupos de andamios después de la liofilización al vacío, todos ellos cilíndricos con micromorfología externa regular. (C) Los 12 grupos de andamios tenían una estructura espacial tridimensional con poros interconectados. Con el aumento del contenido de β-GP, los poros cambiaron de una estructura laminar suelta a una estructura de panal estable, y la rugosidad de la superficie aumentó después de la adición de HA/β-TCP. (D) Se calculó la porosidad de los andamios utilizando ImageJ y se construyó un mapa de distribución de poros.
Se calculó la porosidad de los andamios utilizando la Imagen J y se construyó un mapa de distribución de poros (Figura 3D). Cuando no se añadió HA/β-TCP, el número de poros mayores de 800 μm disminuyó con el aumento del contenido de β-GP. Con el andamio con 14% β-GP tuvo la mayor proporción de poros de 300 a 600 μm, seguido por el andamio con 12% β-GP, y hubo poros menores de 100 μm en estos dos grupos; Además, la aparición de estos pequeños poros aumentó la conectividad interna dentro del andamio. Cuando se agregó un 2% de HA/β-TCP al andamio β-GP al 12%, el 60% de los poros del andamio tenían poros de 300 a 600 μm de diámetro y el 2% tenían menos de 100 μm de diámetro. Cuando se añadió un 4% de HA/β-TCP al andamio de β-GP al 8%, los tamaños de poro de 300 ~ 600 μm fueron los más comunes. Cuando se añadió un 4% de HA/β-TCP a los andamios de 10% de β-GP, 12% de β-GP y 14% de β-GP, 68, 58 y 33% de los poros tenían entre 100 y 300 μm de diámetro, respectivamente.
Propiedades compresivas y porosidad de los andamios
Un material de andamio ideal no solo necesita una alta porosidad para promover la adhesión y el crecimiento de las células, sino también suficiente resistencia a la compresión para proporcionar soporte mecánico. Sin embargo, existe un equilibrio entre la porosidad y la resistencia a la compresión, y las dos deben equilibrarse para lograr los mejores resultados. En este estudio, cuando no se añadió HA/β-TCP, los poros del andamio β-GP al 12% cambiaron de laminar a panal con el cambio en la interacción entre la molécula CS y β-GP. La estructura de panal redujo significativamente la porosidad del andamio, pero aumentó significativamente la resistencia a la compresión (p < 0.05). Cuando se adicionó 2% de HA/β-TCP, no hubo diferencia significativa en la porosidad de los andamios entre los diferentes grupos de contenido de β-GP (p > 0,05). La resistencia a la compresión de los andamios en el grupo de β-GP del 12% fue significativamente mayor que la de los otros grupos (p < 0,05). Cuando se añadió un 4% de HA/β-TCP, la resistencia a la compresión del andamio aumentó significativamente con el aumento del contenido de β-GP, pero la porosidad disminuyó con el aumento del contenido de β-GP (p < 0,05). Sin embargo, cuando el β-GP se incrementó al 14%, la porosidad aumentó y la resistencia a la compresión disminuyó. De acuerdo con los resultados anteriores, cuando el contenido de β-GP fue de 12%, la resistencia a la compresión del andamio se incrementó significativamente (p < 0.05) y se mantuvo una porosidad satisfactoria (Figura 4A).
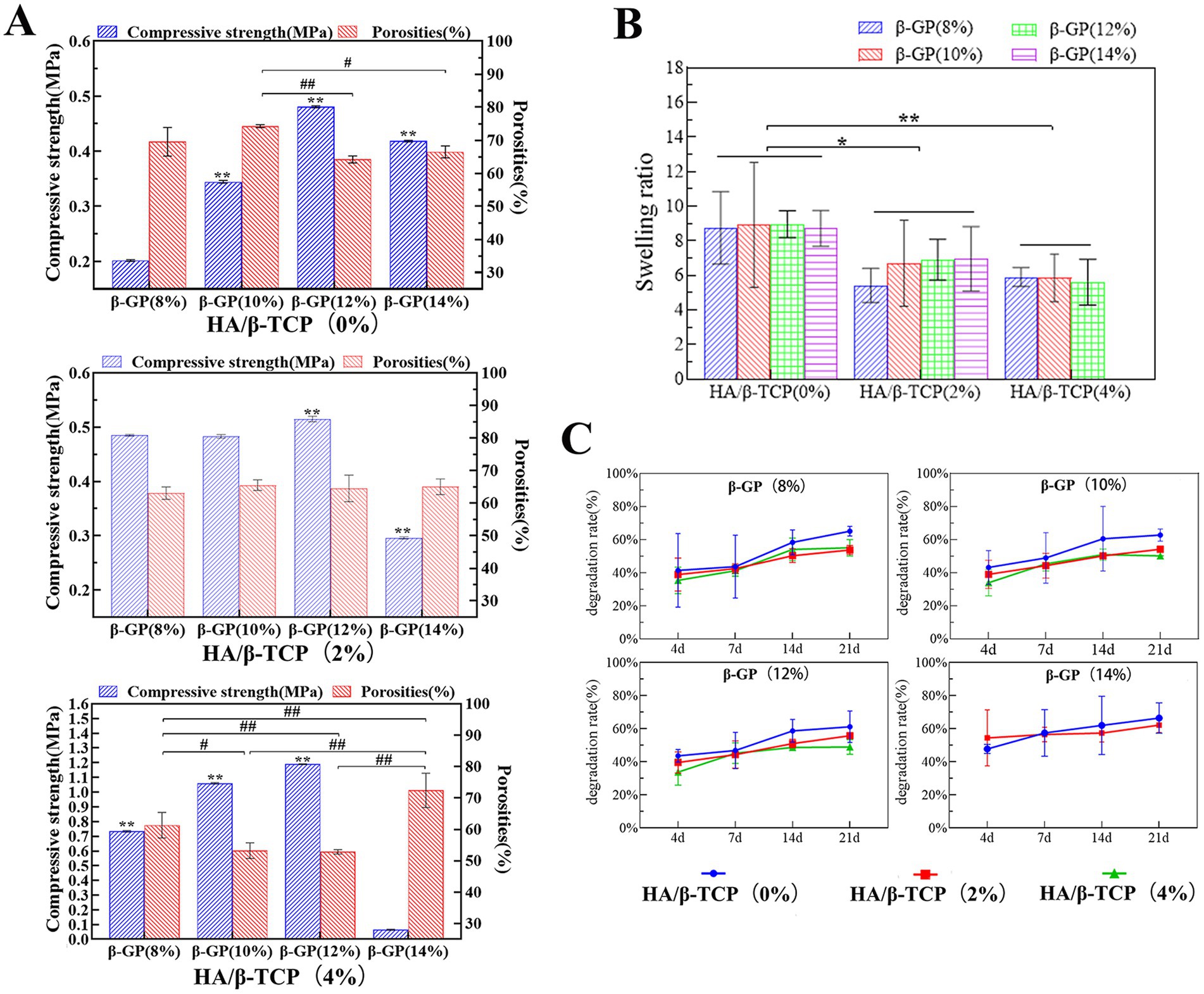
Figura 4. Resultados de las pruebas de rendimiento físico de los andamios. (A) Propiedades de compresión y porosidad de los andamios. El andamio preparado con un 12% de β-GP y un 2% de HA/β-TCP fue el más acorde con las necesidades prácticas. (B) Resultados de la prueba de rendimiento de hinchamiento. Cuando el contenido de HA/β-TCP fue constante, el contenido de β-GP no tuvo un efecto significativo sobre la tasa de hinchamiento del andamio (p > 0,05). Cuando el contenido de β-GP fue constante, la tasa de hinchamiento del andamio disminuyó significativamente con el aumento del contenido de HA/β-TCP (p < 0,05). (C) Comportamiento de degradación de los andamios. Los cambios en el contenido de β-GP no tuvieron un efecto significativo en el rendimiento de degradación de los andamios. Cuando el contenido de β-GP fue constante, la tasa de degradación en los grupos de 2% HA/β-TCP y 4% de HA/β-TCP fue menor que en el grupo sin HA/β-TCP y se estabilizó gradualmente después del 14º día.
En primer lugar, el andamio debe ser capaz de soportar la adhesión y proliferación de las PDLSC caninas y proporcionar nutrientes externos a las células a través de los poros adecuados. Por lo tanto, después de medir la relación entre la porosidad y la resistencia a la compresión, combinada con la distribución del tamaño de los poros, se confirmó una estructura estable de poros en forma de panal del andamio cuando se agregó un 12% de β-GP. La adición de un 2% de HA/β-TCP aumentó tanto la rugosidad como la resistencia a la compresión del andamio. Al 12% de β-GP, la porosidad del grupo con un contenido de 4% de HA/β-TCP fue inferior al 60%, significativamente inferior a la del grupo con un contenido de HA/β-TCP del 2%. Por lo tanto, el andamio preparado con 12% de β-GP y 2% de HA/β-TCP fue el más acorde con las necesidades prácticas.
Resultados de la prueba de rendimiento de hinchamiento
El rendimiento de hinchamiento refleja la hidrofilicidad del material del andamio y representa la capacidad del material para absorber fluidos corporales o sangre después de la implantación y promover la cicatrización de heridas. Cuando el contenido de HA/β-TCP fue constante, el contenido de β-GP no tuvo un efecto significativo sobre la tasa de hinchamiento del andamio (p > 0,05). Cuando el contenido de β-GP fue constante, la tasa de hinchamiento del andamio disminuyó significativamente con el aumento del contenido de HA/β-TCP (p < 0,05; Figura 4B). Después de que el grupo con contenido de 14% de β-GP-4% HA/β-TCP se remojara en agua líquida durante 24 h, se retiró y se pesó, se observó que el soporte estaba suelto, la estructura estaba dañada, el andamio no se podía agarrar. La razón de hinchamiento de esta muestra no se incluyó en el análisis estadístico.
Comportamiento de degradación de los andamios
El rendimiento de degradación es una propiedad importante de los materiales que afecta la regeneración de tejidos en sitios dañados e indica la estabilidad de la estructura del andamio en un momento dado. Los resultados de la prueba mostraron que se produjo una pérdida de peso en todos los grupos al 4º día, y la tasa de degradación de los andamios aumentó gradualmente con el tiempo. Los cambios en el contenido de β-GP no tuvieron un efecto significativo en el rendimiento de degradación de los andamios. Cuando el contenido de β-GP fue constante, la tasa de degradación en los grupos de 2% HA/β-TCP y 4% de HA/β-TCP fue menor que en el grupo sin HA/β-TCP y se estabilizó gradualmente después del 14º día (Figura 4C). Durante el tiempo de degradación, la forma de los andamios en el líquido no cambió significativamente, y los andamios se podían recoger y manipular fácilmente. Solo el 14% β-GP-4% HA/β-TCP tenía una estructura suelta en el 4º día de degradación y no era fácil de sujetar.
En resumen, se formó una matriz de gel mediante la unión de CS a β-GP, y se agregaron partículas de HA/β-TCP a la matriz. Después de la liofilización, se formó un andamio tridimensional con una estructura de poros interconectada. Después de comparar las propiedades físicas de los andamios con diferentes formulaciones, se demostró que los andamios preparados con 2% de CS, 12% de β-GP y una relación 2% HA/β-TCP tenían una estructura de poros en forma de panal. Aproximadamente el 60% de los poros tenían diámetros entre 300 y 600 μm, y la porosidad fue de 64,56% ± 2,48%, lo que favoreció la adhesión y proliferación celular. Además, la resistencia a la compresión del andamio (0,44 ± 0,09 MPa) se equilibró con la porosidad, lo que proporcionó una cierta resistencia mecánica al andamio, mantuvo la estructura del andamio y permitió que el andamio resistiera la presión de los tejidos circundantes. Además, el andamio tenía una buena hidrofilicidad de hinchamiento, era capaz de absorber nutrientes adicionales y se degradaba gradualmente con el tiempo.
Por lo tanto, considerando el rendimiento del andamio, se prepararon andamios con 2% de CS, 12% de β-GP y 2% de HA/β-TCP para las pruebas posteriores.
Proliferación celular en el andamio
La actividad proliferativa de las PDLSC caninas en el andamio fue evaluada por CCK-8, y la proliferación de PDLSCs caninas en el andamio aumentó con el tiempo. Al 1er día después de la inoculación de las PDLSCs caninas, el número de células adheridas al fondo de la placa de Petri fue significativamente mayor que el adherido al andamio (p < 0,05). El día 3, había más células unidas al andamio que al fondo de la placa, pero la diferencia no fue significativa. Al 5º día, el número de células adheridas al andamio y su proliferación fueron significativamente mayores que en el fondo de la placa de Petri (p < 0,05; Figura 5A). Los resultados mostraron que las células podían adherirse al andamio y que el andamio no tenía ningún efecto tóxico sobre las PDLSC caninas ni promovía su proliferación.
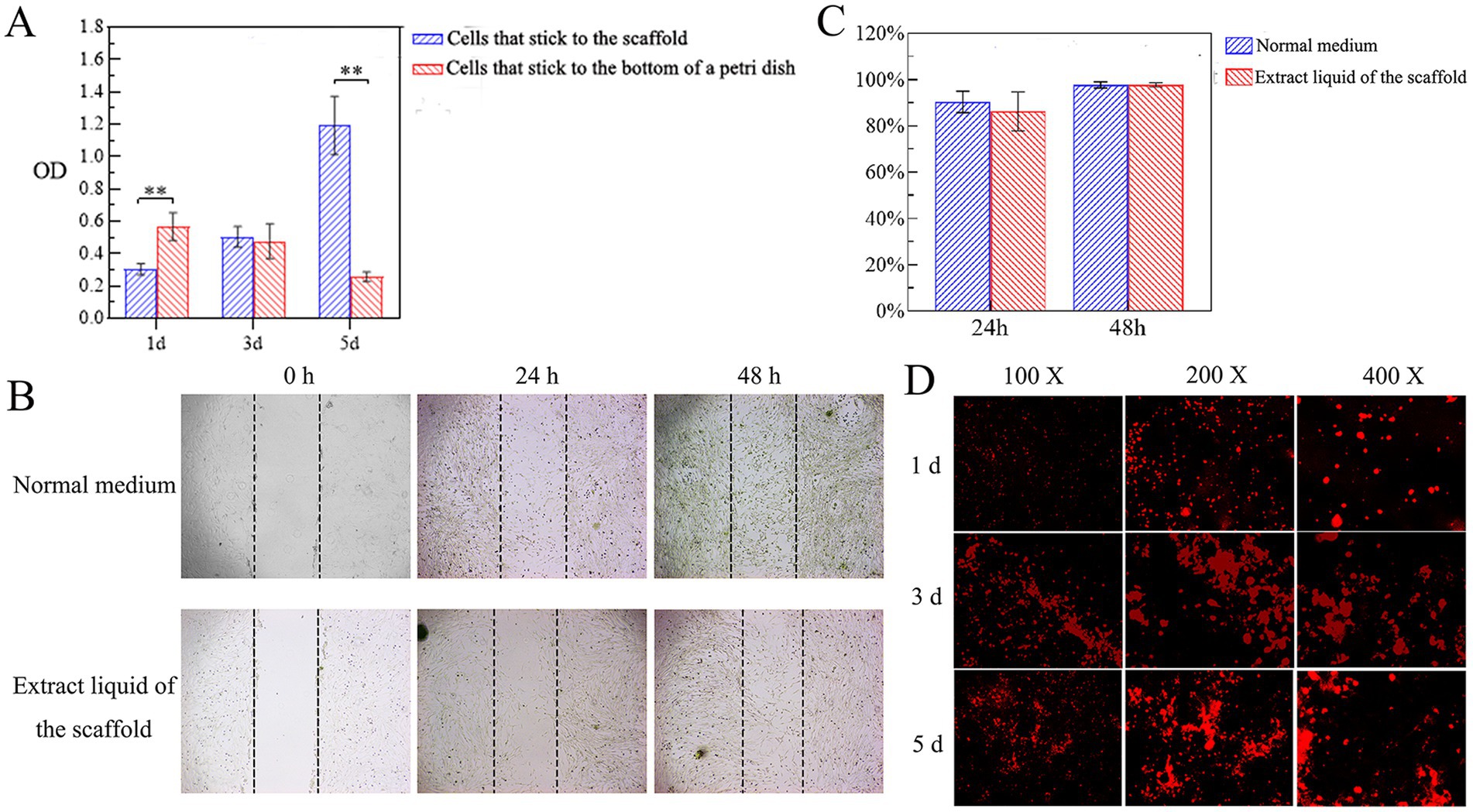
Efectos del extracto líquido de andamio sobre la migración celular
El efecto del líquido de extracto de andamio sobre la capacidad de migración de las PDLSC caninas se investigó mediante una prueba de arañazo. Se monitoreó la migración de las células del grupo experimental y del grupo control al área rascada a las 24 h y 48 h (Figura 5B). A las 48 h, se observó que las células migratorias cubrían casi toda el área rascada. De acuerdo con el análisis cuantitativo del área de rascado, no hubo diferencia significativa en el área de migración celular entre el grupo experimental y el grupo control a las 24 h o 48 h (Figura 5C). Los resultados mostraron que el extracto de andamio no tuvo ningún efecto tóxico sobre las PDLSC caninas y no afectó la capacidad de migración de las células.
Adhesión y crecimiento de células en andamios
Las PDLSC caninas marcadas con CM-Dil se cultivaron junto con los andamios. Bajo microscopía de fluorescencia, las células que acababan de ser inoculadas en el andamio eran redondas y estaban dispersas uniformemente por todo el andamio. Al 1º día, algunas células se adhirieron a la superficie del andamio y entraron en el interior del andamio. Al tercer día, el número de células conectadas al andamio había aumentado gradualmente y el andamio se trasladó a un nuevo pozo para continuar observando el crecimiento celular. Al 5º día, se pudo observar un gran número de células con fluorescencia roja, y la fluorescencia roja se agregó en grupos (Figura 5D). Estos hallazgos indicaron además que las células se adherían al andamio y exhibían una buena proliferación celular.
Resultados de las pruebas de biocompatibilidad in vivo
Los resultados de la monitorización del índice fisiológico básico y del examen bioquímico de los perros de prueba mostraron que los perros de prueba gozaban de buena salud antes y 21 días después de la implantación subcutánea de los andamios y andamios de ingeniería de tejidos; además, los indicadores básicos como la temperatura, la respiración, la frecuencia cardíaca y el pulso eran normales, y ALT, AST y CREA estaban todos dentro de los rangos de referencia normales. No hubo complicaciones ni eventos adversos durante el proceso de curación. Los resultados mostraron que los andamios de ingeniería de tejidos y los andamios no mostraron hepatotoxicidad ni nefrotoxicidad evidentes, por lo que se pudieron realizar estudios de seguimiento.
Se evaluó el proceso de cicatrización de la herida a los 7º, 14º y 21º días después de la cirugía. Al 7º día, la anastomosis de la herida quirúrgica era buena, no había espacio visible en el tejido, se habían formado cicatrices lineales en el sitio de la herida, el tejido era de color marrón grisáceo o marrón rojizo y más profundo que la piel circundante, y los andamios y andamios de ingeniería de tejidos no mostraron un efecto significativo en la cicatrización de la herida. Al día 14, el tejido cicatricial se había degenerado, la herida era suave, el color circundante era rosado o normal y el color de la herida era más claro o similar al color de la piel circundante. Al día 21, las heridas cutáneas habían cicatrizado por completo sin exudación, enrojecimiento o reacciones inflamatorias evidentes (Figura 6A). De acuerdo con la evaluación de la Puntuación de Cicatrices de Vancouver, con el aumento del tiempo de curación, las puntuaciones de flexibilidad, altura, vascularidad y pigmentación disminuyeron gradualmente hasta acercarse a las de la piel normal. Las puntuaciones de los andamios de ingeniería de tejidos fueron generalmente más bajas que las de los andamios (Figura 6B). Después de que los dos grupos de andamios se implantaron en el tejido subcutáneo, el proceso de cicatrización y la velocidad de la herida no se vieron afectados, y la circulación sanguínea en el sitio de implantación no se vio afectada.
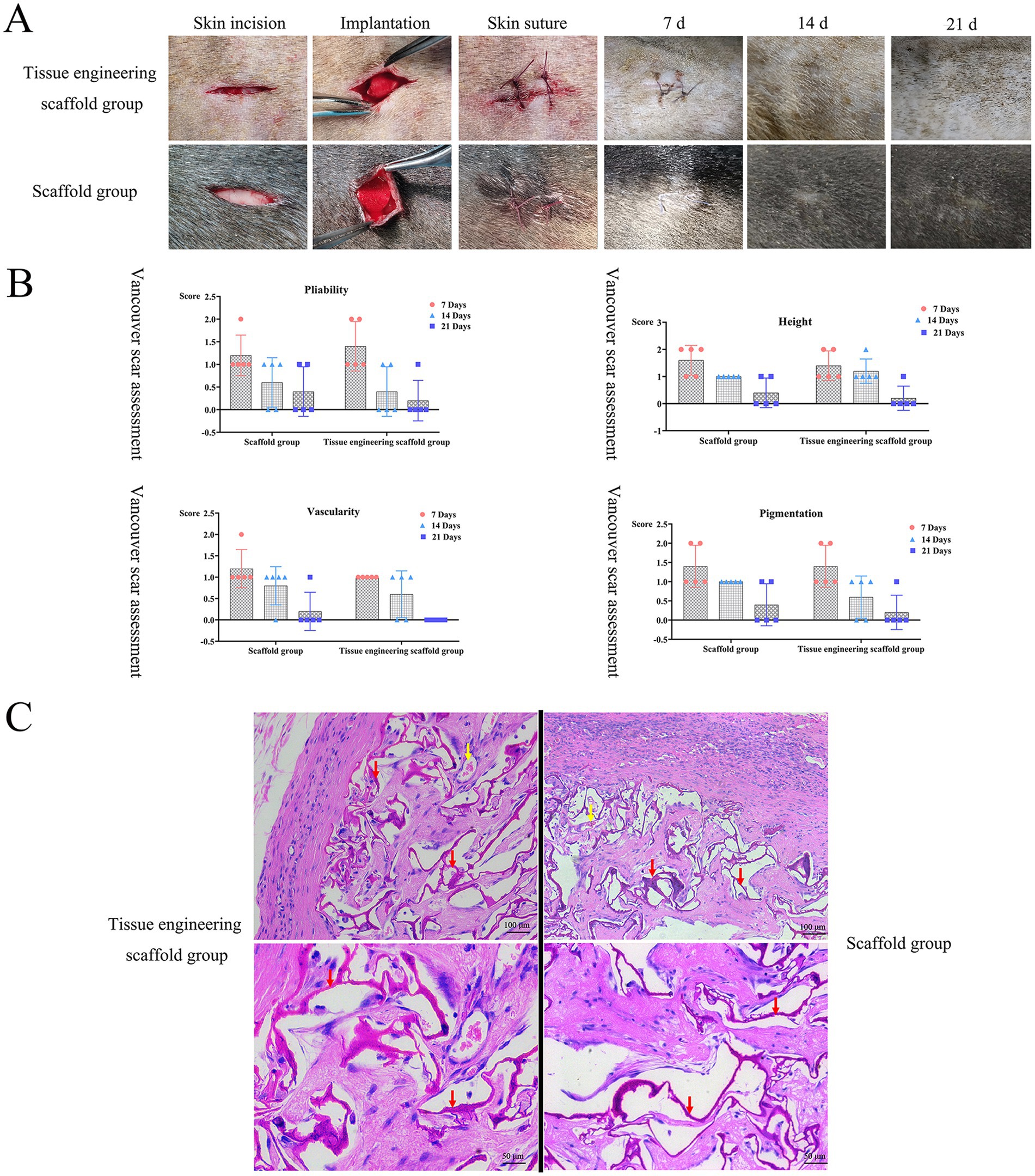
Figura 6. Resultados de pruebas de biocompatibilidad in vivo. (A,B) Después de que los dos grupos de andamios se implantaron en el tejido subcutáneo, el proceso de cicatrización y la velocidad de la herida no se vieron afectados, y la circulación sanguínea en el sitio de implantación no se vio afectada. (C) No hubo una infiltración obvia de células inflamatorias alrededor de los andamios, se pudieron observar nuevos capilares y no hubo daño patológico, como necrosis tisular o hiperplasia, alrededor de los andamios. Ambos grupos de andamios tuvieron buena histocompatibilidad in vivo. Las flechas rojas indican andamios restantes, las flechas amarillas indican vasos sanguíneos.
Cuando los andamios de ingeniería de tejidos se implantan debajo de la piel, se produce un proceso de interacción dinámica entre el andamio de ingeniería de tejidos y el tejido subcutáneo. Tanto los andamios de ingeniería de tejidos como otros andamios mostraron una buena compatibilidad con el tejido subcutáneo. El día 21, los andamios de ambos grupos se habían degradado gradualmente y las estructuras estaban sueltas. En este momento, los tejidos circundantes estaban creciendo lentamente hacia los andamios, pero todavía había un área en blanco alrededor de los andamios. No hubo infiltración evidente de células inflamatorias alrededor de los andamios, se observaron nuevos capilares y no hubo daño patológico, como necrosis tisular o hiperplasia, alrededor de los andamios (Figura 6C). Ambos grupos de andamios tuvieron buena histocompatibilidad in vivo.
Evaluación de la eficacia de la reparación y regeneración de defectos periodontales
En estricta conformidad con los requisitos de la construcción de modelos de defectos óseos de pared única, se generó un modelo de defecto óseo de primer molar canino y se trasplantaron andamios de ingeniería de tejidos (material suplementario S1A) y andamios (material suplementario S1B) al sitio del defecto periodontal, mientras que el grupo de control (material suplementario S1C) no se sometió a ningún trasplante.
Los perros modelo con defectos periodontales fueron tratados con GTR. En la segunda semana después de la cirugía, las heridas en todos los grupos de operación se cerraron y los andamios pudieron llenar de manera estable el área del defecto sin sobresalir de la herida. Las suturas en la cavidad bucal de algunos perros no se absorbieron completamente, y el sangrado gingival ocurrió en todos los grupos durante el sondaje periodontal. A la 4ª semana después de la cirugía, las suturas de la boca de cada grupo se absorbieron por completo, y las encías del grupo de andamio de ingeniería de tejidos y del grupo de andamio rodearon y cubrieron los dientes, mientras que los tejidos blandos periodontales del grupo de control se habían colapsado en el área defectuosa y formaron una depresión. A la 8ª semana después de la cirugía, el epitelio gingival cubría toda la herida tanto en el grupo de andamio de ingeniería tisular como en el grupo de andamio, mientras que el tejido blando periodontal en el grupo control todavía era cóncavo en el sitio del defecto (Figura 7A). Además, no se produjeron reacciones inflamatorias significativas, como edema tisular, necrosis o supuración, en el sitio quirúrgico o en los tejidos circundantes dentro de las 8 semanas posteriores a la cirugía. En resumen, el uso de andamios en GTR puede apoyar el área defectuosa, evitar que el epitelio de unión sobre el material crezca en el área defectuosa, crear espacio para la reparación y regeneración del área defectuosa y estabilizar el colgajo de tejido gingival.
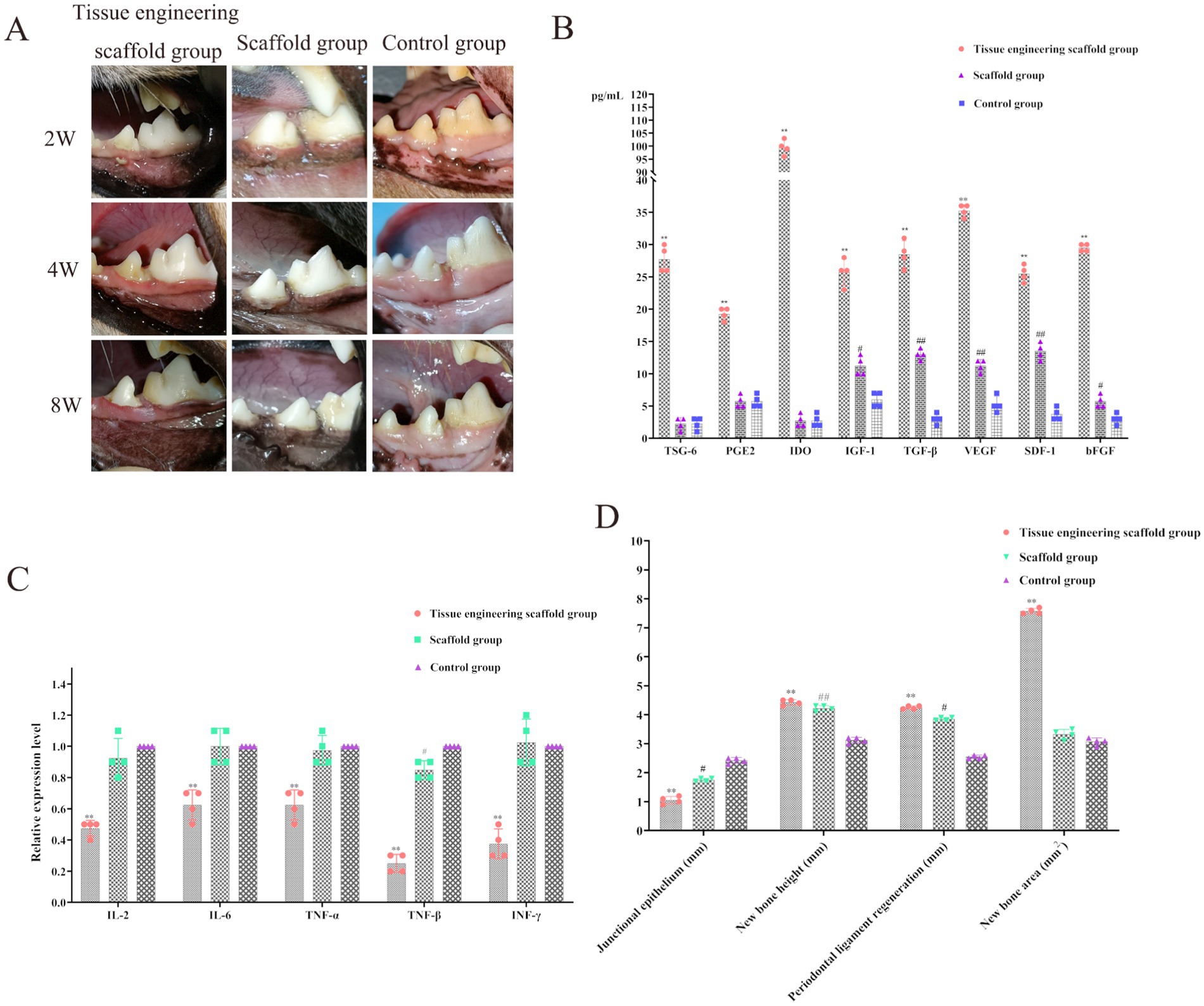
Figura 7. Evaluación de la eficacia de la reparación y regeneración de defectos periodontales. (A) El epitelio gingival cubrió toda la herida tanto en el grupo de andamio de ingeniería de tejidos como en el grupo de andamio, mientras que el tejido blando periodontal en el grupo de control todavía era cóncavo en el sitio del defecto. (B) Los niveles de TSG-6, PGE2, IDO, IGF-1, TGF-β, VEGF, SDF-1 y bFGF en el grupo de andamio de ingeniería de tejidos fueron significativamente mayores que los del grupo de andamio y el grupo de control (p < 0,01). Los niveles de IGF-1, TGF-β, VEGF, SDF-1 y bFGF en el grupo de andamio fueron significativamente mayores que los del grupo control (p < 0,01, p < 0,05). (C) IL-2, IL-6, TNF-α, TNF-β e INF-γ, disminuyeron significativamente después de la implantación del andamio de ingeniería tisular que contenía PDLSC (p < 0,01). La expresión de TNF-β en el grupo de andamio fue significativamente menor que en el grupo control (p < 0,05). (D) Los resultados del epitelio de unión, la nueva altura ósea, la nueva área ósea y la regeneración del ligamento periodontal.
Además, los niveles de TSG-6, PGE2, IDO, IGF-1, TGF-β, VEGF, SDF-1 y bFGF en el grupo de andamio de ingeniería de tejidos fueron significativamente mayores que los del grupo de andamio y el grupo de control (p < 0,01). Los niveles de IGF-1, TGF-β, VEGF, SDF-1 y bFGF en el grupo de andamio fueron significativamente mayores que los del grupo control (p < 0,01; p < 0,05; Figura 7B). Después de la implantación de andamios de ingeniería tisular que contienen PDLSC, las PDLSC pueden secretar factores para promover la reparación y el crecimiento del tejido óseo y otros tejidos, aumentar la inmunosupresión y reducir la respuesta inflamatoria. Además, los andamios pueden estimular hasta cierto punto la expresión de factores relacionados en los tejidos circundantes. Este proceso también contribuye a la reparación y crecimiento del tejido periodontal (Figura 7B).
El análisis de los tres grupos de factores inmunes relacionados reveló que los niveles de factores inflamatorios, como IL-2, IL-6, TNF-α, TNF-β e INF-γ, disminuyeron significativamente después de la implantación del andamio de ingeniería tisular que contenía PDLSC (p < 0,01), lo que demuestra aún más que las PDLSC pueden secretar factores inmunosupresores. Así, el andamio de ingeniería tisular fue capaz de ejercer efectos inmunomoduladores, reducir la respuesta inflamatoria, reducir el rechazo al trasplante y aumentar la duración de la función celular (Figura 7C). Además, la expresión de TNF-β en el grupo de andamio fue significativamente menor que en el grupo control (p < 0,05), lo que indica que el andamio en este estudio inhibió la expresión de TNF-β en los tejidos circundantes, lo cual es muy importante para reducir la respuesta inflamatoria y acelerar el proceso de reparación de los tejidos (Figura 7C).
Los resultados para el epitelio de unión, la nueva altura ósea, la nueva área ósea y la regeneración del ligamento periodontal fueron los siguientes:
Epitelio de unión: Los volúmenes epiteliales de unión en el grupo de andamio, el grupo de andamio y el grupo control fueron de 1,05 ± 0,22 mm, 1,75 ± 0,17 mm y 2,42 ± 0,14 mm, respectivamente. Hubo diferencias significativas entre el grupo de andamio de ingeniería de tejidos y el grupo control (p < 0,01) y entre el grupo de andamio y el grupo control (p < 0,05; Figura 7D).
Nueva altura ósea: Las nuevas alturas de hueso alveolar en el grupo de andamio de ingeniería de tejidos, el grupo de andamio y el grupo control fueron de 4,43 ± 0,22 mm, 4,22 ± 0,23 mm y 3,13 ± 0,26 mm, respectivamente. Hubo diferencias significativas entre el grupo de andamio de ingeniería de tejidos y el grupo control (p < 0,01) y entre el grupo de andamio y el grupo control (p < 0,01; Figura 7D).
Nueva área ósea: Las nuevas áreas óseas alveolares en el grupo de andamio de ingeniería de tejidos, el grupo de andamio y el grupo control fueron 7,76 ± 0,24mm2, 3,33 ± 1,12mm2 y 3,08 ± 0,15mm2, respectivamente. El área de superficie ósea alveolar en el grupo de andamio de ingeniería tisular fue significativamente mayor que la de los otros grupos (p < 0,01), y el área de hueso nuevo en el grupo de andamio fue mayor que en el grupo control, pero la diferencia no fue significativa (p > 0,05; Figura 7D).
Regeneración del ligamento periodontal: Los volúmenes de regeneración del ligamento periodontal en el grupo de andamio de ingeniería tisular, el grupo de andamio de ingeniería tisular y el grupo control fueron de 4,25 ± 0,33 mm, 3,85 ± 0,27 mm y 2,55 ± 0,19 mm, respectivamente. Hubo diferencias significativas entre el grupo de andamio de ingeniería de tejidos y el grupo control (p < 0,01) y entre el grupo de andamio y el grupo control (p < 0,05; Figura 7D).
A la octava semana después de la operación, se recolectó el tejido del sitio de trasplante del perro y se obtuvieron secciones de tejido duro de 8 ~ 10 μm de espesor moliendo las rodajas. No se encontró infiltración de células inmunitarias como mastocitos y macrófagos en la sección. Los resultados fueron los siguientes:
Grupo de andamios de ingeniería de tejidos: Se encontró hueso alveolar nuevo en el sitio del defecto dentro de los 6 mm del límite del hueso del esmalte. Se encontraron osteoblastos en las lagunas del hueso alveolar, y restos de andamios en el área vacía de hueso nuevo. Se observaron osteoblastos alrededor del andamio, y parte del andamio fue reemplazado por hueso nuevo. Fibras de la membrana periodontal neonatal formadas entre el hueso alveolar y el cemento y unidas a ambos lados. Se formó un surco gingival entre el epitelio de la unión gingival y el esmalte dental para mantener un nivel normal de inserción periodontal (Figura 8).
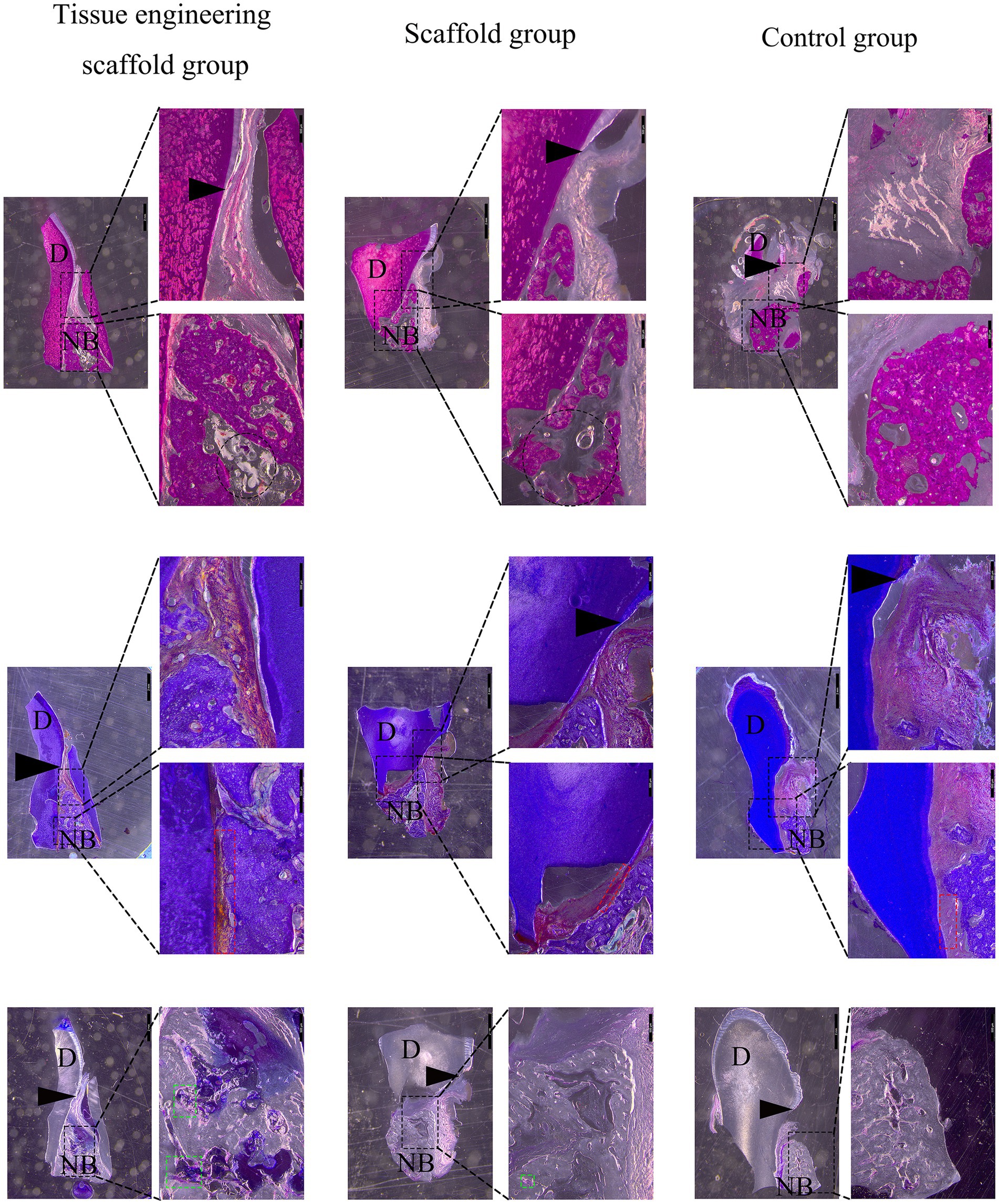
Grupo de andamios: Se encontró hueso alveolar nuevo en el sitio del defecto dentro de los 6 mm del límite del hueso del esmalte. Sin embargo, había más áreas en blanco en el nuevo hueso alveolar que en el grupo de andamio de ingeniería de tejidos, y la densidad ósea era menor. Se encontraron andamios en el área vacíos de hueso nuevo, y otros andamios fueron reemplazados por hueso nuevo. Además, se formaron fibras de la membrana periodontal neonatal entre el hueso alveolar y el cemento, pero debido a que el nuevo hueso alveolar estaba incompleto y los bordes eran desiguales, las fibras de la membrana periodontal no estaban firmemente adheridas. Se formó un surco gingival entre el epitelio de la unión gingival y el esmalte dental para mantener un nivel normal de inserción periodontal (Figura 8).
Grupo control: Se encontró hueso alveolar nuevo en el sitio del defecto dentro de los 6 mm del límite del hueso del esmalte. Sin embargo, la altura coronal y la dirección horizontal del nuevo hueso alveolar fueron menores que las del grupo de andamio de ingeniería de tejidos y el grupo de andamio. El tejido blando por encima del hueso alveolar colapsó en el área defectuosa y se extendió entre el hueso alveolar y el cemento, ocupando el espacio necesario para la formación de hueso y la unión de la fibra de la membrana periodontal. Además, disminuyó la adherencia del epitelio de la unión gingival y se profundizó el surco gingival (Figura 8).
Discusión
Las PDLSC desempeñan un papel importante en el mantenimiento del suministro nutricional de los dientes, el mantenimiento del equilibrio del microambiente y la reparación de los tejidos dañados. Es muy importante obtener suficientes células semilla y mantener las funciones biológicas normales de las células. El establecimiento de un proceso completo para aislar y cultivar PDLSC caninos puede aumentar la eficiencia de todo el estudio experimental y sentar las bases para estudios posteriores (12). En el presente estudio, las PDLSC caninas aisladas por digestión enzimática combinada con el método de bloque de tejido se utilizaron como nuevas células semilla para la investigación en ingeniería de tejidos. Las PDLSCs resultantes tenían las características biológicas de las células madre mesenquimales y fueron exitosamente aisladas y cultivadas in vitro, y una variedad de resultados de identificación mostraron que las PDLSCs exhibieron autodivisión y expansión continua. Además, las PDLSCs exhibieron capacidad de diferenciación multidireccional bajo condiciones de inducción apropiadas, lo que indica que las PDLSCs podrían participar en la reparación y regeneración del tejido nativo. Hakki et al. informaron que no hubo diferencia estadísticamente significativa en la expresión de genes osteogénicos entre las PDLSC y las células madre de la pulpa dental, mientras que las PDLSC mostraron una mayor expresión de colágeno tipo Ι (13). Chen et al. utilizaron PDLSCs combinadas con GTR para tratar los defectos periodontales e informaron que la altura del hueso alveolar aumentó tanto en el grupo celular como en el grupo control, pero que la diferencia no fue significativa. Sin embargo, se demostró que las PDLSC eran seguras para el tratamiento de los defectos periodontales, y se propuso la combinación de terapia celular con andamios para una regeneración periodontal efectiva (14). Por lo tanto, en el presente estudio, se seleccionaron PDLSC caninas como células semilla y se combinaron con andamios para crear andamios de ingeniería de tejidos para la reparación de defectos periodontales. Este estudio demostró que las PDLSC caninas pueden secretar factores de crecimiento relacionados y factores inmunomoduladores, que desempeñan un papel importante en la reparación de tejidos y la regulación inmunitaria, reduciendo así la respuesta inflamatoria, reduciendo el rechazo del trasplante, aumentando el tiempo para que las células desempeñen su papel y promoviendo la reparación del tejido periodontal.
En los últimos años, se han utilizado combinaciones de células madre, biomateriales y factores bioquímicos para mejorar la reparación y regeneración del tejido periodontal con el fin de restaurar y mejorar la función tisular, proporcionando nuevas ideas para el tratamiento de la enfermedad periodontal. Una suspensión celular preparada in vitro puede inyectarse directamente en el lugar lesionado, y las ventajas de este método incluyen la simplicidad y la mínima invasividad. Sin embargo, después de la inyección, existen problemas como el suministro insuficiente de células, la propagación de las células inyectadas a los tejidos sanos circundantes y la pérdida de control del destino celular (15). Los andamios de ingeniería de tejidos construidos a partir de células madre y andamios pueden estabilizar las células. De acuerdo con la teoría de la ingeniería de tejidos, se espera que el cultivo de células madre con andamios promueva una mayor formación de hueso nuevo. Las PDLSC caninas son las células semilla potenciales más directamente relevantes para la regeneración del tejido periodontal. Según los estudios histológicos de la regeneración periodontal humana, el uso de biomateriales en la terapia periodontal puede promover la regeneración periodontal (16). Saito et al. trataron a pacientes con defectos periodontales mayores de 3 mm mediante regeneración guiada combinada con rhFGF-2 y DBBM; El nivel de inserción clínica de los pacientes en el grupo experimental mejoró, y el volumen de llenado óseo en el grupo experimental fue significativamente mayor que en el grupo control (17).
El quitosano (CS) es un material biodegradable y biocompatible muy utilizado en la investigación sobre la cicatrización de heridas debido a su buena adherencia y propiedades antibacterianas (18). El CS es generalmente insoluble en agua y solventes orgánicos, pero en una solución ácida 1 M, el grupo amina se disocia en un estado catiónico (19). En estas condiciones, cuando se añade β-GP a la solución de CS, el anión fosfato puede formar un complejo iónico con el grupo amina CS a través del acoplamiento iónico (20). Después de la liofilización, se puede formar una estructura porosa y se pueden preparar andamios CS con poros interconectados. Los resultados de este estudio mostraron que cuando el contenido de β-GP era del 6% ~ 14%, podía reticularse con CS para formar una matriz de gel estable. Sin embargo, las propiedades mecánicas de los andamios CS no son fuertes y su capacidad para guiar la osteogénesis es inadecuada para la reparación del tejido periodontal. El HA/β-TCP es un material sustituto óseo bifásico de fosfato de calcio compuesto de HA y β-TCP que puede liberar iones de calcio y fósforo y tiene buena biocompatibilidad, conductividad ósea y capacidad de inducción ósea y otras propiedades ventajosas (21). En consecuencia, cuando las partículas de HA/β-TCP se dispersaron en la matriz de gel, el tiempo de gelificación disminuyó y el estado del gel permaneció estable. Después de que el andamio se liofilizó en estado de gel, los poros del andamio se utilizaron como espacio para el intercambio de nutrientes, la migración celular y otras actividades. Los resultados de este estudio mostraron que a la misma concentración β-GP, la adición de HA/β-TCP mejoró la resistencia a la compresión del andamio, pero la porosidad disminuyó con el aumento de la concentración de HA/β-TCP. La porosidad del andamio en el grupo con un contenido de 4% de HA/β-TCP fue significativamente menor que en el grupo con un contenido de 2% de HA/β-TCP. En un estudio sobre las propiedades de los andamios vitrocerámicos, también se informó de una correlación lineal negativa entre la porosidad de los andamios y el módulo de compresión (22). Sin embargo, el hinchamiento del grupo de stent con 2% de HA/β-TCP fue mayor que el del grupo de 4% de HA/β-TCP, y la adición de 2% de HA/β-TCP al andamio fue más adecuada para las demandas reales de aplicaciones de baja carga, como la reparación del hueso alveolar. Además, este estudio mostró que el andamio estimulaba la expresión de factores relacionados (incluidos factores de crecimiento y factores inmunosupresores) en los tejidos circundantes, lo que conducía a la reparación y el crecimiento de los tejidos periodontales.
La biocompatibilidad de los materiales de los andamios se manifiesta principalmente en la adhesión, crecimiento, migración y proliferación celular en el andamio. La respuesta adaptativa entre las células y los andamios es muy importante para la posterior terapia de trasplante. In vitro, cuando las células comenzaron a exhibir inhibición de contacto, el andamio proporcionó espacio adicional para que las PDLSC caninas sobrevivieran, y la proliferación de PDLSC caninas unidas al andamio se hizo significativamente mayor. El extracto de andamio de ingeniería de tejidos no tuvo ningún efecto tóxico sobre las PDLSC caninas y no afectó a la migración celular. Además, las células marcadas con fluorescencia roja se adhirieron al andamio y proliferaron continuamente, lo que indica que el andamio de ingeniería de tejidos construido en el presente estudio tenía una biocompatibilidad satisfactoria in vitro y podía cocultivarse con células para formar un complejo célula-andamio. Además, cuando el complejo célula-andamio se implantó en el tejido subcutáneo en este experimento, no se observaron efectos adversos sobre la función hepática o renal de los perros en 21 días y la cicatrización de las heridas quirúrgicas no se vio afectada. El análisis histopatológico reveló que después de la implantación durante 21 días, el andamio de ingeniería de tejidos se volvió delgado y suelto en estructura, con tejidos circundantes que crecían en el andamio; Además, había pequeños vasos sanguíneos nuevos y células similares a fibroblastos dentro del andamio y no se observó una infiltración obvia de células inflamatorias alrededor del andamio, lo que indica una buena biocompatibilidad in vivo.
Durante el trasplante, se observó que el andamio de ingeniería de tejidos se ajustaba estrechamente al borde del defecto periodontal y exhibía una buena hinchazón. La sangre circundante penetró en el andamio, lo que permitió la cicatrización de las heridas y proporcionó nutrientes para las células, y el andamio se degradó gradualmente con el tiempo. La herida cicatrizó bien y no mostró edema tisular, necrosis, supuración u otras reacciones inflamatorias. Los resultados histopatológicos mostraron que el tamaño de la nueva membrana periodontal y la altura y área del nuevo hueso fueron significativamente mayores cuando el andamio de ingeniería tisular se colocó en el defecto para la regeneración guiada que en los defectos de control. Se formó hueso nuevo alrededor del andamio, lo que indica que el andamio mantenía espacio para la formación de hueso nuevo. Por el contrario, no se realizó regeneración guiada en el grupo control. Como la tasa de crecimiento óseo era más lenta que la del tejido epitelial, la encía combinada con el epitelio y el tejido conectivo se extendía hacia el área defectuosa, ocupando la posición donde se necesitaba la formación de hueso nuevo y, por lo tanto, limitando el espacio de crecimiento para el hueso nuevo. Por lo tanto, la regeneración guiada mediante la colocación de andamios de ingeniería de tejidos en el área del defecto periodontal puede bloquear eficazmente la unión del epitelio fuera del área del defecto periodontal, preservar el espacio para la formación de hueso nuevo, estabilizar el colgajo de tejido gingival para evitar el colapso en el área del defecto periodontal y evitar que se forme la placa en el defecto.
La tinción de Masson mostró que las nuevas fibras de la membrana periodontal en el grupo de andamio de ingeniería de tejidos estaban unidas al nuevo hueso, mientras que las fibras de la membrana periodontal en el grupo de control no estaban firmemente unidas. La tinción con azul de toluidina mostró osteoblastos alrededor del nuevo hueso en el grupo de andamio de ingeniería de tejidos, pero el número de osteoblastos dentro del andamio de ingeniería de tejidos fue menor, mientras que no se observaron osteoblastos en el centro del nuevo hueso en el grupo de control. Por lo tanto, se especula que las PDLSC caninas implantadas, por un lado, pueden diferenciarse en osteoblastos y células periodontales para promover la regeneración periodontal bajo la influencia del microambiente periodontal; Por otro lado, los materiales de andamiaje también pueden inducir la diferenciación celular. Además, los factores secretados por las PDLSC caninas pueden inhibir el rechazo del trasplante y promover la reparación del tejido periodontal. El HA/β-TCP es un fosfato de calcio bifásico, similar a los compuestos del tejido óseo natural, y los estudios han confirmado que la adición de HA no solo puede aumentar el módulo de compresión del andamio, sino también proporcionar una mayor superficie de adhesión, aumentando así la adhesión celular, la actividad biológica y la proliferación (23, 24). β-TCP también se usa ampliamente en la investigación de reparación de defectos óseos y tiene buenos efectos de biocompatibilidad y guía ósea (25). Además, el β-GP es uno de los principales componentes del líquido de inducción osteogénica y puede proporcionar los iones de fósforo necesarios para la precipitación del tejido óseo, acelerando así la calcificación de los nódulos (26). Por lo tanto, los diversos componentes de los andamios de ingeniería de tejidos pueden promover la diferenciación de las células madre periodontales caninas en osteoblastos y células periodontales y la formación de más membranas óseas y periodontales nuevas en el área defectuosa que en el grupo de andamios individuales. Sin embargo, en este estudio, el nuevo tejido periodontal no llenó completamente el área del defecto periodontal, por lo que es necesario continuar mejorando el soporte proporcionado por el andamio de ingeniería de tejidos y agregar las citoquinas correspondientes para promover la regeneración periodontal completa.
Conclusión
En el presente estudio, las PDLSCs caninas aisladas por digestión enzimática combinada con el método de bloqueo tisular exhibieron un crecimiento fibroso adherente y pudieron formar colonias clonales con características fenotípicas de células madre mesenquimales, que pudieron diferenciarse en células adiposas, cartilaginosas y óseas. Los andamios preparados con 2% de CS, 12% de β-GP y 2% de HA/β-TCP tuvieron buenas propiedades físicas y biocompatibilidad tanto in vivo como in vitro. El andamio canino de ingeniería de tejidos PDLSC se trasplantó al defecto óseo de pared única del primer molar mandibular del perro sin causar edema tisular, necrosis, supuración u otras reacciones inflamatorias, y la compatibilidad tisular fue satisfactoria. El complejo célula-andamio puede aumentar el contenido de factores de crecimiento relacionados y factores inmunomoduladores en los tejidos, reducir el contenido de factores proinflamatorios y prevenir el crecimiento del epitelio de unión en el área defectuosa, formando así nuevo hueso y nuevos ligamentos periodontales en el área defectuosa, promoviendo la reparación de defectos periodontales y mejorando el efecto terapéutico de la regeneración guiada.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor o autores correspondientes.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética y Bienestar Animal de la Universidad Forestal y de Agricultura del Noroeste. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
PD: Conceptualización, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Redacción – borrador original. GQ: Conceptualización, Investigación, Metodología, Escritura – borrador original. MZ: Curación de datos, Validación, Redacción – borrador original. QD: Curación de datos, Validación, Redacción – borrador original. KW: Curación de datos, validación, redacción – borrador original. YG: Curación de datos, Recursos, Redacción – borrador original. ML: Curación de datos, Recursos, Redacción – borrador original. XF: Curación de datos, Recursos, Escritura – borrador original. XZ: Obtención de fondos, Investigación, Metodología, Administración de proyectos, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo contó con el apoyo del proyecto de Prevención de Epidemias Animales 2023 (Subvención n.º K3031223086) y la financiación de segunda clase del proyecto de investigación postdoctoral de la provincia de Shaanxi (Subvención n.º 2023BSHEDZZ144).
Reconocimientos
Los autores desean agradecer al Centro de Animales Experimentales de la Universidad Northwest A&F por proporcionar animales de prueba, y a American Journal Experts (AJE) por ayudar con el uso del inglés.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1465879/full#supplementary-material
Referencias
1. Marshall, MD, Wallis, CV, Milella, L, Colyer, A, Tweedie, AD, y Harris, S. Evaluación longitudinal de la enfermedad periodontal en 52 schnauzers miniatura. BMC Vet Res. (2014) 10:166. doi: 10.1186/1746-6148-10-166
2. Wallis, C, y Holcombe, LJ. Una revisión de la frecuencia y el impacto de la enfermedad periodontal en perros. J Pequeña Anim Pract. (2020) 61:529–40. doi: 10.1111/jsap.13218
3. Tamura, K, Tokuzen-Tai, M, Siddiqui, YD, Tamura-Naito, H, Nagahara, Y, Hatanaka-Takeuchi, K, et al. Estimación de la superficie de la bolsa periodontal en perros pequeños y medianos: un estudio de prueba de concepto. BMC Vet Res. (2022) 18:13. doi: 10.1186/s12917-021-03116-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Chapple, IL. Es hora de tomar en serio la periodontitis. BMJ. (2014) 348:G2645. doi: 10.1136/bmj.g2645
5. Vaquette, C, Pilipchuk, SP, Bartold, PM, Hutmacher, DW, Giannobile, WV e Ivanovski, S. Construcciones de ingeniería tisular para la regeneración periodontal: estado actual y perspectivas futuras. Adv Healthc Mater. (2018) 7:E1800457. doi: 10.1002/adhm.201800457
6. Kantarci, A. Bases biológicas de la regeneración periodontal. Dent Clin N Am. (2022) 66:1–9. doi: 10.1016/j.cden.2021.08.001
7. Zhu, W, Zhang, Q, Zhang, Y, Cen, L y Wang, J. Regeneración de PDL a través de la localización celular en la reimplantación tardía de dientes avulsionados. J Transl Med. (2015) 13:357. doi: 10.1186/s12967-015-0719-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Soldatos, NK, Stylianou, P, Koidou, VP, Angelov, N, Yukna, R, y Romanos, GE. Limitaciones y opciones de uso de membranas reabsorbibles frente a no reabsorbibles para una regeneración ósea guiada exitosa. Quintaesencia Int. (2017) 48:131–47. doi: 10.3290/j.qi.a37133
9. Ouchi, T y Nakagawa, T. Terapias de regeneración de tejidos basadas en células madre mesenquimales para la periodontitis. Regen ther. (2020) 14:72–8. doi: 10.1016/j.reth.2019.12.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Tomokiyo, A, Wada, N y Maeda, H. Células madre del ligamento periodontal: potencia regenerativa en el periodonto. Desarrollo de Células Madre. (2019) 28:974–85. doi: 10.1089/scd.2019.0031
11. Ueberschaer, M, Endres, M, Wachtel, N, Oehlschlägel, F, Thorsteinsdottir, J, Schichor, C, et al. Una comparación aleatorizada prospectiva de los resultados funcionales y cosméticos de una incisión coronal en zigzag versus un patrón de incisión recta convencional para la craneotomía. J Neurosurg. (2023) 140:1–8. doi: 10.3171/2023.10.JNS231813
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Amato, M, Santonocito, S, Viglianisi, G, Tatullo, M e Isola, G. Impacto de las aplicaciones de células madre mesenquimales orales como un objetivo terapéutico prometedor en la terapia de la enfermedad periodontal. Int J Mol Sci. (2022) 23. doi: 10.3390/ijms232113419
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Hakki, SS, Kayis, SA, Hakki, EE, Bozkurt, SB, Duruksu, G, Unal, ZS, et al. Comparación de células madre mesenquimales aisladas de pulpa y ligamento periodontal. J Periodontol. (2015) 86:283–91. doi: 10.1902/jop.2014.140257
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Chen, X, Wu, G, Feng, Z, Dong, Y, Zhou, W, Li, B, et al. Biomateriales avanzados y sus potenciales aplicaciones en el tratamiento de la enfermedad periodontal. Crit Rev Biotechnol. (2016) 36:760–75. doi: 10.3109/07388551.2015.1035693
15. Mooney, DJ y Vandenburgh, H. Mecanismos de entrega de células para la reparación de tejidos. célula madre. (2008) 2:205–13. doi: 10.1016/j.stem.2008.02.005
16. Sculean, A, Nikolidakis, D, Nikou, G, Ivanovic, A, Chapple, IL y Stavropoulos, A. Biomateriales para promover la regeneración periodontal en defectos intraóseos humanos: una revisión sistemática. Periodontol. (2015) 68:182–216. doi: 10.1111/prd.12086
17. Saito, A, Bizenjima, T, Takeuchi, T, Suzuki, E, Sato, M, Yoshikawa, K, et al. Tratamiento de los defectos periodontales intraóseos con rhFGF-2 en combinación con mineral óseo bovino desproteinizado o rhFGF-2 solo: un ensayo controlado aleatorizado de 6 meses. J Clin Periodontol. (2019) 46:332–41. doi: 10.1111/jcpe.13086
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Lauritano, D, Limongelli, L, Moreo, G, Favia, G y Carinci, F. Nanomateriales para la ingeniería de tejidos periodontales: andamios basados en quitosano. Una revisión sistemática. Nanomateriales (Basilea). (2020) 10:605. DOI: 10.3390/nano10040605
19. Ou, Y y Tian, M. Avances en hidrogeles autocurables multifuncionales a base de quitosano para aplicaciones biomédicas. J Mater Chem B. (2021) 9:7955–71. DOI: 10.1039/D1TB01363G
20. Zang, S, Dong, G, Peng, B, Xu, J, Ma, Z, Wang, X, et al. Comparación de las propiedades fisicoquímicas del hidrogel de quitosano esterilizado y su aplicabilidad en un modelo canino de regeneración periodontal. Carbohidra Polím. (2014) 113:240–8. doi: 10.1016/j.carbpol.2014.07.018
21. Mishchenko, O, Yanovska, A, Sulaieva, O, Moskalenko, R, Pernakov, M, Husak, Y, et al. De la síntesis al ensayo clínico: nuevo nanomaterial bioinductivo de injerto óseo HA/β-TCP con deficiencia de calcio. Nanomateriales (Basilea). (2023) 13:876. DOI: 10.3390/nano13121876
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Baino, F, Ferraris, M, Bretcanu, O, Verné, E y Vitale-Brovarone, C. Optimización de la composición, estructura y resistencia mecánica de andamios vitrocerámicos 3D bioactivos para la sustitución ósea. J Biomater Appl. (2013) 27:872–90. doi: 10.1177/0885328211429193
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Barbosa, RM, Da Rocha, DN, Bombaldi De Souza, RF, Santos, JL, Ferreira, JRM, Moraes, Â, et al. Membranas de goma quitosano-xantana respetuosas con las células que incorporan hidroxiapatita diseñadas para la regeneración del tejido periodontal. Farmacia. (2023) 15:705. doi: 10.3390/pharmaceutics15020705
24. Filippi, M, Born, G, Chaaban, M, y Scherberich, A. Andamios poliméricos naturales en la regeneración ósea. Frente Bioeng Biotechnol. (2020) 8:474. doi: 10.3389/fbioe.2020.00474
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Lindner, M, Bergmann, C, Telle, R y Fischer, H. Andamios de fosfato de calcio que imitan la arquitectura de gradiente de los huesos largos nativos. J Biomed Mater Res A. (2014) 102:3677–84. doi: 10.1002/jbm.a.35038
26. Miranda, SC, Silva, GA, Hell, RC, Martins, MD, Alves, JB y Goes, AM. Cultivo tridimensional de BMMSCs de rata en un andamio poroso de quitosano-gelatina: una asociación prometedora para la ingeniería de tejidos óseos en la reconstrucción oral. Arch Oral Biol. (2011) 56:1–15. doi: 10.1016/j.archoralbio.2010.08.018
Palabras clave: enfermedad periodontal, células madre del ligamento periodontal, andamio canino de ingeniería tisular PDLSC, regeneración periodontal guía, reparación periodontal
Cita: Dai P, Qi G, Zhu M, Du Q, Wang K, Gao Y, Li M, Feng X y Zhang X (2024) Los andamios de ingeniería de tejidos con células madre del ligamento periodontal pueden guiar y promover la regeneración del tejido periodontal canino. Frente. Vet. Sci. 11:1465879. doi: 10.3389/fvets.2024.1465879
Recibido: 17 de julio de 2024; Aceptado: 24 de septiembre de 2024;
Publicado: 09 de octubre de 2024.
Editado por:
Khan Sharun, Instituto Indio de Investigación Veterinaria (IVRI), India
Revisado por:
Ilya D. Klabukov, Centro Nacional de Investigación Médica y Radiológica, Rusia
Aurelian-Sorin Pasca, Universidad de Ciencias de la Vida de Iasi (IULS), Rumania
Derechos de autor © 2024 Dai, Qi, Zhu, Du, Wang, Gao, Li, Feng y Zhang. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondencia: Xinke Zhang, zxk19830521@163.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía