Investigar el efecto que tiene una dosis única de cannabidiol en las medidas de estrés en gatos
 Jennifer E. Weller
Jennifer E. Weller Hannah E. Flint
Hannah E. Flint Alysia B. G. Hunt
Alysia B. G. Hunt Zack Ellerby
Zack Ellerby Tammie Rey *
Tammie Rey *- Waltham Petcare Science Institute, Waltham on the Wolds, Reino Unido
Los gatos domésticos (Felis Catus) a menudo están expuestos a estímulos que tienen el potencial de afectar negativamente su bienestar. Estos pueden incluir situaciones como visitas al veterinario, viajes, cambios en el entorno de su hogar e interacciones con personas o mascotas desconocidas. Los productos para mascotas con infusión de cannabidiol (CBD) han crecido en popularidad en los últimos años, ya que los dueños de mascotas buscan formas de calmar y relajar a sus mascotas. Sin embargo, la investigación sobre las propiedades farmacocinéticas del CBD en gatos es limitada y las investigaciones sobre su eficacia están en pañales. El presente estudio tuvo como objetivo explorar el efecto de una dosis única de 4 mg/kg de peso corporal de un destilado de CBD sin THC en las medidas de estrés en gatos cuando experimentan un paradigma de estrés compuesto, que consiste en el viaje del gato portador y la exposición a una persona nueva en un entorno desconocido. Se recogieron indicadores fisiológicos y conductuales del estrés antes, durante y después de las pruebas. No se observó ningún efecto significativo del CBD sobre el cortisol, la IgA o la glucosa sérica, ni antes ni inmediatamente después del paradigma del estrés (todos p > 0,05). Esto fue cierto a pesar de que se demostró que el cortisol aumentó significativamente después de la prueba para ambos tratamientos (ambos p < 0,001), lo que sugiere que viajar y conocer a una persona nueva indujo con éxito una respuesta al estrés dentro de esta población de gatos. No se observaron diferencias significativas en ninguna medida del comportamiento del gato, incluida la latencia para acercarse a la nueva persona, entre los tratamientos (todos p > 0,05). En general, no se observó ninguna influencia del CBD en los gatos, lo que sugiere que se deben considerar más investigaciones sobre la dosis adecuada, las matrices de administración y otros factores condicionales, como los estilos de afrontamiento individuales.
Introducción
El cannabidiol, comúnmente conocido como CBD, es el segundo fitocannabinoide más abundante que se encuentra dentro de la planta de cannabis multipropósito (Cannabis sativa) (1). Cuando está presente en el cuerpo, el CBD activa el sistema endocannabinoide, un sistema que se ha observado particularmente generalizado en las especies de mamíferos (2). Si bien aún no se han determinado todos los mecanismos de la farmacología del CBD (1, 3), muchos estudios han indicado que el CBD es eficaz para prevenir y controlar múltiples trastornos neurodegenerativos en humanos (revisado por Iuvone et al. (3)), así como otras afecciones de salud física y mental (4, 5). A diferencia del Δ 9-tetrahdrocannabinol (THC), el CBD es ampliamente reconocido como una molécula no psicoactiva o mínimamente psicoactiva (3, 6), lo que lo hace potencialmente adecuado para su uso como intervención médica. Por ejemplo, una revisión realizada por Blessing et al. (4) informó de pruebas preclínicas del CBD como tratamiento para el trastorno de ansiedad generalizada, el trastorno de pánico, el trastorno de ansiedad social, el trastorno obsesivo-compulsivo y los trastornos de estrés postraumático. Además, los pacientes que experimentan dolor neuropático central relacionado con la esclerosis múltiple informaron de una reducción del dolor y menos trastornos del sueño cuando se trataron con una combinación de CBD y THC (5). El CBD también puede modular el proceso neurobiológico implicado en el condicionamiento pavloviano del miedo y el procesamiento de la memoria contextual del miedo (7), con pruebas que sugieren que la administración de CBD mitiga el aumento del comportamiento de congelación observado en ratones (Mus musculus) condicionados a esperar un choque aversivo en el pie (8).
Por lo tanto, no es de extrañar que el CBD haya sido aclamado por muchos como una «cura milagrosa» y que haya aumentado su popularidad en todo el mundo (9). Los productos para mascotas con infusión de CBD también se han vuelto cada vez más populares, y los dueños de mascotas buscan opciones de tratamiento alternativas para apoyar la salud física y emocional de sus mascotas (1, 10, 11). Si bien los productos veterinarios derivados del cannabis actualmente no se pueden recetar en los EE. UU. y tienen una aprobación variable en todo el mundo (11), el mercado de productos para mascotas que contienen CBD está ganando popularidad (12). Sin embargo, en la actualidad existe una falta de regulación en torno a este tipo de productos, que podrían suponer riesgos de seguridad tanto para el bienestar físico como emocional de las mascotas. Esto pone de manifiesto la necesidad de realizar investigaciones basadas en pruebas sobre los efectos del CBD en las especies de animales de compañía.
Ahora están empezando a surgir ensayos clínicos que exploran la seguridad y la eficacia de fitocannabinoides como el CBD en animales de compañía (10), a pesar de la lentitud del comienzo, probablemente causada por la naturaleza controvertida del consumo recreativo de cannabis. Los estudios actuales se han centrado principalmente en la farmacocinética y la seguridad del CBD en perros (Canis lupus familiaris) y, más recientemente, en gatos (13-19), y solo unos pocos han generado pruebas que respalden la eficacia del CBD en mascotas. Por ejemplo, Gamble et al. (14) observaron una disminución significativa del dolor y un aumento de las puntuaciones de actividad en perros cojos que recibieron una dosis de 2 mg/kg de peso corporal (PC) de aceite de CBD cada 12 h durante 4 semanas. Más recientemente, un estudio que exploró el impacto de una dosis única de 4 mg/kg de peso corporal de CBD en el estrés canino agudo observó un efecto mitigador del CBD sobre múltiples parámetros relacionados con el estrés cuando los perros estaban expuestos a la separación social o a los viajes en automóvil (20, 21).
En comparación con la investigación algo limitada que explora el efecto del CBD en los perros, el efecto del CBD en los gatos ha recibido aún menos atención. Tanto el estrés agudo como el crónico pueden hacer que los gatos muestren comportamientos temerosos y compulsivos, como la agresión, el escondite, el acicalamiento excesivo y la eliminación inapropiada (22). Tales comportamientos a menudo pueden conducir a una ruptura en el vínculo humano-animal, con algunos propietarios renunciando a su mascota (23). Por lo tanto, el suministro de productos que contienen CBD puede ofrecer una solución a algunos de estos problemas, reduciendo la respuesta al estrés de los gatos en tales situaciones y, por lo tanto, mitigando la realización de comportamientos indeseables.
Algunas investigaciones históricas han explorado la influencia del CBD dosificado ocularmente en gatos (24, 25) pero, hasta donde saben los autores, solo se han reportado cuatro estudios recientes que exploran el efecto del CBD en gatos sanos (15, 26-28). Estos estudios se centraron principalmente en la farmacocinética del CBD y se basaron en tamaños de muestra relativamente pequeños. Además, es poco probable que estos grupos pequeños y homogéneos de gatos sanos hayan sido plenamente representativos de la población general de gatos domésticos, lo que dificulta la generalización de los resultados de estos estudios.
Para abordar la falta de investigación en torno al uso de CBD en gatos, un estudio reciente (19) evaluó los efectos que una dosis diaria de 4 mg/kg de peso corporal de CBD, proporcionada como destilado de CBD sin THC, tenía en gatos adultos sanos durante un período de 26 semanas, para monitorear la seguridad a largo plazo de la suplementación con CBD. Se observó que los gatos sanos respondieron bien a la administración a largo plazo de CBD, sin que se informaran problemas de salud duraderos. Con el fin de ampliar esto, el estudio actual tenía como objetivo explorar el efecto que tenía una sola dosis oral de 4 mg/kg de peso corporal de CBD en las métricas fisiológicas y conductuales del estrés mostrado por los gatos durante un evento posterior que induce al estrés. Estudios anteriores han demostrado que los impactos fisiológicos y conductuales de los factores estresantes se pueden cuantificar utilizando medidas como el cortisol sérico, la temperatura corporal, la frecuencia cardíaca y la latencia para acercarse a un ser humano desconocido (29-33).
Por lo tanto, el primer objetivo de este estudio fue comprender el impacto de los viajes en un transportín para gatos y la introducción a una persona nueva en un entorno desconocido (denominados colectivamente como el paradigma del estrés) en las medidas de estrés felino. En segundo lugar, este estudio tenía como objetivo evaluar el efecto de una sola dosis de CBD (destilado de CBD sin THC) en la mitigación del estrés en gatos. Se planteó la hipótesis de que el paradigma de estrés seleccionado induciría cambios significativos en los indicadores conductuales y fisiológicos del estrés felino y que una sola dosis de CBD sería eficaz para aliviar estos cambios en los gatos, como se ha observado previamente en los perros (20).
Materiales y métodos
Animales y ganadería
Cuarenta gatos domésticos, adultos, sanos, de pelo corto (18 hembras esterilizadas y 22 machos castrados) con edades comprendidas entre 1,7 y 12,0 años ( ¯xx¯ = 7,1 años) fueron seleccionados para participar en este estudio, con base en un cálculo de potencia a priori. Todos los gatos fueron alojados en habitaciones interiores con entre 5 y 10 individuos (según la dinámica de grupo y el estilo de vida identificado como el más apropiado para esos gatos) en el Waltham Petcare Science Institute (Leicestershire, Reino Unido). Los gatos se alojaron en habitaciones aprobadas e inspeccionadas por el Ministerio del Interior del Reino Unido en virtud de la Ley de Animales (Procedimientos Científicos) de 1986. Antes de este estudio, los gatos estaban habituados a todos los equipos de muestreo, se les entrenaba para entrar en un transportín en el momento oportuno y se les sometía a un entrenamiento adecuado para facilitar la recolección de muestras de sangre. Además, los gatos estaban habituados a las habitaciones utilizadas para la recolección previa y posterior a la muestra antes del inicio del estudio, lo que requirió el transporte en el transportador montado en el carro utilizado en este estudio. Cuatro semanas antes de la prueba, todos los gatos utilizados en este estudio fueron pasados a la misma dieta de base estándar (alimento húmedo y seco Royal Canin Instinctive; Royal Canin, St Denis, Francia, Mars Incorporated) para minimizar cualquier variación potencial en la absorción de CBD. Los gatos se pesaron una semana después de su tratamiento para establecer una dosis adecuada de CBD en relación con el peso corporal individual. Los gatos no participaron en ningún estudio adicional durante este tiempo. Este estudio fue aprobado por el Waltham Animal Welfare and Ethical Review Body (AWERB: WAL 97671), que incluyó a dos miembros externos y totalmente independientes que son especialistas veterinarios reconocidos internacionalmente en bienestar y ética animal.
Suplementos y suministro de CBD y placebo
El destilado de CBD derivado del cáñamo y el aceite placebo utilizados en este estudio se adquirieron de Kazmira LLC (Colorado, Estados Unidos). El destilado derivado del cáñamo se diluyó con un aceite de girasol de grado alimenticio y se aromatizó con una mezcla de sabor natural tipo pollo asado al 1% (Apex flavors, Inc. Maryland, Estados Unidos), para producir un aceite de CBD con una concentración final de CBD de 43,76 mg/mL. Este aceite de CBD fue analizado por un laboratorio externo para realizar un análisis de espectro completo del contenido de cannabinoides (incluidos el CBD y el THC), los posibles contaminantes y la potencia (Botanacor Laboratories, Colorado, Estados Unidos). El contenido de THC estuvo por debajo del límite de detección analítica (<0,02 mg/mL) y no se detectaron otros cannabinoides, excepto trazas de cannabidivarina (estimadas en 0,17 mg/mL), que estuvieron por debajo del límite de cuantificación (0,32 mg/mL). El aceite placebo consistía en el mismo aceite de girasol de grado alimenticio con una mezcla de sabor natural tipo pollo asado al 1% (Apex flavors, Inc. Maryland, Estados Unidos).
Al menos un mes antes de la recopilación de datos, se examinó la palatabilidad del CBD en gatos para garantizar el éxito del consumo durante el estudio principal. Los gatos recibieron una dosis única de aceite de CBD (dosis de 4 mg/kg de peso corporal del aceite de CBD descrito anteriormente; en lo sucesivo, el tratamiento con CBD) mezclado con Sheba Creamy Snacks (sabor a pollo; Mars Incorporated, Verden, Alemania) que se ofrecían a su hora normal de alimentación en un recipiente separado de su alimento estándar. Treinta y siete gatos consumieron con éxito el aceite de CBD mezclado con los Sheba Creamy Snacks en su primera exposición. Sin embargo, tres gatos rechazaron el tratamiento con CBD. Por lo tanto, se exploraron estrategias de administración alternativas para estos individuos. Un gato consumió el aceite de CBD cuando se mezcló con 8 g de alimento húmedo Royal Canin Instinctive (Mars Incorporated, St Denis, Francia), mientras que otro lo consumió mezclado con 8 g de sopa de atún cremoso Sheba (Mars incorporated, Pak Chong, Tailandia). El gato restante requirió una dosis oral de aceite de CBD a través de una jeringa, e inmediatamente después se le proporcionó 8 g adicionales de alimento húmedo Royal Canin Instinct. Durante el ensayo principal, ocho gatos se negaron a consumir el tratamiento durante su segunda exposición al paradigma del estrés. Por lo tanto, estos gatos recibieron una dosis oral del aceite de CBD (cuatro gatos) o del aceite placebo (cuatro gatos), dependiendo de su asignación de tratamiento restante, a través de una jeringa con un alimento húmedo Royal Canin Instinct adicional de 8 g que se proporcionó inmediatamente después.
Diseño del estudio
El estudio principal se llevó a cabo durante un período de ocho semanas, de mayo a agosto de 2022, y utilizó un diseño cruzado equilibrado, ciego y aleatorio (Figura 1) en el que todos los gatos experimentaron un paradigma de estrés que consistía en viajar en un transportín montado en un carrito (Figura 2) y la introducción a una persona nueva en un entorno de prueba desconocido (Figura 3), en dos ocasiones distintas. Este diseño cruzado permitió que cada gato sirviera como su propio control. La exposición al paradigma del estrés se produjo con cuatro semanas de diferencia, una vez después de consumir una dosis única de 4 mg/kg de peso corporal de CBD y otra después de consumir un placebo (administrado de la misma manera que el tratamiento con CBD). Los tratamientos se administraron dos horas antes de las sesiones de prueba, basándose en farmocinéticos establecidos que indicaban la concentración plasmática media máxima de CBD dos horas después de la ingestión (19). El orden en el que se administraron los tratamientos con CBD y placebo a los gatos se asignó aleatoriamente y se aplicó el cegamiento a todos los participantes en el ensayo hasta después de que se completó el análisis de los datos. Antes del comienzo del estudio, se le pidió a un investigador de otro departamento que etiquetara el tratamiento con CBD como Y o Z, y que la etiqueta restante se asignara al placebo. A continuación, este investigador reveló qué tratamiento contenía CBD una vez finalizado el análisis.
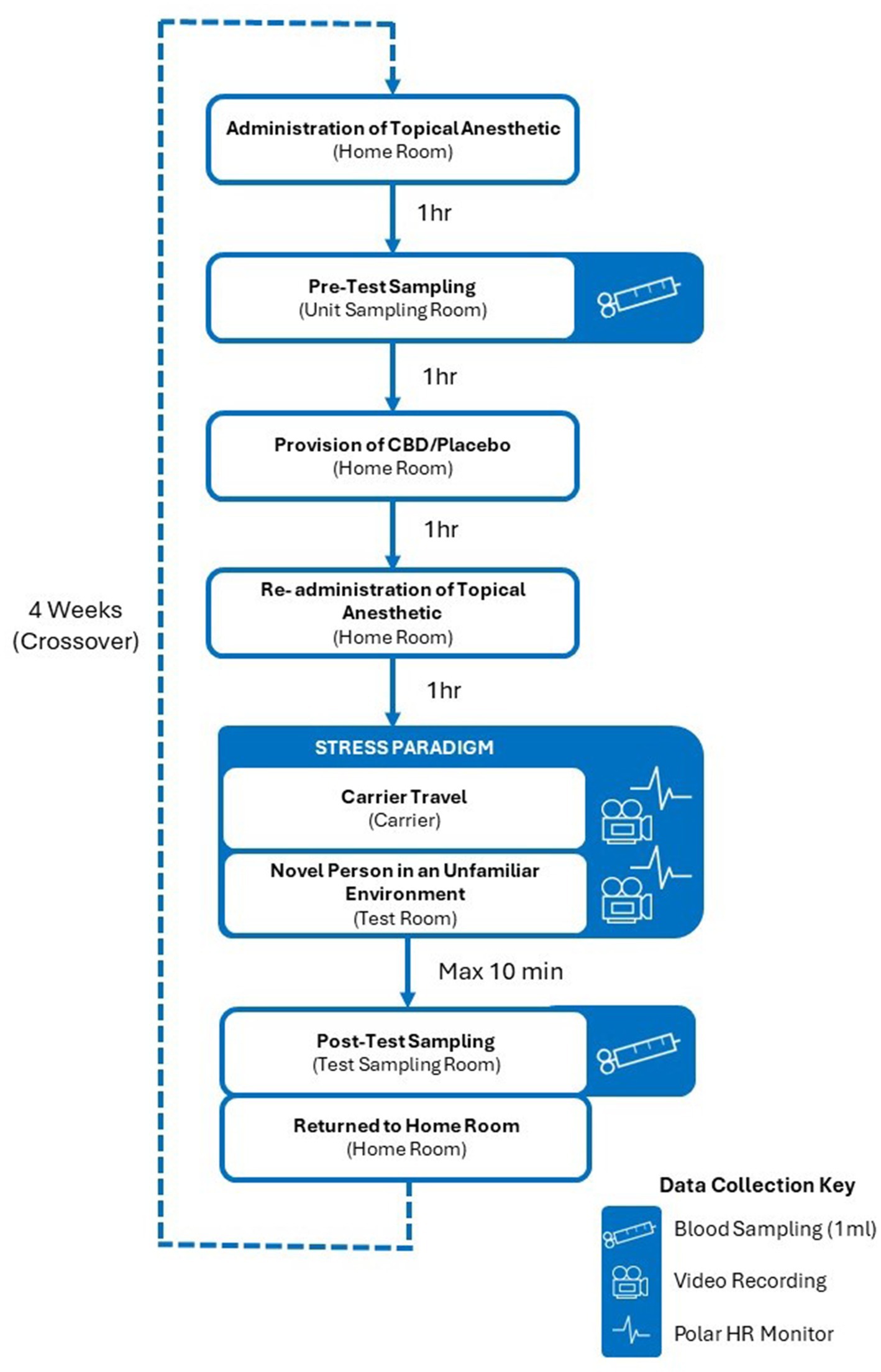


Se recopilaron varias medidas fisiológicas y conductuales del estrés felino a través de tecnología portátil, cámaras de video y muestras de sangre antes, durante y directamente después de las sesiones de prueba. Los gatos fueron monitoreados a través de video a lo largo de cada sesión de prueba para detectar signos de angustia y/o bienestar comprometido, según criterios de eliminación predefinidos. Ningún gato que fue muestreado con éxito durante el muestreo previo a la prueba, y por lo tanto pasó a experimentar el paradigma de estrés, necesitó ser eliminado del paradigma de estrés en ningún momento.
Muestreo previo a la prueba
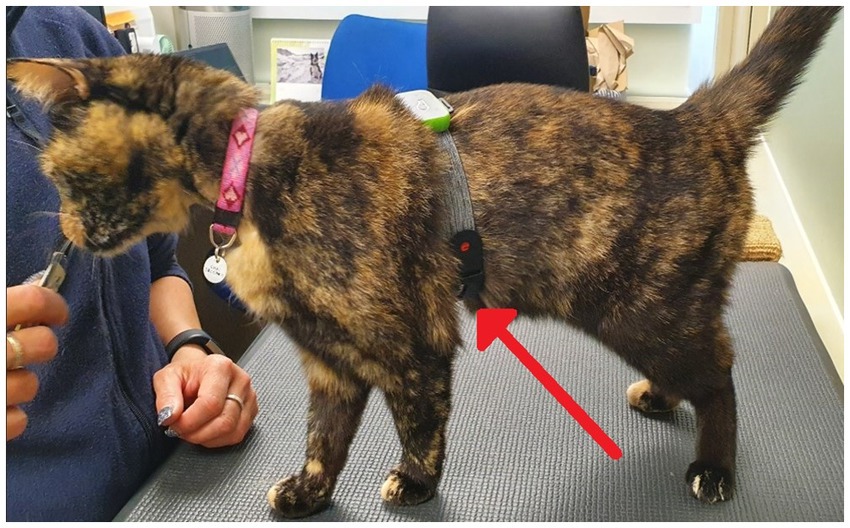
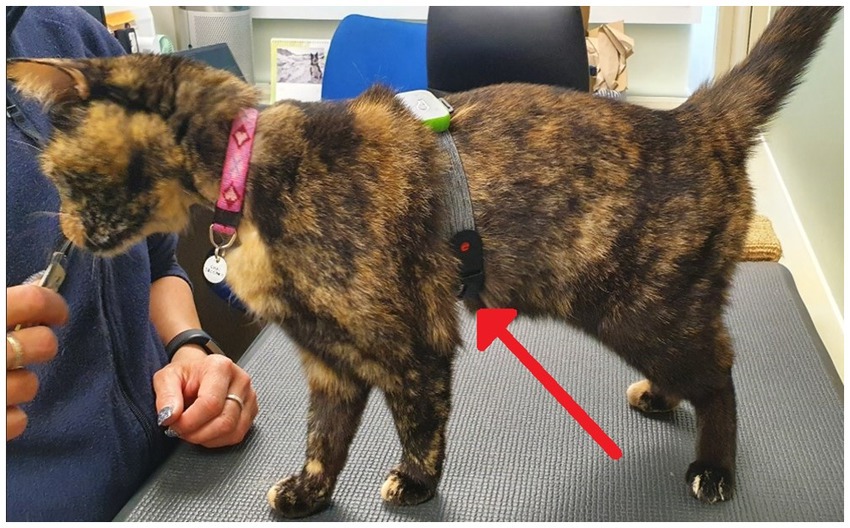
Antes de la recolección de muestras previas a la prueba, se afeitó un pequeño parche de cabello del sitio de la muestra de sangre (vena yugular o cefálica). El afeitado se llevó a cabo dentro de la sala de muestreo de la unidad doméstica de los gatos, ya sea el día anterior o la mañana de la prueba. Un mínimo de una hora antes de la toma de muestras, se aplicó un anestésico tópico (crema EMLA™ 5%, AstraZeneca, Reino Unido) en la piel de los gatos antes de cubrirla con un collar de tela ancha (Kitty Kollar™, Garrouzou Inc., Estados Unidos) en el caso de los gatos muestreados en el sitio de la yugular, o una envoltura suave y veterinaria para los gatos muestreados de la vena cefálica. para ayudar a asegurar la absorción de EMLA en la piel. Tres horas antes de la prueba, los gatos fueron transportados a una sala de muestreo en su unidad doméstica para el muestreo previo a la prueba y se recolectó una muestra de sangre de 1 mL de gatos para permitir la evaluación de las medidas iniciales de cortisol sérico, inmunoglobulina A (IgA) sérica y glucosa sérica (con la excepción de un gato individual, para quien no se intentó tomar muestras de sangre durante todo el ensayo debido a un historial de bajo éxito de muestreo). El anestésico tópico y la cubierta se volvieron a aplicar un mínimo de 1 hora antes de la prueba para la toma de muestras posteriores a la prueba. Se intentaron muestras de sangre, pero no se obtuvieron en gatos durante 9 situaciones de muestreo previas a la prueba (3 gatos para ambos tratamientos, 2 gatos solo durante el tratamiento con placebo y 1 gato solo durante el tratamiento con CBD). Estos gatos fueron devueltos a sus habitaciones de casa y no fueron alimentados con el tratamiento asignado, ni fueron expuestos al paradigma de estrés posterior. Los gatos muestreados con éxito fueron devueltos a su habitación de origen. Una hora después de la exitosa toma de muestras previas a la prueba, los gatos fueron alimentados con el tratamiento con CBD o placebo junto con su dieta estandarizada. Dos horas después del consumo, los gatos fueron equipados con un monitor óptico de frecuencia cardíaca Polar (Polar® Verity Sense Monitors, Polar Electro Oy, Kempele, Finlandia) para permitir la medición continua de la frecuencia cardíaca (FC) y la variabilidad de la frecuencia cardíaca (HRV) en todo el paradigma de estrés. Los monitores de frecuencia cardíaca Polar se aseguraron alrededor del pecho del gato con el brazalete provisto (Figura 4).
Paradigma del estrés
Dos horas después de que se administrara el tratamiento con CBD/placebo (es decir, inmediatamente después de que los gatos fueran equipados con el monitor de frecuencia cardíaca Polar), los gatos fueron transportados desde la sala de muestreo de su unidad doméstica a la nueva sala de pruebas dentro de un transportín de plástico estándar para gatos (W: 40 cm × D: 61 cm × H: 41 cm) que contenía una pequeña pieza de ropa de cama veterinaria antideslizante. que estaba montado de forma segura en un pequeño carro. A los gatos se les indicaba que entraran en la jaula de forma voluntaria, sin embargo, si un gato no respondía a la señal, eran recogidos de manera estandarizada y colocados en la jaula por una persona conocida. Al entrar en el transportador, se cerró la puerta y se subió al carro. A continuación, se aseguró en su lugar con dos cables elásticos cruzados. Se montó una cámara GoPro (GoPro Hero 7, San Mateo, CA, Estados Unidos) en la parte delantera del carrito, apuntando hacia la parte delantera del transportín para capturar imágenes de video del gato. El viaje duró aproximadamente 6 minutos y siguió una de las tres rutas estandarizadas (incluido el movimiento al aire libre entre edificios) dependiendo de la ubicación de la sala de muestreo de la unidad doméstica de los gatos.
La sala de pruebas era desconocida para todos los gatos y estaba equipada con una cámara GoPro montada temporalmente (GoPro Hero 9, San Mateo, CA, Estados Unidos) y una cámara de techo instalada permanentemente (ELP-USBFHD01M, Ailipu Technology Inc., Shenzen, China). Antes de la prueba, una de las 17 personas nuevas (1 hombre y 16 mujeres), vestida con un mono amarillo fluorescente de alta visibilidad y un casco amarillo, se sentó en una silla dentro de la habitación. Se aplicaron al suelo marcas que indicaban una distancia de 1 m y 0,5 m de la silla. Durante las pruebas, la temperatura ambiente se mantuvo entre 19 ± 2 °C. Al llegar al lugar de prueba, un transportín fue levantado por un manipulador del carro y colocado 2 m directamente frente a la nueva persona. Una vez que el cuidador salió de la habitación, la nueva persona se levantó, se acercó a la jaula para gatos, abrió la puerta e inmediatamente volvió a sentarse en la silla. Los gatos pudieron moverse libremente por la sala de pruebas durante 5 minutos. Después de 5 minutos, la persona novelesca se agachó frente a la silla, frente al gato y animó al gato a acercarse a ellos (si el gato aún no estaba en contacto con la persona novelesca). Para animar al gato, la nueva persona extendió su mano hacia el gato y dijo: («Hola<nombre del gato>»). Si el gato ya estaba a su alcance o se acercaba a la nueva persona, la persona acariciaba al gato de la cabeza a la cola tres veces durante los 30 segundos restantes de la prueba. Si el gato no se acercaba, o si el gato permanecía dentro de la jaula, la nueva persona permanecía en la posición agachada durante los 30 segundos restantes y continuaba animando al gato a acercarse. Después de 30 segundos, el guía volvió a entrar en la habitación y se le indicó al gato que regresara a la jaula si aún no estaba adentro. Si el gato no respondía a la señal, el cuidador recogía al gato y lo colocaba en la jaula. Posteriormente, los gatos fueron transportados a una sala de muestreo adyacente para la recolección de muestras posteriores a la prueba.
Muestreo posterior a la prueba
Se recolectó una muestra de sangre adicional de 1 mL un máximo de 10 min después de la finalización del paradigma de estrés. Se entregaron recompensas de alto valor (incluyendo atún enlatado y hierba gatera) a los gatos después del muestreo posterior a la prueba, para minimizar la formación de asociaciones negativas. A continuación, los gatos fueron devueltos a su unidad doméstica utilizando el transportín montado en el carro siguiendo la ruta más directa posible.
Medidas fisiológicas y conductuales
Cortisol sérico, inmunoglobulina A y glucosa
Se recogieron un total de 70 muestras de sangre antes de la prueba (tratamiento con CBD = 36, tratamiento con placebo = 34), mientras que se recogieron un total de 61 muestras de sangre después de la prueba (tratamiento con CBD = 29, tratamiento con placebo = 32). Las cuatro muestras de prueba se recolectaron con éxito para 26 gatos. Las muestras de sangre se recogieron en un tubo sérico activador de coágulos y se mantuvieron en hielo durante un máximo de 60 minutos antes de ser alícuotas para el análisis de IgA, cortisol y glucosa. Las alícuotas de cortisol e IgA se almacenaron a -20 °C en preparación para análisis posteriores. El cortisol sérico se examinó utilizando el inmunoensayo de cortisol de parámetros™ de R&D Systems (bio-techne, Minneapolis, Estados Unidos) según el protocolo del fabricante con una variación intraensayo del <10%. El análisis de la IgA se realizó utilizando un Abcam, IgA Cat ELISA kit (Boston, Estados Unidos), siguiendo el protocolo proporcionado por el fabricante. La glucosa sérica se cuantificó en un analizador de química clínica AU480 (Beckman Coulter, High Wycombe, Reino Unido) utilizando reactivos de glucosa Beckman Coulter (OSR6121), calibradores séricos (66300) y material de control de calidad (ODC0003 & ODC0004) según las instrucciones del fabricante. Las muestras se agruparon mediante controles de calidad previos y posteriores al análisis, lo que proporcionó una variación intraensayo de <2 × desviación estándar. Dos muestras de tratamiento de CBD previas a la prueba no se pudieron analizar debido a que se obtuvieron muestras incompletas. Además, una muestra de tratamiento con CBD previa a la prueba y una muestra de tratamiento con placebo previa a la prueba solo pudieron analizarse para detectar IgA, debido al volumen sanguíneo limitado.
Frecuencia cardíaca, variabilidad de la frecuencia cardíaca
A los gatos se les colocó un monitor de frecuencia cardíaca polar para capturar la frecuencia cardíaca (FC) a través de tecnología óptica durante las partes de «viaje de portador» y «persona nueva en un entorno desconocido» del paradigma. Los datos de FC se convirtieron posteriormente en variabilidad de la frecuencia cardíaca (VFC), que se calculó como la raíz cuadrada media de las diferencias sucesivas entre latidos cardíacos normales (RMSSD).
Puntuación de estrés del gato
Las imágenes de video recopiladas de la GoPro conectada a la parte delantera del transportín para gatos durante el transporte fueron analizadas por dos evaluadores capacitados que estaban familiarizados con el comportamiento de los gatos y estaban ciegos al tratamiento recibido. Puntuaciones de estrés del gato (CSS; (34)) se obtuvieron a intervalos de 30 s para todas las sesiones grabadas. La escala CSS permite a los observadores puntuar el lenguaje corporal de un gato entre 1 (completamente relajado) y 7 (aterrorizado), centrándose en cada una de las siguientes áreas corporales observables: cuerpo, estómago, patas, cola, cabeza, ojos, pupilas, orejas y bigotes, así como la presencia de vocalizaciones y niveles de actividad corporal completa (Tabla suplementaria S1). Se generaron once puntuaciones CSS instantáneas por vídeo y se promediaron para producir una puntuación CSS media general entre 1 y 7 por individuo para cada uno de los dos codificadores. También se pidió a los codificadores que volvieran a puntuar cinco videos seleccionados al azar dos veces más para calcular la confiabilidad intra-evaluador.
Evaluación cualitativa del comportamiento
Durante la parte del paradigma del estrés de «persona nueva en un entorno desconocido», se evaluaron una serie de atributos de comportamiento de los gatos mediante una evaluación cualitativa del comportamiento (QBA). El QBA se desarrolló y modificó utilizando términos recopilados de los QBA utilizados en estudios previos que evaluaron el bienestar en perros de refugio (35) y perros durante viajes en automóvil (20, 36). Se incluyeron términos adicionales («Afectuoso», «Confiado», «Amistoso», «Frustrado» y «Sospechoso») para cumplir con los requisitos del presente estudio. Se utilizó un conjunto final de 23 términos para calificar la respuesta conductual de los gatos al estar en una habitación desconocida con una persona nueva (Tabla 1). Tres evaluadores ciegos y entrenados que estaban familiarizados con el comportamiento de los gatos calificaron los QBA utilizando los videos grabados por la GoPro montada temporalmente en la sala de pruebas.
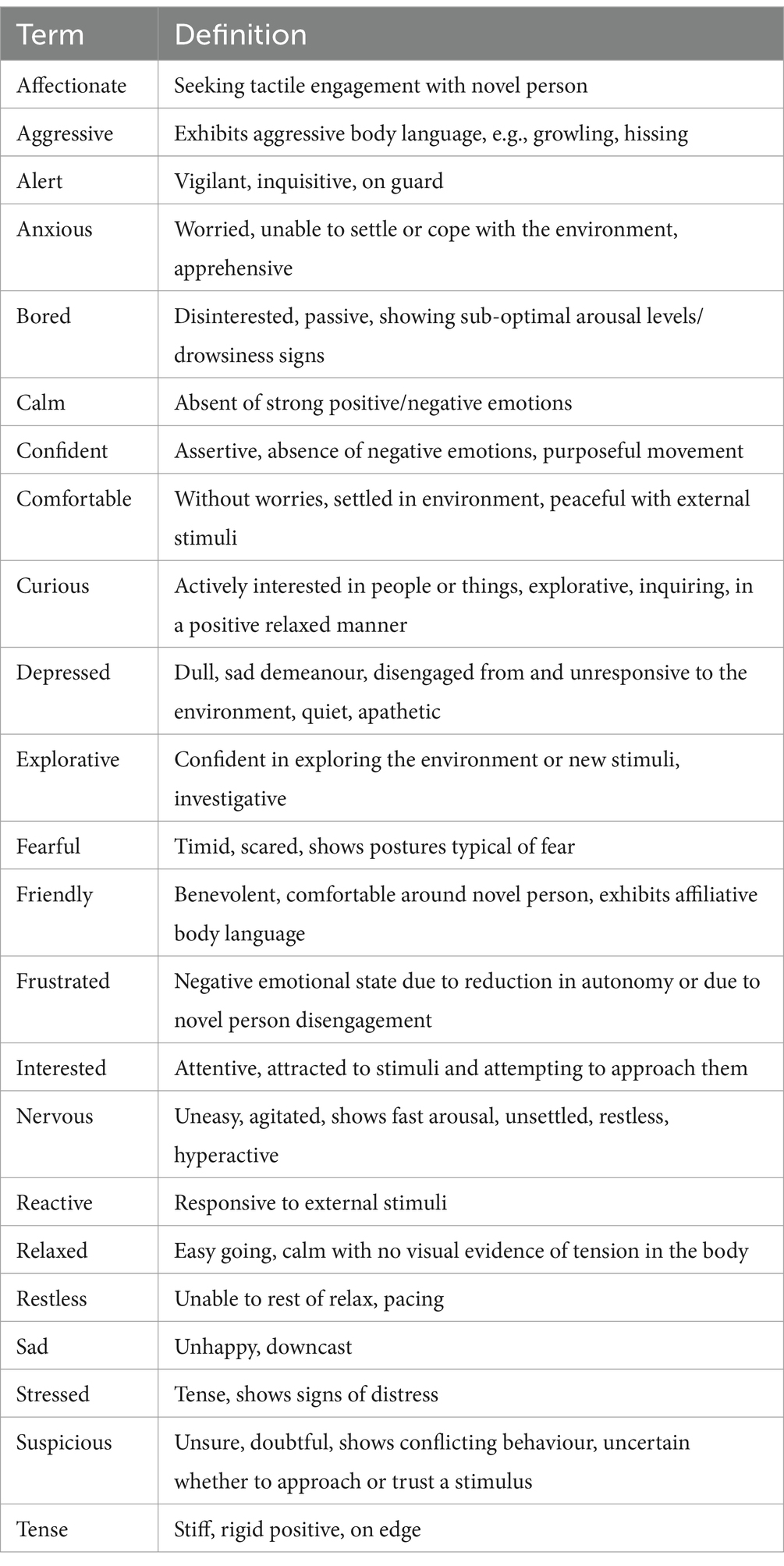
Cada evaluador completó un formulario en línea para cada video, que comprendía una Escala Visual Analógica (EVA) que iba de 0 a 125 colocada junto a cada término. El extremo izquierdo de la escala EVA correspondió a la puntuación mínima posible (0), que representaba la cualidad expresiva indicada por el término estando totalmente ausente en el gato. Por otro lado, el extremo derecho de la escala representaba una puntuación máxima (125), lo que significa que la calidad indicada por el término estaba fuertemente presente en ese gato. Se instruyó a los evaluadores para que vieran los videos y seleccionaran un punto a lo largo del EVA que consideraran apropiado para cada término inmediatamente después de que terminara el video. Los valores numéricos asociados con el punto seleccionado en la escala no eran visibles para el evaluador. Además, se seleccionaron cinco videos al azar y todos los observadores los volvieron a ver dos veces para calcular la confiabilidad dentro del evaluador.
Comportamientos codificados adicionales
El comportamiento de los gatos, incluida la latencia para acercarse a la nueva persona durante la parte de «persona nueva en un entorno desconocido» del paradigma del estrés, fue codificado por dos evaluadores entrenados utilizando videos recopilados por las cámaras de video montadas en la sala de pruebas. Cada codificador anotó los comportamientos específicos de los gatos (Tabla 2) a partir de las imágenes utilizando el software «The Observer XT 15».
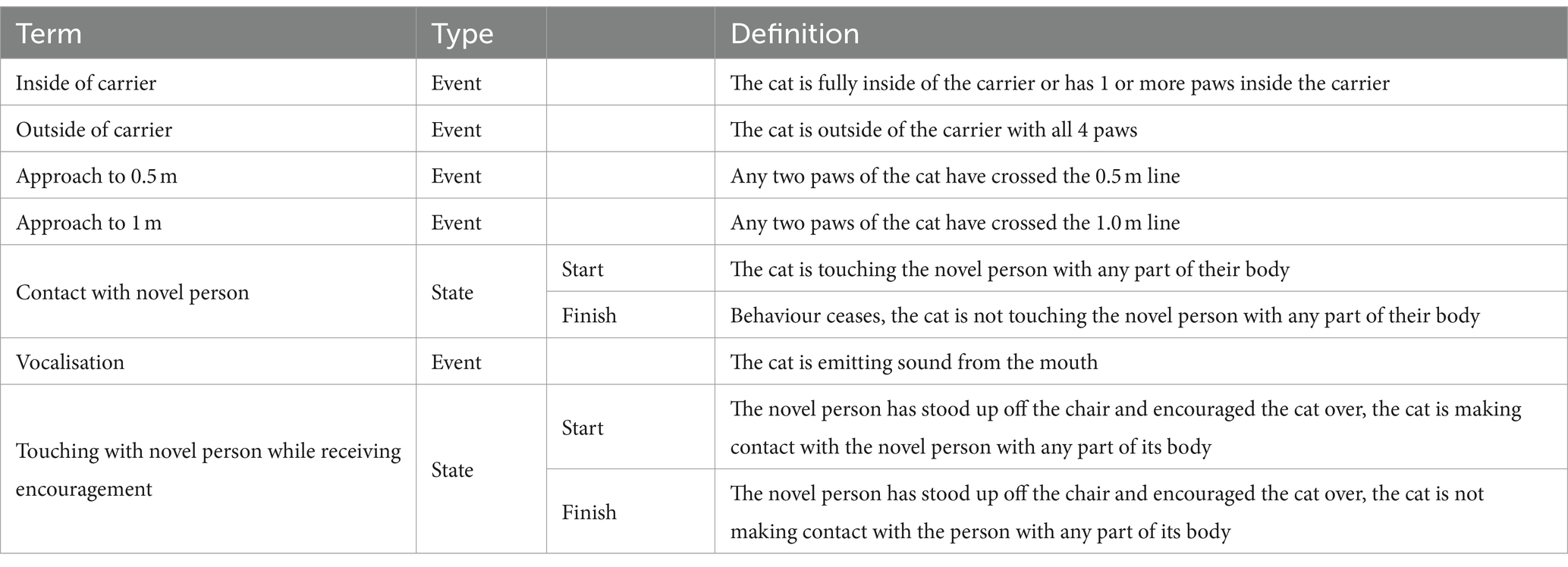
La codificación del comportamiento de los videos comenzó desde el momento en que la nueva persona abrió el soporte y terminó 5 minutos y 30 segundos después. Para calcular la confiabilidad entre evaluadores, ambos evaluadores codificaron nueve videos seleccionados al azar. Para calcular la confiabilidad dentro del evaluador, cada evaluador recodificó cinco videos seleccionados al azar dos veces más.
Análisis estadístico
Todos los análisis se realizaron en R versión 4.2.2 (The R Foundation for Statistical Computing). La fiabilidad inter e intra-evaluador de los CSS, las puntuaciones QBA y la codificación conductual se evaluó mediante coeficientes de correlación interclase (ICC) utilizando modelos de efectos mixtos bidireccionales. Se utilizó la concordancia de consistencia para la confiabilidad entre evaluadores, y la concordancia absoluta para la confiabilidad intraevaluador. Las calificaciones de la ICC se consideraron malas, moderadas, buenas o excelentes con base en las pautas sugeridas por Koo y Li ((37); Excelente: ICC > 0,90, Bueno: 0,75 < ICC < 0,90, Moderado: 0,50 < ICC < 0,75, Pobre: ICC < 0,5).
Todas las medidas, con la excepción de las puntuaciones individuales de QBA (es decir, cortisol, IgA, glucosa, VFC media, FC media y máxima, CSS medio, duración de las vocalizaciones realizadas, duración del tiempo pasado en el portador, duración del tiempo pasado en contacto con la nueva persona sin recibir estímulo, duración del tiempo dedicado a tocar a la nueva persona mientras recibe aliento, latencia hasta acercarse a 1,0 m, y latencia hasta aproximarse a 0,5 m) se evaluaron utilizando modelos lineales de efectos mixtos (LMEM). Todos los modelos incluyeron un efecto fijo para el tratamiento y un efecto aleatorio para el gato (solo intercepción). Los modelos de medidas fisiológicas incluyeron efectos fijos adicionales; en los casos de cortisol, IgA y glucosa para el punto de tiempo de muestreo (es decir, antes frente a después de la prueba), más la interacción bidireccional entre el tratamiento y el punto de tiempo, y en el caso de las mediciones de frecuencia cardíaca polar (FC y VFC), para la parte del paradigma que se registra (es decir, «viaje del portador» frente a «persona nueva en un entorno de prueba desconocido»), más la interacción bidireccional entre la parte del paradigma y el tratamiento. Los modelos para CSS y comportamientos codificados adicionales no incluyeron efectos adicionales.
En el caso de las medidas recogidas solo en puntos temporales (es decir, medidas conductuales), se realizaron comparaciones planificadas por pares entre los grupos de tratamiento. Para las medidas recopiladas en múltiples puntos de tiempo (es decir, medidas fisiológicas, FC y VFC), se realizaron comparaciones planificadas por pares entre los grupos de tratamiento para cada punto de tiempo y entre los puntos de tiempo para cada grupo de tratamiento. Los valores p informados para las diferencias entre pares y los intervalos de confianza del 95% para las estimaciones medias se corrigieron FWE (es decir, para comparaciones múltiples) dentro de los modelos, pero no entre ellos, para cada variable de resultado utilizando el enfoque de «un solo paso» predeterminado de la función glht.
Debido a que los residuos del modelo no transformados violaban gravemente la suposición de normalidad, se llevaron a cabo modelos para varias variables (es decir, IgA, VFC media, duración de las vocalizaciones y duración del tiempo en contacto con extraños) en datos transformados log10. En estos casos, las estimaciones medias informadas se transformaron hacia atrás y las diferencias se informaron como cambios de pliegue (es decir, proporciones). Las puntuaciones de QBA se analizaron utilizando un enfoque exploratorio multivariante, ajustando un análisis de componentes principales (ACP) a los datos y luego trazando por condición de tratamiento y por animal para visualizar las diferencias. Los dos componentes primarios mejor ajustados (PC1 y PC2; descritos a continuación) se extrajeron y modelaron adicionalmente utilizando el mismo método LMEM descrito anteriormente.
Resultados
Cortisol, IgA y glucosa séricos
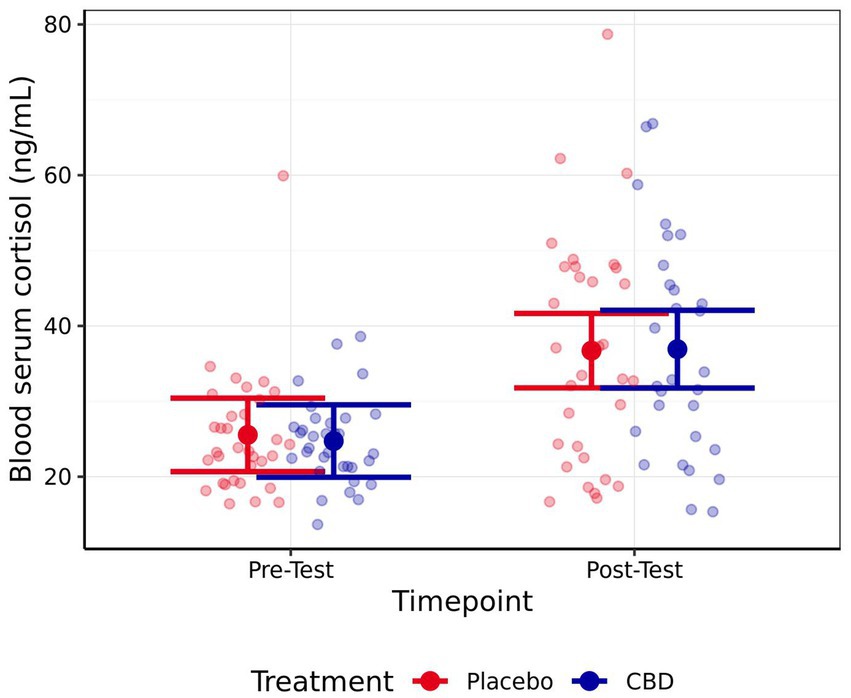
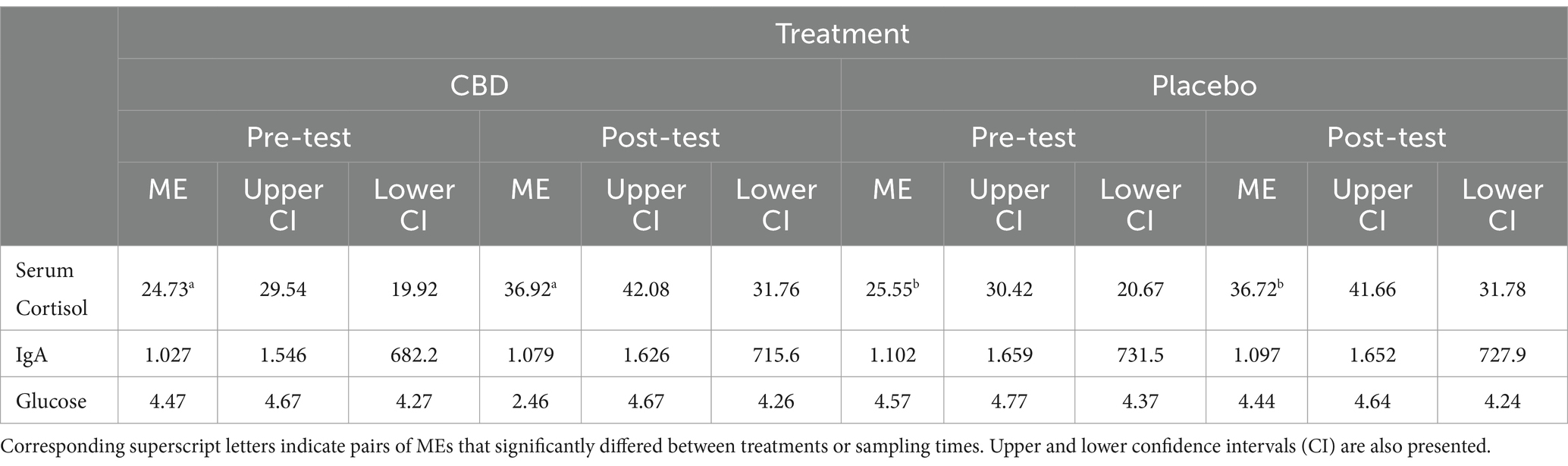
No se observaron diferencias significativas en el cortisol entre el tratamiento con CBD y el tratamiento con placebo en el momento previo a la prueba (z = 0,34, p = 0,98) o posterior (z = −0,08, p > 0,99) (Figura 5). Sin embargo, los gatos demostraron niveles de cortisol significativamente más altos durante las muestras posteriores a la prueba en comparación con las muestras previas a la prueba, independientemente del tratamiento (CBD z = 4,93, p < 0,001; Placebo z = 4,64, p < 0,001). No se observaron diferencias significativas entre las muestras pre o post-test en ninguna de las IgA séricas (CBD z = 1,09, p = 0,64; Placebo z = −0,10, p > 0,99) o glucosa (CBD z = −0,07, p > 0,99; Placebo z = −1,39, p = 0,44). Además, no se observaron diferencias significativas entre los tratamientos para estas medidas, en ninguno de los dos puntos temporales (IgA: Z basal = 1,61, p = 0,31; Postest z = 0,35, p = 0,98; Glucosa: Z basal = 1,10, p = 0,64; Postest z = −0,21, p > 0,99). Las estimaciones medias de cortisol, IgA y glucosa séricas se presentan en la Tabla 3.
Frecuencia cardíaca y variabilidad de la frecuencia cardíaca
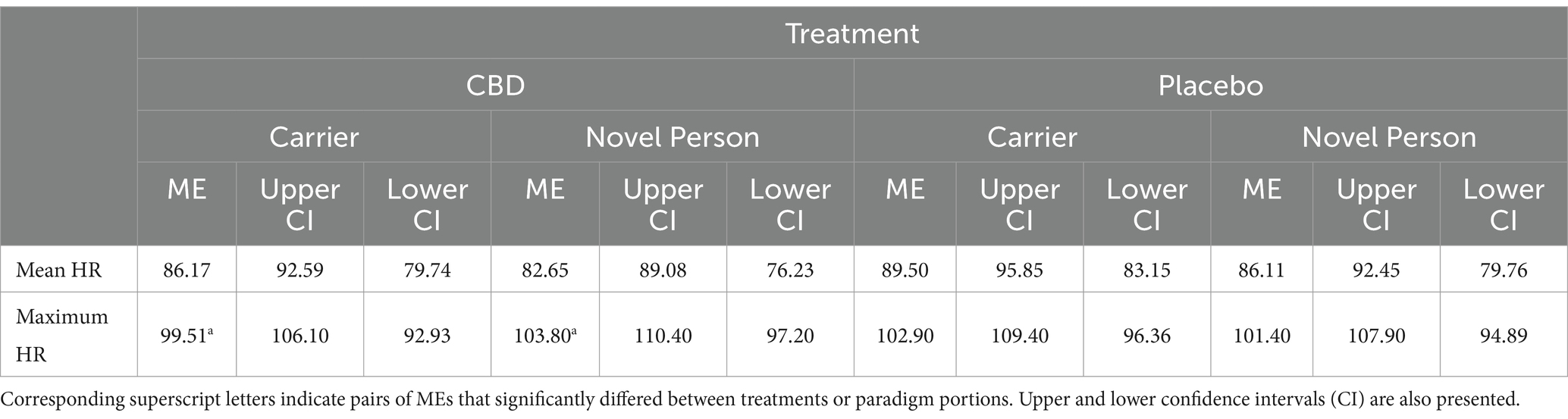
Ni la frecuencia cardíaca media ni la máxima difirieron significativamente entre ninguna de las partes del paradigma de estrés, ni entre el tratamiento proporcionado (todos |z| < 1,35, p > 0,40; las estimaciones medias se presentan en la Tabla 4). La VFC media fue significativamente mayor para la «persona nueva en un entorno desconocido» que para la parte de «viaje de portador» del paradigma de estrés para el tratamiento con CBD, pero no para el tratamiento con placebo (CBD z = 4,01, p < 0,001; Placebo z = 2,04, p = 0,14; Figura 6). Las diferencias en la VFC media entre el tratamiento con CBD y el placebo no fueron significativas para cada parte del paradigma (tanto p > 0,05), pero se evidenció una tendencia en la parte del paradigma de «persona nueva en un entorno desconocido» para una mayor VFC después del tratamiento con CBD en comparación con el placebo (z = -2,36, p = 0,06; lo que representa una reducción del 23% en la estimación de la VFC para el tratamiento con placebo frente al CBD).
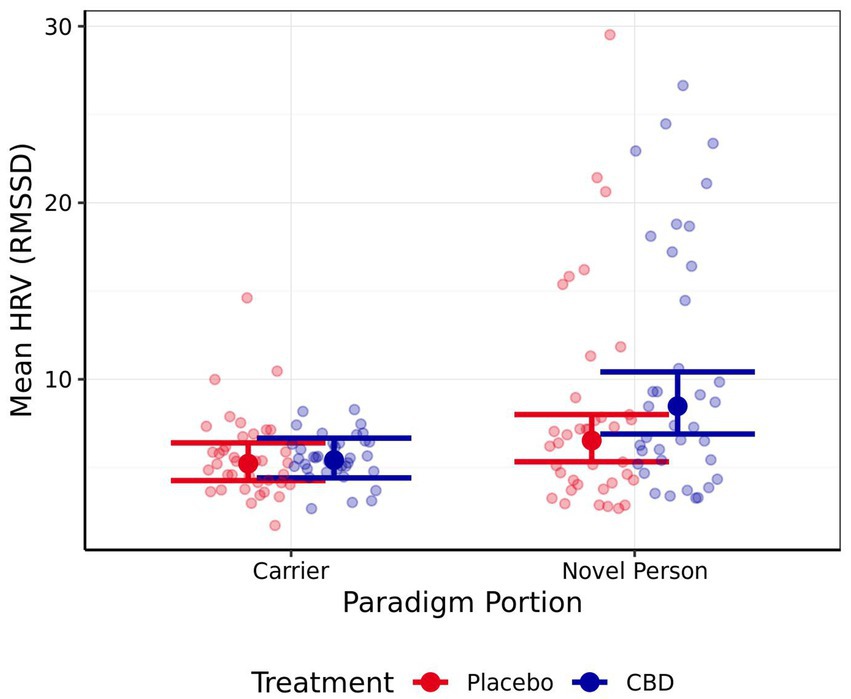
Puntuación de estrés del gato
Al explorar el CSS, se observó que la confiabilidad entre evaluadores e intraevaluadores era buena y excelente, respectivamente. Por lo tanto, se tomó una puntuación CSS promedio de ambos codificadores, para producir una puntuación CSS promedio general para cada video de «viaje de portador», que osciló entre 2 (débilmente relajado) y 4.2 (muy tenso). No se evidenciaron diferencias significativas en el CSS durante la parte del «viaje del portador» del paradigma entre el tratamiento con CBD y placebo (z = −0,57, p = 0,57; las estimaciones medias se presentan en la Tabla Suplementaria S2).
Evaluación cualitativa del comportamiento
No se disponía de datos de QBA durante 13 sesiones de «persona nueva en un entorno desconocido» durante las cuales el gato no pudo abandonar el transportín y, por lo tanto, no fue visible en la cámara. Estos incluyeron ambas sesiones de tratamiento para cinco gatos, solo la sesión de tratamiento con placebo para dos gatos y solo la sesión de tratamiento con CBD para un gato.
La fiabilidad entre evaluadores para los términos individuales de QBA varió de pobre («Agresivo», «Alerta», «Aburrido», «Curioso», «Deprimido», «Frustrado», «Interesado», «Reactivo», «Triste») a moderado («Afectuoso», «Ansioso», «Calma», «Cómodo», «Confiado», «Explorativo», «Temeroso», «Amistoso», «Nervioso», «Relajado», «Inquieto», «Estresado», «Sospechoso», «Tenso»). La confiabilidad intra-evaluador para los términos individuales varió de mala a excelente dependiendo del término y del evaluador. Sobre la base de estos resultados, se eliminó un evaluador (Evaluador 1) del análisis de los datos de QBA, y solo se utilizaron las calificaciones de los dos evaluadores restantes para un análisis posterior. Además, los términos «Alerta» y «Reactivo» se eliminaron del QBA debido a la escasa fiabilidad interna del evaluador. La confiabilidad entre evaluadores se repitió para los dos evaluadores restantes, revelando una excelente confiabilidad para los términos «Afectuoso» y «Sospechoso», una buena confiabilidad para los términos «Ansioso», «Confiado», «Cómodo», «Explorativo», «Amistoso», «Nervioso», «Inquieto», «Estresado», «Tenso», una confiabilidad moderada para los términos «Aburrido», «Callado», «Curioso», «Temeroso», «Frustrado», «Interesado», «Relajado», y una confiabilidad pobre para los términos «Agresivo», «Deprimido», «Triste».
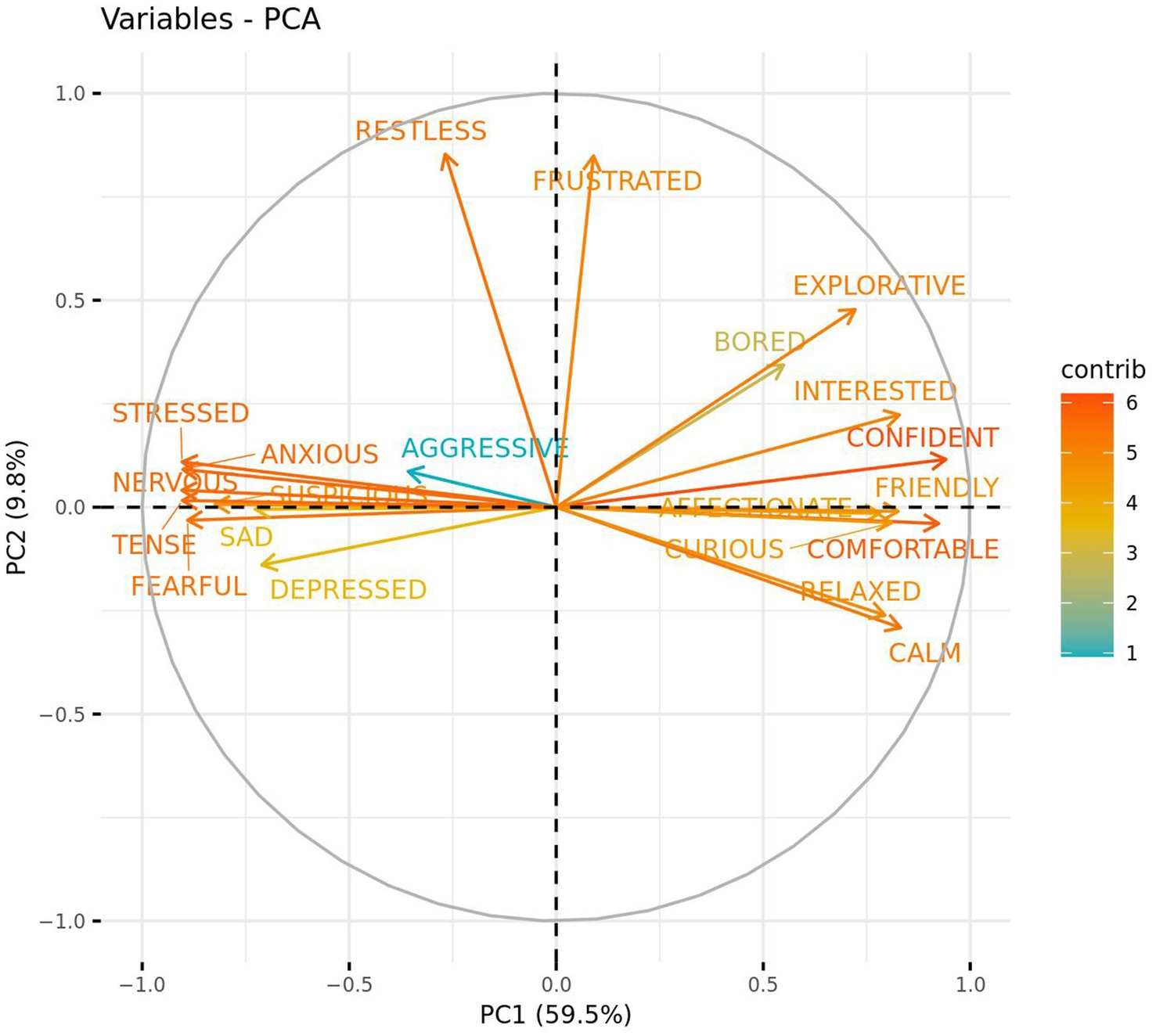
Dos componentes principales (PC1 y PC2) de los datos de QBA se extrajeron mediante el uso de un PCA y parecían representar emociones positivas frente a negativas (PC1-59,5%) y comportamiento activo frente a pasivo (PC2-9,8%). Utilizando un corte de carga de >|0.50|, QBA puntúa para «Confiado», «Cómodo», «Tranquilo», «Interesado», «Amistoso», «Curioso», «Relajado», «Afectuoso», «Explorativo» y «Aburrido» cargado positivamente en PC1, mientras que «Nervioso», «Estresado», «Tenso», «Ansioso», «Temeroso», «Sospechoso», «Triste» y «Deprimido» cargado negativamente. PC2 demostró una carga positiva para las puntuaciones de QBA «Inquieto» y «Frustrado» (Figura 7). También se calcularon los ICC después de la PCA con el fin de evaluar la fiabilidad inter e intraevaluador de PC1 y PC2. La confiabilidad entre evaluadores fue buena para PC1 y PC2. La confiabilidad intra-evaluador para PC1 fue excelente para los dos codificadores restantes, y para PC2 fue buena para el Evaluador 2 y excelente para el Evaluador 3.
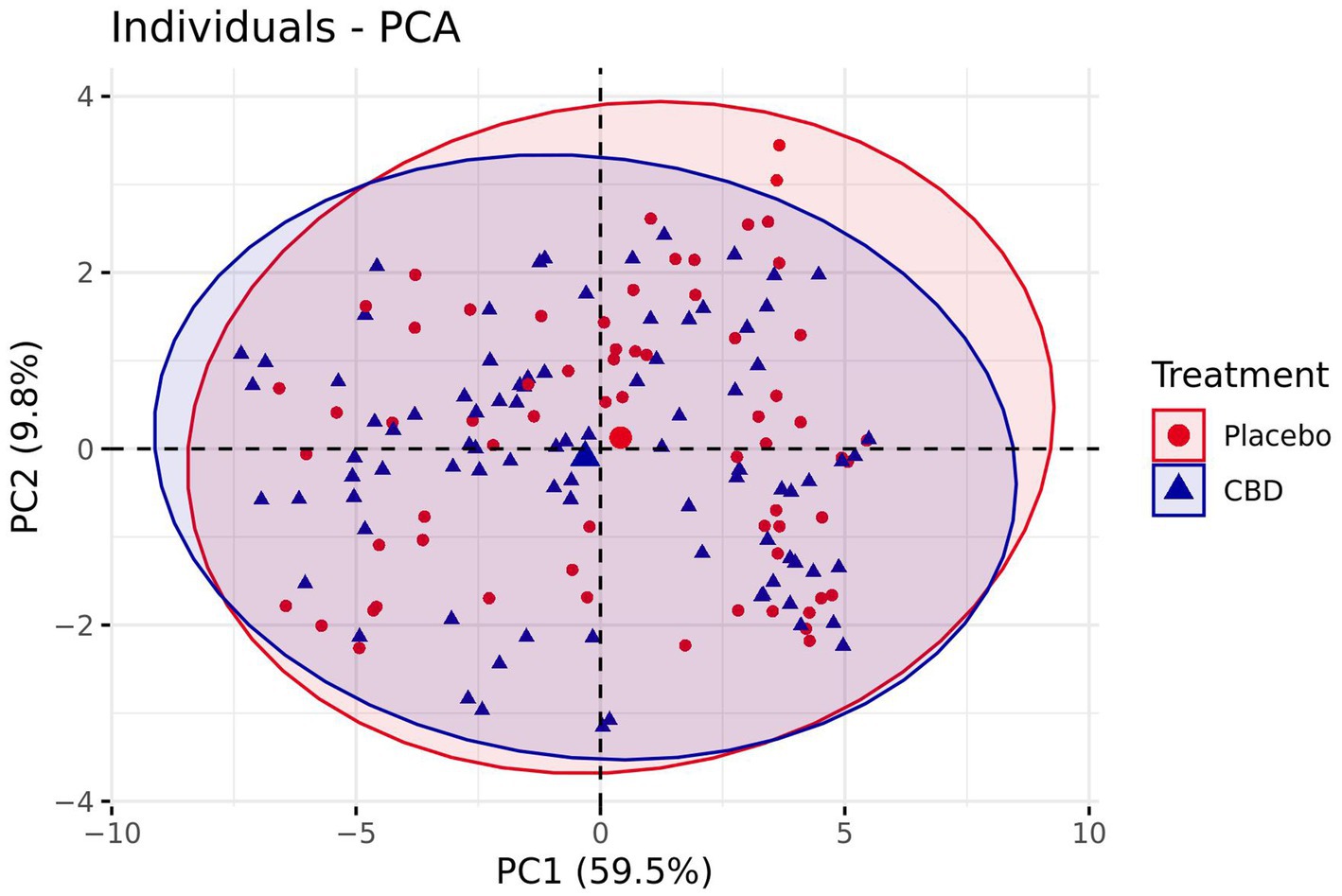
El trazado de las puntuaciones de los componentes individuales reveló muy poca separación entre los grupos de tratamiento, con un sesgo insignificante hacia una emoción más positiva después del tratamiento con placebo, y las elipses de datos se superpusieron considerablemente (Figura 8). Además, el modelo no reveló diferencias significativas entre el grupo de tratamiento con placebo y CBD para PC1 (z = −0,98, p = 0,33) o PC2 (z = −0,22, p = 0,83). Las estimaciones medias para PC1 y PC2 se presentan en la Tabla Suplementaria S2.
Comportamientos codificados adicionales
La fiabilidad entre evaluadores fue excelente para todos los comportamientos codificados. Además, la fiabilidad intra-evaluador fue excelente para los dos codificadores para todos los comportamientos, con la excepción del «contacto con la nueva persona», que fue bueno para un evaluador. No se observó ningún efecto significativo del tratamiento para ninguno de los comportamientos codificados durante la parte del paradigma del estrés «persona nueva en un entorno de prueba desconocido» (todos |z| < 1,4, p > 0,10; las estimaciones medias se presentan en la Tabla Suplementaria S2).
Discusión
El objetivo de este estudio fue investigar el impacto de proporcionar una dosis única de destilado de CBD en las medidas de estrés felino cuando los gatos fueron expuestos a una secuencia de eventos estresantes, es decir, viajar en un transportín para gatos seguido de conocer a una persona nueva en un entorno desconocido. El cortisol sérico aumentó significativamente después de la exposición al paradigma del estrés, lo que sugiere que estos eventos fueron estresantes para esta población de gatos. Sin embargo, no se observaron diferencias significativas en esta respuesta cuando los gatos recibieron un tratamiento con CBD en comparación con cuando se les proporcionó un placebo. Del mismo modo, no se observó ningún efecto del CBD sobre la IgA o la glucosa séricas.
No se observaron diferencias significativas en la FC media o máxima entre ninguna de las partes del paradigma de estrés. Además, no se observó ningún efecto del CBD sobre la TROP. Sin embargo, se demostró que la VFC media era significativamente mayor para la parte de «persona nueva en un entorno desconocido» que para la parte de «viaje de portador» cuando los gatos recibieron el tratamiento con CBD. Se ha considerado que la reducción de la VFC representa un estado emocional más negativo en los perros (38), lo que puede sugerir que los gatos a los que se les administró CBD tuvieron una experiencia más positiva durante la parte del paradigma del estrés de «persona nueva en un entorno de prueba desconocido» que en la parte del «viaje del portador». Cabe señalar, sin embargo, que las medias estimadas para la FC media y máxima a lo largo de este estudio (FC media; ¯xx¯ = 86 ± SD 16 latidos/min, FC máxima = ¯xx¯102 ± DE 16 latidos/min) fueron comparativamente bajos en comparación con lo que normalmente se espera para los gatos en un entorno doméstico no estresante, medido mediante un electrocardiograma (HR medio: ¯xx¯ = 132 ± SD19 latidos/min; (39)). Debido a que este estudio requería que los gatos estuvieran conscientes y completamente móviles, se seleccionó el esternón como la ubicación óptima para colocar los monitores ópticos de frecuencia cardíaca Polar. Sin embargo, un estudio que exploró la idoneidad de diferentes ubicaciones corporales para el uso de la fotopletismografía en gatos anestesiados sugirió que la lengua era el lugar óptimo para medir la frecuencia del pulso, con el esternón resultando en baja potencia de señal y curtosis (40). Esto puede explicar por qué se encontró que más del 25% de las lecturas de FC para 16 de las 150 sesiones de registro de FC no estaban disponibles para el análisis. Estas limitaciones en torno al uso del monitor óptico de FC en el esternón sugieren que los resultados relacionados con la FC y la VFC dentro de este estudio deben interpretarse con precaución. Los estudios futuros deben investigar la idoneidad y la ubicación de los monitores ópticos de FC en gatos, explorar formas alternativas de medir la FC y/o considerar umbrales aceptables para la integridad de los datos de FC necesarios para una inclusión válida en los análisis finales.
Además de la CRI, no se observó ningún efecto significativo del tratamiento en ninguna de las métricas conductuales recogidas. Es posible que el efecto limitado del CBD tanto en el comportamiento como en la fisiología de los gatos observado en este estudio fuera el resultado de la dosis proporcionada. Investigaciones anteriores en perros observaron que una sola dosis oral de 4 mg/kg de peso corporal de CBD fue eficaz para influir positivamente en algunos indicadores de estrés canino agudo cuando los perros estuvieron expuestos a eventos inductores de estrés (20). Sin embargo, durante un estudio que exploró la farmacocinética del CBD en perros y gatos, Deabold y sus colegas (15) observaron que la cinética de absorción de una dosis de 2 mg/kg de CBD en gatos dio como resultado una concentración sérica máxima de aproximadamente una quinta parte de lo observado en perros (gatos = 43 ng/mL SE ± 9; perros = 302 ng/mL SE ± 63). Los gatos también parecieron mostrar un tiempo de retención más largo que los perros (gatos = 3,5 ± 1,4 h, perros = 1,4 ± 0,3 h) y una vida media de CBD de 2,4 h. Estos hallazgos sugieren que la absorción de CBD a base de aceite es menor en los gatos que en los perros y que puede ser necesaria una dosis mayor para inducir un efecto farmacológico o conductual similar. Sin embargo, debe tenerse en cuenta que estudios más recientes en gatos han observado concentraciones medias máximas de CBD en suero más altas ((26); 236 ng/mL DE ± 193; (27); 282 ng/mL DE ± 149) que los observados por Deabold et al. (15). De acuerdo con esto, Coltherd et al. (19) observaron una concentración máxima media de CBD sérico de 251 ng/mL 95%CL: 108,7-393,4 cuando se utilizaba una dosis de CBD y una matriz de administración idénticas a las utilizadas en este estudio. Es probable que estas diferencias se deban a la variación de las dosis, la acumulación de CBD en el plasma sanguíneo en dosis repetidas, la variación en la matriz utilizada para la administración de CBD (es decir, aceite MCT, aceite de pescado, pasta a base de alimentos, etc.) y la presencia de otros cannabinoides además del CBD (26-28).
Múltiples estudios han sugerido un «efecto séquito» en el que los cannabinoides adicionales y otros compuestos que se encuentran en el cannabis pueden interactuar con el CBD y posiblemente aumentar su absorción (41, 42). Además, Rozental et al. (28) sugieren que, debido a su naturaleza como fármaco soluble en lípidos, la variación en la condición corporal y el contenido de grasa de los gatos individuales pueden afectar al potencial de retención de CBD en el cuerpo. Por lo tanto, se sugiere que todos los estudios futuros que exploren la eficacia del CBD en gatos deberían considerar el control de las concentraciones séricas de CBD para tener en cuenta la variación individual en la absorción de CBD.
También pueden haber surgido inconsistencias en la dosis de CBD durante el estudio actual debido a la naturaleza viscosa del aceite de CBD utilizado. A menudo se observaron restos del aceite de CBD después de la alimentación en las placas y dentro de la jeringa de dosificación oral, lo que sugiere que los gatos pueden no haber recibido la dosis de CBD prevista. Además, en un estudio anterior se observó una respuesta conductual negativa a la administración de CBD en gatos que sacudían la cabeza y lamían en exceso (15). Kulpa y sus colegas (26) sugieren que estos efectos negativos pueden ser el resultado de una aversión inmediata al sabor o al olor del aceite de CBD. Si bien no se observaron tales reacciones durante este estudio, varios gatos se negaron a consumir voluntariamente su tratamiento (tanto CBD como placebo) antes de su segunda exposición al paradigma del estrés. Esto puede deberse al desarrollo de una asociación negativa entre la administración del tratamiento y el sabor del propio CBD, el sabor del aceite de girasol aromatizado utilizado para crear los tratamientos de CBD y placebo, o incluso el paradigma de estrés posterior. Si bien se requiere más investigación sobre la razón de estos rechazos, existe la posibilidad de que futuros estudios exploren métodos para aumentar la palatabilidad del CBD para los gatos.
La variación entre la respuesta del individuo al paradigma del estrés se explicó, en parte, en este estudio mediante el uso de un diseño experimental cruzado de orden aleatorio, en el que el gato individual se trató como un efecto aleatorio dentro del análisis. Sin embargo, es posible que la variación en el temperamento individual o los estilos de afrontamiento hayan afectado a la eficacia del tratamiento con CBD. Cabe destacar que durante este estudio se observó una gran variación en las respuestas individuales al paradigma del estrés. Se ha sugerido que la respuesta de un gato al estrés no solo depende del entorno en el que vive, sino también de su temperamento individual (22). El temperamento se define típicamente como el comportamiento de un individuo que es estable a través del tiempo y las situaciones (43) y depende tanto de la composición genética de un individuo como de las experiencias tempranas de la vida (22). Por ejemplo, algunos estudios han observado una influencia del color de la raza e incluso del pelaje en la sociabilidad de los gatos (44, 45). Además, se ha descubierto que rasgos de personalidad conocidos como «Tímido», «Suave», «Tímido», «Juguetón», «Activo» y «Curioso», afectan los estilos de respuesta de los gatos en pruebas que exploran la latencia para acercarse a una persona desconocida (33). Por lo tanto, es posible que las diferencias en el temperamento de los individuos hayan inducido variaciones en respuesta al paradigma de estrés utilizado en este estudio. Desafortunadamente, este estudio no pudo considerar completamente (y tener en cuenta) el efecto de la variación en los estilos de afrontamiento de los gatos en la efectividad del CBD. La ausencia de datos de referencia sobre el comportamiento de los gatos utilizados en este estudio puede haber limitado nuestra capacidad para explorar completamente el impacto del CBD en el comportamiento de los gatos. Sin embargo, en este caso, es posible que estos datos de referencia no hayan sido informativos debido a la falta de estandarización y la variabilidad de las condiciones entre los entornos domésticos de los gatos y la sala de pruebas. Reconocemos el valor de medir el comportamiento antes de la exposición a un paradigma de estrés y nos esforzaremos por llevarlo a cabo en futuros estudios relevantes.
También hay que tener en cuenta que, aunque este estudio utilizó un tamaño de muestra considerablemente mayor que los que han explorado previamente el efecto del CBD en los estados afectivos de los gatos, se debe tener cuidado de minimizar la generalización de estos resultados a poblaciones de gatos más amplias. Todos los individuos utilizados en este estudio se criaron en un centro de investigación y, por lo tanto, es posible que no hayan demostrado temperamentos o estilos de afrontamiento representativos de la población general de gatos domésticos.
A pesar de estas limitaciones, este estudio ha demostrado que la exposición combinada de los gatos a un «viaje de portador» y a una «persona nueva en un entorno desconocido» tuvo éxito en inducir una respuesta fisiológica al estrés en los gatos, como lo indica un aumento en el cortisol sérico, y por lo tanto puede considerarse adecuada para su uso como factor estresante en estudios futuros. Aunque no se observó ningún efecto positivo del CBD en las respuestas al estrés conductual o fisiológico de los gatos durante este estudio, ha puesto de manifiesto múltiples aspectos adicionales de la eficacia del CBD que deben explorarse. Se aconsejaría a los futuros estudios que tengan como objetivo investigar el uso del CBD en cualquier especie de mascota que consideren más a fondo la relación entre el temperamento y la respuesta conductual al CBD, además del impacto farmacocinético de incluir otros fitocannabinoides no psicoactivos dentro del compuesto de CBD.
Conclusión
Los resultados de este estudio sugieren que el uso de CBD en una dosis de 4 mg/kg de peso corporal no fue eficaz para tener un impacto positivo en la respuesta al estrés de los gatos que experimentaron viajar en un transportín para gatos y conocer a una persona nueva en una habitación desconocida. Sin embargo, estos eventos tuvieron éxito en provocar una respuesta significativa al estrés en esta población de gatos, como lo demuestra el cortisol plasmático elevado. Se requiere más investigación para determinar si las diferencias en los rasgos de personalidad de los gatos y las estrategias de afrontamiento enmascararon la influencia del CBD a lo largo de este ensayo. Además, se debe explorar la tasa de absorción de CBD y los efectos tanto del tamaño como de la frecuencia de la dosis en la respuesta al estrés, idealmente en una variedad de otras situaciones potencialmente inductoras de estrés felino.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo se pondrán a disposición previa solicitud razonable, sujeto a las restricciones legales y prácticas aplicables.
Declaración ética
El estudio fue aprobado por el organismo de revisión de ética y bienestar animal de Waltham (PPM 97671), que incluyó la revisión de voluntarios humanos en estudios de investigación con animales. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
JW: Administración de proyectos, Visualización, Redacción – borrador original, Redacción – revisión y edición. HF: Conceptualización, Curación de datos, Análisis formal, Metodología, Visualización, Redacción – revisión y edición. AH: Conceptualización, Metodología, Administración de proyectos, Redacción, revisión y edición. ZE: Análisis formal, Redacción – revisión y edición. TK: Conceptualización, Metodología, Supervisión, Redacción – revisión y edición.
Financiación
El (los) autor(es) declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Los autores declaran que este estudio recibió financiación de Mars Petcare. El financiador no participó en el diseño del estudio, la recopilación, el análisis, la interpretación de los datos, la redacción de este artículo ni la decisión de presentarlo para su publicación.
Reconocimientos
Los autores desean agradecer al personal y a las mascotas del Waltham Petcare Science Institute por hacer posible este estudio. En particular, nos gustaría agradecer a Megan Atkinson por su apoyo técnico en la recopilación de datos. También extendemos nuestro agradecimiento a todos los que sirvieron como personas novedosas durante el paradigma del estrés felino.
Conflicto de intereses
JW, HF, AH, ZE y TK son empleados de Mars Petcare UK, un fabricante de alimentos para mascotas y proveedor de atención veterinaria.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1476296/full#supplementary-material
Referencias
1. Yu, CHJ y Rupasinghe, HPV. Productos naturales de salud a base de cannabidiol para animales de compañía: avances recientes en el manejo de la ansiedad, el dolor y la inflamación. Res Vet Sci. (2021):38–46. doi: 10.1016/j.rvsc.2021.08.001
2. Plata, RJ . El sistema endocannabinoide de los animales. Animales. (2019) 9:686. doi: 10.3390/ani9090686
3. Iuvone, T, Esposito, G, De Filippis, D, Scuderi, C, y Steardo, L. Cannabidiol: ¿un fármaco prometedor para los trastornos neurodegenerativos? SNC Neurosci Ther. (2009):65–75. doi: 10.1111/j.1755-5949.2008.00065.x
4. Blessing, EM, Steenkamp, MM, Manzanares, J y Marmar, CR. Cannabidiol como tratamiento potencial para los trastornos de ansiedad. Neuroterapéutica. (2015):825–36. doi: 10.1007/s13311-015-0387-1
5. Russo, EB, Guy, GW y Robson, PJ. Cannabis, dolor y sueño: lecciones de los ensayos clínicos terapéuticos de Sativex, un medicamento a base de cannabis. Biobuzos químicos. (2007) 4:1729–43.
6. Shannon, S, Lewis, N, Lee, H y Hughes, S. Cannabidiol en la ansiedad y el sueño: una gran serie de casos. Perm J. (2019):23. doi: 10.7812/TPP/18-041
7. Jurkus, R, Day, HLL, Guimarães, FS, Lee, JLC y Bertoglio, LJ. Stevenson CW. Regulación del cannabidiol del miedo aprendido: implicaciones para el tratamiento de los trastornos relacionados con la ansiedad. Frente Pharmacol. (2016):7. doi: 10.3389/fphar.2016.00454
8. Resstel, LBM, Joca, SRL, Moreira, FA, Corrêa, FMA y Guimarães, FS. Efectos del cannabidiol y el diazepam en las respuestas conductuales y cardiovasculares inducidas por el miedo condicionado contextual en ratas. Behav Brain Res. (2006) 172:294–8. doi: 10.1016/j.bbr.2006.05.016
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Hazekamp, A . El problema con el aceite de CBD. Cannabinoides del cannabis medicinal. Karger AG , (2018). 65–72, doi: 10.1159/000489287
10. Hartsel, JA, Boyar, K, Pham, A, Silver, RJ y Makriyannis, A. Cannabis en medicina veterinaria: terapias con cannabinoides para animales. Nutracéuticos en medicina veterinaria. Cham, Suiza: Springer International Publishing; (2019). 121–155
11. De Briyne, N, Holmes, D, Sandler, I, Stiles, E, Szymanski, D, Moody, S, et al. Cannabis, aceites de cannabidiol y tetrahidrocannabinol: ¿qué deben saber los veterinarios? Animales. (2021):1–19. doi: 10.3390/ani11030892
12. Greb, A, y Puschner, B. Tratados cannabinoides como terapia complementaria para mascotas: lagunas en nuestro conocimiento. Toxicol Commun. (2018) 2:10–4. doi: 10.1080/24734306.2018.1434470
13. Bartner, LR, McGrath, S, Rao, S, Hyatt, LK y Wittenburg, LA. Farmacocinética del cannabidiol administrado por 3 métodos de administración en 2 dosis diferentes a perros sanos. Can J Vet Res. (2018) 82:178–83.
14. Gamble, LJ, Boesch, JM, Frye, CW, Schwark, WS, Mann, S, Wolfe, L, et al. Farmacocinética, seguridad y eficacia clínica del tratamiento con cannabidiol en perros artríticos. Frente Vet Sci. (2018):5. doi: 10.3389/fvets.2018.00165
15. Deabold, KA, Schwark, WS, Wolf, L y Wakshlag, JJ. Farmacocinética de dosis única y evaluación preliminar de seguridad con el uso de nutracéuticos de cáñamo ricos en CBD en perros y gatos sanos. Animales. (2019) 9. doi: 10.3390/ani9100832
16. Vaughn, D, Kulpa, J y Paulionis, L. Investigación preliminar de la seguridad de las dosis crecientes de cannabinoides en perros sanos. Frente Vet Sci. (2020):7. doi: 10.3389/fvets.2020.00051
17. Wakshlag, JJ, Schwark, WS, Deabold, KA, Talsma, BN, Cital, S, Lyubimov, A, et al. Farmacocinética del cannabidiol, ácido cannabidiólico, Δ9-tetrahidrocannabinol, ácido tetrahidrocannabinólico y metabolitos relacionados en suero canino después de la dosificación con tres formas orales de extracto de cáñamo. Frente Vet Sci. (2020):7. doi: 10.3389/fvets.2020.00505
18. Bradley, S, Young, S, Bakke, AM, Holcombe, L, Waller, D, Hunt, A, et al. La alimentación diaria a largo plazo con cannabidiol es bien tolerada por los perros sanos. Frente Vet Sci. (2022) 9:977457. doi: 10.3389/fvets.2022.977457
19. Coltherd, JC, Bednall, R, Bakke, AM, Ellerby, Z, Newman, C, Watson, P, et al. Los gatos sanos toleran la alimentación diaria a largo plazo con cannabidiol. Frente Vet Sci. (2024):10. doi: 10.3389/fvets.2023.1324622
20. Hunt, ABG, Flint, HE, Logan, DW y King, T. Una sola dosis de cannabidiol (CBD) influye positivamente en las medidas de estrés en los perros durante la separación y los viajes en coche. Frente Vet Sci. (2023) 10:153. doi: 10.3389/fvets.2023.1112604
21. Flint, HE, Hunt, ABG, Logan, DW y King, T. La dosis diaria de cannabidiol (CBD) demuestra un efecto positivo en las medidas de estrés en los perros durante la exposición repetida a los viajes en automóvil. J Anim Sci. (2024):102. doi: 10.1093/jas/skad414
22. Amat, M, Camps, T y Manteca, X. Estrés en gatos con dueño: cambios de comportamiento e implicaciones para el bienestar. J Feline Med Surg. (2016):577–86. doi: 10.1177/1098612X15590867
23. Strickler, BL y Shull, EA. Una encuesta del propietario sobre juguetes, actividades y problemas de comportamiento en gatos de interior. J Vet Behav Clin Appl Res. (2013) 9:207–14. doi: 10.1016/j.jveb.2014.06.005
24. Colasanti, BK, Craig, CR y Allara, RD. Presión intraocular, toxicidad ocular y neurotoxicidad después de la administración de cannabinol o cannabigerol. Exp Eye Res. (1984) 39:251–9. doi: 10.1016/0014-4835(84)90013-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Colasanti, BK, Brown, RE, y Craig, CR. Hipotensión ocular, toxicidad ocular y neurotoxicidad en respuesta al extracto de marihuana y cannabidiol. Gen Pharmacol Vasc S. (1984) 15:479–84. doi: 10.1016/0306-3623(84)90202-7
26. Kulpa, JE, Paulionis, LJ, Eglit, GML y Vaughn, DM. Seguridad y tolerabilidad de dosis crecientes de cannabinoides en gatos sanos. J Feline Med Surg. (2021) 23:1162–75. doi: 10.1177/1098612X211004215
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Wang, T, Zakharov, A, Gómez, B, Lyubimov, A, Trottier, NL, Schwark, WS, et al. Evaluación farmacocinética en estado estacionario de cannabinoides séricos de 24 h y 1 semana en gatos utilizando una pasta de cáñamo rica en CBD/CBDA. Frente Vet Sci. (2022):9. doi: 10.3389/fvets.2022.895368
28. Rozental, AJ, Gustafson, DL, Kusick, BR, Bartner, LR, Castro, SC y McGrath, S. Farmacocinética de la administración creciente de dosis única de cannabidiol a gatos. J Vet Pharmacol ther. (2023) 46:25–33. doi: 10.1111/jvp.13100
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Kry, K, y Casey, R. El efecto del enriquecimiento oculto sobre los niveles de estrés y el comportamiento de los gatos domésticos (Felis sylvestris catus) en un entorno de refugio y las implicaciones para el potencial de adopción. Anim Welf. (2007) 16:375–83. doi: 10.1017/S0962728600027196
30. Quimby, JM, Smith, ML y Lunn, KF. Evaluación de los efectos del estrés de la visita al hospital sobre los parámetros fisiológicos del gato. J Feline Med Surg. (2011) 13:733–7. doi: 10.1016/j.jfms.2011.07.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Stella, J, Croney, C y Buffington, T. Efectos de los factores estresantes en el comportamiento y la fisiología de los gatos domésticos. Appl anim behav sci. (2013) 143:157–63. doi: 10.1016/j.applanim.2012.10.014
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Nibblett, BM, Ketzis, JK y Grigg, EK. Comparación del estrés exhibido por los gatos examinados en una clínica frente a un entorno doméstico. Appl anim behav sci. (2015) 173:68–75. doi: 10.1016/j.applanim.2014.10.005
33. Stella, J, y Croney, C. Estilos de afrontamiento en el gato doméstico (Felis silvestris catus) e implicaciones para el bienestar de los gatos. Animales. (2019) 9:E370. doi: 10.3390/ani9060370
34. Kessler, MR, y Turner, DC. Estrés y adaptación de gatos (Felis silvestris catus) alojados individualmente, en parejas y en grupos en criaderos. Anim Welf. (1997) 6:243–54. doi: 10.1017/S0962728600019837
35. Arena, L, Wemelsfelder, F, Messori, S, Ferri, N y Barnard, S. Desarrollo de una lista fija de términos para la evaluación cualitativa del comportamiento de los perros de refugio. PLoS Uno. (2019) 14:212652. doi: 10.1371/journal.pone.0212652
36. King, T, Flint, HE, Hunt, ABG, Werzowa, WT y Logan, DW. Efecto de la música sobre los parámetros de estrés en perros durante un simulacro de visita veterinaria. Animales. (2022) 12:E187. doi: 10.3390/ani12020187
37. Koo, TK y Li, MY. Una guía para seleccionar y reportar coeficientes de correlación intraclase para la investigación de confiabilidad. J Chiropr Med. (2016) 15:155–63. doi: 10.1016/j.jcm.2016.02.012
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Katayama, M, Kubo, T, Mogi, K, Ikeda, K, Nagasawa, M y Kikusui, T. La variabilidad de la frecuencia cardíaca predice el estado emocional en los perros. Proceso de comportamiento. (2016) 128:108–12. doi: 10.1016/j.beproc.2016.04.015
39. Abbott, JA . Frecuencia cardíaca y variabilidad de la frecuencia cardíaca de gatos sanos en entornos domésticos y hospitalarios. J Feline Med Surg. (2005) 7:195–202. doi: 10.1016/j.jfms.2004.12.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Cugmas, B, Štruc, E y Spigulis, J. Fotopletismografía en perros y gatos: una selección de sitios de medición alternativos para un monitor de mascotas. Physiol Meas. (2019):40. doi: 10.1088/1361-6579/aaf433
41. Anand, U, Pacchetti, B, Anand, P y Sodergren, MH. Medicamentos a base de cannabis y dolor: una revisión de los posibles efectos sinérgicos y séquitos. Manejo del dolor. (2021):395–403. doi: 10.2217/PMT-2020-0110
42. Ferber, SG, Namdar, D, Hen-Shoval, D, Eger, G, Koltai, H, Shoval, G, et al. El «efecto séquito»: terpenos junto con cannabinoides para el tratamiento de los trastornos del estado de ánimo y los trastornos de ansiedad. Curr Neuropharmacol. (2019) 18:87–96. doi: 10.2174/1570159X17666190903103923
43. Travnik, IDC, Machado, DDS, Gonçalves, LDS, Ceballos, MC y Sant’Anna, AC. Temperamento en gatos domésticos: una revisión de los mecanismos próximos, los métodos de evaluación, sus efectos en las relaciones entre humanos y gatos, y el bienestar de uno. Animales. (2020) 10:1516. doi: 10.3390/ani10091516
44. Pontier, D, Rioux, N, y Heizmann, A. Evidencia de selección en el alelo naranja en el gato doméstico Felis catus: el papel de la estructura social. Oikis. (1995) 73:299–308. doi: 10.2307/3545954
Palabras clave: Cannabidiol, cbd, gato, estrés, ansiedad, comportamiento, bienestar animal
Cita: Weller JE, Flint HE, Hunt ABG, Ellerby Z y King T (2024) Investigación del efecto que tiene una dosis única de cannabidiol en las medidas de estrés en gatos cuando son transportados en un transportador y se encuentran con una persona nueva en un entorno desconocido. Frente. Vet. Sci. 11:1476296. doi: 10.3389/fvets.2024.1476296
Recibido: 05 de agosto de 2024; Aceptado: 16 de septiembre de 2024;
Publicado: 04 Noviembre 2024.
Editado por:
Bárbara Padalino, Universidad de Bolonia, Italia
Revisado por:
Xavier De Jaeger, Ceva Santé Animale, Francia
James Edward Brereton, Sparsholt College, Reino Unido
Derechos de autor Esta obra está escrita por Weller, Flint, Hunt, Ellerby y King. © 2024 Mars Petcare UK y sus afiliados. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Tammie King, Tammie.King@effem.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía