Características histopatológicas del PRRS y perfiles de expresión de receptores virales en el sistema inmune de los lechones
 Hong Chen1
Hong Chen1 Na Chen1
Na Chen1 Hongbo Chen1
Hongbo Chen1 Zefang Zhao1
Zefang Zhao1 Jiayao Yang1
Jiayao Yang1 Jianbo Sol1
Jianbo Sol1 Hanmei Li1
Hanmei Li1 Rihua Cong1
Rihua Cong1 Hailong Liu2*
Hailong Liu2* Tengfei Liu1*
Tengfei Liu1* Shulin Chen1*
Shulin Chen1*- 1Departamento de Medicina Veterinaria Básica, Facultad de Medicina Veterinaria, Universidad del Noroeste A&F, Yangling, China
- número arábigoInstituto de Ciencia Animal y Medicina Veterinaria, Academia de Ciencias Agrícolas de Hainan, Haikou, China
El síndrome reproductivo y respiratorio porcino (PRRS) es una enfermedad viral altamente contagiosa que causa importantes pérdidas económicas a la industria porcina en todo el mundo. La infección por el virus del PRRS (PRRSV) es un proceso de endocitosis y replicación mediado por receptores. El objetivo de este estudio fue determinar la localización y expresión de cuatro importantes receptores de PRRSV en órganos inmunológicos de lechones. Después de que los lechones se infectaron con PRRSV, se utilizó tinción de hematoxilina y eosina, inmunofluorescencia y Western blot para realizar el examen histopatológico y el análisis de distribución de receptores. Los resultados mostraron que el PRRSV causó graves daños a los órganos inmunitarios de los lechones, incluida la atrofia del timo y la inflamación de los ganglios linfáticos. Las lesiones histopatológicas se observaron principalmente en pulmón y ganglio linfático y se caracterizaron por neumonía intersticial, colapso de folículos, agotamiento de los centros germinales y hemorragia extensa. Los resultados de la tinción de inmunofluorescencia y del Western blot mostraron que los receptores de CD163 y NMHCII-A se distribuyeron principalmente en el timo, los ganglios linfáticos hiliares y los ganglios linfáticos mesentéricos. Sin embargo, los receptores de Sn y vimentina se expresaron en niveles bajos en los órganos inmunes de los lechones. La distribución de los cuatro receptores en los órganos inmunes estaba más concentrada en la corteza, pero más dispersa en la médula. En comparación con el grupo de control, la expresión relativa de los cuatro receptores aumentó significativamente en la mayoría de los órganos inmunitarios después de la infección viral. En conclusión, nuestro estudio examinó la distribución y expresión de cuatro receptores de PRRSV en órganos inmunológicos. Observamos un aumento significativo en la expresión de Sn, CD163 y vimentina después de la infección viral. Estos hallazgos pueden proporcionar objetivos potenciales para el diseño futuro de reactivos antivirales o el desarrollo de vacunas.
1 Introducción
El síndrome reproductivo y respiratorio porcino (PRRS, por sus siglas en inglés), también conocido como enfermedad del cerdo de orejas azules en China, ha sido una epidemia en los Estados Unidos durante más de 30 años y en China durante 20 años (1). El PRRS provoca complicaciones reproductivas, como la mortalidad embrionaria, el aborto en fase tardía, el parto prematuro, el aumento de la incidencia de fetos nacidos muertos y momificados, así como el nacimiento de lechones débiles (2). El agente etiológico de esta enfermedad es el PRRSV, un virus de ARN con envoltura que pertenece al género y a la familia de los Arterivirus (3). El genoma del PRRSV tiene una longitud aproximada de 15 kb y tiene al menos 10 marcos de lectura abiertos (ORF) que codifican 16 proteínas no estructurales y 8 estructurales (4). En función de su antigenicidad, el PRRSV se divide en dos especies, PRRSV-1 (Betaarterivirus suid 1, anteriormente conocido como genotipo 1 europeo) y PRRSV-2 (Betaarterivirus suid 1, anteriormente conocido como genotipo 2 norteamericano), de las cuales solo el 50-70% presentan una identidad de secuencia de nucleótidos común (5). En China, PRRSV-2 es el genotipo más prevalente en las granjas porcinas y se divide a su vez en linaje 1 (representado por NADC30 y NADC 34), linaje 3 (representado por QYYZ), linaje 5 (representado por VR-2332) y linaje 8 (representado por JXA1) en función de su secuencia ORF5 (6). Los estudios han demostrado que las cepas de recombinación de diferentes linajes se están convirtiendo en las cepas predominantes en China, especialmente las cepas similares a NADC30 (7, 8). Es importante destacar que el PRRSV se está extendiendo actualmente por todo el mundo. Estudios recientes han mostrado una prevalencia del 16,7% en Campaina (Italia) y del 58% en Costa Rica (9, 10).
Investigaciones anteriores han demostrado que el PRRSV permanece en la sangre, el bazo, los ganglios linfáticos y las amígdalas de los cerdos infectados (11). La infección por PRRSV da lugar a una infección viral crónica debido a una respuesta inmunitaria celular ineficiente y exhibe un tropismo celular restringido, siendo los macrófagos alveolares las principales células diana (12). La intensidad y susceptibilidad a la infección por PRRSV varía con la edad (13, 14). Los macrófagos de los lechones más jóvenes fueron más susceptibles a la infección por PRRSV, aunque no hubo cambios en la expresión de los receptores de superficie en cerdos de diferentes edades (15). La infección por PRRSV es en realidad un proceso de endocitosis y replicación mediado por el receptor de la célula huésped. La presencia o ausencia de los receptores celulares determina si el virus puede penetrar en las células huésped (16). Hasta la fecha, se han identificado al menos seis receptores celulares como mediadores de entrada viral para el PRRSV, incluyendo sialoadhesina (Sn, CD169), vimentina, miosina no muscular cadena II SUBTIPO A (NMHC-II-A), sulfato de heparina, molécula de adhesión intercelular específica de células dendríticas-3-no integrina (CD209) y CD163 (receptor de barrido rico en cisteína) (17, 18). Cada receptor tiene sus propias características en términos de distribución en diferentes células, función en diferentes etapas de la infección viral y patrones de interacción con proteínas o genes virales (19). Brianna Salgado y sus colegas descubrieron recientemente que la edición genómica del receptor CD163 del huésped se puede utilizar como estrategia para crear cerdos modificados genéticamente que sean completamente resistentes a la infección por PRRSV (20). Por lo tanto, los estudios sistemáticos sobre las propiedades de distribución y localización de los receptores de PRRSV se han convertido en una nueva estrategia para la prevención de la infección por PRRSV.
La presente investigación determinó la distribución de cuatro receptores de PRRSV (Sn, CD163, vimentina y NMHCII-A) en los órganos inmunológicos de lechones después de la infección por PRRSV. Nuestros resultados mostraron que cuatro receptores estaban ampliamente distribuidos en el timo, la amígdala, la linfa inguinal, el bazo, los ganglios linfáticos hiliares, la linfa mesentérica y la linfa mandibular. La expresión de Sn, CD163 y vimentina aumentó significativamente después de la infección por PRRSV en comparación con el grupo control. Nuestros resultados morfológicos proporcionan evidencia de interacciones entre virus y órganos inmunes y son valiosos para identificar los mecanismos de las vías de infección viral.
2 Materiales y métodos
2.1 Los animales y la infección
En el presente estudio se utilizaron diez lechones cruzados (30 días de edad, hembra: macho = 5:5). Los lechones fueron alimentados con una dieta libre de antibióticos y tuvieron acceso sin restricciones al agua. Después de las pruebas serológicas periódicas, se confirmó que todos los lechones estaban libres de PRRSV, PPV, PCV y virus de la influenza porcina (VIS) antes de su uso en este estudio. Los lechones se asignaron aleatoriamente al grupo de control o al grupo de infección por PRRSV (cada grupo: 5 lechones). Todos los lechones se inyectaron primero en los músculos del cuello con un adyuvante inmunológico (0,11 mg/kg) a 0 DPI y 14 DPI (d después de la infección). Después de 28 DPI, a los lechones del grupo de infección se les administró sobrenadante celular de células Marc-145 que contenían PRRSV-2 JXA1 (linaje 8, 10-5 TCID50/0,1 mL) en el0º día de inyección posterior al desafío (DPC) por administración intranasal (0,3 mL por lechón). El mismo volumen de sobrenadante celular libre de PRRSV se administró al grupo control. Todos los días, entre 0 y 28 DPC, todos los lechones se sometieron a exámenes clínicos diarios para controlar su comportamiento general, apetito, temperatura rectal, frecuencia respiratoria y cualquier signo de enfermedad respiratoria o diarrea. Se recogieron muestras de sangre a 0, 7, 10, 14, 21 y 28 DPC para determinar los niveles de anticuerpos GP5 y proteína N. Todos los lechones fueron sacrificados en 28 CPD para examen macroscópico e histopatológico. Para su posterior análisis, se recogieron inmediatamente muestras inmunológicas de las amígdalas, el timo, los ganglios linfáticos inguinales, los ganglios linfáticos mesentéricos, los ganglios linfáticos hiliares, el bazo y los ganglios linfáticos mandibulares.
2.2 Análisis ELISA indirecto
El PRRSV es un virus pequeño con envoltura con seis proteínas estructurales (GP2, GP3, GP4, GP5, M y N). Las proteínas GP5 y N son dianas esenciales para la detección serológica mediante ELISA. En la actualidad existen dos kits comerciales ampliamente utilizados para el diagnóstico de anticuerpos contra el PRRSV: IDEXX HerdChek PRRS Ab X3 (IDEXX Laboratories, Westbrook, Maine, Estados Unidos) y LSI Porcine PRRS/AS-serum (LSI-ELISA de la empresa LSI de Francia). Hay diferencias significativas entre los dos kits. El IDEXX-ELISA utiliza placas recubiertas con la proteína nucleocápside del virus (proteína N), mientras que el kit LSI-ELISA utiliza la glicoproteína viral (GP5) (21). El método LSI-ELISA considera que las muestras son positivas si el porcentaje de índice relativo (IRPC) es ≥20 y negativas si es <20. El IRPC se calcula mediante (Muestra OD450-OD 450 de control negativo)/(OD450 positivo-OD 450 de control negativo) × 100. El método IDEXX-ELISA considera que las muestras son positivas si la relación S/P es ≥0,4 y negativas si es <0,4, donde S/P = (Sample OD650-negativo control OD650)/ (Positivo OD650-negativo negativo control OD650). Las muestras de suero de los lechones se analizaron para detectar anticuerpos anti-PRRVS utilizando los dos kits comerciales de ELISA indirecto mencionados anteriormente. Se siguieron las instrucciones del fabricante para garantizar un diagnóstico rápido y preciso del PRRSV en el estudio.
2.3 Examen histopatológico
Al final del experimento, se recogieron rápidamente muestras de tejido de varios órganos inmunitarios, como el timo, la amígdala, los ganglios linfáticos inguinales, el bazo y los ganglios linfáticos hiliares, y se fijaron en formol tampón neutro al 10% (v/v) durante la noche a temperatura ambiente antes de incrustarlas en cera de parafina. Los bloques de cera que contenían las muestras se prepararon y luego se cortaron en secciones de 5 μm de grosor. Estas secciones se sometieron a tinción con la técnica de hematoxilina y eosina (H&E) y luego se examinaron bajo un microscopio óptico equipado con un Olympus DP73 (Tokio, Japón).
2.4 Inmunohistoquímica
Las secciones de tejido del órgano inmune se desparafinaron en xileno y luego se rehidrataron con una serie de soluciones de alcohol. Para neutralizar la actividad de la peroxidasa endógena, las secciones de muestra se sumergieron en una solución de peróxido de hidrógeno al 3% durante 10 min. Después de tres lavados con PBS, la recuperación del antígeno se llevó a cabo hirviendo las secciones de la muestra en tampón de citrato de sodio durante 10 min. Para evitar la unión inespecífica, las secciones de la muestra se trataron con albúmina sérica bovina (BSA) al 5% durante 30 min antes de ser incubadas durante la noche a 4 °C con el anticuerpo primario (anticuerpo anti-CCAPDID contra el virus del PRRS, abcam, ab308202). Después del lavado con PBS, se aplicó un anticuerpo secundario biotinilado a las secciones de la muestra y se incubó durante 30 min a temperatura ambiente. Las secciones de muestra se enjuagaron tres veces con PBS y las reacciones positivas se visualizaron utilizando un kit DAB.
2.5 Inmunofluorescencia
Después de la incubación con albúmina sérica bovina (BSA) al 5% durante 30 min para evitar la unión inespecífica, las secciones de muestra se incubaron durante la noche a 4 °C con el anticuerpo primario Anti CD163 (Afinidad, DF8235), Sn (Afinidad, DF13669), NMHCII-A (Abcam, ab138498) y vimentina (Afinidad, BF8006). Después de tres lavados con PBS, se añadió Alexa Fluor 488 IgG marcada y se incubó durante 1 h a 37 °C. Las secciones de muestra se sometieron a tres ciclos de limpieza antes de ser teñidas con DAPI. Por último, se utilizó microscopía de barrido láser confocal (Leica TCS SP8) para observar las secciones.
2.6 Western blot
Las muestras inmunológicas se recogieron e inmediatamente se colocaron en hielo, seguido de un lavado con PBS en frío. A continuación, las muestras se homogeneizaron en un tampón de lisis celular (tampón RIPA, Beyotime, P0013) que contenía inhibidores de la proteasa y la fosfatasa. Después de la centrifugación a 12.000 × g durante 15 min, se obtuvieron los sobrenadantes. La concentración de proteínas se determinó utilizando un kit de ensayo de proteínas BCA (Solarbio, PC0020) y se separaron cantidades iguales de muestras de proteínas mediante SDS-PAGE en un gel al 12%. Después de la transferencia electroforética de proteínas a una membrana de PVDF (Millipore), la membrana se bloqueó durante 1 h con leche desnatada en polvo al 5% (p/v) en solución salina tamponada con Tris que contenía 0,05% de Tween-20 a temperatura ambiente. A continuación, se incubaron anticuerpos primarios (CD163, Sn, NMHCII-A y vimentina) en las membranas durante la noche a 4 °C. Después de los pasos de lavado TBST, se aplicaron anticuerpos secundarios apropiados a las membranas durante 1 h a temperatura ambiente. Las bandas inmunorreactivas se examinaron utilizando un sistema de detección de quimioluminiscencia mejorada (ECL) (Vazyme Biotech, China) y el software Quantity One (Bio-Rad Laboratories) para cuantificar las bandas inmunorreactivas.
2.7 Análisis estadístico
Los datos se presentaron como medias ± SEM. La significación estadística de las diferencias de medias entre los grupos se determinó mediante ANOVA con una prueba de comparación múltiple realizada en GraphPad Prism 7.0. Todos los datos de cuantificación se repitieron tres veces y los resultados se consideraron estadísticamente significativos cuando el valor de p fue inferior a 0,05 (*) o 0,01 (**).
3 Resultados
3.1 Exploración patológica macroscópica y respuesta inmunitaria humoral
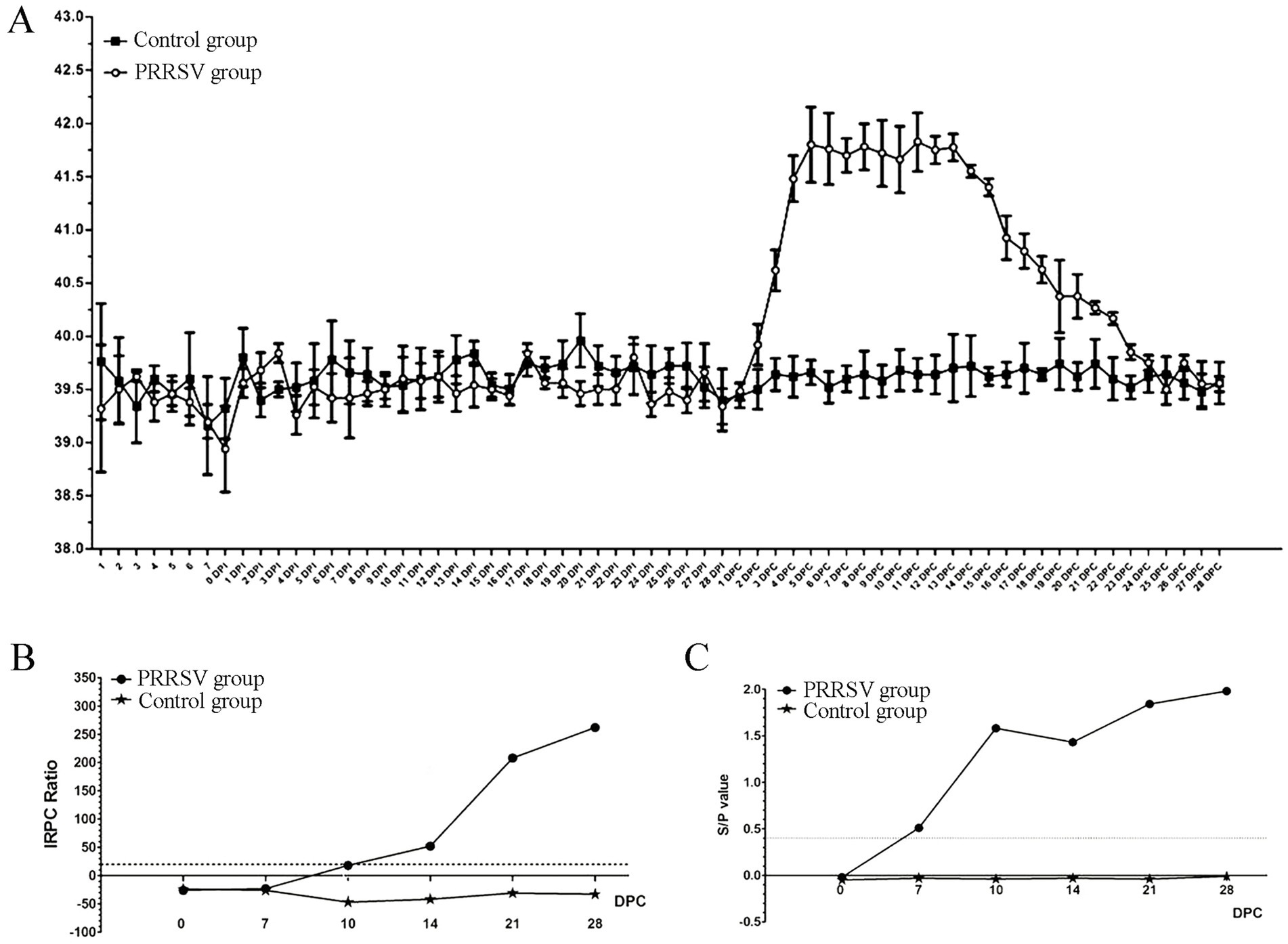
Los lechones del grupo control no mostraron ningún síntoma clínico típico durante el experimento. En el 2º CPD, no hubo cambios en los signos clínicos de enfermedad respiratoria entre los lechones control y los infectados. Casi todos los lechones infectados en los 3º CPD presentaron tos, estornudos, pérdida de apetito y diarrea. Estos síntomas clínicos persistieron hasta que se detuvo el experimento con animales. La temperatura rectal de todos los lechones de control se mantuvo constante a 39,5 °C durante todo el experimento (Figura 1A). Sin embargo, la temperatura rectal de los lechones infectados aumentó a 41 °C en el 4º CPD y se mantuvo por encima de 41 °C durante 12 días (Figura 1A). A continuación, utilizamos un enfoque ELISA indirecto para medir los niveles sanguíneos de los anticuerpos específicos del PRRSV para GP5 y la proteína N. Los resultados mostraron que la tasa de positividad aumentó significativamente en el 10º CPD determinado por el kit LSI-ELISA (Figura 1B). En el 7º CPD, el valor S/p aumentó más significativamente con la incorporación de los kits IDEXX-ELISA (Figura 1C). Los lechones de control permanecieron seronegativos hasta el final del estudio.
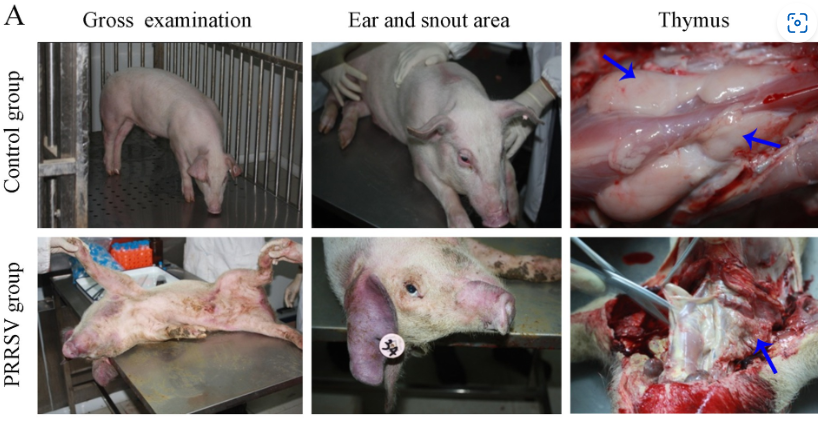
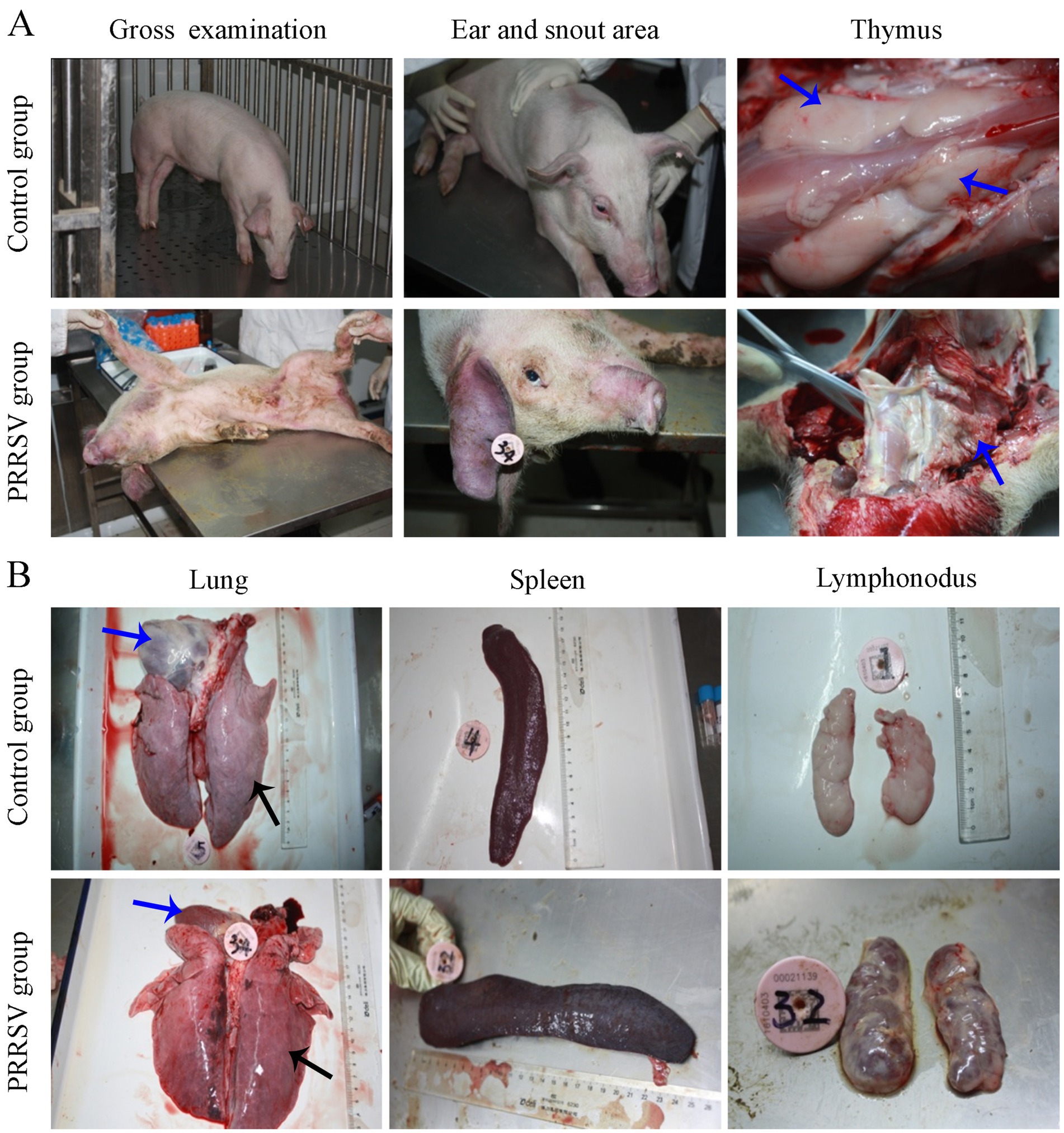
Además, la piel del cuarto trasero y del abdomen era eritematosa, con evidentes cianosis en la piel de la oreja y en la zona del hocico (Figura 2A). Se observaron lesiones patológicas, localizadas principalmente en pulmones y ganglios linfáticos. La glándula timo de los lechones infectados estaba atrofiada y cubierta de manchas hemorrágicas (Figura 2A). La neumonía intersticial y la expansión sistémica de los ganglios linfáticos inguinales, mesentéricos, hiliares y mandibulares fueron los cambios patológicos más significativos. En comparación con los del grupo control, los pulmones de los lechones infectados estaban difusamente enrojecidos, no colapsados, duros y gomosos (Figura 2B). Se encontraron nódulos blancos en el lóbulo apical y el lóbulo diafragmático de los pulmones infectados. Las cavidades del corazón estaban bloqueadas y había líquidos inflamatorios en el pericardio. El bazo de los lechones del grupo infectado estaba agrandado y cubierto de nódulos rojos (Figura 2B). En comparación con los lechones de control, los lechones infectados tenían ganglios linfáticos hiliares, mesentéricos e inguinales más firmes, hemorrágicos y más grandes (Figura 2B).
3.2 Examen histopatológico y detección de virus en tejidos
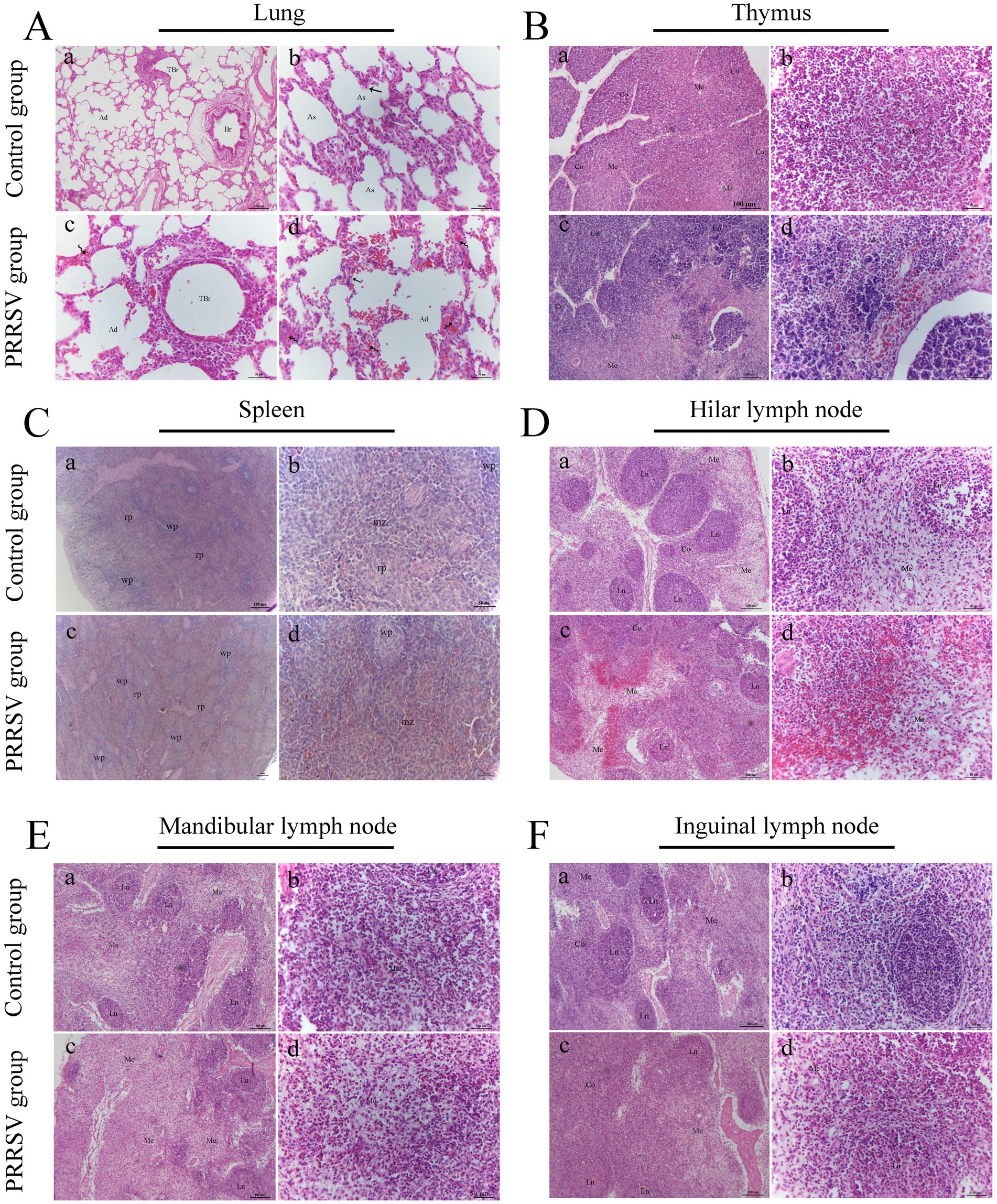
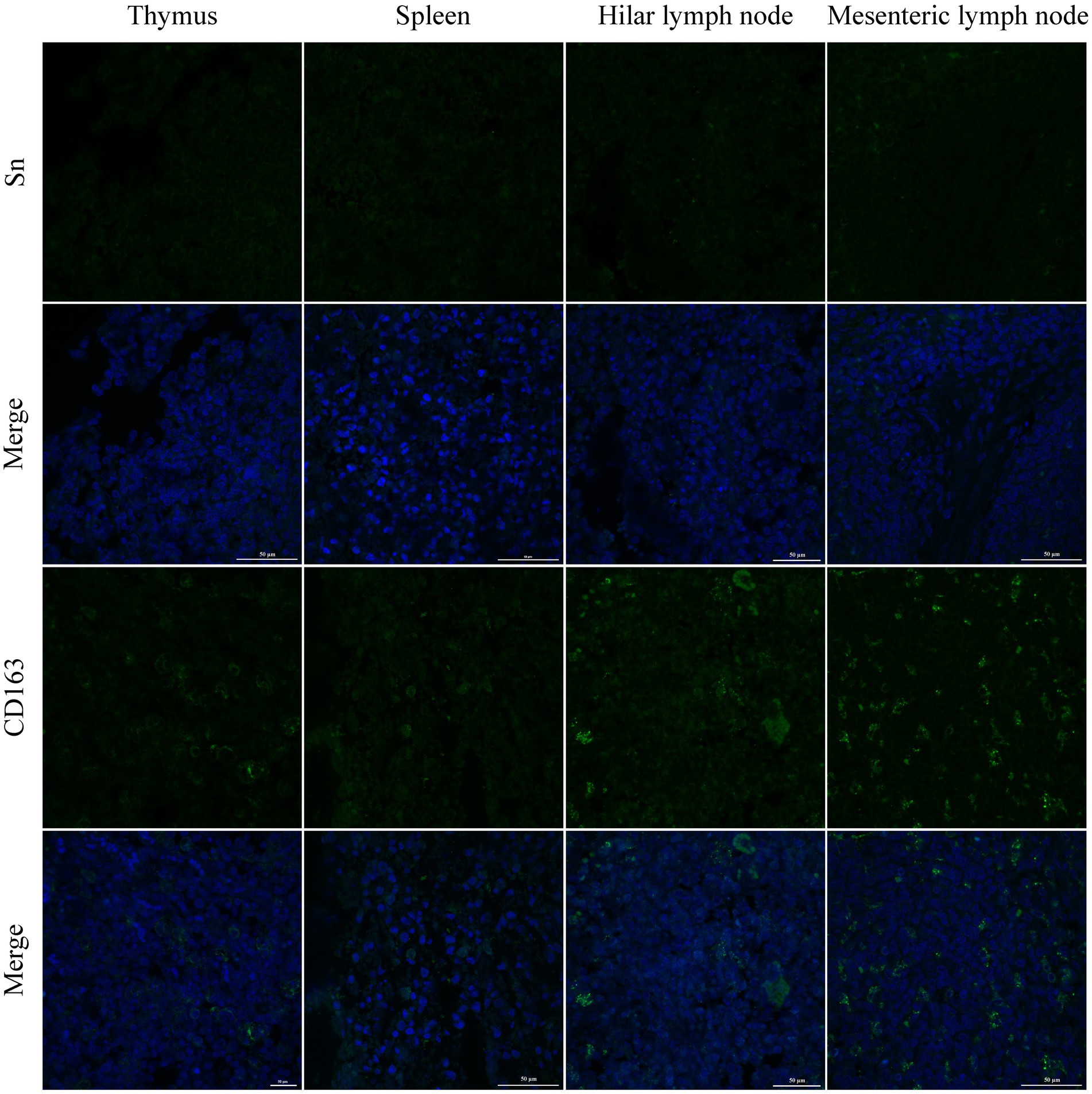
En comparación con los del grupo control, los pulmones de los lechones infectados presentaban lesiones histológicas diferentes. La neumonía intersticial difusa se caracterizó por una hemorragia significativa del conducto alveolar y engrosamiento de los tabiques alveolares por macrófagos, y ocasionalmente por hipertrofia de neumocitos tipo II (Figura 3A). El timo de los lechones infectados se caracterizó por un número reducido de linfocitos. Los linfocitos de la zona cortical se agregaron en pequeños punctums y el espacio entre células se expandió, con algunas manchas hemorrágicas en la zona medular del timo (Figura 3B). Las lesiones histopatológicas en el bazo y los ganglios linfáticos hiliares, mandibulares e inguinales incluyeron folículos colapsados, agotamiento de los centros germinales y hemorragia extensa (figuras 3C-F). A continuación, utilizamos la inmunohistoquímica para detectar la distribución del PRRSV en los órganos inmunológicos (Figura 4). Se observó una reacción positiva más fuerte en la amígdala, los ganglios linfáticos hiliares, los ganglios linfáticos mesentéricos, la región medular del timo y la zona marginal del bazo (Figuras 4A,B). Se observó una reacción positiva relativamente débil en los ganglios linfáticos inguinales (Figura 4B).

3.3 Distribución y expresión de los receptores de PRRSV en los órganos inmunitarios
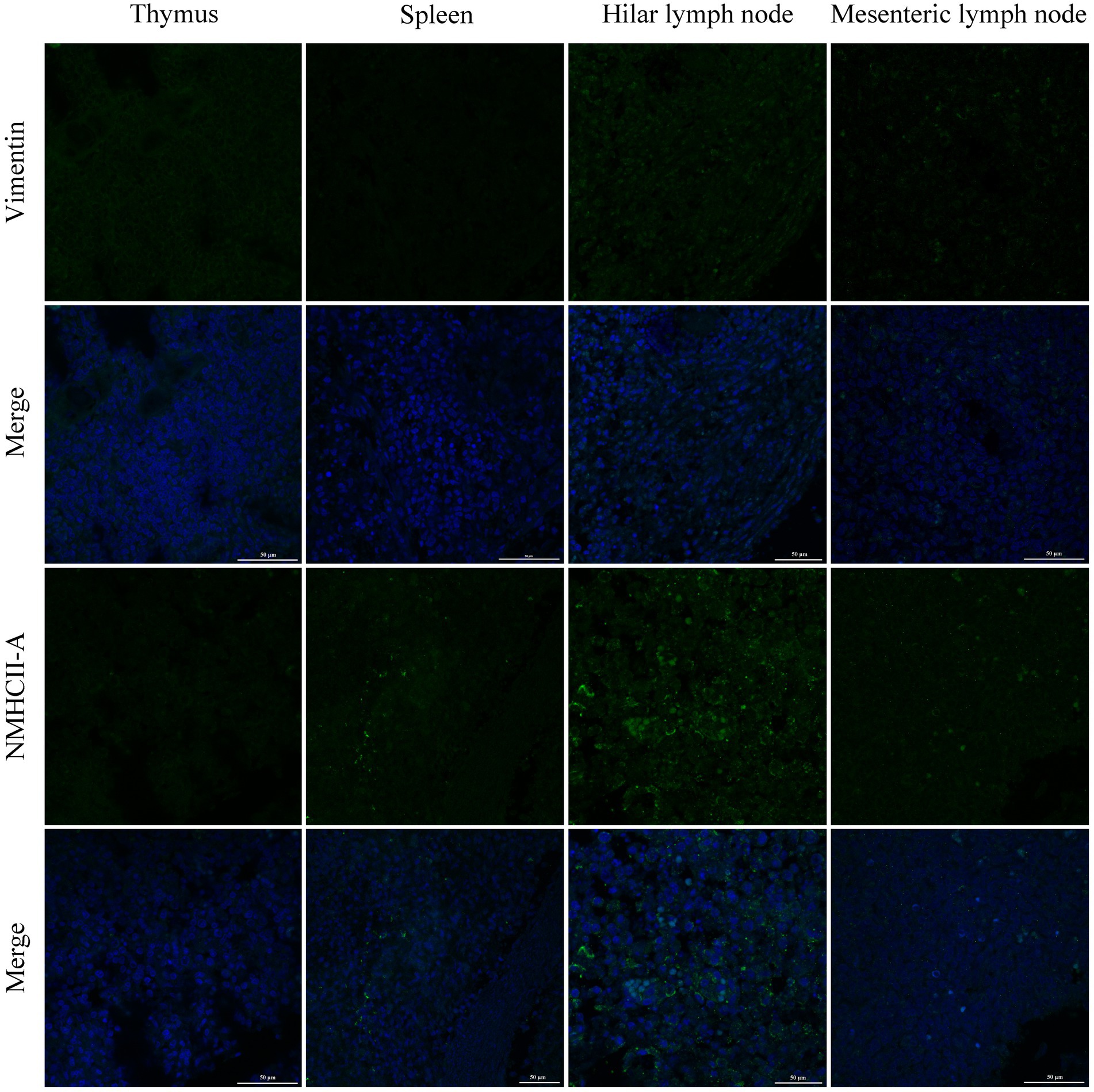
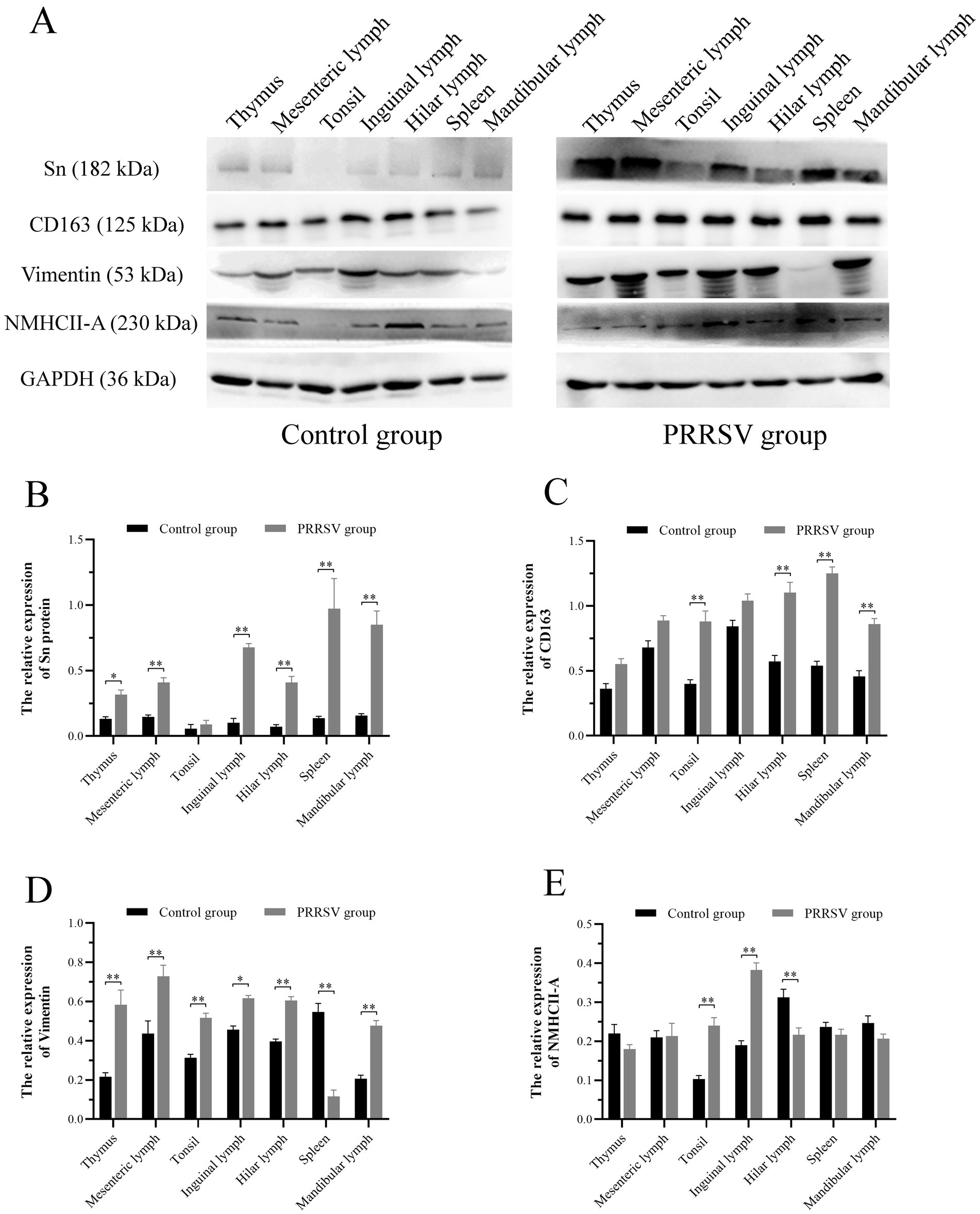
La infección por PRRSV de las células huésped implica endocitosis y replicación mediada por receptores. La presencia o ausencia de receptores celulares determina si las células son permisivas o resistentes a la infección viral. En este estudio, se analizó la distribución y expresión de cuatro receptores importantes de PRRSV en órganos inmunes utilizando IF y WB. Los resultados del FI mostraron que CD163 se distribuyó principalmente en el timo, los ganglios linfáticos hiliares y los ganglios linfáticos mesentéricos (Figura 5). La NMHCII-A se distribuyó principalmente en los ganglios linfáticos hiliares (Figura 6). La vimentina se expresó en todos los órganos inmunitarios y el Sn se expresó en niveles bajos en los tejidos inmunitarios (Figuras 5 y 6). Después de que los lechones se infectaron con el virus, los niveles de proteínas de los receptores se midieron mediante WB. Como se muestra en la Figura 7, la expresión de Sn en el timo, los ganglios linfáticos mesentéricos, los ganglios linfáticos inguinales, los ganglios linfáticos hiliares, el bazo y los ganglios linfáticos mandibulares aumentó significativamente después de la infección por PRRSV (Figuras 7A, B). La expresión de CD163 también aumentó en la amígdala, los ganglios linfáticos hiliares, el bazo y la linfa mandibular después de la infección por PRRSV (Figuras 7A, C). La expresión de vimentina aumentó en todos los ganglios linfáticos, pero disminuyó en el bazo (Figuras 7A,D). Después de la infección por PRRVS, la expresión de NMHCII-A aumentó en los ganglios linfáticos inguinales y las amígdalas (Figuras 7A,E).
4 Discusión
El PRRS es una enfermedad infecciosa que causa importantes pérdidas económicas a la industria porcina en todo el mundo. Los cerdos son los únicos huéspedes naturales conocidos del PRRSV, y el principal objetivo de la infección son los macrófagos alveolares porcinos (HAP) completamente diferenciados (22). El resultado de la infección por PRRSV está significativamente influenciado por la edad del animal, posiblemente debido al aumento de la resistencia inmunitaria innata (14). Se ha demostrado que los lechones son más susceptibles a la infección por PRRSV y sufren infecciones más graves y persistentes que los adultos (23). Sin embargo, la respuesta inmunitaria humoral al PRRSV se activa en un umbral de infección bajo, independientemente de la edad (14). Uno de los obstáculos en el desarrollo de vacunas es la inadecuada comprensión de la respuesta inmunitaria del huésped al PRRSV (24). Un estudio previo encontró que la infección por PRRSV persiste principalmente en los pulmones y los tejidos linfoides, lo que lleva a un agotamiento linfático sistémico (25). Como resultado, la interacción entre el PRRSV y el sistema inmunitario puede afectar al sistema inmunitario del huésped (22). En este estudio, descubrimos que el PRRSV puede causar daños patológicos graves en los órganos inmunitarios del huésped, incluida la atrofia del timo y la hinchazón general de los ganglios linfáticos. El examen histopatológico reveló una hemorragia extensa en el tejido intersticial y una disminución del recuento de linfocitos.
La infección de las células huésped por el PRRSV se ve facilitada por la endocitosis mediada por receptores y su posterior replicación. La permisividad o no permisividad de las líneas celulares a la infección viral está determinada por la presencia o ausencia de receptores celulares (16). Varias líneas celulares, incluidas BHK-21, PK-15 y CHO-K1, mostraron susceptibilidad a la infección por PRRSV tras la expresión de proteínas receptoras recombinantes. Los receptores importantes implicados en la adhesión, internalización o desrecubrimiento del virus son el Sn, el CD163, la vimentina y el NMHCII-A (18). La proteína CD163 específica de macrófagos es necesaria y suficiente para la infección por PRRSV (26). El Sn es una molécula de adhesión celular que tiene una expresión específica en los macrófagos y se localiza predominantemente en la superficie de los macrófagos procedentes de diversos órganos como el bazo, el hígado, los ganglios linfáticos, la médula ósea, el colon y los pulmones (16). Nuestros resultados mostraron que el Sn estaba presente en los órganos inmunológicos y su expresión aumentó drásticamente después de la infección por PRRSV, lo que sugiere que desempeña un papel crucial en la infección por PRRSV. Vanderheijden et al. sugirieron que el Sn podría servir como un objetivo potencial para la inmunoterapia contra la infección por PRRSV (27). La infección por PRRSV se correlaciona bien con un aumento en la expresión de CD163 en monocitos cultivados (28). Además, la expresión de CD163 está directamente relacionada con la infectividad del PRRSV en las células PAM (17). En nuestro análisis, la expresión de CD163 en órganos inmunológicos se asoció con variaciones específicas de tejido en la infección viral. La vimentina se expresa ampliamente en numerosas células, incluidos monocitos, macrófagos, células mesenquimales, fibroblastos y células de Sertoli (29, 30). También se ha demostrado que la vimentina está localizada en las células MARC-145, que son células susceptibles al PRRSV (31). Se ha demostrado que la expresión de vimentina está regulada al alza después de la infección por PRRSV (32). Nuestros resultados mostraron que la expresión de vimentina en el bazo disminuyó después de la infección por PRRSV. La localización y expresión de NMHCII-A, un nuevo receptor de PRRSV, mostró un patrón inconsistente después de la infección viral en lechones.
En resumen, las lesiones graves primarias causadas por la infección por PRRSV incluyen agrandamiento de los ganglios linfáticos, hemorragia pulmonar, atrofia tímica y hemorragia en lechones. El examen histopatológico reveló neumonía intersticial, colapso de folículos, agotamiento del centro germinal y hemorragia extensa. Cada receptor se caracteriza por su distribución en diferentes órganos inmunológicos y su nivel de expresión varía después de la infección viral. En comparación con la investigación sobre la variación genética de los virus, la investigación de sus receptores será el objetivo para generar nuevos reactivos antivirales o desarrollar vacunas más eficaces. Sin embargo, hay que tener en cuenta que nuestros resultados se basaron en el examen histopatológico y en los análisis morfológicos. Se necesitan más estudios para dilucidar las funciones específicas de los receptores del huésped en el proceso de infección por PRRSV.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse a los autores correspondientes.
Declaración ética
El estudio en animales fue aprobado por el Comité del Instituto de Investigación Animal (Universidad Northwest A&F, Shaanxi, China). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
HC: Curación de datos, Adquisición de fondos, Metodología, Administración de proyectos, Redacción – borrador original, Redacción – revisión y edición. NC: Curación de datos, Metodología, Redacción – borrador original. HbC: Análisis formal, Metodología, Software, Redacción – borrador original. ZZ: Análisis formal, Metodología, Software, Redacción – borrador original. JY: Análisis formal, Software, Escritura – borrador original. JS: Curación de datos, Metodología, Redacción – borrador original. HanL: Software, Supervisión, Redacción – revisión y edición. RC: Análisis formal, Supervisión, Redacción, revisión y edición. HaiL: Validación, Supervisión, Redacción – revisión y edición. TL: Conceptualización, Obtención de fondos, Supervisión, Validación, Redacción, revisión y edición. SC: Conceptualización, Administración de proyectos, Supervisión, Validación, Redacción, revisión y edición.
Financiación
El (los) autor(es) declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (número de subvención: 32172811, 32372969) y el programa de Investigación y Desarrollo Clave de la Provincia de Shaanxi (número de subvención: 2021KWZ-22).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1428273/full#supplementary-material
Referencias
1. Guo, Z, Chen, XX, Li, R, Qiao, S y Zhang, G. El estado prevalente y la diversidad genética del virus del síndrome respiratorio y reproductivo porcino en China: una perspectiva epidemiológica molecular. Virol J. (2018) 15:2. doi: 10.1186/s12985-017-0910-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Karniychuk, UU, y Nauwynck, HJ. Patogenia y prevención de la infección por el virus del síndrome respiratorio y reproductivo porcino placentario y transplacentario. Res. Veterinaria. (2013) 44:95. doi: 10.1186/1297-9716-44-95
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Liu, Y, Hu, Y, Chai, Y, Liu, L, Song, J, Zhou, S, et al. Identificación de la proteína no estructural 8 como N-terminal de la ARN polimerasa dependiente de ARN del virus del síndrome respiratorio y reproductivo porcino. Virol Sin. (2018) 33:429–39. doi: 10.1007/s12250-018-0054-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Dea, S, Gagnon, CA, Mardassi, H, Pirzadeh, B, y Rogan, D. Conocimiento actual sobre las proteínas estructurales del virus del síndrome respiratorio y reproductivo porcino (PRRS): comparación de los aislados de América del Norte y Europa. Arco Virol. (2000) 145:659–88. doi: 10.1007/s007050050662
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Allende, R, Lewis, TL, Lu, Z, Rock, DL, Kutish, GF, Ali, A, et al. Los virus del síndrome respiratorio y reproductivo porcino de América del Norte y Europa difieren en las regiones codificantes de proteínas no estructurales. J Gen Virol. (1999) 80:307–15. doi: 10.1099/0022-1317-80-2-307
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Li, C, Fan, A, Liu, Z, Wang, G, Zhou, L, Zhang, H, et al. Prevalencia, tiempo de infección y diversidad del virus del síndrome respiratorio y reproductivo porcino en China. Virus. (2024) 16:774. doi: 10.3390/v16050774
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Xu, H, Li, C, Li, W, Zhao, J, Gong, B, Sun, Q, et al. Características novedosas del PRRSV chino similar a NADC34 durante 2020-2021. Transbound emerg Dis. (2022) 69:E3215–24. doi: 10.1111/tbed.14485
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Jiao, S, Zhang, J, Wang, J, Ma, X, Li, G, Li, J, et al. El análisis del genoma completo de la recombinación y evolución de las cepas del virus del síndrome respiratorio y reproductivo porcino similar a NADC30 recientemente identificadas circularon en la provincia china de Gansu en 2023. Frente Vet Sci. (2024) 11:1372032. doi: 10.3389/fvets.2024.1372032
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Ferrara, G, D’Anza, E, Rossi, A, Improda, E, Iovane, V, Pagnini, U, et al. Una investigación serológica sobre el síndrome reproductivo y respiratorio porcino y tres coronavirus en la región de Campania, sur de Italia. Virus. (2023) 15:300. doi: 10.3390/v15020300
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Meléndez, R, Guzmán, M, Jiménez, C, Piche, M, Jiménez, E, León, B, et al. Seroprevalencia del virus del síndrome respiratorio y reproductivo porcino en granjas porcinas de un país tropical del centro América: el caso de Costa Rica. Trop Anim Salud Prod. (2021) 53:441. doi: 10.1007/s11250-021-02799-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Lamontagne, L, Page, C, Larochelle, R, y Magar, R. La persistencia del virus del síndrome respiratorio y reproductivo porcino en la sangre, el bazo, los ganglios linfáticos y las amígdalas de cerdos infectados experimentalmente depende del nivel de células T CD8 altas. Inmunización Viral. (2003) 16:395–406. doi: 10.1089/088282403322396181
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Bordet, E, Maisonnasse, P, Renson, P, Bouguyon, E, Crisci, E, Tiret, M, et al. Las células alveolares parecidas a los macrófagos porcinos son macrófagos intravasculares pulmonares proinflamatorios que producen grandes títulos del virus del síndrome respiratorio y reproductivo porcino. Sci Rep. (2018) 8:10172. doi: 10.1038/s41598-018-28234-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Cho, JG, Dee, SA, Deen, J, Guedes, A, Trincado, C, Fano, E, et al. Evaluación de los efectos de la edad del animal, la infección bacteriana concurrente y la patogenicidad del virus del síndrome respiratorio y reproductivo porcino sobre la concentración del virus en cerdos. Am J Vet Res. (2006) 67:489–93. doi: 10.2460/ajvr.67.3.489
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Klinge, KL, Vaughn, EM, Roof, MB, Bautista, EM, y Murtaugh, MP. Resistencia dependiente de la edad a la replicación del virus del síndrome respiratorio y reproductivo porcino en cerdos. Virol J. (2009) 6:177. doi: 10.1186/1743-422x-6-177
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Gray, DK, Dvorak, CMT, Robinson, SR y Murtaugh, MP. Caracterización de la susceptibilidad de los macrófagos al virus del síndrome respiratorio y reproductivo porcino. Res. de Virus (2019) 263:139–44. doi: 10.1016/j.virusres.2019.01.015
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Shi, C, Liu, Y, Ding, Y, Zhang, Y y Zhang, J. Receptores de PRRSV y su papel en la infección viral. Arch Microbiol. (2015) 197:503–12. doi: 10.1007/s00203-015-1088-1
17. Wang, F, Qiu, H, Zhang, Q, Peng, Z y Liu, B. Asociación de dos genes receptores del virus del síndrome respiratorio y reproductivo porcino (PRRSV), CD163 y SN con rasgos inmunológicos. Mol Biol Rep. (2012) 39:3971–6. doi: 10.1007/s11033-011-1177-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Su, CM, Rowland, RRR y Yoo, D. Avances recientes en los receptores del virus PRRS y la selección de receptores-ligandos para su control. Vacuna. (2021) 9:354. doi: 10.3390/vacunas9040354
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Zhang, Q y Yoo, D. Receptores del virus PRRS y su papel en la patogénesis. Microbiol veterinario. (2015) 177:229–41. doi: 10.1016/j.vetmic.2015.04.002
20. Salgado, B, Rivas, RB, Pinto, D, Sonstegard, TS, Carlson, DF, Martins, K, et al. Los cerdos modificados genéticamente que carecen del exón 13 codificante del dominio PSTII CD163 son completamente resistentes a la infección por PRRSV. Antivir Res. (2024) 221:105793. doi: 10.1016/j.antiviral.2024.105793
21. Chen, Y, Tian, H, He, JH, Wu, JY, Shang, YJ y Liu, XT. ELISA indirecto con GP5 recombinante para la detección de anticuerpos frente al virus del síndrome respiratorio y reproductivo porcino. Virol Sin. (2011) 26:61–6. doi: 10.1007/s12250-011-3154-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Lunney, JK, Fang, Y, Ladinig, A, Chen, N, Li, Y, Rowland, B, et al. Virus del síndrome respiratorio y reproductivo porcino (PRRSV): patogenia e interacción con el sistema inmunitario. Rev Anual Animal Biosci. (2016) 4:129–54. doi: 10.1146/annurev-animal-022114-111025
23. van der Linden, IF, Voermans, JJ, van der Linde-Bril, EM, Bianchi, AT, y Steverink, PJ. Cinética virológica y respuestas inmunológicas a una infección por el virus del síndrome reproductivo y respiratorio porcino en cerdos a diferentes edades. Vacuna. (2003) 21:1952–7. doi: 10.1016/S0264-410X(02)00822-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Salguero, FJ, Frossard, JP, Rebel, JM, Stadejek, T, Morgan, SB, Graham, SP, et al. Interacciones huésped-patógeno durante la infección por el virus del síndrome respiratorio y reproductivo porcino 1 en lechones. Res. de Virus (2015) 202:135–43. doi: 10.1016/j.virusres.2014.12.026
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Gómez-Laguna, J, Salguero, FJ, Fernández de Marco, M, Barranco, I, Rodríguez-Gómez, IM, Quezada, M, et al. La infección por el virus del síndrome respiratorio y reproductivo porcino tipo 2 mediada por apoptosis en áreas de células B y T en órganos linfoides de cerdos infectados experimentalmente. Transbound emerg Dis. (2013) 60:273–8. doi: 10.1111/j.1865-1682.2012.01338.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Welch, SK, y Calvert, JG. Una breve revisión de CD163 y su papel en la infección por PRRSV. Res. de Virus (2010) 154:98–103. doi: 10.1016/j.virusres.2010.07.018
27. Vanderheijden, N, Delputte, PL, Favoreel, HW, Vandekerckhove, J, Van Damme, J, van Woensel, PA, et al. Implicación de la sialoadhesina en la entrada del virus del síndrome respiratorio y reproductivo porcino en macrófagos alveolares porcinos. J Virol. (2003) 77:8207–15. doi: 10.1128/jvi.77.15.8207-8215.2003
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Wang, L, Zhang, H, Suo, X, Zheng, S y Feng, WH. El aumento de CD163 pero no de sialoadhesina en monocitos de sangre periférica cultivados se coordina con una mayor susceptibilidad a la infección por el virus del síndrome respiratorio y reproductivo porcino. Veterinario Immunol Immunopathol. (2011) 141:209–20. doi: 10.1016/j.vetimm.2011.03.001
29. Ahmed, N, Yufei, H, Yang, P, Muhammad Yasir, W, Zhang, Q, Liu, T, et al. Estudio citológico sobre las células de Sertoli y sus interacciones con las células germinales durante el ciclo reproductivo anual en tortuga. Ecol Evol. (2016) 6:4050–64. doi: 10.1002/ece3.2193
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Fan, Z, Li, L, Li, X, Zhang, M, Dou, M, Zhao, J, et al. Papel antisenescente de la eliminación del gen de la fumarato hidratasa heterocigota en fibroblastos pulmonares de rata in vitro. Envejecimiento. (2019) 11:573–89. doi: 10.18632/aging.101761
31. Kim, JK, Fahad, AM, Shanmukhappa, K y Kapil, S. Definición de los objetivos celulares del anticuerpo monoclonal 7G10 que bloquea el virus del síndrome respiratorio y reproductivo porcino. J Virol. (2006) 80:689–96. doi: 10.1128/jvi.80.2.689-696.2006
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Ding, Z, Li, ZJ, Zhang, XD, Li, YG, Liu, CJ, Zhang, YP, et al. Alteración proteómica de células Marc-145 y PAMs tras infección por el virus del síndrome respiratorio y reproductivo porcino. Veterinario Immunol Immunopathol. (2012) 145:206–13. doi: 10.1016/j.vetimm.2011.11.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: PRRSV, órganos inmunitarios, receptores virales, histopatología, lechones
Cita: Chen H, Chen N, Chen H, Zhao Z, Yang J, Sun J, Li H, Cong R, Liu H, Liu T y Chen S (2024) Características histopatológicas del PRRS y perfiles de expresión de receptores virales en el sistema inmunitario de los lechones. Frente. Vet. Sci. 11:1428273. doi: 10.3389/fvets.2024.1428273
Recibido: 06 de mayo de 2024; Aceptado: 07 de octubre de 2024;
Publicado: 06 de noviembre de 2024.
Editado por:
Peng Ji, Universidad Agrícola de Gansu, China
Revisado por:
Jean-Pierre Frossard, Agencia de Sanidad Animal y Vegetal, Reino Unido
Gianmarco Ferrara, Universidad de Messina, Italia
Xiuge Gao, Universidad Agrícola de Nanjing, China
Derechos de autor © 2024 Chen, Chen, Chen, Zhao, Yang, Sun, Li, Cong, Liu, Liu y Chen. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Shulin Chen, de csl_1359@163.com; Tengfei Liu, liutf@nwafu.edu.cn; Hailong Liu, liuhailong423@126.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía