Firma metabólica de ganado lechero infectado e infeccioso por Mycobacterium avium subsp. paratuberculosis
 Andrea Massaro1†
Andrea Massaro1† Alessandra Tata1*†
Alessandra Tata1*† Ivana Pallante2
Ivana Pallante2 Valentina Bertazzo3
Valentina Bertazzo3 Massimo Bottazzari4
Massimo Bottazzari4 Laura Paganini4
Laura Paganini4 Brunella Dall’Ava4
Brunella Dall’Ava4 Annalisa Stefani3
Annalisa Stefani3 Jeroen De Buck5
Jeroen De Buck5 Roberto Piro1
Roberto Piro1 Nicola Pozzato2
Nicola Pozzato2- 1Laboratorio di Chimica Sperimentale, Istituto Zooprofilattico Sperimentale delle Venezie, Vicenza, Italia
- número arábigoLaboratorio di Medicina Forense Veterinaria, Istituto Zooprofilattico Sperimentale delle Venezie, Vicenza, Italia
- 3Medicina di Laboratorio, Istituto Zooprofilattico Sperimentale delle Venezie, Legnaro, Italia
- 4Laboratorio di Diagnostica Clinica e Sierologia di Piano, Istituto Zooprofilattico Sperimentale delle Venezie, Verona, Italia
- 5Facultad de Medicina Veterinaria, Universidad de Calgary, Calgary, AB, Canadá
El diagnóstico precoz de Mycobacterium avium subsp. paratuberculosis (MAP) es uno de los retos actuales de los ganaderos y veterinarios. Este trabajo tuvo como objetivo investigar los cambios en los niveles metabólicos asociados con la infección natural por MAP en ganado lechero infectado e infeccioso. El estudio incluyó sueros de 23 bovinos infecciosos/seropositivos, 10 infectados pero no infecciosos/seronegativos y 26 bovinos Holstein Fresian negativos. Las muestras fueron seleccionadas de una colección de muestras recolectadas durante un estudio prospectivo. Las muestras se analizaron mediante espectroscopia de resonancia magnética nuclear (RMN) cuantitativa y química sanguínea de rutina. Los índices sanguíneos y los datos de RMN de 1H se concatenaron mediante fusión de datos de bajo nivel, lo que dio como resultado una huella digital global única. Posteriormente, el conjunto de datos fusionado se analizó estadísticamente mediante el operador de selección y contracción mínima absoluta (LASSO), que es un método de reducción y selección para el aprendizaje supervisado. Finalmente, se realizó un análisis de vías para obtener más información sobre las posibles vías metabólicas desreguladas. El modelo LASSO logró, en una validación cruzada de 5 veces repetidas 10 veces, una precisión global del 91,5% con altos valores de sensibilidad y especificidad en la clasificación correcta de los animales negativos, infectados e infecciosos. El análisis de la vía reveló que el ganado infectado con MAP ha aumentado el metabolismo de la tirosina y ha mejorado la biosíntesis de fenilalanina, tirosina y triptófano. El aumento de la síntesis y degradación de los cuerpos cetónicos se observó tanto en el ganado infectado como en el infeccioso. En conclusión, la fusión de datos de múltiples fuentes ha demostrado ser útil para explorar las vías metabólicas alteradas en la infección por MAP y potencialmente diagnosticar animales negativos dentro de rebaños infectados por paratuberculosis.
1. Introducción
Mycobacterium avium subespecie (subsp.) paratuberculosis (MAP), un patógeno intracelular obligado de crecimiento lento, es el agente etiológico de la paratuberculosis, también conocida como enfermedad de Johne (JD) (1). Es una infección granulomatosa crónica que causa pérdidas económicas relevantes en la industria ganadera debido a la reducción de la producción de leche, la pérdida de peso y la eventual muerte (2-4). La PAM se transmite comúnmente por vía fecal-oral (2, 4, 5). La alta resistencia a la MAP, el largo período de incubación y la patogenia de la enfermedad dificultan el manejo de la enfermedad (6). Además, la dificultad, en ausencia de pruebas diagnósticas precisas que conllevan un diagnóstico tardío de la EJ, de realizar un diagnóstico precoz no permite prevenir la difusión de la PAM dentro de las cabañas bovinas, ni proteger a los terneros jóvenes que son más susceptibles a la infección (2). Después del largo período de incubación, los animales pueden dividirse en: (i) infectados, cuando el PAM está presente intracelularmente en los tejidos animales, (ii) infecciosos, cuando el animal está excretando MAP, y (iii) afectados, cuando los animales muestran signos clínicos (7), que son visibles después de 2-6 años después de la infección. Diferentes pruebas, como la reacción en cadena de la polimerasa fecal (PCR) y el ensayo de inmunoabsorción enzimática (ELISA) se utilizan comúnmente para realizar el diagnóstico de EJ (8). Desafortunadamente, el ganado se vuelve positivo a estas pruebas solo durante la fase subclínica tardía y, por lo tanto, el diagnóstico temprano exitoso de la EJ sigue siendo un desafío, especialmente si se considera la baja eficacia de las pruebas de laboratorio (7). En los últimos años, la proteómica y la metabolómica de los sueros animales han proporcionado resultados alentadores (9-11) y se han llevado a cabo diferentes estudios en bovinos infectados para introducir nuevas herramientas con el objetivo de desentrañar importantes marcadores moleculares que describen los diferentes estadios de la EJ, diagnosticar la infección precoz por MAP y superar la falta de pruebas fiables (12-14). Recientemente se utilizaron métodos espectrométricos y espectroscópicos para investigar los cambios metabólicos en bovinos infectados natural y experimentalmente con MAP (13, 15-17). En detalle, los estudios metabolómicos, llevados a cabo en sueros de bovinos infectados experimentalmente con MAP utilizandoespectrometría de resonancia magnética nuclear (RMN) 1 H, mostraron cambios metabolómicos relacionados con la escasez de energía, el aumento del metabolismo de las grasas y la alteración del recambio de proteínas (13). Taylor et al. examinaron primero los perfiles metabólicos de sueros de novillas Holstein-Frisona infectadas naturalmente con MAP y los compararon con los controles, encontrando cambios en algunos aminoácidos relacionados con la reprogramación bioquímica (16) y luego propusieron ácidos grasos poliinsaturados y eicosanoides como posibles biomarcadores para el diagnóstico de MAP (18). En nuestro estudio anterior, aplicamos el análisis directo en espectrometría de masas de alta resolución en tiempo real (DART-HRMS) junto con un enfoque de fusión de datos de nivel medio para desentrañar las características moleculares capaces de caracterizar químicamente los sueros animales en la etapa infectada e infecciosa (15).
El método del operador de selección y contracción mínima absoluta (LASSO, por sus siglas en inglés) produce clasificadores multiclase que involucran solo un pequeño subconjunto de metabolitos discriminantes (19-21). LASSO calcula un peso matemático para cada metabolito estadísticamente informativo, en función de su capacidad para caracterizar una determinada clase. La aplicación del método LASSO ya demostró su utilidad en la clasificación multiclase de tejidos cancerosos para el diagnóstico rápido en entornos intraquirúrgicos tras la integración con espectrometría de masas (20, 22, 23). Recientemente, LASSO mostró buenos rendimientos en la clasificación de muestras biológicas basadas en la información molecular capturada por RMN (24-26). Obsérvese que este método parsimonioso es menos susceptible al ruido ligado a la heterogeneidad de las muestras (27). En el estudio actual, se adoptó la combinación de química sanguínea y análisis de firmas de RMN de 1H, tras la integración con el método LASSO, para determinar de manera robusta las firmas activas de cambios metabólicos capaces de clasificar bovinos infectados (no infecciosos), infecciosos y negativos (control). Por último, se realizó un análisis de la vía de los metabolitos informativos extraídos por LASSO para revelar posibles metabolismos desregulados.
2. Métodos
2.1. Selección de animales
Se seleccionaron bovinos Holstein Frisón de cuatro granjas lecheras de la región del Véneto (Italia) con seroprevalencias iniciales conocidas de paratuberculosis de >10% y se dividieron en cohortes de edad según el ciclo de reproducción: novillas, vacas primíparas y plurivíparas. Un total de 356 animales fueron monitoreados hasta por 4 lactancias. Se recolectaron muestras de sangre y heces entre 30 ± 15 días antes de la fecha esperada de parto para minimizar las variaciones metabólicas individuales, excepto para las novillas jóvenes que se reclutaron a los 13-15 meses de edad. Durante el período de sequía media, las vacas no producen leche y los cambios metabólico-hormonales que conducen al parto de los terneros no están completamente establecidos. Se excluyeron del estudio los animales y bovinos afectados por PAM que presentaban otras enfermedades concurrentes o estaban bajo tratamiento farmacológico. La recolección de muestras de sangre se realizó bajo la autorización n. 506/2015 del Ministerio de Salud italiano para el uso de animales con fines experimentales.
2.2. Recogida de muestras y pruebas de JD
Se recogieron muestras de sangre de la vena yugular en tubos vacutainer libres de anticoagulante [Greiner Bio-One (Kremsmünster, Austria)], se dejaron coagular a temperatura ambiente durante 2-4 h y se centrifugaron a 3.000 x g durante 5 min. Las alícuotas de los sueros obtenidos se utilizaron para detectar anticuerpos séricos contra MAP utilizando un ELISA comercial (IDEXX Paratuberculosis Screening Ab, IDEXX Laboratories, Inc. Westbrook, MN, EE. UU.) y aplicando las instrucciones del fabricante para el análisis. Los sueros no concluyentes y positivos se sometieron a una prueba de confirmación bifásica ELISA (IDEXX Paratuberculosis Verification Ab, IDEXX Laboratories, Inc. Westbrook, MN, USA).
Se recogieron muestras fecales individuales de la ampolla rectal y se analizaron aplicando métodos de diagnóstico microbiológico y molecular para la identificación de la PMA. Todas las muestras se procesaron para su análisis mediante PCR directa en tiempo real IS900 (qPCR, Applied Biosystems, Nieuwerkerk a/d IJssel, Países Bajos) según Pozzato et al. (28, 29), mientras que el cultivo se llevó a cabo mediante un método de doble descontaminación en medios líquidos Middlebrook 7H9 modificados (7H9+). Después de 6 semanas de cultivo, los caldos 7H9+ se examinaron mediante tinción de Ziehl-Nielsen y PCR en tiempo real, según lo informado por nuestro trabajo previo (27a). Una alícuota fecal de cada animal se almacenó a -80 °C para posibles análisis futuros.
2.3. Asignación del estado de salud de JD y selección de muestras para el análisis de RMN de 1H y para la determinación de índices sanguíneos
De 356 animales, se recolectaron un total de 854 muestras de suero durante el período de estudio, lo que resultó en un valor promedio de 2,40 muestras por ganado (rango 1-5). En cuanto a la prueba de JD, la frecuencia de animales positivos a lo largo del período de estudio fue del 6,23% por serología y del 11,05% por PCR/cultivo fecal. Al final del estudio prospectivo, se asignó el estado de infeccioso a las muestras de suero de aquellos animales que dieron positivo en PCR o cultivo fecal. Para excluir a los «excrementos pasivos» (30) y asegurar una mayor confianza en el estado, decidimos seleccionar también aquellos animales que habían seroconvertido para MAP por ELISA. Suponiendo que la infección se produjo en el primer año de vida, el estado de infectado (no infeccioso) se asignó retrospectivamente a la muestra previa de los bovinos clasificados como infecciosos, en la que todas las pruebas de JD (ELISA, PCR y cultivo) arrojaron resultados negativos. Finalmente, el estado de negativo se asignó a los animales de cohorte expuestos de los mismos rebaños infectados que dieron negativo repetidamente a lo largo del período de estudio y mostraron al menos un resultado negativo de JD posterior después de la fecha de muestreo seleccionada. Estos animales control fueron emparejados a los casos de acuerdo con la fecha de muestreo y la categoría de edad (novillas, vacas primíparas y vacas plurivíparas) con el fin de minimizar la variabilidad debida a las condiciones dietéticas y de manejo. El número medio de muestreos para estos animales fue de 2,84 (rango 2-4). De la colección de sueros almacenados a -80 °C, se seleccionaron 23 sueros de animales infecciosos, 10 sueros de animales infectados y 26 sueros de animales negativos, y luego se sometieron a un análisis de RMN de 1H y a la determinación de índices sanguíneos. La edad promedio de los animales seleccionados fue de 53,5 meses (oscilando entre 13 y 119 meses).
2.4. Preparación y análisis de muestras de RMN de 1H
La muestra de suero seco se reconstituyó con 200 μL de agua ultrapura. Posteriormente, se añadieron 50 μL de una solución tampón estándar (54% D2O: 46% 810 mM KH2PO4 pH 7,0 v/v que contenía 5 mM DSS (2,2-dimetil-2-silcepentano-5-sulfonato), 5,84 mM de carboxilato de 2-cloropirimidina-5 y 0,1% de NaN3 en H2O) a la muestra reconstituida. A continuación, la muestra diluida y tamponada (250 μL) se transfirió a un tubo de RMN SampleJet de 3 mm para su posterior análisis espectral. Todos los espectros de 1H-RMN se recogieron en un espectrómetro Avance III de 700 MHz (Bruker Daltonics, Bremen, Alemania) equipado con una criosonda de gradiente de campo pulsado (PFG) HCN de 5 mm con gradiente Z. Los espectros de RMN-1H se adquirieron a 25 °C utilizando el primer transitorio de la secuencia de pulsos de presaturación NOESY (noesy1dpr), elegida por su alto grado de precisión cuantitativa. Todos los decaimientos de inducción libre (FID) se llenaron en ceros hasta 250 K puntos de datos. El singlete producido por los grupos metilo DSS se utilizó como estándar interno para la referencia de cambio químico (establecido en 0 ppm) y para la cuantificación.
2.5. Cuantificación de RMN mediante MagMET
Para la cuantificación, todos los espectros de RMN-H 1 se procesaron y analizaron utilizando un paquete de software MagMET desarrollado internamente (31). MagMET permite el análisis cualitativo y cuantitativo de un espectro de RMN mediante el ajuste automático de las firmas espectrales de una base de datos interna al espectro. En concreto, el ajuste espectral de los metabolitos se realizó utilizando la biblioteca estándar de metabolitos séricos. Normalmente, se asignaron todos los picos visibles. La mayoría de los picos visibles estaban anotados con un nombre compuesto. Se ha demostrado previamente que este procedimiento de ajuste proporciona una precisión de concentración absoluta del 90% o mejor (31).
2.6. Índices sanguíneos
Los índices bioquímicos se determinaron en muestras de suero utilizando kits comerciales dedicados aplicados al analizador automatizado de química clínica, Cobas C501 (Roche Diagnostics, Mannheim, Alemania). Los ácidos grasos no esterificados (NEFA) y β-hidroxibutirato (BHB) se determinaron con un kit colorimétrico producido por Randox (Randox Laboratories Ltd, Crumlin, UK), mientras que la concentración de haptoglobina (Hp) se obtuvo utilizando los reactivos del Tridelta Phase Haptoglobin Colorimetric Assay (Tridelta Development Limited, Maynooth, County Kildare, Irlanda): NEFA, BHB y Hp se analizaron siguiendo la aplicación específica del fabricante para el analizador Cobas C501. Se necesitaron casi 200 μL de cada muestra para el análisis bioquímico como volumen muerto, pero solo se utilizaron 2,0, 6,0 y 3,8 μL para medir NEFA, b-OHB y HP, respectivamente. La electroforesis sérica se realizó en un sistema semiautomático de gel de agarosa (Hydrasys LC Sebia, Bagno a Ripoli, FI, Italia). Se realizó electroforesis sérica para evaluar la relación A/G y el patrón proteico de fase aguda. Solo se utilizaron 10 μL para la electroforesis de proteínas séricas, mientras que 2,0 μL se utilizaron para el análisis de proteínas totales en Cobas 501. El porcentaje de cada fracción proteica, determinado por análisis electroforético, se convirtió en la concentración absoluta (g/L) a partir de la concentración total de proteína obtenida por el método biuret en el analizador Cobas C501.
2.7. Análisis estadístico
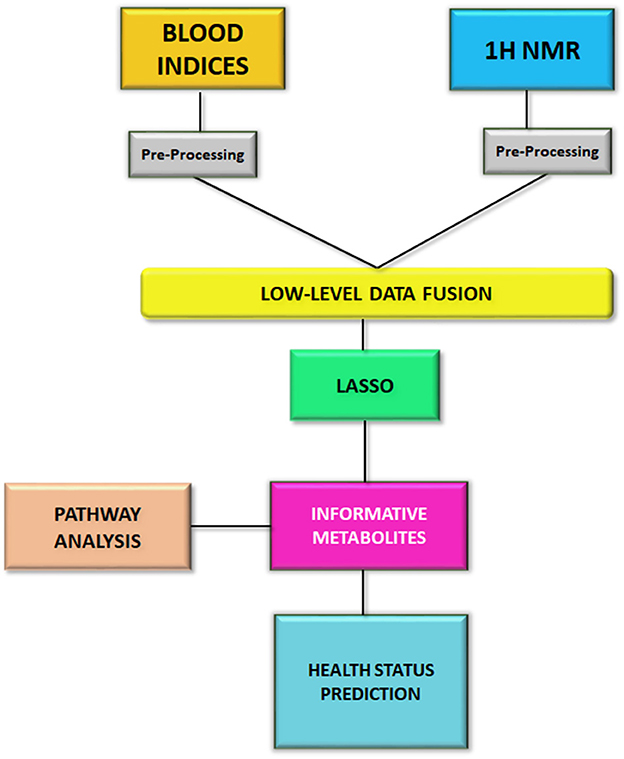
El análisis estadístico se realizó mediante el uso del software RStudio 4.0.2 con el paquete caret (32), un paquete útil para la implementación del modelo. Los datos de RMN de 1H procesados se escalaron automáticamente, mientras que los datos de química sanguínea se imputaron por el vecino k-más cercano y luego se escalaron automáticamente. Posteriormente, los dos conjuntos de datos se concatenaron mediante fusión de datos de bajo nivel. La fusión de datos de bajo nivel es una simple concatenación de datos en una tabla única (33-36). El conjunto de datos fusionado se sometió al método LASSO, una regresión multinomial con penalización L1 optimizada mediante una búsqueda en cuadrícula, con los objetivos de i) seleccionar y reducir variables, y ii) predecir el estado de salud de los animales, es decir, negativos, infectados por MAP o infecciosos por MAP. Además, con el fin de seleccionar el mejor clasificador generado por LASSO, se realizó una validación cruzada de 5 veces repetidas 10 veces en los datos concatenados utilizando las características informativas recuperadas. Para ello, dividimos los datos en un 75% de datos para entrenar el modelo (47 animales) y un 25% para probarlo (12 animales). Para cada iteración, la división de entrenamiento/prueba fue diferente. En la primera iteración, el modelo se probó con datos de prueba (12 animales) y se calcularon los errores de prueba. Después de 50 iteraciones, se determinó el promedio de los errores de la prueba y se calcularon la sensibilidad (tasa de verdaderos positivos), la especificidad (tasa de verdaderos negativos) y la precisión. El flujo de trabajo estadístico de este estudio se presenta en la Figura 1.
2.8. Análisis de la vía
El análisis de la vía metabólica se realizó utilizando la sección «análisis de la vía» de la plataforma web en www.metaboanalyst.ca. Después de cargar los metabolitos discriminantes obtenidos por el LASSO, y los valores cuantitativos de los metabolitos (concentraciones obtenidas por RMN y química sanguínea), se realizó el análisis de la ruta metabólica con el fin de investigar las posibles vías metabólicas que podrían tener significativamente relevancia en animales infectados e infecciosos. El análisis de vías es una forma de análisis de topología, y aplica un algoritmo de prueba global (37) para probar diferencialmente metabolitos en grupos funcionalmente relacionados y una centralidad relativa para estimar la importancia de un compuesto en una ruta metabólica dada. Dado que el análisis de la vía en la plataforma web de Metaboanalyst solo permite una comparación binaria, comparamos (i) el ganado infectado con MAP frente a los animales negativos y ii) el ganado infeccioso con MAP frente a los animales negativos. De acuerdo con el valor p resultante y el valor de impacto, el análisis muestra gráficamente las vías que podrían alterarse entre cada par de etapas MAP comparadas. El análisis de la vía proporciona para cada vía: (i) una lista de los metabolitos emparejados sobre el número total de metabolitos, (ii) el valor p bruto, (iii) el valor p ajustado por el método de Holm-Bonferroni, (iv) el valor p ajustado por la tasa de falsos descubrimientos (FDR), y v) el valor de impacto de la vía. En la gráfica, las rutas superiores se clasifican según los valores p ajustados (eje y) y el número total de aciertos que determinan el impacto de la ruta (eje x). Los valores de corte para los resultados de los análisis de ruta fueron: puntuación de impacto >0,1, tasa de falsos descubrimientos (FDR) < 0,25 y valor p < 0,05. El umbral de FDR < 0,25 denota la confianza de «posible», mientras que el umbral de FDR < 0,05 se considera de «confianza alta» (38).
Además, el color del nodo se basa en el valor p relevante y el radio del nodo se determina en función de su valor de impacto en la trayectoria. Un radio grande significa un valor de impacto alto, un radio pequeño significa un valor de impacto bajo. Finalmente, el color se gradúa del blanco (valor p alto) al amarillo, naranja y rojo (valor p bajo).
3. Resultados
3.1. Metabolitos significativos
La lista de metabolitos cuantificados en las muestras analizadas por RMN-1H y prueba de química sanguínea se presenta en la Tabla Suplementaria S1. Después de la fusión de datos de bajo nivel, el método LASSO recuperó y validó los metabolitos estadísticamente significativos (Figura 2A) dentro de un enfoque de validación cruzada. El LASSO tiene la capacidad de minimizar las variables estadísticamente significativas y, por lo tanto, desentrañar un pequeño patrón de metabolitos capaz de discriminar cada grupo de estudio. El LASSO fue capaz de reducir eficazmente la cantidad de metabolitos significativos para el diagnóstico mediante la selección de un total de 29 moléculas que podían predecir de forma fiable el estado de salud (con respecto a la infección por MAP) de los animales. La Figura 2A y la Tabla Suplementaria S2 reportan la lista de metabolitos y los pesos asignados por el LASSO. El LASSO calcula un peso matemático para cada característica estadísticamente informativa en función de la importancia de la concentración (obtenida por RMN y química sanguínea) para una clase. Las características que no contribuyeron a discriminar una clase recibieron un peso de cero y se descartaron. A cada metabolito cuya concentración era importante para caracterizar las tres clases específicas se le asignó un peso elevado. Como se muestra en la Figura 2A, el magnesio, la D-glucosa, la betaína, la creatinina, la L-asparagina y el isopropanol fueron las variables que permitieron al LASSO predecir que una muestra pertenecía a animales infectados. En la misma línea, el patrón metabólico de hidroxiisovalerato, acetoacetato, creatina quinasa, oxoglutarato, proteína total, ácido láctico, albúmina, bilirrubina, creatina y β-hidroxibutirato fue indicativo de bovinos infecciosos.
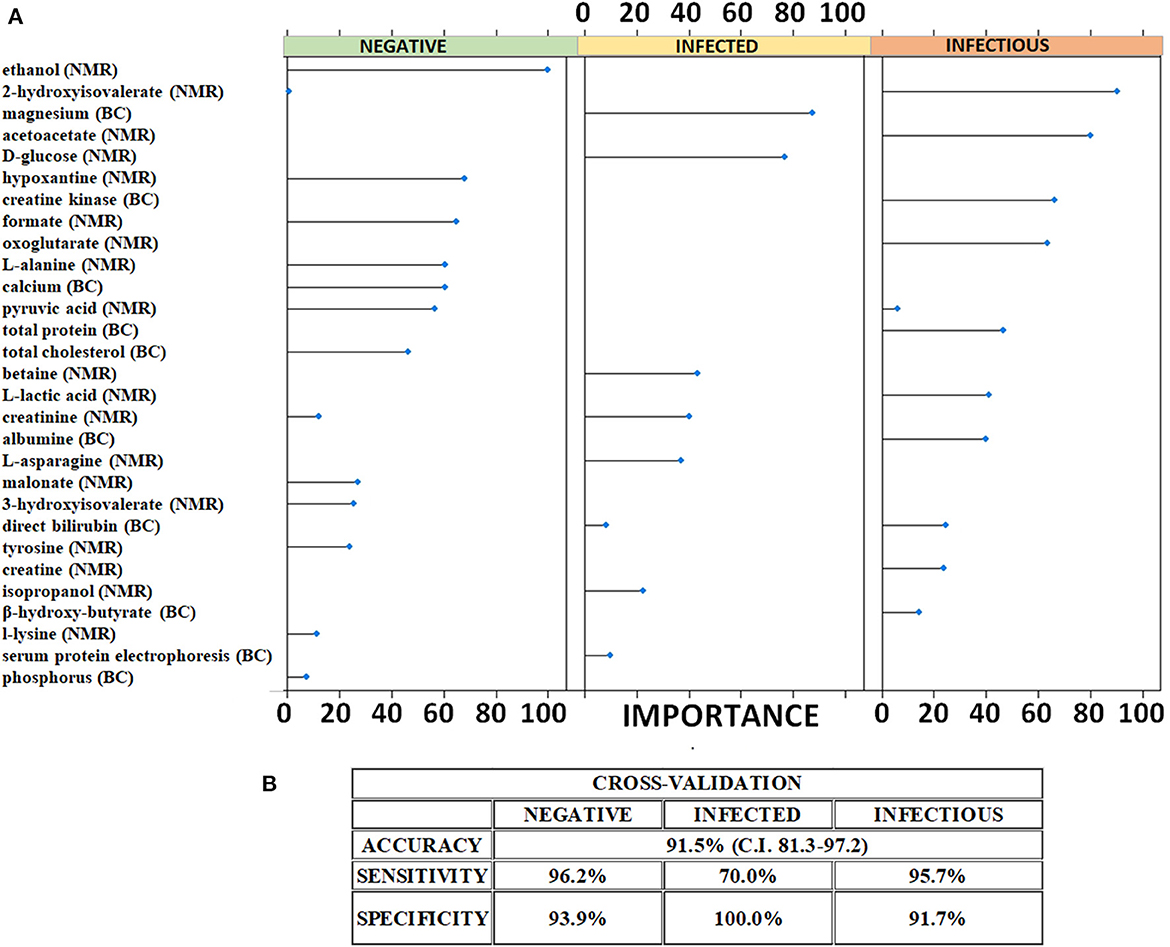
3.2. Clasificador LASSO
Estas características moleculares seleccionadas se utilizaron para construir un clasificador que fue validado de forma cruzada. Los resultados de la validación cruzada se presentan en la Figura 2B. Se realizó una validación cruzada repetida de k-fold para la evaluación del modelo. Los resultados de la validación cruzada se muestran en la matriz de confusión reportada en la Tabla Suplementaria S3. El clasificador clasificó correctamente los sueros de control 25/26 de negativos, 7/10 sueros de infectados y 22/23 sueros de animales infecciosos. A partir de los resultados de la validación cruzada, se calcularon los indicadores estadísticos. El clasificador LASSO alcanzó una precisión general del 91,5% (IC del 95%: 81,3-97,2) con altos valores de sensibilidad y especificidad para cada clase. En concreto, mostró una sensibilidad del 96,2% y una especificidad del 93,9% en la predicción correcta de animales negativos. Los animales infectados fueron predichos correctamente por el clasificador LASSO con una especificidad muy alta (100%) y una sensibilidad moderada (70%). Finalmente, el clasificador también categorizó al ganado infeccioso con una sensibilidad del 96% y una especificidad del 92%.
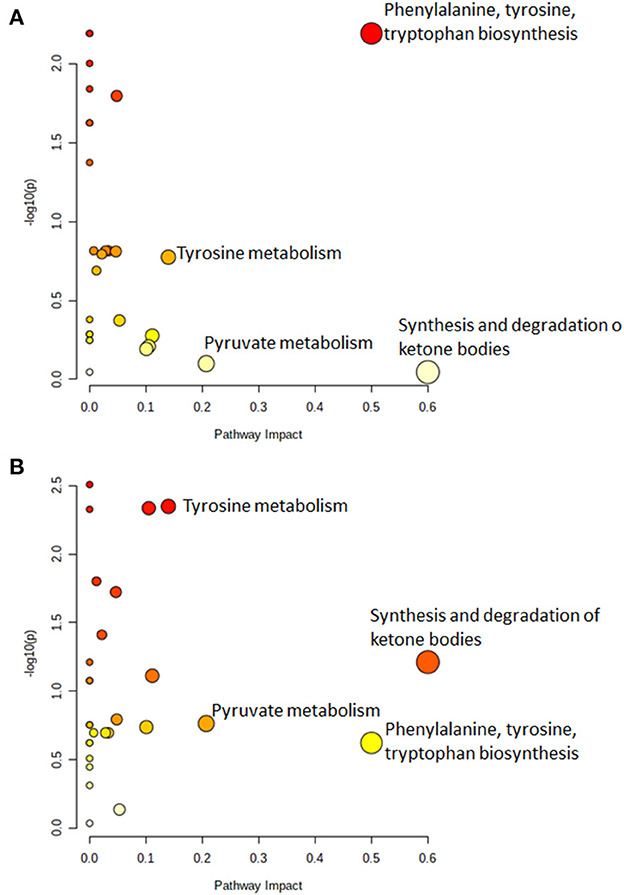
3.3. Análisis de vías
La Figura 3 muestra las vías significativamente alteradas tanto en el ganado infectado como en el infeccioso. Específicamente, las vías desreguladas (considerando los valores de corte para la puntuación de impacto de la vía >0.1, la tasa de falsos descubrimientos (FDR) < 0.25 y el valor p < 0.05) en bovinos infectados, es la biosíntesis de fenilalanina, tirosina y triptófano (Figura 3A). En el ganado infeccioso, la síntesis y degradación de los cuerpos cetónicos y el metabolismo de la tirosina fueron las vías metabolómicas más relevantes potencialmente involucradas en la variación observada de los metabolitos séricos (Figura 3B). Todos los valores p, FDR y valores de impacto se informan en las Tablas Suplementarias S4 y S5 del material complementario.
4. Discusión
El diagnóstico precoz de la EJ es un reto considerable (7). Esta es la razón por la que varios autores han aplicado recientemente alguna combinación de nuevos métodos (13, 15-17) para proporcionar evidencia temprana de infección por MAP en el ganado bovino, para lo cual las pruebas diagnósticas comunes fallan. En este estudio, verificamos la capacidad de laRMN 1 H combinada con la química sanguínea para distinguir eficazmente entre animales negativos, infectados naturalmente e infecciosos, y para identificar algunos metabolitos que podrían estar asociados con la etapa latente de la infección por MAP. El descubrimiento de vías inesperadamente desreguladas es notablemente más exitoso cuando se realizan análisis no dirigidos, y dicho descubrimiento se ve reforzado por la combinación de fuentes de datos (39). En el presente trabajo, el análisis estadístico mediante un LASSO permitió establecer posibles marcadores moleculares de enfermedad y categorizar las muestras de suero según el estado de JD de los animales con alta precisión. En este estudio, capturamos con éxito los perfiles metabólicos característicos de animales sanos, infectados e infecciosos y, por lo tanto, identificamos vías metabólicas potencialmente alteradas asociadas con estos tres estados de salud diferentes. Nuestro análisis de la vía reveló que el ganado infectado con MAP tiene perturbada la biosíntesis de fenilalanina, tirosina y triptófano: estas observaciones concuerdan con De Buck et al., quienes informaron aumentos significativos en el aminoácido tirosina (junto con treonina, isoleucina, leucina y asparagina) en ganado infectado experimentalmente con MAP (13). Por otro lado, Tata et al. encontraron un aumento de los niveles de triptamina en el ganado infectado e infeccioso con MAP, en comparación con los controles (15). En la misma línea, observamos un metabolismo alterado del aminoácido tirosina en animales infecciosos (Figura 3B). Las alteraciones en el metabolismo de los aminoácidos podrían deberse a su utilización por las células inmunitarias o a una absorción restrictiva por el sistema digestivo (17). La alteración de la síntesis y degradación de los cuerpos cetónicos revelada por nuestro análisis de la vía ya fue reportada en 2014 por De Buck et al. en bovinos infectados experimentalmente (13). Esto es consistente con un déficit energético y una mayor movilización de las reservas de lípidos. Tenga en cuenta que se sabe que la síntesis y degradación de la vía metabólica de los cuerpos cetónicos se regula al alza cuando las fuentes de glucosa están severamente restringidas y, en consecuencia, se produce un exceso de cuerpos cetónicos. Si bien el cuerpo cetónico, la acetona, fue uno de los metabolitos más discriminatorios en el ganado infectado con MAP en el estudio previo realizado en 2014 (13), no observamos cambios significativos en la concentración de acetona en nuestros datos brutos actuales, ni después de haber aplicado el método LASSO a estos datos. Tenga en cuenta que la acetona es una molécula muy volátil que puede perderse fácilmente de las muestras. Como se reporta en la Figura 3B, también observamos un aumento del metabolismo del piruvato en bovinos infecciosos, que también observamos en bovinos infectados con MAP, y con un impacto y valor p menores. Es probable que esto se deba a la alteración del metabolismo glucolítico en estos bovinos.
Algunas limitaciones marcan nuestra firma metabólica, con RMN de 1H e índices sanguíneos, además del descubrimiento de biomarcadores metabólicos que se pueden utilizar en el análisis de rutina: (i) el pequeño tamaño de la muestra de muestras clínicas en la etapa de validación estadística para evaluar la capacidad de predicción del método; (ii) la influencia potencial de la dieta y el manejo del rebaño en la huella metabólica. Si bien estamos seguros de que la asignación retrospectiva de los animales infecciosos es altamente confiable, no podemos excluir que los animales categorizados como negativos podrían haber pasado recientemente a un estado diferente.
5. Conclusión
El enfoque propuesto permitió avanzar un paso más en la comprensión y diagnóstico de la PMA. Se observaron alteraciones del metabolismo de los aminoácidos. Mientras que el metabolismo de la tirosina se alteró significativamente en los bovinos infecciosos, la biosíntesis de fenilalanina, tirosina y triptófano se desreguló en los infectados. De acuerdo con los hallazgos científicos previos en bovinos infectados experimentalmente, también se confirmó una perturbación de la síntesis y degradación de los cuerpos cetónicos en animales infecciosos. Se están llevando a cabo más investigaciones para validar el método en nuevas muestras y así evaluar el efecto de la dieta y el manejo del rebaño sobre los marcadores informativos.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue revisado y aprobado por el Ministerio de Salud italiano con la autorización n.º 506/2015. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
RP, JD y NP: concibieron, diseñaron y supervisaron la investigación. AT e IP: analizaron los datos y escribieron el texto principal del manuscrito y realizaron las Figuras 1 a 3. MB, LP, BD, AS y VB: realizaron la investigación. AM: analizó estadísticamente los datos y proporcionó nuevas herramientas estadísticas. Todos los autores leyeron y aprobaron el manuscrito.
Financiación
Este trabajo fue apoyado por el proyecto de investigación del Ministerio de Salud italiano [número de subvención IZS VE 08/15 RC]: Applicazione di metodi spettroscopici e spettrometrici ad elevata capacità per l’identificazione di biomarcatori sierici associati all’infezione paratubercolare nei bovini da latte.
Reconocimientos
Los autores agradecen al Centro de Innovación Metabolómica (www.metabolomicscentre.ca) por el análisis de RMN.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1146626/full#supplementary-material
Referencias
1. Lambrecht RS, Collins MT. Factores de Mycobacterium paratuberculosis que influyen en la dependencia de micobactina. Diagn Microbiol Infect Dis. (1992) 15:239–46. doi: 10.1016/0732-8893(92)90119-E
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Sweeney RW. Transmisión de la paratuberculosis. Veterinario Clin North Am Food Animal Pract. (1996) 12:305–12. doi: 10.1016/S0749-0720(15)30408-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Whitlock RH, Buergelt C. Manifestaciones preclínicas y clínicas de la paratuberculosis (incluida la patología). Veterinario Clin North Am Food Animal Pract. (1996) 12:345–56. doi: 10.1016/S0749-0720(15)30410-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Clarke CJ. Patología y patogenia de la paratuberculosis en rumiantes y otras especies. J Comp Pathol. (1997) 116:217–61. doi: 10.1016/S0021-9975(97)80001-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Whittington R, Donat K, Weber MF, Kelton D, Nielsen SS, Eisenberg S, et al. Control de la paratuberculosis: quién, por qué y cómo. Una revisión de 48 países. BMC Vet Res. (2019) 15:198. doi: 10.1186/s12917-019-1943-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Fecteau ME. Paratuberculosis en bovinos. Veterinario Clin North Am Food Animal Pract. (2018) 34:209–22. doi: 10.1016/j.cvfa.10011
7. Nielsen SS, Toft N. Diagnóstico ante mortem de la paratuberculosis: una revisión de las precisiones de ELISA, ensayo de interferón-γ y técnicas de cultivo fecal. Microbiología Veterinaria. (2008) 129:217–35. doi: 10.1016/j.vetmic.12011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Salem M, Heydel C, El-Sayed A, Ahmed SA, Zschöck M, Baljer G, et al. Mycobacterium avium subespecie paratuberculosis: un problema insidioso para la industria de rumiantes. Trop Anim Salud Prod. (2013) 45:351–66. doi: 10.1007/s11250-012-0274-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Ceciliani F, Lecchi C, Urh C, Sauerwein H. Proteómica y metabolómica que caracterizan la fisiopatología de las reacciones adaptativas a los desafíos metabólicos durante la transición desde el final del embarazo hasta el comienzo de la lactancia en vacas lecheras. Revista de Proteómica. (2017) 178:92–106. doi: 10.1016/j.jprot.10010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Lisuzzo A, Laghi L, Faillace V, Zhu C, Contiero B, Morgante M, et al. Diferencias en el perfil del metaboloma sérico de vacas lecheras según la concentración de BHB revelada por espectroscopia de resonancia magnética nuclear de protones (1H-NMRDConocencias en el perfil del metaboloma sérico de vacas lecheras según la concentración de BHB revelada por espectroscopia de resonancia magnética nuclear de protones (1H-NMR). Sci Rep. (2022) 12:2525. doi: 10.1038/s41598-022-06507-x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Lisuzzo A, Laghi L, Fiore F, Harvatine K, Mazzotta E, Faillace V, et al. Evaluación del perfil metabolómico mediante espectroscopía 1H-RMN en ovejas afectadas por hipercetonemia postparto. Sci Rep. (2022) 12:16463. doi: 10.1038/s41598-022-20371-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Seth M, Lamont EA, Janagama HK, Widdel A, Vulchanova L, Stabel JR, et al. Descubrimiento de biomarcadores en infecciones micobacterianas subclínicas de bovinos. PLoS UNO. (2009) 4:E5478. doi: 10.1371/journal.pone.0005478
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Buck, D. e., Shaykhutdinov, J., Barkema, R. y Vogel, H. W. H. J. Perfil metabolómico en bovinos infectados experimentalmente con Mycobacterium avium subsp. paratuberculosis. PLoS UNO. (2014) 9:E111872. doi: 10.1371/journal.pone.0111872
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Wood PL, Erol E, Hoffsis GF, Steinman M, DeBuck J. Lipidómica sérica de la paratuberculosis bovina: interrupción de los glicerofosfolípidos y esfingolípidos que contienen colina. SAGE Medicina Abierta. (2018) 6:2050312118775302. doi: 10.1177/2050312118775302
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Tata A, Pallante I, Massaro A, Miano B, Bottazzari M, Fiorini P, et al. Perfiles metabolómicos séricos de bovinos lecheros infectados e infecciosos por paratuberculosis mediante espectrometría de masas ambiental. Frente Vet Sci. (2021) 7:5067. doi: 10.3389./fvets.2020.625067
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Taylor EN, Beckmann M, Villarreal-Ramos B, Vordermeier HM, Hewinson G, Rooke D, et al. Los cambios metabolómicos en vaquillonas Holstein-Frisonas infectadas naturalmente por el mapa indican una reprogramación bioquímica inmunológicamente relacionada. Metabolitos. (2021) 11:727. doi: 10.3390/metabo11110727
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Taylor EN, Beckmann M, Markey BK, Gordon SV, Hewinson G, Rooke D, et al. Los cambios metabolómicos en el ganado Holstein-Frisona desafiado por Mycobacterium avium subsp. paratuberculosis (MAP) destacan el papel de los aminoácidos séricos como indicadores de la activación del sistema inmunológico. Metabolómica. (2022) 18:1–12. DOI: 10.1007/S11306-022-01876-W
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Taylor EN, Beckmann M, Hewinson G, Rooke D, Mur LA, Koets AP. Cambios metabolómicos en ácidos grasos poliinsaturados y eicosanoides como biomarcadores de diagnóstico en vaquillonas Holstein-Frisonas inoculadas por Mycobacterium avium ssp. paratuberculosis (MAP). Res. Veterinaria. (2022) 53:68. doi: 10.1186/s13567-022-01087-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Tibshirani R. Regresión de contracción y selección a través del lazo. J Royal Stat Soc Serie B (Methodol). (1996) 58:267–88. doi: 10.1111/j.2517-6161.1996.tb02080.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Zhang J, Li SQ, Lin JQ, Yu W, Eberlin LS. Las imágenes por espectrometría de masas permiten discriminar el oncocitoma renal de los subtipos de cáncer de células renales y los tejidos renales normales. Cáncer Res. (2020) 80:689–98. doi: 10.1158/0008-5472.CAN-19-2522
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Massaro A, Bragolusi M, Tata A, Zacometti C, Lefevre S, Frégière-Salomon A, et al. Autenticación no dirigida de pimienta negra utilizando una plataforma web local: desarrollo, validación y desafíos postanalíticos de un método combinado de espectroscopia NIR y LASSO. Control de alimentos. (2022) 109477. doi: 10.1016./j.foodcont.2022.109477
22. Eberlin LS, Tibshirani RJ, Zhang J, Longacre TA, Berry GJ, Bingham DB, et al. Evaluación molecular de los márgenes de resección quirúrgica del cáncer gástrico mediante imágenes de espectrometría de masas. Proc Natl Acad Sci USA. (2014) 111:2436–41. doi: 10.1073/pnas.1400274111
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Sans M, Gharpure K, Tibshirani R, Zhang J, Liang L, Liu J, et al. Marcadores metabólicos y predicción estadística de la agresividad del cáncer de ovario seroso mediante espectrometría de masas de ionización ambiental. Cáncer Res. (2017) 77:2903–13. doi: 10.1158/0008-5472.CAN-16-3044
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Hochrein J, Klein MS, Zacharias HU, Li J, Wijffels G, Schirra HJ, et al. Evaluación del rendimiento de algoritmos para la clasificación de huellas metabólicas de RMN 1H. J Proteoma Res. (2012) 11:6242–51. doi: 10.1021/PR3009034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Zacharias HU, Altenbuchinger M, Gronwald W. Análisis estadístico de las huellas metabólicas de RMN: métodos establecidos y avances recientes. Metabolitos. (2018) 8:47. doi: 10.3390./metabo8030047
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Cardoso MR, Silva AA, Talarico MC, Sanches PH, Sforça ML, Rocco SA, et al. Metabolomics by NMR combined with machine learning to predict neoadjuvant chemotherapy response for breast cancer. Cancers. (2022) 14:5055. doi: 10.3390/cancers14205055
27. Katz L, Tata A, Woolman M, Zarrine-Afsar A. Lipid profiling in cancer diagnosis with hand-held ambient mass spectrometry probes: addressing the late-stage performance concerns. Metabolites. (2021) 11:660. doi: 10.3390./metabo11100660
28. Pozzato N, Gwozdz J, Gastaldelli M, Capello K, Ben CD, Stefani E, et al. Evaluation of a rapid and inexpensive liquid culture system for the detection of Mycobacterium avium subsp. paratuberculosis in bovine faeces. J Microbiol Methods. (2011) 84:413–7. doi: 10.1016/j.mimet.2011.01.019
29. Pozzato N, Stefani E, Capello K, Muliari R, Vicenzoni G. Mycobacterium avium subsp. paratuberculosis como plantilla en la evaluación de kits automatizados para la extracción de ADN de órganos bovinos. Mundo J Microbiol Biotechnol. (2011) 27:31–7. doi: 10.1007/s11274-010-0423-6
30. Sweeney RW, Whitlock RH, Hamir AN, Rosenberger AE, Herr SA. Aislamiento de Mycobacterium paratuberculosis después de la inoculación oral en bovinos no infectados. Am J Vet Res. (1992) 53:1312–4.
31. Ravanbakhsh S, Liu P, Bjorndahl TC, Mandal R, Grant JR, Wilson M, et al. Perfiles espectrales de RMN precisos y totalmente automatizados para metabolómica. PLoS UNO. (2015) 10:e0124219. doi: 10.1371/journal.pone.0124219
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Kuhn M. Caret: entrenamiento en clasificación y regresión. Código fuente de la astrofísica. Biblioteca ascl. (2015) 1505:003.
33. Biancolillo A, Bucci R, Magrì AL, Magrì AD, Marini F. Fusión de datos para la caracterización multiplataforma de una cerveza artesanal italiana destinada a su autenticación. Analytica Chimica Acta. (2014) 820:23–31. doi: 10.1016/j.aca.02024
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Pirro V, Oliveri P, Ferreira CR, González-Serrano AF, Machaty Z, Cooks RG, et al. Caracterización lipídica de ovocitos porcinos individuales mediante DESI-MS de modo dual y fusión de datos. Chim Acta Anal. (2014) 848:51–60. doi: 10.1016/j.aca.08001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Massaro A, Stella R, Negro A, Bragolusi M, Miano B, Arcangeli G, et al. Nuevas estrategias para la diferenciación de pescado fresco y congelado/descongelado: un método rápido y preciso no dirigido mediante espectrometría de masas ambiental y fusión de datos (parte A). Control de alimentos. (2021) 130:108364. doi: 10.1016/j.foodcont.2021.108364
36. Tata A, Massaro A, Riuzzi G, Lanza I, Bragolusi M, Negro A, et al. Espectrometría de masas ambiental para la autenticación rápida de leche de forraje alpino o de tierras bajas. Sci Rep. (2022) 12:7360. doi: 10.1038/s41598-022-11178-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Goeman JJ, van de Geer SA, Kort de, van Houwelingen FHC. Una prueba global para grupos de genes: prueba de asociación con un resultado clínico. Bioinformática. (2004) 20:93–9. doi: 10.1093/bioinformática/BTG382
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Uzun A, Dewan AT, Istrail S, Padbury JF. Análisis genético basado en vías de parto prematuro. Genómica. (2012) 101:163–70. doi: 10.1016/j.ygeno.12005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. MacNeil SM, Johnson WE, Li DY, Piccolo SR, Bild AH. Inferencia de la desregulación de la vía en los cánceres a partir de múltiples tipos de datos ómicos. Genoma Med. (2015) 7:61–61. doi: 10.1186/s13073-015-0189-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: paratuberculosis, LASSO, RMN, metabolómica, modelo de predicción, biomarcador, análisis de vías, Mycobacterium avium subsp. paratuberculosis
Cita: Massaro A, Tata A, Pallante I, Bertazzo V, Bottazzari M, Paganini L, Dall’Ava B, Stefani A, De Buck J, Piro R y Pozzato N (2023) Firma metabólica de ganado lechero infectado e infeccioso por Mycobacterium avium subsp. paratuberculosis mediante la integración de análisis de resonancia magnética nuclear e índices sanguíneos. Frente. Vet. Sci. 10:1146626. doi: 10.3389/fvets.2023.1146626
Recibido: 17 de enero de 2023; Aceptado: 09 de marzo de 2023;
Publicado: 17 de abril de 2023.
Editado por:
José L. Gonzales, Universidad e Investigación de Wageningen, Países Bajos
Revisado por:
Marta Alonso-Hearn, Instituto Vasco de Investigación y Desarrollo Agrario-Alianza Vasca de Investigación y Tecnología (BRTA), España
Enrico Fiore, Universidad de Padua, Italia
Derechos de autor © 2023 Massaro, Tata, Pallante, Bertazzo, Bottazzari, Paganini, Dall’Ava, Stefani, De Buck, Piro y Pozzato. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Alessandra Tata, atata@izsvenezie.it
†Estos autores comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía