Evaluación de la protección cruzada de una vacuna contra el PRRS MLV de dosis reducida frente al desafío del PRRSV similar a NADC30
 Jiayu Liu1†
Jiayu Liu1† Xinyu Yan2†
Xinyu Yan2† Wensi Wu1
Wensi Wu1 Yan Li1
Yan Li1 Shuaibin Xing1
Shuaibin Xing1 Shan Zhao2
Shan Zhao2 Xiaobo Huang2
Xiaobo Huang2 Qin Zhao2
Qin Zhao2 Yiping Wen2
Yiping Wen2 Sanjie Cao2
Sanjie Cao2 Senyan Du2
Senyan Du2 Qigui Yan2*
Qigui Yan2* Nanfang Zeng1*
Nanfang Zeng1*- 1Giantstar Farming & Husbandry Co., Ltd, Chengdu, Sichuan, China
- número arábigoFacultad de Medicina Veterinaria, Universidad Agrícola de Sichuan, Chengdu, Sichuan, China
Introducción: En la actualidad, la cepa similar a NADC30 se ha convertido en la cepa predominante del PRRSV en China. Muchos estudios han encontrado que las vacunas comerciales existentes son ineficaces o proporcionan solo una protección limitada. Ningún estudio ha investigado la protección cruzada de diferentes dosis de vacunas comerciales MLV contra el PRRSV similar a NADC30. Por lo tanto, este estudio evaluó la efectividad de varias dosis contra una infección por PRRSV similar a NADC30 utilizando vacunas comerciales contra PRRSV, Ingelvac PRRS MLV, que se han utilizado ampliamente en China.
Métodos: En este estudio, inmunizamos lechones con cuatro dosis diferentes de la vacuna MLV e infectamos lechones por vía nasal con PRRSV de FQ similar a NADC30 a los 28 días después de la vacunación. Observamos el estado de los cerdos antes y después del desafío con la cepa de PRRSV CF similar a NADC30 y reflejamos el efecto protector de diferentes dosis de la vacuna MLV a través de múltiples ensayos.
Resultados: En comparación con los lechones inmunizados con 1 dosis, los lechones inmunizados con 0,01 dosis tuvieron un mejor rendimiento, como la ganancia diaria promedio más alta antes del desafío, menos lesiones y viremia después del desafío, bajo puntaje clínico y temperatura estable durante el estudio. Sin embargo, los lechones inmunizados con la dosis de 0,01 seguían mostrando viremia, se detectaron virus en los pulmones, las amígdalas y los ganglios linfáticos inguinales, y se produjeron lesiones patológicas en el pulmón. La tinción inmunohistoquímica del pulmón de los lechones vacunados reveló una carga viral similar a la de los lechones no vacunados, lo que sugiere que la inmunización no pudo eliminar completamente el virus de los tejidos de los lechones vacunados.
Discusión: Nuestra investigación sugiere que la vacuna MLV podría proporcionar una protección limitada contra la infección por PRRSV similar a NADC30, y reducir la dosis a 0,01 puede producir una mejor eficacia protectora. En el contexto de la identificación del objetivo inmunológico, la comprensión de la virulencia del virus en el campo y la garantía de la seguridad, podríamos ser capaces de reevaluar las dosis de vacunación para lograr un mayor valor económico.
1 Introducción
El síndrome reproductivo y respiratorio porcino (PRRS) es la principal causa de muerte que afecta a la industria porcina, aparte de la peste porcina africana (1, 2). El agente etiológico del PRRS es el virus del síndrome respiratorio y reproductivo porcino (PRRSV), que pertenece al orden Nidovirales, familia Arteriviridae (3). Desde su primer descubrimiento en 1996, el PRRSV ha sido prevalente en China durante aproximadamente 30 años. El virus del síndrome respiratorio y reproductivo porcino (PRRSV) es un virus de ARN positivo, pequeño, monocatenario y con envoltura. De acuerdo con la última clasificación, el PRRSV se clasificó en el género Porartevirus, familia Arteriviridae y orden Nidovirales (4). Sobre la base de la investigación filogenética y las características del genoma del virus, el PRRSV con dos genotipos puede clasificarse a su vez en varios subgenotipos (5). Lelystad y VR2332 son las cepas representativas del genotipo 1 europeo y del genotipo 2 norteamericano del PRRSV, respectivamente (6).
En 2001, se aisló una cepa variante del PRRSV, MN184, de cerdas en los Estados Unidos (7). El análisis de la secuencia de genes completos reveló 131 deleciones discontinuas de aminoácidos en la región nsp2 de la cepa, incluida una deleción de 111-aa en la posición 322-432, una deleción de 1-aa en la posición 483 y una deleción de 19-aa en la posición 504-522. En 2008, se notificó en Iowa, EE.UU., una cepa de PRRSV-2 altamente virulenta con las mismas características, a saber, la cepa NADC30, asociada a enfermedades respiratorias graves (8). Desde 2013, China ha notificado varias cepas del virus similares a los nucleótidos de NADC30, denominadas PRRSV similares a NADC30, y su prevalencia ha sido cada vez más extensa, surgiendo en más de 13 provincias o regiones (9). La tasa de detección del PRRSV similar al NADC30 ha aumentado gradualmente y ha superado al HP-PRRSV como la principal cepa circulante en algunas áreas de China desde 2016 (10, 11). Por ejemplo, las pruebas de muestras clínicas de la provincia de Henan, en el centro de China, encontraron que el 83,3% de los aislados pertenecían a la cepa similar a NADC30 (12). Hasta ahora, China ha utilizado ampliamente cinco vacunas comerciales contra el PRRSV, que utilizan las cepas de virus correspondientes: JXA1-P80 (linaje 8), HuN4-F112 (linaje 8), GDr180 (linaje 8), TJM-F92 (linaje 8) y VR2332 (linaje 5) (12). Entre ellos, el más utilizado es Ingelvac PRRS MLV (13). En la actualidad, la mayoría de las vacunas disponibles en el mercado solo proporcionan una protección parcial y un alivio de los síntomas contra las cepas similares a NADC30, pero no pueden lograr una inmunidad total (14), y las empresas gastan mucho dinero en ellas. La cepa PRRS MLV de Ingelvac pertenece al virus del linaje 5, mientras que el PRRSV similar a NADC30 pertenece al linaje 1 según los sistemas de clasificación globales de PRRSV (6). De acuerdo con nuestra investigación, la dosis de la vacuna se ha reducido generalmente en la industria clínica porcina, de 1 dosis (104.8 TCID50) a 0.5 dosis (5 × 103.8 TCID50). Desde el punto de vista de los mecanismos inmunológicos, el concepto tradicional de dosis de vacuna suele ser un valor fijo determinado por un gran número de ensayos clínicos. Considerar la reducción adecuada de las dosis de vacunas desafía esta comprensión establecida. Los estudios anteriores sobre el uso de vacunas se han centrado en el efecto preventivo de la enfermedad, y se ha prestado relativamente poca atención al costo del uso de las vacunas. El estudio sobre la reducción del uso de vacunas es un análisis y una evaluación exhaustivos de los costos y beneficios del uso de vacunas desde la perspectiva de los beneficios económicos. Por lo tanto, en este estudio, se utilizó un desafío de PRRSV similar a NADC30 a los 35 días después de la vacunación (dpv) para evaluar la efectividad protectora de varias dosis de PRRS MLV de Ingelvac en lechones vacunados.
2 Materiales y métodos
2.1 Virus, células y vacuna MLV
La vacuna Ingelvac PRRS MLV, comprada a Boehringer Ingelheim, Alemania, es una vacuna comercial contra el PRRSV viva modificada que incluye la cepa del virus VR2332. La vacuna MLV se diluyó en varias dosis: 1 dosis (104,8 TCID50), 0,5 dosis (5 × 103,8 TCID50), 0,1 dosis (103,8 TCID50) y 0,01 dosis (102,8 TCID50), con procedimientos de vacunación realizados de acuerdo con las pautas del fabricante. La cepa viral utilizada en este estudio fue CF, un PRRSV aislado similar a NADC30 proporcionado por Chengdu SG-Biotech Co., Ltd.
2.2 Ensayos con animales para vacunación y provocación
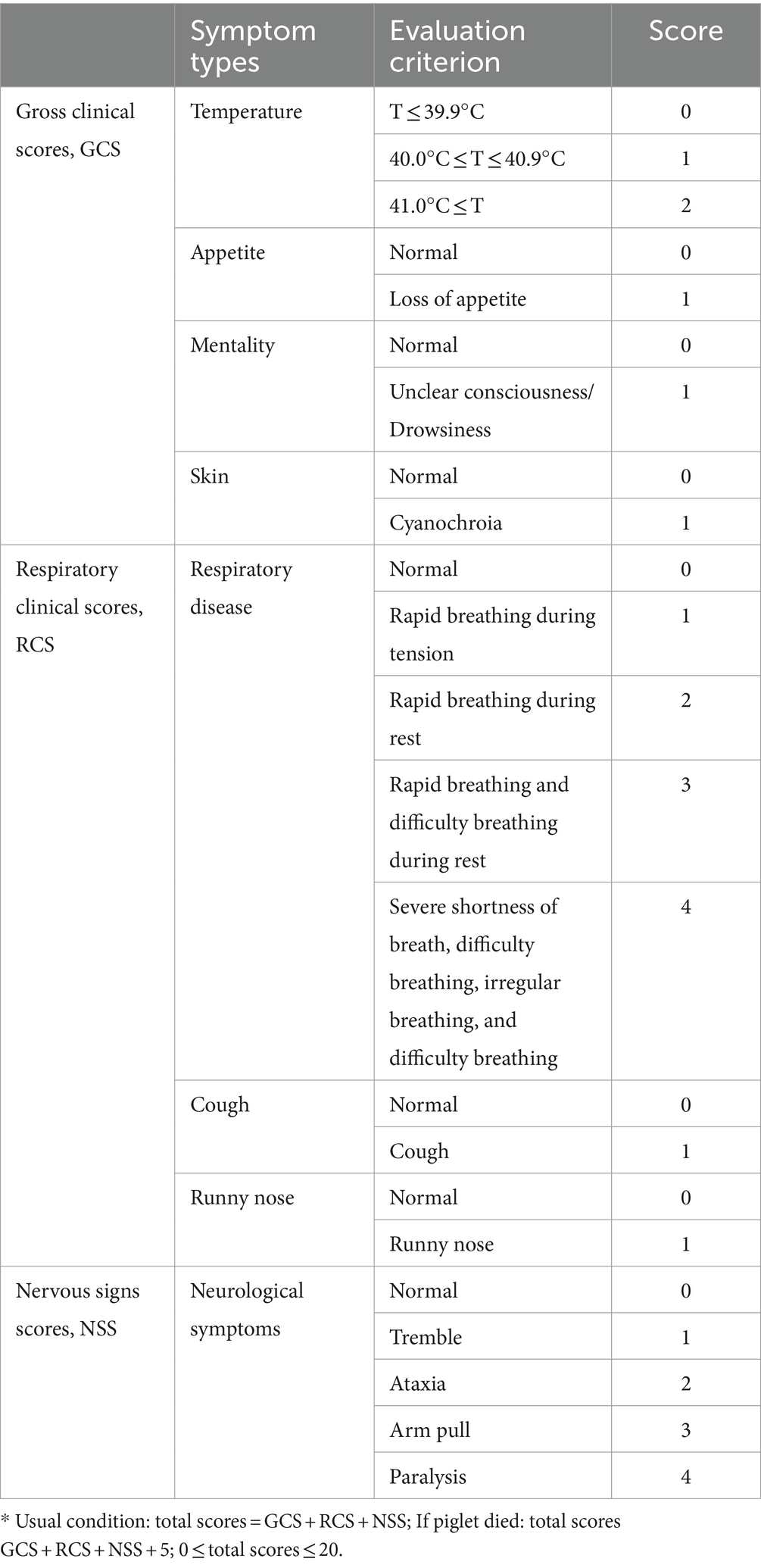
Un total de 35 lechones de 3 semanas de edad que estaban libres del circovirus porcino 2 (PCV2), el virus de la peste porcina clásica (PPC), el virus de la pseudorrabia (PRV) y el PRRSV se asignaron aleatoriamente a siete grupos, cada uno compuesto por cinco lechones. Se les inoculó por vía intramuscular (IM) con solución salina tamponada con fosfato (PBS) y 1 dosis, 0,5 dosis, 0,1 dosis y 0,01 dosis de vacuna. Treinta y cinco días después de la vacunación, los lechones fueron provocación intranasal (2 mL en total). Un simulacro y cada uno de los grupos vacunados fue desafiado con una dosis de 105 TCID50/mL de PRRSV FQ. La temperatura corporal rectal y los signos clínicos de los lechones se registraron una vez cada 2 días durante todo el experimento, y el peso corporal se midió cada semana. Durante el experimento, se registró el estado de los lechones mediante puntuaciones, incluidas las puntuaciones clínicas brutas (GCS), las puntuaciones clínicas respiratorias (RCS) y las puntuaciones de signos nerviosos (NSS). Las reglas de puntuación específicas se muestran en la Tabla 1. Todos los lechones fueron sacrificados humanamente a los 28 días después del desafío (dpc).
2.3 Serología y prueba de viremia
La sangre de los lechones se extrajo de la vena cava anterior cada semana después de la inmunización y a los 7, 14, 21 y 28 días después de la vacunación para identificar la viremia y los anticuerpos específicos contra el PRRSV. Una vez recogida la muestra de sangre, se deja a temperatura ambiente durante 1-2 horas para permitir que se solidifique de forma natural y precipite el suero. El suero extraído se dividió en tubos de centrífuga asépticos secos y limpios, se etiquetó y se colocó en un refrigerador de temperatura ultrabaja a -80 °C. El kit de prueba de anticuerpos contra el virus del síndrome respiratorio y reproductivo porcino PRRS 2XR de IDEXX (IDEXX Laboratories) se utilizó según las indicaciones del fabricante para evaluar los títulos de anticuerpos ELISA específicos del PRRSV. Se utilizaron las proporciones S/P para informar los títulos de anticuerpos específicos contra el PRRSV, y las muestras de suero se consideraron positivas si la relación S/P era de 0,4 o más.
El ARN total se extrajo de muestras de suero utilizando el kit de extracción de ADN/ARN del virus 2.0 (preenvasado) (Vazyme) y se almacenó en el refrigerador de temperatura ultrabaja de -80 °C. Utilizando el kit de sonda HiScript II U+ One Step qRT-PCR (Vazyme), se realizó una PCR en tiempo real utilizando el ADNc de cada muestra. De acuerdo con la secuencia conservada del gen M, los cebadores q-PCR y la sonda se diseñaron utilizando el software AlleleID 6.0. Los cebadores de PCR en tiempo real fueron PRRSV M-F: 5′-CACTACGGTCAACGGCACATT-3′; PRRSV M-R: 5′-GCATATTTGACAAGGTTTACCACTCC-3′. La sonda TaqMan se sintetizó como FAM-CTTTTCTGCCACCCACACGAGGCTT-DBQ. Las condiciones para la amplificación fueron 55 °C durante 15 min y 95 °C durante 30 s, seguidos de 45 ciclos de 95 °C durante 10 s y 60 °C durante 30 s. Se generó una curva estándar con patrones de plásmidos diluidos en serie 10 veces de 101–109 copias/μL. La carga viral de cada muestra se calculó utilizando la ecuación de la curva estándar construida anteriormente (y = 45,46-3,32x, R2 = 0,996).
2.4 Examen histopatológico e inmunohistoquímico
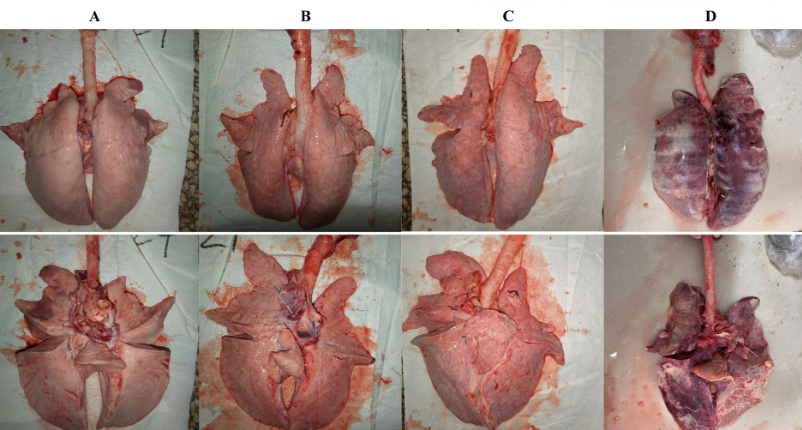
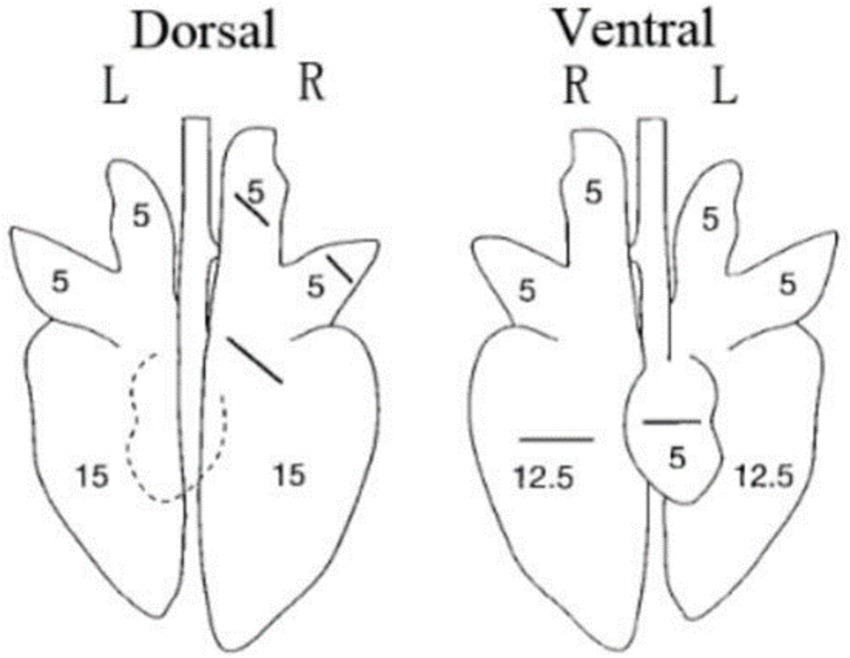
Todos los lechones fueron sacrificados humanamente a 28 dpc. En la necropsia, las tres partes del pulmón se fijaron en formalina neutra tamponada al 10% para la tinción con hematoxilina y eosina (H&E) e inmunohistoquímica. Se utilizaron fotos tomadas con un microscopio de 200× para visualizar los portaobjetos. Se observaron los pulmones y se registraron las lesiones y se puntuaron de acuerdo con la Figura 1 y la Tabla 2.
2.5 Análisis estadístico
Todos los datos se expresaron como el valor medio de 5 lechones ± SEM. Utilizando el programa GraphPad Prism 9 (San Diego, CA), se realizaron análisis estadísticos mediante la realización de ANOVA de dos vías y luego la prueba t de Tukey. Cuando p < 0,05, las diferencias se consideraron estadísticamente significativas.
3 Resultados
3.1 Presentación clínica y rendimiento del crecimiento de los lechones
Todos los datos se expresaron como el valor medio de cinco lechones ± SEM. Utilizando el programa GraphPad Prism 9 (San Diego, CA), se realizaron análisis estadísticos mediante la realización de ANOVA de dos vías y luego la prueba t de Tukey. Cuando p < 0,05, las diferencias se consideraron estadísticamente significativas.
Después de la vacunación, los lechones del grupo de dosis 1 mostraron síntomas leves, incluida una fiebre leve de 14 a 26 días después de la vacunación (dpv), que duró 12 días de ese período, y en el grupo de reducción de dosis, solo dos lechones del grupo de dosis 0,01 mostraron pérdida transitoria del apetito (menos activos en la comida, tiempo de alimentación prolongado y velocidad de alimentación más lenta) a 2 dpv (Figura 2A). De 18 a 22 dpv, las puntuaciones clínicas de los grupos inmunizados con 0,5 dosis y 0,01 dosis de vacunas fueron significativamente más bajas que las del grupo de 1 dosis. Los lechones del grupo de 1 dosis mostraron síntomas evidentes de fiebre, con temperaturas de hasta 41 °C de 14 dpv a 26 dpv (después de 13 días), y los grupos que redujeron la dosis no mostraron fiebre significativa, excepto en el grupo de dosis de 0,1 de 20 a 22 dpv (después de 3 días) (Figura 3). La ganancia diaria promedio del grupo de dosis 0,01 fue significativamente mayor que la de otros grupos de dosis inmunes antes del desafío (Figura 4A). Los grupos de dosis bajas mostraron una mayor seguridad y un mejor rendimiento de crecimiento antes del desafío.
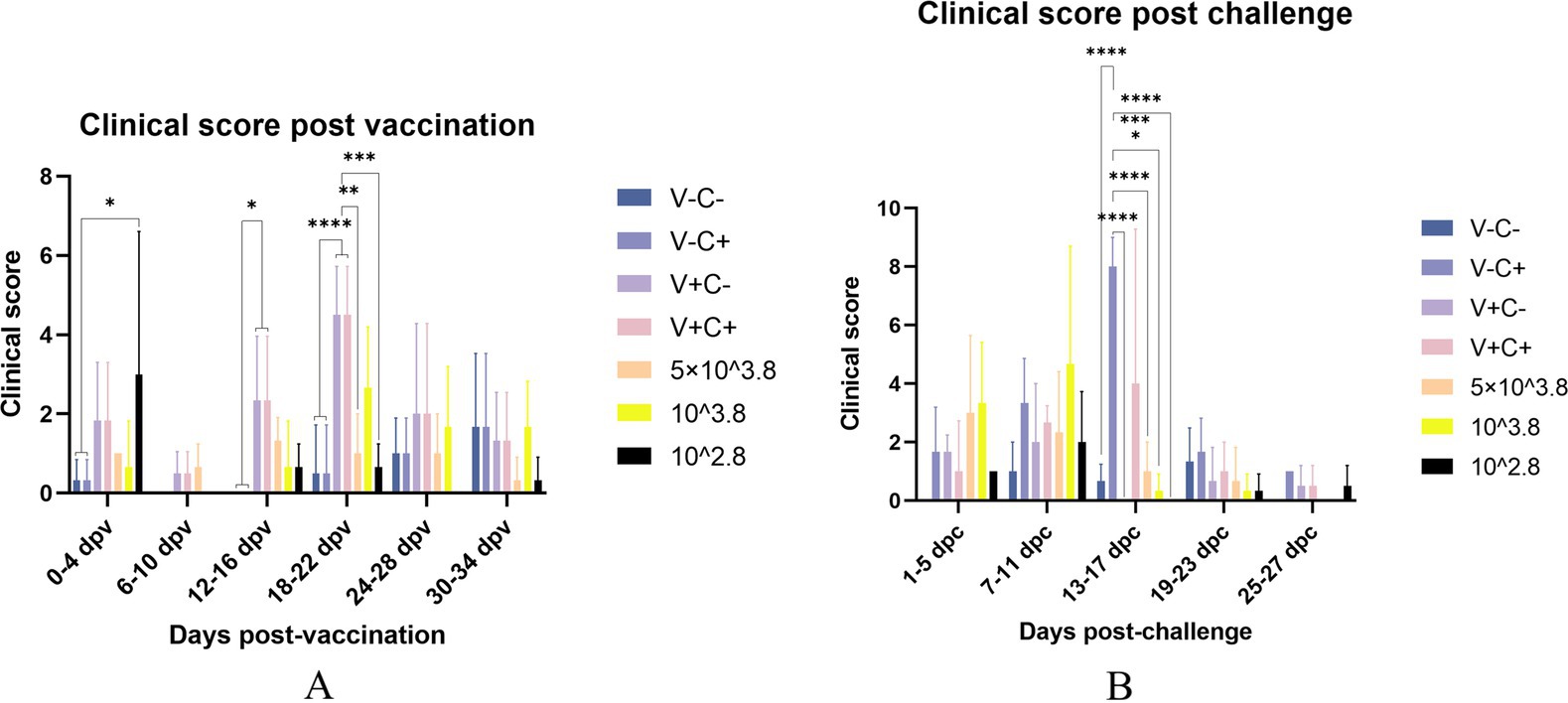
Figura 2. Puntuaciones clínicas evaluadas según la Tabla 1. Las puntuaciones clínicas de los lechones se registraron una vez cada 2 días y se compararon cada tres recuentos adyacentes. (A) Puntuación clínica post-vacunación en diferentes fechas. (B) Puntuación clínica post-desafío en diferentes fechas. V ± significa grupos con la vacuna o no. C ± significa grupos con el desafío o no. Todos los grupos de dosis reducida fueron desafiados. * Indica una diferencia estadísticamente significativa (*: p < 0,05; **: p < 0,01; ***: p < 0,001; ****: p < 0,0001).
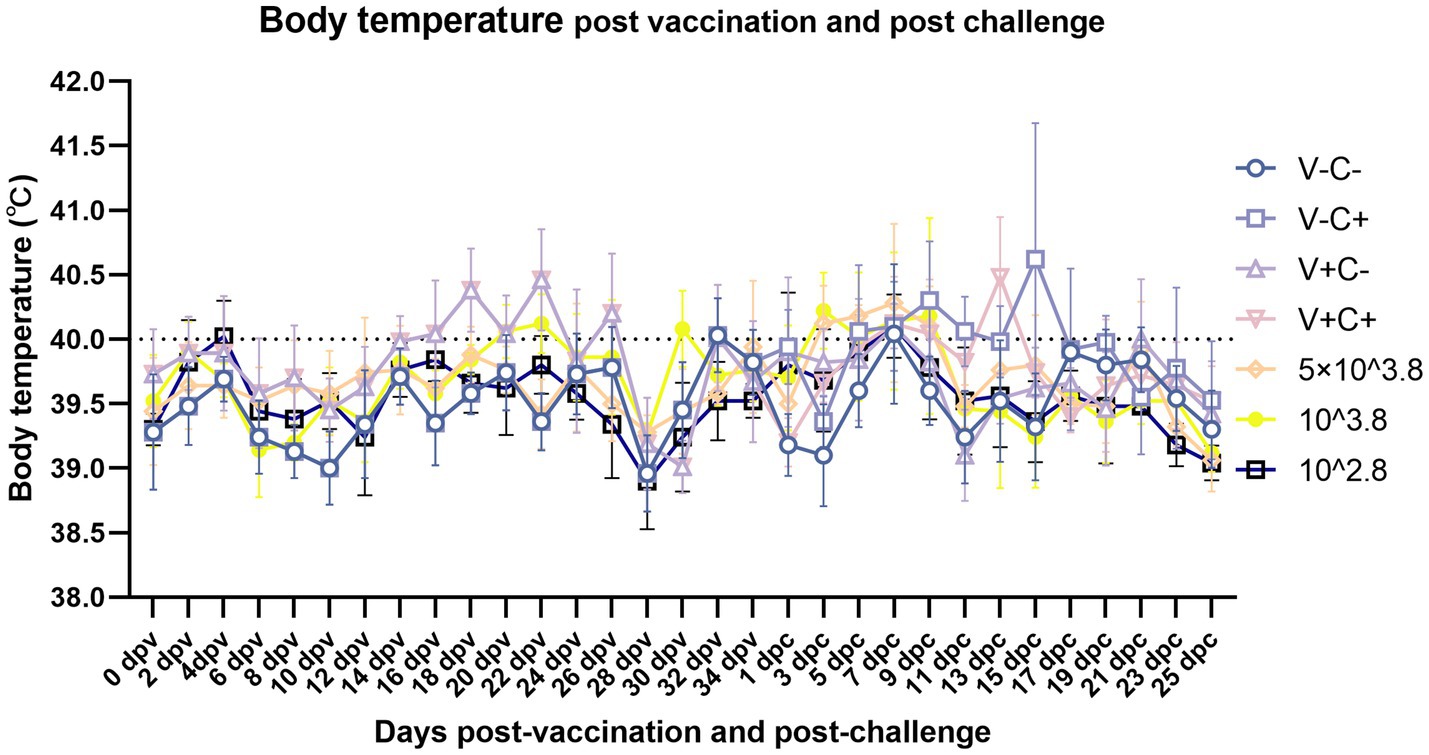
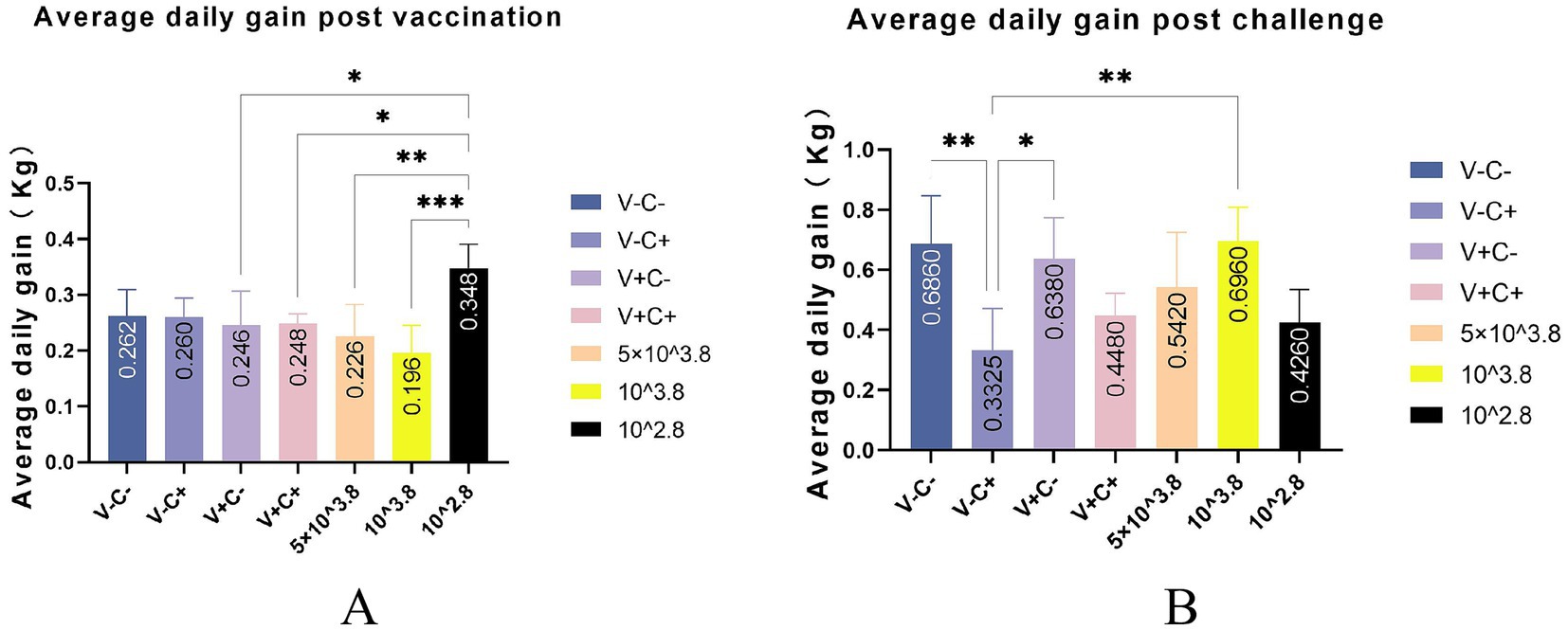
A los 35 dpv, los lechones del grupo de solución salina tamponada con fosfato (PBS), así como los que recibieron la dosis 1, la dosis 0,5, la dosis 0,1 y la dosis 0,01 de la vacuna, fueron desafiados con la cepa CF del PRRSV similar a NADC30. De acuerdo con la Figura 2B, las puntuaciones clínicas de los grupos desafiados inmunizados con la dosis 0,5, la dosis 0,1 y la dosis 0,01 de la vacuna fueron significativamente más bajas que las del control de desafío de 13 a 17 dpc. Los lechones del grupo de control de desafío tuvieron fiebre (hasta 41,6 °C) de 5 a 19 dpc (después de 15 días). Por el contrario, los lechones que recibieron la dosis de 0,5 (hasta 41,2 °C) y la dosis de 0,1 (hasta 41,3 °C) mostraron fiebre de 3 dpc a 9 dpc (después de 7 días), mientras que los del grupo de 1 dosis (hasta 40,9 °C) tuvieron fiebre de 7 dpc a 13 dpc (después de 7 días). Los lechones en el grupo de dosis 0,01 (hasta 40,7) mostraron fiebre solo a los 7 dpc (Figura 3). En particular, la ganancia diaria promedio del grupo de dosis 0.1 fue significativamente mayor que la del control de desafío (Figura 4B). Los datos posteriores al desafío mostraron que los lechones del grupo de dosis baja tenían síntomas más leves y un mejor rendimiento del crecimiento.
Un lechón del grupo de control de desafío murió a los 19 dpc, mientras que los lechones de otros grupos sobrevivieron hasta el final del experimento.
En resumen, antes del reto, reducir la dosis de forma adecuada tiene una mayor seguridad y un mejor rendimiento de crecimiento de los lechones. Después del desafío, la vacuna de dosis baja puede reducir significativamente los síntomas clínicos y reducir la temperatura y la duración de la fiebre causada por la cepa PRRSV CF similar a NADC30 en diversos grados. Además, el rendimiento del crecimiento de los lechones vacunados con una dosis reducida puede ser mejor que con 1 dosis después del desafío.
3.2 Examen anatomopatológico e histopatológico
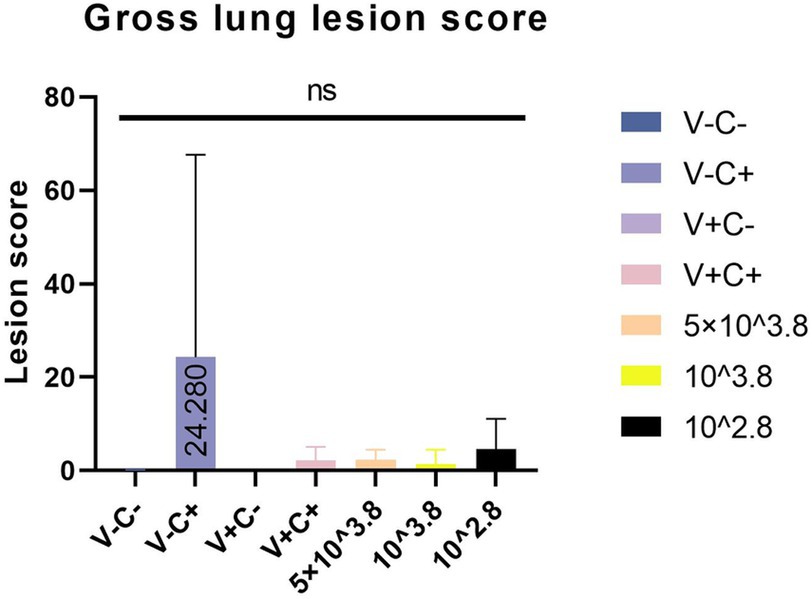
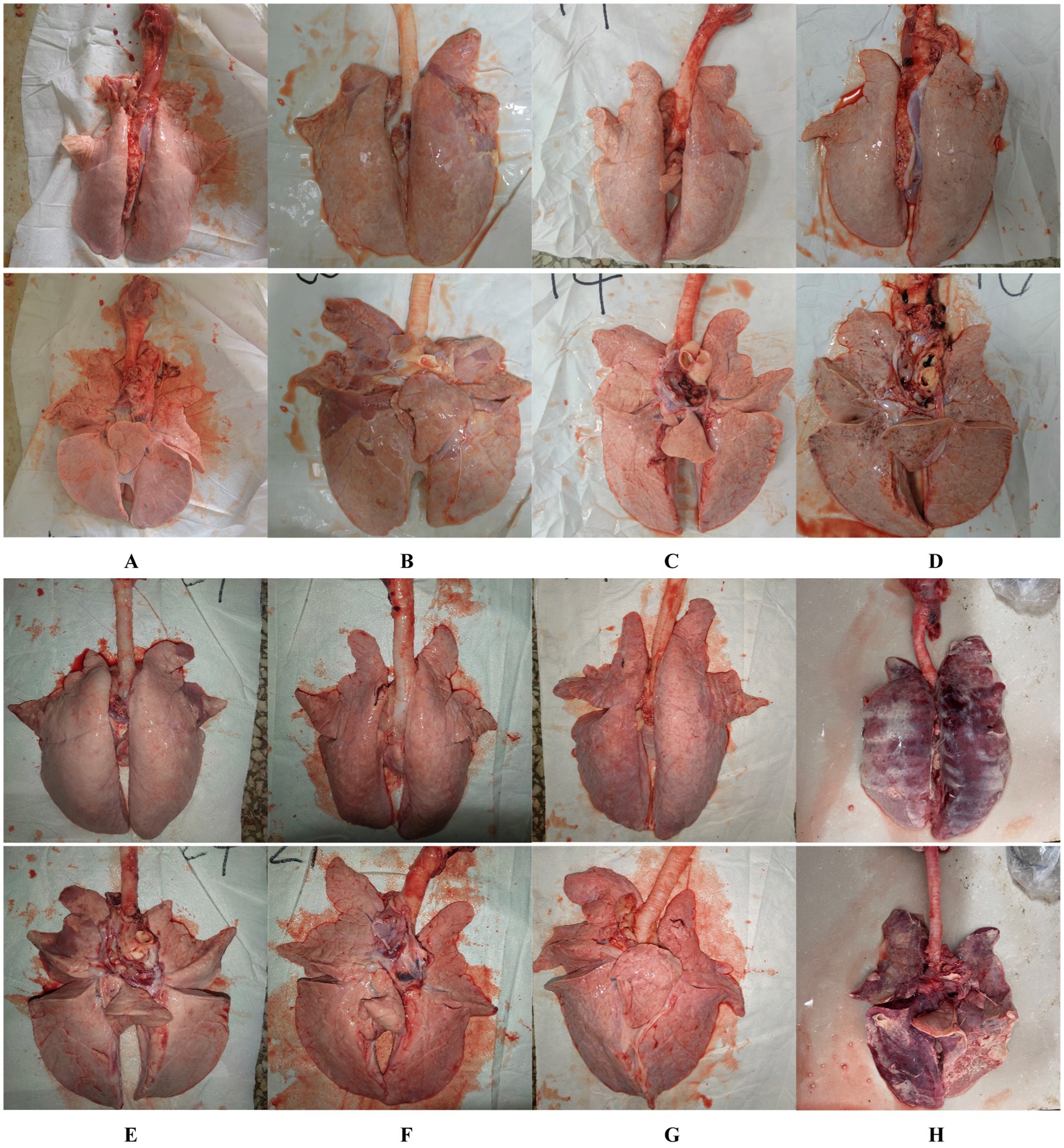
En la necropsia, se encontró hemorragia en los pulmones de los lechones del grupo 1dosis desafiado (Figura 5D). Se encontraron neumonía lobulillar evidente y límites de lesiones en los pulmones de los lechones del grupo control de provocación y de 0,5 dosis desafiadas (Figuras 5B, E). Había edema en los pulmones de los lechones del grupo control del virus atacado (Figura 5B). Los pulmones de los lechones muertos en el grupo control desafiado tenían neumonía lobar evidente y exudación celulósica severa (Figura 5H), y otros grupos no descritos parecían normales (Figuras 5A, C, F, G). No hubo diferencia en la puntuación de las lesiones macroscópicas pulmonares entre todos los grupos (Figura 6). En el examen histopatológico (figuras 7A-H), se encontró neumonía intersticial (la neumonía intersticial se caracterizó por el engrosamiento de los tabiques alveolares y la infiltración de células mononucleares) en los lechones de todos los grupos inmunizados y desafiados, pero el grupo de control de desafío mostró síntomas más graves. Las lesiones difusas con grandes áreas lesionales se encontraron en el lechón muerto del grupo control de desafío, y también se puede observar sangrado (Figuras 5, 7H). Sin embargo, en todos los grupos de desafío vacunados, uno o dos lechones mostraron lesiones difusas moderadas o una distribución severa de las lesiones. Se puntuaron las secciones de tejido pulmonar (Figura 7I), revelando que los grupos desafiados tenían puntuaciones significativamente más altas que el grupo de control negativo. Además, a excepción de los grupos de dosis 0.5 y 1 dosis, los otros grupos desafiados tuvieron puntuaciones significativamente más altas que el grupo de control inmunológico.
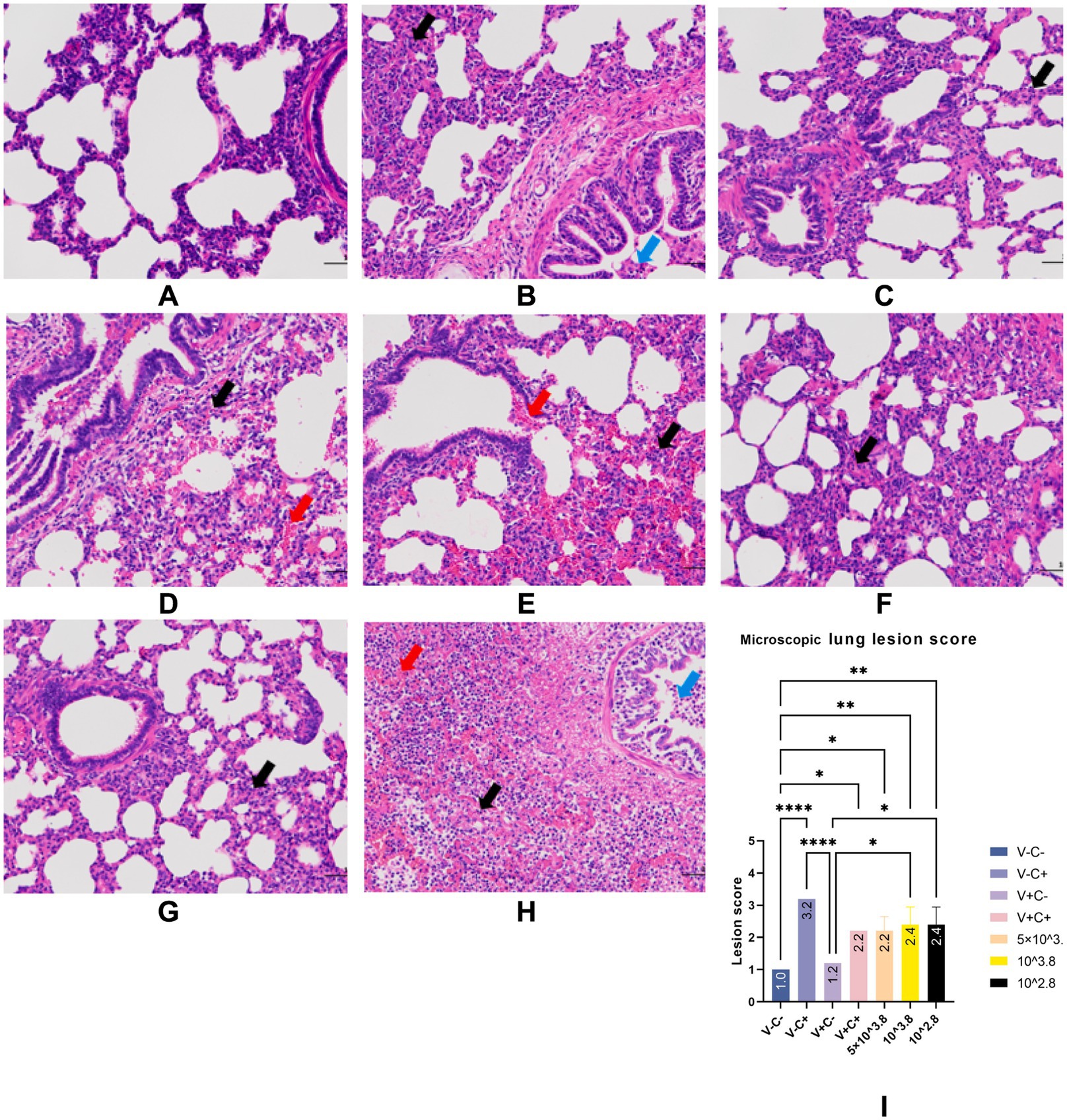
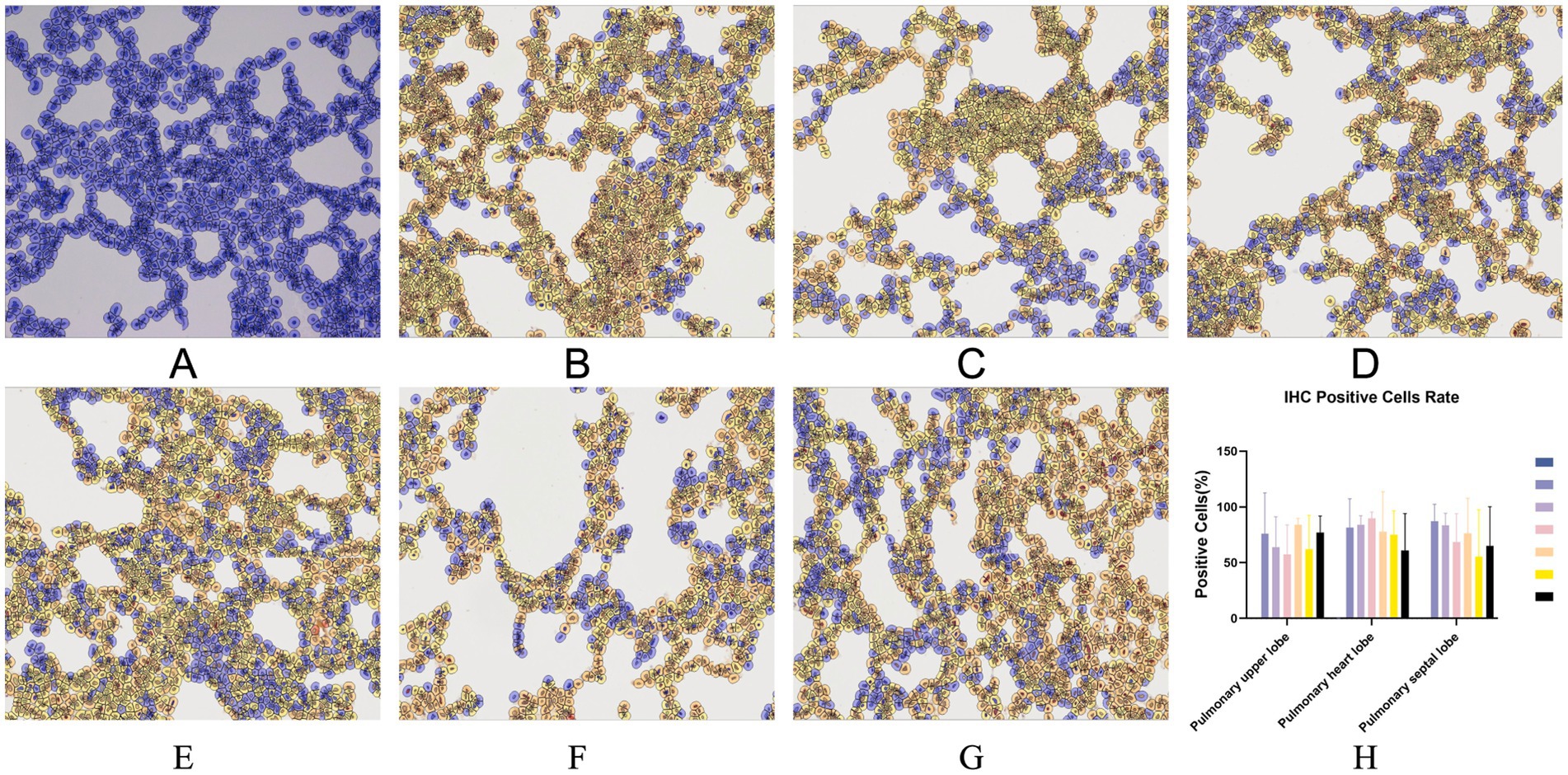
También se realizó una tinción inmunohistoquímica (IHQ) del pulmón para detectar el antígeno viral. Como se muestra en la Figura 8, a excepción del grupo de control negativo, no hubo diferencias significativas en las tasas de positividad celular entre los seis grupos restantes. No se detectó tinción positiva en los pulmones de los lechones del grupo de control negativo.
3.3 Examen de viremia
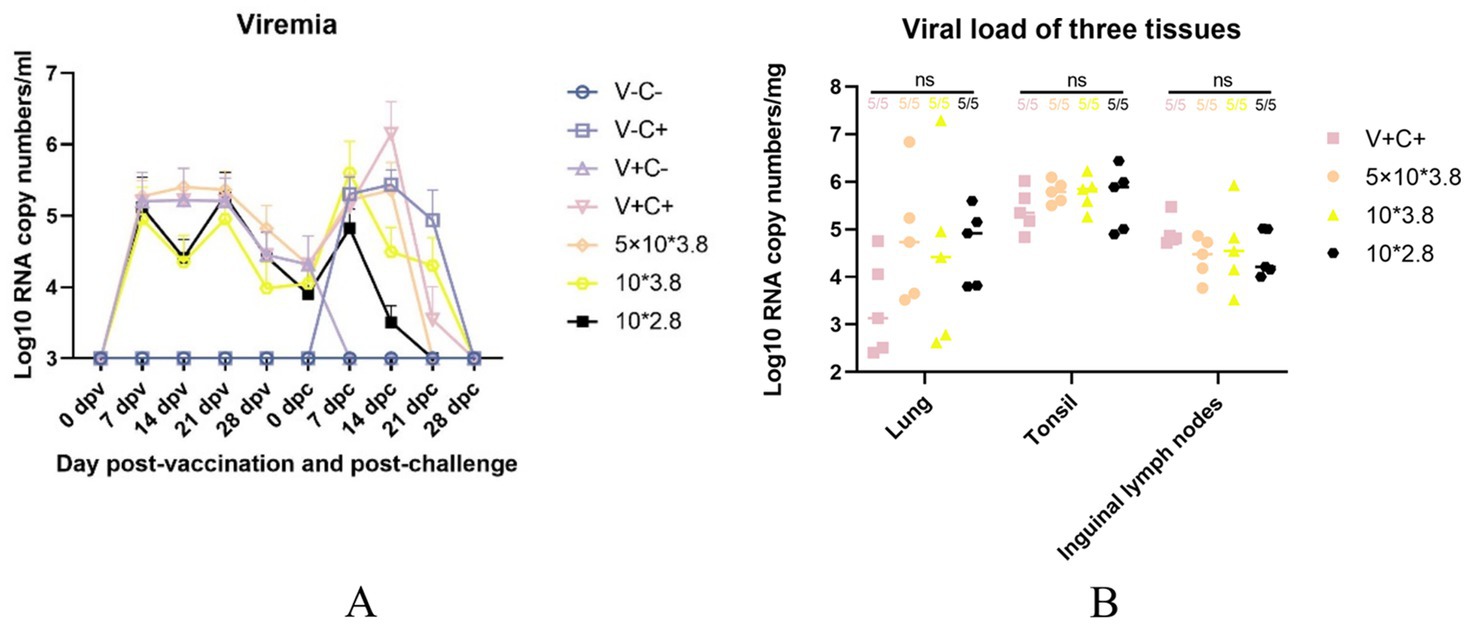
Se tomaron muestras de suero de cerdo a 0, 7, 14, 21, 28 dpv y 0, 7, 14, 21, 28 dpc para la evaluación de la viremia después de la inmunización y la provocación con PRRSV. Como se muestra en la Figura 9A, el grupo de 1 dosis tuvo sustancialmente más números de copias de ARN viral sérico que los otros grupos con 14 dpc. No hubo diferencias significativas en el número de copias de ARN del virus entre los grupos en otros momentos. De acuerdo con la Figura 9B, tampoco hubo diferencias significativas en el número de copias de ARN del virus entre los ganglios linfáticos pulmonares, amígdalos e inguinales de los grupos inmunizados y desafiados. Los datos muestran que los lechones de los grupos de la vacuna de dosis baja tenían una viremia más leve que el grupo de 1 dosis.
3.4 Prueba serológica
Tras la inmunización, se evaluaron los anticuerpos específicos contra el PRRSV mediante un kit ELISA de IDEXX. A los 14 dpv, todos los lechones de los grupos inmunizados mostraron anticuerpos PRRSV positivos, como se muestra en la Figura 10. A 14 dpv, el título de anticuerpos de los lechones en el grupo de dosis de 0,5 fue sustancialmente mayor que el de los grupos que recibieron 1 dosis y 0,1 dosis. A los 21 dpv, el título de anticuerpos de los lechones en el grupo de dosis de 0,5 fue significativamente mayor que el grupo de dosis de 0,1. A los 28 dpv, no hubo variación perceptible en los títulos de anticuerpos entre los grupos de inmunización. Los cerdos del grupo de control de provocación tenían anticuerpos positivos contra el PRRSV 14 días después de la provocación con PRRSV, y su título de anticuerpos fue sustancialmente menor que el de los cerdos de los grupos de dosis de 0,1 y 0,01. A 28 dpc, el título de anticuerpos de los lechones en el grupo de 1 dosis fue significativamente mayor que el grupo de control de desafío.
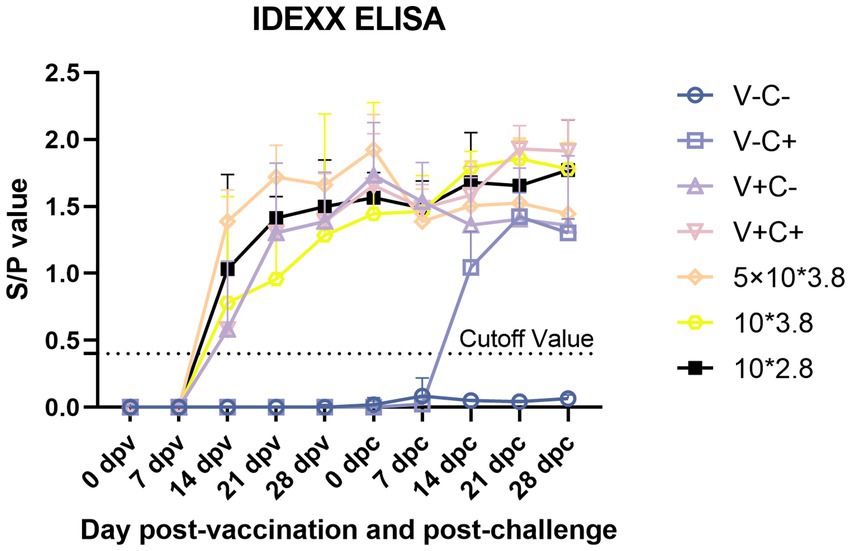
En general, antes del desafío, los lechones vacunados con 0,5 dosis mostraron el título de anticuerpos más alto. Después del desafío, la velocidad de producción temprana de anticuerpos de los lechones vacunados con dosis de 0,1 y 0,01 fue más rápida.
4 Discusión
La situación epidemiológica del PRRSV en China es extremadamente complicada y las características biológicas cambian constantemente con mutaciones y recombinaciones rápidas. La baja fidelidad durante la replicación del virus de ARN, los eventos de recombinación o las mutaciones aleatorias pueden conducir a la aparición de nuevas cepas de PRRSV (15, 16). A pesar de la disponibilidad de varias vacunas comerciales, las medidas de control efectivas del PRRSV en todo el mundo siguen siendo un desafío para la producción porcina. El uso de la vacuna MLV ha sido ampliamente aceptado en muchos países (17, 18). China ha hecho un uso extensivo de cinco vacunas comerciales MLV, pero la más utilizada sigue siendo Ingelvac PRRS MLV de Boehringer Ingelheim, y las granjas porcinas tienen una alta tasa de consumo de esta vacuna.
El PRRSV, similar al NADC30, ha sido prevalente en China desde 2013 y se ha convertido en una de las principales cepas epidémicas (9, 10). En términos genéticos, los PRRSV similares a NADC30 difieren de otras cepas de PRRSV porque contienen tres deleciones discontinuas en el gen nsp2 en comparación con VR2332. Los PRRSV similares a NADC30 reportados tienen una similitud nucleotídica entre el 93,5 y el 95,7% (14). La protección cruzada parcial de las vacunas comerciales contra el PRRSV similar a NADC30 que circula actualmente puede explicarse por la baja similitud genómica entre el PRRSV similar a NADC30 y las cepas vacunales existentes de PRRSV.
Los síntomas de campo de la cepa circulante actual del PRRSV similar a NADC30 van desde la virulencia baja hasta la virulencia alta (19-22). Aunque la cepa PRRSV similar a NADC30 es menos virulenta que el virus del síndrome respiratorio y reproductivo porcino altamente patógeno (HP-PRRSV), aún puede provocar abortos a pequeña escala en cerdas y enfermedades respiratorias en cerdos de engorde, lo que resulta en pérdidas significativas para las granjas porcinas (23). En la actualidad, no existe ninguna vacuna disponible comercialmente contra la cepa de PRRSV similar a NADC30 en China (24). Algunos estudios han demostrado que las vacunas atenuadas disponibles en el mercado proporcionan cierto grado de protección contra las cepas de PRRSV similares a NADC30, aliviando los síntomas y reduciendo las lesiones, asegurando así la supervivencia de los lechones después de un ataque de virus moderadamente virulento (14). Muchas granjas consideran vacunar a los lechones y reducir las dosis de la vacuna según corresponda para lograr efectos protectores y reducir los costos. La efectividad de esta reducción de la dosis contra el PRRSV similar a NADC30 nunca se ha evaluado ni contrastado, y nos gustaría saber si se trata de un movimiento científico. Como resultado, evaluamos la efectividad de varias dosis de vacunas contra una infección por PRRSV similar a NADC30 en este estudio. Afortunadamente, descubrimos que reducir la dosis puede ayudar mejor a los lechones a mitigar los efectos negativos del virus.
En este estudio, se seleccionó la cepa similar a NADC30 CF (PQ213447) del grupo de cepas similares a NADC30 bien caracterizadas de Chengdu SG-Biotech, que mostraron la mayor virulencia en comparación con otras cepas en el estudio de patogenicidad. Después de la comparación, CF compartió 93.2, 85.3 y 85.1% de similitud de nucleótidos con NADC30 (JN654459), VR2332 (AY150564) y la cepa representativa de HP-PRRSV JXA1 (EF112445), respectivamente. Después de la provocación viral, los lechones que no habían recibido vacunas mostraron signos clínicos típicos del PRRSV. Hubo un lechón muerto en el grupo de control de desafío durante el estudio; creemos que su muerte no solo puede ser la causa del virus PRRSV, sino que el desafío con PRRSV puede haber contribuido a su muerte.
Al comparar la ganancia diaria promedio, encontramos que los grupos de dosis reducida superaron a los otros grupos antes o después del desafío (Figuras 4A, B). Sin embargo, debido a la limitación del sitio experimental, es posible que no sea 100% libre y los resultados son solo de referencia. Los lechones de todos los grupos desafiados tenían una viremia que alcanzó un máximo de 7 y 14 dpc (Figura 9A). Al final del estudio, no hubo diferencias significativas en la cantidad de copias de ARN del virus entre los grupos desafiados, aunque los títulos del virus continuaron disminuyendo después de eso. Todos los lechones vacunados y desafiados mostraron niveles comparables de antígeno viral en varios tejidos, lo que fue consistente con los resultados de viremia. Existen diferencias individuales en la viremia, solo como referencia. Se considera que la inmunidad humoral desempeña un papel importante en la protección de los cerdos frente a la infección por PRRSV (18). Se realizaron mediciones de anticuerpos neutralizantes del virus (VN) y anticuerpos específicos contra el PRRSV para investigar la inmunidad humoral provocada por la vacunación. Desafortunadamente, debido a problemas con la conservación de la muestra y a la congelación y descongelación repetida, los resultados de anticuerpos neutralizantes que obtuvimos pueden no ser confiables y no se presentan aquí. A los 14 días después de la vacunación, todos los grupos vacunados desarrollaron anticuerpos IDEXX ELISA específicos contra el PRRSV (Figura 10).
En la comparación de las puntuaciones clínicas y los cambios en la temperatura corporal, los lechones vacunados con dosis reducidas tuvieron menos efectos secundarios antes del desafío y un mejor rendimiento después del desafío (Figuras 2 y 3). No hubo diferencias significativas entre los grupos de desafío vacunados en cuanto a las puntuaciones brutas y de sección o la tasa de células positivas (Figuras 6-8). En la Figura 10, vimos que los anticuerpos específicos en el grupo de dosis reducida eran más altos que los del grupo de dosis original antes del desafío.
En conclusión, la inmunización con vacunas MLV de dosis bajas antes del desafío tiene menos efectos secundarios adversos en los lechones y, por lo tanto, tiene un mejor rendimiento de crecimiento. Después del desafío, la vacuna de dosis baja pudo reducir los síntomas causados por el PRRSV similar a NADC30, y algunos aspectos mostraron efectos de alivio incluso mejores que la dosis normal. El mecanismo específico detrás de este fenómeno es intrigante y se necesita más investigación para descubrirlo. Teniendo en cuenta la producción real, reducir la dosis de la vacuna también significa reducir el costo. Hasta que se disponga de una vacuna eficaz contra la cepa PRRSV similar a la NADC30 o se descubra un mejor programa de vacunación, puede ser beneficioso reconsiderar las dosis de la vacuna. Este enfoque podría aumentar el valor económico y, al mismo tiempo, centrarse en determinar el objetivo inmunitario, comprender la virulencia del virus en el campo y garantizar la seguridad.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio o repositorios y el número de acceso se pueden encontrar en el artículo/material complementario.
Declaración ética
Los procedimientos para el cuidado y uso de los animales fueron aprobados por el Comité de Ética del Comité Institucional de Cuidado y Uso de Animales de la Universidad Agrícola de Sichuan (código de protocolo 20230127 y 28 de febrero de 2023) y se siguieron todas las regulaciones institucionales y gubernamentales aplicables en relación con el uso ético de los animales. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
JL: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Recursos, Software, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. XY: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Recursos, Software, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. WW: Administración de proyectos, supervisión, redacción, revisión y edición. YL: Administración de proyectos, Supervisión, Redacción, revisión y edición. SX: Recursos, Validación, Redacción – revisión y edición. SZ: Supervisión, Redacción – revisión y edición. XH: Supervisión, Redacción – revisión y edición. QZ: Supervisión, Redacción – revisión y edición. YW: Supervisión, Redacción – revisión y edición. SC: Supervisión, redacción, revisión y edición. SD: Supervisión, Redacción – revisión y edición. QY: Conceptualización, Obtención de fondos, Metodología, Administración de proyectos, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición. NZ: Conceptualización, Análisis formal, Adquisición de fondos, Investigación, Metodología, Administración de proyectos, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El (los) autor(es) declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo de subvenciones del Programa de Demostración de Aplicación de Ciencia y Tecnología de Chengdu Major (Giantstar Farming & Husbandry Co., Ltd), número de subvención 2022YF0900050SN.
Reconocimientos
Gracias a todos los participantes, colaboradores e investigadores que contribuyeron a este estudio. Un agradecimiento especial a Chengdu SG-Biotech Co., Ltd. por ayudar.
Conflicto de intereses
JL, WW, YL, SX y NZ fueron empleados por Giantstar Farming & Husbandry Co., Ltd.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Wensvoort, G, Terpstra, C, Pol, JM, ter Laak, EA, Bloemraad, M, de Kluyver, EP, et al. Misteriosa enfermedad porcina en los Países Bajos: el aislamiento del virus Lelystad. Veterinario Q. (1991) 13:121–30. doi: 10.1080/01652176.1991.9694296
2. Cavanagh, D. Nidovirales: un nuevo orden que comprende Coronaviridae y Arteriviridae. Arco Virol. (1997) 142:629–33.
3. Conzelmann, KK, Visser, N, Van Woensel, P, y Thiel, HJ. Caracterización molecular del virus del síndrome respiratorio y reproductivo porcino, miembro del grupo de los arterivirus. Virología. (1993) 193:329–39. doi: 10.1006/viro.1993.1129
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. King, AMQ, Lefkowitz, EJ, Mushegian, AR, Adams, MJ, Dutilh, BE, Gorbalenya, AE, et al. Cambios en la taxonomía y en el código internacional de clasificación y nomenclatura de virus ratificados por el comité internacional de taxonomía de virus. Arco Virol. (2018) 163:2601–31. doi: 10.1007/s00705-018-3847-1
5. Loving, CL, Osorio, FA, Murtaugh, MP y Zuckermann, F. A. Inmunidad innata y adaptativa contra el virus del síndrome respiratorio y reproductivo porcino. Veterinario Inmunol Inmunopatológico. (2015) 167:1–14. doi: 10.1016/j.vetimm.2015.07.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Shi, M, Lam, TT, Hon, CC, Murtaugh, MP, Davies, PR, Hui, RK, et al. Disección evolutiva, demográfica y geográfica basada en la filogenia de los virus del síndrome respiratorio y reproductivo porcino tipo 2 de América del Norte. J Virol. (2010) 84:8700–11. doi: 10.1128/JVI.02551-09
7. Hanz, J, Wang, Y y Faaberg, KS. Análisis completo del genoma de los aislados RFLP 184 del virus del síndrome respiratorio y reproductivo porcino. Res. de Virus (2006) 122:175–82. doi: 10.1016/j.virusres.2006.06.003
8. Brockmeier, SL, Loving, CL, Vorwald, AC, Kehrli, ME Jr, Baker, RB, Nicholson, TL, et al. Comparación de la secuencia genómica y virulencia de cuatro cepas del virus del síndrome respiratorio y reproductivo porcino tipo 2. Res. de Virus (2012) 169:212–21. doi: 10.1016/j.virusres.2012.07.030
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Li, C, Zhuang, J, Wang, J, Han, L, Sun, Z, Xiao, Y, et al. Investigación de un brote de PRRSV similar a NADC30 en el sudeste de China. Transbound emerg Dis. (2016) 63:474–9. doi: 10.1111/tbed.12530
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Zhou, L, Yang, Y, Xia, Q, Guan, Z, Zhang, J, Li, B, et al. Caracterización genética del virus del síndrome respiratorio y reproductivo porcino del este de China durante 2017-2022. Microbiol frontal. (2022) 13:971817. doi: 10.3389/fmicb.2022.971817
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Li, P, Shen, Y, Wang, T, Li, J, Li, Y, Zhao, Y, et al. Encuesta epidemiológica de PRRS y análisis de variación genética del gen ORF5 en la provincia de Shandong, 2020-2021. Frente Vet Sci. (2022) 9:987667. doi: 10.3389/fvets.2022.987667
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Zhou, L, Wang, Z, Ding, Y, Ge, X, Guo, X y Yang, H. Cepa similar a NADC30 del virus del síndrome respiratorio y reproductivo porcino. China emerge infectar enfermedades. (2015) 21:2256–7. doi: 10.3201/eid2112.150360
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Wei, C, Dai, A, Fan, J, Li, Y, Chen, A, Zhou, X, et al. Eficacia de la vacuna contra el PRRSV tipo 2 frente al desafío con PRRSV del linaje chino 1 (similar a NADC30) en cerdos. Informe Científico Sci Rep. (2019) 9:10781. doi: 10.1038/s41598-019-47239-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Bai, X, Wang, Y, Xu, X, Sun, Z, Xiao, Y, Ji, G, et al. Las vacunas comerciales proporcionan una protección limitada contra la infección por PRRSV similar a NADC30. Vacuna. (2016) 34:5540–5. doi: 10.1016/j.vaccine.2016.09.048
15. Yuan, S, Nelsen, CJ, Murtaugh, MP, Schmitt, BJ y Faaberg, KS. Recombinación entre cepas norteamericanas del virus del síndrome respiratorio y reproductivo porcino. Res. de Virus (1999) 61:87–98. doi: 10.1016/S0168-1702(99)00029-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Zimmerman, JJ, Dee, SA, Holtkamp, DJ, Murtaugh, MP, Stadejek, T, Stevenson, GW, et al. Virus del síndrome respiratorio y reproductivo porcino (Arterivirus porcino) En: JJ Zimmerman, LA Karriker, A Ramirez, KJ Schwartz, GW Stevenson y J Zhang, editores. Enfermedades de los cerdos. 11ª ed. Hoboken, Nueva Jersey, Estados Unidos: John Wiley & Sons (2019). 685–708.
17. Charerntantanakul, W. Vacunas contra el virus del síndrome respiratorio y reproductivo porcino: aspectos de inmunogenicidad, eficacia y seguridad. Mundo J Virol. (2012) 1:23–30. doi: 10.5501/wjv.v1.i1.23
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Zuckermann, FA, García, EA, Luque, ID, Christopher-Hennings, J, Doster, A, Brito, M, et al. Evaluación de la eficacia de las vacunas comerciales contra el virus del síndrome respiratorio y reproductivo porcino (PRRSV) basadas en la medición de la respuesta serológica, la frecuencia de las células productoras de gamma-IFN y los parámetros virológicos de protección tras la provocación. Microbiol veterinario. (2007) 123:69–85. doi: 10.1016/j.vetmic.2007.02.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Guo, J, Li, C, Lu, H, Wang, B, Zhang, L, Ding, J, et al. Genética inversa, construcción y patogenicidad de un nuevo PRRSV recombinante similar a NADC30 aislado en China. Frente Vet Sci. (2024) 11:1434539. doi: 10.3389/fvets.2024.1434539
20. Huang, B, Deng, L, Xu, T, Jian, Z, Lai, S, Ai, Y, et al. Isolation and pathogenicity comparison of two novel natural recombinant porcine reproductive and respiratory syndrome viruses with different recombination patterns in Southwest China. Microbiol Spectrum. (2024) 12:e0407123. doi: 10.1128/spectrum.04071-23
21. Ouyang, Y, Du, Y, Zhang, H, Guo, J, Sun, Z, Luo, X, et al. Caracterización genética y patogenicidad de una cepa recombinante del virus del síndrome respiratorio y reproductivo porcino en China. Virus. (2024) 16:993. doi: 10.3390/v16060993
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Tu, T, Li, Y, Zhang, G, Du, C, Zhou, Y, Jiang, D, et al. Aislamiento, identificación, análisis de recombinación y experimento de patogenicidad de una cepa recombinante de PRRSV en la provincia de Sichuan, China. Microbiol frontal. (2024) 15:1362471. doi: 10.3389/fmicb.2024.1362471
23. Xiang, L, Xu, H, Li, C, Tang, YD, An, TQ, Li, Z, et al. El seguimiento del genoma a largo plazo rastrea la evolución de los nuevos virus emergentes del síndrome respiratorio y reproductivo porcino. Microbiol frontal. (2022) 13:885015. doi: 10.3389/fmicb.2022.885015
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Zhang, H, Xiang, L, Xu, H, Li, C, Tang, YD, Gong, B, et al. La vacuna viva atenuada contra el virus del síndrome respiratorio y reproductivo porcino del linaje 1 proporciona una amplia protección cruzada contra el desafío del virus homólogo y heterólogo similar al NADC30 en lechones. Vacuna. (2022) 10:752. doi: 10.3390/vaccines10050752
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: Vacuna MLV, PRRSV similar a NADC30, vacuna, eficacia, patogenicidad
Cita: Liu J, Yan X, Wu W, Li Y, Xing S, Zhao S, Huang X, Zhao Q, Wen Y, Cao S, Du S, Yan Q y Zeng N (2024) Evaluación de la protección cruzada de una vacuna PRRS MLV de dosis reducida contra el desafío PRRSV similar a NADC30. Frente. Vet. Sci. 11:1492173. doi: 10.3389/fvets.2024.1492173
Recibido: 06 de septiembre de 2024; Aceptado: 28 de octubre de 2024;
Publicado: 13 de noviembre de 2024.
Editado por:
Changzhan Xie, Academia China de Ciencias Agrícolas, China
Revisado por:
Zengqi Yang, Universidad del Noroeste A&F, China
Ding Peiyang, Universidad de Zhengzhou, China
Li Wang, Universidad de Agricultura del Noreste, China
Derechos de autor © 2024 Liu, Yan, Wu, Li, Xing, Zhao, Huang, Zhao, Wen, Cao, Du, Yan y Zeng. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Nanfang Zeng, 409220693@qq.com; Qigui Yan, yanqigui@126.com
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía