Terapia con células estromales mesenquimales para la gingivoestomatitis crónica felina
 María Soltero-Rivera1*
María Soltero-Rivera1* Sterling Hart1
Sterling Hart1 Andrés Blandino2
Andrés Blandino2 Natalia Vapniarsky3,4
Natalia Vapniarsky3,4 Boaz Arzi1,4
Boaz Arzi1,4- 1Departamento de Ciencias Quirúrgicas y Radiológicas, Facultad de Medicina Veterinaria, Universidad de California, Davis, Davis, CA, Estados Unidos
- número arábigoDepartamento de Estadística, Universidad de California, Davis, Davis, CA, Estados Unidos
- 3Departamento de Patología, Microbiología e Inmunología, Facultad de Medicina Veterinaria, Universidad de California, Davis, Davis, CA, Estados Unidos
- 4Instituto Veterinario de Curas Regenerativas, Facultad de Medicina Veterinaria, Universidad de California, Davis, Davis, CA, Estados Unidos
Introducción: El tratamiento con células estromales mesenquimales (MSC) ha surgido como una posible opción de tratamiento para el FCGS refractario. Sin embargo, hay una falta de datos a largo plazo sobre el uso de la terapia MSC en gatos. Este estudio tuvo como objetivo evaluar la seguridad y eficacia a largo plazo del tratamiento con MSC para el FCGS e investigar los posibles factores asociados con los resultados del tratamiento.
Métodos: Este estudio fue una evaluación retrospectiva de 38 gatos con FCGS refractarios que recibieron terapia con MSC. Se revisaron las historias clínicas, la histopatología y el Índice de Actividad de la Enfermedad de la Estomatitis (SDAI). Se realizaron correlaciones de las tasas de éxito del seguimiento a largo plazo con la SDAI y el tipo de línea celular utilizada. También se realizó una encuesta a los clientes para evaluar la aparición de efectos secundarios, la calidad de vida después del tratamiento y la satisfacción general con el tratamiento.
Resultados: El seguimiento a largo plazo osciló entre 2 y 9 años después del tratamiento con MSC. La tasa general de respuesta positiva al tratamiento con MSC fue del 65,5 %, con un 58,6 % de los gatos que mostraron una mejoría o curación permanente. Se observaron efectos adversos durante o inmediatamente después del tratamiento en el 34,2% de los casos, la mayoría de los cuales fueron reacciones transitorias similares a las transfusiones que se resolvieron por sí mismas. No se observaron eventos adversos a largo plazo. No se detectó una correlación significativa en el resultado entre el tratamiento alogénico y autólogo con MSC (p = 0,871) o la gravedad de la SDAI a la entrada (p = 0,848) o salida (p = 0,166), o la SDAI delta entre la entrada y la salida (p = 0,178). El estado a los 6 meses (ninguna mejoría parcial vs. mejoría sustancial a la resolución) después de la terapia fue un predictor de respuesta a largo plazo (valor de p < 0,041). La mayoría de los pacientes estaban satisfechos con el tratamiento y los resultados, y el 90,6% estaba dispuesto a continuar con el tratamiento de nuevo, dada una situación similar.
Discusión: Los resultados de este estudio respaldan el uso de MSC autólogos y alogénicos como una opción terapéutica eficaz y segura para el FCGS refractario.
Introducción
La gingivoestomatitis crónica felina (FCGS), una enfermedad inflamatoria debilitante de la mucosa oral, afecta a entre el 0,7 y el 26% de la población de gatos en diversos grados (1-3). La enfermedad se caracteriza por una inflamación de la mucosa oral de moderada a grave que se manifiesta clínicamente como inapetencia, falta de acicalamiento, hipersalivación, sangrado bucal, letargo, pérdida de peso e hiperémica de la mucosa. Histológicamente, las lesiones se caracterizan por la infiltración de células T y B efectoras activadas de la mucosa oral, incluidos los linfocitos CD4+ y CD8+. También hay un notable aumento sistémico de los linfocitos T CD8+ efectores (citotóxicos) con una reducción asociada de los linfocitos CD8+ de memoria central (4-7). La compleja patogenia de la FCGS plantea un reto a la hora de elaborar un plan de tratamiento y prevención específico (8). En la actualidad, el tratamiento recomendado incluye extracciones dentales parciales o completas en función del grado de inflamación presente y de la evidencia de enfermedad periodontal concurrente y reabsorción dental (9). Aproximadamente el 30% de los pacientes no responden a la terapia de extracción y, por lo tanto, requieren el uso continuo de inmunosupresores (es decir, corticosteroides, ciclosporina) u otros inmunomoduladores (es decir, interferón omega), así como analgésicos y antibióticos (9). Los pacientes que no muestran una mejoría suficiente (es decir, FCGS que no responden) a menudo son sacrificados debido a la mala calidad de vida (10). Desde el punto de vista de la etiopatogenia, los datos actuales sugieren una respuesta inmunitaria ineficaz a la estimulación antigénica crónica, probablemente infección por calicivirus felino (FCV) (4, 11).
Las células estromales mesenquimales (MSC) modulan las respuestas inmunitarias al reducir los niveles sistémicos de células T circulantes, células B, células asesinas naturales y células dendríticas, lo que las hace potencialmente ideales para enfermedades inflamatorias inmunomediadas como la FCGS (12). Anteriormente conocidas como células madre mesenquimales, después de la declaración aclaratoria emitida en 2005 por el comité de células del estroma mesenquimal (ISCT MSC) de la Sociedad Internacional de Terapia Celular y Génica (ISCT),® ahora se reconocen como células estromales mesenquimales debido a sus propiedades secretoras, inmunomoduladoras y de localización (13). Datos recientes también respaldan su uso para dar forma a una respuesta inmunitaria antiviral más eficaz y a la regeneración del tejido linfoide en las infecciones virales crónicas (14, 15).
En 2015, se informó por primera vez de la administración sistémica de MSC autóloga y alogénica derivada del tejido adiposo (adMSC) como tratamiento para los pacientes con FCGS que no respondieron, y ambos tipos de células mostraron una mejoría marcada o una resolución completa en la mayoría de los pacientes refractarios (>60%), pero existen discrepancias entre los dos (16, 17). La administración autóloga ofrece beneficios prácticos de una tasa de éxito general más alta (>70%) y tiempos de respuesta clínica más cortos en comparación con adMSC alogénico (16, 17). Sin embargo, la disponibilidad de MSC alogénicas, la posibilidad de almacenamiento y control de calidad, y la evitación de los efectos deletéreos del virus espumoso felino endógeno (18) hacen que esta fuente sea clínicamente más factible, pragmática y sostenible para las prácticas que integran las MSC en la variedad de opciones de tratamiento. En conjunto, el tratamiento con MSC para el FCGS refractario es una adición prometedora al arsenal de tratamiento de los médicos, ya que la elección entre la administración autóloga o alogénica requiere una decisión informada basada en una visión holística de la afección del paciente y las capacidades del centro administrador.
La caracterización de los resultados positivos tras el tratamiento con adMSC en casos de FCGS refractarios proporciona evidencia de una opción terapéutica viable a los métodos de tratamiento tradicionales. Sin embargo, hasta la fecha no se han evaluado exhaustivamente los resultados a largo plazo de la eficacia y la seguridad del tratamiento. Por lo tanto, llevamos a cabo un estudio retrospectivo a largo plazo que incluyó a 38 pacientes con FCGS refractarios con adMSC (células estromales mesenquimales derivadas de adiposo; autólogas y alogénicas) administradas sistémicamente para comprender mejor el valor a largo plazo de adMSC como opción terapéutica.
Materiales y métodos
Población
De 2013 a 2020, se llevaron a cabo dos ensayos clínicos en el Hospital Docente de Medicina Veterinaria de UC Davis, en los que se investigó la seguridad y eficacia de las MSC autólogas y alogénicas en el tratamiento de gatos FCGS que no responden. Se seleccionaron un total de 47 pacientes para participar en este estudio retrospectivo. Sin embargo, solo se incluyeron 38 pacientes debido a la pérdida de seguimiento a largo plazo. Todos los estudios en animales se llevaron a cabo con la aprobación del Comité Institucional de Cuidado y Uso de Animales y la Junta de Revisión de Ensayos Clínicos de la Universidad de California, Davis. Todos los propietarios firmaron el consentimiento informado. Los criterios de elegibilidad incluyeron solo a los gatos afectados por FCGS, sin otras comorbilidades (es decir, FeLV, FIV, neoplasia), que no respondieron a las extracciones bucales completas realizadas al menos 6 meses antes de la inclusión. Como se describió en los ensayos clínicos informados anteriormente, cada gato recibió 20 millones de adMSC por tratamiento por vía intravenosa (IV) para un total de dos tratamientos con aproximadamente 30 días de diferencia (10, 11). Se administraron adMSC autólogos o alogénicos. Se realizó un examen final de salida del ensayo clínico 6 meses después del segundo tratamiento. Se realizaron exámenes adicionales caso por caso en momentos posteriores entre 18 y 108 meses después del segundo tratamiento.
Diseño y distribución de encuestas
Se diseñó una encuesta a los clientes para recopilar información sobre el grado de mejoría de la enfermedad oral (o la falta de ella) años después del tratamiento, la duración de la mejoría, los eventos adversos notables, el historial médico después del tratamiento, incluidos los diagnósticos y los medicamentos recetados, y la satisfacción general con el tratamiento. La encuesta final incluyó entre 13 y 19 preguntas (Material complementario). La variación en el número de sugerencias se debió a la eliminación de ciertas preguntas al seleccionar las respuestas anteriores. Este último permitió una secuencia lógica e individualizada sin indicaciones innecesarias. En este momento, también se solicitó el consentimiento para obtener registros médicos del veterinario de atención primaria del paciente. La encuesta se distribuyó por correo electrónico a través del software de encuestas Qualtrics® (Qualtrics XM)1. Para los propietarios que necesitaban ayuda para completar esto, se les dio la opción de completar a través de una conversación telefónica con uno de los autores (SH), y las respuestas se ingresaron directamente en Qualtrics.
Recogida de datos en Atención Primaria
Con base en la información recopilada en la encuesta inicial, se seleccionaron los participantes que indicaron el desarrollo de enfermedad sistémica o neoplásica, eventos adversos o la recurrencia de estomatitis para una recopilación adicional de datos de su veterinario de atención primaria. Si estaban presentes, se recopilaron los siguientes antecedentes: incidentes de enfermedad aguda (es decir, reacciones de hipersensibilidad, vómitos, diarrea, dificultad respiratoria, letargo), cambios en los análisis de sangre relacionados (es decir, anemia, cambios en los valores renales o hepáticos, anomalías en los recuentos de glóbulos blancos, indicadores de diabetes), diagnósticos oficiales de las enfermedades y causa de muerte (si corresponde). Solo los desarrollos médicos posteriores al tratamiento con adMSC se consideraron aplicables a este estudio.
Eventos adversos
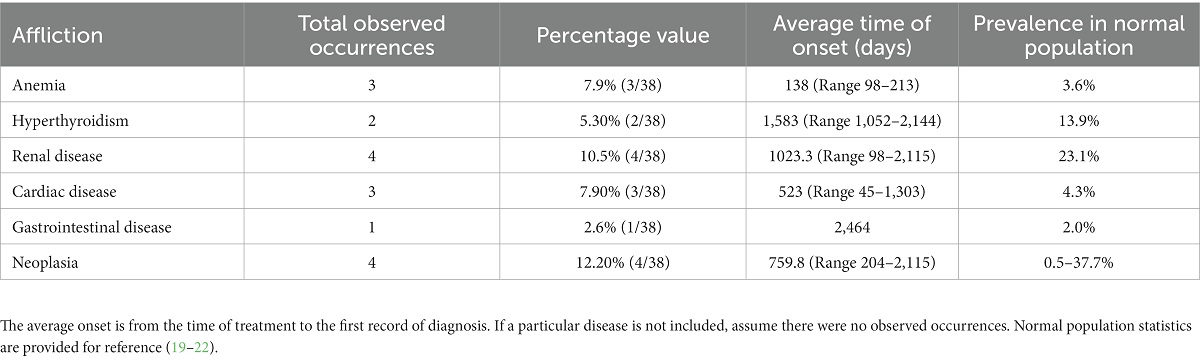
Para considerar el evento adverso a largo plazo, identificamos a los gatos que desarrollaron enfermedades sistémicas u otras afecciones crónicas después de la reevaluación inicial después del tratamiento a los 6 meses. A continuación, determinamos la tasa de ocurrencia de la afección específica en la población del estudio en comparación con la tasa de ocurrencia en la población hospitalaria general. El nivel de gravedad de los eventos adversos se determinó mediante un proceso de clasificación estandarizado basado en las Directrices de los NIH sobre eventos adversos y eventos adversos graves, según se define en la Tabla 1. También registramos la tasa de ocurrencia de eventos adversos a corto plazo que pueden haber ocurrido transitoriamente, durante o inmediatamente después del tratamiento.

Análisis estadístico
Se utilizaron estadísticas descriptivas para analizar la tasa general y el alcance de la mejoría de la inflamación oral, la satisfacción del cliente y los eventos adversos agudos y posibles a largo plazo. Para los gatos que mostraron una respuesta positiva a la terapia con MSC, se calculó el período promedio en el que persistió la mejoría (días, semanas, meses, años o indefinidamente).
Aplicamos un modelo de regresión logística para explorar la asociación entre el resultado del tratamiento a largo plazo de un paciente frente a otras variables diagnósticas de interés, incluido el tipo de línea celular (autóloga vs. alogénica), las puntuaciones SDAI (entrada, salida y cambio entre entrada y salida; Material complementario), el estado del paciente a los 6 meses (ninguno a mejoría parcial vs. mejoría sustancial a la resolución) y el tiempo hasta el diagnóstico (en meses), ajustando por edad (años). Para algunas covariables, faltaba o no estaba disponible una cantidad no trivial de datos, que, si se excluyen siguiendo un análisis de caso completo (CC), podrían conducir a resultados sesgados al crear un subconjunto de solo «casos completos». Para tener en cuenta esto, empleamos imputaciones múltiples (MI) utilizando el paquete MICE en R (13) que predice los valores faltantes varias veces para tener en cuenta la incertidumbre con la predicción. Se calcularon las estimaciones del modelo y los valores p para los datos imputados múltiples a través de MICE y los datos de casos completos para la comparación. Los valores de p se consideraron significativos cuando se alcanzaron intervalos de confianza de <0,05 y 95%. Todo el análisis fue realizado por uno de los autores (AB) en el software estadístico R [R Core Team (2022). R: Un lenguaje y un entorno para la computación estadística. R Foundation for Statistical Computing, Viena, Austria]. número arábigo
Resultados
Características de los participantes
Se identificaron treinta y ocho pacientes para seguimiento, que recibieron al menos dos dosis de adMSC. De ellos, 21 gatos recibieron adMSC autólogo y 17 recibieron adMSC alogénico. El periodo medio de seguimiento fue de 5,5 años (rango 2-9 años). Las edades de los pacientes en el momento del seguimiento oscilaron entre los 6 y los 15 años, con 16 pacientes declarados fallecidos en el momento de la administración de la encuesta. De las 38 familias de pacientes contactadas, 29 completaron la encuesta distribuida por correo electrónico o facilitada por correspondencia telefónica. Siete pacientes sobrevivientes completaron la encuesta y expresaron su voluntad de una visita de seguimiento «en persona» en el Hospital de Enseñanza Médica Veterinaria de UC Davis (VMTH) para una reevaluación y una calificación SDAI a largo plazo (material complementario).
Resultados clínicos
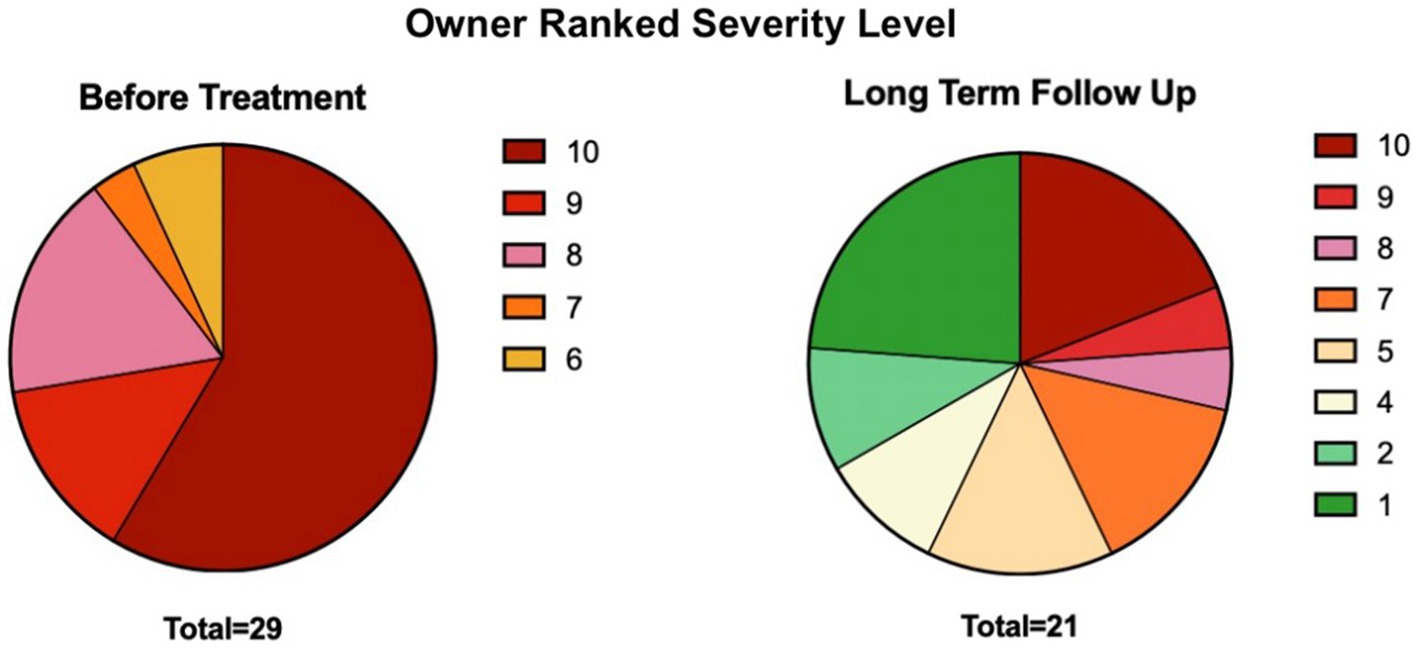
Los propietarios clasificaron los niveles de gravedad de la enfermedad del paciente antes y después del tratamiento en una escala del 1 al 10 (Material complementario, Q3-Q4). Antes del tratamiento, todos los pacientes se clasificaron con un nivel de gravedad de 6 o superior, con un nivel de gravedad de 10 que comprendía el 58,6% de la población. La duración del seguimiento a largo plazo osciló entre 2 y 9 años después de recibir el primer tratamiento. Después del tratamiento, solo se observó un nivel de gravedad de 10 en el 19,0% de los pacientes, y más de la mitad (56,8%) tenía un nivel de gravedad entre 1 y 5 (ocho participantes optaron por no participar en esta pregunta) (Figura 1).
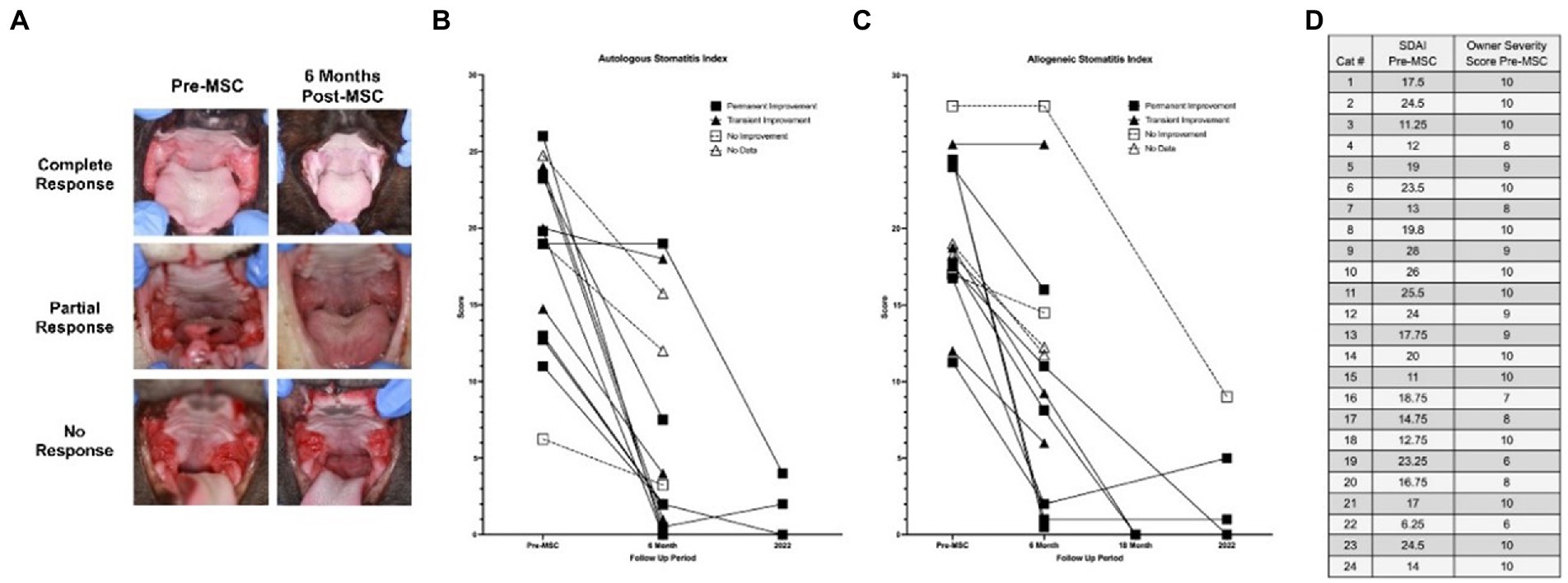
Con base en la gravedad de la enfermedad clasificada por el propietario antes del tratamiento y en el momento del seguimiento, la tasa de respuesta positiva al tratamiento con adMSC para todos los participantes fue del 65,5% (19/29). Los propietarios de pacientes que recibieron adMSC autólogo percibieron una tasa de respuesta positiva del 71,4 % (10/14), mientras que los receptores de adMSC alogénicos mostraron una tasa de respuesta positiva percibida por el propietario del 60,0 % (9/15).
A continuación, se instó a los propietarios a definir la permanencia de la mejora, o la falta de ella (Material complementario, P5). Los gatos con respuesta positiva tras el tratamiento con adMSC hasta el momento del seguimiento o la muerte se consideraron casos de mejoría permanente, que constituyeron el 58,6% de la población estudiada (17/29 total, 9/17 autólogos, 8/17 alogénicos). Se observaron casos de mejoría transitoria, que experimentaron mejoría y posterior recaída de los signos clínicos, en el 17,2% de la población estudiada (5/29 en total, 3/5 autólogos, 2/5 alogénicos). De estos cinco pacientes, tres no mostraron mejoría y dos mostraron una mejoría parcial de la inflamación de la cavidad oral caudal en el examen oral macroscópico durante la visita de salida del ensayo (es decir, 6 meses después de la segunda administración de adMSC). El veinticuatro por ciento de los gatos (7/29 en total, 2/7 autólogos, 5/7 alogénicos) no experimentaron ninguna mejoría en ningún momento después del tratamiento.
La puntuación SDAI de los siete gatos observados para el seguimiento a largo plazo está disponible en la Figura 2. Todos los gatos experimentaron una reducción en SDAI en relación con los valores de entrada, con una media de reducción del 83% (rango 67-100%). Casi todos mostraron una reducción adicional en SDAI en relación con los valores de salida a los seis meses, con un ligero aumento en dos gatos. Curiosamente, antes del tratamiento, en los pacientes para los que los propietarios indicaron una gravedad de 10, los valores de SDAI variaron entre 11 y 26.
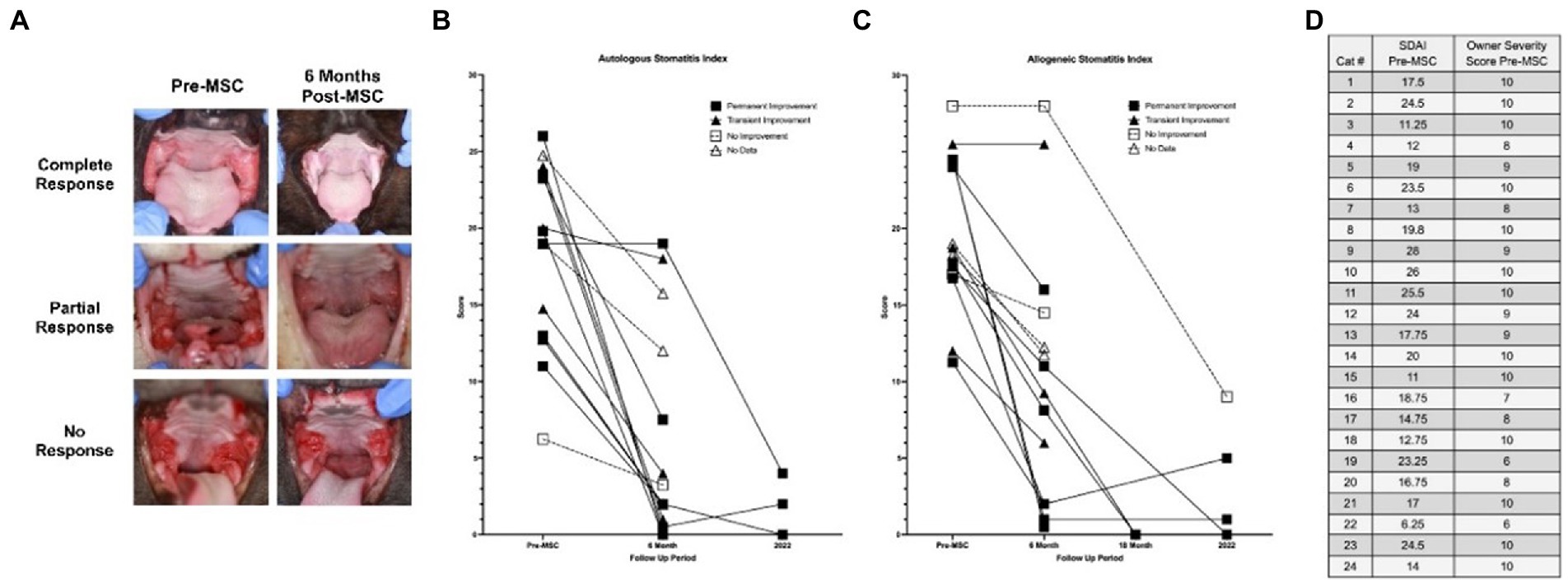
El modelo de regresión logística que investigó la correlación entre la respuesta a largo plazo con la puntuación SDAI a la entrada y delta-SDAI (SDAI entrada-SDAI salida), el tipo de línea celular y el tiempo hasta el diagnóstico produjo resultados estadísticamente insignificantes tanto para el modelo de imputaciones múltiples (IM) como para el análisis de regresión lineal de casos completos (CC) (valor de p = 0,85, 0,17, 0,87, 0,68, respectivamente). El modelo de regresión logística produjo una correlación estadísticamente significativa débil para las puntuaciones de salida de SDAI más grandes con probabilidades de respuesta a largo plazo para CC (valor de p = 0,08), estimación puntual = 0,894 [IC-95%-0,772, 1] para CC. El modelo de imputación múltiple para esta variable produjo resultados estadísticamente insignificantes (valor de p = 0,166). El estado a los 6 meses (ninguno a mejoría parcial vs. mejoría sustancial a la resolución) fue un predictor de respuesta a largo plazo (valor de p < 0,041 tanto para IM como para CC), estimación puntual = 12,766 [IC-95%-1,124, 144,998] para IM, 13,798 [IC-95%-1,851, 291,672] para CC. Por lo tanto, las probabilidades de una respuesta positiva a largo plazo para los gatos con una mejoría sustancial o completa a los 6 meses se correlacionaron positivamente con su respuesta al tratamiento.
Seguridad
En el 34,2% de los casos se observaron eventos adversos durante o inmediatamente después del tratamiento, siendo la reacción similar a una transfusión la más común (46%). Las reacciones similares a las transfusiones incluyeron uno o más de los siguientes signos clínicos durante o dentro de las horas posteriores al tratamiento: vómitos (5/6), diarrea (2/6) y aumento de la frecuencia respiratoria (2/6). El sesenta y siete por ciento de los eventos adversos similares a las transfusiones ocurrieron durante la administración autóloga de adMSC y el 33% durante la administración alogénica de adMSC. Otros eventos adversos incluyeron letargo (7,7%, 1/13), aumento leve de la frecuencia respiratoria (38,4%, 5/13) y un incidente de vómitos 12 h después del tratamiento. Entre la adMSC autóloga y alogénica y considerando el tiempo durante la administración hasta 12 h después del tratamiento (excepto un paciente que experimentó letargo 4 días después del tratamiento), la administración autóloga tuvo una tasa general más alta de eventos adversos en el 69,2% en comparación con el 30,8% observado con el tratamiento alogénico.
El nivel de gravedad de los eventos adversos, clasificados con base en la escala definida en los materiales y métodos, demostró que el 61,5% (8/13) de los eventos se consideraron leves, el 15,4% (2/13) se consideraron moderados y el 23,1% restante (3/13) se clasificaron como graves. Los eventos adversos graves, caracterizados por reacciones pronunciadas similares a las transfusiones, ocurrieron en tres gatos. Dos de estos pacientes experimentaron náuseas y/o vómitos, diarrea y dificultad respiratoria durante el tratamiento. Estos últimos síntomas requirieron intervención médica inmediata y el cese de la administración de adMSC. El tercer paciente quedó obnubilado, tuvo dificultad respiratoria y micción inmediatamente después de la administración de adMSC. Estos signos clínicos se resolvieron a los 10-15 minutos del cese de la administración de adMSC. No hubo incidentes de muerte durante o inmediatamente después de la administración de adMSC.
Los registros proporcionados por los proveedores de atención primaria fueron moderadamente inconsistentes, con lagunas en el tiempo y ambigüedad. Sin embargo, en la Tabla 2 se dispone de un recuento de todos los diagnósticos registrados y el tiempo transcurrido entre el tratamiento con adMSC y el diagnóstico realizado.
Satisfacción del cliente
A partir de las encuestas telefónicas y por correo electrónico realizadas, la satisfacción general de los clientes fue positiva, con un 90,6% de los clientes dispuestos a seguir el tratamiento de nuevo si surgiera una situación similar, un 6,3% que no estaban dispuestos a seguir el tratamiento de nuevo y un 3,1% que no estaban seguros (Material complementario, P11).
A continuación, se pidió a los propietarios que clasificaran los factores que influían en su voluntad de volver a recibir tratamiento. El noventa por ciento de los propietarios calificaron el grado de mejora en la enfermedad de la mascota como importante o muy importante. La disponibilidad de otras opciones de tratamiento y sus tasas de éxito fueron consideradas importantes por el 71% de los propietarios. La facilidad de administración de la medicación oral y el número de citas de repetición requeridas fueron clasificados como importantes por el 52% y el 22% de los participantes, respectivamente (Material complementario, P13). Luego, se les pidió a los clientes que escribieran otros factores que fueran importantes para ellos personalmente, lo que trajo a la discusión el costo, la distancia al centro de tratamiento, los posibles efectos secundarios y el nivel de comodidad de la mascota durante el tratamiento.
Discusión
Este es el primer estudio que investiga la seguridad y eficacia a largo plazo de adMSC para el tratamiento de FCGS refractarios. Este estudio retrospectivo demuestra varios hallazgos clínicamente importantes. En primer lugar, en la mayoría de los casos, las adMSC autólogas y alogénicas administradas sistémicamente producen una mejora marcada y permanente. En segundo lugar, la tasa de éxito clínico de las adMSC autólogas fue mayor que la de las células alogénicas, pero no significativamente. En tercer lugar, el tratamiento con adMSC fue seguro y no produjo eventos adversos a largo plazo. Sin embargo, las reacciones similares a las transfusiones no fueron infrecuentes, especialmente en los participantes que recibieron adMSC autólogo. Además, la respuesta clínica de un paciente a los 6 meses después del tratamiento predice la respuesta positiva a largo plazo a la terapia con adMSC. Por último, la satisfacción de los clientes con la terapia con adMSC para el FCGS refractario fue muy positiva.
La tasa general de respuesta positiva de nuestra población de estudio fue del 65,5 %, según la gravedad de la enfermedad clasificada por el propietario antes y después del tratamiento. Todos los pacientes que se sometieron a exámenes orales a largo plazo mostraron una reducción en el SDAI en comparación con los valores de entrada, y casi todos mostraron una reducción adicional en relación con la puntuación de salida a los seis meses, excepto dos pacientes. En general, se observó una reducción media del 83% en el SDAI. Además, en el 58,6% de los casos, la mejoría fue duradera (36-108 meses). La tasa de respuesta positiva de larga duración permite una mayor confianza en la eficacia del tratamiento que la tasa de respuesta inicial sola. El porcentaje de reclutamiento de este estudio coincidió con el 30% reportado de no respondedores a las extracciones dentales tradicionales de boca completa (9, 23). Por lo tanto, postulamos que el éxito general del 65,5% de adMSC puede reducir el número de pacientes clasificados como refractarios del 30% a solo el 10,3% y, al mismo tiempo, puede aumentar la tasa general de remisión de FCGS de ~70% (9, 23) a ~90%.
Observamos una diferencia en la tasa de éxito clínico entre adMSC autóloga y alogénica, como se observó en estudios previos, con un éxito autólogo a largo plazo del 71,4% y alogénico del 60,0%. Específicamente, se informó previamente que la tasa de éxito fue del 71% en los grupos de tratamiento autólogo y del 57% en los grupos de tratamiento alogénico en los primeros estudios originales a corto plazo (16, 17). Las ligeras variaciones entre las tasas de éxito de los tipos de células pueden ser el resultado de las clasificaciones de respuestas subjetivas de los propietarios de este estudio, el aumento considerable en el tamaño del grupo de participantes o el período de seguimiento más largo. En el caso de los receptores alogénicos de adMSC, los autores encontraron originalmente una tasa de respuesta tardía en comparación con las células autólogas (16), lo que puede explicar el ligero aumento observado en este estudio en la tasa de respuesta alogénica general durante un período más largo. Por último, la razón por la que el adMSC alogénico tiene un rendimiento inferior al autólogo no está clara y justifica una investigación más profunda.
La mayoría de los eventos adversos observados se caracterizaron por reacciones leves a moderadas similares a las transfusiones, todas las cuales se resolvieron rápidamente. En estos pacientes, los tratamientos posteriores se administraron a un ritmo más lento, eliminando la aparición de reacciones adversas. La incidencia de reacciones similares a las transfusiones no fue inesperada (24). Sin embargo, la ocurrencia de estas reacciones en líneas celulares autólogas frente a alogénicas fue diferente. Se espera que las células autólogas derivadas del huésped conlleven menos riesgo de reacción, pero observamos dos veces más reacciones a las transfusiones en los tratamientos autólogos que en los alogénicos. De acuerdo con las observaciones de los médicos, una tasa más rápida de administración de adMSC se asoció con reacciones similares a las transfusiones. Debido a que el primer ensayo clínico se centró únicamente en la investigación de células autólogas, la mayoría de las reacciones similares a las transfusiones se observaron en estas primeras etapas y es probable que se deban a la falta de conocimiento y experiencia en la necesidad de administrar adMSC a un ritmo lento, es decir, más de 30 minutos.
Es deseable establecer indicadores de la probabilidad de que el paciente responda al tratamiento con MSC para implementar un tratamiento eficaz y personalizado. Nuestro estudio encontró que una respuesta clínica positiva 6 meses después del tratamiento predijo positivamente las probabilidades de una respuesta a largo plazo. Si bien esto no ofrece una predicción de la respuesta antes de diseñar un plan de tratamiento, puede ser útil para los médicos que asesoran a los propietarios sobre el éxito futuro del tratamiento y determinan si buscar MSC adicionales o tratamientos alternativos. Por lo tanto, 6 meses deben utilizarse como punto de control estándar para que los médicos determinen si el tratamiento ha sido o seguirá siendo exitoso para evitar conclusiones prematuras sobre la respuesta del paciente.
La gran mayoría de los clientes respondieron positivamente cuando se les preguntó si buscarían un tratamiento similar para su gato en el futuro. La satisfacción del cliente y la mejora de la salud del paciente demuestran el potencial de la terapia con adMSC para tener una gran demanda de otras morbilidades de mascotas en las prácticas veterinarias.
Debido a la falta de datos en los modelos de regresión logística, es posible que los análisis actuales no reflejen correlaciones evaluadas con precisión. Otros estudios prospectivos con tamaños de muestra más grandes pueden revelar una o más de estas variables como marcadores útiles en el diseño de los planes de tratamiento del paciente, solidificar los resultados de este estudio y pueden ayudar a mejorar la determinación del momento del tratamiento para optimizar los resultados. La falta de datos sustanciales y continuos de los veterinarios de atención primaria impidió un análisis confirmado de la aparición de la enfermedad a largo plazo en la población del estudio. Teniendo esto en cuenta, los resultados obtenidos se compararon con la población hospitalaria general, demostrando una mayor prevalencia de anemia, enfermedad cardíaca y un ligero aumento de la enfermedad gastrointestinal en la población estudiada. La prevalencia de anemia más alta de lo normal en la población del estudio no fue inesperada, ya que todos los gatos incluidos en el estudio padecen enfermedades crónicas (25). Del mismo modo, aunque se desconoce, no se puede descartar una asociación entre la enfermedad bucal con la disfunción cardíaca y gastrointestinal como factor causal del aumento de la tasa de enfermedad de estos sistemas observada en la población estudiada. Curiosamente, el FCGS se asoció con una alta incidencia de esofagitis, muy probablemente debido al microbioma alterado de la cavidad oral (26). Efectos similares pueden contribuir a la enfermedad gastrointestinal observada en los gatos evaluados en este estudio. Sin embargo, no se pueden descartar por completo otros diagnósticos diferenciales de la enfermedad gastrointestinal infiltrativa, como la enfermedad inflamatoria intestinal o el linfoma. Siempre que se disponga de un conjunto de datos más completo, las tasas de incidencia de la enfermedad pueden cambiar en cualquier dirección con respecto a las encontradas.
El SDAI utilizado en este (material complementario) y en estudios previos (27) ha sido una herramienta valiosa para el diagnóstico y el seguimiento del estado de los pacientes, pero ciertos aspectos del proceso de puntuación pueden alterar los resultados. Este estudio encontró solo una asociación débil entre las puntuaciones de salida del SDAI y los resultados. Un estudio en una población más grande sería mejor para determinar si las probabilidades de una respuesta positiva disminuyen en un cierto porcentaje por cada aumento de 1 unidad en la puntuación de salida del SDAI del paciente. Como se muestra en la Figura 2D, existe disparidad entre la evaluación del propietario y la evaluación clínica del estado de la enfermedad del paciente, las cuales son necesarias para generar una puntuación SDAI. Con estos dos valores en desacuerdo, es posible que las puntuaciones no reflejen realmente el estado del paciente; por lo tanto, se debe desarrollar un sistema de puntuación más objetivo, o el SDAI debe centrarse en la evaluación del cliente o del clínico (es decir, dos SDAI separadas). Como se describió en estudios previos, los niveles elevados de células T CD8+, las concentraciones de interferón-γ e interleucina (IL)-1β, la neutrofilia en sangre, la hipergammaglobulinemia, las proporciones anormales de CD4/CD8, así como la positividad de calicivirus y virus espumosos se asocian con la gravedad del FCGS y la respuesta al tratamiento (16). El desarrollo de un sistema de puntuación que integre estos factores en la evaluación de la gravedad de la enfermedad puede crear un valor más completo para su uso en un entorno clínico. Además, el uso de estos biomarcadores en la evaluación inicial de los pacientes puede utilizarse en el futuro para crear planes de tratamiento personalizados basados en el estado de la enfermedad del paciente. En el pasado, los pacientes refractarios que no respondían a la terapia de extracción buscaban una transfusión suplementaria de MSC meses después. Es posible que el tratamiento con MSC inmediatamente después de la terapia de extracción pueda ser más beneficioso, una tendencia que actualmente se está explorando en la práctica veterinaria y humana.
En conclusión, este estudio retrospectivo a largo plazo demuestra la seguridad y eficacia de las adMSC autólogas y alogénicas y proporciona información valiosa para pacientes y médicos. El éxito a largo plazo exhibido por la mayoría de los pacientes, independientemente del tipo de célula, es alentador. Los gatos afectados por FCGS refractarios a la terapia de extracción dental pueden beneficiarse de las intervenciones de adMSC.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor de correspondencia.
Declaración ética
El estudio en animales fue revisado y aprobado por la IACUC. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
MS-R: concepto y diseño del estudio, evaluación de los datos, redacción del manuscrito e investigador principal. SH: adquisición de datos, evaluación de datos y redacción del manuscrito. AB: análisis estadístico, evaluación de datos y revisión del manuscrito. NV: evaluación de los datos y revisión del manuscrito para obtener importantes aportaciones intelectuales. BA: concepto y diseño del estudio, evaluación de los datos y redacción del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
El apoyo financiero para los ensayos clínicos fue proporcionado por el NIH 1R21DE024711-01, la subvención Miller Trust de la Fundación Felina WINN y el Fideicomiso de Salud Felina George y Phyllis Miller de la Fundación San Francisco y administrado por el Centro de Salud de Animales de Compañía, UCD.
Reconocimientos
Agradecemos a Karen Boudreaux, especialista en educación del VMTH de UC Davis, por su ayuda en el diseño y distribución de la encuesta. El Índice de Actividad de la Enfermedad de Estomatitis utilizado en este estudio es una versión modificada del SDAI desarrollado originalmente por el Dr. Jamie Anderson. La clasificación del nivel de gravedad de los eventos adversos desarrollada para este estudio se basó en las Directrices de los NIH sobre eventos adversos y eventos adversos graves.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1171922/full#supplementary-material
Abreviaturas
FCGS: Gingivoestomatitis crónica felina; adMSC: Células estromales mesenquimales derivadas del tejido adiposo; MSC: Células estromales mesenquimales; FCV: Calicivirus felino; SDAI: Índice de actividad de la enfermedad de estomatitis.
Notas
Referencias
1. Healey, KAE, Dawson, S, Burrow, R, Cripps, P, Gaskell, CJ, Hart, CA, et al. Prevalencia de gingivoestomatitis crónica felina en la práctica veterinaria de primera opinión. J Feline Med Surg. (2007) 9:373–81. doi: 10.1016/j.jfms.2007.03.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Verhaert, L., y Van Wetter, C. Encuesta de enfermedades bucales en gatos en Flandes-Google Scholar [Internet]. (2004). Disponible en: https://scholar.google.com/scholar_lookup?title=Survey+of+oral+diseases+in+cats+in+Flanders.&author=L+Verhaert&author=C+Van+Wetter&publication_year=2004&journal=Vlaams+Diergeneeskd+Tijdschr&pages=331-341
3. Kim, DH, Kwak, HH y Woo, HM. Prevalencia de gingivoestomatitis crónica felina en gatos callejeros y sus factores de riesgo. J Feline Med Surg. (2023) 25:1098612X221131453. doi: 10.1177/1098612X221131453
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Vapniarsky, N, Simpson, DL, Arzi, B, Taechangam, N, Walker, NJ, Garrity, C, et al. Análisis histológico, inmunológico y genético de la gingivoestomatitis crónica felina. Frente Vet Sci. (2020) 7:310. doi: 10.3389/fvets.2020.00310
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Harley, R, Gruffydd-Jones, TJ, y Day, MJ. Caracterización inmunohistoquímica de lesiones de la mucosa oral en gatos con gingivoestomatitis crónica. J Comp Pathol. (2011) 144:239–50. doi: 10.1016/j.jcpa.2010.09.173
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Arzi, B, Murphy, B, Cox, DP, Vapniarsky, N, Kass, PH y Verstraete, FJM. Presencia y cuantificación de mastocitos en la encía de gatos con reabsorción dentaria, periodontitis y estomatitis crónica. Arch Oral Biol. (2010) 55:148–54. doi: 10.1016/j.archoralbio.2009.11.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Johnessee, JS. Gingivitis-faringitis felina de células plasmáticas – Google Scholar [Internet]. (1983). Disponible en: https://scholar.google.com/scholar_lookup?title=Feline+plasma+cell+gingivitis-pharyngitis.&author=Johnessee+J.S.&publication_year=1983
8. Lee, DB, Verstraete, FJM, y Arzi, B. Una actualización sobre la gingivoestomatitis crónica felina. Veterinario Clin North Am Small Anim Pract. (2020) 50:973–82. doi: 10.1016/j.cvsm.2020.04.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Jennings, MW, Lewis, JR, Soltero-Rivera, MM, Brown, DC, y Reiter, AM. Efecto de la extracción dental sobre la estomatitis en gatos: 95 casos (2000-2013). J am vet med assoc. (2015) 246:654–60. doi: 10.2460/javma.246.6.654
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Winer, JN, Arzi, B, y Verstraete, FJM. Manejo terapéutico de la gingivoestomatitis crónica felina: una revisión sistemática de la literatura. Frente Vet Sci. (2016) 3:54. doi: 10.3389/fvets.2016.00054
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Fried, WA, Soltero-Rivera, M, Ramesh, A, Lommer, MJ, Arzi, B, DeRisi, JL, et al. Uso de análisis metagenómicos y transcriptómicos no sesgados para investigar la asociación entre el calicivirus felino y la gingivoestomatitis crónica felina en gatos domésticos. Am J Vet Res. (2021) 82:381–94. doi: 10.2460/ajvr.82.5.381
12. Jiang, XX, Zhang, Y, Liu, B, Zhang, SX, Wu, Y, Yu, XD, et al. Las células madre mesenquimales humanas inhiben la diferenciación y la función de las células dendríticas derivadas de monocitos. Sangre. (2005) 105:4120–6. doi: 10.1182/blood-2004-02-0586
13. Viswanathan, S, Shi, Y, Galipeau, J, Krampera, M, Leblanc, K, Martin, I, et al. Células madre mesenquimales versus células estromales: Declaración del comité de células estromales mesenquimales de la Sociedad Internacional de Terapia Celular y Génica (ISCT)® sobre la nomenclatura. Citoterapia. (2019) 21:1019–24. doi: 10.1016/j.jcyt.2019.08.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Weber, MG, Walters-Laird, CJ, Kol, A, Santos Rocha, C, Hirao, LA, Mende, A, et al. Regeneración del centro germinal intestinal e inmunidad antiviral mejorada por células madre/estroma mesenquimales en la infección por VIS. Perspectiva de la JCI. (2021) 6:149033. doi: 10.1172/jci.insight.149033
15. Taechangam, N, Kol, A, Arzi, B, y Borjesson, DL. Células estromales multipotentes e interacción viral: implicaciones actuales para la terapia. Célula madre Rev Rep. (2022) 18:214–27. doi: 10.1007/s12015-021-10224-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Arzi, B, Mills-Ko, E, Verstraete, FJM, Kol, A, Walker, NJ, Badgley, MR, et al. Eficacia terapéutica de células madre mesenquimales frescas y autólogas para la gingivoestomatitis refractaria grave en gatos. Células Madre Transl Med. (2016) 5:75–86. doi: 10.5966/sctm.2015-0127
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Arzi, B, Clark, KC, Sundaram, A, Spriet, M, Verstraete, FJM, Walker, NJ, et al. Eficacia terapéutica de las células madre mesenquimales alogénicas frescas para la gingivoestomatitis crónica felina refractaria grave. Células Madre Transl Med. (2017) 6:1710–22. doi: 10.1002/sctm.17-0035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Arzi, B, Kol, A, Murphy, B, Walker, NJ, Wood, JA, Clark, K, et al. El virus espumoso felino afecta negativamente el cultivo y la expansión de células madre mesenquimales felinas: implicaciones para el desarrollo de modelos animales. Desarrollo de Células Madre. (2015) 24:814–23. doi: 10.1089/scd.2014.0317
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Sordo, L, Breheny, C, Halls, V, Cotter, A, Tørnqvist-Johnsen, C, Caney, SMA, et al. Prevalencia de enfermedades y cambios de comportamiento relacionados con la edad en gatos: pasado y presente. Veterinario Sci. (2020) 7:85.
20. Furman, E, Leidinger, E, Hooijberg, EH, Bauer, N, Beddies, G, y Moritz, A. Estudio retrospectivo de 1.098 muestras de sangre con anemia de gatos adultos: frecuencia, clasificación y asociación con la concentración de creatinina sérica. J Veterinario Pasante Med. (2014) 28:1391–7.
22. MacVean, DW, Monlux, AW, Anderson, PS, Silberg, SL, y Roszel, JF. Frecuencia de tumores caninos y felinos en una población definida. Veterinario Pathol. (1978) 15:700–15.
23. Hennet, P. Estomatitis gingivo-crónica en gatos: seguimiento a largo plazo de 30 casos tratados mediante extracciones dentales. J Vet Dent. (1997) 14:15–21. doi: 10.1177/089875649701400103
24. Quimby, JM, Webb, TL, Habenicht, LM y Dow, SW. Seguridad y eficacia de la infusión intravenosa de células madre mesenquimales criopreservadas alogénicas para el tratamiento de la enfermedad renal crónica en gatos: resultados de tres estudios piloto secuenciales. Células madre res ther. (2013) 4:48. doi: 10.1186/scrt198
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Chikazawa, S, y Dunning, MD. Revisión de la anemia de la enfermedad inflamatoria en perros y gatos. J Pequeña Anim Pract. (2016) 57:348–53. doi: 10.1111/jsap.12498
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Kouki, MI, Papadimitriou, SA, Psalla, D, Kolokotronis, A, y Rallis, TS. Gingivoestomatitis crónica con esofagitis en gatos. J Veterinario Pasante Med. (2017) 31:1673–9. doi: 10.1111/jvim.14850
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Lommer, MJ. Eficacia de la ciclosporina para la estomatitis crónica refractaria en gatos: un estudio clínico aleatorizado, controlado con placebo y doble ciego. J Vet Dent. (2013) 30:8–17. doi: 10.1177/089875641303000101
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: gingivoestomatitis, células estromales, MSC, gatos, odontología, medicina regenerativa
Cita: Soltero-Rivera M, Hart S, Blandino A, Vapniarsky N y Arzi B (2023) Terapia con células estromales mesenquimales para la gingivoestomatitis crónica felina: experiencia a largo plazo. Frente. Vet. Sci. 10:1171922. doi: 10.3389/fvets.2023.1171922
Recibido: 22 de febrero de 2023; Aceptado: 23 de marzo de 2023;
Publicado: 14 de abril de 2023.
Editado por:
Serafeim Papadimitriou, Universidad Aristóteles de Tesalónica, Grecia
Revisado por:
Milinda Jean Lommer, Aggie Animal Dental Center, Estados
Unidos Maria Kouki, Veterinaria Dent, Clínica Dental Veterinaria, Grecia
Derechos de autor © 2023 Soltero-Rivera, Hart, Blandino, Vapniarsky y Arzi. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: María Soltero-Rivera, msoltero@ucdavis.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía