Modelo de estrés oxidativo de lipopolisacárido combinado con inductor de trombina en pollos de engorde
 Huiyu Shi†
Huiyu Shi† Fengyuan Yang†
Fengyuan Yang† Zeru Peng
Zeru Peng Junlong Wu
Junlong Wu Qin Wang
Qin Wang Pingfei Qiu
Pingfei Qiu Ruiying Bao
Ruiying Bao Liangmin Huang
Liangmin Huang Xiaochun Li
Xiaochun Li Haiwen Zhang
Haiwen Zhang Xuemei Wang*
Xuemei Wang*- Departamento de Ciencia y Tecnología Animal, Escuela de Agricultura Tropical y Silvicultura, Universidad de Hainan, Haikou, China
Los lipopolisacáridos (LPS) se utilizan habitualmente para construir modelos de inflamación. Sin embargo, las aves de corral tienen un cierto grado de tolerancia al LPS debido a la falta de trombina XI y XII en sus cuerpos. La activación de la trombina produce factores de coagulación que pueden escindir la protrombina para formar trombina. El propósito de este estudio fue construir un modelo de estrés oxidativo de pollitos utilizando diferentes concentraciones de LPS combinado con trombina con el fin de seleccionar la concentración óptima para construir el modelo de estrés oxidativo, y explorar los efectos de este estímulo en varios indicadores de pollitos. Ochenta y un pollitos jóvenes (de 4 días de edad) se dividieron aleatoriamente en tres grupos con 27 pollitos por grupo, donde cada grupo contenía 3 réplicas con 9 aves cada uno: un grupo control (solución salina fisiológica), un grupo de dosis baja (LPS 5 mg/kg de trombina 150 U/kg) y un grupo de dosis alta (LPS 10 mg/kg de trombina 300 U/kg). Los resultados indicaron que, en comparación con el grupo control, el grupo de dosis baja y el grupo de dosis alta aumentaron significativamente el contenido de malondialdehído (MDA) en suero y redujeron el contenido de T-AOC, GSH-PX y SOD, respectivamente. Mientras tanto, los niveles de NO y los factores inflamatorios IL-1β, IL-6 y TNF-α TNF-α en el hígado aumentaron significativamente en los grupos de dosis baja y alta en comparación con el grupo de control, respectivamente. Las secciones de tejido hepático y timo de los grupos de dosis baja y alta mostraron hemorragia, hemólisis y una pequeña cantidad de exudación. En cuanto al efecto inflamatorio, el contenido sérico de MDA y los niveles de NO, IL-1β, IL-6 y TNF-α factores en el hígado aumentaron significativamente en el grupo de dosis baja en comparación con el grupo de dosis alta. En la observación histopatológica, el daño tisular fue más pronunciado en el grupo de dosis baja que en el grupo de dosis alta. En conclusión, el LPS combinado con trombina podría inducir estrés oxidativo en los pollitos y los cambios patológicos del efecto de la dosis baja son más pronunciados.
1 Introducción
La investigación del estrés oxidativo representa un área de investigación importante en el contexto de las aves de corral, particularmente en lo que respecta al desarrollo de modelos inflamatorios adaptados a los pollos de engorde. El estrés oxidativo denota una ruptura en el equilibrio entre la generación de radicales libres y la capacidad del organismo para contrarrestar estas especies reactivas de oxígeno. La inflamación es el principal mecanismo efector del sistema inmunitario innato, que funciona para erradicar el estímulo iniciador, facilitar la reparación de los tejidos y restablecer el equilibrio fisiológico (1). En la modelización experimental de la inflamación, los lipopolisacáridos (LPS) se emplean con frecuencia debido a su capacidad para provocar una respuesta inflamatoria robusta. La administración de LPS puede incitar la activación del sistema inmunitario dentro del medio gastrointestinal, lo que puede culminar en la diseminación sistémica y la posterior endotoxemia (2).
El LPS, un constituyente que se encuentra en las paredes celulares de las bacterias gramnegativas, sirve como un potente iniciador de las respuestas inmunitarias innatas, orquestando el reclutamiento de células inflamatorias en el tejido afectado y precipitando una cascada de reacciones que abarcan el choque de endotoxinas, la sepsis y las reacciones inmunitarias (3). En particular, el LPS también instiga respuestas endoteliales caracterizadas por la regulación positiva de citocinas, moléculas de adhesión y factores tisulares (4). Fisiopatológicamente, la desregulación inmunitaria inducida por LPS se caracteriza por perturbaciones en la permeabilidad endotelial microvascular a las macromoléculas (5). Además, las células endoteliales responden a los LPS sufriendo alteraciones morfológicas, favoreciendo la formación de brechas intercelulares y aumentando la permeabilidad transendotelial (6). No obstante, las especies aviares muestran cierto grado de resistencia al LPS debido a la ausencia de los factores de coagulación XI y XII dentro de su entorno fisiológico (7).
Más allá de su papel fundamental como la proteasa definitiva que orquesta la cascada de coagulación, la trombina asume una prominencia significativa como un potente factor mitogénico. La trombina, generada a través de la activación de factores de coagulación, escinde la protrombina para producir trombina, aumentando así la respuesta inflamatoria (8). El concepto de intrincada interacción entre inflamación y coagulación ha obtenido un reconocimiento sustancial en los últimos años (9). La inflamación vascular instiga la activación de la vía de coagulación, mientras que, recíprocamente, la coagulación ejerce una profunda influencia sobre el medio inflamatorio (10). En particular, la activación de la cascada de coagulación, marcada por la generación de trombina como proteasa fundamental, fomenta un entorno proinflamatorio que afecta particularmente la función endotelial y el comportamiento de las células inmunitarias innatas (11). La trombina ejecuta sus diversas funciones, incluyendo diversas respuestas vasculares proinflamatorias, principalmente a través de la activación de receptores activados por proteasas (PARs) (12). Tras una lesión en la capa endotelial de los vasos sanguíneos, la activación de la cascada de coagulación se convierte en parte integral del proceso natural de curación. La trombina, generada en la superficie de las plaquetas activadas, amplifica la cascada de coagulación y facilita el reclutamiento plaquetario adicional al trombo en desarrollo. Al mismo tiempo, las plaquetas activadas sintetizan y liberan una miríada de moléculas proinflamatorias e inmunomoduladoras, contribuyendo así a los procesos inflamatorios y reparadores (13).
Existe una investigación limitada sobre la concentración óptima de LPS y trombina para construir un modelo de estrés oxidativo en pollitos. Los objetivos del estudio son evaluar la respuesta inflamatoria a diferentes concentraciones de LPS y trombina, evaluar el efecto de LPS y trombina sobre la función inmune e investigar los mecanismos de respuesta inflamatoria inducidos por LPS y trombina en pollitos. Al identificar la concentración óptima de LPS y trombina para construir un modelo de estrés oxidativo en pollitos, este estudio tiene como objetivo contribuir al desarrollo de un modelo más efectivo para estudiar la respuesta al estrés oxidativo en aves de corral y el tratamiento potencial de enfermedades inflamatorias.
2 Materiales y métodos
2.1 Reactivos principales
En este estudio se utilizaron los siguientes reactivos químicos: trombina inyectable de veneno de víbora de ceja blanca (producida por Jinzhou Hong Pharmaceutical Co., Ltd.), LPS (producida por Beijing Solabao Technology Co., Ltd.), solución de tinción HE (producida por Biosharp), kit de ensayo NO (A013-2-1), kit de ensayo T-SOD (A001-1-2), kit de prueba MDA (A003-1-2) y kit de prueba T-AOC (A015-1-2) (producido por el Instituto de Bioingeniería Nanjing Jiancheng, Nanjing, China), kit de ensayo de inmunoabsorción enzimática IL-10 para pollitos (ML-14), kit de ensayo de inmunoabsorción enzimática para pollitos IL-6 (ML-13), kit de ensayo de inmunoabsorción enzimática para pollitos IL-1β (ML-12) y kit de ensayo de fijación de TNF-α para pollitos (ML-11) (producido por Hailian Biological Engineering Co., Ltd., Shanghai, China).
2.2 Animales de experimentación
Obtuvimos 81 pollos de engorde sanos con nivel de SPF AA (4 días de edad) con una proporción de sexos casi igual al incubar 150 huevos de pollos de engorde con nivel de SPF. Los polluelos fueron criados convencionalmente en las instalaciones del laboratorio, alojados en jaulas durante todo el experimento y alimentados con una dieta básica. A los polluelos se les permitió alimentarse y beber libremente durante el experimento. Nos aseguramos de la limpieza y desinfección periódica del galpón experimental de pollitos para mantener la higiene. En este experimento se utilizó alimento comercial para pollos de engorde.
2.3 Diseño experimental y cuidado de los animales
Ochenta y un pollos de engorde AA sanos con nivel de SPF se asignaron aleatoriamente a tres grupos de tratamiento: el grupo de control (solución salina normal), el grupo de dosis baja (LPS 5 mg/kg + trombina 150 U/kg) y el grupo de dosis alta (LPS 10 mg/kg + trombina 300 U/kg). Cada grupo se repitió tres veces, con nueve polluelos en cada réplica, y el experimento se llevó a cabo durante un período de 7 días. A los pollitos del grupo control se les inyectó 0,2 mL de solución fisiológica estéril, mientras que a los de los otros grupos se les inyectó 0,2 mL de la solución correspondiente a diferentes concentraciones. La trombina se inyectó por vía subcutánea en el cuello y el LPS se inyectó por vía intraperitoneal. Los pollitos se alojaron en una instalación de laboratorio convencional, con jaulas que proporcionaban luz las 24 horas y control de temperatura. Se les proporcionó acceso ad libitum a alimento y agua, y el galpón experimental de pollitos se limpió y desinfectó regularmente.
2.4 Rendimiento del crecimiento y tasa de mortalidad
Para medir el rendimiento del crecimiento y la tasa de mortalidad, los pollitos se ayunaron y se pesaron por réplica. Se registró el aumento de peso y se pesó la cantidad de alimento consumido por cada grupo para calcular el aumento de peso diario, la ingesta diaria de alimento y la relación alimento-carne. El estado de salud y la mortalidad de los animales se observaron y registraron a lo largo del experimento. La ganancia de peso media diaria (g/d) se calculó de la siguiente manera: (peso final medio − peso inicial medio)/número de días en el experimento. El cociente de conversión alimenticia se calculó como ingesta diaria de alimento (g)/ganancia de peso diaria (g).
2.5 Evaluación de los síntomas clínicos
Para evaluar los síntomas clínicos, se observó y registró en tiempo real el estado mental, las plumas, la alimentación, la ingesta de agua, la defecación y otras condiciones de los pollitos de cada grupo dentro de las 24 horas posteriores a la inyección. Los síntomas clínicos se evaluaron a partir de las observaciones.
2.6 Evaluación de los cambios de temperatura
Para evaluar los cambios de temperatura, el termómetro se limpió con etanol al 75% después de la inyección del fármaco. Se midió la temperatura de cada pollito durante 2-3 minutos a las 1, 3, 6, 12 y 24 horas después de la inyección. Se dejó estabilizar el termómetro y se registró la temperatura media en cada punto de tiempo y se comparó con la temperatura basal (0 h).
2.7 Medición de los índices séricos
Para determinar el impacto del fármaco en los índices séricos, 8 pollitos seleccionados aleatoriamente de cada grupo se sometieron a punción cardíaca y se recogieron 0,5 mL de sangre a las 0 h, 6 h, 12 h, 24 h, 3 días y 7 días después de la inyección. La sangre recolectada se dejó reposar en un tubo electroproperiférico esterilizado durante 1-2 h, luego se centrifugó a 2.500 rpm durante 15-20 min a 4 °C. El suero superior se recogió cuidadosamente y se almacenó a -20 °C para su posterior análisis.
Se midió el contenido de varios índices séricos, incluidos MDA, T-SOD, T-AOC, GSH-PX y otros, para evaluar el impacto del medicamento en los índices antioxidantes de los pollitos.
2.8 Patología tisular y observación del estado de la mucosa intestinal
A las 6 h y 5 días de inyección, seleccionar un pollo por cada réplica de cada grupo. Se recolectaron muestras de tejido del hígado, bazo, timo, duodeno, yeyuno e íleon en condiciones estériles. Las secciones de parafina tisular se prepararon mediante tinción HE para observar las condiciones patológicas de cada tejido y el estado de la mucosa intestinal.
2.9 Medición de citocinas inflamatorias TNF-α, IL-1β e IL-6
A las 12 h de inyección, seleccionar un pollo por cada réplica de cada grupo. El tejido hepático se sometió a un lavado PBS preenfriado (0,01 M, pH = 7,4) para eliminar la sangre residual y el tejido conectivo. Después del pesaje y la picadura, se añadió PBS al tejido hepático en un volumen adecuado (relación masa/volumen 1:9). A continuación, la mezcla se homogeneizó y se centrifugó a 12.000 r/min durante 10 min. El sobrenadante se recolectó y almacenó a -20 °C para un ensayo ELISA adicional para evaluar los niveles de citocinas inflamatorias, a saber, TNF-α, IL-1β, IL-6 e IL-8. En caso de que se formara algún precipitado durante el almacenamiento, se llevó a cabo una recentrifugación antes de su uso.
2.10 Análisis estadístico
Todos los datos se presentan como el promedio de los valores SEM agrupados. El análisis estadístico se realizó con el programa SPSS 26.0 para Windows (SPSS Inc., Chicago, IL, Estados Unidos). Se utilizó el software GraphPad Prism 9.0.0 (121) para la toma de imágenes y análisis estadísticos. Las diferencias entre los grupos se evaluaron mediante la prueba de Shapiro-Wilk de distribución normal, seguida de ANOVA de un factor y la prueba de Tukey. Un valor de p menor que 0,05 se consideró estadísticamente significativo.
3 Resultados
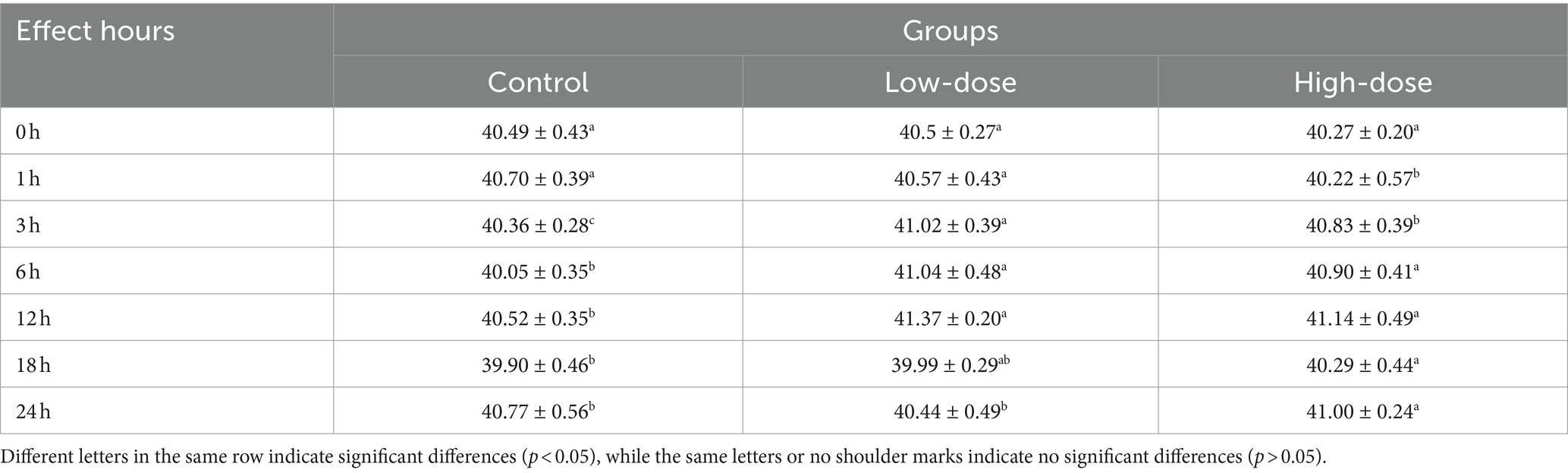
3.1 Efecto de LPS combinado con trombina sobre la temperatura en un modelo de estrés oxidativo de pollitos
Los resultados mostraron un cambio significativo en la temperatura rectal en diferentes momentos después de la inyección de LPS y trombina. En el grupo de dosis alta en comparación con el grupo control, hubo una disminución significativa de la temperatura a 1 h después de la inyección, seguida de un aumento significativo a las 3 h (p < 0,05). En el grupo de dosis bajas, la temperatura aumentó significativamente (p < 0,05) después de 3 h después de la inyección. A las 24 h, el grupo de dosis baja volvió a la temperatura normal, mientras que el grupo de dosis alta mostró un aumento sostenido de la temperatura (p < 0,05) (Tabla 1).
3.2 Efectos de LPS combinado con trombina sobre el rendimiento del crecimiento del modelo de estrés oxidativo de pollitos
Se ha encontrado que no hay diferencias significativas en el peso corporal inicial promedio de cada grupo de tratamiento (p > 0,05). Sin embargo, en comparación con el grupo control, la ganancia diaria de peso de los grupos de prueba después de la inyección de LPS y trombina mostró una tendencia significativa a la baja (p < 0,05). Entre ellos, el grupo de dosis alta tuvo la menor ganancia de peso diaria (p < 0,05).
Además, la tasa de conversión alimenticia del grupo control, del grupo de dosis baja y del grupo de dosis alta fue de 1,75, 1,96 y 2,64, respectivamente, con una diferencia significativa entre los grupos (p < 0,05) (Tabla 2). El estudio sugiere que el LPS puede causar lesiones intestinales, lo que podría conducir a una reducción en la tasa de conversión alimenticia, lo que en última instancia afecta el rendimiento del crecimiento de los pollitos. No hubo muertes de pollitos durante el ensayo.
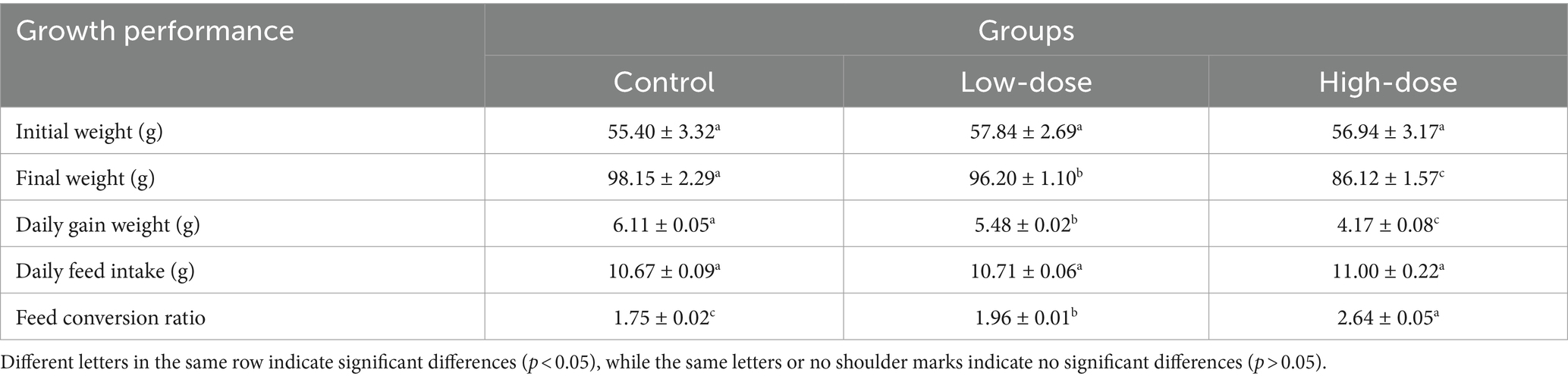
Tabla 2. Efectos de LPS combinado con trombina sobre el rendimiento del crecimiento del modelo de estrés oxidativo de pollitos.
3.3 Efecto del LPS combinado con la trombina sobre los índices antioxidantes séricos del modelo de estrés oxidativo de pollitos
La figura 1a muestra la variación en los niveles séricos de MDA durante diferentes intervalos de tiempo de todo el ciclo de prueba. En comparación con el grupo control, el grupo de dosis baja mostró un aumento no significativo en los niveles séricos de MDA (p > 0,05) después de 6 h de administración, mientras que el grupo de dosis alta mostró un aumento significativo en los niveles de MDA (p < 0,05). Después de 12 h de administración, el grupo de dosis baja mostró un aumento significativo en los niveles de MDA (p < 0,05), mientras que los niveles de MDA del grupo de dosis alta continuaron aumentando. Después de 24 h de administración, los niveles de MDA tanto en el grupo de dosis baja como en el de dosis alta permanecieron elevados (p < 0,05). Después de 72 h de administración, los niveles de MDA del grupo de dosis alta volvieron a la normalidad, mientras que los niveles de MDA del grupo de dosis baja permanecieron altos (p < 0,05).
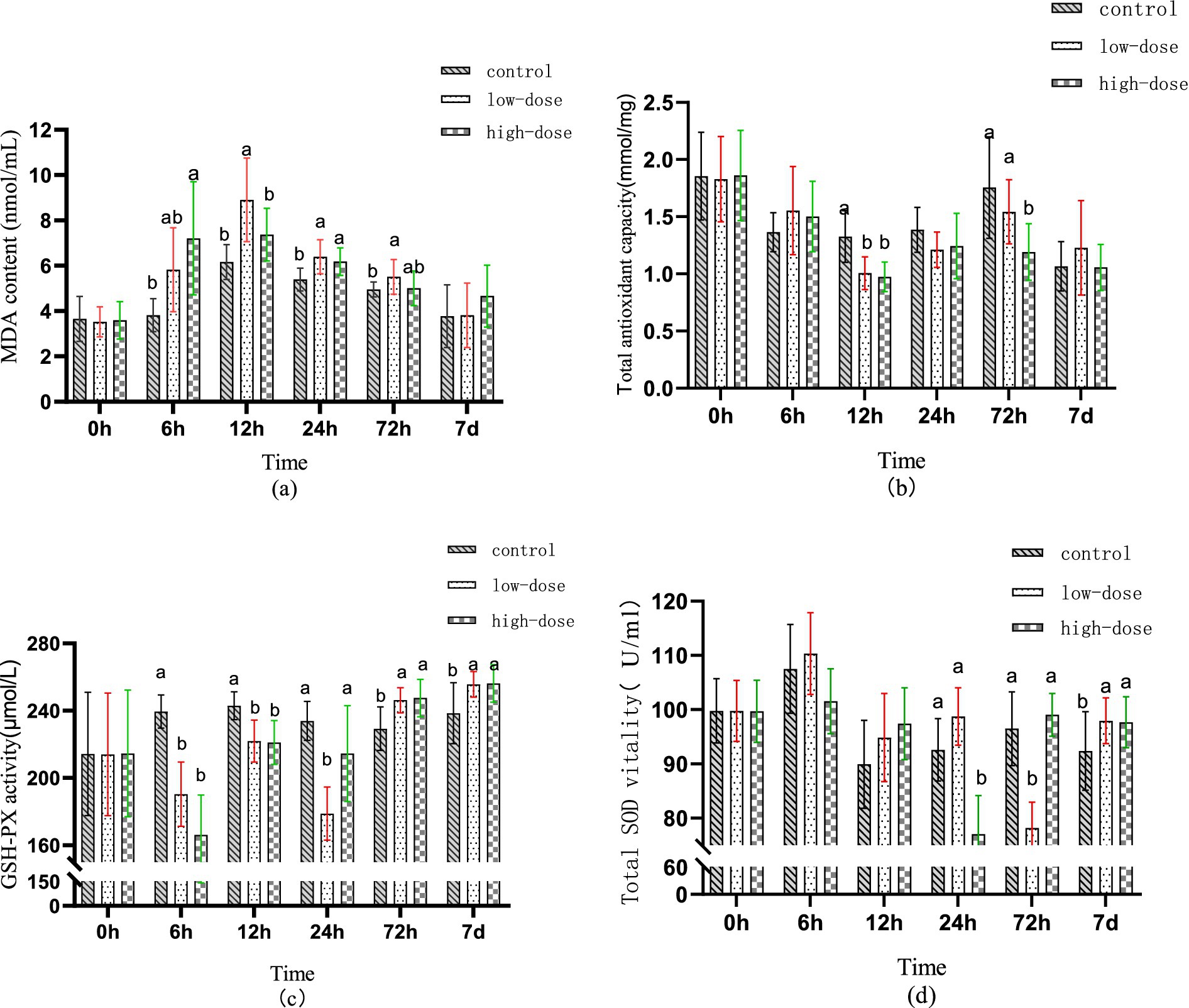
Figura 1. Efecto de LPS combinado con trombina sobre los índices antioxidantes séricos del modelo de estrés oxidativo de pollitos en diferentes momentos: (a) contenido de MDA, (b) T-AOC, (c) GSH-PX, (d) SOD.
La figura 1b ilustra los cambios en el T-AOC sérico en diferentes puntos de tiempo durante el ciclo de prueba. A las 6 h después de la administración, no hubo diferencia significativa en la T-AOC sérica entre los grupos (p > 0,05). Sin embargo, en comparación con el grupo control, el T-AOC sérico de los grupos de dosis baja y alta disminuyó significativamente 12 h después de la administración (p < 0,05). A las 72 h después de la administración, no hubo diferencia significativa en el T-AOC en el suero del grupo de dosis baja (p > 0,05), mientras que el suero del grupo de dosis alta mostró una diferencia significativa (p < 0,05).
La Figura 1c ilustra la tendencia de cambio de GSH-PX en suero en diferentes períodos de tiempo durante el ciclo de prueba. Después de la administración durante 6-12 h, el contenido de GSH-PX en suero de los grupos de dosis baja y alta disminuyó en comparación con el grupo control (p < 0,05). A las 24 h después de la administración, el contenido de GSH-PX en el suero del grupo de dosis baja fue el más bajo (p < 0,05), mientras que el contenido en el suero del grupo de dosis alta volvió al nivel normal (p > 0,05). Además, después de 72 h a 7 días de administración, el contenido de GSH-PX en suero de los grupos de dosis baja y alta fue significativamente mayor que el del grupo control (p < 0,05).
La Figura 1d muestra los cambios en el contenido de T-SOD en el suero durante diferentes períodos de tiempo a lo largo del ciclo de prueba. No se observaron diferencias significativas en el contenido sérico de T-SOD entre los grupos de dosis baja y dosis alta después de 6-12 h de administración en comparación con el grupo control (p > 0,05). Después de 24 h de administración, se observó una disminución significativa en el contenido de T-SOD en suero en el grupo de dosis alta (p < 0,05). Del mismo modo, después de 72 h de administración, se observó una disminución significativa en el contenido de T-SOD en suero en el grupo de dosis baja (p < 0,05). Sin embargo, después de 7 días de administración, se observó un aumento significativo en el contenido de T-SOD en suero tanto en los grupos de dosis baja como en los de dosis alta (p < 0,05).
3.4 Efecto de LPS combinado con trombina sobre los índices inmunes en un modelo de estrés oxidativo de pollitos
La Figura 2a ilustra los cambios en el contenido sérico de óxido nítrico (NO) en el modelo de estrés oxidativo de pollitos inducido por LPS y trombina. Después de 12 h de administración, el contenido de NO en suero aumentó significativamente (p < 0,05) en comparación con el grupo control, alcanzando 103,07 μmol/L en el grupo de dosis baja y 85,59 μmol/L en el grupo de dosis alta.
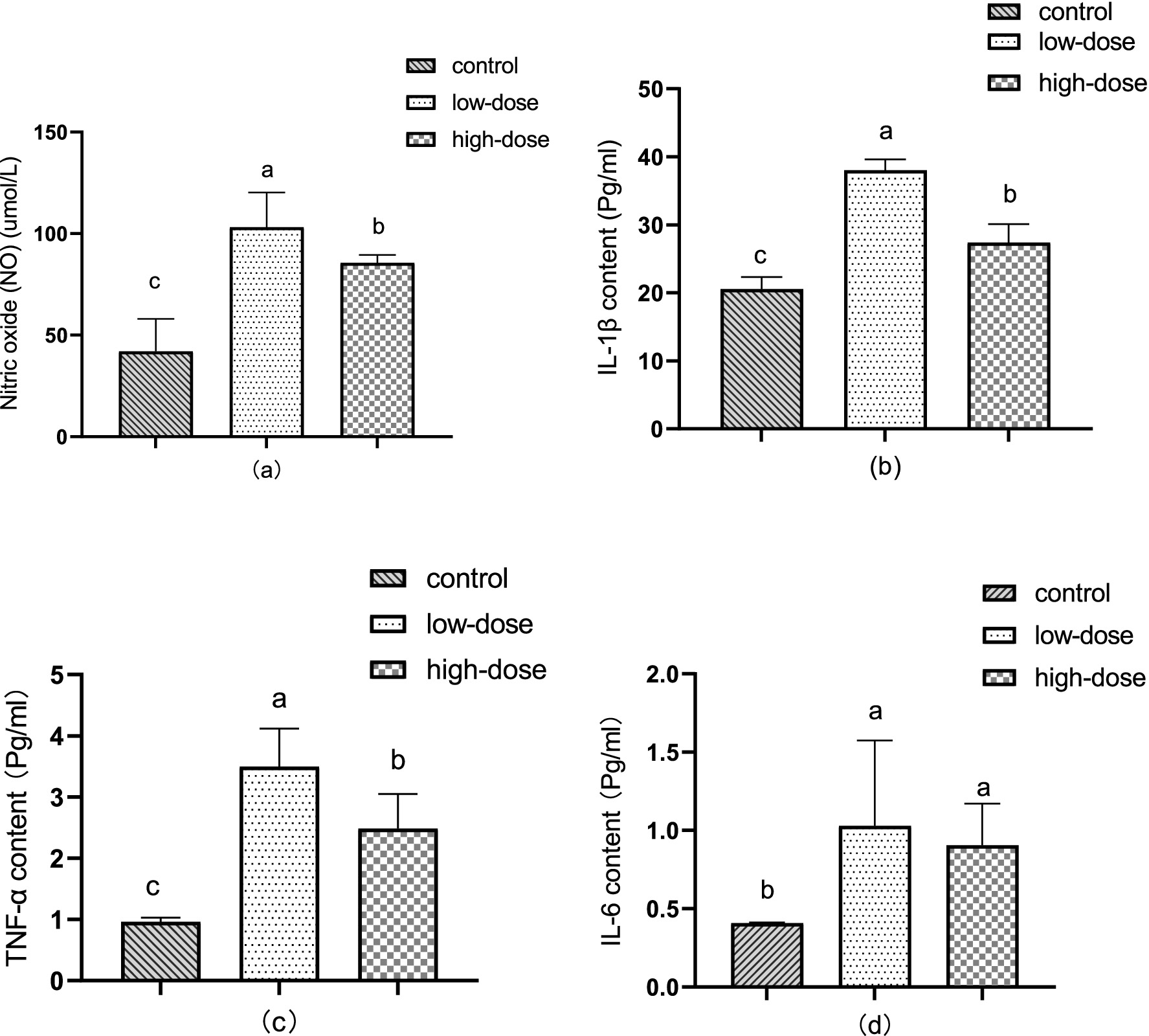
Como se muestra en la Figura 2b, el contenido de IL-1β en el hígado aumentó significativamente (p < 0,05) 12 h después de la administración en comparación con el grupo control. El grupo de dosis baja tuvo un contenido de 38,01 pg/mL, mientras que el grupo de dosis alta tuvo un contenido de 27,37 pg/mL.
Como se muestra en la Figura 2c, el contenido de TNF-α en el hígado aumentó significativamente (p < 0,05) después de 12 h de administración en comparación con el control. El grupo de dosis baja tuvo un contenido de TNF-α de 3,50 pg/mL, mientras que el grupo de dosis alta tuvo un contenido de TNF-α de 2,49 pg/mL.
En la figura 2d, en comparación con el grupo control, el contenido de IL-6 en el hígado aumentó significativamente (p < 0,05) después de 12 h de administración, alcanzando 1,03 pg/mL en el grupo de dosis baja y 0,90 pg/mL en el grupo de dosis alta.
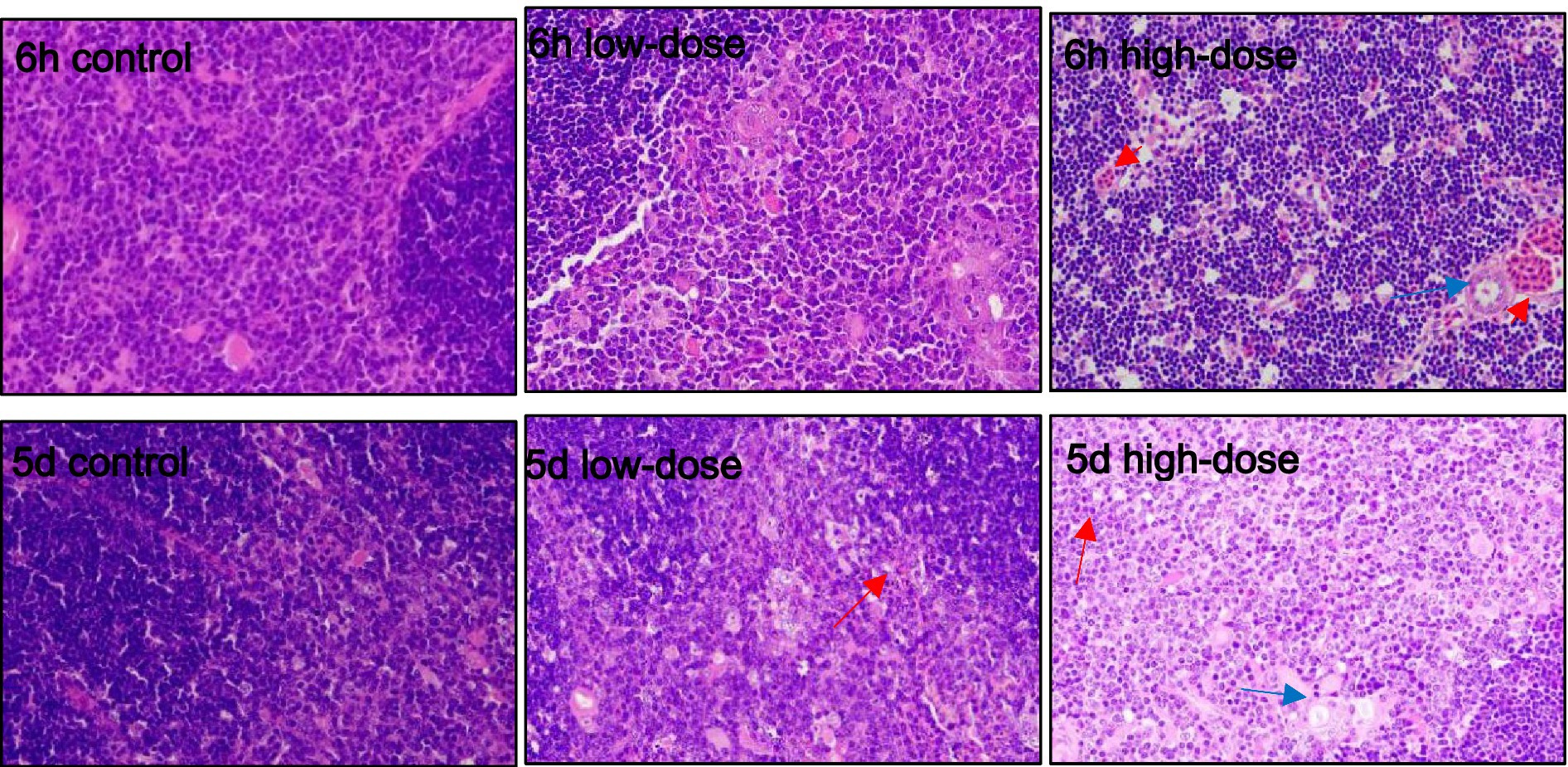
3.5 Observación histopatológica de LPS combinado con estrés oxidativo inducido por trombina en pollitos
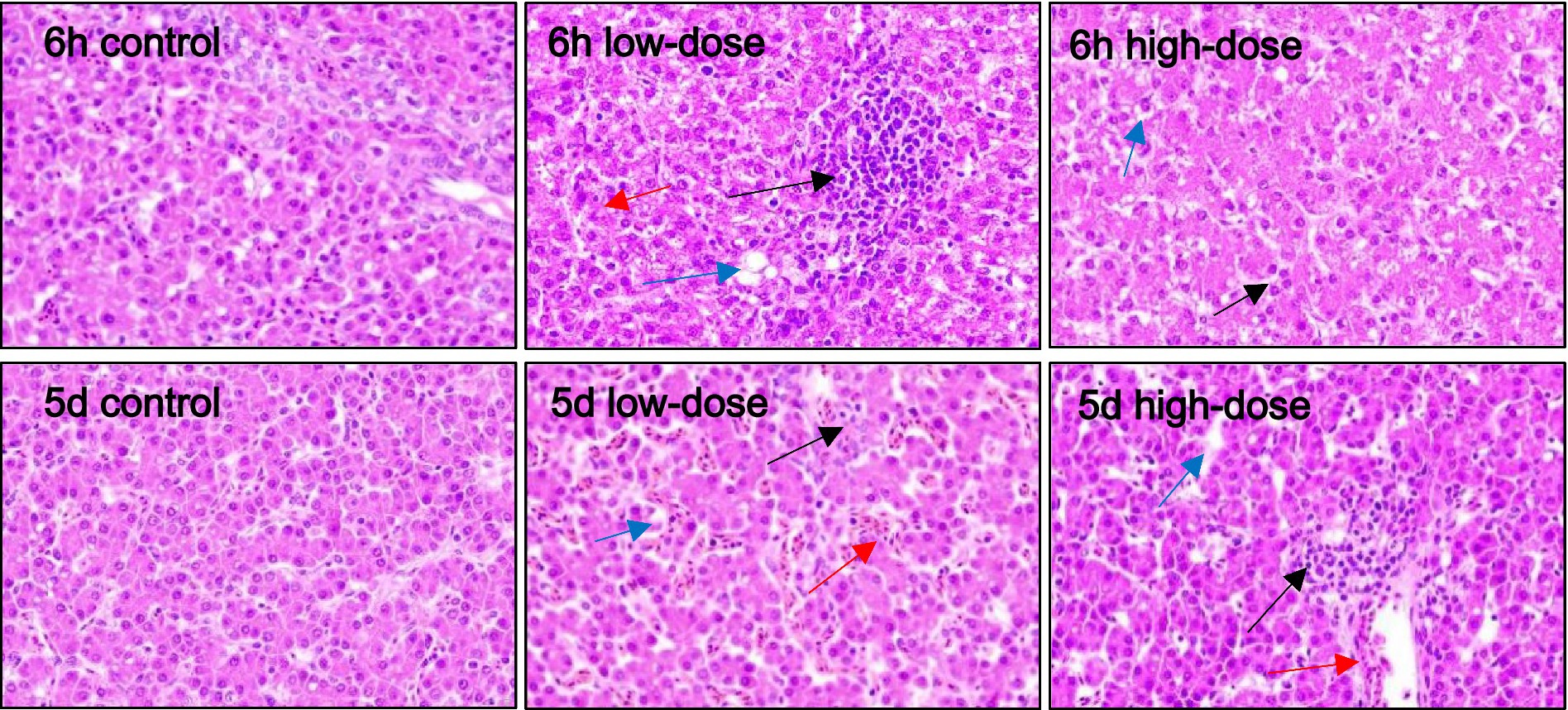
3.5.1 LPS combinado con estrés oxidativo hepático inducido por trombina en pollitos
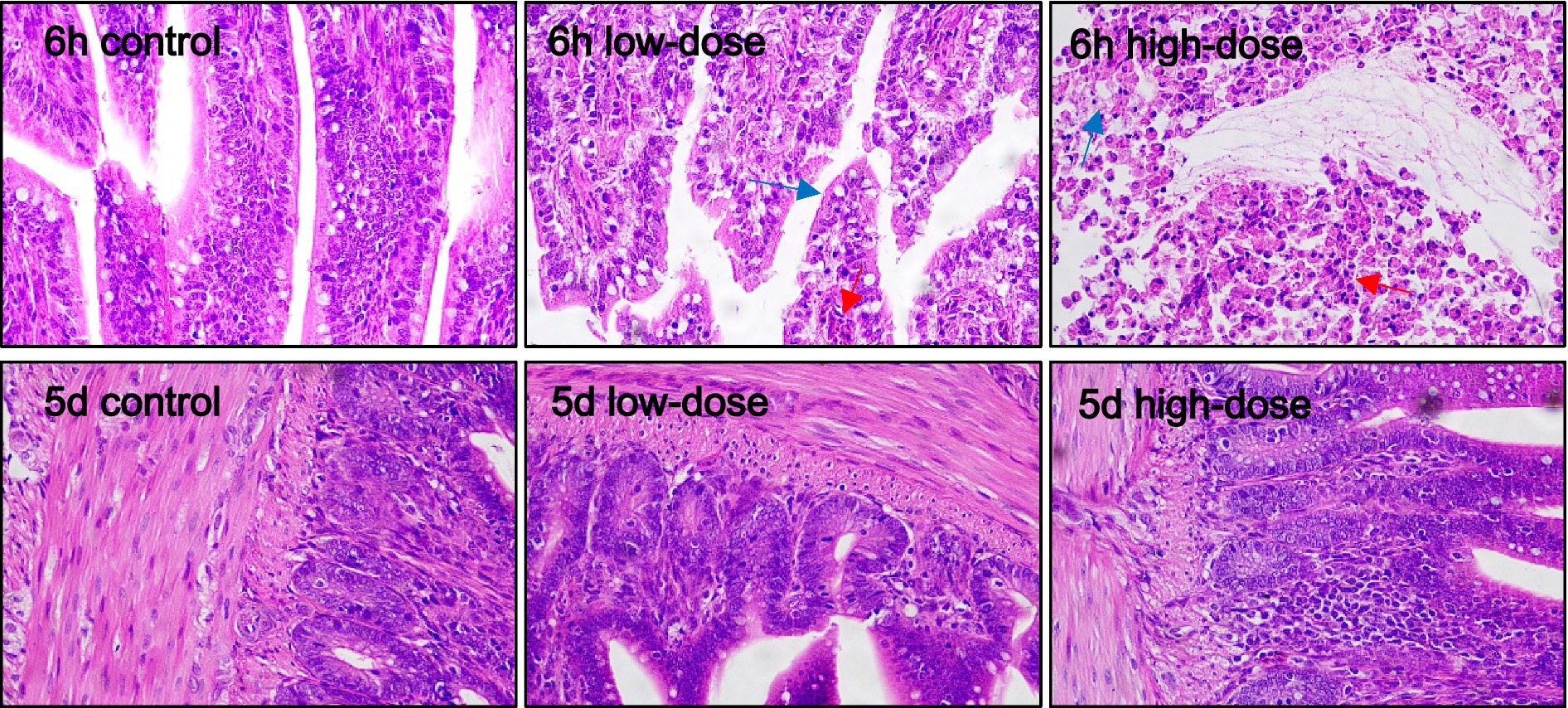
Como se muestra en la Figura 3, los resultados de la tinción HE mostraron que en el grupo control, las células hepáticas estaban claras después de la inyección durante 6 h y 5 días. En el grupo de dosis baja, 6 h después de la inyección, las células hepáticas mostraron una degeneración vacuolar masiva, con un límite ligeramente borroso e infiltración de granulocitos medianos y finos. Después de 5 días de la inyección, el espacio sinusoidal se expandió, con llenado de sangre, inflamación de las células hepáticas con degeneración vacuolar e infiltración de neutrófilos. En el grupo de dosis altas, después de 6 h de inyección, el espacio sinusoidal se expandió, exhibiendo hiperemia leve, degeneración vacuolar de células hepáticas e infiltración de neutrófilos. Al quinto día después de la inyección, las células hepáticas se hincharon con degeneración vacuolar, el espacio sinusoide estaba ligeramente congestionado y la vena sangraba.
3.5.2 Modelo de estrés oxidativo del bazo de un pollito inducido por LPS y trombina
Como se muestra en la Figura 4, el bazo desempeña un papel crucial en el sistema inmunitario, y es importante comprender su respuesta al LPS y a la inflamación inducida por la trombina. En el grupo control, la morfología de las células esplénicas era normal. En el grupo de dosis baja, no hubo ninguna anomalía obvia después de 5 días de inyección. Sin embargo, después de 6 h de la inyección, la necrosis de las células del parénquima del bazo y la pulpa blanca disminuyó significativamente. En el grupo de dosis altas, no hubo ninguna anormalidad obvia después de 5 días de la inyección, y no hubo cambios significativos después de 6 h de la inyección. Estos hallazgos sugieren que el LPS y el estrés oxidativo inducido por la trombina tuvieron un impacto limitado en el bazo a las dosis probadas. Se necesitan más estudios para investigar el efecto de dosis más altas sobre la morfología y la función del bazo.

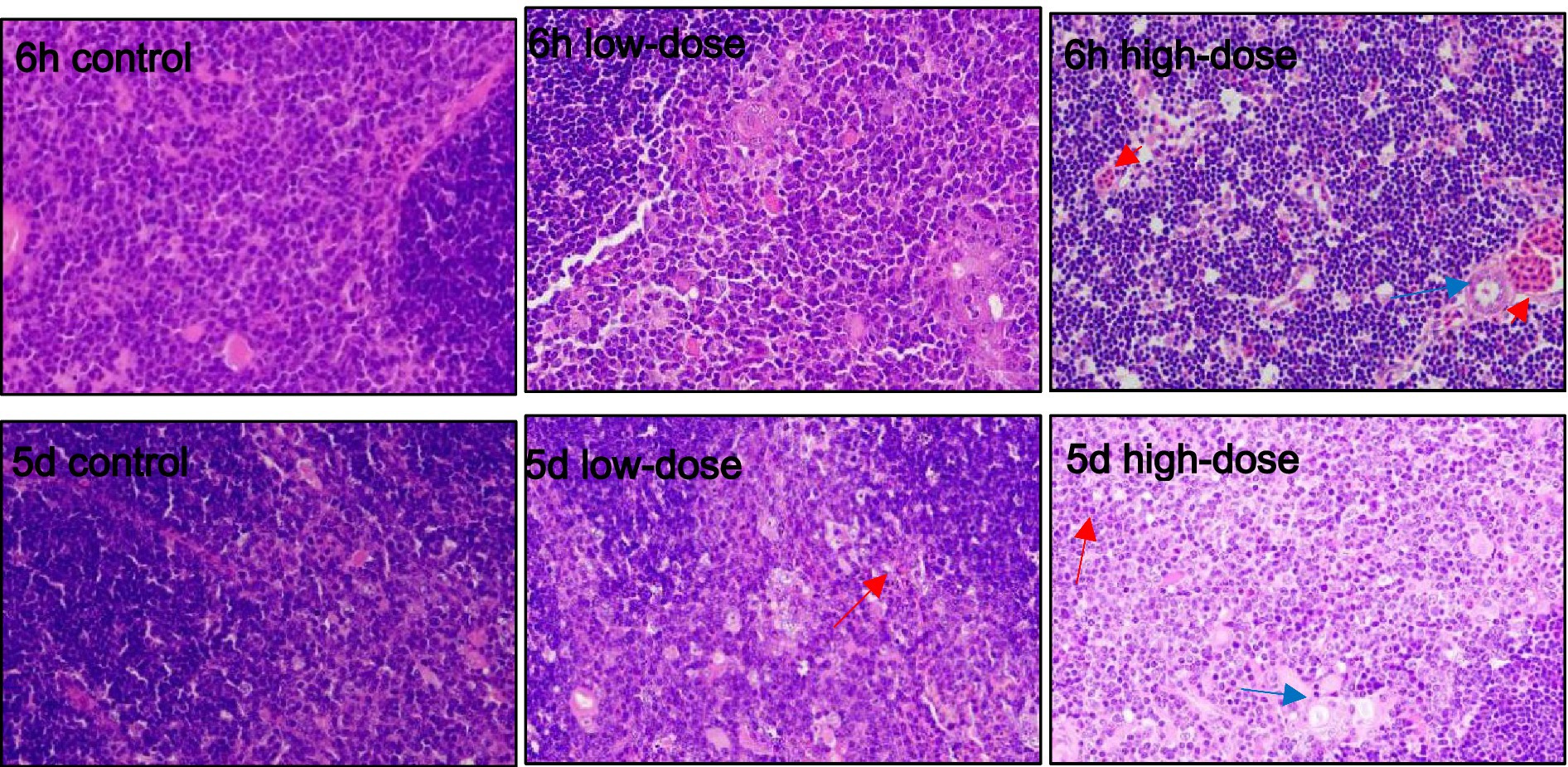
3.5.3 Estrés oxidativo del timo en pollitos inducido por LPS combinado con trombina
Como se muestra en la Figura 5, el grupo control no mostró ninguna anormalidad evidente en la morfología del timo. En el grupo de dosis baja, se produjeron diversos grados de eritrocitosis a los 5 días y 6 h después de la inyección. En el grupo de dosis altas, un gran número de eritrocitos proliferaron en el timo y los macrófagos aparecieron en la corteza a las 6 h después de la inyección. El número de timocitos en la médula disminuyó, lo que resultó en un color pálido de la médula. Al 5º día después de la inyección, hubo proliferación de eritrocitos en el timo y apareció una pequeña cantidad de degeneración vacuolar en la médula.
3.5.4 LPS combinado con estrés oxidativo inducido por trombina en pollitos del segmento intestinal
Como se muestra en la Figura 6, para el duodeno, la morfología de los histiocitos en el grupo control fue normal a las 6 h y 5 días después de la inyección. En el grupo de dosis bajas, hubo degeneración celular vacuolar evidente e infiltración de neutrófilos a las 6 h, y las vacuolas siguieron apareciendo a los 5 días, con cambios morfológicos y sangrado. En el grupo de dosis altas, hubo una pequeña cantidad de degeneración vacuolar celular, infiltración de neutrófilos, daño tisular y sangrado a las 6 h, y aún existían fenómenos vacuolares y hemorrágicos a los 5 días.

Como se muestra en la Figura 7, el grupo control tenía una morfología normal del tejido de las células yeyunales. El grupo de dosis baja tenía una pequeña cantidad de vacuolas y supuración de sangre 6 h y 5 días después de la inyección. En el grupo de dosis altas, los neutrófilos se infiltraron después de 6 h y 5 días, y apareció inflamación, y se observaron algunas vacuolas.
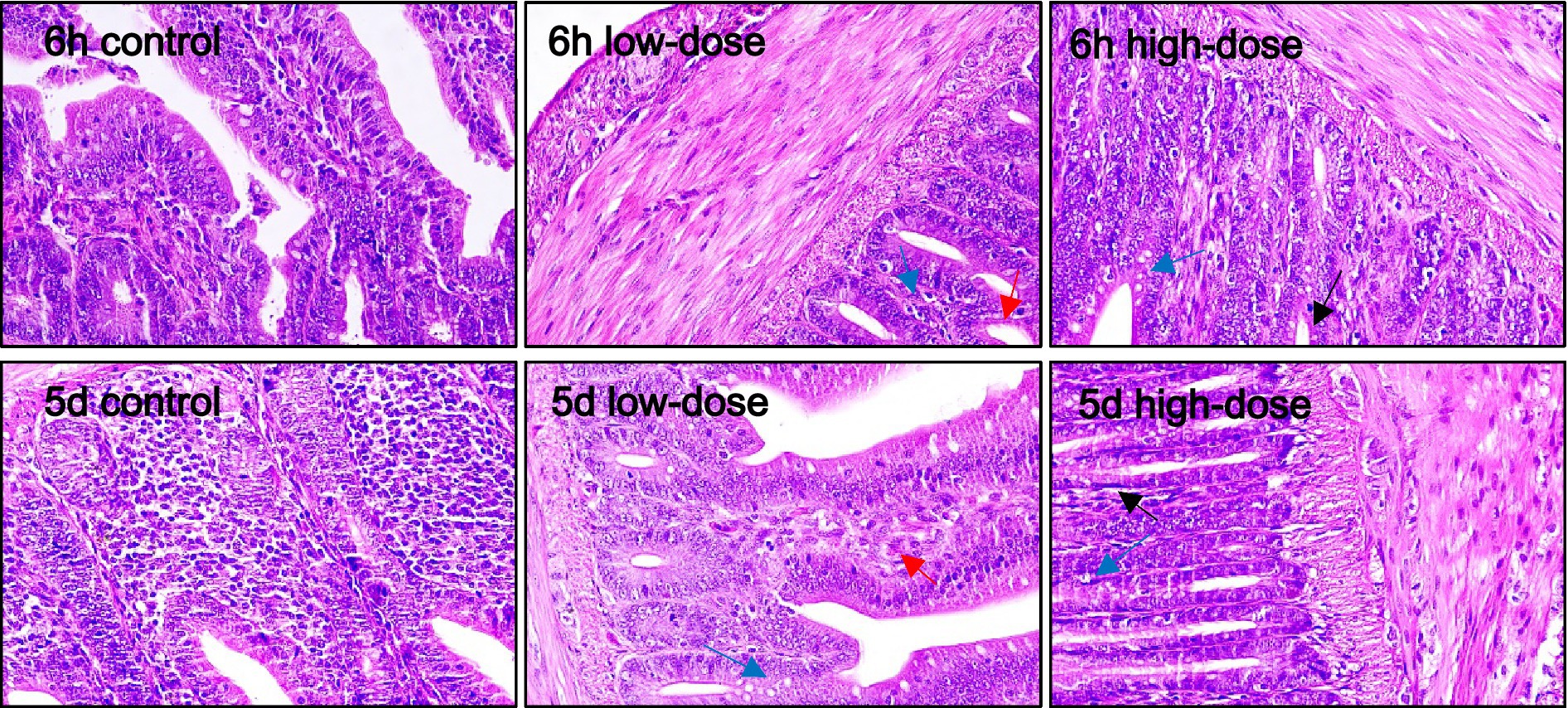
Como se muestra en la Figura 8, a las 6 h, el grupo de histiocitos ileales con dosis bajas y el grupo con dosis altas mostraron cambios morfológicos celulares evidentes, degeneración vacuolar, daño evidente y sangrado.
4 Discusión
4.1 El efecto del LPS combinado con la trombina sobre la temperatura del modelo de estrés oxidativo de los pollitos
El LPS es capaz de inducir la expresión y secreción de citoquinas inflamatorias como el TNF-α a través de diversas vías de señalización, como NF-κB y MAPK, lo que en última instancia desencadena la inflamación en el organismo (14). Además, el LPS actúa como pirógeno exógeno al estimular las células inmunitarias dentro del organismo para producir pirógenos endógenos (TNF-α, IL-1β). Estos pirógenos endógenos provocan fiebre estimulando mediadores en las células corticales del cerebro o participando directamente en la síntesis y liberación de PGE2, un mediador central de la fiebre (15, 16). A través de estudios de la inhibición de la óxido nítrico sintasa y la fiebre L-CIT inducida por endotoxinas sobre la temperatura corporal y las respuestas inflamatorias, se encontró que la hipertermia inducida por LPS se asoció con mayores concentraciones de NO y PGE2 (17). Además, la literatura sugiere que la estimulación de LPS en pollitos puede causar fácilmente endotoxemia en sus intestinos, lo que lleva a una respuesta febril (18). También se demostró que la reducción de la temperatura corporal durante la inflamación sistémica en pollitos incluyó la modulación de la respuesta hipotérmica a LPS, la inhibición de la termogénesis con la inhibición metabólica (19). Por lo tanto, en las primeras etapas del experimento, la temperatura rectal de los pollitos se utilizó como base para explorar los primeros síntomas y fenómenos clínicos del modelo de estrés oxidativo de los pollitos. Los resultados experimentales mostraron que el uso de LPS combinado con trombina para estimular pollitos de 4 días de edad podría causar cambios en su temperatura rectal. La temperatura rectal del grupo de dosis baja comenzó a descender a la normalidad después de 18 h, mientras que el grupo de dosis alta continuó mostrando una respuesta a la fiebre. Los síntomas clínicos de los pollitos incluyeron depresión, disminución de la ingesta de alimentos y algunos pollitos agrupándose y durmiendo, pero estos síntomas clínicos se resolvieron o desaparecieron después de un cierto período de autorregulación.
4.2 Impacto de la combinación de LPS y trombina en el rendimiento del crecimiento en un modelo de estrés oxidativo de pollitos
Investigaciones anteriores han demostrado que la exposición a LPS afecta tanto el sistema inmunológico innato como el adaptativo de los pollitos, provocando una respuesta inflamatoria y, posteriormente, comprometiendo el rendimiento del crecimiento (20, 21). Además, se ha demostrado que la inflamación sistémica inducida por LPS afecta negativamente a la formación ósea en los pollitos al inhibir procesos como el modelado óseo, la remodelación y las funciones de la matriz extracelular (22). En este estudio, el efecto sinérgico de LPS y trombina disminuyó significativamente la ganancia diaria de peso y empeoró la tasa de conversión alimenticia en pollitos. Este fenómeno puede atribuirse a la activación combinada del eje hipotálamo-hipófisis-suprarrenal y a la interrupción de los receptores de señalización del apetito por LPS y trombina, lo que en última instancia induce la anorexia (23). Además, la administración simultánea de LPS y trombina hace que el cuerpo produzca una cantidad sustancial de citocinas proinflamatorias. En consecuencia, los nutrientes del alimento se redirigen hacia el sistema inmunológico, lo que resulta en una disminución de la eficiencia de la utilización de nutrientes y una mayor disminución del rendimiento del crecimiento en los pollitos (24).
4.3 Efecto de LPS combinado con trombina sobre los indicadores séricos en un modelo de estrés oxidativo de pollitos
El LPS tiene la capacidad de provocar inflamación, estrés oxidativo y apoptosis en las células epiteliales mamarias bovinas. Esta inducción da lugar a la producción excesiva de ROS y MDA, al mismo tiempo que disminuye la actividad de las enzimas antioxidantes, como la SOD, y suprime la expresión de la proteína HO-1 (25). La acumulación excesiva de ROS es perjudicial para las macromoléculas, incluidas las proteínas y el ADN, así como para la función mitocondrial, lo que en última instancia causa daño celular y tisular (26, 27). La evidencia acumulada propone una relación bidireccional en la que la inflamación inicia el estrés oxidativo, que posteriormente amplifica la respuesta inflamatoria (28-30). Los hallazgos experimentales demuestran que la exposición combinada a LPS y trombina eleva notablemente los niveles de MDA al tiempo que reduce la actividad de T-AOC, GSH-PX y SOD séricos. Estas observaciones sugieren que el estrés sinérgico inducido por el LPS y la trombina altera el equilibrio normal del sistema oxidativo/antioxidante in vivo, lo que conduce a la manifestación del estrés oxidativo.
4.4 LPS combinado con un modelo de estrés oxidativo de pollitos inducido por trombina: impacto en los índices inmunes hepáticos
La interleucina es un tipo de citocina producida por varias células, que desempeña un papel fundamental en la función inmunitaria del cuerpo humano, incluida la proliferación celular y la regulación inmunitaria. Cuando las bacterias o los patógenos ingresan al cuerpo, la secreción de citocinas proinflamatorias (IL-1β, IL-6, TNF-α) en el cuerpo puede provocar respuestas inmunitarias de células y tejidos (31). La investigación ha demostrado que el LPS producido por la bacteria G es la principal causa de daño a los órganos en el cuerpo, y el primer órgano objetivo atacado por el LPS es el hígado (32). Esta estimulación activa la vía de señalización NF-κB aguas abajo y regula la proteína quinasa activada por mitógenos para causar una serie de respuestas inmunitarias en el cuerpo (33), lo que en última instancia conduce al daño de las células hepáticas. Los estudios han reportado que el LPS puede alterar el microambiente hepático al regular los mediadores inflamatorios relacionados con los macrófagos M1 o M2 y la hepatotoxicidad de los macrófagos (34). La combinación de cefoperazona sódica con LPS aumentó significativamente el contenido de IL-1β, IL-6 y TNF-α citocinas proinflamatorias en el suero de los pollos de engorde e indujo daño hepático en los pollitos (35, 36). Los resultados de este experimento mostraron que, en comparación con el grupo de control, los grupos de dosis baja y dosis alta mostraron un aumento en el contenido de citocinas proinflamatorias de IL-1β, IL-6 y TNF-α en el hígado. Sin embargo, el nivel de citocinas proinflamatorias fue bajo, lo que puede deberse al hecho de que el experimento solo extrajo los factores inflamatorios en el tejido hepático y no pudo reflejar el nivel de expresión de la inflamación sistémica. Como el hígado pertenece a las células epiteliales glandulares y al sistema de células epiteliales del tracto digestivo, el cuerpo debe tener respuestas antiinflamatorias para contrarrestar las respuestas inflamatorias excesivas y reducir el daño causado por la inflamación excesiva en el cuerpo.
4.5 Los efectos de la combinación de LPS y trombina en la patología tisular en un modelo de estrés oxidativo de pollitos
La bolsa de Fabricius y el timo son órganos linfoides centrales en los pollitos que son críticos para el desarrollo de la inmunidad adaptativa (37). Las células tímicas liberan varias citocinas, incluidas IL-1, IL-3, IL-4 e IL-6, así como hormonas como la timopoyetina y la timosina, que desempeñan un papel importante en la regulación de las respuestas inmunitarias (38). La investigación ha demostrado que la inducción de inflamación a través de la estimulación de LPS puede provocar daño tisular, reacciones vasculares y proliferación celular (39). Patológicamente, la estimulación de LPS da lugar a la aparición de vacuolas en las células de los tejidos, lo que se conoce como «abombamiento». Durante el desarrollo de la inflamación, la proliferación celular se hace cada vez más evidente en las últimas etapas. Mecánicamente, los estudios han indicado que ciertas citoquinas producidas durante la inflamación pueden estimular la proliferación celular (40). La estimulación con LPS también da lugar a diversos grados de hemorragia tisular.
Las aves de corral tienen cierta tolerancia al LPS, y la estimulación única de las aves de corral con LPS por sí sola no puede causar una infección obvia (41). Sin embargo, con la ayuda de la trombina, se puede establecer un modelo de estrés oxidativo en aves de corral. Los resultados de este experimento mostraron que bajo la inyección de LPS combinada con trombina, al recolectar tejidos de hígado, bazo, intestino y timo de pollo y hacer cortes, se pueden observar diversos grados de proliferación de eritrocitos y degeneración vacuolar de células tisulares en tejidos de pollo. A través del experimento, se descubrió que el LPS combinado con trombina puede inducir respuestas de estrés oxidativo en los pollitos, y el grado de daño tisular patológico en los pollitos varía a diferentes concentraciones. El daño tisular en los pollitos fue más significativo bajo la estimulación de bajas concentraciones de LPS combinada con trombina.
De acuerdo con la literatura, el uso de LPS solo para establecer un modelo inflamatorio en aves de corral no es ideal, posiblemente debido a factores de coagulación insuficientes en las aves de corral. Algunos estudios han encontrado que los efectos combinados cuando se usa LPS para la inducción de la inflamación (42). Otras investigaciones han encontrado que la enzima de coagulación en la víbora de labios blancos está compuesta por protrombina y trombina, y sus mecanismos de acción son similares. Bajo la acción del Ca2+, pueden activar los factores V, VII, VIII y promover la agregación plaquetaria. La protrombina, bajo la acción del factor III plaquetario, puede transformar la protrombina en trombina, activar el factor V y afectar al factor X (43). Al mismo tiempo, la investigación ha demostrado que la inyección de enzima de coagulación del veneno de víbora de labios blancos en dosis bajas tiene un efecto procoagulante en el cuerpo, mientras que la inyección en dosis altas tiene un efecto anticoagulante (44). Bajo la acción de dosis bajas, se activa el sistema de coagulación de los pollitos, activando así los factores de coagulación. Bajo la acción de dosis altas, el sistema de coagulación de los pollitos se inhibe, lo que resulta en la inhibición de los factores de coagulación (45). En este experimento, los pollitos fueron estimulados con LPS combinado con trombina. Los resultados mostraron que bajo la acción de dosis bajas, la respuesta al estrés oxidativo de los pollitos fue significativa, mientras que bajo la acción de dosis altas, la respuesta al estrés oxidativo de los pollitos no fue significativa. La razón puede ser que la alta dosis de trombina inhibe el sistema de coagulación. Por lo tanto, la baja dosis de trombina y LPS utilizada en este experimento es la concentración más adecuada para construir un modelo de estrés oxidativo de pollitos.
5 Conclusión
Este estudio utilizó pollos de engorde AA de 4 días de edad para investigar la influencia de diferentes concentraciones de LPS combinado con trombina en el rendimiento del crecimiento, los índices de antioxidantes séricos y los índices inmunológicos de los pollos de engorde. Con base en los hallazgos del presente estudio, se puede concluir que tanto el grupo de dosis baja como el de dosis alta pueden desencadenar la respuesta al estrés oxidativo de los pollitos, y la respuesta al estrés oxidativo del grupo de dosis baja es más pronunciada, y por lo tanto el grupo de dosis baja en este estudio es la concentración más adecuada para constituir un modelo experimental efectivo de estrés oxidativo de los pollitos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética Animal de la Universidad de Hainan. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
HS: Conceptualización, Metodología, Visualización, Redacción – revisión y edición. FY: Conceptualización, Metodología, Redacción – borrador original. ZP: Curación de datos, Administración de proyectos, Software, Redacción – revisión y edición. JW: Análisis formal, Investigación, Metodología, Validación, Redacción – revisión y edición. QW: Curación de datos, Metodología, Validación, Redacción, revisión y edición. PQ: Curación de datos, Metodología, Validación, Redacción, revisión y edición. RB: Curación de datos, Metodología, Validación, Redacción, revisión y edición. LH: Curación de datos, Metodología, Validación, Redacción, revisión y edición. XL: Curación de datos, Metodología, Validación, Redacción – revisión y edición. HZ: Curación de datos, Metodología, Validación, Redacción, revisión y edición. XW: Conceptualización, Obtención de fondos, Metodología, Recursos, Supervisión, Redacción – revisión y edición.
Financiación
El (los) autor(es) declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (subvención n.º 31960677).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Serhan, CN, Chiang, N, y Dalli, J. El código de resolución de la inflamación aguda: nuevos mediadores lipídicos pro-resolutivos en la resolución. Semin Immunol. (2015) 27:200–15. doi: 10.1016/j.smim.2015.03.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Gil-Cardoso, K, Comitato, R, Ginés, I, Ardévol, A, Pinent, M, Virgili, F, et al. Efecto protector de las proantocianidinas en un modelo de rata de inflamación intestinal leve y alteración de la permeabilidad intestinal inducida por LPS. Mol Nutr Food Res. (2019) 63:E1800720. doi: 10.1002/mnfr.201800720
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Steimle, A, Autenrieth, IB, y Frick, J-S. Estructura y función: modificaciones lipídicas en comensales y patógenos. Int J Med Microbiol. (2016) 306:290–301. doi: 10.1016/j.ijmm.2016.03.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Bannerman, DD, y Goldblum, SE. Mecanismos de la apoptosis endotelial inducida por lipopolisacáridos bacterianos. Am J Physiol Célula pulmonar Mol Physiol. (2003) 284:L899-914. doi: 10.1152/ajplung.00338.2002
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Aire, WC. El papel del endotelio en la sepsis grave y el síndrome de disfunción orgánica múltiple. Sangre. (2003) 101:3765–77. doi: 10.1182/blood-2002-06-1887
6. Ha, YR, Ha, H y Lee, SJ. Protección de la permeabilidad de los vasos por genisteína frente a la inflamación aguda inducida por lipopolisacáridos en un modelo de membrana corioalantoidea de embrión de pollo. Biotecnología de la ciencia alimentaria. (2013) 22:1–8. doi: 10.1007/s10068-013-0239-x
7. Prezoto, BC, y Oguiura, N. Plasma de pollo deficiente en el factor XII como objetivo útil para el cribado de toxinas de veneno animal procoagulante y anticoagulante. Toxinas. (2020) 12:79. doi: 10.3390/toxinas12020079
8. Essalmani, R, Susan-Resiga, D, Guillemot, J, Kim, W, Sachan, V, Awan, Z, et al. La activación de la proteína C por trombina requiere un procesamiento previo por parte de una proproteína convertasa hepática. J Biol Chem. (2017) 292:10564–73. doi: 10.1074/jbc. M116.770040
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Esmon, Connecticut. Las interacciones entre la inflamación y la coagulación. Hno. J Haematol. (2005) 131:417–30. doi: 10.1111/j.1365-2141.2005.05753.x
10. Davì, G, y Patrono, C. Activación plaquetaria y aterotrombosis. N Engl J Med. (2007) 357:2482–94. doi: 10.1056/NEJMra071014
11. Levi, M, van der Poll, T, y Büller, HR. Relación bidireccional entre inflamación y coagulación. Circulación. (2004) 109:2698–704. doi: 10.1161/01.CIR.0000131660.51520.9A
12. Pape, R, Rauch, BH, Rosenkranz, AC, Kaber, G y Schrör, K. Inhibición transcripcional de la expresión del receptor-1 activado por proteasa por prostaciclina en células de músculo liso vascular humano. Arterioscler Thromb Vasc Biol. (2008) 28:534–40. doi: 10.1161/atvbaha.107.159483
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Popović, M, Smiljanić, K, Dobutović, B, Syrovets, T, Simmet, T e Isenović, ER. Trombina e inflamación vascular. Mol Cell Biochem. (2012) 359:301–13. DOI: 10.1007/S11010-011-1024-X
14. Tang, J, Xu, L, Zeng, Y y Gong, F. Efecto de la microbiota intestinal en la lesión pulmonar aguda inducida por LPS mediante la regulación de la vía de señalización TLR4/NF-kB. Int Immunopharmacol. (2021) 91:107272. doi: 10.1016/j.intimp.2020.107272
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Koch, F, Thom, U, Albrecht, E, Weikard, R, Nolte, W, Kuhla, B, et al. El estrés por calor afecta directamente a la integridad intestinal y recluta distintas poblaciones de células inmunitarias en el intestino bovino. Proc Natl Acad Sci USA. (2019) 116:10333–8. doi: 10.1073/pnas.1820130116
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Dangarembizi, R, Erlwanger, KH, Rummel, C, Roth, J, Madziva, MT, y Harden, LM. La levadura de cerveza es un potente inductor de fiebre, comportamiento de enfermedad e inflamación dentro del cerebro. El cerebro se comporta inmune. (2018) 68:211–23. doi: 10.1016/j.bbi.2017.10.019
17. Uyanga, VA, Zhao, J, Wang, X, Jiao, H, Onagbesan, OM y Lin, H. La L-citrulina dietética influye en la temperatura corporal y las respuestas inflamatorias durante la inhibición de la óxido nítrico sintasa y el desafío de endotoxinas en pollos. Estrés. (2022) 25:74–86. doi: 10.1080/10253890.2021.2023495
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Liu, SD, Song, MH, Yun, W, Lee, JH, Kim, HB y Cho, JH. Efecto de los aceites esenciales de carvacrol sobre la respuesta inmunitaria y la expresión de genes relacionados con la inflamación en pollos de engorde desafiados por lipopolisacáridos. Poult Sci. (2019) 98:2026–33. doi: 10.3382/ps/pey575
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Amaral-Silva, LD, Gargaglioni, LH, Steiner, AA, Oliveira, MT y Bícego, KC. Hipotermia regulada en respuesta a endotoxinas en aves. J Physiol. (2021) 599:2969–86. doi: 10.1113/jp281385
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Chen, W, Du, L, Cai, C, Huang, L, Zheng, Q, Chen, J, et al. Tomemos como ejemplo a los pollitos: Rummeliibacillus stabekisii Cy2 mejora la inmunidad y regula la microbiota intestinal mediante la degradación de LPS para promover el crecimiento y desarrollo del organismo. J Alimentos Fungt. (2023) 105:105583. doi: 10.1016/j.jff.2023.105583
21. Yu, Y, Li, Q, Zeng, X, Xu, Y, Jin, K, Liu, J, et al. Efectos de los probióticos sobre el rendimiento del crecimiento, las funciones antioxidantes, las respuestas inmunitarias y la microbiota cecal de los pollos de engorde desafiados por lipopolisacáridos. Delantero Vete Sci. (2022) 9:846649. doi: 10.3389/fvets.2022.846649
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Tong, X, Zhang, J y Li, J. Modelado y remodelación ósea de los trastornos de inflamación inducidos por LPS mediante la inhibición de la angiogénesis y el trastorno de la osteogénesis en pollos. Inflamm Res. (2020) 69:765–77. DOI: 10.1007/S00011-020-01361-X
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Yamawaki, Y, Shirawachi, S, Mizokami, A, Nozaki, K, Ito, H, Asano, S, et al. La proteína catalíticamente inactiva relacionada con la fosfolipasa C regula la anorexia mediada por la inflamación hipotalámica inducida por lipopolisacáridos en ratones. Neurochem Int. (2019) 131:104563. doi: 10.1016/j.neuint.2019.104563
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Yang, S, Zhang, J, Jiang, Y, Xu, YQ, Jin, X, Yan, SM, et al. Efectos de los flavonoides de Artemisia argyi sobre el rendimiento del crecimiento y la función inmune en pollos de engorde desafiados con lipopolisacáridos. Anim Biosci. (2021) 34:1169–80. doi: 10.5713/ab.20.0656
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Meng, M, Huo, R, Wang, Y, Ma, N, Shi, X, Shen, X, et al. El lentinan inhibe el estrés oxidativo y alivia la inflamación inducida por LPS y la apoptosis de las BMEC mediante la activación de la vía de señalización Nrf2. Int J Biol Macromol. (2022) 222:2375–91. doi: 10.1016/j.ijbiomac.2022.10.024
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Snezhkina, AV, Kudryavtseva, AV, Kardymon, OL, Savvateeva, MV, Melnikova, NV, Krasnov, GS, et al. Generación de ROS y sistemas de defensa antioxidante en células normales y malignas. Oxid Med Cell Longev. (2019) 2019:6175804. doi: 10.1155/2019/6175804
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Jakubczyk, K, Dec, K, Kałduńska, J, Kawczuga, D, Kochman, J y Janda, K. Especies reactivas de oxígeno: fuentes, funciones, daño oxidativo. Pol Merkur Lekarski. (2020) 48:124–7.
28. Gambini, J, y Stromsnes, K. Estrés oxidativo e inflamación: de los mecanismos a los enfoques terapéuticos. Biomedicinas. (2022) 10:753. doi: 10.3390/biomedicinas10040753
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Ramos-González, EJ, Bitzer-Quintero, OK, Ortiz, G, Hernández-Cruz, JJ, y Ramírez-Jirano, LJ. Relación entre inflamación y estrés oxidativo y su efecto sobre la esclerosis múltiple. Neurología. (2024) 39:292–301. doi: 10.1016/j.nrl.2021.10.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Kapoor, D, Singh, S, Kumar, V, Romero, R, Prasad, R y Singh, J. Regulación de enzimas antioxidantes en plantas en referencia a especies reactivas de oxígeno (ROS) y especies reactivas de nitrógeno (RNS). Gen de la planta. (2019) 19:100182. doi: 10.1016/j.plgene.2019.100182
31. Xie, MH, Aggarwal, S, Ho, WH, Foster, J, Zhang, Z, Stinson, J, et al. Interleucina (IL)-22, una nueva citocina humana que envía señales a través de las proteínas relacionadas con el receptor de interferón CRF2-4 e IL-22R. J Biol Chem. (2000) 275:31335–9. doi: 10.1074/jbc. M005304200
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. An, L, Wirth, U, Koch, D, Schirren, M, Drefs, M, Koliogiannis, D, et al. El papel de los lipopolisacáridos derivados del intestino y la barrera intestinal en las enfermedades del hígado graso. J Gastrointest Surg. (2022) 26:671–83. doi: 10.1007/s11605-021-05188-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Huang, X-Y, Ansari, AR, Huang, H-B, Zhao, X, Li, N-Y, Sun, Z-J, et al. El lipopolisacárido media las alteraciones inmunopatológicas en el hígado de pollo joven a través de la señalización de TLR4. BMC Immunol. (2017) 18:12. doi: 10.1186/s12865-017-0199-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Pervin, M, Karim, MR, Kuramochi, M, Izawa, T, Kuwamura, M y Yamate, J. Poblaciones de macrófagos y expresión de factores inflamatorios reguladores en hígados de rata con macrófagos hepáticos bajo tratamiento con lipopolisacáridos (LPS). Toxicol Pathol. (2018) 46:540–52. doi: 10.1177/0192623318776898
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Nakamura, K, Mitarai, Y, Yoshioka, M, Koizumi, N, Shibahara, T y Nakajima, Y. Niveles séricos de interleucina-6, glicoproteína alfa1-ácido y corticosterona en pollos de dos semanas de edad inoculados con lipopolisacárido de Escherichia coli. Sci. (1998) 77:908–11. doi: 10.1093/PS/77.6.908
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Wu, FL, Hu, YH, Ji, P, Li, CC y He, J. Estudio metabonómico sobre el mecanismo del efecto hepatoprotector de los polisacáridos de diferentes productos procesados de Angelica sinensis en pollos ponedoras basado en UPLC-Q/TOF-MS/MS, análisis estadístico multivariado y análisis conjunto. Cromatografía Biomed. (2022) 36:E5362. doi: 10.1002/bmc.5362
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Ribatti, D, Tamma, R, y Elieh Ali Komi, D. Las bases morfológicas del desarrollo del sistema inmune del embrión de pollo. Exp Cell Res. (2019) 381:323–9. doi: 10.1016/j.yexcr.2019.05.027
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Yan, F, Mo, X, Liu, J, Ye, S, Zeng, X y Chen, D. Función tímica en la regulación de las células T y mecanismos moleculares subyacentes a la modulación de citocinas y la señalización del estrés. Mol Med Rep. (2017) 16:7175–84. doi: 10.3892/mmr.2017.7525
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Liang, D, Jin, Y, Lin, M, Xia, X, Chen, X y Huang, A. La regulación a la baja de Xist y Mir-7a-5p mejora la lesión miocárdica inducida por LPS. Int J Med Sci. (2020) 17:2570–7. doi: 10.7150/ijms.45408
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Jain, S, Dash, P, Minz, AP, Satpathi, S, Samal, AG, Behera, PK, et al. El lipopolisacárido (LPS) mejora la metástasis del cáncer de próstata potencialmente a través de la activación de NF-κB, y la administración recurrente de dexametasona no logra suprimirla in vivo. Próstata. (2019) 79:168–82. doi: 10.1002/pros.23722
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Foley, SL, Johnson, TJ, Ricke, SC, Nayak, R, y Danzeisen, J. Patogenic de salmonella y adaptación del huésped en serovares asociados a pollos. Microbiol Mol Biol Rev. (2013) 77:582–607. doi: 10.1128/mmbr.00015-13
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Zhang, Y, Guo, F, Ni, Y y Zhao, R. La inflamación inducida por LPS en el pollo se asocia con la masa grasa mediada por la proteína de unión a CCAAT/potenciador beta y la regulación negativa de genes asociada a la obesidad en el hígado, pero no en el hipotálamo. BMC Vet Res. (2013) 9:257. doi: 10.1186/1746-6148-9-257
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Palta, S, Saroa, R, y Palta, A. Descripción general del sistema de coagulación. Indio J Anaesth. (2014) 58:515–23. doi: 10.4103/0019-5049.144643
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Maduwage, K, e Isbister, GK. Tratamiento actual para la coagulopatía por consumo inducida por veneno por mordedura de serpiente. PLoS negl trop dis. (2014) 8:E3220. doi: 10.1371/journal.pntd.0003220
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Juang, LJ, Mazinani, N, Novakowski, SK, Prowse, ENP, Haulena, M, Gailani, D, et al. El factor XII de la coagulación contribuye a la hemostasia cuando es activado por el suelo en las heridas. Sangre Adv. (2020) 4:1737–45. doi: 10.1182/bloodadvances.2019000425
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: LPS, trombina, pollos de engorde AA, índices inmunitarios, estrés oxidativo
Cita: Shi H, Yang F, Peng Z, Wu J, Wang Q, Qiu P, Bao R, Huang L, Li X, Zhang H y Wang X (2024) Modelo de estrés oxidativo de lipopolisacárido combinado con inducción de trombina en pollos de engorde. Frente. Vet. Sci. 11:1369515. doi: 10.3389/fvets.2024.1369515
Recibido: 16 de enero de 2024; Aceptado: 29 de octubre de 2024;
Publicado: 18 de noviembre de 2024.
Editado por:
Mahmoud Madkour, Centro Nacional de Investigación, Egipto
Revisado por:
Lin Sun, Academia de Ciencias Agrícolas y Ganaderas de Mongolia Interior, China
Shicheng Bi, Universidad del Suroeste, China
Hisham Shoukry, Universidad de Al-Azhar, Egipto
Osama Aboelazab, Centro Nacional de Investigación, Egipto
Derechos de autor © 2024 Shi, Yang, Peng, Wu, Wang, Qiu, Bao, Huang, Li, Zhang y Wang. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Xuemei Wang, wangxuemei@hainanu.edu.cn
†Estos autores han contribuido a partes iguales a este trabajo y comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía