Citología corneal y conjuntival
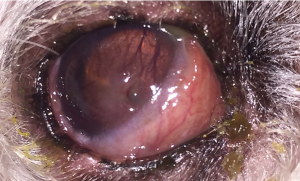
- Un examen ocular inicial con pruebas de diagnóstico básicas (p. Ej., Oftalmoscopia directa e indirecta, tinción con fluoresceína, prueba de desgarro de Schirmer, tonometría) está indicado para la mayoría de los pacientes con enfermedades corneales y / o conjuntivales, que son comunes en animales domésticos. La queratitis ulcerosa (Figura 1) es particularmente común y a menudo se resuelve en 5 a 7 días con el tratamiento adecuado.1 Con úlceras corneales complicadas y otras enfermedades corneales progresivas o persistentes, puede ser necesaria una investigación más allá del diagnóstico básico.
La citología puede tener una variedad de aplicaciones, que incluyen:
* Caracterización inmediata de células inflamatorias o neoplásicas u organismos infecciosos, incluidos los casos en que se pueden indicar pruebas de cultivo y susceptibilidad o PCR
* Permitir la dirección de la terapia empírica mientras se esperan resultados de cultivo y susceptibilidad
* Diagnóstico de muchas enfermedades infecciosas e inflamatorias (p. Ej., Queratitis ulcerosa o fúngica, conjuntivitis eosinofílica felina o queratitis, conjuntivitis bacteriana)
* Facilitar una terapia médica rápida y apropiada 2
* Caracterización de las células de una masa proliferativa corneal o conjuntival
* En pacientes con úlceras corneales que están progresando en profundidad o no responden al tratamiento inicial dentro de 5 a 7 días porque una causa común de progresión es la infección3
La citología corneal está contraindicada en pacientes que tienen úlceras graves con una membrana de Descemet expuesta (es decir, descemetocele) o con perforación corneal. Debido a que estos pacientes requieren tratamiento quirúrgico, la citología es innecesaria y podría causar más lesiones en el ojo1,3. La citología conjuntival rara vez está contraindicada; sin embargo, puede no tener mucho valor diagnóstico en pacientes con lesiones conjuntivales sin una superficie ulcerada o fácilmente exfoliada. Los casos en los que la citología conjuntival puede no ser diagnóstica incluyen engrosamiento o nódulos conjuntivales (p. Ej., Episcleritis granulomatosa nodular), ciertos organismos infecciosos (p. Ej., Micobacterias, hongos) y algunos tipos de neoplasia (p. Ej., Carcinoma de células escamosas) .4 Además, La citología conjuntival, aunque no está contraindicada, tiene una utilidad diagnóstica mínima en la ulceración corneal.
Se pueden realizar pruebas de cultivo y susceptibilidad en combinación con citología si se sospecha enfermedad bacteriana o fúngica. Si se realizan ambos procedimientos, se deben tomar muestras de cultivo antes de la recolección de citología3,4.
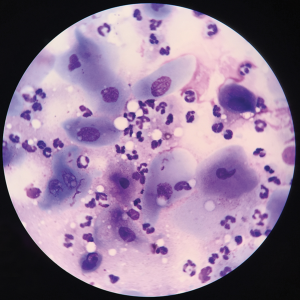
La citología corneal o conjuntival se puede utilizar para identificar el número, la morfología y las características de tinción de las células inflamatorias y los organismos infecciosos presentes en la enfermedad. Las células neoplásicas también pueden identificarse en la muestra.4 Las muestras corneales normales deben incluir células epiteliales no coronadas, pocos linfocitos y neutrófilos y bacterias raras; se puede identificar inflamación neutrofílica moderada en casos de queratitis, incluida la queratitis ulcerosa (Figura 2) .5 Las muestras conjuntivales están compuestas normalmente de células epiteliales escamosas y columnares, células caliciformes, melanina y bacterias ocasionales; Las células inflamatorias pueden visualizarse en casos de conjuntivitis (Figura 3). Raramente se observan linfocitos, neutrófilos, monocitos y células plasmáticas.
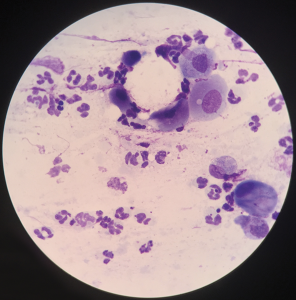
Con la enfermedad bacteriana, predominan los neutrófilos, pueden ser degenerados o no degenerados y pueden contener bacterias intracelulares. Incluso si las bacterias no se visualizan, la presencia de inflamación neutrofílica sugiere infección de la córnea.1 La identificación de hifas fúngicas sugiere enfermedad micótica.3 La presencia de eosinófilos o mastocitos es un hallazgo anormal en una muestra de citología corneal o conjuntival y sugiere queratitis eosinofílica o conjuntivitis alérgica, respectivamente4,6
El tratamiento exitoso de la enfermedad corneal y conjuntival requiere una terapia adecuada e inmediata, ya que la pérdida de visión puede ocurrir rápidamente.3 Se debe considerar la derivación a un oftalmólogo para pacientes con úlceras corneales complicadas y otras enfermedades oculares progresivas.
PASO A PASO CITOLOGÍA CORNEAL Y CONJUNTIVA
¿Qué necesitarás?
* Anestesia tópica (p. Ej., Proparacaína, tetracaína)
* Diapositivas de vidrio
* Espátula Kimura
* Hoja de bisturí # 15 (estéril)
* Microaplicador para recolectar citología
* Mancha tipo Romanowsky
* Microscopio
PASO 1
Usando una bola de algodón húmeda o un trozo de gasa ocular, limpie suavemente cualquier residuo de la superficie ocular, moco o ungüento en exceso. Se puede usar una gasa tradicional de 4 por 4 (10.16 cm x 10.16 cm) para limpiar los restos perioculares, pero nunca debe entrar en contacto con la superficie corneal o conjuntival.
PASO 2
Aplique 1 a 2 gotas de anestésico tópico en el ojo, esperando aproximadamente 30 segundos entre cada gota. Espere aproximadamente 5 minutos para que el anestésico tópico logre el máximo efecto; Los suministros de citología se pueden recoger durante este tiempo.
Perspectiva del autor
La mayoría de los pacientes requieren solo anestesia tópica, y la sedación generalmente no es necesaria; sin embargo, los pacientes frenéticos o excitados pueden requerir sedación química para reducir el riesgo de lesiones durante el procedimiento. Si es necesario, la sedación puede hacer que el globo gire ventralmente, y se necesitarán pinzas de dientes pequeños (por ejemplo, Bishop-Harmon) para agarrar suavemente la conjuntiva bulbar para colocar el globo para la recolección de citología.
 PASO 3
PASO 3
Restrinja o haga que un asistente sujete adecuadamente al paciente colocando una mano en la parte posterior de la cabeza y la otra debajo del mentón, teniendo cuidado de no apretar demasiado el hocico.
Mantenga los párpados abiertos con el pulgar y el índice de la mano no dominante. Apoye la mano dominante sobre la cabeza del paciente. Esta posición asegurará que, si el paciente se mueve, los instrumentos se mueven con el paciente, lo que puede disminuir la posibilidad de lesión ocular. Tenga cuidado de no tocar los párpados con el instrumento, ya que esto puede contaminar la muestra.
PASO 4
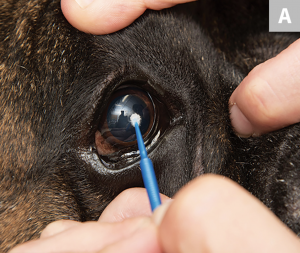
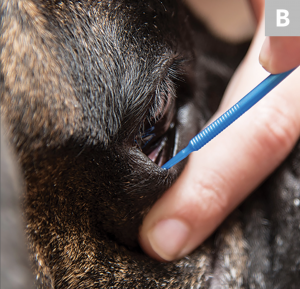 Usando un microaplicador, una espátula Kimura o el extremo romo de una hoja de bisturí estéril # 15, raspe suavemente la córnea o la conjuntiva de 5 a 7 veces. El movimiento de raspado puede ser de hasta 3 a 5 mm de longitud, dependiendo del tamaño del área de infiltración celular. Para la córnea, se recomienda tomar muestras del área que rodea la ulceración o cualquier área que tenga una apariencia celular (A). Para la conjuntiva (palpebral o bulbar), cualquier tejido enfermo debería ser suficiente (B). Se recoge una muestra ideal con una molestia mínima para el paciente y proporciona una monocapa adecuada de células epiteliales corneales o conjuntivales intactas.
Usando un microaplicador, una espátula Kimura o el extremo romo de una hoja de bisturí estéril # 15, raspe suavemente la córnea o la conjuntiva de 5 a 7 veces. El movimiento de raspado puede ser de hasta 3 a 5 mm de longitud, dependiendo del tamaño del área de infiltración celular. Para la córnea, se recomienda tomar muestras del área que rodea la ulceración o cualquier área que tenga una apariencia celular (A). Para la conjuntiva (palpebral o bulbar), cualquier tejido enfermo debería ser suficiente (B). Se recoge una muestra ideal con una molestia mínima para el paciente y proporciona una monocapa adecuada de células epiteliales corneales o conjuntivales intactas.
Perspectiva del autor
El margen del defecto ulcerativo, la placa o las lesiones inflamatorias elevadas tendrán la mayor probabilidad de contener organismos causantes, infiltrado inflamatorio o células de diagnóstico.
 PASO 5
PASO 5
Transfiera la muestra del instrumento de recolección a un portaobjetos de vidrio golpeando suavemente el instrumento o haciendo rodar el cepillo sobre el portaobjetos, teniendo cuidado de no manchar ni aplastar las células. La preparación de varias diapositivas a partir de muestras repetidas y muestras múltiples puede aumentar las posibilidades de recolectar una muestra de diagnóstico adecuada, pero los riesgos de recolectar más de una muestra deben evaluarse en función de la gravedad y la profundidad de la lesión.
PASO 6
Teñir los portaobjetos con una tinción de tipo Romanowsky (p. Ej., Diff-Quik) y una tinción de Gram. Las diapositivas también se pueden enviar a un laboratorio de diagnóstico que esté familiarizado con las enfermedades oftalmológicas veterinarias. Los autores sugieren evaluar al menos una diapositiva interna para iniciar rápidamente la terapia adecuada del paciente.
PASO 7
Evaluar una muestra bajo inmersión en aceite con un microscopio, asegurando la evaluación de múltiples campos de alta potencia.
Fuente Clinician’s Brief
