Agentes infecciosos presentes en especies invasoras de periquito monje (Myiopsitta monachus) y periquito de anillo rosado (Psittacula krameri)

Agentes infecciosos presentes en especies invasoras de periquito monje (Myiopsitta monachus) y periquito de anillo rosado (Psittacula krameri) en los parques de Madrid y Sevilla, España
 Juan López1,2*†
Juan López1,2*†  María Mogedas1†
María Mogedas1†  Carlos Ballesteros2
Carlos Ballesteros2  Bárbara Martín-Maldonado2,3
Bárbara Martín-Maldonado2,3  Irene Sacristán4
Irene Sacristán4  Raúl García2
Raúl García2  Juan Carlos Ortiz5
Juan Carlos Ortiz5  Fernando Esperón3
Fernando Esperón3- 1Facultad de Veterinaria, Universidad Alfonso X El Sabio Avenida de la Universidad 1, Villanueva de la Cañada, Madrid, España
- 2Servicio de Consultoría para la Recuperación y Ordenación de la Fauna y su Ambiente S. L. (SCROFA), Madrid, España
- 3Departamento de Veterinaria, Facultad de Ciencias Biomédicas y de la Salud, Universidad Europea de Madrid, Villaviciosa de Odón, Madrid, España
- 4Centro de Investigación en Sanidad Animal (SIC-INIA), Valdeolmos, España
- 5Departamento de Fauna y Biodiversidad, Área de Gobierno de Medio Ambiente, Ayuntamiento de Madrid, Madrid, España
Introducción: La introducción de especies invasoras en un ecosistema podría resultar en la pérdida de biodiversidad y la propagación de agentes infecciosos que podrían causar enfermedades zoonóticas reemergentes o emergentes. Los periquitos monje (Myiopsitta monachus) y los periquitos de anillo rosado (Psittacula krameri) se consideran especies exóticas invasoras muy extendidas en hábitats urbanos de la Península Ibérica. El objetivo de este estudio fue evaluar la presencia de agentes infecciosos relevantes en periquitos salvajes capturados en parques urbanos de Madrid y Sevilla (España).
Métodos: Se recogieron y analizaron un total de 81 muestras cloacales mediante técnicas moleculares.
Resultados: La prevalencia de agentes infecciosos varió entre las especies de periquitos: el 9,5% de los periquitos monje y el 15% de los periquitos de anillos rosados fueron positivos para E. coli enteropatógena (EPEC), el 13,3% de los periquitos de anillos rosados para el virus de la gripe aviar (AIV), el 3,3% de los periquitos de anillos rosados para el virus de la enfermedad de Newcastle (VEN por el virus) y un 23,8% de los periquitos monje para Chlamydia psittaci.
Discusión: Todos los aislados identificados por C. psittaci se clasificaron como genotipos B, E o E/B, lo que indica la transmisión de palomas urbanas silvestres a periquitos. Estos resultados resaltan la necesidad de monitorear las poblaciones de periquitos debido a las implicaciones para la salud humana y animal.
1. Introducción
La introducción de especies invasoras en un nuevo entorno donde nunca antes habían estado puede tener los mismos efectos negativos en el ecosistema que la introducción de enfermedades exóticas, que pueden conducir a la pérdida de biodiversidad o incluso a la extinción de especies locales (1). En este sentido, se han reportado numerosos problemas en todo el mundo, como la pérdida de poblaciones de anfibios causada por Batrachochytrium dendrobatidis, un hongo transportado por la rana de garras africana (Xenopus laevis) (2), o el declive de la ardilla roja europea (Sciurus vulgaris) en el Reino Unido debido a un poxvirus transmitido por la ardilla gris americana (Sciurus carolinensis) (3). Además, las especies invasoras también pueden conducir a la aparición, o reemergencia, de enfermedades zoonóticas (4). Un ejemplo es el papel del coipo (Myocastor coypus) en la propagación de Leptospira zoonótica (5), o mapaches (Procyon lotor) como huéspedes de Baylisascaris procyonis, que causa enfermedades neurológicas y oculares en humanos (6).
Con respecto a la Clase Aves, se han reportado hasta 971 especies de aves introducidas en 230 países (7). Sin embargo, solo unos pocos estudios confirmaron la introducción de enfermedades por especies de aves exóticas, en su mayoría restringidas a casos esporádicos (8). La más relevante fue la exportación histórica de palomas asilvestradas (Columba livia) de los países mediterráneos. Se ha demostrado que esta especie sinantrópica es portadora de más de 110 patógenos zoonóticos (9); algunos de ellos en altas proporciones, como Campylobacter jejuni y Chlamydia psittaci (10). Otras especies exóticas portadoras de patógenos zoonóticos descritas en la literatura científica son el gorrión común (Passer domesticus), el estornino común (Sturnus vulgaris) y el zorzal común (Turdus philomelos) (8). Por lo tanto, las variables del estado de salud deben incluirse al realizar evaluaciones de riesgo de especies extranjeras para evaluar la introducción de nuevos agentes y los cambios en la epidemiología de los existentes (11).
En España, la población estimada de periquito monje (Myiopsitta monachus) estaba entre 18.980 y 21.455 en 2016 (13), mientras que la población de periquito de anillos rosados (Psittacula krameri) osciló entre 3.005 y 3.115 en 2015 (14). Desde entonces, las poblaciones de ambas especies han aumentado en gran medida. Por ejemplo, en la capital, Madrid, la población de periquitos monje creció de 7.248-8.193 en 2015 a 11.154-12.975 en 2019 (15). Aunque ambas especies son Psittacidae gregarios invasores en todo el mundo, los periquitos monje construyen nidos comunales que pueden ser utilizados por otras especies (13), lo que favorece la difusión, amplificación y propagación de numerosos patógenos, mientras que los periquitos de anillos rosados no lo hacen. En cambio, después de la temporada de apareamiento, los periquitos de anillos rosados se reúnen para posarse alcanzando bandadas de alta densidad que representan el mismo peligro que los nidos comunales. Sin embargo, existe una falta de conocimiento sobre los agentes infecciosos que pueden albergar ambas especies invasoras.
En este contexto, el objetivo de este estudio fue evaluar la presencia de agentes infecciosos zoonóticos y relacionados con la pérdida de biodiversidad en ambas especies, a saber, periquitos monje y periquitos de anillos rosados, procedentes de dos ciudades españolas densamente pobladas
2. Materiales y métodos
2.1. Muestras y áreas de estudio
Debido a la capacidad invasiva de los periquitos monje y los periquitos de anillos rosados, la legislación española incluye un programa de control de especies invasoras en el que la eliminación de nidos y la eutanasia de aves atrapadas de estas especies se consideran clave para reducir las poblaciones (12).
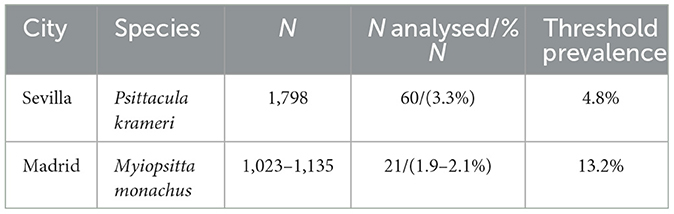
En primer lugar, el tamaño de la población de cada especie en las diferentes áreas de captura se estableció con base en estudios previos (16-19). Luego, las capturas de periquitos monje en Madrid se realizaron entre 2016 y 2017, mientras que las capturas de periquitos de anillos rosados en Sevilla tuvieron lugar entre 2019 y 2020. Las aves fueron atrapadas con señuelos de piso con redes de palmas y trampas para nidos. El tamaño del muestreo (periquitos monje = 21 y periquitos de anillos rosados = 60) fue suficiente para detectar una prevalencia mínima esperada de 13,2% y 4,8% en periquitos monje y periquitos de anillos rosados, respectivamente, para cada patógeno analizado (Tabla 1) (www.winepi.net).
Tabla 1. Aves capturadas (N), número de animales analizados (N analizados) y porcentaje de animales analizados (%N) del Ayuntamiento de Sevilla y Madrid, respectivamente.
Todas las aves capturadas fueron revisadas por un veterinario y muestreadas antes de la eutanasia para obtener el contenido cloacal por enema, según lo descrito por Vázquez (10). En resumen, se introdujo 1 ml de PBS estéril en la cloaca utilizando una pipeta Pasteur estéril e inmediatamente se aspiró. La muestra cloacal se transfirió a un microtubo de 2 ml y se diluyó a un volumen total de 2 ml para realizar análisis adicionales.
Procedimientos de manipulación cumplidos con la legislación europea (Directiva 2010/63/UE) y española (Real Decreto 53/2013). Para la recolección de muestras, no fue necesaria la aprobación ética, ya que las muestras se recolectaron en el marco de una intervención de control de enfermedades veterinarias, y el muestreo se realizó siguiendo las pautas de procedimiento estándar.
2.2. Detección de patógenos
Para cada muestra, la extracción de ARN y ADN se realizó simultáneamente del enema cloacal utilizando un método de filtración a presión (QuickGene DNA Tissue Kit S, Fujifilm Life Science, Tokio, Japón) y agregando un portador de ARN (20).
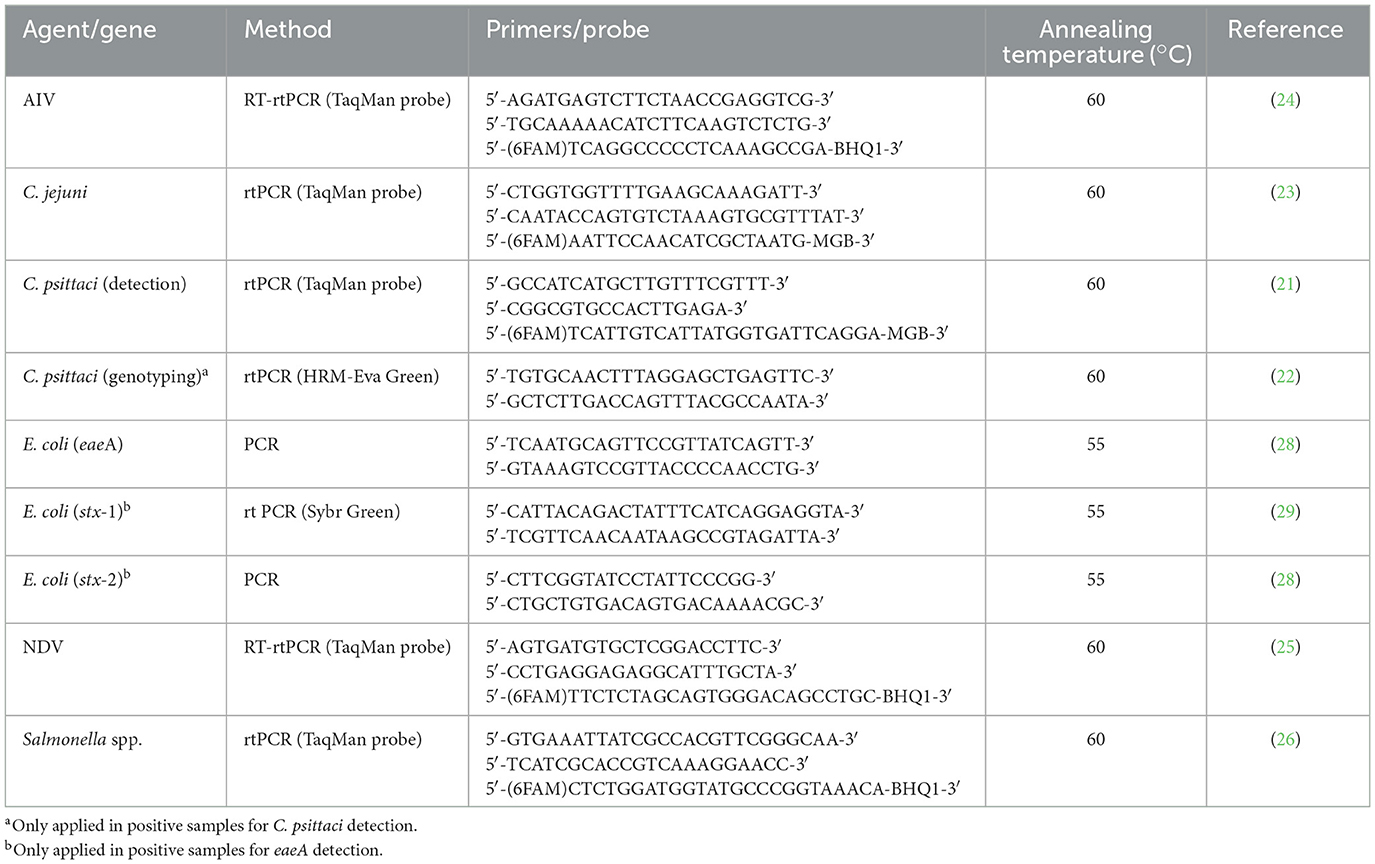
PCR en tiempo real (RT-PCRs) basadas en TaqManTM Se realizaron sondas para la amplificación parcial del gen incA de Chlamydia psittaci (21), el gen mapA de Campylobacter jejuni (23) y el gen Prot6e de Salmonella spp. (26). Las muestras positivas para C. psittaci fueron tipificadas por RT-PCR basado en Eva Green, con análisis de fusión de alta resolución (HRM) (22), que amplifica un fragmento parcial (274 pb) del gen ompA. Se buscó una confirmación positiva mediante la secuenciación de Sanger de los amplicones. Además, transcriptasa inversa en tiempo real (RT-rtPCR) basada en TaqManTM Se realizaron sondas para detectar el gen de la matriz del virus de la influenza aviar (AIV) (24) y el gen de la matriz del virus de la enfermedad de Newcastle (NDV) (25). Finalmente, se detectó E. coli zoonótica siguiendo el protocolo descrito anteriormente para la detección del gen de la intimina (eaeA) (27, 28). Se analizaron muestras positivas para el gen eaeA para evaluar la presencia de stx-1 (29) y stx-2 (28). Si la muestra era positiva para al menos uno de ellos, se consideraba cepa enterotoxigénica (STEC), pero si la muestra era negativa para ambos genes, se consideraba enteropatógena (EPEC) (20, 27). Los cebadores, las sondas y la metodología se resumen en la Tabla 2.
2.3. Análisis estadístico
Se aplicó una prueba no paramétrica (prueba U de Mann-Whitney) para establecer diferencias entre periquitos monje y periquitos de anillos rosados en presencia de cada agente. Las estadísticas se realizaron utilizando una aplicación informática disponible comercialmente (paquete de software SPSS 29.0; SPSS Inc., Chicago, IL, EE.UU., 2002).
3. Resultados
En total, se incluyeron 81 aves en el estudio: 21 periquitos monje y 60 periquitos de anillos rosados. Entre los periquitos monje, 23,8% fueron positivos para C. psittaci (5/21; IC 95% 5,6–42,0%). Los resultados de la secuenciación parcial del gen ompA revelaron que las muestras positivas podrían clasificarse como genotipos B, E o E/B. No se detectaron periquitos de anillos rosados positivos para C. psittaci (p < 0,001). Los AIV y los VEN se detectaron solo en periquitos de anillos rosados: 13,3 % fueron positivos para AIV (8/60: IC 95 % 4,7–21,9 %) y 3,3 % para NDV (2/60; IC 95 %: 0,0–7,9 %). En cuanto a la presencia de E. coli, el 9,5% de los periquitos monje fueron positivos para el gen de la intimina (eaeA) (2/21; IC 95% 0,0–22,1%), mientras que la prevalencia de este gen en periquitos de anillos rosados fue ligeramente mayor (15%; 9/60; IC 95 % 6,0–24 %). Todas las muestras positivas a eaeA se analizaron para detectar los genes stx-1 y stx-2, todos los cuales fueron negativos y, por lo tanto, cepas enteropatógenas (EPEC). Todas las muestras fueron negativas para Campylobacter jejuni y Salmonella spp. (Tabla 3).
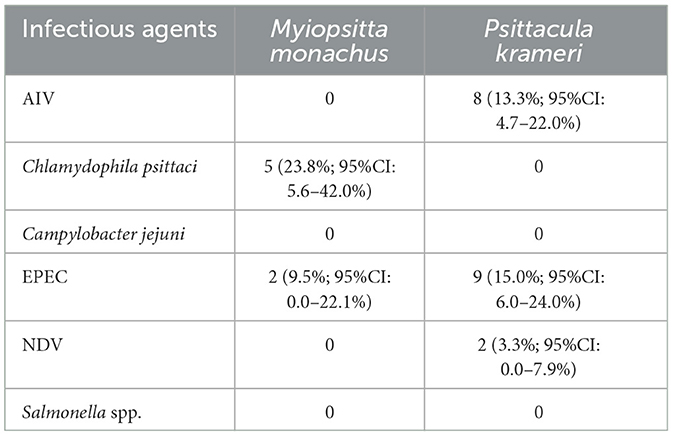 Tabla 3. Resultados tras el análisis en busca de los diferentes agentes infecciosos en ambas especies invasoras (Myiopsitta monachus y Psittacula krameri): número de aves positivas, porcentaje de la población analizada para cada agente y confianza en intervalos al nivel del 95%.
Tabla 3. Resultados tras el análisis en busca de los diferentes agentes infecciosos en ambas especies invasoras (Myiopsitta monachus y Psittacula krameri): número de aves positivas, porcentaje de la población analizada para cada agente y confianza en intervalos al nivel del 95%.
Ninguna de las aves mostró signos clínicos compatibles con esos patógenos, por lo que las aves positivas se consideraron portadoras asintomáticas.
4. Discusión
Hasta donde sabemos, este es el primer estudio de agentes bacterianos y virales potencialmente zoonóticos presentes en Psittacidae invasores que viven en áreas urbanas. Los resultados demuestran que las especies invasoras, a saber, los periquitos monje y los periquitos de anillos rosados, pueden albergar patógenos zoonóticos como Chlamydia psittaci, AIV, NDV o EPEC.
4.1. Discusión sobre patógenos
4.1.1. Chlamydia psittaci
La prevalencia de C. psittaci detectada en periquitos monje estuvo en concordancia con estudios previos con individuos cautivos de la misma especie (30). Sin embargo, aunque los resultados son similares, es importante considerar que las condiciones del hábitat no son las mismas. En contraste con nuestros resultados, C. psittaci también se describió en periquitos de anillos rosados en estudios previos con diferentes tendencias de prevalencia, pero ninguno de esos estudios empleó PCR específica para la detección de C. psittaci (31, 32). Entre los genotipos de Chlamydia descritos para aves, todos los autores están de acuerdo en que el genotipo A es el más prevalente en Psittacidae (33, 34), mientras que los genotipos B, E y E / B son más comunes en palomas (35-37). Hasta donde sabemos, este es el primer genotipado de C. psittaci en periquitos monje en todo el mundo. La presencia de genotipos B, E o E/B en periquitos monje sugiere que las bacterias se han transmitido de palomas a periquitos en la dirección opuesta a la esperada. Las diferentes tendencias de prevalencia entre monje y periquitos de anillos rosados podrían deberse al comportamiento alimentario de cada especie y, por lo tanto, a sus interacciones con otras especies. Mientras que los periquitos monje se alimentan principalmente en el suelo (38), los periquitos de anillos rosados lo hacen en los árboles con mayor frecuencia (39). Alimentarse en el suelo les da a los periquitos monje la oportunidad de interactuar con palomas salvajes y luego compartir patógenos con ellos, principalmente respiratorios. C. psittaci es muy prevalente en palomas de Madrid (10), magnificando la transmisión entre palomas y periquitos monje. Para confirmar esta hipótesis, se podrían intentar varios enfoques. Un enfoque podría ser demostrar la presencia de C. psittaci en palomas de Sevilla. El otro enfoque podría ser genotipar muestras positivas de palomas. En este sentido, resultados inéditos obtenidos por nuestro grupo de investigación confirmaron la presencia de genotipos B, E y B/E en palomas de Madrid, que son los encontrados en el presente estudio, apoyando esta hipótesis. Sin embargo, se requiere un fuerte análisis filogenético, como la secuenciación del gen ompA completo, para demostrar esta posible transmisión.
4.1.2. Virus de la influenza aviar
La información sobre la gripe aviar en periquitos monje y de anillos rosados es escasa. Hasta donde sabemos, el presente estudio es el primero realizado sobre aves urbanas de vida libre. En periquitos monje, solo un estudio evaluó la presencia de AIV por ensayo de hemaglutinación en un periquito monje importado a Austria con un resultado negativo (47). En periquitos de anillos rosados, se notificaron dos aves cautivas positivas para cepas H9N2 durante el diagnóstico virológico de rutina de las aves importadas a Japón (48). Desafortunadamente, en nuestro estudio, los ensayos para la identificación de AIV altamente patógenos (es decir, variantes H5 o H7) no pudieron intentarse debido a la cantidad limitada de muestra.
4.1.3. Virus de la enfermedad de Newcastle
Del mismo modo, la literatura sobre el VEN en periquitos de monje y anillos rosados es antigua, y los estudios se realizaron mediante ensayos de serología; Por lo tanto, las muestras positivas solo confirmaron el contacto de los animales con el virus (49). Otros estudios centrados en Psittacidae mostraron resultados negativos para la detección del VEN (50, 51), con la excepción del estudio de la prevalencia del VEN en la India (52), donde encontraron dos muestras positivas de cuatro Psittaciformes analizadas. Desafortunadamente, no se disponía de datos sobre las especies analizadas. El presente estudio confirma la presencia del VEN en dos periquitos de anillos rosados. Desafortunadamente, la identificación de cepas velogénicas no se pudo intentar debido a la falta de una muestra. Tanto el AIV como el VEN son de declaración obligatoria en avicultura debido a sus graves repercusiones económicas y sanitarias, y las aves silvestres, como las palomas asilvestradas o los patos híbridos (Anas spp.), se consideran reservorios de ambos virus (10).
4.1.4. Escherichia coli
La E. coli diarreica (DEC) es una de las principales causas de diarrea humana, y las aves silvestres se han sugerido como reservorios potenciales para estos patógenos (45). Solo se han publicado unos pocos artículos sobre la detección de DEC en periquitos de monje y anillos rosados. En 1978, Graham y Graham no pudieron encontrar E. coli en las heces de siete periquitos monje cautivos por cultivo bacteriológico (46). Nuestros resultados mostraron que el 9,5% de los periquitos monje y el 15% de los periquitos de anillos rosados fueron positivos para EPEC, pero ninguna de las cepas se clasificó como STEC. Aunque existe una disparidad, es difícilmente comparable debido a la fecha de publicación, la técnica utilizada y el hábitat de las aves. Esto representa la primera descripción de EPEC en esas especies de Psittacine.
4.1.5. Campylobacter jejuni y Salmonella spp.
Finalmente, solo se han realizado pocos estudios sobre la presencia de Campylobacter jejuni y Salmonella spp. en periquitos monje o de anillos rosados (40-44). Nuestros resultados negativos concuerdan con los publicados anteriormente para ambas especies. Sin embargo, un estudio realizado en periquitos de rosa anillada confirmó una positividad del 67% para Campylobacter spp. con detección por PCR (41).
4.2. Debate general
Es importante destacar que el comportamiento gregario de cada especie contribuye a la propagación de patógenos a través de su ecosistema. Además, se ha observado coinfección en dos periquitos de anillos rosados, uno de los cuales es positivo para AIV y EPEC y el otro para AIV y NDV. En conclusión, el presente estudio se centra en patógenos con posibles efectos zoonóticos presentes en dos especies invasoras de Psittacidae y proporciona un enfoque para evaluar su riesgo para la salud en el ecosistema. El aumento de sus poblaciones en zonas verdes urbanas podría representar un peligro tanto para los seres humanos como para la biodiversidad debido a su papel como reservorios de patógenos zoonóticos. En este contexto, nuestros resultados resaltan la necesidad de programas de vigilancia y monitoreo para estas especies.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue revisado y aprobado por la Universidad Alfonso X El Sabio. Aprobación del Comité de Ética Institucional Número de referencia: 2023_3/181.
Contribuciones del autor
JL: diseño experimental y redacción de textos. MM: revisión de estilo y texto. CB: muestreo y revisión de textos. BM-M e IS: análisis de laboratorio de muestras, resultados y estadísticas. RG: muestreo. JO: revisión general. FE: diseño experimental, análisis de laboratorio de muestras, resultados y estadísticas. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este estudio ha sido financiado por los Ayuntamientos de Madrid y Sevilla.
Conflicto de intereses
JL, CB, BM-M y RG son empleados del Servicio de Consultoría para la Recuperación y Ordenación de la Fauna y su Ambiente S.L.
Los autores restantes declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Bellard C, Bernery C, Leclerc C. Extinciones inminentes debido a especies invasoras: pérdida irreversible de estrategia ecológica e historia evolutiva Título de ejecución: Extinciones funcionales y filogenéticas debidas a invasiones biológicas. Glob Chang Biol. (2021) 27:4967–79. doi: 10.1111/gcb.15771
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Stuart SN, Chanson JS, Cox NA, Young BE, Rodrigues ASL, Fischman DL, et al. Estado y tendencias de la disminución y extinción de anfibios en todo el mundo. Ciencia. (2004) 306:1783–6. doi: 10.1126/science.1103538
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Sainsbury AW, Deaville R, Lawson B, Cooley WA, Farelly SSJ, Stack MJ, et al. Enfermedad poxviral en ardillas rojas Sciurus vulgaris en el Reino Unido: tendencias espaciales y temporales de una amenaza emergente. Ecosalud. (2008) 5:305–16. DOI: 10.1007/S10393-008-0191-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Hulme PE. One Biosecurity: Un concepto unificado para integrar la salud humana, animal, vegetal y ambiental. Emerg Top Life Sci Portland Press Ltd. (2020) 4:539–49. doi: 10.1042/ETLS20200067
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Michel V, Ruvoen-Clouet N, Menard A, Sonrier C, Fillonneau C, Rakotovao F, et al. Papel del coipo (Myocastor coypus) en la epidemiología de la leptospirosis en animales domésticos y humanos en origen. Eur J Epidemiol. (2001) 17:111–21. doi: 10.1023/A:1017931607318
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Popiołek M, Szczęsna-Staśkiewicz J, Bartoszewicz M, Okarma H, Smalec B, Zalewski A. Helminth parasites of an introduced invasive carnivore species, the raccoon (Procyon lotor L), from the warta mouth national park (Poland). J Parasitol. (2011) 97:357–60. doi: 10.1645/GE-2525.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Dyer EE, Redding DW, Blackburn TM. El atlas global de invasiones aviares, una base de datos de distribuciones de aves exóticas en todo el mundo. Datos Sci. (2017) 4:170041. doi: 10.1038/sdata.2017.41
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Roy HE, Tricarico E, Hassall R, Johns CA, Roy KA, Scalera R, et al. El papel de las especies exóticas invasoras en la aparición y propagación de zoonosis. Invasiones de Biol. (2022) 25:1249–64. DOI: 10.1007/S10530-022-02978-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Mia MM, Hasan M, Hasnath MR. Global prevalence of zoonotic pathogens from pigeon birds: a systematic review and meta-analysis. Heliyon. (2022) 8:E09732. doi: 10.1016/j.heliyon.2022.e09732
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Vázquez B, Esperón F, Neves E, López J, Ballesteros C, Muñoz MJ. Detección de varios patógenos potenciales en palomas salvajes (Columba livia) en Madrid. Acta Vet Scand. (2010) 52:45. DOI: 10.1186/1751-0147-52-45
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Andersen MC, Adams H, Hope B, Powell M. Risk assessment for invasive species. Riesgo anal. (2004) 24:787–93. doi: 10.1111/j.0272-4332.2004.00478.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Molina B, Postigo JL, Muñoz AR, del Moral JC. La Cotorra Argentina en España, población reproductora en 2015 y método de censo. Disertación. Madrid: ED. SEO/BirdLife (2016).
14. del Moral JC, Somoza A, Muñoz AR, Molina B. La cotorra de Kramer en España, población reproductora en 2015 y método de censo. Disertación. Madrid: ED. SEO/BirdLife (2017).
15. Nebreda A, Escudero E, del Moral JC. Censo de Cotorra Argentina en el municipio de Madrid. Disertación. Madrid: ED. SEO/BirdLife (2019).
16. López R, Ballesteros C, López J. Memoria final sobre el inventariado y evaluación de nidos de Cotorra Argentina (Myopsitta monachus) en el Parque de las Cruces. Disertación. Madrid: ED. SCROFA (2016).
17. López R, Ballesteros C, López J. Memoria final sobre el inventariado y evaluación de nidos de Cotorra Gris Argentina (Myopsitta monachus) en el Parque del Oeste. Disertación. Madrid: ED. SCROFA (2016).
18. López R, Ballesteros C, López J. Memoria final sobre el inventariado y evaluación de nidos de Cotorra Argentina (Myopsitta monachus) en los jardines del Campo del Moro. Disertación. Madrid: ED. SCROFA (2016).
19. López R, Ballesteros C, López J. Informe sobre la estima poblacional de la Cotorra de Kramer (Psittacula krameri) en el Parque de María Luisa (Sevilla)-Dormidero Avenida de Borbolla. Disertación. Sevilla: ED. SCROFA (2019).
20. Sacristán C, Esperón F, Herrera-León S, Iglesias I, Neves E, Nogal V, et al. Genes de virulencia, resistencia a antibióticos e integrones en cepas de Escherichia coli aisladas de aves sinantrópicas de España. Pathol aviar. (2014) 43:172–5. doi: 10.1080/03079457.2014.897683
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Ménard A, Clerc M, Subtil A, Mégraud F, Bébéar C, De Barbeyrac B. Development of a real-time PCR for the detection of Chlamydia psittaci [2]. J Med Microbiol. (2006) 55:471–3. DOI: 10.1099/JMM.0.46335-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Mitchell SL, Wolff BJ, Thacker WL, Ciembor PG, Gregory CR, Everett KDE, et al. Genotipado de Chlamydophila psittaci mediante PCR en tiempo real y análisis de fusión de alta resolución. J Clin Microbiol. (2009) 47:175–81. doi: 10.1128/JCM.01851-08
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Best EL, Powell EJ, Swift C, Grant KA, Frost JA. Aplicabilidad de un ensayo rápido de PCR dúplex en tiempo real para la especiación de Campylobacter jejuni y Campylobacter coli directamente de placas de cultivo. FEMS Microbiol Lett. (2003) 229:237–41. doi: 10.1016/S0378-1097(03)00845-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Spackman E, Senne DA, Myers TJ, Bulaga LL, Garber LP, Perdue ML, et al. Desarrollo de un ensayo de PCR con transcriptasa inversa en tiempo real para el virus de la gripe tipo A y los subtipos de hemaglutinina H5 y H7 aviar. J Clin Microbiol. (2002) 40:3256–60. doi: 10.1128/JCM.40.9.3256-3260.2002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Wise MG, Suarez DL, Seal BS, Pedersen JC, Senne DA, King DJ, et al. Desarrollo de una PCR de transcripción inversa en tiempo real para la detección del ARN del virus de la enfermedad de Newcastle en muestras clínicas. J Clin Microbiol. (2004) 42:329–38. doi: 10.1128/JCM.42.1.329-338.2004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Malorny B, Bunge C, Helmuth R, A. PCR en tiempo real para la detección de Salmonella Enteritidis en carne de ave y huevos de consumo. J Métodos de microbiol. (2007) 70:245–51. doi: 10.1016/j.mimet.2007.04.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Torres-Mejía AM, Blanco-Peña, K, Rodríguez C, Duarte F, Jiménez-Soto M, Esperón F. Zoonotic agents in Silal pigeons (Columba livia) from Costa Rica: possible improvements to dominish contagion risks. Vector Borne Zoonotic Dis. (2018) 18:49–54. DOI: 10.1089/VBZ.2017.2131
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Vidal R, Vidal M, Lagos R, Levine M, Prado V. Multiplex PCR para el diagnóstico de infecciones entéricas asociadas con Escherichia coli diarreicogénica. J Clin Microbiol. (2004) 42:1787–9. doi: 10.1128/JCM.42.4.1787-1789.2004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Chui L, Couturier MR, Chiu T, Wang G, Olson AB, McDonald RR, et al. Comparación de los métodos de detección de Escherichia coli productoras de toxina Shiga utilizando muestras clínicas de heces. J Mol Diagn. (2010) 12:469–75. DOI: 10.2353/jmoldx.2010.090221
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Origlia JA, Cadario ME, Frutos, MC, López NF, Corva S, et al. Detección y caracterización molecular de Chlamydia psittaci y Chlamydia abortus en aves de compañía psittacine en la provincia de Buenos Aires, Argentina. Rev Argent Microbiol. (2019) 51:130–5. doi: 10.1016/j.ram.2018.04.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Pisanu B, Laroucau K, Aaziz R, Vorimore F, Gros A, le Chapuis JL, et al. Detección de Chlamydia avium de un periquito de cuello anillado (Psittacula krameri) en Francia Detección de Chlamydia avium de un periquito de cuello anillado (Psittacula krameri). J Exot Pet Med. (2018) 27:68–74. doi: 10.1053/j.jepm.2018.02.035
32. Chahota R, Katoch RC, Batta MK. Prevalencia de Chlamydia psittaci entre aves salvajes en himachal Pradesh, India. J Appl Anim Res. (1997) 12:89–94. doi: 10.1080/09712119.1997.9706190
33. Sutherland M, Sarker S, Vaz PK, Legione AR, Devlin JM, Macwhirter PL, et al. La vigilancia de enfermedades en cacatuidos victorianos salvajes revela coinfección con múltiples agentes y detección de nuevos virus aviares. Veterinario Microbiol. (2019) 235:257–64. doi: 10.1016/j.vetmic.2019.07.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Vanrompay D, Butaye P, Sayada C, Ducatelle R, Haesebrouck F. Characterization of avian Chlamydia psittaci strains using omp1 restriction mapping and serovar-specific monoclonal antibodies. Res Microbiol. (1997) 148:327–33. doi: 10.1016/S0923-2508(97)81588-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Andersen AA. Serotipado de aislados de Chlamydia psittaci utilizando anticuerpos monoclonales específicos de serovar con la prueba de microinmunofluorescencia. J Clin Microbiol. (1991) 29:707–11. DOI: 10.1128/JCM.29.4.707-711.1991
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Sachse K, Laroucau K, Vanrompay D. Clamidiosis aviar. Curr Clin Microbiol Rep. (2015) 2:10–21. DOI: 10.1007/S40588-014-0010-Y
37. Stokes HS, Berg ML, Bennett ATD, A. Review of chlamydial infections in wild birds. Patógenos. (2021) 10:948. doi: 10.3390/patógenos10080948
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Postigo JL, Carrillo-Ortiz J, Domènech J, Tomàs X, Arroyo L, Senar JC. Plasticidad dietética en una especie invasora e implicaciones para el manejo: el caso del periquito monje en una ciudad mediterránea. Anim Biodivers Conserv. (2021) 44:185–94. doi: 10.32800/abc.2021.44.0185
39. Fraticelli F. La cotorra de anillos rosados Psittacula krameri en un parque urbano: tendencia demográfica, relaciones interespecíficas y preferencias alimentarias (Roma, Italia central). Avocetta. (2014) 38:23–8.
40. De Luca C, Niero G, Cattarossi D, Bedin M, Piccirillo A. Pet and captive birds as potential reservoirs of zoonotic bacteria. J Exot Pet Med. (2018) 27:17–20. doi: 10.1053/j.jepm.2017.10.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Seifi S, Khoshbakht R, Azizpour A, Seifi S. Occurrence of Campylobacter, Salmonella, and Arcobacter in pet birds of northern Iran. J Hellenic Vet Med Soc. (2019) 17:70. DOI: 10.12681/JHVMS.22248
42. Lopes ES, Cardoso WM, Albuquerque ÁH, Teixeira RSC, Salles RPR, Bezerra WGA, et al. Aislamiento de Salmonella spp. en cautiverio Psittaciformes de zoológicos y un establecimiento comercial de Fortaleza, Brasil. Arq Bras Med Vet Zootec. (2014) 66:965–8. doi: 10.1590/1678-41626643
43. Gonzalez GA. Estudio serológico de Chlamidia psittaci y Salmonella sp., Virus Pox Aviar, Adenovirus y virus polioma en aves del orden psittaciforme en cautiverio en Dissertation. Chile: Universidad de Chile (2006).
44. Allgayer MC, Lima-Rosa CA, Weimer TA, Rodenbusch CR, Pereira RA, Streck AF, et al. Diagnóstico molecular de especies de Salmonella en aves psitácidas cautivas. Veterinario Rec. (2008) 162:816–9. doi: 10.1136/vr.162.25.816
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Lopes ES, Maciel WC, Medeiros PHQS, Bona MD, Bindá AH, Lima SVG, et al. Diagnóstico molecular de Escherichia coli diarreica aislada de Psittaciformes de comercio ilegal de vida silvestre. Pesqui Vet Bras. (2018) 38:762–6. DOI: 10.1590/1678-5150-PVB-5083
46. Graham CL, Graham DL. Aparición de Escherichia coli en heces de aves psitácidas. Avian Dis. (1978) 22:717–20. DOI: 10.2307/1589649
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Stunzner D, Thiel W, Potsch F, Sixl W. Isolation of influenza viruses from exotic and central european birds. Zentralbl Bakteriol Mikrobiol Hyg. (1980) 247:8–17. doi: 10.1016/S0172-5599(80)80015-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Mase M, Imada T, Sanada Y, Etoh M, Sanada N, Tsukamoto K, et al. Los periquitos importados albergan virus de influenza A H9N2 que están genéticamente estrechamente relacionados con los transmitidos a los humanos en Hong Kong. J Virol. (2001) 75:3490–4. doi: 10.1128/JVI.75.7.3490-3494.2001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Vijayan V. Role of Parrots in the Epizootiology of Newcastle Disease. Tesis. Mannuthy: Facultad de Ciencias Veterinarias y Animales, Mannuthy (1981).
50. Gilardi KVK, Lowenstine LJ, Gilardi JD, Munn4 CA, A. Survey for selected viral, Chlamydial, and parasitic diseases in wild dusky-headed parakeets (Aratinga weddelii) and tui parakeets (Brotogeris Sanctithomae) in Peru. J Wildl Dis. (1995) 31:523–8. doi: 10.7589/0090-3558-31.4.523
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Johnson DC, Couvillion CE, Pearson JE. Fracaso en demostrar la enfermedad de Newcastle velogénica viscerotrópica en aves psitácidas en la República de Filipinas. Avian Dis. (1986) 30:813–5. DOI: 10.2307/1590590
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Bansal N, Singh R, Chaudhary D, Mahajan NK, Joshi VG, Maan S, et al. Prevalencia del virus de la enfermedad de Newcastle en aves silvestres y migratorias en Haryana, India. Avian Dis. (2022) 66:141–7. doi: 10.1637/aviandiseases-D-21-00115
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Myiopsitta monachus, una salud, Psittacula krameri, PCR en tiempo real, parques urbanos, patógenos zoonóticos, especies invasoras
Cita: López J, Mogedas M, Ballesteros C, Martín-Maldonado B, Sacristán I, García R, Ortiz JC y Esperón F (2023) Agentes infecciosos presentes en especies invasoras de periquito monje (Myiopsitta monachus) y periquito de anillos rosados (Psittacula krameri) en los parques de Madrid y Sevilla, España. Frente. Vet. Sci. 10:1162402. doi: 10.3389/fvets.2023.1162402
Recibido: 09 Febrero 2023; Aprobado: 17 de julio de 2023;
Publicado: 07 agosto 2023.
Editado por:
Marta Canuti, Universidad de Milán, Italia
Revisado por:
Jesús Cardells, Universidad CEU Cardenal Herrera, España Esperanza Gómez-Lucía, Universidad Complutense de Madrid, España
Copyright © 2023 López, Mogedas, Ballesteros, Martín-Maldonado, Sacristán, García, Ortiz y Esperón. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Juan López, juanloro@uax.es
†Estos autores comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía