Alternativas a los antibióticos para el tratamiento de la mastitis en vacas lecheras

Alternativas a los antibióticos para el tratamiento de la mastitis en vacas lecheras
 Xiaoping L1,
Xiaoping L1,  Chuang Xu1,
Chuang Xu1,  Bingchun Liang1,
Bingchun Liang1,  John P. Kastelic2,
John P. Kastelic2,  Bo Han1,
Bo Han1,  Xiaofang Tong1 y
Xiaofang Tong1 y  Jian Gao1*
Jian Gao1*- 1Departamento de Medicina Veterinaria Clínica, Facultad de Medicina Veterinaria, Universidad Agrícola de China, Beijing, China
- 2Facultad de Medicina Veterinaria, Universidad de Calgary, Calgary, AB, Canadá
La mastitis se considera la enfermedad más costosa en las granjas lecheras y también afecta negativamente el bienestar animal. Como el tratamiento (y en menor medida la prevención) de la mastitis dependen en gran medida de los antibióticos, existe una creciente preocupación en la medicina veterinaria y humana con respecto al desarrollo de resistencia a los antimicrobianos. Además, dado que los genes que confieren resistencia son capaces de transferirse a cepas heterólogas, la reducción de la resistencia en cepas de origen animal debería tener un impacto positivo en los seres humanos. Este artículo revisa brevemente las posibles funciones de los medicamentos antiinflamatorios no esteroideos (AINE), las hierbas medicinales, los péptidos antimicrobianos (AMP), los bacteriófagos y sus enzimas líticas, la vacunación y otras terapias emergentes para la prevención y el tratamiento de la mastitis en vacas lecheras. Aunque muchos de estos enfoques actualmente carecen de eficacia terapéutica comprobada, al menos algunos pueden reemplazar gradualmente a los antibióticos, especialmente a medida que las bacterias resistentes a los medicamentos están proliferando a nivel mundial.
1. Introducción
La leche y sus derivados son ricos en nutrientes y un alimento común para personas de todas las edades (1). Además de su contenido de nutrientes, la leche de vacas vacunadas con BCoV tenía anticuerpos BCoV y beber esta leche ayudó a las personas a adquirir anticuerpos heterólogos contra el SARS-CoV-2 y, por lo tanto, desarrollar inmunidad pasiva contra COVID-19 (2). Los anticuerpos de la leche también confirieron protección contra rotavirus, Shigella flexneri, Escherichia coli, Clostridium difficile, Streptococcus mutans, Cryptosporidium parvum y Helicobacter pylori (3, 4).
A pesar del amplio consumo de leche y productos lácteos, la mastitis en las vacas lecheras, típicamente incitada por bacterias (5), plantea muchas preocupaciones sobre la calidad de la leche. La mastitis se puede dividir en 3 etapas: invasión, infección (colonización) e inflamación (6). La mastitis se clasifica como subclínica o clínica, en función de si los signos clínicos están ausentes o presentes. La mastitis subclínica causa algunos cambios en la leche, incluyendo un recuento de glóbulos blancos > 500.000/ml (7), mientras que las vacas con mastitis clínica pueden presentar coágulos de leche, hinchazón de la ubre y síntomas sistémicos en diversos grados (8). La mastitis causada por patógenos infecciosos, incluyendo Staphylococcus aureus, Streptococcus agalactiae y Mycoplasma bovis, es infecciosa (9) (Figura 1), mientras que las infecciones mamarias causadas por patógenos ambientales como E. coli, Klebsiella pneumoniae y estafilococos coagulasa negativos se denominan mastitis ambiental (10, 11).
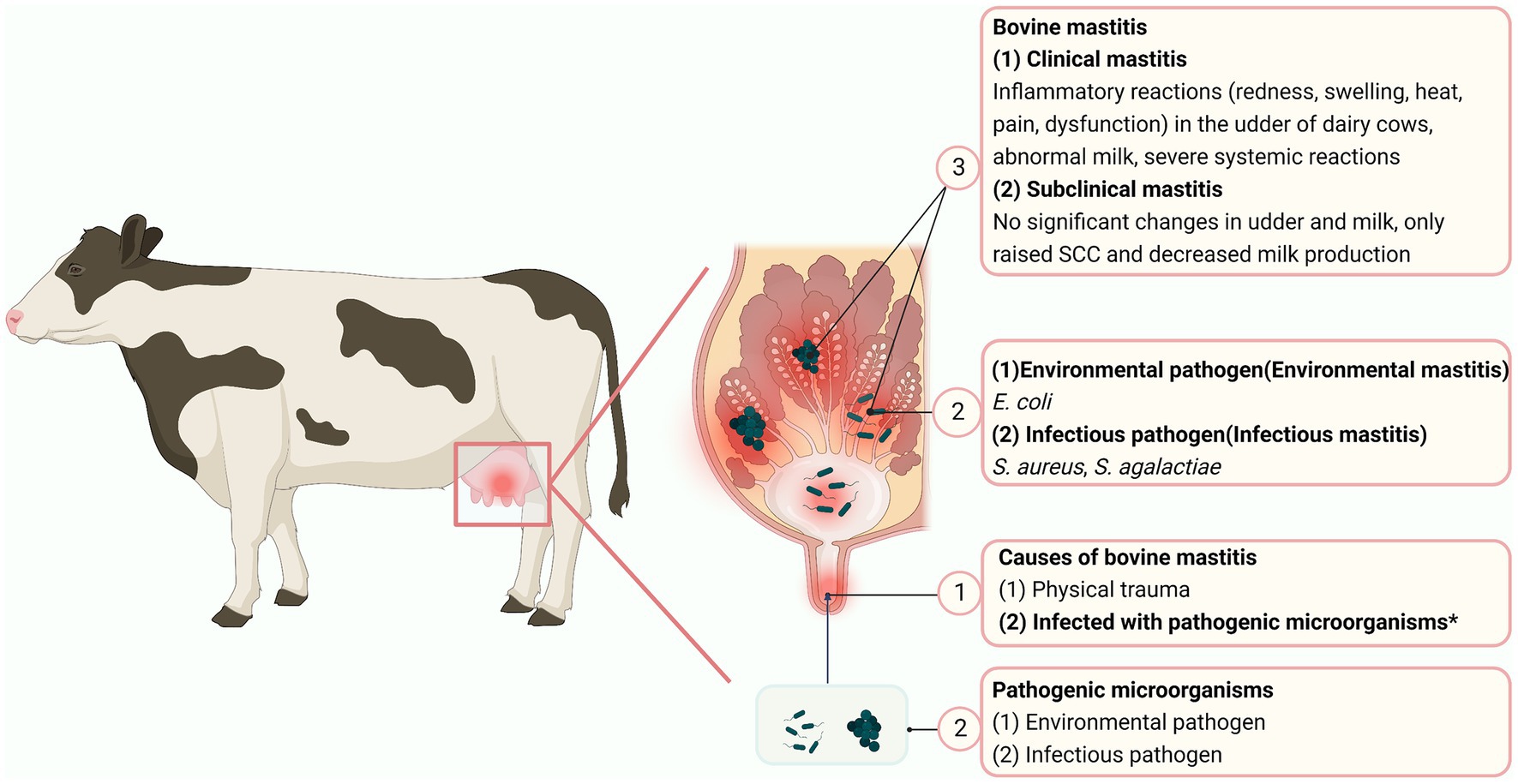 Figura 1. Mastitis en vacas lecheras. Los números marcados en un círculo son para guiar al lector a través de la secuencia de mastitis. «*» representa las principales causas de mastitis en vacas (Creado con BioRender.com).
Figura 1. Mastitis en vacas lecheras. Los números marcados en un círculo son para guiar al lector a través de la secuencia de mastitis. «*» representa las principales causas de mastitis en vacas (Creado con BioRender.com).
El tratamiento actual de la mastitis se basa en antibióticos y es la razón más importante para el uso de antibióticos en vacas lecheras. Sin embargo, la aparición de cepas resistentes a los medicamentos está amenazando la viabilidad de los antibióticos para el tratamiento de la mastitis. La resistencia a los antimicrobianos (RAM) ocurre cuando los patógenos pueden superar los efectos de los antibióticos que originalmente eran efectivos. Se informó que la RAM se detectó por primera vez en la resistencia a la penicilina de Streptococcus pneumoniae, y la tasa de aislamiento de cepas resistentes a los medicamentos aumentó en un 11 por ciento durante la década siguiente (12). Los genes responsables de la resistencia a los medicamentos pueden transferirse entre bacterias de diferentes grupos taxonómicos y ecológicos mediante elementos genéticos móviles como fagos, plásmidos, ADN desnudo o transposones (13). Por lo tanto, las cepas resistentes de origen animal y las cepas resistentes de origen humano pueden interactuar y transferir resistencia.
Con la aparición de señales de cepas resistentes a los medicamentos, está claro que los antibióticos ya no serán completamente efectivos contra la mastitis. Esto se atribuye a décadas de uso de antimicrobianos y mal uso en medicina humana y veterinaria (13). En consecuencia, existe un enfoque global en la búsqueda de alternativas para tratar enfermedades bacterianas. Finlandia redujo sustancialmente el uso de macrólidos, lo que resultó en una disminución de casi el 50% en la resistencia a la eritromicina (14). Esta fue una prueba de concepto de que reducir el uso de antibióticos puede reducir la RAM.
En un estudio realizado en 40 grandes granjas lecheras de los Estados Unidos, el tratamiento antibiótico de vacas secas y los casos clínicos de mastitis representaron > el 75% de todo el uso de antibióticos (15) (Figura 2). En las granjas lecheras, los costos directos del tratamiento de la mastitis incluyen: costos de tratamiento farmacológico, tarifas de servicios veterinarios y el valor de la leche desechada que contiene antibióticos u otros ingredientes (16). Como los antibióticos y los honorarios veterinarios representan el 24% de las pérdidas financieras por mastitis clínica (17-19), reducir el uso de antibióticos podría ahorrar mucho dinero. Combinado con la presencia de cepas resistentes a los medicamentos que prolongan el tratamiento, también hay un impacto potencial en la mortalidad y la morbilidad (13). Además, como la retirada de antibióticos para tratar y prevenir la mastitis bovina presenta desafíos sustanciales para los agricultores, es esencial proporcionar alternativas viables.
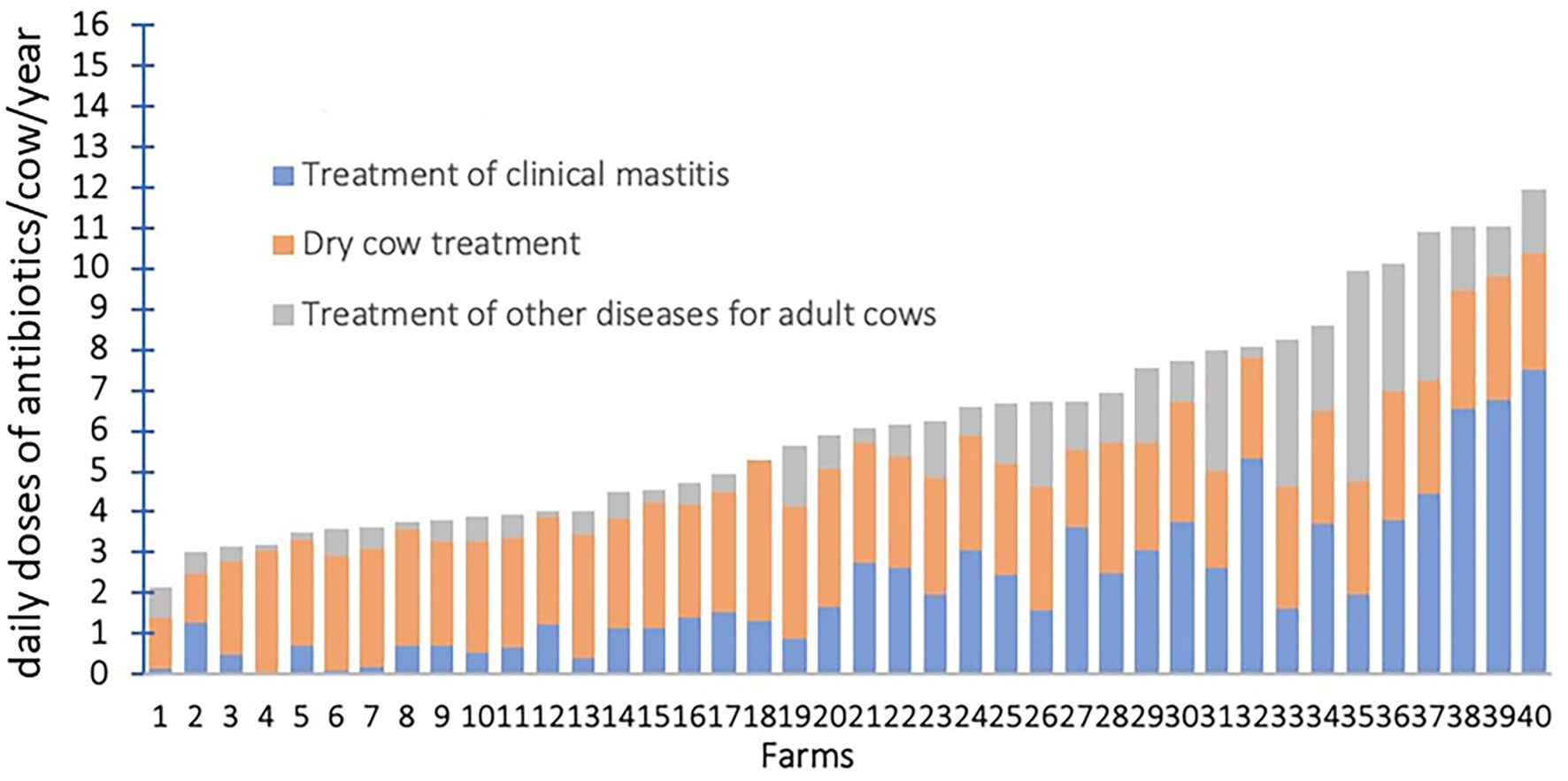 Figura 2. Uso anual de antibióticos en granjas lecheras en los Estados Unidos. Reimpreso de Campos et al. (15) bajo CC-BY-NC-ND.
Figura 2. Uso anual de antibióticos en granjas lecheras en los Estados Unidos. Reimpreso de Campos et al. (15) bajo CC-BY-NC-ND.
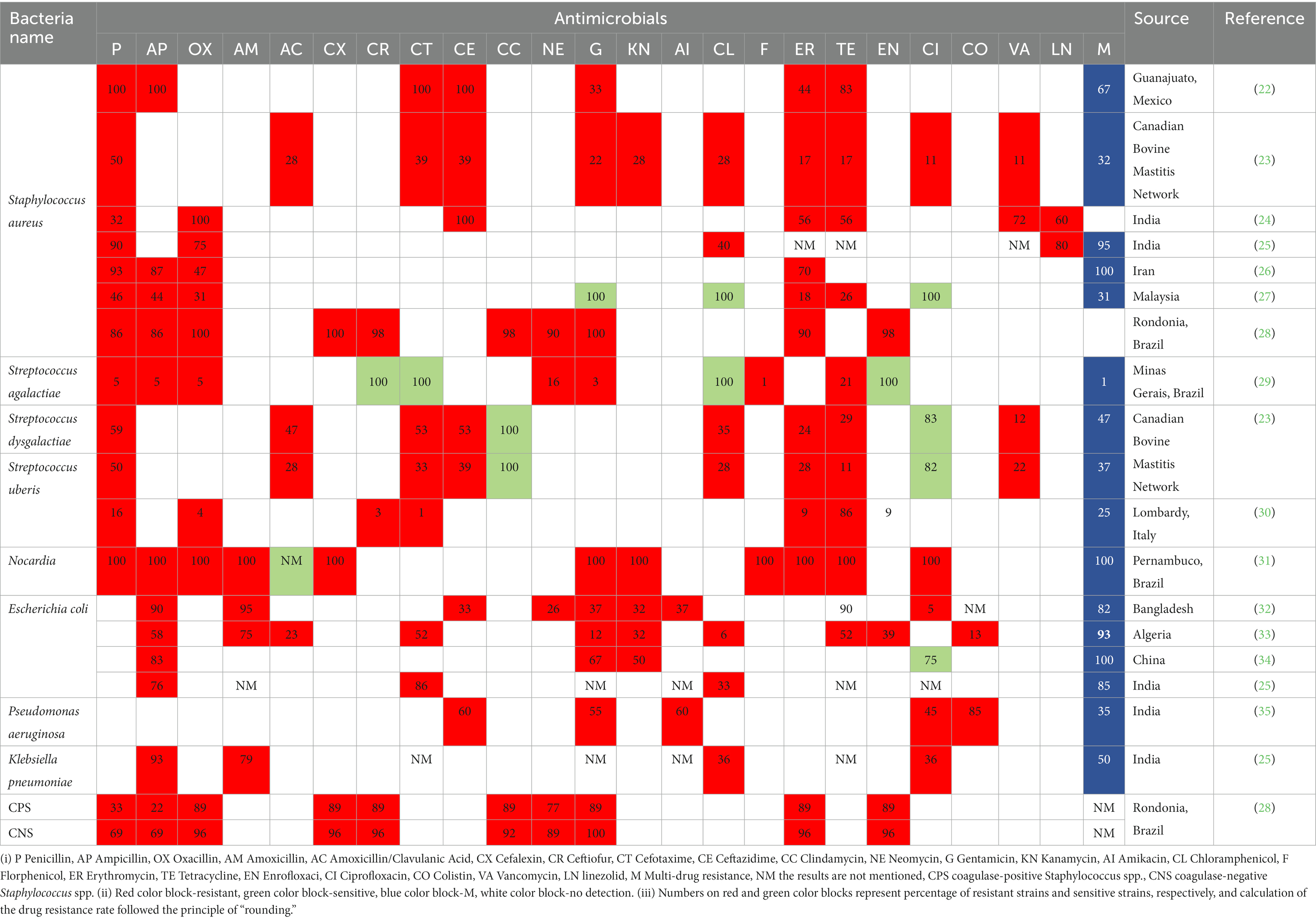
El tratamiento antimicrobiano de la mastitis en vacas lecheras generalmente se considera necesario para mantener un equilibrio entre la economía, el bienestar animal y la salud de la ubre (20). Sin embargo, la aparición de cepas de RAM se está convirtiendo en una de las mayores amenazas para la salud mundial, la seguridad alimentaria y el desarrollo social (21). Muchos patógenos derivados de la mastitis de varios países son resistentes a los antibióticos comunes (Tabla 1). Además, los patógenos comunes de mastitis recolectados por nuestro equipo de investigación (Tabla 2) tuvieron una mayor prevalencia de RAM que los patógenos de mastitis de Europa (5, 36), lo que confirma que la mastitis causada por cepas resistentes a múltiples fármacos es un problema en grandes rebaños lecheros chinos (5).
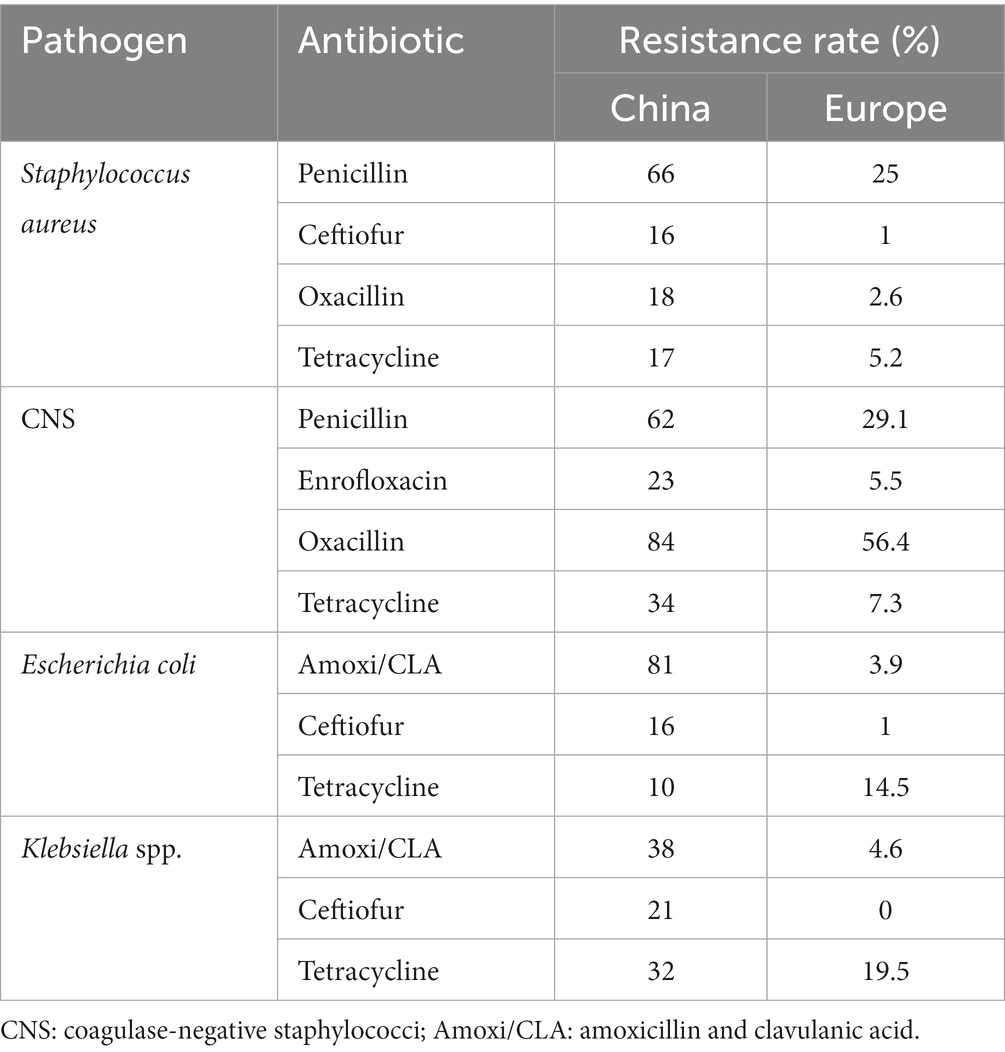 Tabla 2. Comparación de la farmacorresistencia en cepas comunes de resistencia a los antimicrobianos (RAM) de mastitis bovina en China y Europa.
Tabla 2. Comparación de la farmacorresistencia en cepas comunes de resistencia a los antimicrobianos (RAM) de mastitis bovina en China y Europa.
Dada la urgencia de reducir el uso de antibióticos en la industria láctea, revisamos las opciones para el tratamiento y la prevención de la mastitis, con los objetivos de reducir la aparición de cepas resistentes a los antibióticos y minimizar las pérdidas financieras. En este artículo, revisamos los efectos clínicos y las perspectivas de aplicación de los medicamentos antiinflamatorios no esteroideos (AINE), medicamentos herbales, péptidos antimicrobianos (AMP), bacteriófagos (y endolisinas de fagos), vacunación y otras terapias emergentes para el tratamiento de la mastitis bovina. La vacunación, las hierbas medicinales y los AMP pueden prevenir la mastitis al regular el sistema inmunitario. Además, las hierbas medicinales y los AMP también pueden actuar directamente sobre las bacterias para producir efectos terapéuticos. Los fagos (y las endolisinas de fagos) y los AINE son más efectivos en el tratamiento. Cabe mencionar que aunque pueden prevenir y/o tratar la mastitis, la aplicación clínica inmadura hace que sigan siendo una alternativa a la prevención y tratamiento de la mastitis.
2. Terapia con medicamentos antiinflamatorios no esteroideos
No todos los casos de mastitis clínica se benefician de los antibióticos, ya que el 10-40% de los cultivos en casos clínicos de mastitis no tienen crecimiento bacteriano y no requieren terapia con antibióticos, y otro 40% de los cultivos positivos (principalmente bacterias gramnegativas y levaduras) no son sensibles a los antibióticos aprobados para uso intramamario (8). La terapia antibiótica intramamaria generalmente se recomienda solo para infecciones causadas por bacterias grampositivas como S. aureus, S. agalactiae y Streptococci spp. ambientales (37). En contraste, la mayoría de las infecciones Gram-negativas son eliminadas por el propio sistema inmunológico de la vaca (38). Por lo tanto, los antibióticos aprobados para su uso en la ubre de vacas lecheras son efectivos en solo el 20-50% de la mastitis clínica (8).
El mecanismo específico de acción de los AINE es la inhibición de la ciclooxigenasa (COX), reduciendo la producción de prostaglandinas (un mediador inflamatorio) (39). La COX tiene 2 isoformas, COX-1 y COX-2; El primero se expresa naturalmente en todos los tejidos y tiene un papel en el mantenimiento de las funciones fisiológicas normales, mientras que el segundo es inducido por estímulos inflamatorios y citoquinas (40). Los AINE que son inhibidores más selectivos de la COX-2 tienen mayores efectos terapéuticos, mientras que los que son inhibidores altamente selectivos de la COX-1 tienen más efectos secundarios, incluido un mayor riesgo de placenta retenida, inflamación uterina e irritación gástrica (41) (Figura 3).
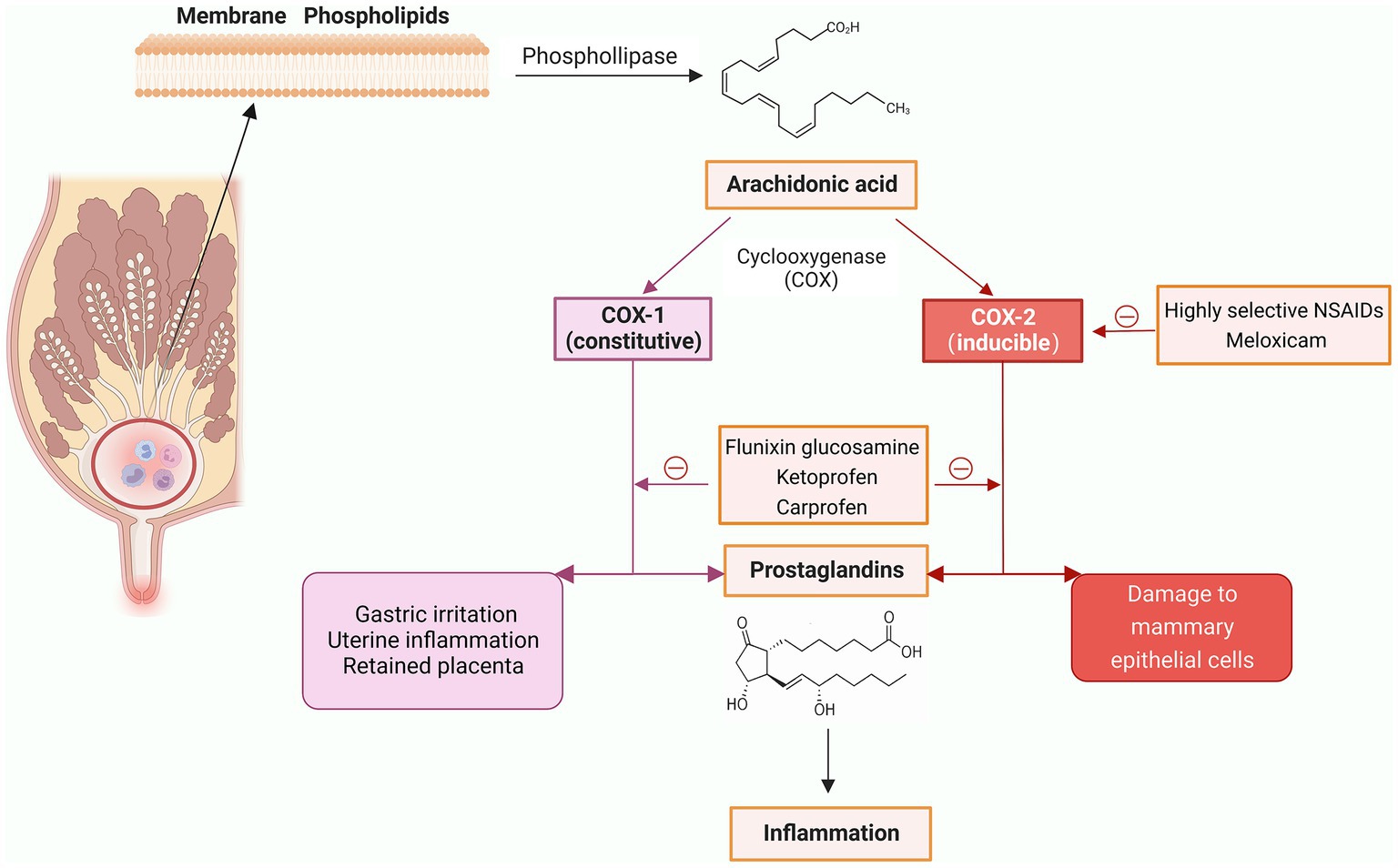 Figura 3. Mecanismos de acción de los fármacos antiinflamatorios no esteroideos (AINE) y los AINE de uso común (creados con BioRender.com).
Figura 3. Mecanismos de acción de los fármacos antiinflamatorios no esteroideos (AINE) y los AINE de uso común (creados con BioRender.com).
Los AINE utilizados para tratar la mastitis bovina incluyen flunixina meglumina, meloxicam, ketoprofeno y carprofeno. La flunixina meglumina, el único AINE aprobado por la FDA en los Estados Unidos para que las vacas lecheras controlen la fiebre asociada con la mastitis y la endotoxemia asociada con la mastitis por E. coli, se usa comúnmente como analgésico en animales destinados a la alimentación de los Estados Unidos (42, 43). Inhibe tanto la COX-1 como la COX-2, pero es más selectiva para la COX-1, lo que aumenta el riesgo de placenta retenida y trastornos digestivos (41). Sin embargo, el uso de una sola dosis de flunixina meglumina puede reducir estos efectos secundarios (44). En vacas con mastitis inducida por lipopolisacáridos, flunixina meglumina aumentó el tiempo de alimentación y rumia durante las primeras 9 y 12 h, y mejoró la actividad ruminal (45, 46). Además, la flunixina meglumina disminuyó las concentraciones de ácidos grasos no esterificados e Isop en sangre en vacas con mastitis por E. coli, lo que indica una respuesta inflamatoria reducida (45).
El meloxicam es un inhibidor más selectivo de la COX-2, evitando en gran medida los efectos secundarios asociados con la inhibición de la COX-1 (47). En un ensayo aleatorizado en 2.653 vacas de 20 rebaños, 1 mg/kg de meloxicam por vía oral en el parto redujo la incidencia de mastitis subclínica, aumentó la ingesta de alimento y la producción de leche, y redujo la inflamación sistémica (48). Además, el meloxicam alivió el dolor de la mastitis clínica inducida por LPS, mitigó el edema de la ubre y redujo la temperatura rectal (49). Cuando el meloxicam se usó para tratar la mastitis leve a moderada en los primeros 120 días de lactancia, se redujo el intervalo de parto de las vacas infectadas y se mejoró la tasa de concepción de las vacas infectadas, lo que tuvo beneficios positivos para la producción lechera basada en pastos (50).
El ketoprofeno inhibe tanto la COX-1 como la COX-2 (51) y se ha utilizado para el tratamiento de la mastitis bovina debido a su rápido inicio de acción, corta vida media plasmática, baja toxicidad y ausencia de extracción de leche. Ha sido aprobado para su uso en Canadá, Brasil y otros países (52). La administración intramamaria de ketoprofeno redujo el SCC y el daño a la barrera sangre-leche, disminuyendo las concentraciones de IgG en la leche durante la mastitis inducida por LPS (53). El ketoprofeno solo tuvo efectos positivos sobre la mastitis crónica (54), aunque los efectos sobre la mastitis aguda fueron menos claros (52, 55).
El carprofeno, al igual que el meloxicam, es un AINE selectivo, de dosis única y de acción prolongada de la COX-2 para tratar la mastitis bovina (42, 56). En vacas con mastitis, el carprofeno redujo la frecuencia cardíaca, la temperatura rectal y la hinchazón de la ubre (57). En vacas con mastitis por E. coli, el carprofeno redujo la temperatura rectal y promovió la motilidad ruminal (58).
Existe un creciente reconocimiento de los AINE para controlar la inflamación, el dolor y la producción de endotoxinas en vacas con mastitis (59). En Dinamarca, el 72% de los veterinarios usan AINE solos para la mastitis, especialmente si son causados por bacterias gramnegativas (60). Algunos AINE sinergizan con antibióticos en el tratamiento de la mastitis, como meloxicam o ketoprofeno más gentamicina (59). Además, algunos AINE (por ejemplo, meloxicam) pueden bloquear los genes de virulencia, prevenir la hemólisis, regular negativamente la expresión de genes relacionados con la formación de biopelículas e inhibir el crecimiento de S. aureus (59). Se dedujo que los AINE tienen potencial para sustituir completamente a los antibióticos en el tratamiento de la mastitis en vacas en ausencia de crecimiento bacteriano o para la mayoría de las infecciones gramnegativas. Además, dado que el principal mecanismo de acción de los AINE contra la mastitis bovina no es bacteriano, las cepas resistentes no deberían afectar a la eficacia.
3. Hierbas medicinales
Las hierbas medicinales se derivan de plantas naturales y tienen una larga historia de valor medicinal, con efectos secundarios limitados o nulos en comparación con los antibióticos. El valor medicinal de las hierbas a menudo se debe a sus metabolitos (por ejemplo, ácidos fenólicos, alcaloides, flavonoides, terpenoides y aceites volátiles) que tienen capacidades antibacterianas, antioxidantes y antiinflamatorias (61).
Muchas hierbas medicinales tienen capacidad antibacteriana. Por ejemplo, el jengibre rojo tuvo buenos efectos bactericidas sobre Staph epidermidis, S. aureus y S. agalactiae derivados de la mastitis bovina (62); El mecanismo bactericida es la curcumina y el gingerol que matan a las bacterias al alterar su membrana extracelular (62). La biopelícula es un factor de virulencia clave para aumentar la resistencia de S. aureus resistente a la meticilina (SARM) derivado de la mastitis; sin embargo, los bigotes de maíz inhibieron significativamente la producción de biopelícula por las cepas de MRSA (63). Los aceites esenciales son metabolitos secundarios de plantas con propiedades antimicrobianas que no estimulan la resistencia a los medicamentos con el uso prolongado (64). Los aceites esenciales (esencial de orégano, esencial de tomillo, esencial de carvacrol y timol) mataron a más de 30 especies de estafilococos (64). Varias otras hierbas medicinales y sus extractos, incluyendo Terminalia Chebula, Purslane y Dandelion también tenían actividad bactericida contra varios patógenos de mastitis (65).
La mastitis ocurre cuando el sistema inmunológico de la glándula mamaria no se defiende contra la invasión bacteriana; Por lo tanto, es muy importante mejorar la actividad inmune para prevenir y tratar la mastitis. El diente de león tiene funciones eliminadoras de radicales libres, antioxidantes, antibacterianas y antiinflamatorias (66) y en un modelo murino de infección de la glándula mamaria con S. aureus, el diente de león redujo la respuesta inflamatoria (67). El tratamiento con Vitexin aumentó la actividad de la enzima T-AOC, SOD, GSH-PX, CAT durante la infección por S. aureus, tanto in vitro como in vivo (68). Baicalin, el componente bioactivo de Scutellaria baicalensis georgi, redujo la expresión de factores inflamatorios y la apoptosis de bMECs en vacas con mastitis inducida por LPS. Baicalein protegió la glándula mamaria, reduciendo el daño inducido por la mastitis (69, 70). El efecto curativo del mangostán sobre la mastitis inducida por LPS se atribuyó a la supresión de la producción de citoquinas inflamatorias, particularmente el inflamasoma NF-κB y NLRP3 (71). La genipósita anpolidatina fue antiinflamatoria al interferir con la expresión de TLR4 y TLR2 y reducir la expresión de TNF-α, IL1β e IL-6 (72, 73).
La inmunidad tiene un papel decisivo en la aparición, desarrollo y eliminación de la mastitis. Las vacas con inmunidad robusta a menudo pueden eliminar las bacterias patógenas durante la invasión de la ubre. Además de su poderosa influencia antibacteriana, los aceites esenciales se pueden usar como una alternativa a los antibióticos para mejorar la eficiencia de la alimentación, el uso de nutrientes y la salud animal (64, 74). La suplementación dietética con aceite de semilla negra, aceite de manzanilla o aceite de origanum de creciana a partir de 8 semanas antes del parto mejoró la inmunidad en vacas lecheras (74). Además, la adición de aceites esenciales a las dietas de las vacas mejoró la producción de leche, la calidad de la leche, la salud de la ubre y la inmunidad (74). Una preparación herbal china que contenía 18 hierbas medicinales, incluyendo Astmgali radix, Platycladi cacumen, Crataegi fructus y Chuanxiong, promovió en gran medida la productividad en vacas de lactancia tardía expuestas al estrés por calor (75).
En resumen, las hierbas medicinales contienen componentes bioactivos de gran valor en la prevención y el tratamiento de la mastitis bovina, con mecanismos de acción similares a los antibióticos, pero sin la presencia de residuos de antibióticos en la leche (76). Sin embargo, algunas bacterias son naturalmente resistentes a los compuestos herbales y otras desarrollan resistencia con el tiempo (77-79). Además, la FDA ha aprobado pocos medicamentos a base de hierbas para uso clínico, principalmente debido a la complejidad de su composición y la dificultad para evaluar con precisión la eficacia y la seguridad (80), aunque al menos algunos de estos problemas pueden abordarse fácilmente.
4. Terapia con péptidos antimicrobianos
Los péptidos antimicrobianos son otro reemplazo prometedor para los antibióticos. La mayoría de las células producen moléculas naturales similares a los antibióticos, conocidas como AMP, componentes clave de la inmunidad innata (81). Su actividad antimicrobiana se atribuye a la carga neta, hidrofobicidad y anfifilicidad (82). A partir de diciembre de 2022, la base de datos de péptidos antimicrobianos (APD, https://aps.unmc.edu/home) continuamente actualizada incluía 3.425 AMP de 6 reinos, 147 péptidos de defensa del huésped humano, 385 bacteriocinas / antibióticos peptídicos aislados / predichos de bacterias, 5 de arqueas, 8 de protozoos, 25 de hongos, 368 de plantas y 2.489 de animales, incluidos algunos péptidos sintéticos.
La nisina, un péptido antimicrobiano natural producido por Lactococcus lactis, tuvo una excelente actividad antimicrobiana contra bacterias grampositivas aisladas de mastitis en vacas lecheras (83). En un ensayo de mastitis bovina, no hubo diferencias entre Nisin y un grupo de antibióticos para las tasas de curación bacteriológica o clínica (84). Un aislado de S. aureus de mastitis que era resistente a una variedad de antibióticos fue fácilmente eliminado por Nisin (84). Para el tratamiento de la mastitis subclínica, Nisin no solo redujo el recuento de células somáticas, sino que también tuvo buenas tasas de curación bacteriológica contra S. agalactiae, S. aureus y estafilococos coagulasa negativos (SNC) (85).
Polybia MP-1, un AMP de 14 aminoácidos del veneno de avispa, fue bactericida contra cepas de S. aureus, E. coli y K. pneumoniae resistentes a múltiples fármacos de mastitis bovina (25, 35). Esculentin 1-21, un AMP de piel de rana, tenía actividad antimicrobiana de amplio espectro (86), particularmente contra Pseudomonas aeruginosa, E. coli y S. agalactiae in vivo e in vitro (87). En un ensayo clínico, Esculentin 1-21 tuvo una tasa de mejoría del 100% después de 5 días sin efectos secundarios (87). Aunque un número creciente de cepas derivadas de mastitis tienen resistencia a múltiples fármacos, los AMP tenían una buena capacidad bactericida contra ellos.
Los AMP secretados en el tejido mamario de las vacas incluyen β-defensinas, psoriasina, catelicidinas y lactoferrina (88). Se han estudiado las funciones bactericidas y terapéuticas de los AMP secretados por la glándula mamaria de las vacas, especialmente las β-defensinas (89). El péptido antimicrobiano traqueal (TAP), una β-defensina catiónica, puede ser producido por bMEC (90). Tanto en modelos de infección in vitro como in vivo, TAP mató eficazmente S. aureus y redujo la apoptosis inducida de bMEC (91). La plectasina, un AMP catiónico con 40 aminoácidos aislados de hongos, tiene baja citotoxicidad (92). MP1102 es similar a la plectasina y tenía una fuerte actividad antibacteriana contra MRSA, incluso dentro de bMEC (66, 93). Recientemente, se produjeron una serie de péptidos antimicrobianos específicos y dirigidos basados en la feromona y péptidos penetrantes de células de S. agalactiae y se designaron péptidos antimicrobianos selectivos de penetración celular L1-L12 (94). L1, L2 y L11 mataron a S. agalactiae por ruptura de la membrana, mientras que L2 y L10 entraron en las células y activaron la endocitosis (94).
Aunque los AMP secretados directamente del tejido mamario tienen homología tisular y alta eficiencia bactericida, los métodos de purificación, la producción y la estabilidad de la preservación in vitro restringen las aplicaciones clínicas (95). Por lo tanto, la investigación futura debe utilizar vectores de expresión eucariota o ingeniería genética para desarrollar nuevos AMP basados en AMP naturales. Las bacterias pueden volverse resistentes a los AMP, y se ha reportado una posible resistencia cruzada entre los AMP y los antibióticos convencionales (23). Las bacterias gramnegativas pueden resistir los efectos de los AMP mediante la remodelación de la superficie, la estructura de la biopelícula, las bombas de flujo, la intercepción (unión y aislamiento de péptidos antimicrobianos para que no puedan actuar sobre la membrana bacteriana), la degradación proteolítica y la modulación de la expresión de péptidos antimicrobianos catiónicos (96).
5. Bacteriófagos
Los bacteriófagos son virus que pueden lisar bacterias; Según su ciclo de vida, se clasifican como líticos o lisogénicos (temperatura) (97). Los fagos líticos generalmente unen una estructura de adsorción a un receptor específico en la superficie de la bacteria, inyectan ADN en la bacteria huésped a través de la estructura de la cola, lisan al huésped y liberan una gran cantidad de fagos (98). A diferencia de los fagos líticos, los fagos lisogénicos ensamblan sus propios genes en el genoma bacteriano del huésped y coexisten sin causar lisis bacteriana del huésped (98) (Figura 4). Debido a su efecto bactericida directo, los fagos líticos son preferidos para el tratamiento de enfermedades infecciosas bacterianas. Por el contrario, los fagos lisogénicos se utilizan generalmente como vectores para transmitir genes que codifican la inhibición de la virulencia bacteriana, para desarrollar pequeñas proteínas moleculares de derivados bacteriófagos simulados para la virulencia bacteriana y para diseñar vacunas (99). Los fagos suelen ser seguros, efectivos, no residuales, altamente específicos y sin efecto sobre bacterias no objetivo, con un gran potencial para reemplazar la terapia antibiótica para la mastitis en vacas. Dos cepas de fagos de S. aureus, SAJK-IND y MSP, se aislaron de la leche de mastitis y aguas residuales ambientales y fueron 100% bactericidas contra 120 cepas de S. aureus (100). En otro estudio, se aislaron 36 cepas de MRSA de leche y piel de pezones de vacas con mastitis subclínica y tenían una susceptibilidad del 100% a los fagos de S. aureus (22). Teng et al. (101) aislaron el fago 4086-1 de S. aureus de la leche de mastitis, que mató eficientemente MRSA en la glándula mamaria murina y tuvo un buen efecto terapéutico. Los fagos de S. aureus ΦSA012 y ΦSA039 tenían amplios espectros líticos (102). In vivo, el fago ΦSA012 eliminó S. aureus de la glándula mamaria murina, suprimiendo la respuesta inflamatoria y el daño tisular (102).
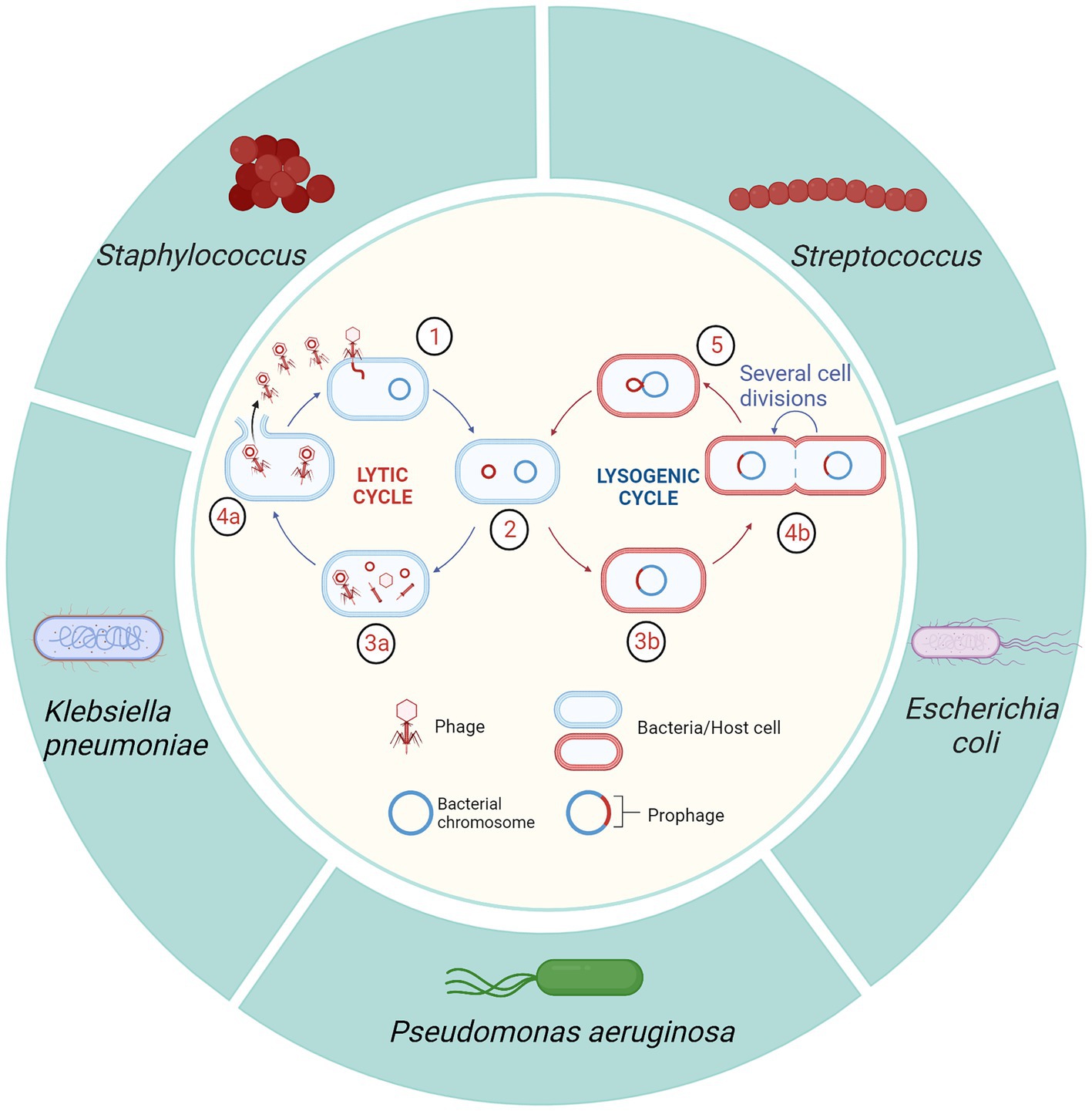 Figura 4. Mecanismo de lisis fágica de bacterias huésped y tipos publicados de mastitis bacterias patógenas dirigidas por fagos. 1. El fago se adhiere a la bacteria huésped e inyecta ADN. 2. El ADN del fago entra en el ciclo lítico o lisogénico. 3a. Síntesis de ADN y proteínas seguida del ensamblaje de nuevos fagos. 4a. Lisis de la bacteria huésped, liberando un gran número de nuevos fagos. 3b. El ADN del fago está integrado en el cromosoma de la bacteria huésped. 4b. Las bacterias lisogénicas tienen una reproducción normal. 5. Bajo condiciones específicas, el profago se aísla del genoma de la bacteria huésped y entra en el ciclo de lisis (creado con BioRender.com).
Figura 4. Mecanismo de lisis fágica de bacterias huésped y tipos publicados de mastitis bacterias patógenas dirigidas por fagos. 1. El fago se adhiere a la bacteria huésped e inyecta ADN. 2. El ADN del fago entra en el ciclo lítico o lisogénico. 3a. Síntesis de ADN y proteínas seguida del ensamblaje de nuevos fagos. 4a. Lisis de la bacteria huésped, liberando un gran número de nuevos fagos. 3b. El ADN del fago está integrado en el cromosoma de la bacteria huésped. 4b. Las bacterias lisogénicas tienen una reproducción normal. 5. Bajo condiciones específicas, el profago se aísla del genoma de la bacteria huésped y entra en el ciclo de lisis (creado con BioRender.com).
Con respecto al uso de fagos para controlar otros patógenos que causan mastitis bovina, Bai et al. (103) aislaron un fago de S. agalactiae JX01, informaron su secuencia genómica completa y determinaron que puede lisar el 65,3% de S. agalactiae bovino sin efecto de muerte en cepas humanas o de peces (es decir, alta especificidad). El fago T4 vB_EcoM-UFV13, un nuevo fago de E. coli con un amplio rango de huéspedes, disminuyó la carga bacteriana en un 90% en las glándulas mamarias murinas y tuvo un resultado positivo en la mastitis inducida por E. coli en vacas lecheras (104). PAJD-1, un fago aislado de muestras de aguas residuales en una granja lechera, lisó el 80% de las cepas de P. aeruginosa (105). El edema y la respuesta hemorrágica de los tejidos mamarios de ratón causada por P. aeruginosa se alivió en gran medida por la acción de PAJD-1 in vivo, similar a los antibióticos (105). Nuestro equipo de investigación aisló 5 cepas de fagos de K. pneumoniae de las muestras de aguas residuales de granjas lecheras y realizó la identificación biológica, la secuenciación del genoma y la investigación terapéutica (106-108). Informamos que los fagos de K. pneumoniae mitigaron la inflamación inducida por K. pneumoniae en bMEC y redujeron el daño estructural y las respuestas inflamatorias del tejido murino de la glándula mamaria (107, 108).
La ley de supervivencia del más apto sugiere que la coexistencia de fagos y bacterias durante millones de años resulta de su coevolución, es decir, el fago no puede eliminar completamente la bacteria huésped porque siempre hay una porción de la bacteria huésped que ha evolucionado en una cepa mutante que no se ve afectada por el fago (109). A pesar de la competencia lítica superior de los fagos en bacterias patógenas, incluso cepas en estado de biopelícula, no hay escasez de mutantes de fagos (110). En ese sentido, se afirmó que E. coli puede desarrollar resistencia a los fagos en un intervalo corto (111). Los experimentos de Pires et al. (112) también observaron el desarrollo de resistencia. Además, después de 24 h de acción fágica, P. aeruginosa desarrolló dos cepas de mutantes insensibles a los bacteriófagos (BIM). La naturaleza coevolutiva de fagos y bacterias, junto con la abundancia y diversidad de fagos en la naturaleza, puede ser una solución crítica para abordar la resistencia bacteriana a los fagos (113). Un método es reemplazar el fago al que las bacterias han desarrollado resistencia, y otro enfoque es usar un cóctel de múltiples fagos con diferentes receptores y huéspedes complementarios (110). Los cócteles de fagos no solo pueden ampliar el alcance de la respuesta, sino también disminuir la aparición de cepas de fagos mutantes (114). Los cócteles de fagos son mezclas de fagos que amplían el rango de huéspedes y minimizan la producción de bacterias resistentes a los fagos (114). Al mezclar 3 cepas de fagos, García et al. (115) demostraron que el poder bactericida del cóctel se mejoró significativamente. En el tratamiento de la mastitis, un cóctel de E. coli que consiste en fagos (SYGD1, SYGE1 y SYGMH1) tuvo una actividad bactericida más potente y un efecto terapéutico clínico más potente que un solo fago (34).
Las endolisinas codificadas por fagos también tienen un gran potencial para la aplicación clínica debido al amplio espectro de liasa, seguridad y estabilidad (116). PlySs2 y PlySs9, 2 bacteriocinas de Streptococcus suis prophage, tuvieron una amplia actividad lítica contra Streptococcus uberis aislado de mastitis bovina (117). LysRODI, codificado por el fago estafilocócico phiIPLA-RODI, tuvo una capacidad de lisis superior contra cepas de Staphylococci de granjas lecheras y disminuyó el daño tisular mamario causado por la infección por Staphylococcus en ratones (118).
En los últimos años, se han realizado más y más modelos animales y ensayos clínicos para evaluar los efectos terapéuticos de los fagos, y algunos productos de fagos han sido aprobados para el tratamiento clínico. Sin embargo, todavía hay muchas dificultades para usar fagos como agentes de primera línea, debido a: (i) la falta de quimiotaxis, evitando que los fagos se dispersen y lleguen a los sitios de infección (102); ii) la administración intravenosa de fagos está limitada por el sistema inmunitario del organismo y se centra en la acción directa en el lugar de la infección, siendo menos accesibles los tejidos profundos y las bacterias intracelulares (119); (iii) los fagos son complejos de nucleoproteínas competentes para la replicación, y su «farmacología», por ejemplo, la dosis, no se comprende bien (120); iv) la seguridad de los productos fagos se ve afectada por muchos elementos, por ejemplo, la pureza y la esterilidad (121); (v) los fagos aún no han alcanzado un estándar de oro para los ensayos de eficacia doble ciego (122); y (vi) las terapias con fagos aún no tienen un marco regulatorio legal específico y solo se han implementado en unos pocos países (121, 123).
6. Vacunación
Las vacunas eficaces pueden reducir la incidencia de mastitis, reduciendo así eficazmente el uso de antibióticos. Se han desarrollado vacunas para algunos patógenos que causan mastitis clínica, por ejemplo, E. coli, S. aureus y Streptococcus spp. Entre ellas, las vacunas basadas en cepas mutantes J5 representan un gran avance en el desarrollo de vacunas contra E. coli (124). En ensayos clínicos, la vacunación contra E. coli J5 redujo la incidencia de mastitis gramnegativa en vacas lecheras, con protección que duró hasta el tercer mes de lactancia (125). En otro estudio, la vacunación J5 no logró reducir la incidencia de mastitis por E. coli, aunque mitigó la gravedad (126). Las vacunas para controlar la mastitis por S. aureus consisten en células enteras (vacunas autólogas) o subunidades (proteínas recombinantes y extractos de superficie bacteriana) (124). Las variantes de colonias pequeñas de S. aureus tienen potencial para el desarrollo de una vacuna viva capaz de prevenir la mastitis en vacas lecheras. Côté-Gravelet et al. (127) desarrollaron un nuevo mutante atenuado eliminando los genes hemB y vraG y demostrando su potencial como vacuna atenuada para mejorar las infecciones de la ubre causadas por S. aureus. Una vacuna experimental basada en la proteína asociada a la superficie de S. aureus fue prometedora, mejorando los títulos de proteínas asociadas al suero y manteniendo la eficacia durante ~ 4 meses (128). Otro estudio utilizó tecnología de proteínas recombinantes para confirmar que los genes asociados con la adquisición de hierro tenían buena inmunogenicidad tanto en conejos como en ganado. Se examinaron 54 cepas de S. aureus para detectar 5 genes relacionados con el sistema de adquisición de hierro: ISD, Feo, Sir, SST y FHU. La proteína IsdH del sistema Isd indujo una respuesta inmune duradera cuando se inoculó en el ganado, lo que implica que IsdH era un buen candidato para una vacuna contra la mastitis por S. aureus (129). Las especies de estreptococos estrechamente asociadas con la mastitis en vacas lecheras son principalmente S. uberis, y también S. agalactiae y Streptococcus dysgalactiae (130, 131). Al utilizar la cepa de S. uberis que formó la mayor biopelícula como fuente de la vacuna, Collado et al. (132) evaluaron una vacunación de subunidades basada en ácido lipofosfatídico (LTA) para S. uberis contra cepas heterocigotas experimentales intralácteas de infección en vacas lecheras. La protección fue incompleta, pero la vacunación redujo significativamente los signos clínicos y aceleró la recuperación de la leche en comparación con el grupo de control (132). Las vacas que recibieron S. uberis vivo por inyección subcutánea tuvieron títulos de anticuerpos séricos más altos y signos clínicos menos graves en comparación con las vacas no vacunadas (133). Sin embargo, esta vacuna fue efectiva contra cepas homólogas pero no heterólogas (133).
Las vacunas tienen mucho potencial para prevenir la mastitis en vacas lecheras. Sin embargo, es evidente que el número de bacterias patógenas que causan mastitis en las vacas supera con creces las bacterias objetivo del desarrollo de vacunas existentes. Además, las vías y mecanismos de infección para estas bacterias patógenas no son uniformes, lo que plantea desafíos para el desarrollo de vacunas efectivas para la mastitis en las vacas. Además, existen numerosas limitaciones, como el momento de la administración y la duración del efecto.
7. Otras terapias
7.1. Probióticos
El hecho de que la flora intestinal pueda inducir mastitis bovina a través de vías endógenas destaca el potencial de usar probióticos para tratar la mastitis en vacas lecheras (134). La alimentación de Bacillus subtilis a novillas y vacas de transición subtilis durante 3 semanas antes del parto y durante toda la lactancia redujo la incidencia de mastitis clínica, SCC y días de leche desechada (135). Además, los lactobacilos, la levadura y las BAL (una mezcla de lactobacilos y maltodextrina) optimizaron la microbiota mamaria y aumentaron la resistencia mamaria de las vacas lecheras (136). Lactobacillus casei, un probiótico que regula el sistema digestivo, puede adherirse e internalizarse en bMEC sin alterar la viabilidad celular y la morfología, pero prohibiendo la infección por S. aureus (137). Además, L. casei activó la inmunidad innata de los bMEC y redujo la susceptibilidad a la infección (138). Una solución comercial post-inmersión que contiene L. casei, L. brucei y L. paracasei se ha utilizado en granjas lecheras y ha reducido la incidencia de mastitis (139).
7.2. Células madre
Las células madre mesenquimales (MSC) son células pluripotentes no especializadas capaces de autorrenovarse y diferenciarse en tipos de células específicas, con potencial para la regeneración tisular. Como son fácilmente accesibles, su competencia terapéutica es de interés (140). Las MSC de médula ósea bovina fetal (BM-MSC) y tejido adiposo (AT-MSC) redujeron el crecimiento de S. aureus in vitro (141). La administración intramamaria de AT-MSC en vacas lecheras mató S. aureus en la ubre sin efectos secundarios (142). Un estudio reciente utilizó MSC de cordones umbilicales y sus vesículas extracelulares para tratar la mastitis subclínica (143). Las MSC pueden tener un papel inmunomodulador al liberar componentes bioactivos y promover la reparación de tejidos dañados en vacas lecheras con mastitis (142, 143).
7.3. Terapia basada en la nanotecnología
La administración de fármacos basada en la nanotecnología permite que los medicamentos se depositen, mantengan y liberen lentamente en los lugares objetivo, superando así algunas limitaciones de los medicamentos convencionales, incluida la resistencia a los antibióticos (144). El nanogel de tilmicosina de autoensamblaje se usó en vacas con mastitis por S. aureus y tuvo una tasa de curación más alta en comparación con un grupo de tratamiento convencional (145). El aceite de canela y las nanopartículas de plata fueron bactericidas contra S. agalactiae (146). Los nanocoloides poliherbales de diente de león, canela, Phyllanthus emblica, Terminalia y citronela tenían una capacidad antibacteriana eficiente y dependiente de la dosis contra patógenos derivados de mastitis (147).
7.4. Terapia fotodinámica
La terapia fotodinámica (TFD) tiene mucho potencial para tratar la mastitis bovina (148). Un fotosensibilizador no tóxico se activa para producir ROS que mata las bacterias al alterar sus membranas celulares y ADN (149). En vacas con mastitis subclínica, la TFD fue bactericida contra S. uberis y coagulasa negativa para S. aureus (SNC) (150). Además, en ovejas con mastitis, la TFD redujo el SNC, Streptococcus spp. y E. coli dentro de las ubres (151). Aunque la TFD tiene muchas promesas para tratar la mastitis, el método aún se encuentra en las etapas iniciales de investigación. Se necesitan mejoras en el fotosensibilizador, las fuentes de luz y el suministro de oxígeno para fortalecer la efectividad de la acción y reducir los efectos secundarios adversos (152).
7.5. Pulsoterapia acústica
La terapia de pulso acústico (APT) es otra estrategia libre de antibióticos para tratar la mastitis bovina. Las vacas con mastitis pueden ser tratadas por dispositivos APT utilizando pulsos acústicos de baja potencia para penetrar el tejido profundo y dispersar las ondas de presión sobre una amplia región de ubres (153). Además, la APT puede activar las células inmunes y reparar el tejido dañado (153). Del mismo modo, la APT fue más efectiva para tratar la mastitis causada por E. coli en comparación con Streptococcus (154), con vacas tratadas con APT que produjeron una adición de 500 L de leche en una lactancia de 305 días (154).
8. Conclusión y perspectivas futuras
Es probable que las granjas lecheras comerciales tengan problemas continuos con la mastitis. En la actualidad, la terapia con antibióticos es la primera línea de tratamiento, pero existe mucha preocupación por la aparición de cepas resistentes a múltiples fármacos en las granjas lecheras y la posibilidad de que esa resistencia se propague a patógenos que afectan a los humanos. Por lo tanto, existe un gran impulso para identificar alternativas para tratar la mastitis en vacas lecheras.
Desde nuestra perspectiva, los AINE, las hierbas medicinales, los AMP, los bacteriófagos y la vacunación tienen mucho potencial para aliviar la difícil situación de la resistencia a los antibióticos. Muchos veterinarios ya usan AINE como terapia adyuvante para la mastitis. Además, algunos médicos están usando AINE solos para tratar la mastitis. Las ventajas de las hierbas medicinales son innegables, pero se necesita mucho esfuerzo para producir productos comercialmente viables. Aunque los AMP también pueden tener efectos positivos, su capacidad para dañar las células eucariotas debe abordarse. Los fagos son bien conocidos por sus efectos selectivos sobre las bacterias objetivo, lo que los convierte en el sucesor más prospectivo de los antibióticos para la mastitis bovina. De hecho, ya han contribuido a salvar muchas vidas en la infección humana. Las vacunas pueden prevenir la mastitis, limitar la gravedad de los signos clínicos y acelerar la cura. Sin embargo, debido a la amplia gama de organismos causantes de mastitis, especialmente patógenos ambientales que se están volviendo dominantes, el control de la mastitis por vacunación enfrenta muchos desafíos. Algunas otras posibilidades también se describieron brevemente en la revisión. Los probióticos pueden funcionar modulando la flora intestinal, con una prueba de concepto del efecto directo de los probióticos sobre la mastitis en vacas lecheras. Aunque en la etapa inicial de investigación, la nanotecnología tiene un gran potencial de aplicación en el tratamiento de la mastitis en combinación con otras sustancias antibacterianas debido a su buena capacidad de transporte de fármacos. PDT y APT están emergiendo como enfoques potenciales en el tratamiento de la mastitis en vacas lecheras, pero se necesita más investigación para que sean prácticos y efectivos.
Contribuciones del autor
XL escribió el manuscrito con el apoyo de CX, BL, JK, BH, XT y JG. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este estudio fue apoyado financieramente por el Proyecto de la Comunidad de Innovación Colaborativa Beijing-Tianjin-Hebei (21346601D) y la Fundación Nacional de Ciencias Naturales de China (32273082 y U21A20262).
Reconocimientos
Agradecemos al profesor Yuxiang Shi de la Universidad de Ingeniería de Hebei por proporcionar el estado actual del uso de antibióticos en muchas granjas lecheras.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Abreviaturas
AMP: péptidos antimicrobianos; RAM: resistencia a los antimicrobianos; APT: terapia de pulso acústico; BIM: mutantes insensibles a los bacteriófagos; bMEC: célula epitelial mamaria bovina; SNC: estafilococos coagulasa negativos; COX: ciclooxigenasa; SARM: S. aureus resistente a la meticilina; MSC, BM-MSC, AT-MSC, células madre mesenquimales o médula ósea bovina fetal, o tejido adiposo; AINE: fármaco antiinflamatorio no esteroideo; TFD: terapia fotodinámica; CCE: recuento de células somáticas.
Referencias
1. Marangoni, F, Pellegrino, L, Verduci, E, Ghiselli, A, Bernabei, R, Calvani, R, et al. Consumo de leche de vaca y salud: una guía para profesionales de la salud. J Am Coll Nutr. (2019) 38:197–208. doi: 10.1080/07315724.2018.1491016
2. Arenas, A, Borge, C, Carbonero, A, Garcia-Bocanegra, I, Cano-Terriza, D, Caballero, J, et al. Leche inmune al coronavirus bovino contra COVID-19. Frente Immunol. (2021) 12:637152. DOI: 10.3389/FIMMU.2021.637152
3. Ebina, T, Ohta, M, Kanamaru, Y, Yamamoto-Osumi, Y, and Baba, K. Passive immunizations of suckling mice and infants with bovine colostrum containing antibodies to human rotavirus. J Med Virol. (1992) 38:117–23. doi: 10.1002/jmv.1890380209
4. Korhonen, HJ, y Marnila, P. 10 – Bovine milk immunoglobulins against microbial human diseases. En: Ingredientes derivados de lácteos. ed. M. Corredig (Sawston: Woodhead Publishing). (2009), 269–89.
5. Cheng, J, Qu, W, Barkema, HW, Nobrega, DB, Gao, J, Liu, G, et al. Perfiles de resistencia antimicrobiana de 5 patógenos comunes de mastitis bovina en grandes rebaños lecheros chinos. J Dairy Sci. (2019) 102:2416–26. DOI: 10.3168/JDS.2018-15135
6. Ruegg, PL. Una revisión de 100 años: detección, manejo y prevención de mastitis. J Dairy Sci. (2017) 100:10381–97. DOI: 10.3168/JDS.2017-13023
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Plastridge, WN. Mastitis bovina: una revisión. J Dairy Sci. (1958) 41:1141–81. DOI: 10.3168/JDS. S0022-0302(58)91071-3
8. Roberson, JR. Establecimiento de protocolos de tratamiento para la mastitis clínica. Veterinario Clin North Am Food Anim Pract. (2003) 19:223–34, viii. doi: 10.1016/s0749-0720(02)00071-3
9. Ashraf, A, and Imran, M. Causes, types, etiological agents, prevalencia, diagnosis, treatment, prevention, effects on human health and future aspects of bovine mastitis. Anim Health Res Rev. (2020) 21:36–49. doi: 10.1017/S1466252319000094
10. Bogni, C, Odierno, L, Raspanti, C, Giraudo, J, Larriestra, A, Reinoso, E, et al. Guerra contra la mastitis: conceptos actuales sobre el control de patógenos de mastitis bovina En: A Me’ndez-Vilas, editor. Ciencia contra patógenos microbianos: Comunicar la investigación actual y los avances tecnológicos. Singapur: World Scientific (2011). 483–94.
11. De Visscher, A, Supré, K, Haesebrouck, F, Zadoks, RN, Piessens, V, Van Coillie, E, et al. Evidencia adicional de la existencia de especies ambientales y asociadas al huésped de estafilococos coagulasa negativos en el ganado lechero. Veterinario Microbiol. (2014) 172:466–74. doi: 10.1016/j.vetmic.2014.06.011
12. Appelbaum, PC. Resistencia a los antimicrobianos en Streptococcus pneumoniae: una visión general. Clin infectar dis. (1992) 15:77–83. doi: 10.1093/clínidos/15.1.77
13. Levy, SB, y Marshall, B. Antibacterial resistance worldwide: causes, challenges and responses. Nat Med. (2004) 10:C122–9. DOI: 10.1038/NM1145
14. Seppälä, H, Klaukka, T, Vuopio-Varkila, J, Muotiala, A, Helenius, H, y Lager, K. El efecto de los cambios en el consumo de antibióticos macrólidos sobre la resistencia a la eritromicina en estreptococos del grupo a en Finlandia. N Engl J Med. (1997) 337:441–6. doi: 10.1056/NEJM199708143370701
15. de Campos, JL, Kates, A, Steinberger, A, Sethi, A, Suen, G, Shutske, J, et al. Cuantificación del uso de antimicrobianos en vacas adultas y terneros predestetados en 40 grandes granjas lecheras de Wisconsin utilizando métricas basadas en dosis y en masa. J Dairy Sci. (2021) 104:4727–45. DOI: 10.3168/JDS.2020-19315
16. Blosser, TH. Pérdidas económicas y el programa nacional de investigación sobre mastitis en los Estados Unidos. J Dairy Sci. (1979) 62:119–27. DOI: 10.3168/JDS. S0022-0302(79)83213-0
17. Cha, E, Bar, D, Hertl, JA, et al. El costo y manejo de diferentes tipos de mastitis clínica en vacas lecheras estimados por programación dinámica. J Dairy Sci. (2011) 94:4476–87. DOI: 10.3168/JDS.2010-4123
18. Huijps, K, Lam, TJ, y Hogeveen, H. Costos de la mastitis: hechos y percepción. J Dairy Res. (2008) 75:113–20. doi: 10.1017/S0022029907002932
19. Rollin, E, Dhuyvetter, KC, y Overton, MW. El costo de la mastitis clínica en los primeros 30 días de lactancia: una herramienta de modelado económico. Prev Vet Med. (2015) 122:257–64. doi: 10.1016/j.prevetmed.2015.11.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Krömker, V, y Leimbach, S. Mastitis treatment— reduction in antibiotic usage in dairy cows. Reprod Dom Anim. (2017) 52:21–9. DOI: 10.1111/RDA.13032
21. Organización Mundial de la Salud. Plan de acción mundial sobre la resistencia a los antimicrobianos. Ginebra: OMS (2015).
22. Varela-Ortiz, DF, Barboza-Corona, JE, González-Marrero, J, León-Galván, MF, Valencia-Posadas, M, Lechuga-Arana, AA, et al. Susceptibilidad antibiótica de Staphylococcus aureus aislado de casos subclínicos de mastitis bovina y eficacia in vitro de bacteriófagos. Vet Res Commun. (2018) 42:243–50. doi: 10.1007/s11259-018-9730-4
23. Bennett, S, Ben Said, L, Lacasse, P, Malouin, F, and Fliss, I. Susceptibility to nisin, bactofencin, pediocin and reuterin of multidrug resistant Staphylococcus aureus, Streptococcus dysgalactiae and Streptococcus uberis causing bovine mastitis. Antibióticos (Basilea). (2021) 10:1418. doi: 10.3390/antibióticos10111418
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Gogoi, P, Shrivastava, S, Shah, P, Saxena, S, Srivastava, S, y Gaur, GK. Las formas lineales y ramificadas de péptido antimicrobiano corto-irk inhiben el crecimiento de aislados de Staphylococcus aureus resistentes a múltiples fármacos de la leche de vaca mastítica. Int J Pept Res Ther. (2021) 27:2149–59. DOI: 10.1007/S10989-021-10243-7
25. Shah, P, Shrivastava, S, Gogoi, P, Saxena, S, Srivastava, S, Singh, RJ, et al. El péptido de veneno de avispa (polybia mp-1) muestra actividad antimicrobiana contra bacterias resistentes a múltiples fármacos aisladas de leche de vaca mastítica. Int J Pept Res Ther. (2022) 28:44. DOI: 10.1007/S10989-021-10355-0
26. Mohammadian, F, Rahmani, HK, Bidarian, B, and Khoramian, B. Isolation and evaluation of the efficacy of bacteriophages against multidrug-resistant (MDR), methicillin-resistant (MRSA) and biofilm-producing strains of Staphylococcus aureus recovered from bovine mastitis. BMC Vet Res. (2022) 18:406. DOI: 10.1186/S12917-022-03501-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Saeed, SI, Mat Yazid, KA, Hashimy, HA, Dzulkifli, SK, Nordin, F, Nik Him, NA, et al. Prevalencia, resistencia a los antimicrobianos y caracterización de Staphylococcus aureus aislado de mastitis bovina subclínica en la costa este de Malasia. Animales (Basilea). (2022) 12:1680. DOI: 10.3390/ANI12131680
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Dias, JA, de Menezes, CA, Brito, MAVP, y Lange, CC, Queiroz RBde. Perfil de resistencia antimicrobiana de Staphylococcus spp. aislados en rebaños de ganado de la Amazonía occidental. Semin Cienc Agrar. (2022) 43: 1355–1364. doi: 10.5433/1679-0359.2022v43n3p1355
29. da Costa, GM, Ribeiro, NA, Gonçalves, MS, da Silva, JR, da Custódio, DA, y Mian, GF. Perfil de susceptibilidad antimicrobiana de cepas de Streptococcus agalactiae aisladas de mastitis bovina. Braz J Vet Res Anim Sci. (2021) 58:E178109. doi: 10.11606/issn.1678-4456.bjvras.2021.178109
30. Monistero, V, Barberio, A, Cremonesi, P, Castiglioni, B, Morandi, S, Lassen, DCK, et al. Genotipado y perfil de susceptibilidad antimicrobiana de Streptococcus uberis aislado de un brote clínico de mastitis bovina en una granja lechera. Antibióticos (Basilea). (2021) 10:644. doi: 10.3390/antibióticos10060644
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Pereira de Oliveira, R, Francelino Dias, RF, Da Silva, RA, Bandeira de Melo, RP, Cabral de Araujo, CAS, Nogueira, JF, et al. Mastitis bovina causada por Nocardia farcinica multirresistente. Acta Sci Vet. (2020) 48:520. doi: 10.22456/1679-9216.101045
32. Bag, MAS, Khan, MSR, Sami, MDH, Begum, F, Islam, MS, Rahman, MM, et al. Determinantes de virulencia y resistencia antimicrobiana de E. coli aislada de mastitis clínica bovina en algunas granjas lecheras seleccionadas de Bangladesh. Saudí. J Biol Sci. (2021) 28:6317–23. doi: 10.1016/j.sjbs.2021.06.099
33. Ghallache, L, Mohamed-Cherif, A, China, B, Mebkhout, F, Boilattabi, N, Bouchemal, A, et al. Perfil de resistencia a antibióticos de Escherichia coli aislada de mastitis subclínica bovina de granjas lecheras en Argelia de 2017 a 2019. Veterinario del mundo J. (2021) 11:402–15. doi: 10.54203/scil.2021.wvj52
34. Guo, M, Gao, Y, Xue, Y, Liu, Y, Zeng, X, Cheng, Y, et al. Los cócteles de bacteriófagos protegen a las vacas lecheras contra la mastitis causada por la infección por Escherichia coli resistente a los medicamentos. Las células frontales infectan microbiol. (2021) 11:690377. DOI: 10.3389/fcimb.2021.690377
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Shah, P, Shrivastava, S, Singh, RJ, Gogoi, P, Saxena, S, Srivastava, S, et al. El péptido antimicrobiano sintético polybia mp-1 (mastoparan) inhibe el crecimiento de aislados de Pseudomonas aeruginosa resistentes a los antibióticos de la leche de vaca mastítica. Int J Pept Res Ther. (2021) 27:2471–86. DOI: 10.1007/S10989-021-10266-0
36. de Jong, A, Garch, FE, Simjee, S, Moyaert, H, Rose, M, Youala, M, et al. Monitorización de la susceptibilidad antimicrobiana de patógenos de ubres recuperados de casos de mastitis clínica en vacas lecheras en toda Europa: resultados de la trayectoria veterinaria. Veterinario Microbiol. (2018) 213:73–81. doi: 10.1016/j.vetmic.2017.11.021
37. Lago, A, Godden, SM, Bey, R, Ruegg, PL, y Leslie, K. El tratamiento selectivo de la mastitis clínica basado en los resultados del cultivo en granja: I. efectos sobre el uso de antibióticos, el tiempo de retención de la leche y los resultados clínicos y bacteriológicos a corto plazo. J Dairy Sci. (2011) 94:4441–56. DOI: 10.3168/JDS.2010-4046
38. Pyörälä, S, Kaartinen, L, Käck, H, and Rainio, V. Efficacy of two therapy regimens for treatment of experimentalally induced Escherichia coli mastitis in cows. J Dairy Sci. (1994) 77:453–61. DOI: 10.3168/JDS. S0022-0302(94)76973-3
39. Ricciotti, E, y Fitz Gerald, GA. Prostaglandinas e inflamación. Arterioscler Thromb Vasc Biol. (2011) 31:986–1000. doi: 10.1161/ATVBAHA.110.207449
40. Vane, JR. Introducción: mecanismo de acción de los AINE. H. J Reumatol. (1996) 35:1–3. doi: 10.1093/reumatología/35.suppl_1.1
41. Trimboli, F, Ragusa, M, Piras, C, Lopreiato, V, and Britti, D. Outcomes from experimental testing of nonsteroidal anti-inflammatory drug (NSAID) administration during the transition period of dairy cows. Animales (Basilea). (2020) 10:1832. DOI: 10.3390/ANI10101832
42. Smith, GW, Davis, JL, Tell, LA, Webb, AI, y Riviere, JE. Uso extraetiqueta de medicamentos antiinflamatorios no esteroideos en el ganado. J Am Vet Med Assoc. (2008) 232:697–701. doi: 10.2460/javma.232.5.697
43. Wagner, BK, Nixon, E, Robles, I, Baynes, RE, Coetzee, JF, y Pairis-Garcia, MD. Antiinflamatorios no esteroideos: farmacocinética y mitigación del dolor procesal en bovinos. Animales (Basilea). (2021) 11:282. doi: 10.3390/ani11020282
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Giammarco, M, Fusaro, I, Vignola, G, Manetta, AC, Gramenzi, A, Fustini, M, et al. Efectos de una sola inyección de flunixina meglumina o carprofeno posparto sobre parámetros hematológicos, rendimiento productivo y fertilidad del ganado lechero. Anim Prod Sci. (2018) 58:322–31. DOI: 10.1071/AN16028
45. Walker, CCF, Brester, JL, y Sordillo, LM. La flunixina meglumina reduce las concentraciones de isoprostano de la leche en el ganado lechero Holstein que sufre de mastitis coliforme aguda. Antioxidantes (Basilea). (2021) 10:834. DOI: 10.3390/antiox10060834
46. Yeiser, EE, Leslie, KE, McGilliard, ML, y Petersson-Wolfe, CS. Los efectos de la mastitis por Escherichia coli inducida experimentalmente y la administración de flunixina meglumina sobre las medidas de actividad, la ingesta de alimento y los parámetros de la leche. J Dairy Sci. (2012) 95:4939–49. DOI: 10.3168/JDS.2011-5064
47. Newby, NC, Renaud, D, Tremblay, R, y Duffield, TF. Evaluación de los efectos del tratamiento de vacas lecheras con meloxicam en el parto sobre el riesgo de membranas fetales retenidas. Can Vet J. (2014) 55:1196–9.
48. Shock, DA, Renaud, DL, Roche, SM, Poliquin, R, Thomson, R, y Olson, ME. Evaluación del impacto de la suspensión oral de meloxicam administrada en el parto en la producción posterior, la salud y el sacrificio en vacas lecheras: un ensayo clínico aleatorizado de campo. PLoS One. (2018) 13:E0209236. doi: 10.1371/journal.pone.0209236
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Fitzpatrick, CE, Chapinal, N, Petersson-Wolfe, CS, DeVries, TJ, Kelton, DF, Duffield, TF, et al. El efecto del meloxicam sobre la sensibilidad al dolor, el tiempo de rumia y los signos clínicos en vacas lecheras con mastitis clínica inducida por endotoxinas. J Dairy Sci. (2013) 96:2847–56. DOI: 10.3168/JDS.2012-5855
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. van Soest, FJS, Abbeloos, E, McDougall, S, and Hogeveen, H. Addition of meloxicam to the treatment of bovine clinical mastitis gives in a net economic benefit to the dairy farmer. J Dairy Sci. (2018) 101:3387–97. DOI: 10.3168/JDS.2017-12869
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Breen, J. La importancia de los fármacos antiinflamatorios no esteroideos (AINE) en la terapéutica de la mastitis. Ganadería. (2017) 22:182–5. doi: 10.12968/live.2017.22.4.182
52. Latosinski, GS, Amzalak, MJ, y Pantoja, JCF. Eficacia del ketoprofeno para el tratamiento de casos leves espontáneos, negativos para el cultivo de mastitis clínica: un ensayo aleatorizado y controlado de superioridad. J Dairy Sci. (2020) 103:2624–35. DOI: 10.3168/JDS.2019-17504
53. Dan, D, Bruckmaier, RM, y Wellnitz, O. El ketoprofeno afecta la respuesta inmune mamaria en vacas lecheras in vivo e in vitro. J Dairy Sci. (2018) 101:11321–9. DOI: 10.3168/JDS.2018-15034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Zecconi, A, Frosi, S, Cipolla, M, and Gusmara, C. Effects of chronic mastitis and its treatment with ketoprofen on the milk ejection curve. J Dairy Res. (2018) 85:50–2. doi: 10.1017/S0022029917000863
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Shpigel, NY, Chen, R, Winkler, M, Saran, A, Ziv, G, and Longo, F. Anti-inflammatory ketoprofen in the treatment of field cases of bovine mastitis. Res Vet Sci. (1994) 56:62–8. DOI: 10.1016/0034-5288(94)90197-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Suojala, L, Kaartinen, L, and Pyörälä, S. Treatment for bovine Escherichia coli mastitis—an evidence-based approach. J Vet Pharmacol Ther. (2013) 36:521–31. DOI: 10.1111/JVP.12057
57. Lohuis, JA, van Werven, T, Brand, A, van Miert, AS, Rohde, E, Ludwig, B, et al. Farmacodinamia y farmacocinética del carprofeno, un fármaco antiinflamatorio no esteroideo, en vacas y vacas sanas con mastitis inducida por endotoxinas de Escherichia coli. J Vet Pharmacol Ther. (1991) 14:219–29. doi: 10.1111/j.1365-2885.1991.tb00830.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Vangroenweghe, F, Duchateau, L, Boutet, P, Lekeux, P, Rainard, P, Paape, MJ, et al. Efecto del tratamiento con carprofeno después de la mastitis por Escherichia coli inducida experimentalmente en vacas primíparas. J Dairy Sci. (2005) 88:2361–76. DOI: 10.3168/JDS. S0022-0302(05)72914-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Muzammil, I, Ijaz, M, Saleem, MH, y Ali, MM. Drug reforposing strategy: an emerging approach to identify potential therapeutics for treatment of bovine mastitis. Microb Pathog. (2022) 171:105691. doi: 10.1016/j.micpath.2022.105691
60. Wilm, J, Svennesen, L, Østergaard Eriksen, E, Halasa, T, y Krömker, V. Veterinary treatment approach and antibiotic usage for clinical mastitis in Danish dairy herds. Antibióticos (Basilea). (2021) 10:189. doi: 10.3390/antibióticos10020189
61. Lopes, TS, Fontoura, PS, Oliveira, A, Rizzo, FA, Silveira, S y Streck, AF. Uso de extractos de plantas y aceites esenciales en el control de la mastitis bovina. Res Vet Sci. (2020) 131:186–93. doi: 10.1016/j.rvsc.2020.04.025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Poeloengan, M. El efecto del extracto de jengibre rojo (zingiber officinale roscoe) en el crecimiento de mastitis que causa aislados bacterianos. Afr J Microbiol Res. (2011) 5:382–8. doi: 10.5897/AJMR10.776
63. Shang, F, Li, L, Yu, L, Ni, J, Chen, X, and Xue, T. Effects of stigmata maydis on the methicillin resistant Staphylococus aureus biofilm formation. Par J. (2019) 7:e6461. doi: 10.7717/peerj.6461
64. Dal Pozzo, M, Santurio, DF, Rossatto, L, Vargas, AC, Alves, SH, Loreto, ES, et al. Actividad de los aceites esenciales de especias contra Staphylococcus spp. aislados de mastitis bovina. Arq Bras Med Vet Zootec. (2011) 63:1229–32. doi: 10.1590/S0102-09352011000500026
65. Kher, MN, Sheth, NR, y Bhatt, VD. Evaluación antibacteriana in vitro de Terminalia chebula como alternativa de antibióticos contra mastitis subclínica bovina. Anim Biotechnol. (2019) 30:151–8. doi: 10.1080/10495398.2018.1451752
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Li, XH, He, XR, Zhou, YY, Zhao, HY, Zheng, WX, Jiang, ST, et al. El extracto de Taraxacum mongolicum indujo estrés del retículo endoplásmico asociado a la apoptosis en células de cáncer de mama triple negativo. J Etnofarmacol. (2017) 206:55–64. doi: 10.1016/j.jep.2017.04.025
67. Ge, BJ, Zhao, P, Li, HT, Sang, R, Wang, M, Zhou, HY, et al. Taraxacum mongolicum protege contra la mastitis infectada por Staphylococcus aureus ejerciendo un papel antiinflamatorio a través de las vías TLR2-NF-κB/MAPKs en ratones. J Etnofarmacol. (2021) 268:113595. doi: 10.1016/j.jep.2020.113595
68. Chen, Y, Yang, J, Huang, Z, Yin, B, Umar, T, Yang, C, et al. Vitexin mitiga la mastitis inducida por Staphylococcus aureus a través de la regulación de la vía ROS/ER stress/NF-κB/MAPK. Oxidativo Med Cell Longev. (2022) 2022:7977433. DOI: 10.1155/2022/7977433
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. He, X, Wei, Z, Zhou, E, Chen, L, Kou, J, Wang, J, et al. Baicalein atenúa las respuestas inflamatorias al suprimir las vías de señalización NF-κB y MAPK mediadas por TLR4 en mastitis inducida por LPS en ratones. Int Immunopharmacol. (2015) 28:470–6. doi: 10.1016/j.intimp.2015.07.012
70. Yang, W, Li, H, Cong, X, Wang, X, Jiang, Z, Zhang, Q, et al. Baicalin atenúa la inflamación inducida por lipopolisacáridos y la apoptosis de las células epiteliales mamarias de vaca mediante la regulación de NF-κB y HSP72. Int Immunopharmacol. (2016) 40:139–45. doi: 10.1016/j.intimp.2016.08.032
71. Qu, S, Wang, W, Li, D, Li, S, Zhang, L, Fu, Y, et al. La mangiferina inhibe la mastitis inducida por LPS a través de la supresión de las vías de señalización NF-ĸB y NLRP3. Int Immunopharmacol. (2017) 43:85–90. doi: 10.1016/j.intimp.2016.11.036
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Jiang, KF, Zhao, G, Deng, GZ, Wu, HC, Yin, NN, Chen, XY, et al. La polidatina mejora la mastitis inducida por Staphylococcus aureus en ratones a través de la inhibición de la activación mediada por TLR2 de la vía p 38 MAPK / NF-κB. Acta Pharmacol Sin. (2017) 38:211–22. doi: 10.1038/aps.2016.123
73. Song, X, Zhang, W, Wang, T, Jiang, H, Zhang, Z, Fu, Y, et al. La genipósita desempeña un papel antiinflamatorio a través de la regulación de TLR4 y las vías de señalización aguas abajo en la mastitis inducida por lipopolisacáridos en ratones. Inflamación. (2014) 37:1588–98. DOI: 10.1007/S10753-014-9885-2
74. Salem, A, El-Awady, H, Tagel-Dein, M, y Eisa, D. Effect of supplementation of aromatic plants oils on immunity, ubre health and milk production of friesian cows. SVR [Internet]. (2019):56. doi: 10.26873/SVR-790-2019
75. Zhao, S, Shan, C, Wu, Z, Feng, M, Song, L, Wang, Y, et al. Fermented Chinese herbal preparation: impacts on milk production, nutrient digestibility, blood biochemistry, and antioxidant capacity of late-lactation cows under heat stress. Anim Feed Sci Technol. (2022) 292:115448. doi: 10.1016/j.anifeedsci.2022.115448
76. Yin, B, Li, W, Qin, H, Yun, J y Sun, X. El uso de escutelaria china (Scutellaria baicalensis) y sus extractos para la producción animal sostenible. Animales (Basilea). (2021) 11:1039. doi: 10.3390/ani11041039
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Khan, R, Islam, B, Akram, M, Shakil, S, Ahmad, A, Ali, SM, et al. Actividad antimicrobiana de cinco extractos herbales contra cepas multirresistentes (MDR) de bacterias y hongos de origen clínico. Moléculas. (2009) 14:586–97. doi: 10.3390/moléculas14020586
78. Singh, BR, Singh, V, Singh, RK, et al. Actividad antimicrobiana del aceite de hierba de limón (Cymbopogon citratus) contra microbios de origen ambiental, clínico y alimentario. Int Res J Pharm Pharmacol. (2011) 1:228–36.
79. Vadhana, P, Singh, BR, Bharadwaj, M, et al. Aparición de resistencia a los medicamentos antimicrobianos a base de hierbas en aislados bacterianos clínicos. Pharm Anal Acta. (2015) 6:434. doi: 10.4172/2153-2435.1000434
80. You, L, Liang, K, An, R, y Wang, X. El camino hacia la aprobación de la FDA: un viaje desafiante para la medicina tradicional china. Farmacol Res. (2022) 182:106314. doi: 10.1016/j.phrs.2022.106314
81. Zhang, LJ, y Gallo, RL. Péptidos antimicrobianos. Curr Biol. (2016) 26:14–9. doi: 10.1016/j.cub.2015.11.017
82. Tan, P, Fu, H, and Ma, X. Design, optimization, and nanotechnology of antimicrobial peptides: from exploration to applications. Nano hoy. (2021) 39:101229. doi: 10.1016/j.nantod.2021.101229
83. Sears, PM, Smith, BS, Stewart, WK, Gonzalez, RN, Rubino, SD, Gusik, SA, et al. Evaluación de una formulación germicida a base de nisina en piel de pezones de vacas vivas. J Dairy Sci. (1992) 75:3185–90. DOI: 10.3168/JDS. S0022-0302(92)78083-7
84. Cao, LT, Wu, JQ, Xie, F, Hu, SH, and Mo, Y. Efficacy of nisin in treatment of clinical mastitis in lactating dairy cows. J Dairy Sci. (2007) 90:3980–5. DOI: 10.3168/JDS.2007-0153
85. Wu, J, Hu, S, and Cao, L. Therapeutic effect of nisin Z on subclinical mastitis in lactating cows. Agentes antimicrobianos Chemother. (2007) 51:3131–5. doi: 10.1128/AAC.00629-07
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Simmaco, M, Mignogna, G, Barra, D, and Bossa, F. Antimicrobial peptides from skin secretions of Rana esculenta. Clonación molecular de ADNc que codifican esculentina y brevininas y aislamiento de nuevos péptidos activos. J Biol Chem. (1994) 269:11956–61. doi: 10.1016/S0021-9258(17)32666-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
87. Islas-Rodrìguez, AE, Marcellini, L, Orioni, B, Barra, D, Stella, L, y Mangoni, ML. Esculentin 1-21: un péptido antimicrobiano lineal de piel de rana con efecto inhibitorio sobre bacterias causantes de mastitis bovina. J Pept Sci. (2009) 15:607–14. DOI: 10.1002/PSC.1148
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. Tetens, J, Friedrich, JJ, Hartmann, A, Schwerin, M, Kalm, E, y Thaller, G. El patrón de expresión espacial de péptidos antimicrobianos a través de la ubre bovina sana. J Dairy Sci. (2010) 93:775–83. DOI: 10.3168/JDS.2009-2729
Resumen de PubMed | Texto completo de CrossRef | Google Académico
89. Gurao, A, Kashyap, SK, y Singh, R. β-defensins: an innate defense for bovine mastitis. Mundo veterinario. (2017) 10:990–8. doi: 10.14202/vetworld.2017.990-998
Resumen de PubMed | Texto completo de CrossRef | Google Académico
90. López-Meza, JE, Gutiérrez-Barroso, A, y Ochoa-Zarzosa, A. Expression of traqueal antimicrobial peptide in bovine mammary epithelial cells. Res Vet Sci. (2009) 87:59–63. doi: 10.1016/j.rvsc.2008.12.005
91. Zhang, Z, Chen, D, Lu, X, Zhao, R, Chen, Z, Li, M, et al. Directed expression of tracheal antimicrobial peptide as a treatment for bovine-associated Staphylococcus aureus-induced mastitis in mice. Front Vet Sci. (2021) 8:700930. doi: 10.3389/fvets.2021.700930
92. Mygind, PH, Fischer, RL, Schnorr, KM, Hansen, MT, Sönksen, CP, Ludvigsen, S, et al. Plectasin is a peptide antibiotic with therapeutic potential from a saprophytic fungus. Nature. (2005) 437:975–80. doi: 10.1038/nature04051
93. Zhang, Y, Teng, D, Wang, X, Mao, R, Cao, X, Hu, X, et al. In vitro and in vivo characterization of a new recombinant antimicrobial peptide, MP1102, against methicillin-resistant Staphylococcus aureus. Appl Microbiol Biotechnol. (2015) 99:6255–66. doi: 10.1007/s00253-015-6394-7
94. Li, J, Shang, L, Lan, J, Chou, S, Feng, X, Shi, B, et al. Targeted and intracellular antibacterial activity against S. agalactiae of the chimeric peptides based on pheromone and cell-penetrating peptides. ACS Appl Mater Interfaces. (2020) 12:44459–74. doi: 10.1021/acsami.0c12226
95. Shao, C, Zhu, Y, Lai, Z, Tan, P, and Shan, A. Antimicrobial peptides with protease stability: progress and perspective. Future Med Chem. (2019) 11:2047–50. doi: 10.4155/fmc-2019-0167
96. Band, VI, and Weiss, DS. Mechanisms of antimicrobial peptide resistance in gram-negative bacteria. Antibiotics (Basel). (2015) 4:18–41. doi: 10.3390/antibiotics4010018
97. Röhrig, C, Huemer, M, Lorgé, D, Luterbacher, S, Phothaworn, P, Schefer, C, et al. Targeting hidden pathogens: cell-penetrating enzybiotics eradicate intracellular drug-resistant Staphylococcus aureus. MBio. (2020) 11:e00209–20. doi: 10.1128/mBio.00209-20
98. Kortright, KE, Chan, BK, Koff, JL, and Turner, PE. Phage therapy: a renewed approach to combat antibiotic-resistant bacteria. Cell Host Microbe. (2019) 25:219–32. doi: 10.1016/j.chom.2019.01.014
99. Schroven, K, Aertsen, A, and Lavigne, R. Bacteriophages as drivers of bacterial virulence and their potential for biotechnological exploitation. FEMS Microbiol Rev. (2021) 45:fuaa041. doi: 10.1093/femsre/fuaa041
100. Ganaie, MY, Qureshi, S, Kashoo, Z, Wani, SA, Hussain, MI, Kumar, R, et al. Isolation and characterization of two lytic bacteriophages against Staphylococcus aureus from India: newer therapeutic agents against bovine mastitis. Vet Res Commun. (2018) 42:289–95. doi: 10.1007/s11259-018-9736-y
101. Teng, F, Xiong, X, Zhang, S, Li, G, Wang, R, Zhang, L, et al. Efficacy assessment of phage therapy in treating Staphylococcus aureus-induced mastitis in mice. Viruses. (2022) 14:620. doi: 10.3390/v14030620
102. Iwano, H, Inoue, Y, Takasago, T, Kobayashi, H, Furusawa, T, Taniguchi, K, et al. Bacteriophage ΦSA012 has a broad host range against Staphylococcus aureus and effective lytic capacity in a mouse mastitis model. Biology (Basel). (2018) 7:8. doi: 10.3390/biology7010008
103. Bai, Q, Zhang, W, Yang, Y, Tang, F, Nguyen, X, Liu, G, et al. Characterization and genome sequencing of a novel bacteriophage infecting Streptococcus agalactiae with high similarity to a phage from Streptococcus pyogenes. Arch Virol. (2013) 158:1733–41. doi: 10.1007/s00705-013-1667-x
104. da Silva, DV, Dias, RS, Kropinski, AM, Campanaro, S, Treu, L, Siqueira, C, et al. Genomic analysis and immune response in a murine mastitis model of vB_EcoM-UFV13, a potential biocontrol agent for use in dairy cows. Sci Rep. (2018) 8:6845. doi: 10.1038/s41598-018-24896-w
105. Wang, Z, Xue, Y, Gao, Y, Guo, M, Liu, Y, Zou, X, et al. Phage vB_PaeS-PAJD-1 rescues murine mastitis infected with multidrug-resistant Pseudomonas aeruginosa. Front Cell Infect Microbiol. (2021) 11:689770. doi: 10.3389/fcimb.2021.689770
106. Liang, B, Zhao, W, Han, B, Barkema, HW, Niu, YD, Liu, Y, et al. Biological and genomic characteristics of two bacteriophages isolated from sewage, using one multidrug-resistant and one non-multidrug-resistant strain of Klebsiella pneumoniae. Front Microbiol. (2022) 13:943279. doi: 10.3389/fmicb.2022.943279
107. Shi, Y, Zhao, W, Liu, G, Ali, T, Chen, P, Liu, Y, et al. Bacteriophages isolated from dairy farm mitigated Klebsiella pneumoniae-induced inflammation in bovine mammary epithelial cells cultured in vitro. BMC Vet Res. (2021) 17:37. doi: 10.1186/s12917-020-02738-0
108. Zhao, W, Shi, Y, Liu, G, Yang, J, Yi, B, Liu, Y, et al. Bacteriophage has beneficial effects in a murine model of Klebsiella pneumoniae mastitis. J Dairy Sci. (2021) 104:3474–84. doi: 10.3168/jds.2020-19094
109. Monteiro, R, Pires, DP, Costa, AR, and Azeredo, J. Phage therapy: going temperate? Trends Microbiol. (2019) 27:368–78. doi: 10.1016/j.tim.2018.10.008
110. McCallin, S, and Oechslin, F. Bacterial resistance to phage and its impact on clinical therapy In: A Górski, R Międzybrodzki, and J Borysowski, editors. Phage Therapy: A Practical Approach. Cham: Springer (2019)
111. Costa, P, Pereira, C, Gomes, ATPC, and Almeida, A. Efficiency of single phage suspensions and phage cocktail in the inactivation of Escherichia coli and Salmonella Typhimurium: an in vitro preliminary study. Microorganisms. (2019) 7:94. doi: 10.3390/microorganisms7040094
112. Pires, D, Sillankorva, S, Faustino, A, and Azeredo, J. Use of newly isolated phages for control of Pseudomonas aeruginosa PAO1 and ATCC 10145 biofilms. Res Microbiol. (2011) 162:798–806. doi: 10.1016/j.resmic.2011.06.010
113. Rohde, C, Wittmann, J, and Kutter, E. Bacteriophages: a therapy concept against multi-drug-resistant bacteria. Surg Infect. (2018) 19:737–44. doi: 10.1089/sur.2018.184
114. Pires, DP, Costa, AR, Pinto, G, Meneses, L, and Azeredo, J. Current challenges and future opportunities of phage therapy. FEMS Microbiol Rev. (2020) 44:684–700. doi: 10.1093/femsre/fuaa017
115. García, P, Madera, C, Martínez, B, Rodríguez, A, and Evaristo, SJ. Prevalence of bacteriophages infecting Staphylococcus aureus in dairy samples and their potential as biocontrol agents. J Dairy Sci. (2009) 92:3019–26. doi: 10.3168/jds.2008-1744
116. Love, MJ, Bhandari, D, Dobson, RCJ, and Billington, C. Potential for bacteriophage endolysins to supplement or replace antibiotics in food production and clinical care. Antibiotics (Basel). (2018) 7:17. doi: 10.3390/antibiotics7010017
117. Vander Elst, N, Linden, SB, Lavigne, R, Meyer, E, Briers, Y, and Nelson, DC. Characterization of the bacteriophage-derived endolysins PlySs2 and PlySs9 with in vitro lytic activity against bovine mastitis Streptococcus uberis. Antibiotics (Basel). (2020) 9:621. doi: 10.3390/antibiotics9090621
118. Gutiérrez, D, Garrido, V, Fernández, L, Portilla, S, Rodríguez, A, Grilló, MJ, et al. Phage lytic protein Lys RODI prevents staphylococcal mastitis in mice. Front Microbiol. (2020) 11:7. doi: 10.3389/fmicb.2020.00007
119. Bassetti, M, Poulakou, G, Ruppe, E, Bouza, E, Van Hal, SJ, and Brink, A. Antimicrobial resistance in the next 30 years, humankind, bugs and drugs: a visionary approach. Intensive Care Med. (2017) 43:1464–75. doi: 10.1007/s00134-017-4878-x
120. Dąbrowska, K, and Abedon, ST. Pharmacologically aware phage therapy: pharmacodynamic and pharmacokinetic obstacles to phage antibacterial action in animal and human bodies. Microbiol Mol Biol Rev. (2019) 83:e00012–9. doi: 10.1128/MMBR.00012-19
121. Furfaro, LL, Payne, MS, and Chang, BJ. Bacteriophage therapy: clinical trials and regulatory hurdles. Front Cell Infect Microbiol. (2018) 8:376. doi: 10.3389/fcimb.2018.00376
122. Chan, BK, Abedon, ST, and Loc-Carrillo, C. Phage cocktails and the future of phage therapy. Future Microbiol. (2013) 8:769–83. doi: 10.2217/fmb.13.47
123. Pirnay, JP, Verbeken, G, Ceyssens, PJ, Huys, I, De Vos, D, Ameloot, C, et al. El fago magistral. Virus. (2018) 10:64. DOI: 10.3390/v10020064
Resumen de PubMed | Texto completo de CrossRef | Google Académico
124. Rainard, P, Gilbert, FB, Germon, P, y Foucras, G. Revisión invitada: una evaluación crítica de las vacunas contra la mastitis para vacas lecheras. J Dairy Sci. (2021) 104:10427–48. DOI: 10.3168/JDS.2021-20434
125. González, RN, Cullor, JS, Jasper, DE, Farver, TB, Bushnell, RB y Oliver, MN. Prevención de la mastitis coliforme clínica en vacas lecheras mediante una vacuna mutante contra Escherichia coli. Can J Vet Res. (1989) 53:301–5.
126. Wilson, DJ, Grohn, YT, Bennett, GJ, González, RN, Schukken, YH, and Spatz, J. Comparison of J5 vaccinates and controls for incidence, etiologic agent, clinical severity, and survival in the herd following naturally happening cases of clinical mastitis. J Dairy Sci. (2007) 90:4282–8. DOI: 10.3168/JDS.2007-0160
127. Côté-Gravel, J, Brouillette, E, Obradović, N, Ster, C, Talbot, BG, and Malouin, F. Characterization of a vraG mutant in a genetically stable Staphylococcus aureus small-colony variant and preliminary assessment for use as a live-attenuated vaccine against intrammamary infections. PLoS One. (2016) 11:E0166621. doi: 10.1371/journal.pone.0166621
128. Vidlund, Jessica J. Staphylococcal surface proteins as vaccine candidate for the control of Staphylococcal mastitis in dairy cows. Tesis de maestría, Universidad de Tennessee, (2022). Disponible en: https://trace.tennessee.edu/utk_gradthes/7061
129. Ster, C, Beaudoin, F, Diarra, MS, Jacques, M, Malouin, F, and Lacasse, P. Evaluation of some Staphylococcus aureus iron-regulated proteins as vaccine targets. Veterinario Immunol Immunopathol. (2010) 15:311–8. doi: 10.1016/j.vetimm.2010.03.010
130. Kabelitz, T, Aubry, E, van Vorst, K, Amon, T, y Fulde, M. El papel de Streptococcus spp. en la mastitis bovina. Microorganismos. (2021) 9:1497. doi: 10.3390/microorganismos9071497
Resumen de PubMed | Texto completo de CrossRef | Google Académico
131. Klaas, IC, y Zadoks, RN. Una actualización sobre la mastitis ambiental: desafiando las percepciones. Transbound Emerg Dis. (2018) 65:166–85. doi: 10.1111/tbed.12704
132. Collado, R, Montbrau, C, Sitjà, M, y Prenafeta, A. Estudio de la eficacia de una vacuna contra mastitis por Streptococcus uberis contra una infección intramamaria experimental con una cepa heteróloga en vacas lecheras. J Dairy Sci. (2018) 101:10290–302. DOI: 10.3168/JDS.2018-14840
133. Finch, JM, Winter, A, Walton, AW y Leigh, JA. Estudios adicionales sobre la eficacia de una vacuna viva contra la mastitis causada por Streptococcus uberis. Vacuna. (1997) 15:1138–43. DOI: 10.1016/S0264-410X(96)00307-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
134. Luo, S, Wang, Y, Kang, X, Liu, P, and Wang, G. Research progress on the association between mastitis and gastrointestinal microbes in dairy cows and the effect of probiotics. Microb Pathog. (2022) 173:105809. doi: 10.1016/j.micpath.2022.105809
Resumen de PubMed | Texto completo de CrossRef | Google Académico
135. Urakawa, M, Zhuang, T, Sato, H, Takanashi, S, Yoshimura, K, Endo, Y, et al. Prevención de mastitis en vacas lecheras multíparas con antecedentes de mastitis por alimentación oral con probióticos Bacillus subtilis. Anim Sci J. (2022) 93:E13764. doi: 10.1111/asj.13764
Resumen de PubMed | Texto completo de CrossRef | Google Académico
136. Gao, J, Liu, YC, Wang, Y, Li, H, Wang, XM, Wu, Y, et al. Impacto de la levadura y las bacterias del ácido láctico en la mastitis y la composición de la microbiota de la leche de las vacas lecheras. AMB Express. (2020) 10:22. DOI: 10.1186/S13568-020-0953-8
137. Bouchard, DS, Rault, L, Berkova, N, Le Loir, Y, and Even, S. Inhibition of Staphylococcus aureus invasion into bovine mammary epithelial cells by contact with live Lactobacillus casei. Aplicación Environ Microbiol. (2013) 79:877–85. doi: 10.1128/AEM.03323-12
138. Souza, RFS, Rault, L, Seyffert, N, Azevedo, V, Le Loir, Y, y Even, S. Lactobacillus casei BL23 modula la respuesta inmune innata en células epiteliales mamarias bovinas estimuladas por Staphylococcus aureus. Microbios Benef. (2018) 9:985–95. doi: 10.3920/BM2018.0010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
139. Alawneh, JI, James, AS, Phillips, N, Fraser, B, Jury, K, Soust, M, et al. Eficacia de un spray de tetina a base de Lactobacillus en la salud de la ubre en vacas lecheras lactantes. Front Vet Sci. (2020) 7:584436. DOI: 10.3389/FVETS.2020.584436
140. Yousefi Dehbidi, M, Goodarzi, N, Azhdari, MH, y Doroudian, M. Mesenchymal stem cells and their derived exosomes to combat Covid-19. Rev Med Virol. (2022) 32:E2281. DOI: 10.1002/RMV.2281
141. Cahuascanco, B, Bahamonde, J, Huaman, O, Jervis, M, Cortez, J, Palomino, J, et al. Las células madre mesenquimales fetales bovinas ejercen un efecto antiproliferativo contra el patógeno causante de la mastitis Staphylococcus aureus. Vet Res. (2019) 50:25. DOI: 10.1186/S13567-019-0643-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
142. Peralta, OA, Carrasco, C, Vieytes, C, Tamayo, MJ, Muñoz, I, Sepúlveda, S, et al. Seguridad y eficacia de una terapia intramamaria con células madre mesenquimales en vacas lecheras con mastitis clínica por Staphylococcus aureus inducida experimentalmente. Sci Rep. (2020) 10:2843. DOI: 10.1038/S41598-020-59724-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
143. Ghai, S, Saini, S, Ansari, S, Verma, V, Chopra, S, Sharma, V, et al. Las células madre mesenquimales alogénicas de la sangre del cordón umbilical son más efectivas que los antibióticos para aliviar la mastitis subclínica en vacas lecheras. Teriogenología. (2022) 187:141–51. doi: 10.1016/j.theriogenology.2022.05.001
144. Ferreira, M, Ogren, M, Dias, JNR, Silva, M, Gil, S, Tavares, L, et al. Liposomas como distemos de administración de antibióticos: una estrategia nanotecnológica prometedora contra la resistencia a los antimicrobianos. Moléculas. (2021) 26:2047. doi: 10.3390/moléculas26072047
Resumen de PubMed | Texto completo de CrossRef | Google Académico
145. Zhou, K, Wang, X, Chen, D, Yuan, Y, Wang, S, Li, C, et al. Efectos mejorados del tratamiento de tilmicosina contra la mastitis de vaca por Staphylococcus aureus mediante el nanogel de alginato de sodio-quitosano de autoensamblaje. Farmacia. (2019) 11:524. DOI: 10.3390/Pharmaceutics11100524
146. Abd El-Aziz, NK, Ammar, AM, El-Naenaeey, EYM, El Damaty, HM, Elazazy, AA, Hefny, AA, et al. Potenciales antimicrobianos y antibiofilm de nanopartículas de aceite de canela y plata contra Streptococcus agalactiae aislado de mastitis bovina: nuevas vías para contrarrestar la resistencia. BMC Vet Res. (2021) 17:136. doi: 10.1186/s12917-021-02842-9
147. Ranjani, S, Priya, PS, Veerasami, M, y Hemalatha, S. Novel polyherbal nanocolloids to control bovine mastitis. Appl Biochem Biotechnol. (2022) 194:246–65. DOI: 10.1007/S12010-021-03748-W
148. Sperandio, FF, Huang, YY, and Hamblin, MR. Terapia fotodinámica antimicrobiana para matar bacterias gramnegativas. Reciente Pat Antiinfect Drug Discov. (2013) 8:108–20. doi: 10.2174/1574891×113089990012
149. Hamblin, MR, y Hasan, T. Terapia fotodinámica: ¿un nuevo enfoque antimicrobiano para las enfermedades infecciosas? Photochem Photobiol Sci. (2004) 3:436–50. DOI: 10.1039/b311900a
150. Moreira, LH, de Souza, JCP, de Lima, CJ, Salgado, MAC, Fernandes, AB, Andreani, DIK, et al. Uso de la terapia fotodinámica en el tratamiento de la mastitis subclínica bovina. Photodiagn Photodyn Ther. (2018) 21:246–51. doi: 10.1016/j.pdpdt.2017.12.009
151. Silva, LO, da Silva Souza, KL, de Jesus, BL, Neto, WMR, Núñez, SC, y Frias, DFR. Uso de terapia fotodinámica y fotobiomodulación como alternativas para el control microbiano en mastitis clínica y subclínica en ovinos. Láseres Med Sci. (2022) 37:2305–10. DOI: 10.1007/S10103-022-03506-2
152. Yang, D, Lei, S, Pan, K, Chen, T, Lin, J, Ni, G, et al. Aplicación de la terapia fotodinámica en enfermedades inmunorelacionadas. Photodiagn Photodyn Ther. (2021) 34:102318. doi: 10.1016/j.pdpdt.2021.102318
153. Leitner, G, Zilberman, D, Papirov, E, y Shefy, S. Evaluación de la terapia de pulso acústico (APT), un tratamiento no antibiótico para vacas lecheras con mastitis clínica y subclínica. PLoS One. (2018) 13:E0199195. doi: 10.1371/journal.pone.0199195
Cita: Li X, Xu C, Liang B, Kastelic JP, Han B, Tong X y Gao J (2023) Alternativas a los antibióticos para el tratamiento de la mastitis en vacas lecheras. Frente. Vet. Sci. 10:1160350. doi: 10.3389/fvets.2023.1160350
Recibido: 07 Febrero 2023; Aprobado: 26 de mayo de 2023;
Publicado: 19 de junio de 2023.
Editado por:
Cristina Carresi, Universidad Magna Graecia de Catanzaro, Italia
Revisado por:
Mahmoud Mohamed Fayez, Instituto de Investigación de Sueros Veterinarios y Vacunas, Egipto
Magdalena Zalewska, Universidad de Varsovia, Polonia
Derechos de autor © 2023 Li, Xu, Liang, Kastelic, Han, Tong y Gao. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Jian Gao, gaojian2016@cau.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía