Artrodesis tarsal canina ex vivo
Artrodesis tarsal canina ex vivo: fijación mediante el uso de un nuevo pegamento de tejido óseo
 Tobias Per Otto Lundin1*
Tobias Per Otto Lundin1*  Michael Pujari-Palmer2
Michael Pujari-Palmer2  Gustaf Svensson1
Gustaf Svensson1  Extraño vikingo Höglund2
Extraño vikingo Höglund2- 1Departamento de Cirugía, Blå Stjärnans Djursjukhus, Gotemburgo, Suecia
- 2Departamento de Ciencias Clínicas, Universidad Sueca de Ciencias Agrícolas, Uppsala, Suecia
Introducción: La artrodesis, realizada como un procedimiento quirúrgico de rescate para tratar afecciones articulares intratables en perros y gatos, se asocia con una alta incidencia de complicaciones intra y postoperatorias, lo que demuestra la necesidad de técnicas mejoradas y nuevas en la cirugía de artrodesis. Agregar un nuevo pegamento óseo reabsorbible a la artrodesis podría agregar fuerza de fijación y menores complicaciones. Los objetivos de este estudio biomecánico experimental ex vivo fueron, por lo tanto, desarrollar un modelo de prueba biomecánica de artrodesis tarsal parcial y determinar si el nuevo pegamento óseo reabsorbible (cemento modificado con fosfoserina) produjo una resistencia de fijación medible en la artrodesis calcaneocuartal canina, sin implantes ortopédicos.
Métodos: Se utilizaron cuatro modelos de prueba biomecánica con un total de 35 articulaciones tarsales caninas. Los tejidos blandos se diseccionaron en 4 modelos de prueba diferentes con contribuciones variables de los tejidos blandos. La articulación calcaneocuartal se preparó como artrodesis in vivo y el pegamento se aplicó a las superficies articulares como líquido/masilla (0,4 cc). Después del curado durante 24 h, se aplicó una fuerza de cizallamiento a la junta (1 mm por minuto) y se registró la resistencia a la falla.
Resultados: Articulaciones calcaneocuartales, donde todos los tejidos blandos habían sido completamente resecados y fijados con pegamento (1–1,5 cm2 superficie articular), resistió 2–5 mm de desplazamiento y un promedio de 100 ± 58 N/cm2 de fuerza de cizallamiento (Modelo 1). Se obtuvieron resistencias de fijación adhesivas similares en los modelos 2 y 3 con contribuciones crecientes de los tejidos blandos (80 ± 44 y 63 ± 23 N/cm2, p = 0,39, ANOVA).
Conclusión: El modelo biomecánico desarrollado fue lo suficientemente sensible como para medir las diferencias en las resistencias de fijación entre diferentes formulaciones de pegamento. La resistencia media a la fijación (60–100 N/cm2) debe ser lo suficientemente fuerte como para soportar la carga a corto plazo en caninos de tamaño mediano (20 kg). El modelo de prueba biomecánica de cadáveres desarrollado es de uso potencial para otros estudios de artrodesis. El nuevo pegamento reabsorbible puede contribuir potencialmente a la estabilidad en la cirugía de artrodesis, actuando como complemento de la fijación estándar actual, los implantes metálicos.
1. Introducción
La artrodesis de la articulación tarsiana es una cirugía delicada realizada como un procedimiento quirúrgico de rescate, utilizado en perros y gatos para tratar afecciones tarsales intratables. Algunos ejemplos son fracturas, roturas de ligamentos, lesiones por cizallamiento, enfermedades osteocondral, infecciones, malformaciones y lesiones en el mecanismo de Aquiles (1–6). La artrodesis se asocia con una alta incidencia de complicaciones (hasta el 80%) que van desde complicaciones menores como complicaciones del yeso, cierre difícil de la herida y dehiscencia, hinchazón de las extremidades y tendinopatía gastrocnemio, hasta complicaciones mayores como necrosis plantar, infecciones, falla del implante y colocación incorrecta, varo / valgo / mala unión rotacional y retraso o no unión de la artrodesis (6-9). La artrodesis pantarsiana, fusión de las articulaciones talocrural, intertarsiana y tarsometatarsiana, tiene una mayor incidencia de complicaciones mayores que la artrodesis tarsiana parcial (ParTA), la fusión de las articulaciones intertarsiana y/o tarsometatarsiana (6).
La alta incidencia de complicaciones postoperatorias y dificultades intraoperatorias, muestran la necesidad de nuevas y mejoradas técnicas que puedan permitir menores tasas de complicaciones en la cirugía de artrodesis. Un adhesivo que facilite la colocación del implante y la alineación articular, y agregue fuerza a la fijación interna, podría ser una herramienta clínica complementaria útil para reducir el riesgo de complicaciones. Además, los casos en los que la coaptación externa postoperatoria todavía se considera necesaria pueden reducirse potencialmente (2, 6-8, 10, 11).
En este estudio experimental ex vivo se evaluó un nuevo pegamento óseo como adhesivo óseo subcondral (12-16). El pegamento está compuesto de materiales naturales que están presentes en el cuerpo, calcio, silicato y el aminoácido fosfoserina. Pruebas previas ex vivo e in vivo, ha demostrado que el pegamento se une al hueso cortical, con una fuerza de unión promedio de 100-400 N cm−2 (14 y 16). El pegamento es reabsorbible in vivo cuando se implanta en hueso esponjoso, y mantiene la fuerza de unión y fijación, ya que es reabsorbido activamente por el cuerpo y convertido en hueso nuevo, sin inflamación excesiva o patológica (14). Los componentes del pegamento pueden ser esterilizados por irradiación gamma y reaccionarán y funcionarán de manera comparable. Dependiendo de la mezcla de formulación, el pegamento se puede adaptar a una solidificación/endurecimiento más rápido (30 s) o más lento (10 min), con fuerza total después de 2–4 h o 12–24 h, respectivamente, y con idéntica fuerza de unión (Datos en archivo). Planteamos la hipótesis de que agregar el pegamento a una artrodesis de la articulación calcaneocuartal aumentaría la estabilidad intra y postoperatoria. Esto podría facilitar la alineación, la colocación del implante y reducir las complicaciones después de la operación.
Ningún pegamento óseo subcondral similar, no sintético y degradable está aprobado para uso clínico. Además, no existe un modelo de prueba biomecánica ya existente, donde se aplica un pegamento directamente en la articulación de artrodesis, que se puede usar para evaluar una fuerza adhesiva. El primer objetivo de este estudio fue, por lo tanto, desarrollar un modelo de prueba biomecánica de cadáveres de ParTa canino, destinado a detectar fuerzas de carga durante la falla de un pegamento. Nuestro segundo objetivo fue utilizar el modelo biomecánico para determinar si el pegamento producía una fuerza de fijación medible (24 h) en una artrodesis de la articulación calcaneocuartal, sin fijación ortopédica adicional.
2. Métodos
2.1. Materiales
Se utilizaron extremidades traseras de cadáveres caninos (izquierda y derecha), de perros sacrificados por razones ajenas a este estudio, que no mostraban signos macroscópicos de enfermedades musculoesqueléticas. Los cadáveres fueron donados por los propietarios a través de un formulario de consentimiento firmado (en el momento de la eutanasia del perro). La aprobación ética para el uso de cadáveres se obtuvo del Comité de Ética Animal de Uppsala, 15533-2018, 04682-2020.
El adhesivo se preparó a partir de silicato de calcio (AB Sigma-Aldrich Suecia, Estocolmo, Suecia) y fosfoserina (Flamma SpA, Chignolo D’isola BG, Italia), y se mezcló con agua desionizada.
2.2. Preparación de la muestra
Las extremidades traseras caninas se almacenaron a -20 ° C envueltas en bolsas de plástico y descongeladas (4 ° C) durante 48 h antes de su uso. El día de la prueba, las extremidades se mantuvieron a temperatura ambiente hasta que alcanzaron la temperatura ambiente (21-22 ° C). Las extremidades estaban desarticuladas en las articulaciones talocrurales. La piel se diseccionó de las articulaciones calcaneocuartosa y tarsometatarsiana 4-5. La articulación tarsometatarsiana 4-5 se desarticuló completamente para evitar la interferencia con el movimiento en la articulación calcaneocuartal. En la artrodesis de la articulación calcaneocuartal in vivo, dependiendo del tipo de lesión, diversos grados de tejidos blandos están intactos. Para imitar esto, las articulaciones se dividieron aleatoriamente en 4 modelos donde los tejidos blandos se diseccionaron parcial o completamente.
En el Modelo 1 las articulaciones intertarsales proximales estaban completamente desarticuladas. El modelo 1 representa una prueba de «corte puro», sin contribuciones de ningún tejido blando. En el Modelo 2 se cortaron los tendones colateral lateral, calcaneocuartal, plantar largo y calcaneocentral, retináculo extensor tarsiano y flexor con la cápsula articular de la articulación calcaneocuartal. En el Modelo 3 se cortó el ligamento colateral lateral de la articulación calcaneocuartal (Figura 1A).
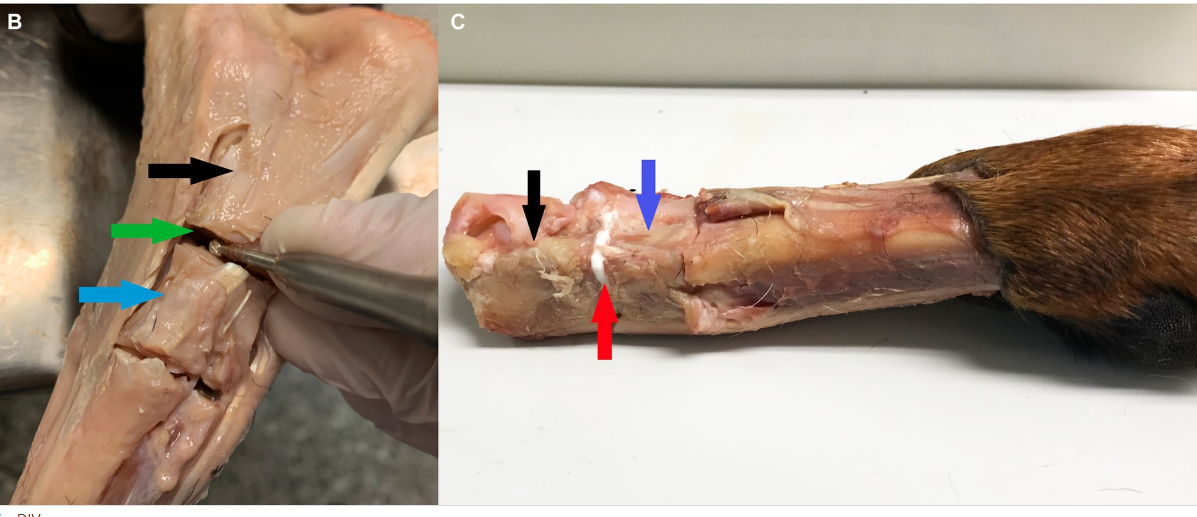
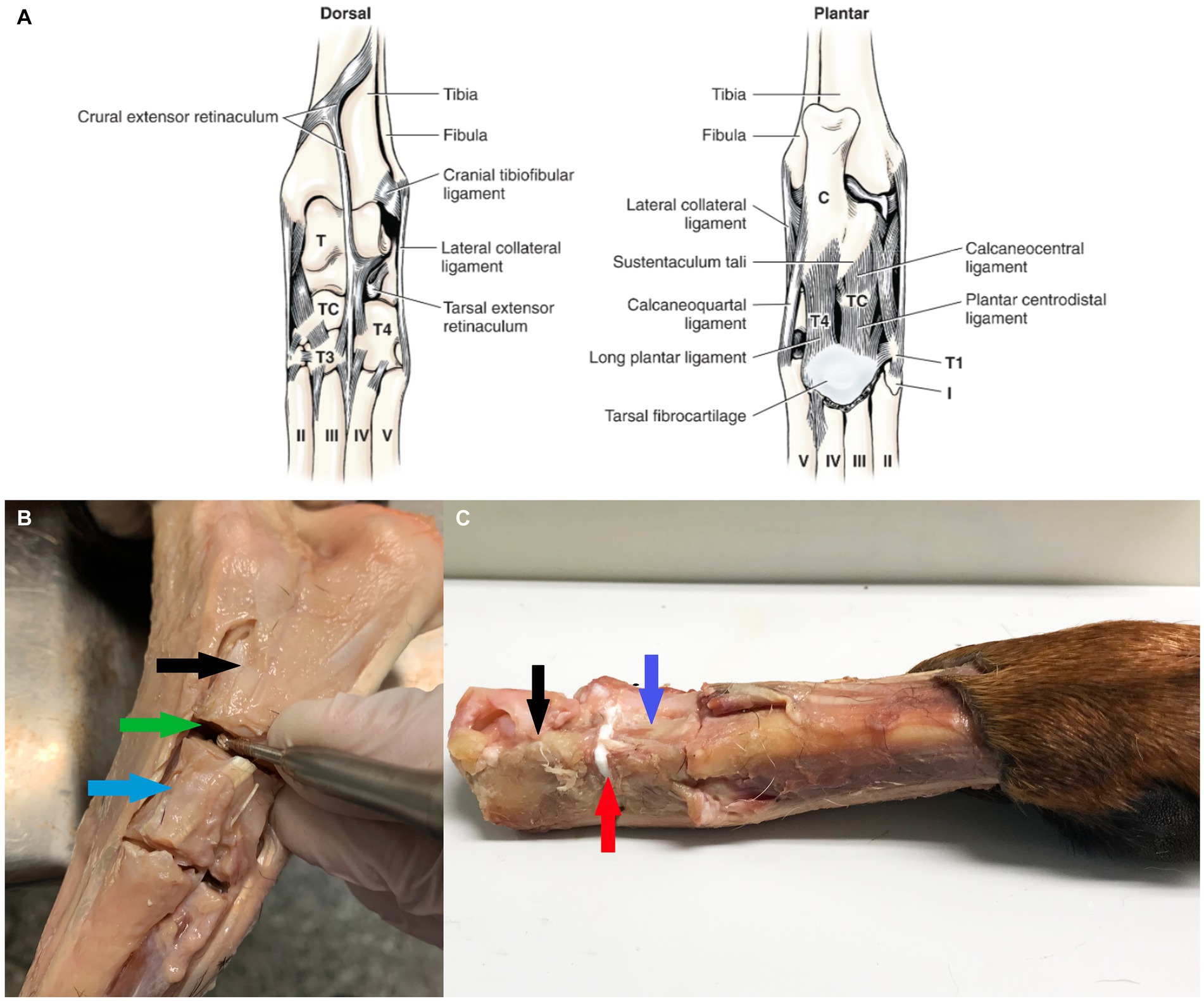 Figura 1. Descripción general de la anatomía del tarso y la preparación de los tejidos. (A) Ligamentos del tarso izquierdo (de Evans y de Lahunta (17), con permiso). (B) Se resecaron los tejidos blandos que rodean la articulación calcánea-cuartal, la articulación se desbridó del cartílago. La flecha negra resalta el calcáneo, el hueso cuartal de flecha azul y la flecha verde la articulación calcáneo-cuartal. (C) Se aplicó pegamento a la junta calcáneo-cuarto, el adhesivo de color blanco es visible como línea de unión, resaltada por una flecha roja.
Figura 1. Descripción general de la anatomía del tarso y la preparación de los tejidos. (A) Ligamentos del tarso izquierdo (de Evans y de Lahunta (17), con permiso). (B) Se resecaron los tejidos blandos que rodean la articulación calcánea-cuartal, la articulación se desbridó del cartílago. La flecha negra resalta el calcáneo, el hueso cuartal de flecha azul y la flecha verde la articulación calcáneo-cuartal. (C) Se aplicó pegamento a la junta calcáneo-cuarto, el adhesivo de color blanco es visible como línea de unión, resaltada por una flecha roja.
Dado que tanto el extremo proximal como el distal se fijaron en un banco de pruebas para el Modelo 2 y el Modelo 3, la tróclea del astrágalo se cortó con una sierra de cinta para crear una superficie nivelada, para el agarre. Para la comparación entre la biomecánica de las articulaciones intactas y nuestros modelos 1-3, se probó una articulación tarsal completamente intacta (sin resección de ningún tejido blando) (Modelo 4). Luego se expuso la articulación calcaneocuartal, solo mediante un enfoque dorsal mínimo preservando todos los ligamentos mediales, laterales y plantares (Modelo 4-Glue), para determinar si la presencia de tejidos blandos intactos enmascaraba los efectos del pegamento (por ejemplo, reparto de carga). En todos los modelos se utilizó una rebaba de alta velocidad de 2-3 mm (Medtronic Integrated Power Control EC 300, Medtronic, Fort Worth, Texas), dependiendo del tamaño del perro, para eliminar meticulosamente el cartílago de las superficies de la articulación calcaneocuartal (Figura 1B). El cartílago y los restos óseos se eliminaron y se midió el diámetro de las superficies óseas calcáneas y cuartales, los tejidos se almacenaron a -20 ° C hasta su uso.
El adhesivo se preparó a partir de kits premezclados, que contenían silicato de calcio y fosfoserina (70% de silicato de calcio por porcentaje molar). Se añadió agua desionizada para iniciar la reacción adhesiva (0,5 cc por 2 gramos de polvos premezclados), y el adhesivo se mezcló manualmente durante 30 s, antes de aplicar (0,4 cc) como una pasta espesa a la junta calcaneocuartal (Figura 1C). La junta se fijó manualmente durante 90 s, luego se colocó sobre una superficie plana para continuar el curado durante 24 h a 21 ° C. El grupo del Modelo 1 también incluyó el grupo con una formulación de pegamento más débil (85% de silicato de calcio por porcentaje molar, Modelo 1-Débil), para servir como validación del modelo si el modelo de prueba de cadáver actual era lo suficientemente sensible como para detectar diferencias en la resistencia del pegamento.
En el Modelo 3, las contribuciones del tejido blando a la resistencia a la falla, y a cómo el tejido dispersó la carga en y por encima del punto de falla del pegamento, se evaluaron probando la junta primero con pegamento (Modelo 3), luego sin pegamento (Modelo 3-sin).
2.3. Ensayos mecánicos
Después del curado durante 24 h, toda la junta se cargó en un banco de pruebas diseñado a medida, se colocó un impactador de 1 cm de ancho sobre el calcáneo (Modelo 1) o el hueso cuartal (Modelo 2-4), se aplicó una fuerza de cizallamiento a través del impactador y la resistencia a la falla se registró a partir de curvas de fuerza-desplazamiento (Figura 2). Los datos se obtuvieron en una máquina de ensayo mecánico AGS-H, Shimadzu (Shimadzu Europa Gmbh, Duisburg, Alemania), utilizando una velocidad de desplazamiento de 1 mm por minuto, y una célula de carga de 5kN. Los datos fueron analizados utilizando el software del fabricante, Trapezium-X Lite, versión 1.2.0 (Shimadzu Europa).
 Figura 2. Equipo de pruebas mecánicas y posicionamiento de muestras. (A) El banco de pruebas con una junta tarsal fijada en el banco de pruebas para la prueba de cizallamiento. El impactador se coloca sobre el hueso cuartal (flecha azul), donde se aplicó la fuerza de cizallamiento (Modelo 2-4). (B) Muestra cómo se prepararon y probaron los tejidos para el Modelo 1, con el impactador metálico directamente sobre el calcáneo (flecha negra) y la junta calcaneocuartal pegada (flecha roja). Los fondos se editaron con Photoshop, para aumentar la visibilidad para el lector.
Figura 2. Equipo de pruebas mecánicas y posicionamiento de muestras. (A) El banco de pruebas con una junta tarsal fijada en el banco de pruebas para la prueba de cizallamiento. El impactador se coloca sobre el hueso cuartal (flecha azul), donde se aplicó la fuerza de cizallamiento (Modelo 2-4). (B) Muestra cómo se prepararon y probaron los tejidos para el Modelo 1, con el impactador metálico directamente sobre el calcáneo (flecha negra) y la junta calcaneocuartal pegada (flecha roja). Los fondos se editaron con Photoshop, para aumentar la visibilidad para el lector.
Para investigar si el tamaño de la superficie de unión afectaba el rendimiento del pegamento (es decir, las diferencias en la fuerza de unión entre perros con diferentes tamaños de articulaciones), todos los resultados mecánicos se normalizaron al área de superficie promedio de las dos superficies de unión que estaban pegadas. El área de superficie se aproximó como un cuadrado, multiplicando el diámetro en las direcciones antero-posterior y medio-lateral y se trazó en un análisis de diagrama de dispersión.
2.4. Estadísticas
Las medias del grupo se compararon utilizando un ANOVA unidireccional, en el software estadístico JASP, versión 0.16.0.0.
3. Resultados
En total, se utilizaron 35 juntas tarsales (modelo 1 n = 9 y n = 8 pegamento «débil», modelo 2 n = 8, modelo 3 n = 9, modelo 4 n = 1).
En el Modelo 1, la resistencia adhesiva promedio fue de 92,3 N/cm2, para la formulación normal de pegamento (formulación: 70% de silicato de calcio por porcentaje molar). En el Modelo 1-Débil con la formulación de pegamento más débil (formulación: 85% silicato de calcio por porcentaje molar), produjo un promedio de 12.0 N/cm2 Máxima fuerza de unión.
Usando modelos de cizallamiento que incluían más tejidos blandos, la resistencia de unión promedio fue ligeramente menor en ambos Modelo 2, a 79.7 N / cm2, y el modelo 3 con una resistencia de unión media de 63,1 N/cm2. La diferencia en la fuerza de enlace promedio entre los modelos 1, 2 y 3 no fue estadísticamente significativa (p = 0,37, ANOVA).
Las curvas de desplazamiento de fuerza del Modelo 4/Modelo 4-Glue no mostraron ningún punto de falla, y no hubo diferencia en las curvas de desplazamiento de fuerza (Figura 3).
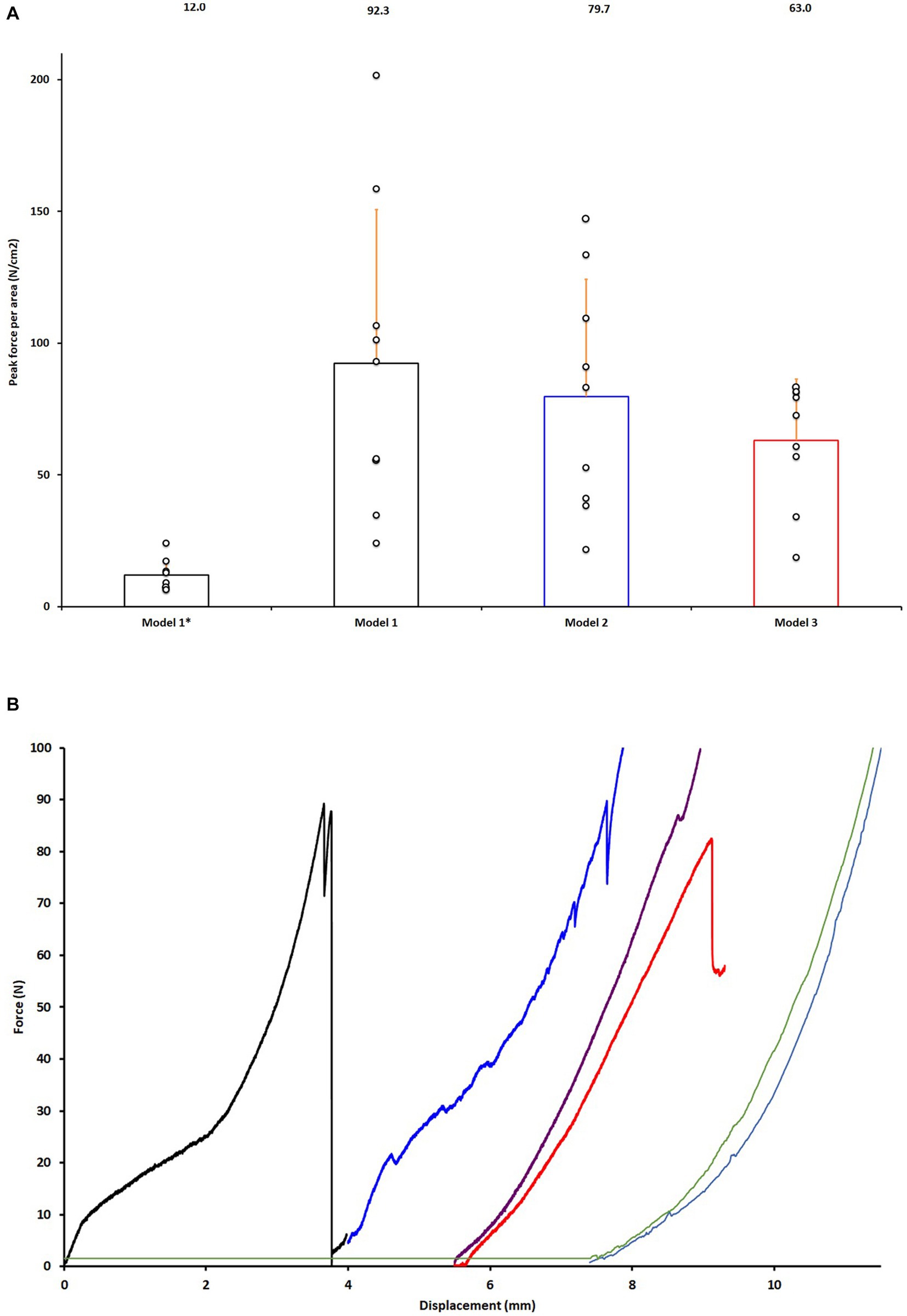 Figura 3. Validación y prueba de modelos en juntas encoladas. (A) Comparación de la resistencia adhesiva de las dos formulaciones de pegamento en el Modelo 1-Débil (Modelo 1*) y el Modelo 1 para la validación del modelo de prueba y el Modelo 2-3. Los datos se normalizan al tamaño promedio de la superficie de las dos articulaciones (fuerza por centímetro cuadrado). (B) Curvas representativas de desplazamiento de fuerza de juntas calcaneocutales encoladas a partir de puntos de datos mostrados en (A), Modelo 3-sin y Modelos 4. Curva negra que representa el Modelo 1, curva azul Modelo 2, curva roja Modelo 3, curva púrpura Modelo 3-sin, azul claro Modelo 4 y verde Modelo 4-Pegamento.
Figura 3. Validación y prueba de modelos en juntas encoladas. (A) Comparación de la resistencia adhesiva de las dos formulaciones de pegamento en el Modelo 1-Débil (Modelo 1*) y el Modelo 1 para la validación del modelo de prueba y el Modelo 2-3. Los datos se normalizan al tamaño promedio de la superficie de las dos articulaciones (fuerza por centímetro cuadrado). (B) Curvas representativas de desplazamiento de fuerza de juntas calcaneocutales encoladas a partir de puntos de datos mostrados en (A), Modelo 3-sin y Modelos 4. Curva negra que representa el Modelo 1, curva azul Modelo 2, curva roja Modelo 3, curva púrpura Modelo 3-sin, azul claro Modelo 4 y verde Modelo 4-Pegamento.
El diámetro óseo promedio (área superficial) de las superficies calcáneas y cuarttales fue de 1,07 ± 0,23 (Modelo 1), 0,86 ± 0,21 (Modelo 2) y 1,01 ± 0,20 (Modelo 3) cm2. La fuerza de correlación entre el tamaño del animal (diámetro óseo promedio, área superficial, de las superficies calcáneas y cuartales se utilizó como medida indirecta) y la fuerza de unión del pegamento, fue pobre (R2 < 0,20). Si bien la fuerza de unión promedio fue ligeramente más fuerte para animales más grandes, cuando se normalizó dividiendo la fuerza adhesiva por el área de superficie, se obtuvieron fuerzas de unión aproximadamente equivalentes, por centímetro cuadrado, tanto para animales grandes como pequeños (Figura 4).
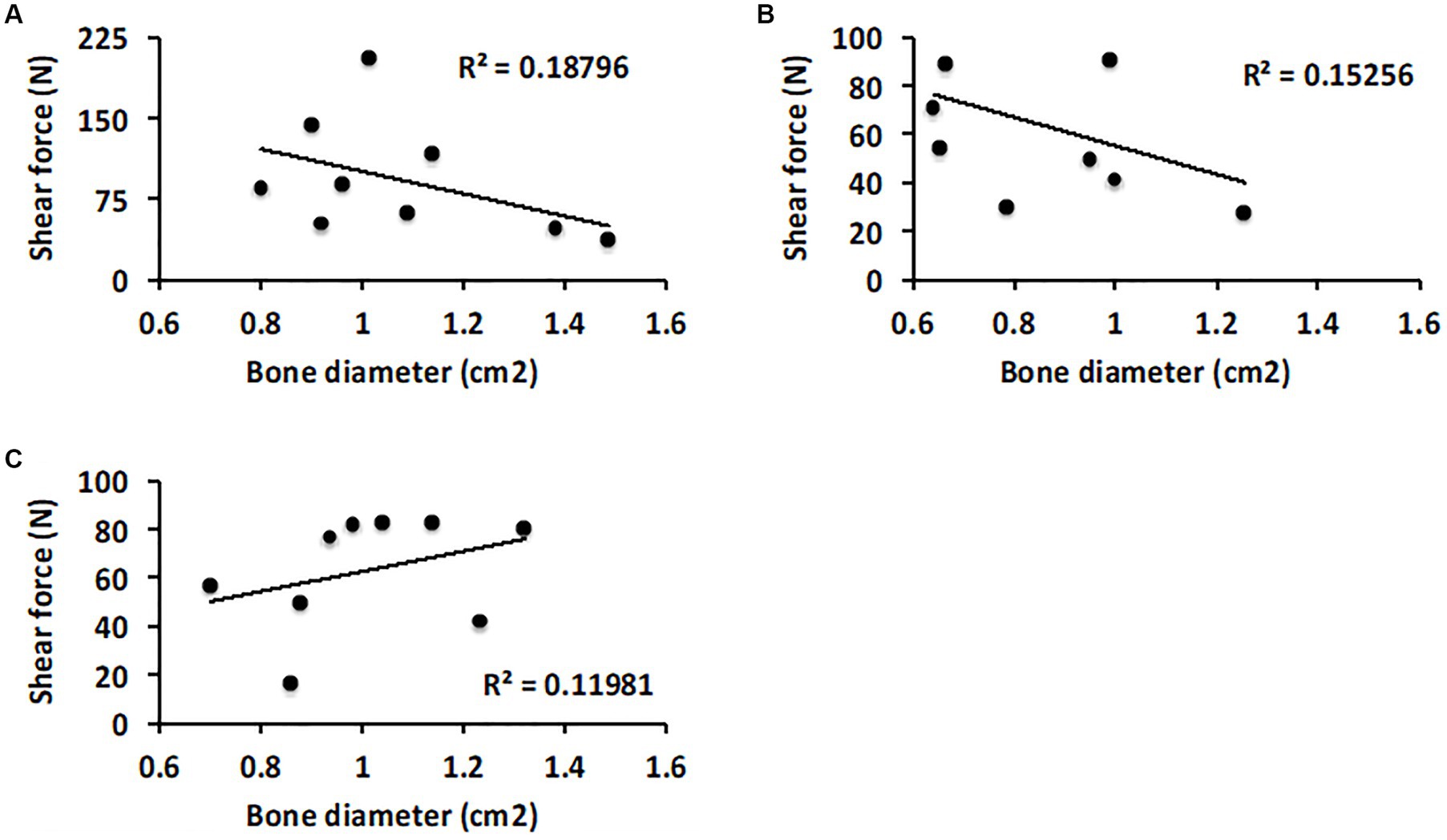 Figura 4. Análisis de diagrama de dispersión de cómo el tamaño de las superficies de la junta tarsal se correlaciona con el rendimiento del pegamento. (A) Comparación de la resistencia a la falla y el diámetro promedio de las superficies óseas calcáneas y cuartales en el Modelo 1. B) Modelo 2 y C) Modelo 3.
Figura 4. Análisis de diagrama de dispersión de cómo el tamaño de las superficies de la junta tarsal se correlaciona con el rendimiento del pegamento. (A) Comparación de la resistencia a la falla y el diámetro promedio de las superficies óseas calcáneas y cuartales en el Modelo 1. B) Modelo 2 y C) Modelo 3.
4. Discusión
En este estudio hemos desarrollado un modelo de prueba biomecánica cadavérica para la artrodesis calcaneocuartal lo suficientemente sensible como para detectar diferencias en la resistencia del pegamento y hemos demostrado que un nuevo pegamento óseo modificado con fosfoserina agrega fuerza a la artrodesis, ex vivo. Este es el primer estudio que evalúa un pegamento para fusionar superficies óseas subcondral. Nuestra hipótesis de que al agregar el pegamento a una artrodesis de la articulación calcaneocuartal podría agregar estabilidad se confirmó.
La artrodesis implica la eliminación meticulosa del cartílago articular, la colocación de un injerto óseo esponjoso por sus propiedades osteoconductoras, osteoinductivas y osteogénicas, y una fijación rígida interna o externa para lograr la fusión ósea (18, 19). La estabilidad rígida de la fijación es el principal determinante del éxito de la artrodesis, al promover la osificación intramembranosa, mientras que la fijación deficiente conduce a la formación de fibrocartílago y a la falta de unión (20-25). En las articulaciones metatarsofalángicas humanas, el movimiento de las superficies 2 mm después de la artrodesis es suficiente para interrumpir la curación, lo que lleva a la no unión (26, 27). En el presente estudio, las juntas tratadas con pegamento soportaron un desplazamiento de 2-3 mm antes de que el pegamento fallara. En un entorno clínico, el pegamento puede ser suficiente para reducir o prevenir los micromovimientos entre las superficies de las articulaciones unidas por implantes ortopédicos. Una tecnología que reduzca el riesgo de fallas de implantes y falta de unión, especialmente en la artrodesis tarsiana canina y carpiano, donde no todas las partes de la articulación están fijadas por el implante (s) podría ser de gran valor clínico.
Otra técnica potencial, aún no investigada, podría ser fijar las articulaciones en alineación correcta con el pegamento (se solidifica en 60-90 s) antes de colocar los implantes durante la artrodesis, evitando así las desalineaciones posteriores o la colocación incorrecta de los implantes (6).
Históricamente se ha recomendado el uso de una coaptación externa, generalmente un yeso, para agregar rigidez y reducir la carga de los implantes internos (8). Sin embargo, la efectividad de la coaptación sigue siendo poco clara y estudios recientes sugieren lo contrario para la artrodesis tarsiana y carpiano (2, 28). Un pegamento que agrega estabilidad a la fijación podría disminuir aún más la necesidad de una coaptación externa, después de que alcanzara su fuerza máxima en 2-24 h, dependiendo de la mezcla de formulación del pegamento, en los casos en que todavía se considere necesario (29).
El pegamento evaluado en este estudio es un tipo de biomaterial: un pegamento cerámico que se reabsorbe y es reemplazado por hueso. El número de informes de casos que evalúan biomateriales para la artrodesis es pequeño y, hasta donde sabemos, hasta ahora no existe un biomaterial cerámico o polimérico que pueda estabilizarse, fijarse o unirse con el hueso subcondral (30-36). Ningún material reabsorbible ha logrado la aprobación regulatoria para su uso en el pegado o fijación del hueso subcondral y no hay otros informes de casos de un adhesivo que pueda aumentar o mejorar los procedimientos de artrodesis.
El modelo de cadáver desarrollado fue lo suficientemente sensible como para distinguir entre pegamentos con diferentes resistencias e identificar la falla del pegamento en presencia de algunos tejidos blandos, similar a las condiciones clínicas reales de la artrodesis. Sin embargo, la presencia de tejidos blandos intactos contribuyó a la estabilidad e interfirió con las mediciones en articulaciones intactas. Concluimos, por lo tanto, que los modelos biomecánicos de artrodesis de la articulación tarsiana, que utilizan un adhesivo para unir o fijar superficies articulares, requieren la eliminación de al menos tejidos blandos proximales para identificar la falla del pegamento y medir la fuerza de unión. El pegamento parecía participar en el reparto de carga con los tejidos blandos cercanos, similar a lo que ocurriría en las articulaciones fusionadas in vivo.
Después del curado, el pegamento en este estudio se asemeja a un material cerámico. Los defectos o defectos, como los poros, limitan la resistencia estructural de la cerámica (37). La probabilidad de que surjan defectos durante la unión o el ajuste debe aumentar con los aumentos en el tamaño de la superficie de unión. Por lo tanto, era teóricamente posible que la resistencia a la falla de las juntas reconstruidas pudiera correlacionarse con el tamaño de la articulación. Sin embargo, las fuerzas de unión por centímetro cuadrado fueron similares tanto para perros pequeños como grandes.
El pegamento parecía lo suficientemente fuerte como para justificar más pruebas en la artrodesis articular, a la espera de pruebas en un modelo de carga crónica (cíclica) para tener en cuenta la falla prematura debido a la fatiga. Si bien solo fue posible evaluar la fuerza de fijación inmediata a corto plazo (24 h) en el modelo actual, en un estudio reciente hemos demostrado que el adhesivo se une al hueso esponjoso y cortical vivo (in vivo) (14) tan fuertemente como al hueso del cadáver (13) en roedores y en hueso humano (38). Por lo tanto, se espera que los resultados de este estudio predigan de cerca cómo se comportará el pegamento en caninos vivos, dentro de las 24 horas posteriores a la fijación. Sin embargo, en este estudio, en lugar de usar tejido a temperatura fisiológica (37 ° C), los tejidos se calentaron a temperatura ambiente (21-22 ° C) para evitar la variabilidad. El uso de tejidos ex vivo calentados (37 ° C) haría que el rendimiento del pegamento dependiera de variables de confusión que afectan la rapidez con que los tejidos se enfrían, en lugar de cómo el pegamento interactuó con las superficies del tejido osteocondral. En consecuencia, dado que el tiempo de curado del pegamento, no la fuerza de unión máxima, se ve afectado por la temperatura con superficies más frías que ralentizan la reacción del pegamento, cuando se usa in vivo el adhesivo reaccionará más rápido y alcanzará la fuerza máxima antes que en este estudio.
En pruebas de laboratorio, en metales y hueso cortical, la resistencia adhesiva promedio del pegamento es típicamente de 400 N / cm2 (15). Esto sugiere que la fuerza de fusión articular podría aumentarse 2-4 veces (para alcanzar la verdadera fuerza del pegamento) con mejoras adicionales en la técnica de manipulación y fijación, o optimizando el pegamento para unirse con el hueso subcondral, en lugar del hueso cortical, para estudios futuros.
Había varias limitaciones al modelo y los datos actuales. En primer lugar, el modelo actual de cadáver representaba un compromiso entre la necesidad de eliminar todos los tejidos blandos y la musculatura para lograr un régimen de carga uniaxial en una sola interfaz hueso/adhesivo (por ejemplo, cizallamiento puro). También hubo una necesidad de reproducir la situación clínica, donde las lesiones a menudo son más complejas, involucrando varias articulaciones y donde los tejidos blandos circundantes y el músculo dispersan la carga, evitando así una medición precisa de la fuerza biomecánica que surge solo de las superficies articulares unidas. Las pruebas ex vivo tampoco consideraron los cambios en la viscoelasticidad entre el tejido vivo y el tejido del cadáver debido a la descomposición (cadáver), la temperatura, la cicatrización, la inflamación o la presencia de fluidos que pueden afectar las propiedades del material en el tejido vivo.
Otra limitación en el presente estudio fue el tipo de fuerzas de carga. Se utilizó una fuerza puramente cortante porque esta es la prueba más rigurosa para un pegamento (es decir, la mayoría de los pegamentos son más débiles en cizallamiento), además de ser una fuerza que surge durante la locomoción normal, además de la compresión, flexión y torsión. Mientras que la carga tarsal se ha evaluado en general utilizando: flexión de 1, 2 y 3 puntos (26, 39–41); torsión pura (24); compresión (42); Cizallamiento (27) y carga multimodal utilizando tobillos intactos (cadáver) (43) No existe un consenso claro sobre qué tipo(s) de carga son suficientes para modelar con precisión las fuerzas que surgen durante la locomoción. Ningún otro estudio ha evaluado los adhesivos para la fijación articular, y la magnitud de la(s) fuerza(s) que surgen(n) durante el movimiento articular están mal caracterizadas en los caninos. El estudio más completo hasta ahora en humanos, Wang et al. (25) encontró que la carga máxima esperada en las articulaciones calcaneocuboidales humanas durante el movimiento era equivalente al 9% del peso corporal (0.3-0.5 MPa o 40-100 N). Traducir directamente los resultados de Wang et al. (25) de humano a canino, es imposible debido a las diferencias en los patrones de movimiento, anatomía y ángulos de carga funcionales, entre bípedos y cuadrúpedos. Sin embargo, una suposición razonable de la carga en la articulación calcaneocuartal canina es que no sería mayor que en los humanos. Sobre la base de esta suposición, la fuerza de carga máxima esperada en una raza de juguete (que pesa 1-3 kg) podría ser de 1-3 N, mientras que un perro de tamaño mediano (5-20 kg) podría ejercer hasta 20 N en la articulación calcaneocuartal durante el movimiento. Este rango de fuerzas de carga sería mucho menor que la resistencia medida del pegamento. Tanto la articulación como los tejidos blandos circundantes dispersan la carga, lo que puede reducir las fuerzas que actúan sobre las superficies articulares, al tiempo que complica el análisis de qué tan fuerte debe ser un pegamento para resistir el desplazamiento / deformación y garantizar la fusión articular.
Finalmente, dado que evaluamos una junta donde las superficies no eran visibles durante la prueba, la falla de la junta pegada se confirmó visualmente cuando aparecieron grietas en la línea de unión. Es posible que se hayan producido fallos más pequeños o parciales en el pegamento (por ejemplo, fatiga), cuando se sometió a cargas repetidas. Se necesitan estudios adicionales para evaluar las propiedades de fatiga del pegamento. Si bien no es obvio a partir de los datos o la discusión hasta el momento, el mayor desafío en este estudio fue desarrollar un método de fijación manual para mantener estables las superficies irregulares de la junta y evitar interrumpir el adhesivo mientras se curaba, durante el tiempo de curado / trabajo de 60-90 s. Las superficies de las juntas no eran planas, ni estaban perfectamente alineadas, lo cual es un impedimento crucial para cualquier pegamento, lo que hace que los resultados de este estudio sean aún más relevantes.
5. Conclusión
Un modelo de cadáver de artrodesis de la articulación calcaneocuartal canina fue lo suficientemente sensible como para medir la resistencia inmediata de fijación de materiales de tipo adhesivo óseo. También hemos demostrado que el pegamento óseo produce una fuerte fijación en el tejido del cadáver con un tiempo mínimo de fijación manual. Finalmente, la fuerza adhesiva podría ser suficiente para la carga in vivo a corto plazo por razas pequeñas y medianas (20 kg), apoyando la evaluación futura en animales vivos.
Nota del autor
Se presentó un resumen en la Cumbre de Cirugía ACVS 2022, del 13 al 15 de octubre, Portland, Oregón, EE. https://doi.org/10.1111/vsu.13879.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
La aprobación ética para el uso de cadáveres se obtuvo del Comité de Ética Animal de Uppsala, 15533-2018, 04682-2020. Los cadáveres fueron donados por los propietarios a través de un formulario de consentimiento firmado (en el momento de la eutanasia del perro).
Contribuciones del autor
TL preparó el espécimen, interpretó los datos y redactó, revisó, editó y completó el manuscrito. MP-P preparó la muestra, realizó y analizó experimentos de propiedades mecánicas, redactó, revisó y editó el manuscrito. GS preparó el espécimen, interpretó los datos, redactó, revisó y editó el manuscrito. OH recolectó el espécimen, interpretó los datos, redactó, revisó y editó el manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
El estudio fue apoyado, en parte, por la subvención interdisciplinaria U-Share (SLU 2020.2.5.1-1074). La agencia de financiación no participó en ninguna planificación o análisis experimental.
Reconocimientos
Los autores agradecen a Håkan Engqvist de la Universidad de Uppsala por donar generosamente las materias primas para fabricar el adhesivo.
Conflicto de intereses
MP-P declara la propiedad parcial de una empresa que posee toda la propiedad intelectual relacionada, GPBio LTD.
Los autores restantes declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Abrams, BE, Wavreille, VA, Hettlich, BF y Selmic, LE. Osteotomía correctiva y artrodesis tarsiana parcial en dos galgos con mala unión del calcáneo. Veterinario Surg. (2020) 49:1600–8. DOI: 10.1111/VSU.13517
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Anesi, S, Clarke, S, Gemmill, T, Oxley, B, Pink, J, Smith, K, et al. Resultados a largo plazo después de la artrodesis pantarsal con fijación de la placa medial sin coaptación externa en 30 perros. Veterinario Surg. (2020) 49:502–11. DOI: 10.1111/VSU.13354
3. Franch, J, Lafuente, P, Diaz-Bertrana, MC, Munilla, A, Durall, I, Pastor, J, et al. Manejo de lesiones osteolíticas leishmaniales en un perro hipotiroideo mediante artrodesis tarsal parcial. Veterinario Rec. (2004) 155:559–62. DOI: 10.1136/VR.155.18.559
4. Massimo, P, and Michela, B. Pantarsal arthrodesis to treat a full-thickness lateral trochlear ridge osteochondritis disecantes in a dog. VCOT Abierto. (2019) 2:E27–31. DOI: 10.1055/S-0039-1687885
5. Ost, PC, Dee, JF, Dee, LG y Hohn, RB. Fracturas del calcáneo en galgos de carreras. Veterinario Surg. (1987) 16:53–9. doi: 10.1111/j.1532-950X.1987.tb00913.x
6. Roch, SP, Clements, DN, Mitchell, RAS, Downes, C, Gemmill, TJ, Macias, C, et al. Complicaciones después de la artrodesis tarsiana mediante fijación de la placa ósea en perros. J Small Anim Pract. (2008) 49:117–26. doi: 10.1111/j.1748-5827.2007.00468.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Barnes, DC, Knudsen, CS, Gosling, M, McKee, M, Whitelock, RG, Arthurs, GI, et al. Complicaciones de la fijación de la placa lateral en comparación con el cableado de la banda de tensión y la fijación con pasador o tornillo de retardo para la artrodesis calcaneocuartal. Tratamiento de la subluxación intertarsiana proximal que ocurre secundaria a una ruptura no traumática del ligamento tarsiano plantar en perros. Vet Comp Orthop Traumatol. (2013) 26:445–52. doi: 10.3415/VCOT-12-07-0089
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Klause, SE, Piermattei, DL, y Schwarz, PD. Artrodesis tarso-crural: complicaciones y recomendaciones. Vet Comp Orthop Traumatol. (1989) 2:119–24. doi: 10.1055/s-0038-1633208
9. Choi, CJ, Balara, JM, Casale, SA, y Wendelburg, KL. Tasa de extracción de implantes después de la artrodesis carpiano parcial en perros: un análisis retrospectivo de 22 casos. Front Vet Sci. (2023) 10:10. doi: 10.3389/fvets.2023.1160129
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. McKee, WM, May, C, Macias, C, y Lapish, JP. Artrodesis pantarsiana con placa ósea medial o lateral personalizada en 13 perros. Veterinario Rec. (2004) 154:165–70. DOI: 10.1136/VR.154.6.165
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Hulsart-Billström, G, Stelzl, C, Procter, P, Pujari-Palmer, M, Insley, G, Engqvist, H, et al. Evaluación de seguridad in vivo de un adhesivo óseo bioinspirado. J Mater Sci-Mater M. (2020) 31:24. DOI: 10.1007/S10856-020-6362-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Procter, P, Pujari-Palmer, M, Hulsart-Billström, G, Wenner, D, Insley, G, Larsson, S, et al. Un modelo de prueba biomecánica para evaluar adhesivos de tejido óseo y osteocondral. BMC Biomed Ing. (2019) 1:11. DOI: 10.1186/S42490-019-0011-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Procter, PH-BG, Alves, A, Pujari-Palmer, M, Wenner, D, Insley, G, Engqvist, H, et al. Pegado de hueso vivo mediante un bioadhesivo biomimético: desde el corte inicial hasta la curación final. Frente Bioeng Biotechnol. (2021) 9:9. DOI: 10.3389/fbioe.2021.728042
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Pujari-Palmer, M, Giró, R, Procter, P, Bojan, A, Insley, G, and Engqvist, H. Factors that determine the adhesive strength in a bioinspired bone tissue adhesive. Ingeniero Químico (2020) 4:1–19. DOI: 10.3390/chemengineering4010019
16. Pujari-Palmer, M, Guo, H, Wenner, D, Autefage, H, Spicer, CD, Stevens, MM, et al. Una nueva clase de biocerámicas inyectables que pegan tejidos y biomateriales. Materiales. (2018) 11:1–15. DOI: 10.3390/MA11122492
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Evans, HE, y de Lahunta, A. Miller’s anatomy of the dog. 4ª ed. St Louis: Saunders/Elsevier (2013).
18. Ogawa, T, Ishii, T, Mishima, H, Sakai, S, Watanabe, A, Nishino, T, et al. Efectividad del trasplante de médula ósea para revitalizar un hueso pequeño gravemente necrótico: modelo experimental de conejo. J Orthop Sci. (2010) 15:381–8. DOI: 10.1007/S00776-010-1459-Z
19. Johnson, KA, y Bellenger, CR. Efectos del injerto óseo autólogo en la curación ósea después de la artrodesis carpiano en el perro. Veterinario Rec. (1980) 107:126–32. DOI: 10.1136/VR.107.6.126
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Bennett, GL, Cameron, B, Njus, G, Saunders, M, y Kay, DB. Artrodesis tibiotalocalcaneal: una evaluación biomecánica de la estabilidad. Pie Tobillo Int. (2005) 26:530–6. DOI: 10.1177/107110070502600706
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Buda, M, Hagemeijer, NC, Kink, S, Johnson, AH, Guss, D, and DiGiovanni, CW. Effect of fixation type and bone graft on tarsometatarsal fusion. Pie Tobillo Int. (2018) 39:1394–402. doi: 10.1177/1071100718793567
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Dock, CC, Freeman, KL, Coetzee, JC, McGaver, RS, and Giveans, MR. Outcomes of nitinol compression staples in tarsometatarsal fusion. Ortopedia de tobillo del pie. (2020) 5:1–6. DOI: 10.1177/2473011420944904
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Lareau, CR, Deren, ME, Fantry, A, Donahue, RMJ y DiGiovanni, CW. ¿Funciona el injerto óseo autógeno? Un análisis de regresión logística de datos de 159 artículos en la literatura de pie y tobillo. Cirugía de tobillo del pie. (2015) 21:150–9. doi: 10.1016/j.fas.2015.03.008
24. Riedl, M, Glisson, RR, Matsumoto, T, Hofstaetter, SG, y Easley, ME. Rigidez torsional después de la artrodesis subtalar con tornillos de compresión sin cabeza de segunda generación: comparación biomecánica de la fijación de 2 tornillos y 3 tornillos. Clin Biomech. (2017) 45:32–7. doi: 10.1016/j.clinbiomech.2017.04.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Wang, Y, Li, Z, Wong, DW-C, and Zhang, M. Effects of tokle arthrodesis on biomechanical performance of the entire foot. PLoS One. (2015) 10:1–22. doi: 10.1371/journal.pone.0134340
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Campbell, B, Schimoler, P, Belagaje, S, Miller, MC, and Conti, SF. Weight-bearing recommendations after first metatarsophalangeal joint arthrodesis fixation: a biomechanical comparison. J Orthop Surg Res. (2017) 12:23. DOI: 10.1186/S13018-017-0525-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Milshteyn, MA, Dwyer, M, Andrecovich, C, Bir, C, y Needleman, RL. Comparación de dos métodos de fijación para la artrodesis de la articulación calcaneocuboide: un estudio biomecánico. Pie Tobillo Int. (2014) 36:98–102. doi: 10.1177/1071100714552479
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Bristow, PC, Meeson, RL, Thorne, RM, Butterworth, SJ, Rutherford, S, Renwick, AIC, et al. Comparación clínica de la placa de compresión dinámica híbrida y la placa Castless para la artrodesis pancarpiana en 219 perros. Veterinario Surg. (2015) 44:70–7. doi: 10.1111/j.1532-950X.2014.12183.x
29. Meeson, RL, Davidson, C, y Arthurs, GI. Lesiones de tejidos blandos asociadas con la aplicación de yeso para afecciones ortopédicas distales de las extremidades. Vet Comp Orthop Traumatol. (2011) 24:126–31. doi: 10.3415/VCOT-10-03-0033
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Beuchel, MW, y Brage, M. Reconstitución ósea con material de injerto óseo sintético para defectos óseos en la revisión total de artroplastia de tobillo. Ortopedia de pie y tobillo. (2016) 1. doi: 10.1177/2473011416S00139
31. Bitterman, A, Mathew, C, Patel, M, y Gurtowski, JP. Artroplastia espaciadora antibiótica para la artrodesis MTP de revisión: un nuevo medio para construir el implante: un informe de caso. Cureus. (2016) 8:e537. DOI: 10.7759/CUREUS.537
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Gonçalves, H, Pascal-Moussellard, H, Lesoeur, J, Schnitzler, V, Fellah, BH y Wagner, NMS. Inyección de cemento apatítico de fosfato de calcio / compuestos sanguíneos en jaulas de fusión intervertebral: una alternativa simple y eficiente al autoinjerto que conduce a una fusión mejorada de la columna vertebral. Columna vertebral. (2020) 45:E1288–95. doi: 10.1097/BRS.0000000000003598
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Klos, K, Wähnert, D, Gueorguiev, B, Schwieger, K, Hofmann, GO, Windolf, M, et al. Desarrollo de una técnica para el aumento de cemento de construcciones de artrodesis tibiotalocalcaneal clavadas. Clin Biomech. (2010) 25:576–81. doi: 10.1016/j.clinbiomech.2010.03.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Liverneaux, P, y Khallouk, R. Calcium phosphate cement in wrist arthrodesis: three cases. J Orthop Sci. (2006) 11:289–93. DOI: 10.1007/S00776-006-1008-Y
35. O’Donnell, SW, Vaughn, JJ, Sangeorzan, AP, DeFontes, KW III, y Bluman, EM. Estrategias quirúrgicas: espaciador de cemento para la primera artrodesis metatarsofalángica por etapas después de la artroplastia fallida. Cirugía de tobillo del pie tecnológico. (2020) 19:225–9. doi: 10.1097/BTF.0000000000000252
36. Pomeroy, G, and De Ben, S. Ankle arthrodesis with silicate-substituted calcium phosphate bone graft. Pie Tobillo Online J. (2013) 6:2. doi: 10.3827/faoj.2013.0601.002
37. Pujari-Palmer, M, Robo, C, Persson, C, Procter, P, and Engqvist, H. Influence of cement compressive strength and porosity on augmentation performance in a model of orthopedic screw pull-out. J Mech Behav Biomed. (2018) 77:624–33. doi: 10.1016/j.jmbbm.2017.10.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Bojan, AJ, Stadelmann, VA, Wu, D, Pujari-Palmer, M, Insley, G, Sundh, D, et al. Un nuevo candidato adhesivo óseo: ¿funciona en hueso humano? Una evaluación preclínica ex-vivo en hueso fresco de la cabeza femoral osteoporótica humana. Lesión. (2022) 53:1858–66. DOI: 10.1016/J.Injury.2022.04.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Aiyer, A, Russell, NA, Pelletier, MH, Myerson, M, y Walsh, WR. El impacto de las grapas de nitinol en las fuerzas de compresión, el área de contacto y las propiedades mecánicas en comparación con una placa de garra y tornillos cruzados para la primera artrodesis tarsometatarsiana. Especificaciones del tobillo del pie. (2015) 9:232–40. DOI: 10.1177/1938640015620655
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Rodriguez, R, Dun, S, He, JK, McKissack, H, Fleisig, GS, and Jain, M. Biomechanical comparison of plantar-to-dorsal and dorsal-to-plantar screw strength for subtalar arthrodesis. Ortopedia de pie y tobillo. (2019) 4. doi: 10.1177/2473011419S00363
41. Wininger, FA, Kapatkin, AS, Radin, A, Shofer, FS y Smith, GK. El modo de falla y el momento de flexión de la artrodesis pancarpiana canina se estabilizan con dos sistemas de implantes diferentes. Veterinario Surg. (2007) 36:724–8. doi: 10.1111/j.1532-950X.2007.00326.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Jastifer, JR, Alrafeek, S, Howard, P, Gustafson, PA, y Coughlin, MJ. Evaluación biomecánica de la resistencia y rigidez de las construcciones de tornillos de artrodesis de la articulación subtalar. Pie Tobillo Int. (2015) 37:419–26. DOI: 10.1177/1071100715619680
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Simons, P, Sommerer, T, Zderic, I, Wahl, D, Lenz, M, Skulev, H, et al. Investigación biomecánica de dos sistemas de chapado para la fusión de la columna medial en pie. PLoS One. (2017) 12:E0172563. doi: 10.1371/journal.pone.0172563
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: artrodesis, fijación, estabilidad, modelo biomecánico, cola, adhesivo, reabsorbible
Cita: Lundin TPO, Pujari-Palmer M, Svensson G y Höglund OV (2023) Artrodesis tarsal canina ex vivo: fijación mediante el uso de un nuevo pegamento de tejido óseo. Frente. Vet. Sci. 10:1250147. doi: 10.3389/fvets.2023.1250147
Recibido: 06 Julio 2023; Aprobado: 04 Septiembre 2023;
Publicado: 20 septiembre 2023.
Editado por:
Alessia Di Giancamillo, Universidad de Milán, Italia
Revisado por:
Zbigniew Adamiak, Clínica Veterinaria Białystok, Polonia
Regina Zavodovskaya, VDx Veterinary Diagnostics and Preclinical Research Services, Estados Unidos
Derechos de autor © 2023 Lundin, Pujari-Palmer, Svensson y Höglund. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Tobias Per Otto Lundin, tobias.lundin@blastjarnan.se
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

