Beneficios de la suplementación con pectina materna en la dieta de gestación sobre la microbiota vaginal de las cerdas
Beneficios de la suplementación con pectina materna en la dieta de gestación sobre la microbiota vaginal de las cerdas y la salud intestinal de los lechones recién nacidos
 Jiaqi He
Jiaqi He  Jie Zheng,
Jie Zheng,  Yingyan, Huang
Yingyan, Huang  Shuang, Li
Shuang, Li  Lun, Hua
Lun, Hua  Xuemei, Jiang
Xuemei, Jiang  Lianqiang Che,
Lianqiang Che,  Zhengfeng Fang
Zhengfeng Fang  Bin Feng
Bin Feng  Yan Lin
Yan Lin  Shengyu Xu
Shengyu Xu  Jian Li
Jian Li  De Wu*
De Wu*- Laboratorio Clave para la Nutrición Resistente a Enfermedades Animales del Ministerio de Educación de China, Instituto de Nutrición Animal, Universidad Agrícola de Sichuan, Chengdu, China
La pectina es un prebiótico probado y ampliamente utilizado en productos para la salud humana. Este estudio tiene como objetivo evaluar el impacto de la suplementación con pectina dietética durante la gestación en la microbiota vaginal de las cerdas y en la composición intestinal de las crías. Treinta cerdas fueron asignadas aleatoriamente a dos grupos y alimentadas con una dieta estándar (CON) o una dieta estándar suplementada con 3 g/kg de pectina (PEC). Se recolectaron y analizaron muestras de sangre, heces e hisopos vaginales de las cerdas y muestras de sangre, flujo intestinal y contenido colónico de las crías. Los resultados indican que la abundancia relativa de Lactobacillus vaginal aumentó notablemente en el grupo PEC y que la actividad fecal de la β-glucuronidasa (β-G) y la concentración plasmática de 17β-estradiol (E2) también aumentaron significativamente en el grupo PEC. También se descubrió que los lechones recién nacidos albergaban diferentes comunidades microbianas. A nivel de filo, Proteobacteria dominó en el grupo CON, y Firmicutes fue predominante en el grupo PEC. Los lechones recién nacidos en el grupo PEC tenían una concentración más baja de interleucina-6 (IL-6) en su plasma. También mejoró la expresión de citoquinas intestinales de la descendencia. La altura de las vellosidades y la altura de las vellosidades/profundidad de las criptas (V/C) en el grupo PEC fueron extremadamente más altas que las del grupo CON. En conclusión, la suplementación dietética con pectina puede ser beneficiosa tanto para las cerdas como para los lechones recién nacidos.
1 Introducción
Se ha descrito que la microbiota vaginal desempeña un papel importante en la salud del tracto reproductor materno (1). La mayoría de las veces, se encontró que las bacterias vaginales causan infecciones del tracto reproductivo como la endometritis o la vaginitis bacteriana (2). Estas bacterias también pueden dañar a las cerdas y a los lechones recién nacidos (3), lo que conlleva graves pérdidas económicas. Nuestro grupo también encontró que la microbiota vaginal estaba asociada con el rendimiento de las cerdas y sus citoquinas inflamatorias (4). Aunque son pocos los estudios disponibles que caracterizan la microbiota vaginal y su desarrollo en cerdas gestantes (5), los estudios en humanos han revelado que los Lactobacillus vaginales tienen la capacidad de resistir a las bacterias patógenas y mantener el equilibrio microecológico vaginal (6-8). Además, la abundancia relativa de Lactobacillus vaginal se ve alterada por la concentración de estradiol en sangre (6, 7, 9). La beta-glucuronidasa (β-G) secretada en el intestino puede desconjugar los estrógenos conjugados en aglicona estrona y 17β-estradiol (E2) (10). Las dietas más ricas en fibra dietética se asociaron con menores probabilidades de vaginitis bacteriana (11) y la fibra dietética fermentable también puede aumentar la actividad cecal β-G (12). La pectina, una fibra dietética fermentable extraída de las frutas (13), se considera una fibra dietética ideal tanto para humanos como para animales. Los estudios en cerdos destetados, ratas y seres humanos in vitro o in vivo han demostrado que la suplementación con pectina en la dieta puede alterar la microbiota intestinal y fecal, así como mejorar la antiinflamación sistémica (13-16). Además, los estudios sugirieron que el suministro de pectina a las ratas puede aumentar la actividad de la β-G cecal y se ha confirmado que la pectina también contribuye a un aumento de la actividad de la β-G (15, 17-19).
Por lo tanto, los objetivos de este estudio fueron investigar los efectos de la pectina dietética sobre la microbiota vaginal de cerdas en su etapa final de gestación. Al mismo tiempo, también nos interesaba saber si la suplementación dietética gestacional de las cerdas con pectina beneficiaría a los lechones recién nacidos.
2 Materiales y métodos
2.1 Aprobación ética
Este experimento se llevó a cabo en la Granja de Investigación del Instituto de Nutrición Animal de la Universidad Agrícola de Sichuan, Ya’an, China. El protocolo experimental utilizado en el presente estudio siguió las leyes vigentes en materia de protección animal (Aprobación Nº 20200156).
2.2 Animales y dietas
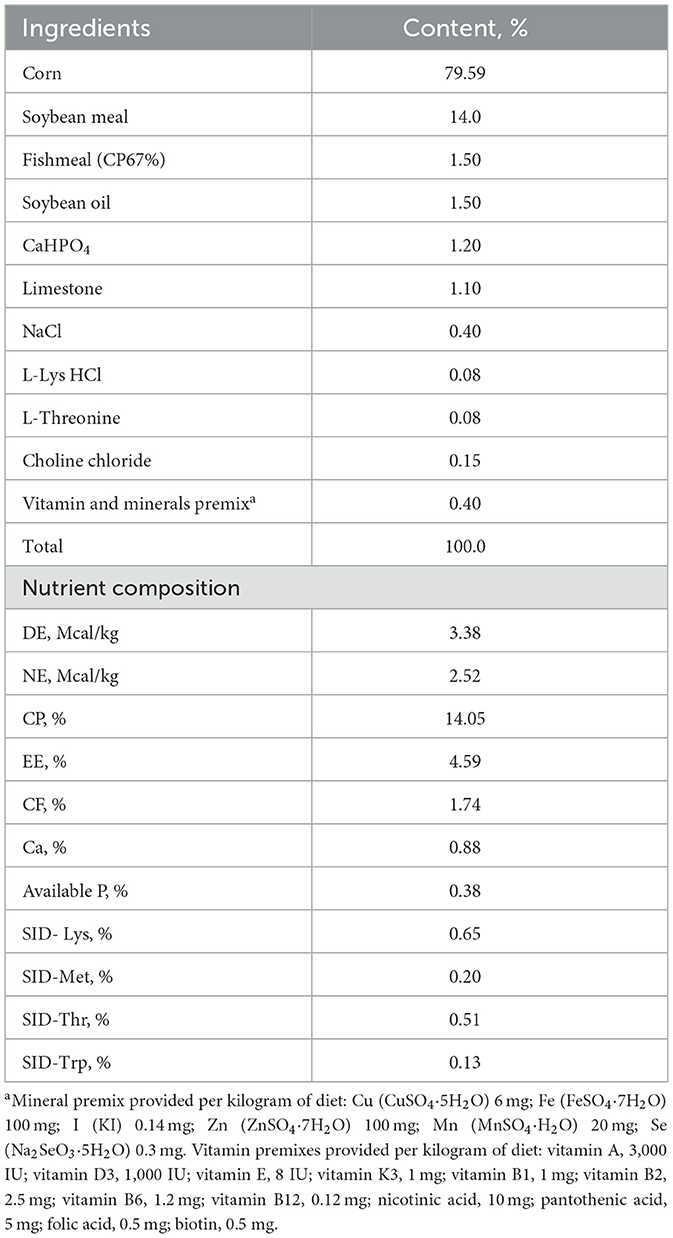
En este estudio se utilizaron 30 cerdas grandes cruzadas de raza blanca × criollo, que estaban estrechamente emparejadas en términos de peso corporal (228,16 ± 6,16 kg), grosor de la grasa dorsal (12,88 ± 0,26 mm) y paridad (5-7). Después de la inseminación artificial, las cerdas se dividieron aleatoriamente en dos grupos: control (CON) o pectina (PEC). Cada grupo contenía 15 corrales replicados, cada uno de los cuales tenía capacidad para una cerda. La dieta CON se formuló en una dieta de harina de maíz y soja para proporcionar 3,38 Mcal de energía digestible/kg y 12,08 g/kg de fibra dietética total de acuerdo con los requerimientos de nutrientes de las cerdas gestantes del Consejo Nacional de Investigación (NRC) (20) (Tabla 1).
Las dietas gestacionales se elaboraron meticulosamente para mantener un contenido constante de nutrientes en todos los grupos. Para el grupo CON, el régimen de alimentación varió según la etapa de gestación: 2,4 kg/día de 0 a 30 d, 2,3 kg/día de 30 a 90 d y 2,7 kg/día de 90 a 110 d de gestación. Por el contrario, las cerdas del grupo PEC fueron alimentadas con una dieta suplementada con 30 g/kg de pectina. La escala de alimentación en este grupo fue de 2,47, 2,37 y 2,78 kg/d en diferentes etapas de gestación. Las cerdas fueron alimentadas a las 08:30 y 14:30 h, y se les proporcionó agua ad libitum. En el día 110 de gestación, todas las cerdas fueron limpiadas y transferidas a parideras individuales equipadas con pisos de rejillas y almohadillas calientes para los lechones recién nacidos. Para estandarizar el tamaño de la camada a 8-12 lechones por nido, se realizó la acogida cruzada dentro de las 24 h posteriores al parto, exclusivamente entre cerdas del mismo grupo de tratamiento. La ingesta de alimento durante la lactancia comenzó a los 2 kg/día, aumentando gradualmente en 0,5 kg/día durante los primeros 5 días después del parto, permitiendo a partir de entonces el acceso a la dieta ad libitum. Tanto las cerdas como los lechones tenían acceso irrestricto al agua. Todos los lechones fueron destetados el día 21 de lactación.
2.3 Recogida de muestras
2.3.1 Comportamiento de crecimiento de los lechones lactantes
El peso de los lechones se registró individualmente a las 10:00 h a los 7, 14 y 21 d de lactación.
2.3.2 Muestras vaginales
Para evitar la contaminación de las muestras vaginales, se utilizó un equipo de hisopo de doble protección especialmente diseñado. En resumen, se colocó un hisopo estéril dentro de un tubo de plástico estéril, cuya parte frontal se cubrió con una envoltura de plástico estéril para proteger el hisopo. Se utilizó un palo delgado estéril, insertado desde la parte posterior, para empujar el hisopo hacia adelante. El área externa del perineo se desinfectó con etanol al 75%. Luego, un dilatador vaginal, que se utilizó para abrir la vulva, facilitó la inserción del hisopo en la vagina. Para evitar la contaminación del hisopo de la zona vaginal frontal, la pipeta, aún cubierta por la lámina de plástico, se introdujo más profundamente en la vagina profunda. Una vez en la vagina más profunda, la vaina de plástico se rompió empujando el palo delgado, exponiendo el hisopo. El hisopo permaneció en la vagina más profunda durante 1 minuto para garantizar una exposición completa a las secreciones vaginales. Después, el hisopo se retiró cuidadosamente del tubo y se retiró, mientras que el tubo en sí se mantuvo dentro de la vagina para evitar la contaminación. A continuación, los hisopos se colocaron en microtubos estériles y se almacenaron a -80 °C hasta su posterior procesamiento. Todo este procedimiento se llevó a cabo en el día 110 de gestación, después de la transferencia de las cerdas a las parideras.
2.3.3 Muestras de sangre
Se recogieron muestras de sangre en ayunas de las venas de las orejas de cada cerda antes de la comida de la mañana en el día 110 de gestación. Las muestras de sangre (10 mL) se recogieron en tubos heparinizados, se mantuvieron a 4 °C durante 30 min y luego se centrifugaron durante 15 min a 3.000 × g a 4 °C. Las muestras de plasma se recolectaron y almacenaron a -20 °C hasta su análisis.
2.3.4 Muestras de lechones recién nacidos
Al nacer, se sacrificaron para su muestreo un total de 12 lechones machos recién nacidos (n = 6 por grupo) de diferentes camadas, sin consumir calostro, con un peso corporal cercano a la media en cada tratamiento. Se extrajeron aproximadamente 10 ml de sangre de cada cerdo a través de la venopunción de la vena yugular. Las muestras de sangre se mantuvieron a 4 °C durante 30 min, se centrifugaron a 3.000 × g durante 15 min a 4 °C como se mencionó anteriormente. El contenido del colon se recogió en tubos estériles y se almacenó a -80 °C para el análisis del ARNr 16S. El yeyuno, el íleon, el ciego y los tejidos colónicos de los lechones se separaron en una mesa de trabajo estéril. A continuación, se seccionaron las porciones medias de estos tejidos, se congelaron inmediatamente en nitrógeno líquido y se almacenaron a -80 °C para la prueba cuantitativa de reacción en cadena de la polimerasa (qPCR). Mientras tanto, los segmentos intestinales (duodeno, yeyuno e íleon) se fijaron en paraformaldehído al 4% durante al menos 24 h, se deshidrataron, aclararon y se realizó inclusión en parafina. A continuación, se realizaron cortes seriados de 5 μm de espesor, a los que siguió la tinción con hematoxilina y eosina. Se prepararon dos secciones transversales de cada muestra intestinal (duodeno, yeyuno o íleon) en un portaobjetos para su análisis morfométrico. Se eligieron al azar y midieron un total de 12 a 20 unidades de criptas-vellosidades intactas y bien orientadas por muestra. Las mediciones de la altura de las vellosidades se tomaron desde la punta hasta la base de las vellosidades entre las vellosidades individuales, y la profundidad de las criptas se midió desde el valle entre las vellosidades individuales hasta la membrana basal. La profundidad de la cripta del intestino delgado (μm) y la altura de las vellosidades (μm) se midieron con el software de análisis de imágenes morfológicas JD801 (JEDA Science-Technology Development Co., Ltd., Nanjing, China), y luego se calculó la altura de las vellosidades/profundidad de la cripta (V/C) como la altura de las vellosidades dividida por la profundidad de la cripta.
2.4 Análisis de β-G fecal
Se utilizó un kit comercial de ELISA (Meimian, Jiangsu, China) para determinar la actividad fecal β-G. Las muestras de heces fueron pretratadas para cumplir con los requisitos del kit. En primer lugar, se añadieron 9 mL de solución salina tamponada con fosfato (PBS) a 1 g de heces y se homogeneizó mediante vórtice. A continuación, las mezclas se centrifugaron a 2.500 × g a 4°C durante 20 min para recoger los sobrenadantes. Finalmente, se midió la actividad de los sobrenadantes para β-G con un kit.
2.5 Análisis plasmático de 17β-estradiol
Se seleccionó un kit comercial de ELISA (R&D Company, EE.UU.) para medir la concentración de 17β-estradiol en el plasma de cerdas en el día 110 de gestación.
2.6 Cultivo y recuento de colonias planas vaginales de Lactobacillus
Dentro de una cabina de flujo laminar estéril, se extrajeron los hisopos previamente almacenados a -80 °C y se sumergieron en 10 ml de PBS preenfriado dentro de tubos de centrífuga de 15 ml durante 30 min para garantizar la elución completa de la secreción vaginal en hisopos. El líquido resultante se diluyó a 10−7 en PBS. A partir de esta dilución, se decantaron 10 μL en agar Man Rogosa Sharp (MRS) de 15 mL (Hopebiol, Qingdao, China) y posteriormente se incubaron anaeróbicamente a 37°C durante 72 h. Las condiciones anaeróbicas se conservaron utilizando bolsas de generación de atmósfera anaeróbica (Hopebiol, Qingdao, China) en frascos Anaero (Fisher, Hampton, NH, EE. UU.). Después de 72 h de incubación, se enumeraron las colonias resultantes y los recuentos se expresaron como logaritmos decimales de las unidades formadoras de colonias por mililitro (log UFC/mL).
2.7 Análisis microbiano
La diversidad microbiana se determinó como se describe en una investigación previa de nuestro grupo (21). En resumen, el ADN genómico bacteriano de las heces congeladas de las cerdas, los hisopos vaginales y el contenido del colon de los lechones recién nacidos se extrajeron utilizando el kit de ADN (Omega Bio-Tek, Norcross, GA, EE. UU.). Posteriormente, Majorbio Company (Shanghai, China) realizó la secuenciación y análisis de datos en la plataforma Illumina HiSeq 2000. La misma unidad taxonómica operativa (OTU) se definió como una similitud de secuencia que alcanzaba el 97%. La taxonomía de cada OTU se llevó a cabo con el programa clasificador Ribosomal Database Project (RDP) contra la base de datos de ARNr Silva 16S (Release138: http://www.arb-silva.de). Los datos categóricos se compararon mediante el cálculo de la diversidad α y la diversidad β. Se utilizaron los índices de Simpson y Shannon para determinar la diferencia de α-diversidad. Se utilizó el análisis de coordenadas principales (PCoA) basado en la matriz de distancia ponderada de Unifrac para resumir la β-diversidad (22, 23) Se utilizó el análisis de similitudes (Anosim) para acceder a las diferencias entre las comunidades microbianas. Todos los análisis, desde el agrupamiento hasta la diversidad de α y β, se realizaron en QIIME (V1.9.1) y se mostraron en el software R (V3.3.1).
Todos los conjuntos de datos de secuencias sin procesar obtenidos se han cargado en el archivo de lectura de secuencias (SRA) del NCBI con el número de acceso PRJNA754492.
2.8 Análisis de citoquinas inflamatorias plasmáticas
Se utilizaron kits comerciales de ELISA (MEIMIAN, Jiangsu, China) para determinar las concentraciones plasmáticas de IL-1β, IL-6, IL-10 y TNF-α de lechones recién nacidos siguiendo las instrucciones respectivas.
2.9 Medición de la expresión génica
Se utilizó una reacción en cadena de la polimerasa cuantitativa en tiempo real (qPCR) para analizar los niveles de expresión de ARNm de IL-1β, IL-6, IL-8, IL-10 y TNF-α en muestras intestinales de lechones. Las secuencias específicas de cebadores utilizadas para el análisis de PCR en tiempo real se enumeran en la Tabla complementaria 1. La β-actina se utilizó como control interno, coamplificada junto con los genes diana para facilitar la normalización y cuantificación de la expresión génica. Todas las muestras se midieron por duplicado. La abundancia relativa de ARNm de los genes detectados en las muestras intestinales se calculó con elΔΔCt método.
2.10 Análisis estadístico
Los datos mostrados en el estudio se expresaron como media ± error estándar de la media (SEM) o media con errores estándar de conglomerados. La actividad de las cerdas β-G fecal, el plasma de cerdas E2 y la expresión génica de citocinas en yeyuno, íleon, ciego y colon de lechones se analizaron mediante una prueba T de muestras independientes después de pruebas de normalidad. La significación estadística se evaluó mediante el programa SPSS 22.0 (IBM SPSS Company, Armonk, NY, USA), y se consideró estadísticamente significativo un valor de P < 0,05, mientras que 0,05 ≤ P < 0,10 se consideró una tendencia.
Al principio, se realizaron pruebas de normalidad en los datos microbianos. Si los datos se ajustan a la distribución normal, se utilizará la prueba t de Student para el análisis. De lo contrario, los análisis estadísticos de la abundancia relativa de la microbiota vaginal y fecal se realizarán con la prueba de suma de rangos de Wilcoxon con el paquete stats R (versión 3.3.1) y el paquete scipy de Python. Se consideró significación estadística para un valor de P < 0,05, mientras que 0,05 ≤ P < 0,10 se consideró una tendencia.
3 Resultados
3.1 Concentración de E2 en el plasma de la cerda
La concentración de E2 en el plasma de las cerdas del grupo pectina fue sustancialmente mayor que la del grupo control en el día 110 de gestación (P < 0,05, Figura 1A).
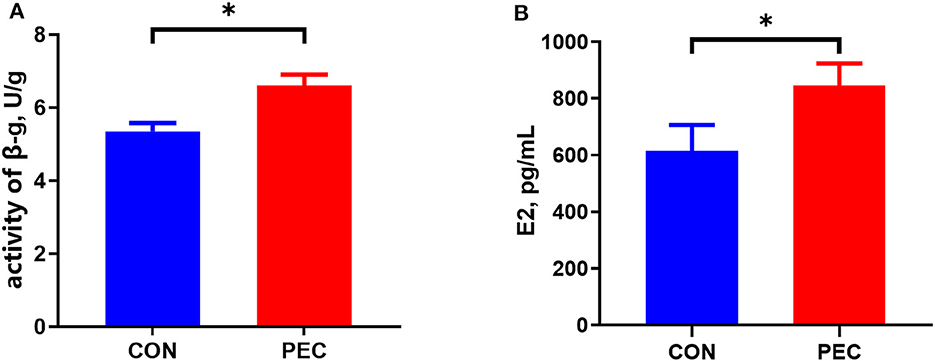 Figura 1. Efectos de la pectina dietética en dietas de cerdas gestantes sobre el E2 (A) plasmático y el β-G fecal (B). CON: grupo control; PEC: grupo pectina. n = 15. P < 0,05.*
Figura 1. Efectos de la pectina dietética en dietas de cerdas gestantes sobre el E2 (A) plasmático y el β-G fecal (B). CON: grupo control; PEC: grupo pectina. n = 15. P < 0,05.*
3.2 Actividad de la β-Glucuronidasa en heces de cerdas
La suplementación dietética con pectina para cerdas durante la gestación aumentó significativamente la actividad de β-G en las heces (P < 0,05, Figura 1B).
3.3 Cambios en la microbiota vaginal de las cerdas
Los cuatro primeros filos dominados fueron Firmicutes, Proteobacteria, Bacteroidota, y Actinobacteriota en ambos grupos (Figura 2A). Se crearon diagramas de barras (Figura 2B) para ilustrar la proporción de microbiota vaginal de las cerdas a nivel de género en el día 110 de gestación. El género Lactobacillus estuvo presente en un 5,72% en el grupo PEC, pero solo en un 1,85% en el grupo CON.
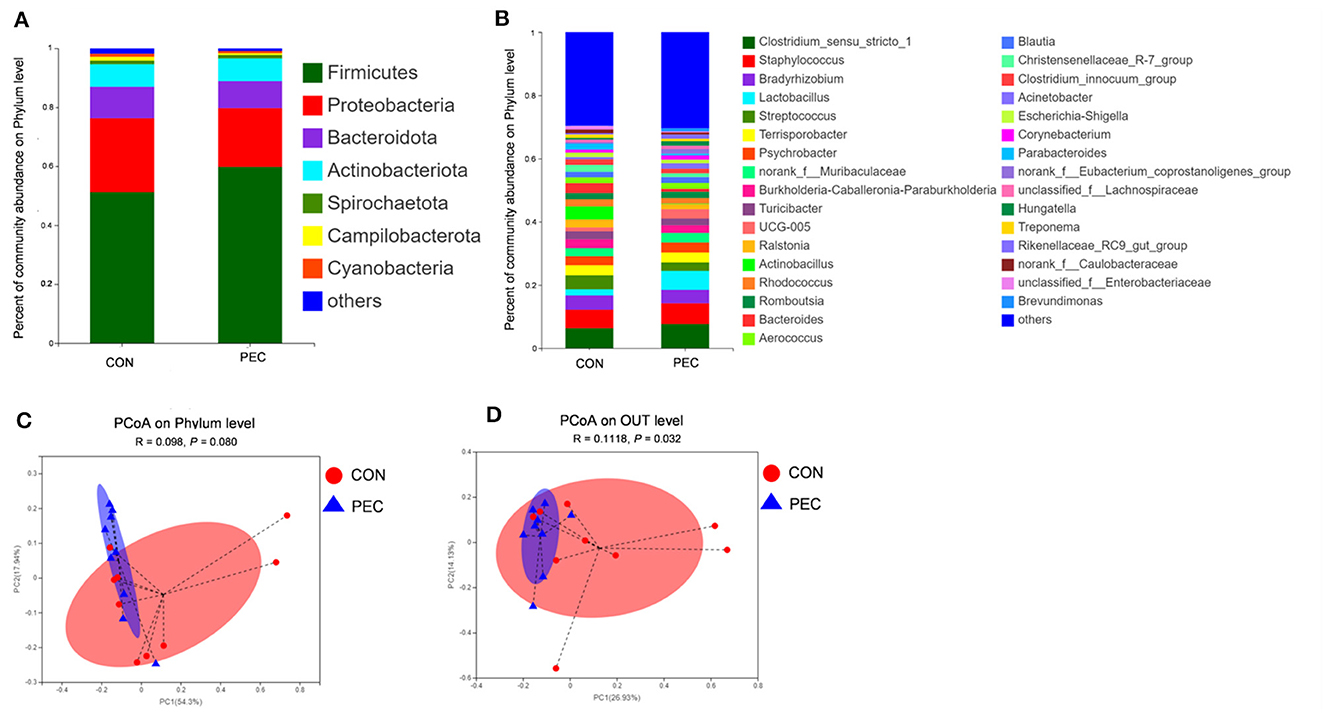 Figura 2. Comparación de la composición de la microbiota vaginal de las cerdas en el día 110 de gestación. (A) Diagrama de la abundancia relativa de la microbiota a nivel de filo y género (B). Perfil de PCoA de nivel de filo (C) y nivel de OTU (D) basado en la distancia Unifrac ponderada de las OTU en cada muestra en el día 110 de gestación. CON: grupo control; PEC: grupo pectina. n = 9.
Figura 2. Comparación de la composición de la microbiota vaginal de las cerdas en el día 110 de gestación. (A) Diagrama de la abundancia relativa de la microbiota a nivel de filo y género (B). Perfil de PCoA de nivel de filo (C) y nivel de OTU (D) basado en la distancia Unifrac ponderada de las OTU en cada muestra en el día 110 de gestación. CON: grupo control; PEC: grupo pectina. n = 9.
Se utilizó PCoA para analizar la β-diversidad entre muestras. No se observaron diferencias a nivel de filo, mientras que se encontraron diferencias significativas tanto a nivel de especie como a nivel de OTU (Figuras 2C, D). A los 110 días de gestación, la microbiota vaginal de las cerdas PEC era más cercana dentro del grupo, mientras que la distribución era más discreta en el grupo CON.
A nivel de filo, la verrugomicrobiota aumentó notablemente en PEC (P < 0,05, Tabla suplementaria 2), mientras que a nivel de género, la abundancia relativa de Lactobacillus (P < 0,05) y UCG-005 (P < 0,05) en la microbiota vaginal aumentó notablemente en las cerdas PEC en el día 110 de gestación (Tabla 2). A nivel de especie, la abundancia relativa de Lactobacillus amylovorus fue significativamente mayor (P < 0.01) en el grupo PEC que en el grupo CON. Por su parte, la abundancia de Lactobacillus reuteri y Lactobacillus salivarius también se incrementó significativamente (P < 0,05) en el grupo PEC que en el grupo CON (Figura 3).
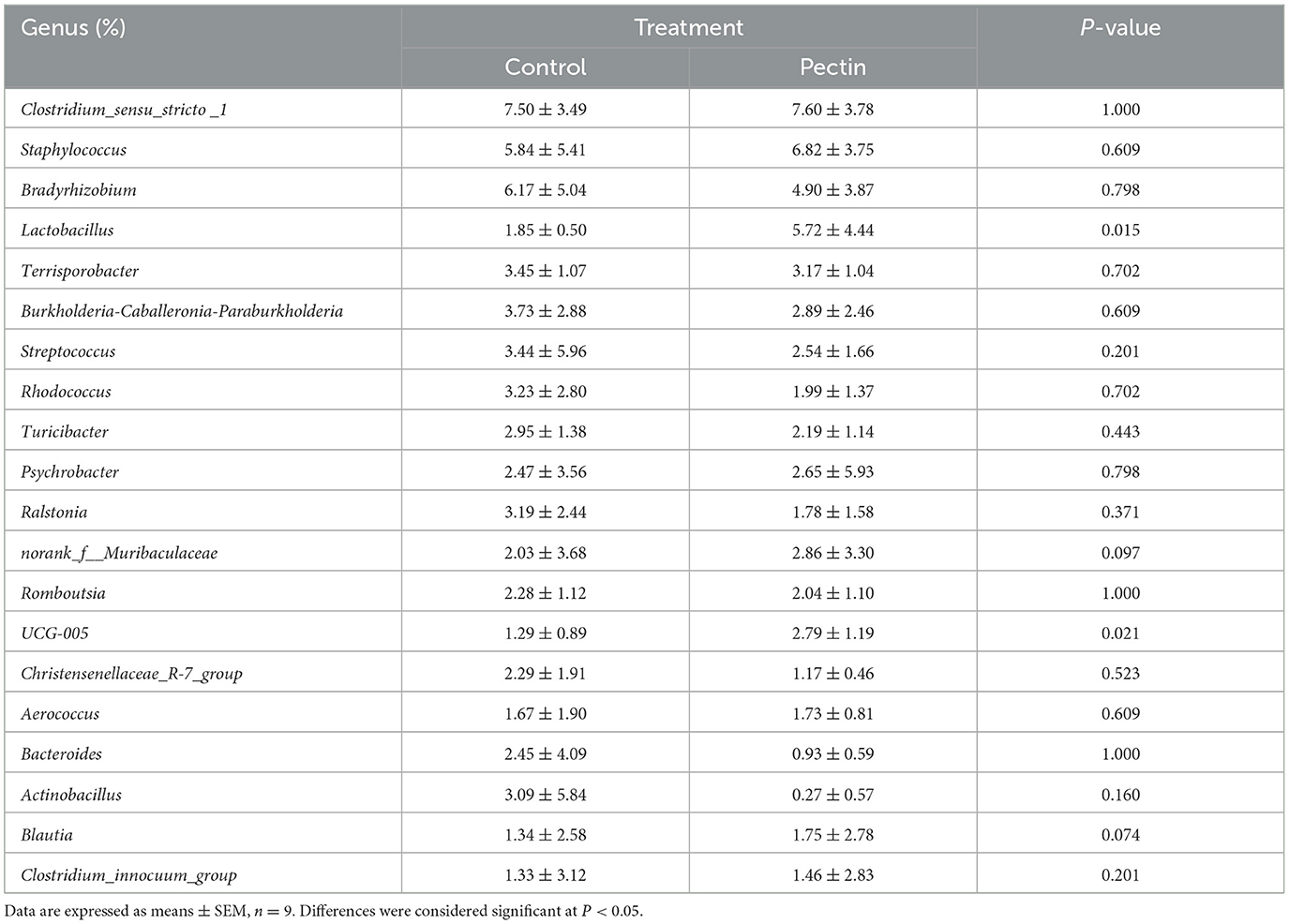 Tabla 2. Abundancia relativa de los 20 principales géneros bacterianos de la microbiota vaginal de las cerdas.
Tabla 2. Abundancia relativa de los 20 principales géneros bacterianos de la microbiota vaginal de las cerdas.
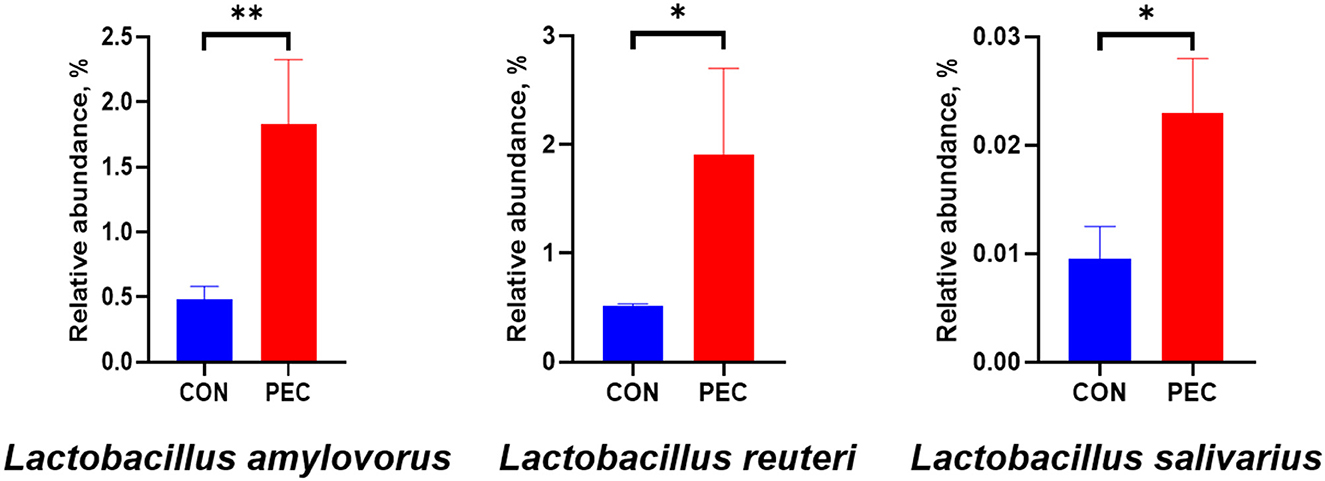 Figura 3. Abundancia relativa de Lactobacillus vaginal de cerda. CON: grupo control; PEC: grupo pectina. n = 9. P < 0,05, P < 0,01.***
Figura 3. Abundancia relativa de Lactobacillus vaginal de cerda. CON: grupo control; PEC: grupo pectina. n = 9. P < 0,05, P < 0,01.***
La abundancia relativa de Myroides odoratimimus, Actinobacillus rossii y Streptococcus Str.122 también fue significativamente menor en el grupo PEC que en el grupo CON (P < 0.05, Figura 4).
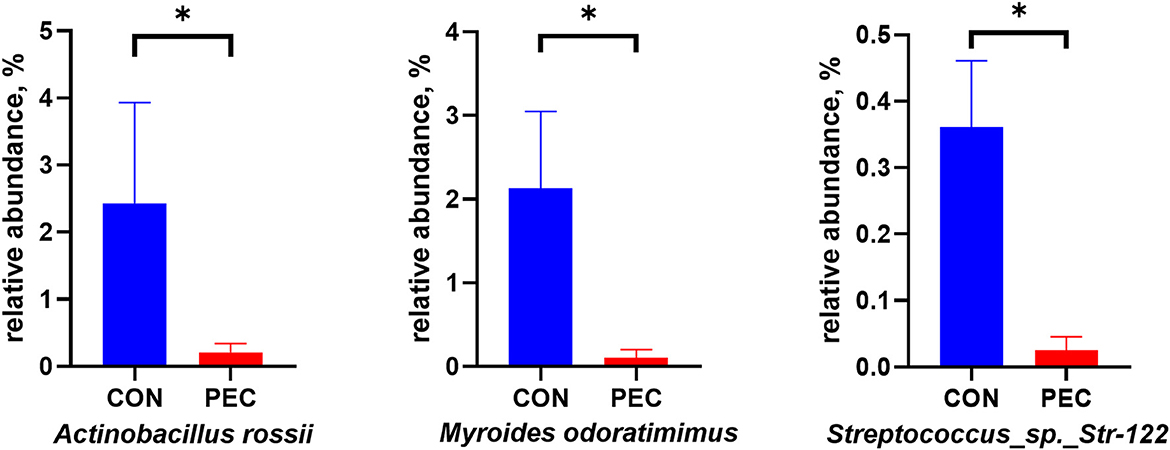 Figura 4. Abundancia relativa de bacterias patógenas en la microbiota de la vagina de la cerda. CON: grupo control; PEC: grupo pectina. n = 9. P < 0,05.*
Figura 4. Abundancia relativa de bacterias patógenas en la microbiota de la vagina de la cerda. CON: grupo control; PEC: grupo pectina. n = 9. P < 0,05.*
A través del cultivo de colonias planas y el conteo con agar MRS, se detectó la concentración de Lactobacillus vaginal en el grupo PEC significativamente mayor que en el grupo CON (P < 0.05, Figura 5).
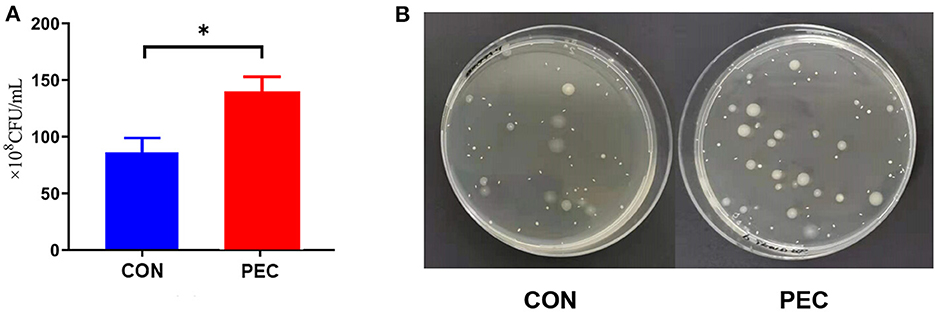 Figura 5. (A) Comparación del conteo de colonias planas. (B) Fotos de los pisos. CON: grupo control; PEC: grupo de la pectina; n = 9. P < 0,05.*
Figura 5. (A) Comparación del conteo de colonias planas. (B) Fotos de los pisos. CON: grupo control; PEC: grupo de la pectina; n = 9. P < 0,05.*
3.4 Rendimiento de crecimiento de los lechones lactantes
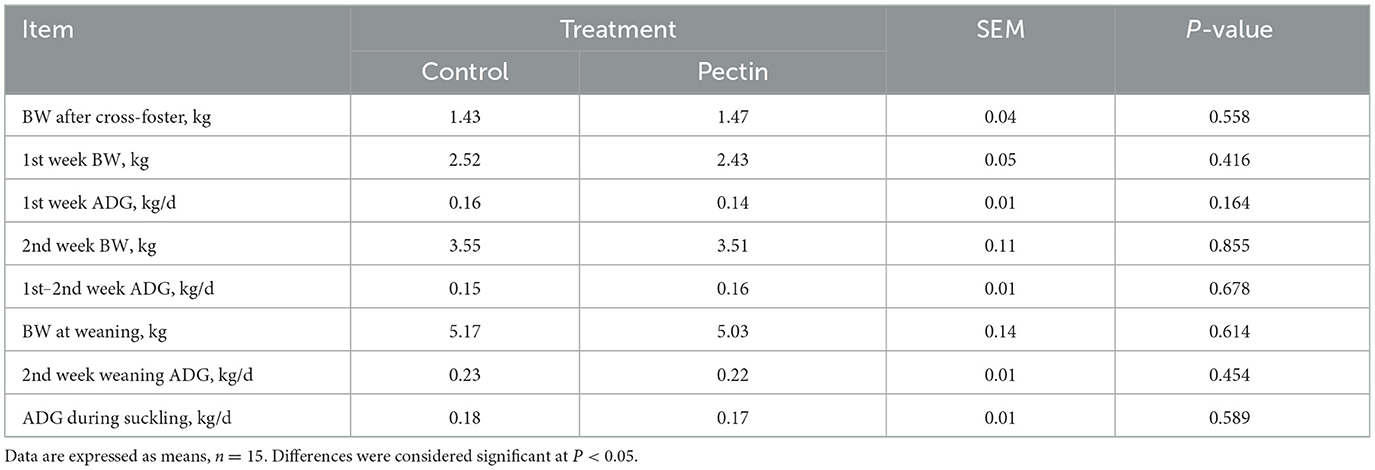
Como se muestra en la Tabla 3, no se determinaron diferencias en el rendimiento de crecimiento de los lechones lactantes entre tratamientos.
3.5 Cambios en la microbiota del colon de los lechones recién nacidos
La α diversidad de la microbiota del colon de los lechones recién nacidos se vio afectada significativamente por la suplementación materna con pectina. El índice de Simpson en el grupo PEC fue notablemente inferior al del grupo CON (P < 0,05, Figura 6A). Además, el índice de Shannon fue mayor en el grupo PEC que en el grupo CON (P < 0,1, Figura 6B).
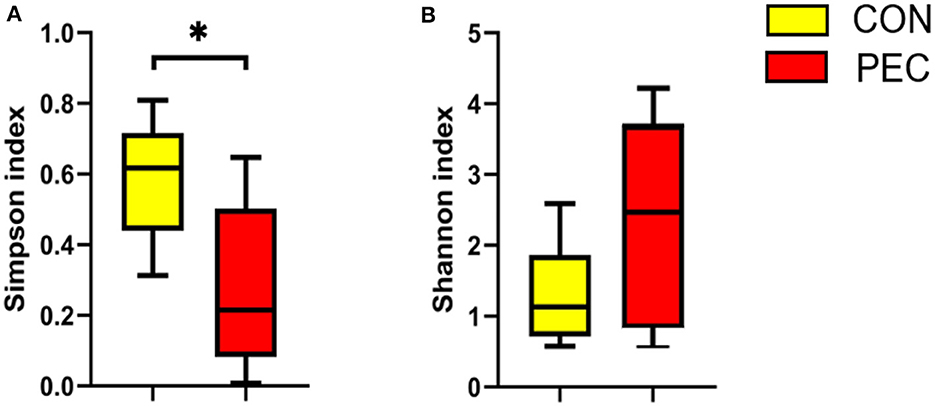 Figura 6. Efectos de la diversidad alfa de la microbiota del colon en lechones recién nacidos (n = 6). (A) Índice de Simpson. (B) Índice de Shannon. P < 0,05.*
Figura 6. Efectos de la diversidad alfa de la microbiota del colon en lechones recién nacidos (n = 6). (A) Índice de Simpson. (B) Índice de Shannon. P < 0,05.*
La composición microbiana en el colon de los lechones recién nacidos es obviamente diferente tanto a nivel de filo (Figura 7A) como de especie (Figura 7B). La diversidad beta, evaluada por PCoA basada en la distancia Unifrac ponderada, reveló que la microbiota del colon de los lechones recién nacidos formaba un conglomerado bien definido y se observó una separación evidente a nivel del filo (P = 0,050, Figura 7C). Sin embargo, el resultado a nivel de especie no mostró diferencias (P > 0.1, Figura 7D).
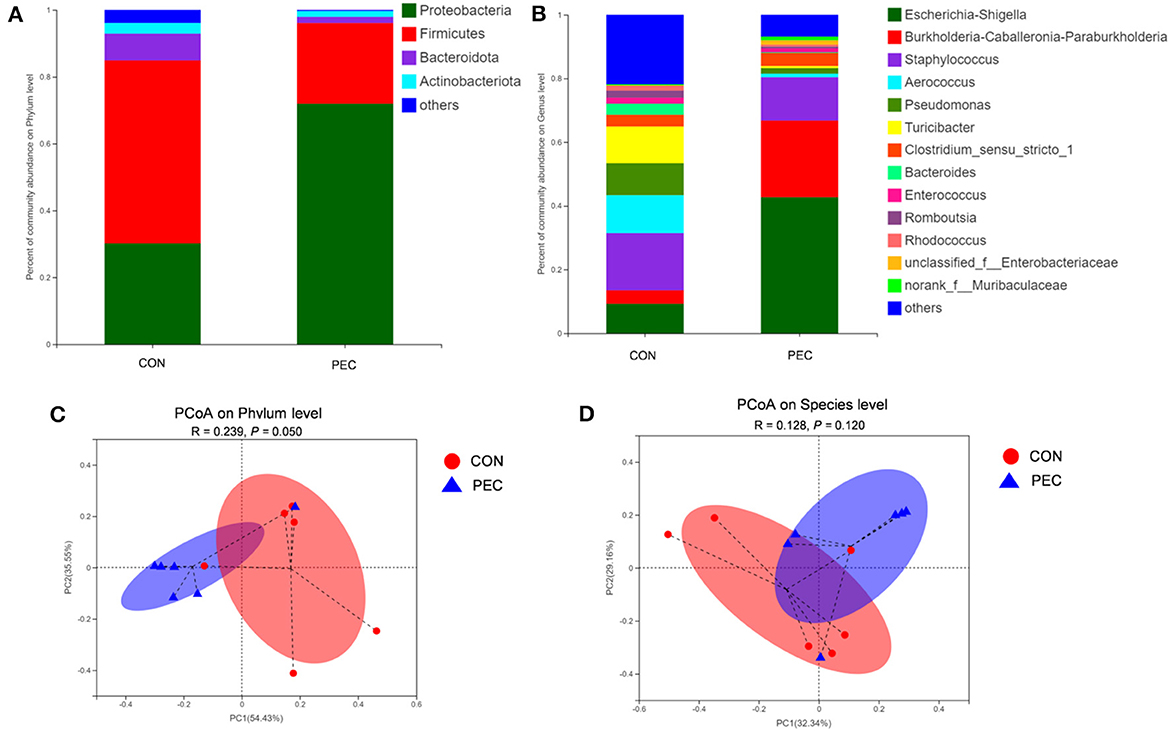 Figura 7. Comparación de la composición de géneros en el contenido de colon de lechones neonatos. Diagrama de la abundancia relativa de la microbiota a nivel de filo (A), nivel de género (B), nivel de filo (C) y nivel de especie (D). Perfil de PCoA basado en la distancia Unifrac ponderada de las OTU en cada muestra. CON: grupo control; PEC: grupo pectina. n = 6.
Figura 7. Comparación de la composición de géneros en el contenido de colon de lechones neonatos. Diagrama de la abundancia relativa de la microbiota a nivel de filo (A), nivel de género (B), nivel de filo (C) y nivel de especie (D). Perfil de PCoA basado en la distancia Unifrac ponderada de las OTU en cada muestra. CON: grupo control; PEC: grupo pectina. n = 6.
A nivel de filo, la abundancia relativa de Proteobacteria en el colon de los lechones fue significativamente menor en el grupo PEC, mientras que la abundancia relativa de Firmicutes tendió a ser mayor que en el grupo CON (Tabla 4).
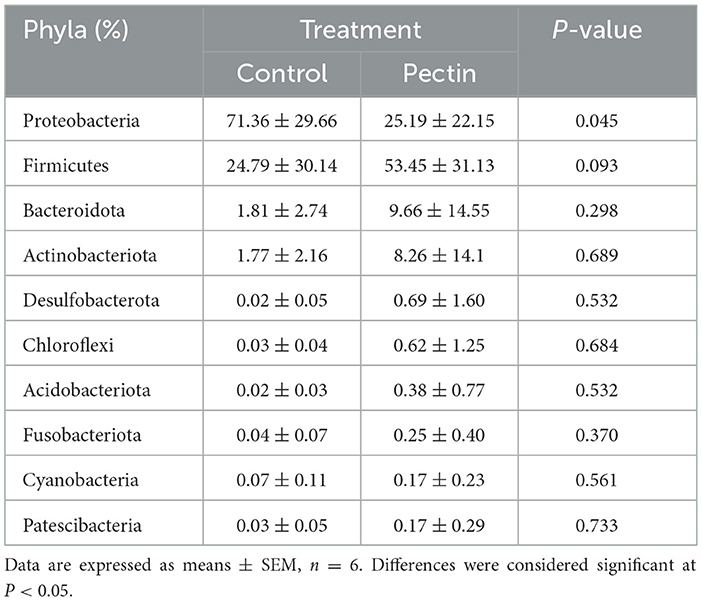 Tabla 4. Abundancia relativa de los principales filos bacterianos en el colon de lechones recién nacidos.
Tabla 4. Abundancia relativa de los principales filos bacterianos en el colon de lechones recién nacidos.
3.6 Cambios en las citoquinas inflamatorias plasmáticas del lechón recién nacido
La concentración de IL-6 en el plasma de los lechones recién nacidos disminuyó notablemente en el grupo PEC que en el grupo CON (P < 0,05, Figura 8).
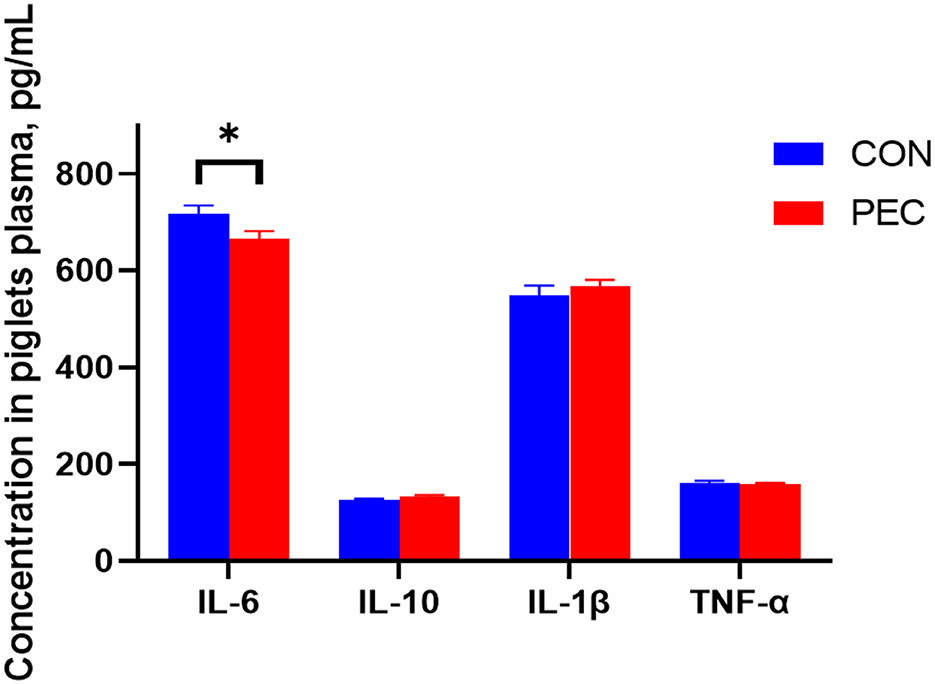 Figura 8. Efectos de la pectina dietética en dietas de cerdas gestantes sobre las citoquinas inflamatorias plasmáticas de lechones recién nacidos. IL-1β: Interleucina 1β; IL-6: Interleucina 6; IL-10, interleucina 10; TNF-α, factor de necrosis tumoral alfa. Los valores son la media ± error estándar. n = 6. P < 0,05.*
Figura 8. Efectos de la pectina dietética en dietas de cerdas gestantes sobre las citoquinas inflamatorias plasmáticas de lechones recién nacidos. IL-1β: Interleucina 1β; IL-6: Interleucina 6; IL-10, interleucina 10; TNF-α, factor de necrosis tumoral alfa. Los valores son la media ± error estándar. n = 6. P < 0,05.*
3.7 Cambios en la expresión relativa de ARNm en intestinos de lechones recién nacidos
En la Figura 9 se muestran los efectos de la suplementación con pectina en la dieta gestacional sobre la expresión relativa de ARNm de citoquinas en el intestino de los lechones. En yeyuno no se detectaron diferencias (Figura 9A). Pero en íleon, se encontró que la expresión relativa de ARNm de TNF-α fue significativamente mayor en el grupo CON que en el grupo PEC (P < 0,05; Figura 9B). La expresión relativa de ARNm de IL-10 en el ciego fue notablemente mayor en el grupo PEC que en el grupo CON (P < 0,01). Se encontró que la IL-1β se expresó menor en el grupo PEC en comparación con el grupo CON (P < 0,05; Figura 9C). La expresión relativa de TNF-α en el colon (Figura 9D) fue significativamente menor (P < 0,05) en el grupo PEC que en el grupo CON, mientras que en el grupo CON, la expresión de IL-10 fue mayor (P < 0,1).
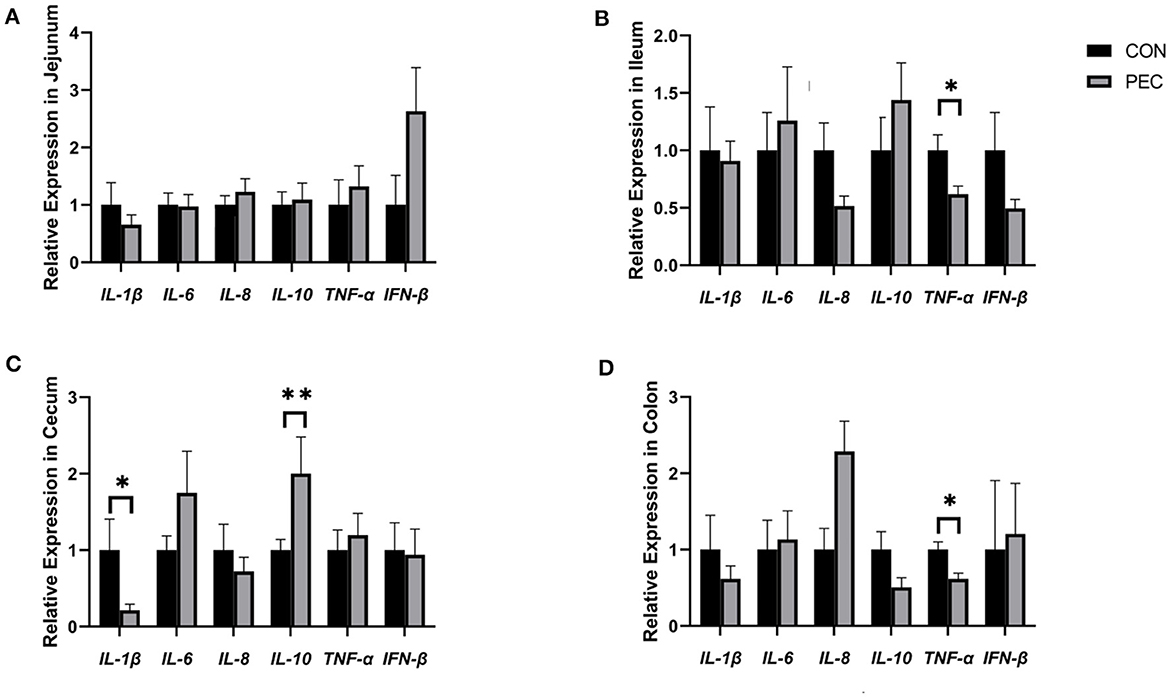 Figura 9. Efectos de la expresión relativa de ARNm de citocinesis intestinal de lechones: (A) yeyuno; B) íleon; (C) ciego; (D) dos puntos. IL-1β: Interleucina 1β; IL-6: Interleucina 6; IL-8, interleucina 8; IL-10, interleucina 10; TNF-α, Factor de Necrosis Tumoral alfa; IFN-β, Interferón-beta; CON, recién nacido del control; PEC, recién nacido de pectina. Los valores son la media ± error estándar. n = 6. P < 0,05, P < 0,01.***
Figura 9. Efectos de la expresión relativa de ARNm de citocinesis intestinal de lechones: (A) yeyuno; B) íleon; (C) ciego; (D) dos puntos. IL-1β: Interleucina 1β; IL-6: Interleucina 6; IL-8, interleucina 8; IL-10, interleucina 10; TNF-α, Factor de Necrosis Tumoral alfa; IFN-β, Interferón-beta; CON, recién nacido del control; PEC, recién nacido de pectina. Los valores son la media ± error estándar. n = 6. P < 0,05, P < 0,01.***
3.8 Cambios en el desarrollo intestinal de los lechones recién nacidos
Los resultados de las mediciones morfométricas en duodeno, yeyuno e íleon en lechones recién nacidos se muestran en la Tabla 5. La altura de las vellosidades y la relación V/C del duodeno, íleon y yeyuno en el grupo PEC fue extremadamente significativamente mayor que en el grupo CON (P < 0,001). La profundidad de la cripta del íleon en el grupo CON fue mayor que en el grupo PEC (P < 0,1). Mientras tanto, el grosor de la capa muscular del duodeno en el grupo PEC fue marcadamente mayor que en el grupo CON (P < 0,05).
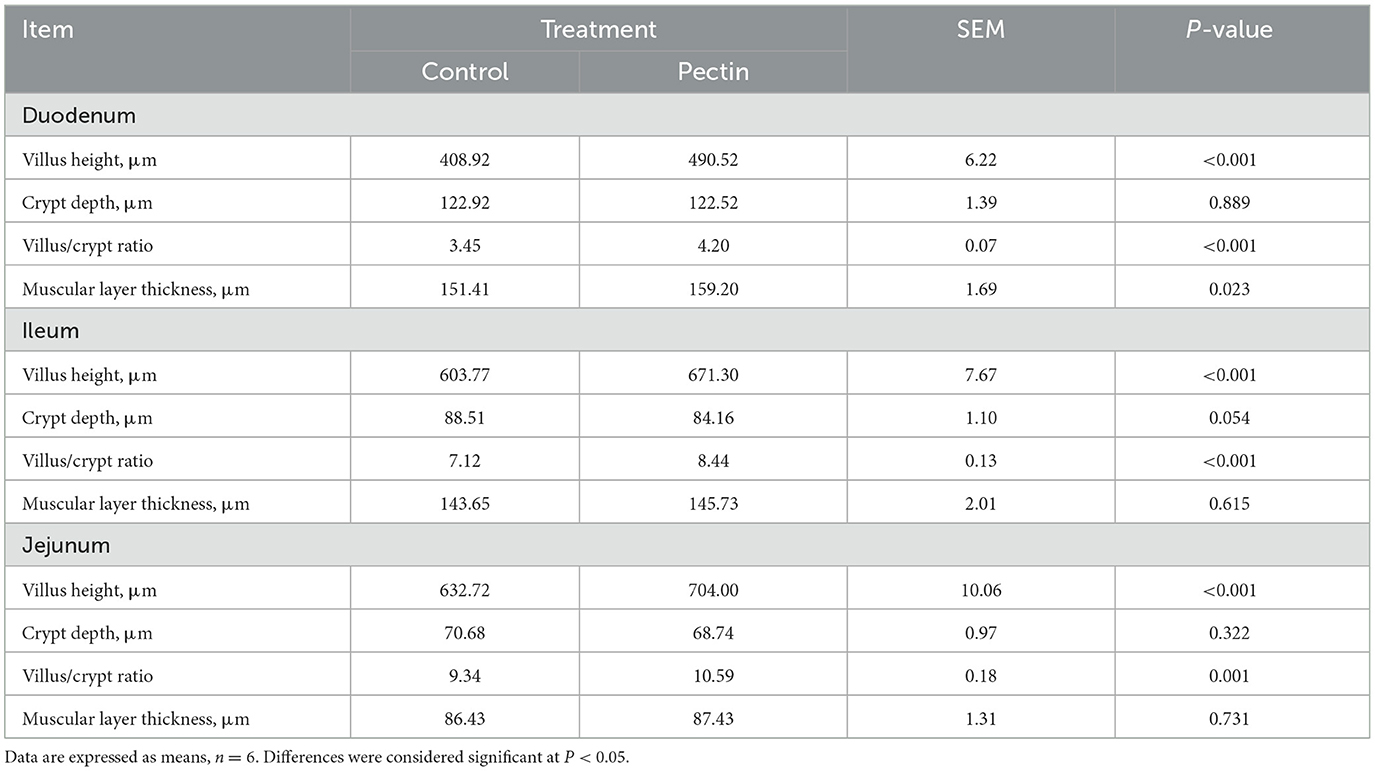 Tabla 5. Efectos de las medidas morfométricas en duodeno, yeyuno e íleon en lechones recién nacidos.
Tabla 5. Efectos de las medidas morfométricas en duodeno, yeyuno e íleon en lechones recién nacidos.
4 Discusión
4.1 β-G y E2 influenciados por la suplementación con pectina en la dieta
El estroboloma se ha definido como el repertorio de genes de la microbiota intestinal que son capaces de regular los estrógenos. Los estrógenos conjugados existentes en el intestino pueden ser desconjugados por bacterias secretadas β-G en estrógeno, que será reabsorbido a través de las células epiteliales al torrente sanguíneo (24, 25) y distribuido a diferentes órganos distantes como el epitelio en la vagina (26). Microorganismos como Faecalibacterium prausnitzii, Ruminococcus, Clostridium, etc., demostraron su capacidad para producir β-G (27-30). El aumento observado en la actividad fecal de β-G dentro del grupo de pectina corrobora nuestra hipótesis. Este hallazgo se alinea con Licht et al. (19), quienes demostraron que la incorporación de un 7% de pectina de manzana en la dieta de ratas durante 14 semanas eleva sustancialmente la actividad de β-G en las heces de ratas. De manera similar, otros investigadores (18) sostuvieron que en presencia de un complejo pectina-proteína aislado de repollo, la actividad de β-G aumentó significativamente in vitro. Además, se ha informado que la adición de aleurona de harina de trigo, una fibra dietética fermentable procedente de la capa externa de los granos de trigo, aumenta significativamente la actividad de β-G en el ciego de las ratas (12).
En nuestro estudio, observamos un aumento significativo de la concentración de estradiol (E2) en plasma en el día 110 de gestación con la suplementación de pectina a las cerdas durante la gestación. La elevación de los niveles de E2 puede estar influenciada por la actividad del β-G, que se ha visto modificada por las alteraciones de la microbiota intestinal mencionadas. Esto está en línea con los hallazgos en mujeres posmenopáusicas, quienes, a pesar de que sus ovarios no producen estrógenos, exhiben concentraciones más altas de E2 en sangre cuando sus dietas son ricas en fibra soluble (31). Por el contrario, algunos estudios han demostrado que el aumento de la composición de fibra en las dietas puede reducir el nivel de E2 libre en el torrente sanguíneo (32-34). Esta teoría es plausible ya que la ingesta de fibra puede aumentar el volumen de las heces, facilitando la excreción prematura de metabolitos de estrógenos conjugados que se originan en la circulación enterohepática. Por ejemplo, Jiang (35) informó que la ingesta de fibra cruda puede aumentar notablemente la concentración de E2 libre en las heces, pero no en la saliva, lo que indica que la ingesta de fibra podría facilitar la desconjugación de E2 en el intestino posterior, pero el estrógeno se excretó en las heces expandidas como resultado de la fibra insoluble antes de ser reabsorbido en el torrente sanguíneo.
4.2 La ingestión de pectina aumentó Lactobacillus en la vagina
Durante el embarazo, E2 no solo puede mantener el estado de embarazo, sino también mejorar la microbiota vaginal para que esté dominada por Lactobacillus. Los niveles elevados de E2 promueven la maduración y el depósito de glucógeno en las células epiteliales vaginales. El glucógeno de las células epiteliales exfoliadas y lisadas es catabolizado por la α-amilasa en la luz vaginal a polímeros más pequeños que posteriormente son metabolizados a ácido láctico por Lactobacillus. El ácido láctico acidifica el medio vaginal, favoreciendo la proliferación de Lactobacillus e inhibiendo el crecimiento de microorganismos asociados a infecciones (36-40). Por lo tanto, algunos estudios tuvieron como objetivo mejorar los microbios vaginales durante el embarazo a través de métodos de nutrición. Yang (41) intentó mejorar la microbiota vaginal de las mujeres embarazadas administrándoles Lactobacillus rhamnosus GR-1 y Lactobacillus reuteri RC-14 por vía oral, pero se comprobó que eran ineficaces para aumentar los microbios. Sin embargo, se sugirió que el suministro de Lactobacillus rhamnosus GR-1 y Lactobacillus reuteri RC-14 en cápsulas a mujeres embarazadas reduce significativamente la colonización vaginal por Streptococcus agalactiae (42). Sin embargo, casi todos los estudios anteriores solo proporcionaron probióticos directamente a mujeres embarazadas y no analizaron los efectos de los prebióticos no microbianos sobre la microbiota vaginal, mientras que el presente estudio indica que es posible aumentar la abundancia relativa de Lactobacillus en la vagina de las cerdas con una dieta suministrada con pectina.
También se encontró que dos especies de bacterias se redujeron notablemente en la vagina en el grupo PEC. Myroides odoratimimus se asocia con la inflamación del tracto urinario en humanos (43, 44), lo que indica que el suministro de pectina a las cerdas durante la gestación puede disminuir el riesgo de inflamación del tracto urinario. Mayor et al. (45) certificaron que Actinobacillus rossii fue aislado de lechones abortados, útero y secreción vaginal desde 1989 en EE.UU. Holyoake y Thompson (46) también aislaron A. rossii de un lechón abortado, lo que significa que estos abortos son probablemente causados por A. rossii, o podría haber alguna relación entre el aborto y A. rossii. Por lo tanto, exploramos más a fondo la salud intestinal de la nueva generación de lechones.
4.3 La suplementación con pectina durante el embarazo mejora la microbiota intestinal de la descendencia
Proporcionar una dieta que contenga pectina a las cerdas durante la gestación tiene un impacto significativo en la diversidad microbiana del colon y su composición en los lechones recién nacidos. En comparación con el grupo CON, la flora colónica de los lechones en PEC tiene un índice de Shannon más alto y un índice de Simpson más bajo, lo que significa una mayor diversidad microbiana. La β diversidad de la microbiota colónica de los lechones de cada grupo se encontró con una discriminación significativa a través del PCoA. La abundancia relativa del filo Proteobacteria y de las especies Escherichia-Shigella, ambas generalmente consideradas como bacterias dañinas, fue menor en el grupo PEC que en el grupo CON. Además, los estudios han demostrado que parte de la microbiota vaginal de la madre será colonizada en los intestinos de la descendencia a través del parto vaginal (47). Y en las cerdas y lechones, el modo de parto y la nutrición temprana modulan la colonización microbiana (48). Esto sugiere que si la madre tiene una microbiota vaginal dominada por probióticos antes de dar a luz, la microbiota del intestino del recién nacido puede estar colonizada por probióticos y puede proporcionar una mejor condición a la descendencia. Sorprendentemente, se encontró que Streptococcus_suis enriquecido en la vagina de las cerdas CON era notablemente mayor en el colon de la descendencia CON, pero los Lactobacillus, que también estaban notablemente enriquecidos en la vagina de las cerdas en el grupo PEC, no mostraron ninguna diferencia en el colon de los lechones de ambos grupos. Esto puede indicar que la transmisión de microorganismos entre cerdas y lechones no depende totalmente del contacto con el moco vaginal durante el parto vaginal. Recientemente, la secuenciación ha indicado que la placenta y la sangre del cordón umbilical no son estériles, y que la microbiota dentro del meconio del neonato comparte una similitud significativa con la de la placenta, lo que sugiere que la transferencia materna de microbiota es posible y podría ocurrir durante la gestación (49-51). Por lo tanto, la microbiota materna desempeña un papel vital en la composición de la flora intestinal de las crías.
4.4 La suplementación con pectina mejora el desarrollo y la capacidad antiinflamatoria de los lechones recién nacidos
Se sabe que la nutrición materna tiene un impacto en el desarrollo del intestino (52), y la morfología del intestino sirve como un indicador clave de su salud. La altura de las vellosidades, en particular, juega un papel crucial en la determinación de la capacidad de absorción de nutrientes del intestino delgado. La relación entre la altura de las vellosidades y la profundidad de las criptas (V/C) se considera una medida fiable para evaluar el potencial de absorción de nutrientes del intestino delgado. En este estudio, los hijos de madres suplementadas con pectina durante el embarazo mostraron un aumento de la altura de las vellosidades y de la relación V/C, lo que sugiere una mayor capacidad para absorber nutrientes. Del mismo modo, las investigaciones existentes indican que las dietas maternas ricas en fibra soluble durante la gestación pueden alterar la microbiota intestinal, mejorar el rendimiento del crecimiento y reducir la permeabilidad intestinal en los lechones (53).
La evidencia acumulada indica que la inflamación materna también tiene consecuencias a largo plazo para la descendencia al afectar el ambiente intrauterino (54). En el presente estudio, encontramos que los lechones del grupo PEC exhibieron niveles plasmáticos más bajos de IL-6. La IL-6 es una citoquina pleiotrópica que participa en la fisiología de prácticamente todos los sistemas de órganos (55). No solo podemos encontrar el cambio de citoquinas inflamatorias en el plasma del lechón sino también en su intestino. Aunque no se encontraron diferencias en el yeyuno, poco a poco fueron surgiendo del íleon. Se cree que la mejora de la función inmune intestinal de los lechones recién nacidos está mediada por microorganismos (56, 57). Un estudio mostró un resultado similar de una dieta materna de fibra soluble que aumenta las concentraciones plasmáticas de factores antiinflamatorios, IL-10, en la descendencia, y se encontró que tanto las cerdas como los lechones tenían niveles plasmáticos más bajos de TNF-α con la ingesta de fibra soluble (21).
5 Conclusión
En primer lugar, la suplementación dietética con pectina puede ser beneficiosa para sembrar la microbiota vaginal y aumentar la abundancia relativa de Lactobacillus. En segundo lugar, la suplementación con pectina para cerdas durante la gestación puede mejorar el desarrollo y la capacidad antiinflamatoria del intestino de los lechones recién nacidos.
Declaración de disponibilidad de datos
Todos los conjuntos de datos de secuencias sin procesar obtenidos se han cargado en el Archivo de Lectura de Secuencias (SRA) del NCBI con el número de acceso: PRJNA754492.
Declaración ética
El estudio en animales fue aprobado por el Comité de Cuidado y Uso de Animales de la Universidad Agrícola de Sichuan. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
JH: Escritura – borrador original, Escritura – revisión y edición. JZ: Escritura, revisión y edición. YH: Escritura – revisión y edición. SL: Redacción – revisión y edición. LH: Escritura – revisión y edición. XJ: Escritura – revisión y edición. LC: Escritura – revisión y edición. ZF: Redacción – revisión y edición. BF: Escritura, revisión y edición. YL: Redacción – revisión y edición. SX: Escritura – revisión y edición. JL: Escritura – revisión y edición. DW: Redacción – revisión y edición, Obtención de fondos, Redacción – borrador original.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Esta investigación fue financiada por la Fundación Nacional de Ciencias Naturales de China (No. 31872372).
Reconocimientos
Nos gustaría agradecer al personal de nuestro laboratorio por su continua asistencia.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
The Supplementary Material for this article can be found online at: https://www.frontiersin.org/articles/10.3389/fvets.2024.1392399/full#supplementary-material
Referencias
1. Oakley BB, Fiedler TL, Marrazzo JM, Fredricks DN. Diversity of human vaginal bacterial communities and associations with clinically defined bacterial vaginosis. Appl Environ Microbiol. (2008) 74:4898–909. doi: 10.1128/AEM.02884-07
2. Lamont RF, Sobel JD, Akins RA, Hassan SS, Chaiworapongsa T, Kusanovic JP, et al. The vaginal microbiome: new information about genital tract flora using molecular based techniques. Int J Obstetr Gynaecol. (2011) 118:533–49. doi: 10.1111/j.1471-0528.2010.02840.x
3. Sheldon IM, Cronin J, Goetze L, Donofrio G, Schuberth HJ. Defining postpartum uterine disease and the mechanisms of infection and immunity in the men women reproductive tract in cattle. Biol Reprod. (2009) 81:1025–32. doi: 10.1095/biolreprod.109.077370
4. Xu S, Dong Y, Shi J, Li Z, Che L, Lin Y, et al. Responses of vaginal microbiota to dietary supplementation with lysozyme and its relationship with rectal microbiota and sow performance from late gestation to early lactation. Animals. (2021) 11:593. doi: 10.3390/ani11030593
5. Kiefer ZE, Koester LR, Showman L, Studer JM, Chipman AL, Keating AF, et al. Vaginal microbiome and serum metabolite differences in late gestation commercial sows at risk for pelvic organ prolapse. Sci Rep. (2021) 11:6189–6189. doi: 10.1038/s41598-021-85367-3
6. Tachedjian G, Aldunate M, Bradshaw CS, Cone RA. The role of lactic acid production by probiotic Lactobacillus species in vaginal health. Res Microbiol. (2017) 168:1. doi: 10.1016/j.resmic.2017.04.001
7. Vaneechoutte M. The human vaginal microbial community. Res Microbiol. (2017) 168:1. doi: 10.1016/j.resmic.2017.08.001
8. Petrova MI, Reid G, Vaneechoutte M, Lebeer S. Lactobacillus iners: friend or foe? J Trends Microbiol. (2017) 25:182. doi: 10.1016/j.tim.2016.11.007
9. Baker J, Al-Nakkash L, Herbst-Kralovetz M. Estrogen-gut microbiome axis: physiological and clinical implications. Maturitas. (2017) 103:25. doi: 10.1016/j.maturitas.2017.06.025
10. Ervin S, Li H, Lim L, Roberts L, Liang X, Mani S, et al. Gut microbiome-derived β-glucuronidases are components of the estrobolome that reactivate estrogens. J Biol Chem. (2019) 294:jbc.RA119.010950. doi: 10.1074/jbc.RA119.010950
11. Shivakoti R, Tuddenham S, Caulfield LE, Murphy C, Robinson C, Ravel J, et al. Dietary macronutrient intake and molecular-bacterial vaginosis: role of fiber. Clin Nutr. (2020) 39:3066–71. doi: 10.1016/j.clnu.2020.01.011
12. McIntosh GH, Royle PJ, Pointing G. Wheat aleurone flour increases cecal beta-glucuronidase activity and butyrate concentration and reduces colon adenoma burden in azoxymethane-treated rats. J Nutr. (2001) 131:127–31. doi: 10.1093/jn/131.1.127
13. Chung WS, Walker AW, Louis P, Parkhill J, Vermeiren J, Bosscher D, et al. Modulation of the human gut microbiota by dietary fibres occurs at the species level. BMC Biol. (2016) 14:3. doi: 10.1186/s12915-015-0224-3
14. Jiang T, Gao X, Wu C, Tian F, Lei Q, Bi J, et al. Apple-derived pectin modulates gut microbiota, improves gut barrier function, and attenuates metabolic endotoxemia in rats with diet-induced obesity. Nutrients. (2016) 8:126. doi: 10.3390/nu8030126
15. Tian L, Bruggeman G, van den Berg M, Borewicz K, Scheurink AJ, Bruininx E, et al. Effects of pectin on fermentation characteristics, carbohydrate utilization, and microbial community composition in the gastrointestinal tract of weaning pigs. Mol Nutr Food Res. (2017) 61:186. doi: 10.1002/mnfr.201600186
16. Wu W, Zhang L, Xia B, Tang S, Xie J, Zhang H. Modulation of pectin on mucosal innate immune function in pigs mediated by gut microbiota. Microorganisms. (2020) 8:40535. doi: 10.3390/microorganisms8040535
17. Borisenkov M, Bakutova L, Latkin D, Golovchenko V, Vityazev F. Interaction of microbial beta-glucuronidase with vegetable pectins. J Agric Food Chem. (2011) 59:9922–6. doi: 10.1021/jf202307r
18. Borisenkov MF, Bakutova LA, Golovchenko VV, Vityazev FV, Patova OA, Ponomareva SA, et al. Impact of cabbage pectin-protein complex on microbial β-glucuronidase activity. J Agric Food Chem. (2013) 61:3054–8. doi: 10.1021/jf305537x
19. Licht TR, Hansen M, Bergström A, Poulsen M, Krath BN, Markowski J, et al. Effects of apples and specific apple components on the cecal environment of conventional rats: role of apple pectin. BMC Microbiol. (2010) 10:13. doi: 10.1186/1471-2180-10-13
20. National Research Council. Nutrient Requirements of Swine: Eleventh Revised Edition. Washington, DC: The National Academies Press (2012).
21. Li Y, Liu H, Zhang L, Yang Y, Lin Y, Zhuo Y, et al. Maternal dietary fiber composition during gestation induces changes in offspring antioxidative capacity, inflammatory response, and gut microbiota in a sow model. Int J Mol Sci. (2019) 21:31. doi: 10.3390/ijms21010031
22. Segata N, Izard J, Waldron L, Gevers D, Miropolsky L, Garrett W, et al. Metagenomic biomarker discovery and explanation. Genome Biol. (2011) 12:R60. doi: 10.1186/gb-2011-12-6-r60
23. Xu C, Chuanshang C, Zhang X, Peng J. Inclusion of soluble fiber in the gestation diet changes the gut microbiota, affects plasma propionate and odd-chain fatty acids levels, and improves insulin sensitivity in sows. Int J Mol Sci. (2020) 21:635. doi: 10.3390/ijms21020635
24. Plottel C, Blaser M. Microbiome and malignancy. Cell Host Microbe. (2011) 10:324–35. doi: 10.1016/j.chom.2011.10.003
25. Shin JH, Park YH, Sim M, Kim SA, Joung H, Shin DM. Serum level of sex steroid hormone is associated with diversity and profiles of human gut microbiome. Res Microbiol. (2019) 170:192–201. doi: 10.1016/j.resmic.2019.03.003
26. Laborda-Illanes A, Sánchez-Alcoholado L, Dominguez-Recio M, Jimenez-Rodriguez B, Lavado R, Comino-Méndez I, et al. Breast and gut microbiota action mechanisms in breast cancer pathogenesis and treatment. Cancers. (2020) 12:2465. doi: 10.3390/cancers12092465
27. Dabek M, McCrae S, Currie V, Duncan S, Louis P. Distribution of Î2-glucosidase and Î2-glucuronidase activity and of Î2-glucuronidase gene gus in human colonic bacteria. FEMS Microbiol Ecol. (2008) 66:487–95. doi: 10.1111/j.1574-6941.2008.00520.x
28. Karine G, Berteau O, Oumami H, Béguet F, Leclerc M, Dore J. A metagenomic -glucuronidase uncovers a core adaptive function of the human intestinal microbiome. Proc Natl Acad Sci U S A. (2011) 108(Suppl1):4539–46. doi: 10.1073/pnas.1000066107
29. McIntosh F, Maison N, Holtrop G, Young P, Currie V, Ince J, et al. Phylogenetic distribution of genes encoding β-glucuronidase activity in human colonic bacteria and the impact of diet on faecal glycosidase activities. Environ Microbiol. (2012) 14:1876–87. doi: 10.1111/j.1462-2920.2012.02711.x
30. Zhu B, Han GZ, Shim JY, Wen Y, Jiang XR. Quantitative structure-activity relationship of various endogenous estrogen metabolites for human estrogen receptor α and β subtypes: insights into the structural determinants favoring a differential subtype binding. Endocrinology. (2006) 147:4132–50. doi: 10.1210/en.2006-0113
31. Monroe K, Murphy S, Henderson B, Kolonel L, Stanczyk F, Adlercreutz H, et al. Dietary fiber intake and endogenous serum hormone levels in naturally postmenopausal Mexican American women: the multiethnic cohort study. Nutr Cancer. (2007) 58:127–35. doi: 10.1080/01635580701327935
32. Aubertin-Leheudre M, Gorbach S, Woods M, Dwyer JT, Goldin B, Adlercreutz H. Fat/fiber intakes and sex hormones in healthy premenopausal women in USA. J Steroid Biochem Mol Biol. (2008) 112:32–9. doi: 10.1016/j.jsbmb.2008.08.002
33. Gaskins AJ, Mumford SL, Zhang C, Wactawski-Wende J, Hovey KM, Whitcomb BW, et al. Effect of daily fiber intake on reproductive function: the BioCycle Study. Am J Clin Nutr. (2009) 90:1061–9. doi: 10.3945/ajcn.2009.27990
34. Deschasaux M, Zelek L, Pouchieu C, His M, Hercberg S, Galan P, et al. Prospective association between dietary fiber intake and breast cancer risk. PLoS ONE. (2013) 8:e79718–e79718. doi: 10.1371/journal.pone.0079718
35. Jiang X, Lu N, Xue Y, Liu S, Lei H, Tu W, et al. Crude fiber modulates the fecal microbiome and steroid hormones in pregnant Meishan sows. General Compar Endocrinol. (2019) 277:6. doi: 10.1016/j.ygcen.2019.04.006
36. Aldunate M, Srbinovski D, Hearps A, Latham C, Ramsland P, Gugasyan R, et al. Antimicrobial and immune modulatory effects of lactic acid and short chain fatty acids produced by vaginal microbiota associated with eubiosis and bacterial vaginosis. Front Physiol. (2015) 6:164. doi: 10.3389/fphys.2015.00164
37. Amabebe E, Anumba D. The vaginal microenvironment: the physiologic role of Lactobacilli. Front Med. (2018) 5:181. doi: 10.3389/fmed.2018.00181
39. Muhleisen A, Herbst-Kralovetz M. Menopause and the vaginal microbiome. Maturitas. (2016) 91:15. doi: 10.1016/j.maturitas.2016.05.015
40. Smith S, Ravel J. La microbiota vaginal, la defensa del huésped y la fisiología reproductiva. J Physiol. (2016) 595:JP271694. doi: 10.1113/JP271694
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Yang S, Reid G, Challis JRG, Gloor GB, Asztalos E, Money D, et al. Efecto de los probióticos orales Lactobacillus rhamnosus GR-1 y Lactobacillus reuteri RC-14 sobre la microbiota vaginal, citoquinas y quimiocinas en mujeres embarazadas. Nutrientes. (2020) 12:368. doi: 10.3390/nu12020368
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Ho M, Chang YY, Chang WC, Lin HC, Wang MH, Lin WC, et al. Oral Lactobacillus rhamnosus GR-1 y Lactobacillus reuteri RC-14 para reducir la colonización por estreptococos del grupo B en mujeres embarazadas: un ensayo controlado aleatorizado. Taiwán J Obstetr Gynecol. (2016) 55:515–8. doi: 10.1016/j.tjog.2016.06.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Ahamed I, Annapandian V, Muralidhara K. Myroides odoratimimus infección del tracto urinario. Saudi J Kidney Dis Transpl. (2018) 29:1220–2. doi: 10.4103/1319-2442.243957
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Licker M, Sorescu T, Rus M, Cirlea N, Horhat F, Jurescu C, et al. Myroides odoratimimus extremadamente resistente a los medicamentos: una serie de casos de infecciones del tracto urinario en pacientes inmunocomprometidos. Infectar la resistencia a los medicamentos. (2018) 11:743–9. doi: 10.2147/IDR. S161069
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Mayor D, Korczak B, Christensen H, Bisgaard M, Frey J, Kuhnert P. Distribución de genes de toxina RTX en cepas de Actinobacillus rossii y Pasteurella mairii. Microbiol veterinario. (2006) 116:194–201. doi: 10.1016/j.vetmic.2006.03.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Holyoake PK, Thompson A. Aislamiento de Actinobacillus rossii de un lechón abortado. Aust Vet J. (2017) 95:483–5. doi: 10.1111/avj.12652
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Domínguez-Bello M, Jesús-Laboy K, Shen N, Cox L, Amir A, González A, et al. Restauración parcial de la microbiota de los nacidos por cesárea mediante transferencia microbiana vaginal. Nat Med. (2016) 22:4039. doi: 10.1038/nm.4039
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Wang M, Radlowski EC, Monaco MH, Fahey GC Jr, Gaskins HR, Donovan SM. El modo de parto y la nutrición temprana modulan la colonización microbiana y los productos de fermentación en lechones neonatos. J Nutr. (2013) 143:795–803. doi: 10.3945/jn.112.173096
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Aagaard K. Microbioma: la placenta alberga un microbioma único. Sci Transl Med. (2014) 6:3010007. doi: 10.1126/scitranslmed.3010007
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Collado MC, Rautava S, Aakko J, Isolauri E, Salminen S. La colonización intestinal humana puede iniciarse en el útero por distintas comunidades microbianas en la placenta y el líquido amniótico. Sci Rep. (2016) 6:23129. doi: 10.1038/srep23129
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Leblois J, Sebastien M, Li B, Wavreille J, Bindelle J, Everaert N. Modulación de la microbiota de los lechones: efectos diferenciales de una dieta materna alta en salvado de trigo durante la gestación y la lactancia. Sci Rep. (2017) 7:2. doi: 10.1038/s41598-017-07228-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Li Y, Zhang L, Liu H, Yang Y, He J, Cao M, et al. Efectos de la relación entre fibra insoluble y fibra soluble en dietas de gestación sobre el rendimiento de las cerdas y el desarrollo intestinal de las crías. Animales. (2019) 9:ani9070422. doi: 10.3390/ani9070422
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Cheng C, Wei H, Xu C, Xie X, Jiang S, Peng J. La dieta materna de fibra soluble durante el embarazo cambia la microbiota intestinal, mejora el rendimiento del crecimiento y reduce la permeabilidad intestinal en lechones. Appl Environ Microbiol. (2018) 84:18. doi: 10.1128/AEM.01047-18
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Segovia S, Vickers M, Gray C, Reynolds C. Obesidad materna, inflamación y programación del desarrollo. BioMed Res Int. (2014) 2014:14. doi: 10.1155/2014/418975
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Kimura A, Kishimoto T. IL-6: regulador del equilibrio Treg/Th17. Eur J Immunol. (2010) 40:1830–5. doi: 10.1002/eji.201040391
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Dang G, Wang W, Zhong R, Wu W, Chen L, Zhang H. El suplemento de pectina alivia potencialmente las lesiones intestinales mediante la mejora de la comunidad de microbiota intestinal en lechones. Microbiol frontal. (2022) 13:1069694. doi: 10.3389/fmicb.2022.1069694
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Dang G, Wen X, Zhong R, Wu W, Tang S, Li C, et al. La pectina modula la inmunidad intestinal en un modelo porcino mediante la regulación de la vía del metabolito del triptófano derivado de la microbiota intestinal, AhR-IL22. J Anim Sci Biotechnol. (2023) 14:38. doi: 10.1186/s40104-023-00838-z
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: salud intestinal, lechón recién nacido, pectina, cerda, microbiota vaginal
Cita: He J, Zheng J, Huang Y, Li S, Hua L, Jiang X, Che L, Fang Z, Feng B, Lin Y, Xu S, Li J y Wu D (2024) Beneficios de la suplementación materna con pectina en la dieta de gestación sobre la microbiota vaginal de las cerdas y la salud intestinal de los lechones recién nacidos. Frente. Vet. Sci. 11:1392399. doi: 10.3389/fvets.2024.1392399
Recibido: 15 de marzo de 2024; Aceptado: 26 de abril de 2024;
Publicado: 04 Junio 2024.
Editado por:
Jiali Chen, Universidad Agrícola de Shandong, China
Revisado por:
Runqi Fu, Universidad Agrícola de Yunnan, China
Chuanpi Xiao, Universidad de Lieja, Bélgica
Derechos de autor © 2024 Él, Zheng, Huang, Li, Hua, Jiang, Che, Fang, Feng, Lin, Xu, Li y Wu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: De Wu, wude@sicau.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía