Biomarcadores de alergia, inflamación, hepatopatía y coagulación en perros con sospecha de anafilaxia por envenenamiento por insectos
 Kate Turner1*
Kate Turner1* Corrin Boyd1
Corrin Boyd1 Gabriele Rossi2
Gabriele Rossi2 Claire R. Sharp1,3
Claire R. Sharp1,3 Melissa A. Claus1
Melissa A. Claus1 Abbie Francis4,5
Abbie Francis4,5 Lisa Inteligente1,6
Lisa Inteligente1,6- 1Departamento de Urgencias y Cuidados Críticos, Facultad de Medicina Veterinaria, Universidad Murdoch, Perth, WA, Australia
- número arábigoDepartamento de Patología Veterinaria, Facultad de Medicina Veterinaria, Universidad Murdoch, Perth, WA, Australia
- 3Instituto Harry Butler, Universidad Murdoch, Perth, WA, Australia
- 4Telethon Kids Cancer Centre, Telethon Kids Institute, Nedlands, WA, Australia
- 5Disciplina de Pediatría, Facultad de Medicina, Universidad de Australia Occidental, Nedlands, WA, Australia
- 6Departamento de Urgencias y Cuidados Críticos, Hospital Especializado en Pequeños Animales, North Ryde, Nueva Gales del Sur, Australia
Objetivos: Para comparar las concentraciones de biomarcadores de; alergia [triptasa de mastocitos (MCT) e histamina], inflamación [interleucina (IL)-6,-10 y -18, CXCL8, CCL2, quimioatrayente de queratinocitos (KC), proteína C reactiva (PCR)], desprendimiento de glicocálix endotelial (hialuronano), coagulación [tiempo de protrombina, tiempo de tromboplastina parcial activado, concentración de fibrinógeno y antígeno del factor de von Willebrand, actividad de la proteína C (PC) y antitrombina (AT)] y hepatopatía [alanina transaminasa (ALT), aspartato transaminasa (AST), fosfatasa alcalina (ALP), y bilirrubina total] entre perros con anafilaxia después de una sospecha de exposición a insectos, perros con enfermedad crítica y perros sanos.
Diseño: Este fue un estudio clínico observacional comparativo de un solo centro que incluyó 25 perros con anafilaxia (evidencia de exposición a insectos, signos dermatológicos agudos y otros órganos comprometidos), 30 perros con otras enfermedades críticas y 20 perros sanos. Las diferencias entre los grupos en las concentraciones de biomarcadores se probaron mediante ANOVA de un factor o prueba de Kruskal-Wallis, con valores significativos de P (<0,05) informados para las diferencias por pares detectadas por pruebas post-hoc. Se utilizaron modelos de regresión logística para calcular el área bajo la curva característica del operador receptor (AUROC) para la discriminación entre anafilaxia y enfermedad no anafiláctica.
Resultados: La concentración de histamina fue significativamente mayor en el grupo de anafilaxia que en los grupos sanos (P < 0,001) y críticos (P < 0,001), mientras que no se detectaron diferencias en el TCM entre los grupos. Las concentraciones de biomarcadores que aumentaron en relación con los perros sanos tanto en el grupo de anafilaxia como en el de enfermos críticos incluyeron IL-10 (P < 0,001 y P = 0,007, respectivamente), CCL2 (P = 0,007 y P < 0,001, respectivamente) y AST (ambos P < 0,001), mientras que solo el grupo de enfermos críticos había aumentado significativamente la PCR (P < 0,001), IL-6 (P < 0,001), KC (P < 0,001), ALP (P < 0,001) y concentraciones de fibrinógeno (P = 0,016), en comparación con el grupo sano. Solo los perros con anafilaxia tuvieron concentraciones significativamente más altas de hialuronano (P = 0,021) y ALT (P = 0,021), y menores actividades de PC (P = 0,030) y AT (P = 0,032), en comparación con los perros sanos. Tanto la PCR como la concentración de histamina mostraron una buena discriminación entre la anafilaxia y otras enfermedades críticas, con un AUROC de 0,96 (IC del 95%: 0,91-1) y 0,81 (IC del 95%: 0,69-0,93), respectivamente.
Conclusiones: Este estudio preliminar en perros con anafilaxia después de una sospecha de exposición a insectos, encontró evidencia de una respuesta inmune innata temprana, desprendimiento de glicocálix y consumo de anticoagulantes. Tanto la PCR como la histamina mostraron una utilidad clínica potencial para diferenciar entre la anafilaxia y otras enfermedades críticas.
Introducción
La anafilaxia es una reacción grave de hipersensibilidad tipo 1 que causa disfunción orgánica múltiple, secundaria a la exposición al antígeno. La sospecha de envenenamiento por insectos es la causa más frecuente en los perros (1–3). La disfunción multiorgánica está mediada por interacciones inmunológicas complejas que se han caracterizado en modelos de ratón y personas con anafilaxia (4, 5). La vía clásica de la anafilaxia implica la sensibilización previa de las células inmunitarias, la reticulación de IgE y antígenos, y la activación de mastocitos y basófilos. La activación de neutrófilos, IgG y vías no inmunológicas también pueden contribuir a la respuesta inflamatoria (4, 6, 7). Estas vías inflamatorias dan lugar a la liberación de aminas biógenas, mediadores lipídicos, citocinas y quimiocinas (4, 5, 8). La anafilaxia también puede activar y modular el sistema de coagulación a través de una variedad de mediadores, incluyendo el factor activador de plaquetas, la triptasa, la quimasa y la heparina (9-13). Se supone que las vías inflamatorias y de coagulación de la anafilaxia son similares en los perros, sin embargo, los datos se limitan a una descripción de las concentraciones de metabolitos de la histamina y la vía del ácido araquidónico en un modelo experimental (14). Se sabe poco sobre la activación de las vías inflamatorias y de coagulación durante la anafilaxia natural en perros, aunque se ha descrito un síndrome hemorrágico clínico en varias series de casos (3, 15-17).
El reconocimiento clínico de la anafilaxia se basa en la evidencia de exposición a alérgenos, un detalle que a menudo falta en la historia clínica, y el conocimiento de los signos clínicos informados, ya que no existe una prueba diagnóstica definitiva (1, 2, 7, 17-19). El diagnóstico fiable de la anafilaxia sin antecedentes de exposición a alérgenos puede ser difícil tanto en medicina veterinaria como en humana, especialmente en ausencia de signos dermatológicos (7). Existe una serie de biomarcadores candidatos que tienen potencial teórico como pruebas complementarias en el punto de atención para distinguir la anafilaxia de otras enfermedades críticas en perros, incluidos los biomarcadores de alergia, inflamación aguda y hepatopatía. Los biomarcadores de alergia circulantes, la triptasa de mastocitos (MCT) y la histamina, han sido investigados por su potencial discriminatorio en las personas (8, 20-27). A pesar de que los primeros estudios son prometedores (26-28), ninguno de los biomarcadores ha demostrado aumentar de forma fiable por encima de los niveles de control sanos en pacientes con anafilaxia del servicio de urgencias (22, 23). La utilidad diagnóstica puede verse obstaculizada por la variación en la magnitud de las respuestas de estos biomarcadores en las personas, que pueden verse afectadas por el momento de la toma de muestras en relación con el curso temporal de la liberación de biomarcadores, o el tipo y la ruta de exposición a alérgenos. Las alergias a medicamentos y alimentos se notifican con mayor frecuencia en las personas que acuden a los servicios de urgencias (8), mientras que la exposición a insectos se notifica con mayor frecuencia en los perros (1, 2). La concentración de histamina en sangre aumenta en perros con anafilaxia experimental (14, 29); sin embargo, la histamina no se ha investigado en la anafilaxia natural, y la concentración de MCT en sangre no se ha explorado en ninguno de los dos ámbitos.
Los biomarcadores inflamatorios de la respuesta inmune innata se han explorado en personas con anafilaxia, pero estos resultados no se han comparado con aquellos con enfermedad crítica para investigar su potencial discriminatorio (8, 30). Los biomarcadores de inflamación medidos en el momento de la presentación pueden tener valor como biomarcadores negativos, donde el diagnóstico de anafilaxia es más probable que el de otras enfermedades críticas si estos biomarcadores no están elevados. Los biomarcadores de inflamación inespecíficos que aumentan en perros críticamente enfermos incluyen la proteína C reactiva (PCR), las interleucinas (IL)-6, la IL-10, la quimiocina de queratinocitos (KC), el ligando 8 de quimiocinas con motivo C-X-C (CXCL8) y el ligando 2 de quimiocinas con motivo C-C (CCL2), también conocido como proteína quimioatrayente de monocitos-1 (31-37). Estas citocinas pueden tardar horas en aumentar su circulación después de la estimulación (34-40). Las concentraciones circulantes de estos mediadores inflamatorios no se han caracterizado en perros con anafilaxia, ya sea para comprender los mecanismos subyacentes de la anafilaxia o explorar la utilidad diagnóstica.
El objetivo general de este estudio fue medir los biomarcadores de alergia e inflamación en perros con anafilaxia; Desarrollar una comprensión de los mecanismos del síndrome clínico y para la identificación de posibles marcadores diagnósticos. El objetivo principal fue comparar las concentraciones plasmáticas de biomarcadores de alergia (MCT e histamina), mediadores de la inflamación (IL-6, -10 y -18, CXCL8, CCL2, KC, PCR) e hialuronano (un marcador de la diseminación de glicocálix endotelial) entre perros con evidencia de anafilaxia después de una sospecha de exposición a insectos, perros con otras enfermedades críticas y controles sanos. Planteamos la hipótesis de que las concentraciones de histamina y MCT serían significativamente más altas, y las concentraciones de otros biomarcadores de inflamación significativamente más bajas, en perros con anafilaxia en comparación con los perros críticamente enfermos sin anafilaxia. Se incluyeron biomarcadores de hepatopatía para la comparación, dada la evidencia previa de su potencial discriminatorio (2). El objetivo secundario fue comparar biomarcadores de coagulación; en concreto, el tiempo de protrombina (TP), el tiempo de tromboplastina parcial activada (TTPA), la concentración de fibrinógeno y las actividades del antígeno del factor de von Willebrand (fv), la proteína C (PC) y la antitrombina (AT) entre perros con anafilaxia, perros críticamente enfermos sin anafilaxia y perros sanos.
Métodos
El estudio Biomarkers of ANAphylaxis associated with hymeNopterA Sting in dogs (BANANAS) fue un estudio comparativo de biomarcadores observacionales clínicos prospectivos de un solo centro que incluyó 25 perros en el grupo de anafilaxia, 30 perros en el grupo de enfermos críticos y 20 perros en el grupo sano. Todos los perros fueron propiedad del cliente con el consentimiento informado del propietario obtenido antes de la toma de muestras de sangre. Si el tratamiento era emergente para perros con anafilaxia y se recolectaba una muestra de sangre previa al tratamiento como parte de la atención de rutina, se obtenía el consentimiento informado del cliente más tarde cuando correspondía. El estudio fue aprobado por el Comité de Ética Animal de la Universidad de Murdoch (números de aprobación: anafilaxia y sano R3090/18 566, enfermedad crítica R2964/17) y se llevó a cabo de acuerdo con el Código Australiano para el Cuidado y Uso de Animales con Fines Científicos. El estudio se presenta de acuerdo con las directrices de notificación de STROBE (41).
Grupo de anafilaxia
Los perros que se presentaron entre febrero de 2019 y marzo de 2020 fueron examinados prospectivamente para determinar los criterios de inclusión que se muestran en la Figura 1, que incluían evidencia de exposición a insectos, signos dermatológicos agudos y afectación de otro órgano (42, 43). La inclusión obligatoria de la exposición a insectos y las anomalías dermatológicas se estableció para aumentar la confianza en el diagnóstico de la anafilaxia. Se excluyó a los perros que tenían antecedentes de signos de enfermedad durante más de 3 h, cualquier administración reciente de antiinflamatorios no esteroideos (AINE) o corticosteroides, cualquier enfermedad concurrente significativa antes de la anafilaxia, si ya habían recibido un antihistamínico, corticosteroide o catecolamina exógena para la reacción anafiláctica, o si su peso corporal era de <5 kg.
En el momento de la inscripción, los médicos tratantes completaron una hoja de recopilación de datos con información sobre la señalización del paciente; signos dermatológicos, neurológicos y gastrointestinales; y parámetros cardiovasculares, de temperatura y respiratorios (Ficha Complementaria 1). Los perros se definieron como portadores de signos dermatológicos difusos si había angioedema, urticaria, eritema o prurito; signos gastrointestinales si había vómitos, diarrea, regurgitación, ptialismo, arcadas o deglución exagerada; y signos neurológicos si había ataxia o convulsiones. Se definió que los perros tenían signos cardiovasculares si había presencia de una frecuencia cardíaca e hipotensión anormales, o una frecuencia cardíaca anormal o hipotensión con al menos una anomalía en el color de la membrana mucosa, la calidad del pulso o el tiempo de llenado capilar (TRC) (1). Una frecuencia cardíaca anormal se clasificó como bradicardia (frecuencia cardíaca <70 latidos por minuto) o taquicardia (frecuencia cardíaca >120 latidos por minuto) (44). El color anormal de la membrana mucosa se definió como pálido o hiperémico. La TRC anormal se definió como <1 s o >2 s (44). La calidad anormal del pulso se definió como reducida, débil o limitante (44). La hoja de datos también incluía los resultados de las pruebas diagnósticas, como la ecografía en el punto de atención, el análisis bioquímico y las pruebas de coagulación, que se realizaban a discreción del médico tratante. En el caso de los datos faltantes, las historias clínicas fueron revisadas por K.T. antes del análisis de biomarcadores para recuperar la información faltante. Se extrajo sangre antes de cualquier tratamiento, incluida la fluidoterapia intravenosa, la administración de corticosteroides, antihistamínicos o catecolaminas. Se alentó a los médicos a realizar una ecografía específica en el punto de atención para evaluar el edema de la pared de la vesícula biliar y el líquido abdominal libre durante el tratamiento inicial, y registrar sus hallazgos, dados los informes anteriores de su asociación con la anafilaxia en perros (1, 2). La técnica ecográfica no se estandarizó para los fines del estudio, aunque los criterios para determinar el edema de la vesícula biliar descritos anteriormente (1) son el estándar de atención en la institución del estudio. El médico de cabecera dictaba todos los aspectos del tratamiento clínico.
Grupo de enfermedades críticas
Se utilizó una muestra de conveniencia de muestras almacenadas en un banco de un ensayo clínico aleatorizado de 40 perros que requirieron la administración de líquidos intravenosos en bolo (45). Las muestras de ese ensayo clínico solo incluyeron las tomadas antes de la intervención del estudio (es decir, la muestra de referencia). Los perros se inscribieron entre enero de 2018 y febrero de 2019. Se excluyeron las muestras si el diagnóstico final era consistente con una reacción anafiláctica (n = 3), si no había suficiente muestra (n = 1) o si había preocupaciones con respecto a la calidad de la muestra, como lipemia (n = 3), retraso en el procesamiento de la muestra (n = 1) o etiquetado incorrecto de alícuotas (n = 2). Las 30 muestras restantes fueron incluidas. Los datos se recogieron de los formularios de informes de casos clínicos y de las historias clínicas, incluida la señalización, la duración de los signos clínicos antes de la inclusión, el diagnóstico, el tratamiento médico concurrente, si se había administrado alguna terapia con líquido en bolo cristaloide antes de la recogida de las muestras y la supervivencia hasta el alta hospitalaria.
Grupo saludable
Se inscribieron perros sanos propiedad de la comunidad, del personal o de los estudiantes. Se requirió que los perros tuvieran un examen físico normal, que no recibieran medicamentos actuales aparte de la profilaxis antiparasitaria y las vacunas, y que no tuvieran ninguna enfermedad conocida.
Recogida de muestras, procesamiento y análisis de biomarcadores
Se recogieron seis mililitros de sangre de un catéter intravenoso, utilizando una técnica de tres jeringas, o de venopunción, y se dividieron en ácido etilendiaminotetraacético (EDTA), citrato y tubos de coágulos simples. Los tubos se colocaron en hielo durante no más de 1 h hasta la centrifugación a 1.358 g a 4 °C durante 10 minutos. A continuación, el plasma y el suero se separaron en múltiples alícuotas. Todas las muestras se procesaron y congelaron a -80 °C dentro de las 3,5 h posteriores a la recolección.
El análisis de laboratorio por lotes se realizó en plasma o suero descongelado después del almacenamiento durante períodos de tiempo variables; hasta 25 meses (saludable hasta 5 meses, anafilaxia hasta 13 meses y enfermedad crítica hasta 25 meses) (IL-6, IL-10, IL-18, KC, CCL2, CXCL8 y parámetros de coagulación), hasta 33 meses (sano hasta 13 meses, anafilaxia hasta 22 meses y enfermedad crítica hasta 33 meses) (MCT), hasta 39 meses (saludable hasta 17 meses, anafilaxia hasta 26 meses y enfermedad crítica hasta 39 meses) (histamina) y hasta 43 meses (sano hasta 19 meses, anafilaxia hasta 28 meses y enfermedad crítica hasta 43 meses) (parámetros de hialuronano, PCR y hepatopatía). Todos los ensayos se realizaron de acuerdo con las instrucciones del fabricante. Para la medición de la concentración de IL-6, IL-10, IL-18, KC, CCL2 y CXCL8 se utilizó un ensayo comercial de matriz múltiplex de perlas magnéticas (Milliplex(R) MAP Canine Cytokine Bead Magnetic Bead Panel, MilliporeSigma, Burlington, MA, EE. UU. validado por el fabricante para el plasma canino. Se utilizaron kits comerciales de ELISA para MCT (kit de ELISA de triptasa para perros, Abbexa, Cambridge, Reino Unido), histamina (kit de ELISA de histamina; Beckman-Coulter, Brea, CA, EE.UU.) y el hialurónico (Quantikine Hyaluronan ELISA kit, R & D systems, Minneapolis MN, EE.UU.) validado para su uso en plasma o suero canino, según corresponda. Todas las muestras se realizaron por duplicado y se repitieron si el coeficiente de variación era >20% (o >15% para el hialurónico), según las recomendaciones del fabricante. Las muestras por encima del límite superior de detección se repitieron a una dilución más alta. A las muestras que permanecían por encima del límite superior de detección se les asignó el límite superior de detección. Las muestras por debajo del límite inferior de detección, pero que presentaban cierta fluorescencia, se repitieron sin dilución. A las muestras que permanecieron por debajo del límite inferior de detección se les asignó el siguiente valor: Límite inferior de detección/√2 (46).
Se utilizó un analizador de coagulación turbidimétrico comercial (ACL-TOP CTS 300, Instrumentation Laboratories, Bedford, MA, EE. UU.) para medir PT, APTT, concentración de fibrinógeno y actividades de antígeno AT, PC y vWF en plasma citrato. El aseguramiento de la calidad se realizó diariamente en plasmas de control disponibles comercialmente (plasma de calibración HaemosIL, Instrumentation Laboratories, Bedford, MA, USA). Para la calibración de las actividades de los factores se utilizó plasma canino agrupado, y para la concentración de fibrinógeno se utilizó plasma de calibración disponible comercialmente (plasma de calibración HaemosIL, Instrumentation Laboratories, Bedford, MA, EE. UU.) La calibración se realizó para cada nuevo lote de reactivo.
Análisis por lotes de biomarcadores de hepatopatía; Las alanina transaminasa (ALT), la aspartato transaminasa (AST), la fosfatasa alcalina (ALP) y la bilirrubina total (Tbil) se realizaron utilizando un analizador comercial (Cobas Integra 400 plus, Roche Diagnostics, Basilea, Suiza) validado para su uso con suero canino. La calibración y la verificación del rendimiento se realizaron utilizando los reactivos recomendados por el fabricante (Calibrador para sistemas automatizados c.f.a.s. y PreciControl ClinChem Multi 1 y 2, Roche Diagnostics, Basilea, Suiza) antes de cada uso. La ALT y la AST se midieron según la Federación Internacional de Química Clínica y Medicina de Laboratorio (IFCC) sin fosfato de piridoxal, la FA se midió según la IFCC según el método de Schumann y la Tbil se midió por el método diazo colorimétrico. La PCR sérica se midió mediante inmunoensayo turbidimétrico mejorado con partículas (Inmunoensayo de PCR canina, Genciana AS, Moss, Noruega) tras calibración de 6 puntos (Kit calibrador de PCR canina, Genciana AS, Moss, Noruega) y control de calidad (Kit de control de PCR canina, Genciana AS, Moss, Noruega). Las muestras se diluían aún más y se repetía la medición si la concentración estaba por encima del límite superior de detección.
Métodos estadísticos
Aunque este es solo un estudio preliminar de biomarcadores, se realizó un cálculo de potencia utilizando datos de un estudio previo de biomarcadores (47) para ayudar con la selección del tamaño de la muestra. Este estudio identificó que los perros con sepsis (n = 21) tenían una concentración media de PCR de 223 mg/L (DE 85), mientras que los controles sanos tenían una concentración media de 76 mg/L (DE 17). Como anticipamos que el grupo de enfermedad crítica tendría concentraciones similares a las de los perros con sepsis y que el grupo de anafilaxia sería similar al grupo sano, se estimó que un tamaño de muestra de 5 perros por grupo daba un 80% de potencia para detectar una diferencia entre enfermedad crítica y anafilaxia (alfa = 0,05). Dado que se trata de un estudio preliminar, la variabilidad prevista en los grupos y entre los diferentes biomarcadores, y reconociendo que los perros con enfermedad crítica pueden no estar tan enfermos como los perros con sepsis, aumentamos arbitrariamente nuestra estimación del tamaño de la muestra a 30 para los grupos de anafilaxia y enfermedad crítica. Se eligió arbitrariamente un tamaño de muestra de 20 para el grupo sano, dada la homogeneidad relativa prevista.
El análisis estadístico se realizó utilizando software estadístico comercial (SAS® 9.3, SAS Institute, Cary, NC). Se utilizó la visualización de histogramas y gráficos Q-Q para evaluar la distribución normal. Si era necesario, se realizaba la transformación logarítmica de los datos para lograr una distribución normal. Los datos continuos se informaron como media (intervalo de confianza del 95%) cuando se distribuyen normalmente, media geométrica (intervalo de confianza del 95%) si se transforman logarítmicamente y mediana [Q1-Q3] cuando no se distribuyen normalmente. Los datos categóricos se reportaron como número (porcentaje). Debido a la relevancia clínica de la medición de PT y TTPA, se identificaron aún más perros individuales con valores por encima del intervalo de error de los perros control sanos.
Las diferencias entre los grupos se evaluaron mediante ANOVA de un factor para los parámetros distribuidos normalmente y la prueba de Kruskal-Wallis para los parámetros distribuidos no normalmente. Cuando se detectó una diferencia significativa entre los grupos, se realizaron comparaciones por pares con la prueba de Tukey-Kramer para parámetros distribuidos normalmente y la prueba de Dwass-Steel-Critchlow-Fligner para parámetros no distribuidos normalmente. Se utilizaron modelos de regresión logística univariados para calcular el área bajo la curva característica del operador receptor (AUROC) para la capacidad de cada biomarcador para discriminar la anafilaxia de la enfermedad crítica. Se reportan el AUROC y el intervalo de confianza del 95%. También se calculó un AUROC a partir de un modelo multivariante que contenía todos los biomarcadores con AUROC > 0,8 en el análisis univariante. Dado el carácter preliminar de este estudio, que el grupo de comparación era una muestra de conveniencia y que no había una cohorte de validación, no se determinaron los puntos de corte de sensibilidad y especificidad. Un valor de P de <0,05 se consideró significativo para todas las pruebas.
Resultados
Características
Doscientos cincuenta y cinco perros con sospecha de reacción de hipersensibilidad tipo I secundaria a envenenamiento por insectos fueron examinados para determinar la elegibilidad del grupo de anafilaxia durante el período de estudio. Doscientos veintiún perros no cumplieron con los criterios de inclusión, por lo que 103 perros no tenían evidencia de exposición a insectos, 93 perros no tenían signos dermatológicos y 133 perros no tenían evidencia de afectación de otros órganos (es decir, solo dermatológicos). Muchos de estos perros carecían de múltiples criterios de inclusión. Treinta y cuatro perros cumplieron con los criterios de inclusión, de los cuales 9 fueron excluidos, quedando 25 perros restantes en el estudio. Motivos de exclusión incluidos; tratamiento previo (n = 6), peso corporal <5 kg (n = 2) y tratamiento con lokivetmab (n = 1). El reclutamiento se suspendió en un tamaño de muestra de 25 perros debido al impacto de las restricciones de COVID-19 en la institución del estudio.
Las razas más frecuentes, y sus cruces, en el grupo de anafilaxia fueron Caniches (n = 4; 16%) y 2 perros cada uno (8%) de Dachshund, Kelpie australiano, Labrador Retriever y Golden Retriever. Todas las demás razas solo estaban representadas por un perro individual. La mediana de peso fue de 10,6 kg (7,3-16,9) y la mediana de edad fue de 1,1 años (0,4-5,2). Había 7 (28%) perros machos castrados y 6 perros (24%) de hembra esterilizada, hembra entera y macho entero. A trece perros (52%) se les retiró un aguijón de insecto, 11 perros tenían signos focales en la piel sin un aguijón encontrado (44%) y el propietario informó que 5 perros habían tenido contacto con una abeja u hormiga (20%). Varios perros cumplieron con más de uno de los criterios de exposición a insectos. La mediana de duración de los signos clínicos (n = 19) fue de 1 h (0,5-1) antes de la inclusión. Además de los signos dermatológicos, 22 perros (88%) tenían signos gastrointestinales y 21 perros (84%) tenían signos cardiovasculares, incluidos 6 perros (24%) con hipotensión arterial. Ningún perro presentó signos neurológicos. Los signos clínicos adicionales incluyeron aumento de la frecuencia respiratoria o del esfuerzo (n = 6; 24%) y aumento de la temperatura rectal (n = 1; 4%). Veintidós perros (88%) tuvieron resultados reportados de una ecografía abdominal en el punto de atención realizada por el médico tratante. De estos, a 13 perros (59%) se les detectó edema de vesícula biliar y a 3 perros (14%) se les presentó derrame peritoneal. Ningún perro con anafilaxia murió durante la hospitalización; Sin embargo, un perro fue sacrificado después de un segundo episodio de anafilaxia de marcada gravedad, 3 meses después de la inscripción en el estudio.
Las razas frecuentes, y sus cruces, en el grupo de enfermedades críticas incluían tres perros (10%) de Labrador Retriever, Rottweiler, Poodle y Shih Tzu y dos perros (6,7%) de Golden Retriever y Silky Terrier. Todas las demás razas solo estaban representadas por un perro individual. La mediana de peso fue de 25,4 kg (12,2-34,5) y la mediana de edad fue de 7,9 años (3,8-10,5). Había 11 (37%) perros machos castrados, 9 (30%) hembras esterilizadas, 7 (23%) machos enteros y 3 (10%) hembras enteras. La mediana de duración de los signos clínicos antes de la presentación fue de 24 h (8-48). Los diagnósticos más frecuentes fueron síndrome de diarrea hemorrágica aguda (n = 10), vólvulo de dilatación gástrica (n = 4), obstrucción por cuerpo extraño gastrointestinal (n = 3) y traumatismo por mordida (n = 2). Otros diagnósticos (1 perro cada uno) incluyeron derrame bicavitario y piotórax, toxicosis por cícadas, poliartropatía mediada por el sistema inmunológico, hemoperitoneo con masa abdominal, vólvulo mesentérico, peritonitis séptica, enfermedad prostática, trombosis auricular derecha y masa suprarrenal, tétanos con neumonía y traumatismo por accidente automovilístico. Un perro recibía corticosteroides en dosis bajas en el momento de la inscripción (<0,5 mg/kg de prednisolona cada dos días). Por lo demás, ningún perro recibió AINE, antihistamínicos u otros fármacos inmunomoduladores antes de la recogida de la muestra. Diez perros recibieron la administración en bolo de fluidoterapia con cristaloides antes de la inclusión, con un volumen medio de 15 ml/kg (rango 10-44 ml/kg). De los perros con enfermedad crítica, 20 (66,7%) sobrevivieron hasta el alta, 2 (6,7%) murieron y 8 (26,7%) fueron sacrificados.
El grupo saludable incluía una variedad de razas y sus cruces, incluidos los pastores australianos (n = 3; 15%) y 2 perros (10%) de Gordon Setter, Border Collie y Kelpie. Todas las demás razas solo estaban representadas por un perro individual. La mediana de peso fue de 27 kg (16,1-33) y la mediana de edad fue de 5,5 años (3,05-7,15). Hubo 9 machos castrados (45%), 7 hembras esterilizadas (35%) y 2 (10%) de perros hembras enteros y machos enteros.
Comparación de biomarcadores entre grupos
La concentración sérica de histamina fue significativamente mayor en el grupo de anafilaxia, en comparación con el grupo de enfermedad crítica (P < 0,0001) y el grupo sano (P < 0,0001) (Figura 2; Tabla complementaria 1), mientras que no se encontraron diferencias significativas en el TCM entre los grupos (P = 0,12) (Figura 2; Cuadro complementario 1). No se pudo medir la concentración de histamina en un perro del grupo de anafilaxia debido a un volumen de muestra insuficiente. Las concentraciones de proteína C reactiva, IL6 y KC fueron significativamente mayores en el grupo de enfermedad crítica, en comparación con los grupos de anafilaxia (PCR P < 0,0001, IL6 P < 0,001, KC P = 0,015) y sanos (PCR P < 0,0001, IL6 P < 0,0001, KC P < 0,0001) (Figura 3; Cuadro complementario 1). Por el contrario, el grupo de anafilaxia no tuvo concentraciones significativamente más altas de estos tres biomarcadores, en comparación con el grupo sano (PCR P = 0,99, IL6 P = 0,17, KC P = 0,08). No se pudo medir la concentración de proteína C reactiva en dos perros del grupo de enfermedad crítica debido a un volumen de muestra insuficiente. Las concentraciones de IL-10 y CCL2 fueron significativamente mayores en el grupo de anafilaxia (IL10 P < 0,0001, CCL2 P = 0,007) y en el grupo de enfermedad crítica (IL10 P = 0,007, CCL2 P < 0,001), en comparación con el grupo sano (Figura 3; Cuadro complementario 1). No hubo diferencias significativas en CXCL8 o IL18 entre los grupos (CXCL8 P = 0,067, IL18 P = 0,58) (Tabla suplementaria 1). El grupo de anafilaxia tuvo una concentración sérica de hialuronano significativamente mayor, en comparación con el grupo sano (P = 0,021) (Figura 3, Tabla suplementaria 1). No se detectaron otras diferencias entre grupos en la concentración de hialurónico. No se pudo medir la concentración de hialuronano en un perro del grupo de enfermedad crítica debido a un volumen de muestra insuficiente.
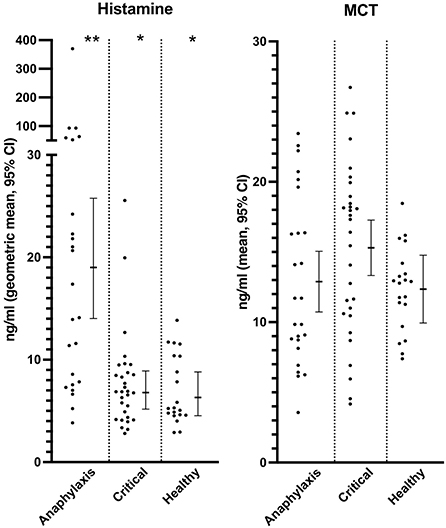
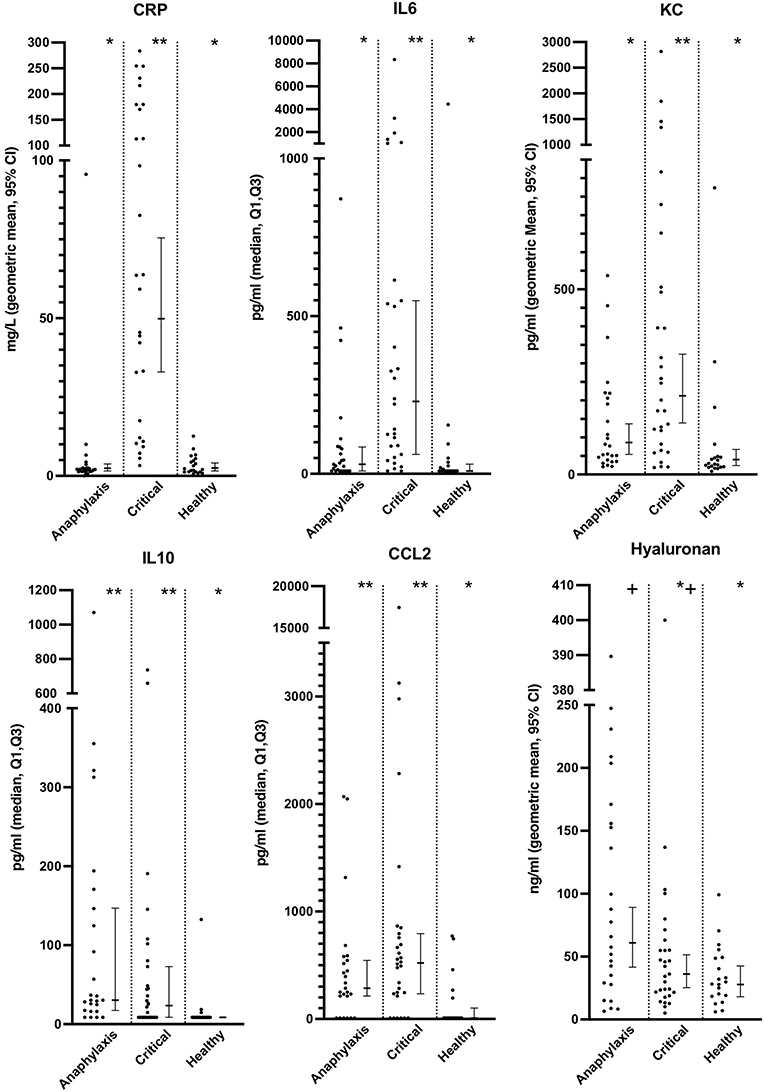
Figura 3. Diagramas de dispersión y de caja y bigotes de proteína C reactiva (PCR), interleucina (IL) 6 y 10, ligando-2 de quimiocina con motivo C-C (CCL2), quimiocina derivada de queratinocitos (KC) y concentraciones de hialuronano en perros con anafilaxia, perros con otras enfermedades críticas y perros sanos. Los diagramas de caja y bigotes muestran la media geométrica y el intervalo de confianza del 95% (PCR, KC e hialurónico) o la mediana y Q1, Q3 (IL6, IL10 y CCL2) según corresponda para la distribución de datos. * y **indican una diferencia significativa (P < 0,05) entre los grupos.
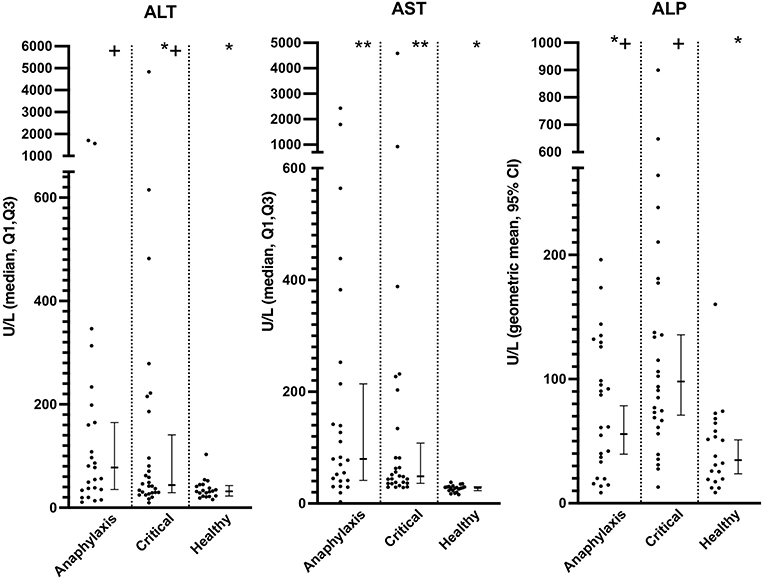
Las concentraciones séricas de AST fueron significativamente más altas tanto en el grupo de anafilaxia como en el de enfermedad crítica, en comparación con el grupo sano (ambos P < 0,0001), mientras que solo el grupo de anafilaxia tuvo una concentración de ALT significativamente mayor, en comparación con el grupo sano (P = 0,021) (Figura 4; Cuadro complementario 1). No hubo diferencias significativas en las concentraciones de ALT (P = 0,73) o AST (P = 0,44) entre el grupo de anafilaxia y el de enfermedad crítica. La concentración sérica de FA fue significativamente mayor en el grupo de enfermedad crítica, en comparación con el grupo sano (P < 0,001), pero esta fue la única diferencia entre grupos detectada (Figura 4; Cuadro complementario 1). No hubo diferencia significativa en la concentración sérica de Tbil entre los grupos (P = 0,066; Cuadro complementario 1). No se pudieron medir las concentraciones de AST, ALP y Tbil en dos perros del grupo de enfermedad crítica debido a un volumen de muestra insuficiente.
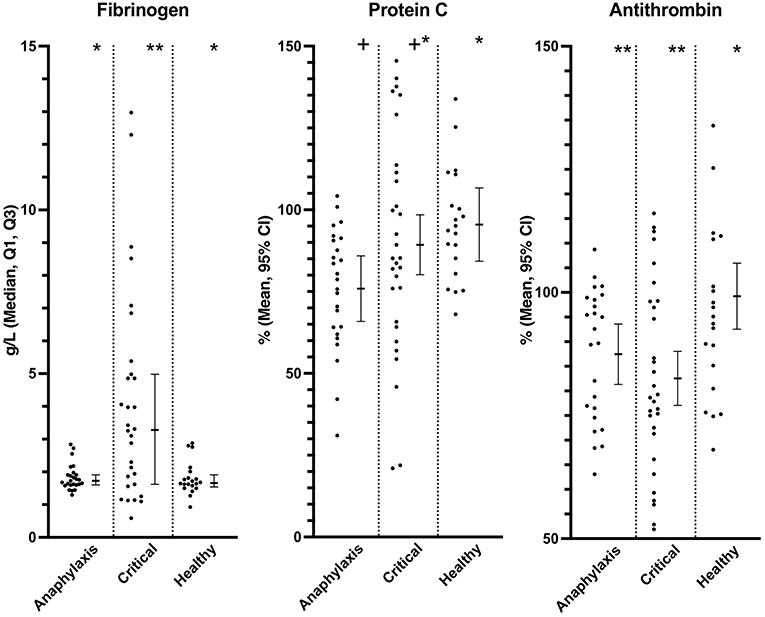
La concentración plasmática de fibrinógeno fue significativamente mayor en el grupo de enfermedad crítica, en comparación con los grupos sanos (P = 0,016) y anafilaxia (P = 0,016); sin embargo, no hubo diferencia significativa entre el grupo de anafilaxia y el grupo sano (P = 0,89) (Figura 5; Cuadro complementario 1). La actividad plasmática de TA fue significativamente menor tanto en el grupo de anafilaxia (P = 0,032) como en el de enfermedad crítica (P < 0,001), en comparación con el grupo sano (Figura 5; Cuadro complementario 1). La proteína C fue significativamente menor en el grupo de anafilaxia, en comparación con el grupo sano (P = 0,03); sin embargo, no se detectaron otras diferencias entre los grupos (Figura 5; Cuadro complementario 1). No hubo diferencias significativas entre los grupos en TP (P = 0,08), TTAP (P = 0,058) o WFA (P = 0,58) (Tabla suplementaria 1). Ocho perros del grupo de anafilaxia y 15 perros del grupo de enfermedad crítica tuvieron un TP mayor que el intervalo de confianza del 95% del grupo sano. Trece perros en el grupo de anafilaxia y 9 perros en el grupo de enfermedad crítica tenían un TTAP mayor que el Q3 de los perros sanos.
Los datos resumidos de todos los biomarcadores y los resultados de las comparaciones estadísticas entre grupos se pueden encontrar en la Tabla Suplementaria 1. En la Tabla complementaria 2 se incluyen los datos resumidos para el grupo de enfermedad crítica y el grupo de enfermedad crítica, excluyendo a los pacientes que habían recibido fluidoterapia intravenosa en bolo previo.
Potencial discriminatorio: anafilaxia comparada con enfermedad crítica
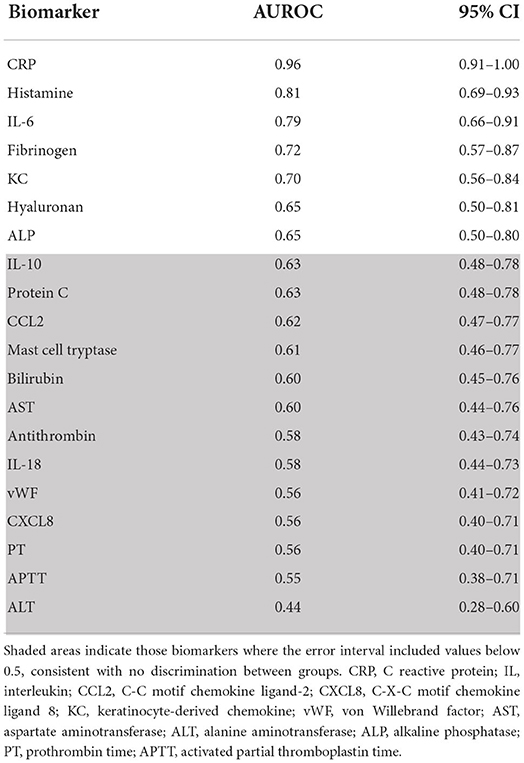
El AUROC y el intervalo de confianza del 95% para todos los biomarcadores se proporcionan en la Tabla 1, en el orden de mejor a peor discriminación. La proteína C reactiva y la histamina tuvieron un AUROC >0,8; mientras que los perros con anafilaxia tendían a tener una alta concentración de histamina y una baja concentración de PCR, mientras que ocurría lo contrario en los perros con enfermedad crítica. Cuando se combinaron la PCR y la histamina en un modelo multivariante, el AUROC indicó una discriminación casi perfecta de 0,96 (IC del 95%: 0,91-1), aunque comparable al modelo univariado de la PCR.
Discusión
Este estudio detectó numerosas diferencias en los biomarcadores de alergia, inflamación, coagulación y hepatopatía entre perros con anafilaxia, perros sanos y perros con una enfermedad crítica no anafiláctica. Estos resultados identificaron que la PCR sola, o la combinación de PCR e histamina, puede tener utilidad como biomarcadores diagnósticos para diferenciar la anafilaxia de la enfermedad crítica no anafiláctica en perros.
La proteína C reactiva es una proteína de fase aguda producida principalmente por el hígado en respuesta a la estimulación de citocinas proinflamatorias, especialmente IL-1, IL-6 y el factor de necrosis tumoral-α (TNF-α) (48). La falta de un aumento en la mayoría de los individuos con anafilaxia, en comparación con los perros sanos, se considera más probable debido a la rápida aparición de signos clínicos. Es probable que la proteína C reactiva tarde al menos 4 horas en aumentar su circulación en los perros después de un estímulo inflamatorio, según los modelos experimentales (34-37, 48), mientras que los perros con sospecha de anafilaxia tienden a presentarse dentro de 1-2 horas de los signos clínicos (1). El momento de la toma de muestras de sangre puede ser el aspecto crucial para identificar los biomarcadores negativos para la anafilaxia, como lo sugiere este estudio. Por ejemplo, muchos perros con anafilaxia mostraron un aumento de la concentración plasmática de IL-10, que se sabe que aumenta dentro de una hora después del choque (38) o endotoxemia (40), y algunos perros mostraron niveles elevados de IL-6 o CCL2 plasmáticos, que se sabe que aumentan dentro de 1-3 h después del choque (38), endotoxemia (40) o estímulo quirúrgico (34, 49). Esta variabilidad redujo el potencial discriminatorio de estos biomarcadores inflamatorios.
Además de la PCR, la concentración plasmática de histamina mostró un buen potencial discriminatorio entre los perros con anafilaxia y los pacientes críticos no anafilácticos, basándose en un AUROC de 0,81. Aunque más de la mitad de los perros con anafilaxia mostraron una concentración plasmática de histamina superior a la de los controles sanos, no todos la tuvieron, y algunos perros con enfermedad crítica también mostraron elevaciones leves. En medicina humana, la histamina tiene buena especificidad (0,88) pero poca sensibilidad (0,60) para separar la anafilaxia de los individuos sanos (20), lo que significa una alta tasa de falsos negativos. Esto puede deberse al curso temporal de la liberación de histamina en las personas; Las concentraciones séricas de histamina alcanzan su punto máximo a los 5-10 minutos del envenenamiento de las abejas antes de volver a la línea de base a los 30-40 minutos (26). Aunque el curso temporal de la liberación de histamina en las personas parece comparable al de los perros en un modelo experimental de anafilaxia (14), los resultados de este estudio sugieren que el aumento de las concentraciones séricas de histamina puede persistir durante más tiempo en los perros con anafilaxia natural, dado que la mediana del tiempo de los signos clínicos antes de la presentación fue de 1 h. La persistencia en la elevación de histamina también puede estar asociada con el envenenamiento de insectos específicamente, ya que este estudio no incluyó otros desencadenantes de anafilaxia.
Dado el rápido aumento y disminución de la histamina circulante observado en las personas con anafilaxia, se ha sugerido que el MCT es un biomarcador diagnóstico superior, ya que su aumento y disminución son más lentos (26). Sin embargo, cuando se comparó a las personas que acudían a un servicio de urgencias con anafilaxia con las que presentaban una enfermedad crítica, la utilidad imitaba a la concentración de histamina, con una buena especificidad (0,93) pero poca sensibilidad (0,58) (22). Curiosamente, no encontramos diferencias en el TCM entre los grupos de este estudio. Esto puede deberse a una verdadera ausencia de una diferencia entre los grupos o puede deberse a una falla del ELISA utilizado para detectar una diferencia. No validamos de forma independiente el rendimiento del MCT ELISA utilizado en este estudio. Se justifica la realización de más investigaciones con kits de ELISA MCT validados de forma independiente.
Este estudio identificó concentraciones significativamente más altas de inflamación y biomarcadores endoteliales en perros con anafilaxia, en comparación con perros sanos, incluidos CCL2, IL-10 e hialuronano, que no se habían descrito anteriormente. Además, algunos perros individuales tenían concentraciones plasmáticas de IL-6 o KC superiores al intervalo de confianza del 95% de los perros sanos. Las elevaciones en estos biomarcadores proinflamatorios son consistentes con una respuesta inmune innata temprana, similar a los patrones observados en estudios de biomarcadores de perros con sepsis y otros tipos de enfermedades críticas (40, 50). El hialuronano es un biomarcador de la diseminación del glicocálix endotelial y su aumento sugiere activación endotelial y alteración estructural (38, 51). La fluidoterapia también puede aumentar la concentración de hialurónico, sin embargo, se tomaron muestras del grupo de anafilaxia antes de administrar cualquier tratamiento (38, 51). La pérdida del glicocálix endotelial puede contribuir al aumento de la permeabilidad vascular y desempeñar un papel en la extravasación de líquidos, que se sabe que ocurre en la anafilaxia (52). Por el contrario, no identificamos diferencias en la IL-18 entre los grupos de estudio. La interleucina-18 es un biomarcador proinflamatorio producido por los macrófagos y está incrementado en otros tipos de reacciones de hipersensibilidad en personas (53, 54), por lo que se incluyó en este estudio por su potencial como biomarcador discriminatorio. No se ha demostrado que esta citocina aumente de manera confiable en perros con enfermedad crítica temprana (40, 50, 55, 56), lo que es consistente con los hallazgos de este estudio, incluso en perros con anafilaxia.
La concentración sérica de ALT tiene potencial como biomarcador diagnóstico de anafilaxia, ya que se ha demostrado que es significativamente mayor en perros con anafilaxia, en comparación con los perros con una reacción alérgica leve (2). Este hallazgo puede deberse a cambios en la perfusión hepática que pueden ocurrir durante la anafilaxia, incluyendo obstrucción de la salida venosa hepática y congestión venosa portal55-58. Este estudio corroboró aumentos no solo en la concentración sérica de ALT, sino también en la concentración de AST. Los aumentos en AST también surgen debido al daño muscular, que se ha reportado en personas después de un envenenamiento masivo de abejas (57). Sin embargo, la enfermedad crítica no anafiláctica puede asociarse con alteración de la perfusión hepática y daño de los miocitos, y ninguno de estos biomarcadores resultó ser suficientemente discriminatorio entre la anafilaxia y la enfermedad crítica.
Se han descrito tiempos de coagulación prolongados y hemoperitoneo en perros con anafilaxia (1, 15-17, 58), aunque se desconocen los mecanismos actuales. Los mecanismos propuestos han incluido la liberación de heparina de los mastocitos, la hiperfibrinólisis de la producción de triptasa y los efectos tóxicos directos del veneno de himenópteros a través de la actividad de la fosfolipasa A2 (59, 60). Aunque no encontramos diferencias significativas en los tiempos medios de coagulación entre los perros con anafilaxia y los perros sanos en este estudio, identificamos muchos perros con elevación de TP y/o TTPA por encima del intervalo de error de los tiempos de control sanos. Es importante destacar que estos cambios se detectaron antes de la administración de cualquier fluidoterapia. Además, las concentraciones de los anticoagulantes medidos, proteína C y antitrombina, fueron significativamente más bajas en los perros con anafilaxia, en comparación con los perros sanos. Esto proporciona evidencia de que puede estar ocurriendo un proceso de coagulación consuntivo. Se requiere una investigación adicional de los factores de coagulación individuales en una cohorte más grande de perros con anafilaxia, incluidos aquellos con evidencia clínica de coagulopatía o hemoperitoneo secundario a anafilaxia, con el fin de dilucidar aún más los mecanismos subyacentes de la coagulación alterada.
Este estudio preliminar de biomarcadores tiene varias limitaciones importantes. En primer lugar, los criterios clínicos para identificar los casos de anafilaxia eran estrictos en comparación con los estudios previos, requiriendo tanto signos dermatológicos como evidencia de exposición a insectos (1, 2, 15, 17). Aunque estos criterios maximizan la probabilidad de que todos los perros inscritos realmente sufrieran una reacción anafiláctica, pueden haber creado un sesgo en nuestra muestra de estudio, reduciendo la generalización a todos los perros con anafilaxia. La presencia de signos dermatológicos también puede haber sesgado las respuestas de los biomarcadores (21). Además, a pesar de los estrictos criterios de inclusión, este estudio puede haber incluido casos que fueron diagnosticados erróneamente con anafilaxia, aunque no se identificó un diagnóstico alternativo durante la hospitalización. La segunda limitación es el uso de una muestra de conveniencia para el grupo de enfermos críticos con un rango de gravedad de la enfermedad, que puede no representar el tipo de caso para el cual la anafilaxia es un diagnóstico diferencial genuino. El grupo de enfermedad crítica incluyó perros que tuvieron signos clínicos de enfermedad durante más de 12 horas antes de la presentación, lo que puede haber sesgado los resultados del análisis AUROC, dado que el momento de la toma de muestras de sangre es probablemente importante para la presencia o ausencia de ciertas elevaciones de biomarcadores. Otra consideración importante para el grupo de enfermos críticos fue la administración de fluidoterapia intravenosa antes de la recolección de muestras en 10 perros. Esto es importante ya que la administración de líquidos en bolo de gran volumen puede alterar los niveles de hialuronano y marcadores inflamatorios como IL-6, 10, CXCL8 y KC y, por lo tanto, puede haber afectado estos resultados (38, 51, 61). Los verdaderos efectos de la fluidoterapia intravenosa sobre el hialuronano y otros biomarcadores inflamatorios no se han resuelto por completo, especialmente cuando se utiliza la fluidoterapia para la corrección de la hipovolemia (51). Dos estudios en perros han identificado aumentos en la concentración de hialuronano después de la fluidoterapia para el manejo del shock (38) o la cirugía (61), en comparación con el valor basal. Sin embargo, es difícil separar el efecto de la agresión (ya sea shock o cirugía) del efecto de la fluidoterapia sobre la muda de hialurónico, y estos estudios pueden reflejar una combinación de ambos efectos. Un estudio en ovejas con sepsis identificó una concentración de IL-8 significativamente mayor en un punto de tiempo singular (12 h) en ovejas que fueron resucitadas con líquidos, en comparación con ovejas sin reanimación con líquidos, mientras que no se detectaron diferencias significativas en la concentración de hialuronano, IL6 e IL10 entre los grupos (62). También se considera la posibilidad de reducir la concentración de hialuronano y otros marcadores inflamatorios después de un bolo de líquidos (51). Los perros que recibieron líquido en el grupo de enfermedad crítica antes de la investigación no se excluyeron del análisis debido a preocupaciones de sesgo en los resultados, sin embargo, las concentraciones de biomarcadores resumidas post-hoc se han proporcionado en la Tabla Suplementaria 2. Los resultados de este estudio deben validarse en una cohorte más grande que incluya un grupo de comparación de enfermedad crítica aguda que tenga signos clínicos compatibles con un diagnóstico diferencial de anafilaxia, y que se inscriban antes de cualquier administración rápida de líquidos. Por último, el pequeño tamaño de la muestra puede haber dificultado la capacidad de encontrar diferencias significativas entre los grupos de tratamiento para algunos biomarcadores.
En conclusión, este estudio detectó algunas diferencias importantes entre los biomarcadores alérgicos, inflamatorios, de coagulación y de hepatopatía en perros con anafilaxia secundaria a sospecha de envenenamiento por insectos, perros sanos y perros con enfermedad crítica no anafiláctica. Identificamos evidencia de liberación de histamina, una respuesta inmune innata temprana, desprendimiento de glicocálix endotelial y consumo de anticoagulantes en perros con anafilaxia antes de cualquier tratamiento, en comparación con perros sanos. Este estudio también identificó la utilidad potencial de la concentración sérica de PCR, o una combinación de histamina sérica y concentración de PCR, para distinguir la anafilaxia de la enfermedad no anafiláctica. Este resultado es particularmente convincente dado que la PCR está fácilmente disponible en el entorno clínico, sin embargo, este resultado debe validarse en un estudio más amplio.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Ética Animal de la Universidad Murdoch. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
KT contribuyó al diseño del estudio, la recolección de muestras, el análisis de laboratorio y escribió el manuscrito. CB y LS contribuyeron al diseño del estudio, la recolección de muestras, el análisis de laboratorio y la revisión del manuscrito. GR contribuyó al diseño del estudio, análisis de laboratorio y revisión del manuscrito. MC y CS contribuyeron al diseño del estudio, la recolección de muestras y la revisión del manuscrito. AF contribuyó al diseño del estudio y a la revisión del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por el Fondo Australiano de Salud de Animales de Compañía y el Fondo de Cuidado de Mascotas de la Universidad de Murdoch.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.875339/full#supplementary-material
Referencias
1. Turner K, Boyd C, Stander N, Smart L. Características clínicas de doscientos treinta y dos perros (2006-2018) tratados por sospecha de anafilaxia en Perth, Australia Occidental. Aust Vet J. (2021) 99:505–12. doi: 10.1111/avj.13114
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Quantz JE, Miles MS, Reed AL, White GA. Elevación de las transaminasas alanina y las anomalías de la pared de la vesícula biliar como biomarcadores de anafilaxia en pacientes con hipersensibilidad canina. J Vet Emerg Critic Care. (2009) 19:536–44. doi: 10.1111/j.1476-4431.2009.00474.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Summers AM, Culler C, Cooper E. Derrame abdominal espontáneo en perros con presunta anafilaxia. J Vet Emerg Critic Care. (2021) 31:483–9. doi: 10.1111/vec.13070
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Finkelman FD. Anafilaxia: lecciones de modelos de ratón. J Alergia Clin Immunol. (2007) 120:506–15. doi: 10.1016/j.jaci.2007.07.033
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Guilarte M, Sala-Cunill A, Luengo O, Labrador-Horrillo M, Cardona V. Los mastocitos, el contacto y la conexión del sistema de coagulación en la anafilaxia. Frente Immunol. (2017) 8:32–6. doi: 10.3389/fimmu.2017.00846
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Francis A, Bosio E, Stone SF, Fatovich DM, Arendts G, Nagree Y, et al. Activación de neutrófilos durante la anafilaxia humana aguda: análisis de MPO y sCD62L. Clin Exp Alergia. (2017) 47:361–70. doi: 10.1111/cea.12868
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Shmuel DL, Cortés Y. Anafilaxia en perros y gatos. J Vet Emerg Critic Care. (2013) 23:377–94. doi: 10.1111/vec.12066
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Stone SF, Cotterell C, Isbister GK, Holdgate A, Brown SGA. Citocinas séricas elevadas durante la anafilaxia humana: identificación de posibles mediadores de reacciones alérgicas agudas. J Alergia Clin Immunol. (2009) 124:786–92.e4. doi: 10.1016/j.jaci.2009.07.055
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Shibamoto T, Liu W, Cui S, Zhang W, Takano H, Kurata Y, et al. En lugar de histamina, participa en la hipotensión anafiláctica del ratón. Farmacología. (2008) 82:114–20. doi: 10.1159/000141516
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Tchougounova E, Pejler G. Regulación de la coagulación extravascular y fibrinólisis por la quimasa de mastocitos dependiente de heparina. FASEB J. (2001) 15:1–25. doi: 10.1096/fj.01-0486fje
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Pejler G, Karlström A. La trombina es inactivada por la quimasa granulosa secretora de mastocitos. J Biol Chem. (1993) 268:11817–22. doi: 10.1016/S0021-9258(19)50273-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Sala-Cunill A, Björkqvist J, Senter R, Guilarte M, Cardona V, Labrador M, et al. La activación del sistema de contacto con plasma impulsa la anafilaxia en reacciones alérgicas graves mediadas por mastocitos. J Alergia Clin Immunol. (2015) 135(4):1031-43e.6. doi: 10.1016/j.jaci.2014.07.057
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Choi IH, Ha TY, Lee DG, Park H-J, Lee JH, Park YM, et al. Aparición de coagulación intravascular diseminada (CID) en la anafilaxia sistémica activa: papel del factor activador de plaquetas. Clin Exp Immunol. (1995) 100:390–4.
14. Mink SN, Bandas C, Becker A, Elkin J, Sharma S, Unruh H, et al. Efecto del bolo de epinefrina sobre la hemodinámica sistémica en el shock anafiláctico canino. Cardiovasc Res. (1998) 40:546–56.
15. Hnatusko AL, Gicking JC, Lisciandro GR. Hemioperitóneo relacionado con la anafilaxia en 11 perros. J Vet Emerg Critic Care. (2020) 1:15–6. doi: 10.1111/vec.13017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Birkbeck R, Greensmith T, Humm K, Tinson E. Hemoabdomen debido a sospecha de anafilaxia en cuatro perros. Vet Record Case Rep. (2019) 7:e000734–5. doi: 10.1136/vetreccr-2018-000734
17. Smith MR, Wurlod VA, Ralph AG, Daniels ER, Mitchell M. Tasa de mortalidad y factores pronósticos para perros con anafilaxia grave: 67 casos (2016-2018). J am vet med assoc. (2020) 256:1137–44. doi: 10.2460/javma.256.10.1137
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Spaulding KA. Esquina de ultrasonido del espesor de la pared de la vesícula biliar. Ecografía Radiol Veterinaria. (1993) 34:270–2.
19. Walter AM, Brien MA, Selmic LE, McMichael MA. Comparación de los hallazgos clínicos entre perros con sospecha de anafilaxia y perros con sepsis confirmada. J am vet med assoc. (2017) 251:281–8. doi: 10.2460/javma.251.6.681
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Brown SGA, Blackman KE, Heddle RJ. ¿Puede la triptasa de mastocitos sérica ayudar a diagnosticar la anafilaxia? Emerg Med Aust EMA. (2004) 16:120–4. doi: 10.1111/j.1742-6723.2004.00562.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Dybendal T, Guttormsen AB, Elsayed S, Askeland B, Harboe T, Florvaag E. Cribado de triptasa de mastocitos y anticuerpos IgE séricos en 18 pacientes con shock anafiláctico durante la anestesia general. Acta Anaesthesiol Scand. (2003) 47:1211–8. doi: 10.1046/j.1399-6576.2003.00237.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Francis A, Fatovich DM, Arendts G, Macdonald SP, Bosio E, Nagree Y, et al. Mediciones séricas de triptasa de mastocitos: sensibilidad y especificidad para el diagnóstico de anafilaxia en pacientes del servicio de urgencias con shock o hipoxemia. Emerg Med Aust. (2017) 30:366–74. doi: 10.1111/1742-6723.12875
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Lin RY, Schwartz LB, Curry A, Pesola GR, Knight RJ, Lee H-S, et al. Niveles de histamina y triptasa en pacientes con reacciones alérgicas agudas: un estudio realizado en el servicio de urgencias. J Alergia Clin Immunol. (2000) 106:65–71. doi: 10.1067/mai.2000.107600
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Ludolph-Hauser D, Ruëff F, Fries C, Schöpf P, Przybilla B. Concentraciones séricas constitutivamente elevadas de triptasa de mastocitos y reacciones anafilácticas graves a las picaduras de himenópteros. Lanceta. (2001) 357:361–2. doi: 10.1016/S0140-6736(00)03647-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Schwartz LB, Bradford TR, Rouse C, Irani AM, Rasp G, Van Der Zwan JK, et al. Desarrollo de un nuevo inmunoensayo más sensible para la triptasa humana: uso en anafilaxia sistémica. J Clin Immunol. (1994) 14:190–204. doi: 10.1007/BF01533368
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Schwartz LB, Yunginger JW, Bokhari R, Dull D. Curso temporal de la aparición y desaparición de la triptasa de mastocitos humanos en la circulación después de la anafilaxia. J Clin Investig. (1989) 83:1551–5. doi: 10.1172/JCI114051
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Schwartz LB, Metcalfe DD, Miller JS, Earl H, Sullivan T. Niveles de triptasa como indicador de la activación de mastocitos en la anafilaxia sistémica y la mastocitosis. Nuevo Engl J Med. (1987) 316:1622–6. doi: 10.1056/NEJM198706253162603
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Valent P, Akin C, Arock M, Brockow K, Butterfield JH, Carter MC, et al. Definiciones, criterios y clasificación global de los trastornos de los mastocitos con especial referencia a los síndromes de activación de mastocitos: una propuesta de consenso. Int Arch Allergy Immunol. (2012) 157:215–25. doi: 10.1159/000328760
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Frey MJ, Chesrown SE, Reed BR, Greenspon LW, Shields RL, Bourne HR, et al. Liberación inmunológica de histamina en el pulmón de perro: comparación de respuestas in vivo e in vitro en el mismo animal. J Alergia Clin Immunol. (1984) 74:728–37. doi: 10.1016/0091-6749(84)90237-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Lin RY, Trivino MR, Curry A, Pesola GR, Knight RJ, Lee H-S, et al. Niveles de interleucina 6 y proteína C reactiva en pacientes con reacciones alérgicas agudas: un estudio realizado en el servicio de urgencias. Ann Alergia Asma Immunol. (2001) 87:412–6. doi: 10.1016/S1081-1206(10)62923-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Galán A, Mayer I, Rafaj RB, Bendelja K, Sušić V, Cerón JJ, et al. MCP-1, KC-like e IL-8 como mediadores críticos de la patogénesis causada por Babesia canis. PLoS UNO. (2018) 13:E0190474–21. doi: 10.1371/journal.pone.0190474
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Gommeren K, Desmas I, García A, Bauer N, Moritz A, Roth J, et al. Concentraciones de citocinas inflamatorias y proteínas C reactivas en perros con síndrome de respuesta inflamatoria sistémica. J Vet Emerg Critic Care. (2017) 28:9–19. doi: 10.1111/vec.12685
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Goggs R, Letendre J-A. El grupo de alta movilidad box-1 y las citocinas proinflamatorias aumentan en los perros después de un traumatismo, pero no predicen la supervivencia. Frente Vet Sci. (2018) 5:S4–14. doi: 10.3389/fvets.2018.00179
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Lu H-Y, Chu Y, Wu Y-C, Liu C-Y, Hsieh M-J, Chao Y-K, et al. Respuestas hemodinámicas e inflamatorias tras la resección transumbilical y transtorácica en cuña pulmonar en un modelo canino vivo. Int J Surg. (2015) 16(Parte A):116–22. doi: 10.1016/j.ijsu.2015.02.027
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Liu H-F, Ren Q-M, Wang Z-B, Li X, Jiang S, Zhang J-T, et al. Comparación de variables proteicas y hemodinámicas en fase aguda en perros sometidos a neumonectomía videotoracoscópica vs. neumonectomía abierta. Exp Therap Med. (2017) 13:2391–8. doi: 10.3892/etm.2017.4257
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Tvarijonaviciute A, Eralp O, Kocaturk M, Yilmaz Z, Ceron JJ. La adiponectina y el IGF-1 son proteínas negativas de fase aguda en un modelo canino de endotoxemia aguda. Veterinario Immunol Immunopathol. (2011) 140:147–51. doi: 10.1016/j.vetimm.2010.11.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Solomon SB, Cortés-Puch I, Sun J, Remy KE, Wang D, Feng J, et al. Los glóbulos rojos más viejos almacenados transfundidos mejoran el curso clínico y el resultado en un modelo canino de hemorragia letal y reperfusión. Transfusión. (2015) 55:2552–63. doi: 10.1111/trf.13213
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Smart L, Boyd CJ, Claus MA, Bosio E, Hosgood G, Raisis A. El líquido cristaloide de gran volumen se asocia con un aumento de la eliminación de hialuronano y la inflamación en un modelo de shock hemorrágico canino. Inflamación. (2018) 11:1–9. doi: 10.1007/s10753-018-0797-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Rau S, Kohn B, Richter C, Fenske N, Kuechenhoff H, Hartmann K, et al. La respuesta plasmática a la interleucina-6 es predictiva de la gravedad y la mortalidad en el síndrome de respuesta inflamatoria sistémica canina y la sepsis. Veterinario Clin Pathol. (2007) 36:253–60. doi: 10.1111/j.1939-165x.2007.tb00220.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Floras ANK, Holowaychuk MK, Bienzle D, Bersenas AME, Sharif S, Harvey T, et al. Péptido pro-C-natriurético N-terminal y cinética de citocinas en perros con endotoxemia. J Veterinario Pasante Med. (2014) 28:1447–53. doi: 10.1111/jvim.12409
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Vandenbroucke JP, von Elm E, Altman DG, Gøtzsche PC, Mulrow CD, Pocock SJ, et al. Fortalecimiento de la presentación de informes de estudios observacionales en epidemiología (STROBE): explicación y elaboración. Ann Pasante Med. (2007). 147:1628–54. doi: 10.1016/j.gaceta.2008.12.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Sampson HA, Muñoz-Furlong A, Campbell RL., Adkinson Jr NF, Bock SA, Branum A, et al. Segundo simposio sobre la definición y el tratamiento de la anafilaxia: informe resumido—Segundo simposio del Instituto Nacional de Alergias y Enfermedades Infecciosas/Red de Alergias Alimentarias y Anafilaxia J Allergy Clin Immunol. (2006) 117:391–7. doi: 10.1016/j.jaci.2005.12.1303
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Turner PJ, Worm M, Ansotegui IJ, El-Gamal Y, Rivas MF, Fineman S, et al. ¿Es hora de revisar la definición y los criterios clínicos de la anafilaxia? Órgano Mundial de Alergia J. (2019) 12:100066. doi: 10.1016/j.waojou.2019.100066
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Hackett TB. Exploración física y valoración diaria del paciente crítico. Segunda Edición ed. Ámsterdam: Elsevier Inc. (2015). págs. 6-10.
45. Boyd CJ, Sharp CR, Claus MA, Raisis AL, Hosgood G, Smart L. Ensayo clínico prospectivo, aleatorizado, controlado y ciego que evalúa biomarcadores de lesión renal aguda después de almidón de hidroxietilo al 6% 130/0.4 o la solución de Hartmann en perros. J Vet Emerg Critic Care. (2021) 31:306–14. doi: 10.1111/vec.13056
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Hornung RW, Reed LD. Estimación de la concentración media en presencia de valores no detectables. Appl Occup Environ Hyg. (1990) 5:46–51. doi: 10.1080/1047322X.1990.10389587
47. Gaudette SM, Hughes D, Sharp CR, Bailey SR, Dandrieux JRS, Santos LL, et al. Los biomarcadores de activación endotelial están aumentados en perros con sepsis grave (Póster). J Vet Emerg Crit Care. (2018) 28:S14. doi: 10.1111/vec.12758
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Cerón JJ, Eckersall PD, Martinez-Subiela S. Proteínas de fase aguda en perros y gatos: conocimiento actual y perspectivas futuras. Veterinario Clin Pathol. (2005) 34:85–99. doi: 10.1111/j.1939-165x.2005.tb00019.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Haraguchi T, Kimura S, Itoh H, Nishikawa S, Hiyama M, Tani K, et al. Comparación del dolor postoperatorio y la reacción inflamatoria en perros sometidos a gastropexia preventiva asistida por laparoscopia e incisional. J Vet Med Sci. (2017) 79:1524–31. doi: 10.1292/jvms.17-0103
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Goggs R, Letendre J-A. Evaluación de la respuesta de citocinas del huésped en perros con sepsis y síndrome de respuesta inflamatoria sistémica no infecciosa. J Vet Emerg Critic Care. (2019) 29:593–603. doi: 10.1111/vec.12903
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Inteligente L, Hughes D. Los efectos de la fluidoterapia de reanimación en la capa superficial endotelial. Frente Vet Sci. (2021) 8:661660. doi: 10.3389/fvets.2021.661660
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Fisher McD M. Observaciones clínicas sobre la fisiopatología y el tratamiento del colapso cardiovascular anafiláctico. Anaesth Intens Care. (1986) 14:17–21. doi: 10.1177/0310057X8601400105
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Tanaka H, Miyazaki N, Oashi K, Teramoto S, Shiratori M, Hashimoto M, et al. La IL-18 podría reflejar la actividad de la enfermedad en la exacerbación leve y moderada del asma. J Alergia Clin Immunol. (2001) 107:331–6. doi: 10.1067/mai.2001.112275
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Sanders NL, Mishra A. Papel de la interleucina-18 en la fisiopatología de las enfermedades alérgicas. Factor de crecimiento de citocinas Rev. (2016) 32:31–9. doi: 10.1016/j.cytogfr.2016.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Kjelgaard-Hansen M, Goggs R, Wiinberg B, Chan DL. Uso de concentraciones séricas de interleucina-18 y proteína quimioatrayente monocitaria-1 como indicadores pronósticos en la anemia hemolítica inmunomediada primaria en perros. J Veterinario Pasante Med. (2011) 25:76–82. doi: 10.1111/j.1939-1676.2010.0642.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Johnson V, Burgess B, Morley P, Bragg R, Avery A, Dow S. Comparación de las respuestas de citocinas entre perros con sepsis y perros con anemia hemolítica inmunomediada. Veterinario Immunol Immunopathol. (2016) 180:15–20. doi: 10.1016/j.vetimm.2016.08.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. França F, Benvenuti LA, Fan HW, Dos Santos DR, Hain SH, Picchi-Martins FR, et al. Ataques masivos severos y mortales de abejas «asesinas» (abejas melíferas africanizadas, Apis mellifera scutellata) en Brasil: estudios clinicopatológicos con medición de suero. Q J Med. (1994) 87:269–82.
58. Caldwell DJ, Petras KE, Mattison BL, Wells RJ, Heffelman VL. Hemoperitóneo espontáneo y shock anafiláctico asociado a envenenamiento por himenópteros en un perro. J Vet Emerg Critic Care. (2018) 28:476–82. doi: 10.1111/vec.12751
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Lombardini C, Helia R-E, Boehlen F, Merlani P. «Heparinización» e hiperfibrinogenólisis por picadura de avispa. Am J Emerg Med. (2009) 27:1176.e1–.e3. doi: 10.1016/j.ajem.2009.02.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Petroianu G, Liu J, Helfrich U, Maleck W, Rüfer R. Anomalías de la coagulación inducidas por la fosfolipasa A2 después de la picadura de abeja. Am J Emerg Med. (2000) 18:22–7.
61. Beiseigel M, Simon BT, Michalak C, Stickney MJ, Jeffery U. Efecto de la tasa de líquido cristaloide perioperatorio en el hialuronano circulante en perros sanos: un estudio piloto. Veterinario J. (2021) 267:105578. doi: 10.1016/j.tvjl.2020.105578
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Byrne L, Obonyo NG, Diab SD, Dunster KR, Passmore MR, Boon A-C, et al. Consecuencias no deseadas: la reanimación con líquidos empeora el shock en un modelo ovino de endotoxemia. Am J Resp Crit Care. (2018) 198:1043–54. doi: 10.1164/rccm.201801-0064oc
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Proteína C reactiva, histamina, proteína C (PC), antitrombina (AT), hialurónico, triptasa de mastocitos, anafilaxia canina, citocinas
Cita: Turner K, Boyd C, Rossi G, Sharp CR, Claus MA, Francis A y Smart L (2022) Biomarcadores de alergia, inflamación, hepatopatía y coagulación en perros con sospecha de anafilaxia por envenenamiento por insectos. Frente. Vet. Sci. 9:875339. doi: 10.3389/fvets.2022.875339
Recibido: 14 de febrero de 2022; Aceptado: 18 de julio de 2022;
Publicado: 08 Agosto 2022.
Editado por:
Tanmoy Rana, Universidad de Ciencias Animales y Pesqueras de Bengala Occidental, India
Revisado por:
Ivayla Danielova Yozova, Universidad de Massey, Nueva Zelanda
Scott P. Commins, Universidad de Carolina del Norte en Chapel Hill, Estados
Unidos Steven Epstein, Universidad de California, Davis, Estados Unidos
Derechos de autor © 2022 Turner, Boyd, Rossi, Sharp, Claus, Francis y Smart. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Kate Turner, kate.turner@murdoch.edu.au
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


