Cambios asociados con la edad en los biomarcadores de salud intestinal en perros

Cambios asociados con la edad en los biomarcadores de salud intestinal en perros
 Anna Fernández-Pinteño1*
Anna Fernández-Pinteño1*  Raquel Pilla2
Raquel Pilla2  Xavier Manteca3
Xavier Manteca3  Jan Suchodolski2
Jan Suchodolski2  Celina Torre1
Celina Torre1  Anna Salas-Mani1
Anna Salas-Mani1- 1Departamento de Investigación y Desarrollo, Affinity Petcare, L’Hospitalet de Llobregat, España
- 2Laboratorio Gastrointestinal, Departamento de Ciencias Clínicas de Pequeños Animales, Texas A&M University, College Station, TX, Estados Unidos
- 3Facultad de Ciencias Veterinarias, Universitat Autònoma de Barcelona, Bellaterra, España
El microbioma intestinal es fundamental para mantener la salud del huésped. En humanos sanos, el proceso de envejecimiento es uno de los principales factores que modulan los cambios en la microbiota intestinal. Sin embargo, se sabe poco sobre la relación entre la salud intestinal, la microbiota y el proceso de envejecimiento en los perros. El presente estudio tiene como objetivo explorar las diferencias en la microbiota intestinal y la salud intestinal basadas en biomarcadores fecales en una población de perros de diferentes edades. En el estudio participaron 106 perros de diferentes razas con edades comprendidas entre 0,2 y 15 años categorizados como mayores (>7 años; n = 40), adulto (2–7 años; n = 50), y junior (<2 años; n = 16). Las muestras fecales se recogieron durante el mismo período en las mismas instalaciones. El análisis incluyó los siguientes indicadores de salud intestinal: secuenciación del gen 16S rRNA para investigar las diferencias en la microbiota fecal; qPCR para determinar el índice de disbiosis; concentraciones fecales de ácidos grasos de cadena corta; calprotectina fecal; e inmunoglobulina A. El análisis de diversidad beta reveló una diferencia significativa con un tamaño de efecto pequeño (p = 0,003; R = 0,087) entre las categorías de edad basadas en la métrica UniFrac no ponderada, pero no se observó significancia basada en la métrica UniFrac ponderada o las distancias de Bray-Curtis. No hubo diferencias significativas en las medidas de diversidad alfa o el índice de disbiosis fecal entre las categorías de edad. Los perros mayores tuvieron proporciones de abundancia relativa significativamente más altas en los filos Bacteroidota y Pseudomonadota y el género Faecalibacterium, pero no en el análisis de qPCR. A nivel familiar, Ruminococcaceae, Uncl. Las abundancias de Clostridiales.1, Veillonellaceae, Prevotellaceae, Succinivibrionaceae y Bacteroidaceae fueron mayores en la categoría senior que en las categorías adulta y/o junior. Las proporciones relativas, pero no las concentraciones de acetato fecal, fueron mayores en la categoría senior, mientras que el butirato, el ácido isovalérico y el ácido valérico fueron más bajos. La concentración de ácido valérico fue significativamente menor en la categoría senior que en la categoría de adultos. Los niveles de calprotectina e inmunoglobulina A no difirieron significativamente entre los grupos. En conclusión, este estudio observó múltiples cambios menores en la composición de la microbiota fecal y la cantidad relativa de ácidos grasos de cadena corta en perros entre diferentes grupos de edad, pero se justifican estudios en poblaciones más grandes representativas de todas las edades para refinar los resultados actuales.
1. Introducción
El microbioma intestinal se define como toda la colección de microorganismos que viven en el tracto gastrointestinal, dominados por bacterias y complementados por poblaciones comensales de hongos, virus, arqueas y protistas (1). Tiene la mayor población de microbiota en el cuerpo en comparación con otros órganos colonizados. Se estima que la microbiota intestinal está compuesta por 1013-1014 (2), y su genoma es 150 veces más grande que el genoma humano.
El microbioma intestinal juega un papel importante en el estado fisiológico y patológico de su huésped. Participa en múltiples funciones metabólicas, protege contra patógenos y desempeña un papel crucial en la respuesta inmune. Estos procesos son críticos para mantener el estado de salud del huésped (3). La composición de la microbiota es crucial para mantener una funcionalidad intestinal equilibrada. Una microbiota desequilibrada o alterada está relacionada con varias enfermedades intestinales y extraintestinales (4).
Cada vez hay más estudios que evalúan los diferentes elementos que modulan la microbiota intestinal (5-8). Los principales factores se pueden clasificar en externos e internos, incluyendo, por ejemplo, la dieta y los tratamientos farmacológicos y la edad y la genética, respectivamente. Además, los trastornos patológicos (por ejemplo, inflamación y diabetes tipo 2) pueden inducir desviaciones en la microbiota intestinal, causando un desequilibrio en la microbiota intestinal, definida como disbiosis. Entre todos estos factores, la edad es una de las variables más importantes que hay que tener en cuenta a la hora de estudiar la evolución y los cambios de la microbiota intestinal.
El envejecimiento y su relación con la salud intestinal y la microbiota intestinal se están explorando actualmente en mamíferos, y ya están bien establecidos en humanos. Badal et al. (9) resumieron el conocimiento actual de la microbiota intestinal humana, considerando la composición, la función y los productos metabólicos de la microbiota en relación con el envejecimiento y la esperanza de vida. Se han descrito cambios en la microbiota humana relacionados con la edad y aparentemente están asociados con el escenario de salud del huésped. Por ejemplo, las bifidobacterias pertenecientes a miembros del género Bifidobacterium, que se consideran un grupo bacteriano beneficioso, disminuyen durante el cambio de la mediana edad a la vejez. Por el contrario, Clostridium perfringens, lactobacilos, enterococos y enterobacterias aumentan durante el proceso de envejecimiento (10). A diferencia de la microbiota humana, las bifidobacterias pueden no desempeñar un papel importante en la salud intestinal del perro, según los resultados reportados por Masuoka et al. (10), en los que las bifidobacterias solo se encontraron en la mitad de los perros más jóvenes y ninguno de los perros adultos muestreados, aunque las diferencias en las metodologías deben tenerse en cuenta al interpretar estos resultados.
Ya se ha descrito la existencia de una microbiota central en perros sanos (11). Además, Ziese y Suchodolski (12) asociaron los cambios en la microbiota fecal canina con ciertas patologías. Garrigues et al. (13) revisaron recientemente el desarrollo de la microbiota intestinal durante las primeras etapas de la vida canina, apoyando los cambios observados en las comunidades bacterianas desde el día 2 de edad hasta las 52 semanas. El día 2 después del nacimiento, la riqueza de la microbiota intestinal aumenta, y del día 2 al 21, el predominio de Bacillota se sustituye por un codominio de Bacillota, Bacteroidota y Fusobacteriota (14). Los cachorros en las primeras semanas de vida tienen microbiota inmadura, caracterizada por un mayor índice de disbiosis (DI), abundancia de Clostridium difficile y disminución de Clostridium hiranonis en comparación con los perros adultos (15). Aproximadamente después de los 4-6 meses de edad, la microbiota se asemeja a la observada en perros adultos y permanece en gran medida estable en la edad adulta (13). Sin embargo, la relación entre la microbiota intestinal, las condiciones de salud intestinal y el proceso de envejecimiento en perros mayores no está bien establecida. Se necesitan estudios en este campo primero para comprender esta relación y luego explorar estrategias efectivas para mejorar la calidad del proceso de envejecimiento en perros desde esta perspectiva.
El presente estudio tuvo como objetivo investigar las diferencias en la microbiota intestinal y la salud intestinal basadas en biomarcadores fecales en una población de perros de diferentes edades, con un enfoque especial en la categoría senior.
2. Materiales y métodos
Todas las muestras recogidas de perros estaban de acuerdo con la directiva 2010/63/UE, y se llevaron a cabo procedimientos adicionales a la rutina diaria de los perros. Antes del estudio, el protocolo se compartía con el Comité de Ética de Affinity para garantizar las buenas prácticas y el bienestar de los animales. Todos los perros fueron alojados en el Affinity Nutrition Center (Barcelona, España).
2.1. Animales
En el estudio participaron 106 perros de razas múltiples (n = 53 perros machos; n = 53 perras) con edades comprendidas entre 0,2 y 15,0 años (edad media = 6,3 años). Las razas de perros que participaron en el estudio fueron las siguientes: Beagle, Bichón Maltés, Jack Russell Terrier, Boxer, Pointer Alemán de Pelo Corto, Caniche, Chihuahua, Cocker Spaniel, Dálmata, Pastor Alemán, Perro de Agua Español, Pinscher Miniatura, Podenco Andaluz, Pointer, Pomerania, Miniatura, Schnauzer, Shih Tzu, Brittany Spaniel y Yorkshire Terrier [información detallada está en la Tabla Suplementaria 1]. Los animales fueron agrupados en categorías junior (J), adulto (A) y senior (S), considerando los respectivos rangos de edad: hasta 2 años, de 2 a 7 años y más de 7 años (Tabla 1).
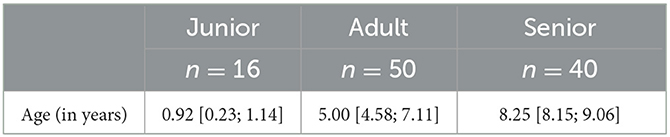 Tabla 1. Información descriptiva sobre la distribución por edades de los perros ordenados por categoría de edad.
Tabla 1. Información descriptiva sobre la distribución por edades de los perros ordenados por categoría de edad.
Los animales vivían en perreras en grupos de entre dos y siete individuos, dependiendo del tamaño de los perros. Los perros que viven en parejas compartieron un área de 15 m2, mientras que los que vivían en grupos más grandes compartían un área de 57-60 m2. Todos los animales tenían acceso gratuito a las partes exteriores e interiores de sus perreras, y pasaban entre 2 y 4 horas por día en un parque al aire libre más grande donde podían socializar con un grupo más grande de perros.
El suministro de agua era ad libitum. Se fabricaron y ofrecieron dietas no específicas debido al estudio. Los perros fueron alimentados con dietas comercialmente disponibles, secas-completas y equilibradas adecuadas a sus necesidades. Además, el 54% de los perros fueron alimentados con una dieta constante, mientras que la dieta se cambió para el 46% de los perros antes y durante el período de recolección. Todas las dietas cumplieron con todos los requisitos de proteínas, grasas, vitaminas y minerales recomendados por FEDIAF (16). La mayoría de los perros en el estudio (89%) fueron alimentados con dietas formuladas con el siguiente rango de composición: 7-8% de humedad, 22-30% de proteína, 15-21% de grasa y 2-5% de fibra. El resto de los perros (11%) estaban fuera de rango debido a la composición de proteínas, grasas y / o fibra [la información detallada se encuentra en la Tabla Suplementaria 2]. Los niveles de minerales y vitaminas fueron similares en todas las dietas que estuvieron presentes a lo largo del estudio.
Los criterios de inclusión para la inscripción fueron generalmente animales sanos y comprendieron perros machos y hembras esterilizados de todas las razas y edades puras. Según la literatura, los criterios de exclusión incluyeron la presencia de enfermedad clínica o cualquier tratamiento farmacológico que pudiera interferir con la microbiota intestinal y/o la salud intestinal. Específicamente, no se administraron antibióticos, AINE, IBP, prebióticos, probióticos o tratamientos antiparasitarios durante o 4 semanas antes del muestreo. Ninguno de los animales que participaron en este estudio fueron alimentados con dietas que contenían probióticos. Los perros con heces acuosas, blandas o sin formación en tres muestras consecutivas fueron excluidos del estudio. No se observaron signos clínicos compatibles con trastornos gastrointestinales (como vómitos, regurgitación e hiporexia) en ninguno de los animales que participaron en el estudio.
2.2. Recolección fecal
Las muestras se recolectaron durante 3 meses (marzo, abril y mayo) sin interferir con las rutinas diarias de los perros. Las heces se recolectaron a través de la observación directa, mientras que los animales se mantuvieron en sus perreras o áreas recreativas al aire libre. La mayoría de las muestras se obtuvieron durante el primer mes, pero debido al volumen de muestras y las rutinas fisiológicamente atípicas de algunos animales, la recolección se extendió hasta 3 meses. En todos los casos, se evitó individualizar a los animales y/o utilizar jaulas para recoger las muestras.
Se recolectó una muestra de heces por perro, y primero se calificó de acuerdo con una escala adaptada de cinco puntos de consistencia fecal (0 = heces acuosas; 25 = heces blandas sin formar; 50 = heces suaves formadas y húmedas que conservan la forma cuando se recolectan; 75 = heces formadas duras que permanecen en forma pero blandas; y 100 = heces secas duras). El sistema de puntuación fue adaptado de la escala de cinco puntos previamente descrita por Strickling et al. (17).
Si la consistencia fecal era igual o inferior a 50, la muestra no se recolectó y los investigadores esperaron una puntuación fecal más alta. Se tomó toda la materia fecal o cantidad suficiente para llenar el tubo de recolección fecal estéril con 250 ml. Los contaminantes externos (piedras, hierba, arena, etc.) fueron desechados. Todas las muestras se procesaron dentro de las 4 h posteriores a la deposición. Todos los materiales utilizados, desde la recolección de muestras hasta la separación en alícuotas, eran estériles y estaban destinados a un solo uso.
Las heces se dividieron en dos alícuotas diferentes según el análisis a realizar. Para el análisis de la microbiota, se prepararon entre 0,5 y 1 g de heces en un tubo estéril de 1,5 ml libre de ARNasa. Para el análisis de ácidos grasos de cadena corta (AGCC), la calprotectina (cCP) y la inmunoglobulina A (IgA) se llenaron en un tubo de heces estéril con 5 g de heces. Ambos tubos se almacenaron a -80 ° C antes de ser enviados y analizados en el Departamento de Ciencias Clínicas de Pequeños Animales de la Universidad de Texas A&M (College Station, TX).
2.3. Biomarcadores fecales
2.3.1. Análisis de la microbiota
La secuenciación de Illumina de los genes 16S rRNA bacterianos se realizó utilizando cebadores 515F (5′-GTGYCAGCMGCCGCGGTAA) (18) a 806RB (5′-GGACTACNVGGGTWTCTAAT) (19) en el laboratorio de ADN MR (Shallowater, TX, EUA).
Las secuencias se procesaron y analizaron utilizando la tubería Quantitative Insights Into Microbial Ecology 2 (QIIME 2) (20) v 2021.8. Las secuencias sin procesar se cargaron en el NCBI Sequence Read Archive bajo la identificación BioProject PRJNA901473. En resumen, las secuencias fueron demultiplexadas, y la tabla ASV fue creada usando DADA2 (21). Antes del análisis posterior, se eliminaron las secuencias asignadas como cloroplasto, mitocondrias y ASV de baja abundancia, que contenían < 0,01% de las lecturas totales en el conjunto de datos. Todas las muestras se enrarecieron a una profundidad de secuenciación uniforme, basada en la profundidad de lectura más baja de las muestras, a 21.025 secuencias por muestra.
La diversidad alfa se midió con las métricas de diversidad Chao1 (riqueza) y Shannon dentro de QIIME2. La diversidad beta se evaluó con la métrica de distancia UniFrac (22) basada en filogenia no ponderada y ponderada (medidas que consideran información filogenética) y la métrica de distancia de Bray-Curtis y se visualizó utilizando gráficos de Análisis de Coordenadas Principales (PCoA), generados dentro de QIIME2.
El índice de disbiosis (logDNA) se basa en un algoritmo validado que considera un panel de ocho grupos bacterianos identificados mediante un ensayo de PCR cuantitativa para bacterias totales, Faecalibacterium spp., Turicibacter spp., Escherichia coli, Streptococcus spp., Blautia spp., Fusobacterium spp. y Clostridium hiranonis (23). Un DI de <0 se definió como normal, un DI entre 0 y 2 se definió como un cambio de microbiota leve a moderado, y un DI de >2 se consideró disbiosis significativa.
2.3.2. Indicadores de salud intestinal
Las concentraciones de AGCC (acetato, propionato, butirato, ácido isobutírico, ácido isovalérico y ácido valérico) en las heces se midieron mediante un ensayo de cromatografía de gases de dilución de isótopos estables-espectrometría de masas (GC-MS) con algunas modificaciones (24). Para considerar la diferencia en el contenido de agua entre las muestras fecales, las concentraciones finales de AGCC fecales se ajustaron mediante materia seca fecal (MS) y se expresaron como μmol/g de MS fecal (25).
La IgA fecal (mg/g) se cuantificó utilizando el kit ELISA comercial para la determinación de IgA canina (Bethyl Laboratories, Montgomery, TX, EUA). La cuantificación del cCP fecal (ng/g) también se analizó utilizando el kit ELISA previamente validado en perros (26, 27).
2.4. Análisis estadístico
Para el análisis estadístico de los datos de la microbiota, se realizó una prueba de análisis de similitud (ANOSIM) dentro del paquete de software PRIMER 7 (PRIMER-E Ltd., Luton, Reino Unido) para analizar las diferencias significativas en las comunidades microbianas y el efecto del tamaño (valores R entre 0 y 1; un valor R más alto indica un efecto de tamaño mayor) entre los grupos de edad (J, A y S). Todos los conjuntos de datos se probaron para determinar su normalidad mediante la realización de la prueba Shapiro-Wilk (JMP Pro 11, SAS Software Inc.). Se realizó la prueba de Kruskal-Wallis (Prism v. 9, GraphPad Software Inc.), seguida de una prueba de comparación múltiple post-hoc de Dunn, para determinar las diferencias de grupos de edad en taxones bacterianos (incluyendo filo, clase, orden, familia, género y especie). Todos los valores de p se ajustaron para comparaciones múltiples utilizando la tasa de descubrimiento falso de Benjamini y Hochberg (28) en cada nivel taxonómico, y un valor p ajustado de <0,05 (valor q) se consideró estadísticamente significativo.
Para el análisis estadístico general, el modelo incluyó información demográfica como variable explicativa e indicadores fecales como variables de respuesta. La principal variable explicativa fue la edad, que se agrupó en las tres categorías diferentes descritas. Las posibles variables explicativas incluyeron las siguientes: peso corporal, sexo, «rutina de alimentación», «vivienda» y «raza». Se establecieron dos categorías para las rutinas de alimentación: rotación (R), si los animales cambiaban el tipo de dieta en períodos inferiores a 2 semanas, y estable (S), si los animales comían la misma dieta durante al menos 4 semanas. Ningún animal tuvo un cambio de dieta en el rango de 2 a 4 semanas. Cada animal solo fue asignado a una categoría durante todo el estudio. La vivienda fue la variable definida para identificar los tres edificios diferentes donde se asignaron los animales. Finalmente, en cuanto a la raza, los perros se clasificaron en dos grupos: beagles y perros no beagle. Las diferentes razas no se analizaron estadísticamente debido al alto número de razas diferentes, sino debido al bajo número de perros dentro de cada raza; Sin embargo, el tamaño del perro se introdujo en el análisis estadístico para reducir la heterogeneidad de los perros que participaron en el estudio. Las variables de respuesta consideradas en el análisis estadístico general fueron las siguientes: consistencia fecal; concentración de AGCC (acetato, propionato, butirato, ácido isobutírico, ácido isovalérico, ácido valérico y AGCC total); Cantidades relativas de AGCC (acetato, propionato, butirato, ácido isobutírico y ácido isovalérico); calprotectina; inmunoglobulina A; diversidad alfa (diversidad Chao 1 y Shannon); y finalmente, de qPCR, bacterias totales, Faecalibacterium, Turicibacter, Streptococcus, E. coli, Blautia, Fusobacterium, Clostridium hiranonis, Bifidobacterium, Bacteroides, Lactobacillus e índice de disbiosis.
Para el análisis estadístico general, se realizó una primera estadística de resumen, en la que se analizaron variables cuantitativas utilizando la media y la desviación estándar. Las variables cualitativas fueron probadas utilizando frecuencias relativas y absolutas. La existencia de diferencias entre los grupos de edad se comprobó mediante la realización de las pruebas apropiadas (ANOVA y prueba de Kruskal-Wallis), considerando la hipótesis nula de igualdad entre los grupos. El cumplimiento de los criterios de aplicación se evaluó mediante la realización de la prueba de normalidad de Shapiro-Wilk. La relación entre las variables cuantitativas se analizó utilizando la correlación de Spearman.
Para analizar la relación entre las categorías de edad y los marcadores fecales, se consideró el modelo lineal apropiado, que incluye posibles variables explicativas como el peso corporal, el sexo, las rutinas de alimentación y la raza de vivienda. Las medias estimadas (emmeans) para las categorías de edad se calcularon utilizando el modelo ajustado. También se realizaron comparaciones post-hoc por pares y se analizó la validación del modelo mediante la realización de un análisis gráfico residual. Para los análisis estadísticos generales, las diferencias se consideraron significativas con un valor de p de <0,05.
3. Resultados
3.1. Análisis cuantitativo de PCR en tiempo real e índice de disbiosis
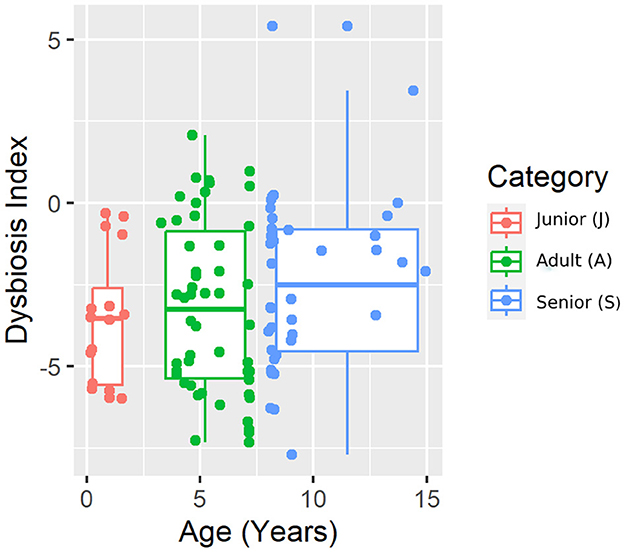
Los resultados del análisis de qPCR se resumen en la Tabla 2. La abundancia de Bifidobacterium fue diferente entre J y A, siendo mayor en A. Sin embargo, no se encontraron diferencias al considerar S vs. J y A. El índice de disbiosis calculado no fue diferente entre las categorías de edad (Figura 1). En J, 0 de 16 (0%) perros tenían un DI de >0, mientras que en A y S, 8 de 50 (16%) y 5 de 40 (13%) perros tenían un DI de >0.
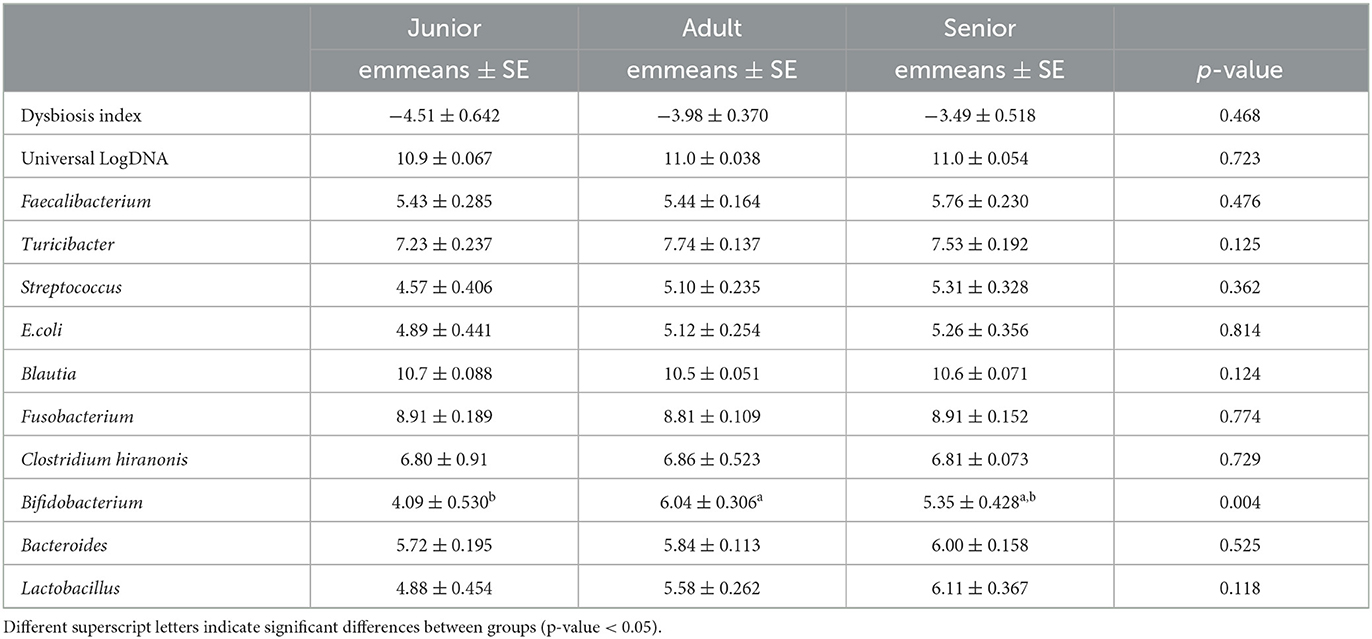 Tabla 2. Resultados de la PCR cuantitativa en tiempo real (abundancia expresada como LogDNA) y valores del índice de disbiosis calculado (ratio).
Tabla 2. Resultados de la PCR cuantitativa en tiempo real (abundancia expresada como LogDNA) y valores del índice de disbiosis calculado (ratio).
3.2. Secuenciación del ARNr 16s
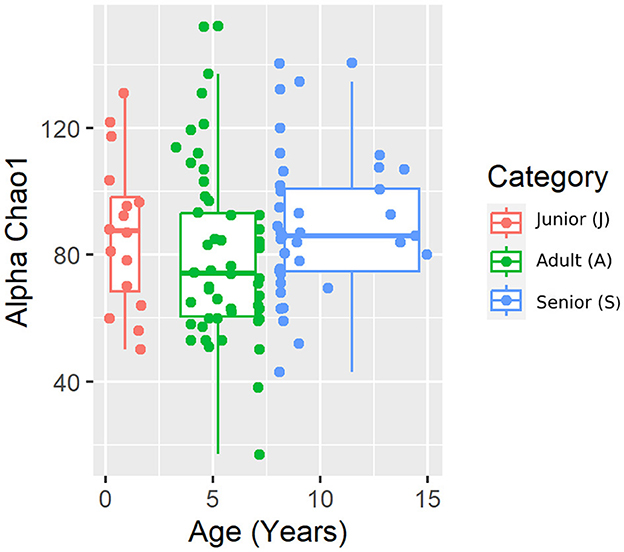
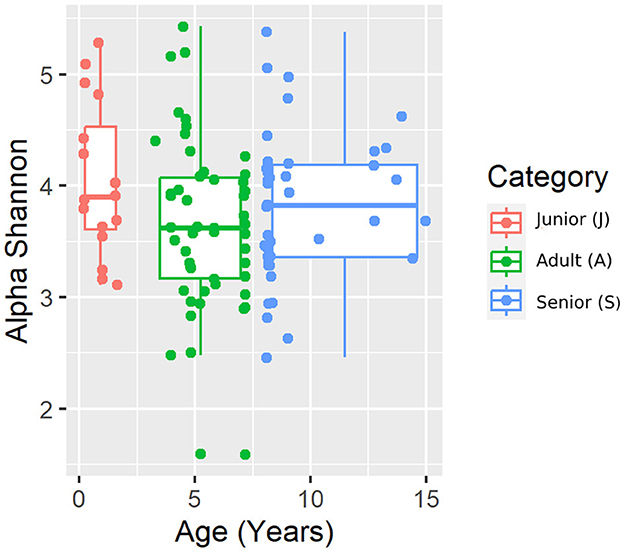
Se obtuvieron un total de 3.856.065 secuencias de ARNr 16S bacteriano de calidad a partir de las 106 muestras fecales analizadas. El recuento de rango por muestra estuvo entre 21.030 y 60.827 (mediana: 33.688 y media: 36.378). La diversidad beta se analizó mediante las distancias UniFrac ponderadas y no ponderadas y la distancia Bray-Curtis. El análisis UniFrac no ponderado de similitudes, que solo considera la presencia o ausencia de taxones individuales, reveló diferencias significativas en las comunidades microbianas entre las categorías de edad (gráfico PCoA que se muestra en la Figura 2). Sin embargo, no se observó significancia basada en la métrica UniFrac ponderada o las distancias de Bray-Curtis (Tabla 3). Los índices de diversidad alfa (Chao1 y Shannon) no fueron significativamente diferentes entre los grupos de edad (Figuras 3, 4).
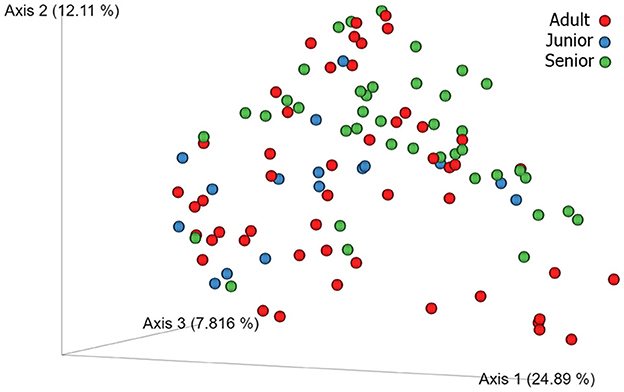 Figura 2. Patrones de diversidad beta 3D de la microbiota fecal canina comparando las categorías Adulto (rojo), Junior (azul) y Senior (verde) basadas en la distancia UniFrac no ponderada.
Figura 2. Patrones de diversidad beta 3D de la microbiota fecal canina comparando las categorías Adulto (rojo), Junior (azul) y Senior (verde) basadas en la distancia UniFrac no ponderada.
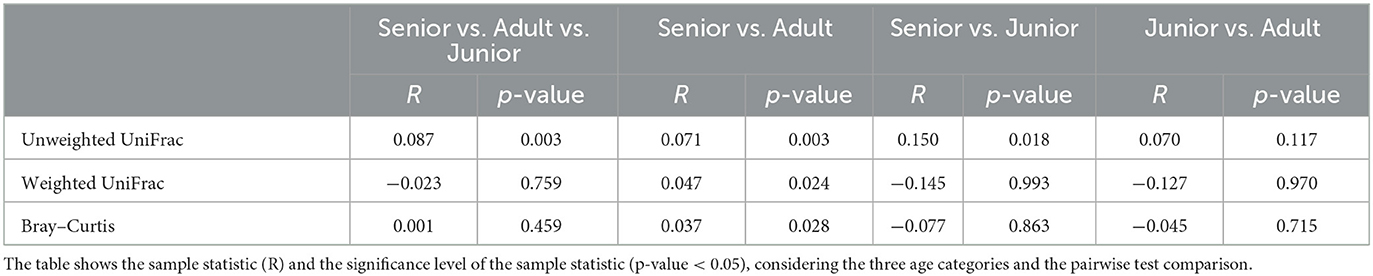 Tabla 3. Resultados del análisis de diversidad beta, incluidas las distancias no ponderadas de UniFrac, UniFrac ponderado y Bray-Curtis.
Tabla 3. Resultados del análisis de diversidad beta, incluidas las distancias no ponderadas de UniFrac, UniFrac ponderado y Bray-Curtis.
3.2.1. Nivel taxonómico del filo
Cuando se estudió la abundancia relativa bacteriana a nivel de impuestos, el filo principal identificado fue Bacillota, seguido de Actinomycetota, Fusobacteriota, Bacteroidota y Pseudomonadota. La misma distribución, considerando la abundancia relativa, se describió en las tres categorías de edad. Se encontraron diferencias significativas para el filo Bacteroidota y Pseudomonadota, en el cual S tuvo mayor abundancia que A y J (Tabla 4). Sin embargo, el valor q corregido no alcanzó significación.
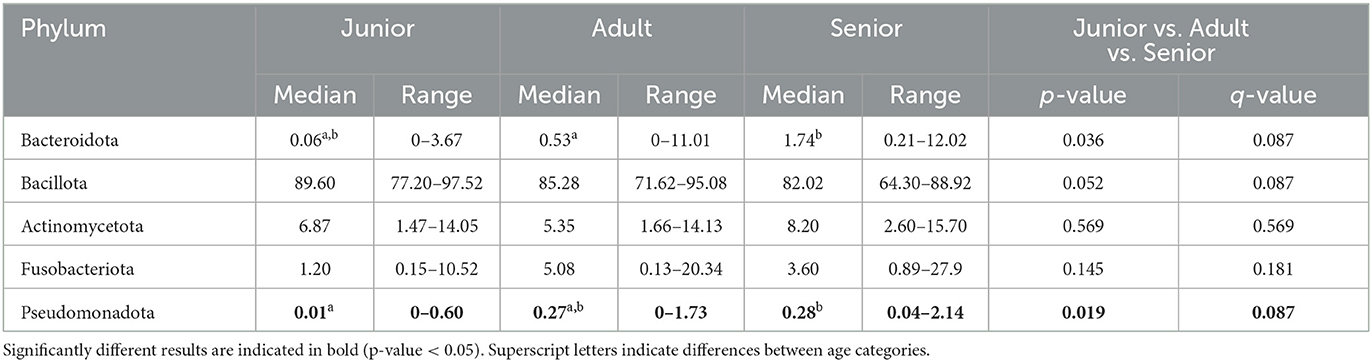 Tabla 4. Composición de la microbiota fecal (% de abundancia relativa a partir de datos enrarecidos) a nivel de filo dividido por categoría de edad.
Tabla 4. Composición de la microbiota fecal (% de abundancia relativa a partir de datos enrarecidos) a nivel de filo dividido por categoría de edad.
3.2.2. Nivel taxonómico familiar
Cayendo en el filo principal (Bacillota), Ruminococcaceae, Uncl. Las familias Clostridiales.1, Veillonellaceae y Lachnospiraceae fueron significativamente diferentes entre las categorías de edad (Figuras 5-8). Específicamente, la abundancia de Ruminococcaceae y Uncl. Clostridiales.1 fue mayor en la categoría S que en la categoría A, y Veillonellaceae mostró una mayor abundancia en la categoría S que en la categoría J. Lachnospiraceae fueron significativamente más altas en la categoría J que en las categorías A y S y no difirieron significativamente. Dentro del filo Bacteroidota, la abundancia relativa de Bacteroidaceae y Prevotellaceae fue diferente entre las categorías de edad; Bacteroidaceae fue más alta en la categoría S que en las categorías A y J, y Prevotellaceae fue mayor en la categoría S que en la A. Para Pseudomonadota, la abundancia relativa de Succinivibrionaceae fue mayor en la categoría S que en la categoría A. Finalmente, la familia Bifidobacteriaceae (Actinomycetota) fue significativamente mayor en la categoría A que en la categoría J; sin embargo, el valor q ajustado no fue significativo (Tabla 5).
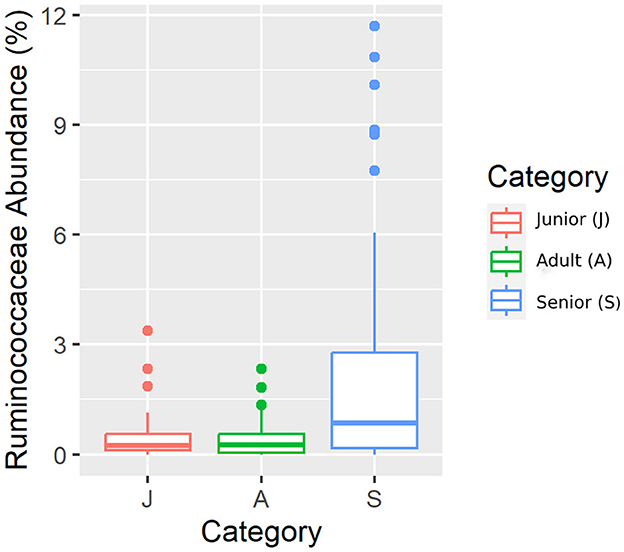 Figura 5. Una representación de diagrama de caja de la abundancia relativa de datos enrarecidos de la familia Ruminococcaceae por categoría de edad.
Figura 5. Una representación de diagrama de caja de la abundancia relativa de datos enrarecidos de la familia Ruminococcaceae por categoría de edad.
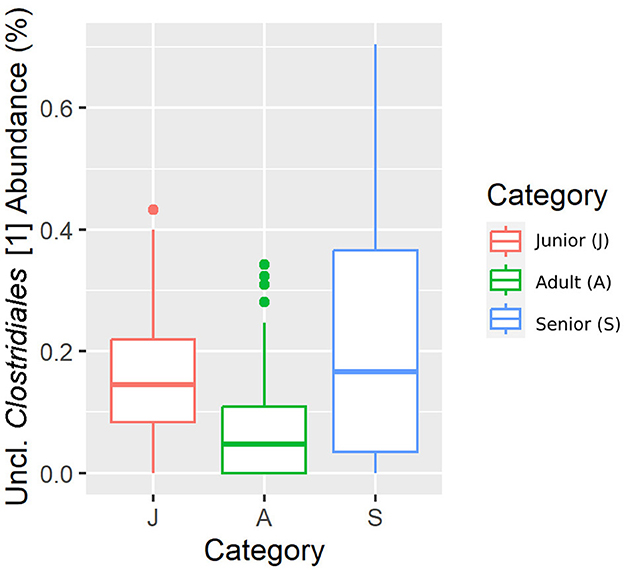 Figura 6. Una representación de diagrama de caja de la abundancia relativa de datos enrarecidos de la Uncl. Clostridiales.1 familia por categoría de edad.
Figura 6. Una representación de diagrama de caja de la abundancia relativa de datos enrarecidos de la Uncl. Clostridiales.1 familia por categoría de edad.
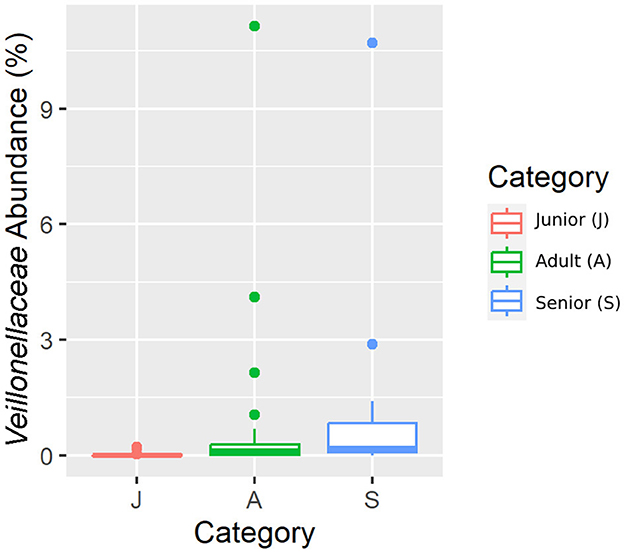 Figura 7. Una representación de diagrama de caja de la abundancia relativa de datos enrarecidos de la familia Veillonellaceae por categoría de edad.
Figura 7. Una representación de diagrama de caja de la abundancia relativa de datos enrarecidos de la familia Veillonellaceae por categoría de edad.
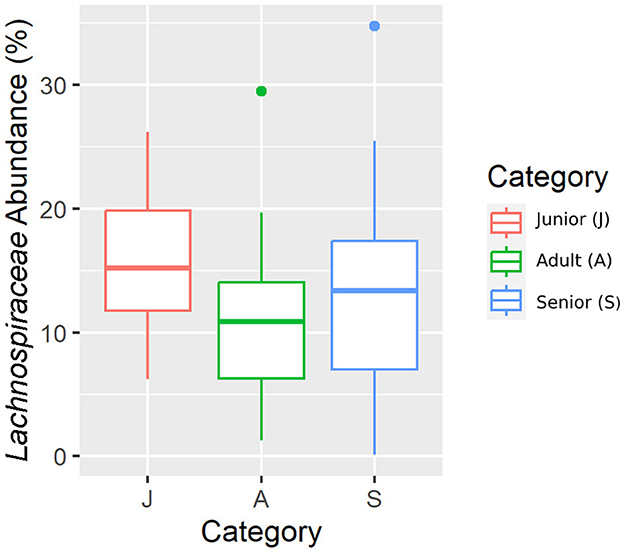 Figura 8. Una representación de diagrama de caja de la abundancia relativa de datos enrarecidos de la familia Lachnospiraceae por categoría de edad.
Figura 8. Una representación de diagrama de caja de la abundancia relativa de datos enrarecidos de la familia Lachnospiraceae por categoría de edad.
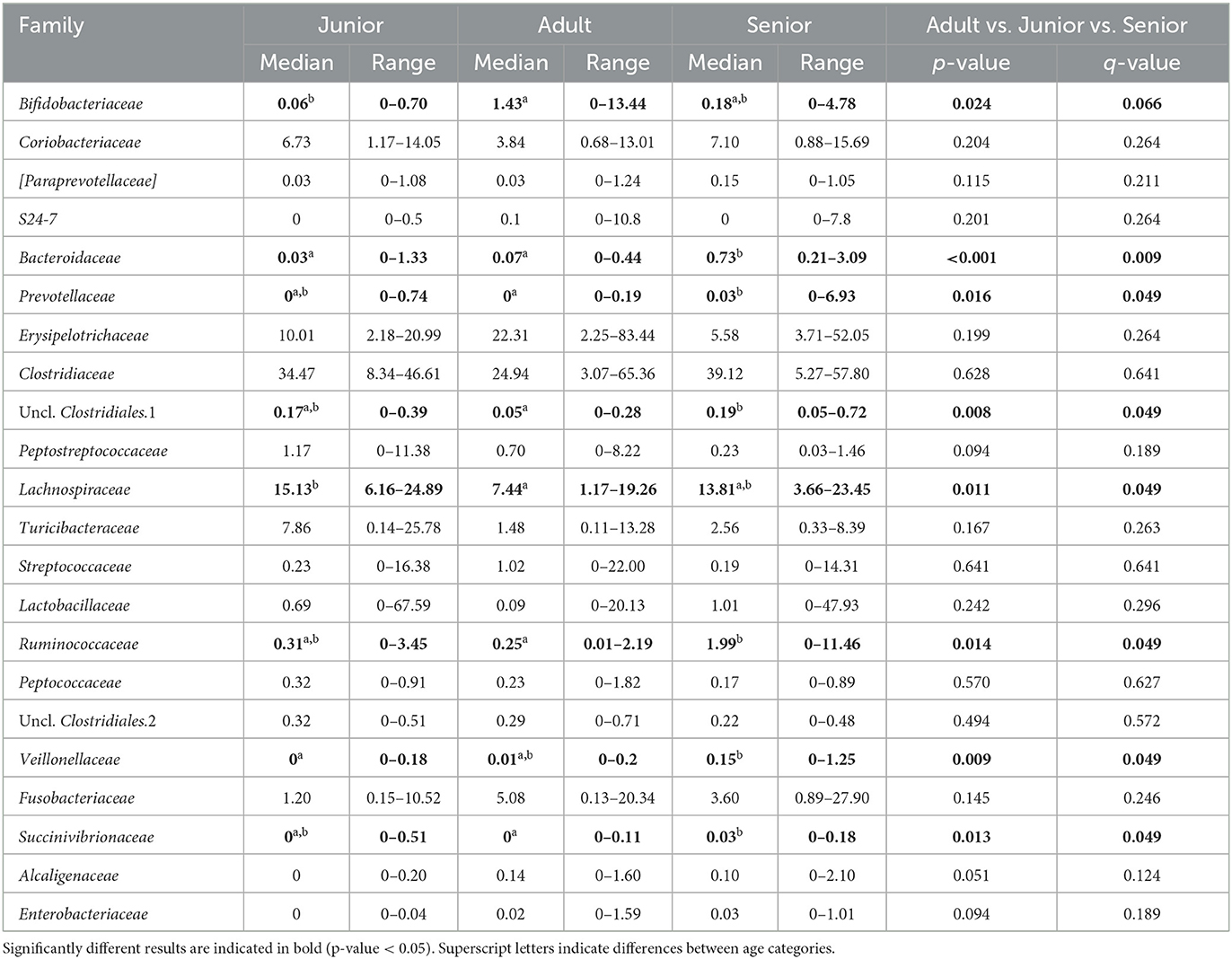 Tabla 5. Composición de la microbiota fecal (% de abundancia relativa a partir de datos enrarecidos) a nivel familiar dividida por grupo de edad.
Tabla 5. Composición de la microbiota fecal (% de abundancia relativa a partir de datos enrarecidos) a nivel familiar dividida por grupo de edad.
3.2.3. Nivel taxonómico del género
Los dos géneros predominantes identificados en la población de perros pertenecían al filo Bacillota, Uncl. Clostridiaceae.1, y Allobaculum. Dentro de Bacillota, Faecalibacterium y Uncl. Los clostridiales.3 mostraron los valores más altos en S, siendo significativamente diferentes cuando se compararon con A (p = 0,006 y 0,008, respectivamente). La abundancia relativa observada en el género Faecalibacterium fue 18,6 veces mayor en la categoría S que en la categoría A. Sin embargo, la diferencia en Faecalibacterium no se confirmó mediante una qPCR dirigida. Dentro de este género, la abundancia relativa de F. prausnitzii fue 18,4 veces mayor en la categoría S (mediana 1,3% de las secuencias) que en la categoría A (mediana 0,07%; p = 0,006 y q = 0,030). La información detallada a nivel de especie se encuentra en la Tabla Suplementaria 3. En relación a la abundancia de Phascolarctobacterium, S fue mayor que las categorías A y J (p = 0,011). Aunque la categoría S también mostró valores más altos para Ruminococcus en comparación con A (p = 0,035), el valor q ajustado no alcanzó significación. Por el contrario, la abundancia de Eubacterium, Uncl. Erysipelotrichaceae, y Uncl. Lachnospiraceae no fue significativamente diferente cuando se consideraron las categorías S frente a las categorías J y A. Sin embargo, J mostró valores significativamente más altos para los tres géneros en comparación con la categoría A (p = 0,005 , p = 0,001 y p = 0,002). Específicamente, J mostró 8.6 y 7.2 veces más abundancia relativa en Eubacterium y Uncl. Géneros de Erysipelotrichaceae, respectivamente, comparados con A. Considerando el Uncl. Peptostreptococcaceae género, la abundancia relativa fue mayor en J que en las categorías S y A (p = 0,009).
La abundancia relativa de Bacteroides (filo Bacteroidota) fue 24,3 y 10,4 veces mayor en la categoría S que en las categorías J y A, respectivamente (p < 0,001). Prevotella (familia Prevotellaceae) fue mayor en la categoría S que en la categoría A (p = 0,016); Sin embargo, el valor Q ajustado no fue significativo. La abundancia relativa de Fusobacterium (filo Fusobacteriota) fue mayor en la categoría S que en la categoría A cuando se consideró solo la significación del valor p (p = 0,045), pero esto no fue confirmado por qPCR dirigida. La información detallada a nivel de género se encuentra en la Tabla Suplementaria 4.
3.3. AGCC fecales, IgA y cCP
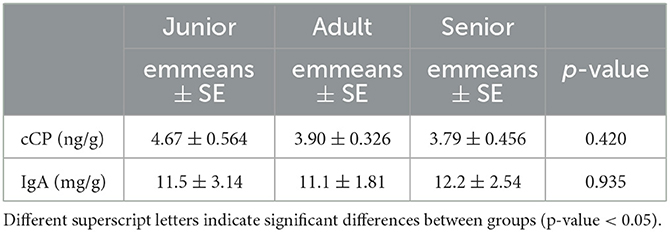
El ácido valérico fue significativamente menor en la categoría S que en la categoría A. Sin embargo, las concentraciones para el AGCC total fueron numéricamente más altas (pero no significativas) en la categoría S y más bajas en las categorías A y J (Tabla 6). El acetato, el butirato, el ácido isovalérico y el ácido valérico alcanzaron resultados significativos cuando fueron analizados como porcentajes relativos (Tabla 6). En el análisis post-hoc, la categoría S mostró valores más altos que A para acetato (p < 0,001) y valores más bajos para butirato, ácido isovalérico y ácido valérico (p = 0,001, p = 0,045 y p = 0,026, respectivamente). Para el ácido isovalérico, la categoría S tuvo valores más bajos que J. Finalmente, no se encontraron diferencias significativas entre las categorías de edad para las concentraciones fecales de IgA y cCP (Tabla 7).
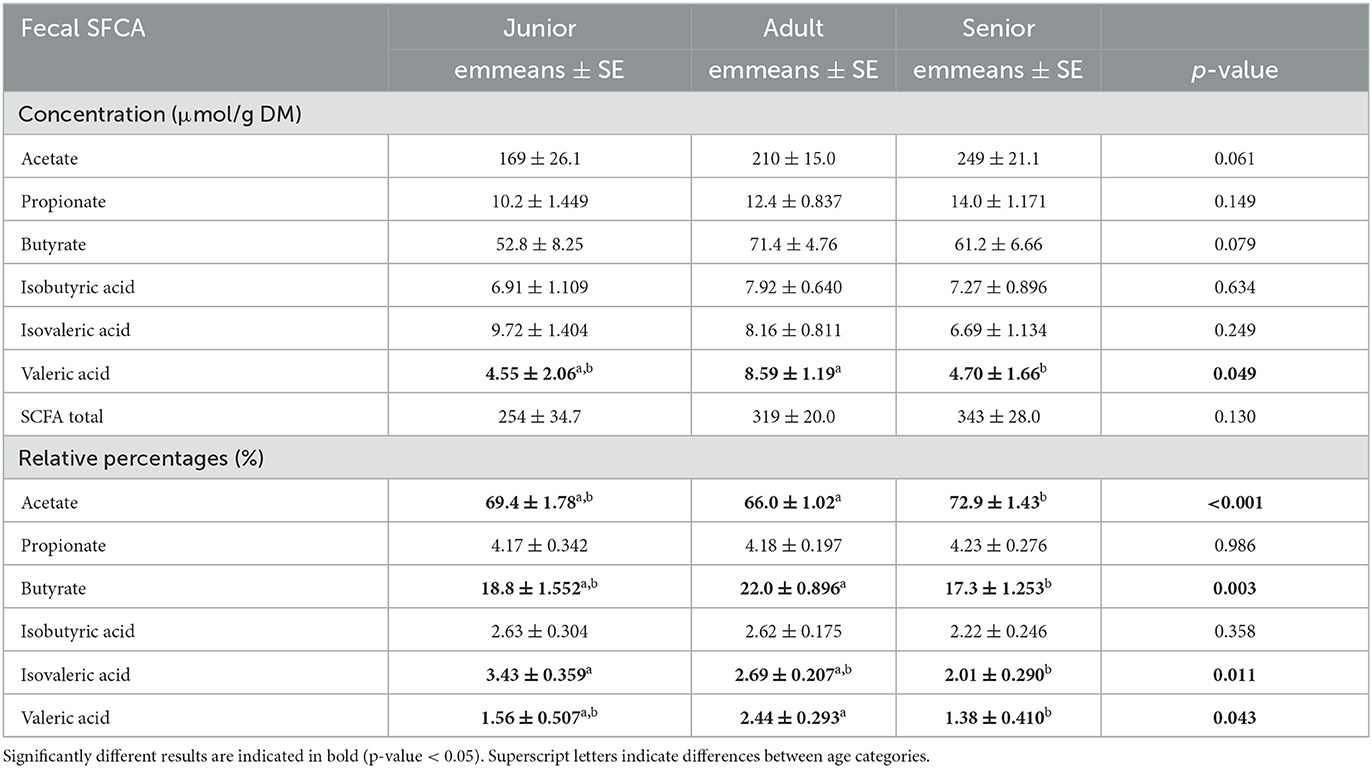 Tabla 6. Valores de AGCC fecal expresados como concentración (μmol/g MS) y porcentajes relativos (%) informados por categoría de edad.
Tabla 6. Valores de AGCC fecal expresados como concentración (μmol/g MS) y porcentajes relativos (%) informados por categoría de edad.
3.4. Correlaciones entre qPCR, IgA, cCP y SCFA
Considerando correlaciones significativas (rho) iguales o >0.3, la abundancia de Faecalibacterium se correlacionó positivamente con las concentraciones de propionato y ácido valérico, mientras que Fusobacterium se correlacionó positivamente con la concentración isobutírica. Clostridium hiranonis se correlacionó positivamente con el porcentaje de ácido isovalérico, y Bifidobacterium se correlacionó positivamente con la concentración de ácido valérico. Este género se correlacionó positivamente con el porcentaje relativo de acetato, mientras que la correlación con el porcentaje relativo de butirato fue negativa. El género Bacteroides se correlacionó positivamente con la concentración de ácido valérico y su porcentaje relativo. Las concentraciones de IgA se correlacionaron negativamente con las concentraciones de ácido isobutírico, isovalérico y valérico. Este indicador también se correlacionó negativamente con los porcentajes absolutos isobutíricos y valéricos. Los índices de correlación se detallan en la Tabla Suplementaria 5.
4. Discusión
Nuestro estudio respalda los resultados publicados anteriormente sobre la relación entre el proceso de envejecimiento y la salud intestinal y la microbiota intestinal en perros. En particular, incluimos un rango de edad más amplio (entre 0,2 y 15 años) que los estudios previos sobre cachorros y perros adultos. Además, estudiamos nuestra población canina desde diferentes perspectivas basadas en el análisis de la microbiota fecal junto con otros biomarcadores de salud intestinal para comprender ampliamente los cambios generales. Nuestro enfoque principal para la discusión de los resultados es la etapa de la vida de la tercera edad, el período en que la calidad de vida se ve amenazada por el proceso de envejecimiento en sí. Explorar la salud intestinal y la microbiota basada en indicadores fecales puede ayudar a encontrar intervenciones dietéticas específicas para mejorar la calidad de vida de los perros de edad avanzada.
Para comparar los indicadores seleccionados a lo largo de las diferentes etapas de la vida, este estudio incluyó perros con necesidades dietéticas específicas debido a su edad, lo que puede considerarse un factor de confusión para comprender los resultados entre las categorías de edad. Sin embargo, la dieta, junto con el peso corporal, el sexo, la rutina de alimentación, la vivienda y la raza, se consideraron posibles variables explicativas para el análisis estadístico general.
4.1. Resultados de la microbiota
Bacillota, Actinomycetota, Fusobacteriota, Bacteroidota y Pseudomonadota fueron los cinco filos principales encontrados en las muestras fecales analizadas en nuestra población estudiada de perros utilizando la secuenciación del gen 16S rRNA. Estudios previos describieron que la mayoría de las secuencias bacterianas identificadas en el intestino pertenecen a estos cinco filos diferentes (29-31). En este sentido, la literatura previa puede haber utilizado la antigua terminología del filo para Bacillota, Actinomycetota, Fusobacteriota, Bacteroidota y Pseudomonadota, que anteriormente se llamaban Firmicutes, Actinobacteria, Fusobacteria, Bacterioidetes y Proteobacteria, respectivamente (32). Aunque los nombres han cambiado recientemente, estos filos han sido identificados previamente como los principales contribuyentes a la composición microbiana intestinal en perros. Más específicamente, Bacillota, Bacteroidota y Fusobacteriota fueron descritos como los tres filos predominantes en el microbioma fecal canino sano en estudios previos (33, 34). Sin embargo, en nuestro estudio, dentro de los tres grupos bacterianos principales, se encontró el filo Actinomycetota en lugar de Bacteroidota. Curiosamente, la distribución de la abundancia relativa fue la misma en las tres categorías. La baja abundancia en el filo Bacteroidota podría deberse a la obesidad y la enfermedad gastrointestinal (35-37). Aunque Actinomycetota está presente en el intestino delgado de animales sanos, la abundancia relativa encontrada en las heces es menor y su aumento puede estar asociado con condiciones patológicas (29). Considerando el estado de salud de la población estudiada, la obesidad y las patologías gastrointestinales no explican los bajos números obtenidos, y las diferencias pueden explicarse por el propio análisis. Es importante considerar la influencia de los aspectos metodológicos en la secuenciación del gen 16S rRNA en los resultados, por lo que es difícil comparar diferentes estudios. Estudios previos han reportado diferencias significativas en la abundancia de grupos bacterianos basados en variaciones en laboratorios y metodologías (38-40).
La familia Bifidobacteriaceae es un grupo bacteriano importante para los seres humanos. Considerando los resultados de Bifidobacterium en la qPCR y el análisis de secuenciación, este género estuvo presente en las tres categorías de edad (perros mayores, perros adultos y cachorros), siendo más representativo en adultos y menos representativo en cachorros. Aunque la composición de la microbiota intestinal se ha estudiado en diferentes especies animales, incluidos los perros, la transición de la microbiota intestinal con la edad no se ha investigado a fondo. Masuoka et al. (10) estudiaron una población de edad diferente, desde cachorros predestetados hasta perros mayores, para evaluar las diferencias dependientes de la edad y los cambios en la microbiota intestinal empleando un método basado en el cultivo. Las bifidobacterias se detectaron en cachorros, pero no estaban presentes al analizar perros mayores de 3 años (perros adultos y perros mayores). Con base en la literatura sobre seres humanos, la presencia de este género en las tres categorías debe entenderse como positiva. La bifidobacteria es la bacteria más prevalente en bebés y adultos, y se presume que promueve beneficios para la salud en el huésped (41). Sin embargo, la extrapolación de los resultados entre especies animales debe interpretarse cuidadosamente. La abundancia de Bifidobacterium en la qPCR se correlacionó positivamente con la concentración de ácido valérico y el porcentaje relativo de acetato. Se han descrito previamente correlaciones positivas entre Bifidobacterium y acetato (42, 43), aunque se pueden justificar estudios adicionales que investiguen los vínculos con el ácido valérico.
Los perros mayores tenían una mayor abundancia relativa de las familias Ruminococcaceae, Veillonellaceae, Bacteroidaceae y Lachnospiraceae (filo Bacillota). Estudios previos han encontrado disminuciones en este nivel en perros con enfermedad inflamatoria intestinal (EII) (25, 44), pero no existe una relación clara con el envejecimiento. Los perros mayores también tuvieron valores más altos en el porcentaje relativo de acetato, uno de los principales productos de la fermentación bacteriana. Estos dos hallazgos van en la misma dirección que los datos publicados anteriormente; existe una correlación positiva bien conocida entre los grupos bacterianos clasificados en filos Bacillota y la producción de AGCC (25). Sin embargo, nuestros resultados apoyaron el hecho de que los porcentajes relativos de butirato y ácido valérico fueron significativamente más bajos en la población de perros mayores. Los porcentajes relativos están lógicamente influenciados por los altos números en la concentración de acetato. Centrándonos en el resultado valérico, el porcentaje relativo fue apoyado por el resultado de concentración, que también fue menor en el grupo senior. Estos hallazgos pueden interpretarse como negativos teniendo en cuenta la salud intestinal, ya que la producción de AGCC proporciona un entorno de pH adecuado para mantener una microbiota saludable, inhibe el crecimiento de bacterias patógenas sensibles al pH y preserva la integridad intestinal (45). Además, el ácido valérico se ha asociado positivamente con el eje intestino-cerebro y la función cognitiva en ratones (46). Por lo tanto, los perros mayores pueden no beneficiarse de los mecanismos que rodean la producción de AGCC que promueven la salud intestinal y contribuyen positivamente a la función cognitiva.
Aunque los géneros de Faecalibacterium no fueron significativamente diferentes en el análisis de qPCR, se encontró que Faecalibacterium prausnitzii era mayor en perros mayores, lo que puede considerarse un cambio positivo menor para esta población de edad avanzada. Esta discrepancia puede ser causada por el hecho de que F. prausnitzii cae en los géneros Faecalibacterium junto con otras especies. Otra posible razón podría ser que Facecalibacterium con frecuencia no se detecta en perros durante la secuenciación debido a su baja abundancia, pero podría detectarse mediante qPCR. Además, Faecalibacterium qPCR se correlacionó significativamente positivamente con las concentraciones de propionato y ácido valérico, lo cual es positivo para la salud intestinal. La ausencia de esta bacteria se ha asociado con trastornos gastrointestinales en perros (36) y humanos (47). Centrándose en el nivel de especie, F. prausnitzii se ha asociado claramente con una mayor utilización de fibra y diferentes tipos de fibra en las dietas de los perros (8, 48). Sin embargo, el contenido de fibra de la dieta no se consideró una causa de la mayor abundancia descrita en la categoría S para F. prausintzii. En nuestro estudio, solo el 5% de los perros estaban fuera del rango definido de composición de fibra (2-5%), y se distribuyeron de manera similar en las tres categorías de edad diferentes (J = 2/106; A = 2/106; y S = 1/106). A partir de esta información, considerando la importancia de F. prausnitzii dentro de los géneros Faecalibacterium, podríamos afirmar que la diferencia encontrada en perros mayores es un cambio positivo en la población de microbiota relacionado con el envejecimiento.
A nivel de género, los dos grupos predominantes identificados pertenecen al filo Bacillota (Uncl. Clostridiaceae.1 y Allobaculum). Estos hallazgos apoyan datos publicados previamente en perros, en los que los taxones principales caían dentro del grupo Bacillota y la clase bacteriana Clostridia se consideraba el taxón más abundante (29). En nuestro estudio, el género Fusobacterium (dentro del filo Fusobacteriota) estaba presente en todas las poblaciones de edad y fue específicamente mayor en perros mayores de 7 años. Este hallazgo puede considerarse positivo para el microbioma de los perros mayores, ya que este género se ha relacionado previamente con un microbioma intestinal saludable en perros (13).
4.2. Diversidad beta, diversidad alfa e índice de disbiosis
Para la diversidad beta, UniFrac no ponderado fue significativamente diferente entre las categorías de edad cuando se realizó el análisis ANOSIM. Sin embargo, el efecto de tamaño estimado por el valor R fue extremadamente pequeño, y otras métricas de distancia no fueron significativas. Los cambios encontrados en nuestra población, y especialmente las categorías definidas, pueden no ser suficientes para cambiar la diversidad beta ponderada de UniFrac y Bray-Curtis. Otra posible explicación para las diferencias observadas en el UniFrac no ponderado, pero no en la diversidad beta ponderada de UniFrac y Bray-Curtis, podría atribuirse al hecho de que estas dos métricas consideran abundancias relativas en lugar de solo la presencia / ausencia de taxones diferentes. Además, el análisis de diversidad alfa medido por los índices Chao1 y Shannon no fue significativamente diferente entre los grupos de edad. Nuestros hallazgos son consistentes con estudios previos. You y Kim (31) estudiaron diferentes rasgos individuales en perros sanos y tampoco informaron diferencias a nivel de edad al estudiar los patrones de diversidad microbiana. Curiosamente, ninguno de los perros pertenecientes a la categoría junior tuvo un cambio moderado o significativo en el índice (DI > 0). Blake et al. (15) mostraron que el DI aumentó en cachorros más jóvenes, pero muchos perros a las 9 semanas y la mayoría de los perros después de los 6 meses de edad tenían DI normal. En nuestro estudio, la edad junior varió de 2 a 19 meses; por lo tanto, nuestros datos son consistentes con estudios previos, ya que se espera que la mayoría de los perros mayores de 6 meses tengan un DI de <0. A partir de esos resultados, podríamos afirmar que, en nuestro estudio, pueden haberse producido pequeños cambios en la microbiota debido al envejecimiento. Para concluir con los datos de la microbiota, el rendimiento de la prueba de Kruskal-Wallis para evaluar la abundancia diferencial entre grupos podría ser una limitación. Esta prueba estadística considera la abundancia general entre grupos, pero no la frecuencia de identificación de organismos en muestras dentro de un grupo. Otras pruebas estadísticas para evaluar la abundancia diferencial entre grupos (por ejemplo, ANCOM y DESeq) podrían complementar la información analizada por la prueba de Kruskal-Wallis.
4.3. AGCC fecales, IgA y cCP
Las concentraciones fecales de cCP e IgA en las heces se han estudiado como biomarcadores no invasivos de la salud intestinal en perros adultos. El cCP fecal es un indicador de inflamación intestinal en perros (49, 50), mientras que la IgA se asocia más con la respuesta inmune intestinal (51). En el presente estudio, la concentración fecal de cCP e IgA no se relacionó con el proceso de envejecimiento, ya que no se observaron diferencias entre las tres categorías de edad. Según la literatura, los ratones y humanos envejecidos no mostraron una relación clara entre la edad y la concentración de IgA mucosa (52). Zaine et al. (53) no informaron diferencias significativas en los valores fecales de IgA en perros mayores en comparación con adultos y cachorros. Sin embargo, los cachorros de 5 meses tenían concentraciones más bajas de IgA que los perros adultos. Las concentraciones fecales de cCP se correlacionaron recientemente con la edad en humanos sanos en Corea (54), pero hasta donde sabemos, los resultados sobre las concentraciones de cCP en perros sanos de diferentes edades no son consistentes. La falta de valores de referencia claros para la CPC fecal y la IgA considerando las diferentes etapas de edad es una clara limitación para comprender a fondo nuestros resultados en relación con la edad y la correlación SCFA encontrada en nuestro estudio. Sin embargo, en nuestro estudio, la edad no cambió el estado de inflamación intestinal o la respuesta inmune intestinal en función de los dos indicadores analizados.
4.4. Características principales
Teniendo en cuenta los resultados generales del presente estudio, se encontraron cambios menores en los biomarcadores de salud intestinal analizados entre las categorías junior, adulto y senior. La comunidad de microbiota y la producción de AGCC mostraron diferencias dependientes de la edad. Sin embargo, la IgA y la cCP no fueron significativamente diferentes en las tres categorías.
Nuestra definición de categoría de edad puede ser una limitación para comprender a fondo los cambios continuos del microbioma en relación con el proceso de envejecimiento. Significativamente, no existe un consenso claro sobre esta clasificación en la investigación animal o la medicina veterinaria (55). La definición de categorías de edad puede reducir la sensibilidad de comprender si las diferentes edades afectan por igual la salud intestinal y la microbiota. Por lo tanto, un mayor número de animales representativos de todas las categorías de edad puede ayudar a definir más categorías para aumentar la sensibilidad de estos primeros resultados.
Además, la extrapolación de este ensayo en un estudio de campo puede ayudar a explorar mejor estrategias efectivas, como intervenciones dietéticas, en la población canina.
5. Conclusión
En conclusión, en este estudio, la microbiota intestinal canina y ciertos AGCC mostraron variaciones menores entre los grupos de edad en los perros. Otros biomarcadores de salud intestinal (IgA y cCP) fueron similares entre los grupos de edad. Teniendo en cuenta todos los parámetros, podemos afirmar que, una vez que la microbiota se estabiliza en perros sanos, se producen cambios menores durante el proceso de envejecimiento.
La modulación de estos cambios menores, teniendo en cuenta la microbiota intestinal y la producción de ácidos grasos de cadena corta, podría mejorar la salud intestinal general durante el envejecimiento en los perros.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio / repositorios y los números de acceso se pueden encontrar a continuación: https://www.ncbi.nlm.nih.gov/, PRJNA901473.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité Ético de Affinity Petcare.
Contribuciones del autor
AF-P, AS-M y CT diseñaron y realizaron el estudio. AF-P y RP analizaron los resultados y prepararon las tablas y gráficos para su inclusión en el manuscrito. AF-P escribió el manuscrito. En general, todos los autores contribuyeron al artículo, discutieron sus resultados, revisaron los borradores y aprobaron la versión final presentada para su publicación.
Financiación
Este estudio recibió fondos de Affinity Petcare. El financiador no participó en el diseño del estudio, la recopilación, el análisis, la interpretación de los datos, la redacción de este artículo o la decisión de enviarlo para su publicación.
Conflicto de intereses
AF-P, AS-M y CT fueron empleados por la compañía de alimentos para mascotas Affinity Petcare, que financió el estudio. JS y RP fueron empleados por el Laboratorio Gastrointestinal de la Universidad de Texas A&M, que proporciona evaluación del microbioma en base a una tarifa por servicio.
El autor restante declara que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1213287/full#supplementary-material
Abreviaturas
DI: índice de disbiosis; J, Junior; A: Adulto; S: Senior; AGCC: ácido graso de cadena corta; cCP: Calprotectina; IgA: inmunoglobulina A; PCoA: Análisis de Coordenadas Principales; DM: materia seca; GC-MS: Cromatografía de Gases-Espectrometría de Masas; RIA: Radioinmunoensayo; ANOSIM, Análisis de similitud; R: rotación; S, estable; significa, medios estimados; FDR: tasa de descubrimiento falso; ANCOM, Análisis de composición de microbiomas; EII: enfermedad inflamatoria intestinal.
Referencias
1. Matijašić M, Meštrović T, Paljetak HC, Perić M, Barešić A, Verbanac D. Gut microbiota beyond bacteria—mycobiome, virome, archaeome, and eukaryotic parasites in IBD. Int J Mol Sci. (2020) 21:2668. DOI: 10.3390/IJMS21082668
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Gill SR, Pop M, DeBoy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, et al. Análisis metagenómico del microbioma intestinal distal humano. Ciencia. (2006) 312:1355–9. doi: 10.1126/science.1124234
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Jandhyala SM, Talukdar R, Subramanyam C, Vuyyuru H, Sasikala M, Reddy DN. Mundo J Gastroentero. (2015) 21:8787–803. doi: 10.3748/wjg.v21.i29.8787
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. de Vos WM, Tilg H, Hul MV, Cani PD. Gut microbiome and health: mecanicistic insights. Tripa. (2022) 71:1020–32. DOI: 10.1136/GuTJNL-2021-326789
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Bajinka O, Darboe A, Tan Y, Abdelhalim KA, Cham LB. La microbiota intestinal y los cambios fisiológicos del intestino humano. Ann Microbiol. (2020) 70:65. DOI: 10.1186/S13213-020-01608-2
6. Wen L, Duffy A. Factores que influyen en la microbiota intestinal, inflamación y diabetes tipo 2. J Nutrición. (2017) 147:1468S–75S. doi: 10.3945/jn.116.240754
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Hasan N, Yang H. Factores que afectan la composición de la microbiota intestinal y su modulación. PeerJ. (2019) 7:E7502. doi: 10.7717/peerj.7502
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Pilla R, Suchodolski JS. El microbioma intestinal de perros y gatos, y la influencia de la dieta. Veterinario Clin North am Pequeño Animal Pract. (2021) 51:605–21. doi: 10.1016/j.cvsm.2021.01.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Badal VD, Vaccariello ED, Murray ER, Yu KE, Knight R, Jeste DV, et al. El microbioma intestinal, el envejecimiento y la longevidad: una revisión sistemática. Nutrientes. (2020) 12:3759. DOI: 10.3390/nu12123759
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Masuoka H, Shimada K, Kiyosue-Yasuda T, Kiyosue M, Oishi Y, Kimura S, et al. Transición de la microbiota intestinal de los perros con la edad. Biosci Microbiota Food Heal. (2016) 36:27–31. DOI: 10.12938/BMFH. BMFH-2016-021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Suchodolski JS. Análisis del microbioma intestinal en perros y gatos. Vet Clin Path. (2022) 50:6–17. DOI: 10.1111/vcp.13031
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Ziese A-L, Suchodolski JS. Impacto de los cambios en la microbiota gastrointestinal en enfermedades digestivas caninas y felinas. Veterinario Clin North am Pequeño Animal Pract. (2021) 51:155–69. doi: 10.1016/j.cvsm.2020.09.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Garrigues Q, Apper E, Chastant S, Mila H. Desarrollo de la microbiota intestinal en el perro en crecimiento: un proceso dinámico influenciado por factores maternos, ambientales y del huésped. Front Vet Sci. (2022) 9:964649. doi: 10.3389/fvets.2022.964649
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Guard BC, Mila H, Steiner JM, Mariani C, Suchodolski JS, Chastant-Maillard S. Caracterización del microbioma fecal durante el desarrollo neonatal y pediátrico temprano en cachorros. PLoS ONE. (2017) 12:E0175718. doi: 10.1371/journal.pone.0175718
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Blake AB, Cigarroa A, Klein HL, Khattab MR, Keating T, Coevering PVD, et al. Etapas de desarrollo en microbiota, ácidos biliares y especies clostridiales en cachorros sanos. J Vet Pasante Med. (2020) 34:2345–56. DOI: 10.1111/JVIM.15928
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. FEDIAF. La industria europea de alimentos para mascotas. Pautas nutricionales para alimentos completos y complementarios para gatos y perros. (2021). Disponible en línea en: https://europeanpetfood.org/wp-content/uploads/2022/03/Updated-Nutritional-Guidelines.pdf
17. Strickling JA, Harmon DL, Dawson KA, Gross KL. Evaluación de la adición de oligosacáridos a las dietas de los perros: influencias sobre la digestión de nutrientes y las poblaciones microbianas. Anim Feed Sci Technol. (2000) 86:205–19. doi: 10.1016/S0377-8401(00)00175-9
18. Parada AE, Needham DM, Fuhrman JA. Cada base importa: evaluar pequeños cebadores de ARNr de subunidades para microbiomas marinos con comunidades simuladas, series temporales y muestras de campo globales. Environ Microbiol. (2015) 18:1403–14. doi: 10.1111/1462-2920.13023
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Apprill A, McNally S, Parsons R, Weber L. Minor revision to V4 region SSU rRNA 806R gene primer aumenta en gran medida la detección del bacterioplancton SAR11. Aquat Microb Ecol. (2015) 75:129–37. DOI: 10.3354/ame01753
20. Bolyen E, Rideout JR, Dillon MR, Bokulich NA, Abnet CC, Al-Ghalith GA, et al. Ciencia de datos de microbiomas reproducible, interactiva, escalable y extensible utilizando QIIME 2. Nat Biotechnol. (2019) 37:852–7. DOI: 10.1038/S41587-019-0209-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJA, Holmes SP. DADA2: inferencia de muestra de alta resolución a partir de datos de amplicón Illumina. Métodos Nat. (2016) 13:581–3. DOI: 10.1038/NMETH.3869
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Lozupone C, Knight R. UniFrac: a new phylogenetic method for comparing microbial communities. Appl Environ Microb. (2005) 71:8228–35. doi: 10.1128/AEM.71.12.8228-8235.2005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. AlShawaqfeh MK, Wajid B, Minamoto Y, Markel M, Lidbury JA, Steiner JM, et al. Un índice de disbiosis para evaluar los cambios microbianos en muestras fecales de perros con enteropatía inflamatoria crónica. FEMS Microbiol Ecol. (2017) 93:fix136. doi: 10.1093/femsec/fix136
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Moreau NM, Goupry SM, Antignac JP, Monteau FJ, Bizec BJL, Champ MM, et al. Medición simultánea de concentraciones plasmáticas y enriquecimiento de 13C de ácidos grasos de cadena corta, ácido láctico y cuerpos cetónicos mediante cromatografía de gases acoplada a espectrometría de masas. J Cromatografía B. (2003) 784:395–403. doi: 10.1016/S1570-0232(02)00827-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Minamoto Y, Minamoto T, Isaiah A, Sattasathuchana P, Buono A, Rangachari VR, et al. Concentraciones fecales de ácidos grasos de cadena corta y disbiosis en perros con enteropatía crónica. J Vet Pasante Med. (2019) 33:1608–18. DOI: 10.1111/JVIM.15520
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Heilmann RM, Suchodolski JS, Steiner JM. Desarrollo y validación analítica de un radioinmunoensayo para la cuantificación de calprotectina canina en suero y heces de perros. Am J Vet Res. (2008) 69:845–53. doi: 10.2460/ajvr.69.7.845
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Heilmann RM, Ruaux CG, Grützner N, Cranford SM, Bridges CS, Steiner JM. Variación biológica de las concentraciones séricas de calprotectina canina medidas por ELISA en perros sanos. Veterinario J. (2019) 247:61–4. doi: 10.1016/j.tvjl.2019.03.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Benjamini Y, Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing. J R Stat Soc B. (1995) 57:289–300. doi: 10.1111/j.2517-6161.1995.tb02031.x
29. Pilla R, Suchodolski JS. El papel del microbioma intestinal canino y el metaboloma en la salud y la enfermedad gastrointestinal. Front Vet Sci. (2020) 6:498. DOI: 10.3389/FVETS.2019.00498
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Deschamps C, Humbert D, Zentek J, Denis S, Priymenko N, Apper E, et al. De Chihuahua a San Bernardo: cómo evolucionaron la digestión y la microbiota con el tamaño de los perros. Int J Biol Sci. (2022) 18:5086–102. DOI: 10.7150/IJBS.72770
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Tú yo, Kim MJ. Comparación de la microbiota intestinal de 96 perros sanos por rasgos individuales: raza, edad y puntuación de condición corporal. Anim Open Access J. (2021) 11:2432. doi: 10.3390/ani11082432
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Oren A, Garrity GM. Publicación válida de los nombres de cuarenta y dos filos de procariotas. Int J Syst Evol Microbiol. (2021) 71:005056. doi: 10.1099/ijsem.0.005056
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Hand D, Wallis C, Colyer A, Penn CW. Pyrosequencing the canine fecal microbiota: amplitud y profundidad de la biodiversidad. PLoS ONE. (2013) 8:E53115. doi: 10.1371/journal.pone.0053115
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Middelbos IS, Boler BMV, Qu A, White BA, Swanson KS, Fahey GC. Caracterización filogenética de comunidades microbianas fecales de perros alimentados con dietas con o sin fibra dietética suplementaria utilizando pirosecuenciación 454. PLoS ONE. (2010) 5:E9768. doi: 10.1371/journal.pone.0009768
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Salas-Mani A, Jeusette I, Castillo I, Manuelian CL, Lionnet C, Iraculis N, et al. La composición de la microbiota fecal cambia después de una dieta de pérdida de peso corporal en perros Beagle. J Anim Sci. (2018) 96:3102–11. doi: 10.1093/jas/sky193
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Minamoto Y, Otoni CC, Steelman SM, Büyükleblebici O, Steiner JM, Jergens AE, et al. Alteración de la microbiota fecal y de los perfiles de metabolitos séricos en perros con enfermedad inflamatoria intestinal idiopática. Microbios intestinales. (2015) 6:33–47. doi: 10.1080/19490976.2014.997612
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Söder J, Wernersson S, Höglund K, Hagman R, Lindåse S, Dicksved J. Composition and short-term stability of gut microbiota in lean and spontaneously overweight healthy Labrador retriever dogs. Acta Vet Scand. (2022) 64:8. DOI: 10.1186/S13028-022-00628-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Handl S, Dowd SE, Garcia-Mazcorro JF, Steiner JM, Suchodolski JS. La pirosecuenciación masiva paralela del gen 16S rRNA revela comunidades bacterianas y fúngicas fecales muy diversas en perros y gatos sanos. Fems Microbiol Ecol. (2011) 76:301–10. doi: 10.1111/j.1574-6941.2011.01058.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Garcia-Mazcorro JF, Lanerie DJ, Dowd SE, Paddock CG, Grützner N, Steiner JM, et al. Efecto de una formulación simbiótica multiespecie sobre la microbiota bacteriana fecal de gatos y perros sanos según lo evaluado por pirosecuenciación. Fems Microbiol Ecol. (2011) 78:542–54. doi: 10.1111/j.1574-6941.2011.01185.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Guard BC, Barr JW, Reddivari L, Klemashevich C, Jayaraman A, Steiner JM, et al. Caracterización de la disbiosis microbiana y cambios metabolómicos en perros con diarrea aguda. PLoS ONE. (2015) 10:E0127259. doi: 10.1371/journal.pone.0127259
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Mitsuoka T. Historia y evolución de los probióticos. Jpn J Lact ácido Bact. (2011) 22:26–37. doi: 10.4109/jslab.22.26
42. Oliphant K, Allen-Vercoe E. Macronutrient metabolism by the human gut microbiome: major fermentation by-products and their impact on host health. Microbioma. (2019) 7:91. DOI: 10.1186/S40168-019-0704-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Koh A, De Vadder F, Kovatcheva-Datchary P, Bäckhed F. De la fibra dietética a la fisiología del huésped: ácidos grasos de cadena corta como metabolitos bacterianos clave. Celda. (2016) 165:1332–45. doi: 10.1016/j.cell.2016.05.041
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Suchodolski JS, Dowd SE, Wilke V, Steiner JM, Jergens AE. La pirosecuenciación del gen 16S rRNA revela disbiosis bacteriana en el duodeno de perros con enfermedad inflamatoria intestinal idiopática. PLoS ONE. (2012) 7:E39333. doi: 10.1371/journal.pone.0039333
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Mackei M, Talabér R, Müller L, Sterczer Á, Fébel H, Neogrády Z, et al. Producción intestinal alterada de ácidos grasos volátiles en perros desencadenada por el tratamiento con lactulosa y psyllium. Veterinario Sci. (2022) 9:206. doi: 10.3390/vetsci9050206
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Lai Z, Shan W, Li J, Min J, Zeng X, Zuo Z. El nivel de ejercicio apropiado atenúa la disbiosis intestinal y el aumento del ácido valérico para mejorar la neuroplasticidad y la función cognitiva después de la cirugía en ratones. Mol Psiquiatra. (2021) 26:7167–87. DOI: 10.1038/S41380-021-01291-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Varela E, Manichanh C, Gallart M, Torrejón A, Borruel N, Casellas F, et al. Colonización por faecalibacterium prausnitzii y mantenimiento de la remisión clínica en pacientes con colitis ulcerosa. Aliment Pharm Therap. (2013) 38:151–61. doi: 10.1111/apt.12365
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Mori A, Goto A, Kibe R, Oda H, Kataoka Y, Sako T. Comparación de los efectos de cuatro regímenes de dieta recetados disponibles comercialmente sobre el microbioma fecal en perros sanos. J Vet Med Sci. (2019) 81:1783–90. DOI: 10.1292/JVMS.19-0055
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Grellet A, Heilmann RM, Lecoindre P, Feugier A, Day MJ, Peeters D, et al. Concentraciones de calprotectina fecal en perros adultos con diarrea crónica. Am J Vet Res. (2013) 74:706–11. doi: 10.2460/ajvr.74.5.706
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Otoni CC, Heilmann RM, García-Sancho M, Sainz A, Ackermann MR, Suchodolski JS, et al. Marcadores serológicos y fecales para predecir la respuesta a la terapia de inducción en perros con enfermedad inflamatoria intestinal idiopática. J Vet Pasante Med. (2018) 32:999–1008. DOI: 10.1111/JVIM.15123
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Grellet A, Mila H, Heilmann RM, Feugier A, Gruetzner N, Suchodolski JS, et al. Efecto de la edad, gestación y lactancia sobre las concentraciones fecales de IgA y calprotectina en perros. J Nutritional Sci. (2014) 3:e41. doi: 10.1017/jns.2014.44*
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Fujihashi K, McGhee JR. Inmunidad y tolerancia de la mucosa en ancianos. Mech Ageing Dev. (2004) 125:889–98. doi: 10.1016/j.mad.2004.05.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Zaine L, Ferreira C, de OS Gomes M, Monti M, Tortola L, Vasconcellos RS, et al. La concentración fecal de IgA está influenciada por la edad en perros. Brit J Nutr. (2011) 106:S183–6. doi: 10.1017/S0007114511000559
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Parque SY. Concentraciones de calprotectina fecal relacionadas con la edad en adultos sanos. Coreano J Clin Laboratorio Sci. (2020) 52:181–7. doi: 10.15324/kjcls.2020.52.3.181
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Harvey ND. ¿Qué edad tiene mi perro? Identificación de grupos de edad racionales en perros de compañía basados en procesos normativos vinculados a la edad. Front Vet Sci. (2021) 8:643085. DOI: 10.3389/fvets.2021.643085
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: microbiota fecal, canino, envejecimiento, salud intestinal, nutrición
Cita: Fernández-Pinteño A, Pilla R, Manteca X, Suchodolski J, Torre C y Salas-Mani A (2023) Cambios asociados a la edad en biomarcadores de salud intestinal en perros. Frente. Vet. Sci. 10:1213287. doi: 10.3389/fvets.2023.1213287
Recibido: 27 de abril de 2023; Aprobado: 13 de julio de 2023;
Publicado: 22 agosto 2023.
Editado por:
Shengfa F. Liao, Universidad Estatal de Mississippi, Estados Unidos
Revisado por:
Zhongyue Yang, Universidad de California, Davis, Estados Unidos Emily Coffey, Universidad de Minnesota Twin Cities, Estados
Unidos
Copyright © 2023 Fernández-Pinteño, Pilla, Manteca, Suchodolski, Torre y Salas-Mani. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Anna Fernández-Pinteño, anfernandez@affinity-petcare.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía