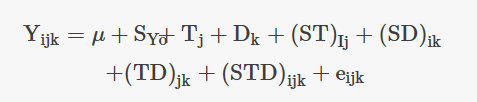Cambios inducidos por hipertermia en la supervivencia y fagocitosis leucocitaria
Cambios inducidos por hipertermia en la supervivencia y fagocitosis leucocitaria: un estudio comparativo en leucocitos bovinos y búfalos
 Maria Carmela Scatà1*
Maria Carmela Scatà1*  Mohanned Naif Alhussien2
Mohanned Naif Alhussien2  Francesco Grandoni1
Francesco Grandoni1  Anna Reale3
Anna Reale3  Michele Zampieri3
Michele Zampieri3  Jamal Hussen4
Jamal Hussen4  Giovanna De Matteis1*
Giovanna De Matteis1*- 1Centro de Investigación para la Producción Animal y la Acuicultura, Consejo de Investigación y Economía Agrícola (CREA), Roma, Italia
- 2Biotecnología Reproductiva, Facultad de Ciencias de la Vida de la TUM, Universidad Técnica de Múnich, Freising, Alemania
- 3Departamento de Medicina Experimental, Facultad de Medicina y Odontología, Universidad La Sapienza de Roma, Roma, Italia
- 4Departamento de Microbiología, Facultad de Medicina Veterinaria, Universidad Rey Faisal, Al-Ahsa, Arabia Saudita
El estrés por calor afecta negativamente la salud, el bienestar y la productividad del ganado al afectar la función inmunológica, aumentando la incidencia de enfermedades. En los últimos años, ha habido un creciente interés en comprender el sistema inmunológico del búfalo de agua debido al creciente impacto económico de esta especie para la alta calidad y el valor nutricional de la leche de búfala. Si bien existen respuestas comunes entre las especies bovinas y búfalas, también existen algunas variaciones específicas de cada especie en las respuestas fisiológicas al estrés por calor, atribuidas principalmente a las diferencias en el metabolismo y la eficiencia de disipación de calor. A nivel celular, la exposición al estrés térmico induce varias anomalías en las funciones celulares. Sin embargo, existe un conocimiento limitado sobre la respuesta diferencial de los leucocitos bovinos y búfalos a la exposición temprana y tardía a diferentes grados de exposición térmica. El objetivo de este estudio fue comparar el efecto in vitro de la hipertermia sobre la apoptosis y fagocitosis en leucocitos de especies bovinas y búfalas. Para ello, se incubaron muestras de sangre total de seis bovinos y nueve búfalos a 39 °C (imitando la condición de normotermia) o 41 °C (imitando la condición de estrés térmico) durante 1, 2 y 4 h. A continuación, se realizaron dos ensayos de citometría de flujo para evaluar la apoptosis y determinar la capacidad funcional de las células fagocíticas (neutrófilos y monocitos). Los resultados mostraron que la viabilidad de los leucocitos bovinos y búfalos se vio afectada de manera diferente por la temperatura y el tiempo de exposición in vitro. Se observó un mayor porcentaje de leucocitos apoptóticos en bovinos que en búfalos a 39°C (3.19 vs. 1.51, p < 0.05) y 41°C (4.01 vs. 1.69, p < 0.05) y para todos los puntos de tiempo de incubación (p < 0.05). Por el contrario, no se observaron diferencias en la fracción de leucocitos necróticos entre las dos especies. En ambas especies, los linfocitos mostraron la mayor sensibilidad a la hipertermia, mostrando un aumento de las tasas de apoptosis junto con un aumento del tiempo de incubación. En bovinos, los linfocitos apoptóticos aumentaron de 5.79 a 12.7% a 39°C (p < 0.05), en búfalos, esta población aumentó de 1.50 a 3.57% a 39°C y de 2.90 a 4.99% a 41°C (p < 0.05). Aunque no se encontraron diferencias significativas entre las dos especies en cuanto al porcentaje de neutrófilos fagocíticos, se encontraron valores de capacidad de fagocitosis más bajos (MFI, intensidad media de fluorescencia) en bovinos en comparación con búfalos a 41°C (27960.72 vs. 53676.45, p > 0.05). Sin embargo, para los monocitos, las diferencias entre especies fueron significativas tanto para la actividad como para la capacidad de fagocitosis, con menores porcentajes de monocitos fagocíticos bovinos después de 2 h a 39 °C y después de 1 h a 41 °C. Los monocitos bovinos mostraron valores de IMF más bajos para todas las variaciones de temperatura y tiempo que los búfalos (37538.91 vs. 90445.47 a 39°C y 33752.91 vs. 70278.79 a 41°C, p < 0.05). En conclusión, el presente estudio representa el primer informe sobre el análisis comparativo del efecto del estrés térmico in vitro en poblaciones de leucocitos bovinos y búfalos, destacando que los leucocitos de búfalo exhiben una adaptación térmica relativamente mayor que las células bovinas.
Introducción
En los últimos años, se han llevado a cabo muchas investigaciones para estudiar el estrés térmico en el ganado e investigar los efectos del aumento de las temperaturas globales en la salud y el bienestar de los animales de granja. Sobre la base de modelos matemáticos, la temperatura media mundial aumentaría en 2.100 °C por encima de su nivel preindustrial a 3,28 °C (2,46-4,10 °C) (1). Varios estudios han demostrado que las altas temperaturas ambientales afectan negativamente la salud y las funciones biológicas de las vacas lecheras, induciendo una reducción de la producción de leche y del rendimiento reproductivo (2-5). Estudios recientes se han centrado en el impacto del estrés térmico en la respuesta inmunitaria de los animales de granja (6-9). Lemal et al. (2) revisaron el efecto del estrés térmico sobre las enfermedades y la respuesta inmune en bovinos, destacando que el estrés térmico desencadena el eje hipotálamo-hipófisis-suprarrenal que estimula la secreción de cortisol en el torrente sanguíneo. Las células diana del cortisol son las células inmunitarias. El complejo formado por el cortisol y su receptor reduce la capacidad de las células inmunitarias para reaccionar a la infección y limita el reclutamiento de células inmunitarias en el lugar de la infección. Además, se ha descubierto que el cortisol dificulta la expresión de citoquinas proinflamatorias como el TNF-α, una citoquina implicada en la proliferación celular y la apoptosis. Lendez et al. (3) demostraron que en condiciones de estrés térmico, la expresión de TNF-α y su receptor disminuye en vacas lecheras.
Las condiciones de estrés térmico in vitro causaron una disminución de la viabilidad y un aumento de la tasa apoptótica en monocitos bovinos (10). También se han reportado cambios en la viabilidad y función de las células leucocitarias, incluyendo una reducción de la fagocitosis y el estallido respiratorio (producción de especies reactivas de oxígeno) en células polimorfonucleares bovinas (11). La muerte celular apoptótica es un proceso evolutivamente conservado y genéticamente programado de organismos multicelulares que normalmente ocurre durante el desarrollo y en células envejecidas. La activación de la caspasa es un evento clave bien conocido en el proceso apoptótico, y la actividad de la caspasa-3 es el efector común de la mayoría de las vías apoptóticas. Existe una gran variedad de estímulos y condiciones, tanto fisiológicas como patológicas, que pueden desencadenar la apoptosis. El estrés térmico es un estímulo externo que puede causar daño celular y es uno de los importantes factores de estrés inductor de apoptosis (11). Wohlgemuth et al. (12) informaron que las altas temperaturas reducen la actividad de proliferación de las células epiteliales mamarias bovinas e inducen la apoptosis. Recientemente, se propuso un modelo para explorar la adaptación biológica del sistema inmune a las altas temperaturas en dromedarios, donde la exposición in vitro de sangre total a la hipertermia conduce a un aumento de la fagocitosis y la producción de ROS en los fagocitos (13). La fagocitosis representa la primera línea de defensa del huésped contra los patógenos y es un componente central de la inmunidad innata.
El análisis funcional de las células inmunitarias se realiza ampliamente mediante citometría de flujo, que también se puede utilizar para controlar la apoptosis y la fagocitosis. La citometría de flujo es una herramienta versátil que puede beneficiar a varias disciplinas. Se utiliza principalmente para el inmunofenotipado, la identificación y cuantificación de células inmunitarias y sus niveles de actividad en muestras mixtas, como la sangre, para examinar los procesos celulares.
En los últimos años, ha habido un creciente interés en comprender el sistema inmunológico del búfalo de agua (Bubalus bubalis) debido al creciente impacto económico de esta especie para la alta calidad y el valor nutricional de la leche de búfala, que es particularmente adecuada para la fabricación de queso fresco (14). Si bien los búfalos están naturalmente adaptados al estrés por calor, muestran signos de angustia severa cuando se exponen a la radiación solar directa. Esta vulnerabilidad se debe a que tiene una piel más oscura y gruesa y menos glándulas sudoríparas que el ganado. Estas características distintivas de los búfalos dificultan la disipación efectiva del calor y los hacen más susceptibles al estrés por calor (15). Bagath et al. (8) han descrito exhaustivamente el impacto del estrés térmico en el sistema inmunitario del ganado lechero, concluyendo que el estrés calórico agudo puede tener un efecto estimulante sobre el sistema inmunitario. Por el contrario, el estrés térmico crónico parece tener un papel inhibidor de la capacidad del sistema inmunitario para mantener la homeostasis.
Existe un conocimiento limitado sobre la respuesta diferencial de los leucocitos bovinos y búfalos a la exposición temprana y tardía a diferentes grados de choque térmico. Este conocimiento es la clave para descubrir diferencias entre vacas y búfalos en la respuesta inmune a la hipertermia, sacando a la luz las diferencias en la termotolerancia y, por lo tanto, la susceptibilidad al estrés por calor. Además, esta comprensión puede allanar el camino para desarrollar estrategias para mitigar los efectos adversos del estrés por calor en estos animales, optimizando su salud y productividad. En consecuencia, el presente estudio se llevó a cabo para investigar el impacto de la hipertermia in vitro en las funciones de las células inmunitarias en especies bovinas y búfalas. Para ello, se emplearon dos ensayos de citometría de flujo para evaluar las alteraciones en la apoptosis y fagocitosis de leucocitos bovinos y búfalos expuestos a temperaturas de 39 y 41°C durante 1, 2 y 4 h. Esto nos permitió evaluar los efectos del choque térmico a corto y largo plazo y comparar la termotolerancia de estas dos especies.
Materiales y métodos
Muestreo de animales y sangre
El estudio fue planificado y realizado en la granja experimental del Centro de Investigación CREA para la Producción Animal y la Acuicultura, que estaba autorizada a utilizar animales de granja para el diseño experimental (como se indica en el DM 26/96-4 del Ministerio de Salud y Bienestar italiano). La gestión y el cuidado de los animales se llevaron a cabo de conformidad con la directiva 2010/63/UE y el reglamento italiano D. Lgs n. 26/2014. El ensayo se llevó a cabo de marzo a junio, cuando los animales no estuvieron expuestos a condiciones de estrés térmico. Registros meteorológicos de la ciudad de Monterotondo (Italia)1 se utilizaron para recoger datos sobre la temperatura y la humedad durante la toma de muestras de sangre. La temperatura media mensual osciló entre una temperatura mínima de 12,05 °C y una máxima de 22,52 °C. La humedad media mensual para el mismo periodo osciló entre 56,49 y 53,56%.
Se recolectó sangre de vacas lactantes multíparas (de 2 a 5 lactancias), 6 Holstein y 9 búfalos mediterráneos. Antes de la toma de muestras de sangre, las vacas se sometieron a exámenes veterinarios de rutina para excluir animales con signos y síntomas clínicos de enfermedades. La sangre se obtuvo por venopunción de la venopunción de la vena yugular externa en tubos vacutáineros de heparina de litio (BD Biosciences, San José, CA, Estados Unidos).
Diseño experimental
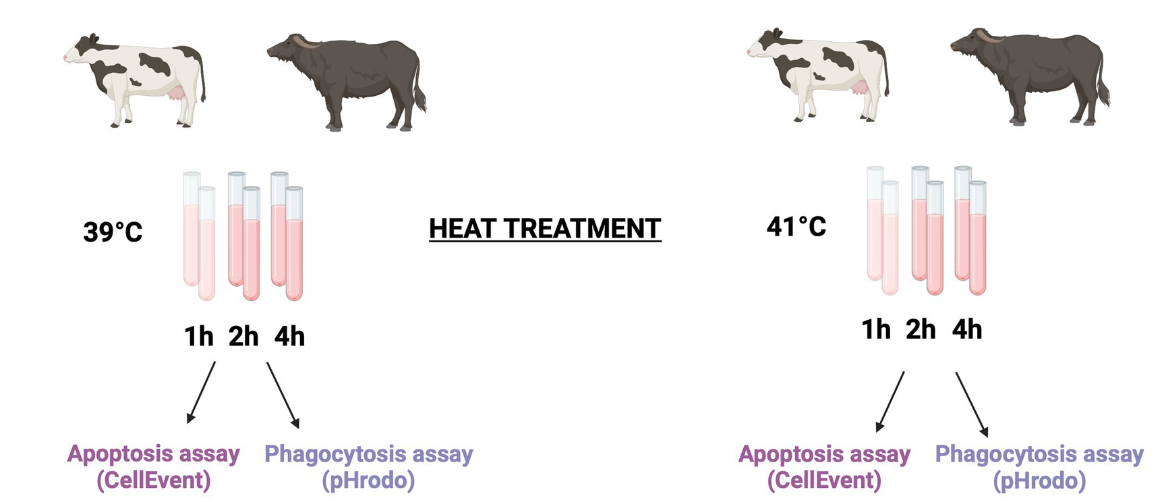
Para explorar el efecto de la hipertermia sobre la viabilidad celular, la apoptosis y la fagocitosis, realizamos un tratamiento a temperatura in vitro de muestras de sangre. Se incubaron seis tubos experimentales que contenían 100 μL de sangre total de cada animal en un baño de agua termostático a 39 °C (imitando la condición de normotermia) y 41 °C (imitando la condición de estrés térmico severo) durante 1, 2 y 4 h. El diagrama de flujo de los procedimientos operativos se muestra en la Figura 1.
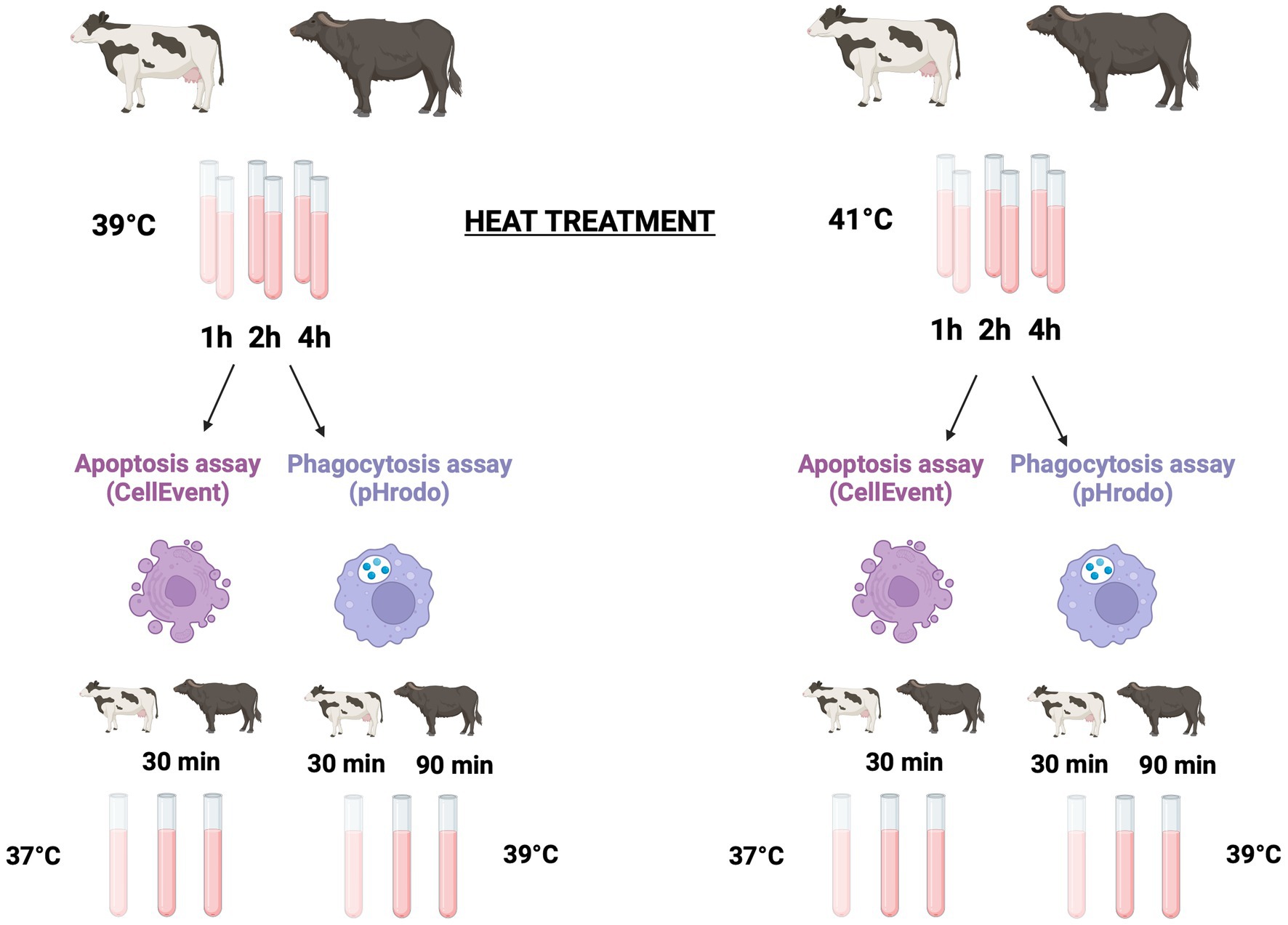 Figura 1. Diseño experimental. Se utilizaron seis búfalos Holstein y nueve búfalos mediterráneos para explorar el efecto de la hipertermia sobre la apoptosis y la fagocitosis. Seis tubos experimentales que contenían 100 μL de sangre total de cada animal se incubaron en un baño de agua termostático a 39 °C (imitando la condición de normotermia) y a 41 °C (imitando la condición de estrés térmico severo) durante 1, 2 y 4 h, respectivamente. Para detectar la apoptosis y la muerte celular, después del tratamiento térmico, las muestras se mantuvieron en hielo durante 10 minutos y luego se lisaron y lavaron. Los leucocitos se incubaron durante 30 min a 37 °C en presencia del ensayo verde CellEvent Caspasa-3/7. Después de eso, las células se recolectaron inmediatamente en un citómetro de flujo. Para analizar la fagocitosis, después del tratamiento térmico, todos los tubos se mantuvieron en hielo durante 10 min. A continuación, se añadieron biopartículas de E. coli verde pHrodo™ a cada tubo. Para iniciar la fagocitosis, las muestras se incubaron a 39 °C. Las muestras bovinas se incubaron durante 30 min, mientras que las muestras de búfalo se incubaron durante 90 min. Después de la incubación, la fagocitosis se detuvo colocando las muestras en hielo durante 10 min, y los eritrocitos se lisaron y lavaron antes del análisis citométrico de flujo. Creado con BioRender.com.®
Figura 1. Diseño experimental. Se utilizaron seis búfalos Holstein y nueve búfalos mediterráneos para explorar el efecto de la hipertermia sobre la apoptosis y la fagocitosis. Seis tubos experimentales que contenían 100 μL de sangre total de cada animal se incubaron en un baño de agua termostático a 39 °C (imitando la condición de normotermia) y a 41 °C (imitando la condición de estrés térmico severo) durante 1, 2 y 4 h, respectivamente. Para detectar la apoptosis y la muerte celular, después del tratamiento térmico, las muestras se mantuvieron en hielo durante 10 minutos y luego se lisaron y lavaron. Los leucocitos se incubaron durante 30 min a 37 °C en presencia del ensayo verde CellEvent Caspasa-3/7. Después de eso, las células se recolectaron inmediatamente en un citómetro de flujo. Para analizar la fagocitosis, después del tratamiento térmico, todos los tubos se mantuvieron en hielo durante 10 min. A continuación, se añadieron biopartículas de E. coli verde pHrodo™ a cada tubo. Para iniciar la fagocitosis, las muestras se incubaron a 39 °C. Las muestras bovinas se incubaron durante 30 min, mientras que las muestras de búfalo se incubaron durante 90 min. Después de la incubación, la fagocitosis se detuvo colocando las muestras en hielo durante 10 min, y los eritrocitos se lisaron y lavaron antes del análisis citométrico de flujo. Creado con BioRender.com.®
Ensayo de apoptosis
Se utilizó el kit de ensayo verde CellEvent Caspasa-3/7 (Thermo Fisher Scientific, Waltham, MA, Estados Unidos) para evaluar la activación de la caspasa mediante citometría de flujo, una característica de las primeras etapas de la apoptosis. Este reactivo, un péptido de 4 aminoácidos (DEVD) conjugado con un colorante de unión a ácidos nucleicos, detecta las caspasas-3 y 7 activadas en células apoptóticas. Durante la apoptosis, esta secuencia es reconocida y escindida por las enzimas activadas. La escisión de la secuencia de reconocimiento y la unión del ADN por el colorante permiten etiquetar las células apoptóticas. En este kit, la caspasa-3/7 de CellEvent se utiliza junto con la tinción de células muertas SYTOX AADvanced, lo que permite una diferenciación directa entre células vivas, apoptóticas y necróticas. Después del tratamiento térmico, las muestras se lisaron con 1 mL de solución de cloruro de amonio tamponada con Tris (0,87% p/v, pH 7,3) a temperatura ambiente durante 10 min. La lisis se detuvo con 3 mL de PBS frío y los leucocitos se recuperaron por centrifugación a 300 × g durante 5 min a 4 °C. Las células se resuspendieron en 1 mL de PBS/BSA al 2% y se incubaron durante 30 min a 37°C en un CO humidificado2 incubadora en presencia de 1 mL del reactivo de detección verde CellEvent Caspasa-3/7. Durante los últimos 5 min de tinción, se añadió a las muestras 1 mL de la tinción de células muertas SYTOX AADvanced de 1 mM. Las muestras se adquirieron inmediatamente en un citómetro de flujo CytoFLEX (Beckman Coulter, Brea, CA, Estados Unidos). Cada reactivo se excitó con un láser de 488 nm y la emisión de fluorescencia se recogió utilizando un filtro de paso de banda 525/40 para el reactivo de detección verde CellEvent Caspasa-3/7 y un filtro de paso de banda 690/50 para la tinción de células muertas SYTOX AADvanced. También se analizaron los controles de muestra teñida única de ambos reactivos para ajustarlos al nivel de compensación.
Ensayo de fagocitosis
Se utilizó el pHrodo™ Green E. coli Bioparticles Conjugated (Thermo Fisher Scientific, Waltham, MA, Estados Unidos) para evaluar la fagocitosis en muestras de sangre total mediante citometría de flujo. Después del tratamiento térmico, todos los tubos experimentales se mantuvieron en hielo durante 10 min. A continuación, se añadieron 20 μL de 1 mg/mL de biopartículas de E. coli verde de pHrodo™ a cada tubo. Para iniciar la fagocitosis, las muestras se incubaron a 39 °C.®®
Para probar diferentes tiempos de incubación (30, 60, 90 y 120 min) y la proporción celular de biopartículas de E. coli verde pHrodo™ (5:1; 10:1; y 20:1) para especies bovinas y búfalas, se llevaron a cabo experimentos preliminares. Con base en consideraciones operativas y el mayor nivel de fagocitosis encontrado en ambas especies (datos no mostrados), identificamos el tiempo de incubación de 30 y 90 min para muestras de bovino y búfalo, respectivamente.®
Para cada condición experimental, se mantuvo un tubo en hielo como muestra de control negativa (inhibición de la fagocitosis). Después de la incubación, la fagocitosis se detuvo colocando las muestras en hielo durante 10 min. A continuación, los eritrocitos se lisaron con 1 mL de solución de cloruro de amonio tamponada con Tris (0,87% p/v, pH 7,3) a temperatura ambiente durante 10 min. Todos los tubos se centrifugaron a 300 × g durante 5 min a 4 °C y se lavaron dos veces con PBS. El colorante pHrodo™ es altamente fluorescente en el ambiente ácido del fagosoma al internalizarse y, luego, esta propiedad elimina el paso de enfriamiento. Las células se resuspendieron en 100 μL de PBS y se recogieron inmediatamente en un citómetro de flujo CytoFLEX. Las biopartículas de E. coli pHrodo™ Green se excitaron con un láser de 488 nm utilizando un filtro de paso de banda 525/40. Para analizar los datos de la citometría de flujo se utilizó el software Kaluza Analysis v 2.1 (Beckman Coulter, Brea, CA, Estados Unidos). Para analizar las muestras, configuramos diagramas de puntos que muestran la dispersión directa (FSC) frente a la dispersión lateral (SSC) para seleccionar granulocitos y monocitos y un diagrama de puntos que muestra SSC frente a la fluorescencia para medir la fluorescencia. Los neutrófilos y los eosinófilos se separaron fácilmente por el aumento de la autofluorescencia de esta última población en todos los canales fluorescentes. Se analizaron los porcentajes de células fagocíticas como neutrófilos y monocitos (actividad fagocítica), y su IMF es la expresión del número de bacterias ingeridas (capacidad fagocítica).®
Análisis estadístico
Los datos se analizaron con el software SPSS (IBM, versión 22) y los gráficos se crearon con GraphPad Prism (versión 8.3.1). Las comparaciones por pares se realizaron mediante una prueba de comparación múltiple (prueba de Tukey). Todos los datos se expresaron como media ± S.E y se analizaron con la prueba de ANOVA de tres vías de medidas repetidas. Se comprobó la significación de los valores medios a niveles de 5 y 1%. Se empleó el siguiente modelo estadístico para evaluar el impacto de las especies, la temperatura, la duración de la exposición al estrés térmico y sus interacciones en la variable dependiente:
En este modelo, YIJK representa la variable dependiente, μ es la media de la población general, SYo representa el efecto de la especie (i = 2 para dos especies), Tj representa el efecto de la temperatura (j = 2 para dos niveles de temperatura), Dk representa el efecto de la duración del estrés térmico (k = 3 para tres niveles de duración), y eIJK representa el error aleatorio, que se supone que es independiente y se distribuye normalmente.
Resultados
Efecto de la hipertermia sobre la viabilidad de los leucocitos bovinos y búfalos
Para evaluar el efecto de la temperatura sobre la viabilidad de las células, se utilizó un ensayo de citometría de flujo que permite medir la etapa temprana de la apoptosis y la necrosis celular tardía al mismo tiempo. Como se muestra en la Figura 2, en un diagrama de puntos de doble parámetro de la fluorescencia de células muertas avanzadas de CellEvent Caspasa-3/7 frente a SYTOX AADvanced, se pueden distinguir tres poblaciones celulares (células vivas, necróticas y apoptóticas), revelando así el efecto de la hipertermia sobre la viabilidad de los leucocitos.
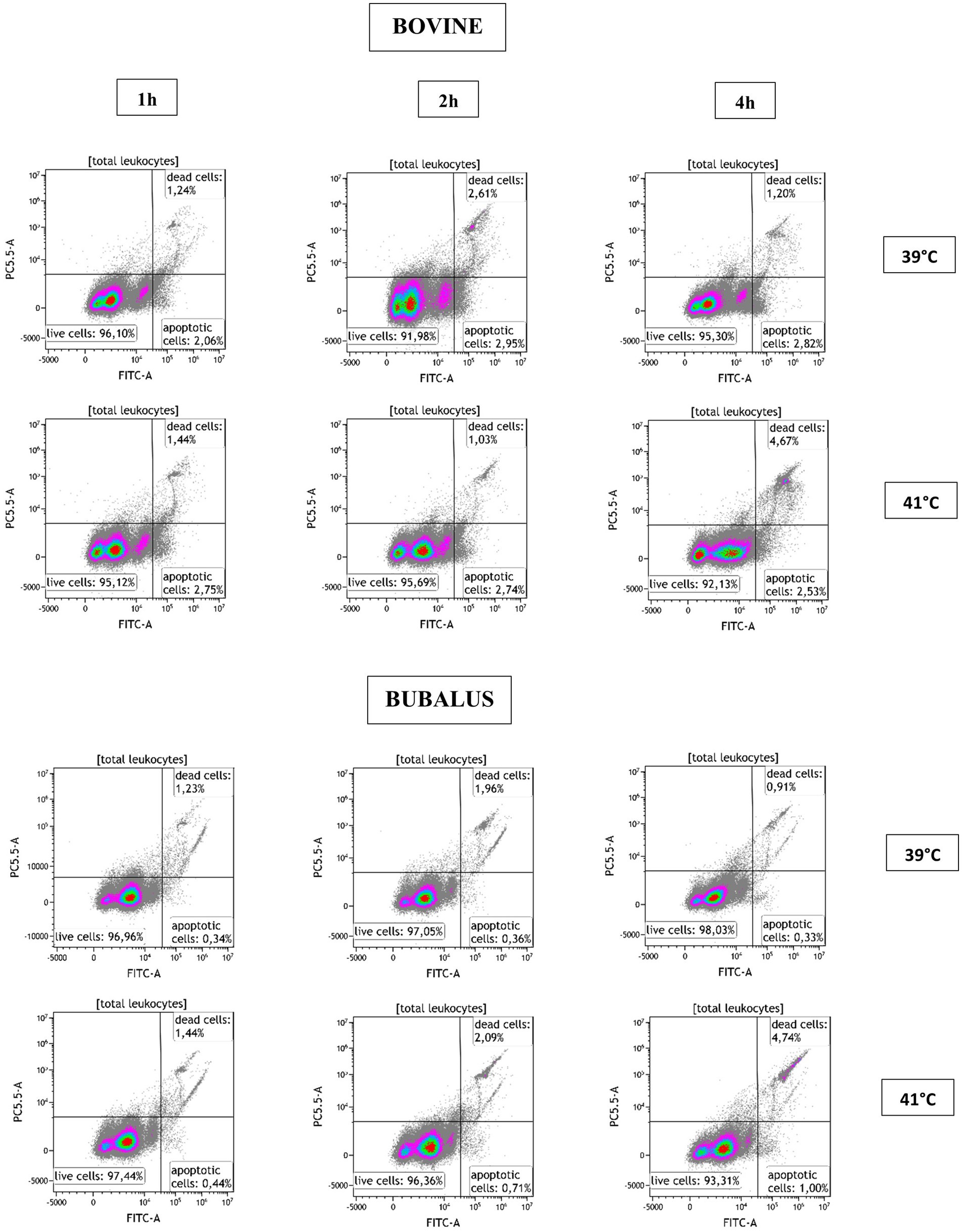 Figura 2. Análisis por citometría de flujo de apoptosis con activación de Caspasa-3/7. Después de la exclusión de los dobletes celulares, los leucocitos se identificaron en función de sus características FSC y SSC y se graficaron en un diagrama de puntos de doble parámetro CellEvent Caspasa-3/7 (FITC-A) vs. SYTOX AADvanced Dead Cell fluorescence. Se identificaron tres poblaciones (células vivas, necróticas y apoptóticas) y se calcularon para la muestra de sangre después de la incubación a 39 y 41 °C durante 1, 2 y 4 h.
Figura 2. Análisis por citometría de flujo de apoptosis con activación de Caspasa-3/7. Después de la exclusión de los dobletes celulares, los leucocitos se identificaron en función de sus características FSC y SSC y se graficaron en un diagrama de puntos de doble parámetro CellEvent Caspasa-3/7 (FITC-A) vs. SYTOX AADvanced Dead Cell fluorescence. Se identificaron tres poblaciones (células vivas, necróticas y apoptóticas) y se calcularon para la muestra de sangre después de la incubación a 39 y 41 °C durante 1, 2 y 4 h.
En la Tabla 1 se muestran los porcentajes medios de leucocitos, granulocitos, monocitos y linfocitos apoptóticos y necróticos, después de la incubación a 39 o 41 °C durante 1, 2 y 4 h.
 Tabla 1. Comparación de los valores porcentuales de los subgrupos leucocitarios apoptóticos y necróticos entre bovinos y búfalos después de la incubación in vitro a 39 °C (temperatura normal) y 41 °C (hipertermia).
Tabla 1. Comparación de los valores porcentuales de los subgrupos leucocitarios apoptóticos y necróticos entre bovinos y búfalos después de la incubación in vitro a 39 °C (temperatura normal) y 41 °C (hipertermia).
Además, se presentan los efectos de las especies, la temperatura, el tiempo y las interacciones entre las diferentes variables. En vacas bovinas, se observó un aumento significativo de linfocitos y granulocitos necróticos y monocitos apoptóticos después de la incubación a 41 °C en comparación con 39 °C. En búfalos, la incubación a 41°C provocó un aumento solo de linfocitos necróticos (p < 0,05). En general, se observaron valores más altos en bovinos para la fracción de leucocitos apoptóticos (p ≤ 0,001), granulocitos necróticos (p = 0,001), monocitos apoptóticos (p = 0,003) y linfocitos apoptóticos (p ≤ 0,001) en comparación con los búfalos. Después de la incubación a 41°C de las células bovinas, se observó un aumento significativo de granulocitos necróticos (p = 0,021), monocitos apoptóticos (p = 0,007) y linfocitos necróticos (p = 0,018). El efecto del tiempo de incubación se observó en leucocitos necróticos (p = 0,028), monocitos (p = 0,005) y linfocitos apoptóticos y necróticos (p = 0,018 y p ≤ 0,001, respectivamente). Se observó una interacción especie*temperatura en monocitos apoptóticos (p = 0,032) mientras que una interacción especie*tiempo influyó en el porcentaje de granulocitos necróticos (p = 0,006) y linfocitos (p = 0,011); Esta última población se vio afectada por la temperatura de interacción*tiempo (p = 0,045). Finalmente, la interacción de todos los factores (especie*temperatura*tiempo) afectó significativamente el porcentaje de granulocitos necróticos (p = 0,039).
La Figura 3 muestra cómo la viabilidad celular de los leucocitos bovinos y búfalos se vio afectada de manera diferente por la hipertermia y el tiempo de incubación. Se observó una mayor proporción de leucocitos apoptóticos en bovinos que en búfalos a ambas temperaturas (39 y 41 °C) y para todos los puntos temporales (Figura 3A), mientras que no se observó diferencia en el porcentaje de leucocitos necróticos entre las dos especies (Figura 3B). Aunque la fracción de granulocitos apoptóticos no difirió significativamente entre las dos especies (Figura 3C), se encontró un aumento significativo de los granulocitos necróticos después de 4 h de incubación de las células bovinas a 41 °C en comparación con los búfalos (Figura 3D).
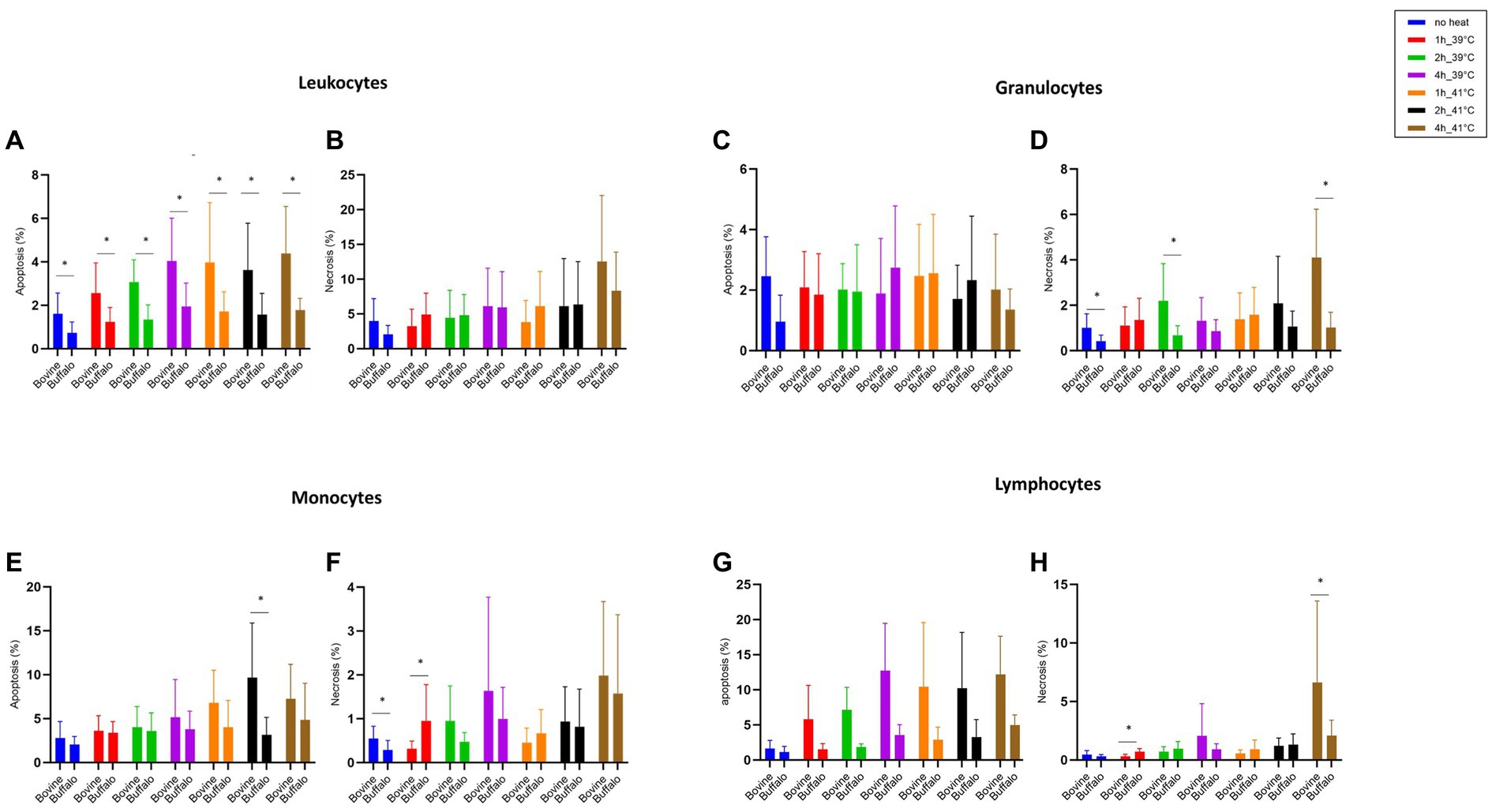 Figura 3. El impacto de la hipertermia en la apoptosis y necrosis de las células leucocitarias. Las muestras de sangre se incubaron en diferentes momentos (1, 2 y 4 h) y temperaturas (39 y 41°C). Para ambas especies, no se utilizó ninguna muestra de calor como control del nivel basal. Se calcularon los porcentajes de células apoptóticas y necróticas para leucocitos, granulocitos, monocitos y linfocitos totales cerrados y se presentaron como media ± SEM (*indica p < 0,05).
Figura 3. El impacto de la hipertermia en la apoptosis y necrosis de las células leucocitarias. Las muestras de sangre se incubaron en diferentes momentos (1, 2 y 4 h) y temperaturas (39 y 41°C). Para ambas especies, no se utilizó ninguna muestra de calor como control del nivel basal. Se calcularon los porcentajes de células apoptóticas y necróticas para leucocitos, granulocitos, monocitos y linfocitos totales cerrados y se presentaron como media ± SEM (*indica p < 0,05).
Para los monocitos, la apoptosis celular fue mayor en bovinos que en búfalos después de 2 h de incubación a 41°C (Figura 3E). Sin embargo, no se encontraron diferencias en la necrosis de monocitos (Figura 3F). Los linfocitos apoptóticos mostraron un patrón similar al de los leucocitos totales, aunque las diferencias entre bovinos y búfalos no fueron significativas (Figura 3G). Por el contrario, los linfocitos necróticos fueron significativamente más altos después de 1 h a 39 °C en los búfalos en comparación con los bovinos, mientras que se encontraron valores más altos en los bovinos en comparación con los búfalos después de 4 h a 41 °C (Figura 3H).
En la Tabla 2 se presenta el impacto del tiempo de exposición al estrés térmico in vitro (1, 2 y 4 h) sobre la viabilidad celular de los leucocitos y sus subpoblaciones. En los bovinos, la incubación de sangre a 39°C provocó un aumento de los leucocitos apoptóticos con valores significativamente más altos después de 2 y 4 h en comparación con los valores basales antes de la incubación. Sin embargo, se observó un aumento de las células apoptóticas después de 1 h cuando la sangre se incubó a 41 °C. No se observó un aumento de los leucocitos necróticos durante el curso a 39 °C, mientras que la incubación a 41 °C aumentó los leucocitos necróticos después de 2 y 4 h en comparación con los valores basales antes de la incubación. Se observó un efecto pronecrótico similar en los granulocitos de muestras de sangre incubadas durante 4 h a 41 °C en comparación con 39 °C. Se observó un aumento sustancial de los monocitos apoptóticos al principio de la incubación a 41 °C, con un aumento significativo después de 1 h de incubación y un aumento máximo después de 2 h. La población de linfocitos mostró el mayor aumento en la apoptosis celular con el aumento del tiempo de incubación en comparación con los monocitos y granulocitos. Este aumento se encontró después de 4 h para las muestras incubadas a 39 °C y después de 1, 2 y 4 h para las muestras incubadas a 41 °C.
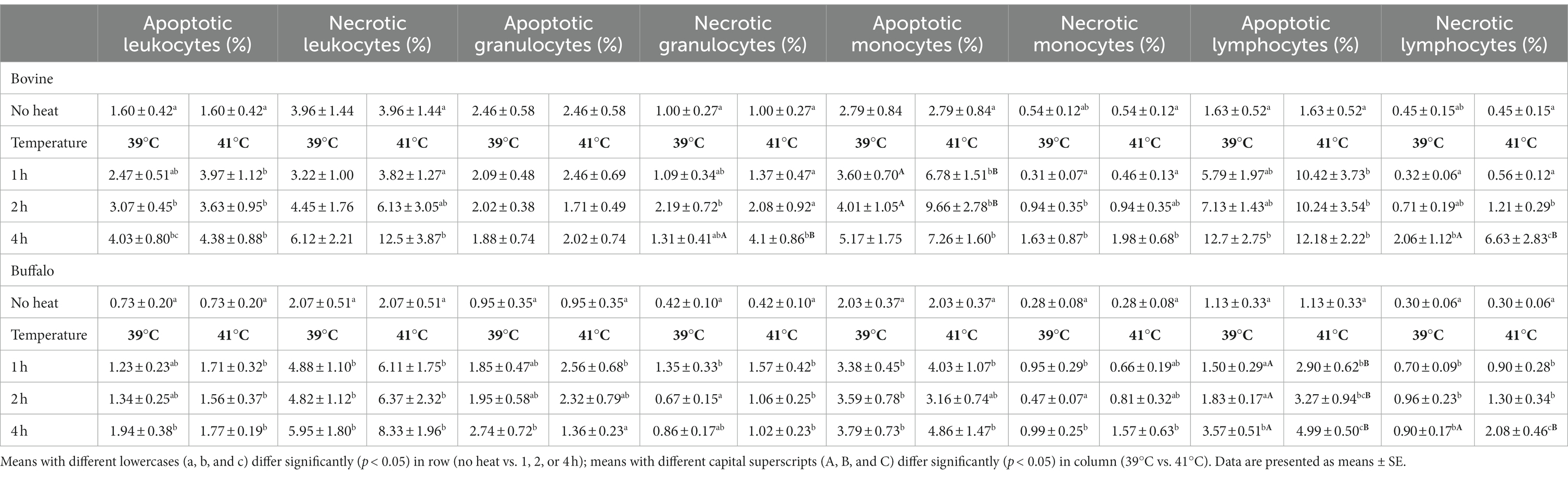 Tabla 2. Comparación de células apoptóticas y necróticas en bovinos y búfalos en diferentes momentos y temperaturas.
Tabla 2. Comparación de células apoptóticas y necróticas en bovinos y búfalos en diferentes momentos y temperaturas.
En la población total de leucocitos y granulocitos de búfalos, la incubación a 39°C provocó un aumento de las células apoptóticas con valores significativamente más altos después de 4 h. Por el contrario, la exposición de la sangre a 41 °C provocó un aumento significativo de la apoptosis celular después de 1 h en comparación con los valores basales antes del tratamiento térmico. La incubación a 41 °C dio lugar a un aumento significativo de los granulocitos necróticos en todos los puntos temporales. Para los monocitos, la apoptosis celular fue inducida con un aumento del tiempo de incubación a ambas temperaturas, mientras que el aumento de la necrosis celular se observó después de 4 h a ambas temperaturas. Los linfocitos mostraron un aumento significativo de la apoptosis celular después de 4 h de incubación a 39 °C y para cada punto de tiempo a 41 °C, mientras que el aumento de linfocitos necróticos comenzó después de 1 h de incubación a 41 °C con un aumento continuo hasta 4 h (Tabla 2).
Efecto de la hipertermia sobre la actividad fagocitosis de neutrófilos y monocitos bovinos y búfalos
La fagocitosis se evaluó mediante citometría de flujo con el sistema basado en colorante pHrodo™ que mide la actividad fagocítica en función de la acidificación de las partículas a medida que se ingieren, eliminando los pasos de lavado y enfriamiento. Este reactivo fue previamente validado como una herramienta rápida y confiable para evaluar la fagocitosis de múltiples especies (16). La configuración del detector del citómetro se optimizó utilizando muestras no marcadas. Se utilizó sangre sin biopartículas de E. coli verde pHrodo™ para establecer un marcador de autofluorescencia FL1, de modo que menos del 3% de los eventos fueron positivos. El porcentaje de células fagocitadoras (actividad fagocitosis) en la muestra experimental se determinó identificando la fracción de eventos por encima de esta posición del marcador, mientras que la capacidad de fagocitosis se identificó como la intensidad media de fluorescencia (MFI) de las células fluorescentes positivas para pHrodo™ para indicar el número de bacterias engullidas por cada célula fagocítica (Figura 4).®
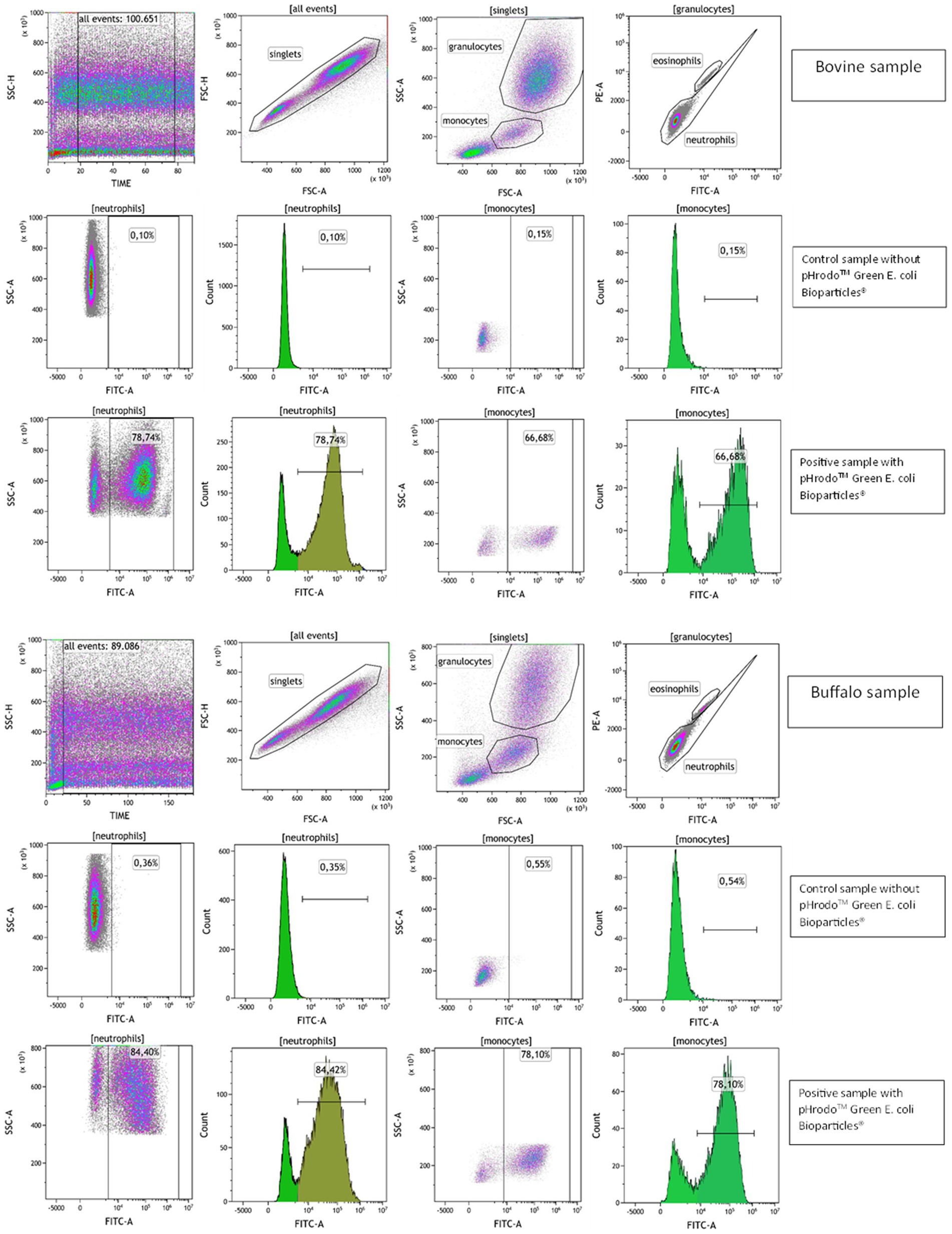 Figura 4. Estrategia de activación por citometría de flujo para evaluar la fagocitosis en muestras de sangre de bovino y búfalo. Se utilizó un parámetro de tiempo frente a un diagrama de puntos SSC para excluir la ráfaga de eventos y un diagrama de puntos FSC-A frente a FSC-H para excluir los dobletes. Los granulocitos y monocitos se identificaron en función de sus características de SSC y FSC, y los eosinófilos se excluyeron en el diagrama de puntos de PE frente al canal FITC debido a su autofluorescencia. Las muestras de sangre bovina y búfala se incubaron sin (muestras control) y con biopartículas de E. coli verde pHrodo (muestras positivas), y se determinaron los porcentajes de células pHrodo™ positivas de neutrófilos y monocitos.®
Figura 4. Estrategia de activación por citometría de flujo para evaluar la fagocitosis en muestras de sangre de bovino y búfalo. Se utilizó un parámetro de tiempo frente a un diagrama de puntos SSC para excluir la ráfaga de eventos y un diagrama de puntos FSC-A frente a FSC-H para excluir los dobletes. Los granulocitos y monocitos se identificaron en función de sus características de SSC y FSC, y los eosinófilos se excluyeron en el diagrama de puntos de PE frente al canal FITC debido a su autofluorescencia. Las muestras de sangre bovina y búfala se incubaron sin (muestras control) y con biopartículas de E. coli verde pHrodo (muestras positivas), y se determinaron los porcentajes de células pHrodo™ positivas de neutrófilos y monocitos.®
Para probar el sistema basado en colorantes pHrodo™ en especies bovinas y búfalas, se utilizó un control negativo dependiente de la temperatura incubado a 4 °C para inhibir el envolvimiento bacteriano y la fusión de la membrana fagosoma-lisosoma, como lo demostraron Neaga et al. (16). Como era de esperar, las muestras incubadas en hielo exhibieron un bajo porcentaje de neutrófilos y monocitos que engullen bacterias, como se muestra en la Figura Suplementaria S1.
El impacto de las especies, la temperatura, el tiempo y sus interacciones en la actividad y capacidad de fagocitosis en fagocitos bovinos y búfalos se presenta en la Tabla 3. Para ambas especies, se observaron porcentajes y valores de MFI significativamente más bajos para los neutrófilos pHrodo cuando la sangre se incubó a 41 °C en comparación con 39 °C. Aunque se observó un efecto similar de la temperatura para los monocitos de pHrodo, la diferencia fue significativa solo en los búfalos. Tanto la temperatura como el tiempo de exposición al calor mostraron un efecto significativo sobre la actividad fagocitosis de neutrófilos (p ≤ 0,001) y monocitos (p = 0,004; p ≤ 0,001), mientras que solo la capacidad de fagocitosis (IMF) de los monocitos se vio afectada por la temperatura (p = 0,001). Se observó un efecto significativo de las especies sobre el MFI de los neutrófilos (p = 0,035) y el porcentaje y MFI de los monocitos (p ≤ 0,001) (Tabla 3).++
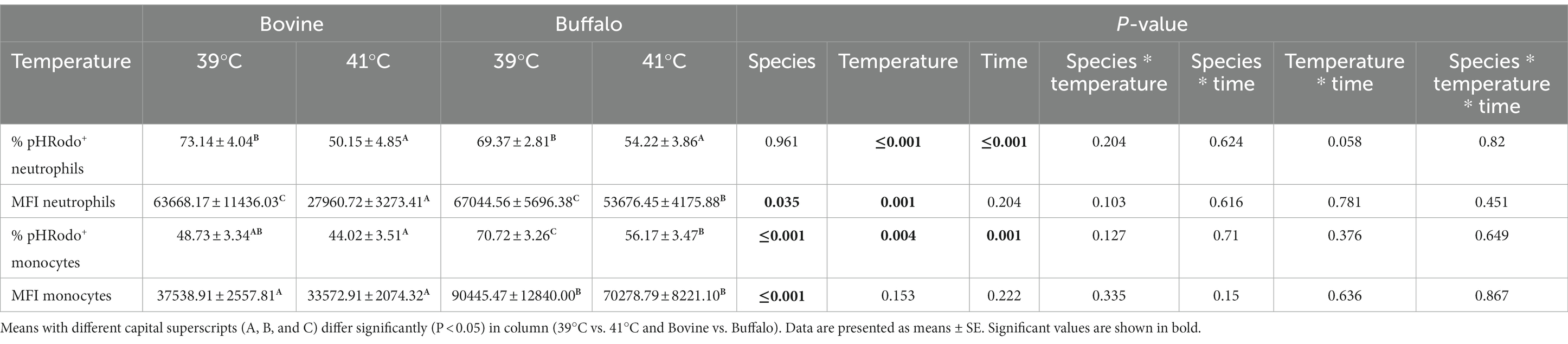 Tabla 3. Comparación de los valores porcentuales de neutrófilos y monocitos de pHrodo y su Intensidad Fluorescente Media (IMF) entre bovinos y búfalos después de la incubación in vitro a 39 °C (temperatura normal) y 41 °C (hipertermia). +
Tabla 3. Comparación de los valores porcentuales de neutrófilos y monocitos de pHrodo y su Intensidad Fluorescente Media (IMF) entre bovinos y búfalos después de la incubación in vitro a 39 °C (temperatura normal) y 41 °C (hipertermia). +
Aunque no se encontraron diferencias significativas entre las dos especies en cuanto a la actividad de fagocitosis de los neutrófilos (Figura 5A), se encontraron valores más bajos de capacidad de fagocitosis (MFI) en las células bovinas en comparación con las células de búfalo a 41 °C (Figura 5B). Curiosamente, los monocitos de búfalo mostraron una actividad y capacidad de fagocitosis significativamente mayor que los bovinos (Figuras 5C, D).
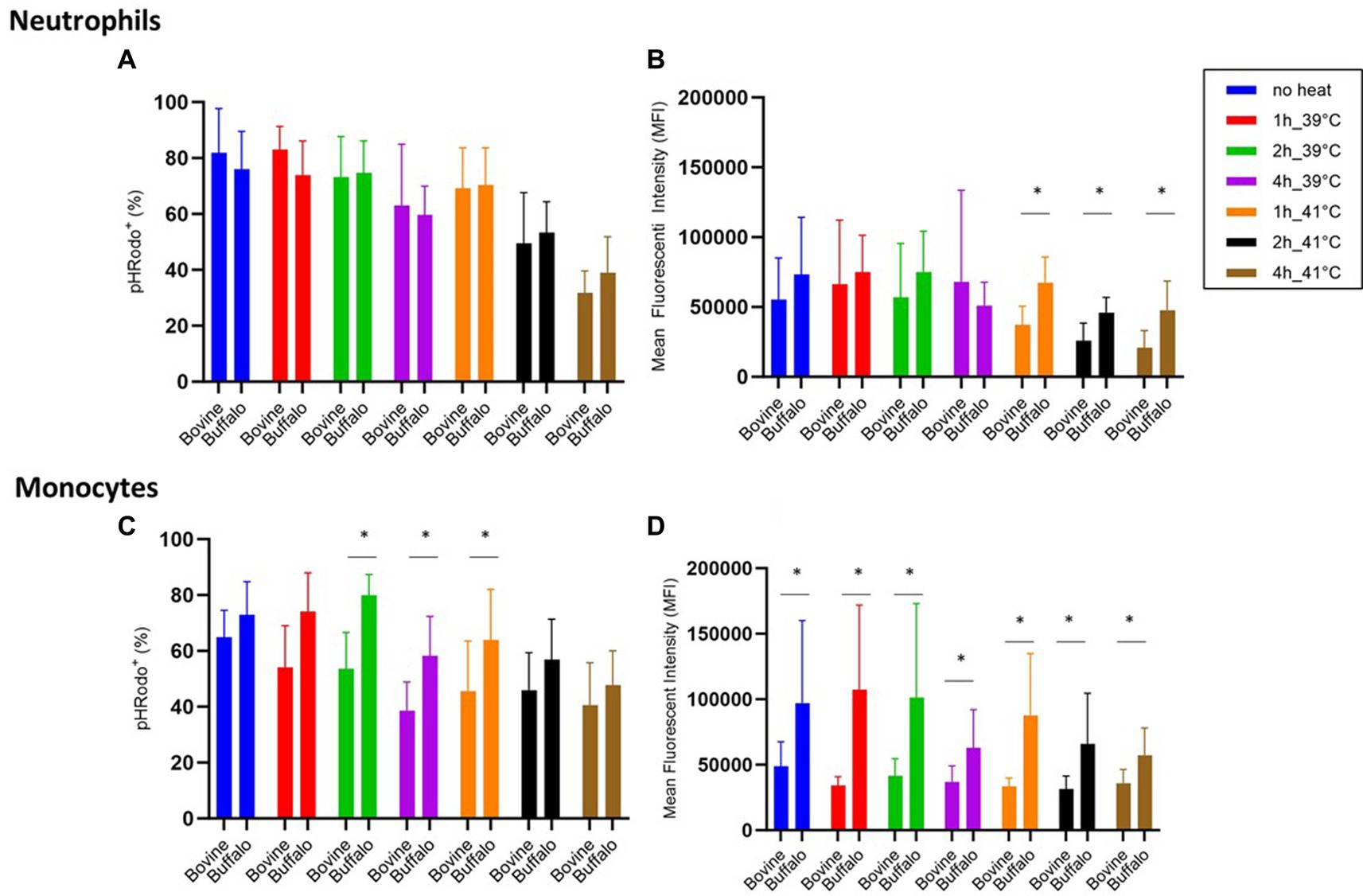 Figura 5. Impacto de la hipertermia en la fagocitosis bacteriana por neutrófilos y monocitos bovinos y búfalos. Las muestras de sangre se incubaron en diferentes momentos y temperaturas. Para ambas especies, no se utilizó ninguna muestra de calor como control del nivel basal. Se calcularon los porcentajes de células pHrodo y sus IMF para neutrófilos y monocitos activados. Los datos se presentaron como media ± SEM (*indica p < 0,05).+
Figura 5. Impacto de la hipertermia en la fagocitosis bacteriana por neutrófilos y monocitos bovinos y búfalos. Las muestras de sangre se incubaron en diferentes momentos y temperaturas. Para ambas especies, no se utilizó ninguna muestra de calor como control del nivel basal. Se calcularon los porcentajes de células pHrodo y sus IMF para neutrófilos y monocitos activados. Los datos se presentaron como media ± SEM (*indica p < 0,05).+
El curso temporal de la actividad de fagocitosis y la capacidad de los neutrófilos y monocitos se presenta en la Tabla 4. En comparación con las muestras sin tratamiento térmico (muestra fresca), las muestras de sangre de ambas especies incubadas durante 4 h a 39 o 41 °C mostraron una disminución de los porcentajes de neutrófilos y monocitos pHrodo. Los valores a 41 °C fueron inferiores a los valores a 39 °C solo para los neutrófilos.+
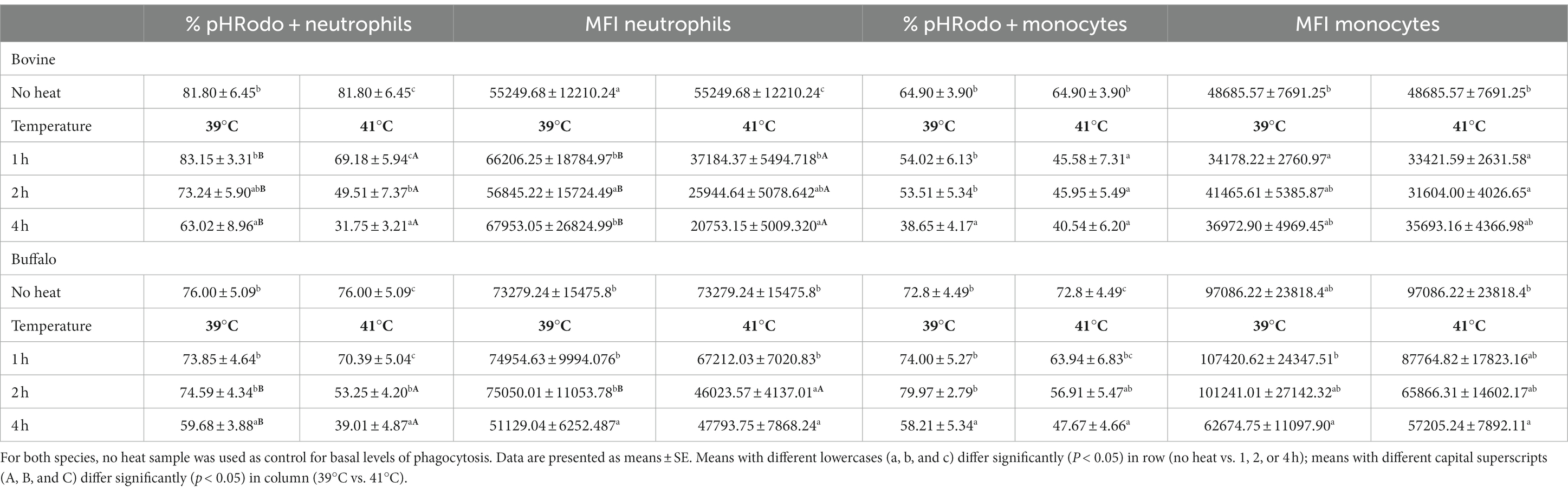 Tabla 4. Las muestras de sangre bovina y búfala se incubaron en diferentes momentos según lo indicado, y el porcentaje de neutrófilos y monocitos fluorescentes positivos para pHrodo y la intensidad media de fluorescencia (IMF) de las células positivas para pHrodo™ fluorescente se analizaron mediante citometría de flujo utilizando biopartículas de E. coli verde de pHrodo™™. ®
Tabla 4. Las muestras de sangre bovina y búfala se incubaron en diferentes momentos según lo indicado, y el porcentaje de neutrófilos y monocitos fluorescentes positivos para pHrodo y la intensidad media de fluorescencia (IMF) de las células positivas para pHrodo™ fluorescente se analizaron mediante citometría de flujo utilizando biopartículas de E. coli verde de pHrodo™™. ®
Discusión
El desafío del calentamiento global y los efectos negativos resultantes del estrés térmico en la salud y la productividad de los animales refuerzan la necesidad de una investigación intensiva para identificar especies animales y razas con mayor adaptación térmica (17, 18). Se ha reportado un profundo impacto del estrés por calor en el sistema inmunológico para varias especies animales (19-22). La investigación sobre el sistema inmunitario del búfalo de agua ha cobrado especial interés recientemente, lo que ha llevado a la caracterización de elementos clave del sistema inmunitario con algunas similitudes y diferencias con el sistema inmunitario bovino (23-27). Sin embargo, aún no se sabe si las dos especies muestran diferentes capacidades de termotolerancia de su sistema inmunológico. Por lo tanto, el presente estudio analizó comparativamente el impacto de la hipertermia in vitro sobre la viabilidad celular y la actividad fagocitosis de los leucocitos y sus subpoblaciones en especies bovinas y búfalas.
El impacto del estrés térmico en diferentes funciones fisiológicas del sistema corporal se ha descrito en varios estudios. Esto incluye una reducción de las capacidades de producción y reproducción, una anemia asociada al estrés térmico debido a la disminución del número de eritrocitos, una disminución de las concentraciones de hemoglobina y una reducción del volumen de células empaquetadas, y respuestas inmunitarias innatas y adaptativas comprometidas debido al efecto directo de los glucocorticoides y las catecolaminas en la producción de citoquinas, lo que favorece la polarización de la respuesta de las células T hacia una respuesta dominante Th2 (28). La existencia de mecanismos de adaptación térmica específicos de cada especie ha sido intensamente investigada en la literatura. Las respuestas de los mamíferos al estrés por calor incluyen respuestas fisiológicas, conductuales y metabólicas, como el aumento de la ingesta de agua, la sudoración y la frecuencia respiratoria y la reducción de la frecuencia cardíaca y la ingesta de alimento (29). Los humanos y los caballos muestran una mayor capacidad para disipar el calor, mientras que otras especies como perros, gatos, cerdos y búfalos tienen pocas glándulas sudoríparas, dependiendo de otros mecanismos de termorregulación (30).
La diferencia en las respuestas termorreguladoras al estrés por calor en el ganado vacuno y el búfalo se atribuye principalmente a distinciones anatómicas, como el color y el grosor de la epidermis, la densidad del cabello y la densidad de las glándulas sudoríparas. Investigaciones recientes han puesto de relieve un inicio y una gravedad más pronunciados del estrés por calor en los búfalos en comparación con el ganado vacuno a varios niveles de índice de temperatura-humedad (THI), lo que sugiere posibles variaciones en el momento y la magnitud de la respuesta inmunitaria al estrés por calor entre las dos especies (31, 32). En este contexto, los búfalos exhiben una mayor carga de estrés oxidativo, lo que conduce a una reducción posterior de la actividad metabólica y la respuesta inmunitaria. En consecuencia, se postula que el deterioro de diferentes funciones inmunes es más notable en los búfalos estresados por calor en comparación con el ganado vacuno (31, 32).
El impacto directo de la hipertermia en la muerte celular ha sido demostrado en varios estudios (33, 34). Los mecanismos por los cuales el estrés por calor induce la apoptosis involucran la activación de una vía mitocondrial, lo que conduce a la generación de ROS, la pérdida del potencial de membrana mitocondrial, la liberación del citocromo c de las mitocondrias, la apertura de los poros de transición de permeabilidad, la expresión de los miembros de la familia Bcl-2 y la activación de las caspasas-9 y 3 (35). Además, se ha descrito una vía apoptótica independiente de las mitocondrias, en la que interviene el Ca2+−calpaína proteasa cisteína dependiente que induce la localización de la caspasa-12 en el lado citoplasmático del RE (36). Los métodos de detección de la muerte celular incluyen el análisis de la fosfatidilserina de membrana, los cambios en la MMP y la actividad de las caspasas. En el presente estudio, se utilizó un sustrato fluorogénico de caspasas-3 y 7 en combinación con un colorante de unión al ADN, para evaluar el impacto de la hipertermia en la viabilidad celular. La ventaja de esta metodología radica en su alto potencial para diferenciar entre células apoptóticas y necróticas, ya que la activación de la caspasa-3 es un marcador clave de la apoptosis temprana, mientras que la necrosis celular se asocia con la falta de activación de caspasas y el aumento de la permeabilidad de la membrana celular (37).
En el caso de los leucocitos frescos antes de la incubación, se observó una menor viabilidad celular con un mayor porcentaje de células apoptóticas en los bovinos en comparación con las células de búfalo, un efecto que siguió siendo significativo durante varios tiempos de incubación bajo hipertermia. Si esto podría estar relacionado con una mayor resistencia natural de las células de búfalo a la lisis hipotónica durante el procedimiento de separación celular, debe investigarse en estudios posteriores. Para ambas especies, los linfocitos mostraron una mayor sensibilidad a la hipertermia in vitro en comparación con los granulocitos y monocitos con mayores tasas de apoptosis junto con un mayor tiempo de incubación. Esto parece contrastar con la mayor resistencia al choque térmico reportada para los linfocitos de camello en comparación con otros subconjuntos (13). En un estudio previo, observamos que las células mononucleares bovinas eran susceptibles al cultivo in vitro estándar prolongado al mostrar un aumento de células con caspasa-3 activa (38).
Aquí, la falta de cambios significativos en la vitalidad celular reportada para los granulocitos de búfalo bajo estrés térmico in vitro indica una mayor termotolerancia de esta población celular en comparación con sus contrapartes bovinas, donde 4 h de incubación a 41 °C se asociaron con un aumento de la necrosis celular. Este resultado contradice los hallazgos de Lecchi et al., quienes no observaron ningún impacto del choque térmico sobre la vitalidad de los neutrófilos bovinos (11). Los diferentes resultados podrían estar relacionados con los tipos de muestra utilizados. De hecho, Lecchi et al. utilizaron neutrófilos purificados (11) mientras que aquí se utilizó sangre entera, lo que puede implicar un posible efecto indirecto del estrés térmico sobre los neutrófilos mediado por otros tipos de células leucocitarias. Otra causa de los diferentes resultados podría deberse a los diferentes ensayos utilizados para evaluar la actividad de las caspasas. Aunque la incubación prolongada (4 h) indujo necrosis celular de monocitos de ambas especies y bajo temperaturas normales o de hipertermia, la apoptosis celular solo se observó en monocitos bovinos bajo hipertermia. El impacto de la hipertermia en los monocitos bovinos parece estar en línea con la disminución de la viabilidad celular previamente reportada con el aumento de la apoptosis de monocitos después del estrés térmico in vitro (10). Estudios recientes identificaron la proteína de choque térmico 70 (HSP70) como un actor clave en la reparación de las células y la protección contra la muerte celular programada durante el estrés térmico (39, 40). Por lo tanto, futuras investigaciones podrían centrarse en la expresión diferencial de HSP70 y su papel en la diferente sensibilidad al estrés térmico entre las células bovinas y búfalas.
La fagocitosis es una función clave de las células inmunitarias innatas, como los monocitos y los neutrófilos. El análisis de la fagocitosis generalmente se evalúa utilizando bacterias marcadas con fluorocromo o biopartículas. Una limitación de este método es la falta de distinción entre las bacterias ingeridas y las adheridas a la superficie celular. Para superar esta limitación, algunos estudios utilizaron un extintor fluorescente para diferenciar entre las bacterias adheridas y las ingeridas. Recientemente se ha validado un sistema basado en colorantes pHrodo™ para la evaluación de la actividad fagocítica real mediante la medición de la acidificación de las biopartículas dentro del fagolisosoma debido a su envolvimiento, eliminando así la necesidad de pasos de lavado y enfriamiento (16). El presente estudio representa el primer informe que valida la metodología pHrodo™ para el análisis de la actividad de fagocitosis en bovinos y búfalos de agua e identifica el tiempo óptimo de incubación y la relación biopartícula/célula en las dos especies. En el presente estudio, el análisis comparativo de la fagocitosis utilizando el mismo protocolo reveló un mayor porcentaje general de células fagocíticas (actividad fagocítica) y el MFI de cada célula (capacidad de fagocitosis) para los monocitos de búfalo en comparación con los monocitos bovinos. En los neutrófilos, esto se observó para la capacidad de fagocitosis, pero no para la fracción de células positivas para fagocitosis. Al ser una función mediada por receptores, la eficacia de la fagocitosis está influenciada por la expresión de receptores especializados que mejoran la absorción de los microbios diana a través de diferentes mecanismos, incluida la participación de anticuerpos opsonizantes o factores del complemento que cubren el microbio. Dado que el presente estudio no utilizó biopartículas opsonizadas, no se puede plantear una hipótesis sobre el papel de la expresión diferencial de los receptores fagocíticos de opsonina, como los receptores FC CD16, CD32 y CD64, y de los receptores del complemento (RC), como CR3 (41, 42), en las diferencias observadas. Sin embargo, el papel de la expresión diferencial de otros receptores de fagocitosis (43), como los receptores carroñeros, los receptores de lectina de tipo C y los receptores tipo Toll en fagocitos de búfalos y bovinos, podría ser objeto de estudios adicionales. Además, dado que los monocitos clásicos (cM) son el principal subconjunto de monocitos fagocitadores tanto en bovinos como búfalos, el aumento de la actividad fagocitosis de los monocitos de bubalina podría estar relacionado con el fenotipo específico de cM de bubalina que es positivo para el marcador de activación CD16 (CD14CD16), que contrasta con el fenotipo CD16 (CD14CD16++++++−) de cM bovino (24).
Varios estudios previos in vitro e in vivo han reportado una reducción de la fagocitosis en neutrófilos bovinos en condiciones de estrés térmico (11, 44, 45). Los resultados del presente estudio confirman el efecto negativo del estrés térmico en la función de fagocitosis de los neutrófilos bovinos y revelan un efecto similar en los neutrófilos búfalos. Esto apunta a un deterioro de la función antimicrobiana de estas células fagocitarias, lo que podría ser responsable de una mayor susceptibilidad de los animales estresados por calor a las infecciones microbianas. Teniendo en cuenta el factor tiempo, el efecto inducido por el estrés sobre los neutrófilos comenzó antes en las células bovinas (después de 1 h) que en las de búfalo (después de 2 h), lo que indica una resistencia relativamente mayor de los neutrófilos de búfalo al estrés térmico in vitro. Por el contrario, la fracción de monocitos positivos para fagocitosis se redujo en ambas especies a mayor tiempo de exposición al estrés térmico (4 h). Sin embargo, esta reducción podría deberse a la disminución observada de la vitalidad celular. De hecho, los monocitos de ambas especies no cambiaron significativamente en su función de fagocitosis en ninguna duración del estrés térmico in vitro. Este resultado puede indicar la existencia de mecanismos de adaptación térmica en monocitos en lugar de neutrófilos, lo que hace que los monocitos sean relativamente más resistentes al estrés térmico corto.
Una de las limitaciones del presente estudio es el bajo número de animales de estudio. Además, los efectos observados del estrés térmico in vitro sobre el sistema inmunitario deben confirmarse mediante el análisis ex vivo de las funciones antimicrobianas de los fagocitos en bovinos y búfalos sometidos a estrés térmico.
Conclusión
El presente estudio representa el primer informe sobre el análisis comparativo del efecto del estrés térmico in vitro en poblaciones de leucocitos bovinos y búfalos. Este estudio ha revelado variaciones notables en la modulación de la viabilidad y las funciones de los leucocitos sanguíneos entre bovinos y búfalos en respuesta a diferentes niveles de hipertermia, destacando que las células de búfalo exhiben una adaptación térmica relativamente mayor en comparación con las células bovinas. Estos hallazgos no solo han profundizado nuestra comprensión de cómo el estrés por calor afecta las respuestas inmunitarias en estas dos especies cruciales, sino que también han identificado el grado y la duración específicos de la exposición a la hipertermia que comprometen las funciones inmunitarias específicas de cada especie. Se requieren más estudios para explorar los mecanismos subyacentes a través de los cuales la hipertermia afecta al sistema inmunológico e identificar los candidatos genéticos asociados con una mayor adaptación térmica del sistema inmunológico del búfalo de agua que podrían ser de utilidad considerable para los estudios de cría.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética Institucional de CREA-ZA. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
MS: Conceptualización, Curación de datos, Investigación, Metodología, Recursos, Visualización, Redacción – borrador original. MA: Análisis formal, Software, Visualización, Escritura – borrador original, Escritura – revisión y edición. FG: Redacción – borrador original, Redacción – revisión y edición. AR: Redacción – revisión y edición. MZ: Escritura – revisión y edición. JH: Escritura – borrador original, Escritura – revisión y edición. GM: Conceptualización, Curación de datos, Investigación, Metodología, Recursos, Supervisión, Visualización, Redacción – borrador original.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Los autores agradecen al Dr. Cesare Petricca de CREA-ZA por el hábil apoyo técnico en materia de datos y manejo de animales.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1327148/full#supplementary-material
Figura complementaria 1 | Superposiciones de histograma de porcentaje de neutrófilos y monocitos pHrodo, representativos de un bovino (arriba) y un búfalo (abajo). Para probar el sistema basado en colorante pHrodo™, se utilizó un control negativo dependiente de la temperatura incubado a 4 °C para inhibir el envolvimiento bacteriano y la fusión de la membrana fagosoma-lisosoma. Se utilizó sangre sin biopartículas de E. coli verde pHrodo™ para establecer un marcador de autofluorescencia de FL1. En cada superposición de histograma se compararon cuatro muestras frescas sin tratamiento térmico: 2 muestras incubadas a 4 °C sin (4 °C neg) y con biopartículas de E. coli verde pHrodo (pHrodo 4 °C), y 2 muestras incubadas a 39 °C sin (39 °C neg) y con biopartículas de E. coli verde pHrodo™ (39 °C pHrodo).™ +®®
Notas
1. ^https://www.meteoproject.it/ftp/stazioni/monterotondo
Referencias
1. Canción, J , Pinza, G , Chao, J , Chung, J , Zhang, M , Lin, W, et al. Análisis de vías basadas en datos y pronóstico del calentamiento global y el aumento del nivel del mar. Sci Rep. (2023) 13:5536. doi: 10.1038/s41598-023-30789-4
2. Lemal, P , Mayo, K , König, S , Schroyen, M y Gengler, N . Revisión invitada: desde el estrés térmico hasta la respuesta inmune a la enfermedad y los genes candidatos implicados en la termotolerancia bovina. J Lácteos Sci. (2023) 106:4471–88. doi: 10.3168/jds.2022-22727
3. Lendez, Pensilvania , Martinez Cuesta, L , Nieto Farías, MV , Vater, AA , Dr. Ghezzi , Mota-Rojas, D, et al. Alteraciones en la expresión de TNF-alfa y sus receptores en vacas sometidas a estrés térmico. Veterinario Inmunol Inmunopatíaco. (2021) 235:110232. doi: 10.1016/j.vetimm.2021.110232
4. Polsky, L y von Keyserlingk, MAG . Revisión invitada: efectos del estrés térmico en el bienestar del ganado lechero. J Lácteos Sci. (2017) 100:8645–57. doi: 10.3168/jds.2017-12651
5. Abdelnour, S.A. , Abd El-Hack, ME , Khafaga, AF , Arif, M , Taha, AE y Noreldin, AE . Biomarcadores de estrés y alteración proteómica del estrés térmico en rumiantes: una revisión. J Therm Biol. (2019) 79:120–34. doi: 10.1016/j.jtherbio.2018.12.013
6. Herbut, P , Angrecka, S y Walczak, J . Parámetros ambientales para la evaluación del estrés térmico en el ganado lechero: una revisión. Int J Biometeorol. (2018) 62:2089–97. doi: 10.1007/s00484-018-1629-9
7. Matera, R , Cotticelli, A , Carpio, MG , Biffani, S , Iannacone, F , Salzano, A, et al. Relación entre los rasgos de producción, la puntuación de células somáticas y el índice de temperatura-humedad en el búfalo mediterráneo italiano. Ital J Anim Sci. (2021) 21:551–61. doi: 10.1080/1828051X.2022.2042407
8. Bagath, M , Krishnan, G , Devaraj, C , Rashamol, Vicepresidente , Pragna, P , Lees, AM, et al. El impacto del estrés por calor en el sistema inmunológico en el ganado lechero: una revisión. Res Vet Sci. (2019) 126:94–102. doi: 10.1016/j.rvsc.2019.08.011
9. Dahl, GE , Tao, S y Laporta, J . El estrés por calor afecta el estado inmunológico de las vacas a lo largo del ciclo de vida. Front Vet Sci. (2020) 7:116. doi: 10.3389/fvets.2020.00116
10. Catozzi, C , Ávila, G , Zamarian, V , Pravettoni, D , Sala, G , Ceciliani, F, et al. Efecto in vitro del estrés térmico sobre la vida útil y la polarización de los monocitos bovinos. Inmunobiología. (2020) 225:151888. doi: 10.1016/j.imbio.2019.11.023
11. Lecchi, C , Rota, N , Vitali, A , Ceciliani, F y Lacetera, N . Evaluación in vitro de los efectos de la temperatura sobre la fagocitosis, la producción de especies reactivas de oxígeno y la apoptosis en células polimorfonucleares bovinas. Veterinario Inmunol Inmunopatíaco. (2016) 182:89–94. doi: 10.1016/j.vetimm.2016.10.007
12. Wohlgemuth, SE , Ramírez-Lee, Y , Tao, S , Monteiro, APA , Ahmed, BM y Dahl, GE . Comunicación corta: efecto del estrés térmico sobre los marcadores de autofagia en la glándula mamaria durante el período seco. J Lácteos Sci. (2016) 99:4875–80. doi: 10.3168/jds.2015-10649
13. Hussen, J . Cambios en la vitalidad celular, el fenotipo y la función de los leucocitos de camello dromedario después de la exposición de sangre total al estrés por calor in vitro. Front Vet Sci. (2021) 8:647609. doi: 10.3389/fvets.2021.647609
14. Minervino, AHH , Zava, M , Vecchio, D y Borghese, A . Bubalus bubalis: un cuento. Front Vet Sci. (2020) 7:570413. doi: 10.3389/fvets.2020.570413
15. Marai, IFM y Haeeb, AAM . Las funciones biológicas de los búfalos afectadas por el estrés por calor: una revisión. Livest Sci. (2010) 127:89–109. doi: 10.1016/j.livsci.2009.08.001
16. Neaga, A , Lefor, J , Lich, KE , Liparoto, SF y Xiao, YQ . Desarrollo y validación de un método de citometría de flujo para evaluar la fagocitosis de biopartículas de pHrodo (R) por granulocitos en múltiples especies. J Métodos Immunol. (2013) 390:9–17. doi: 10.1016/j.jim.2011.06.027
17. Worku, D , Hussen, J , De Matteis, G , Schusser, B y Alhussien, MN . Genes candidatos asociados con el estrés por calor y estrategias de cría para aliviar sus efectos en el ganado lechero: una visión más profunda de la arquitectura genética y la respuesta inmune al estrés por calor. Front Vet Sci. (2023) 10:10. doi: 10.3389/fvets.2023.1151241
18. Canción, Y , Zhao, X , Aihemaiti, A , Haire, A , Gao, Y , Niu, C, et al. El mecanismo de resistencia al estrés térmico durante la espermatogénesis en ovejas negras de Turpan. Front Vet Sci. (2022) 9:846981. doi: 10.3389/fvets.2022.846981
19. Chauhan, SS , Rashamol, Vicepresidente , Bagath, M , Sejian, V y Dunshea, FR . Impactos del estrés por calor en las respuestas inmunitarias y el estrés oxidativo en animales de granja y estrategias nutricionales para su mejora. Int J Biometeorol. (2021) 65:1231–44. doi: 10.1007/s00484-021-02083-3
20. Zmrhal, V , Svoradova, A , Venusova, E y Slama, P . La influencia del estrés térmico en el sistema inmunológico de los pollos y la mitigación de los impactos negativos de la baicalina y la baicaleína. Animales. (2023) 13:2564. doi: 10.3390/ani13162564
21. Guo, H , Liu, R , Él, J , Yao, W y Zheng, W . El estrés térmico modula una respuesta inmune placentaria asociada con alteraciones en el desarrollo del intestino fetal y su sistema inmune innato en ratones preñados tardíamente. Fisiola delantera. (2022) 13:841149. doi: 10.3389/fphys.2022.841149
22. Marrero, MG , Dado-Senn, B , Campo, S.L. , Yang, G , Conductor, JP y Laporta, J . El estrés térmico crónico retrasa el desarrollo del sistema inmunitario y altera la señalización de la serotonina en los terneros lecheros predestetados. PLoS Uno. (2021) 16:e0252474. doi: 10.1371/journal.pone.0252474
23. Davis, WC , Khalid, AM , Hamilton, MJ , Ahn, JS , Parque, YH y Cantor, GH . El uso de anticuerpos monoclonales de reacción cruzada para caracterizar el sistema inmune del búfalo de agua (Bubalus bubalis). J Vet Sci. (2001) 2:103–9. doi: 10.4142/jvs.2001.2.2.103
24. Grandoni, F , Fraboni, D , Canónico, B , Papá, S , Buccisano, F , Schuberth, HJ, et al. Identificación y enumeración por citometría de flujo de subconjuntos de monocitos en sangre periférica bovina y búfalo de agua. Curr Protoc. (2023) 3:E676. DOI: 10.1002/CPZ1.676
25. Grandoni, F , Signorelli, F , Martucciello, A , Napolitano, F , De Donato, I , Donniacuo, A, et al. El inmunofenotipado en profundidad revela una alteración significativa de los linfocitos en búfalos con brucelosis. Citometría A. (2023) 103:528–36. doi: 10.1002/cyto.a.24710
26. Grandoni, F , Elnaggar, MM , Abdellrazeq, GS , Signorelli, F , Alevines, LM , Marchitelli, C, et al. Caracterización de subgrupos leucocitarios en búfalo (Bubalus bubalis) con anticuerpos monoclonales de reacción cruzada específicos para moléculas bovinas MHC clase I y clase II y moléculas de diferenciación leucocitaria. Dev Comp Immunol. (2017) 74:101–9. doi: 10.1016/j.dci.2017.04.013
27. De Matteis, G , Grandoni, F , Scata, MC , Catizone, A , Reale, A , Crisa, A, et al. Evaluación de la expresión del receptor de leptina en leucocitos de búfalo. Veterinario Inmunol Inmunopatíaco. (2016) 177:16–23. doi: 10.1016/j.vetimm.2016.05.009
28. Aggarwal, A y Upadhyay, R . Estrés térmico y productividad animal. Nueva Delhi: Springer. (2013). doi: 10.1007/978-81-322-0879-2
29. Bernabucci, U , Lacetera, N , Baumgard, LH , Rhoads, RP , Ronchi, B y Nardone, A . Aclimatación metabólica y hormonal al estrés térmico en rumiantes domesticados. Animal. (2010) 4:1167–83. doi: 10.1017/S175173111000090X
30. Mota-Rojas, D , Napolitano, F , Braghieri, A , Guerrero-Legarreta, I , Bertoni, A , Martínez-Burnes, J, et al. Biología térmica en búfalos de río en los trópicos húmedos: respuestas neurofisiológicas y conductuales evaluadas por termografía infrarroja. J Anim Behav Biometeorol. (2021) 9:1–12. doi: 10.31893/jabb.21003
31. Li, M , Hassan, FU , Guo, Y , Tang, Z , Liang, X , Xie, F, et al. Dinámica estacional de las respuestas fisiológicas, oxidativas y metabólicas en búfalos Nili-Ravi no lactantes en climas cálidos y húmedos. Front Vet Sci. (2020) 7:622. doi: 10.3389/fvets.2020.00622
32. Sharma, S , Sharma, V , Konwar, D , Khan, A , Kumar, D y Brahma, B . Un estudio comparativo sobre el efecto del estrés térmico en las respuestas fisiológicas y celulares de ganado mestizo y búfalo ribereño en la región subtropical de la India. Int J Biometeorol. (2023) 67:1619–28. doi: 10.1007/s00484-023-02523-2
33. Thompson, SM , Callstrom, MR , Mantequillas, KA , Knudsen, B , Grande, JP , Roberts, LR, et al. Mecanismos de muerte celular inducidos por estrés térmico en hepatocitos y carcinoma hepatocelular: estudio in vitro e in vivo. Láseres Surg Med. (2014) 46:290–301. doi: 10.1002/lsm.22231
34. Li, L , Tan, H , Gu, Z , Liu, Z , Geng, Y , Liu, Y, et al. El estrés por calor induce la apoptosis a través de una vía apoptótica mitocondrial mediada por ca (2)(+) en las células endoteliales de la vena umbilical humana. PLoS Uno. (2014) 9:e111083. doi: 10.1371/journal.pone.0111083
35. Gu, ZetaTalk , Wang, H , Li, L , Liu, YS , Deng, XB , Huo, SF, et al. El estrés por calor induce la apoptosis a través de las vías mitocondriales mediadas por p53 independientes de la transcripción en las células endoteliales de la vena umbilical humana. Sci Rep. (2014) 4:4469. doi: 10.1038/srep04469
36. Gu, ZetaTalk , Li, L , Wu, F , Zhao, P , Yang, H , Liu, YS, et al. La apoptosis inducida por estrés térmico se desencadena por p53 independiente de la transcripción, la dishomeostasis de Ca(2+) y la posterior translocación mitocondrial de Bax. Sci Rep. (2015) 5:11497. doi: 10.1038/srep11497
37. Lekshmi, A , Varadarajan, SN , Lupitha, SS , Indira, D , Mathew, KA , Chandrasekharan Nair, A, et al. Un enfoque cuantitativo en tiempo real para discriminar la apoptosis y la necrosis. Muerte celular Discov. (2017) 3:16101. doi: 10.1038/cddiscovery.2016.101
38. De Matteis, G , Grandoni, F , Zampieri, M , Reale, A y Scata, MC . Nuevos conocimientos sobre la importancia de la activación de PARP-1: detección por citometría de flujo de poli (ADP-ribosa) como marcador de infección intramamaria bovina. Células. (2021) 10:599. doi: 10.3390/cells10030599
39. Cartwright, S.L. , Schmied, J , Livernois, A y Mallard, BA . Efecto de la provocación por calor in vivo sobre los parámetros fisiológicos y la función de las células mononucleares de sangre periférica en bovinos lecheros inmunofenotipados. Veterinario Inmunol Inmunopatíaco. (2022) 246:110405. doi: 10.1016/j.vetimm.2022.110405
40. Collier, RJ , Baumgard, LH , Zimbelman, RB y Xiao, Y . Estrés térmico: fisiología de la aclimatación y adaptación. Frente de animación. (2019) 9:12–9. doi: 10.1093/af/vfy031
41. Freeman, S.A. y Grinstein, S . Fagocitosis: receptores, integración de señales y citoesqueleto. Immunol Rev. (2014) 262:193–215. doi: 10.1111/imr.12212
42. Fu, YL y Harrison, RE . Receptores fagocíticos microbianos y su posible implicación en la inducción de citoquinas en macrófagos. Frente Immunol. (2021) 12:662063. doi: 10.3389/fimmu.2021.662063
43. Uribe-Querol, E y Rosales, C . Fagocitosis: nuestra comprensión actual de un proceso biológico universal. Frente Immunol. (2020) 11:1066. doi: 10.3389/fimmu.2020.01066
44. Alhussien, MN y Dang, AK . Impacto de diferentes estaciones en los recuentos celulares somáticos y diferenciales de la leche, el cortisol de la leche y la funcionalidad de los neutrófilos de tres razas nativas de ganado de la India. J Therm Biol. (2018) 78:27–35. doi: 10.1016/j.jtherbio.2018.08.020
45. do Amaral, a.C. , Connor, EE , Tao, S , Hayen, MJ , Bubolz, JW y Dahl, GE . La reducción del estrés por calor durante el período seco influye en la expresión génica metabólica y mejora el estado inmunológico en el período de transición de las vacas lecheras. J Lácteos Sci. (2011) 94:86–96. doi: 10.3168/jds.2009-3004
Palabras clave: estrés térmico, leucocitos, apoptosis, fagocitosis, bovino, búfalo, citometría de flujo
Cita: Scatà MC, Alhussien MN, Grandoni F, Reale A, Zampieri M, Hussen J y De Matteis G (2024) Cambios inducidos por hipertermia en la supervivencia y fagocitosis leucocitaria: un estudio comparativo en leucocitos bovinos y búfalos. Frente. Vet. Sci. 10:1327148. doi: 10.3389/fvets.2023.1327148
Recibido: 24 de octubre de 2023; Aceptado: 18 de diciembre de 2023;
Publicado: 23 enero 2024.
Editado por:
Daniel Mota-Rojas, Universidad Autónoma Metropolitana, México
Revisado por:
Adriana Domínguez-Oliva, Universidad Autónoma Metropolitana, México
Maria Giovanna Ciliberti, Universidad de Foggia, Italia
Derechos de autor © 2024 Scatà, Alhussien, Grandoni, Reale, Zampieri, Hussen y De Matteis. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Maria Carmela Scatà, de mariacarmela.scata@crea.gov.it; Giovanna De Matteis, giovanna.dematteis@crea.gov.it
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía