Caracterización de la microbiota en todo el tracto digestivo de caballos alimentados con una dieta rica en fibra frente a una dieta alta en almidón
Caracterización de la microbiota en todo el tracto digestivo de caballos alimentados con una dieta rica en fibra frente a una dieta alta en almidón
 Federica Raspa1*
Federica Raspa1*  Stefania Chessa1
Stefania Chessa1  Domenico Bergero1
Domenico Bergero1  Paola Sacchi1
Paola Sacchi1  Ilario Ferrocino2
Ilario Ferrocino2  Luca Cocolin2
Luca Cocolin2  María Rita Corvaglia2
María Rita Corvaglia2  Riccardo Moretti1
Riccardo Moretti1  Damiano Cavallini3
Damiano Cavallini3  Emanuela Valle1
Emanuela Valle1- 1Departamento de Ciencias Veterinarias, Universidad de Turín, Grugliasco, Italia
- 2Departamento de Ciencias Agrícolas, Forestales y de los Alimentos, Universidad de Turín, Grugliasco, Italia
- 3Departamento de Ciencias Veterinarias, Universidad de Bolonia, Bolonia, Italia
Introducción: La dieta es uno de los principales factores que influyen en la microbiota intestinal de los caballos, pero no existe una caracterización sistemática de la microbiota a lo largo del tracto digestivo en caballos clínicamente sanos, homogéneos para la edad y la raza y que reciban una dieta específica.
Métodos: El estudio utilizó la secuenciación del amplicón del ARNr 16S para caracterizar la microbiota del tracto intestinal de 19 caballos Bardigiano sanos de 14,3 ± 0,7 meses de edad alimentados con una de dos dietas. Nueve caballos recibieron una dieta alta en almidón (HS) y diez caballos recibieron una dieta alta en fibra (HF). Después de 129 días, los caballos fueron sacrificados y se recogieron muestras de los diferentes compartimentos del tracto intestinal.
Resultados y discusión: Los índices de diversidad alfa de la microbiota fueron menores en el ciego, la flexión pélvica y el colon dorsal derecho de los caballos alimentados con la dieta HS (False Discovery Rate, FDR < 0,05). Los valores de diversidad beta indicaron diferencias composicionales significativas entre los compartimentos del tracto intestinal estudiados según la dieta recibida (FDR < 0,05). A nivel taxonómico inferior (género o familia), la dieta HS se asoció con una mayor frecuencia relativa de Enterobacteriaceae en el intestino delgado (yeyuno y duodeno) (FDR < 0,05). Dentro del intestino posterior (ciego y flexión esternal), la dieta HS se asoció con frecuencias relativas más bajas (es decir, una comunidad central más pequeña) de bacterias pertenecientes a Fibrobacteraceae y Prevotellaceae (FDR < 0,05). Además, los caballos alimentados con la dieta HS mostraron una mayor abundancia relativa de Streptococcus en el ciego (FDR < 0,05) y Fusobacterium en la flexión esteral (FDR < 0,05), ambas bacterias patógenas responsables de enfermedades inflamatorias. Las muestras recolectadas de la flexión pélvica y el recto de caballos alimentados con la dieta HS mostraron frecuencias relativas significativamente más altas de Succinivibrionaceae (FDR < 0.05), bacterias amilolíticas asociadas con acidosis. Las frecuencias relativas de Lachnospiraceae y Ruminococcaceae fueron menores en las heces recolectadas del recto de los caballos que recibieron la dieta HS frente a la dieta HF, lo que indica comunidades centrales más pequeñas de estas bacterias (FDR < 0.05). Se deben promover dietas fibrosas para prevenir la disbiosis de la microbiota asociada a una dieta rica en almidón.
1 Introducción
Una mejor comprensión de la etiología de los trastornos digestivos es crucial para salvaguardar el bienestar y la salud digestiva de los caballos (1). Varios factores relacionados tanto con las condiciones intrínsecas al individuo como con las de manejo pueden predisponer al caballo a la aparición de trastornos digestivos (2). Uno de los principales factores de riesgo de los trastornos digestivos es alimentarse con una dieta rica en almidón y baja en fibra (3). De hecho, la capacidad del caballo para digerir el almidón es muy limitada debido a su baja producción de α-amilasa pancreática (4, 5). En consecuencia, varios autores están de acuerdo en que el consumo de almidón debe limitarse a no más de 1 gramo de almidón/kg de peso corporal (PC)/comida (6-9). A pesar de esta recomendación, los caballos suelen ser alimentados con dietas caracterizadas por cantidades mucho más altas de almidón (10-12). Esta práctica de alimentación da lugar a un deterioro de la salud intestinal, causando acidosis del intestino posterior, disbiosis y cólicos (13). También son posibles consecuencias sistémicas, como laminitis, pérdida de peso y bajo rendimiento (1, 14, 15). La presencia de almidón no digerido en el intestino posterior puede desencadenar cambios en la población microbiana durante los procesos de fermentación (5, 16), sin embargo, se han realizado pocos esfuerzos de investigación para caracterizar la microbiota equina en los diferentes compartimentos del tracto intestinal según la dieta con respecto a otras especies animales (17-19). De Fombelle et al. (20) aplicaron una metodología basada en cultivo a muestras obtenidas del yeyuno, íleon, ciego, colon ventral derecho y colon dorsal izquierdo; Por lo tanto, este enfoque limitó la producción únicamente a las especies cultivables (21). Dougal et al. (22) investigaron comunidades de poblaciones microbianas utilizando un método basado en PCR en muestras de ciego, colon dorsal derecho y recto de ocho equinos sacrificados por razones no relacionadas con alteraciones metabólicas o intestinales. Sin embargo, ni las metodologías dependientes del cultivo ni las basadas en la PCR permiten caracterizar toda la riqueza y diversidad de las poblaciones bacterianas que residen en el intestino (23). Hasta donde sabemos, Dougal et al. (24) utilizaron un enfoque de secuenciación de amplicones para identificar la comunidad bacteriana central en siete regiones diferentes del intestino grueso de diez equinos. Además, el estudio llevado a cabo por Costa et al. (18) aplicó un enfoque de secuenciación para evaluar la microbiota del caballo en los diferentes compartimentos del tracto intestinal. Sin embargo, en este último estudio solo participaron once caballos pertenecientes a diferentes razas, caracterizados por un amplio rango de edad (2 a 30 años) y que fueron sacrificados por patologías (no relacionadas con enfermedades gastrointestinales). El objetivo del presente estudio fue profundizar nuestra comprensión de las diferencias microbianas en diferentes compartimentos del tracto intestinal en caballos sanos, homogéneos para la raza y la edad, de acuerdo con la dieta que se alimenta, es decir, una dieta alta en fibra (HF) frente a una dieta alta en almidón (HS). Planteamos la hipótesis de que se observarían diferencias en la microbiota intestinal en los distintos compartimentos del tracto intestinal entre los dos grupos dietéticos. Este estudio tiene como objetivo ampliar nuestra comprensión de los cambios microbianos asociados con una dieta HS en el entorno intestinal.
2 Materiales y métodos
El presente estudio forma parte de un proyecto de investigación más amplio que investiga los efectos de una dieta alta en fibra (HF) frente a una dieta alta en almidón (HS). También se investigaron otros parámetros de salud intestinal en los mismos caballos, como la histomorfometría intestinal (25) y los productos finales de la fermentación (16); comportamiento (26) y rendimiento creciente (15).
El estudio siguió las directrices de la actual Directiva Europea (2010/63/UE) sobre el cuidado y la protección de los animales, y fue aprobado por el Comité de Ética del Departamento de Ciencias Veterinarias de la Universidad de Turín (Italia) (Prot. Nº 2.202/2019).
2.1 Manejo de animales y alimentación
El estudio se realizó en Piamonte, noroeste de Italia, entre junio y octubre de 2019. Diecinueve caballos Bardigiano sanos de 14,3 ± 0,7 meses de edad (media ± desviación estándar, DE) se inscribieron en el estudio. A su llegada a la granja, todos los caballos fueron desparasitados con un preparado de gel oral (1,29 g/100 kg de peso corporal, Eqvalan Duo, Merial Animal Health). Los caballos se aclimataron primero al entorno de la granja en un área de potrero al aire libre durante dos semanas antes de ser asignados aleatoriamente a dos corrales grupales interiores durante los siguientes 129 días hasta el sacrificio. Los corrales grupales estaban situados dentro de un establo con dos lados abiertos y sin acceso a ningún área de potrero al aire libre. Los corrales estaban rodeados por barras metálicas horizontales, que también delimitaban los corrales en el comedero. Los caballos alimentados con la dieta HF fueron 7 potrancas y 3 potros con un peso corporal inicial (PC) promedio ± desviación estándar (DE) de 221.10 ± 5.00 kg; los caballos alimentados con la dieta HS fueron 5 potrancas y 4 potros con un peso corporal inicial promedio de ± SD de 217.56 ± 9.28 kg. Los caballos pertenecientes a los grupos HF y HS recibieron el mismo heno de pradera de primer corte, pero diferentes alimentos complementarios. Los caballos fueron alimentados individualmente con los piensos complementarios que se fueron incrementando gradualmente hasta alcanzar la cantidad final durante los últimos 72 días del periodo de engorde (15). Brevemente, para el SA, la cantidad (tal como se alimentó) del alimento peletizado rico en almidón se incrementó gradualmente de la siguiente manera: 3 kg/animal/día durante los primeros 13 días, seguido de 4,5 kg/animal/día durante los 6 días siguientes, 5 kg/animal día durante otros 36 días y 8 kg/animal/día durante los últimos 72 días del período de engorde. Esas cantidades se alimentaron de acuerdo con la práctica habitual de alimentación adoptada por el ganadero. Para el HF, la cantidad (tal como se alimenta) del alimento peletizado rico en fibra se incrementó gradualmente de la siguiente manera: 1 kg/animal/día durante 7 días, 2 kg/animal/día durante 9 días, 2,5 kg/animal/día durante 25 días, 3 kg/animal/día durante 9 días y, finalmente, 3,5 kg/animal/día hasta el final del período de engorde (72 días). La dieta IC fue planificada por un nutricionista veterinario de acuerdo con los requisitos nutricionales del Instituto Nacional de Investigación Agronómica (INRA) (27).
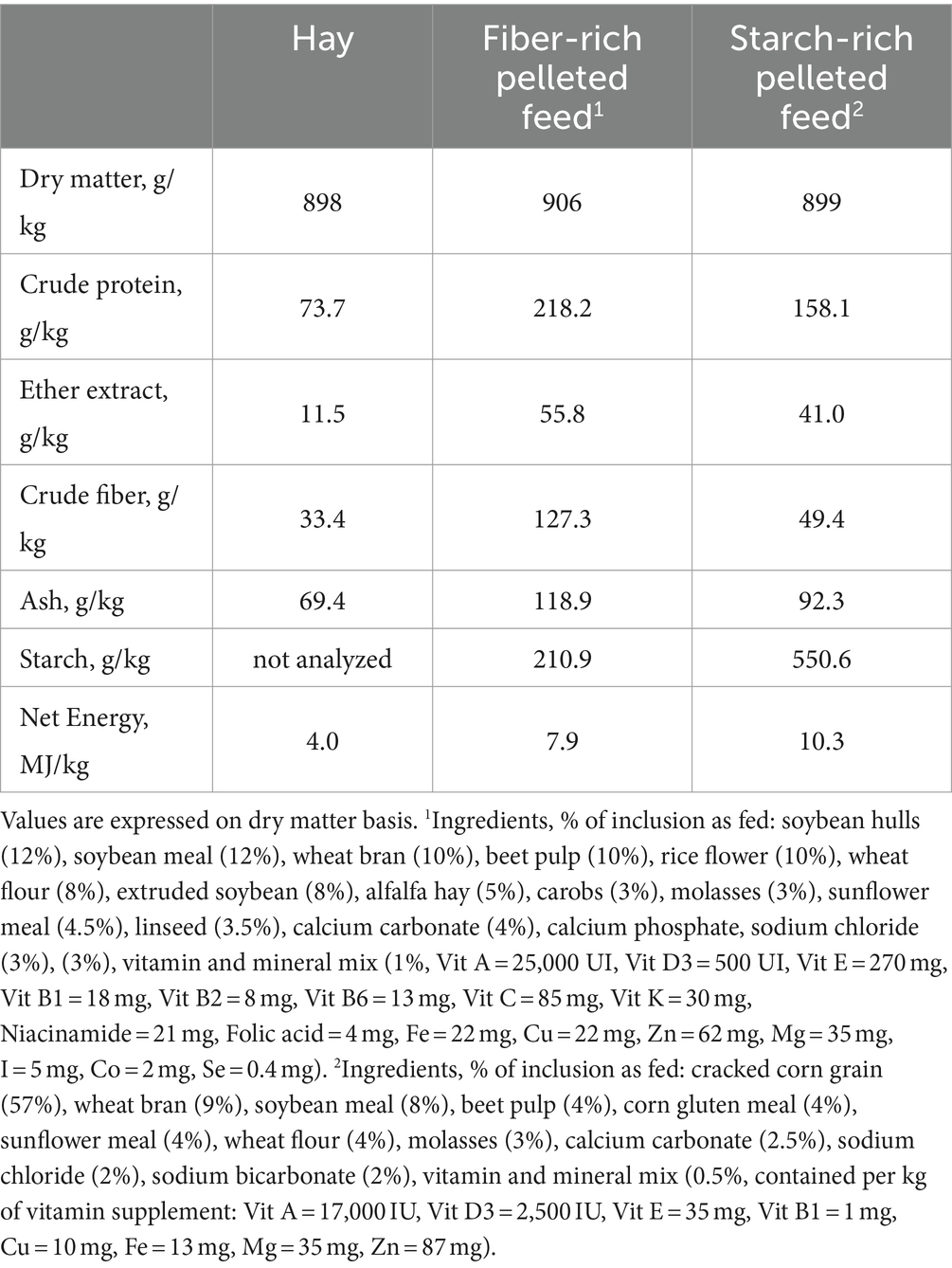
Durante los últimos 72 días del período de engorde, cada caballo perteneciente al SA recibió 8 kg/caballo/día del alimento peletizado rico en almidón que contenía 5,70 g (como alimentado) de almidón por kg de peso corporal/harina, mientras que cada caballo perteneciente al grupo HF recibió 3,5 kg/caballo/día del alimento peletizado rico en fibra que contenía 0,97 g (como alimentado) de almidón por kg de peso corporal/comida. Los piensos complementarios peletizados se suministraron individualmente a los caballos dos veces al día (7 am y 6 pm). Al mismo tiempo, se suministró heno, y el consumo de heno fue de 8 kg/caballo/día para HF y de 6 kg/caballo/día para HS. Los ingredientes y la composición química del heno y de los piensos complementarios se muestran en la Tabla 1. La composición nutricional diaria de las dietas (heno más alimento) se muestra en la Tabla 2.
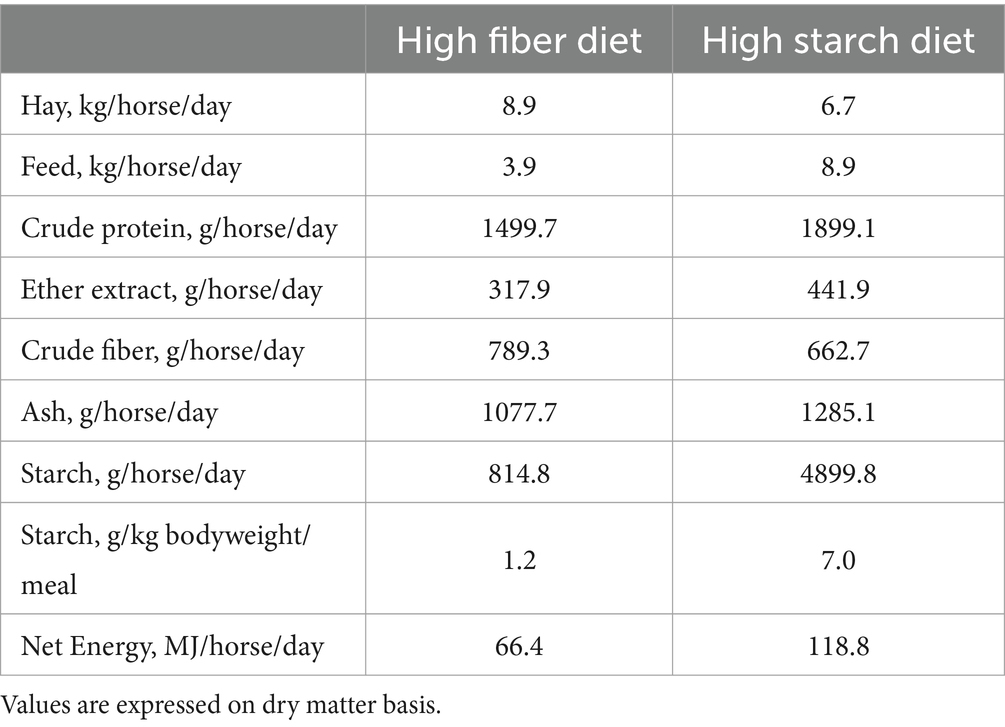 Tabla 2. Composición nutricional del conjunto de las dietas diarias (heno más pienso) durante el periodo de engorde (72 días).
Tabla 2. Composición nutricional del conjunto de las dietas diarias (heno más pienso) durante el periodo de engorde (72 días).
2.2 Recogida de muestras
Los animales fueron sacrificados 129 días después de su llegada a la granja, al final del período de engorde. Los procedimientos de sacrificio se realizaron de acuerdo con la normativa de la Unión Europea (UE 2009/853 y UE 627/2019) bajo la supervisión de veterinarios oficiales.
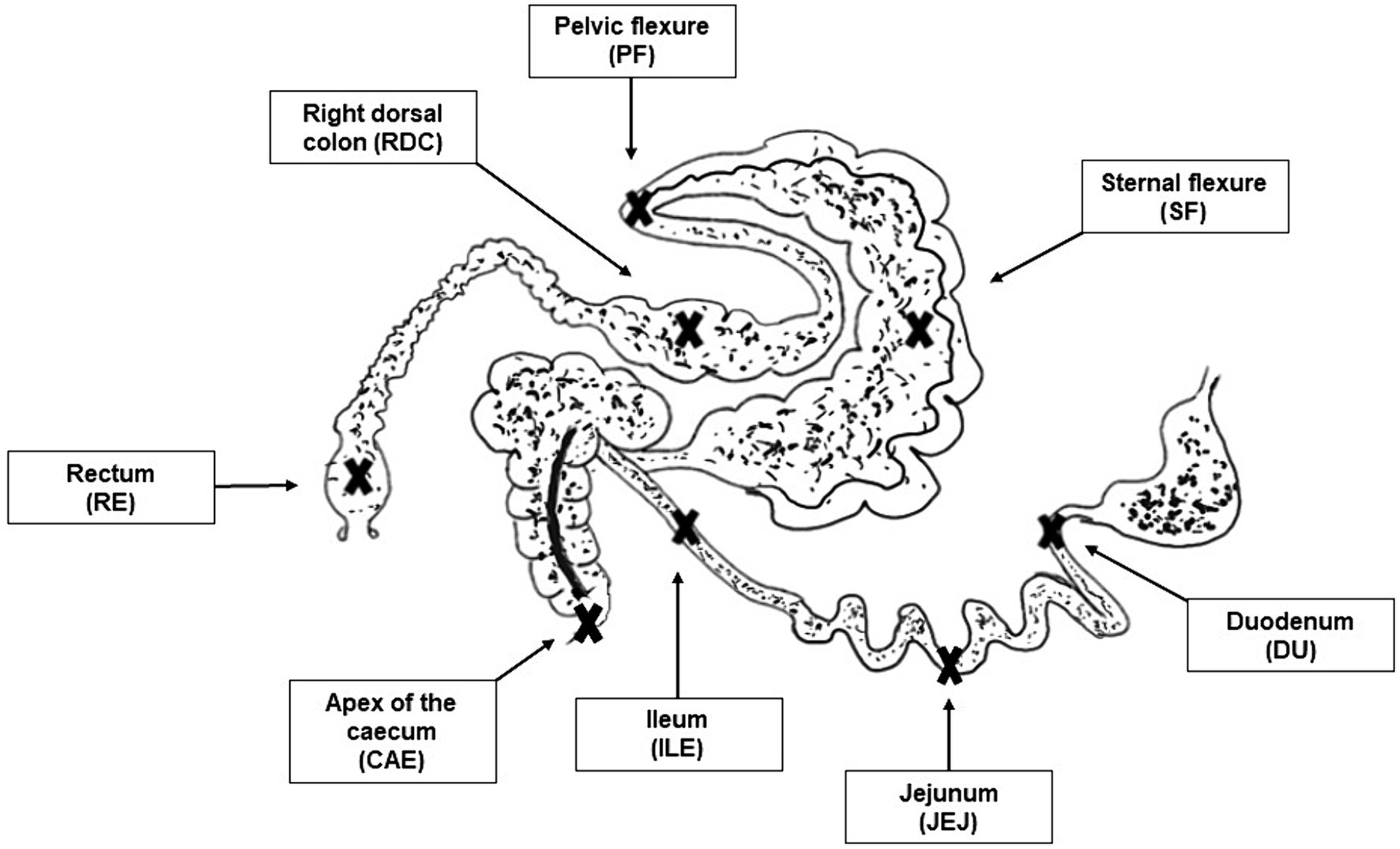
Después del sacrificio, los siguientes compartimentos del tracto intestinal (descritos en la Figura 1) se identificaron inmediatamente y se sujetaron antes de abrirlos para la recolección de muestras:
•duodeno
•yeyuno
•íleon
•intestino ciego
• Flexión esternal
• Flexión pélvica
• colon dorsal derecho
•recto
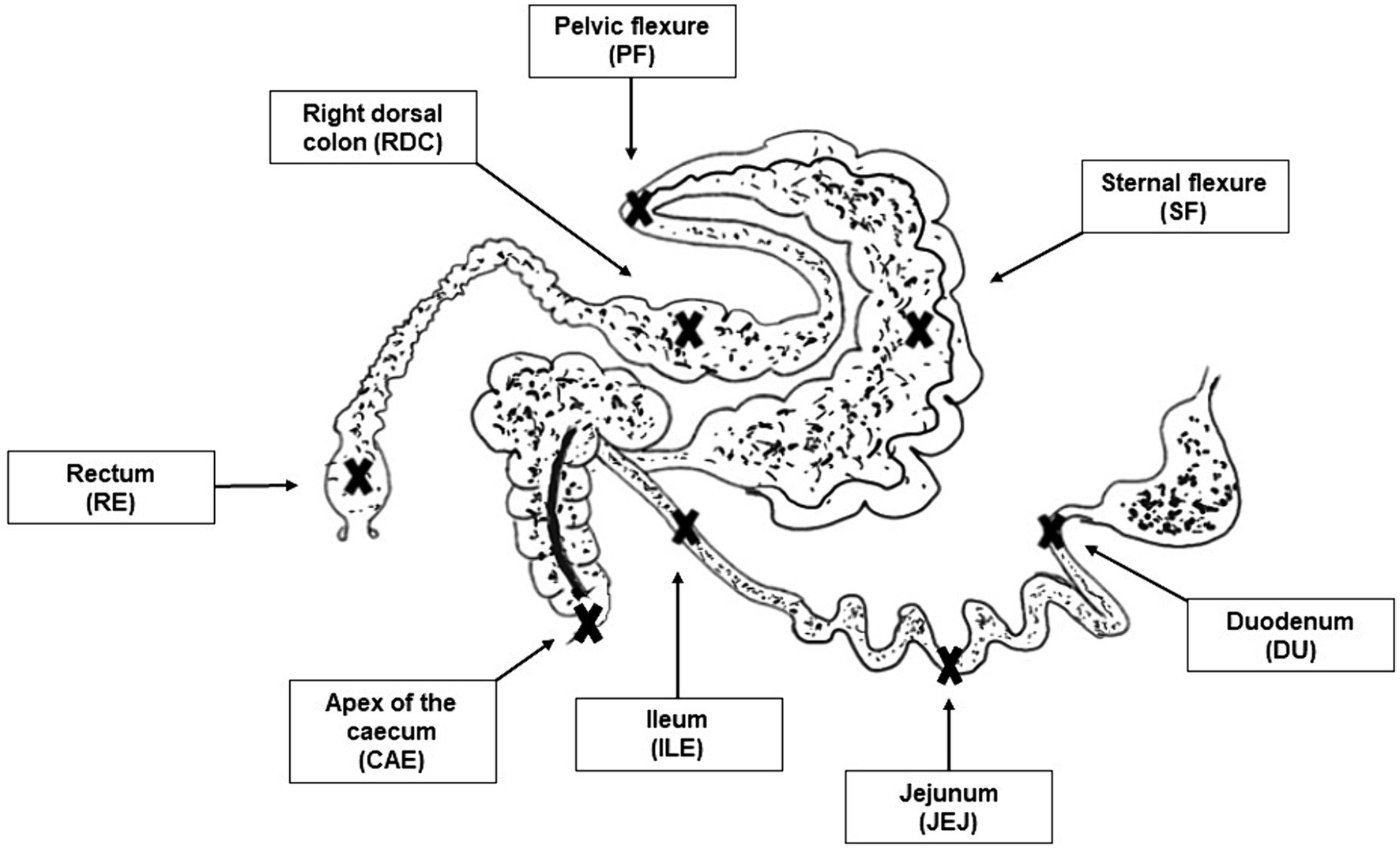 Figura 1. Imagen de los sitios de muestreo. Las cruces indican los sitios de muestreo para los compartimentos del tracto intestinal seleccionados: duodeno (DU), yeyuno (JEJ), íleon (ILE), ciego (CAE), flexión esternal (SF), flexión pélvica (PF), colon dorsal derecho (RDC), recto (RE).
Figura 1. Imagen de los sitios de muestreo. Las cruces indican los sitios de muestreo para los compartimentos del tracto intestinal seleccionados: duodeno (DU), yeyuno (JEJ), íleon (ILE), ciego (CAE), flexión esternal (SF), flexión pélvica (PF), colon dorsal derecho (RDC), recto (RE).
2.3 Extracción de ADN y análisis metataxonómico
Un total de 152 muestras (8 compartimentos del tracto intestinal/caballo para 19 caballos) fueron sometidas a extracción y secuenciación de ADN. El ADN se aisló utilizando el kit de ADN QIAamp Power Fecal Pro (QIAGEN, Milán, Italia) de acuerdo con las instrucciones del fabricante. Añadimos un microlitro de ARNasa (50 mg/mL, Illumina Inc., San Diego, CA) a las muestras de ADN y las incubamos durante 1 h a 37 °C para digerir cualquier ARN presente. El ADN se normalizó a 5 ng/μL y se utilizó como molde para la amplificación de la región V3-V4 del gen 16S rRNA (16S Amplicon PCR Forward Primer = 5’TCGTCGGCAGCGTCAGATGTGTGTATAAGAGACAGCCTACGGGNGGCWGCAG; 16S Amplicon PCR Reverse Primer = 5’GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTAATCC) (28). Los productos de PCR se purificaron y se etiquetaron con el índice Nextera de acuerdo con la preparación de la biblioteca de secuenciación metagenómica 16S de Illumina (Illumina, San Diego, EE. UU.). Secuenciamos las librerías en la plataforma Illumina MiSeq (Illumina Italy s.r.l., Milán, Italia) con química V3 y generamos lecturas de 250 pb de extremo emparejado de acuerdo con las instrucciones del fabricante.
2.4 Bioinformática y análisis estadístico
Cada caballo dentro de cada grupo de dieta fue considerado como unidad experimental. Después de la secuenciación, analizamos las lecturas en bruto utilizando el software Quantitative Insights into Microbial Ecology (QIIME) 2 (29). Después de la desenolización, realizada por DADA2 (30), se utilizaron variantes de secuencia de amplicones (ASV) para la asignación taxonómica utilizando el complemento clasificatorio de características QIIME classify-consensus-vsearch (31) contra la base de datos greengenes (v.13). A continuación, utilizamos el guión de diversidad QIIME (29) para calcular los parámetros de diversidad alfa y beta, que luego se sometieron a comparaciones por pares para evaluar las diferencias en la composición de la microbiota en los diferentes compartimentos del tracto intestinal según la dieta utilizada (IC vs. HS). En particular, se analizaron los índices de diversidad alfa (Chao1, Shannon y la riqueza de especies observada) mediante pruebas de Kruskal-Wallis, y se compararon las diversidades beta mediante el análisis por pares de PERMANOVA basado en la matriz de distancias de Bray-Curtis utilizando el script QIIME2 (29).
Importamos los ASVs (Amplicon sequence variants), en el nivel taxonómico más bajo (familia o género), a R para construir un mapa de calor aplicando la función «made4» (32). Además, se utilizaron pruebas de Kruskal-Wallis por pares para evaluar las diferencias en la abundancia de taxones microbianos según la dieta (HF vs. HS). Los valores p se ajustaron para pruebas múltiples utilizando el método de tasa de falso descubrimiento (FDR) (métodos de ajuste del valor p de Benjamini-Hochberg). Consideramos significativa una < FDR de 0,05. A continuación, se utilizó el paquete informático Picrust2 (Phylogenetic Investigation of Communities by Reconstruction of Unobserved States) (33) para predecir las funciones potenciales de la microbiota. Los ortólogos KEGG se colapsaron en el nivel 3 de la jerarquía y la tabla se importó al paquete GAGE Bioconductor (34) para identificar las vías potenciales subrrepresentadas o sobrerrepresentadas en las muestras de los grupos dietéticos HF vs. HS.
3 Resultados
Al final del período de engorde, no se observaron diferencias significativas en el promedio ± peso corporal de sacrificio de los caballos alimentados con la dieta HF vs. la dieta HS: 344,40 ± 2,91 kg vs. 347,67 ± 6,71 kg, respectivamente (15). No se registraron signos clínicos de cólicos o ulceraciones gástricas durante el período de estudio, pero los caballos pertenecientes al grupo HS produjeron heces no formadas. Además, la evaluación histopatológica de los diferentes compartimentos del tracto intestinal mostró un mayor nivel de inflamación en el yeyuno y la flexión pélvica de los caballos alimentados con la dieta HS en comparación con los alimentados con la dieta HF (25).
3.1 Diversidad alfa y beta
Después de la secuenciación y la desenolación, se utilizaron un total de 565.643 lecturas sin procesar para el análisis posterior, lo que corresponde a una cobertura de muestra superior al 99%. En primer lugar, comparamos las medidas de diversidad alfa y beta para investigar el efecto de la dieta sobre la diversidad de la microbiota. La diversidad alfa se midió mediante los índices de Chao1 y Shannon y la riqueza de especies observada. Como se muestra en la Tabla 3, el índice Chao1 fue mayor en el ciego de los caballos alimentados con HF en comparación con HS (p = 0,01). El índice de Shannon fue menor en el íleon de los caballos alimentados con IC en comparación con HS (p = 0,04), y fue mayor en el ciego (p = 0,04), la flexión pélvica (p = 0,01) y el colon dorsal derecho (p = 0,01) de los caballos alimentados con la dieta HF en comparación con la dieta HS. Además, la riqueza de especies observada fue significativamente mayor en el colon dorsal derecho de los caballos pertenecientes al grupo HF en comparación con los pertenecientes al grupo HS (p < 0.01).
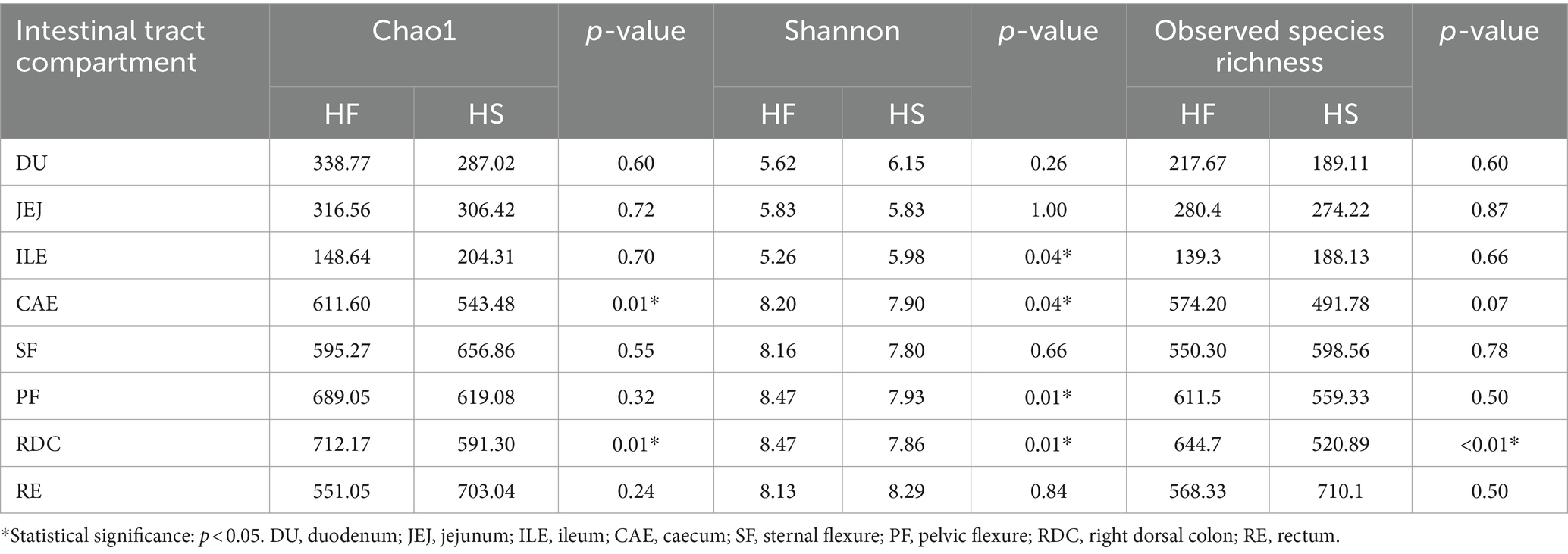 Tabla 3. Medidas de la diversidad alfa de la composición de la microbiota en los compartimentos del tracto intestinal seleccionados entre los caballos alimentados con la dieta alta en almidón (HS) y la dieta alta en fibra (HF).
Tabla 3. Medidas de la diversidad alfa de la composición de la microbiota en los compartimentos del tracto intestinal seleccionados entre los caballos alimentados con la dieta alta en almidón (HS) y la dieta alta en fibra (HF).
Para evaluar el efecto de las dos dietas HF y HS sobre la composición de la microbiota en los diferentes lugares de muestreo, teniendo en cuenta todos los ASV detectados, realizamos un análisis PERMANOVA por pares, basado en la matriz de distancias de Bray Curtis, para generar una medida de la diversidad beta. Con la excepción del duodeno, la microbiota de cada tracto muestreado difirió significativamente según la práctica de alimentación adoptada (IC vs. HS, p < 0,05, Figura 2). Estas diferencias fueron demostradas por el análisis de Coordenadas Principales basado en la matriz de distancias de Bray Curtis (PCoA, Figura 2). Además, las muestras formaron dos grupos distintos, diferenciando entre el tracto digestivo superior (DU, JEJ, ILE) e inferior (CAE, SF, PF, RDC, RE) del caballo.
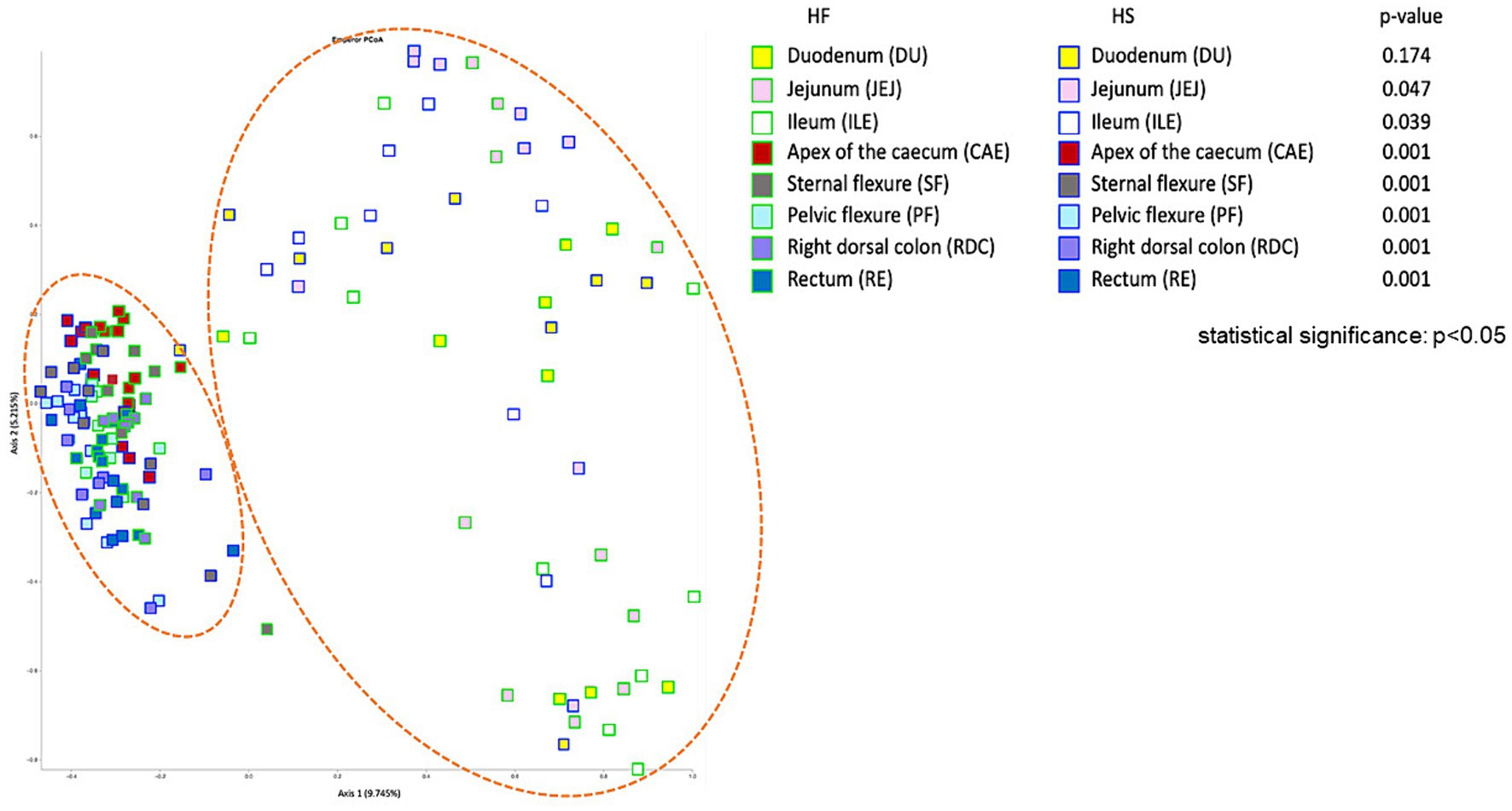 Figura 2. Análisis de coordenadas principales (PCoA), basado en la distancia de Bray Curtis, para estudiar el efecto de la dieta (alta en fibra, HF vs. alta en almidón, HS) sobre la microbiota bacteriana en diferentes compartimentos del tracto intestinal del caballo.
Figura 2. Análisis de coordenadas principales (PCoA), basado en la distancia de Bray Curtis, para estudiar el efecto de la dieta (alta en fibra, HF vs. alta en almidón, HS) sobre la microbiota bacteriana en diferentes compartimentos del tracto intestinal del caballo.
3.2 Caracterización de la microbiota bacteriana a nivel de filo
La distribución y las frecuencias relativas (%) de los filos obtenidos por secuenciación del gen 16S rRNA se resumen en la Figura 3. Los firmicutes representaron el filo dominante tanto en HF como en HS, superando en número a los filos Bacteroidetes, Proteobacteria y Verrucomicrobia.
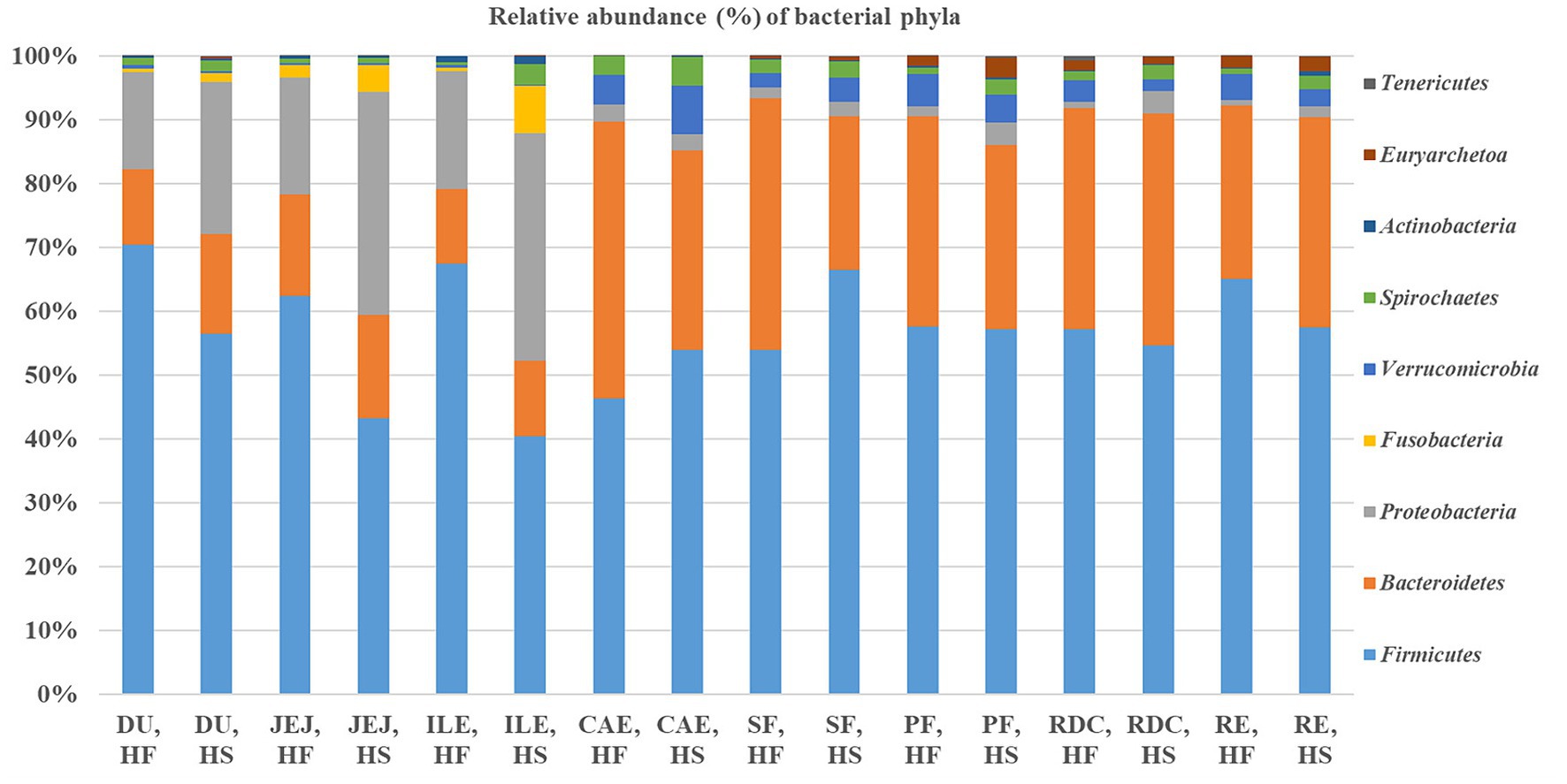 Figura 3. Frecuencia relativa (%) de los filos bacterianos en los compartimentos del tracto intestinal seleccionados (uranio empobrecido, duodeno; JEJ, yeyuno; ILE: íleon; CAE, ciego; SF: flexión esternal; PF: flexión pélvica; RDC: colon dorsal derecho; RE, recto) de los caballos alimentados con la dieta alta en fibra (HF) y de los caballos alimentados con la dieta alta en almidón (HS).
Figura 3. Frecuencia relativa (%) de los filos bacterianos en los compartimentos del tracto intestinal seleccionados (uranio empobrecido, duodeno; JEJ, yeyuno; ILE: íleon; CAE, ciego; SF: flexión esternal; PF: flexión pélvica; RDC: colon dorsal derecho; RE, recto) de los caballos alimentados con la dieta alta en fibra (HF) y de los caballos alimentados con la dieta alta en almidón (HS).
Teniendo en cuenta la microbiota según el sitio intestinal, encontramos diferencias en las frecuencias de abundancia relativa de los diferentes filos. En particular, dentro del intestino delgado, la abundancia de Firmicutes fue mayor en el íleon de la IC en comparación con la HS (67,4% de IC vs. 40,4% de HS; FDR < 0,05), mientras que las Proteobacteria fueron más prolíficas en el yeyuno (18,3% HF vs. 35% HS) e íleon (18,4% HF vs. 35,6% HS) de HS en comparación con IC (FDR < 0,05). En el intestino posterior, la frecuencia de Firmicutes en la flexión esteral de HS fue mayor en comparación con la IC (53,9% HF vs. 66,5% HS; FDR < 0,05); mientras que la frecuencia del filo Bacteroidetes fue mayor en los caballos que recibieron la dieta HF tanto en el ciego (43,4% HF vs. 31,2% HS, FDR < 0,05) como en la flexión esteral (39,4% HF vs. 24,1% HS, FDR < 0,05). Además, la frecuencia relativa de Spirochaetes fue mayor en el recto de los caballos alimentados con la dieta HS en comparación con los caballos alimentados con la dieta HF (0,9% HF vs. 2,2% HS; FDR < 0,05).
3.3 Caracterización de la microbiota bacteriana a nivel de género
En el nivel taxonómico más bajo, el análisis de conglomerados de los ASV más frecuentes confirmó la presencia de conglomerados distintos (Figura 4). Un conglomerado (A) comprendió la mayoría de las muestras recogidas del intestino posterior (ciego, flexión esternal, flexión pélvica, colon dorsal derecho y recto). Además, dentro del grupo A, se evidenció una clara distinción entre el ciego y la flexión esternal, y entre la flexión pélvica, el colon dorsal derecho y el recto. El segundo conglomerado (B) comprendió la mayoría de las muestras recogidas en duodeno, yeyuno e íleon.
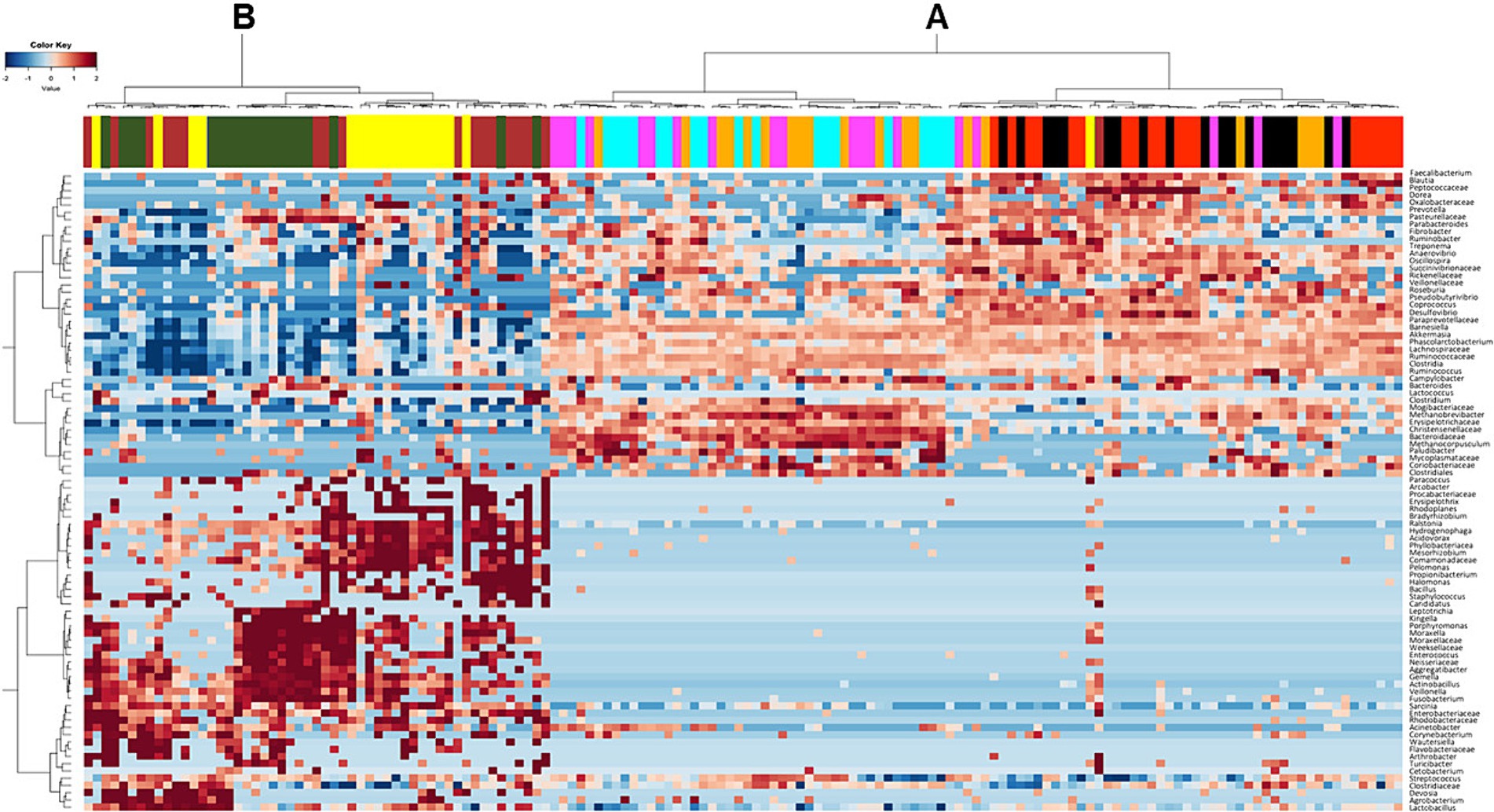 Figura 4. Mapa de calor que muestra la distribución de las variantes de secuencia de amplicones (ASVs) detectadas en caballos alimentados con la dieta alta en fibra (HF) y la dieta alta en almidón (HS) en los diferentes compartimentos del tracto intestinal (duodeno = amarillo, yeyuno = verde oscuro, íleon = marrón, ápice del ciego = rojo, flexión esternal = negro, flexión pélvica = rosa, colon dorsal derecho = cian, recto = naranja). La frecuencia de los ASV está representada por la intensidad del color, desde el azul oscuro (frecuencia más baja) hasta el rojo oscuro (frecuencia más alta).
Figura 4. Mapa de calor que muestra la distribución de las variantes de secuencia de amplicones (ASVs) detectadas en caballos alimentados con la dieta alta en fibra (HF) y la dieta alta en almidón (HS) en los diferentes compartimentos del tracto intestinal (duodeno = amarillo, yeyuno = verde oscuro, íleon = marrón, ápice del ciego = rojo, flexión esternal = negro, flexión pélvica = rosa, colon dorsal derecho = cian, recto = naranja). La frecuencia de los ASV está representada por la intensidad del color, desde el azul oscuro (frecuencia más baja) hasta el rojo oscuro (frecuencia más alta).
En la Figura 5 se muestra la distribución de los principales géneros que se encuentran a lo largo de los diferentes compartimentos del tracto intestinal según la dieta recibida. La comparación de la frecuencia relativa de ASVs en el duodeno entre los dos grupos (IC vs. HS) mostró mayores niveles de Clostridium (0,1% IC vs. 2,9% HS; FDR < 0,05) y Moraxella (0,2% HF vs. 1,2% HS; FDR < 0,05) en caballos alimentados con HS.
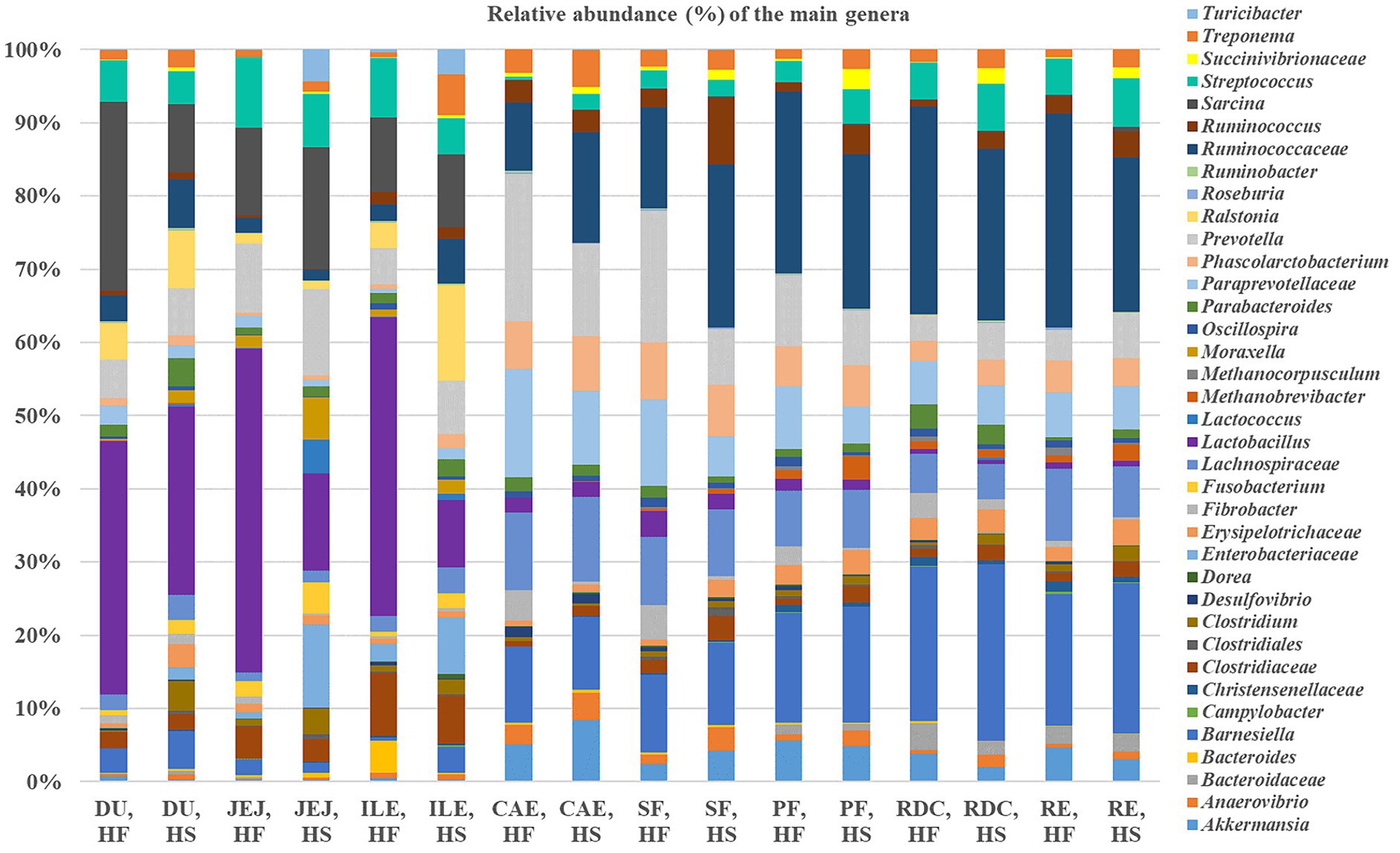 Figura 5. Frecuencias relativas (%) de los géneros principales a través de los diferentes compartimentos del tracto intestinal (DU, duodeno; JEJ, yeyuno; ILE: íleon; CAE, ciego; SF: flexión esternal; PF: flexión pélvica; RDC: colon dorsal derecho; RE, recto) según grupo dietético (alto contenido de fibra, HF y alto contenido de almidón, HS).
Figura 5. Frecuencias relativas (%) de los géneros principales a través de los diferentes compartimentos del tracto intestinal (DU, duodeno; JEJ, yeyuno; ILE: íleon; CAE, ciego; SF: flexión esternal; PF: flexión pélvica; RDC: colon dorsal derecho; RE, recto) según grupo dietético (alto contenido de fibra, HF y alto contenido de almidón, HS).
En el yeyuno, Anaevibrio (0,1% HF vs. 0,3% HS), Lactococcus (0% HF vs. 3% HS) y Turicibacter (2,9% HS vs. 0% HF) fueron todos más altos en los caballos alimentados con la dieta HS en comparación con los caballos alimentados con la dieta HF (FDR < 0,05); mientras que Fibrobacter (0,7% HF vs. 0,1% HS) y Lactobacillus (33,2% HF vs. 8,7% HS) fueron mayores en los caballos alimentados con la dieta HF en comparación con la dieta HS (FDR < 0,05). Se encontró una diferencia significativa para las enterobacterias que fueron más abundantes en HS que en IC (0,7% HF vs. 7,5% HS; FDR < 0,05).
Al comparar las frecuencias relativas de los ASV en el íleon, encontramos que Phascolarctobacterium fue más abundante en caballos alimentados con HS que con HF (0,5% HF vs. 1,1% HS; FDR < 0,05). Lo mismo ocurrió con Barnesiella (0,4% IC vs. 2,1% HS; FDR < 0,05). Además, Enterobacteriaceae (0,7% en IC vs. 1,1% HS) y Ralstonia (2,6% HF vs. 7,8% HS) fueron mayores en el íleon de los caballos alimentados con la dieta HS en comparación con los caballos alimentados con la dieta HF (FDR < 0,05).
El ciego se caracterizó por niveles más altos de Fibrobacter en IC en comparación con HS (3,8% HF vs. 0,3% HS; FDR < 0,05); mientras que se encontraron mayores niveles de Streptococcus en caballos alimentados con la dieta HS (0,4% HF vs. 1,9% HS; FDR < 0,05).
En cuanto a la flexión esternal, los Fibrobacter fueron mayores en IC en comparación con HS (4,3% IC vs. 0,5% HS; FDR < 0,05), mientras que Anaevibrio (1,2% IC vs. 2,9% HS) y Erysipelotrichaceae (0,8% IC vs. 2,1% HS) fueron significativamente mayores en HS (FDR < 0,05). Paraprevotellaceae (10,8% IC vs. 4,9% HS) y Prevotella (16,5% IC vs. 6,9% HS) fueron mayores en IC en comparación con HS (FDR < 0,05). Además, los Methanobrevibacter fueron más abundantes en HS en comparación con HF (0,3% HF vs. 0,6% HS; FDR < 0,05) y Fusobacterium solo se detectó en caballos alimentados con HS (0% HF vs. 0,04% HS; FDR < 0,05).
La comparación de los ASV en la flexión pélvica mostró que Ruminococcus (1,2% IC vs. 3,6% HS), Anaevibrio (0,7% IC vs. 2% HS), Sarcinia (0% IC vs. 0,2% HS) y Roseburia (0,1% IC vs. 0,2% HS) fueron mayores en HS en comparación con IC (FDR < 0,05); mientras que Dorea (0,2% HF vs. 0,1% HS) y Oscillospira (1,1% HF vs. 0,4% HS) fueron mayores en los caballos alimentados con la dieta HF en comparación con HS (FDR < 0,05). Las succinivibrionaceae fueron más abundantes en HS en comparación con HF (0,3% HF vs. 2,5% HS; FDR < 0,05).
El colon dorsal derecho se caracterizó por mayores niveles de Clostridium (0,4% HF vs. 1,2% HS) y Ruminococcus (0,7% HF vs. 2% HS) en caballos alimentados con la dieta HS en comparación con los caballos alimentados con la dieta HF (FDR < 0,05). Los clostridiales fueron más abundantes en la IC en comparación con la HS (0,4% de IC vs. 0,1% de HS; FDR < 0,05). La prevotella fue más abundante en HS (3% IC vs. 4,5% HS; FDR < 0,05), mientras que los Bacteroides solo se detectaron en IC (0,3% HF vs. 0% HS; FDR < 0,05). Además, Akkermansia (3,3% IC vs. 1,8% HS) y Methanocorpusculum (0,1% HS vs. 0,6% HF) estuvieron presentes en mayores niveles en IC en comparación con HS (FDR < 0,05).
Finalmente, las muestras colectadas del recto de los caballos alimentados con la dieta HF revelaron mayores abundancias relativas de bacterias pertenecientes a Lachnospiraceae (8,7% HF vs. 6,3% HS; FDR < 0,05) y Ruminococcaceae (25,5% HF vs. 18,8% HS; FDR < 0,05). Los resultados también revelaron mayores niveles de Treponema (0,9% HF vs. 2,2% HS; FDR < 0,05) y Succinivibrionaceae en caballos alimentados con la dieta HS en comparación con los alimentados con HF (0,9% HF vs. 2,2% HS; FDR < 0,05).
En cuanto a las diferencias funcionales en la microbiota de los dos grupos dietéticos, el análisis reveló que la dieta HS produce un enriquecimiento en los géneros implicados en las vías fermentativas, como la glucólisis/gluconeogénesis (ko00010), el metabolismo del piruvato (ko00620), el metabolismo del metano (ko00680) y el metabolismo del propanoato (ko00640). Por el contrario, la dieta HF provocó una reducción de las funciones potenciales de la microbiota relacionadas con la degradación de ácidos grasos (ko00071), el metabolismo del nitrógeno (ko00910) y el metabolismo del azufre (ko00920).
4 Discusión
El presente estudio buscó variaciones en la microbiota intestinal a lo largo del tracto digestivo de caballos sanos de acuerdo con dos dietas. Comparamos los efectos de una dieta alta en almidón (HS), que excede el nivel seguro recomendado de 1 gramo de almidón/kg de peso corporal/comida (8), y una dieta alta en fibra (HF), que satisface los requisitos nutricionales del caballo.
La literatura científica disponible confirma los efectos negativos de las dietas HS en la salud intestinal y el bienestar de los caballos (35), pero falta una evaluación sistemática de la microbiota en los diferentes compartimentos del tracto digestivo (19). La composición de la microbiota está influenciada por la edad, la raza y el sistema de gestión de la alimentación aplicado (23, 36). Para evitar efectos asociados a la raza o la edad en el presente estudio, se utilizaron caballos de la misma edad (14,3 ± 0,7 meses) y raza (raza Bardigiano). No eran homogéneos para el sexo; sin embargo, es poco probable que esto haya influido en los resultados, ya que no se encontraron diferencias dependientes del sexo en la microbiota intestinal en los diferentes compartimentos del tracto gastrointestinal del caballo analizado mediante el enfoque NGS (18, 37). Además, todos los caballos del presente estudio fueron alojados en las mismas condiciones ambientales, y la única diferencia fue la dieta.
Se analizaron las poblaciones microbianas a partir de la diversidad alfa y beta, las poblaciones bacterianas presentes y su función potencial dentro del tracto digestivo de los caballos.
Un primer hallazgo importante fue que los caballos alimentados con la dieta HF mostraron mayores índices de diversidad alfa en el ciego, la flexión pélvica y el colon dorsal derecho en comparación con los alimentados con la dieta HS. Esto es relevante porque los altos niveles de diversidad bacteriana se han asociado con una mayor estabilidad de la microbiota intestinal y una mayor resistencia a la colonización frente a bacterias potencialmente patógenas (38, 39). Sin embargo, el índice de Shannon se incrementó en el íleon de los caballos alimentados con la dieta HS, mientras que los índices de diversidad alfa de los otros compartimentos del tracto intestinal no fueron diferentes entre las dos dietas. Esto podría explicarse por la variabilidad individual o por el hecho de que la duración del ensayo de alimentación (72 días) fue demasiado corta para inducir cambios significativos en los otros compartimentos del tracto intestinal. Además, las medidas de diversidad beta revelaron diferencias composicionales significativas entre los diferentes compartimentos del tracto intestinal estudiados según la dieta (IC vs. HS). Esto no es sorprendente, ya que se sabe que la dieta es el principal factor que afecta a la composición de la microbiota en el caballo (1).
Como ya se ha informado en la literatura científica, nuestros hallazgos apoyan la división del tracto digestivo equino en dos regiones distintas según la composición de la microbiota: el tracto digestivo superior (duodeno, yeyuno e íleon) y el tracto digestivo inferior (ciego, flexión esternal, flexión pélvica, colon dorsal derecho y recto) (ver Figura 1) (18, 37). Curiosamente, el análisis de conglomerados (Figura 4) reveló una mayor diferenciación dentro del intestino posterior: un conglomerado comprendía el ciego y la flexión esternal, y otro estaba formado por la flexión pélvica, el colon dorsal derecho y el recto; una vez más, confirmando los hallazgos de Costa y colaboradores (18) quienes demostraron que los compartimentos del tracto intestinal vecinos son más similares entre sí.
Mostramos que Firmicutes es el filo bacteriano primario en todos los compartimentos del tracto intestinal, de acuerdo con los hallazgos de otros autores (18, 24, 40). Bacteroidetes fue el segundo filo más abundante (41, 42), y el tercero fue Proteobacteria en el intestino delgado y Verrucomicrobia en el intestino posterior (19).
Al observar la composición de la microbiota a nivel de género/familia, encontramos diferencias interesantes según la dieta adoptada (IC vs. HS). El intestino delgado (yeyuno e íleon) de los caballos alimentados con la dieta HS mostró una mayor abundancia relativa de Proteobacteria en comparación con los caballos alimentados con la dieta HF como resultado de una mayor abundancia relativa de Ralstonia y Enterobacteriaceae. Se ha reportado que el aumento de la presencia de bacterias pertenecientes a Proteobacteria está asociado con enfermedades inflamatorias intestinales en el caballo (41). En particular, las enterobacterias comprenden algunas bacterias patógenas, como Escherichia Coli y Salmonella spp., que pueden provocar disfunciones de la barrera intestinal, generando una condición de intestino permeable y enteritis (1). Investigaciones previas publicadas por nuestro equipo de investigación en los mismos caballos alimentados con la dieta HS mostraron que se caracterizaban por mayores niveles de inflamación de la pared intestinal en el yeyuno (25) y por mayores niveles de permeabilidad intestinal (15). Por lo tanto, podemos especular que estas condiciones fueron desencadenadas por cambios en la composición de la microbiota asociados con el consumo de una dieta HS caracterizada por una sobreabundancia de bacterias pertenecientes a las Proteobacterias.
Progresando hacia los compartimentos más distales del tracto digestivo, el ciego y la flexión esteral parecían similares en cuanto a la composición de su microbiota, como se muestra en el mapa de calor (Figura 4). Sin embargo, las diferencias significativas a nivel de género revelaron algunos efectos positivos de la dieta HF relacionados con una mejora en las vías metabólicas involucradas en los procesos de fermentación con la producción de ácidos grasos de cadena corta (AGCC). En concreto, los caballos alimentados con la dieta HF mostraron mayores frecuencias de Fibrobacter en sus comunidades de microbiota cecal con respecto a los alimentados con la dieta HS. Además, las abundancias de Fibrobacter, Prevotella y Paraprevotellaceae dentro de la flexión esteral también fueron mayores. Dougal et al. (39) identificaron a Fibrobacteraceae y Prevotellaceae como dos de los miembros más abundantes de las comunidades bacterianas centrales en el tracto intestinal equino. Por lo tanto, en nuestro estudio, la dieta HS parece estar asociada con una reducción del tamaño total de la microbiota central dentro del ciego y la flexión esternal. Se ha informado que tal reducción aumenta el riesgo de enfermedades digestivas y disfunciones metabólicas en el caballo (43). Además, se encontró una mayor abundancia de Streptococcus en el ciego y Fusobacterium en la flexión esteral de los caballos alimentados con la dieta HS, ambas bacterias patógenas potenciales asociadas a la presencia de colitis o diarrea (44). De hecho, las heces de los caballos alimentados con la dieta HS estaban menos formadas en comparación con las alimentadas con la dieta HF (16).
Considerando los compartimentos distales del tracto intestinal (flexión pélvica, colon dorsal derecho y recto), las Succinivibrionaceae fueron más abundantes en la flexión pélvica y el recto de los caballos alimentados con la dieta HS. Esto no es sorprendente ya que estas bacterias son amilolíticas, y es probable que su mayor prevalencia esté asociada con la presencia de almidón no digerido en el intestino posterior (26, 45). Las muestras colectadas de la flexión pélvica y del colon dorsal derecho de ambos grupos de caballos mostraron diferencias composicionales relacionadas con los géneros pertenecientes a Firmicutes y Bacteroidetes. La mayoría de estos taxones (Clostridium, Clostridiales, Ruminococcus, Prevotella y Bacteroides) son miembros típicos de la microbiota fisiológica del caballo. Sin embargo, es interesante notar el efecto positivo que la dieta HF tuvo en el colon dorsal derecho. Las muestras recogidas del colon dorsal derecho de los caballos alimentados con la dieta HF mostraron una mayor abundancia relativa de Akkermansia, un género que degrada la mucina y que ayuda a mantener la integridad de la capa de mucina de la barrera intestinal (19, 46). Por último, las muestras fecales recogidas del recto de los caballos alimentados con dieta IC mostraron un aumento en la frecuencia relativa de bacterias pertenecientes a las familias Lachnospiraceae y Ruminococcaceae, que forman parte de la microbiota del núcleo intestinal del caballo (39). Además, Spirochaetes (en particular Treponema), aunque con menor frecuencia de abundancia que Lachnospiraceae y Ruminococcacea, fueron mayores en las muestras fecales de los caballos alimentados con la dieta HS. Este fue un hallazgo inesperado ya que estas bacterias están involucradas en la degradación de la fibra.
Hasta donde sabemos, el presente estudio es el primero en evaluar la composición de la microbiota de todos los compartimentos del tracto digestivo de los caballos homogéneos para la raza, la edad y las prácticas de manejo previas. Una limitación del presente estudio fue el pequeño tamaño de la muestra. El segundo fue el hecho de que los animales no se utilizaron como sus propios controles mediante la comparación de su microbiota fecal. El estudio de la microbiota fecal antes y después del ensayo de alimentación nos habría permitido discernir si los cambios limitados de las diferencias de la microbiota en determinadas zonas del tracto digestivo entre los grupos HF y HS eran realmente atribuibles a la composición microbiana de los nichos ecológicos o a un reflejo de la variabilidad entre caballos. No obstante, el estudio proporciona evidencia que apoya la opinión de que cada compartimento del tracto intestinal se comporta como un nicho ecológico, como lo sugirieron por primera vez Costa y sus colegas (18). Además, demostramos que no se puede obtener información sobre los cambios que ocurren en el nivel taxonómico inferior a lo largo del tracto digestivo (como los causados por la dieta) mediante el análisis de muestras fecales recogidas del recto (que revelaron una reducción del tamaño total de la comunidad bacteriana central y un aumento de las bacterias amilolíticas en los caballos del grupo HS). Este hallazgo tiene importantes implicaciones prácticas para el diseño de estudios dirigidos a investigar los cambios en la microbiota del caballo asociados a determinadas variables, como la dieta.
5 Conclusión
Este es el primer estudio que evalúa los efectos de una dieta alta en fibra (HF) frente a una dieta alta en almidón (HS) sobre la microbiota dentro de los diferentes compartimentos del tracto intestinal de caballos sanos, homogéneos para la edad y la raza. Los resultados confirman que cada compartimento del tracto intestinal del sistema digestivo del caballo representa un nicho ecológico distinto, y que la dieta influye significativamente en la composición de la microbiota. En particular, el tamaño total de la comunidad central y los índices de diversidad alfa fueron más bajos en los caballos alimentados con la dieta HS, que también mostraron niveles más altos de bacterias amilolíticas. Desde el punto de vista clínico, nuestros hallazgos subrayan la necesidad de ser cautelosos a la hora de sacar conclusiones sobre la salud intestinal de los caballos a partir del análisis de la microbiota fecal. Se deben promover dietas fibrosas para prevenir la disbiosis de la microbiota asociada a las dietas ricas en almidón.
Declaración de disponibilidad de datos
Los datos presentados en el estudio están depositados en el repositorio del NCBI, número de acceso PRJNA1105226.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Ética del Departamento de Ciencias Veterinarias de la Universidad de Turín (Italia) (Prot. N. 2202/2019). Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
FR: Conceptualización, Curación de datos, Investigación, Metodología, Redacción – borrador original. SC: Curación de datos, Metodología, Recursos, Redacción, revisión y edición. DB: Administración de proyectos, Recursos, Supervisión, Redacción, revisión y edición. PD: Metodología, Recursos, Supervisión, Redacción, Revisión y Edición. IF: Análisis formal, Metodología, Software, Redacción – revisión y edición. LC: Curación de datos, Análisis formal, Metodología, Software, Redacción – revisión y edición. MC: Curación de datos, Análisis formal, Metodología, Software, Redacción, revisión y edición. RM: Metodología, Redacción – revisión y edición. DC: Curación de datos, análisis formal, redacción, revisión y edición. EV: Conceptualización, Administración de Proyectos, Recursos, Supervisión, Redacción, Revisión y Edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Stewart, AS, Pratt-Phillips, S, y González, LM. Alteraciones en la permeabilidad intestinal: el papel del «intestino permeable» en la salud y la enfermedad. J Veterinario Equino. (2017) 52:10–22. doi: 10.1016/j.jevs.2017.02.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Valle, E, Giusto, G, Penazzi, L, Giribaldi, M, Bergero, D, Fradinho, MJ, et al. Resultados preliminares sobre la asociación con la alimentación y la duración de la recuperación en pacientes con cólicos equinos después de laparotomía. J Anim Physiol Anim Nutr. (2019) 103:1233–41. doi: 10.1111/jpn.13102
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Daly, K, Proudman, CJ, Duncan, SH, Flint, HJ, Dyer, J y Shirazi-Beechey, SP. Alteraciones en la microbiota y los productos de fermentación en el intestino grueso equino en respuesta a la variación de la dieta y la enfermedad intestinal. Hno. J Nutr. (2012) 107:989–95. doi: 10.1017/S0007114511003825
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Lorenzo-Figueras, M, Morisset, SM, Morisset, J, Lainé, J, y Merrit, AM. Concentraciones y actividades de enzimas digestivas en tejido pancreático sano de caballos. Am J Vet Res. (2007) 68:1070–2. doi: 10.2460/ajvr.68.10.1070
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Merritt, AM, y Julliand, V. Fisiología gastrointestinal En: WB Saunders editor. Nutrición equina aplicada y clínica. Ámsterdam: Elsevier Ltd (2013). 3–32.
6. Bulmer, LS, Murray, JA, Burns, NM, Garber, A, Wemelsfelder, F, McEwan, NR, et al. Las dietas ricas en almidón alteran la microbiota fecal equina y aumentan la reactividad conductual. Sci Rep. (2019) 9:1–11. doi: 10.1038/s41598-019-54039-8
7. Coenen, M, Kienzle, E, Vervuert, I, y Zeyner, A. Desarrollos alemanes recientes en la formulación de las necesidades de energía y nutrientes en caballos y las recomendaciones de alimentación resultantes. J Veterinario Equino. (2011) 31:219–29. doi: 10.1016/j.jevs.2011.03.204
8. Harris, P, y Shepherd, M. Lo que sería bueno que todos los veterinarios supieran sobre nutrición equina. Veterinario Clin North Am. (2021) 37:1–20. doi: 10.1016/j.cveq.2020.11.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Vervuert, I, Voigt, K, Hollands, T, Cuddeford, D, y Coenen, M. Efecto de la alimentación con cantidades crecientes de almidón sobre las respuestas glucémicas e insulinémicas en caballos sanos. Veterinario J. (2009) 182:67–72. doi: 10.1016/j.tvjl.2008.04.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Hoffman, CJ, Costa, LR, y Freeman, LM. Encuesta sobre las prácticas de alimentación, el uso de suplementos y el conocimiento de la nutrición equina entre una subpoblación de propietarios de caballos en Nueva Inglaterra. J Veterinario Equino. (2009) 29:719–26. doi: 10.1016/j.jevs.2009.08.005
11. Murray, J-AMD, Bloxham, C, Kulifay, J, Stevenson, A, y Roberts, J. Nutrición equina: una encuesta de percepciones y prácticas de los propietarios de caballos que realizan un curso masivo abierto en línea sobre nutrición equina. J Veterinario Equino. (2015) 35:510–7. doi: 10.1016/j.jevs.2015.02.005
12. Raspa, F, Tarantola, M, Bergero, D, Bellino, C, Mastrazzo, CM, Visconti, A, et al. La densidad de población afecta los indicadores de bienestar en caballos criados para la producción de carne. Animales. (2020) 10:1103. doi: 10.3390/ani10061103
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Julliand, V, de Fombelle, A, Drogoul, C, y Jacoto, E. Alimentación y trastornos microbianos en caballos: parte 3- efectos de tres heno: proporciones de grano en el perfil y las actividades microbianas. J Veterinario Equino. (2001) 21:543–6. doi: 10.1016/S0737-0806(01)70159-1
14. Davis, JL, Blikslager, AT, Catto, K y Jones, SL. Análisis retrospectivo de la lesión hepática en caballos con enteritis proximal (1984-2002). J Veterinario Pasante Med. (2003) 17:896–901. doi: 10.1111/j.1939-1676.2003.tb02530.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Raspa, F, Dinardo, FR, Vervuert, I, Bergero, D, Bottero, MT, Pattono, D, et al. Dieta a base de cereales: ¿cuál es mejor para el bienestar de los caballos? Efectos sobre la permeabilidad intestinal, las características musculares y el estado oxidativo en caballos criados para la producción de carne. J Anim Physiol Anim Nutr. (2021) 106:313–26. doi: 10.1111/jpn.13643
16. Raspa, F, Vervuert, I, Capucchio, MT, Colombino, E, Bergero, D, Forte, C, et al. Una dieta alta en almidón vs. alta en fibra: efectos en el entorno intestinal de los diferentes compartimentos intestinales del tracto digestivo del caballo. BMC Vet Res. (2022) 18:1–11. doi: 10.1186/s12917-022-03289-2
17. Ang, L, Vinderola, G, Endo, A, Kantanen, J, Jingfeng, C, Binetti, A, et al. Características del microbioma intestinal en caballos salvajes y domesticados de diferentes ubicaciones geográficas. Commun Biol. (2022) 5:1–10. doi: 10.1038/s42003-022-03116-2
18. Costa, MC, Silva, G, Ramos, RV, Staempfli, HR, Arroyo, LG, Kim, P, et al. Caracterización y comparación de la microbiota bacteriana en diferentes compartimentos del tracto gastrointestinal en caballos. Veterinario J. (2015) 205:74–80. doi: 10.1016/j.tvjl.2015.03.018
19. Kauter, A, Epping, L, Semmler, T, Antao, E-M, Kannapin, D, Stoeckle, SD, et al. El microbioma intestinal de los caballos: investigación actual sobre la microbiota enteral equina y perspectivas de futuro. Anim Microbioma. (2019) 1:1–14. doi: 10.1186/s42523-019-0013-3
20. De Fombelle, A, Varloud, M, Goachet, AG, Jacotot, E, Philippeau, C, Drogoul, C, et al. Caracterización del perfil microbiano y bioquímico de los diferentes segmentos del tracto digestivo en caballos a los que se les administran dos dietas distintas. Anim Sci. (2003) 77:293–304. doi: 10.1017/S1357729800059038
21. Panek, M, Paljetak, HČ, Barešić, A, Perić, M, Matijašić, M, Lojkić, I, et al. Desafíos metodológicos en el estudio de la microbiota intestinal humana: efectos de la recolección, el almacenamiento, la extracción de ADN y las tecnologías de secuenciación de próxima generación OPEN. Sci Rep. (2018) 8:5143. doi: 10.1038/s41598-018-23296-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Dougal, K, Harris, PA, Edwards, A, Pachebat, JA, Blackmore, TM, Worgan, HJ, et al. Una comparación del microbioma y el metaboloma de diferentes regiones del intestino posterior equino. FEMS Microbiol Ecol. (2012) 82:642–52. doi: 10.1111/j.1574-6941.2012.01441.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Costa, MC, y Weese, JS. El microbioma intestinal equino. Anim Health Res Rev. (2012) 13:121–8. doi: 10.1017/S1466252312000035
24. Dougal, K, De la Fuente, G, Harris, PA, Girdwood, SE, Pinloche, E, y Newbold, CJ. Identificación de una comunidad bacteriana central dentro del intestino grueso del caballo. PLoS Uno. (2013) 8:e77660. doi: 10.1371/journal.pone.0077660
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Colombino, E, Raspa, F, Perotti, M, Bergero, D, Vervuert, I, Valle, E, et al. Salud intestinal de los caballos: efectos de una dieta alta en fibra frente a una dieta alta en almidón sobre los parámetros histológicos y morfométricos. BMC Vet Res. (2022) 18:1–9. doi: 10.1186/s12917-022-03433-y
26. Raspa, F, Tarantola, M, Muca, E, Bergero, D, Soglia, D, Cavallini, D, et al. ¿El manejo de la alimentación hace una diferencia en las actividades conductuales y el bienestar de los caballos criados para la producción de carne? Animales. (2022) 12:1740. doi: 10.3390/ani12141740
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Martin-rosset, W . Nutrición equina: requerimientos de nutrientes del INRA, cantidades recomendadas y tablas de alimentación. Acad Publ. (2015). doi: 10.3920/978-90-8686-855-1
28. Klindworth, A, Pruesse, E, Schweer, T, Rg Peplies, J, Quast, C, Horn, M, et al. Evaluación de cebadores generales de PCR del gen del ARN ribosómico 16S para estudios de diversidad basados en secuenciación clásica y de próxima generación. Ácidos nucleicos Res. (2013) 41:e1. doi: 10.1093/nar/gks808
29. Bolyen, E, Ram Rideout, J, Dillon, MR, Bokulich, NA, Abnet, CC, Al-Ghalith, GA, et al. Ciencia de datos del microbioma reproducible, interactiva, escalable y extensible utilizando QIIME 2. Nat Biotechnol. (2019) 37:852–7. doi: 10.1038/s41587-019-0209-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Callahan, BJ, Mcmurdie, PJ, Rosen, MJ, Han, AW, Johnson, AJA y Holmes, SP. DADA2: inferencia de muestra de alta resolución a partir de datos de amplicones de illumina. Métodos Nat. (2016) 13:581–3. doi: 10.1038/nmeth.3869
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Bokulich, NA, Kaehler, BD, Rideout, JR, Dillon, M, Bolyen, E, Knight, R, et al. Optimización de la clasificación taxonómica de secuencias de amplicones de genes marcadores con el complemento q2-feature-classifier de QIIME 2. Microbioma. (2018) 6:1–17. doi: 10.1186/s40168-018-0470-z
32. Culhane, AC, Thioulouse, J, Perrière, G, y Higgins, DG. MADE4: un paquete R para el análisis multivariante de datos de expresión génica. Bioinformática. (2005) 21:2789–90. doi: 10.1093/bioinformatics/bti394
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Douglas, GM, Maffei, VJ, Zaneveld, JR, Yurgel, SN, Brown, JR, Taylor, CM, et al. PICRUSt2 para la predicción de las funciones del metagenoma. Nat Biotechnol. (2020) 386:685–8. doi: 10.1038/s41587-020-0548-6
34. Luo, W, Friedman, MS, Shedden, K, Hankenson, KD, y Woolf, PJ. GAGE: enriquecimiento de conjuntos de genes de aplicación general para el análisis de vías. BMC Bioinformática. (2009) 10:1–17. doi: 10.1186/1471-2105-10-161
35. Al Jassim, RAM, y Andrews, FM. La comunidad bacteriana del tracto gastrointestinal equino y su relación con la acidosis fermentativa, la laminitis, los cólicos y las úlceras estomacales. Veterinario Clin North Am. (2009) 25:199–215. doi: 10.1016/j.cveq.2009.04.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Carrillo Heredero, AM, Sabbioni, A, Asti, V, Ablondi, M, Summer, A, y Bertini, S. Caracterización de la microbiota fecal de una raza de caballos local italiana. Front Vet Sci. (2024) 11:1236476. doi: 10.3389/fvets.2024.1236476
37. Ericsson, A.C., Johnson, PJ, Lopes, MA, Perry, SC, y Lanter, HR. Un mapa microbiológico del tracto gastrointestinal equino sano. PLoS Uno. (2016) 11:1–17. doi: 10.1371/journal.pone.0166523
38. Biasato, I, Ferrocino, I, Biasibetti, E, Grego, E, Dabbou, S, Sereno, A, et al. Modulación de la microbiota intestinal, morfología y composición de mucinas mediante la inclusión de harina de insectos en la dieta en pollos criados en libertad. BMC Vet Res. (2018) 14:1–15. doi: 10.1186/s12917-018-1690-y
39. Dougal, K, de la Fuente, G, Harris, PA, Girdwood, SE, Pinloche, E, Geor, RJ, et al. Caracterización de la comunidad bacteriana fecal en caballos adultos y ancianos alimentados con una dieta alta en fibra, alta en aceite o alta en almidón utilizando pirosecuenciación 454. PLoS Uno. (2014) 9:e87424. doi: 10.1371/journal.pone.0087424
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Steelman, SM, Chowdhary, BP, Dowd, S, Suchodolski, J, y Janečka, JE. La pirosecuenciación de los genes 16S rRNA en muestras fecales revela una alta diversidad de microflora del intestino posterior en caballos y posibles vínculos con la laminitis crónica. BMC Vet Res. (2012) 8:1–11. doi: 10.1186/1746-6148-8-231
41. Costa, MC, Arroyo, LG, Allen-Vercoe, E, Stämpfli, HR, Kim, PT, Sturgeon, A, et al. Comparación de la microbiota fecal de caballos sanos y caballos con colitis mediante secuenciación de alto rendimiento de la región V3-V5 del gen 16s rRNA. PLoS Uno. (2012) 7:E41484. doi: 10.1371/journal.pone.0041484
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Daly, K, Stewart, CS, Flint, HJ y Shirazi-Beechey, SP. Diversidad bacteriana dentro del intestino grueso equino revelada por el análisis molecular de genes clonados de ARNr 16S. FEMS Microbiol Ecol. (2001) 38:141–51. doi: 10.1111/j.1574-6941.2001.tb00892.x
43. Julliand, V, y Grimm, P. Simposio sobre especies de caballos: el microbioma del intestino posterior del caballo: historia y conocimiento actual. J Anim Sci. (2016) 94:2262–74. doi: 10.2527/jas.2015-0198
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Rodríguez, C, Taminiau, B, Brévers, B, Avesani, V, Van Broeck, J, Leroux, A, et al. Caracterización de la microbiota fecal de caballos mediante pirosecuenciación con código de barras de ADNr 16 y tasa de portación de Clostridium difficile al ingreso hospitalario. BMC Microbiol. (2015) 15:181. doi: 10.1186/s12866-015-0514-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Harlow, BE, Lawrence, LM, Hayes, SH, Crum, A, y Flythe, MD. Efecto de la fuente y concentración de almidón en la dieta sobre la microbiota fecal equina. PLoS Uno. (2016) 11:e0154037. doi: 10.1371/journal.pone.0154037
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Everard, A, Belzer, C, Geurts, L, Ouwerkerk, JP, Druart, C, Bindels, LB, et al. La comunicación cruzada entre Akkermansia muciniphila y el epitelio intestinal controla la obesidad inducida por la dieta. Proc Natl Acad Sci USA. (2013) 110:9066–71. doi: 10.1073/pnas.1219451110
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: caballo, ARNr 16S, microbiota, nutrición, bienestar
Cita: Raspa F, Chessa S, Bergero D, Sacchi P, Ferrocino I, Cocolin L, Corvaglia MR, Moretti R, Cavallini D y Valle E (2024) Caracterización de la microbiota en todo el tracto digestivo de caballos alimentados con una dieta alta en fibra frente a una dieta alta en almidón. Frente. Vet. Sci. 11:1386135. doi: 10.3389/fvets.2024.1386135
Recibido: 14 de febrero de 2024; Aceptado: 29 de abril de 2024;
Publicado: 14 de mayo de 2024.
Editado por:
Massimo Trabalza-Marinucci, Universidad de Perugia, Italia
Revisado por:
Simon Daniels, Real Universidad de Agricultura, Reino Unido
Alicia Maria Carrillo Heredero, Universidad de Parma, Italia
Iolanda Altomonte, Universidad de Pisa, Italia
Derechos de autor © 2024 Raspa, Chessa, Bergero, Sacchi, Ferrocino, Cocolin, Corvaglia, Moretti, Cavallini y Valle. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Federica Raspa, federica.raspa@unito.it
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía