Carbonato cálcico amorfo como nuevo tratamiento potencial para la osteoartritis en perros
 Hadas Sarig-Rapaport1*
Hadas Sarig-Rapaport1* Sigal Krupnik2
Sigal Krupnik2 Tim G. Rowan3
Tim G. Rowan3- 1Amorphical Ltd., Departamento de Sanidad Animal, Nes Ziona, Israel
- número arábigoHospital de Animales Regev, Ramat Gan, Israel
- 3Rowdix Ltd., York, Reino Unido
Fondo: El carbonato cálcico amorfo (ACC) es un nuevo tratamiento potencial para la osteoartritis canina (OA) con mecanismos novedosos basados en la modulación local del pH y dirigidos a la remodelación ósea, la inflamación y el dolor. El objetivo de este estudio clínico exploratorio piloto era obtener datos iniciales sobre la eficacia y seguridad potenciales de la ACC en perros con artrosis y determinar si era apropiado realizar más investigaciones utilizando métodos de evaluación similares.
Materiales y métodos: En este estudio piloto prospectivo, aleatorizado, doble ciego y controlado, se asignaron 41 perros propiedad de clientes en una proporción de 2:1 a ACC: placebo administrado por vía oral durante 56 días. Las evaluaciones de eficacia incluyeron mejoras en el dolor y la movilidad mediante cuestionarios para propietarios [Inventario Breve de Dolor Canino (CBPI), Medida de Resultado Específica del Cliente (CSOM) y Puntuaciones Ortopédicas Veterinarias (VOS)]. La seguridad en la población estudiada se controló mediante exámenes veterinarios, patología clínica y eventos adversos.
Resultados: Cincuenta y tres perros fueron examinados, de los cuales 41 se inscribieron y sirvieron para la evaluación de seguridad. Se encontró que treinta y seis perros eran evaluables para la evaluación inicial de la eficacia. Tres perros que recibieron placebo (21,4%) y uno que recibió ACC (4,5%) fueron retirados antes del día 56 debido al dolor percibido por el propietario y se consideraron fracasos del tratamiento. No hubo eventos adversos graves ni efectos clínicamente significativos relacionados con el tratamiento en el estudio. En general, se encontró que el ACC era seguro en la pequeña población de estudio. En el día 56, proporcionalmente más ACC que los perros placebo fueron éxitos de tratamiento basados en CBPI (45,5% vs. 21,4%) y CSOM (63,6% vs. 30,8%, respectivamente); sin embargo, estas diferencias no fueron estadísticamente significativas (p = 0,15 y 0,06, respectivamente). En el día 56, dentro del grupo ACC pero no en el grupo placebo, las evaluaciones CBPI, CSOM y VOS fueron menores en comparación con el día 0 y el día 14 (p < 0,05).
Limitaciones: El número relativamente pequeño de perros limitó el poder estadístico del estudio piloto para evaluar la eficacia y la seguridad del ACC.
Conclusión: Los resultados de los estudios respaldan la realización de estudios más grandes y con el poder estadístico adecuado que utilizan evaluaciones similares para confirmar si el ACC puede ser un tratamiento seguro y eficaz para la artrosis en perros.
1 Introducción
La osteoartritis (OA) es una enfermedad común de las articulaciones degenerativa, crónica y dolorosa en los perros, caracterizada por acidez articular, pérdida progresiva de cartílago y remodelación ósea anormal (1-4).
Aunque la pérdida de cartílago articular se ha considerado la principal causa de la artrosis, cada vez hay más pruebas que sugieren que la integridad y el proceso de remodelación del hueso subcondral desempeñan un papel importante en la fisiopatología de la artrosis y en los resultados clínicos (5-8). Los principales medicamentos en la artrosis incluyen los AINE, que se asocian con reacciones adversas (4, 9), no proporcionan un alivio adecuado del dolor en muchos perros y es posible que no retrasen la progresión de la enfermedad (10, 11). Más recientemente, se han aprobado los factores de crecimiento antinerviosos (NGF) para aliviar el dolor asociado con la osteoartritis sin un efecto modificador de la enfermedad (12). Se necesitan medicamentos novedosos, eficaces y seguros dirigidos a la remodelación y mineralización ósea para preservar la estructura articular y aliviar el dolor.
El carbonato de calcio amorfo (ACC) es una forma natural, no cristalina y metaestable de carbonato de calcio. Es utilizado por los cangrejos de río para almacenar grandes cantidades de calcio en sitios de almacenamiento transitorio y para reabsorber rápidamente el calcio a través del epitelio intestinal, lo que permite una remineralización notablemente rápida del exoesqueleto remodelado (13-16). Las dispersiones sólidas amorfas, especialmente las basadas en partículas de tamaño nanométrico, son un método establecido para aumentar la permeabilidad, la biodisponibilidad y la actividad biológica, particularmente de compuestos poco solubles (17, 18). Un ACC comercial, producido sintéticamente, estabilizado, amorfo y de tamaño nanométrico se utiliza actualmente como suplemento dietético en humanos y perros. 1 Debido a su estructura molecular amorfa y a sus dimensiones nanométricas (partículas primarias con un tamaño medio de 40-60 nm), el ACC ha aumentado la solubilidad y la biodisponibilidad. Es ~120 veces más soluble y tiene el doble de biodisponibilidad oral en humanos que los carbonatos de calcio convencionales (cristalinos) (13, 14, 16). La disolución de ACC depende del pH. Se vuelve soluble a pH inferior a 7,35, y a pH ≥ 7,4, la solubilidad de ACC se vuelve insignificante. En condiciones fisiológicas, el pH del cartílago es débilmente ácido (pH 6,9-7,2), pero en los pacientes con artrosis, el medio ambiente puede acidificarse masivamente por la producción de factores proinflamatorios y el aumento de la glucólisis anaeróbica (el pH puede caer hasta 5,5), lo que afecta significativamente el metabolismo del cartílago e inhibe la síntesis de la matriz (19). Tras su absorción sistémica, se postula, pero aún no se ha establecido, que el ACC ejerza su efecto sobre la artrosis contrarrestando la acidez local en la articulación artrosis para atenuar la consiguiente destrucción inflamatoria de la articulación y el deterioro de la remodelación ósea. A pesar de los estrictos mecanismos de control del pH extracelular e intracelular, esenciales para mantener las reacciones bioquímicas celulares y la homeostasis tisular, las fluctuaciones locales del pH ocurren con frecuencia en condiciones patológicas, y se sabe que los microambientes extracelulares ácidos caracterizan muchas enfermedades neoplásicas, isquémicas e inflamatorias, incluida la osteoartritis (8, 20-22). Tras su disolución en calcio y carbonato, los aniones de carbonato básicos de ACC pueden convertirse espontáneamente en iones de bicarbonato (el principal regulador del pH del cuerpo) uniéndose a protones para normalizar el pH localmente y modular los procesos inflamatorios desencadenados por la acidez local (22, 23). En un modelo de artritis reumatoide en ratas, por ejemplo, los niveles de catepsina K, una proteasa clave activada por la acidez de la cisteína involucrada en la patogénesis de la artrosis, la sensación de dolor y la degradación ósea y cartilaginosa se redujeron con la ACC.2 En modelos animales de osteoporosis, la resorción ósea se reduce notablemente, mientras que la tasa de formación ósea y la resistencia ósea mecánica aumentan con la ACC oral (15, 16). El efecto de ACC sobre los procesos de remodelación ósea en los trastornos óseos inflamatorios aboga por su investigación en artrosis.
Existen déficits en el conocimiento actual de la efectividad de la ACC, la velocidad de aparición y la seguridad en el tratamiento de la artrosis en perros. Sin embargo, se ha establecido la seguridad para uso humano como suplemento nutricional. En este estudio, se utilizaron dos cuestionarios para propietarios previamente descritos, el Inventario de Dolor Breve Canino (CBPI) y la Medida de Resultado Específica del Cliente (CSOM), como medidas de resultado de eficacia, además de las evaluaciones veterinarias (24-29). La utilidad de CBPI y CSOM en perros con artrosis a los que se les administra ACC no se ha estudiado previamente, y la evidencia de la eficacia de ACC en perros con artrosis es necesaria para avanzar en el desarrollo de ACC como un nuevo fármaco animal.
La hipótesis principal de este estudio fue que el ACC administrado durante 8 semanas es eficaz para reducir el dolor y mejorar la movilidad en perros con artrosis natural. Los objetivos de este estudio exploratorio piloto fueron evaluar la eficacia potencial de la ACC para controlar el dolor y mejorar la movilidad en perros con artrosis, basándose principalmente en las evaluaciones de los propietarios, determinar la seguridad en la población de estudio y estimar la variabilidad de los datos para su uso en el diseño de futuros estudios definitivos o confirmatorios.
2 Materiales y métodos
2.1 Diseño del estudio
Este estudio piloto fue diseñado como un estudio clínico prospectivo, aleatorizado, doble ciego y controlado con placebo. Dado que este fue el primer estudio clínico en el que se utilizó ACC, se utilizó un tamaño de muestra más grande para el ACC con el fin de aumentar la potencia para detectar efectos adversos. Los perros inscritos fueron asignados aleatoriamente a tratamientos con ACC o placebo en una proporción de 2:1 por orden de entrada en el estudio en las clínicas participantes. Los perros fueron tratados durante 56 días desde el día 0. Las visitas del estudio se realizaron al inicio del estudio (día 0) y los días 14, 28 y 56. La aleatorización utilizó una tabla de aleatorización computarizada única en bloques de tres.
Los objetivos del estudio fueron evaluar el éxito del tratamiento después de 56 días de tratamiento con ACC en comparación con placebo para los criterios estándar utilizados en CBPI [disminuciones tanto en la puntuación de gravedad del dolor (PSS) como en la puntuación de interferencia del dolor (PIS)] y estimar los tamaños del efecto del tratamiento. Los objetivos adicionales fueron: (i) evaluar las tasas de éxito del tratamiento mediante CSOM, (ii) observar los cambios en las puntuaciones de PSS, PIS y CSOM y la puntuación ortopédica veterinaria (VOS) a lo largo del tiempo, y (iii) evaluar la seguridad reconociendo al mismo tiempo que la pequeña población del estudio limita la aplicabilidad más amplia de las observaciones de seguridad.
2.2 Animales y elegibilidad
El estudio piloto fue aprobado por el Consejo de Experimentación Animal de Israel el 20 de junio de 2021 (número de aprobación 20062021). Se obtuvo el consentimiento firmado por el propietario de cada perro antes de ingresar al estudio. En el estudio se inscribieron perros de ≥2 años, con un peso corporal ≥10 kg, de cualquier raza o sexo, procedentes de 11 clínicas veterinarias de Israel. Los datos demográficos de la población estudiada se muestran en la Tabla 1. Los perros inscritos deben haber tenido signos de artrosis informados por el propietario y signos radiológicos y clínicos confirmados de artrosis, incluida una puntuación de cojera de ≥1 utilizando VOS. Cada perro debía gozar de buena salud general según lo evaluado por el examen físico, la historia clínica y la patología clínica (hematología y química clínica), incluidas las concentraciones séricas normales de calcio y fósforo. Se excluyeron las perras que estaban preñadas, lactando o destinadas a la reproducción, o con enfermedad renal o hepática, anomalías neurológicas, infecciones articulares o cojera asociadas con otras enfermedades ortopédicas o neoplásicas que pudieran interferir con la evaluación del tratamiento. La severidad del dolor y su efecto en el desempeño de las actividades diarias fueron evaluados por los propietarios en el día 0 (inicio, primer día de tratamiento) utilizando el CBPI para producir puntuaciones para PSS, PIS y calidad de vida (CV). Para ser inscrito, cada perro tenía que tener un PSS medio ≥2 y un PIS medio ≥3. Los medicamentos analgésicos o antiinflamatorios se prohibieron durante todo el estudio, y los AINE, los corticosteroides de acción corta, los corticosteroides de acción prolongada, las inyecciones intraarticulares de tratamiento con láser articular y la hidroterapia se retiraron 10, 14, 28, 90 y 10 días, respectivamente, antes del día 0. Los perros que recibieron nutracéuticos durante ≥30 días antes del día 0 permanecieron en ese tratamiento. No se impusieron condiciones sobre la alimentación o el ejercicio que se les dio a los perros. Los perros que requerían analgésicos fueron rescatados del estudio y se consideraron fracasos en el tratamiento.
2.3 Procedimientos y tratamientos del estudio
Al inicio del estudio, se obtuvo el consentimiento de los propietarios, seguido de procedimientos de selección para determinar la elegibilidad para la inscripción. Durante cada visita en los días 0, 14, 28 y 56, los propietarios completaron cuestionarios CBPI y CSOM, y los veterinarios realizaron exámenes ortopédicos y completaron un cuestionario VOS. Al inicio del estudio, se realizaron radiografías de la articulación con los signos clínicos más graves de artrosis, seleccionada por el veterinario como la «articulación de estudio». En los días 0 y 56, los veterinarios completaron un examen físico completo y se extrajo sangre para hematología y bioquímica. Los perros fueron tratados con ACC durante 56 días a una dosis de aproximadamente 60 mg/kg (~20 mg/kg de calcio elemental) dos veces al día, dispensados en sobres numerados secuencialmente que contenían polvo. Este régimen de dosificación se seleccionó en función de los datos previos de eficacia y seguridad de estudios clínicos preclínicos y en humanos. El placebo fue polvo de celulosa microcristalina emparejado con ACC por color, forma, tamaño de partícula y empaque. Se instruyó a los propietarios para que mezclaran el polvo con pequeñas cantidades de comida húmeda y verificaran que se consumiera la dosis completa. El cumplimiento de la dosificación se evaluó mediante el recuento de los sobres vacíos devueltos y los registros de administración del diario del propietario. El etiquetado del producto y la codificación del tratamiento fueron realizados por personal de la planta de fabricación que de otro modo no estaba involucrado en el estudio y se enmascaró para las asignaciones de tratamiento en las clínicas. Se tuvo cuidado de garantizar que los propietarios, los veterinarios y el personal de la clínica estuvieran enmascarados para la asignación de grupos de tratamiento durante todo el estudio.
2.4 Medidas de resultado
Las puntuaciones CBPI y CSOM se utilizaron como criterios de valoración de eficacia para el tratamiento de la ACC. Para las evaluaciones veterinarias se utilizó el cuestionario VOS. Los propietarios y veterinarios no tuvieron acceso a las puntuaciones de las evaluaciones anteriores. El CBPI completado por el propietario, un instrumento validado en dos partes que evalúa los cambios en la gravedad del dolor y los ítems de interferencia del dolor [cada uno en una escala numérica de 11 puntos (0-10)], sirvió como criterio de inclusión y se utilizó como se describió anteriormente para evaluar el éxito del tratamiento (24-26). El CSOM completado por el propietario evaluó el deterioro de la movilidad relacionado con la OA en función de tres actividades deterioradas seleccionadas individualmente (p. ej., subir escaleras, levantarse del descanso y saltar al automóvil) en comparación con cuando el perro fue considerado normal y calificado por los propietarios utilizando una escala de 5 puntos (1-5) para producir las puntuaciones totales del CSOM (suma de las tres actividades, rango 3-15) como se usaba anteriormente (27). Se completó el cuestionario VOS para la articulación con los signos clínicos más graves de artrosis («articulación de estudio») y se evaluó la cojera al caminar (0-4) y al trote (0-4), el dolor a la palpación o manipulación de la articulación (0-3), el rango de movimiento (0-3) y la hinchazón articular (0-3). El VOS total fue la suma de las puntuaciones de cada uno de los cinco componentes (rango de 0 a 17) y fue muy similar a otros cuestionarios veterinarios, como el Total Orthopedic Score (TOS) (28). Todos los perros que necesitaron analgésicos fueron rescatados y salidos del estudio, y se registró el porcentaje de perros que necesitaron tratamiento de rescate para cada grupo.
Se registró cualquier evento adverso (EA), definido como un signo clínico considerado indeseable independientemente de si se considera o no relacionado con el tratamiento. Un EA grave (EAG) era un EA que ponía en peligro la vida y provocaba hospitalización, discapacidad persistente o sustancial, o muerte. La seguridad del ACC se evaluó mediante exámenes físicos veterinarios, patología clínica, observaciones del propietario y EA.
2.5 Tamaño de la muestra
Este estudio se planificó como un estudio piloto para obtener indicaciones iniciales de datos potenciales de eficacia y seguridad. Dado que este fue el primer estudio clínico en el que se utilizó ACC en perros con artrosis, no se disponía de valores preliminares para la varianza o el tamaño del efecto de la ACC sobre el dolor y/o la movilidad para el cálculo del tamaño de la muestra. Para determinar el tamaño muestral indicativo para la evaluación de las posibles diferencias en la eficacia entre tratamientos, utilizamos un enfoque descrito anteriormente para la estimación del tamaño de la muestra de un estudio clínico inicial o piloto, que tiene como objetivo minimizar el tamaño de la muestra del estudio general de un estudio principal posterior, con el poder estadístico adecuado para evaluar las diferencias estadísticas (30). Para un diseño de estudio principal (confirmatorio) de 90% de potencia y significación bilateral del 5%, el tamaño de la muestra de cada grupo de tratamiento en un estudio piloto inicial debe ser de 75, 25, 15 o 10 para tamaños de efecto estandarizados de extra pequeño (<0,1), pequeño (0,2, rango de 0,1 a <0,3), mediano (0,5, rango ≥0,3 a 0,7) o grande (≥0,7), respectivamente. Se anticipó que el ACC tendría tamaños de efecto medios clínicamente beneficiosos sobre la gravedad del dolor (PSS) y la interferencia del dolor (PIS) determinados en el día 56 en comparación con el día 0. Dada una tasa de deserción común del 10 al 20% observada en otros estudios caninos de artrosis, este estudio inicial tuvo como objetivo inscribir a un total de aproximadamente 40 perros.
2.6 Métodos estadísticos
Cada perro sirvió como unidad experimental. La significación estadística se evaluó con una α bilateral = 0,05. El análisis de seguridad se realizó en la población por intención de tratar (ITT) de todos los perros que fueron aleatorizados y recibieron al menos una dosis de tratamiento. La evaluación de la eficacia potencial se llevó a cabo en la población por protocolo (PPP), un subconjunto del grupo ITT sin violaciones sustanciales del protocolo.
La puntuación CBPI en el día 56 en comparación con el día 0 fue el principal indicador a priori de la eficacia potencial y se comparó entre los grupos de tratamiento. Se utilizó un criterio predefinido de éxito para clasificar a cada perro como éxito o fracaso del tratamiento. Un perro con PSS disminuyó en ≥1, el PIS disminuyó en ≥2 y la misma o mejor calidad de vida se consideró éxito del tratamiento, como se describió anteriormente (25, 26). Cualquier perro que no se definiera como un éxito se consideraba un fracaso del tratamiento. Un análisis adicional utilizó criterios menos conservadores para el éxito, definidos como PSS disminuyó en ≥1, PIS disminuyó en ≥1 y una CV igual o mejor en el día 56 en comparación con el día 0. El éxito definido como disminuciones en PSS ≥ 1 combinado con PIS ≥ 2 ha sido ampliamente utilizado; sin embargo, también se han considerado los criterios menores de disminución en el PSS ≥ 1 y el PIS ≥ 1 sobre la base de que si los propietarios pueden notar una diferencia en el nivel de dolor de su mascota, como se refleja en una mejora de 1 en las puntuaciones para CPBI, entonces esa mejora es clínicamente relevante, aunque puede no ser una gran diferencia o indicar que el perro está completamente libre de dolor (26). Se resumió la proporción (%) de perros clasificados como exitosos del tratamiento y se comparó entre los grupos de tratamiento para los días 14, 28 y 56 utilizando la prueba de Chi-cuadrado N−1 (31, 32). 3 También se comparó la proporción (%) de perros rescatados antes del día 56 entre los tratamientos mediante la prueba de Chi-cuadrado N-1.
Las puntuaciones de CSOM en los días 0 y 56 se compararon entre tratamientos, de forma similar a la CBPI, para evaluar la eficacia potencial utilizando esta herramienta. Un perro con una puntuación CSOM disminuyó en ≥2 en el día 56 en comparación con el día 0 se consideró un éxito, como se describió anteriormente (27). También se comparó la proporción (%) de perros rescatados antes del día 56 entre los tratamientos mediante la prueba de Chi-cuadrado N-1.
Se evaluaron los datos de PSS, PIS, CSOM y VOS para los días 0, 14, 28 y 56 para explorar las diferencias entre los grupos de tratamiento y el tiempo hasta el efecto, utilizando el análisis de varianza de medidas repetidas y, según lo recomendado por la EMA, se incluyó como covariable la medida basal (día 0) de la respuesta (33, 34). 4 Las comparaciones entre medias se basaron en comparaciones por pares planificadas previamente a priori. Las comparaciones entre los grupos de tratamiento se consideraron secundarias a las comparaciones entre los grupos de tratamiento.
Los tamaños del efecto estandarizados de las comparaciones en el día 56 entre los grupos de tratamiento y los grupos dentro del tratamiento para las puntuaciones de PSS, PIS y CSOM se calcularon utilizando la fórmula d de Cohen (35, 36). Se utilizaron odds ratios para evaluar el tamaño del efecto del éxito del tratamiento (% de respondedores) en función del CBPI y el CSOM.
El último método de observación se realizó con perros excluidos en momentos específicos debido únicamente al dolor relacionado con la artrosis. La bioquímica sérica, las concentraciones de calcio y fósforo, la hematología, los datos del examen físico y los EA fueron resumidos y evaluados por el grupo de tratamiento mediante estadística descriptiva. No faltaron datos, excepto las puntuaciones de CSOM para un perro en el grupo de tratamiento con placebo; este animal fue excluido del análisis de datos solo para CSOM.
3 Resultados
3.1 Población de estudio
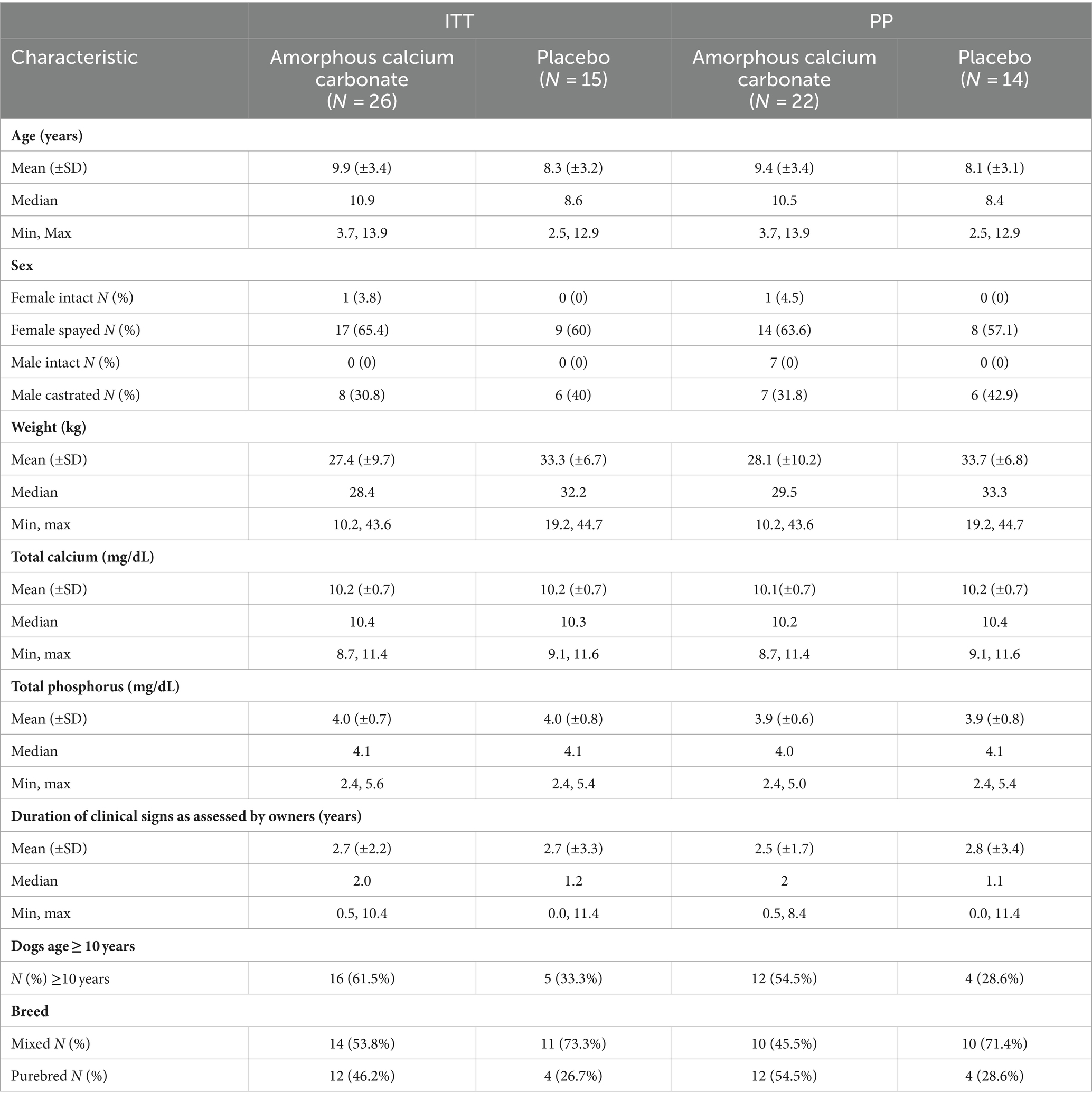
La matrícula comenzó en octubre de 2021 y finalizó en marzo de 2022. Cincuenta y tres perros fueron examinados, de los cuales 41 fueron inscritos e incluidos en la población de seguridad (ITT) y 36 perros fueron incluidos en el PPP (ACC, n = 22, placebo, n = 14; Figura 1). En la población de seguridad, la edad de los perros osciló entre los 2,5 y los 13,9 años. El peso corporal osciló entre 10,2 kg y 44,7 kg (Tabla 1). Hubo más mujeres que hombres en la población (27 mujeres y 14 hombres), pero sus proporciones dentro de los grupos ACC y placebo fueron similares (69,2 y 60,0%, respectivamente). El grupo ACC tuvo una mayor proporción de perros mayores (≥10 años) que placebo (61,5 y 33,3%, respectivamente). Las concentraciones séricas de calcio y fósforo totales fueron similares entre los grupos de tratamiento.
Del mismo modo, en la población PP hubo más mujeres que hombres (23 mujeres, 13 hombres), pero sus proporciones dentro de los grupos ACC y placebo fueron similares (68,1 y 57,1%, respectivamente). El grupo ACC tuvo una mayor proporción (~ dos veces) de perros mayores (≥ 10 años) que placebo (54,5% frente a 28,6%, respectivamente), así como una mayor proporción (~ dos veces) de perros de raza pura (54,5 % frente a 28,6 %, respectivamente). Las articulaciones más comunes seleccionadas como «articulaciones de estudio» tanto en el grupo ACC como en el grupo placebo fueron caderas con proporciones similares (68,2 y 57,1%, respectivamente).
3.2 Resultados
Tres perros (21,4%) que recibieron placebo y un perro (4,5%) que recibió ACC fueron retirados del estudio antes del día 56 para tratamiento de rescate debido al dolor percibido por el propietario y se consideraron fracasos del tratamiento (p = 0,12).
Sobre la base del criterio principal de valoración de la eficacia del éxito del tratamiento mediante evaluaciones CBPI en el día 56 (disminución del PSS ≥1, disminución del PIS ≥2), proporcionalmente más ACC que los perros placebo fueron éxitos del tratamiento [(45,5% 10/22) frente a 21,4% (3/14), respectivamente]; sin embargo, estas diferencias no fueron estadísticamente significativas (p = 0,15). Del mismo modo, en el día 28, más perros con ACC que placebo fueron éxitos del tratamiento [45,5% (10/22) frente a 14,3% (2/14), respectivamente]. En el día 14, la proporción de éxitos del tratamiento fue similar entre ACC y placebo [27,3% (6/22) frente a 28,6% (4/14), respectivamente] (Figura 2A).
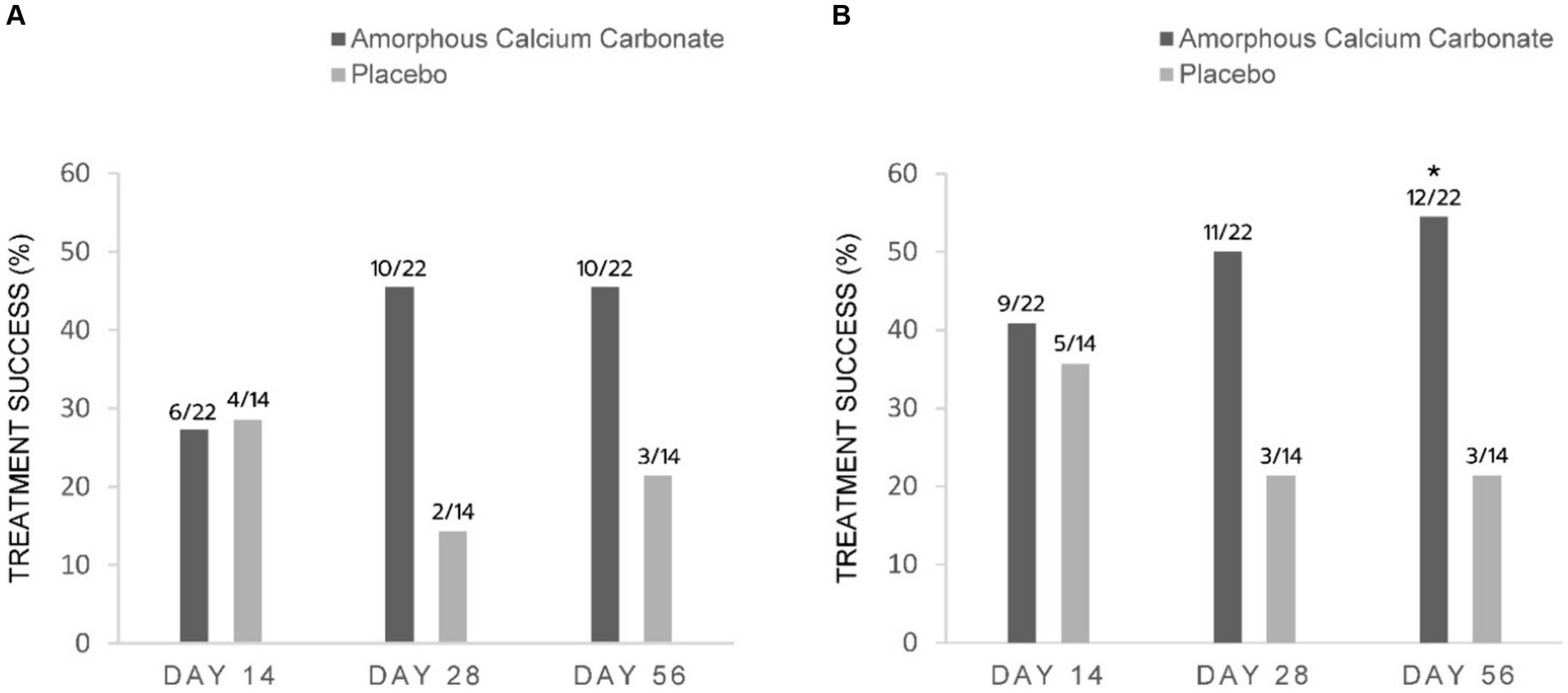
Utilizando criterios menos conservadores para las evaluaciones de CBPI en el día 56 (disminución de PSS ≥ 1, disminución de PIS ≥ 1), el tratamiento fue significativamente mayor que el de los perros placebo en el día 56 [54,5% (12/22) frente a 21,4% (3/14), respectivamente, una diferencia del 33,1%, p = 0,05]. En los días 28 y 14, las diferencias de 28,6 y 5,2% entre tratamientos no fueron significativas (Figura 2B).
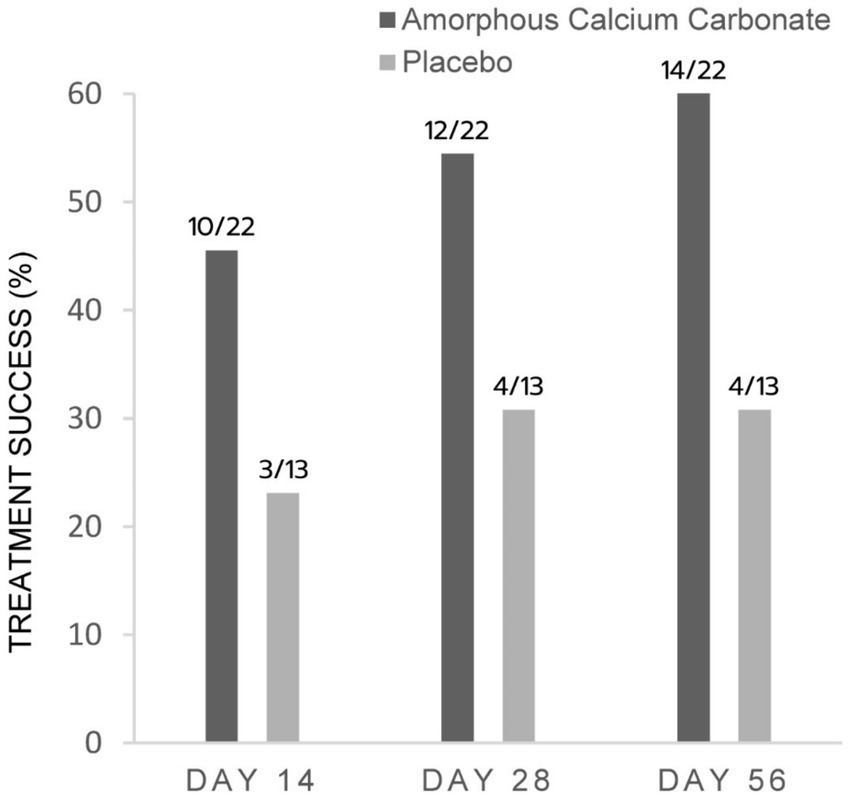
Para las evaluaciones de CSOM, proporcionalmente más ACC que los perros placebo fueron éxitos del tratamiento en los días 56, 28 y 14, con diferencias del 32,8% (p = 0,06), 23,7 y 22,4% en el éxito del tratamiento, respectivamente. Estas diferencias no fueron estadísticamente significativas (Figura 3).
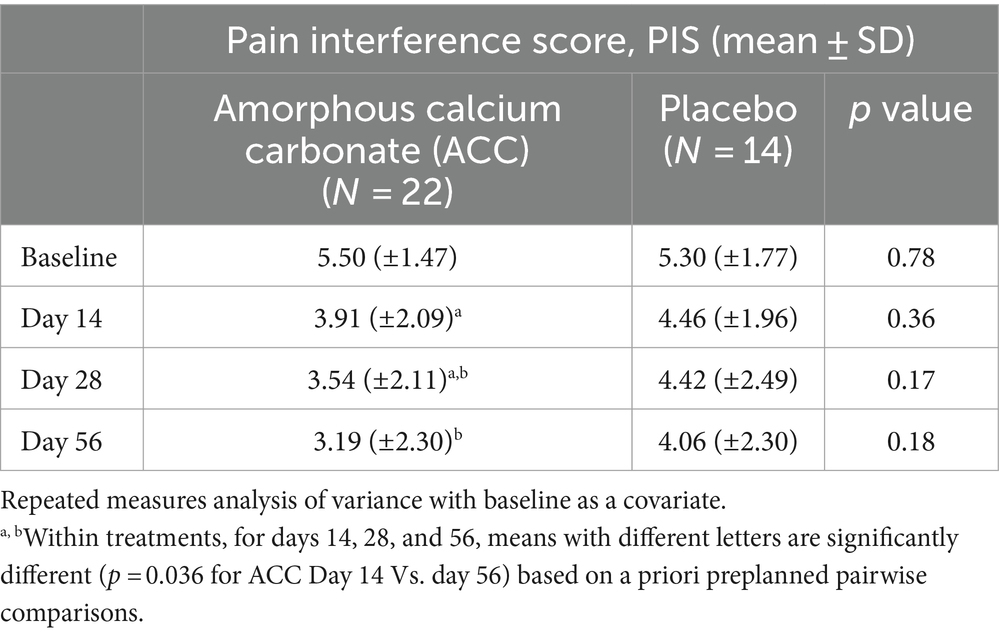
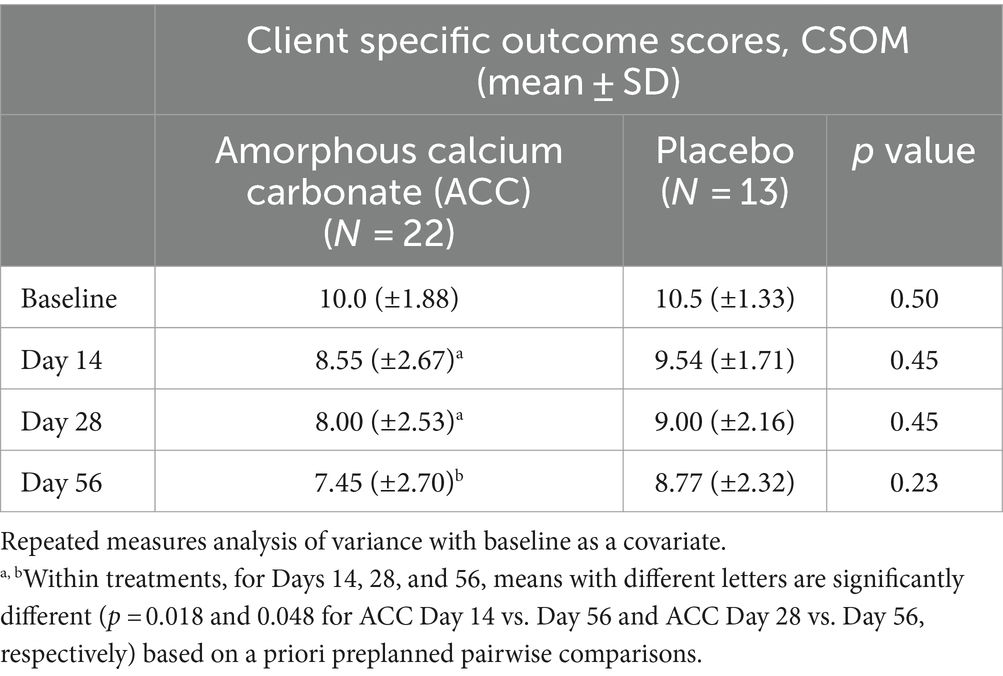
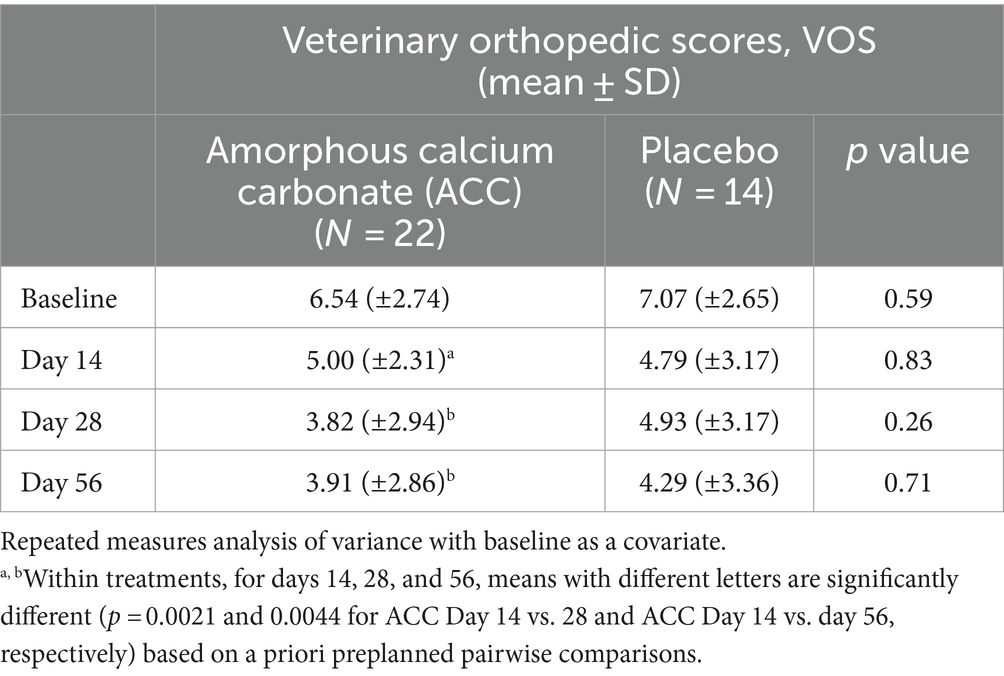
Para las evaluaciones de eficacia basadas en las puntuaciones de PSS, PIS, CSOM y VOS, no hubo diferencias significativas entre los tratamientos con ACC y placebo (p > 0,05) (Tablas 2-5). Cada una de las puntuaciones fue más baja en el día 14 que al inicio (día 0) en ambos grupos de tratamiento, lo que es consistente con un efecto placebo inicialmente fuerte. A partir del día 14, hubo reducciones significativas en cada una de las puntuaciones de la evaluación en el día 56 en los animales tratados con ACC (p < 0,05), mientras que en los animales placebo no hubo cambios comparables (p > 0,05).
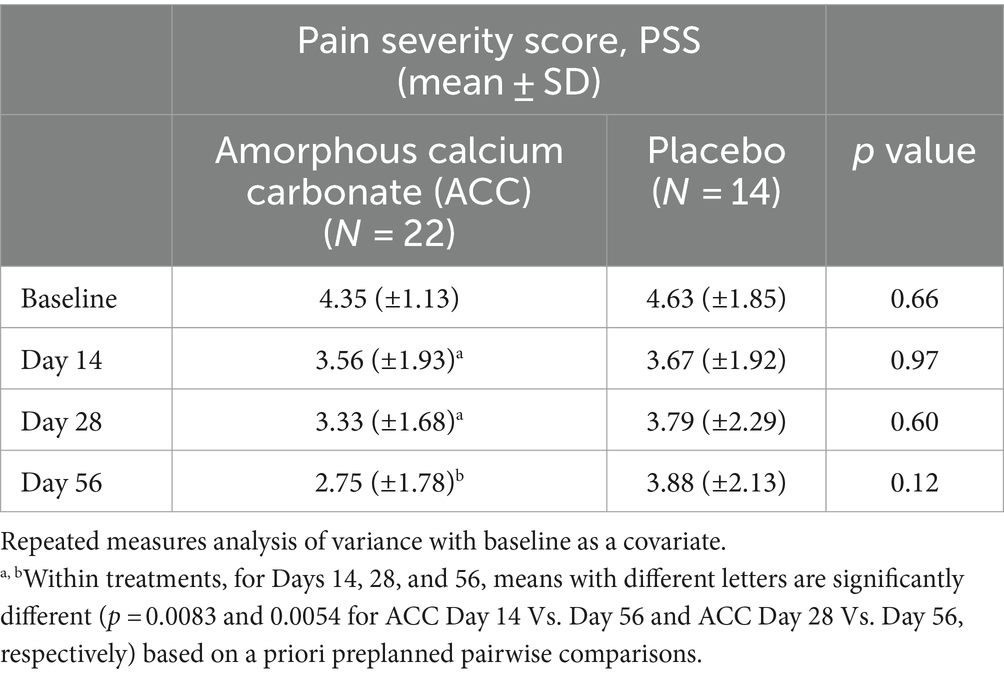
Para PSS, los perros que recibieron ACC tuvieron puntuaciones significativamente más bajas en el día 56 en comparación con los días 14 y 28 (p < 0,01), mientras que no hubo diferencias significativas dentro del grupo de tratamiento con placebo (p > 0,05).
Para PIS, los perros que recibieron ACC tuvieron puntuaciones más bajas en los días 28 y 56 en comparación con el día 14, significativamente para el día 56 (p = 0,04), mientras que no hubo diferencias significativas dentro del grupo de tratamiento con placebo (p > 0,05).
Para el CSOM, los perros que recibieron ACC tuvieron puntuaciones significativamente más bajas en el día 56 en comparación con los días 14 y 28 (p < 0,05), mientras que no hubo diferencias similares dentro del grupo de tratamiento con placebo (p > 0,05).
Para VOS, los perros que recibieron ACC tuvieron puntuaciones significativamente más bajas en los días 28 y 56 en comparación con el día 14 (p < 0,01), mientras que no hubo diferencias similares dentro del grupo placebo (p > 0,05).
Los tamaños del efecto estandarizados de la ACC en comparación con placebo en el día 56 para PSS, PIS y CSOM fueron 0,58 [intervalo de confianza [IC] del 95%; -1,27 a 0,09], 0,38 (IC del 95%; -1,05 a 0,29) y 0,52 (IC del 95%; -1,19 a 0,16), respectivamente. Para las comparaciones dentro del tratamiento, los tamaños del efecto estandarizados para los cambios hasta el día 56 para el ACC en las puntuaciones de PSS y PIS fueron de 1,4 y 1,57, respectivamente, mientras que los tamaños del efecto de los cambios en placebo fueron de 0,4 y 0,3, respectivamente. Los tamaños del efecto basados en los odds ratios para la proporción de perros considerados exitosos del tratamiento en el día 56 por CBPI (disminución del PSS ≥ 1, disminución del PIS ≥ 2), CBPI (disminución del PSS ≥ 1, disminución del PIS ≥ 1) y disminución del CSOM ≥ 2 fueron 3,1 (IC del 95%; 0,67 a 14,1), 4,4 (IC del 95%; 0,96 a 20,3) y 3,9 (IC del 95%; 0,91 a 17,0), respectivamente.
La población de seguridad (ITT) incluyó 41 perros. En la Tabla 6 se resume el tipo, la frecuencia y la relación de los EA con los tratamientos. No había SAEs. En general, dos perros que recibieron ACC y un perro que recibió placebo tuvieron diarrea/heces blandas leves, transitorias y autolimitadas (máximo de 4 días); estos EA podrían haber estado relacionados con el tratamiento. Dos perros tratados con ACC con antecedentes de infecciones recurrentes del tracto urinario (ITU) desarrollaron infecciones urinarias en el estudio, y se consideraron posiblemente relacionadas con el tratamiento. Otros dos posibles EA relacionados con el tratamiento en el grupo de ACC fueron un perro con diuresis excesiva transitoria (2 días) y un perro con estreñimiento transitorio (4 días). Un perro placebo fue diagnosticado con linfadenopatía general no relacionada y salió del estudio.
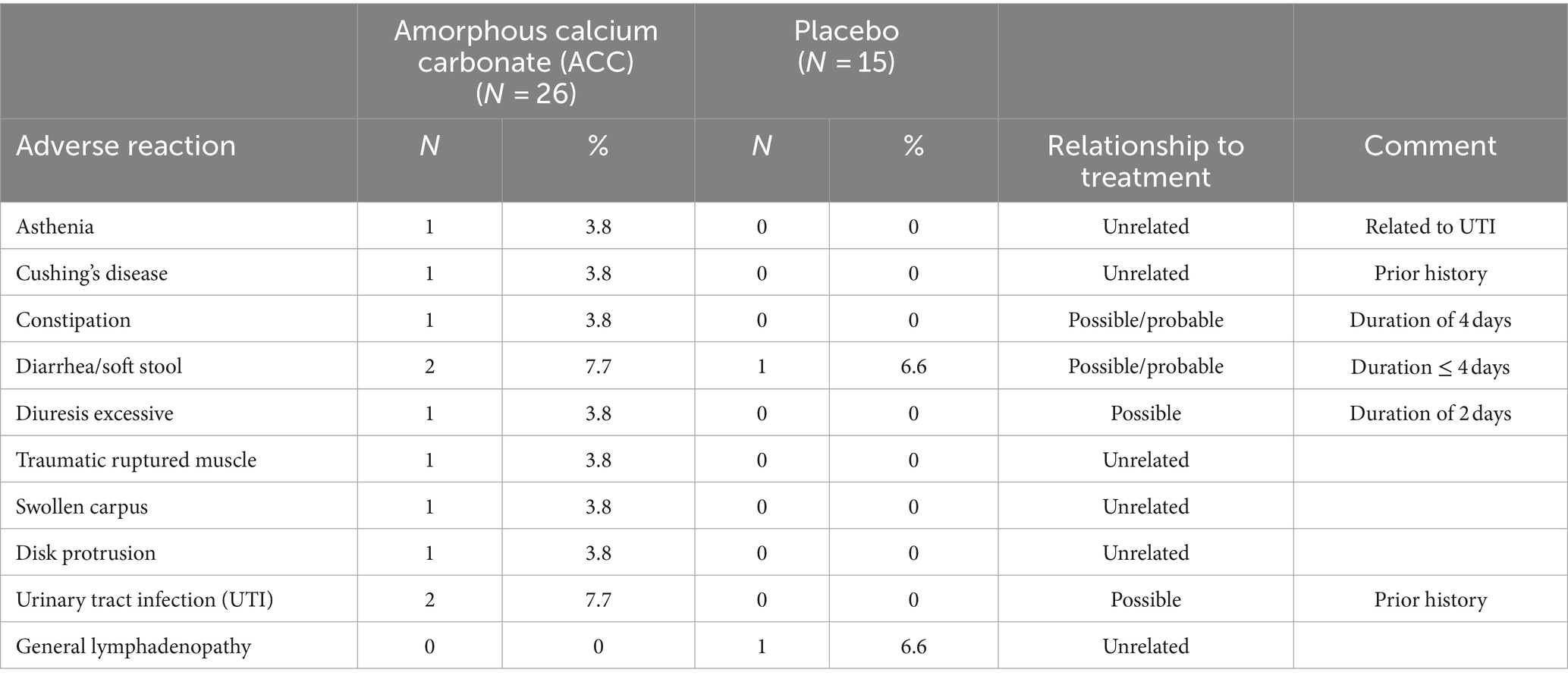
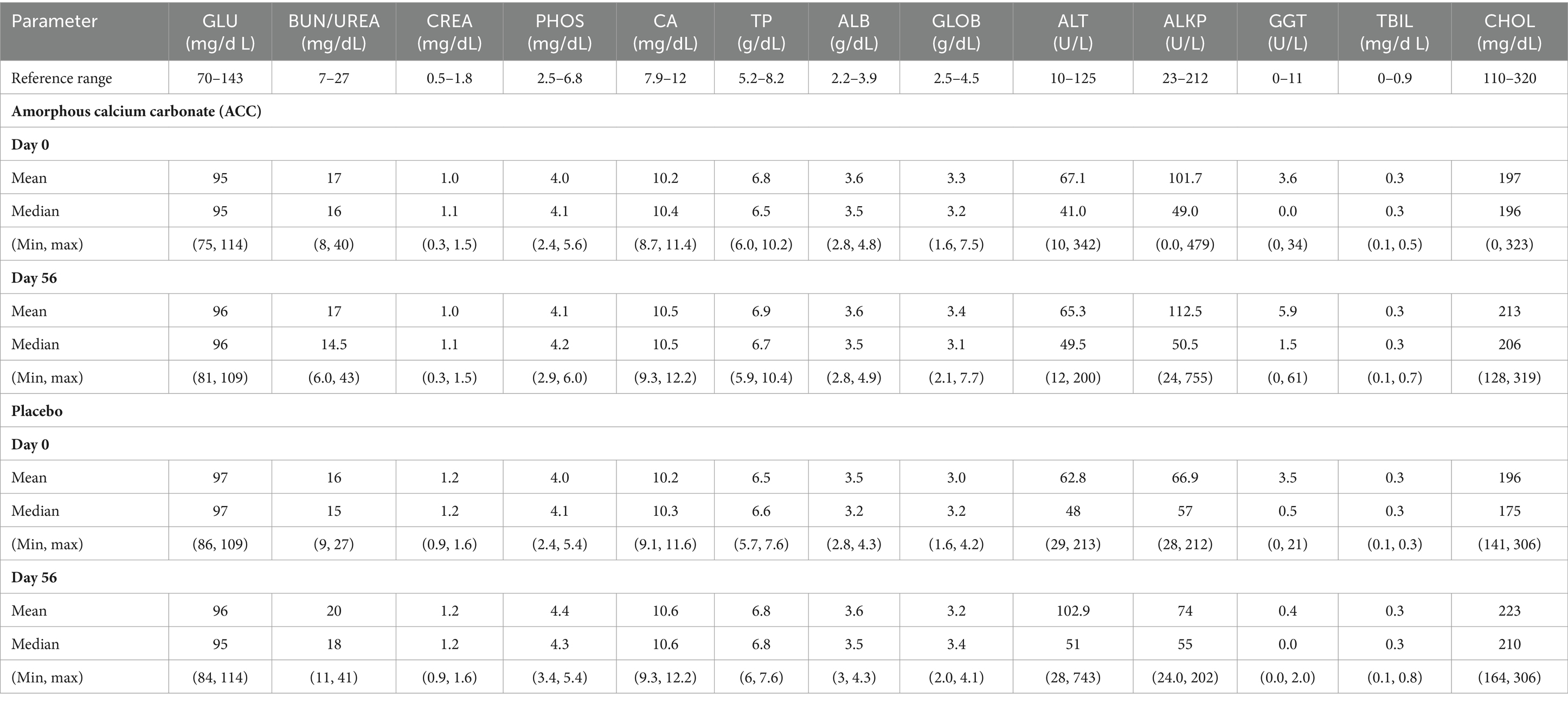
No se identificaron cambios relacionados con el tratamiento en los resultados de patología clínica en las muestras recogidas el día 56 (Tabla 7); Los valores medios y medianos de laboratorio para los días 0 y 56 estuvieron dentro de los rangos de referencia, y los pocos cambios menores en los resultados de patología clínica no se consideraron relacionados con el tratamiento. No hubo diferencias en las concentraciones séricas medias de calcio y fósforo totales en los días 0 y 56 entre tratamientos. Dos perros, uno en cada grupo de tratamiento, tuvieron un ligero aumento de las concentraciones de calcio total (12,2 mg/dL, rango de valores de referencia 7,9-12,0 mg/dL) con calcio ionizado normal en el día 56. Estos aumentos no se consideraron relacionados con el tratamiento, ya que el calcio ionizado es fisiológicamente más relevante, y los cambios se observaron en ambos grupos de tratamiento.
4 Discusión
Se trata de un estudio clínico piloto y exploratorio en perros con artrosis espontánea. El estudio utilizó un diseño aleatorizado, controlado con placebo y doble ciego para realizar una evaluación preliminar de la ACC administrada por vía oral en comparación con un tratamiento con placebo y para obtener información sobre la aplicabilidad de algunas medidas de resultado a una evaluación del tratamiento con ACC y la variabilidad de los datos relacionados para su posible utilización en estudios futuros. Como estudio piloto, no fue diseñado para proporcionar una evaluación estadística sólida de la eficacia terapéutica de la ACC debido al número relativamente pequeño de casos clínicos caninos utilizados.
Los resultados de la ACC en comparación con placebo no mostraron efectos estadísticamente significativos en las principales medidas de resultado de eficacia. Sin embargo, los contrastes entre el ACC y el placebo para los cambios en el PSS, PIS, CSOM y VOS durante el estudio de 8 semanas sugieren posibles beneficios terapéuticos del ACC y apoyan la realización de estudios más grandes y con el poder estadístico adecuado para evaluar de manera más sólida la eficacia del ACC para controlar el dolor y mejorar la movilidad en perros con artrosis.
Para la demostración de la eficacia, la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) exige a las empresas patrocinadoras que se basen en las evaluaciones de los propietarios como medida principal de eficacia en los estudios clínicos de medicamentos para la artrosis en perros, en lugar de en mediciones objetivas o evaluaciones veterinarias. Además, la FDA requiere que se utilice una definición predeterminada de éxito para clasificar a cada perro como éxito o fracaso del tratamiento y para comparar las proporciones de perros que tuvieron éxito en el tratamiento entre las intervenciones del estudio (26, 28). En este estudio, se utilizaron dos cuestionarios validados para propietarios, CBPI y CSOM, para evaluar la eficacia potencial de ACC. Ambos cuestionarios han sido aceptados por la FDA y la Agencia Europea del Medicamento (EMA) para evaluar los AINE en el tratamiento de la artrosis canina. El estudio confirmó la relevancia de las evaluaciones CBPI y CSOM para la evaluación de la eficacia del ACC y proporcionó datos iniciales de eficacia y seguridad, así como estimaciones del rango de tamaño del efecto y la variabilidad de los datos para el diseño de estudios adicionales.
En este estudio, se utilizaron criterios predefinidos para el éxito del tratamiento para CBPI basados en una definición clínicamente relevante de disminución de PSS ≥1 y disminución de PIS ≥2 en comparación con el día 0 y una puntuación de CV igual o mejor en el día 56, similar a la descrita anteriormente (26, 28). También evaluamos una definición menos conservadora de éxito, de disminución de PSS ≥1 y disminución de PIS ≥1, y una puntuación de CV igual o mejor a los 56 días, similar a la descrita anteriormente (26). Los cambios observados, pero no estadísticamente significativos, en los porcentajes de éxito del tratamiento con CBPI y CSOM para el ACC son comparables a los de estudios mucho más grandes sobre el uso de AINE en la artrosis. En un estudio en el que se utilizó CBPI y una PPP de 131 perros/tratamiento y una definición exitosa de la disminución del PSS ≥1 y la disminución del PIS ≥2 en el día 28 desde el día 0, el grapiprant5 mejoró el dolor en comparación con el placebo después de 28 días (48,1 y 31,3% de éxitos del tratamiento, respectivamente) (28). De manera similar, se utilizó CBPI para evaluar la eficacia del carprofeno6 en un estudio de OA de 14 días (n = 116 perros), con tasas de éxito basadas en CBPI de 45,5 y 23,7% para carprofeno y placebo, respectivamente (26). En nuestro estudio, el 45,5 y el 54,5 % de los perros tratados con ACC se clasificaron como exitosos del tratamiento en el día 56, en comparación con el 21,4 y el 21,4 % en el grupo tratado con placebo, utilizando definiciones de éxito de disminuciones en PSS ≥1 y PIS ≥2, o PSS ≥1 y PIS ≥ 1, respectivamente. Las diferencias en el éxito entre los tratamientos no fueron estadísticamente significativas en función de la primera definición, pero sí en los criterios de éxito menos conservadores cuando se basaron en la segunda. Un estudio de 280 perros con artrosis (ITT) utilizó las puntuaciones de CSOM y encontró un éxito de tratamiento significativamente mayor después de 28 días de tratamiento con meloxicam7 (72,6%) que con placebo (46,9%). En el mismo estudio, no se observaron diferencias entre los tratamientos en las evaluaciones veterinarias (27). En nuestro estudio, los éxitos del tratamiento en el día 56 según las puntuaciones de CSOM fueron del 63,6% en los perros tratados con ACC en comparación con el 30,8% en el grupo de placebo; sin embargo, estas diferencias no fueron significativas, y los éxitos del tratamiento basados en las mejoras en las puntuaciones de VOS se encontraron solo dentro del grupo ACC.
Si bien no se encontraron contrastes significativos para las puntuaciones de PSS, PIS, CSOM y VOS entre los grupos de tratamiento, fue interesante observar que se encontraron puntuaciones de PSS, PIS, CSOM y VOS significativamente mejoradas (más bajas) dentro del grupo de ACC en el día 56, mientras que no se encontraron diferencias similares dentro del grupo de placebo. Estas mejoras pueden indicar que los efectos del CCA aumentaron durante las 8 semanas del período de tratamiento del estudio. Esto debe tenerse en cuenta en el diseño de futuros estudios.
Los tamaños del efecto estandarizados para las comparaciones entre tratamientos en el día 56 para la media de PSS y PIS (0,58 y 0,38, respectivamente) se clasifican como medios (rango ≥ 0,3-0,7) (30). De manera similar, para los éxitos del tratamiento basados en CBPI y CSOM (% de respondedores) en el día 56, se obtuvieron tamaños de efecto medios para ACC utilizando odds ratios (3.1-4.4) (37). Los tamaños del efecto para las comparaciones dentro del tratamiento de los cambios en PSS y PIS hasta el día 56 para el ACC fueron mayores (1,4 y 1,57) que para placebo (0,4 y 0,3, respectivamente). Estos resultados son comparables a los de un estudio de OA en perros que evaluó los tamaños del efecto basados en PSS y PIS de carprofeno (0,55 y 0,66), tramadol (0,55 y 1,3) y placebo (0,33 y 0,35), respectivamente (38). Cabe destacar que, en el caso de los AINE, las mejoras en el PSS y el PIS suelen ser evidentes en un plazo de 14 días, mientras que en el caso de los ACC con un modo de acción diferente, las mejoras parecen ser más observables después de 28 a 56 días. Sin embargo, el momento de inicio de la eficacia terapéutica debe aclararse en un estudio más amplio.
Dos casos leves y transitorios de heces blandas/diarrea, un caso de diuresis excesiva y un caso de estreñimiento fueron los pocos eventos adversos posiblemente relacionados con el tratamiento observados en el grupo de ACC durante este estudio de 8 semanas. Los dos perros que desarrollaron infecciones urinarias tenían antecedentes antes de la inscripción de infecciones urinarias recurrentes; Uno de estos perros también tenía incontinencia urinaria y recibió tratamiento con fenilpropanolamina antes y durante el estudio. No está claro si estas infecciones urinarias estaban relacionadas con el tratamiento; sin embargo, dado que el carbonato de calcio puede estar asociado con un aumento del pH urinario (no evaluado) y, por lo tanto, con un posible aumento del riesgo de infección, la evaluación de los efectos del ACC sobre el pH urinario y la incidencia de ITU será importante en estudios futuros. La proporción de heces blandas/diarrea fue similar entre los grupos ACC y placebo (7,7 y 6,6%, respectivamente). No hubo EAG ni otros EA relacionados con el tratamiento, no hubo cambios relacionados con el tratamiento en los resultados de patología clínica, incluidos los niveles séricos de calcio y fósforo, y el uso de ACC durante 56 días fue seguro en los perros del estudio. En los seres humanos, se han acumulado sólidos datos de seguridad del ACC procedentes de estudios preclínicos y clínicos y de encuestas posteriores a la comercialización en seres humanos que utilizan el suplemento nutricional comercializado (véase la nota 2). Estos datos son alentadores y respaldan la seguridad del ACC para el uso crónico en perros. No obstante, se necesitan datos adicionales para garantizar la seguridad, incluidos los procedentes de un mayor número de casos clínicos junto con los datos del margen de los estudios de seguridad en perros.
La patogenia de la artrosis y los mecanismos de dolor relacionados es compleja e involucra a toda la unidad osteocondral. Las terapias existentes para la artrosis se dirigen principalmente al dolor y/o la inflamación; otros están diseñados para preservar el cartílago articular. Cada vez hay más pruebas que sugieren que la remodelación ósea subcondral en las articulaciones con artrosis es un objetivo importante para los nuevos fármacos modificadores de la enfermedad (5, 7). En el desarrollo temprano de la artrosis, la acidificación de la matriz extracelular por los osteoclastos es necesaria para la reabsorción osteoclástica ósea, la desmineralización del hueso subcondral y la liberación de enzimas proteolíticas, como las metaloproteinasas de la matriz y las catepsinas, lo que conduce a la degradación del cartílago articular (5, 8, 21, 39-41). Disminuciones tan pequeñas como 0.1 en el pH extracelular pueden causar una duplicación de la resorción de calcio del hueso subcondral (41). Mientras que la síntesis de cartílago es óptima con un pH ~7,2, el pH en las articulaciones de la artrosis puede alcanzar 6,0, lo que provoca la modulación de la función de los condrocitos y la integridad del cartílago y el desarrollo de sinovitis (20, 40). La acidez también juega un papel importante en la sensación de dolor. Los canales iónicos sensibles al ácido (ASIC) son importantes para la excitación de los nociceptores por pH bajo, y las respuestas en etapa temprana a la lesión tisular en el dolor de la osteoartritis pueden ser inducidas por el ácido (42).
Se postula, pero aún no se ha establecido, que al aumentar los niveles de bicarbonato localmente, el ACC puede atenuar la acidez local y la cascada inflamatoria y dolorosa destructiva en las articulaciones de la artrosis, mientras que el aumento de los niveles de calcio puede estar disponible para el hueso subcondral reabsorbido para mejorar la actividad osteoblástica y mejorar la mineralización ósea. Dado que se sabe que el remodelado óseo subcondral en la artrosis progresa desde el aumento inicial de la resorción ósea hasta la posterior acumulación ósea esclerótica y poco mineralizada (41), existe una buena justificación para los enfoques terapéuticos que se dirigen a la resorción y/o formación ósea subcondral para modificar la progresión y el resultado de la enfermedad. Se están investigando varias estrategias terapéuticas en pacientes humanos con artrosis para dirigir el proceso de remodelación en el hueso subcondral de la artrosis, por ejemplo, bifosfonatos y ranelato de estroncio (utilizados también para la prevención y el tratamiento de la osteoporosis mediante la inhibición de la actividad de los osteoclastos y la mejora de los osteoblastos), y los inhibidores de la catepsina K, que pueden actuar tanto en la remodelación del cartílago como en la del hueso subcondral (5).
Una limitación importante de este estudio fue el pequeño número de perros en relación con la variabilidad de los datos. Además, el uso de una asignación de perros 2:1 al grupo de tratamiento puede reducir el poder de estudio, lo que podría haberse compensado aumentando el tamaño de la muestra del estudio. Para una evaluación definitiva de la seguridad y eficacia de un medicamento, es evidente que se requiere un número mucho mayor de perros, ya que este estudio no mostró diferencias de eficacia estadísticamente significativas entre las puntuaciones de ACC y placebo. Sin embargo, es alentador que, a pesar del número relativamente pequeño de perros en este estudio, se identificaron diferencias estadísticamente significativas clínicamente relevantes dentro del grupo de ACC para las puntuaciones de PSS, PIS, CSOM y VOS y entre ACC y placebo para los criterios menos conservadores de éxito de CBPI consistentes con la posible eficacia de ACC, particularmente después de 8 semanas de tratamiento. Apoyar el mérito de la realización de estudios clínicos a gran escala, que deben diseñarse para aclarar el momento de inicio de la eficacia terapéutica. Si bien se reconoce que este estudio fue pequeño, los resultados facilitan la estimación del tamaño de los grupos de tratamiento para futuros estudios confirmatorios, que, dependiendo de los supuestos, es probable que requieran de 150 a 190 perros por tratamiento (basados, por ejemplo, en un 80% de potencia y un 20% de deserción de casos). Los estudios más amplios también pueden permitir la estratificación y evaluación de algunas subpoblaciones de perros con artrosis, por ejemplo, según la edad, la raza, la condición corporal y la enfermedad concurrente. Otra limitación del estudio derivada de su carácter piloto fue la evaluación de una sola dosis de ACC, que se administró dos veces al día. Se recomienda la evaluación de regímenes de dosis alternativos, más altos y más bajos. En un estudio con un poder estadístico adecuado, es posible, por ejemplo, que una dosis más baja pueda ser eficaz. También se podría evaluar un régimen de una vez al día que respalde el cumplimiento por parte del propietario.
El presente estudio mostró que las evaluaciones de eficacia basadas en CBPI y CSOM son aplicables a la evaluación de ACC; sin embargo, la duración del tratamiento y la evaluación debe ser más larga que la utilizada para los AINE, como lo ejemplifican los tamaños del efecto aparentemente mayores observados en el día 56 en comparación con los puntos de tiempo anteriores. Sería útil evaluar la posibilidad de un uso combinado y seguro de la ACC con analgésicos de acción rápida en la fase inicial del tratamiento de la ACC hasta el efecto clínico. Los estudios futuros se beneficiarían no solo de ser más grandes, sino también del uso de técnicas de visualización (p. ej., resonancia magnética cuantitativa) y otros indicadores modificadores de la enfermedad observados antes y después del tratamiento para ayudar a estadificar la progresión de la artrosis y evaluar si el ACC mejora la progresión de la artrosis.
5 Conclusión
Los resultados del estudio piloto son alentadores y respaldan la realización de estudios más amplios con mayor poder estadístico para evaluar más a fondo la eficacia y seguridad potenciales de ACC y para evaluar su posible modo de acción novedoso en perros que sufren de OA.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue aprobado el 20 de junio de 2021 por el comité de ética del Consejo de Experimentación Animal de Israel (número de aprobación 20062021). El protocolo del estudio cumplió plenamente con los requisitos legislativos de Bienestar Animal de Israel, incluidos los requisitos del Consejo de Experimentación Animal de Israel. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
HS-R: Conceptualización, Curación de datos, Análisis formal, Metodología, Administración de proyectos, Recursos, Supervisión, Visualización, Redacción – borrador original, Redacción – revisión y edición. SK: Curación de datos, Investigación, Redacción – borrador original, Escritura – revisión y edición. TGR: Análisis formal, Metodología, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio fue financiado por Amorphical Ltd.
Reconocimientos
Los autores agradecen a Tseela Schwartz por su ayuda con el análisis estadístico y a los veterinarios y al personal de las clínicas participantes.
Conflicto de intereses
Este estudio clínico fue financiado por Amorphical Ltd. HS-R es empleado de Amorphical Ltd., y TGR es un consultor remunerado de Amorphical Ltd. SK fue uno de los investigadores veterinarios del estudio y no tenía ninguna relación financiera con Amorphical.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Notas
1. ^Densidad/Densypet, Amórfico, Ness Ziona, Israel.
2. ^Carbonato de calcio amorfo para el tratamiento de la acidosis, US20230124095A1 patente.
3. ^MedCalc Statistical Software versión 20.118, MedCalc Software, Ostende, Bélgica (https://www.medcalc.org).
4. ^InVivoStat, versión 4.6 (2022), Cambridge, Reino Unido (https://invivostat.co.uk).
5. ^Galliprant, Elanco, Greenfield, IN.
6. ^Rimadyl, Zoetis, Kalamazoo, MI.
7. ^Metacam, Boehringer-Ingelheim, San José, MO.
Referencias
1. Anderson, KL, O’Neill, DG, Brodbelt, DC, Church, DB, Meeson, RL, Sargan, D, et al. Prevalencia, duración y factores de riesgo de la osteoartritis apendicular en una población canina del Reino Unido bajo atención veterinaria primaria. Sci Rep. (2018) 8:5641. DOI: 10.1038/S41598-018-23940-Z
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Craig, LE, y Reed, A. Degeneración del cartílago asociada a la edad de la cabeza humeral canina. Veterinario Pathol. (2013) 50:264–8. doi: 10.1177/0300985812452584
3. Millis, DL, Weigel, JP, Moyers, T, y Buonomo, FC. Efecto del deracoxib, un nuevo inhibidor de la COX-2, en la prevención de la cojera inducida por sinovitis química en perros. Vet Ther. (2002) 3:453–64.
4. Mosley, C, Edwards, T, Romano, L, Truchetti, G, Dunbar, L, Schiller, T, et al. Pautas de consenso canadienses propuestas sobre el tratamiento de la osteoartritis basadas en las etapas 1-4 de OA-COAST. Front Vet Sci. (2022) 9:9. doi: 10.3389/fvets.2022.830098
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Kwan Tat, S, Lajeunesse, D, Pelletier, JP y Martel-Pelletier, J. Apuntar al hueso subcondral para el tratamiento de la osteoartritis: ¿cuál es la evidencia? Mejor Pract Res Clin Rheumatol. (2010) 24:51–70. doi: 10.1016/j.berh.2009.08.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Jung, YK, Han, MS, Park, HR, Lee, EJ, Jang, JA, Kim, GW, et al. El aumento del complejo calcio-fosfato durante la remodelación ósea subcondral afecta a la osteoartritis en estadio temprano. Sci Rep. (2018) 8:487. doi: 10.1038/s41598-017-18946-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Zhu, X, Chan, YT, Yung, PSH, Tuan, RS y Jiang, Y. Remodelación ósea subcondral: una diana terapéutica para la artrosis. Front Cell Dev Biol. (2021) 8:8. doi: 10.3389/fcell.2020.607764
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Hu, W, Chen, Y, Dou, C, y Dong, S. Microambiente en hueso subcondral: Regulador predominante para el tratamiento de la artrosis. Ann Rheum Dis. (2021) 80:413–22. doi: 10.1136/annrheumdis-2020-218089
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés). Animales y veterinarios, Información sobre la seguridad de los productos, Medicamentos antiinflamatorios no esteroideos (AINE) veterinarios. (2023). Disponible en: www.fda.gov/animal-veterinary/product-safety-information/veterinary-nonsteroidal-anti- inflamatorios-fármacos-aine (consultado el 16 de julio de 2023).
10. Muller, C, Enomoto, M, Buono, A, Steiner, JM, y Lascelles, BDX. Estudio piloto controlado con placebo de los efectos de un suplemento basado en membrana de cáscara de huevo sobre la movilidad y los biomarcadores séricos en perros con osteoartritis. Veterinario J. (2019) 253:105379. doi: 10.1016/j.tvjl.2019.105379
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Barbeau-Grégoire, M, Otis, C, Cournoyer, A, Moreau, M, Lussier, B, y Troncy, E. Una revisión sistemática y metaanálisis de 2022 de dietas terapéuticas enriquecidas y nutracéuticos en la osteoartritis canina y felina. Int J Mol Sci. (2022) 23:10384. doi: 10.3390/ijms231810384
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Librela-EPAR-producto-información. Anexo I. Resumen de las características del producto. (2023). Disponible en: https://medicines.health.europa.eu/veterinary/en/600000001761 (consultado el 13 de junio de 2024).
13. Bentov, S, Weil, S, Glazer, L, Sagi, A y Berman, A. Estabilización de carbonato de calcio amorfo por proteínas de matriz orgánica ricas en fosfato y por fosfoaminoácidos individuales. J Struct Biol. (2010) 171:207–15. doi: 10.1016/j.jsb.2010.04.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Meiron, OE, Bar-David, E, Aflalo, ED, Shechter, A, Stepensky, D, Berman, A, et al. Solubilidad y biodisponibilidad del carbonato cálcico amorfo estabilizado. J Bone Miner Res. (2011) 26:364–72. doi: 10.1002/jbmr.196
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Shaltiel, G, Bar-David, E, Meiron, OE, Waltman, E, Shechter, A, Aflalo, ED, et al. Prevención de la pérdida ósea en ratas ovariectomizadas utilizando carbonato cálcico amorfo estable. Salud. (2013) 5:18–29. doi: 10.4236/health.2013.57a2003
16. Vaisman, N, Shaltiel, G, Daniely, M, Meiron, OE, Shechter, A, Abrams, SA, et al. Aumento de la absorción de calcio a partir de carbonato de calcio amorfo estable sintético: ensayo clínico cruzado aleatorizado doble ciego en mujeres posmenopáusicas. J Bone Miner Res. (2014) 29:2203–9. doi: 10.1002/jbmr.2255
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Schittny, A, Huwyler, J y Puchkov, M. Mecanismos de aumento de la biodisponibilidad a través de dispersiones sólidas amorfas: una revisión. Droga Deliv. (2020) 27:110–27. doi: 10.1080/10717544.2019.1704940
18. Wdowiak, K, Miklaszewski, A, Pietrzak, R, y Cielecka-Piontek, J. Sistema amorfo de hesperetina y piperina: mejora de la solubilidad aparente, la permeabilidad y las actividades biológicas. Int J Mol Sci. (2023) 24:4859. doi: 10.3390/ijms24054859
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Kittl, M, Winklmayr, M, Helm, K, Lettner, J, Gaisberger, M, Ritter, M, et al. Corrientes de cloruro sensibles al ácido y al volumen en condrocitos humanos. Front Cell Dev Biol. (2020) 8:583131. doi: 10.3389/fcell.2020.583131
20. Collins, JA, Moots, RJ, Winstanley, R, Clegg, PD, y Milner, PI. Sensibilidad al oxígeno y al pH de condrocitos osteoartríticos humanos en un sistema de cultivo de perlas de alginato en 3D. Osteoartro Cartil. (2013) 21:1790–8. doi: 10.1016/j.joca.2013.06.028
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Erra Díaz, F, Dantas, E, y Geffner, J. Desentrañando la interacción entre la acidosis extracelular y las células inmunitarias. Mediat Inflamm. (2018) 2018:1218297. doi: 10.1155/2018/1218297
22. Natan, Y, Blum, YD, Arav, A, Poliansky, Y, Neuman, S, Ecker Cohen, O, et al. El carbonato cálcico amorfo muestra propiedades anticancerígenas que se atribuyen a su capacidad amortiguadora. Cánceres. (2023) 15:3785. doi: 10.3390/cancers15153785
23. Saleh, NA, Blum, Y, El-Roeiy, A, Stark, Y, Jabal, KA y Deutch, F. Carbonato de calcio amorfo sublingual e inhalado para pacientes hospitalizados con SARS-CoV-2: un estudio clínico de fase 1/2. J Clin Trials. (2023) 13. doi: 10.35248/2167-0870.23.13.538
24. Brown, DC, Boston, RC, Coyne, JC y Farrar, JT. Desarrollo y pruebas psicométricas de un instrumento diseñado para medir el dolor crónico en perros con osteoartritis. Am J Vet Res. (2007) 68:631–7. doi: 10.2460/ajvr.68.6.631
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Brown, DC, Boston, RC, Coyne, JC y Farrar, JT. Capacidad del Inventario de Dolor Breve Canino para detectar la respuesta al tratamiento en perros con osteoartritis. J Am Vet Med Assoc. (2008) 233:1278–83. doi: 10.2460/javma.233.8.1278
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Brown, DC, Bell, M y Rhodes, L. Definiciones del poder del éxito del tratamiento cuando se utiliza el Inventario Breve de Dolor Canino para evaluar el tratamiento con carprofeno para el control del dolor y la inflamación en perros con osteoartritis. Am J Vet Res. (2013) 74:1467–73. doi: 10.2460/ajvr.74.12.1467
27. Cozzi, EM, y Spensley, MS. Evaluación clínica prospectiva aleatorizada multicéntrica de meloxicam administrado a través de un aerosol oral transmucoso en perros propiedad de clientes. J Vet Pharmacol Ther. (2013) 36:609–16. doi: 10.1111/jvp.12050
28. Rausch-Derra, L, Huebner, M, Wofford, J y Rhodes, L. Estudio clínico multicéntrico prospectivo, aleatorizado, enmascarado y controlado con placebo de Grapiprant, un antagonista del receptor de prostaglandina EP4 (PRA), en perros con osteoartritis. J Veterinario Pasante Med. (2016) 30:756–63. doi: 10.1111/jvim.13948
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Radke, H, Joeris, A y Chen, M. Evaluación basada en la evidencia de las medidas de resultado informadas por el propietario para la atención ortopédica canina: una evaluación COSMIN de 6 instrumentos. Cirugía veterinaria. (2022) 51:244–53. doi: 10.1111/vsu.13753
30. Whitehead, AL, Julious, SA, Cooper, CL, y Campbell, MJ. Estimación del tamaño de la muestra para un ensayo piloto aleatorio para minimizar el tamaño de la muestra general del ensayo para el ensayo piloto externo y el ensayo principal para una variable de resultado continua. Stat Methods Med Res. (2016) 25:1057–73. doi: 10.1177/0962280215588241
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Campbell, I. Pruebas de Chi-cuadrado y Fisher-Irwin de tablas de dos por dos con recomendaciones de muestras pequeñas. Stat Med. (2007) 26:3661–75. doi: 10.1002/sim.2832
32. Richardson, JTE. El análisis de 2 × 2 tablas de contingencia, una vez más. Stat Med. (2011) 30:890–12. doi: 10.1002/sim.4116
33. Clark, RA, Shoaib, M, Hewitt, KN, Stanford, SC, y Bate, ST. Una comparación de InVivoStat con otros paquetes de software estadístico para el análisis de datos generados a partir de experimentos con animales. J Psicofarmaco. (2012) 26:1136–42. doi: 10.1177/0269881111420313
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. CHMP. (2015). Guía del Comité de Medicamentos de Uso Humano (CHMP) sobre el ajuste de las covariables basales en los ensayos clínicos. Disponible en: www.ema.europa.eu/contact.
35. Aarts, S, van den Akker, M, y Winkens, B. La importancia de los tamaños de los efectos. Eur J Gen Pract. (2014) 20:61–4. doi: 10.3109/13814788.2013.818655
36. Sullivan, GM y Feinn, R. Uso del tamaño del efecto: o por qué el valor de p no es suficiente. J Grad Med Educ. (2012) 4:279–82. doi: 10.4300/jgme-d-12-00156.1
37. Chen, H, Cohen, P, y Chen, S. ¿Qué tan grande es una gran razón de probabilidades? Interpretación de las magnitudes de odds ratios en estudios epidemiológicos. Commun stat simul comput. (2010) 39:860–4. doi: 10.1080/03610911003650383
38. Malek, S, Sample, SJ, Schwartz, Z, Nemke, B, Jacobson, PB, Cozzi, EM, et al. Efecto de la terapia analgésica en las medidas de resultados clínicos en un ensayo controlado aleatorizado con perros con osteoartritis de cadera propiedad de clientes. BMC Vet Res. (2012) 8:185. doi: 10.1186/1746-6148-8-185
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Lin, JH, Hung, CH, Han, DS, Chen, ST, Lee, CH, Sun, WZ, et al. Detección de acidosis: ¿Nocicepción o sngception? J Biomed Sci. (2018) 25:85. doi: 10.1186/s12929-018-0486-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Chen, H, Qin, Z, Zhao, J, He, Y, Ren, E, Zhu, Y, et al. Nanosondas teranósticas orientadas al cartílago y duales sensibles a MMP-13/pH para la obtención de imágenes de artrosis y terapia de precisión. Biomateriales. (2019) 225:119520. doi: 10.1016/j.biomaterials.2019.119520
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Redlich, K, y Smolen, JS. Pérdida ósea inflamatoria: patogenia e intervención terapéutica. Nat Rev Droga Discov. (2012) 11:234–50. doi: 10.1038/nrd366
42. Asaki, T, Wang, K, Luo, Y, Arendt-Nielsen, T, Graven-Nielsen, T y Arendt-Nielsen, L. Dolor de rodilla experimental inducido por ácido e hiperalgesia en humanos sanos. Exp Brain Res. (2018) 236:587–98. doi: 10.1007/s00221-017-5155-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: artrosis, tratamiento, dolor, perro, movilidad, modificador de la enfermedad, inflamación, fármaco
Cita: Sarig-Rapaport H, Krupnik S y Rowan TG (2024) Carbonato de calcio amorfo como un nuevo tratamiento potencial para la osteoartritis en perros: un estudio clínico piloto. Frente. Vet. Sci. 11:1381941. doi: 10.3389/fvets.2024.1381941
Recibido: 04 de febrero de 2024; Aceptado: 05 de junio de 2024;
Publicado: 25 de junio de 2024.
Editado por:
Michael Jaffe, Universidad Estatal de Mississippi, Estados Unidos
Revisado por:
Erin Miscioscia, Universidad de Florida, Estados
Unidos Natalie Butterfield, Imperial College London, Reino Unido
Derechos de autor © 2024 Sarig-Rapaport, Krupnik y Rowan. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Hadas Sarig-Rapaport, hadas@amorphical.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

