Carcinomatosis peritoneal con desmoplasia y metaplasia
Carcinomatosis peritoneal con desmoplasia y metaplasia ósea que imita la esclerosis peritoneal encapsulada en un gato: reporte de un caso
 So-Jeong Nam1
So-Jeong Nam1  Canción de Sun-Hye1
Canción de Sun-Hye1  Seung-Hyun Lee1
Seung-Hyun Lee1  So-Young Jeung1
So-Young Jeung1  Jae Gon Ah1
Jae Gon Ah1  Su-Hyung Lee2
Su-Hyung Lee2  Min-Ok Ryu3*†
Min-Ok Ryu3*†- 1Centro Médico Animal VIP KR, Seúl, República de Corea
- 2Sección de Ciencias Quirúrgicas, Centro de Biología Epitelial, Centro Médico de la Universidad de Vanderbilt, Nashville, TN, Estados Unidos
- 3Laboratorio de Medicina Interna, Departamento de Ciencias Clínicas Veterinarias, Facultad de Medicina Veterinaria, Universidad Nacional de Seúl, Seúl (República de Corea)
Un gato coreano macho castrado de pelo corto de 13 años presentó anorexia, letargo y abdomen severamente distendido, lo que sugiere ascitis. La abdominocentesis produjo líquido serosanguíneo. Posteriormente, se realizó un estudio diagnóstico, que incluyó análisis de sangre, análisis del líquido ascítico, estudios de imagen [radiografía, ecografía y tomografía computarizada (TC) y examen histopatológico, para identificar la causa subyacente. Los estudios de imagen revelaron características de la esclerosis peritoneal encapsulante (EPS) como engrosamiento peritoneal, hebras de grasa y calcificación. Durante la laparotomía, se observaron membranas fibrosas que encapsulan los órganos abdominales y ascitis, y se detectaron múltiples regiones calcificadas en la pared abdominal. El análisis histopatológico confirmó el diagnóstico de neoplasias malignas invasivas poco diferenciadas, que se clasificaron además como carcinomatosis con base en los resultados positivos de citoqueratina y vimentina negativa. Hasta donde sabemos, este es el primer reporte de carcinomatosis peritoneal esclerosante con metaplasia ósea en un gato.
1 Introducción
La esclerosis peritoneal encapsulante (EPS), también llamada peritonitis encapsulante esclerosante (SEP), es una afección rara caracterizada por un peritoneo fibroso engrosado que recubre los órganos abdominales y descrita por primera vez en medicina humana (1), que a menudo se presenta con ascitis. En medicina humana, la EPS inducida por diálisis peritoneal es la más común y la cirugía abdominal o un cuerpo extraño pueden causar EPS (2). La EPS idiopática también se ha descrito en algunos casos en medicina humana (2). En medicina veterinaria, la EPS se clasifica como primaria (idiopática) o secundaria (3, 4) como en humanos. En felinos, se han notificado casos de EEP con EEP idiopática, infección o leiomiosarcoma (3-5). En las imágenes, el EPS se presenta como distensión abdominal, varamiento de grasa mesentérica, líquido abdominal loculado, asas intestinales acumuladas y calcificación tanto en medicina humana (6) como en medicina veterinaria (5).
Presentamos el caso de un gato coreano macho castrado de pelo corto de 13 años de edad en el que se sospechó EPS con base en radiografía, ecografía y tomografía computarizada (TC); sin embargo, la histopatología reveló un diagnóstico inesperado de carcinomatosis peritoneal esclerosante (CCP) con metaplasia ósea. Dada la naturaleza desafiante del diagnóstico de EPS y sus posibles implicaciones terapéuticas, nuestro objetivo fue explorar el proceso diagnóstico y resaltar la importancia de considerar el SPC con metaplasia ósea como un diagnóstico diferencial, cuando se sospecha EPS en función de los hallazgos de imagen. Este informe de caso proporciona información clínica valiosa, subrayando la importancia del análisis histopatológico para establecer un diagnóstico preciso y guiar el manejo adecuado de los casos complicados.
2 Descripción del caso
Un gato coreano macho castrado de pelo corto de 13 años presentó anorexia y letargo que había estado en curso durante al menos 2 semanas. El gato se mantenía dentro de casa y nunca lo habían sacado a pasear al aire libre. Se administraron vacunas felinas básicas (herpesvirus felino-1, calicivirus felino, parvovirus felino, Chlamydia psittaci) durante su etapa adulta joven. Si bien la desparasitación se realizaba anualmente, no se aplicaban medidas preventivas contra ectoparásitos. No había antecedentes de traumatismos. El gato solo se había sometido a una cirugía dos veces, incluida la castración cuando tenía menos de 1 año y la extirpación de verrugas hace 2 años. La verruga, localizada en el empeine de la extremidad anterior derecha, medía menos de 0,5 cm de diámetro, estaba encapsulada y no creció durante varios años, lo que sugiere que se consideraba un tumor benigno.
El gato parecía deprimido, pero respondía a la presentación. A la exploración física se observaron signos vitales normales, excepto abdomen severamente distendido que presentaba fluctuaciones sugestivas de ascitis. Se realizó abdominocentesis, resultando en la extracción de 1 litro de líquido serosanguíneo. Posteriormente se realizaron análisis de sangre y de fluidos para identificar las causas subyacentes de la ascitis.
Todos los resultados de los análisis de sangre estuvieron dentro del rango normal, excepto un nivel sérico de dimetilarginina simétrica ligeramente elevado de 21 μg/dl (rango de referencia: 0-14 μg/dl). El nivel de NT-proBNP fue inferior a 50 pmol/L (rango de referencia: 0-270 pmol/L), descartando una etiología cardiogénica de la ascitis. Además, los resultados de las pruebas de antígeno del virus de la leucemia felina (FeLV), anticuerpos contra el virus de la inmunodeficiencia felina (FIV) y antígeno del gusano del corazón utilizando el kit de prueba triple felina SNAP (laboratorios IDEXX, Westbrook, ME, Estados Unidos) fueron negativos. En el análisis del líquido ascítico, el recuento total de células nucleadas (TNCC) fue de 2040 células/μL, y la proteína total (TP) fue de 3,4 g/dL, confirmando que la ascitis es un trasudado modificado. En citología, el líquido ascítico contenía un pequeño número de macrófagos, neutrófilos, linfocitos y glóbulos rojos (RBC), sin ninguna evidencia de células neoplásicas. Además, las pruebas de PCR para coronavirus felino y el cultivo microbiano del líquido ascítico arrojaron resultados negativos, lo que indica una baja posibilidad de peritonitis infecciosa felina (PIF) o peritonitis séptica como etiologías.
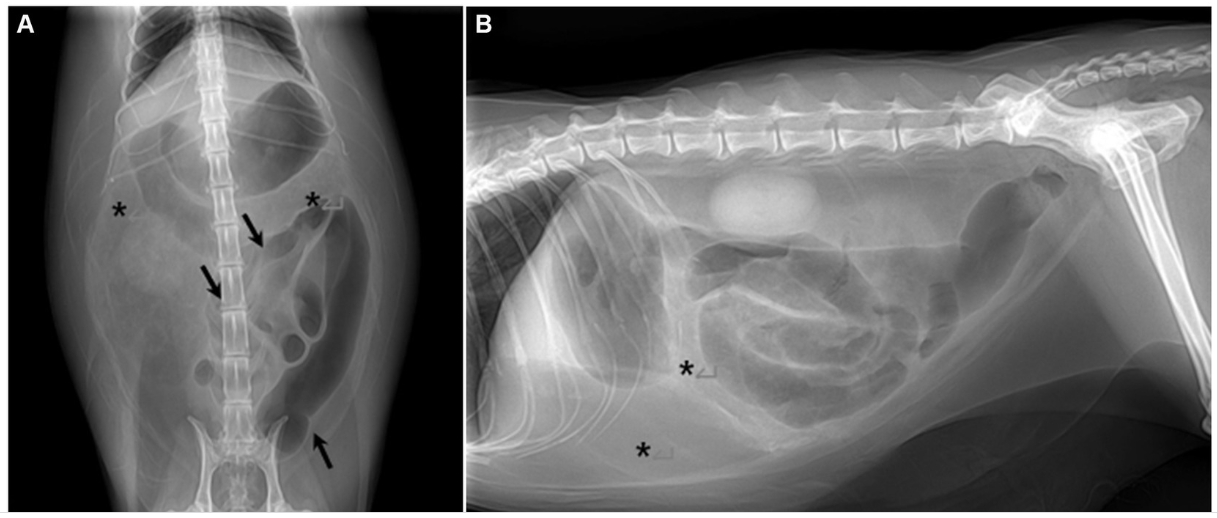
Las radiografías posteriores a la abdominocentesis revelaron una opacidad grasa anormalmente heterogéneamente alta en las áreas abdominal superior y media-inferior derecha (Figura 1). Además, los intestinos llenos de gas se desplazaron hacia el abdomen izquierdo. La ecografía abdominal reveló un mesenterio y epiplón intestinal multilobulado con ecogenicidad grasa focalmente aumentada y una pequeña cantidad de líquido libre en la cavidad abdominal (Figura 1). Además, parte del peritoneo parietal abdominal estaba engrosado y el peritoneo mesentérico del abdomen derecho estaba calcificado focalmente, mostrando un revestimiento hiperecogénico con un fuerte sombreado acústico. Los segmentos intestinales llenos de gas estaban ligeramente corrugados.
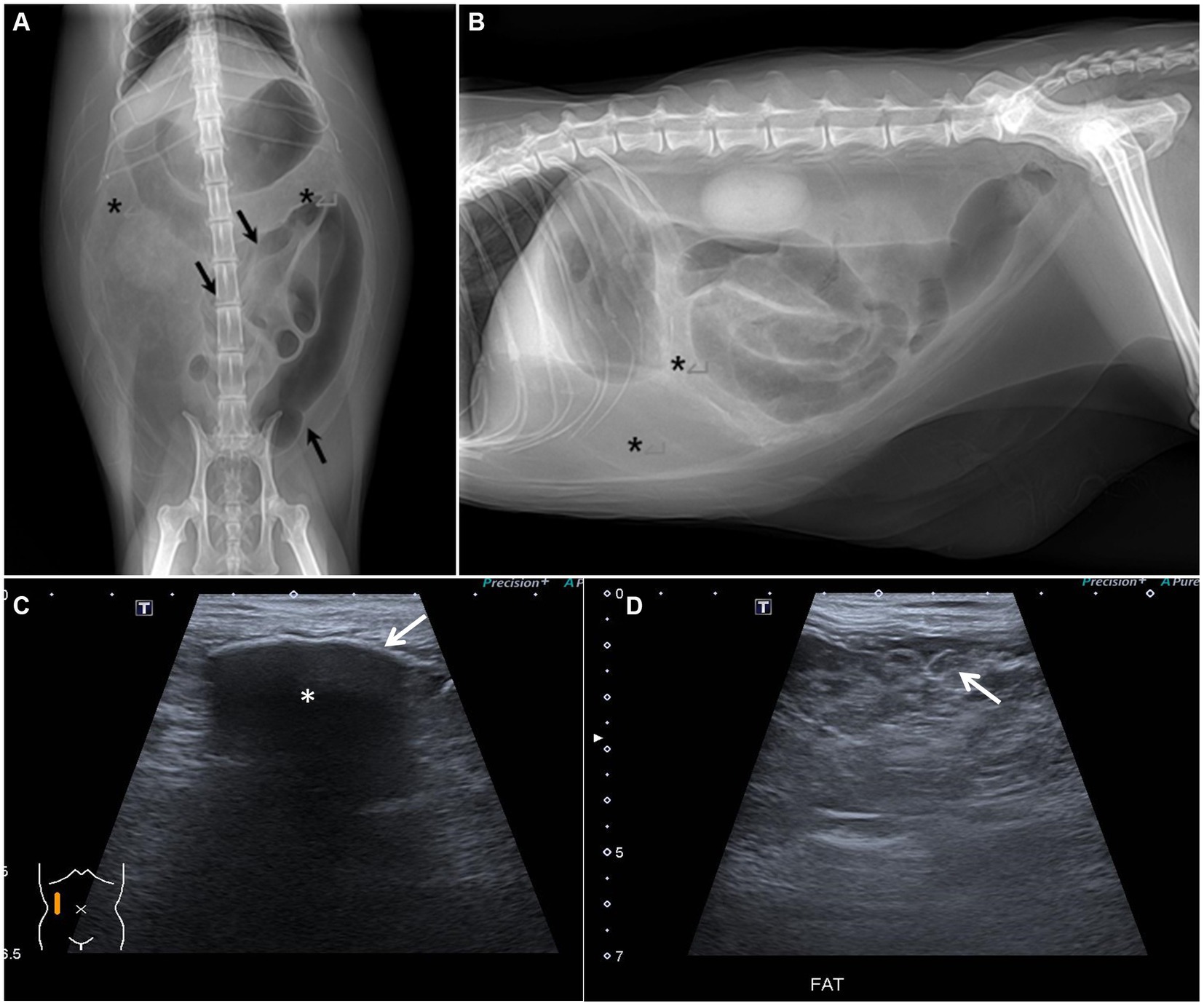 Figura 1. Radiografías abdominales y ecografías. (A,B) Radiografías abdominales después de abdominocentesis. (A) Imagen ventro-dorsal. (B) Imagen lateral derecha. El intestino lleno de gas se desplaza y se acumula hacia la izquierda (flecha negra). La opacidad que se supone que es grasa omental y mesentérica se incrementa de forma heterogénea (asteriscos). (C,D) Ecografía abdominal. (C) Se sospechó calcificación peritoneal debido a un cambio peritoneal hiperecogénico (flecha blanca) con fuerte sombreado acústico (asterisco). (D) La grasa peritoneal fue multilobulada y mostró una ecogenicidad heterogéneamente alta (flecha blanca).
Figura 1. Radiografías abdominales y ecografías. (A,B) Radiografías abdominales después de abdominocentesis. (A) Imagen ventro-dorsal. (B) Imagen lateral derecha. El intestino lleno de gas se desplaza y se acumula hacia la izquierda (flecha negra). La opacidad que se supone que es grasa omental y mesentérica se incrementa de forma heterogénea (asteriscos). (C,D) Ecografía abdominal. (C) Se sospechó calcificación peritoneal debido a un cambio peritoneal hiperecogénico (flecha blanca) con fuerte sombreado acústico (asterisco). (D) La grasa peritoneal fue multilobulada y mostró una ecogenicidad heterogéneamente alta (flecha blanca).
El gato recibió fluidoterapia, tratamiento antibiótico y bloqueador H2 de acuerdo con el manejo de la colitis. Además, para abordar el problema de la anorexia, se insertó una sonda nasoesofágica para la alimentación enteral.
La tomografía computarizada (TC; Brivo CT 385, GE Hangwei Medical System Co., Ltd., Beijing, China) se realizó bajo anestesia general en decúbito esternal al día siguiente para lograr un diagnóstico preciso y para la planificación quirúrgica (Figura 2). Para las tomografías computarizadas, se realizó anestesia general durante un total de 1 h y se midieron los signos vitales principales a intervalos de 5 minutos. Se utilizaron butorfanol 0,2 mg/kg y midazolam 0,1 mg/kg como premedicación, y la inducción se realizó con propofol 6 mg/kg IV y isoflurano para el mantenimiento. Los parámetros de adquisición fueron los siguientes: modo helicoidal, 120 kVp, exposición 120-200 mAs, espesor de corte de 2,5 mm, espaciado de 2,5 mm. La inyección de contraste se realizó manualmente y las imágenes se adquirieron 35 s después de la inyección en bolo. Se realizó un reformateo multiplanar (MPR) para obtener imágenes planas transversales, sagitales y dorsales con los siguientes parámetros; 2 mm de grosor de la rebanada, 2 mm de espaciado. Se observó un trenzamiento de grasa mesentérica y omental como múltiples hiperatenuaciones lineales agrupadas en la cavidad abdominal craneolateral derecha. Esto dio lugar a un desplazamiento caudolateral izquierdo de los intestinos apilados y derrame peritoneal. Algunos intestinos delgados estaban llenos de gas, y el duodeno descendente estaba severamente dilatado con líquido gástrico retenido. Se observó un fuerte realce en el peritoneo parietal y visceral engrosado alrededor de la vejiga urinaria. Se observó una calcificación extensa en el peritoneo parietal ventral y pequeños focos calcificados en el epiplón y el mesenterio. Sobre la base de estos hallazgos de la TC, se sospechó que el EPS había causado la ascitis.
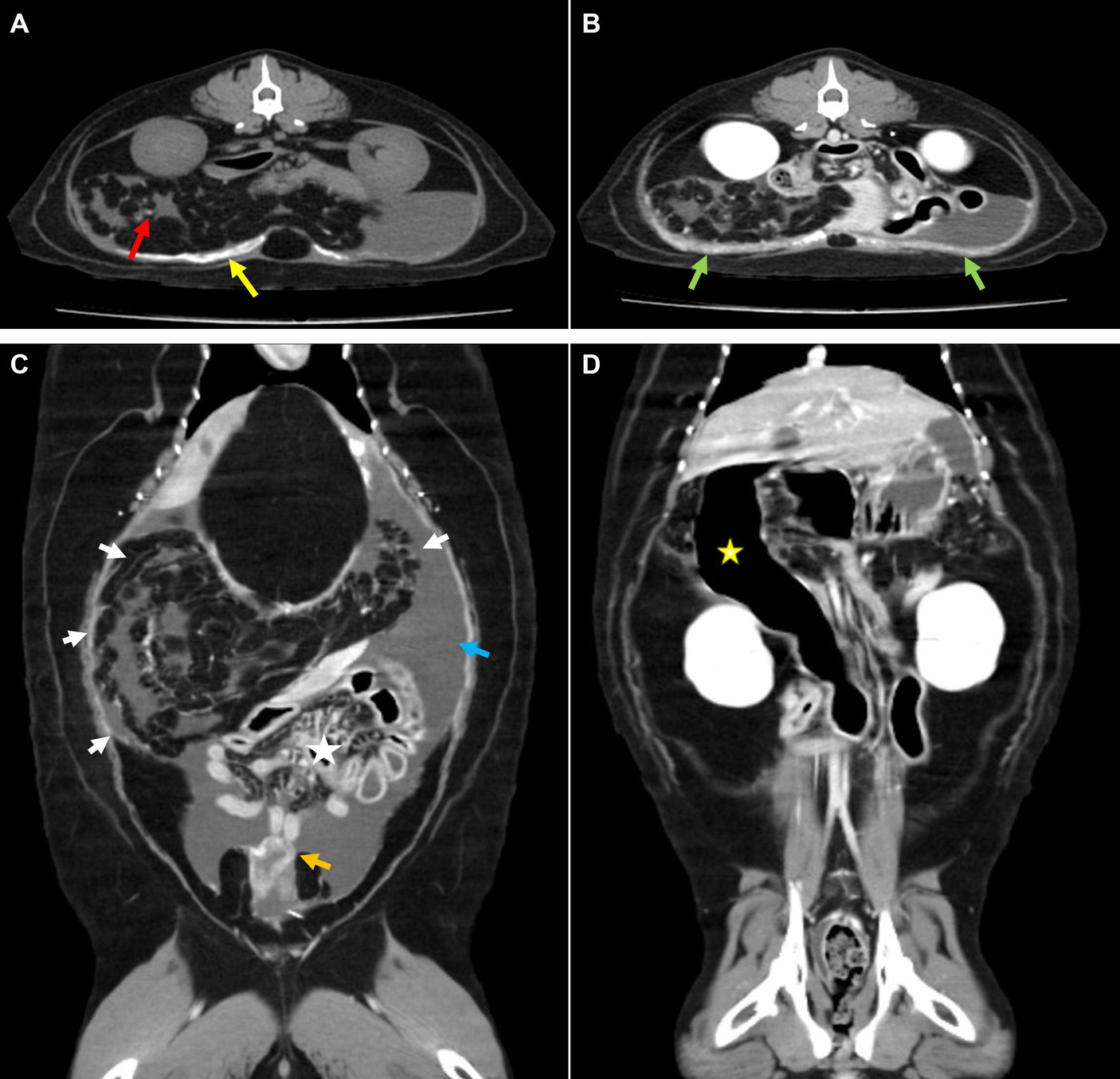 Figura 2. Tomografía computarizada. (A) Imágenes de TC previas al contraste y (B-D) posteriores al contraste. (A) Calcificación amplia en el peritoneo parietal (flecha amarilla) y pequeños focos calcificados en el mesenterio (flecha roja). (B) El peritoneo engrosado mostró una fuerte realce (flecha verde). (C) Se observó epiplón y mesenterio acumulados en la cavidad abdominal craneolateral con varamiento de grasa (flecha blanca), lo que provocó desplazamiento intestinal hacia la parte inferior del abdomen (asterisco). También se detectó derrame peritoneal circundante (flecha azul) y engrosamiento del peritoneo visceral adyacente a la vejiga urinaria (flecha naranja). (D) Se identificó un duodeno descendente anormalmente dilatado con gas (asterisco amarillo).
Figura 2. Tomografía computarizada. (A) Imágenes de TC previas al contraste y (B-D) posteriores al contraste. (A) Calcificación amplia en el peritoneo parietal (flecha amarilla) y pequeños focos calcificados en el mesenterio (flecha roja). (B) El peritoneo engrosado mostró una fuerte realce (flecha verde). (C) Se observó epiplón y mesenterio acumulados en la cavidad abdominal craneolateral con varamiento de grasa (flecha blanca), lo que provocó desplazamiento intestinal hacia la parte inferior del abdomen (asterisco). También se detectó derrame peritoneal circundante (flecha azul) y engrosamiento del peritoneo visceral adyacente a la vejiga urinaria (flecha naranja). (D) Se identificó un duodeno descendente anormalmente dilatado con gas (asterisco amarillo).
Después de la exploración por TC, se observó una temperatura elevada (temperatura corporal de 40 °C) en el control vital regular y se normalizó después del enfriamiento físico. Durante la hospitalización se administró fluidoterapia, antibióticos, antieméticos, inhibidor de la bomba de protones, estimulador del apetito y analgésicos (butorfanol 0,2 mg/kg cada 6 h).
Dos días después de la tomografía computarizada, para determinar la causa de la sospecha de EPS, se realizaron múltiples biopsias por laparotomía. Se utilizó cefazolina 30 mg/kg IV e hidromorfona 0,1 mg/kg IV como premedicación para la laparotomía y propofol 6 mg/kg IV como agente de inducción. Se realizó anestesia general durante un total de 90 minutos desde la inducción hasta la extubación del tubo endotraqueal, se midieron los principales signos vitales a intervalos de 5 minutos. Se utilizó isoflurano para el mantenimiento de la anestesia y la profundidad se ajustó según el tipo de procedimiento y el signo vital del paciente. Tras la incisión de la pared abdominal, se observó una membrana fibrosa que conectaba la pared con los órganos abdominales encapsulados y el líquido ascítico (Figura 3). Además, la grasa del epiplón se calcificó y condensó en la dirección craneal. La porción parietal de la pared abdominal también presentaba signos de calcificación, lo que motivó la recolección de muestras de biopsia de estas áreas. Los nódulos anormales de varios tamaños se distribuyeron difusamente en el peritoneo y la pared serosa intestinal. El examen macroscópico reveló además una pared serosa de la vejiga eritematosa y un páncreas contraído, lo que concuerda con los hallazgos de la TC.
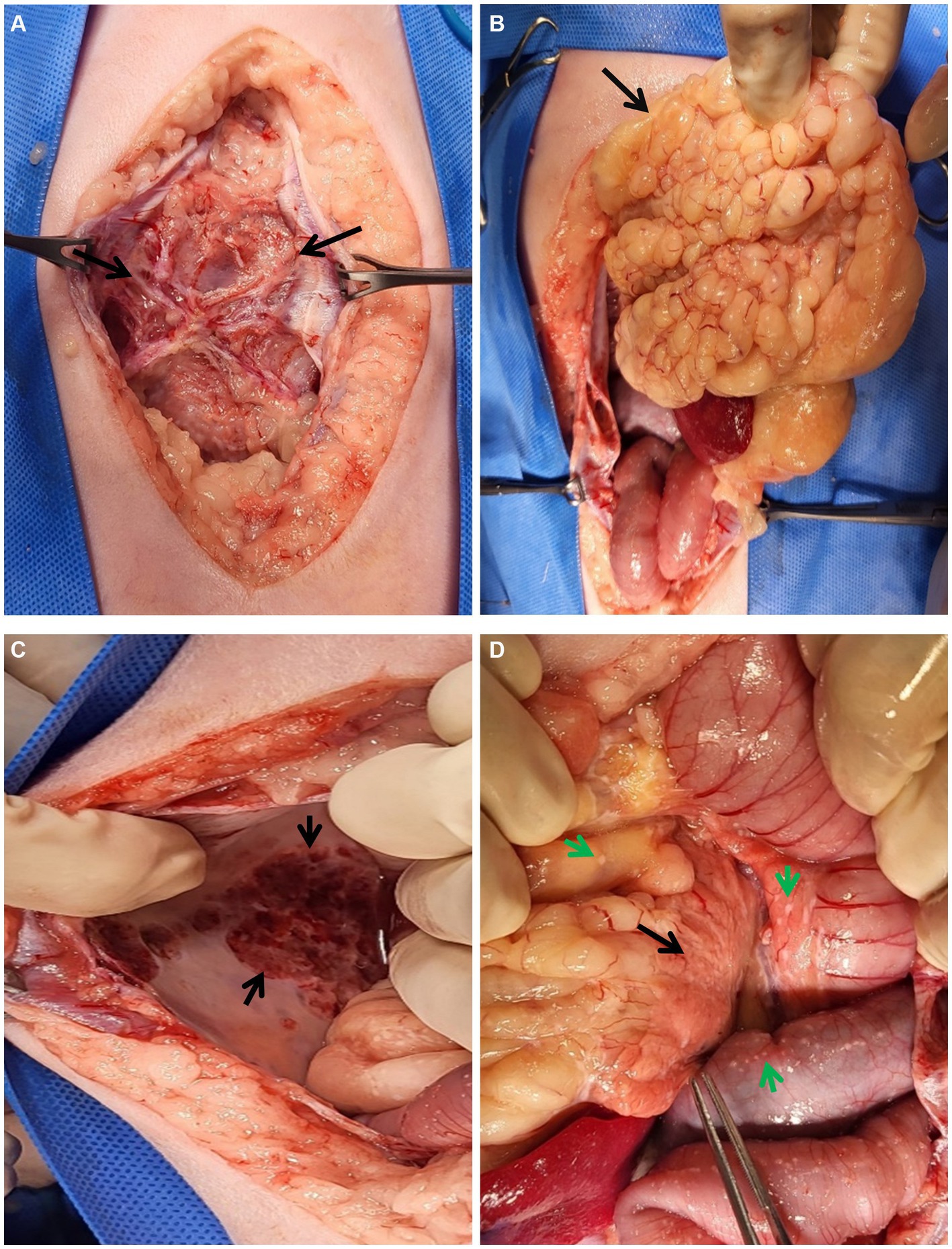 Figura 3. Lesiones macroscópicas durante la laparotomía. (A-D) Lesiones macroscópicas de los órganos abdominales durante la laparotomía. (A) Una membrana fibrosa inusual (flechas negras) cubre los órganos abdominales y los fluidos. Después de la incisión de la membrana, (B) el epiplón (flecha negra) se veía anormalmente lobulado y cranealmente condensado. (C) La pared peritoneal parietal estaba calcificada (flecha negra). (D) Se observaron múltiples placas fibrosas (flechas verdes) en todo el peritoneo, especialmente en los intestinos y el abdomen. El páncreas (flecha negra) también parecía estar atrofiado.
Figura 3. Lesiones macroscópicas durante la laparotomía. (A-D) Lesiones macroscópicas de los órganos abdominales durante la laparotomía. (A) Una membrana fibrosa inusual (flechas negras) cubre los órganos abdominales y los fluidos. Después de la incisión de la membrana, (B) el epiplón (flecha negra) se veía anormalmente lobulado y cranealmente condensado. (C) La pared peritoneal parietal estaba calcificada (flecha negra). (D) Se observaron múltiples placas fibrosas (flechas verdes) en todo el peritoneo, especialmente en los intestinos y el abdomen. El páncreas (flecha negra) también parecía estar atrofiado.
Las muestras de biopsia obtenidas del epiplón, las paredes abdominales calcificadas y los tejidos fibrosos adheridos a las paredes abdominales se enviaron para su examen histopatológico en los laboratorios IDEXX (Westbrook, ME, Estados Unidos). La tinción con hematoxilina y eosina (H&E) reveló neoplasias malignas invasivas poco diferenciadas (recuento mitótico de 5 a 8 en 10 de alta potencia de 0,237 mm2 (Figuras 4A a C). Las células neoplásicas tenían bordes celulares indistintos, una cantidad pequeña a moderada de citoplasma eosinófilo, núcleos redondos con cromatina finamente punteada y uno o dos nucléolos distintos. Los tejidos fibrosos adheridos a la pared abdominal estaban compuestos por tejido conectivo adiposo y abundante estroma escirroso con islas y grupos de células neoplásicas poco diferenciadas. En secciones del epiplón y de la pared abdominal calcificada, se observó de forma prominente la formación ósea caracterizada por trabéculas óseas y células dentro de las lagunas en las proximidades de las células neoplásicas.
 Figura 4. Características histopatológicas de las muestras de biopsia. (A,B) Las células neoplásicas forman pequeños nidos o islas, rodeados de fibrosis espesa con mineralización basófila o matriz mucinosa inter o intracelular. Las células neoplásicas se caracterizan por un grado moderado de atipia celular, una alta relación nuclear-citoplasmática, nucléolos prominentes y un índice mitótico aumentado. Barra de escala = 100 μm para (A) o 50 μm para (B). (C) Las trabéculas óseas están presentes en el centro de la muestra de tejido de la pared abdominal calcificada, cerca de los grupos de células neoplásicas. Una serie de células estromales en forma de huso y glóbulos rojos se intercalan entre las trabéculas óseas. Barra de escala = 50 μm. (D-F) Se presenta la tinción inmunohistoquímica de WT1 (D), citoqueratina (E) y vimentina (F) en células neoplásicas dentro de la grasa del epiplón. Los recuadros revelaron células cancerosas con una expresión negativa de WT1 (D), mientras que el resultado positivo típico de WT1 debería exhibir una tinción nuclear pardusca. Los recuadros demostraron que las células cancerosas positivas para citoqueratina (rojo, E) son completamente negativas para la vimentina (F), que se expresa fuertemente en las células estromales que rodean a las células cancerosas. La tinción de citoqueratina y vimentina se observa en el citoplasma, indicada por la presencia de partículas de color rojo, lo que significa positividad. Barra de escala = 100 μm.
Figura 4. Características histopatológicas de las muestras de biopsia. (A,B) Las células neoplásicas forman pequeños nidos o islas, rodeados de fibrosis espesa con mineralización basófila o matriz mucinosa inter o intracelular. Las células neoplásicas se caracterizan por un grado moderado de atipia celular, una alta relación nuclear-citoplasmática, nucléolos prominentes y un índice mitótico aumentado. Barra de escala = 100 μm para (A) o 50 μm para (B). (C) Las trabéculas óseas están presentes en el centro de la muestra de tejido de la pared abdominal calcificada, cerca de los grupos de células neoplásicas. Una serie de células estromales en forma de huso y glóbulos rojos se intercalan entre las trabéculas óseas. Barra de escala = 50 μm. (D-F) Se presenta la tinción inmunohistoquímica de WT1 (D), citoqueratina (E) y vimentina (F) en células neoplásicas dentro de la grasa del epiplón. Los recuadros revelaron células cancerosas con una expresión negativa de WT1 (D), mientras que el resultado positivo típico de WT1 debería exhibir una tinción nuclear pardusca. Los recuadros demostraron que las células cancerosas positivas para citoqueratina (rojo, E) son completamente negativas para la vimentina (F), que se expresa fuertemente en las células estromales que rodean a las células cancerosas. La tinción de citoqueratina y vimentina se observa en el citoplasma, indicada por la presencia de partículas de color rojo, lo que significa positividad. Barra de escala = 100 μm.
La inmunohistoquímica (IHQ) se llevó a cabo en los laboratorios IDEXX para categorizar los tipos de células neoplásicas. La citoqueratina (AE1/AE3) y la vimentina se utilizaron como tinciones para clasificar aún más el tipo de tumor como carcinoma, sarcoma o mesotelioma. El diagnóstico de mesotelioma suele implicar positividad para los marcadores de citoqueratina y vimentina. Por el contrario, si las células neoplásicas son positivas solo para citoqueratina, sugiere carcinoma, mientras que la positividad solo para vimentina indica sarcoma. Los resultados revelaron que más del 90% de las células neoplásicas invasivas y pobremente diferenciadas exhibieron una fuerte inmunorreactividad a la citoqueratina (AE1/AE3) en el citoplasma (Figura 4E). Sin embargo, solo unas pocas células dentro de la población de células neoplásicas dieron positivo para vimentina (Figura 4F), lo que se alinea con las características del carcinoma. Además, se realizó inmunostaing para el tumor de Wilm 1 (WT1) para excluir definitivamente el mesotelioma, y el resultado fue negativo (Figura 4D).
Como no se observó ningún tumor primario sospechoso durante la ecografía, la tomografía computarizada o la laparotomía, el gato fue diagnosticado con carcinomatosis peritoneal. Además, teniendo en cuenta la presencia de tejido fibroso que encapsula los órganos abdominales y la formación ósea, se estableció el diagnóstico de CPS con metaplasia ósea. Desafortunadamente, debido al rápido deterioro del paciente después de la laparotomía, finalmente se realizó la eutanasia y no se inició ningún ensayo de tratamiento. La eutanasia se llevó a cabo mediante la administración de T-61™ (Intervet International GmbH, Alemania) a una dosis de 0,5 mL/kg después de la anestesia con un bolo IV de propofol de 6 mg/kg. No se pudo realizar una autopsia, ya que el propietario se negó.
3 Discusión
Este informe de caso destaca los desafíos diagnósticos encontrados en un paciente felino que presenta ascitis y sospecha de EPS en función de las características de imagen. Su importancia clínica radica en la confirmación histopatológica inesperada de la CPS con metaplasia ósea, enfatizando la importancia de considerar la CPS como un diagnóstico diferencial cuando se sospecha de EPS en las imágenes.
En los seres humanos, los hallazgos distintivos de la EPS en la TC incluyen engrosamiento peritoneal, acumulación de líquido loculado, calcificación peritoneal, anclaje o estera intestinal, realce peritoneal y engrosamiento ocasional de la pared intestinal (6). Algunos estudios han sugerido que la aparición de la TC, junto con los síntomas clínicos, puede permitir un diagnóstico seguro de EEP, reduciendo la necesidad de confirmación histopatológica (6-8).
Se dispone de información limitada sobre las características imagenológicas del EPS en medicina veterinaria. Un estudio de animales con presunta EPS incluyó siete perros y dos gatos, todos los cuales presentaron ascitis (5). Las características radiográficas de este estudio incluyeron la acumulación de asas intestinales y distensión abdominal, mientras que los hallazgos ultrasonográficos mostraron líquido ecogénico, asas intestinales recogidas o corrugadas y ganglios linfáticos abdominales agrandados. Todos los pacientes animales que se sometieron a TC presentaron varamiento de grasa mesentérica. Otros informes de casos felinos también mostraron características de imagen similares de asas corrugadas del intestino delgado, estómagos o intestinos dilatados llenos de líquido, ganglios linfáticos agrandados en la ecografía y un abdomen distendido lleno de ascitis en las radiografías (3, 9).
En nuestro caso, el gato presentaba características imagenológicas sugestivas de EPS, incluyendo un intestino apilado unilateral en la radiografía, y un mesenterio intestinal multilobulado y epiplón con aumento de la ecogenicidad grasa, engrosamiento peritoneal con calcificación e intestinos corrugados en la ecografía. Además, los hallazgos de la TC revelaron varamiento de grasa mesentérica y epiplónica, intestinos apilados unilaterales, intestinos llenos de gas, engrosamiento peritoneal y calcificación. Sobre la base de estos hallazgos de imágenes combinadas, el paciente fue presuntamente diagnosticado con EPS. Durante la laparotomía, observamos una membrana fibrosa que encapsula los órganos abdominales y la ascitis, similar a las características macroscópicas previamente reportadas de otro gato con EPS (5).
El examen histopatológico y la IHQ de las muestras de biopsia fueron cruciales para proporcionar un diagnóstico definitivo, revelando neoplasias malignas invasivas poco diferenciadas, positivas para citoqueratina (AE1/AE3) y negativas para vimentina, y por lo tanto compatibles con carcinoma. En este estudio, no se identificaron tumores primarios sospechosos durante los exámenes de TC o ecografía, ni se detectaron en la inspección visual durante la laparotomía. Por lo tanto, este caso fue diagnosticado con carcinomatosis peritoneal, desmoplasia y metaplasia ósea. Hasta donde sabemos, hasta la fecha no se han reportado casos de carcinomatosis peritoneal con metaplasia ósea, calcificación o mineralización en la literatura veterinaria. En dos estudios retrospectivos de las características de imagen de la carcinomatosis peritoneal felina, ninguno de los 24 gatos examinados mostró mineralización en radiografías, ecografías o tomografías computarizadas (10, 11). En este reporte se presenta el primer caso documentado de carcinomatosis peritoneal con calcificación o EPS en un gato.
Se presume que la etiología de la desmoplasia y la metaplasia ósea en la carcinomatosis peritoneal es similar a los mecanismos por los que se producen la desmoplasia y la metaplasia ósea en el carcinoma. La patogenia de la desmoplasia en el carcinoma implica interacciones complejas entre las células neoplásicas y el microambiente tumoral, lo que incluye un papel importante desempeñado por los fibroblastos asociados al cáncer (CAF) (12, 13). Los CAF secretan proteínas de la matriz extracelular (MEC), como el colágeno y la fibronectina, y moléculas de señalización que promueven la remodelación tisular y la angiogénesis, lo que puede facilitar el crecimiento y la invasividad del tumor (12). En medicina humana, se demostró que la gravedad de la desmoplasia está relacionada con un pronóstico negativo en numerosos tipos de carcinoma, como el adenocarcinoma ductal pancreático, el carcinoma colorrectal y el adenocarcinoma endometrioide uterino (14-17). En este caso felino, dado el pronunciado cambio escirrótico, es probable que se asocie con el rápido deterioro de la condición del paciente. En medicina humana, algunos estudios mostraron que los cánceres metastásicos tenían niveles significativos de desmoplasia comparables a los observados en tumores primarios, como el adenocarcinoma ductal pancreático y el cáncer colorrectal (14–16). La desmoplasia sustancial observada en este caso felino de carcinomatosis peritoneal se considera similar en su mecanismo a la desmoplasia en lesiones metastásicas.
La formación ósea en el tumor se puede clasificar en tres tipos; osteogénesis en el osteosarcoma, diferenciación osteoblástica en el carcinoma sarcomatoide y metaplasia ósea (18). Se han notificado casos de carcinoma con metaplasia ósea en carcinoma oral de células escamosas, carcinoma gastrointestinal y linfosarcoma tímico en felinos (19–22). Si bien no existe un mecanismo establecido para la metaplasia ósea en ningún tipo de carcinoma en pacientes felinos, se cree que la mucina, la osteopontina, MAPK, P53 y CD44 producidas por las células tumorales están involucradas en la metaplasia ósea en el carcinoma intestinal humano (23, 24) y la transformación inducida por proteínas morfogenéticas óseas (BMP) de las células estromales en osteoblastos, la actividad de la fosfatasa alcalina, los niveles locales de calcio y fosfato están involucrados en la metaplasia ósea en carcinoma urotelial humano (18). Dada la extensa desmoplasia observada en este caso, es plausible considerar la posibilidad de metaplasia ósea resultante de la transformación de las células estromalas. Sería útil realizar más investigaciones que examinen los mecanismos relacionados con la metaplasia ósea en la carcinomatosis peritoneal en gatos.
En conclusión, este caso clínico ofrece información clínica valiosa sobre el proceso diagnóstico de un paciente felino con sospecha de SPE, donde el análisis histopatológico reveló un diagnóstico inesperado de SPC. Los veterinarios deben considerar la CPS como parte del diagnóstico diferencial cuando se encuentren con casos de sospecha de EEP, especialmente cuando las características radiológicas y clínicas son atípicas o no concluyentes. El intercambio de experiencias clínicas similares mejorará la precisión diagnóstica y potencialmente mejorará los enfoques terapéuticos para las enfermedades peritoneales felinas.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
Se obtuvo el consentimiento informado por escrito del propietario para la publicación de este informe de caso.
Contribuciones de los autores
S-JN: Escritura – borrador original, Conceptualización, Investigación. S-HS: Análisis formal, Escritura – borrador original. Se-HL: Investigación, Escritura – revisión y edición. S-YJ: Investigación, Escritura – Revisión y Edición. JA: Administración de proyectos, redacción, revisión y edición. Su-NS: Análisis formal, Redacción – borrador original, Redacción – revisión y edición. M-OR: Conceptualización, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Danford, CJ, Lin, SC, Smith, MP, y Wolf, JL. Esclerosis peritoneal encapsulante. Mundo J Gastroenterol. (2018) 24:3101–11. doi: 10.3748/wjg.v24.i28.3101
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Machado, NO. Peritonitis encapsulante esclerosante: revisión. Sultán Qaboos Univ Med J. (2016) 16:E142-51. doi: 10.18295/squmj.2016.16.02.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Kiniger, C, Janssen, JN, Lederer, KA, Lipnik, K y Doulidis, PG. Peritonitis encapsulante esclerosante en gatos: un informe de dos casos y revisión de la literatura. JFMS Open Rep. (2023) 9:20551169231178447. doi: 10.1177/20551169231178447
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Hardie, EM, Rottman, JB y Levy, JK. Peritonitis encapsulante esclerosante en cuatro perros y un gato. Cirugía veterinaria. (1994) 23:107–14. doi: 10.1111/j.1532-950x.1994.tb00454.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Gremillet, BCH, Porsmoguer, C, Bolen, G, Billen, F, Noël, S, Brutinel, F, et al. Hallazgos imagenológicos en perros y gatos con presunta peritonitis encapsulante esclerosante. Front Vet Sci. (2022) 9:891492. doi: 10.3389/fvets.2022.891492
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. George, C, Al-Zwae, K, Nair, S, y Cast, JEI. Apariencia en tomografía computarizada de peritonitis encapsulante esclerosante. Clin Radiol. (2007) 62:732–7. doi: 10.1016/j.crad.2007.01.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Tannoury, JN, y Abboud, BN. Peritonitis encapsulante esclerosante idiopática: capullo abdominal. Mundo J Gastroenterol. (2012) 18:1999–2004. doi: 10.3748/wjg.v18.i17.1999
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Zhang, Z, Zhang, M, y Li, L. Peritonitis encapsulante esclerosante: tres informes de casos y revisión de la literatura. J Int Med Res. (2020) 48:300060520949104. doi: 10.1177/0300060520949104
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Sonck, L, Chiers, K, Ducatelle, R, y Van Brantegem, L. Encapsulación de la esclerosis peritoneal en un gato joven. Representante de casos de Vet Rec. (2018) 6:E000541. doi: 10.1136/vetreccr-2017-000541
10. Wu, B, Kastl, B, Cino-Ozuna, AG, Springer, NL, Thakkar, R, Biller, D, et al. Carcinoma de células renales sarcomatoide felino con carcinomatosis peritoneal y derrame. J Vet Diagn Investig. (2022) 34:153–9. doi: 10.1177/10406387211054826
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Weston, PJ, Baines, SJ, Finotello, R, y Mortier, JR. Características clínicas, TC y ultrasonográficas de la carcinomatosis y sarcomatosis pleural y peritoneal canina y felina. Ecografía Radiol Veterinaria. (2021) 62:331–41. doi: 10.1111/vru.12951
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Franco, OE, Shaw, AK, Strand, DW y Hayward, SW. Fibroblastos asociados al cáncer en la patogénesis del cáncer. Semin Cell Dev Biol. (2010) 21:33–9. doi: 10.1016/j.semcdb.2009.10.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Lee, JI, y Campbell, JS. Papel de la desmoplasia en el colangiocarcinoma y el carcinoma hepatocelular. J Hepatol. (2014) 61:432–4. doi: 10.1016/j.jhep.2014.04.014
14. Ao, T, Kajiwara, Y, Yonemura, K, Shinto, E, Mochizuki, S, Okamoto, K, et al. Consistencia morfológica de las reacciones desmoplásicas entre la lesión primaria de cáncer colorrectal y las lesiones metastásicas asociadas. Arco de Virchows. (2020) 477:47–55. doi: 10.1007/s00428-019-02742-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Whatcott, CJ, Diep, CH, Jiang, P, Watanabe, A, LoBello, J, Sima, C, et al. Desmoplasia en tumores primarios y lesiones metastásicas de cáncer de páncreas. Clin Cáncer Res. (2015) 21:3561–8. doi: 10.1158/1078-0432.ccr-14-1051
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Nakayama, H, Ohuchida, K, Yoshida, M, Miyazaki, T, Takesue, S, Abe, T, et al. El grado de desmoplasia en las lesiones metastásicas de los ganglios linfáticos se relaciona con el tamaño de la lesión y el mal pronóstico en los pacientes con cáncer de páncreas. Oncol Lett. (2017) 14:3141–7. doi: 10.3892/ol.2017.6549
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Wei, S, Conner, MG, Zhang, K, Siegal, GP y Novak, L. Reacciones estromales yuxtatumorales en el adenocarcinoma endometrioide uterino y su importancia pronóstica. Int J Gynecol Pathol. (2010) 29:562–7. doi: 10.1097/PGP.0b013e3181e36321
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Razafimahefa, J, Gosset, C, Mongiat-Artus, P, Andriamampionona, TF y Verine, J. Metaplasia ósea estromal en el carcinoma urotelial de vejiga: informe de un caso raro y revisión de la literatura. Diagn Pathol. (2019) 14:75. doi: 10.1186/s13000-019-0851-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Jung, JH, Kim, NY, Yang, Y, Seo, D, Choi, G, Hong, H, et al. Adenocarcinoma intestinal metastásico con metaplasia ósea en dos gatos domésticos coreanos de pelo corto. J Vet Sci. (2023) 24:24. doi: 10.4142/jvs.23124
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Uneyama, M, Chambers, JK, Nakashima, K, Uchida, K y Nakayama, H. Clasificación histológica y estudio inmunohistoquímico de los tumores epiteliales colorrectales felinos. Veterinario Pathol. (2021) 58:305–14. doi: 10.1177/0300985820974279
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Martin, CK, Tannehill-Gregg, SH, Wolfe, TD, y Rosol, TJ. Carcinoma oral de células escamosas invasivo óseo en gatos: patología y expresión de la proteína relacionada con la hormona paratiroidea. Veterinario Pathol. (2011) 48:302–12. doi: 10.1177/0300985810384414
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Thilsted, JP, y Bolton, RG. Linfosarcoma tímico con metaplasia ósea en un gato. Veterinario Pathol. (1985) 22:424–5. doi: 10.1177/030098588502200422
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Haque, S, Eisen, RN y West, AB. Formación ósea heterotópica en el tracto gastrointestinal. Arch Pathol Lab Med. (1996) 120:666–70.
24. Liu, X, Xu, J y Chen, L. Carcinoma colorrectal con metaplasia ósea. Oncotarget. (2017) 8:65407–13. doi: 10.18632/oncotarget.18577
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: esclerosis peritoneal encapsulada, carcinomatosis peritoneal, calcificación, felino, reporte de caso
Cita: Nam S-J, Song S-H, Lee S-H, Jeung S-Y, Ah JG, Lee S-H y Ryu M-O (2023) Carcinomatosis peritoneal con desmoplasia y metaplasia ósea que imita la esclerosis peritoneal encapsulada en un gato: informe de caso. Frente. Vet. Sci. 10:1298736. doi: 10.3389/fvets.2023.1298736
Recibido: 22 de septiembre de 2023; Aceptado: 17 de noviembre de 2023;
Publicado: 01 Diciembre 2023.
Editado por:
Ricardo Marcos, Universidad de Oporto, Portugal
Revisado por:
Justina Oliveira, Universidad de Trás-os-Montes y Alto Douro, Portugal
Toshiyuki Tanaka, Universidad Metropolitana de Osaka, Japón
Derechos de autor © 2023 Nam, Song, Lee, Jeung, Ah, Lee y Ryu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Min-Ok Ryu, apple963@snu.ac.kr
†ORCID: Min-Ok Ryu https://orcid.org/0000-0002-5614-9846
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía