Caso clínico: Diagnóstico y tratamiento del coristoma pulmonar en un ternero recién nacido
 Caso clínico: Diagnóstico y tratamiento del coristoma pulmonar en un ternero recién nacido
Caso clínico: Diagnóstico y tratamiento del coristoma pulmonar en un ternero recién nacido
 Noriyo Usaki1
Noriyo Usaki1  Takeshi Tsuka2*
Takeshi Tsuka2*  Midori Hatanaka1
Midori Hatanaka1  Yuji Sunden2
Yuji Sunden2  Aoi Imamura2
Aoi Imamura2  Takehito Morita2
Takehito Morita2- 1Asociación de Ayuda Mutua Agrícola de la Federación de la Prefectura de Hyogo, Hyogo, Japón
- 2Departamento de Medicina Clínica Veterinaria, Departamento Conjunto de Medicina Veterinaria, Facultad de Agricultura, Universidad de Tottori, Tottori, Japón
Una cría Holstein hembra de 4 días de edad presentó una masa protuberante de gran tamaño en la espalda, al nacer. La radiografía identificó la apófisis espinosa deformada en la segunda y tercera vértebras lumbares, sugiriendo espina bífida. La ecografía de la masa dorsal reveló estructuras anecoicas similares a bronquios y grandes vasos sanguíneos con un rico flujo sanguíneo que corría paralelo dentro del parénquima homogéneo de la masa ecogénica. La ecografía Doppler también reveló vasos pulsátiles que entraban en el lado más profundo de la apófisis transversa de las vértebras lumbares en la base derecha de la masa protuberante. Estos resultados de las imágenes fueron útiles para la planificación quirúrgica, en la que se suturó un vaso arterial grande en la base de la masa del lado derecho, seguido de la resección de la masa misma. La resección de la masa se pudo llevar a cabo de acuerdo con el procedimiento quirúrgico planificado, aunque su invasión era demasiado profunda para ser resecada por completo. La histopatología de los especímenes resecados reveló que la masa tenía principalmente estructuras similares al tejido pulmonar compuestas por estructuras similares a bronquios, bronquiolos y alvéolos, y grandes vasos, lo que permitió el diagnóstico de coristoma pulmonar. La ecografía Doppler podría contribuir a la diferenciación entre la estructura tubular tipo bronquio y los grandes vasos arteriales en las mismas imágenes, ayudando al diagnóstico de esta enfermedad.
Introducción
El coristoma es una anomalía del desarrollo embrionario en la que los tejidos histológicamente normales de varios órganos se forman en diferentes posiciones anatómicas hasta sus orígenes (1-4). Se ha informado que los orígenes del coristoma han incluido tejidos mamarios, musculares estriados, endometriales y müllerianos en pacientes humanos (1, 2, 5–8).
El coristoma pulmonar (CP) es una anomalía congénita caracterizada por la formación de lesiones masivas debidas a la reduplicación durante el desarrollo embrionario o derivadas de yemas pulmonares supernumerarias (9). Esta enfermedad se conoce como pulmón ectópico o accesorio, malformación broncopulmonar del intestino anterior y secuestro pulmonar extralobar (9, 10). Los quistes broncogénicos también se asocian etiológicamente con el secuestro pulmonar (11). La heterotopía del tejido pulmonar también se asemeja a la CP en términos de formación de masa derivada del tejido pulmonar, pero tiene diferentes hallazgos histológicos, por ejemplo, no hay formación de capas de células mesoteliales (12). En medicina humana, el secuestro pulmonar se utiliza con frecuencia para diferenciar este tipo extralobar del tipo intralobar que se encuentra predominantemente dentro de las estructuras pulmonares o la pleura visceral (9, 10, 13). El secuestro pulmonar extralobar representa entre el 14% y el 26% de los casos humanos de secuestro pulmonar (10, 14). En la literatura veterinaria, las anomalías congénitas derivadas de los tejidos pulmonares han sido denominadas con otros nombres, como secuestro pulmonar (15, 16), pulmón ectópico o accesorio (17, 18), malformación broncopulmonar del intestino anterior (19) y CP (3, 4, 9, 20). Un estudio retrospectivo en el que se utilizaron 28 casos bovinos con CP confirmó la afectación subcutánea de estas lesiones en aproximadamente el 32% de los animales, en comparación con aproximadamente el 68% de los animales con lesiones intraabdominales e intratorácicas (21). El otro informe bovino anterior describió la prevalencia de las afectaciones torácicas, abdominales y subcutáneas de estas enfermedades en aproximadamente 10, 50 y 40%, respectivamente (16). Además, las posiciones anatómicas donde se han visto afectadas las lesiones subcutáneas son la cabeza, el cuello, los hombros, el tórax, la espalda y el ano (4, 9, 16, 19, 22, 23).
La deformidad esquelética es menor en casos humanos o animales, con coristomas originados en varios órganos, así como en el pulmón (6, 13, 14). En comparación con la menor prevalencia (14%) del tipo de secuestro pulmonar intralobar acompañado de otras anomalías, la mitad de los pacientes humanos con el tipo extralobar (CP) presentaron diversas anomalías concurrentes, representando el 4% en afectaciones de deformidades esqueléticas (14). En cuanto a la deformidad esquelética congénita asociada al CP, dos terneros recién nacidos anteriores presentaban defectos óseos frontales o parietales anchos asociados a masas que sobresalían de la cabeza (3, 16). También se encontraron anomalías vertebrales congénitas en los casos bovinos anteriores que involucraban PC en la espalda (22, 23). Aunque la causa de la formación de espina bífida asociada con CP no se conoce completamente, como se identificó en el presente caso, la formación subcutánea de las masas congénitas dentro de la espalda, como lipoma, coristoma, teratoma y hamartoma, antes del cierre del tubo neural puede contribuir a la formación de la espina bífida oculta en pacientes humanos (1, 24). Al igual que en los dos animales anteriores con PCs en la cabeza, las estructuras ectópicas pueden funcionar como obstáculos mecánicos que inducen el fallo de la fusión del cráneo durante el periodo de desarrollo (3, 16). Alternativamente, los defectos vertebrales pueden ser simplemente una de las anomalías embriogénicas comunes que ocurren durante el mismo período fetal que los CP; Informes previos describieron la asociación de defectos vertebrales debidos a hipoplasia pulmonar y quistes broncogénicos (15, 25-27). Dos casos humanos previos con secuestro pulmonar intralobar tenían defectos congénitos, incluida la fusión intravertebral en sus vértebras cervicales, separados de las localizaciones de esta enfermedad (28). Las anomalías neurovertebrales congénitas y del intestino anterior pueden estar sincronizadas, lo que da lugar a defectos del arco neural (como la espina bífida y las hemivértebras) y a la formación de secuestro pulmonar debido al desarrollo en las mismas etapas embriológicas (28, 29). En fetos bovinos, la formación de yemas pulmonares supernumerarias, como origen del CP, puede ocurrir entre los días 30 a 50 de gestación (9, 26). También se han encontrado múltiples anomalías concurrentes, como ectopia cordis, extremidad extraposterior y húmero rudimentario en una cría anterior con una masa de PC en la espalda (17). Por lo tanto, a la hora de diagnosticar el CP, es necesario tratar de detectar las deformidades esqueléticas asociadas, incluida la espina bífida (30).
Una masa dorsal protuberante e hinchada fue la característica macroscópica común en los casos bovinos anteriores con PC en la espalda (22, 23, 30). Así, la observación macroscópica permite una fácil detección de esta enfermedad cuando se apoya en la palpación (11, 12, 18, 19, 22, 23). Sin embargo, no se puede hacer un diagnóstico diferencial basado en la espalda hinchada, debido a las apariencias macroscópicas compartidas de las lesiones de masa cutánea o subcutánea como la espina bífida quística, la celulitis, el absceso, los tumores (p. ej., lipoma) y las masas similares a tumores (p. ej., hamartoma) en animales recién nacidos o más jóvenes (4, 24, 25, 30–37). Además, los exámenes macroscópicos y palpadores no pueden proporcionar hallazgos patológicos más profundos que las masas superficiales, como el grado de invasión o destrucción de las estructuras subyacentes y la vasculatura. En particular, es muy difícil identificar la deformidad esquelética congénita en tales exámenes (22, 23, 30).
La radiografía y la tomografía computarizada (TC) fueron las modalidades de imagen utilizadas para el diagnóstico y la toma de decisiones terapéuticas en los casos bovinos anteriores con varios tipos de corisíntomas en múltiples sitios (15, 16, 18-20, 23, 26). Los usos de la radiografía y la TC son útiles para evaluar la invasión de la masa para las estructuras subyacentes y las afectaciones concurrentes, incluida la deformidad esquelética (15, 16, 18-20, 23, 26). Sin embargo, la ecografía no se ha utilizado como herramienta diagnóstica, a pesar de que un informe bovino anterior describía el uso de la ecografía para diagnosticar un quiste broncogénico (11). En medicina humana, la ecografía es una modalidad de imagen valiosa (a pesar de su inferioridad a la TC con contraste) para evaluar la vasculatura anormal intramasa que indica un secuestro pulmonar intralobar o extralobar (14, 38, 39).
En el presente informe se describe el uso clínico de la radiografía y la ecografía en un ternero recién nacido que presenta CP en la espalda y el procedimiento quirúrgico para la resección de esta masa. La eficacia diagnóstica de dos modalidades de imagen, en particular, los dos signos ultrasonográficos específicos, se discute sobre la base de los resultados de informes previos en humanos y animales.
Presentación del caso
Una cría Holstein hembra de aproximadamente 40 kg de peso nació con la asistencia del parto del propietario. En ese momento, el propietario notó la formación de una hinchazón de gran tamaño en su espalda, ubicándose a nivel entre trece vértebras torácicas y cuartas lumbares (Figuras 1A, B). A los 4 días de edad, este ternero tenía una condición física normal, buen apetito y estaba activo y bebiendo normalmente. Este caso podía caminar normalmente sin debilidad neurológica en sus extremidades posteriores. La hinchazón de la espalda fue causada por la formación subcutánea de la masa, que medía 20 cm, 30 cm y 20 cm en su longitud, ancho y altura cráneo-caudal, respectivamente. La palpación identificó la presencia subcutánea de una lesión de masa blanda y redondeada, con separación de la piel a nivel de transición entre las vértebras torácicas y lumbares. La masa subcutánea estaba anatómicamente conectada con las estructuras de tejidos blandos que se encontraban debajo de ella.
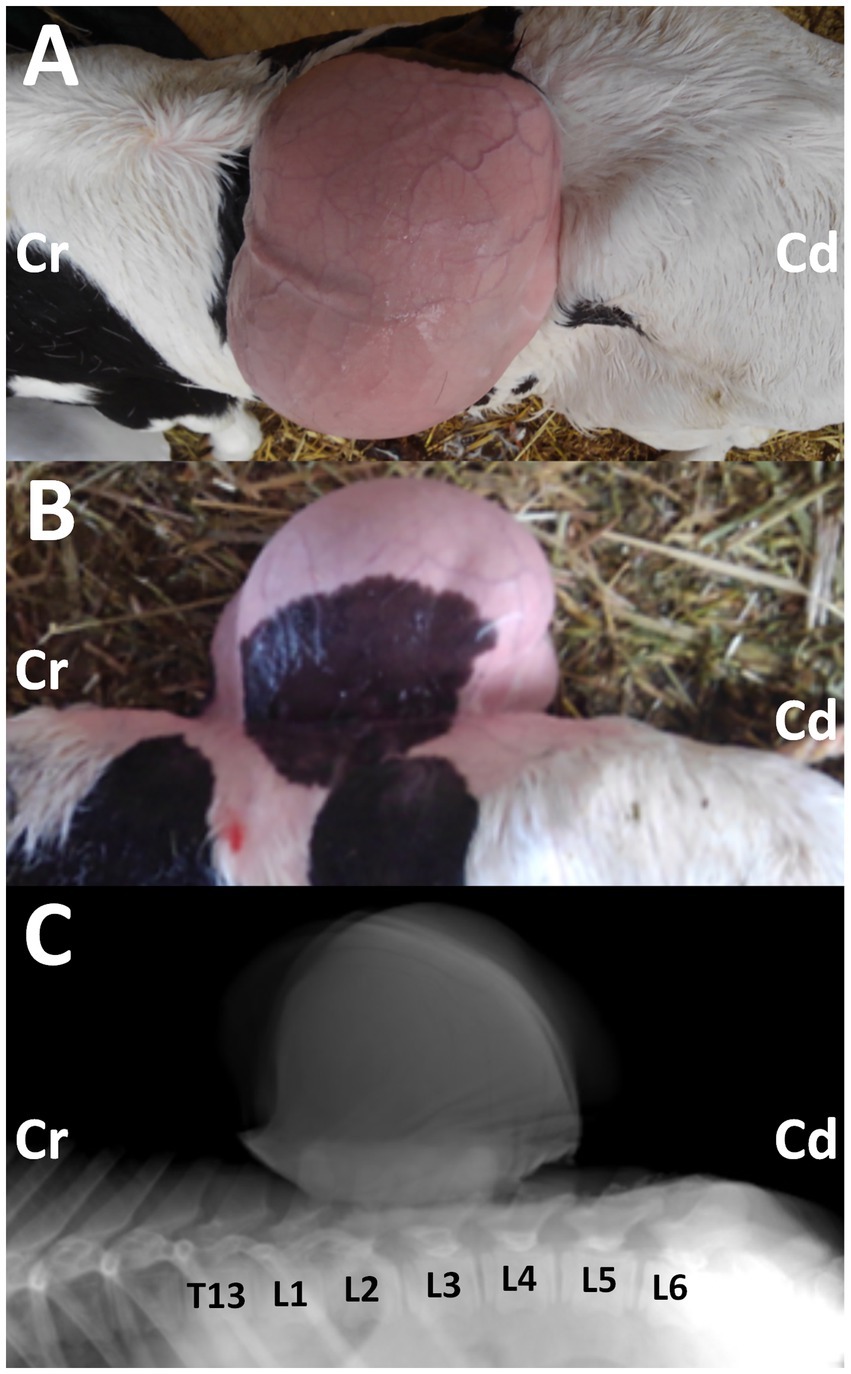 Figura 1. Fotos de las vistas dorsal (A) y lateral (B) de la cría Holstein hembra de 3 días de edad con la masa que sobresale en su espalda, cuando se toman después del recorte en el día 14. Cr: craneal; Cd: caudal. Radiografía lateral (C) que muestra la masa localizada a nivel entre la primera y cuarta vértebras lumbares (L1 y L4). La apófisis espinosa deformada es evidente en la segunda y tercera vértebras lumbares (L2 y L3), en comparación con las formas radiopacas de la apófisis espinosa en las trece vértebras torácicas (T13) y en la primera, cuarta, quinta y sexta vértebras lumbares (L1, L4, L5 y L6). Cr: craneal; Cd: caudal.
Figura 1. Fotos de las vistas dorsal (A) y lateral (B) de la cría Holstein hembra de 3 días de edad con la masa que sobresale en su espalda, cuando se toman después del recorte en el día 14. Cr: craneal; Cd: caudal. Radiografía lateral (C) que muestra la masa localizada a nivel entre la primera y cuarta vértebras lumbares (L1 y L4). La apófisis espinosa deformada es evidente en la segunda y tercera vértebras lumbares (L2 y L3), en comparación con las formas radiopacas de la apófisis espinosa en las trece vértebras torácicas (T13) y en la primera, cuarta, quinta y sexta vértebras lumbares (L1, L4, L5 y L6). Cr: craneal; Cd: caudal.
La radiografía se realizó en decúbito lateral bajo sedación, con inyección intramuscular de clorhidrato de xilacina (0,2 mg/kg). La radiografía lateral identificó una masa lisa de gran tamaño localizada cerca y dorsalmente de la segunda y tercera vértebras lumbares (Figura 1C). La masa era homogéneamente radiopaca en el centro, revestida por el contorno radiopaco más alto. En la base de la masa, se observó que las estructuras radiopacas irregulares y heterogéneas se superponían con la apófisis espinosa de las vértebras lumbares. Dentro de la región superpuesta, la deformación en la apófisis espinosa fue evidente en la segunda y tercera vértebras lumbares. Este hallazgo sugería espina bífida, a pesar de la falta de claridad causada por la masa superpuesta.
La ecografía se realizó con un ecógrafo portátil (MyLabOne VET, Esaote Corporation, Génova, Italia). Después de cortar al ternero, rociarlo con alcohol y aplicarle gel de ultrasonido, se aplicó un transductor lineal de 10,0 MHz a la espalda hinchada del animal no sedado en su posición de pie. Esto reveló un vaso más grande de 8–10 mm de diámetro que corre dentro del parénquima ecogénico homogéneo a aproximadamente 3 cm por debajo de la superficie de la piel (Figuras 2A–D). Además, también se observaron vasos de 2 a 5 mm de diámetro en el parénquima proximal al vaso grande. Se observó que las estructuras tubulares corrían a lo largo de estas vasijas dentro de los espacios entre ellas. Estas estructuras tenían lúmenes anecoicos delineados por estructuras de pared hiperecogénicas de 1-2 mm de espesor, lo que sugiere una estructura similar a los bronquios. El manejo suave del transductor aplicado para seguir el gran vaso identificó varias estructuras tubulares anecoicas, manteniendo su posición paralela mientras se envolvían alrededor de las ramas del vaso. Estas estructuras tubulares parecían tener comunicación anatómica, aunque la comunicación anatómica entre el vaso grande y las ramas no pudo demostrarse en las mismas ecografías. La ecografía Doppler identificó flujos sanguíneos pulsátiles dentro de los lúmenes de los vasos grandes y pequeños, lo que sugiere que los vasos intramasa eran vasos arteriales. El vaso grande se podía visualizar como corriendo hacia el cuerpo, cuando se escaneaba la base del lado derecho de la masa utilizando un transductor microconvexo de 3,5 MHz (Figuras 2E, F). Esta vasija tenía un diámetro de más de 1 cm a este nivel y estaba separada en dos partes. En la ecografía, la parte craneal de la bifurcación de los vasos se dirigía directamente hacia las estructuras hiperecogénicas, mostrando la apófisis transversa de las vértebras lumbares, a pesar de que la carrera del vaso no era evidente a nivel más profundo. La ecografía Doppler en la misma posición de exploración reveló que este vaso tenía un flujo sanguíneo pulsátil y era más profundo que la apófisis transversa de las vértebras lumbares. Sin embargo, no se pudo detectar el vaso arterial principal como el extremo de este vaso. Sobre la base de estos hallazgos ultrasonográficos, se sospechó que esta masa era un coristoma pulmonar. Con esta información, se pudo planificar el procedimiento quirúrgico: la sutura del vaso grande a nivel de la base de la masa debe ocurrir antes de la extirpación de la masa, para ligar la intercepción de los flujos sanguíneos completamente arteriales.
 Figura 2. Ecografías Doppler (A-D) de la masa, cuando se escanea por el movimiento cráneo-caudal de un transductor lineal de 10,0 MHz. Las estructuras anecoicas similares a los bronquios (Br) y los grandes vasos con rico flujo sanguíneo (V) discurren dentro de los parénquimas homogéneos de la masa ecogénica (M), separados por las estructuras septales hiperecogénicas. Ecografía (E) y ecografía Doppler (F) que muestran la parte bifurcada del vaso grande (V) en el margen ventral de la masa protuberante (M) a nivel del cuerpo vertebral lumbar (VB), al explorar la base derecha de la masa utilizando un transductor microconvexo de 3,5 MHz. Barra: 1 cm.
Figura 2. Ecografías Doppler (A-D) de la masa, cuando se escanea por el movimiento cráneo-caudal de un transductor lineal de 10,0 MHz. Las estructuras anecoicas similares a los bronquios (Br) y los grandes vasos con rico flujo sanguíneo (V) discurren dentro de los parénquimas homogéneos de la masa ecogénica (M), separados por las estructuras septales hiperecogénicas. Ecografía (E) y ecografía Doppler (F) que muestran la parte bifurcada del vaso grande (V) en el margen ventral de la masa protuberante (M) a nivel del cuerpo vertebral lumbar (VB), al explorar la base derecha de la masa utilizando un transductor microconvexo de 3,5 MHz. Barra: 1 cm.
El día 14, el ternero fue anestesiado con una inyección intramuscular de solución de clorhidrato de xilacina (0,2 mg/kg, inyección de xilacina al 2% Fujita, Fujita Pharmaceutical. Co., Ltd., Tokio, Japón). La anestesia local se realizó mediante la inyección subcutánea de una solución de 50 ml de clorhidrato de procaína (Enpro injection KS, Kyoritsu Seiyaku Co. Ltd., Tokio, Japón) alrededor de la región inflamada. Se realizó una incisión cutánea de 20 cm a lo largo del margen de la base derecha de la masa. La disección roma de los tejidos subcutáneos pronto permitió exponer una superficie de color rojo oscuro de la masa (Figura 3A). En la superficie de la masa, se detectaron macroscópicamente varios vasos tortuosos de 2 a 5 mm de diámetro (Figura 3B). En las partes craneales de la base de la masa, entrando dentro de las estructuras más profundas, se pudo detectar un vaso pulsado de aproximadamente 1 cm de diámetro. La disección roma del vaso grande de la superficie de la masa era imposible, ya que las estructuras membranosas engrosadas lo cubrían herméticamente. La ruta de este vaso podría detectarse macroscópicamente al levantar la masa a través de la abertura quirúrgica; Este buque dio un rodeo alrededor de la zona media de la masa, corrió caudalmente y luego giró a la derecha. Este vaso finalmente penetró más profundamente en el espacio entre la apófisis transversa de la primera y la segunda vértebras lumbares. En la parte de la entrada del vaso, este vaso se suturó firmemente con material de sutura de seda trenzado (Nescosuture, Alfresa Pharma Co. Ltd., Osaka, Japón) en posiciones proximales y distales a la parte de la incisión planificada, lo más cerca posible de ella (Figuras 3C, D). Este vaso podría cortarse sin sangrado arterial. Posteriormente, también se suturó cada pequeño vaso ubicado en la superficie de la masa. Después del corte completo de los vasos principales, la disección roma de la parte de transición entre la masa y las estructuras de tejidos blandos subyacentes permitió la exposición de la base de la masa. Esta base de 7 cm de diámetro, en forma de tallo, penetraba profundamente en el espacio entre las capas musculares dorsales. El extremo de la estructura en forma de tallo no pudo ser detectado cuando fue palpado a lo largo de su ruta por los dedos del operador. Por lo tanto, la sutura se realizó utilizando un material de sutura de seda para la estructura en forma de tallo de la masa, lo más profunda posible. La incisión se realizó en la parte proximal de la sutura. Los procedimientos de sutura-incisión tres veces podrían permitir la resección masiva en una ubicación de 1 a 2 cm por debajo de la superficie de la piel (Figura 3E). La parte de resección se cerró con sutura enterrada con un material de sutura absorbible (Suturas Covidien Polysorb USP 2–0, Covidien Japan Co., Ltd., Tokio, Japón), seguida de sutura cutánea (Figura 3F). El animal fue tratado con un ciclo de cinco días de solución mixta intramuscular de penicilina y estreptomicina (Mycillin Sol, Tamura Pharmaceutical Co. Ltd., Osaka, Japón), seguido de una administración subcutánea de cinco días de solución de enrofloxacina (Baytril 5%, Bayer Yakuhin Ltd., Osaka, Japón). No se evidenció ninguna complicación en la zona de la herida quirúrgica, a pesar de estar ligeramente hinchada y dura durante varias semanas en el postoperatorio. Sin embargo, el animal presentó una parálisis progresiva de las extremidades posteriores que coincidió con el desarrollo gradual de la hinchazón de la espalda, lo que resultó en una protuberancia de aproximadamente 1 cm de espesor acompañada de secreción purulenta entre 3 y 4 meses después de la cirugía. Por lo tanto, la masa regenerada se extirpó quirúrgicamente en el día 177 (163 días postoperatorios). Sin embargo, la reintervención no pudo permitir una mejoría completa de la p de las extremidades posteriores.arálisis, a pesar de que no había hinchazón en la herida quirúrgica. El animal fue sacrificado mediante inyección intravenosa de cloruro de potasio (aproximadamente 2 nmol/kg) hasta la auscultación de la identificación de paro cardíaco bajo anestesia profunda con infecciones intravenosas de clorhidrato de xilacina (1 mg/kg) y propofol (10 mg/kg) en el día 196 (182 días postoperatorios), según solicitud del propietario. La necropsia reveló la formación de la masa fibromatosa y capsular que envolvía los materiales purulentos que no se podían eliminar en la reoperación debido a que se extendía profundamente hasta la ubicación de las vértebras lumbares subyacentes. Además, la apófisis espinosa defectuosa de la segunda vértebra lumbar, identificada como espina bífida, podría observarse macroscópicamente como la ruta de compresión asociada a la masa a la médula espinal.
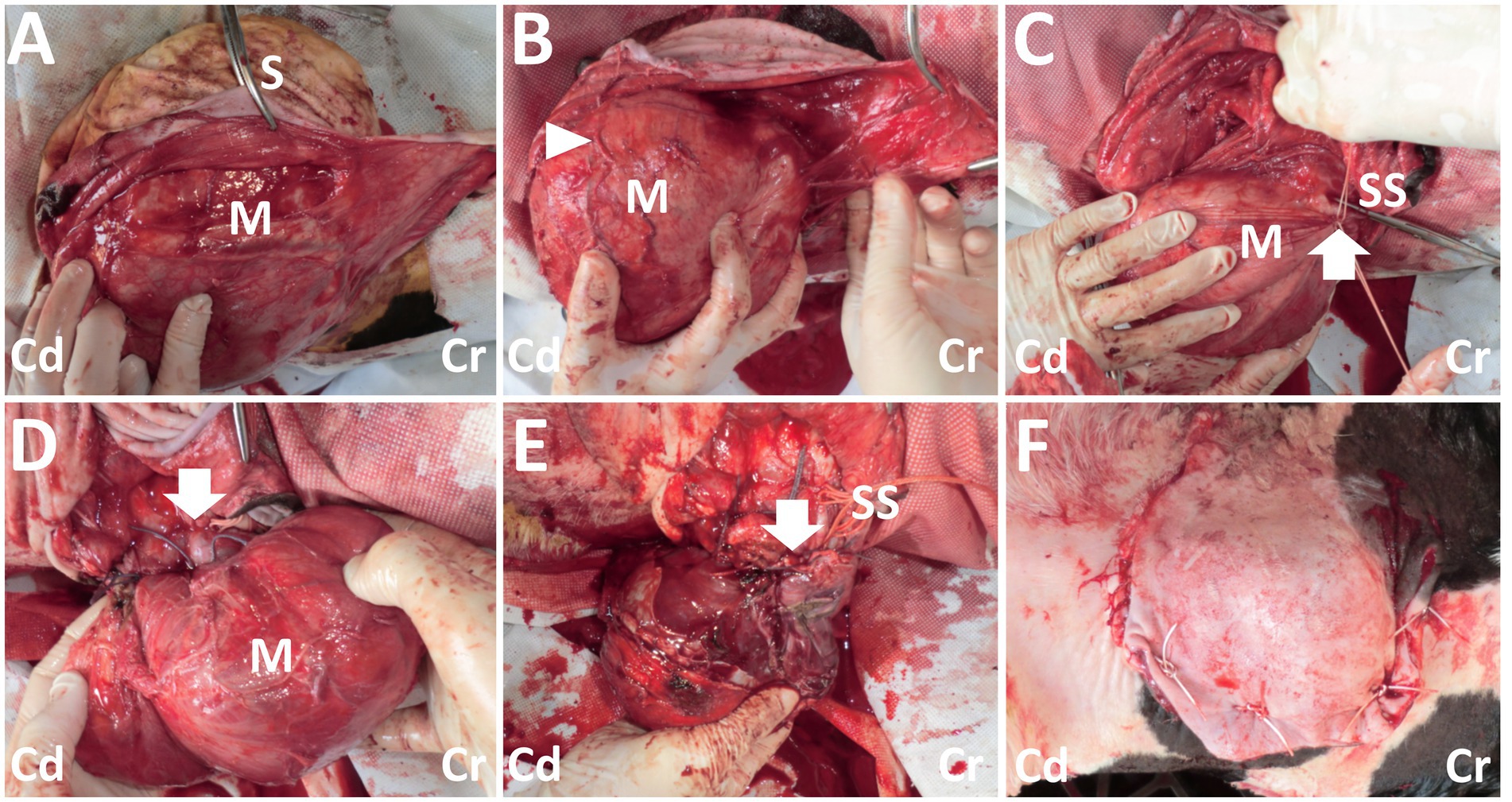
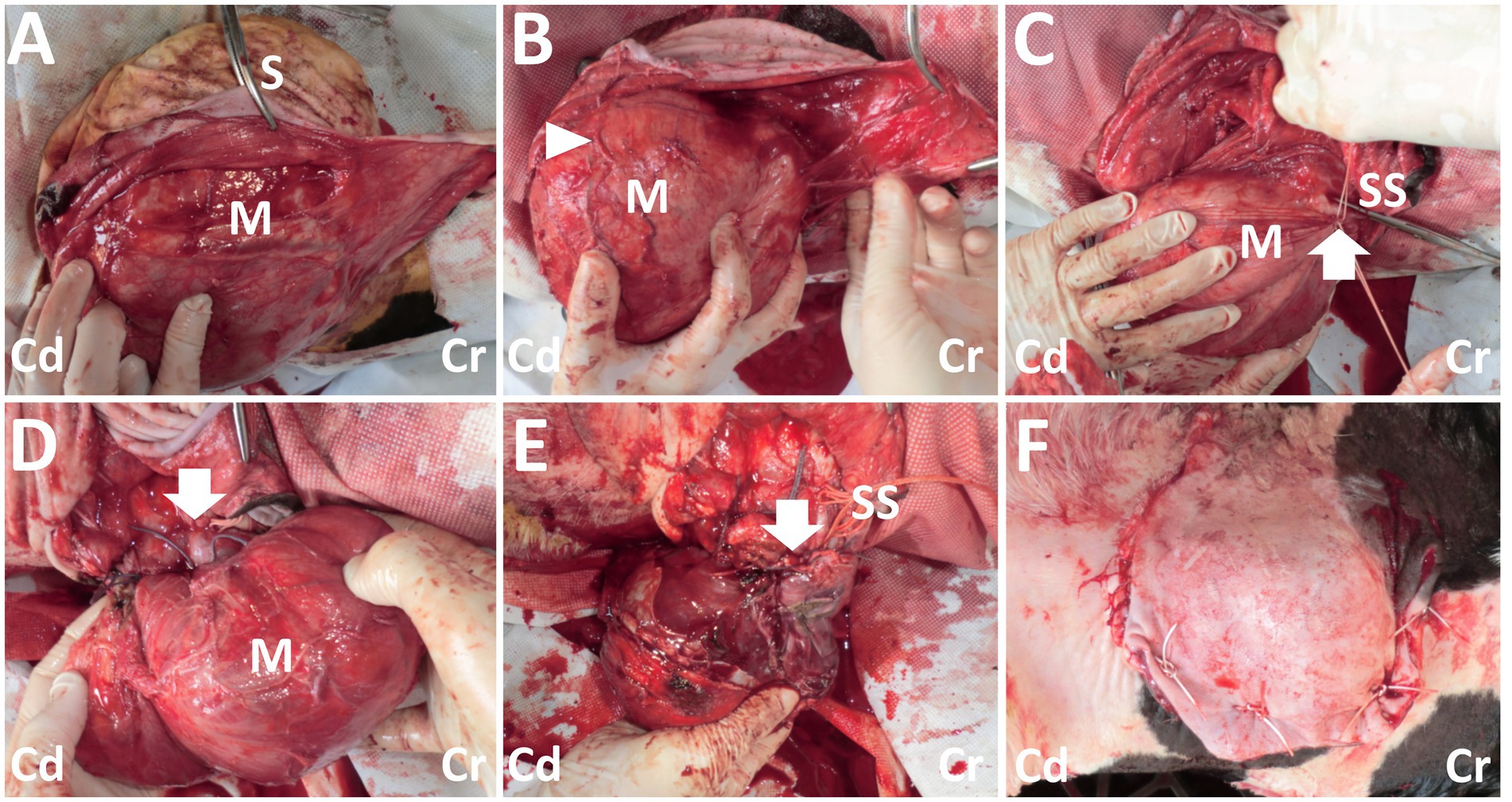 Figura 3. Fotos del procedimiento quirúrgico para la resección de la masa dorsal. (A) Una masa de color rojo oscuro (M) queda expuesta cuando la piel incisa (S) se disecciona sin rodeos. (B) Los vasos grandes y tortuosos (punta de flecha) son evidentes en la superficie de la masa (M). (C) Se colocan dos suturas de seda trenzada (SS) alrededor de la parte de la entrada del vaso (flecha) a la masa (M). (D) Se sutura la parte de la entrada del recipiente (flecha) a la masa (M). (E) Se lleva a cabo la resección de la masa, mientras que la estructura en forma de tallo de la base de la masa se sutura con material de sutura de seda trenzada (SS). La flecha muestra la parte resecada. (F) Las vistas macroscópicas después de la sutura de la piel. Cr: Craneal; Cd: Caudal.
Figura 3. Fotos del procedimiento quirúrgico para la resección de la masa dorsal. (A) Una masa de color rojo oscuro (M) queda expuesta cuando la piel incisa (S) se disecciona sin rodeos. (B) Los vasos grandes y tortuosos (punta de flecha) son evidentes en la superficie de la masa (M). (C) Se colocan dos suturas de seda trenzada (SS) alrededor de la parte de la entrada del vaso (flecha) a la masa (M). (D) Se sutura la parte de la entrada del recipiente (flecha) a la masa (M). (E) Se lleva a cabo la resección de la masa, mientras que la estructura en forma de tallo de la base de la masa se sutura con material de sutura de seda trenzada (SS). La flecha muestra la parte resecada. (F) Las vistas macroscópicas después de la sutura de la piel. Cr: Craneal; Cd: Caudal.
Macroscópicamente, la masa tenía una superficie externa irregular de color rojo oscuro, que cubría las estructuras internas por completo, cuando se extirpó quirúrgicamente el día 14 (Figura 4A). El parénquima masivo incluía mezclas de estructuras duras y espongiformes. Dentro del parénquima masivo había una rica red de vasos sanguíneos con varios diámetros de luz. Los vasos más grandes medían aproximadamente 1 cm. Estos vasos se juntaron hacia el centro de la masa, formando el plexo del vaso en la superficie cortada de la base de la masa. También se evidenciaron múltiples estructuras similares a bronquios dentro del parénquima masivo. Estas estructuras similares a los bronquios se parecían mucho al árbol traqueobronquial dentro del pulmón normal. El contenido estaba en su mayoría vacío (incluido el aire) dentro de los lúmenes formados por las paredes circunferenciales circundantes, similares a cartílagos, de estas estructuras. Las estructuras similares a los bronquios tenían un diámetro de lúmenes > 1 cm en la superficie de corte de la base de la masa.
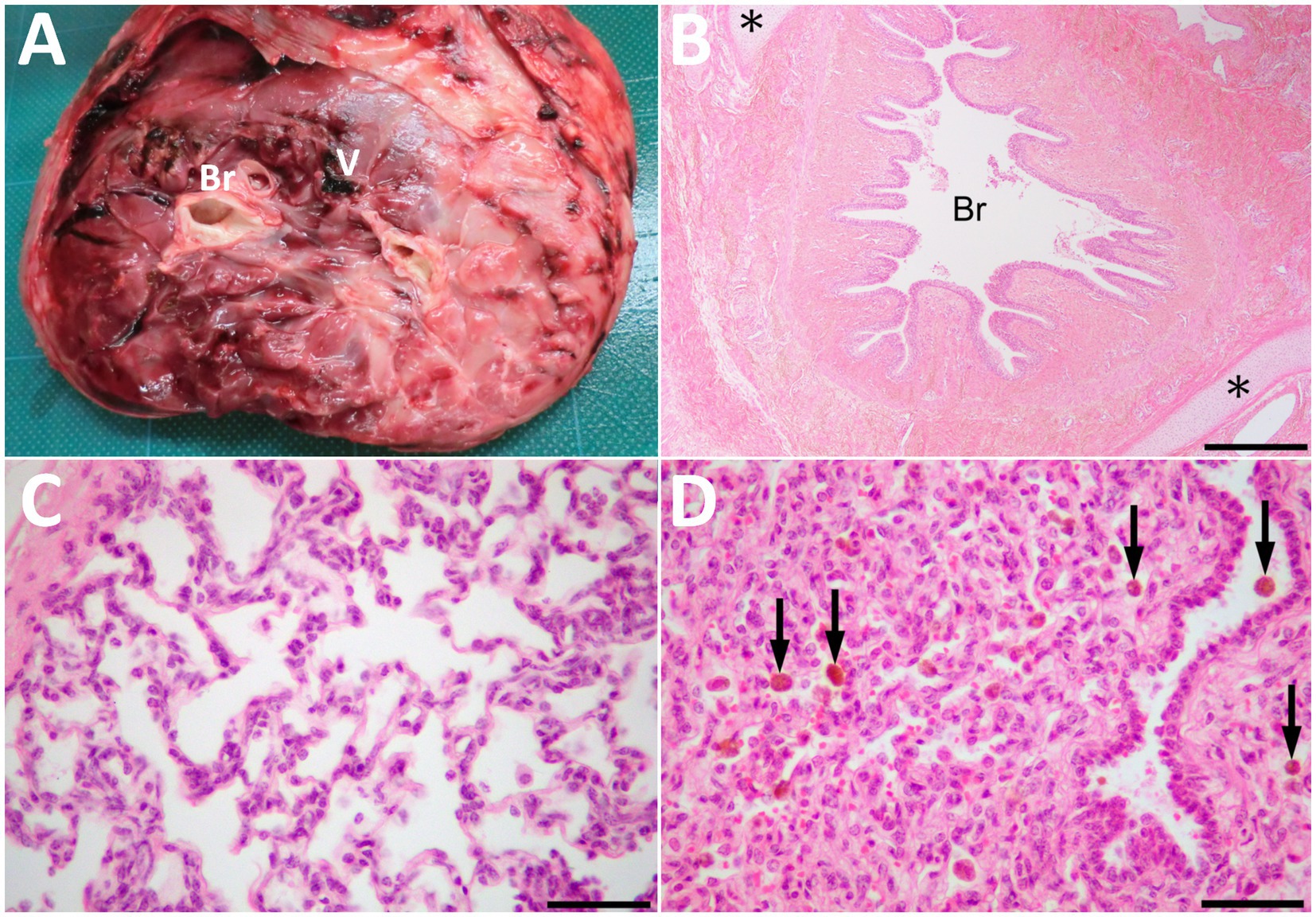 Figura 4. La superficie cortada de la masa resecada (A) que muestra las estructuras similares a los bronquios (Br) y el vaso grande (V) en el centro del parénquima, incluidas las mezclas de estructuras duras y espongiformes. (B) Histopatológicamente, la masa compuesta por tejidos pulmonares, incluidos los bronquiolos (Br) y los tejidos colágenos. Los tejidos cartilaginosos (asteriscos) se ubican alrededor de los bronquiolos. UES Barra, 500 μm. (C) Estructuras similares a los alvéolos similares a los alvéolos pulmonares en una vista ampliada de la masa. El tejido fibroso similar a la pleura se encuentra en la parte superior izquierda de la foto. UES (D) El área comprimida es similar al tejido pulmonar atelectático. Las flechas indican macrófagos cargados de hemosiderina dentro de los alvéolos y bronquiolos. UES Las barras son de 50 μm en C y D.
Figura 4. La superficie cortada de la masa resecada (A) que muestra las estructuras similares a los bronquios (Br) y el vaso grande (V) en el centro del parénquima, incluidas las mezclas de estructuras duras y espongiformes. (B) Histopatológicamente, la masa compuesta por tejidos pulmonares, incluidos los bronquiolos (Br) y los tejidos colágenos. Los tejidos cartilaginosos (asteriscos) se ubican alrededor de los bronquiolos. UES Barra, 500 μm. (C) Estructuras similares a los alvéolos similares a los alvéolos pulmonares en una vista ampliada de la masa. El tejido fibroso similar a la pleura se encuentra en la parte superior izquierda de la foto. UES (D) El área comprimida es similar al tejido pulmonar atelectático. Las flechas indican macrófagos cargados de hemosiderina dentro de los alvéolos y bronquiolos. UES Las barras son de 50 μm en C y D.
La histopatología de la masa resecada contenía estructuras ramificadas similares a bronquios con una sola capa de células epiteliales ciliadas cilipilares (Figura 4B). Dentro de la masa también se encontraron depósitos de fibras colágenas, arterias de tamaño mediano a grande, tejidos cartilaginosos y estructuras similares a alvéolos pulmonares (Figura 4C). Los espacios alveolares se expandieron irregularmente con una leve infiltración de macrófagos y neutrófilos. Esas estructuras alveolares estaban lobuladas por tejidos fibrosos, y los lóbulos comprimidos eran similares al tejido pulmonar atelectático. También se observó congestión, hemorragia, macrófagos cargados de hemosiderina, edema y depósito de fibrina en estas áreas (Figura 4D). Otros hallazgos histológicos de la masa fueron la formación de tejido de granulación, tejidos fibrosos similares a los tejidos conectivos interlobulillares en pulmones y pleura, tejidos adiposos y algunos haces de nervios periféricos. Sobre la base de estos hallazgos histológicos, la masa se diagnosticó como coristoma pulmonar.
Discusión
Este informe incluyó la eficacia diagnóstica de dos modalidades de imagen, la radiografía y la ecografía, en el presente caso. En casos bovinos previos con CP en cuello y tórax, los usos clínicos de la radiografía tuvieron como objetivo evaluar el grado de invasión de la masa en los tejidos blandos subyacentes y la cavidad torácica (11, 15, 19). En un caso bovino previo con lesión intratorácica, la radiografía de tórax pudo identificar la línea clara y suave entre el contenido anecoico y ecogénico; Estos representaban gas y fluido, respectivamente, dorsal y ventralmente dentro de la cavidad quística envuelta por la estructura capsular de la masa (26). La radiografía de cráneo de un caso bovino previo con lesión en la cabeza demostró el defecto de la fisura en el hueso frontal afectado (16). Estos hallazgos radiográficos fueron valiosos para decidir la intervención quirúrgica (11, 15, 16, 26). Con base en los datos clínicos de los casos humanos y bovinos previos que presentaron varios tipos de coritomas en la espalda, la radiografía es útil para identificar la falta de formas radiolúcidas de la apófisis espinosa, lo que permite sospechar espina bífida en las vértebras lumbares (1, 5, 23, 24). Los datos previos apoyan la afectación concurrente de la espina bífida en el presente caso, combinada con el resultado desfavorable debido a la paresia progresiva de las extremidades posteriores. En la radiografía lateral del presente caso, la anomalía en la apófisis espinosa no era claramente detectable debido a la superposición de la masa y las vértebras periféricas (23). Por lo tanto, se deben realizar radiografías ventorsales o dorsoventrales para la región lumbar afectada, ya que son preferibles para evaluar la malformación de la apófisis espinosa en comparación con las radiografías laterales (37).
El uso de la radiografía dificulta la diferenciación del CP de otras masas subcutáneas de tejidos blandos (40). Esta masa pudo demostrarse en las radiografías como una opacidad de tejidos blandos, idéntica a la del presente caso (11). La opacidad de los tejidos blandos fue el aspecto radiográfico común de las masas dorsales en los animales anteriores con espina bífida quística, hamartoma y lipoma infiltrante (31, 34). La radiografía con contraste parece ser una ayuda menos diagnóstica porque no mejoró la radiopacidad de la masa (15).
La ecografía es superior a la radiografía en cuanto a la visibilidad de las estructuras de los tejidos blandos, a pesar de su escasa visibilidad de las estructuras óseas. La ecografía se utiliza con frecuencia para observar la hinchazón superficial, como abscesos, hematomas, hernias, bursitis y tumores (32-36, 41, 42). La ecotextura del PC es una masa sólida ecogénica homogénea bien definida o irregular (39, 43, 44). El aspecto ultrasonográfico común es fácilmente distinguible de los de abscesos, hematomas y bursitis que se manifiestan como masas capsulares, incluyendo contenidos ecogénicos variables con o sin las estructuras septales ecogénicas (35, 36, 41, 42). La espina bífida quística, que tiene el mismo aspecto macroscópico, puede aparecer como una masa quística llena de líquidos anecoicos o hipoecoicos en las ecografías de espaldas hinchadas. La masa ecogénica del cerebro o la médula espinal se puede ver en los fluidos si se desarrolla meningoencefalocele o mielomeningocele (45). Los quistes broncogénicos también deben distinguirse del CP: aparecen ultrasonográficamente como una masa quística ecogénica mixta, a pesar del mismo origen embriológico (11, 40). Los hallazgos ultrasonográficos de abscesos y tumores o masas tumorales muestran una consistencia y ecogenicidad mixtas, pero la ecografía no presenta evidencia suficiente para diferenciarlos del CP (32-35). Con base en los resultados obtenidos de la cría presente con una masa dorsal de PC, ya que no hay informes discutidos sobre el uso de la ecografía para una enfermedad similar, los dos signos ultrasonográficos parecen útiles para diferenciar esta enfermedad de las masas sólidas.
Un signo ultrasonográfico específico son los vasos tortuosos y grandes con flujo sanguíneo pulsátil dentro de la masa. Este signo ya se ha observado en informes humanos anteriores, donde la ecografía reveló que los vasos anormales intramasa tenían grandes diámetros de luz que medían de 1 a 12 mm (14, 29, 38, 43, 46). El aporte arterial a la CP se adquiere a través de los grandes vasos anormales derivados de los vasos sistémicos, que incluyen con mayor frecuencia la aorta torácica y abdominal descendente (4, 9, 13, 14, 21, 27, 30). Desafortunadamente, a pesar de que el origen del flujo sanguíneo es desconocido en el presente caso, los vasos intramasa podrían derivar de la aorta abdominal. Esta sugerencia se basa en su ruta de salida de la masa, que luego ingresó a la cavidad abdominal a través del espacio entre las apófisis transversas de la primera y la segunda vértebras. Se pudo obtener evidencia adicional de suministro arterial a partir de los flujos sanguíneos pulsátiles hacia los vasos tortuosos y grandes, como se ve en la ecografía Doppler de la masa. Las vasculaturas intramasa que suministraban flujos arteriales desde los vasos sistémicos fueron los hallazgos macroscópicos comunes observados al eliminar las masas de espalda y tórax de los casos bovinos previamente reportados (19, 22, 23). Los usos previos de la ecografía Doppler para el hamartoma y el lipoma infiltrativo revelaron que las masas eran avasculares (32, 34). Por lo tanto, los hallazgos ecográficos Doppler de las vasculaturas anormales intramasa pueden utilizarse eficazmente como evidencia significativa para diferenciar esta enfermedad de varias lesiones de masa subcutánea (14, 39, 40, 44). Sin embargo, en la mayoría de los casos humanos, los vasos anormales son demasiado pequeños para ser detectados en ecografías Doppler (39, 44). En la práctica bovina, la ecografía Doppler se utiliza para detectar vasos anormales como indicador de PC, ya que los vasos suelen medir centímetros de diámetro dentro de grandes masas. Para detectar los vasos principales que proporcionan el flujo sanguíneo intramasa y los vasos de alimentación dentro de la masa, la radiografía con contraste o la fluoroscopia pueden mostrar la ruta del flujo sanguíneo desde los vasos principales hacia la masa a través de los vasos tortuosos anormales (13, 47).
Otro signo ultrasonográfico son las estructuras tubulares anecoicas intramasa, que discurren a lo largo de los vasos anormales, representando estructuras similares a los bronquios. Este signo no fue evidente en los usos previos de la ecografía en casos humanos con secuestro pulmonar intralobar o extralobar (38, 40, 43, 46). La dificultad en la visualización de estructuras bronquiales anormales dentro de la masa puede depender del menor diámetro de los pequeños vasos de alimentación intramasa, lo que limita su visibilidad (39, 44). Puede haber diferencias macroscópicas o histopatológicas entre los especímenes humanos y bovinos en las estructuras tubulares anormales compuestas por estructuras similares a bronquios, bronquiolos y alvéolos dentro de las masas. En casos humanos anteriores, las estructuras similares a los bronquiolos parecían predominantemente presentes. En casos humanos anteriores, las estructuras similares a los bronquiolos parecían estar predominantemente presentes (40, 44, 46). Por otro lado, dentro de los especímenes obtenidos de los casos bovinos anteriores, se observaron las ramas de las estructuras bronquio-bronquiolos-alvéolos dentro de las estructuras parenquimatosas (15, 16, 18, 21). Las estructuras similares a los bronquios tenían tamaños tubulares detectables macroscópicamente y estaban revestidas microscópicamente por las diversas paredes epiteliales, en su mayoría hipoplásicas (15, 16, 18, 21). La visibilidad ultrasonográfica de las estructuras bronquiales intramasa puede depender del grado de hipoplasia de las estructuras similares a los bronquios dentro de la masa. Según nuestros resultados, la ecografía Doppler es necesaria para distinguir entre las estructuras tubulares similares a los bronquios y los vasos de alimentación, ya que estas dos estructuras corren juntas dentro de la masa.
Si el presente caso se ha examinado con TC, esta modalidad avanzada de diagnóstico por imagen podría haber proporcionado la información completa obtenida de la radiografía y la ecografía. La TC habría ofrecido una visibilidad superior de las estructuras óseas y de tejidos blandos. La valiosa evidencia de la TC habría incluido la ubicación anatómica relativa entre la masa dorsal de tejido blando y las estructuras esqueléticas subyacentes en el presente caso. En un ternero con una masa de PC en el cráneo, la TC se ha utilizado previamente para detectar una ausencia de comunicación entre el espacio subaracnoideo y esta enfermedad (20). En otro ternero con secuestro pulmonar intratorácico, la dimensión de la masa y su relación con las estructuras pulmonares circundantes fueron evidentes (26). Con base en la medicina humana previa, la angiografía por TC puede mostrar las vasculaturas anormales intramasa y la formación de grandes ramas derivadas de la arteria principal, como la aorta descendente y abdominal (7, 10, 12, 39, 44, 47). El drenaje venoso, como la vena pulmonar hacia la masa, no siempre es evidente en la angiografía por TC que involucra la cavidad torácica, a pesar de que el vaso venoso de diámetros ≥10 mm es detectable (44). En el presente caso había un único vaso de alimentación de gran tamaño para suministrar flujo sanguíneo a su masa posterior. El único tipo de vaso de alimentación se detecta predominantemente en casos humanos, en comparación con los múltiples tipos, y se informa que representa el 15-20% del secuestro pulmonar (47).
Los usos preoperatorios de la modalidad de imagen son de gran ayuda para la planificación quirúrgica de masas subcutáneas (11, 15, 16, 18, 20, 26, 42). Ningún hallazgo radiográfico de la invasividad de la masa en la cavidad torácica pudo apoyar la decisión quirúrgica de intervenir en masas de CP de cuello y tórax (11, 15). Los usos preoperatorios de la radiografía y la TC podrían contribuir a la resección completa de la masa de CP intratorácica mediante toracotomía, lo que resultó en un resultado favorable (26). En el presente caso, la ecografía contribuyó a la planificación preoperatoria de la vía quirúrgica para el abordaje de la masa y del gran vaso de alimentación. Con base en la ecografía Doppler del flujo sanguíneo pulsátil del vaso de alimentación, se encontró que este vaso requería sutura antes de la resección quirúrgica de la masa para evitar el sangrado arterial durante la cirugía. Sin embargo, la exploración percutánea en la superficie de la masa posterior de PC extremadamente grande no pudo mostrar la interfaz entre la masa y las estructuras subyacentes, lo que impidió que la evidencia ultrasonográfica predijera si la masa podía resecarse por completo (42). Desgraciadamente, el presente caso tuvo un desenlace desfavorable cinco meses después de la cirugía, en la que se desarrolló una paresia progresiva de las extremidades posteriores, que dio lugar a la eutanasia. Los CP pueden contribuir a la formación de la deformidad esquelética subyacente cuando se involucran por vía subcutánea (16, 23, 30). La resección de la masa subcutánea de PC extremadamente grande puede ser un desafío para estos casos bovinos. El recrecimiento de la masa restante puede comprimir el cerebro y la médula espinal a través de defectos en la fisura del cráneo y la apófisis espinosa, inducidos por la inflamación y la infección asociadas a la cirugía. La cirugía de un ternero anterior con una masa en la espalda PC resultó en una paresia progresiva de las extremidades posteriores, seguida de eutanasia entre un mes después de la operación (23). Otro ternero anterior con una masa en el cráneo de PC murió repentinamente en el camino de regreso a la granja el día de la cirugía (16).
Conclusión
Se requiere el uso combinado de radiografía y ecografía para diagnosticar el CP en la espalda, acompañando a la espina bífida en la vértebra subyacente. Esta enfermedad se puede diferenciar de las otras masas subcutáneas de la espalda en función de los signos ultrasonográficos de vasos tortuosos y grandes con flujo sanguíneo pulsátil y estructuras similares a bronquios que corren una al lado de la otra dentro de la masa.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por el Reglamento de Experimentos con Animales de la Universidad de Tottori. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
NU: Curación de datos, Investigación, Redacción – borrador original. TT: Conceptualización, Curación de datos, Supervisión, Redacción – borrador original, Redacción – revisión y edición. MH: Curación de datos, Investigación, Escritura – borrador original. YS: Curación de datos, Investigación, Redacción – borrador original. AI: Curación de datos, Investigación, Escritura – borrador original. TM: Curación de datos, Investigación, Redacción – borrador original.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Los autores desean agradecer a los veterinarios de la Asociación de Ayuda Mutua Agrícola de la Federación de la Prefectura de Hyogo (Harumi Sasakura, Yuka Higeshiro, Atsushi Kitayama y Kenji Konishi) y al Centro de Servicios de Higiene Ganadera Himeji de la Prefectura de Hyogo (Minako Teraichi) por su valioso apoyo clínico.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1257329/full#supplementary-material
Película complementaria S1 | En la ecografía Doppler, cuando se escanea mediante el movimiento cráneo-caudal de un transductor lineal de 10,0 MHz, se muestran varios vasos de 5-10 mm entre cero y cinco segundos de esta película. Estos vasos discurren tortuosamente y muestran flujos sanguíneos pulsátiles dentro de la ventana de la exploración Doppler. A partir de los cinco segundos de esta película, las estructuras tubulares anecoicas corren a lo largo de los vasos pulsantes dentro del parénquima masivo en la misma imagen.
Película complementaria T2 | La ecografía identifica la parte bifurcada de un vaso de 10 mm de diámetro en el margen ventral de la masa protuberante a los niveles de la apófisis transversa de la vértebra lumbar al escanear la base derecha de la masa utilizando un transductor microconvexo de 3,5 MHz. A partir de los 11 segundos de esta película, la ecografía Doppler muestra el flujo sanguíneo pulsátil en este vaso, la parte craneal de la bifurcación que es más profunda que la apófisis transversa de la vértebra lumbar. Sin embargo, la entrada de este vaso a la arteria sistémica no es evidente.
Referencias
1. Molleston, MC, Roth, KA, Wippold, FJ 2º y Grubb, RL. Síndrome del cordón anclado de un coristoma de origen mülleriano. Caso clínico. J Neurosurg. (1991) 74:497–500. doi: 10.3171/jns.1991.74.3.0497
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Chen, X, Harter, J, Iskandar, BJ y Salamat, MS. Coristoma mamario en crecimiento disfrazado de lipomielomeningocele lumbosacro en una niña púber. J Neurosurg Pediatr. (2011) 8:321–4. doi: 10.3171/2011.6.PEDS10480
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Wronski, JG, Argenta, FF, Kemper, RT, Raiter, J, de Oliveira, NR, Driemeier, D, et al. Coristoma pulmonar en un ternero recién nacido con malformaciones multiplecraneales y nerviosas. Ciência Rural. (2022) 52:e20210253. doi: 10.1590/0103-8478cr20210253
4. Jacinto, JG, Bolcato, M, Sheahan, BJ, Muscatello, LV, Gentile, A, Avallone, G, et al. Tumores congénitos y lesiones similares a tumores en terneros: una revisión. J Comp Pathol. (2021) 184:84–94. doi: 10.1016/j.jcpa.2021.02.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Kurman, RJ, Funk, RL y Kirshenbaum, AH. Espina bífida con coristoma asociado de origen mülleriano. J Pathol. (1969) 99:324–7. doi: 10.1002/path.1710990409
6. Sharma, MC, Sarkar, C, Jain, D, Suri, V, Garg, A y Vaishya, S. Masa similar al útero de origen mülleriano en la región lumbosacra que causa el anclaje del cordón umbilical. Reporte de dos casos. J Neurocirugía de la columna vertebral. (2007) 6:73–6. doi: 10.3171/spi.2007.6.1.73
7. Cui, L, Cao, J, Fan, G, Lin, X y Xu, K. Desarrollo de tejido endometrial ectópico intraespinal en relación con el síndrome de la médula anclada. Médico Pasante. (2014) 53:2741–3. doi: 10.2169/internalmedicine.53.2266
8. Chang, PF, Qu, LM, Li, M y Qi, B. Coristoma intraespinal derivado del músculo estriado: informe de un caso. Oncol Lett. (2017) 14:1787–9. doi: 10.3892/ol.2017.6302
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Bassi, P, Gentile, A, y Militerno, G. Coristoma pulmonar retroperitoneal en un ternero recién nacido. J Vet Diagn Investig. (2010) 22:1008–10. doi: 10.1177/104063871002200631
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Yilmaz, A, Bektemur, G, Ekinci, GH, Ongel, EA, Kavas, M, Haciomeroglu, O, et al. Secuestro pulmonar extralobar: reporte de un caso. Monaldi Arch Chest Dis. (2013) 79:90–2. doi: 10.4081/monaldi.2013.98
11. Lee, JY, Yoon, IH, Cho, SW, Jeong, SM, Park, CS y Kim, MC. Quiste broncogénico cervical congénito en un ternero. J Vet Diagn Investig. (2010) 22:479–81. doi: 10.1177/104063871002200329
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Jeon, GW, Han, SW, Jung, JM, Kang, MS, y Sin, JB. El primer caso coreano de heterotopía cutánea del tejido pulmonar. J Korean Med Sci. (2010) 25:1387–9. doi: 10.3346/jkms.2010.25.9.1387
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Corbett, HJ, y Humphrey, GME. Secuestro pulmonar. Paediatr Respir Rev. (2004) 5:59–68. doi: 10.1016/j.prrv.2003.09.009
14. Savic, B, Birtel, FJ, Tholen, W, Funke, HD y Knoche, R. Secuestro pulmonar: informe de siete casos y revisión de 540 casos publicados. Tórax. (1979) 34:96–101. doi: 10.1136/thx.34.1.96
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Canpolat, İ, y Eröksüz, Y. Secuestro pulmonar y quiste broncogénico en un ternero. F ü Sağ bil derg. (2007) 21:281–4.
16. Medeiros de Oliveira, D, Araújo Medeiros, JM, de Araújo, AL, da Anunciação, PL, Pierezan, F, Miranda Neto, EG, et al. Coristoma pulmonar asociado a meningocele de terneros. Ciência Rural. (2009) 39:2652–4. doi: 10.1590/S0103-84782009000900045
17. Islam, MR, Roh, YS, Cho, A, Park, H, Heo, SY, Lee, K, et al. Múltiples anomalías congénitas en un ternero nativo de Corea (Bos taurus coreanae). Coreano J Vet Res. (2011) 51:63–7. doi: 10.14405/kjvr.2011.51.1.063
18. Kılıç, E, Yayla, S, Beytut, E, Baran, V, y Ermutlu, CŞ. Pulmón ectópico subcutáneo en la región cervical de un ternero: informe de un caso. Veterinario Arhiv. (2015) 85:701–9.
19. Brown, PJ, Cooke, PM, Lucke, VM, Pearson, H, y Wardle, GB. Malformaciones broncopulmonares congénitas del intestino anterior en dos bovinos frisones más jóvenes. Rec. Veterinario (1988) 122:208–9. doi: 10.1136/vr.122.9.208
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Chauvet, AE, Lipsitz, D, Burek, K y Bailey, CS. Coristoma pulmonar en una pantorrilla. ¿Puede Vet J. (1994) 35:441–2.
21. Thomson, RG. Congenital bronchial hypoplasia in calves. Pathol Vet. (1966) 3:89–109. doi: 10.1177/030098586600300201
22. Sjolte, IP, and Christiansen, MJ. Zehn Fälle von Nebenlungenbei Tieren. Virchows Arch. (1937) 302:93–117.
23. Koç, Y, Ogurtan, Z, Tuzcu, M, Alkan, F, and Ciftci, MK. Heterotypic pulmonary anomaly in paralumbar region of a calf. Vet Bil Derg. (1998) 14:151–4.
24. Kieck, CF, and De Villiers, JC. Subcutaneous lumbosacral lipomas. S Afr Med J. (1975) 49:1563–6.
25. Boyd, JS. Unusual case of spina bifida in a Friesian cross calf. Vet Rec. (1985) 116:203–5. doi: 10.1136/vr.116.8.203
26. Berchtold, B, Meylan, M, Gendron, K, Morath, U, Rytz, U, and Lejeune, B. Successful treatment of an intrathoracic bronchogenic cyst in a Holstein-Friesian calf. Acta Vet Scand. (2013) 55:14. doi: 10.1186/1751-0147-55-14
27. Chakraborty, RK, and Sharma, S. Pulmonary sequestration. Treasure Island (FL): StatPearls; (2020). Available at: https://europepmc.org/article/NBK/nbk532314
28. Arcomano, JP, and Azzoni, AA. Intralobar pulmonary sequestration and intralobar enteric sequestration associated with vertebral anomalies. J Thorac Cardiovasc Surg. (1967) 53:470–6. doi: 10.1016/S0022-5223(19)43170-X
29. Büyükkaya, R, Büyükkaya, A, Ilce, Z, Erdoğmuş, B, Küçük, A, and Özturk, B. Role and importance of Doppler ultrasound in the diagnosis of pulmonary sequestration: report of two adolescent cases. Med Ultrason. (2013) 15:326–9. doi: 10.11152/mu.2013.2066.154.rb2
30. Yoshioka, K, Ishikawa, A, Sugiyama, M, Nagasao, J, and Kikuchi, M. A case of a giant mass in the lumbar region of a newborn calf. Okajimas Folia Anat Jpn. (2017) 94:1–6. doi: 10.2535/ofaj.94.1
31. Middleton, JR, Valdez, R, Britt, LG, Parish, SM, and Tyler, JW. Progressive hindlimb paraparesis in a goat associated with a vascular hamartoma. Vet Rec. (1999) 144:264–5. doi: 10.1136/vr.144.10.264
32. Collins, N, Kelly, G, Pollock, PJ, McAllister, H y Schumacher, J. Hamartoma fibroso subcutáneo en un potro. Rec. Veterinario (2004) 154:474–6. doi: 10.1136/vr.154.15.474
33. Sickinger, M, Wasieri, J, Koehler, K, Doll, K y Reinacher, M. Lipomas infiltrativos congénitos en un ternero. J Vet Diagn Investig. (2009) 21:719–21. doi: 10.1177/104063870902100522
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Rebsamen, E, Gygax, D, Dennler, M, Jud, R, y Kummer, M. Limpoma infiltrante externo en un potro de dos semanas de edad: evaluación tomográfica computarizada para la evaluación de la extensión e invasividad del tumor. Veterinario Equino Educ. (2010) 22:602–7. doi: 10.1111/j.2042-3292.2010.00137.x
35. Abouelnasr, K EL-Shafaey ES, Mosbah E, EL-Khodery S. Utilidad de la ecografía para el diagnóstico de hinchazones superficiales en búfalos (Bubalus bubalis). J Vet Med Sci. (2016) 78:1303–9. doi: 10.1292/jvms.15-0629
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Braun, U, Suárez, J, Gasparini, S, Warislohner, S, y Dennler, M. Resonancia magnética en un cordero con compresión de la médula espinal torácica por un absceso. Schweiz Arch Tierheilkd. (2016) 158:573–7. doi: 10.17236/sat00079
37. Toma, HS, Barreto, JVP, Amude, AM, Toma, CDM, Carvalho, AM, Cabral, LS, et al. Primera aparición de malformación Arnold Chiari tipo II y anomalías asociadas en un ternero Gir producido in vitro en Brasil – reporte de caso. Arq Bras Med Vet Zootec. (2021) 73:916–22. doi: 10.1590/1678-4162-12351
38. Yuan, A, Yang, PC, Chang, DB, Yu, CJ, Kuo, SH, Luh, KT, et al. Diagnóstico con ecografía y técnica Doppler triplex en un adulto. Pecho. (1992) 102:1880–2. doi: 10.1378/chest.102.6.1880
39. Kang, M, Khandelwal, N, Ojili, V, Rao, KLN y Rana, SS. Angiografía por TC multidetector en el secuestro pulmonar. J Comput Assist Tomogr. (2006) 30:926–32. doi: 10.1097/01.rct.0000224626.94703.61
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Osama, M, Sharma, R, y Dhawan, S. Ectopia cutánea del pulmón, localizada en la espalda y el cuello: presentación hasta ahora no descrita. J Cutan Pathol. (2022) 49:95–8. doi: 10.1111/cup.14131
41. Morita, Y, Sugiyama, S y Tsuka, T. Imágenes de ultrasonido asociadas con mordeduras de serpiente en un ternero negro japonés. J Anim Sci Res. (2019) 3:3. doi: 10.16966/2576-6457.127
42. Tsuka, T, Okamoto, Y, Osaki, T, Azuma, K, Yamashita, M, Amaha, T, et al. Tratamiento de heridas con presión negativa con una técnica de jeringa para el hematoma subcutáneo en una vaquilla. J Vet Med Animal Sci. (2021) 4:1053.
43. Jaffe, MH, Bank ER Silver, TM, y Bowerman, RA. Secuestro pulmonar: aspecto ultrasónico. J Clin Ultrasonido. (1982) 10:294–6. doi: 10.1002/jcu.1870100612
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Ko, SF, Ng, SH, Lee, TY, Wan, YL, Liang, CD, Lin, JW, et al. Imágenes no invasivas del secuestro broncopulmonar. Am J Roentgenol. (2000) 175:1005–12. doi: 10.2214/ajr.175.4.1751005
45. Ohba, Y, Iguchi, T, Hirose, Y, Takasu, M, Nishii, N, Maeda, S, et al. Diagnóstico por tomografía computarizada de meningoencefalocele en ternero. J Vet Med Sci. (2008) 70:829–31. doi: 10.1292/jvms.70.829
46. Newman, B. Ecografía en tiempo real e imágenes Doppler color en el secuestro pulmonar. Pediatría. (1990) 86:620–3. doi: 10.1542/peds.86.4.620
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Yue, SW, Guo, H, Zhang, YG, Gao, JB, Ma, XX y Ding, PX. Valor clínico de la angiografía por tomografía computarizada para el diagnóstico y la planificación terapéutica de pacientes con secuestro pulmonar. Eur J Cirugía cardiotorácica. (2013) 43:946–51. doi: 10.1093/ejcts/ezs484
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: estructuras bronquiales, pantorrilla, ecografía Doppler, vaso arterial de alimentación, coristoma pulmonar
Cita: Usaki N, Tsuka T, Hatanaka M, Sunden Y, Imamura A y Morita T (2024) Reporte de caso: Diagnóstico y tratamiento del coristoma pulmonar en un ternero recién nacido. Frente. Vet. Sci. 10:1257329. doi: 10.3389/fvets.2023.1257329
Recibido: 12 de julio de 2023; Aceptado: 13 de diciembre de 2023;
Publicado: 01 Febrero 2024.
Editado por:
Sibylle Maria Kneissl, Universidad de Medicina Veterinaria de Viena, Austria
Revisado por:
Annamaria Grandis, Universidad de Bolonia, Italia Marilena Bolcato, Universidad de Bolonia, Italia
Derechos de autor © 2024 Usaki, Tsuka, Hatanaka, Sunden, Imamura y Morita. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Takeshi Tsuka, tsuka@tottori-u.ac.jp
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

