Citometría de flujo de células no hematopoyéticas en derrames caninos
 Federica SiniUn †
Federica SiniUn † Maverick MelegaUn †
Maverick MelegaUn † Francesca Tiziana Cannizzo1
Francesca Tiziana Cannizzo1 Bárbara Miniscalco1
Bárbara Miniscalco1 Paola Valenti2
Paola Valenti2 Fulvio Rionato1*
Fulvio Rionato1*- 1Departamento de Ciencias Veterinarias, Facultad de Agricultura y Medicina Veterinaria, Universidad de Turín, Grugliasco, TO, Italia
- número arábigoClinica Veterinaria Malpensa AniCura, Samarate, VA, Italia
La identificación de células no hematopoyéticas en derrames es un reto diagnóstico en citología. Las biopsias de mesotelio o lesiones primarias se realizan con poca frecuencia en entornos clínicos y la inmunoquímica en frotis o la inmunohistoquímica en bloques celulares son las pruebas auxiliares más comunes para refinar el diagnóstico citológico. Los derrames cavitarios son una matriz ideal para la citometría de flujo y la disponibilidad de un panel citométrico para describir las células no hematopoyéticas representaría una herramienta útil. En este trabajo se presentan los resultados de la determinación por citometría de flujo e inmunohistoquímica de citoqueratina (CK), vimentina (VIM) y desmina (DES) en 36 derrames caninos. La concordancia entre los dos métodos fue perfecta para CK (100%), sustancial para VIM (77,8%) y casi perfecta para DES (97,2%). El panel se interpretó para definir el origen epitelial (CK+VIM-DES-), mesotelial (CK+VIM+DES+) o mesenquimal (CK-VIM+DES-) de las células. Los perfiles inesperados se consideraron dudosos y los patrones observados se discutieron individualmente. La concordancia de la interpretación del panel entre ambos métodos fue del 75%. La evaluación de los casos discordantes y dudosos sugiere una menor sensibilidad de la citometría de flujo en la detección de la expresión de VIM y reveló una alta frecuencia de células epiteliales VIM+, expresión variable de VIM en células mesoteliales y un papel importante de DES en la exclusión de un origen epitelial cuando es positivo. Son necesarios estudios multicéntricos basados en diagnósticos histopatológicos para confirmar estos hallazgos y evaluar la utilidad diagnóstica del panel para refinar el diagnóstico citológico. Nuestros resultados muestran que la citometría de flujo puede ser una alternativa que ahorra tiempo a la IHQ en bloques celulares en entornos clínicos para detectar la expresión de CK, VIM y DES. La interpretación del grupo especial es similar en la mayoría de los casos; sin embargo, pueden ocurrir resultados discordantes ocasionales, particularmente para VIM.
1 Introducción
La citología del derrame es compleja, ya que puede haber múltiples células inflamatorias, reactivas y posiblemente neoplásicas en la misma muestra. Los principales desafíos incluyen la identificación de células en función de la forma (las células en el líquido parecen redondas independientemente de su origen), la presencia de células mesoteliales que se exfolian fácilmente independientemente de la causa subyacente y la morfología superpuesta de células mesoteliales reactivas, células mesoteliales neoplásicas y otras células malignas exfoliativas (por ejemplo, células epiteliales neoplásicas). La presencia de grupos cohesivos puede sugerir un origen epitelial; Sin embargo, tanto las células mesoteliales reactivas como las neoplásicas pueden exfoliarse en agregados cohesivos variables. Además, los carcinomas pobremente diferenciados pueden ser menos cohesivos con predominio de células individualizadas (1).
Si bien la citología puede ser útil para clasificar los derrames trasudados e inflamatorios, su sensibilidad para el diagnóstico de neoplasias malignas es limitada, particularmente en el caso de células no hematopoyéticas (NH) (2-4). En estos casos, se puede lograr un diagnóstico final con histopatología y, posiblemente, inmunohistoquímica (IHQ) de las lesiones primarias. Sin embargo, la recolección de líquidos y la citología a menudo no van seguidas de procedimientos de diagnóstico más invasivos; La recolección de biopsias de tejido intratorácico o abdominal a menudo es rechazada por los dueños de mascotas o no se recomienda clínicamente dada la condición inestable de algunos de estos pacientes. Se pueden utilizar técnicas auxiliares para afinar el diagnóstico citológico definiendo el inmunofenotipo y, por tanto, el origen de las células NH en los derrames cavitarios. En medicina veterinaria, se han descrito y aplicado con éxito la inmunoquímica en preparaciones citológicas (5) y la IHQ en bloques celulares en derrames para la caracterización inmunoquímica (4, 6-9).
Actualmente, el panel mínimo para diferenciar las células epiteliales y mesoteliales debería incluir citoqueratina (CK) y vimentina (VIM) (10). La coexpresión de CK y VIM se considera la característica principal de las células mesoteliales, mientras que la expresión de CK o VIM solo se espera en las células epiteliales y mesenquimales, respectivamente (11). Sin embargo, varios informes revelaron una expresión variable de VIM en células epiteliales y mesoteliales (4, 7). Para superar esta limitación, se ha recomendado un panel más amplio que incluya los marcadores positivos y negativos esperados para el diagnóstico del mesotelioma maligno en medicina humana (12). La desmina (DES) se utiliza para distinguir las células mesoteliales y epiteliales neoplásicas (DES-) reactivas (DES+) en las personas (13, 14). En medicina veterinaria, el DES no parece ser un marcador exclusivo para distinguir las células mesoteliales reactivas de las neoplásicas, pero se ha demostrado su utilidad para diferenciar las células mesoteliales y epiteliales (4, 5, 15). Una combinación de CK, VIM y DES puede representar un panel de partida para diferenciar el linaje celular en los derrames. Las técnicas inmunoquímicas y la producción de bloques celulares tienen limitaciones, como la necesidad de capacitación adicional y una cantidad significativa de tiempo práctico del técnico, un tiempo de respuesta prolongado y una posibilidad limitada de análisis de marcadores múltiples (6, 16, 17). Por el contrario, la citometría de flujo (FC) es un método sensible, rápido y asequible para estudiar matrices de fluidos. Permite el análisis simultáneo de múltiples antígenos en un gran número de células si se compara con la IHQ y permite la caracterización de subconjuntos de células en una población mixta. Sin embargo, no permite estudios retrospectivos ya que el análisis se limita a muestras frescas y viabilidad celular. En medicina humana, varios estudios demostraron que la CF puede contribuir a refinar el diagnóstico citológico de los trastornos no hematopoyéticos en los derrames (17-19). Si bien la CF se utiliza de forma rutinaria en medicina veterinaria para el inmunofenotipado de trastornos hematológicos en sangre periférica, médula ósea, ganglios linfáticos, tejidos periféricos y fluidos corporales (20-23), no se dispone de datos sobre el uso de esta técnica para caracterizar las células NH en los derrames cavitarios.
El objetivo de este estudio es comparar la determinación de FC de CK, VIM y DES en células NH en derrames caninos con los resultados de IHQ pareados en bloques celulares. El objetivo final es proporcionar una herramienta adicional para caracterizar las células NH en derrames.
2 Materiales y métodos
Se consideraron para el estudio los derrames pleurales, pericárdicos y cavitarios peritoneales caninos recibidos en el Laboratorio de Análisis Clínicos del Hospital Veterinario Docente de la Universidad de Turín (Grugliasco, IT). Los perros eran de propiedad privada y se sometieron a muestreos con fines diagnósticos con el consentimiento informado firmado por los propietarios. Por lo tanto, no se requirió la aprobación formal específica del Comité Institucional para el Cuidado de los Animales de los autores (protocolo 1965-2017, Comité de Ética, Universidad de Turín). Las muestras se recogieron en tubos de EDTA y se procesaron de forma rutinaria. Se incluyeron en el estudio muestras con evidencia citológica de células de presunto origen NH y muestras con abundantes células mesoteliales reactivas si se disponía de al menos 2 ml de líquido después del análisis de rutina. Las muestras se procesaron para FC y los bloques de celdas se prepararon dentro de las 24 horas posteriores a la recolección. Se excluyeron los casos con bloques celulares inadecuados para IHQ y muestras con <1% de población CD45 negativa o CD11b negativa en CF.
2.1 Citometría de flujo
El análisis de FC se realizó con un BD Accuri C6 (Becton Dickinson, San José, CA) y un citómetro de flujo Cytoflex (Beckman Coulter, Brea, USA).
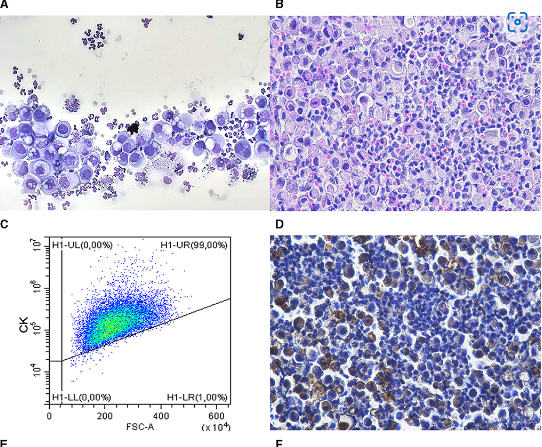
Las células NH se detectaron como CD45 negativos (13 casos) o grandes CD11b negativos (23 casos). Previamente evaluamos la coexpresión de los dos marcadores en ocho casos, mostrando que los dos marcadores permiten la detección de la misma población (Figura complementaria 1).
La celularidad de la muestra se evaluó mediante citometría de flujo tras la extracción de eritrocitos con un tampón base de cloruro de amonio (dilución 1:10, 10 min de incubación). La calidad de la muestra se evaluó mediante la adición adicional de 10 uL de yoduro de propidio. Un tubo con ~60 × 105 células se incubó 20 min a 4 °C en la oscuridad con un anticuerpo monoclonal anti-CD11b o anti-CD45 previamente titulado. Los eritrocitos se lisaron como se describió anteriormente y las células se lavaron con PBS mediante centrifugación a 1.200 rpm durante 5 min. El pellet celular se procesó para la tinción citoplasmática utilizando un kit comercial (eBioscienceTM Intracellular Fixation & Permeabilization Buffer Set, ThermoFisher). Brevemente, se incubó durante 10 min a 4°C con tampón de fijación, se lavó una vez con PBS y dos veces con tampón de permeabilización, se resuspendió en 240 uL de tampón de permeabilización y el volumen obtenido se dividió en seis tubos. Se utilizaron cuatro tubos para la tinción directa: control negativo (adicionado con 10 uL de PBS) para ajustar la autofluorescencia, control de isotipo, CK y VIM de acuerdo con la titulación previa. Se utilizaron dos tubos para la tinción indirecta añadiendo 10 ul de PBS y anticuerpo monoclonal anti-DES, respectivamente. Las muestras se incubaron durante 30 min a 4°C y se lavaron dos veces con solución de permeabilización. Los tubos para tinción directa se resuspendieron en PBS y se adquirieron inmediatamente en el citómetro. Los tubos para tinción indirecta se incubaron durante 20 min adicionales a 4 °C con el anticuerpo secundario conjugado AlexaFluor488, se lavaron con tampón de permeabilización, se resuspendieron en PBS y se adquirieron. La información sobre los anticuerpos utilizados se presenta en la Tabla 1.

Se adquirieron un mínimo de 1.000 eventos CD11b negativos grandes o CD45 negativos para cada tubo. Se estableció una primera puerta en un diagrama de dispersión FSC-H vs. FSC-A para excluir dobletes y una segunda puerta morfológica (FSC-A vs. SSC-A) para excluir eventos más pequeños que linfocitos pequeños. Las células NH se clasificaron como grandes eventos CD11b negativos o CD45 negativos y la puerta positiva se describió para incluir el <1% de los eventos en controles negativos (Figura complementaria 2). La inmunorreacción a los marcadores citoplasmáticos (CK, VIM, DES) se definió como positiva cuando al menos el 20% de la población cayó en la puerta positiva. Todos los casos fueron analizados por el mismo patólogo (FR), que estaba ciego a los resultados de la IHQ.
2.2 Bloqueos celulares e inmunohistoquímica
Los bloques de tubos celulares se prepararon como se describió anteriormente (6). Se evaluaron los cortes teñidos con H y E para determinar la presencia de células diana con una morfología y celularidad adecuadas. Los bloques celulares considerados adecuados para IHQ se procesaron posteriormente y se tiñeron para CK, VIM y DES. Brevemente, se cortaron cuatro secciones micrométricas, se colocaron en portaobjetos de vidrio adhesivo Tomo® IHC (Matsunami glass Ltd.) y se secaron en horno de convección a 50 °C durante 30 min. Las IHC se realizaron en una sesión con un inmunotinción automatizado (procesador BenchMark XT, Ventana Medical Systems, Tucson, AZ). Las secciones se desparafinaron con xileno y se rehidrataron con concentraciones decrecientes de etanol. La actividad de la peroxidasa endógena se inhibió con una solución de peróxido de hidrógeno al 3% y la recuperación del antígeno inducida por calor se realizó con una solución CC1 (EDTA) durante 24 min a 100 °C. La incubación se realizó a 37 °C durante 30 min para todos los anticuerpos. Los clones de anticuerpos fueron los mismos utilizados en el análisis de FC (Tabla 1). Para todas las muestras se utilizó el kit de detección de DAB universal Ventana ultraView. Se utilizaron como controles la sección histológica del intestino canino, hígado, páncreas, bazo y ganglio linfático.
La interpretación de la IHQ se realizó revisando la preparación citológica de May-Grunwald Giemsa y los bloques celulares teñidos con H&E para asegurar una correcta identificación de las células NH y evaluar la inmunorreacción. Las secciones se evaluaron para determinar la proporción de células NH positivas, proporcionando un porcentaje de 0 a 100. La población NH se definió como positiva cuando más del 20% de las células eran positivas. Todas las muestras fueron evaluadas por el mismo patólogo (FTC).
2.3 Interpretación del Grupo Especial
Los paneles se interpretaron para ambos métodos en función de los patrones de tinción esperados para las células epiteliales (CK+VIM-DES-), las células mesoteliales (CK+VIM+DES+) y las células mesenquimales (CK-VIM+DES-), según la presentación más frecuente (4, 5, 10, 24). Los patrones que se desviaban de lo esperado se interpretaron como «dudosos».
2.4 Análisis estadístico
Los resultados de FC para cada parámetro (CK, VIM, DES) se informan en el texto como porcentaje medio y rango (mínimo-máximo). Se calculó la concordancia entre los resultados de la CF y la IHQ para la expresión (positiva o negativa) de los marcadores individuales y para la interpretación del panel. El grado de concordancia se definió de acuerdo con el valor kappa reportado previamente (25): malo (0-0,20), regular (0,21-0,40), moderado (0,41-0,60), sustancial (0,61-0,80) o casi perfecto (0,81-1,00).
3 Resultados
Se incluyeron treinta y seis muestras de las cavidades pleural (N = 19), peritoneal (N = 11) y pericárdica (N = 6) de 36 perros. Los pacientes fueron 17 mujeres (9 castrados) y 19 hombres (3 castrados), la edad media fue de 9,7 años (rango 4-15 años).
Los resultados de los análisis de líquidos de rutina, incluida la citología, el recuento total de células nucleadas, los sólidos totales y la interpretación diagnóstica final basada en datos clínicos y clínico-patológicos, se informan en la Tabla Suplementaria 1.
3.1 Citometría de flujo
Los detalles de los casos individuales se muestran en la Tabla 2, Tabla Suplementaria 1. La mediana de la proporción de células NH fue del 13,1% (rango 1,1%-65,3%). Treinta y cinco de las 36 muestras fueron CK positivas. La mediana de la proporción de células diana positivas fue del 93,2% (rango 45,3%-99,5%). Una muestra fue CK negativa (0,3% de la población objetivo). Dieciocho de las 36 muestras fueron VIM positivas (mediana 66,3%; rango 21,4%-98,9%). Dieciocho de las 36 muestras fueron VIM negativas (mediana 7,8%; rango 0,4%-18,2%). Dieciséis de las 36 muestras fueron positivas para DES (mediana 76%; rango 34%-96,2%). Veinte de las 36 muestras fueron negativas para DES (mediana 4,3%; rango 0,1%-18,2%).
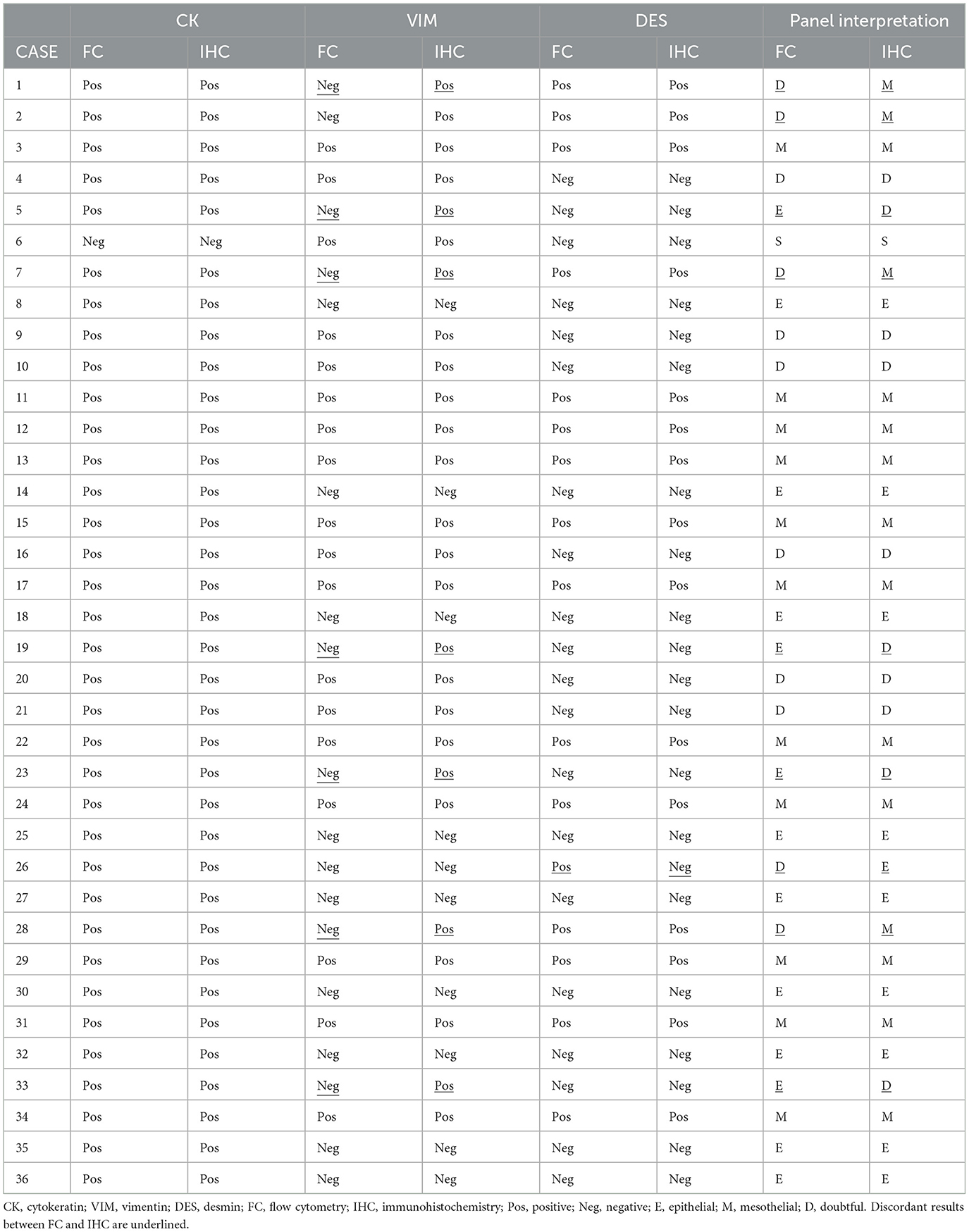
De acuerdo con la interpretación del panel, las células NH fueron mesoteliales en 11 casos (CK+VIM+DES+), epiteliales en 13 casos (CK+VIM-DES-), mesenquimales en 1 caso (CK-VIM+DES-) y dudosas en 11 casos (6 CK+VIM+DES- y 5 CK+VIM-DES+).
3.2 Inmunohistoquímica
Los detalles de los casos individuales se muestran en la Tabla 2, Tabla Suplementaria 1. Treinta y cinco de las 36 muestras fueron CK positivas. La mediana de la proporción de células diana positivas fue del 91 % (intervalo del 72 % al 100 %). En una muestra no había células CK positivas. Veintiséis de las 36 muestras fueron VIM positivas (mediana 87%; rango 21%-100%) mientras que 10 muestras fueron VIM negativas (mediana 2,5%; rango 0%-15%). Quince de las 36 muestras fueron DES positivas (mediana 78%; rango 25%-92%) y 21 fueron DES negativas (mediana 3%; rango 0%-15%).
De acuerdo con la interpretación del panel, las células NH fueron mesoteliales en 15 casos (CK+VIM+DES+), epiteliales en 10 casos (CK+VIM-DES-), mesenquimales en 1 caso (CK-VIM+DES-) y dudosas en 10 casos (CK+VIM+DES-).
3.3 Concordancia entre los resultados de FC e IHC
FC e IHC reportaron 36 resultados concordantes de CK (35 CK+ y 1 CK-) con un 100% de concordancia.
Los dos métodos reportaron 28 resultados concordantes (18 positivos y 10 negativos) y 8 discordantes de VIM con un 77,8% de concordancia. Todos los casos discordantes fueron VIM- en FC y VIM+ en IHQ en bloque celular. El porcentaje de eventos positivos en CF fue de <10% en seis casos, 17,4% y 18,2% en los dos restantes. El porcentaje de células positivas en la IHQ fue de >70% en todos los casos excepto en dos (21% y 32%). FC e IHC reportaron 35 resultados concordantes (15 DES+ y 20 DES-) y un DES discordante con un 97,2% de concordancia. El caso discordante fue DES+ en FC (34% de eventos positivos) y DES- en IHQ (15% de células positivas). En la Figura 1 se muestran imágenes representativas de IHC y diagramas de dispersión de FC.

La interpretación del panel fue concordante en 27/36 casos (11 mesoteliales; 9 epiteliales; 1 mesenquimatoso; 6 dudosos) con un 75% de acuerdo. De los nueve casos discordantes, cinco se interpretaron como dudosos en la CF y mesoteliales (4) o epiteliales (1) en la IHQ en los bloques celulares. Mientras que cuatro casos fueron epiteliales en la CF y dudosos en la IHQ. En 8/9 casos la discrepancia se debió a VIM+ en IHQ y VIM- en FC, en un caso la discrepancia se debió a DES- en IHQ y DES+ en FC.
4 Discusión
Técnicas auxiliares como la inmunocitoquímica y la IHQ en bloques celulares son útiles para refinar el diagnóstico citológico de los derrames (10). A pesar de ser utilizado de forma rutinaria para las neoplasias hematológicas malignas en perros y gatos (26), las aplicaciones de la FC en el inmunofenotipado de células NH en derrames no han sido investigadas en medicina veterinaria. En este trabajo describimos por primera vez una aproximación de citometría de flujo a células de inmunofenotipo NH en derrames cavitarios caninos.
La FC requiere que las células estén en una suspensión para ser analizadas y los fluidos corporales son una matriz «lista para usar» para esta técnica, lo que la convierte en un método rápido y rentable para estudiar los derrames y una alternativa potencial a la inmunocitoquímica en frotis y a la IHQ en bloques celulares. En patología humana, la CF se está utilizando cada vez más para inmunofenotipar células NH en derrames con resultados prometedores (17-19). La FC permite la identificación de subpoblaciones de células en función de las propiedades morfológicas (es decir, el tamaño y la complejidad) y el uso de combinaciones de marcadores. En este caso, se utilizaron CD45 o CD11b para excluir las células hematopoyéticas del análisis e identificar las células NH. A continuación, se describió su fenotipo a partir de la inmunorreacción a los anticuerpos frente a tres filamentos intermedios (CK, VIM y DES). Este enfoque permitió el análisis de muestras incluso en presencia de bajos porcentajes de células NH.
El acuerdo entre FC e IHC en la interpretación de los marcadores individuales fue perfecto para CK, casi perfecto para DES, y sustancial para VIM, lo que llevó a un acuerdo sustancial en la interpretación final del panel. El único caso con interpretación de panel discordante debido a DES condujo a una clasificación epitelial en IHQ (CK+VIM-DES-) y dudosa en FC (CK+VIM-DES+). Este caso fue un derrame pleural que se sospechó en citología mesotelial-neoplásico; Desafortunadamente, no se disponía de un diagnóstico definitivo. Todos los demás resultados discordantes se debieron a una reacción VIM positiva en IHQ y negativa en FC. La mitad de estos casos fueron CK+VIM+DES- en IHQ, interpretada como dudosa, y CK+VIM-DES- en CF, interpretada como epitelial. En este estudio, el perfil CK+VIM+DES- se consideró dudoso, ya que la posible interpretación incluía células mesoteliales DES- o células epiteliales VIM+. Se han descrito previamente células desmesoteliales (4, 15); sin embargo, esto se consideró poco probable en estos casos. El origen epitelial se apoyó además en el diagnóstico clínico, citológico y/o histopatológico del carcinoma (2 carcinomas de mama con diseminación multiorgánica, 1 carcinoma de pulmón, 1 carcinoma gástrico). En estos casos, aunque la FC proporcionó el fenotipo esperado para las células epiteliales, se consideró más probable una expresión genuina de VIM dada la tinción fuerte y específica en la IHQ. Las células epiteliales VIM+ se han descrito previamente en derrames (4, 5, 7) y en algunos carcinomas (27). La expresión variable de VIM en células epiteliales neoplásicas puede ser el resultado de una transición epitelio-mesenquimal (EMT) de tipo tres, donde las células pierden polarización y estabilidad, adquieren rasgos migratorios y aumentan VIM mientras disminuyen las proteínas de adhesión epitelial como las cadherinas (28). La razón por la que no se reconoce el VIM en la FC aún no se ha establecido y múltiples factores pueden estar contribuyendo. La agregación de células NH puede haber afectado a la permeabilización e impedido la unión antígeno-anticuerpo. La expresión de VIM puede haber sido demasiado baja para la detección por FC, donde el brillo de la señal se correlaciona con la cantidad total de antígeno en cada célula, a diferencia de la IHQ, donde la intensidad de la tinción y el patrón citoplasmático son parámetros independientes. Todos estos casos fueron DES-, lo que refuerza la hipótesis de que el DES es negativo en las células epiteliales y sugiere que la positividad del DES podría ayudar a excluir un origen epitelial. En la mitad restante de los casos, las células NH fueron CK+VIM+DES+ en IHQ, interpretadas como mesoteliales, y CK+VIM-DES+ en FC, interpretadas como dudosas. El perfil CK+VIM-DES+ se consideró dudoso, ya que la posible interpretación incluía células mesoteliales VIM-o células epiteliales DES+. Se ha descrito la presencia de células epiteliales DES+ en una pequeña proporción de células (1-25%) en el derrame de un perro con carcinoma (4). Esta posibilidad se consideró menos probable en este caso, ya que los datos citológicos, clínicos, de imagen y de seguimiento respaldaban firmemente el origen mesotelial reactivo de estas células en 3 de cada 4 casos; Diagnóstico clínico definitivo de ascitis por insuficiencia cardíaca congestiva, pericarditis idiopática (viva a los 2 años, sin recaída) y derrame pericárdico hemorrágico por rotura de masa auricular derecha compatible con hemangiosarcoma. Desafortunadamente, no se disponía de pruebas suficientes para un diagnóstico definitivo en un caso; Se trataba de una sospecha de mesotelioma basada únicamente en la citología; Los pacientes presentaron derrame pleural recurrente sin evidencia de lesión primaria en las imágenes y se les practicó la eutanasia 3 meses después de la presentación, se rechazó la necropsia. Estos hallazgos apoyan la evidencia actual de que las células mesoteliales expresan VIM de manera variable, variando de negativo a fuertemente positivo (4, 7, 15) y consolidan la hipótesis de que la falta de VIM no excluye un origen mesotelial.
En general, estos hallazgos confirman que la coexpresión de CK y VIM por sí sola no es fiable para distinguir entre células epiteliales y mesoteliales en los derrames, como se ha informado anteriormente (4) y que es necesario un panel más amplio de marcadores. Por ejemplo, WT-1 (4, 7) y DES parecen ser buenos candidatos para este propósito. Al considerar la IHQ como método de referencia, las discrepancias entre las dos técnicas sugieren una menor fiabilidad de la FC en la detección de la expresión de VIM, pero la adición de DES es útil para descartar un origen epitelial. Pueden estar indicados estudios adicionales que investiguen diferentes clones para detectar la expresión de VIM en FC.
Si bien la presencia de células epiteliales o mesenquimales en el derrame es un fuerte indicador de neoplasia, se necesita una caracterización adicional para distinguir entre células mesoteliales reactivas y neoplásicas. Sobre la base de los datos disponibles en esta serie, la VIM se expresó de forma variable tanto en las células mesoteliales reactivas como en las neoplásicas, y es poco probable que la expresión de VIM desempeñe un papel en la diferenciación entre ambas. En las personas, el DES se utiliza principalmente para distinguir las células mesoteliales reactivas (DES+) de las neoplásicas (DES-) (13, 14), mientras que en los perros parece limitarse a distinguir entre células mesoteliales y epiteliales (4, 5, 15). En esta cohorte, seis casos mostraron un perfil dudoso de DES- tanto por CF como por IHQ. La interpretación clínico-patológica final fue indicativa de derrame neoplásico en cinco de estos casos; sin embargo, el número limitado de casos y la falta de un diagnóstico definitivo dificultan cualquier asociación sólida entre la ausencia de DES y la neoplasia. Anteriormente, es probable que el DES tenga menor sensibilidad y especificidad en perros que en personas para distinguir entre células mesoteliales reactivas y neoplásicas (4, 5, 15); Esto también sugiere que su utilidad en perros probablemente se limite a distinguir las células mesoteliales y epiteliales. Para diferenciar con precisión entre células mesoteliales reactivas y neoplásicas, se necesitan marcadores adicionales para los linajes celulares. En humanos, las directrices recomendaron el uso de un panel de IHQ que incluyera al menos dos marcadores mesoteliales y dos epiteliales, junto con el antígeno de membrana epitelial (EMA), el transportador de glucosa 1 (GLUT1) y la proteína de unión al ARNm del factor de crecimiento similar a la insulina II 3 (IMP3) para distinguir entre el mesotelioma y la hiperplasia reactiva (12). Pocos de estos marcadores se han probado en perros con fines diagnósticos similares, como EMA (29, 30), calretinina (29, 31-36), HBME-1 (37, 38), WT1 (4, 7, 9, 29, 33, 39), GLUT1 e IMP3 (4, 15). Agregar uno o más de ellos al panel puede mejorar la especificidad y la precisión de la clasificación de las células de linaje.
Aunque no es una restricción para el objetivo principal del estudio (comparación de los resultados entre CF y IHQ), la falta de un diagnóstico histopatológico definitivo representa una de las principales limitaciones de nuestro estudio, dificultando la evaluación del valor diagnóstico del panel. Sin embargo, al integrar los resultados de este estudio con la literatura disponible actualmente, en la Figura complementaria 3 se describe un posible algoritmo diagnóstico para interpretar un panel que incluye CK, VIM y DES en FC. Se necesitan estudios prospectivos basados en diagnósticos histopatológicos en una cohorte más grande de casos para investigar su aplicación y se justifican revisiones basadas en investigaciones futuras de marcadores de células mesoteliales reactivas y neoplásicas.
En conclusión, nuestros resultados muestran que la FC puede ser una alternativa multiparamétrica y que ahorra tiempo a la IHQ en bloques celulares en entornos clínicos. La histopatología de la lesión primaria y la inmunohistoquímica deben seguir considerándose las principales herramientas para un diagnóstico definitivo. Sin embargo, el método descrito es una técnica eficaz y no invasiva para refinar el diagnóstico citológico y puede integrarse fácilmente en paneles de rutina para diagnosticar y caracterizar trastornos hematopoyéticos. La interpretación del panel del CF y de la IHC es similar en la mayoría de los casos; sin embargo, pueden ocurrir resultados discordantes ocasionales, particularmente para VIM. Se necesita una cohorte más grande de casos con diagnóstico histológico para evaluar la precisión diagnóstica de esta técnica y del algoritmo propuesto. Al ser FC un método flexible que garantiza el análisis multiparamétrico, el desarrollo de un enfoque multicolor y la inclusión de marcadores adicionales pueden mejorar y consolidar el panel.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán facilitados por los autores, sin reservas indebidas.
Declaración ética
El Comité de Ética de la Universidad de Turín eximió del requisito de aprobación ética a los estudios con animales, ya que los perros eran de propiedad privada, estaban afectados por enfermedades espontáneas y se sometían a muestreos con fines diagnósticos. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
FS: Curación de datos, Análisis formal, Investigación, Visualización, Redacción – revisión y edición. MM: Conceptualización, Análisis formal, Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición. FC: Investigación, Redacción – revisión y edición, Captación de fondos. BM: Investigación, Escritura – revisión y edición. PV: Recursos, Redacción – revisión y edición. FR: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Supervisión, Visualización, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El autor o autores declararon ser miembros del comité editorial de Frontiers, en el momento de la presentación. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1414271/full#supplementary-material
Referencias
1. Valenciano AC, Rizzi TE. Derrames abdominales, torácicos y pericárdicos. En:Valenciano AC, Cowell RL, , editores. Citología diagnóstica y hematología del perro y el gato de Cowell y Tyler. St. Louis, Missouri: Elsevier (2020). págs. 229-246.
2. Hirschberger J, DeNicola DB, Hermanns W, Kraft W. Sensibilidad y especificidad de la evaluación citológica en el diagnóstico de neoplasia en fluidos corporales de perros y gatos. Veterinario Clin Pathol. (1999) 28:142–6. doi: 10.1111/j.1939-165x.1999.tb01065.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Cagle LA, Epstein SE, Owens SD, Mellema MS, Hopper K, Burton AG. Rendimiento diagnóstico del análisis citológico del derrame pericárdico en perros. J Veterinario Pasante Med. (2014) 28:66–71. doi: 10.1111/jvim.12253
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Milne EM, Piviani M, Hodgkiss-Geere HM, Piccinelli C, Cheeseman M, Cazzini P, et al. Comparación del bloqueo celular de derrame y la inmunohistoquímica de la biopsia en la hiperplasia mesotelial, el mesotelioma y el carcinoma en perros. Veterinario Clin Pathol. (2021) 50:555–67. doi: 10.1111/vcp.13002
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Przezdziecki R, Sapierzyński R. Uso de la inmunocitoquímica en el diagnóstico diferencial de neoplasias de cavidades serosas en perros. Pol J Vet Sci. (2014) 17:149–59. doi: 10.2478/pjvs-2014-0020
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Melega M, Santos M, Caniatti M, Valenti P, Miniscalco B, Sulce M, et al. Bloques celulares en medicina veterinaria: comparación de dos métodos (tubo celular y agar) en 52 derrames de perros y gatos. Veterinario Clin Pathol. (2020) 49:632–9. doi: 10.1111/vcp.12922
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Marcos R, Marrinhas C, Malhão F, Canadas A, Santos M, Caniatti M. La técnica de bloqueo de tubos celulares y un panel de inmunohistoquímica que incluye el tumor de Wilms 1 para ayudar a diagnosticar derrames cavitarios en perros y gatos. Veterinario Clin Pathol. (2019) 48:50–60. doi: 10.1111/vcp.12709
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Sampaio F, Marrinhas C, Fonte Oliveira L, Malhão F, Lopes C, Gregório H, et al. Detección de marcadores linfoides (CD3 y PAX5) para inmunofenotipado en perros y gatos: comparación de portaobjetos de citología teñidos y bloques celulares pareados. Veterinario Sci. (2023) 10:157. doi: 10.3390/vetsci10020157
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Kita C, Chambers JK, Tanabe M, Irie M, Yamasaki H, Uchida K. Características inmunohistoquímicas del adenocarcinoma papilar de ovario canino y utilidad de la técnica de bloqueo celular para detectar células neoplásicas en derrames de cavidades corporales. J Vet Med Sci. (2022) 84:406–13. doi: 10.1292/jvms.21-0633
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Camus S, Kelly LA, Barger AB. Inmunocitoquímica. En Valenciano AC y Cowell RL, editores. Citología diagnóstica y hematología del perro y el gato de Cowell y Tyler. St. Louis, Missouri: Elsevier (2020). págs. 512-520.
11. Sawa M, Yabuki A, Kohyama M, Miyoshi N, Yamato O. Tinción inmunofluorescente múltiple rápida para la detección simultánea de citoqueratina y vimentina en la citología de tumores caninos. Veterinario Clin Pathol. (2018) 47:326–32. doi: 10.1111/vcp.12598
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Husain AN, Chapel DB, Attanoos R, et al. Guías para el diagnóstico anatomopatológico del mesotelioma. Arch Pathol Lab Med. (2024). doi: 10.5858/arpa.2023-0304-RA. [Epub antes de imprimir].
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Elmahdy M, Gouda MH, Eloseily GM. Diferenciación inmunohistoquímica entre proliferaciones mesoteliales reactivas y malignas en el derrame pleural. Med J El Cairo Univ. (2019) 87:4345–53. doi: 10.21608/mjcu.2019.78251
14. Attanoos RL, Griffin A, Gibbs AR. El uso de la inmunohistoquímica para distinguir el mesotelio reactivo del neoplásico. Un uso novedoso para la desmina y la evaluación comparativa con el antígeno de la membrana epitelial, p53, el receptor del factor de crecimiento derivado de plaquetas, la glicoproteína P y el Bcl-2. Histopatología. (2003) 43:231-8. doi: 10.1046/j.1365-2559.2003.01686.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Milne E, Martínez Pereira Y, Muir C, Scase T, Shaw DJ, McGregor G, et al. Diferenciación inmunohistoquímica del mesotelio reactivo del maligno como ayuda diagnóstica en la enfermedad pericárdica canina. J Pequeña Anim Pract. (2018) 59:261–71. doi: 10.1111/jsap.12830
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Priest HL, Hume KR, Killick D, Kozicki A, Rizzo VL, Seelig D, et al. El uso, la publicación y las direcciones futuras de la inmunocitoquímica en medicina veterinaria: un consenso del Grupo de Trabajo de Oncología-Patología. Veterinario Comp Oncol. (2017) 15:868–80. doi: 10.1111/vco.12228
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Gaur G, Awasthi NP, Gupta A, Agarwal A, Sachan R, Malhotra KP, et al. Precisión diagnóstica de la citometría de flujo en la detección de células epiteliales malignas en derrames serosos. J Am Soc Citopatol. (2023) 12:423–35. doi: 10.1016/j.jasc.2023.09.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Gostomczyk K, Łukaszewska E, Borowczak J, Bator A, Zdrenka M, Bodnar M, et al. Citometría de flujo en la detección de células tumorales circulantes en derrames neoplásicos. Clin Chim Acta. (2024) 552:117651. doi: 10.1016/j.cca.2023.117651
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Wong-Arteta J, Rey M, Aragón L, Gil-Rodríguez E, Bujanda L. Utilidad de la citometría de flujo en el diagnóstico de derrames malignos por neoplasias no hematopoyéticas. Cytom Parte B – Clin Cytom. (2020) 98:504–15. doi: 10.1002/cyto.b.21886
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Parys M, Bavcar S, Mellanby RJ, Argyle D, Kitamura T. Uso de la citometría de flujo multicolor para la caracterización de células inmunitarias caninas en el cáncer. PLoS UNO. (2023) 18:e0279057. doi: 10.1371/journal.pone.0279057
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Sulce M, Marconato L, Martano M, Iussich S, Dentini A, Melega M, et al. Utilidad de la citometría de flujo en el tumor cutáneo primario canino y en el tumor de mastocitos ganglionares pareados. Veterinario J. (2018) 242:15–23. doi: 10.1016/j.tvjl.2018.10.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Comazzi S, Riondato F. Citometría de flujo en el diagnóstico del linfoma canino de células T. Frente Vet Sci. (2021) 8:600963. doi: 10.3389/fvets.2021.600963
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Riondato F, Comazzi S. Citometría de flujo en el diagnóstico del linfoma canino de células B. Frente Vet Sci. (2021) 8:600986. doi: 10.3389/fvets.2021.600986
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Wallace KA, Goldschmidt MH, Patel RT. Conversión de muestras citológicas basadas en fluidos en muestras histológicas para inmunohistoquímica. Veterinario Clin Pathol. (2015) 44:303–9. doi: 10.1111/vcp.12239
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Landis JR, Koch GG. La medición de la concordancia del observador para datos categóricos. Biometría. (1977) 33:159–74. doi: 10.2307/2529310
26. Evans SJM. Citometría de flujo en la práctica veterinaria. Vet Clin North Am – Pequeña Anim Pract. (2023) 53:89–100. doi: 10.1016/j.cvsm.2022.07.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Burgess HJ, Kerr ME. Coexpresión de citoqueratina y vimentina en 21 neoplasias epiteliales pulmonares primarias caninas. J Vet Diagnóstico Investig. (2009) 21:815–20. doi: 10.1177/104063870902100607
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Dongre A, Weinberg RA. Nuevos conocimientos sobre los mecanismos de la transición epitelio-mesénquima y sus implicaciones para el cáncer. Nat Rev Mol Cell Biol. (2019) 20:69–84. doi: 10.1038/s41580-018-0080-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Sato T, Miyoshi T, Shibuya H, Fujikura J, Koie H, Miyazaki Y. Mesotelioma bifásico peritoneal en un perro. J Vet Med A Physiol Pathol Clin Med. (2005) 52:22–5. doi: 10-1111/j.1439-0442.2004.00680.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Hu C, Zhao M, Wei Q, Chen Z, Zhao B. Carcinoma hepatocelular sarcomatoide: informe de un caso y revisión de la literatura. Medicina. (2024) 103:e37641. doi: 10.1097/MD.0000000000037641
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Geninet C, Bernex F, Rakotovao F, Crespeau FL, Parodi AL, Fontaine JJ. Mesotelioma peritoneal esclerosante en un perro: informe de un caso. J Vet Med A Physiol Pathol Clin Med. (2003) 50:402–5. doi: 10.1046/j.0931-184x.2003.00566.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Morini M, Bettini G, Morandi F, Burdisso R, Marcato PS. Mesotelioma peritoneal deciduoide en un perro. Veterinario Pathol. (2006) 43:198–201. doi: 10.1354/vp.43-2-198
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. D’Angelo AR, Di Francesco G. Mesotelioma peritoneal esclerosante en un perro: investigaciones histopatológicas, histoquímicas e inmunohistoquímicas. Vet Ital. (2014) 50:301–5. doi: 10.12834/VetIt.20.1309.130
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Choi EW. Mesotelioma maligno pericárdico diagnosticado en un perro por inmunocitoquímica del líquido pericárdico: reporte de un caso. BMC Vet Res. (2023) 19:89. doi: 10.1186/s12917-023-03655-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Inanaga M, Yoneji W, Ozaki K. Mesotelioma pleural localizado en un perro. J Comp Pathol. (2023) 207:25–9. doi: 10.1016/j.jcpa.2023.09.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Osaki T, Amaha T, Murahata Y, et al. Utilidad de la biopsia endoscópica guiada por fluorescencia con ácido 5-aminolevulínico para el mesotelioma maligno en perros y gatos. Aust Vet J. (2023) 101:99–105. doi: 10.1111/avj.13224
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Machida N, Tanaka R, Takemura N, Fujii Y, Ueno A, Mitsumori K. Desarrollo de mesotelioma pericárdico en golden retrievers con antecedentes a largo plazo de derrame pericárdico hemorrágico idiopático. J Comp Pathol. (2004) 131:166–75. doi: 10.1016/j.jcpa.2004.03.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Banco B, Antuofermo E, Borzacchiello G, Cossu-Rocca P, Grieco V. Tumores de ovario canino: un estudio inmunohistoquímico con anticuerpo HBME-1. J Vet Diagn Invertir. (2011) 23:977–81. doi: 10.1177/1040638711416848
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Vascellari M, Carminato A, Camali G, Melchiotti E, Mutinelli F. Mesotelioma maligno de la túnica vaginal testicular en un perro: caracterización histológica e inmunohistoquímica. J Vet Diagn Invertir. (2011) 23:135–9. doi: 10.1177/104063871102300125
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: derrame, bloqueo celular, citometría de flujo, vimentina, citoqueratina, desmina, carcinoma, mesotelioma
Cita: Sini F, Melega M, Cannizzo FT, Miniscalco B, Valenti P y Riondato F (2024) Citometría de flujo de células no hematopoyéticas en derrames caninos. Frente. Vet. Sci. 11:1414271. doi: 10.3389/fvets.2024.1414271
Recibido: 08 de abril de 2024; Aceptado: 22 de agosto de 2024;
Publicado: 24 de septiembre de 2024.
Editado por:
Maria Elena Gelain, Universidad de Padua, Italia
Revisado por:
Ricardo Marcos, Universidad de Oporto, Portugal
Filippo Torrigiani, Merck KgaA, Italia
Copyright © 2024 Sini, Melega, Cannizzo, Miniscalco, Valenti y Riondato. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondencia: Fulvio Riondato, fulvio.riondato@unito.it
†Estos autores comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía