Coagulopatía intravascular diseminada crónica con hiperfibrinólisis secundaria paraneoplásica
Caso clínico: Coagulopatía intravascular diseminada crónica con hiperfibrinólisis secundaria paraneoplásica concurrente en un perro con adenocarcinoma nasal metastásico
 Kyle L. Granger Jr.*†
Kyle L. Granger Jr.*†  Trish Paulos†
Trish Paulos†  Mary-Keara Boss Jr.
Mary-Keara Boss Jr.  Liz Guieu
Liz Guieu  Sarah Shropshire
Sarah Shropshire- Departamento de Ciencias Clínicas, Facultad de Medicina Veterinaria y Ciencias Biomédicas, Universidad Estatal de Colorado, Fort Collins, CO, Estados Unidos
En la medicina humana, los trastornos hemostáticos como la trombocitopenia, la hiperfibrinólisis y la coagulopatía intravascular diseminada (CID) se han asociado con muchos cánceres. La hemorragia aguda secundaria a hiperfibrinólisis se ha notificado predominantemente con adenocarcinoma prostático en pacientes humanos. Hasta donde sabe el autor, la hemorragia grave debida a la hiperfibrinólisis paraneoplásica aún no se ha descrito en medicina veterinaria. El caso involucra a un Border Collie macho castrado de 8 años de edad que fue evaluado por epistaxis progresiva y recurrente, con antecedentes de 1 año de tratamiento por adenocarcinoma nasal metastásico. Se diagnosticó una coagulopatía progresiva y grave que se cree que está relacionada con el cáncer conocido. Las pruebas avanzadas de coagulación fueron compatibles con una CID crónica e hiperfibrinólisis secundaria. A lo largo de 1 semana de hospitalización, el perro fue tratado con múltiples hemoderivados, vitamina K1y medicamentos antifibrinolíticos. Si bien el perro fue dado de alta inicialmente a casa, el perro volvió a presentarse al día siguiente y fue sacrificado humanitariamente debido a una mala calidad de vida percibida. El análisis post-mortem reveló un diagnóstico histopatológico de adenocarcinoma diseminado. En perros con adenocarcinoma nasal diseminado que experimentan hemorragias graves, la hiperfibrinólisis secundaria paraneoplásica debe considerarse como un diferencial. Conocer esta asociación podría ayudar a guiar las recomendaciones de tratamiento para un manejo óptimo del paciente.
Introducción
Aunque no se comprende completamente, la interacción entre los procesos neoplásicos y el sistema de coagulación se caracteriza por un desequilibrio entre los factores procoagulantes y anticoagulantes (1). Actualmente, se teoriza que el sistema hemostático es activado por factores procoagulantes como el factor tisular que es producido por las células cancerosas. Esta activación da lugar a la producción local de trombina, lo que conduce al depósito de fibrina y al reclutamiento de plaquetas y, en última instancia, a la trombosis y al consumo de factores de coagulación (2). Se cree que la hiperfibrinólisis paraneoplásica ocurre de dos maneras; las células tumorales (A) producen proteínas profibrinolíticas, como el activador del plasminógeno de tipo uroquinasa (uPA) y el activador del plasminógeno de tipo tisular (tPA) o (B) las membranas de las células tumorales transportan el receptor específico de uPA que puede desencadenar el ensamblaje de componentes fibrinolíticos y, posteriormente, dar lugar a una activación excesiva de la cascada fibrinolítica (3). En las personas, este fenómeno se ha documentado con el adenocarcinoma prostático (4-6). Entre los individuos con adenocarcinoma prostático, el trastorno hemostático predominante es la coagulopatía intravascular diseminada (CID). Si bien se ha documentado la hiperfibrinólisis asociada al adenocarcinoma prostático, solo se ha informado que afecta hasta el 1,65% de los pacientes y generalmente se manifiesta después de intervenciones quirúrgicas (3). En medicina veterinaria, aún no se han reportado hemorragias graves causadas por trastornos paraneoplásicos con hiperfibrinólisis secundaria. Este reporte demuestra el desarrollo de hiperfibrinólisis secundaria paraneoplásica con hemorragia severa en un perro con adenocarcinoma nasal metastásico.
Descripción del caso
Un Border Collie macho castrado de 8 años (25,7 kg) fue evaluado en serie en un Hospital Veterinario Docente (VTH) en enero de 2023 por epistaxis recurrente.
Antecedentes médicos significativos
El perro fue diagnosticado de adenocarcinoma nasal mediante biopsia nasal, sin evidencia de metástasis en la TC torácica o abdominal. En junio de 2022, como parte de un ensayo clínico en curso, el perro fue tratado con losartán (10 mg/kg VO cada 12 h) y propranolol (1 mg/kg VO cada 12 h) durante 7 días, seguidos de 3 días de radioterapia corporal estereotáctica (SBRT) utilizando tres fracciones de terapia de fotones de 10 Gy. Tras la finalización de la SRBT, el régimen de tratamiento del perro se mantuvo con losartán (10 mg/kg VO cada 12 h), propranolol (1 mg/kg VO cada 12 h) y carprofeno (2,2 mg/kg VO cada 12 h). En septiembre de 2022 (5 meses después de la RTBE), la repetición de la TC reveló que el tumor nasal tenía un tamaño reducido. Sin embargo, los aspirados con aguja fina y la citología del ganglio linfático mandibular izquierdo fueron compatibles con adenocarcinoma metastásico. En el examen físico, el perro tenía una secreción nasal serosanguinosa bilateral leve, que luego se volvió más hemorrágica pero autoresuelta y posteriormente fue dada de alta. Aproximadamente 2 semanas después, el perro fue presentado al VTH para su reevaluación, como parte del ensayo clínico, momento en el que no hubo evidencia de secreción nasal. El perro fue sometido a anestesia general para la biopsia tumoral, tras lo cual se apreció una hemorragia importante de las narinas bilaterales. Se realizó un lavado nasal para eliminar la hemorragia y se administró solución de clorhidrato de oximetazolina y epinefrina. Posteriormente, el perro fue hospitalizado con órdenes de aplicación de compresas frías y sedación (gabapentina 10 mg/kg VO cada 12 h, trazodona 7 mg/kg VO cada 8-12 h y acepromazina 0,02 mg/kg VO PRN). Al día siguiente, no se apreció más epistaxis y el perro fue dado de alta a casa. No se realizaron pruebas de coagulación en esta visita. En noviembre de 2022 (7 meses después de la SBRT), el perro se sometió a la extirpación del ganglio linfático mandibular izquierdo. La cirugía fue de rutina y no se observaron eventos adversos en el período perioperatorio ni en el postoperatorio. En diciembre de 2022 (8 meses después de la SBRT), se realizó una nueva tomografía computarizada y el tumor nasal disminuyó aún más de tamaño. Sin embargo, se observó un agrandamiento de los ganglios linfáticos retrofaríngeos y parotídeos, y la PAAF con citología confirmó una mayor diseminación metastásica.
Presentaciones clínicas e investigaciones seriadas
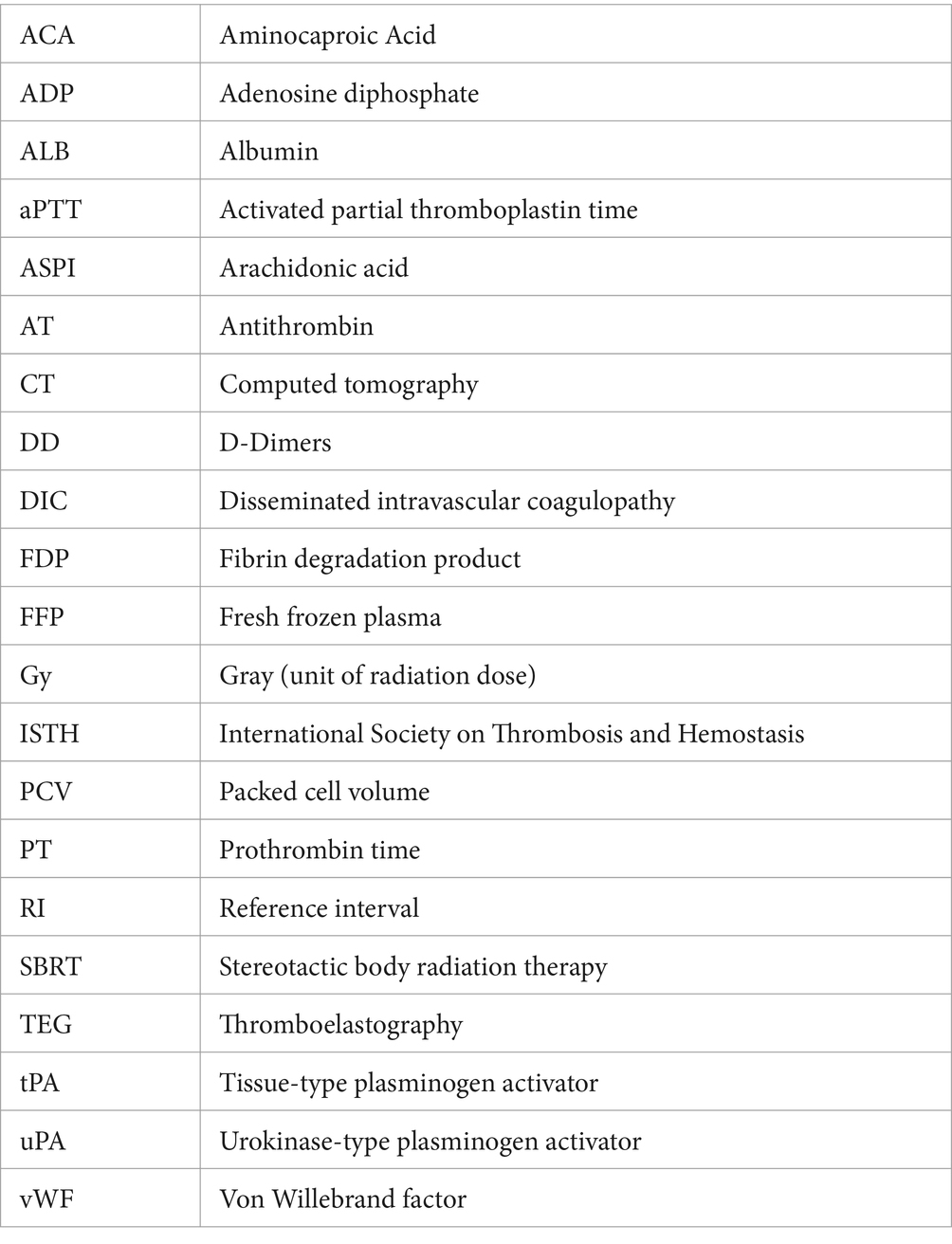
En enero de 2023 (9 meses después de la SBRT), el perro fue presentado a la CSU VTH por una epistaxis unilateral prolongada reportada durante aproximadamente 18 h. El examen físico solo confirmó la epistaxis unilateral y, por lo demás, no tuvo nada de especial. Las pruebas de coagulación revelaron un tiempo de protrombina (TP), tiempo de trombina parcial (TTP) marcadamente prolongado, aumento de los dímeros D, hipofibrinogenemia, leve aumento del producto de degradación de la fibrina (FDP) y disminución leve de la antitrombina (Tabla 1). En el hemograma completo (CSC), solo una leucocitosis leve [26,9 × 103/μL, intervalo de referencia (IR): 4,5–15 × 103/μL]. El perfil bioquímico mostró hipoalbuminemia leve (ALB: 2,9 g/dL, IR: 3-4,3 g/dL) e hipomagnesemia leve (Mg2+: 1,7 mg/dL, IR: 1,8-2,4 mg/dL) y, por lo demás, se encontraba dentro de los límites normales. El perro fue hospitalizado durante la noche con ácido aminocaproico (ACA) (50 mg/kg IV cada 6 h durante cuatro dosis), maropitant (1 mg/kg IV cada 24 h) y trazodona (4 mg/kg VO cada 8 h/PRN) y fue dado de alta al día siguiente debido a la resolución de la epistaxis. El perro fue dado de alta con ACA (50 mg/kg VO cada 8 h), gabapentina (12 mg/kg VO cada 8 h) y trazodona (4 mg/kg VO cada 8 h/PRN), con instrucciones de continuar la administración hasta la próxima visita programada de revisión.
El perro se presentó 4 días después por epistaxis bilateral continua. En esta visita, los hallazgos de laboratorio revelaron que el perro tiene anemia progresiva y fuertemente regenerativa (hematocrito: 26%, IR: 40-55%, hemoglobina: 8 g/dL, IR: 13-20 g/dL y recuento absoluto de reticulocitos: 335,1 × 103/μL, IR: 0–100 × 103/μL), trombocitopenia leve con aglomeración plaquetaria observada en la revisión del frotis sanguíneo (recuento de plaquetas: 90 × 103/μL, IR: 200–500 × 103/μL), leucocitosis estática (leucocitos: 27,7 × 103/μL, IR: 4,5–15 × 103/μL), hipoglucemia leve (glucosa: 64 mg/dL, IR: 70-115 mg/dL) e hipoalbuminemia leve (albúmina: 2,8 g/dL, IR: 3-4,3 g/dL). Las radiografías torácicas revelaron un nódulo pulmonar recién identificado. Un panel de coagulación reveló un empeoramiento progresivo de la coagulopatía con hipofibrinogenemia continuada (Tabla 1). La tromboelastografía nativa (TEG) (sin activadores) demostró un inicio prolongado a la formación de coágulos, además de un retraso en la cinética del coágulo y un coágulo extremadamente débil (Figura 1). No se pudo formar un coágulo en el trazado TEG de factor tisular + tPA (Figura 1). La agregación plaquetaria se realizó con un aggregómetro de electrodos múltiples (Multiplate 5.0 Analyzer, DiaPharma Group Inc., West Chester, Ohio) utilizando agregación de impedancia de sangre total y mostró una disminución de la agregación en comparación con los rangos de referencia de la institución en presencia de dos agonistas plaquetarios [difosfato de adenosina (ADP) y ácido araquidónico (ASPI)] (Figura 2). El perro fue hospitalizado con fluidoterapia, maropitant (1 mg/kg IV cada 24 h) y ACA (50 mg/kg IV cada 6 h) como tratamientos iniciales. Sin embargo, teniendo en cuenta los hallazgos antes mencionados, el perro recibió una transfusión de plasma fresco congelado (FFP) (250 ml IV durante 4 h, 10 ml/kg) y vitamina K1 (5 mg/kg SC cada 12 h) a los tratamientos. Al segundo día de hospitalización, las pruebas repetidas encontraron anemia progresiva [volumen de células empaquetadas (PCV): 19%, IR: 29-51%], y el perro desarrolló pulsos femorales hipercinéticos, disminución de la mentalidad y letargo progresivo. Se realizó una ecografía abdominal que mostró una escasa cantidad de derrame peritoneal anecoico, insuficiente para la toma de muestras. Aunque la vesícula biliar presentaba un pequeño volumen de restos ecogénicos en su luz, el resto del abdomen, incluidos el bazo y el hígado, parecía ultradigitalmente normal. Dada la progresión clínica de la anemia y la evidencia de hipovolemia, se administró una transfusión de glóbulos rojos empaquetada (10 ml/kg IV durante 4 h), una transfusión adicional de FFP (10 ml/kg IV durante 4 h) y dos unidades de crioprecipitado (1,2 ml/kg IV durante 1 h). Después de esos tratamientos, el perro demostró una notable mejoría en los parámetros circulatorios, epistaxis no apreciable y mejoría de la anemia (PCV: 29%, IR: 29-51%). Al tercer día de hospitalización, el perfil de coagulación del perro se mantuvo sin cambios (Tabla 1). Dadas las mejoras clínicas, el dueño optó por llevar al perro a casa en ese momento, y el perro fue dado de alta del VTH con instrucciones de hacer la transición a la vitamina K oral1 y ACA en las dosis antes mencionadas.
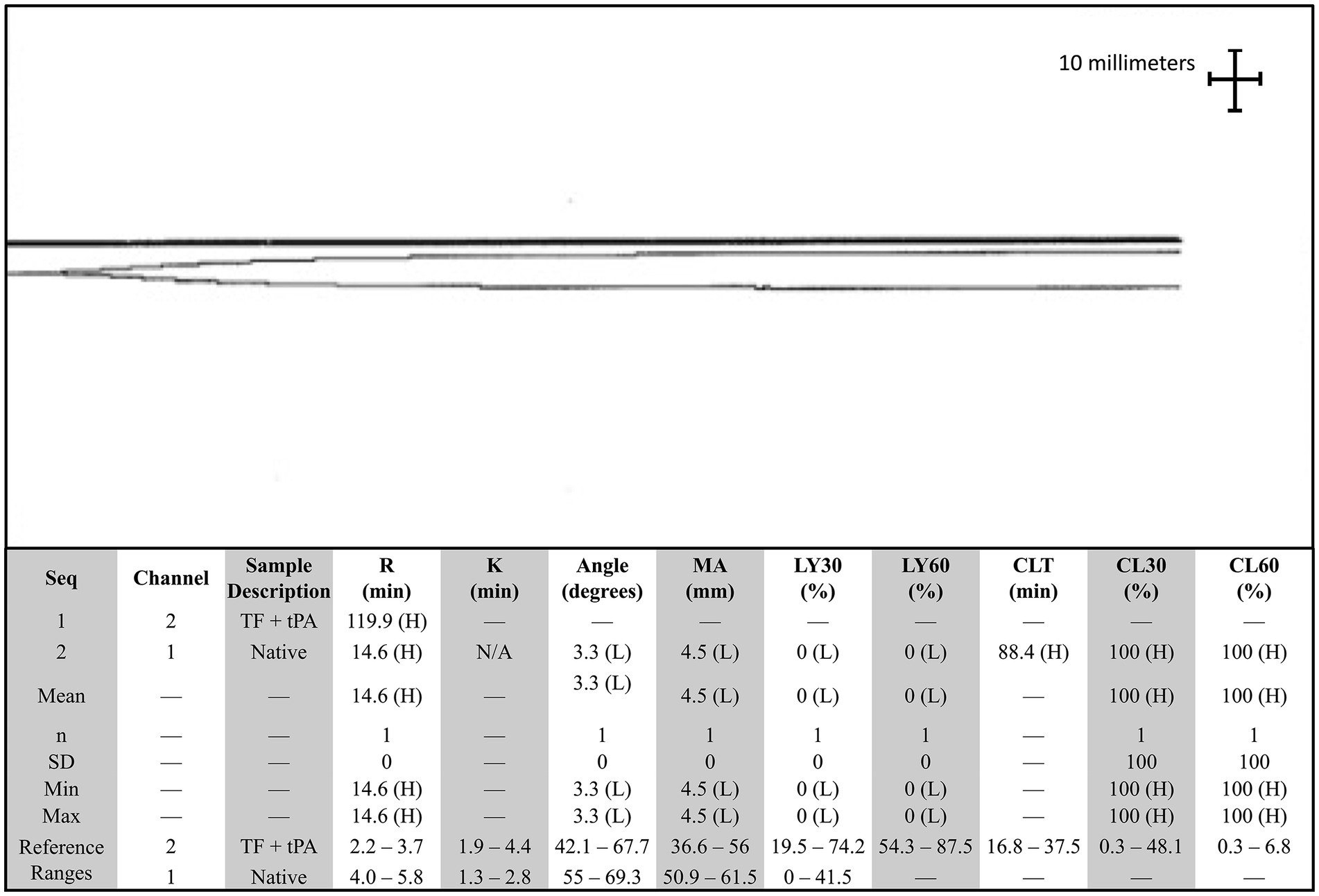 Figura 1. Trazado de tromboelastografía nativa y de factor tisular + activador tisular del plasminógeno (TEG) en un perro con epistaxis persistente. El trazado superior es el trazado TEG del factor tisular y del activador tisular del plasminógeno, y el trazado inferior es el trazado nativo. No se pudo formar un coágulo en presencia de un activador tisular del plasminógeno. Ángulo, ángulo alfa; CLT: tiempo de lisis de coágulos; G, Módulo elástico de cizallamiento; K: tiempo de formación de coágulos; LY30, lisis de coágulos a los 30 min; LY60, lisis de coágulos a los 60 min; MA, Amplitud máxima; R: Tiempo de reacción; DE: Desviación estándar; TEG: Tromboelastografía; TF: Factor tisular; tPA, activador tisular del plasminógeno.
Figura 1. Trazado de tromboelastografía nativa y de factor tisular + activador tisular del plasminógeno (TEG) en un perro con epistaxis persistente. El trazado superior es el trazado TEG del factor tisular y del activador tisular del plasminógeno, y el trazado inferior es el trazado nativo. No se pudo formar un coágulo en presencia de un activador tisular del plasminógeno. Ángulo, ángulo alfa; CLT: tiempo de lisis de coágulos; G, Módulo elástico de cizallamiento; K: tiempo de formación de coágulos; LY30, lisis de coágulos a los 30 min; LY60, lisis de coágulos a los 60 min; MA, Amplitud máxima; R: Tiempo de reacción; DE: Desviación estándar; TEG: Tromboelastografía; TF: Factor tisular; tPA, activador tisular del plasminógeno.
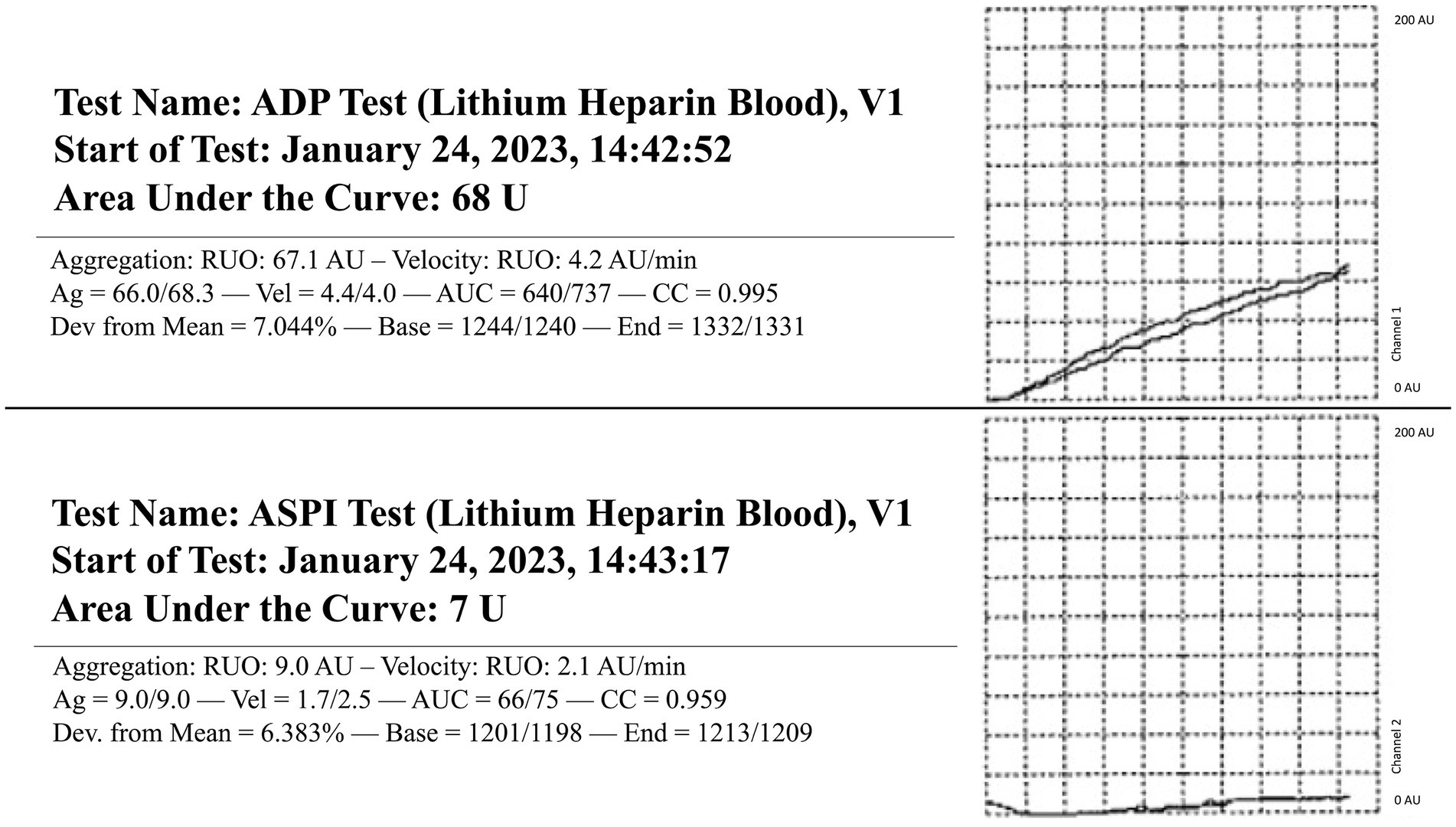 Figura 2. Aggregometría plaquetaria por impedancia de sangre total en un perro con epistaxis persistente. Se evaluaron dos agonistas plaquetarios: difosfato de adenosina (ADP) y ácido araquidónico (ASPI). RI: Intervalo de referencia. ADP RI (175-294), ASPI RI (131-325).
Figura 2. Aggregometría plaquetaria por impedancia de sangre total en un perro con epistaxis persistente. Se evaluaron dos agonistas plaquetarios: difosfato de adenosina (ADP) y ácido araquidónico (ASPI). RI: Intervalo de referencia. ADP RI (175-294), ASPI RI (131-325).
Al día siguiente del alta, el perro fue representado por letargo severo, epistaxis bilateral y nueva secreción oral serosanguinosa. Dado el mal pronóstico y la percepción de deterioro de la calidad de vida, el propietario optó por la eutanasia humanitaria. Antes de la eutanasia, se tomaron muestras de sangre adicionales para el análisis específico del factor de coagulación, el fibrinógeno y el factor von Willebrand, que reveló factores II y factor von Willebrand normales, disminución de los factores VII, VIII y X, y una disminución severa del fibrinógeno (Tabla 2). Se realizó necropsia que encontró adenocarcinoma nasal metastásico en senos nasales, ganglios linfáticos regionales y pulmones. La masa nasal, localizada dentro del seno nasal, fue descalcificada y se encontró que contenía células epiteliales neoplásicas, acompañadas de osteonecrosis significativa caracterizada por trabéculas óseas irregulares carentes de osteocitos dentro de las lagunas, así como trabéculas festoneadas que mostraban líneas de inversión profundamente basófilas. Además, los cornetes nasales mostraron una masa epitelial invasiva y densamente celular de células epiteliales neoplásicas, con formaciones sólidas y ocasionalmente tubulares, anisocitosis y anisocariosis moderadas, alta actividad mitótica (>100 por 10 campos de alta potencia), necrosis multifocal con infiltrado inflamatorio asociado y regiones dispersas de epitelio respiratorio y submucosa bien diferenciados. El examen del ganglio linfático retrofaríngeo derecho reveló que la arquitectura ganglionar se expande por una masa multilobulada compuesta por células epiteliales neoplásicas, que son similares a las de la masa nasal y los cornetes. En el pulmón, focalmente, el parénquima pulmonar se expande por un nódulo compuesto por células epiteliales neoplásicas. Existen émbolos tumorales multifocales dentro de las estructuras linfovasculares y los vasos pulmonares. En el hígado, se identificó una degeneración hepatocelular crónica moderada de zona media a periportal con un émbolo tumoral intravascular focal.
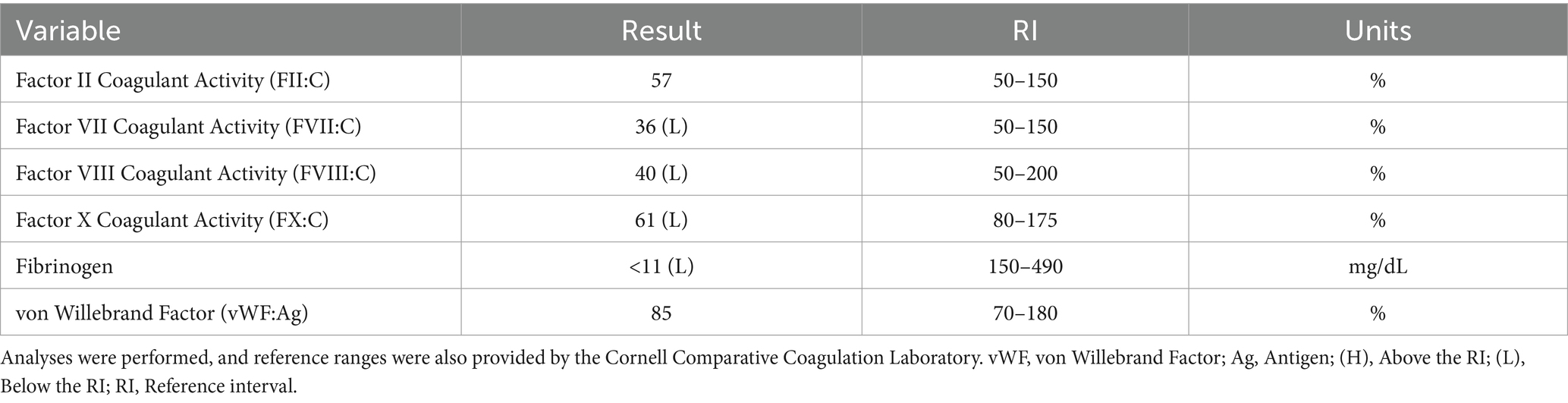 Tabla 2. Análisis de los niveles de actividad de factores específicos, fibrinógeno y vWF en un perro con epistaxis persistente.
Tabla 2. Análisis de los niveles de actividad de factores específicos, fibrinógeno y vWF en un perro con epistaxis persistente.
Discusión
La coagulopatía intravascular diseminada es un trastorno complejo caracterizado por una activación hemostática anormal, con manifestación clínica dependiendo de la causa. El diagnóstico de laboratorio de CID se caracteriza por disminución del recuento de plaquetas, TP prolongado, TTPa prolongado, disminución de la concentración plasmática de fibrinógeno, disminución de la actividad de la antitrombina (TA) plasmática, aumento de los dímeros D y aumento de la FDP plasmática (7, 8). Si bien estos criterios ayudan a identificar la CID en medicina veterinaria, esta descripción no abarca los diversos fenotipos de CID observados en la medicina humana. La Sociedad Internacional de Trombosis y Hemostasia (ISTH, por sus siglas en inglés) caracteriza dos fenotipos distintos de CID: trombótico y fibrinolítico. La forma trombótica a menudo conduce a la disfunción orgánica debido a la coagulación, mientras que la forma fibrinolítica causa hemorragias graves debido a la descomposición excesiva del coágulo (9, 10). En muchos casos, las anomalías hemostáticas pueden preceder a la evidencia clínica y diagnóstica de CID y, según se informa, se desencadenan por una multitud de causas, incluido el cáncer (11-13). En medicina veterinaria, no se han notificado hemorragias graves secundarias a hiperfibrinólisis asociadas a neoplasias malignas diseminadas.
Las neoplasias nasosinusales primarias son relativamente poco comunes, ya que representan menos del 2% de todos los cánceres caninos conocidos (14, 15). Los signos clínicos típicos incluyen epistaxis, deformidades faciales, linfadenopatía regional y obstrucción del flujo aéreo nasal (16). Afortunadamente, estos signos clínicos a menudo responden bien con la terapia adecuada. Curiosamente, Maruyama et al. (7) han observado una asociación entre la CID y perros con tumores malignos sólidos, ocurriendo en el 9,6% de los casos (20/208). Entre estos casos, 18 perros fueron diagnosticados con adenocarcinoma nasal, y la mayoría (16 de 18) no mostraron evidencia clínica o clinicopatológica de CID (7). Estos datos sugieren que el sangrado grave espontáneo y tardío en perros con adenocarcinoma nasal es poco común.
Al considerar el presente reporte de caso, aproximadamente 5 meses después de la radioterapia, se observó el primer evento hemorrágico después de la biopsia tumoral. En ese momento, no se realizaron pruebas de coagulación ni de función plaquetaria, y el sangrado excesivo cesó de la noche a la mañana sin ninguna intervención adicional. Cuando el perro fue representado 9 meses después de la radioterapia por epistaxis persistente, las pruebas de coagulación fueron sugestivas de CID e hiperfibrinólisis (Tabla 1). En medicina humana, la CID asociada a neoplasias malignas se clasifica como subaguda, aguda y crónica y se ha asociado con mayor frecuencia con adenocarcinomas prostáticos (4–6, 17–19). Si bien los mecanismos subyacentes a la asociación entre el cáncer y la CID son multifactoriales y se comprenden parcialmente, la teoría más destacada se centra en la acción de la uPA como agente primario en la CID asociada a neoplasias malignas (19). La uPA se ha asociado con la migración de células cancerosas, la invasión y la modulación de la adhesión celular, promoviendo así la formación y progresión de varios tipos de cáncer (19, 20). También se sabe que la uPA cataliza la conversión de plasminógeno en plasmina sin retroalimentación negativa, lo que resulta en la descomposición de los coágulos de fibrina y la degradación de la matriz extracelular (18, 21, 22). Esta patogénesis da lugar al desarrollo de hiperfibrinólisis secundaria, ya que la hipofibrinogenemia resultante es el resultado de una activación excesiva desequilibrada de enzimas fibrinolíticas estructuralmente normales o de una mayor susceptibilidad de la fibrina a la proteólisis (23). En este caso, el perro también presentaba deficiencias en los factores VII, VIII y X, junto con hipofibrinoginemia severa, todo lo cual es sugestivo de una capacidad deteriorada para formar un coágulo y disfunción hemostática (Tabla 2). Además, la reducción del factor VIII específicamente se ha asociado con una regulación positiva del sistema fibrinolítico, lo que resulta en una hiperfibrinólisis secundaria (23). Por lo tanto, cuando se toma junto con los antecedentes del perro de adenocarcinoma metastásico confirmado, trombocitopenia, anemia regenerativa, perfil hipocoagulable en TEG (Figura 1) y disminución de la agregación plaquetaria en agregametría de impedancia (Figura 2), la causa más probable del deterioro clínico progresivo del perro es la CID crónica con una hiperfibrinólisis secundaria paraneoplásica concurrente, un diagnóstico poco frecuente en medicina veterinaria (21).
Al explorar otras razones de hemorragia grave, la hipofibrinogenemia grave es inusual y rara vez se relaciona con la neoplasia en medicina veterinaria o, más específicamente, con perros con adenocarcinoma nasal. Los diferenciales como la hiperfibrinólisis primaria, la hipofibrinogenemia adquirida y la toxicidad tardía por radiación se consideraron como posibles causas del sangrado excesivo del perro. En este caso, el perro tenía hipofibrinogenemia severa, que podría representar hiperfibrinólisis primaria, o una anormalidad cuantitativa o cualitativa absoluta de las proteínas estaba directamente involucrada en el proceso fibrinolítico (23). Sin embargo, la hiperfibrinólisis primaria suele ocurrir con valores elevados de FDP y dímeros D normales, lo que no encajaría con las anomalías de la coagulación del perro. Además, el análisis de TEG, que es indicativo de hiperfibrinólisis primaria, mostraría una rápida formación de coágulos y la posterior lisis rápida de coágulos (24). En este caso, el perfil de TEG de este perro reveló un inicio prolongado a la formación de coágulos, un retraso en la cinética del coágulo y un coágulo débil, consistente con la degradación de la fibrina y la CID o hiperfibrinólisis secundaria, lo que respalda aún más la noción de una hiperfibrinólisis secundaria, como se observa en el contexto de la coagulopatía subyacente inducida por malignidad. A continuación, debido a los agentes citotóxicos (quimioterapia), se considera la hipofibrinogenemia, ya que se ha relacionado con la leucemia mieloide aguda en personas (25). Cabe destacar que este fenómeno nunca se ha reportado en medicina veterinaria. Además, en este caso, el perro no había recibido ningún agente quimioterapéutico citotóxico. En cambio, la inmunoterapia y la radioterapia se habían seguido durante aproximadamente 9 meses antes de los eventos hemorrágicos y, por lo tanto, también se excluyó como diferencial. Otras causas de este tipo de hipofibrinogenemia grave y otras anomalías de la coagulación podrían haber incluido la insuficiencia hepática sintética, pero desde el punto de vista clínico, diagnóstico o histológico no hubo pruebas que respaldaran este diagnóstico. Por último, también se consideró la toxicidad tardía por radiación después de la radioterapia, pero se consideró poco probable debido al retraso en la aparición de la hemorragia, la respuesta tisular inusual y la presencia de otras anomalías de la coagulación. Independientemente de la etiología, el tratamiento de elección para la hipofibrinogenemia es el crioprecipitado, que contiene factor VIII, factor von Willebrand (vWF), fibrinógeno, factor XIII y fibronectina (26). En este caso, los tratamientos como las infusiones de crioprecipitado, las transfusiones múltiples de FFP y varios días de administración de ACA fueron de corta duración, lo que reforzó aún más el diagnóstico de hiperfibrinólisis paraneoplásica secundaria grave (27-29).
Finalmente, la anemia regenerativa y la trombocitopenia leve del perro podrían haber representado una respuesta a la hemorragia continua experimentada durante varios días. Se sospecha que la disminución de la agregabilidad plaquetaria observada en este paciente está relacionada con varios factores, como un proceso consuntivo de la epistaxis grave, un cambio in vitro debido a la trombocitopenia y una disfunción plaquetaria secundaria a una neoplasia metastásica (30-33).
Conclusión
Este caso clínico presenta el primer caso documentado de hiperfibrinólisis secundaria paraneoplásica en un perro con adenocarcinoma nasal metastásico, que requirió múltiples transfusiones de hemoderivados y un curso prolongado de ACA debido a hemorragias graves y recurrentes. Aunque las coagulopatías representan menos del 5% de los casos en perros con epistaxis (34), la literatura sugiere que las coagulopatías ocurren en aproximadamente el 56% de los perros con neoplasia maligna (7). Por lo tanto, los médicos deben considerar la realización de pruebas sistemáticas de coagulación en pacientes con neoplasia maligna que presenten episodios hemorrágicos agudos. Estos perfiles de coagulación pueden guiar la administración de medicamentos antifibrinolíticos y hemoderivados.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales porque este estudio con animales es un informe de caso. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
KG: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Recursos, Redacción – borrador original, Redacción – revisión y edición. TP: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Recursos, Redacción – borrador original, Redacción – revisión y edición. M-KB: Conceptualización, Curación de datos, Investigación, Metodología, Software, Supervisión, Redacción – revisión y edición. LG: Escribir, revisar y editar. SS: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Recursos, Software, Supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Los autores desean agradecer al servicio de diagnóstico por imágenes de pequeños animales del Hospital Docente Veterinario James L. Voss por su interpretación inicial de radiografías, ultrasonido y tomografía computarizada, así como al servicio de anatomía patológica por su análisis e interpretación post-mortem.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Iba, T, Levy, JH, Thachil, J, Wada, H, y Levi, M. La progresión de la coagulopatía a la coagulación intravascular diseminada en enfermedades subyacentes representativas. Res. de trombos. (2019) 179:11–4. doi: 10.1016/j.thromres.2019.04.030
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Camerer, E, Qazi, AA, Duong, DN, Cornelissen, I, Advíncula, R, y Coughlin, SR. Plaquetas, receptores activados por proteasa y fibrinógeno en metástasis hematógenas. Sangre. (2004) 104:397–401. doi: 10.1182/blood-2004-02-0434
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Okajima, K, Kohno, I, Soe, G, Okabe, H, Takatsuki, K, y Binder, BR. Evidencia directa de fibrinogenólisis sistémica en pacientes con deficiencia adquirida de inhibidores de α2-plasmina. Am J Hematol. (1994) 45:16–24. doi: 10.1002/ajh.2830450104
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Kulić, A, Cvetković, Z y Libek, V. Hiperfibrinólisis primaria como signo de presentación del cáncer de próstata: informe de un caso. Vojnosanit Pregl. (2016) 73:877–80. doi: 10.2298/VSP150525076K
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Jafri, MA, Cohen, JV, Much, MA, Petrylak, DP, y Podoltsev, NA. Un paciente con pancitopenia, epistaxis intratable y cáncer de próstata metastásico: cómo el diagnóstico correcto de la hiperfibrinólisis primaria ayuda a detener el sangrado. Clin Genitourina Cáncer. (2016) 14:E545–8. doi: 10.1016/j.clgc.2016.05.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Hyman, DM, Soff, GA, y Kampel, LJ. Coagulación intravascular diseminada con fibrinólisis excesiva en cáncer de próstata: una serie de casos y revisión de la literatura. Oncología. (2011) 81:119–25. doi: 10.1159/000331705
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Maruyama, H, Miura, T, Sakai, M, Koie, H, Yamaya, Y, Shibuya, H, et al. Incidencia de coagulación intravascular diseminada en perros con tumor maligno. J Vet Med Sci. (2004) 66:573–5. doi: 10.1292/jvms.66.573
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Stokol, T . Dímero D plasmático para el diagnóstico de trastornos tromboembólicos en perros. Vet Clin Pequeño Anim Pract. (2003) 33:1419–35. doi: 10.1016/S0195-5616(03)00096-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Wada, T, y Gando, S. Fenotipos de coagulación intravascular diseminada. Hemaste del trombo. (2023) 100:958–9.
10. Leví, M . Coagulación intravascular diseminada en cáncer: una actualización En: Seminarios en Trombosis y Hemostasia. Nueva York, NY, EE. UU.: Thieme Medical Publishers (2019).
11. Falanga, A, Panova-Noeva, M, y Russo, L. Mecanismos procoagulantes en células tumorales. Best Pract Res Clin Haematol. (2009) 22:49–60. doi: 10.1016/j.beha.2008.12.009
12. Lu, G, Jia, L, Yang, R, Lv, Z y Cui, J. Hiperfibrinólisis adquirida como signo de presentación del cáncer de mama metastásico: informe de un caso. Oncol Lett. (2023) 25:1–6. doi: 10.3892/ol.2023.13692
13. Winther-Larsen, A, Sandfeld-Paulsen, B, y Hvas, A-M. Hiperfibrinólisis en pacientes con neoplasias malignas sólidas: una revisión sistemática En: Seminars in Thrombosis and Hemostasis, Nueva York, NY 10001, EE. UU.: Thieme Medical Publishers, Inc. (2021). Vol. 47:581-8.
14. Madewell, B, Priester, W, Gillette, E y Snyder, S. Neoplasias de las fosas nasales y los senos paranasales en animales domésticos según lo informado por 13 facultades de veterinaria. Am J Vet Res. (1976) 37:851–6.
15. Mortier, J y Blackwood, L. Tratamiento de tumores nasales en perros: una revisión. J Pequeña Anim Pract. (2020) 61:404–15. doi: 10.1111/jsap.13173
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Strasser, JL y Hawkins, EC. Características clínicas de la epistaxis en perros: un estudio retrospectivo de 35 casos (1999-2002). J Am Anim Hosp Assoc. (2005) 41:179–84. doi: 10.5326/0410179
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Smith, JA Jr, Soloway, MS, y Young, MJ. Complicaciones del cáncer de próstata avanzado. Urología. (1999) 54:8–14. doi: 10.1016/S0090-4295(99)00448-3
18. Prokopchuk-Gauk, O, y Brose, K. Ácido tranexámico para tratar la hemorragia potencialmente mortal en el cáncer de próstata asociada a la coagulación intravascular diseminada con fibrinólisis excesiva. Cureus. (2015) 7:E428. doi: 10.7759/cureus.428
19. Ong, SY, Taverna, J, Jokerst, C, Enzler, T, Hammode, E, Rogowitz, E, et al. Coagulación intravascular diseminada asociada al cáncer de próstata con fibrinólisis excesiva tratada con degarelix. Representante de Caso Oncol Med. (2015) 2015:1–6. doi: 10.1155/2015/212543
20. Mahmood, N, Mihalcioiu, C, y Rabbani, SA. Papel multifacético del activador del plasminógeno de tipo uroquinasa (uPA) y su receptor (uPAR): aplicaciones diagnósticas, pronósticas y terapéuticas. Frente Oncol. (2018) 8:24. doi: 10.3389/fonc.2018.00024
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Zoia, A, Drigo, M, Caldin, M, Simioni, P, y Piek, CJ. Fibrinólisis en perros con derrame intracavitario: una revisión. Animales. (2022) 12:2487. doi: 10.3390/ani12192487
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Chapin, JC, y Hajjar, KA. Fibrinólisis y control de la coagulación sanguínea. Rev. de Sangre. (2015) 29:17–24. doi: 10.1016/j.blre.2014.09.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Kolev, K, y Longstaff, C. Hemorragia relacionada con la fibrinólisis alterada. Hno. J Haematol. (2016) 175:12–23. doi: 10.1111/bjh.14255
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Carey, M, y Cressey, DM. Hiperfibrinólisis: ¿es común? Medición y tratamiento, incluido el papel de la tromboelastografía. Riesgo de Clin. (2009) 15:188–91. doi: 10.1258/cr.2009.090028
25. Elamil, ZG, Tuncer, HH, Tara, R, y Homsi, SAA. Hipofibrinogenemia consistente asociada con quimioterapia antitumoral de inducción para la leucemia mieloide aguda. Am Soc Hematol. (2010) 116:1400. doi: 10.1182/sangre. V116.21.1400.1400
26. Pantanowitz, L, Kruskall, MS y Uhl, L. Crioprecipitado: patrones de uso. Am J Clin Pathol. (2003) 119:874–81. doi: 10.1309/56MQVQAQG8YU90X9
27. Plaut, D . El papel del laboratorio en la coagulación intravascular diseminada. J Contin Educ Principales Temas. (2011) 13:24–9.
28. Fisher, VR, Scott, MK, Tremblay, CA, Beaulieu, GP, Ward, DC, y Byrne, KM. Coagulación intravascular diseminada: apoyo de laboratorio para el manejo y el tratamiento. Medicina de laboratorio. (2013) 44:e10-4. doi: 10.1309/LMTCAVNHBUGWTP7K
29. Toh, C-H, Alhamdi, Y, y Abrams, ST. Consideraciones patológicas y de laboratorio actuales en el diagnóstico de la coagulación intravascular diseminada. Ann Lab Med. (2016) 36:505–12. doi: 10.3343/alm.2016.36.6.505
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Crispín, P, y Gardiner, EE. Plaquetas y cáncer… La trama no siempre se complica. J Trombo hemostático. (2020) 18:2482–5. doi: 10.1111/jth.14944
31. Braun, A, Anders, H-J, Gudermann, T y Mammadova-Bach, E. Interacción plaqueta-cáncer: mecanismos moleculares y nuevas vías terapéuticas. Frente Oncol. (2021) 11:665534. doi: 10.3389/fonc.2021.665534
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Sweeney, JD, Labuzetta, JW, y Fitzpatrick, JE. Efecto del recuento de plaquetas en la respuesta de agregación y liberación de trifosfato de adenosina en un lumi-aggregómetro de impedancia. Am J Clin Pathol. (1988) 89:655–9. doi: 10.1093/ajcp/89.5.655
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Müller, MR, Salat, A, Pulaki, S, Stangl, P, Ergun, E, Schreiner, W, et al. Influencia del hematocrito y el recuento de plaquetas en la impedancia y reactividad de la sangre total para la agregación eléctrica. J Métodos de Toxicol de Pharmacol. (1995) 34:17–22. doi: 10.1016/1056-8719(94)00075-F
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Bissett, SA, Drobatz, KJ, McKnight, A, y Degernes, LA. Prevalencia, características clínicas y causas de la epistaxis en perros: 176 casos (1996-2001). J Am Vet Med Assoc. (2007) 231:1843–50. doi: 10.2460/javma.231.12.1843
Resumen de PubMed | Texto completo de Crossref | Google Académico
Glosario
Palabras clave: paraneoplásico, CID, hiperfibrinólisis secundaria, adenocarcinoma, perro
Cita: Granger KL, Paulos T, Boss M-K, Guieu L y Shropshire S (2024) Caso clínico: Coagulopatía intravascular diseminada crónica con hiperfibrinólisis secundaria paraneoplásica concurrente en un perro con adenocarcinoma nasal metastásico. Frente. Vet. Sci. 11:1375507. doi: 10.3389/fvets.2024.1375507
Recibido: 23 de enero de 2024; Aceptado: 26 de abril de 2024;
Publicado: 17 mayo 2024.
Editado por:
Carlos Eduardo Fonseca-Alves, Universidad Paulista, Brasil
Revisado por:
Alex Lynch, Universidad Estatal de Carolina del Norte, Estados
Unidos Julie Michele Walker, Universidad de Wisconsin-Madison, Estados Unidos
Derechos de autor © 2024 Granger, Paulos, Boss, Guieu y Shropshire. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Kyle L. Granger Jr., kyle.granger@colostate.edu
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía