Comparación de la SDMA sérica y la creatinina como biomarcador para la detección de la lesión renal inducida por meloxicam en gatos
Comparación de la SDMA sérica y la creatinina como biomarcador para la detección de la lesión renal inducida por meloxicam en gatos
 Matthew K. Wun1
Matthew K. Wun1  Liam E. Broughton-Neiswanger2
Liam E. Broughton-Neiswanger2  Nicolás F. Villarino1*
Nicolás F. Villarino1*- 1Departamento de Ciencias Clínicas Veterinarias, Facultad de Medicina Veterinaria, Universidad Estatal de Washington, Pullman, WA, Estados Unidos
- 2Departamento de Microbiología y Patología Veterinaria, Facultad de Medicina Veterinaria, Universidad Estatal de Washington, Pullman, WA, Estados Unidos
Introducción: La dimetilarginina simétrica sérica (SDMA) y la creatinina son biomarcadores de la función renal comúnmente utilizados en gatos. Nuestra hipótesis es que los analitos séricos creatinina y SDMA son igualmente eficaces en la detección de la función renal alterada causada por la lesión renal inducida por meloxicam en gatos. Nuestro objetivo principal fue comparar las concentraciones séricas de SDMA y creatinina en gatos antes, durante y después de la inducción de lesión renal a partir de dosis repetidas de meloxicam en el contexto de un pequeño estudio piloto.
Métodos: Este estudio de seguimiento es el resultado de los datos recopilados en un estudio bien controlado que incluyó a 12 gatas adultas sanas criadas con propósito. Los gatos del grupo de tratamiento recibieron meloxicam 0,3 mg/kg por vía subcutánea (SC) cada 24 h durante 31 días. Los gatos del grupo control recibieron solución salina (0,1 mL SC). La lesión renal se definió como la presencia de daño tubular, daño de la membrana basal y/o inflamación intersticial en secciones histológicas de tejido renal. Se midió la creatinina sérica y la concentración de SDMA cada 4 días.
Resultados: En el grupo control, ningún gato desarrolló azotemia renal. En el grupo de tratamiento, cuatro de cada seis gatos desarrollaron creatinina sérica elevada y evidencia histopatológica de lesión renal. Tres de estos gatos desarrollaron una elevación de la SDMA sérica. El tiempo transcurrido hasta el desarrollo de azotemia renal mediante creatinina sérica o AMDS no fue significativamente diferente (p > 0,05).
Discusión: En este estudio piloto, no hubo evidencia de que la SDMA sérica fuera superior a la creatinina sérica en la detección de la función renal alterada causada por la lesión renal inducida por meloxicam en gatos.
1 Introducción
La creatinina sérica y la dimetilarginina simétrica (SDMA) son actualmente los analitos más utilizados para estimar la función renal en la práctica felina (1). Ambos son biomarcadores de la tasa de filtración glomerular (TFG). El coeficiente de determinación entre la creatinina y la AMDS con TFG es de 0,81 y 0,82, respectivamente (2), y la correlación reportada de los dos biomarcadores con la TFG es similar (3-5). Su relación con el FG es exponencial, requiriendo una reducción sustancial del FG antes de que se observen valores séricos elevados (1). Esto presenta un problema para la detección temprana de la lesión renal aguda (LRA) y la enfermedad renal crónica (ERC), cuando las intervenciones médicas pueden ser más efectivas.
Unas guías recientes publicadas por la Sociedad Internacional de Interés Renal afirman que «la SDMA parece ser un indicador más sensible de la ERC en estadio temprano en perros y gatos» (6) y «que, en comparación con la creatinina sérica, la SDMA puede ser un biomarcador de la función renal más sensible y proporciona información adicional cuando se utiliza junto con la creatinina sérica» (7). En gatos, la evidencia de estas afirmaciones se deriva de un estudio de 2014 que encontró que el límite superior del intervalo de referencia (IR) para SDMA (14 μg/dL) correspondía a una TFG de aproximadamente un 24% más baja que la mediana de la TFG de gatos sanos, con una sensibilidad y especificidad del 100 y el 91%, respectivamente, para la detección de una disminución del 30% con respecto a la mediana de la TFG (3). Sin embargo, el uso de 14 μg/dl como límite superior de la IR se ha asociado recientemente con resultados falsos positivos para la disfunción renal (especificidad del 75%), recomendándose un valor de corte más alto de 18 μg/dl (5). Además, este estudio encontró que la SDMA no fue superior a la creatinina en la detección de disfunción renal leve (TFG < límite de FG de 1,7 ml/[min kg]) u obvia (TFG < punto de corte de GFR bajo de 1,2 ml/[min kg]) (5). Por lo tanto, el beneficio propuesto de la SDMA sobre la creatinina sigue sin estar claro sobre la base de estas publicaciones científicas contradictorias.
El meloxicam es un fármaco antiinflamatorio no esteroideo (AINE) preferencial a la COX-2 asociado con el desarrollo de lesión renal aguda en gatos (8, 9). Nuestra hipótesis es que los analitos séricos creatinina y SDMA son igualmente eficaces en la detección de la función renal alterada causada por la lesión renal inducida por meloxicam en gatos. El objetivo principal de este estudio piloto fue comparar las concentraciones séricas de SDMA y creatinina en gatos adultos sanos criados con fines específicos, antes, durante y después de la inducción de lesión renal por dosis repetidas de meloxicam. Para abordar este objetivo se utilizaron los datos recogidos en un estudio metabolómico terminal previamente bien controlado (10).
2 Materiales y métodos
Los datos se recopilaron de los registros de un proyecto de investigación anterior completado en la Universidad Estatal de Washington (WSU) (protocolo # 4915 aprobado por la IACUC de la WSU) (10).
2.1 Población de estudio, criterios de inclusión y manejo
La población de estudio y el diseño experimental han sido descritos previamente (10). Brevemente, se obtuvieron 12 gatas adultas intactas (1-1,5 años de edad) clínicamente sanas (2,5-3,8 kg) criadas con un propósito de un criador comercial con licencia del USDA (Centro de Nutrición y Cuidado de Mascotas, Universidad de California Davis, Davis, Estados Unidos).
Los gatos se aclimataron al nuevo entorno de alojamiento al menos 10 días antes de comenzar el estudio. Los gatos fueron alojados por separado en jaulas de 49″ de ancho, 37″ de alto y 38″ de profundidad. La temperatura de la habitación (21-23 °C), la humedad (25-35%) y el ciclo de luz/oscuridad de 12 h estaban controlados. A lo largo del estudio, los gatos tuvieron libre acceso a agua potable y comida (Purina Cat Chow Indoor Formula). Cada día, se cambiaba el agua, la comida y la arena, y se limpiaban las jaulas. Los gatos fueron examinados al menos dos veces al día durante todo el estudio para descartar posibles problemas de salud. El ciclo estral de las gatas no se evaluó objetivamente más que mediante el seguimiento del comportamiento durante el estudio. Tras el periodo de aclimatación, se implantaron en la yugular puertos de acceso vascular (VAP, small size) (Le Port Companion Port, Norfolk Vet, Skokie, IL, Estados Unidos) al menos 7 días antes de iniciar la administración de los tratamientos siguiendo los procedimientos estándar recomendados por el fabricante. Los VAP se mantuvieron siguiendo las recomendaciones del fabricante.
2.2 Diseño del estudio
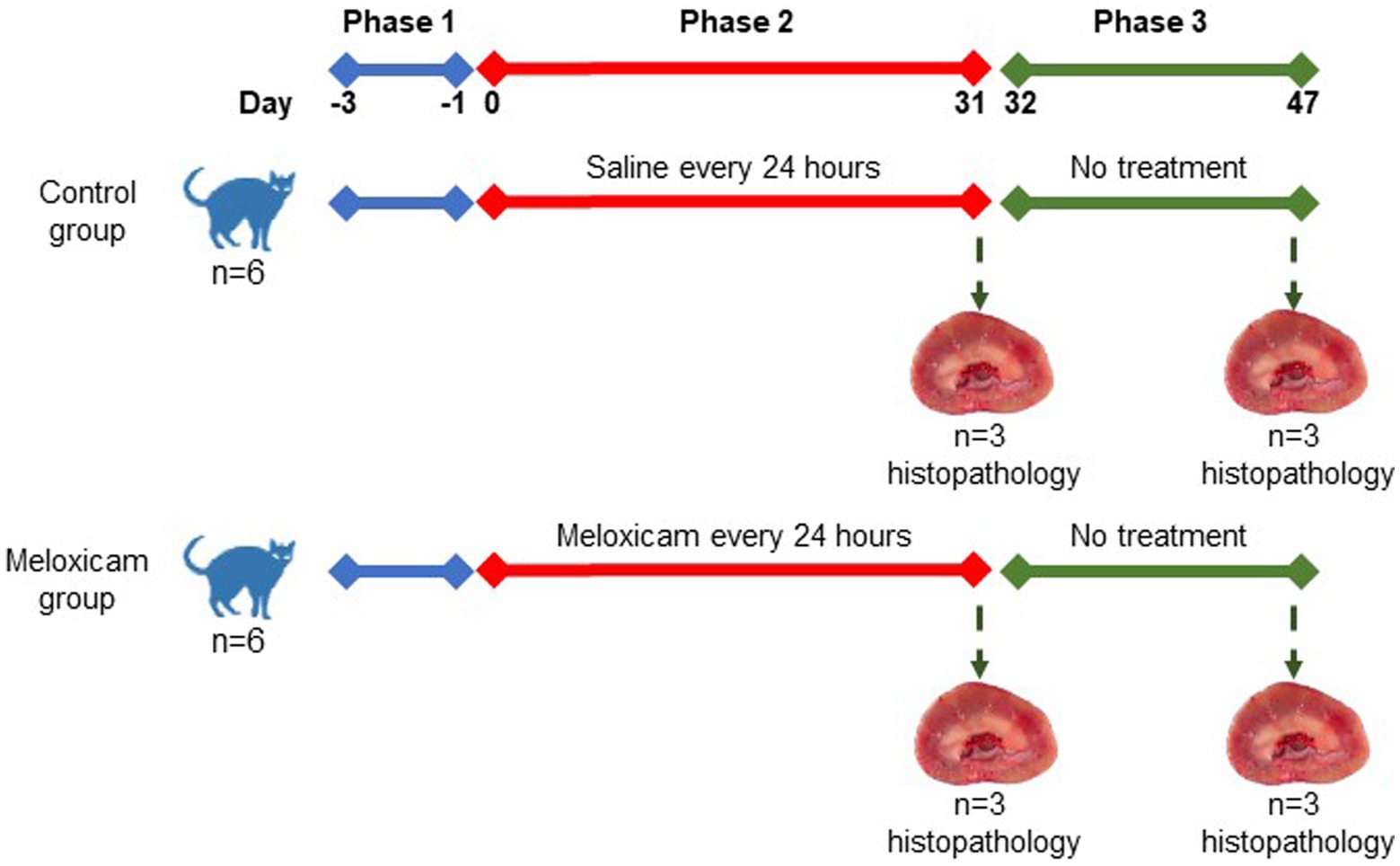
En un diseño experimental controlado, los gatos se asignaron aleatoriamente a cuatro grupos experimentales: los grupos de control (i) a largo plazo (n = 3) y (ii) a corto plazo (n = 3), y los grupos de meloxicam a largo plazo (n = 3) y (iv) a corto plazo (n = 3). La aleatorización de los tratamientos se realizó utilizando el paquete RandomizeR en R. El experimento comprendió tres fases consecutivas, como se muestra en la Figura 1. La fase uno duró 3 días (día 3 a día 0), durante los cuales todos los gatos fueron tratados con 0,1 ml/kg de peso corporal de suero fisiológico por vía subcutánea (SC) cada 24 h. Durante la fase dos del experimento (a partir del día 0), los gatos del grupo de meloxicam fueron tratados SC con meloxicam a una dosis de 0,3 mg/kg de peso corporal (equivalente a 0,1 ml/kg) (Metacam inyectable, Boehringer Ingelheim Vetmedica, Inc.) cada 24 h durante 31 días. Los gatos del grupo control recibieron una solución salina de 0,1 ml/kg de peso corporal cada 24 h durante 31 días. Al final de la fase dos, los gatos de los grupos de control a corto plazo y meloxicam fueron sacrificados dentro de las 24 horas posteriores al último tratamiento. Durante la fase tres, los gatos de los grupos de control a largo plazo (n = 3) y meloxicam (n = 3) fueron monitoreados durante 16 días (días 32-47), y luego sacrificados con una sobredosis intravenosa de pentobarbital (Beuthanasia-D, Intervet/Merck Animal Health, Giralda Farms, Madison, NJ).®
Los gatos del grupo de control permanecieron clínicamente sanos durante la duración del estudio, aunque un gato vomitó una vez el día 4 después de la administración de solución salina. En los grupos de meloxicam, el peso corporal y las puntuaciones de condición de los gatos fueron relativamente estables, excepto en el caso de un gato cuyo peso corporal se redujo en ~7%, probablemente debido a una disminución en la ingesta de alimentos. Durante las fases dos y tres, cinco de cada seis gatos en el grupo de meloxicam vomitaron de 2 a 15 veces, pero no más de una vez al día. Sin embargo, las puntuaciones de ingesta de alimentos, peso corporal y condición fueron consistentes con los valores previos al tratamiento.
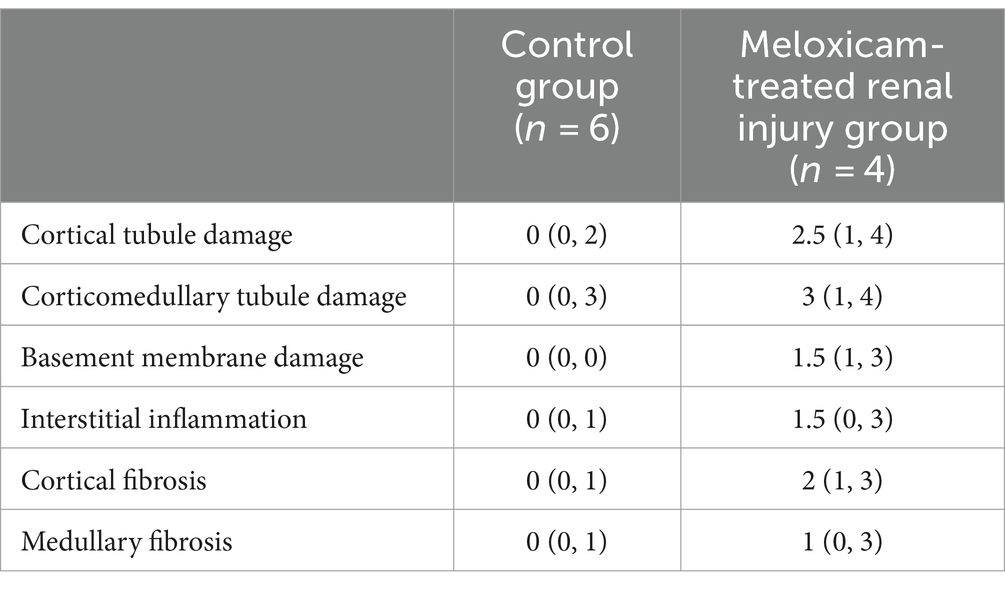
Los tejidos de ambos riñones de todos los gatos se recolectaron post mortem. Inmediatamente después de la recolección, las muestras de tejido se conservaron en formol tamponado neutro al 10%. Las secciones replicadas de cada riñón se cortaron con un espesor de 5 μm y se tiñeron con hematoxilina y eosina para la clasificación histológica general y el tricrómico de Masson para la evaluación de la fibrosis. Se cortaron secciones adicionales a 3 μm de espesor y se tiñeron con plata de ácido peryódico-metenamina para evaluar la membrana basal de los túbulos y glomérulos. Los tejidos fueron evaluados en busca de una serie de características histológicas semicuantitativas por un solo patólogo veterinario ciego y certificado por la junta. Las características histológicas evaluadas incluyen daño tubular cortical y corticomedular, integridad de la membrana basal, fibrosis cortical, fibrosis medular e inflamación intersticial. El daño tubular se definió como la presencia de al menos una o más de las siguientes características histológicas: necrosis de células epiteliales, regeneración, degeneración, atenuación o cariomegalia y dilatación tubular. La fibrosis se definió como la expansión del intersticio con matriz colágena confirmada por tricrómico en asociación con lesión tubular adyacente. Las características histológicas semicuantitativas se puntuaron de la siguiente manera para todos los riñones individuales: 0 = sin cambios en <1%, 1 = 1-25%, 2 = 26-50%, 3 = 51-75%, 4 = 76-100% de los campos examinados afectados. Se evaluaron un total de al menos diez campos de alta potencia de 400x para los cambios histológicos antes mencionados para producir la puntuación semicuantitativa para cada categoría, siendo 4 la puntuación más alta por característica. En los grupos tratados con meloxicam, se determinó que los gatos tenían lesión renal si al menos un riñón tenía una puntuación de ≥1 para daño tubular, daño en la membrana basal y/o inflamación intersticial (11). Para el análisis de los datos, estos gatos fueron asignados al grupo de lesión renal tratado con meloxicam. Los gatos de los grupos de control a corto y largo plazo se asignaron a un grupo de control combinado.
2.2.1 Toma de muestras de sangre y orina para determinar la SDMA, la creatinina y la concentración de proteínas y creatinina en orina
Los tiempos y procedimientos de muestreo se han descrito anteriormente (10) y se resumen brevemente a continuación.
2.2.2 Tiempos de muestreo
Se recogieron muestras de sangre y orina durante la fase uno del día 3 e inmediatamente antes de la fase dos del día 0; Durante la fase dos, se recolectaron muestras los días 4, 9, 13, 17, 23, 26 y 31; En la fase tres, se recolectaron muestras en los días 34, 40 y 47.
2.2.3 Procedimientos de muestreo
Los gatos no tuvieron acceso a la comida durante las 8 horas previas a la toma de muestras de sangre y orina. Se recogieron muestras de sangre de un puerto de acceso vascular (NAV) antes de la administración del tratamiento (que tuvo lugar a las 18 ± 1 h). Antes de la recolección de la muestra, la solución de bloqueo VAP se aspiró y se desechó. La sangre (1,2 mL) se recolectó en tubos que contenían activador de coágulos utilizando agujas Huber estériles. Inmediatamente después de la recolección de la muestra de sangre, el suero se obtuvo por centrifugación (1800 x g durante 8 min) y se congeló. Al comienzo de la primera fase, se recolectó 1,2 ml adicionales de sangre en un tubo de EDTA. Después de la extracción de sangre, los VAP se lavaron con solución salina heparinizada (100 UI/ml, 0,7 ml en cada momento de muestreo). Las muestras de orina se recogieron inmediatamente después de la toma de muestras de sangre mediante cistocentesis guiada por ecografía siguiendo los procedimientos estándar. Tras la recolección de orina, las muestras de orina se centrifugaron a 1800 x g durante 8 min, y el sobrenadante se alícuota y almacenó a -80 °C hasta el análisis. Los gatos tuvieron libre acceso a agua potable durante todo el estudio.
2.2.4 Determinación de SDMA y creatinina séricas, y análisis de orina
Las muestras de suero congelado se enviaron a los laboratorios de IDEXX (transportadas en hielo seco dentro de las 24 h posteriores a la recolección) para perfiles bioquímicos de suero (Chem 10 con prueba IDEXX SDMA) y análisis de orina. Las muestras se procesaron dentro de las 24 horas posteriores al envío. Se consideró azotemia cuando la concentración de creatinina sérica fue de ≥1,6 mg/dl, según las guías IRIS LRA (12). Se utilizaron dos límites superiores diferentes de la IR para SDMA; 14 μg/dL [según IDEXX (13)] y 18 μg/dL (según lo recomendado por Brans et al. (5) para reducir la probabilidad de un resultado falso positivo para la disfunción renal). La azotemia renal se definió como creatinina sérica y/o AMDS por encima del límite superior del intervalo de referencia (IR) combinado con un peso específico en orina ≤1,035 (14).
2.3 Análisis estadístico
2.3.1 Análisis estadístico descriptivo
Debido al pequeño tamaño de la muestra, se informan datos individuales de animales para SDMA sérica y creatinina. Las distribuciones de los datos se probaron mediante la prueba de normalidad ómnibus de D’Agostino y Pearson y la prueba de Shapiro-Wilk. Las puntuaciones histológicas semicuantitativas se informan como mediana (rango) para los grupos control y de lesión renal.
2.3.2 Análisis estadístico comparativo
El área bajo la curva (AUC) (media, error estándar) para la concentración sérica de SDMA y creatinina frente a la curva temporal para la fase dos (AUC0-31 días) y la fase tres (AUC31-47 días) para los grupos de lesión renal tratada con meloxicam y control se calcularon para cada individuo por el método trapezoidal (15). Las AUC0-31 días y AUC31-47 días para la creatinina y la SDMA para los dos grupos se compararon estadísticamente mediante una prueba t no apareada de 2 colas. Se calculó la correlación de medidas repetidas entre las concentraciones séricas de SDMA y creatinina de los grupos de lesión renal y control para determinar si estos dos biomarcadores estaban correlacionados linealmente. En el grupo de lesión renal, el tiempo hasta el desarrollo de azotemia renal utilizando las concentraciones de creatinina o SDMA se estimó mediante el análisis de supervivencia de Kaplan-Meier, y las funciones de supervivencia se compararon mediante la prueba de rango logarítmico. El análisis se realizó dos veces, utilizando 14 μg/dL y 18 μg/dL como límite superior de la IR para SDMA. El nivel de significación para las comparaciones estadísticas se fijó en p ≤ 0,05. Los análisis descriptivos, de AUC y de supervivencia de Kaplan-Meier se realizaron con Prism 9.5.0 (GraphPad Software, LLC). El análisis de correlación de medidas repetidas se realizó utilizando rmcorrShiny (16).
3 Resultados
3.1 Histopatología renal
Los hallazgos histopatológicos renales se resumen en la Figura 2 y en la Tabla 1. Dos gatos del grupo de meloxicam a corto plazo no presentaron evidencia de lesión renal, no desarrollaron azotemia renal durante el estudio (concentraciones máximas de creatinina sérica de 1,0 mg/dl y 1,1 mg/dl) y se excluyeron de análisis posteriores. Los cuatro gatos restantes en los grupos de meloxicam tenían evidencia de lesión renal y se incluyeron en el grupo de lesión renal tratado con meloxicam. De los seis gatos del grupo control, uno tenía inflamación intersticial leve y daño tubular cortical y corticomedular leve-moderado, y otros dos gatos presentaban inflamación intersticial leve (Figura 2).
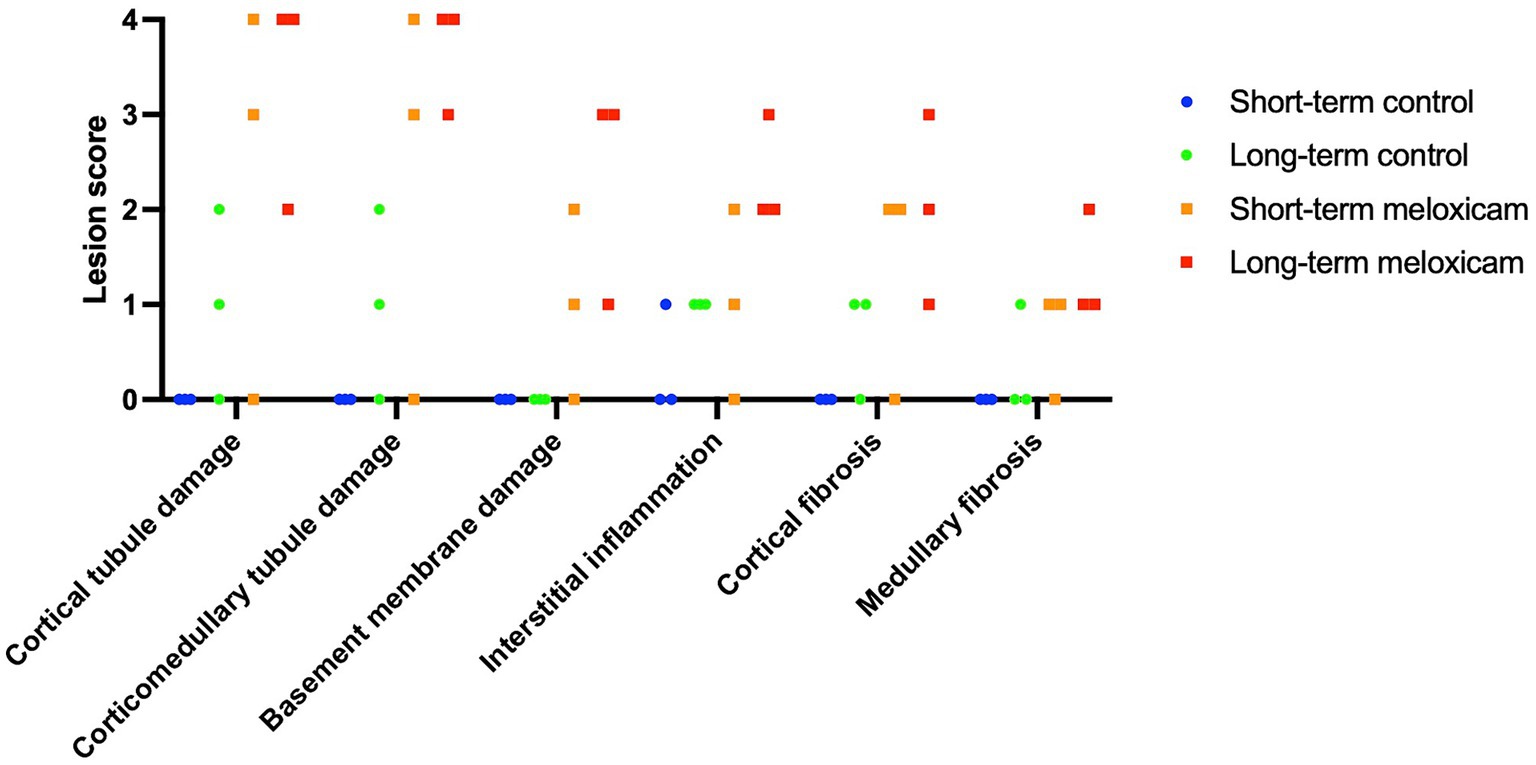 Figura 2. Puntuaciones histológicas semicuantitativas. Los seis puntos de datos para cada grupo abarcan tres gatos con puntuaciones para cada riñón individual.
Figura 2. Puntuaciones histológicas semicuantitativas. Los seis puntos de datos para cada grupo abarcan tres gatos con puntuaciones para cada riñón individual.
3.2 Cambios en la SDMA sérica, la creatinina y la gravedad específica de la orina
Al comienzo de la fase uno, todos los gatos tuvieron un examen físico normal, hemograma completo, perfil químico sérico y análisis de orina, con gravedades específicas >1.055. Todos los datos se distribuyeron normalmente. En las Figuras 3 y 4 se presentan los perfiles de creatinina sérica y concentración de SDMA frente a los perfiles temporales de cada gato. Las AUC0-31 días para la creatinina en los grupos control y con lesión renal tratada con meloxicam fue de 31,74 ± 0,9014 y 72,39 ± 17,66, respectivamente (p = 0,0085). Las AUC0-31 días para SDMA en los grupos control y lesión renal fue de 395,9 ± 17,23 y 587,0 ± 126,0, respectivamente (p = 0,0823). Las AUC31-47 días para la creatinina en los grupos control y tratamiento con lesión renal con meloxicam fue de 16,48 ± 0,2799 y 25,86 ± 4,262, respectivamente (p = 0,0454). Las AUC31-47 días para SDMA en los grupos control y lesión renal tratada con meloxicam fue de 188,0 ± 19,90 y 260,6 ± 47,79, respectivamente (p = 0,1826). Todos los gatos que desarrollaron una creatinina sérica y/o SDMA por encima del límite superior del IR desarrollaron una reducción simultánea de la gravedad específica de la orina a ≤1,035. Las concentraciones séricas de creatinina y SDMA en el grupo de lesión renal tratado con meloxicam se correlacionaron linealmente (rMedidas repetidas = 0,96, p = <0,001), mientras que los grupos control se correlacionaron medianamente de forma lineal (rMedidas repetidas = 0,62, p = <0,001). En el grupo de lesión renal tratado con meloxicam, el tiempo transcurrido hasta el desarrollo de azotemia renal mediante creatinina o AMDT no fue significativamente diferente utilizando 14 μg/dl (mediana de 21,5 días y 15,0 días, respectivamente, p = >0,9999) o 18 μg/l (mediana de 24,0 días, p = 0,8838) como límite superior del IR para SDMA (Figuras 5A, B). Ningún gato del grupo control desarrolló azotemia renal. Las puntuaciones de histopatología renal, la creatinina y los valores de AUC de SDMA para cada gato en el grupo de lesión renal tratado con meloxicam se presentan en la Tabla Suplementaria S1.
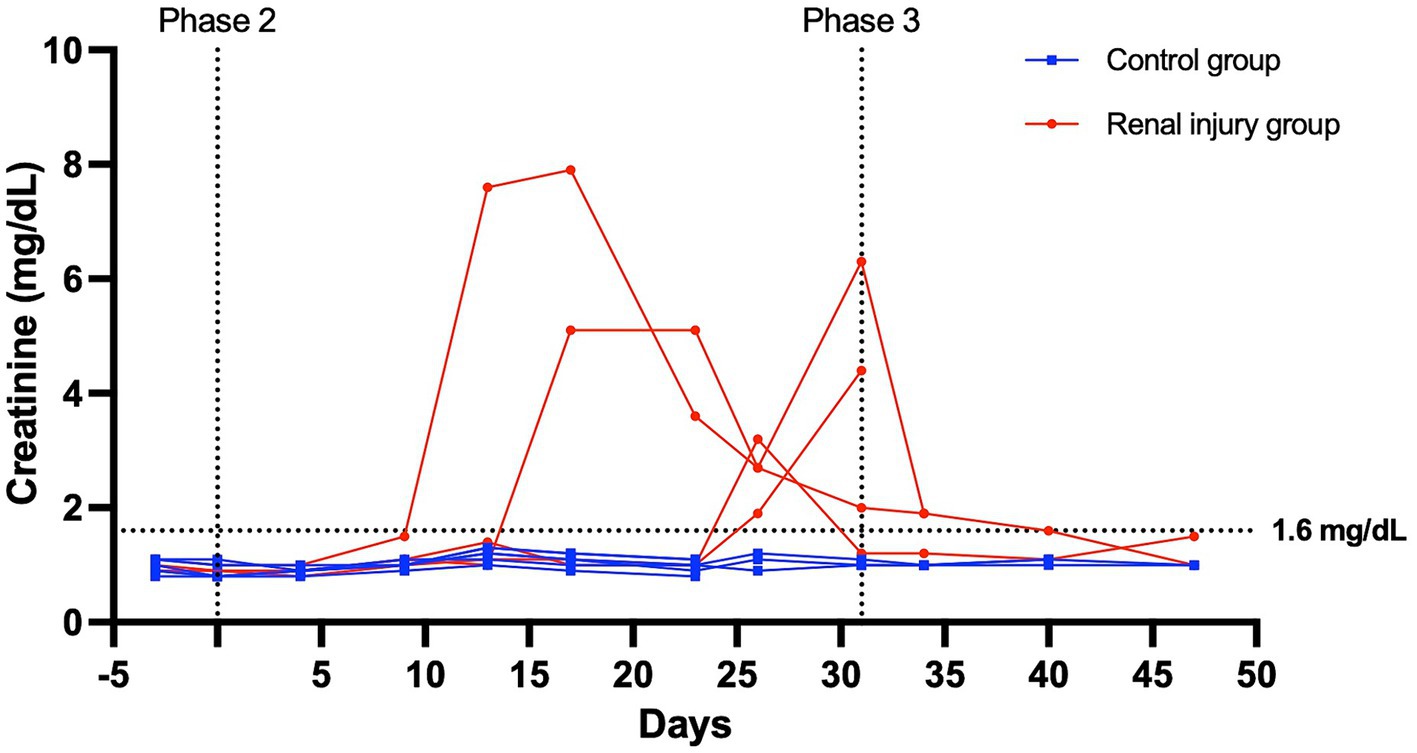 Figura 3. Creatinina sérica versus perfil temporal para seis gatos en el grupo control y cuatro gatos en el grupo de lesión renal tratada con meloxicam. Durante la fase 2 (días 0-31), a los gatos del grupo de lesión renal se les administró meloxicam 0,3 mg/kg SC cada 24 h, y a los gatos del grupo control se les administró solución salina 0,1 ml/kg SC cada 24 h. Los gatos fueron monitoreados durante la fase 3 (días 32-47). Se utilizó una creatinina sérica ≥1,6 mg/dl para definir la azotemia.
Figura 3. Creatinina sérica versus perfil temporal para seis gatos en el grupo control y cuatro gatos en el grupo de lesión renal tratada con meloxicam. Durante la fase 2 (días 0-31), a los gatos del grupo de lesión renal se les administró meloxicam 0,3 mg/kg SC cada 24 h, y a los gatos del grupo control se les administró solución salina 0,1 ml/kg SC cada 24 h. Los gatos fueron monitoreados durante la fase 3 (días 32-47). Se utilizó una creatinina sérica ≥1,6 mg/dl para definir la azotemia.
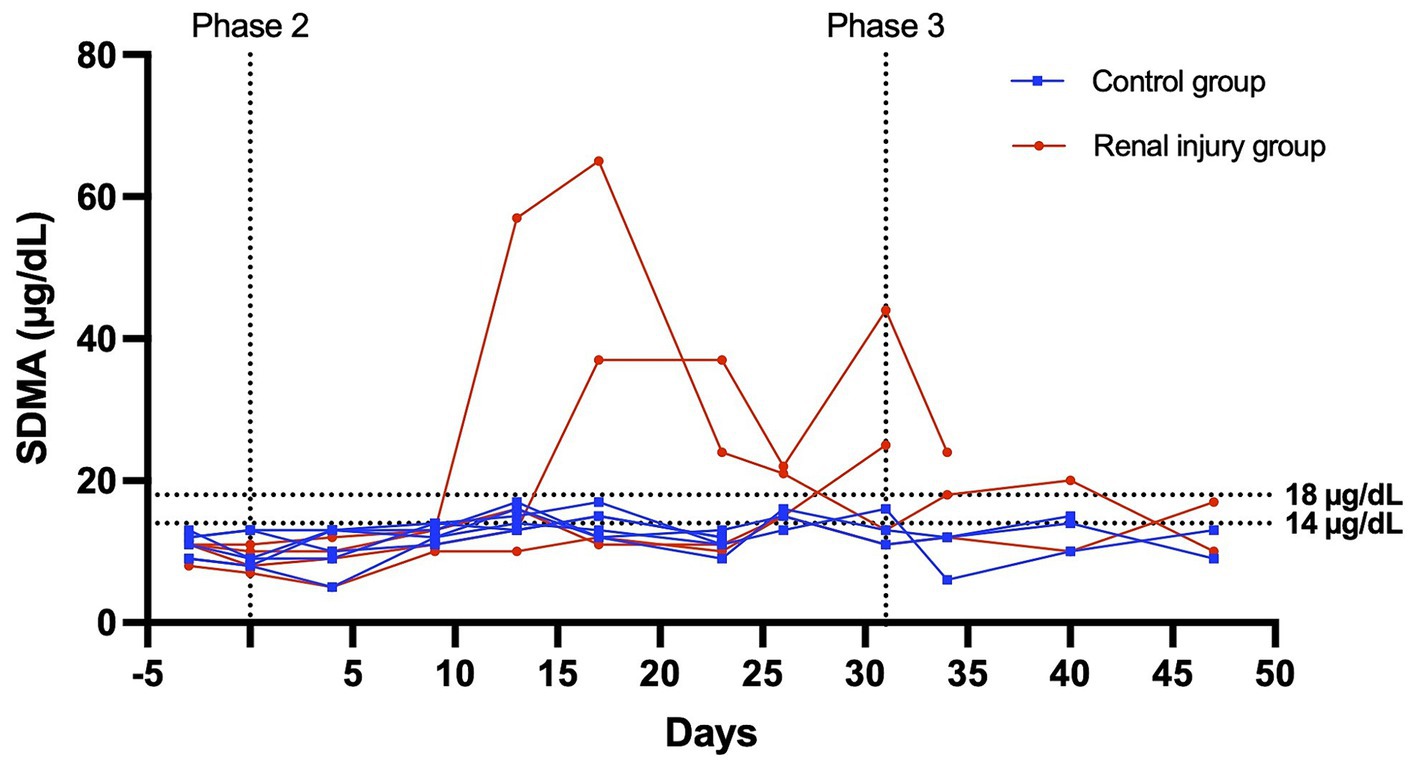 Figura 4. SDMA sérica frente al perfil temporal para seis gatos en el grupo control y cuatro gatos en el grupo de lesión renal tratado con meloxicam. Durante la fase 2 (días 0-31), a los gatos del grupo de lesión renal se les administró meloxicam 0,3 mg/kg SC cada 24 h, y a los gatos del grupo control se les administró solución salina 0,1 ml/kg SC cada 24 h. Los gatos fueron monitoreados durante la fase 3 (días 32-47). Se utilizó un SDMA ≥14 mg/dL y ≥ 18 mg/dL para definir la azotemia.
Figura 4. SDMA sérica frente al perfil temporal para seis gatos en el grupo control y cuatro gatos en el grupo de lesión renal tratado con meloxicam. Durante la fase 2 (días 0-31), a los gatos del grupo de lesión renal se les administró meloxicam 0,3 mg/kg SC cada 24 h, y a los gatos del grupo control se les administró solución salina 0,1 ml/kg SC cada 24 h. Los gatos fueron monitoreados durante la fase 3 (días 32-47). Se utilizó un SDMA ≥14 mg/dL y ≥ 18 mg/dL para definir la azotemia.
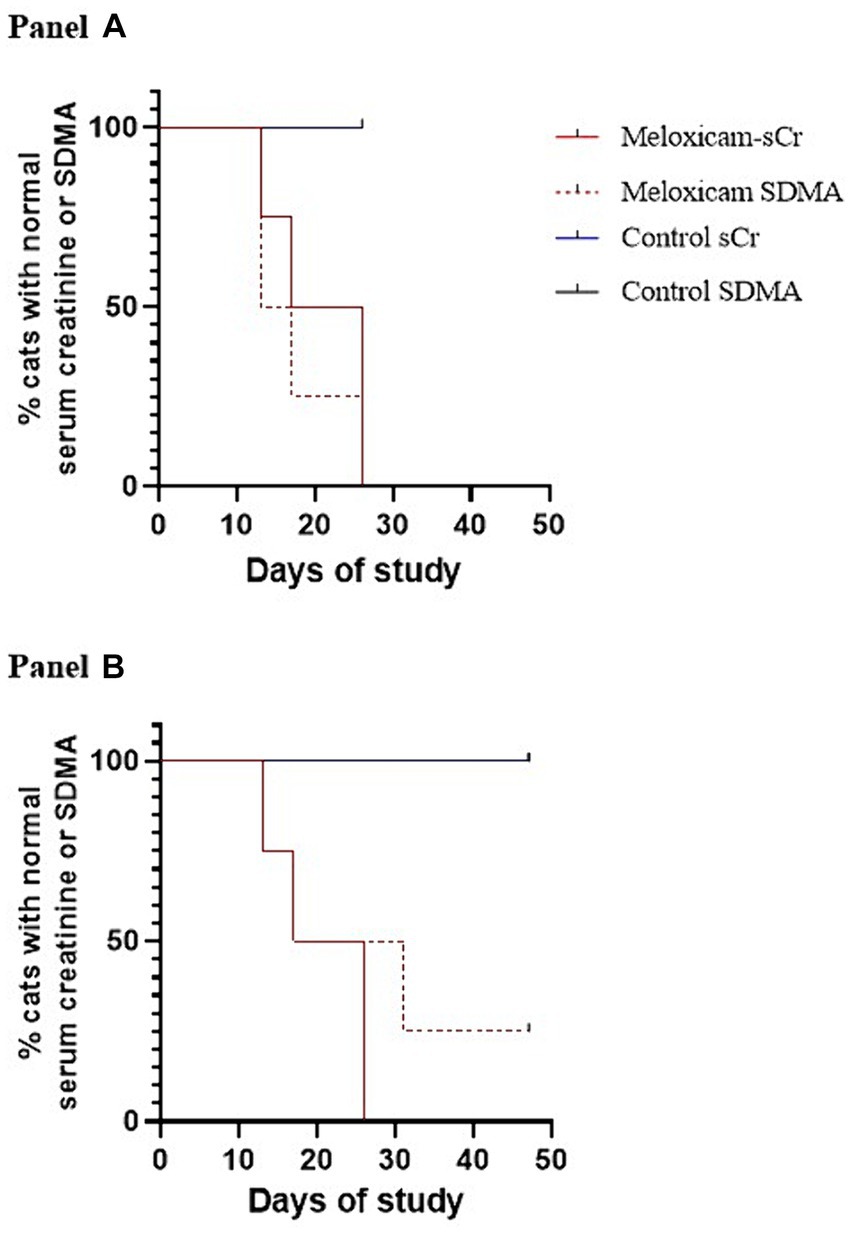 Figura 5. Curvas de supervivencia de Kaplan-Meier que representan el momento en que los gatos con lesión renal inducida por meloxicam desarrollaron azotemia utilizando creatinina sérica y SDMA (n = 3). La azotemia se definió como una creatinina sérica ≥1,6 mg/dL, y una SDMA sérica >14 mg/dL (A) o > 18 mg/dL (B).
Figura 5. Curvas de supervivencia de Kaplan-Meier que representan el momento en que los gatos con lesión renal inducida por meloxicam desarrollaron azotemia utilizando creatinina sérica y SDMA (n = 3). La azotemia se definió como una creatinina sérica ≥1,6 mg/dL, y una SDMA sérica >14 mg/dL (A) o > 18 mg/dL (B).
4 Discusión
Este estudio piloto compara el efecto de la administración repetida de 0,3 mg/kg de meloxicam al día sobre la creatinina sérica y la AMDS. Nuestros resultados no proporcionan pruebas suficientes para rechazar nuestra hipótesis nula de que la creatinina sérica y la SDMA son igualmente efectivas en la detección de la función renal alterada causada por la lesión renal inducida por meloxicam en gatos.
Uno de los hallazgos más reveladores de este estudio es que parece haber una variabilidad individual significativa en la forma en que los gatos toleran el meloxicam. Dos de cada seis gatos de nuestro estudio no desarrollaron lesión renal a pesar de recibir meloxicam 0,3 mg/kg SC cada 24 h durante 31 días. Se observó una variabilidad similar en la solicitud de nuevo medicamento para animales de la FDA de meloxicam, que informa que cuatro de cada seis gatos no tenían evidencia histopatológica de lesión renal después de que se les administrara meloxicam 0,3 mg/kg SC cada 24 h durante tres días (17). Otra evidencia reciente sugiere que la lesión renal puede ocurrir en ausencia de desafío hemodinámico en gatos después de una sola inyección SC a una dosis ≤0,3 mg/kg (9) y después de dosis repetidas (8), mientras que otros estudios demuestran la seguridad de meloxicam cuando se administra VO a una dosis baja repetida (0,01-0,03 mg/kg SID) (18-20). Los factores que explican la tolerancia o susceptibilidad individual al meloxicam, y si esta variabilidad interindividual se extiende a otros AINE, siguen sin estar claros, pero merecen más investigación.
En el grupo control tratado con solución salina, tres gatos presentaban algunas lesiones renales sutiles de origen desconocido, pero no desarrollaron azotemia (Tabla 1; Figura 2), lo que sugiere que estas lesiones renales no alteraron el FG lo suficiente como para alterar la creatinina sérica y el filtrado renal SDMA. Cuatro de los seis gatos tratados con meloxicam tenían lesiones renales generalizadas. En estos cuatro gatos, la concentración de creatinina sérica aumentó por encima del intervalo de referencia IRIS. Del mismo modo, todos los gatos tenían una concentración sérica de SDMA por encima del intervalo de referencia IDEXX (14 μg/dL). Sin embargo, en un gato, la SDMA sérica no superó el punto de corte de 18 μg/dL recomendado por Brans et al. (5). Las elevaciones de ambos biomarcadores en el grupo de lesión renal tratado con meloxicam presumiblemente reflejan cambios funcionales inducidos por meloxicam que resultan en una reducción de la TFG (21). Sin embargo, la TFG no se midió directamente en este estudio. Las lesiones renales observadas pueden conducir a una obstrucción luminal proximal y a un reflujo de filtrado a través de las células tubulares proximales lesionadas, lo que resulta en una disminución del FG (22).
Durante las etapas dos y tres de este estudio, los gatos tratados con meloxicam con lesión renal tenían concentraciones de creatinina sérica significativamente más altas que los gatos control (p = 0,0085 y 0,0454, respectivamente) (Figura 3). Sin embargo, la SDMA sérica en el grupo de lesión renal tratada con meloxicam no fue significativamente mayor que en el grupo control en ninguna de las fases del estudio, a pesar de la buena correlación con la creatinina (r = 0,9524 y r = 0,8410 en los grupos de lesión renal y control tratados con meloxicam, respectivamente) (23, 24).
Otro resultado relevante de este estudio es el importante desfase entre la inducción de la lesión renal y el desarrollo de azotemia renal. En el grupo de lesión renal inducida por meloxicam, el tiempo para desarrollar azotemia renal utilizando creatinina o SDMA no fue diferente (p > 0,05), a pesar de utilizar 14 μg/dL como límite superior del IR para SDMA según lo especificado por IDEXX. Se desconoce cuándo los cambios renales y la TFG comienzan a disminuir durante el curso del tratamiento. Sin embargo, esperábamos que la elevación de estos biomarcadores se produjera antes, teniendo en cuenta que la administración de meloxicam 0,3 mg/kg por vía subcutánea cada 24 h durante 3 días provocaba dilatación de los túbulos corticales e infiltración de células inflamatorias intersticiales en algunos gatos (17). Cabe destacar que, en nuestro estudio, la creatinina y la SDMA tampoco fueron capaces de detectar la presencia de lesiones histopatológicas renales sutiles en tres de nuestros gatos control. Teniendo en cuenta el tiempo de retraso potencialmente prolongado (intervalo entre la TFG anormal y la creatinina sérica anormal/SDMA) y las lesiones renales observadas en este estudio, los marcadores urinarios de estrés de las células epiteliales (como la molécula de lesión renal-1) y las moléculas pequeñas excretadas en orina como la taurina, el triptófano, la tirosina, el lixitol, la pseudouridina, el xilitol, el ácido treónico (10) y la cistatina B (23) podrían ser más sensibles que los biomarcadores de TFG para detectar cambios renales tempranos inducidos por meloxicam. Nuestros resultados sugieren que estos marcadores de lesión renal deberían ser el foco de futuras investigaciones en esta área, y que los estudios terminales adicionales que investiguen los cambios en los biomarcadores de la TFG pueden no ser éticamente justificables.
Nuestros hallazgos son consistentes con los reportados por Brans et al. (5), quienes midieron retrospectivamente la creatinina sérica, SDMA y FG en 17 gatos con ERC, 15 gatos con diabetes mellitus y 17 gatos sanos. El análisis de las características operativas del receptor (ROC) de este conjunto de datos mostró que la SDMA no fue superior a la creatinina en la detección de disfunción renal leve u obvia (5). Esto, y los resultados de nuestro estudio, no respaldan los materiales de marketing actuales de IDEXX de que «la SDMA puede detectar la pérdida de función de leve a moderada que la creatinina pasa por alto» (24). En gatos, esta afirmación parece derivarse de un único estudio retrospectivo que evaluó la creatinina sérica, la SDMA y la TFG en 21 gatos con ERC y 21 gatos geriátricos sanos (3). Desafortunadamente, este estudio tiene limitaciones significativas, incluida la falta de información sobre los criterios de selección de la muestra (los gatos fueron seleccionados de una colonia de más de 400) y el análisis ROC de las concentraciones de SDMA, con conclusiones extraídas de modelos lineales y no lineales no especificados y no validados (3). Además, se utilizó 2,1 mg/dL como límite superior de la normalidad para la creatinina, frente a los <1,6 mg/dL especificados por IRIS (6). Por lo tanto, es probable que la sensibilidad informada de la creatinina sérica para la detección de ERC en este estudio sea inferior a la obtenida si se hubieran seguido las directrices IRIS. Otro estudio que documentó las concentraciones de SDMA y creatinina en una cohorte de perros y gatos con enfermedad renal natural utilizó un límite superior aún más alto de creatinina sérica normal (2,3 mg/dL) (25).
La principal limitación de este estudio es el pequeño tamaño muestral y el riesgo asociado de error de tipo II. No se realizó ningún análisis de potencia a priori y, como tal, no está claro si el tiempo hasta la comparación de la concentración anormal de biomarcadores refleja un estudio verdaderamente negativo o con un poder estadístico insuficiente. Otra limitación de este estudio es la falta de muestras de tejido renal y de estudios histopatológicos renales antes y durante la administración de los tratamientos, por lo que se desconoce en qué momento se produjeron las lesiones microscópicas renales. Las biopsias previas al tratamiento podrían proporcionar información valiosa como parte de los criterios de inclusión de los animales y deben tenerse en cuenta en futuros estudios.
La medida en que nuestros hallazgos pueden extrapolarse a los gatos con enfermedad renal natural está abierta a la discusión. No está claro el mecanismo exacto a través del cual el meloxicam indujo lesión renal y elevación de la creatinina sérica y la SDMA en algunos gatos de nuestro estudio (26, 27). Es dudoso que nuestro modelo experimental de enfermedad renal felina pueda recapitular todos los aspectos de la LRA o la ERC que ocurren de forma natural, dado el rango de posibles etiologías que a menudo se desconocen (28, 29). Por otro lado, los gatos de nuestro grupo de lesión renal presentaron cambios histopatológicos renales comparables a los observados con la ERC y la LRA de origen natural (11, 30, 31), y el curso clínico de la LRA asociada a meloxicam es comparable a otras causas de LRA en gatos (9, 28).
Hasta donde sabemos, este es el único estudio prospectivo que evalúa las concentraciones séricas de creatinina y SDMA antes, durante y después de la inducción de la lesión renal en gatos. Nuestros hallazgos, en el contexto de la literatura actual y las condiciones experimentales, no proporcionan evidencia que sugiera que la SDMA sérica sea superior a la creatinina sérica en la detección de la función renal deteriorada causada por la lesión renal inducida por meloxicam en gatos, y destacan la necesidad de descubrir y validar biomarcadores para detectar la lesión renal temprana.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por la Universidad Estatal de Washington ICACCUC. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
MW: Curación de datos, Análisis formal, Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición. LB-N: Metodología, Redacción – revisión y edición. NV: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Software, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Esta investigación fue financiada por la Fundación Autzen y el John and Ruth Ottmar Memorial Endowment con fondos internos de la Facultad de Medicina Veterinaria de la Universidad Estatal de Washington, Estados Unidos. Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Reconocimientos
El programa de investigación renal de NV cuenta con el apoyo de la Facultad de Medicina Veterinaria de la Universidad Estatal de Washington, Kay Yarborough Nelson, Profesora Distinguida en Feline Health Endowment y una generosa donación de Mary Kay Fowler.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1395505/full#supplementary-material
Referencias
1. Sargent, HJ, Elliott, J y Jepson, RE. La nueva era de los biomarcadores renales: ¿la SDMA resuelve todos nuestros problemas? J Pequeña Anim Pract. (2021) 62:71–81. doi: 10.1111/jsap.13236
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Braff, J, Obare, E, Yerramilli, M, Elliott, J y Yerramilli, M. Relación entre la concentración sérica de dimetilarginina simétrica y la tasa de filtración glomerular en gatos. J Veterinario Pasante Med. (2014) 28:1699–701. doi: 10.1111/jvim.12446
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Hall, JA, Yerramilli, M, Obare, E, Yerramilli, M, y Jewell, DE. Comparación de las concentraciones séricas de dimetilarginina y creatinina simétricas como biomarcadores de función renal en gatos con enfermedad renal crónica. J Veterinario Pasante Med. (2014) 28:1676–83. doi: 10.1111/jvim.12445
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Hall, JA, Yerramilli, M, Obare, E, Yerramilli, M, Yu, S, y Jewell, DE. Comparación de las concentraciones séricas de dimetilarginina y creatinina simétricas como biomarcadores de la función renal en gatos geriátricos sanos alimentados con alimentos reducidos en proteínas enriquecidos con aceite de pescado, L-carnitina y triglicéridos de cadena media. Veterinario J. (2014) 202:588–96. doi: 10.1016/j.tvjl.2014.10.021
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Brans, M, Daminet, S, Mortier, F, Duchateau, L, Lefebvre, HP y Paepe, D. Concentraciones plasmáticas simétricas de dimetilarginina y creatinina y tasa de filtración glomerular en gatos con función renal normal y disminuida. J Veterinario Pasante Med. (2021) 35:303–11. doi: 10.1111/jvim.15975
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. IRIS. Estadificación IRIS de la ERC. Sociedad Internacional de Interés Renal; (2023). Disponible en: http://www.iris-kidney.com/education/pdf/2_IRIS_Staging_of_CKD_2023.pdf
7. Grauer, GF. Utilidad de la creatinina, UPC y SDMA en el diagnóstico precoz de la ERC en perros y gatos (actualizado 2019) [internet]. (2019) (consultado el 7 de diciembre de 2023). Disponible en: http://www.iris-kidney.com/education/education/utility_creatine_early_diagnosis_ckd.html
8. Administración de Alimentos y Medicamentos de EE. UU. [Internet] (2022) (citado el 11 de marzo de 2023). Información sobre el recuadro de advertencia en las etiquetas de meloxicam con respecto a los riesgos de seguridad en gatos. Disponible en: https://www.fda.gov/animal-veterinary/product-safety-information/information-about-boxed-warning-meloxicam-labels-regarding-safety-risks-cats
9. Wun, M, Leister, E, King, T, Korman, R, y Malik, R. Lesión renal aguda en 18 gatos después de meloxicam subcutáneo y una actualización sobre el uso de medicamentos antiinflamatorios no esteroideos en pacientes felinos en Australia. Aust Vet J. (2023) 101:90–8. doi: 10.1111/avj.13222
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Broughton-Neiswanger, LE, Rivera-Vélez, SM, Suárez, MA, Eslovaco, JE, Piñeyro, PE, Hwang, JK, et al. Huella química urinaria dejada por la administración repetida de AINE: descubrimiento de biomarcadores putativos mediante inteligencia artificial. PLoS Uno. (2020) 15:e0228989. doi: 10.1371/journal.pone.0228989
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Kudose, S, Hoshi, M, Jain, S, y Gaut, JP. Hallazgos histopatológicos renales asociados a la gravedad de la lesión renal aguda clínica. Am J Patología Quirúrgica. (2018) 42:625–35. doi: 10.1097/PAS.000000000000001028
12. Cowgill, L. Clasificación de la lesión renal aguda [Internet]. Sociedad Internacional de Interés Renal; (2016). Disponible en: http://www.iris-kidney.com/pdf/4_ldc-revised-grading-of-acute-kidney-injury.pdf
13. IDEXX. Interpretación de los resultados de la SDMA [Internet]. [citado 17 dic 2022]. Disponible en: https://www.idexx.com/en/veterinary/reference-laboratories/sdma/interpreting-your-sdma-results/
14. Syme, HM y Jepson, R. Enfoque clínico y evaluación de laboratorio de la enfermedad renal En: SJ Ettinger, editor. Libro de texto de medicina interna veterinaria. 8ª ed. Filadelfia: W.B. Saunders Co. (2017). 4603–49.
15. Gagnon, RC y Peterson, JJ. Estimación de intervalos de confianza para el área bajo la curva a partir de datos farmacocinéticos obtenidos destructivamente. J Farmacokinet Biopharm. 26:87–102.
16. Marusich, LR, y Bakdash, JZ. rmcorrShiny: una aplicación web e independiente para la correlación de medidas repetidas. F1000Investigación. (2021) 10:697. doi: 10.12688/f1000research.55027.1
17. NADA suplementario Metacam, solución inyectable de meloxicam 5 mg/ml, Administración de Alimentos y Medicamentos. (2028). 141–219. Disponible en: https://animaldrugsatfda.fda.gov/adafda/app/search/public/document/downloadFoi/751#:~:text=Supplemental%20NADA%20141-219%20METACAM%20Meloxicam%205%20mg%2FmL%20Solution,castration%20in%20cats%2C%20when%20administered%20prior%20to%20surgery
18. Gowan, RA, Baral, RM, Lingard, AE, Catt, MJ, Stansen, W, Johnston, L, et al. Un análisis retrospectivo de los efectos de meloxicam en la longevidad de gatos ancianos con y sin enfermedad renal crónica manifiesta. J Feline Med Surg. (2012) 14:876–81. doi: 10.1177/1098612X12454418
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Gowan, RA, Lingard, AE, Johnston, L, Stansen, W, Brown, SA y Malik, R. Estudio retrospectivo de casos y controles de los efectos de la dosificación a largo plazo de meloxicam sobre la función renal en gatos ancianos con enfermedad articular degenerativa. J Feline Med Surg. (2011) 13:752–61. doi: 10.1016/j.jfms.2011.06.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. KuKanich, K, George, C, Roush, JK, Sharp, S, Farace, G, Yerramilli, M, et al. Efectos de las dosis bajas de meloxicam en gatos con enfermedad renal crónica. J Feline Med Surg. (2021) 23:138–48. doi: 10.1177/1098612X20935750
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Dixit, M, Doan, T, Kirschner, R, y Dixit, N. Lesión renal aguda significativa debido a medicamentos antiinflamatorios no esteroideos: entorno hospitalario. Productos farmacéuticos (Basilea). (2010) 3:1279–85. doi: 10.3390/ph3041279
22. Sharfuddin, AA, y Molitoris, BA. Fisiopatología de la lesión renal aguda isquémica. Nat Rev Nephrol. (2011) 7:189–200. doi: 10.1038/nrneph.2011.16
23. Segev, G, Vaden, S, Ross, S, Dufayet, C, Cohn, LA, Farace, G, et al. La cistatina B urinaria diferencia la enfermedad renal crónica en estadio 1 IRIS progresiva y estable en perros. J Veterinario Pasante Med. (2023) 37:2251–60. doi: 10.1111/jvim.16887
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. IDEXX. ¿Por qué incluir SDMA? [Internet]. [citado 24 nov 2022]. Disponible en: https://www.idexx.com/en/veterinary/reference-laboratories/sdma/why-sdma-matters/
25. Mack, RM, Hegarty, E, McCrann, DJ, Michael, HT y Grauer, GF. Evaluación longitudinal de la dimetilarginina simétrica y concordancia de biomarcadores renales en perros y gatos. Veterinario J. (2021) 276:105732. doi: 10.1016/j.tvjl.2021.105732
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Bindu, S, Mazumder, S, y Bandyopadhyay, U. Antiinflamatorios no esteroideos (AINE) y daño a los órganos: una perspectiva actual. Biochem Pharmacol. (2020) 180:114147. doi: 10.1016/j.bcp.2020.114147
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Hunter, LJ, Wood, DM y Dargan, PI. Los patrones de toxicidad y el tratamiento de la sobredosis aguda de antiinflamatorios no esteroideos (AINE). Open Access Emerg Med Oaem. (2011) 3:39–48. doi: 10.2147/OAEM. S22795
28. Legatti, SAM, Dib, RE, Legatti, E, Botan, AG, Camargo, SEA, Agarwal, A, et al. Lesión renal aguda en perros y gatos: un metaanálisis proporcional de estudios de series de casos. PLoS Uno. (2018) 13:e0190772. doi: 10.1371/journal.pone.0190772
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Finch, NC, Syme, HM y Elliott, J. Factores de riesgo para el desarrollo de enfermedad renal crónica en gatos. J Veterinario Pasante Med. (2016) 30:602–10. doi: 10.1111/jvim.13917
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Chakrabarti, S, Syme, HM, Brown, CA y Elliott, J. Histomorfometría de la enfermedad renal crónica felina y su correlación con los marcadores de disfunción renal. Veterinario Pathol. (2013) 50:147–55. doi: 10.1177/0300985812453176
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. McLeland, SM, Cianciolo, RE, Duncan, CG, y Quimby, JM. Comparación de la estadificación bioquímica e histopatológica en gatos con enfermedad renal crónica. Veterinario Pathol. (2015) 52:524–34. doi: 10.1177/0300985814561095
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: dimetilarginina simétrica, lesión renal aguda, felino, renal, biomarcador
Cita: Wun MK, Broughton-Neiswanger LE y Villarino NF (2024) Comparación de SDMA sérica y creatinina como biomarcador para la detección de lesión renal inducida por meloxicam en gatos. Frente. Vet. Sci. 11:1395505. doi: 10.3389/fvets.2024.1395505
Recibido: 04 de marzo de 2024; Aceptado: 02 de mayo de 2024;
Publicado: 15 mayo 2024.
Editado por:
Claire Rebecca Sharp, Universidad Murdoch, Australia
Revisado por:
Corrin John Boyd, Universidad de Murdoch, Australia
Jonathan Elliott, Royal Veterinary College (RVC), Reino Unido
Derechos de autor © 2024 Wun, Broughton-Neiswanger y Villarino. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Nicolás F. Villarino, nicolas.villarino@wsu.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía