Comparativa de los genotipos del virus de la bronquitis infecciosa en gallinas ponedoras
Patogenicidad comparativa de los genotipos del virus de la bronquitis infecciosa de Massachusetts y Delmarva (DMV/1639) en gallinas ponedoras
 Muhammad Farooq1
Muhammad Farooq1  Reham M. Abd-Elsalam1,2
Reham M. Abd-Elsalam1,2  Natalia Ratcliff1
Natalia Ratcliff1  Mohamed S. H. Hassan1,3
Mohamed S. H. Hassan1,3  Shahnas M. Najimudeen1
Shahnas M. Najimudeen1  Susan C. Cork1
Susan C. Cork1  Sylvia Checkley1
Sylvia Checkley1  Yan Dong Niu1
Yan Dong Niu1  Mohamed Faizal Abdul-Careem1*
Mohamed Faizal Abdul-Careem1*- 1Centro de Innovación en Investigación en Salud, Facultad de Medicina Veterinaria, Universidad de Calgary, Calgary, AB, Canadá
- 2Facultad de Medicina Veterinaria, Universidad de El Cairo, Giza, Egipto
- 3Departamento de Medicina Aviar y Convinina, Facultad de Medicina Veterinaria, Universidad de Assiut, Assiut, Egipto
La bronquitis infecciosa (IB) es una enfermedad viral aguda y altamente contagiosa del pollo causada por el virus de la bronquitis infecciosa (IBV) de la familia Coronaviridae. Incluso con una vacunación exhaustiva contra la IB por parte de la industria avícola, la aparición de nuevos genotipos de IBV es un desafío continuo al que se enfrenta la industria avícola mundial. Este experimento fue diseñado para comparar la patogenicidad de dos cepas de IBV pertenecientes a los genotipos Massachusetts (Mass) y Delmarva DMV/1639. Las gallinas ponedoras libres de patógenos específicos fueron desafiadas durante el pico de producción (30 semanas), manteniendo un grupo de control infectado simulado. Durante los 21 días de observación después de la infección, se observó una caída significativa en la producción de huevos con cáscaras blandas y mal formadas solo en las gallinas infectadas con el DMV/1639 IBV. El grupo infectado por el virus del IBV DMV/1639 mostró una diseminación viral cloacal prolongada y más alta en comparación con el grupo infectado por el virus del IBV masivo. Al final del estudio (21 días después de la infección), las cargas del genoma viral en los tejidos respiratorio, urogenital e inmunitario fueron significativamente más altas en el grupo infectado por el IBV DMV/1639 en comparación con el grupo infectado por el IBV masivo. Las lesiones macroscópicas, como óvulos distorsionados que condujeron a peritonitis del huevo, se observaron solo en el grupo infectado por el DMV/1639 IBV. Además, las puntuaciones de lesiones microscópicas fueron significativamente más altas en el pulmón, el riñón, las amígdalas cecales y el oviducto del grupo infectado por el DMV/1639 IBV en comparación con el grupo infectado por el IBV masivo. Finalmente, el índice de apoptosis en el riñón, el ovario, el magnum, el istmo y la glándula de la concha fue significativamente más alto en el grupo infectado por el DMV/1639 IBV en comparación con los grupos de control e infectados por la masa. Este estudio examinó la patogenicidad de dos genotipos de IBV que están afectando a la industria de ponedoras en América del Norte.
1 Introducción
La bronquitis infecciosa (IB) es una enfermedad viral económicamente importante del pollo y causada por un coronavirus gamma aviar conocido como virus de la bronquitis infecciosa (IBV). A pesar de la vacunación generalizada contra la IB, la aparición de nuevos serotipos y variantes que escapan de las vacunas actuales se ha convertido en una preocupación cada vez mayor (1). Al ser un virus respiratorio, el IBV se dirige inicialmente al epitelio del tracto respiratorio superior, induciendo manifestaciones clínicas respiratorias (2). Algunas cepas del IBV pueden alcanzar y replicarse en otros sistemas del cuerpo, como el sistema urogenital que causa nefritis, reducción de la producción de huevos y huevos deformados en ponedoras (3). Los pollos infectados se vuelven susceptibles a infecciones secundarias, más comúnmente especies de Mycoplasma y otras bacterias, que eventualmente aumentan la gravedad de la IB en las parvadas (4).
Algunas cepas de IBV son bien conocidas por causar pérdidas económicas en la industria del huevo de mesa al afectar la producción y la calidad del huevo (5). Además de las infecciones bacterianas secundarias, muchos otros factores, como la edad del lote, la raza, el estado inmunitario del huésped y el manejo, pueden influir en la gravedad del resultado de la IB (6). Se han llevado a cabo varios estudios de control sobre cepas individuales del IBV. Por ejemplo, se observó un 40% de caída de huevos en ponedoras libres de patógenos específicos (SPF) infectadas experimentalmente con DMV/1639 IBV (7). La caída promedio en la producción de huevos fue del 21,67% en las granjas de ponedoras en el oeste de Canadá infectadas con IBV masivo. Además, las gallinas maduras con SPF, cuando se infectaron con IBV masivo, no produjeron huevos regulares hasta 10 días después de la infección (dpi) (8). También se observó una disminución de la producción de huevos en gallinas infectadas con Mass IBV (9). Del mismo modo, la cepa Ark del IBV disminuye la producción de huevos hasta en un 15% (10). Las ponedoras infectadas experimentalmente con la cepa D1466 IBV dejaron caer el 16% de los huevos a 10-12 dpi, y la producción no se recuperó hasta el final del experimento (11).
El tropismo tisular y la patogenicidad del IBV varían entre las diferentes cepas. Una cepa ampliamente distribuida del IBV, el genotipo QX, se encuentra entre las cepas conocidas por causar lesiones quísticas en el tracto reproductivo de pollitos jóvenes (1). Además, la cepa DMV/1639 del IBV causa un oviducto quístico en pollos libres de patógenos específicos (SPF) cuando se infectan a una edad temprana (2, 3). La infección con la cepa M41 del IBV causó daño ciliar traqueal severo en pollos susceptibles (4). Además, las cepas Mass y T del IBV fueron virulentas y causaron lesiones en el oviducto en desarrollo, mientras que las cepas Conn y Iowa 609 no produjeron patología en el oviducto inmaduro (5). Se ha determinado que otros aislados de IBV como DMV/1639/11 y PA/9579A/10 son nefropatógenos en pollos susceptibles, lo que produce reaislamientos del virus del riñón e induce lesiones microscópicas características de nefritis intersticial (6).
La muerte celular programada que resulta de la activación de la vía bioquímica intracelular de autodestrucción se denomina apoptosis (12). El proceso de apoptosis es activado por una familia de cisteínas proteasas (caspasas) a través de moléculas de señalización extrínsecas e intrínsecas, dependiendo del origen de los estímulos (13). La apoptosis inducida por virus provoca daños en los tejidos e interfiere directamente con la replicación viral en las células (14). Los estudios in vitro han demostrado que el IBV conduce a la apoptosis en células de riñón de mono verde africano (Vero), células humanas, como Huh7, y células de fibroblastos de pollo (DF1) (15, 16). Anteriormente, también se ha demostrado que el IBV es capaz de conducir a la apoptosis in vitro en células de macrófagos de pollo HD 11 (17). Chhabra et al. investigaron que las cepas IBV 885 y QX inducen una mayor apoptosis en las células renales de embriones de pollo que M41, mientras que M41 causa un mayor índice de apoptosis en cultivos de órganos traqueales en comparación con las cepas 885 y QX IBV (18), y este estudio in vitro y ex vivo proporcionó evidencia de una posible diferencia en la tasa de apoptosis debido a la diferencia en las cepas de IBV. In vivo, se ha demostrado que el IBV masivo induce la apoptosis en la tráquea, los pulmones, el riñón y la LM temprano durante la infección de 12 h a 7 días después de la infección (19). Sin embargo, la información es escasa para indicar si la inducción de apoptosis en los tejidos es dependiente de la cepa del IBV in vivo. En relación con la infección por IBV, se ha demostrado que tanto los mecanismos intrínsecos como los extrínsecos están implicados en la apoptosis inducida por IBV (17, 20).
Los estudios, que están dirigidos a investigar la patogénesis de cepas específicas del IBV, aclararán la patogenicidad de las cepas virales, lo que llevará a la inclusión de estas cepas del IBV en el desarrollo de nuevas vacunas (21). Recientemente, la cepa DMV/1639 del IBV fue identificada como una variante circulante virulenta en las parvadas de ponedoras del este de Canadá (7). La cepa del IBV, Mass (15AB-01), se aisló de las parvadas de ponedoras en Alberta (AB), con un fondo de disminución de la producción de huevos, produciendo anomalías en la cáscara del huevo (8). Con base en el gen de la espícula (S)1, la cepa DMV/1639 del IBV es solo un 97% similar a la cepa original de DMV1639 descrita en 2011 en EE. UU. (22), y la cepa 15AB-01 Mass IBV es solo un 95,5% similar a la cepa M41 del IBV (23). Cuando comparamos la secuencia del gen S1 entre DMV1639 y 15AB-01 Mass IBV, la similitud es solo del 78%. Con base en la secuencia del genoma completo, la cepa DMV/1639 del IBV es un 93,7 % similar a la cepa de la vacuna de Connecticut (Connecticut) (22), y la cepa 15AB-01 Mass IBV es un 92,8 % similar al IBV M41 (8). Cuando comparamos la secuencia del genoma completo entre DMV1639 y 15AB-01 Mass IBV, solo son similares en un 98,59%. El objetivo de la presente investigación fue estudiar la patogenicidad y patogénesis comparativa de dos cepas del IBV DMV/1639 y Mass en gallinas ponedoras, centrándose en la capacidad del IBV para inducir la apoptosis en células infectadas.
2 Materiales y métodos
2.1 Cepas virales
La cepa DMV (Canadian DMV/1639) del IBV utilizada en este estudio se aisló de una parvada de ponedoras en el este de Canadá, con antecedentes de disminución de la producción de huevos en 2017 (22). La cepa Mass IBV (15AB-01) se aisló de pollos con antecedentes de anomalías en la cáscara del huevo en el oeste de Canadá (8). Estas dos cepas de IBV se valoraron en huevos de gallina embrionados con SPF, se alícuotas y se almacenaron a -80 °C. El uso de huevos y pollos y los procedimientos relacionados con los animales descritos fueron aprobados por el Comité de Cuidado de Animales de Ciencias Veterinarias de la Universidad de Calgary (número de protocolo: AC19-0011).
2.2 Pollos
Las gallinas Leghorn blancas SPF (24 semanas de edad) se obtuvieron de la Agencia Canadiense de Inspección de Alimentos (CFIA), Ottawa, Canadá. Las gallinas (n = 36) se mantuvieron en la Estación de Investigación de Ciencias Veterinarias (VSRS) en el Campus Spy Hill de la Universidad de Calgary. Se permitió que las gallinas se aclimataran y alcanzaran el período pico de puesta antes de la infección. El alimento, el agua, la luz, la temperatura y la humedad se ajustaron de acuerdo con los procedimientos de manejo recomendados para las gallinas ponedoras maduras White Leghorn.
2.3 Diseño experimental
2.3.1 IBV e infección simulada
Las gallinas se distribuyeron aleatoriamente en tres grupos (n = 12 gallinas por grupo) y se alojaron en tres salas separadas de presión negativa con un movimiento dirigido predeterminado del personal. Las gallinas del grupo infectado fueron inoculadas por vía intratraqueal y óculo-nasal con 1 × 106 dosis infecciosa embrionaria (EID)50 del DMV/1639 IBV y Mass IBV. Al grupo control se le administró solución salina tamponada con fosfato (PBS), con pH 7,4, por la misma vía.
2.3.2 Observaciones clínicas y recolección de hisopos, sangre y óvulos
Las gallinas de los tres grupos fueron observadas dos veces al día (por la mañana y por la noche) en busca de signos clínicos. Los signos clínicos se puntuaron en una escala de 0 a 3, desde ningún signo clínico hasta signos graves, como se ilustró anteriormente (24). En resumen, cada uno de los resultados generales, como depresión, plumas erizadas y alas caídas, se puntuó con 1. Los signos específicos de las puntuaciones respiratorias leves, como el aumento de la respiración con el pico cerrado, son 1, y los signos respiratorios moderados, como el aumento de la respiración con la boca abierta, la tos, los ojos llorosos y la secreción nasal, son 2, y los signos respiratorios graves, como el jadeo marcado, son 3. La puntuación clínica agregada total de 5 para una sola ave fue el punto final humanitario según las directrices del Consejo Canadiense de Cuidado Animal (CCAC). Se recolectaron hisopos orofaríngeos (OP) y cloacales (CL) a 3, 10, 17 y 21 ppp utilizando el medio de transporte del virus Puritan (Puritan Medical Products Co., Guilford, ME, Estados Unidos). Las muestras se transportaron en hielo y se almacenaron a -80 °C hasta su posterior procesamiento. Además, todas las gallinas fueron sangradas a 10 y 21 dpi para recolectar 1 mL de sangre de la vena del ave en tubos lisos que se mantuvieron a 4°C durante la noche. El suero se separó por centrifugación a 1.503 g (4.000 rondas por minuto o rpm) durante 10 min, se alícuota en tubos de microcentrífuga de 100 μL y se almacenó a -20 °C. Los huevos de los tres grupos se recolectaron una vez al día. Los huevos se pesaron con una báscula sensible (0,01 g LCD Mini Precision). La longitud, el ancho y la altura de la albúmina gruesa de cada huevo se midieron con un calibrador vernier (calibre digital LCD modelo H-7352).®
2.3.3 Examen post mortem y recogida de muestras
A los 21 dpi, todos los animales fueron anestesiados con isoflurano y luego sacrificados por luxación cervical (25). Las muestras de la tráquea, el pulmón, el riñón, el bazo, las amígdalas cecales (TC), el ovario y el oviducto se recogieron en RNA Save (Biological Industries, Beit Haemek, Israel). Además, también se recolectaron segmentos de la tráquea, el pulmón, el riñón, la TC, el magnum, el istmo y la glándula de la concha en formol tamponado neutro al 10 % (VWR International, Edmonton, AB, Canadá) para análisis histopatológicos e inmunohistoquímicos. Los tejidos de RNA Save se congelaron a -80 °C hasta su posterior procesamiento.®
2.4 Técnicas
2.4.1 Cuantificación de la carga genómica del IBV
La extracción de ácido ribonucleico (ARN) total se realizó en las muestras de tejido e hisopo utilizando el reactivo Trizol (Invitrogen Canada Inc., Burlington, ON, Canadá), siguiendo las pautas del fabricante. La concentración de ARN y la calidad del ARN extraído se determinaron utilizando el espectrofotómetro Nanodrop1000 (Thermo Scientific, Wilmington, DE, Estados Unidos), basado en la absorbancia de longitud de onda de 260/280 nm. En total, se utilizaron 2 μg de ARN de cada hisopo y muestra de tejido para sintetizar ácido desoxirribonucleico (ADNc) complementario utilizando el kit de transcripción inversa de ADNc de alta capacidad (Invitrogen Life Technologies, Carlsbad, CA, Estados Unidos), de acuerdo con el protocolo del fabricante. Los genomas del IBV en muestras de hisopos y tejidos se cuantificaron con el ensayo cuantitativo de reacción en cadena de la polimerasa (qPCR) basado en verde SYBR utilizando cebadores del gen de la nucleocápside (N) como se describió anteriormente (26). Se utilizó un plásmido del gen N del IBV preparado internamente para generar la curva estándar utilizando diluciones seriadas de 10 veces. Todos los ensayos se realizaron con Fast SYBR Green Master Mix (Quntabio, Beverly, MA, Estados Unidos) en 20 μL de volumen de reacción. La reacción se realizó en placas de PCR de 96 pocillos con 10 μL de SYBR Green Master Mix, 100 ng de la respectiva plantilla de ADNc en 2 μL, 0,5 μL de cebadores directos e inversos y 7 μL de agua de grado molecular. Las condiciones establecidas para el termociclado fueron 95 °C durante 20 s (s), seguido de 40 ciclos de amplificación, extensión a 95 °C durante 3 s y 60 °C durante 30 s; El análisis de la curva de fusión se realizó a 95 °C durante 10 s (Segmento 1), 65 °C durante 5 s (Segmento 2) y 9 °C durante 5 s (Segmento 3). La adquisición fluorescente se realizó a 60 °C durante 30 s.®®®
2.4.2 Ensayo de inmunoabsorción ligado a enzimas
Los anticuerpos de los lavados de suero y oviducto se analizaron con un kit comercial de ELISA (IDEXX Laboratories, Inc., Westbrook, ME, Estados Unidos). Se siguió el protocolo y la fórmula del fabricante para la cuantificación de los títulos de anticuerpos considerando los títulos >396 (valor de corte) como positivos.
2.4.3 Histopatología
Los tejidos (tráquea, pulmón, riñón, bazo, amígdalas cecales, ovario y oviducto) se fijaron en formol tamponado neutro al 10%, seccionados a 5 μm de espesor y teñidos con hematoxilina y eosina (H&E) en la Unidad de Servicios de Diagnóstico (DSU) de la Universidad de Calgary. Todos los portaobjetos se examinaron mediante microscopía óptica (Olympus BX51, Center Valley, PA, Estados Unidos) para determinar la puntuación de la lesión atribuible a la infección por IBV. El desprecio de las lesiones de la tráquea, el pulmón, el riñón y el oviducto se realizó de acuerdo con los métodos publicados anteriormente (21) con algunas modificaciones. En resumen, las lesiones como pérdida de epitelio, degeneración, necrosis, depleción de las glándulas mucosas e infiltración linfoplasmocítica recibieron una puntuación de la siguiente manera: normal (0); leve (1); moderado (2); y grave (3) (27). El espesor de la mucosa traqueal se midió con el analizador Image J (National Institute of Health, Bethesda, Maryland, Estados Unidos). Se fotografió digitalmente la mucosa traqueal ventral con un poder de aumento del 200× y, a continuación, se midió el grosor total de la mucosa.
2.4.4 Inmunohistoquímica
Se realizó una técnica inmunohistoquímica siguiendo los métodos descritos anteriormente (28). Las secciones de 5 μm de espesor se desparafinaron en dos cambios de xileno y luego se rehidrataron en alcohol. La actividad peroxidasa endógena se bloqueó mediante la incubación de secciones en 3% H2O2 Solución en metanol a temperatura ambiente durante 10 min. El método de recuperación antigénica de calor se realizó para desenmascarar los epítopos antigénicos utilizando tampón citrato de 10 mM a pH 6,0 (29). Las secciones de tejido se incubaron en tampón bloqueante (suero de caballo al 2,5%) durante 1 h a temperatura ambiente. El anticuerpo primario anti-IBV de ratón (Novus Biological, Bio-Techne, Toronto, ON, Canadá) diluido (1.400) en suero de caballo al 2,5% se añadió a la sección de tejido y se incubó a 4 °C durante la noche en una cámara humidificada. Las secciones de tejido se incubaron con anticuerpo secundario anti-ratón de cabra (DK-2594, Vector Laboratories Inc., Burlingame, CA, Estados Unidos) durante 30 min. La unión de anticuerpos se detectó mediante la solución del kit de peroxidasa ABC (Vector Laboratories Inc., Burlingame, CA, Estados Unidos) y el sustrato DAB (3, 3′-Diaminobencidina) (Vector Laboratories Inc., Burlingame, CA, Estados Unidos). Las secciones se contratiñeron con hematoxilina de Gill (Vector Laboratories Inc., Burlingame, CA, Estados Unidos) y luego se cubrió con medios de montaje Vectashield 4′, 6-diamidino-2-fenilindol (DAPI, Vector Laboratories Inc., Burlingame, CA, Estados Unidos).®
2.4.5 Marcaje terminal de la desoxinucleotidil transferasa dUTP para la detección de apoptosis en secciones de tejido
La apoptosis se detectó en la tráquea, el pulmón, el riñón, el ovario y los oviductos utilizando un kit de ensayo TUNEL, siguiendo los procedimientos del fabricante (Promega, Madison, Wisconsin, Estados Unidos) y el protocolo previamente publicado (30). En resumen, las secciones de tejido incluidas en parafina se desparafinaron en xileno, se rehidrataron en diferentes grados de alcoholes y luego se fijaron con paraformaldehído al 4% en PBS durante 15 min. Las secciones de tejido se permeabilizaron mediante la adición de 100 μL de una solución de proteinasa K de 20 μg/mL durante 30 min a temperatura ambiente. Se añadió tampón de equilibrio a las secciones de tejido durante 10 min. Las secciones de tejido se incubaron con una mezcla de reacción de desoxinucleotidil transferasa terminal (TdT) durante 60 min a 37 °C en una cámara humidificada. La reacción se detuvo sumergiendo los portaobjetos en citrato de sodio salino al 2× durante 15 min. La actividad peroxidasa endógena se bloqueó mediante la incubación de secciones en 3% H2O2 solución a temperatura ambiente durante 5 min. Las secciones de tejido se incubaron con estreptavidina peroxidasa de rábano picante (diluida 1:500 en PBS) durante 30 min a temperatura ambiente, y luego, la reacción se visualizó agregando solución de DAB hasta que aparece un fondo marrón claro (3-5 min dependiendo del tipo de órgano y el grosor de la sección). Las secciones de tejido se contratiñeron con hematoxilina de Gill y luego se montaron con un cubreobjetos. El índice de apoptosis se calculó como el número promedio de células apoptóticas TUNEL-positivas en cinco campos diferentes por órgano bajo el objetivo del 20×. El índice apoptótico medio representa el promedio del índice apoptótico de seis aves seleccionadas al azar por grupo.
2.4.6 Análisis estadístico
Se utilizó una prueba de ANOVA de dos vías, seguida de la prueba de comparación múltiple de Tukey, para las puntuaciones clínicas y los datos de medición de huevos. La producción de huevos entre los grupos se comparó con una prueba de chi-cuadrado de 2 × 3. Las cargas genómicas del IBV en hisopos y tejidos OP y CL se analizaron mediante la prueba de ANOVA de dos vías, seguida de la prueba de comparación múltiple de Sidak. Se utilizó una prueba de ANOVA de un factor, seguida de la prueba de comparación múltiple de Tukey, para analizar los datos de los títulos de anticuerpos. Finalmente, se aplicó la prueba de Kruskal-Wallis y la prueba de comparación múltiple de Dunn para la puntuación de la lesión patológica y la puntuación de la apoptosis. Los supuestos de las pruebas estadísticas se evaluaron y se cumplieron antes de proceder con el análisis. Para el análisis estadístico y la generación de figuras se utilizó el software GraphPad Prism 9.4.1 (GraphPad Software, San Diego, CA, Estados Unidos).
3 Resultados
3.1 Manifestación clínica
Después de la infección por IBV, se observaron gallinas de todos los grupos dos veces al día para el desarrollo de signos clínicos hasta los 21 dpi. No se observaron signos clínicos en el grupo control. Por el contrario, las gallinas de ambos grupos infectados (DMV/1639 y Mass IBV) comenzaron a mostrar signos clínicos, como plumas erizadas y un leve aumento de la respiración a partir de los 2 dpi. En el grupo infectado por el IBV en masa, un ave mostró signos respiratorios moderados (aumento de la respiración, respiración constante con el pico abierto). La puntuación clínica media del grupo infectado por IBV masivo fue significativamente mayor a 4 dpi en comparación con el grupo control (p < 0,05) (Figura 1A). A partir de los 7 dpi, todas las gallinas de los grupos infectados comenzaron a normalizarse; no se observaron manifestaciones clínicas en los grupos infectados por el IBV.
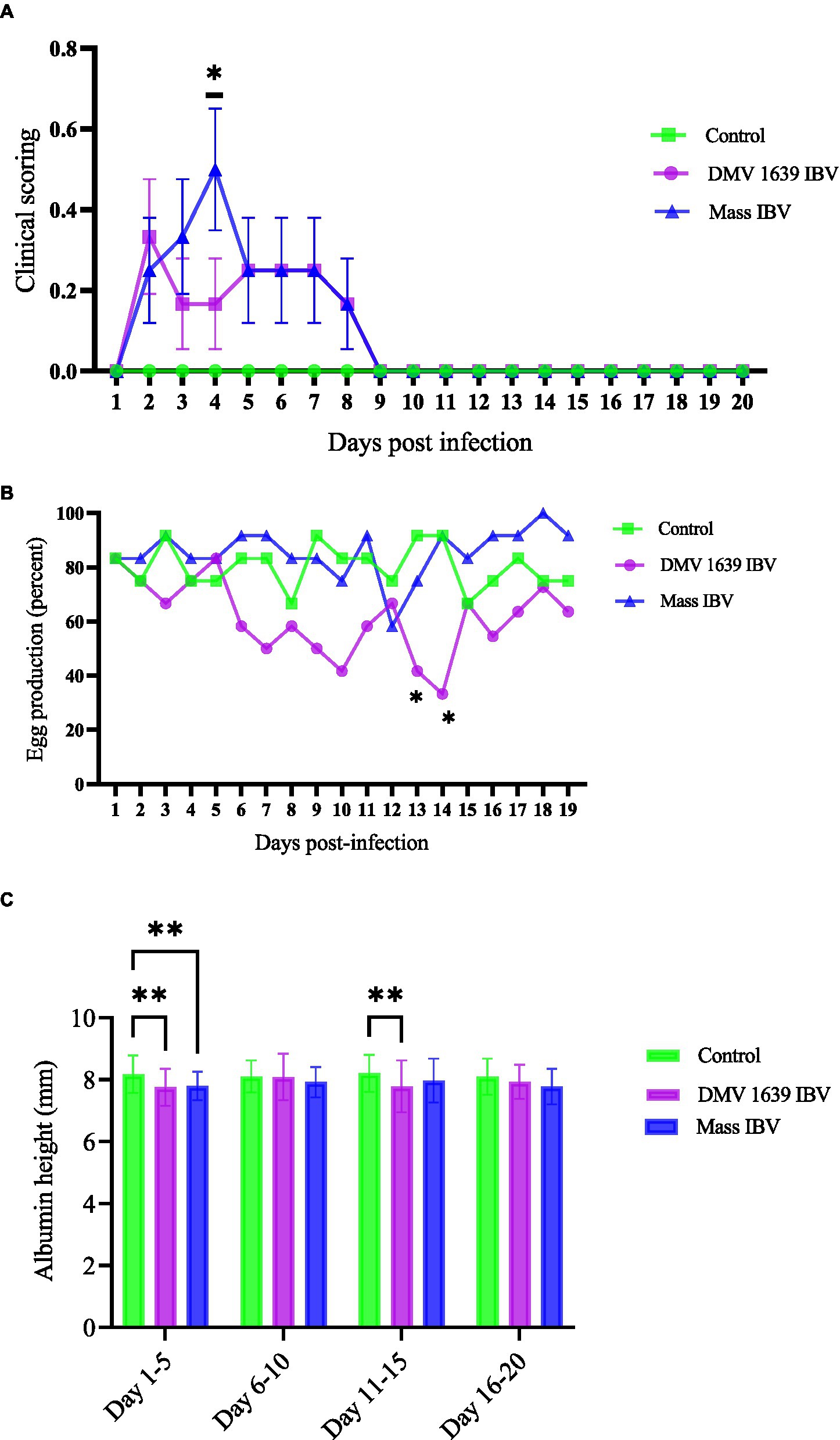 Figura 1. Puntuación clínica, producción de huevos y altura de albúmina gruesa. (A) Puntuaciones clínicas medias ± SEM de gallinas infectadas y control por IBV: El eje x muestra la puntuación clínica en la escala de 0 a 5 de la hoja de puntuación y el eje y muestra los días posteriores a la infección. (B) El porcentaje medio de producción diaria de huevos de gallinas infectadas por el IBV y de control con diferencias analizadas mediante una prueba de chi-cuadrado de 2 × 3. (C) La altura media de albúmina ± SEM se analizó con un ANOVA de dos vías. El eje x muestra la altura de la albúmina en milímetros medida con un calibre vernier digital de 0,01 mm de precisión, y el eje y muestra los días combinados (5 juntos) después de la infección. La significación estadística se evaluó en *p < 0,05, **p < 0,01.
Figura 1. Puntuación clínica, producción de huevos y altura de albúmina gruesa. (A) Puntuaciones clínicas medias ± SEM de gallinas infectadas y control por IBV: El eje x muestra la puntuación clínica en la escala de 0 a 5 de la hoja de puntuación y el eje y muestra los días posteriores a la infección. (B) El porcentaje medio de producción diaria de huevos de gallinas infectadas por el IBV y de control con diferencias analizadas mediante una prueba de chi-cuadrado de 2 × 3. (C) La altura media de albúmina ± SEM se analizó con un ANOVA de dos vías. El eje x muestra la altura de la albúmina en milímetros medida con un calibre vernier digital de 0,01 mm de precisión, y el eje y muestra los días combinados (5 juntos) después de la infección. La significación estadística se evaluó en *p < 0,05, **p < 0,01.
3.2 Producción y medidas de huevos
Durante su pico de producción de huevos (80-100%), las gallinas de los dos grupos se infectaron con el IBV (DMV/1639, Massachusetts), y un grupo se mantuvo como control. La producción de huevos en los grupos de control e infectados masivamente por el IBV no disminuyó, excepto en 12 dpi, el grupo infectado por el IBV masivo produjo aproximadamente el 55% de los huevos. La producción de huevos del grupo infectado por el IBV DMV/1639 disminuyó significativamente (p < 0,05). En el grupo infectado por el DMV/1639 IBV, a los 13 y 14 dpi, hubo una caída del 40 y 30% en la producción de huevos, respectivamente (Figura 1B).
Aunque los parámetros del huevo, como el peso, la longitud, el ancho y la altura de la albúmina gruesa, se midieron hasta los 20 dpi, solo la altura de la albúmina gruesa (que rodea inmediatamente a la yema) fue significativamente diferente entre los grupos. La altura de albúmina gruesa de los grupos infectados por DMV/1639 y Mass IBV fue significativamente menor (p < 0,05) que la del grupo control de 1 a 5 días de huevos agrupados en datos, mientras que de 11 a 15 días solo el grupo infectado por DMV/1639 IBV tenía huevos con albúmina significativamente más delgada (p < 0,05) que la del grupo de control MASS y no infectado (Figura 1C).
3.3 Cargas genómicas del IBV en muestras de hisopos
A los 3, 10, 17 y 21 dpi, no se cuantificó ningún genoma del IBV en las muestras de hisopos OP o CL del grupo control. En el hisopado OP, la carga genómica del IBV fue la más alta a 3 dpi en ambos grupos infectados por IBV. Aunque la excreción del IBV disminuyó gradualmente en 21 ppp, 3 aves del grupo infectado por el IBV del DMV y 2 aves del grupo infectado por el IBV masivo continuaron con la excreción. No hubo diferencias significativas en la carga genómica del IBV OP entre los dos grupos infectados por el IBV (Figuras 2A, p > 0,05). Por el contrario, las cargas genómicas del IBV en los hisopos de CL del grupo infectado por IBV del DMV fueron significativamente mayores (p < 0,05) a los 3, 10, 17 y 21 dpi que las observadas en el grupo infectado por IBV masivo (Figura 2B). La diseminación viral de la ruta CL del grupo DMV/1639 IBV aumentó continuamente desde 3 dpi hasta el final del experimento (21 dpi), mientras que en el grupo infectado por IBV masivo, solo 2-3 gallinas comenzaron la excreción viral de CL a los 10 dpi, alcanzó un máximo de 17 dpi y luego disminuyó en 21 dpi (Figura 2).
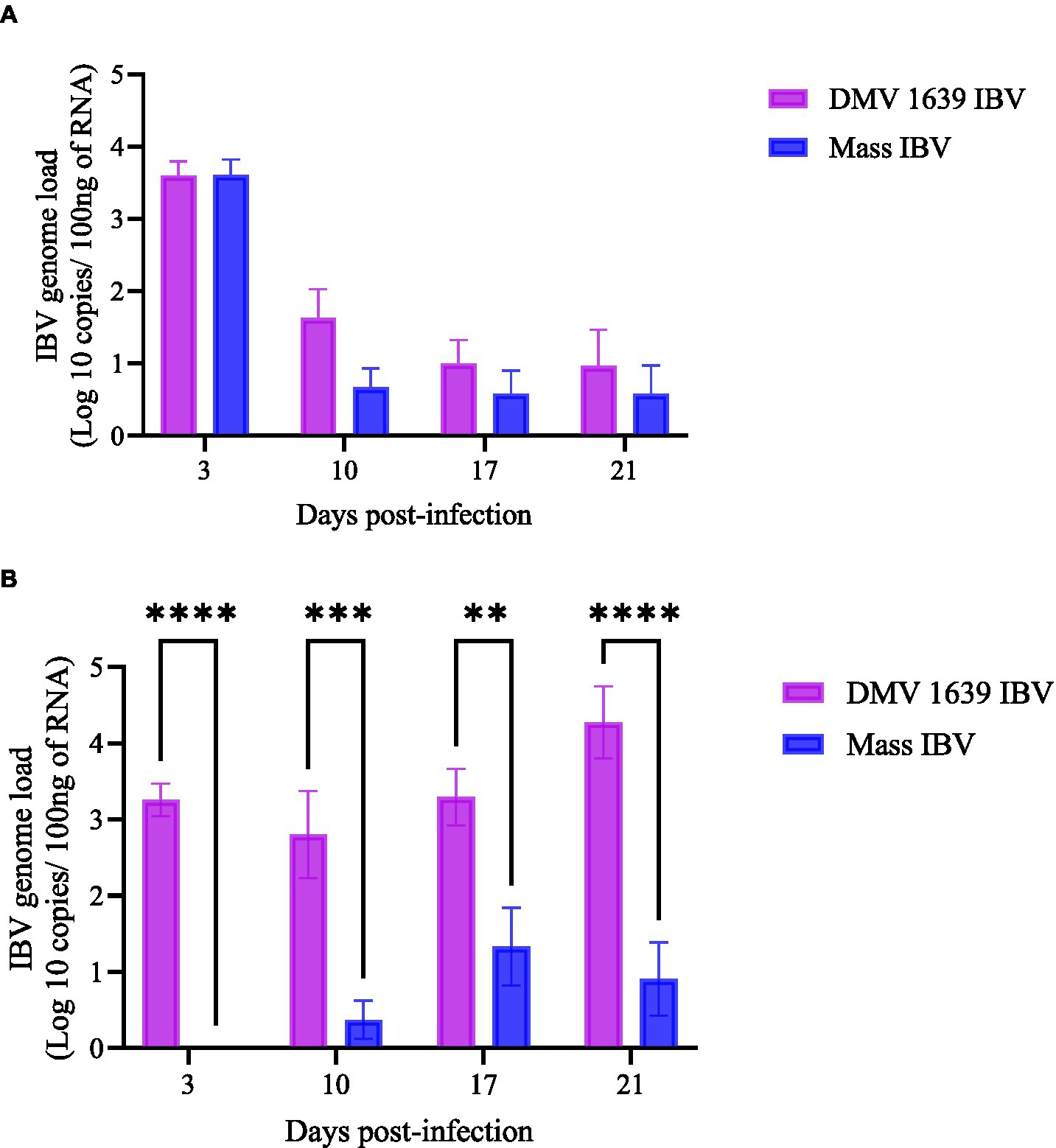 Figura 2. El genoma del IBV se carga en muestras de hisopos recogidas a 3, 10, 17 y 21 ppp. (A) La carga media del genoma del IBV de gallinas infectadas por el DMV/1639 por el IBV e infectadas masivamente por el IBV en hisopos OP. (B) La carga media del genoma del IBV de gallinas infectadas por DMV/1639 e infectadas por IBV masivo en hisopos CL. Las copias del IBV se midieron por cada 100 ng del ARN extraído. Las barras de error muestran ± SEM analizado con un ANOVA de dos vías, seguido de la prueba de comparación múltiple de Sidak, y se consideró significación estadística en **p < 0.01, ***p < 0.001 y ****p < 0.0001.
Figura 2. El genoma del IBV se carga en muestras de hisopos recogidas a 3, 10, 17 y 21 ppp. (A) La carga media del genoma del IBV de gallinas infectadas por el DMV/1639 por el IBV e infectadas masivamente por el IBV en hisopos OP. (B) La carga media del genoma del IBV de gallinas infectadas por DMV/1639 e infectadas por IBV masivo en hisopos CL. Las copias del IBV se midieron por cada 100 ng del ARN extraído. Las barras de error muestran ± SEM analizado con un ANOVA de dos vías, seguido de la prueba de comparación múltiple de Sidak, y se consideró significación estadística en **p < 0.01, ***p < 0.001 y ****p < 0.0001.
3.4 Títulos de anticuerpos anti-IBV
Las concentraciones de anticuerpos anti-IBV en los lavados séricos y del tracto reproductivo se presentan en la Figura 3. A los 10 y 21 dpi, no se pudo cuantificar ningún título de anticuerpos anti-IBV en los lavados séricos y del tracto reproductivo del grupo control. A los 10 y 21 dpi, el título de anticuerpos anti-IBV en los lavados de suero y oviducto de ambos grupos infectados por IBV fue significativamente mayor (p < 0,05) que en el grupo control. A los 10 y 21 dpi, no se observaron diferencias estadísticas (p > 0,05) entre los títulos de anticuerpos anti-IBV de lavado sérico y de oviducto de los grupos infectados por el IBV DMV/1639 e infectados por el IBV masivo.
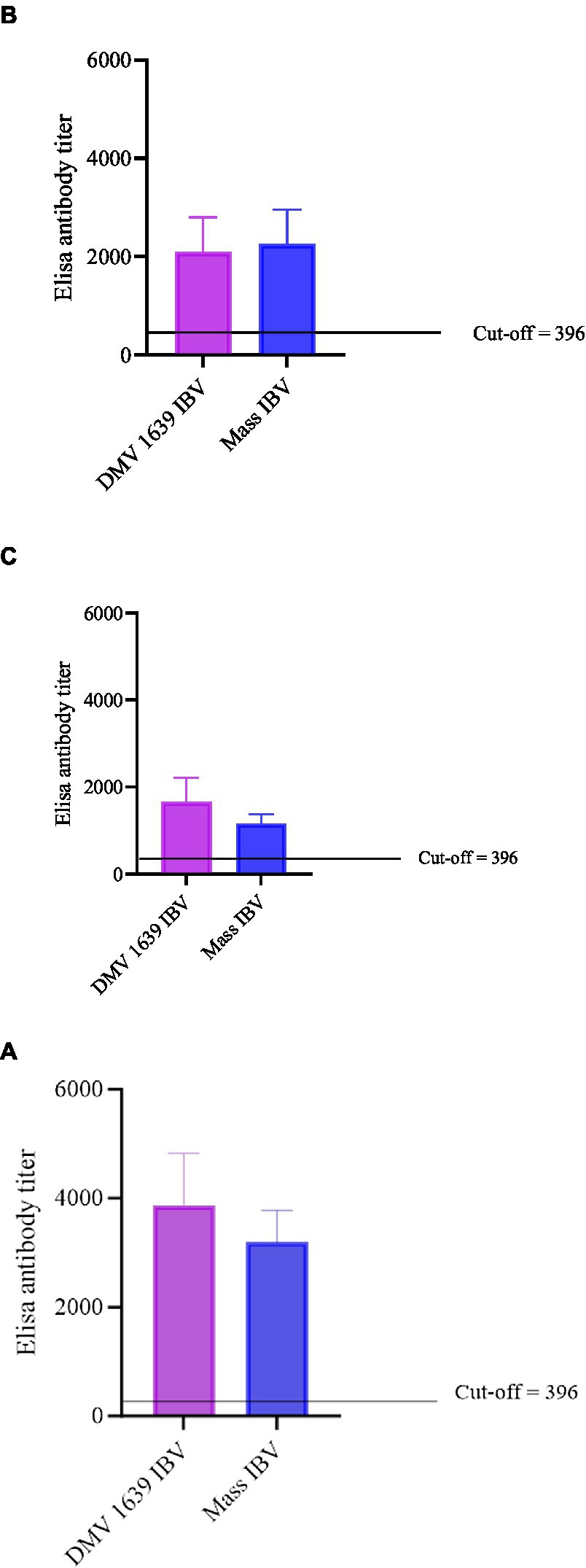 Figura 3. Títulos de anticuerpos anti-IBV en lavados de suero y oviducto de gallinas infectadas por IBV y de control. (A) Títulos de anticuerpos anti-IBV en suero a 10 dpi. (B) Títulos de anticuerpos anti-IBV en suero a 21 dpi. (C) Títulos de ELISA de anticuerpos anti-IBV en lavados de oviductos recolectados a 21 dpi. Los títulos medios de todos los grupos se analizaron con ANOVA de un factor seguido de la prueba de comparación múltiple de Tukey. Las barras de error representan ±SEM, y la significación estadística se considera en *p < 0,05, **p < 0,01 y ***p < 0,001.
Figura 3. Títulos de anticuerpos anti-IBV en lavados de suero y oviducto de gallinas infectadas por IBV y de control. (A) Títulos de anticuerpos anti-IBV en suero a 10 dpi. (B) Títulos de anticuerpos anti-IBV en suero a 21 dpi. (C) Títulos de ELISA de anticuerpos anti-IBV en lavados de oviductos recolectados a 21 dpi. Los títulos medios de todos los grupos se analizaron con ANOVA de un factor seguido de la prueba de comparación múltiple de Tukey. Las barras de error representan ±SEM, y la significación estadística se considera en *p < 0,05, **p < 0,01 y ***p < 0,001.
3.5 Replicación del IBV en los tejidos
La carga del genoma del IBV en varios tejidos se midió mediante RT-qPCR (Figura 4). A los 21 dpi, el grupo de control no mostró un genoma cuantificable del IBV en ningún tejido. Por el contrario, el grupo infectado por el IBV del DMV mostró una carga genómica significativamente mayor en varios tejidos, incluidos el pulmón, el riñón, el bazo, la TC, el magnum, el istmo y la glándula de la concha, en comparación con el grupo infectado por el IBV masivo (p < 0,05). La carga genómica más alta detectada fue en la TC del grupo infectado por el IBV del DMV. Las cargas genómicas del IBV en la tráquea y el ovario no fueron significativamente diferentes (p > 0,05).
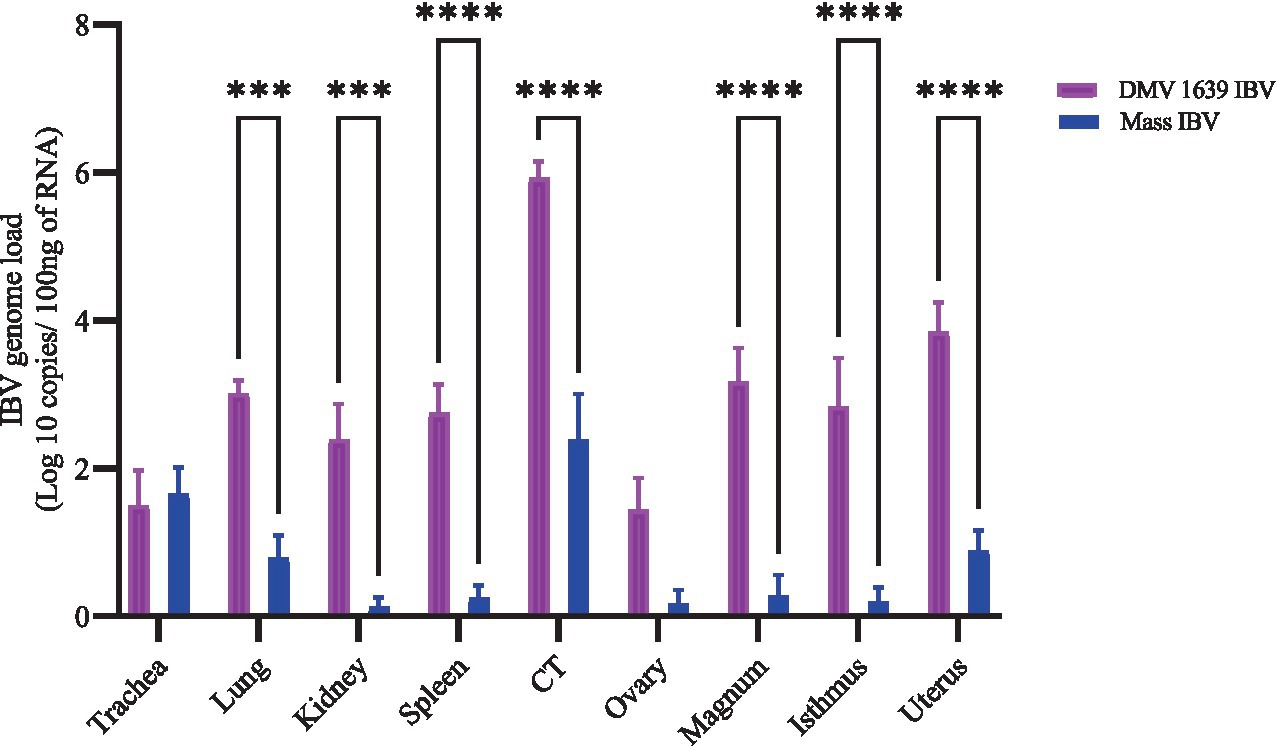 Figura 4. Cargas genómicas del IBV en tejidos recolectados a 21 dpi después de la infección por DMV/1639 IBV y Mass IBV. Las barras de error representan ± SEM analizado. Las copias del genoma del IBV se cuantificaron por 100 ng del ARN extraído. Las cargas genómicas del IBV entre los tejidos se compararon mediante un ANOVA de dos vías, seguido de la prueba de comparación múltiple de Sidak, y se consideró la significación estadística en ***p < 0,001 y ****p < 0,0001.
Figura 4. Cargas genómicas del IBV en tejidos recolectados a 21 dpi después de la infección por DMV/1639 IBV y Mass IBV. Las barras de error representan ± SEM analizado. Las copias del genoma del IBV se cuantificaron por 100 ng del ARN extraído. Las cargas genómicas del IBV entre los tejidos se compararon mediante un ANOVA de dos vías, seguido de la prueba de comparación múltiple de Sidak, y se consideró la significación estadística en ***p < 0,001 y ****p < 0,0001.
3.6 Inmunohistoquímica
La expresión de antígenos del IBV en diferentes tejidos se presenta en las Figuras 5 y 6. A los 21 dpi, no se observó antígeno viral del IBV en el grupo control ni en las tráqueas, bazos y ovarios de ambos grupos infectados. Al mismo tiempo, se observó el antígeno viral en los pulmones, los riñones, la TC y los oviductos del grupo infectado por el DMV/1639 IBV. Las células infectadas exhibieron una reacción inmunopositiva intracitoplasmática y finamente granular gruesa. Por el contrario, el antígeno del IBV solo se detectó en la TC y el riñón de tres aves del grupo infectado por el IBV masivo (Figura 7).
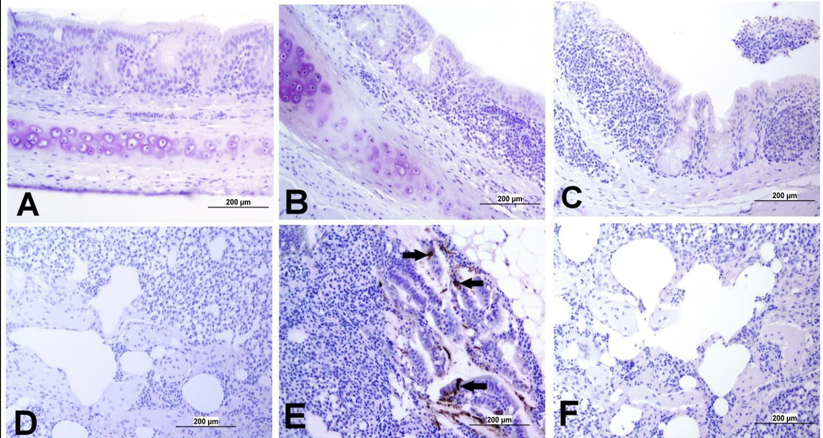
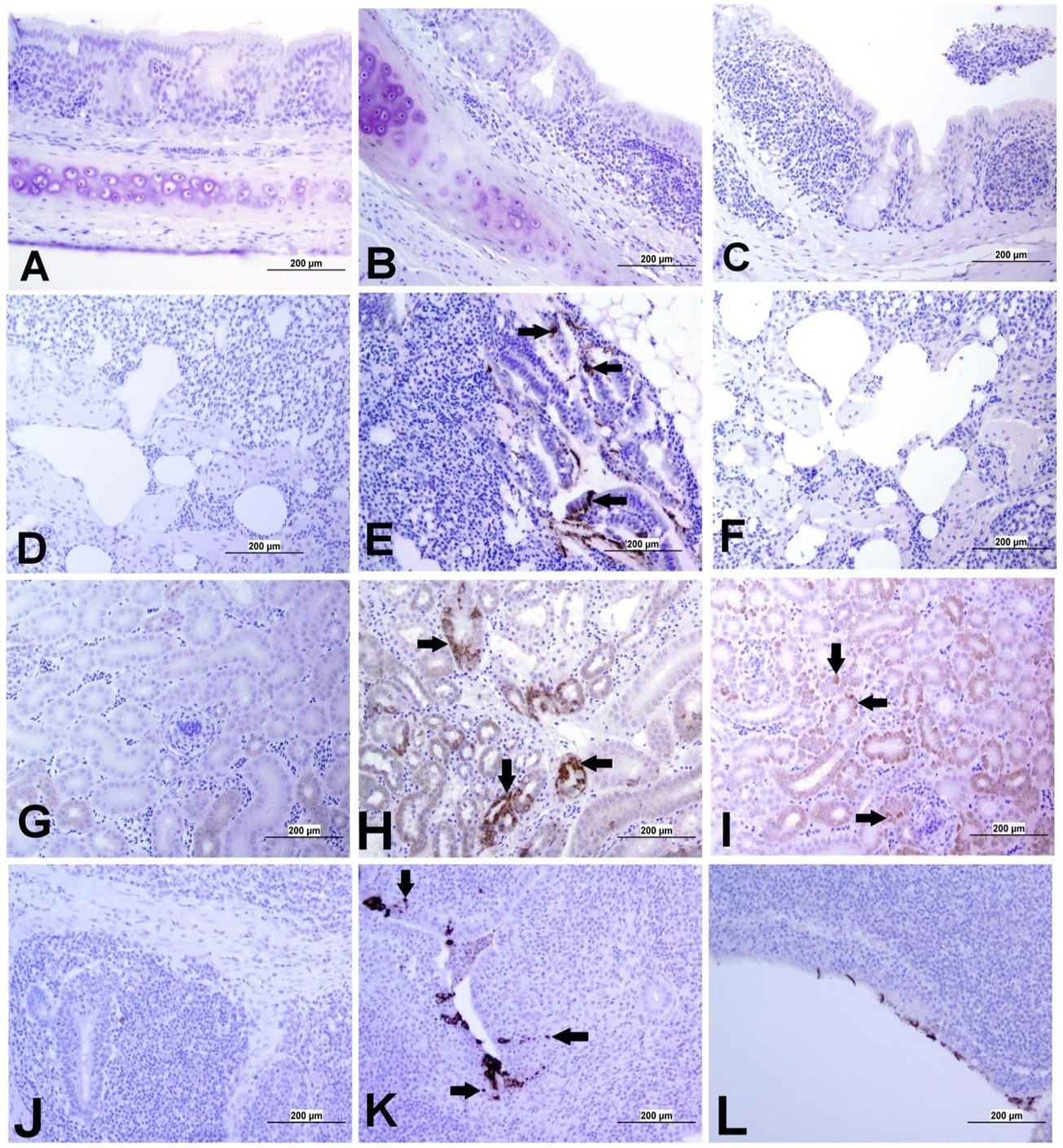 Figura 5. Imágenes representativas captadas tras el análisis inmunohistoquímico de antígenos del IBV en diferentes tejidos a 21 dpi. (A) Tráquea del grupo control, (B) Tráquea del grupo infectado por el DMV/1639 IBV y (C) Tráquea del grupo infectado por el IBV masivo, sin mostrar reacción inmunopositiva. (D) Pulmón del grupo control; (E) Pulmón del grupo infectado por el DMV/1639 IBV que muestra tinción inmunopositiva en el revestimiento del epitelio de los bronquios (flecha). (F) Pulmón del grupo infectado por el IBV masivo que no muestra reacción inmunopositiva. (G) Riñón del grupo control; (H) Riñón del grupo infectado por DMV/1639 IBV que muestra una fuerte reacción inmunopositiva en los túbulos renales (flecha). (I) Riñón del grupo infectado por IBV que muestra una reacción inmunopositiva débil en los túbulos renales (flecha). (J) TC del grupo de control; (K) TC del grupo infectado por DMV/1639 IBV que muestra una fuerte reacción inmunopositiva en las células inflamatorias del linfoepitelio y subepitelio (flecha); (L) TC del grupo infectado por IBV masivo con reacción inmunopositiva en el epitelio.
Figura 5. Imágenes representativas captadas tras el análisis inmunohistoquímico de antígenos del IBV en diferentes tejidos a 21 dpi. (A) Tráquea del grupo control, (B) Tráquea del grupo infectado por el DMV/1639 IBV y (C) Tráquea del grupo infectado por el IBV masivo, sin mostrar reacción inmunopositiva. (D) Pulmón del grupo control; (E) Pulmón del grupo infectado por el DMV/1639 IBV que muestra tinción inmunopositiva en el revestimiento del epitelio de los bronquios (flecha). (F) Pulmón del grupo infectado por el IBV masivo que no muestra reacción inmunopositiva. (G) Riñón del grupo control; (H) Riñón del grupo infectado por DMV/1639 IBV que muestra una fuerte reacción inmunopositiva en los túbulos renales (flecha). (I) Riñón del grupo infectado por IBV que muestra una reacción inmunopositiva débil en los túbulos renales (flecha). (J) TC del grupo de control; (K) TC del grupo infectado por DMV/1639 IBV que muestra una fuerte reacción inmunopositiva en las células inflamatorias del linfoepitelio y subepitelio (flecha); (L) TC del grupo infectado por IBV masivo con reacción inmunopositiva en el epitelio.
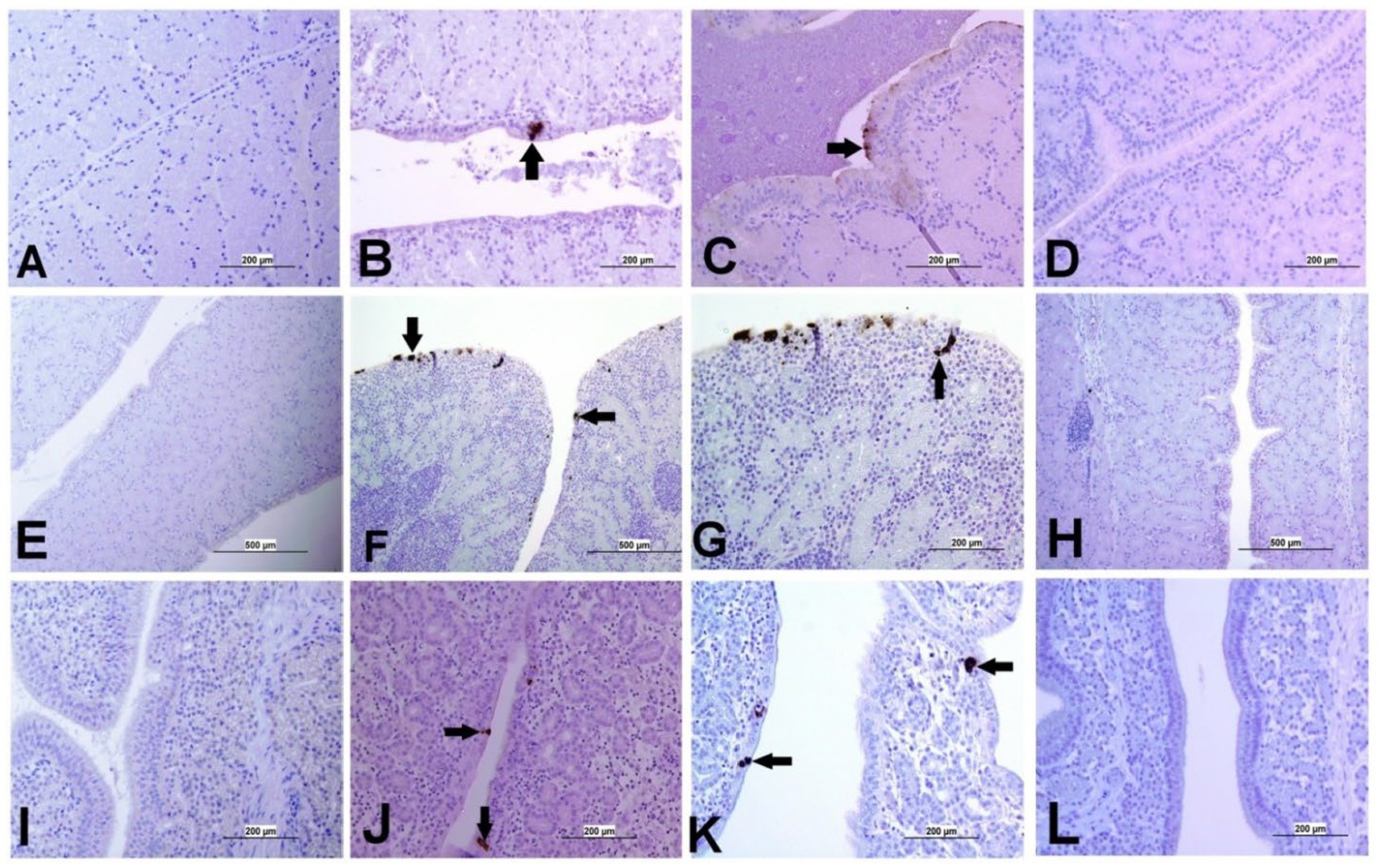 Figura 6. Imágenes representativas captadas tras el análisis inmunohistoquímico de antígenos del IBV en diferentes partes del oviducto a 21 dpi. (A) Magnum del grupo de control que no muestra tinción inmunopositiva; (B,C) Magnum del grupo infectado por DMV/1639 IBV que muestra tinción positiva del antígeno viral en el revestimiento epitelial (flecha). (D) Magnum del grupo infectado por IBV masivo que no muestra ninguna reacción inmunopositiva, (E) Istmo del grupo de control que no muestra tinción inmunopositiva; (F,G) Istmo del grupo infectado por DMV/1639 IBV que muestra una fuerte reacción inmunopositiva en el epitelio y el tejido subepitelio (flecha). (H) Grupo infectado por el IBV del istmo de la masa sin reacción inmunopositiva. (I) Glándula de la concha del grupo control que no muestra reacción inmunopositiva. (J,K) Glándula de la concha del grupo infectado por el DMV/1639 IBV; (L) Glándula de la cáscara del grupo infectado por Mass IBV sin reacción inmunopositiva.
Figura 6. Imágenes representativas captadas tras el análisis inmunohistoquímico de antígenos del IBV en diferentes partes del oviducto a 21 dpi. (A) Magnum del grupo de control que no muestra tinción inmunopositiva; (B,C) Magnum del grupo infectado por DMV/1639 IBV que muestra tinción positiva del antígeno viral en el revestimiento epitelial (flecha). (D) Magnum del grupo infectado por IBV masivo que no muestra ninguna reacción inmunopositiva, (E) Istmo del grupo de control que no muestra tinción inmunopositiva; (F,G) Istmo del grupo infectado por DMV/1639 IBV que muestra una fuerte reacción inmunopositiva en el epitelio y el tejido subepitelio (flecha). (H) Grupo infectado por el IBV del istmo de la masa sin reacción inmunopositiva. (I) Glándula de la concha del grupo control que no muestra reacción inmunopositiva. (J,K) Glándula de la concha del grupo infectado por el DMV/1639 IBV; (L) Glándula de la cáscara del grupo infectado por Mass IBV sin reacción inmunopositiva.
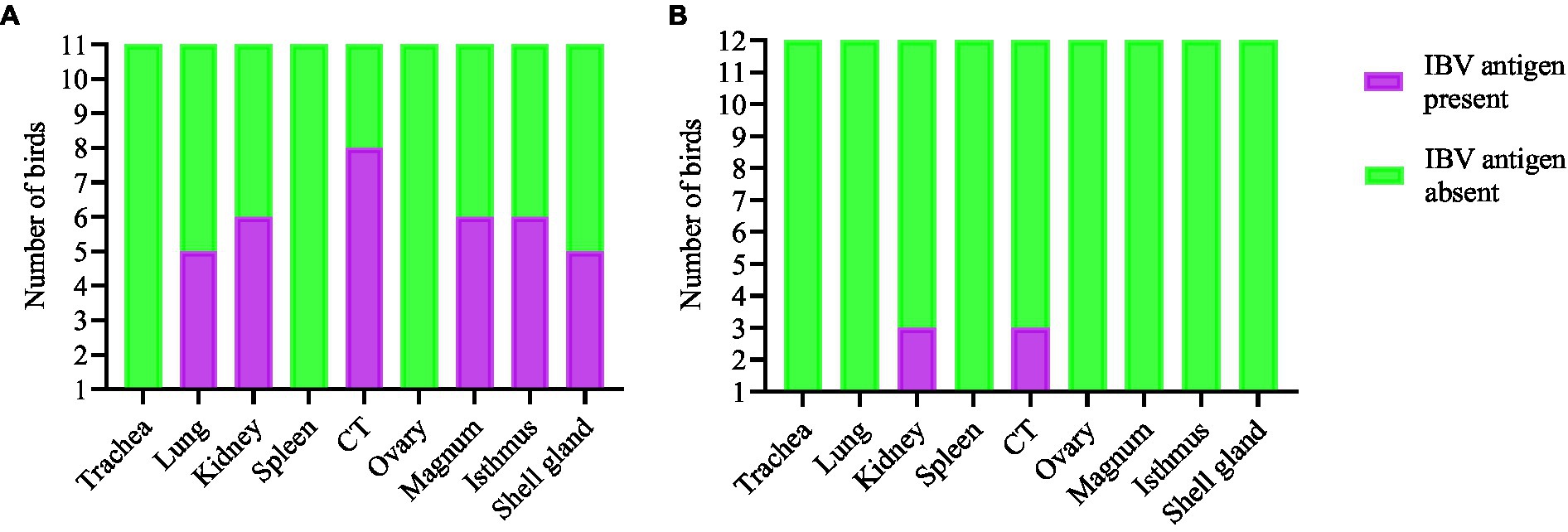 Figura 7. Expresión del antígeno del IBV en diferentes tejidos a través de IHQ muestreadas a 21 dpi. (A) Tejidos de aves infectadas con el DMV/1639 IBV y (B) Tejidos de aves infectadas con el IBV masivo.
Figura 7. Expresión del antígeno del IBV en diferentes tejidos a través de IHQ muestreadas a 21 dpi. (A) Tejidos de aves infectadas con el DMV/1639 IBV y (B) Tejidos de aves infectadas con el IBV masivo.
3.7 Patología macroscópica y calidad del óvulo
A los 21 dpi, no se observaron lesiones macroscópicas en los tejidos de ninguna de las aves del grupo control no infectado. Se observó marcada patología macroscópica en el oviducto de 5 de las 12 aves del grupo infectado por DMV/1639. Principalmente, las lesiones en el ovario se observaron con peritonitis distorsionada de óvulos maduros y huevos, mientras que solo se observaron 2 aves con ovario y oviducto congestionados en el grupo infectado en masa (Figura suplementaria S1). No se observó patología macroscópica prominente en los otros órganos y tejidos de ambos grupos infectados. Tanto el grupo de control como el infectado en masa produjeron huevos con cualidades internas y externas normales hasta el final del experimento. En contraste, 1 a 2 aves en el grupo infectado con DMV/1639 estaban produciendo huevos deformes con cáscara blanda, cáscara delgada y yemas carnosas y sanguinolentas desde 8 dpi hasta que finalizó el experimento (Figura Suplementaria S1).
3.8 Histopatología
A los 21 dpi, no se observaron lesiones histopatológicas en la tráquea, pulmón, riñón, bazo, TC, ovario y oviducto del grupo control. No se observaron cambios histopatológicos evidentes en el bazo de ambos grupos infectados por el IBV. La lesión observada en diferentes órganos se presenta en las Figuras 8 a 12, proporcionando datos cuantitativos en la Figura 13. El grupo infectado por el IBV DMV/1639 presentó las lesiones más graves en múltiples órganos, mientras que las lesiones observadas en el grupo infectado por el IBV masivo fueron comparativamente menos graves.
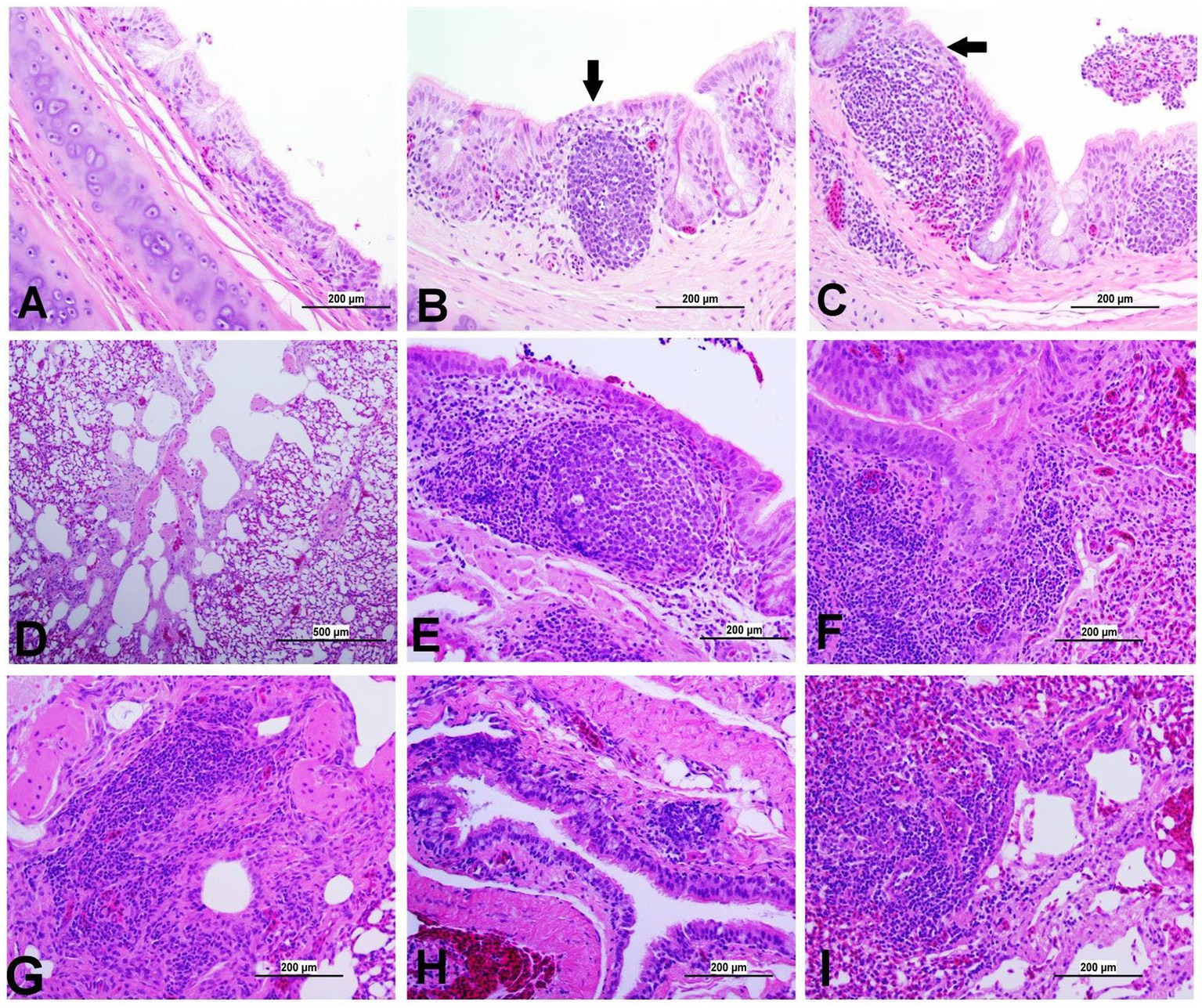 Figura 8. Fotomicrografías representativas de la tráquea y los pulmones de los grupos infectados por el IBV y de los grupos control. (A) Tráquea del grupo de control; (B) Tráquea de DMV1639 grupo infectado por IBV que muestra un área focal de degeneración epitelial y necrosis (flecha), reclutamiento leve de células mononucleares de la mucosa y agregación del folículo linfoide. (C) Tráquea del grupo infectado por IBV que muestra agregación severa de células inflamatorias mononucleares y glóbulos rojos en mucosa y submucosa, área focal de necrosis epitelial respiratoria (flecha) y acumulación de moco, desechos celulares, células inflamatorias y glóbulos rojos en el lumen. (D) Pulmón del grupo control; (E,F) Pulmón de DMV1639 grupo infectado por el IBV que muestra bronquitis grave. (G) Pulmón de DMV1639 grupo infectado por el IBV que muestra una parabronquitis grave. (H) Pulmón del grupo infectado por IBV que muestra bronquitis leve. (I) Pulmón del grupo infectado por el IBV que muestra para bronquitis moderada.
Figura 8. Fotomicrografías representativas de la tráquea y los pulmones de los grupos infectados por el IBV y de los grupos control. (A) Tráquea del grupo de control; (B) Tráquea de DMV1639 grupo infectado por IBV que muestra un área focal de degeneración epitelial y necrosis (flecha), reclutamiento leve de células mononucleares de la mucosa y agregación del folículo linfoide. (C) Tráquea del grupo infectado por IBV que muestra agregación severa de células inflamatorias mononucleares y glóbulos rojos en mucosa y submucosa, área focal de necrosis epitelial respiratoria (flecha) y acumulación de moco, desechos celulares, células inflamatorias y glóbulos rojos en el lumen. (D) Pulmón del grupo control; (E,F) Pulmón de DMV1639 grupo infectado por el IBV que muestra bronquitis grave. (G) Pulmón de DMV1639 grupo infectado por el IBV que muestra una parabronquitis grave. (H) Pulmón del grupo infectado por IBV que muestra bronquitis leve. (I) Pulmón del grupo infectado por el IBV que muestra para bronquitis moderada.
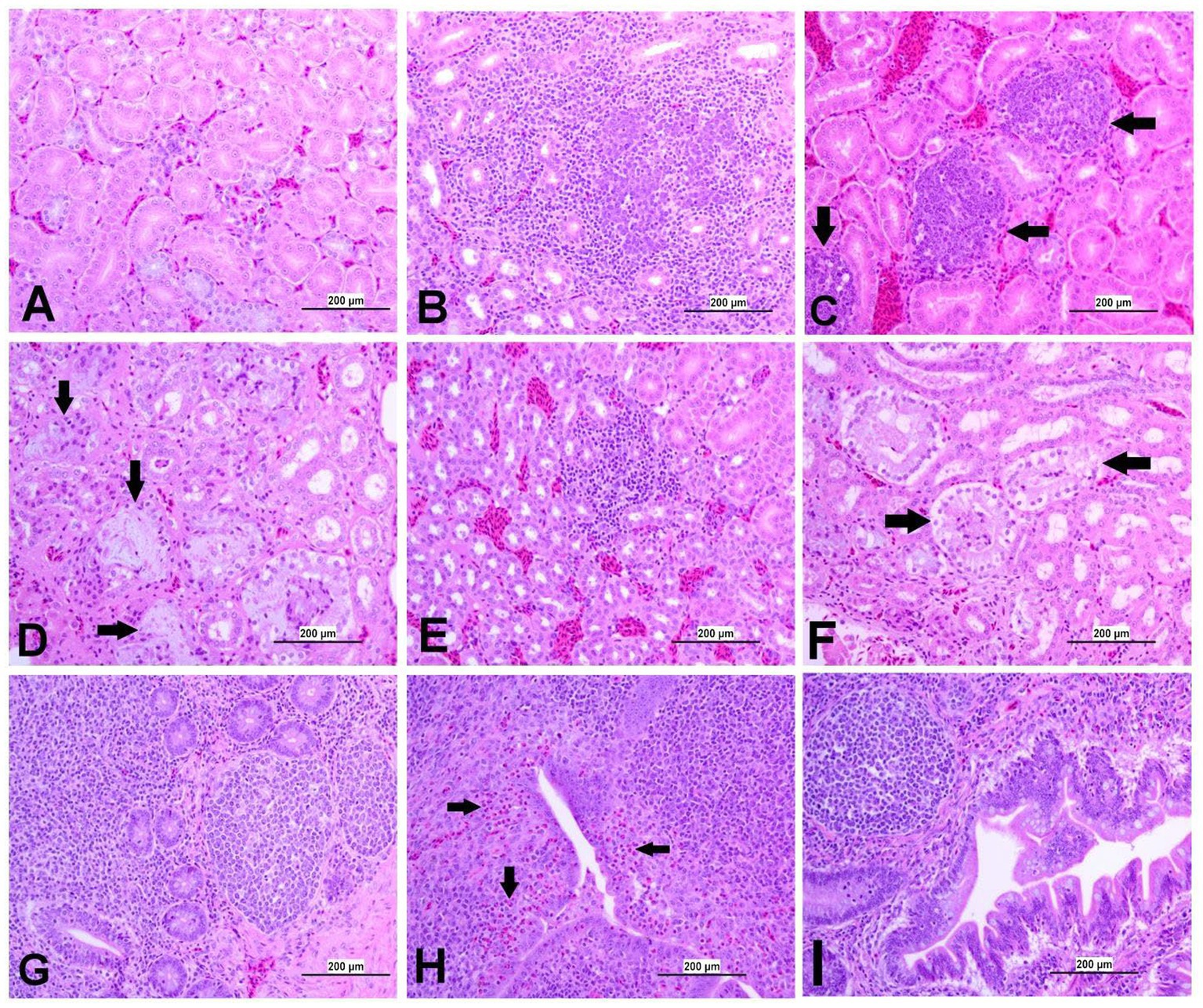 Figura 9. Fotomicrografías representativas de riñón y TC de grupos infectados y controles. (A) Riñón del grupo control. (B) Riñón de DMV1639 grupo infectado por el IBV que muestra nefritis linfoplasmocítica. (C) Riñón de DMV1639 grupo infectado por el IBV que muestra agregación de múltiples folículos linfoides intersticiales (flecha). (D) Riñón de DMV1639 grupo infectado por IBV que muestra una marcada degeneración y necrosis de los túbulos renales del revestimiento epitelial, algunos de ellos contienen restos celulares, expansión del tejido intersticial con un tenue material de uratos basófilos rodeado de macrófagos que reemplazan a los túbulos renales normales (flecha). y fibrosis intersticial. (E) Riñón de masa Grupo infectado por IBV que muestra nefritis intersticial leve. (F) Riñón de masa Grupo infectado por IBV que muestra necrosis tubular renal moderada con acumulación intraluminal de gotitas proteicas y restos celulares (flecha). (G) TC del grupo control. (H) TC de DMV1639 grupo infectado por IBV que muestra degeneración y necrosis unicelular del linfoepitelio, marcada infiltración heterofílica subepitelial (flecha) con acumulación intraluminal de restos celulares, exudado y células inflamatorias; (I) TC del grupo infectado por Mass IBV que muestra marcado plegamiento e hiperplasia de células linfoepitelias y mucosas con degeneración y necrosis de algunas de ellas, linfocitos subepiteliales, macrófagos y agregación de pocos heterófilos.
Figura 9. Fotomicrografías representativas de riñón y TC de grupos infectados y controles. (A) Riñón del grupo control. (B) Riñón de DMV1639 grupo infectado por el IBV que muestra nefritis linfoplasmocítica. (C) Riñón de DMV1639 grupo infectado por el IBV que muestra agregación de múltiples folículos linfoides intersticiales (flecha). (D) Riñón de DMV1639 grupo infectado por IBV que muestra una marcada degeneración y necrosis de los túbulos renales del revestimiento epitelial, algunos de ellos contienen restos celulares, expansión del tejido intersticial con un tenue material de uratos basófilos rodeado de macrófagos que reemplazan a los túbulos renales normales (flecha). y fibrosis intersticial. (E) Riñón de masa Grupo infectado por IBV que muestra nefritis intersticial leve. (F) Riñón de masa Grupo infectado por IBV que muestra necrosis tubular renal moderada con acumulación intraluminal de gotitas proteicas y restos celulares (flecha). (G) TC del grupo control. (H) TC de DMV1639 grupo infectado por IBV que muestra degeneración y necrosis unicelular del linfoepitelio, marcada infiltración heterofílica subepitelial (flecha) con acumulación intraluminal de restos celulares, exudado y células inflamatorias; (I) TC del grupo infectado por Mass IBV que muestra marcado plegamiento e hiperplasia de células linfoepitelias y mucosas con degeneración y necrosis de algunas de ellas, linfocitos subepiteliales, macrófagos y agregación de pocos heterófilos.
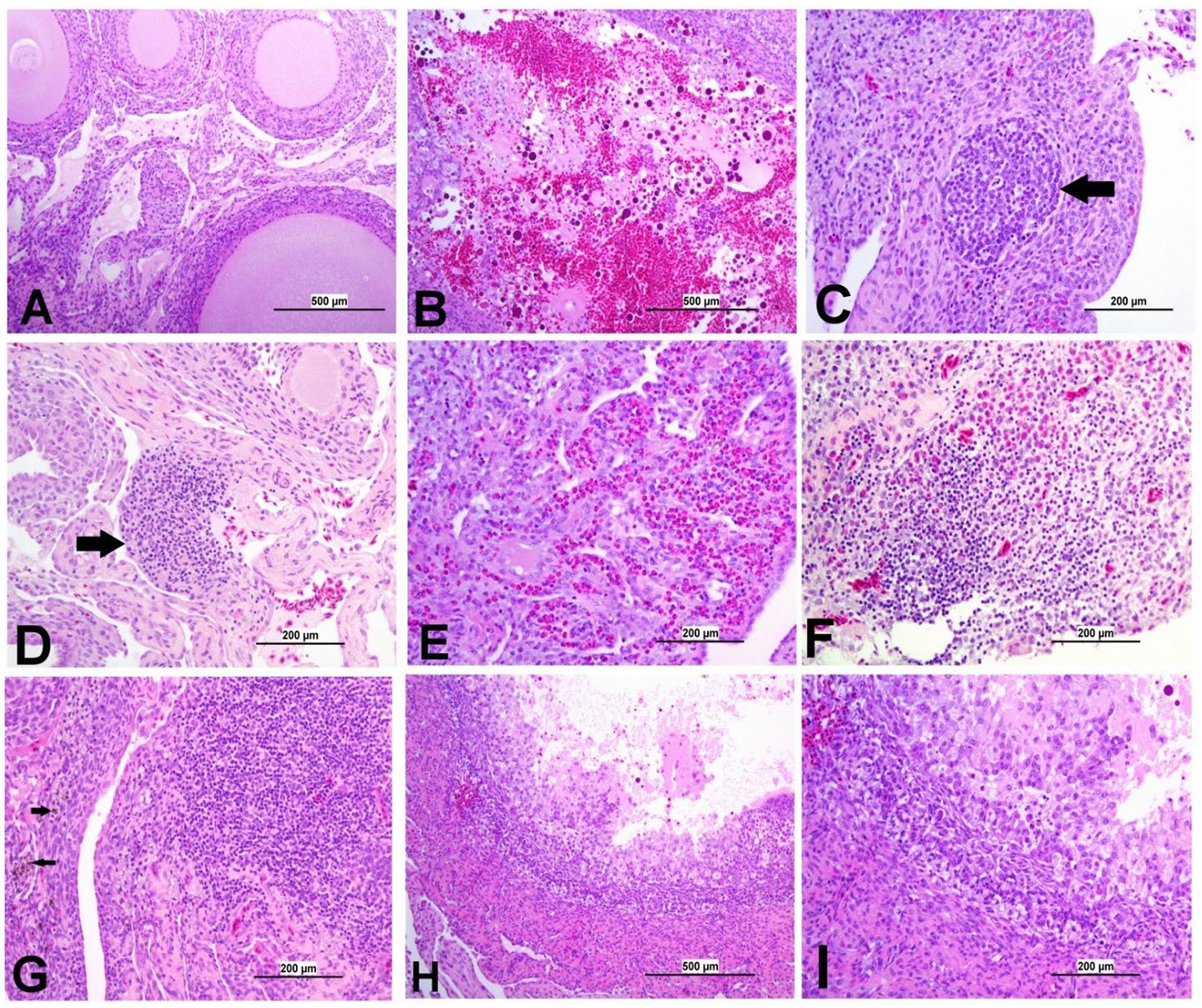 Figura 10. Fotomicrografías representativas de ovario de grupos infectados por IBV y control. (A) Ovario del grupo control que muestra hallazgos histológicos normales. (B) DMV1639 grupo infectado por el IBV que muestra una gran área de hemorragia ovárica. (C) DMV1639 grupo infectado por el IBV que muestra agregación del folículo linfoide (flecha). (D) DMV1639 grupo infectado por IBV que muestra el área focal de agregación de células mononucleares (flecha). (E) DMV1639 grupo infectado por IBV que muestra infiltración heterofílica difusa con poco número de agregación de células mononucleares. (F) Grupo infectado masivamente por IBV que muestra infiltración difusa de células mononucleares con agregación heterofílica. (G) Grupo de infección masiva por IBV que muestra una gran área focal de agregación linfocítica con una acumulación de macrófagos cargados de hemosiderina (flecha). (H) Grupo infectado masivamente por IBV que muestra atresia folicular obliterante. (I) Un aumento mayor de la imagen anterior (H) muestra una membrana perivitelina indistinta, invasión de las células de la granulosa y teca interna que llenan el folículo y destruyen el ovocito con agregación de células inflamatorias en la pared folicular.
Figura 10. Fotomicrografías representativas de ovario de grupos infectados por IBV y control. (A) Ovario del grupo control que muestra hallazgos histológicos normales. (B) DMV1639 grupo infectado por el IBV que muestra una gran área de hemorragia ovárica. (C) DMV1639 grupo infectado por el IBV que muestra agregación del folículo linfoide (flecha). (D) DMV1639 grupo infectado por IBV que muestra el área focal de agregación de células mononucleares (flecha). (E) DMV1639 grupo infectado por IBV que muestra infiltración heterofílica difusa con poco número de agregación de células mononucleares. (F) Grupo infectado masivamente por IBV que muestra infiltración difusa de células mononucleares con agregación heterofílica. (G) Grupo de infección masiva por IBV que muestra una gran área focal de agregación linfocítica con una acumulación de macrófagos cargados de hemosiderina (flecha). (H) Grupo infectado masivamente por IBV que muestra atresia folicular obliterante. (I) Un aumento mayor de la imagen anterior (H) muestra una membrana perivitelina indistinta, invasión de las células de la granulosa y teca interna que llenan el folículo y destruyen el ovocito con agregación de células inflamatorias en la pared folicular.
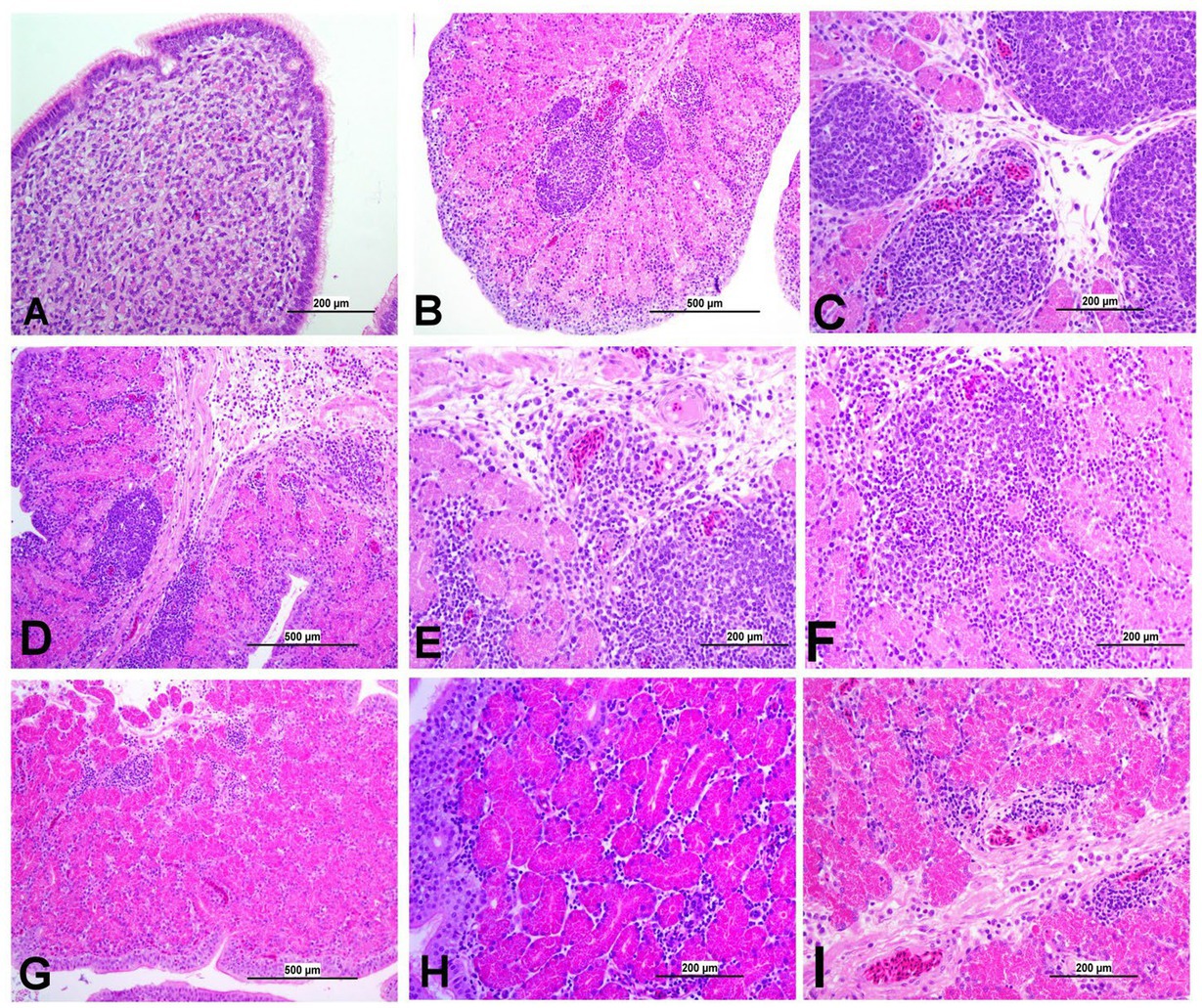 Figura 11. Fotomicrografías representativas del istmo de los grupos infectados por IBV y control. (A) Istmo del grupo de control; (B) DMV1639 grupo infectado por el IBV que muestra salpingitis grave. (C) DMV1639 grupo infectado por el IBV que muestra un marcado edema perivascular con agregación linfoplasmocítica y múltiples agregaciones linfoides. (D) DMV1639 grupo infectado por el IBV que muestra una marcada infiltración de células inflamatorias mononucleares musculares y mucosas. (E,F) DMV1639 grupo infectado por el IBV que mostraba necrosis glandular que fue reemplazada por un gran número de células linfoplasmocíticas. (G) Grupo infectado masivamente por el IBV que muestra salpingitis moderada. (H) Grupo infectado por IBV masivo que muestra hiperplasia del epitelio mucoso, necrosis glandular y agregación de células mononucleares. (I) Grupo infectado por IBV masivo que muestra congestión mucosa, agregación de células mononucleares perivasculares leves, necrosis glandular leve y agregación de células mononucleares de la mucosa.
Figura 11. Fotomicrografías representativas del istmo de los grupos infectados por IBV y control. (A) Istmo del grupo de control; (B) DMV1639 grupo infectado por el IBV que muestra salpingitis grave. (C) DMV1639 grupo infectado por el IBV que muestra un marcado edema perivascular con agregación linfoplasmocítica y múltiples agregaciones linfoides. (D) DMV1639 grupo infectado por el IBV que muestra una marcada infiltración de células inflamatorias mononucleares musculares y mucosas. (E,F) DMV1639 grupo infectado por el IBV que mostraba necrosis glandular que fue reemplazada por un gran número de células linfoplasmocíticas. (G) Grupo infectado masivamente por el IBV que muestra salpingitis moderada. (H) Grupo infectado por IBV masivo que muestra hiperplasia del epitelio mucoso, necrosis glandular y agregación de células mononucleares. (I) Grupo infectado por IBV masivo que muestra congestión mucosa, agregación de células mononucleares perivasculares leves, necrosis glandular leve y agregación de células mononucleares de la mucosa.
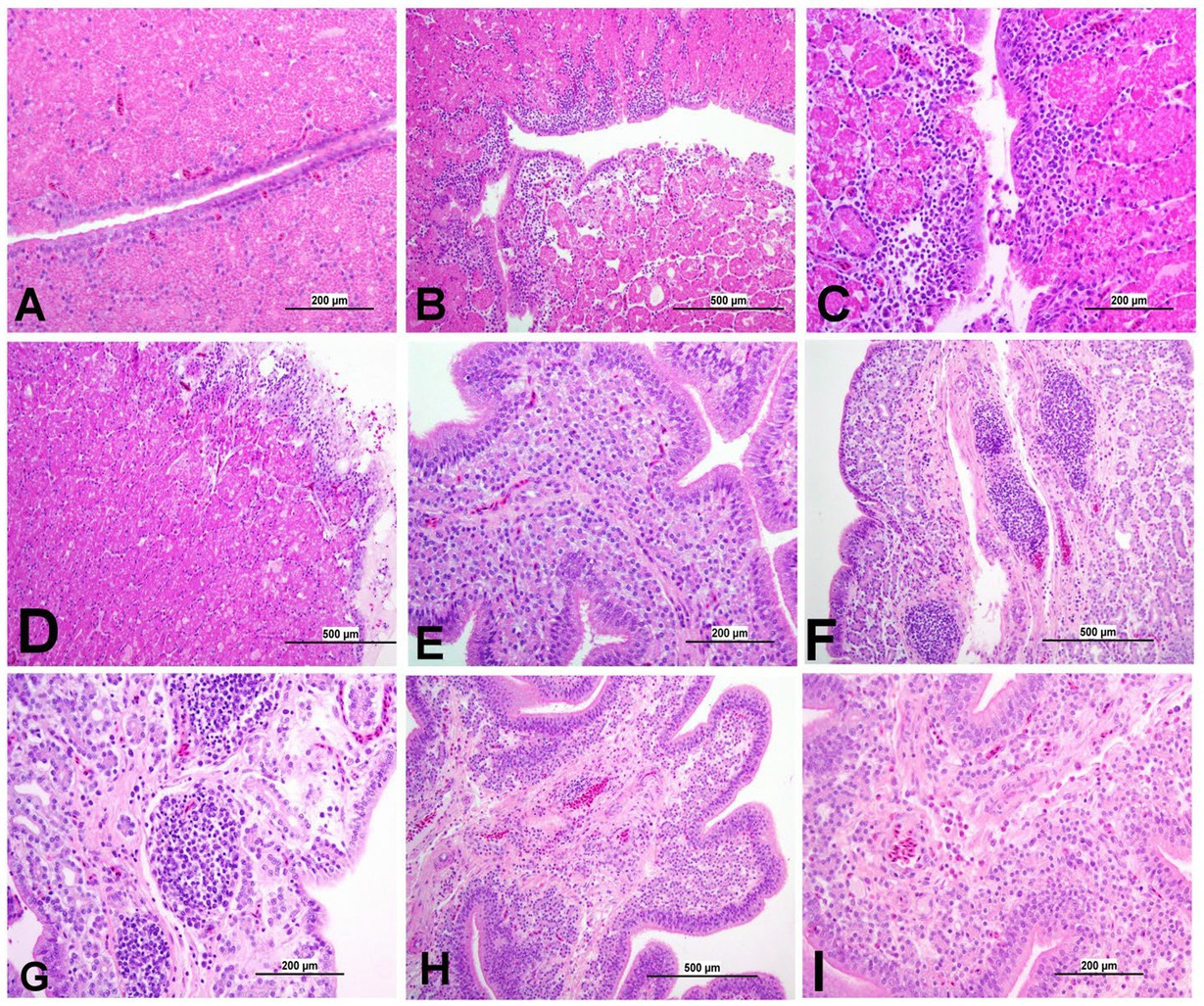 Figura 12. Fotomicrografías representativas de la glándula magnum y de la concha de los grupos infectados por el IBV y de los grupos control. (A) Magnum del grupo de control; (B,C) Magnum de DMV1639 grupo infectado por IBV que muestra cambios degenerativos y necrosis en el epitelio mucoso y las glándulas secretoras junto con infiltración de láminas propias con células mononucleares y acumulación de restos celulares y células inflamatorias en la luz. (D) Grupo infectado por IBV de Magnum of Mass que muestra una marcada degeneración, necrosis del epitelio mucoso, agregaciones de células inflamatorias mononucleares en epitelio y subepitelio y necrosis leve de las glándulas secretoras. (E) Glándula de concha del grupo de control; (F,G) Glándula de la concha de DMV1639 grupo infectado por el IBV que muestra múltiples agregaciones linfoplasmocíticas de la mucosa, necrosis epitelial y glandular. (H,I) Glándula de la cáscara del grupo infectado por Mass IBV que muestra edema, necrosis glandular leve y agregación celular inflamatoria principalmente heterófilos y linfocitos.
Figura 12. Fotomicrografías representativas de la glándula magnum y de la concha de los grupos infectados por el IBV y de los grupos control. (A) Magnum del grupo de control; (B,C) Magnum de DMV1639 grupo infectado por IBV que muestra cambios degenerativos y necrosis en el epitelio mucoso y las glándulas secretoras junto con infiltración de láminas propias con células mononucleares y acumulación de restos celulares y células inflamatorias en la luz. (D) Grupo infectado por IBV de Magnum of Mass que muestra una marcada degeneración, necrosis del epitelio mucoso, agregaciones de células inflamatorias mononucleares en epitelio y subepitelio y necrosis leve de las glándulas secretoras. (E) Glándula de concha del grupo de control; (F,G) Glándula de la concha de DMV1639 grupo infectado por el IBV que muestra múltiples agregaciones linfoplasmocíticas de la mucosa, necrosis epitelial y glandular. (H,I) Glándula de la cáscara del grupo infectado por Mass IBV que muestra edema, necrosis glandular leve y agregación celular inflamatoria principalmente heterófilos y linfocitos.
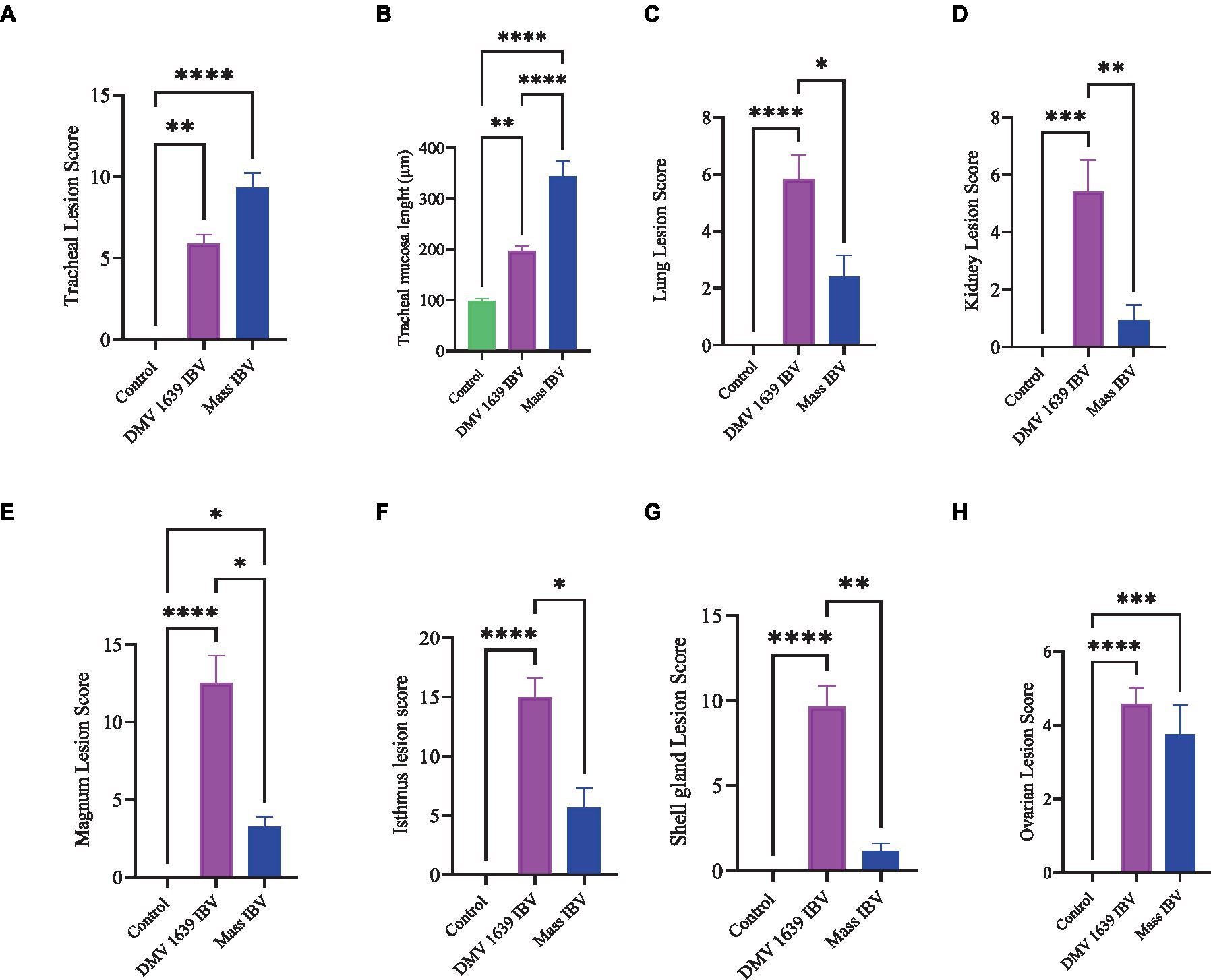 Figura 13. Puntuaciones de lesiones de diferentes órganos de grupos infectados por el IBV y simulados. (A) Puntuaciones de lesiones traqueales. (B) Espesor de la mucosa traqueal. (C) Puntuaciones de lesiones pulmonares. (D) Puntuaciones de lesiones renales. (E) Puntuaciones de lesiones magnas. (F) Puntuaciones de lesiones del istmo. (G) Puntuaciones de lesiones de la glándula de la concha. (H) Puntuaciones de lesiones ováricas. Los valores se expresaron como mediana con rango intercuartílico y se analizaron mediante la prueba de Kruskal-Wallis seguida de la comparación múltiple de Dunn. Significación: *p < 0,05, **p < 0,01, ***p < 0,001.
Figura 13. Puntuaciones de lesiones de diferentes órganos de grupos infectados por el IBV y simulados. (A) Puntuaciones de lesiones traqueales. (B) Espesor de la mucosa traqueal. (C) Puntuaciones de lesiones pulmonares. (D) Puntuaciones de lesiones renales. (E) Puntuaciones de lesiones magnas. (F) Puntuaciones de lesiones del istmo. (G) Puntuaciones de lesiones de la glándula de la concha. (H) Puntuaciones de lesiones ováricas. Los valores se expresaron como mediana con rango intercuartílico y se analizaron mediante la prueba de Kruskal-Wallis seguida de la comparación múltiple de Dunn. Significación: *p < 0,05, **p < 0,01, ***p < 0,001.
3.8.1 Lesiones en la tráquea
Los resultados del estudio revelaron un claro contraste entre el grupo de control y los dos grupos infectados por el IBV. Mientras que la tráquea del grupo control se encontraba en estado sano, ambos grupos expuestos al IBV presentaban lesiones histopatológicas. De los dos grupos infectados, el que se expuso al IBV masivo mostró lesiones más graves y tejidos mucosos más gruesos que el grupo infectado con DMV/1639-IBV. Las lesiones observadas en la tráquea infectada por el IBV incluyen pérdida de epitelio en algunas áreas, degeneración y necrosis de la tráquea del revestimiento epitelial, depleción de las glándulas mucosas y marcada infiltración linfoplasmocítica difusa de la mucosa y submucosa con marcada hiperplasia de folículos linfoides en la mucosa, mientras que algunas áreas están revestidas por células epiteliales hiperplásicas regenerativas (Figuras 8A-C).
3.8.2 Lesiones en el pulmón
El pulmón del grupo control era normal. La naturaleza de la lesión fue la misma en ambos grupos infectados por el IBV, pero el grupo infectado por el DMV/1639 por el IBV mostró lesiones más graves. Los bronquios primarios y secundarios mostraron inflamación con marcado plegamiento e hiperplasia de su revestimiento epitelial, acumulación de moco en la luz bronquial y reclutamiento masivo de células mononucleares en lámina propia con marcada agregación del folículo linfoide. Los tabiques parabronquiales estaban engrosados con edema, congestión y agregación de células inflamatorias (Figuras 8E-I).
3.8.3 Lesiones en el riñón
Los riñones del grupo control eran normales (Figura 9A). La mayoría de las aves infectadas con la cepa DMV/1639 IBV mostraron infiltración linfocitaria de moderada a grave y focal a difusa en el tejido intersticial con dilatación y necrosis de los túbulos renales del revestimiento epitelial. Algunos túbulos renales contenían material celular de yeso y urato. Además, se observó la generación de folículos linfoides en muchas aves. Por el contrario, el grupo infectado por el IBV Mass reveló nefritis intersticial linfocítica medular leve con una reducción significativa en la puntuación de la lesión (Figura 13) en comparación con el grupo infectado por el DMV/1639 por el IBV (Figuras 9B-F).
3.8.4 Lesiones en las amígdalas cecales
La TC del grupo control fue normal. El grupo infectado por el IBV DMV/1639 reveló degeneración y necrosis del revestimiento linfoepitelial de la TC con agregación de heterófilos y macrófagos espumosos en la zona subepitelial y el área interfolicular, mientras que en el grupo infectado por el IBV se observó hiperplasia del revestimiento epitelial y las células mucosas. Se detectó depleción linfoide leve en ambos grupos infectados por el IBV (Figuras 9G-I).
3.8.5 Lesiones en el ovario
El ovario de las aves del grupo control era normal, como se muestra en la Figura 10A. Las lesiones ováricas fueron más graves en el grupo infectado por el DMV/1639 por el IBV en comparación con el grupo infectado por el IBV masivo. Las lesiones se presentaron como atresia quística, caracterizada por ruptura de la yema, pérdida de la definición de la membrana perivitelina, marcada degeneración vacuolar de las células de la granulosa, congestión ovárica, hemorragia e infiltración heterofílica con ooforitis linfocítica. Además, el grupo infectado por el IBV en masa reveló la agregación de algunos folículos linfoides (Figuras 10B-I).
3.8.6 Lesiones en el oviducto
El oviducto del grupo control era normal, como se muestra en las Figuras 11 y 12. Las lesiones fueron de leves a moderadas en el grupo infectado por el IBV masivo y de moderadas a graves en el grupo infectado por el DMV/1639 IBV. El istmo fue una parte del oviducto, que fue la más afectada en ambos grupos (Figura 11). El magnum del grupo infectado por el DMV/1639 IBV mostró alteraciones de moderadas a graves en forma de degeneración epitelial y necrosis con agregación de células mononucleares subepiteliales, necrosis de la glándula, marcada expansión de la lámina propia con células inflamatorias mononucleares, manguito linfocítico perivascular y agregación de células mononucleares en la capa muscular (Figuras 12B-D). La glándula de la concha del grupo infectado por el virus del IBV DMV/1639 mostró degeneración del revestimiento epitelial, necrosis de algunas glándulas, edema intersticial, agregación focal de células mononucleares en la lámina propia con edema perivascular marcado y manguito linfocítico. Por otro lado, el útero del grupo infectado por el IBV mostró una lesión de leve a moderada en algunas aves, y hubo una diferencia significativa en la puntuación de la lesión entre los dos grupos infectados por el IBV (Figuras 11-13).
3.9 Ensayo TUNEL para la detección de apoptosis en secciones de tejido
Se detectaron células apoptóticas en los tres grupos experimentales. Las células apoptóticas tenían un núcleo de color marrón oscuro. Las células apoptóticas se observaron normalmente en el epitelio que recubre la tráquea, los bronquios primarios y secundarios, el epitelio tubular renal, las células del estroma ovárico, el epitelio que recubre los folículos atréticos y el epitelio que recubre la magnum, el istmo y la glándula de la concha, como se muestra en las Figuras 14 y 15. Sin embargo, tanto el grupo de DMV1639 de IBV como el de Mass no revelaron diferencias significativas en el índice de apoptosis en la tráquea y los pulmones. En cuanto al riñón, la infección DMV1639 mostró un aumento en el índice de apoptosis en comparación con los grupos control e infectados por IBV masivo. Las células apoptóticas positivas se observaron en túbulos renales, células linfoplasmocíticas y agregados de folículos linfoides (Figuras 14H, I). En el ovario, la magnum, el istmo y la glándula de la concha, hubo elevaciones significativas en el índice de apoptosis en el grupo infectado por DMV1639 en comparación con los grupos Mass y control. Se detectaron muchas células apoptóticas en los agregados de células inflamatorias mononucleares, los agregados de folículos linfoides y el ovario y el oviducto del revestimiento epitelial (Figura 15). El índice apoptótico de las células en diferentes tejidos se presenta en la Figura 16.
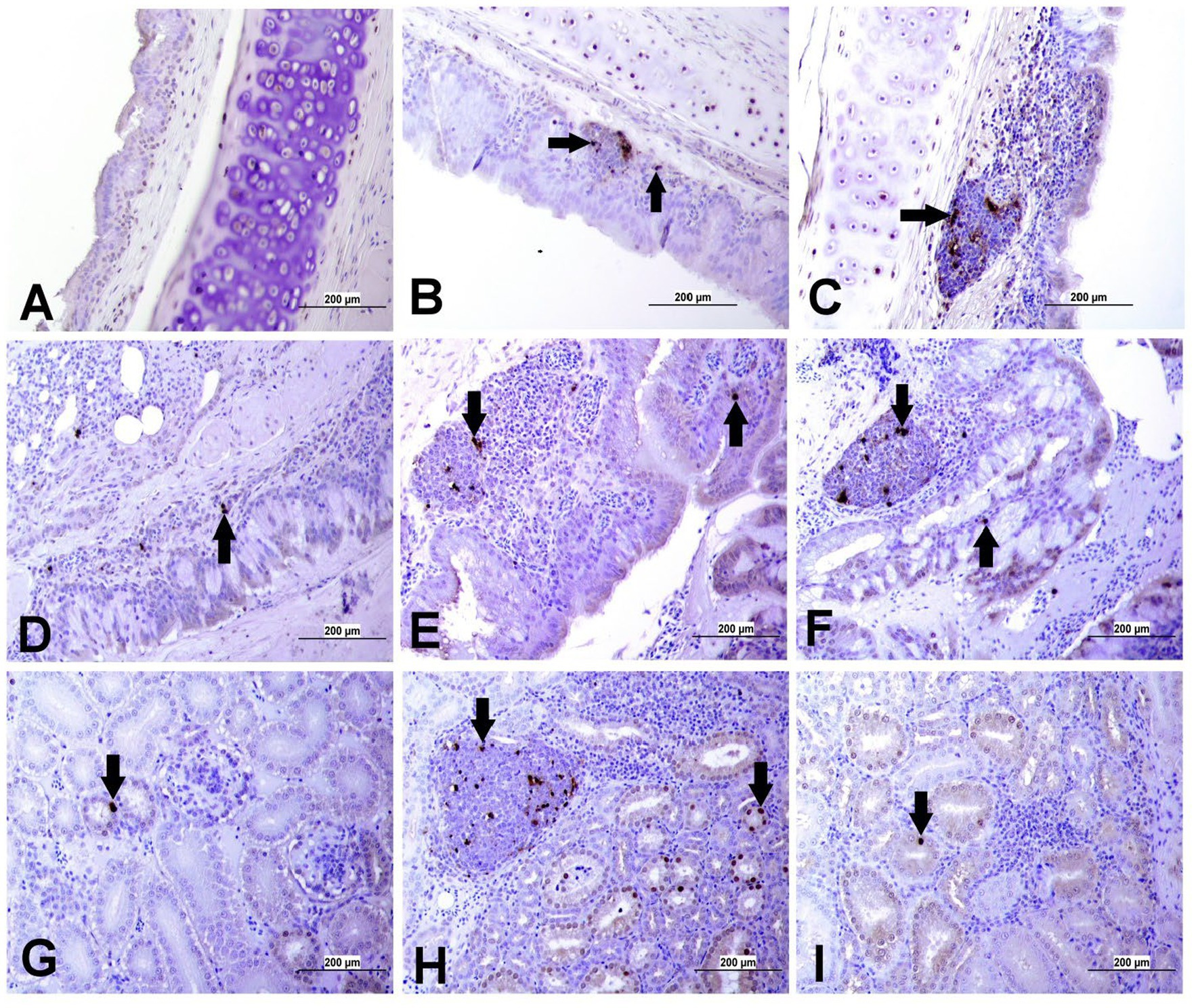 Figura 14. Detección de apoptosis mediante ensayo de túnel en tráquea, pulmón y riñón de diferentes grupos. La flecha negra indica la celda positiva del túnel. (A) Tráquea del grupo control (B) Tráquea del IBV DMV1639 grupo infectado que muestra células apoptóticas en células inflamatorias mononucleares. (C) Grupo de la tráquea de masa que muestra células apoptóticas en el folículo linfoide y células inflamatorias mononucleares. (D) Pulmón del grupo control. (E) Pulmón del IBV DMV1639 infectado y (F) Pulmón del grupo infectado por IBV masivo que muestra células apoptóticas en el folículo linfoide, células inflamatorias mononucleares y bronquios del revestimiento epitelial. (G) Riñón del grupo control. (H) Riñón del grupo infectado DMV1639 IBV que muestra células Tunnel positivas en el folículo linfoide y los túbulos renales del revestimiento epitelial. (I) Grupo Riñón de masa que muestra una célula Tunnel positiva en los túbulos renales del revestimiento epitelial.
Figura 14. Detección de apoptosis mediante ensayo de túnel en tráquea, pulmón y riñón de diferentes grupos. La flecha negra indica la celda positiva del túnel. (A) Tráquea del grupo control (B) Tráquea del IBV DMV1639 grupo infectado que muestra células apoptóticas en células inflamatorias mononucleares. (C) Grupo de la tráquea de masa que muestra células apoptóticas en el folículo linfoide y células inflamatorias mononucleares. (D) Pulmón del grupo control. (E) Pulmón del IBV DMV1639 infectado y (F) Pulmón del grupo infectado por IBV masivo que muestra células apoptóticas en el folículo linfoide, células inflamatorias mononucleares y bronquios del revestimiento epitelial. (G) Riñón del grupo control. (H) Riñón del grupo infectado DMV1639 IBV que muestra células Tunnel positivas en el folículo linfoide y los túbulos renales del revestimiento epitelial. (I) Grupo Riñón de masa que muestra una célula Tunnel positiva en los túbulos renales del revestimiento epitelial.
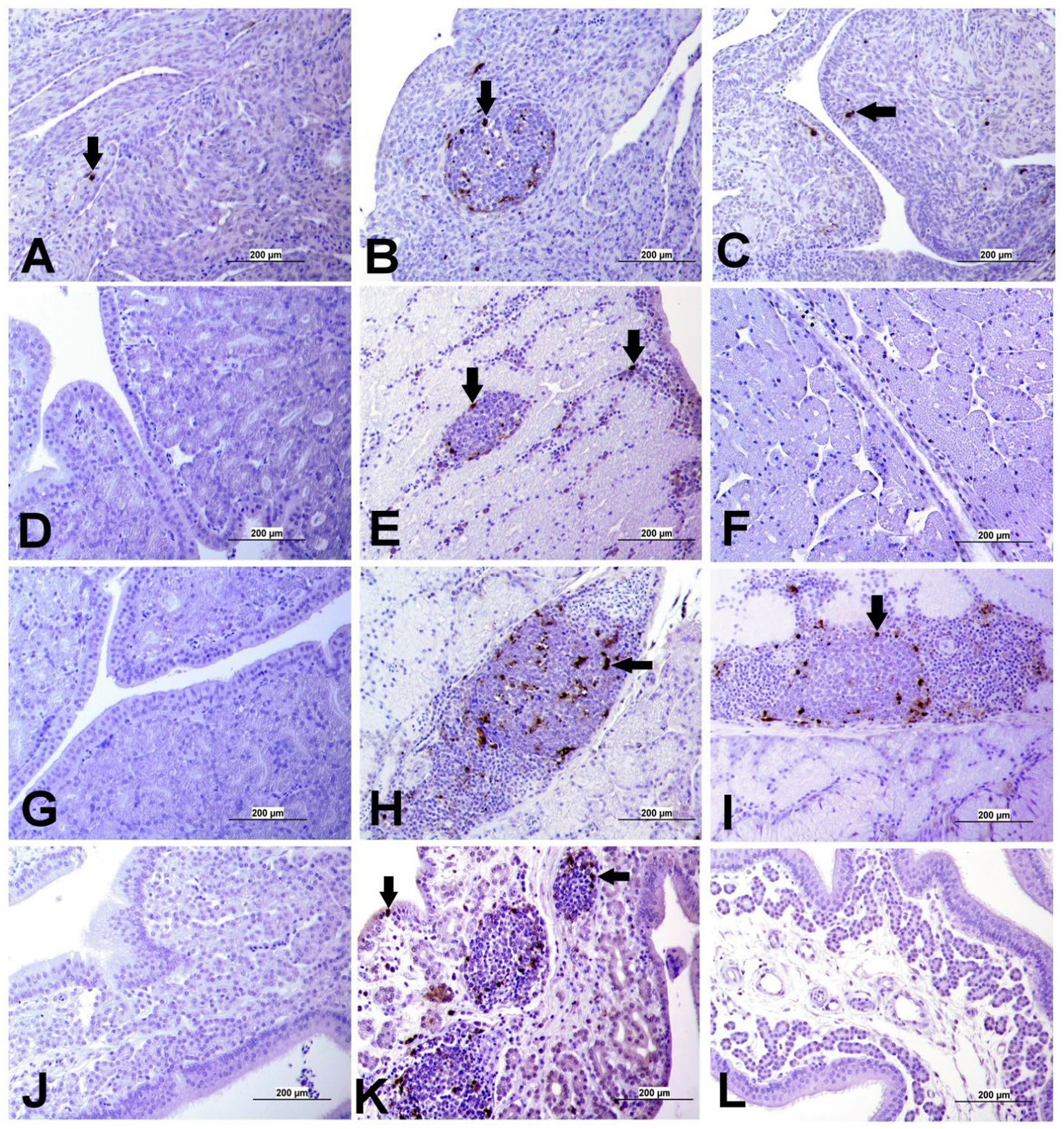 Figura 15. Detección de apoptosis mediante ensayo de túnel en ovario y oviducto de diferentes grupos. La flecha negra indica la celda positiva del túnel. (A) Ovario del grupo control; (B) Ovario del IBV, DMV1639 grupo infectado que muestra células positivas en los agregados de folículos linfoides y células estromalas. (C) Ovario del grupo infectado por IBV masivo. (D) Magnum del grupo de control. (E) Magnum del IBV DMV1639 grupo infectado. (F) Magnum del grupo infectado por el IBV masivo. (G) Istmo de control y (H) Istmo de IBV DMV1639 grupos infectados que muestran células positivas en el folículo linfoide y células inflamatorias mononucleares. (I) Grupo del Istmo de la Misa. (J) Glándula de la cáscara del grupo de control. (K) Glándula de la cáscara del IBV DMV1639 grupo infectado que muestra células Tunnel positivas en agregados de folículos linfoides, células inflamatorias mononucleares y glándula de la cáscara epitelial. (L) Glándula de la concha del grupo infectado por Mass IBV.
Figura 15. Detección de apoptosis mediante ensayo de túnel en ovario y oviducto de diferentes grupos. La flecha negra indica la celda positiva del túnel. (A) Ovario del grupo control; (B) Ovario del IBV, DMV1639 grupo infectado que muestra células positivas en los agregados de folículos linfoides y células estromalas. (C) Ovario del grupo infectado por IBV masivo. (D) Magnum del grupo de control. (E) Magnum del IBV DMV1639 grupo infectado. (F) Magnum del grupo infectado por el IBV masivo. (G) Istmo de control y (H) Istmo de IBV DMV1639 grupos infectados que muestran células positivas en el folículo linfoide y células inflamatorias mononucleares. (I) Grupo del Istmo de la Misa. (J) Glándula de la cáscara del grupo de control. (K) Glándula de la cáscara del IBV DMV1639 grupo infectado que muestra células Tunnel positivas en agregados de folículos linfoides, células inflamatorias mononucleares y glándula de la cáscara epitelial. (L) Glándula de la concha del grupo infectado por Mass IBV.
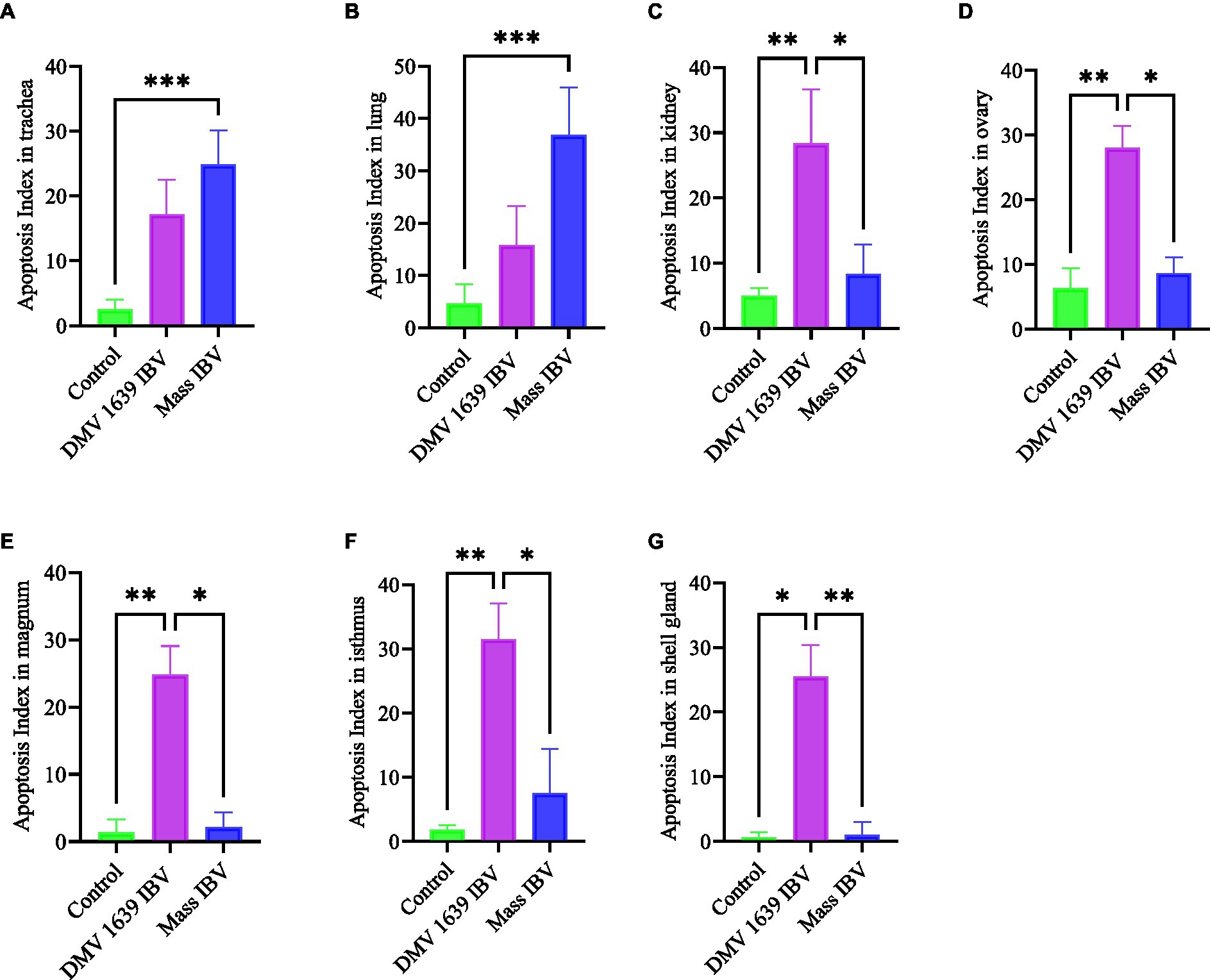 Figura 16. El gráfico de barras representaba el índice de apoptosis de diferentes órganos. (A) Tráquea. (B) Pulmón. c) Riñón. d) Ovario. (E) Magnum. f) Istmo. (G) Glándula de la concha. Los valores se expresaron como media + − SE y se analizaron mediante la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Significación: *p < 0,05, **p < 0,01, ***p < 0,001.
Figura 16. El gráfico de barras representaba el índice de apoptosis de diferentes órganos. (A) Tráquea. (B) Pulmón. c) Riñón. d) Ovario. (E) Magnum. f) Istmo. (G) Glándula de la concha. Los valores se expresaron como media + − SE y se analizaron mediante la prueba de Kruskal-Wallis seguida de la prueba de comparación múltiple de Dunn. Significación: *p < 0,05, **p < 0,01, ***p < 0,001.
4 Discusión
Este experimento fue diseñado para comparar la patogenicidad de dos aislados de IBV pertenecientes a dos genotipos principales, Mass y DMV/1639. En el este de Canadá, el DMV/1639 IBV es prevalente (22, 31), y en el oeste de Canadá, el IBV masivo es prevalente (8). Nuestro estudio arrojó tres hallazgos significativos. En primer lugar, observamos una disminución significativa en el número de huevos en gallinas infectadas con DMV/1639 IBV. Esto sugiere que la cepa DMV/1639 IBV es más patógena en gallinas ponedoras en comparación con la cepa Mass IBV. En segundo lugar, observamos que la patología inducida por el virus es significativa en los tejidos (excepto la tráquea) de los pollos infectados con DMV/1639 IBV que en los pollos infectados por el IBV masivo. En tercer lugar, observamos que el IBV masivo indujo tasas de apoptosis significativamente más altas en los tejidos respiratorios, mientras que el DMV/1639 IBV fue capaz de inducir tasas de apoptosis más altas en los tejidos renales y del oviducto.
La aparición de signos clínicos seguidos de una disminución de la producción de huevos en este estudio es consistente con estudios previos sobre la infección por IBV en ponedoras de SPF (7). En este estudio, se ha observado que la aparición de signos clínicos, incluida la disminución del número de huevos a los 2 y 5 dpi, respectivamente, en gallinas maduras, está infectada con la cepa DMV/1639 del IBV. A pesar de que la infección de gallinas ponedoras con DMV/1639 IBV en nuestro estudio estuvo en línea con las observaciones previas, no encontramos una disminución significativa en el número de huevos en las gallinas debido a la infección masiva por IBV, a diferencia de estudios anteriores (8). Es difícil explicar esta inconsistencia en la producción de huevos en gallinas ponedoras infectadas por Mass IBV entre los estudios actuales y los anteriores; Es posible que las diferencias entre el sistema de alojamiento y el bajo número de animales en el estudio anterior hayan influido en la infección en el sistema reproductivo, lo que llevó a discrepancias en los datos de producción de huevos. Criamos las aves (n = 12 aves en el corral) en corrales de piso, proporcionando espacio adecuado, posaderos y cajas nido, y el estudio anterior se ha realizado en aisladores de alta contención con espacio limitado (n = 3 en el espacio de 4 × cubículos de 4′). Sin embargo, se necesitan más estudios para descartar estas posibilidades en la discrepancia observada en los datos de producción de huevos, después de la infección masiva por IBV en gallinas ponedoras.
Previamente se ha registrado una mala calidad interna de los óvulos después de la infección por IBV (32, 33). La estatura de albúmina gruesa de los grupos infectados por el IBV DMV/1639 e infectados por el IBV masivo fue significativamente menor (p < 0,05) que la del grupo control después de la infección. La infección por IBV suele afectar a las células del magnum, lo que da lugar a una albúmina delgada y acuosa que, en última instancia, reduce los valores unitarios de Haugh (34). Los cambios patológicos en las células epiteliales glandulares de las glándulas tubulares en el magnum pueden resultar en la reducción de la síntesis de la proteína albúmina (35). En el presente estudio, observamos que tanto los grupos infectados por DMV/1639 IBV como los infectados por IBV masivo indujeron cambios histológicos en el magnum 21 dpi, coincidiendo con la replicación del IBV al menos en el grupo infectado por DMV/1639 IBV.
Varios modelos animales experimentales que investigan la apoptosis demuestran una fuerte relación entre la tasa de apoptosis y la infección por el virus (14), y esto concuerda con la observación actual. En condiciones ex vivo e in vitro, se ha demostrado que el IBV masivo induce una mayor apoptosis en el cultivo de órganos traqueales que en el cultivo de células renales, y el IBV nefropatogénico induce una mayor apoptosis en el riñón que en el cultivo de órganos traqueales. La inducción de la apoptosis celular por virus puede conducir a daño tisular (36), y esto se reflejó en la patología inducida por el Mass IBV, que es más grave en la tráquea y la patología inducida por el IBV DM1639, que es más grave en el riñón.
En conclusión, tanto los aislados de DMV/1639 como los aislados de IBV masivo son capaces de infectar a las gallinas ponedoras maduras en su punto máximo de puesta, causando signos clínicos graves, como dificultad respiratoria y disminución de la producción de huevos. Aunque ambas cepas son virulentas, la cepa DMV/1639 del IBV tiene un rango más amplio de tropismo tisular y una afinidad particular por el riñón y el oviducto de las gallinas ponedoras, lo que provoca daños graves y una caída significativa en la producción de huevos. La cepa Mass IBV se dirige principalmente al tracto respiratorio de las gallinas ponedoras, causando dificultad respiratoria. La gravedad y el alcance de la apoptosis variaron entre las cepas DMV/1639 y Mass IBV, siendo la primera la cepa la que causó una apoptosis más extensa en los riñones y los oviductos, mientras que la segunda afectó principalmente al epitelio traqueal. Los resultados resaltan la importancia de las diferencias específicas de la cepa en la patogenicidad del IBV y su impacto potencial en la industria avícola.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité de Cuidado de Animales de Ciencias Veterinarias (VSACC) de la Universidad de Calgary (AC19-0011). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
MF: Investigación, Metodología, Validación, Redacción – revisión y edición, Análisis Formal, Visualización, Escritura – borrador original. RA-E: Análisis Formal, Investigación, Metodología, Validación, Visualización, Escritura – borrador original, Escritura – revisión y edición. NR: Análisis Formal, Investigación, Escritura – Revisión y Edición. MH: Análisis Formal, Investigación, Visualización, Escritura – Revisión y Edición. SN: Análisis Formal, Investigación, Visualización, Escritura – Revisión y Edición. SCo: Metodología, Supervisión, Validación, Visualización, Redacción – revisión y edición. SCh: Metodología, Supervisión, Validación, Visualización, Redacción – revisión y edición. YN: Metodología, Supervisión, Validación, Visualización, Redacción – revisión y edición. MA-C: Conceptualización, Obtención de Financiamiento, Investigación, Metodología, Administración de Proyectos, Recursos, Supervisión, Validación, Redacción, Revisión y Edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Agradecemos la financiación de Agriculture and Agri Food Canada (AAFC) a través de la financiación del Clúster de Ciencias Avícolas al Consejo Canadiense de Investigación Avícola (CPRC, número de proyecto ASC-20) y a Egg Farmers of Canada (EFC, subvención número 10022788). Los estudios de doctorado de MF están financiados por el proyecto AHBP de la Comisión de Educación Superior de Pakistán. El proyecto fue financiado por fondos conjuntos del Consejo Canadiense de Investigación (CPRC) y Egg Farmers of Canada.
Reconocimientos
Los autores desean agradecer al personal de la Estación de Investigación de Ciencias Veterinarias en el Campus de Spy Hills, Universidad de Calgary, por el manejo de animales experimentales.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1329430/full#supplementary-material
Referencias
1. Jordan, B. Vacunación contra el virus de la bronquitis infecciosa: un desafío continuo. Vet Microbiol [Internet]. (2017) 206:137–43. doi: 10.1016/j.vetmic.2017.01.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Zhang, X, Liao, K, Chen, S, Yan, K, Du, X, Zhang, C, et al. Evaluación del desarrollo del sistema reproductivo y el rendimiento de la puesta de huevos de gallinas infectadas con el virus de la bronquitis infecciosa tipo TW I. Vet Res [Internet]. (2020) 51:95. doi: 10.1186/s13567-020-00819-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Najimudeen, M, Hassan, MSH, Cork, SC, y Abdul-Careem, MF. Infección por coronavirus bronquitis infecciosa en pollos: enfermedad multisistémica con inmunosupresión. Patógenos (Basilea, Suiza) (2020); 9: 779, doi: 10.3390/pathogens9100779
4. Chhabra, R, Chantrey, J y Ganapathy, K. Respuestas inmunitarias a cepas virulentas y vacunales de virus de bronquitis infecciosa en pollos. Inmunología Viral. (2015) 28:478–88. doi: 10.1089/vim.2015.0027
5. Cook, JKA, Jackwood, M, y Jones, RC. Una visión a largo plazo: 40 años de investigación sobre la bronquitis infecciosa. Patopatía aviar [Internet]. (2012) 41:239–50. doi: 10.1080/03079457.2012.680432
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Raj, GD, y Jones, RC. Virus de la bronquitis infecciosa: Inmunopatogenia de la infección en el pollo. Patopatía aviar [Internet]. (1997) 26:677–706. DOI: 10.1080/03079459708419246
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Hassan, MSH, Najimudeen, SM, Ali, A, Altakrouni, D, Goldsmith, D, Coffin, CS, et al. Inmunopatogenia del virus de la bronquitis infecciosa (IBV) Delmarva canadiense (DMV/1639): impacto en el tracto reproductivo en ponedoras. Microb Pathog [Internet]. (2022) 166:105513. doi: 10.1016/j.micpath.2022.105513
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Amarasinghe, A, Popowich, S, De Silva, SU, Abdul-Cader, MS, Marshall, F, van der Meer, F, et al. El síndrome del huevo sin cáscara (SES, por sus siglas en inglés), muy extendido en las operaciones de ponedoras del oeste de Canadá, está relacionado con una cepa aislada del virus de la bronquitis infecciosa (IBV) de tipo Massachusetts (masa). Virus. (2018) 10:437. doi: 10.3390/v10080437
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Jka, C. Recuperación del virus de la bronquitis infecciosa a partir de huevos y pollitos producidos por gallinas inoculadas experimentalmente. J Comp Pathol. (1971) 81:203–11. doi: 10.1016/0021-9975(71)90093-4
10. Muneer, MA, Newman, JA, Halvorson, DA, Sivanandan, V, y Coon, CN. Efectos del virus de la bronquitis infecciosa aviar (cepa de Arkansas) en pollos ponedoras vacunados. Avian Dis. (1987) 31:820–8. doi: 10.2307/1591038
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. de Wit, JJ, Nieuwenhuisen-van Wilgen, J, Hoogkamer, A, van de Sande, H, Zuidam, GJ, y Fabri, THF. Inducción de oviductos quísticos y protección contra el desafío precoz con el virus de la bronquitis infecciosa serotipo D388 (genotipo QX) mediante anticuerpos de origen materno y mediante vacunación temprana. Patopatía aviar [Internet]. (2011) 40:463–71. Disponible en:. doi: 10.1080/03079457.2011.599060
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Elmore, S. Apoptosis: una revisión de la muerte celular programada. Toxicol Pathol. (2007) 35:495–516. doi: 10.1080/01926230701320337
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Thornberry, NA, y Lazebnik, Y. Caspasas: enemigos internos. Ciencia. (1998) 281:1312–6. doi: 10.1126/science.281.5381.1312
14. Clarke, P, y Tyler, KL. Apoptosis en modelos animales de enfermedad inducida por virus. Nat Rev Microbiol [Internet]. (2009) 7:144–55. doi: 10.1038/nrmicro2071
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Yang, X, Zhou, Y, Li, J, Fu, L, Ji, G, Zeng, F, et al. La cepa de vacuna H120 del virus de la bronquitis infecciosa recombinante (IBV) que expresa la proteína hemaglutinina-neuraminidasa (HN) del virus de la enfermedad de Newcastle (NDV) protege a los pollos contra el IBV y el NDV. Arch Virol [Internet]. (2016) 161:1209–16. doi: 10.1007/s00705-016-2764-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Zhong, Y, Liao, Y, Fang, S, Tam, JP y Liu, DX. La regulación positiva de Mcl-1 y Bak por la infección por coronavirus de células humanas, aviares y animales modula la apoptosis y la replicación viral. PLoS UNO. (2012) 7:E30191. doi: 10.1371/journal.pone.0030191
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Han, X, Tian, Y, Guan, R, Gao, W, Yang, X, Zhou, L, et al. La infección por el virus de la bronquitis induce la apoptosis durante la replicación en las células HD11 de macrófagos de pollo. Virus. (2017) 9:198. doi: 10.3390/v9080198
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Chhabra, R, Kuchipudi, SV, Chantrey, J y Ganapathy, K. La patogenicidad y el tropismo tisular del virus de la bronquitis infecciosa se asocian con una apoptosis elevada y respuestas inmunitarias innatas. Virología. (2016) 488:232–41. doi: 10.1016/j.virol.2015.11.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Song, S, Lee, J, Park, Y, Shin, Y y Park, I. Apoptosis en pollitos infectados experimentalmente con bronquitis infecciosa aviar [internet]. Servicio veterinario Kor J. (2002) 25:347–55. doi: 10.7853/.1970.0.0
20. Liu, C, Xu, HY y Liu, DX. Inducción de apoptosis dependiente de caspasas en células cultivadas por el virus de la bronquitis infecciosa por coronavirus aviar. J Virol. (2001) 75:6402–9. doi: 10.1128/JVI.75.14.6402-6409.2001
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Benyeda, Z, Szeredi, L, Mató, T, Süveges, T, Balka, G, Abonyi-Tóth, Z, et al. Histopatología e inmunohistoquímica comparadas de los serotipos QX-like, Massachusetts y 793/B de infección por el virus de la bronquitis infecciosa en pollos. J Comp Pathol. (2010) 143:276–83. doi: 10.1016/j.jcpa.2010.04.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Hassan, MSH, Ojkic, D, Coffin, CS, Cork, SC, van der Meer, F, y Abdul-Careem, MF. Las variantes del virus de la bronquitis infecciosa (IBV) de Delmarva (DMV/1639) aisladas en el este de Canadá muestran evidencia de recombinación. Virus. (2019) 11:1054. doi: 10.3390/v11111054
23. Amarasinghe, A, Popowich, S, Senapathi, UDS, Abdul-cader, MS, Marshall, F, Van Der Meer, F, et al. (2018) 1–15.
24. De Silva, SU, Abdul-Cader, MS, Amarasinghe, A, Van Marle, G, Czub, M, Gomis, S, et al. La administración in ovo de oligonucleótidos CpG protege contra la bronquitis infecciosa con el reclutamiento de células inmunitarias en el tracto respiratorio de los pollos. Virus. (2018) 10:635. doi: 10.3390/v10110635
25. CCAC. Guías del CCAC sobre: eutanasia de animales utilizados en ciencia. Ottawa, ON, Canadá: Consejo Canadiense sobre el Cuidado de los Animales (2010). 36 págs.
26. Kameka, AM, Haddadi, S, Kim, DS, Cork, SC, y Abdul-Careem, MF. Inducción de la respuesta inmune innata después de la infección por corona virus de bronquitis infecciosa en el tracto respiratorio de pollos. Virología [Internet]. (2014) 450-451:114–21. doi: 10.1016/j.virol.2013.12.001
27. Gonzales-viera, A, Francisco, R, Emily, R, Gonzales-viera, O, Crossley, AB, Carvallo-chaigneau, AFR, et al. Prevalencia del virus de la bronquitis infecciosa, caracterización e identificación de cepas en pollos de traspatio de California. Avian Dis. (2021) 65:197:188. doi: 10.1637/aviandiseases-D-20-00113
28. Abd-Elsalam, RM, El Badawy, SA, Ogaly, HA, Ibrahim, FM, Farag, OM, y Ahmed, KA. El extracto de semilla de Eruca sativa modula el estrés oxidativo y la apoptosis y regula al alza la expresión de los genes Bcl-2 y Bax en la disfunción testicular inducida por acrilamida en ratas. Environ Sci Pollut Res Int. (2021) 28:53249–66. doi: 10.1007/s11356-021-14532-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Sibony, M, Commo, F, Callard, P, y Gasc, JM. Mejora de la señal de hibridación in situ de ARNm mediante calentamiento por microondas. Laboratorio de Investigación. (1995) 73:586–91.
30. Gavrieli, Y, Sherman, Y, y Ben-Sasson, SA. Identificación in situ de la muerte celular programada mediante marcaje específico de la fragmentación del ADN nuclear. J Cell Biol. (1992) 119:493–501. doi: 10.1083/jcb.119.3.493
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Martin, E, Brash, M y Stalker, M. Uso del análisis filogenético para examinar las cepas cambiantes de las infecciones por el virus de la bronquitis infecciosa en Ontario a lo largo del tiempo • características del virus. (2017).
32. Crinion, ARAP, Ball, RA, y Hofstad, MS. Anomalías en pollos ponedoras después de la exposición al virus de la bronquitis infecciosa al día de edad. Avian Dis. (1971) 15:42–8.
33. Hewson, KA, Robertson, T, Steer, PA, Devlin, JM, Noormohammadi, AH e Ignjatovic, J. Evaluación de la posible relación entre la calidad del huevo y la infección por el virus de la bronquitis infecciosa en parvadas de ponedoras australianas. Aust Vet J. (2014) 92:132–8. doi: 10.1111/avj.12156
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Robineau, B, y Moalic, P. Une manifestation clinique de la bronchite infectieuse: les poules fausses pondeuses; évolution en France des coronavirus responsables. (2021); 155–160.
35. Chousalkar, KK y Roberts, JR. Estudio ultraestructural de la infección por el virus de la bronquitis infecciosa en infundíbulo y magnum de gallinas ponedoras comerciales. Microbiol veterinario. (2007) 122:223–36. doi: 10.1016/j.vetmic.2007.01.021
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Hay, S, y Kannourakis, G. Un tiempo para matar: manipulación viral del programa de muerte celular. J Gen Virol. (2002) 83:1547–64. doi: 10.1099/0022-1317-83-7-1547
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: apoptosis, cepa Delmarva (DMV)/1639, virus de la bronquitis infecciosa, cepa Massachusetts (Mass), patogenia, gallina ponedora
Cita: Farooq M, Abd-Elsalam RM, Ratcliff N, Hassan MSH, Najimudeen SM, Cork SC, Checkley S, Niu YD y Abdul-Careem MF (2024) Patogenicidad comparativa de los genotipos del virus de la bronquitis infecciosa de Massachusetts y Delmarva (DMV/1639) en gallinas ponedoras. Frente. Vet. Sci. 10:1329430. doi: 10.3389/fvets.2023.1329430
Recibido: 28 de octubre de 2023; Aceptado: 29 de diciembre de 2023;
Publicado: 19 enero 2024.
Editado por:
Camila Hamond, Servicio de Inspección de Sanidad Agropecuaria (USDA), Estados Unidos
Revisado por:
Pavulraj Selvaraj, Universidad Estatal de Luisiana, Estados
Unidos Shahriar Behboudi, Universidad de Bristol, Reino Unido
Derechos de autor © 2024 Farooq, Abd-Elsalam, Ratcliff, Hassan, Najimudeen, Cork, Checkley, Niu y Abdul-Careem. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Mohamed Faizal Abdul-Careem, faizal.abdulcareem@ucalgary.ca
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía