Compuestos de fagos microencapsulados para el tratamiento oral de la colonización por Salmonella en pollo

Compuestos de fagos microencapsulados con mayor estabilidad gastrointestinal para el tratamiento oral de la colonización por Salmonella en pollo
 Bo Zhang1
Bo Zhang1  Yongxia Wang1
Yongxia Wang1  Fangfang Wang1
Fangfang Wang1  Yongying Zhang1
Yongying Zhang1  He Hao1
He Hao1  Xingbang Lv1
Xingbang Lv1  Liuhang Hao1
Liuhang Hao1  Yuxiang Shi1,2*
Yuxiang Shi1,2*- 1Facultad de Ciencias de la Vida e Ingeniería de Alimentos, Universidad de Ingeniería de Hebei, Handan, Hebei, China
- 2Centro de Investigación de Ingeniería para Enfermedades Avícolas de la Provincia de Hebei, Handan, Hebei, China
La infección por salmonela, una de las epidemias comunes en la industria ganadera y avícola, causa grandes pérdidas económicas en todo el mundo. En la actualidad, los antibióticos son el tratamiento más comúnmente utilizado para la infección por Salmonella, pero el uso generalizado de antibióticos ha aumentado la resistencia a los medicamentos para Salmonella. La terapia con fagos se ha convertido gradualmente en un método alternativo para controlar la infección por Salmonella. Sin embargo, el fago, un virus específico que puede infectar bacterias, tiene poca estabilidad y es propenso a la inactivación durante el tratamiento. Las microesferas de fagos microencapsulados pueden resolver eficazmente este problema. En consecuencia, en este estudio, los fagos de Salmonella fueron microencapsulados, utilizando la goma xantana / alginato de sodio / CaCl2/método de chitooligosacáridos, para mejorar su estabilidad gastrointestinal. Además, se evaluaron los fagos microencapsulados para determinar la temperatura in vitro y la estabilidad del almacenamiento y el efecto terapéutico in vivo. Microesferas fágicas preparadas con 1 g/100 ml de goma xantana, 2 g/100 ml de alginato de sodio, 2 g/100 ml de CaCl2, y 0,6 g/100 ml de quitooligosacáridos fueron de forma regular y estables en el rango de temperatura de 10-30◦C. Además, los fagos microencapsulados mostraron una estabilidad significativamente mejor en el ambiente de jugo gástrico simulado que los fagos libres (p < 0,05). En el fluido intestinal simulado, los fagos microencapsulados se liberaron completamente después de 4 h. Además, los fagos microencapsulados mostraron una buena estabilidad de almacenamiento a 4◦C. En los experimentos in vivo que detectaron la colonización por Salmonella en el tracto intestinal de los pollitos, los fagos microencapsulados mostraron un mejor efecto terapéutico que los fagos libres. En conclusión, los fagos microencapsulados mostraron una estabilidad significativamente mejorada, resistencia al ácido gástrico y, por lo tanto, eficacia que los fagos libres. Los fagos microencapsulados pueden ser potencialmente utilizados como agentes de control biológico contra infecciones bacterianas.
Introducción
La salmonelosis causa graves pérdidas económicas a la industria ganadera y avícola. Las enfermedades se pueden dividir en dos categorías: una es tifoidea y paratifoidea, y la otra es gastroenteritis aguda (1-3). La salmonela, un patógeno principal de intoxicación alimentaria, también puede causar enfermedades infecciosas relacionadas, como el pullorum. En general, el ganado y las aves de corral son altamente vulnerables a la infección por Salmonella (4), y los principales sitios de infección son el intestino y los órganos (5). En caso de resistencia comprometida, la Salmonella ingresa al torrente sanguíneo a través de los intestinos causando una infección sistémica que aumenta la mortalidad del ganado y el uso excesivo / abuso de antibióticos (6). Con los crecientes casos de resistencia a los medicamentos, el problema de la resistencia a los medicamentos Salmonella se ha convertido en una gran preocupación. Los estudios epidemiológicos de Salmonella en los Estados Unidos y la UE han demostrado que los aislados humanos y animales no tienen resistencia distinguida a nivel molecular, pero una vez que el antibiótico es aprobado para uso veterinario, la Salmonella resistente a múltiples fármacos aparece solo unos años después (7-9). Lister y O’Brien et al. (10, 11) obtuvieron a través de investigaciones que en el caso de infección con S. enteritidis, se observó una alta mortalidad en pollitos <2 semanas, a veces hasta el 20%, y algunos pollitos en las parvadas de pollos afectadas mostraron signos de retraso en el crecimiento. Por otro lado, se observaron variaciones en las tasas de mortalidad en infecciones experimentales en pollitos. Gast y Beard (12) sugirieron la presencia de diferencias significativas en las tasas de mortalidad (14,5-89,5%) en pollitos de 1 día de edad inoculados por vía oral con ocho S. enteritidis aislados. Suzuki S et al. (13) encontraron que S. La enteritidis puede causar que los pollitos se infecten con salmonelosis y tengan una alta tasa de mortalidad. Por lo tanto, la búsqueda de un nuevo método para prevenir y tratar S. Enteritidis ha atraído mucha atención.
El fago, un virus bacteriano naturalmente ampliamente existente que se replica y prolifera rápidamente infectando o lisando bacterias, se puede usar para efectos antibacterianos (14-16). Se espera que los fagos con ventajas tales como una fuerte especificidad, seguridad y no toxicidad, autorreplicación y existencia generalizada reemplacen a los antibióticos contra las infecciones bacterianas (17, 18). Los fagos también se han encontrado efectivos contra las enfermedades bacterianas animales, pero son propensos a la degradación del ácido gástrico y las enzimas digestivas (19). Por lo tanto, para la terapia sostenida con fagos orales, mejorar la estabilidad de los fagos en el intestino del animal se ha convertido en un tema de investigación importante.
La microencapsulación, una tecnología relativamente nueva, tiene una perspectiva muy amplia (20). Un fármaco/agente biológico se microencapsula envolviéndolo con una o varias sustancias (21) para lograr una liberación o estabilidad controlada (22). Aunque hay muchos estudios de microencapsulación, solo unos pocos tratan sobre la microencapsulación del fago de Salmonella y, por lo tanto, requieren más estudios (23). La selección de un material de recubrimiento adecuado es extremadamente importante para lograr el resultado deseado de la microencapsulación (24). Los materiales de recubrimiento inadecuados pueden reducir las tasas de encapsulación o liberación de fármacos (25). Además, los materiales de microencapsulación deben ser no tóxicos, resistentes a los ácidos y tener una buena biocompatibilidad (26). La gelatina, la proteína de suero, el alginato de sodio (SA), el quitosano, los oligosacáridos de quitosano (COS), la pectina, la goma xantana (XG), el almidón modificado, etc. son los materiales de recubrimiento natural comúnmente utilizados. Aquí, preparamos fagos microencapsulados de Salmonella SP4 usando XG, SA, CaCl2, y COS para mejorar el efecto antibacteriano de los fagos.
Materiales y métodos
Bacterias, fagos y animales de prueba
Salmonella Enteritidis (S. Enteritidis) CICC10467 [La cepa CICC10467 es una S común. Cepa Enteritidis. Wang et al. (27) han demostrado a través de la investigación que la secuencia de aminoácidos de la proteína FliC de la cepa CICC10467 y S. Gallinarum es idéntico, lo que causará síntomas obvios de Salmonella en pollitos y aumentará el número de colonización de Salmonella en los intestinos de los pollitos] se obtuvo del Centro de Recolección de Cultivos de Microorganismos Industriales de China, y el fago SP4, aislado de aguas residuales, se almacenó en el laboratorio de la Universidad de Ingeniería de Hebei. Se recogieron muestras de aguas residuales de la estación de tratamiento de aguas residuales de la Universidad de Ingeniería de Hebei para la separación de fagos. Aproximadamente 100 ml de la muestra se almacenaron en botellas estériles y se almacenaron en un refrigerador (4 ° C) durante el transporte al laboratorio para su análisis. Centrifugar las aguas residuales a 6.000 rpm a 4◦C durante 15 min, e incubarlas con la bacteria huésped a 37◦C. Se eligió una sola placa para la purificación de tres pasajes con un huésped específico que mostró un resultado positivo, utilizando una técnica de agar de doble capa. La placa aislada del tercer pasaje de purificación se utilizó para preparar diluciones seriadas 10 veces en tampón SM. Se utilizaron diluciones apropiadas para preparar la superposición con el huésped dado para producir la lisis semiconfluente y luego cosechar con 5 ml de tampón SM seguido de centrifugación a 6.000 rpm durante 15 min a 4◦C. El sobrenadante se filtró a través de filtros de jeringa de 0,22 μm, y los lisados de fagos se mantuvieron a 4 ° C (28).
Se compraron 120 gallinas ponedoras Jingfen No. 1 de un día de edad (macho y hembra 1: 1) a Handan Xinguan Poultry Industry Co., Ltd (Handan, China). Todos los animales fueron criados en una casa de animales con alimento ad libitum y agua. Los protocolos del estudio (BER-YXY-2022027) fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales y el Comité de Ética de Investigación Animal de la Universidad de Ingeniería de Hebei, China.
Cultivo bacteriano y propagación de fagos
S. enteritidis CICC10467 se cultivó en medio líquido Luria-Bertani (LB) a 37◦C durante 12 h (fase logarítmica). Para la propagación de fagos, se mezclaron 20 μL de suspensión de fagos con 500 μL de suspensión de cepa de Salmonella en la fase de crecimiento logarítmico y 5 mL de medio LB que contenía 7 g/L de agar; la mezcla se incubó a 37◦C durante la noche. La solución de fagos se esterilizó por filtro utilizando un filtro de membrana de 0,22 μm.
Preparación de microcápsulas
La microencapsulación se realizó como se describe en Ma et al. (29) con modificaciones apropiadas para los fagos. Brevemente, se preparó 1 g/100 ml de solución XG disolviendo gránulos XG en agua desionizada. Se prepararon 2 g/100 ml de solución de SA en tampón Tris-HCl de 50 mmol/L (pH 7.5). La solución XG, la solución SA y la solución de fagos propagados se mezclaron bien en un vaso de precipitados con agitación y desgasificación al vacío para eliminar las burbujas de aire a 4 ° C. A continuación, la solución mixta mencionada anteriormente se añadió gota a gota utilizando una jeringa estéril a 2 g/100 ml de CaCl2 (en agua desionizada) a 10 mL/min, y la reacción se permitió durante 30 min a temperatura ambiente (RT). Las microesferas de fagos se recolectaron por filtración, se lavaron con agua desionizada y luego se movieron a la solución de COS de 0,6 g / 100 ml (en agua desionizada) durante 30 minutos. Después del tratamiento con COS, las microesferas de fagos se recolectaron por filtración, se limpiaron con agua desionizada y algunas se almacenaron en un recipiente cerrado a 4 ° C. La otra parte de las microesferas se secó al aire en un horno a 30 ° C durante 24 h y luego se almacenó en un recipiente cerrado a 4 ° C. El título de fagos se calculó de la siguiente manera: título de fagos (UFP/ml) = número de placa × factor de dilución × 100 (30). La eficiencia de encapsulación del fago se calculó de la siguiente manera: Eficiencia de encapsulación (%) = (cantidad de fagos liberados de las microesferas disueltas / número de fagos utilizados inicialmente para preparar las microesferas) × 100 (31). Los resultados se expresan como la eficiencia media de encapsulación ± la desviación estándar (DE) y cada experimento tuvo dos réplicas.
Microscopía electrónica
Las microesferas se examinaron para determinar el tamaño y las morfologías de la superficie mediante microscopía electrónica de barrido (SEM) a 5,0 kV (Hitachi S-4500; Hitachi Co. Ltd., Tokio, Japón). Las microesferas secas se montaron en rejillas metálicas utilizando cinta de doble cara y se recubrieron con Au/Pd al vacío. El diámetro de las microesferas de fagos se midió utilizando un micrómetro ocular y la fórmula de cálculo d¯¯¯�¯ = ∑di/n (In the formula, d¯¯¯�¯ is the average particle size, ∑di is the sum of each particle size, and n is the number).
Análisis de diseño ortogonal de microencapsulación de fagos
A continuación, realizamos una prueba ortogonal para explorar la relación de concentración óptima de los materiales de recubrimiento para la preparación de fagos microencapsulados; la eficiencia de encapsulación se utilizó como índice para evaluar los efectos de XG, SA, CaCl2 y cantidades de COS en el proceso de encapsulación. Los factores ortogonales de la prueba fueron los siguientes: Factor A, concentración XG 0,5, 1 y 1,5 g/100 ml; Factor B: SA concentración 1, 2 y 3 g/100 ml; Factor C, CaCl2 concentración 1, 2 y 3 g/100 ml; Factor D, concentración de COS 0,4, 0,6 y 0,8 g/100 mL (Tabla 1). Todos los niveles de factor fueron seleccionados con base en la literatura previa (29). El experimento se repitió dos veces y los resultados se expresan como tasa media de supervivencia ± DE.
Estabilidad de temperatura de fagos
Para determinar la estabilidad de la temperatura, 1 mL de fagos libres (1 × 108 PFU/mL) se colocaron en diferentes tubos de microcentrífuga, que fueron, respectivamente, incubados a 10, 20, 30, 40, 50, 60 y 70◦C en un baño de agua. Después de 1 h de incubación, las muestras se diluyeron 10 veces y se utilizaron para la determinación de los títulos de fagos utilizando agar de doble capa (29). Para fagos microencapsulados, 1 g de fagos microencapsulados (1 × 108 PFU/g) se colocaron en diferentes tubos de microcentrífuga, que fueron, respectivamente, incubados a 10, 20, 30, 40, 50, 60 y 70◦C en un baño de agua. Después de 1 h de incubación, solución de lisis de microesferas (La solución de lisis de microesferas estaba compuesta de 14,7 g C6H5O7Na3·2H2O y 16,8 g NaHCO3 disuelto en tampón SM de 1 L. Universidad de Ingeniería de Hebei, China) se agregó a cada tubo para abrir la microesfera, y las partículas libres se filtraron a través de un filtro de membrana de 0,22 μm. Estas partículas de fagos libres se sometieron a la determinación del título (29). El experimento se repitió dos veces y los resultados se expresan como tasa media de supervivencia ± DE.
Estabilidad gástrica de fagos
La estabilidad gástrica de fagos libres y microencapsulados se evaluó utilizando fluido gástrico simulado (SGF) (32), que consistió en 3,2 mg/ml de pepsina (Sigma-Aldrich, Oakville, Ontario, Canadá) en NaCl al 0,2% (peso / vol), pH 2,0 y 3,0. Brevemente, 1 mL de fagos libres (1 × 108 PFU/mL) se agregaron a un tubo que contenía 10 ml de SGF precalentado (37◦C), y el tubo se incubó a 37◦C durante 10, 20, 30, 40, 50 y 60 min. Se recolectaron 100 μL de la muestra en el punto de tiempo respectivo y se diluyeron 10 veces para la determinación del título de fagos como se describió anteriormente. Debido al tiempo de supervivencia prolongado de los fagos microencapsulados en SGF, 1 g de microesferas de fagos (1 × 108 PFU/g) se añadieron a un tubo que contenía 10 ml de SGF precalentado (37◦C) y se incubaron a 37◦C durante 30, 60, 90, 120, 150 y 180 min. En el momento respectivo, los fagos microencapsulados fueron lisados y sujetos a determinación de títulos (29). El tampón SM que contiene principalmente sulfato de magnesio, cloruro de sodio y gelatina se utilizó como control, que se esteriliza y se utiliza para diluir y preservar el stock de fagos. Los experimentos se repitieron dos veces y los resultados se expresan como tasa media de supervivencia ± DE.
Ensayo de liberación in vitro de fagos en fluido intestinal simulado
SIF se preparó como se describe en la Farmacopea de los Estados Unidos y consistió en 10 mg / ml de pancreatina (Sigma-Aldrich, Oakville, Ontario, Canadá) en 50 mM KH2PO4, pH 7,5 (33). Brevemente, 1 mL de fagos libres (1 × 108 UFP/ml) y 1 g de fagos microencapsulados (1 × 108 PFU/g) se añadieron a un tubo que contenía 10 mL de SIF precalentado (37◦C), respectivamente, que se incubaron a 37◦C y 100 rpm. Para investigar el comportamiento de liberación de fagos microencapsulados en SIF, se recolectaron muestras de 100 μL a las 0, 1, 2, 3, 4, 5, 6, 7 y 8 h, respectivamente. Al igual que antes, la determinación del título de fagos se realizó mediante el método de placa de doble capa (29). Los experimentos se repitieron dos veces y los resultados se expresan como tasa media de supervivencia ± DE.
Estabilidad de almacenamiento de fagos a 4 y 25◦C
Para determinar la estabilidad de almacenamiento, ambos tipos de fagos se almacenaron a 4 y 25 ° C, respectivamente. Se recuperó una pequeña cantidad de fagos libres y microencapsulados cada 7 días y se sometió a la determinación del título como se describió anteriormente (29). Los experimentos se repitieron dos veces y los resultados se expresan como tasa media de supervivencia ± DE.
Evaluación terapéutica de fagos microencapsulados en pollitos infectados
Los animales se dividieron aleatoriamente en tres grupos experimentales (Grupos B, C y D) y un grupo de control (Grupo A). Esto se repitió dos veces para cada grupo de 10 polluelos. Todos los grupos experimentales fueron infectados con S. Enteritidis CICC10467 (3 × 1010 UFC/ml, 0,5 ml/pollitos) por gavaging oral. Por el contrario, el grupo A (control) fue alimentado con solución salina normal (0,5 mL/pollitos). El grupo B no tenía ningún tratamiento con fagos. Los grupos C y D fueron, respectivamente, tratados con libres (3 × 1010 UFP/ml, 0,5 ml/pollitos) y fagos microencapsulados (3 × 1010 UFP/g, 0,5 g/pollitos) inmediatamente después de S. Infección por enteritidis. Al estar en forma sólida, primero se pesaron 0,5 g de fago microencapsulado y luego se administraron a los pollitos. Todos los animales fueron criados en una casa de animales con alimento ad libitum y agua. Después de 7 días del experimento, todos los animales fueron sacrificados con dióxido de carbono (Equipo de eutanasia animal, SHANGHAI BIOWILL CO., Ltd.). El duodeno, el yeyuno, el íleon y los tejidos colorrectales se recolectaron y lavaron para eliminar el contenido intestinal. Cada segmento del tubo intestinal se pesó, trituró y luego diluyó continuamente la solución de molienda del tubo intestinal y realizó el cultivo de Salmonella en medio XLD (el medio XLD es un medio selectivo, que se puede usar para aislar Salmonella). Es bien sabido que Salmonella presenta colonia negra y Shigella presenta colonia incolora en medio XLD. Para evitar colonias de falsos positivos en medio XLD. Por lo tanto, se seleccionan colonias negras cultivadas en medio XLD, se utilizó el kit de identificación API 20E Enterobacteriaceae G-bacilli (para la identificación de Enterobacteriaceae y otros bacilos gramnegativos no fastidiosos, Shanghai Xinzhong Biotechnology Co., Ltd., China) para realizar la identificación bioquímica de bacterias de acuerdo con el método del manual del usuario, y además se verificó que era Salmonella. El efecto terapéutico de los fagos libres y microencapsulados en pollitos infectados se estimó como el número de colonización por Salmonella, que se calculó en función del número de colonias de Salmonella en el medio XLD y el peso del tubo intestinal.
Análisis estadístico
Los resultados fueron expresados como las medias ± DE. Todos los análisis se realizaron utilizando el software GraphPad Prism 8 y SPSS Statistics 26. Se empleó ANOVA unidireccional para identificar diferencias significativas entre múltiples grupos. Nsp > 0,05, p < 0,05, p < 0,01, p < 0,05 y p < 0,01. Una diferencia fue considerada estadísticamente significativa en p < 0,05.***###
Resultados
Macro y microestructura de fagos microencapsulados
Las microesferas de fagos microencapsulados fueron analizadas por una cámara digital (SONY, ILCE-7RM3, 24,2 millones de píxeles, China). Las microesferas con superficies exteriores circulares tenían un tamaño promedio uniforme de 950 μm (rango 930-970 μm) (Figura 1A). Debido a que las microesferas deben secarse durante el escaneo SEM, después del secado, las microesferas perderán agua y se reducirán, por lo que el tamaño promedio de las microesferas se hará más pequeño. El análisis morfológico microscópico de las microesferas se realizó mediante microscopía electrónica de barrido. Las microesferas eran generalmente esféricas con una superficie arrugada y un centro colapsado; el tamaño promedio de la microesfera se redujo a 350 μm (rango 330-370 μm) (Figura 1B).
 Figura 1. Imagen de observación de fagos microencapsulados. (A) Imagen macroscópica de fagos microencapsulados. (B) Imagen microscópica de fagos microencapsulados.
Figura 1. Imagen de observación de fagos microencapsulados. (A) Imagen macroscópica de fagos microencapsulados. (B) Imagen microscópica de fagos microencapsulados.
Parámetros óptimos de microencapsulación
El análisis ortogonal encontró que 1 g/100 mL XG, 2 g/100 mL SA, 2 g/100 mL CaCl2, y 0,6 g/100 ml de COS produjo la mejor eficiencia de encapsulación de 85,62 ± 2,14%. La menor eficiencia de microencapsulación fue de 24,12 ± 2,36% (Tabla 1).
La microencapsulación mejoró la estabilidad térmica de los fagos
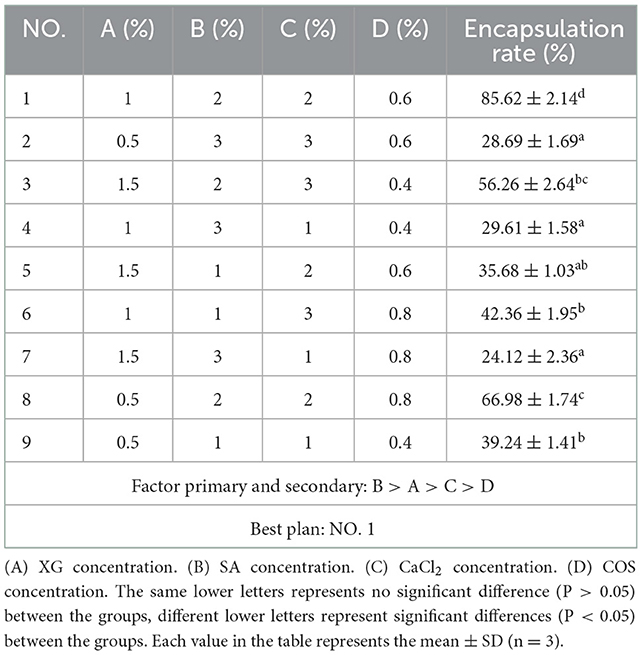
La comparación de actividad reveló que la microencapsulación mejoró la estabilidad de la temperatura de los fagos. A 10, 20 y 30 ° C, las actividades de los fagos libres y microencapsulados no mostraron diferencias, pero un aumento adicional de la temperatura (40-70 ° C) disminuyó sus actividades. Sin embargo, en comparación con los fagos libres, la actividad de los fagos microencapsulados se mantuvo mayor; a 70◦C, la actividad de los fagos libres fue de 2 log10UFP/ml (Figura 2A), mientras que el de los fagos microencapsulados fue de 6 log10UFP/g (p < 0,05) (Figura 2B). Estos datos indicaron que los fagos microencapsulados eran más resistentes a la temperatura que los fagos libres.
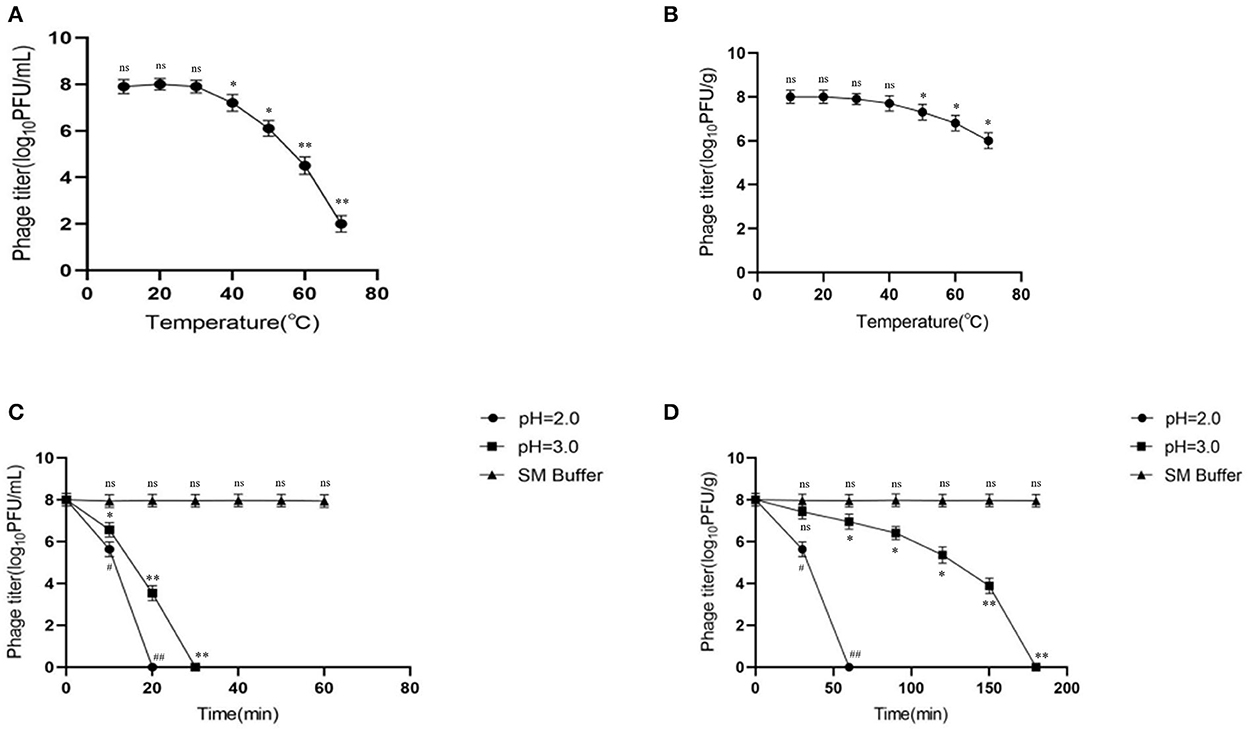 Figura 2. Estabilidad de fagos microencapsulados a diferentes temperaturas y SGF. (A) Efectos de diferentes temperaturas sobre el fago libre. (B) Efectos de diferentes temperaturas sobre fagos microencapsulados. (C) El efecto de SGF en fagos libres. (D) El efecto de SGF en fagos microencapsulados. ns representa significativamente lo mismo (P > 0,05); *representa significativamente los diferentes (P < 0,05); **representa significativamente los diferentes (P < 0,01); representa significativamente las diferencias (P < 0,05); representa significativamente el diferente (P < 0,01). Cada valor de la figura representa la media ± SD (n = 3).###
Figura 2. Estabilidad de fagos microencapsulados a diferentes temperaturas y SGF. (A) Efectos de diferentes temperaturas sobre el fago libre. (B) Efectos de diferentes temperaturas sobre fagos microencapsulados. (C) El efecto de SGF en fagos libres. (D) El efecto de SGF en fagos microencapsulados. ns representa significativamente lo mismo (P > 0,05); *representa significativamente los diferentes (P < 0,05); **representa significativamente los diferentes (P < 0,01); representa significativamente las diferencias (P < 0,05); representa significativamente el diferente (P < 0,01). Cada valor de la figura representa la media ± SD (n = 3).###
La microencapsulación mejoró la estabilidad gástrica de los fagos
Para determinar el efecto de la microencapsulación en la estabilidad gástrica de los fagos, los fagos microencapsulados se probaron en SGF. A pH 2.0 y 3.0, la actividad de los fagos libres disminuyó rápidamente alcanzando la inactivación a los 20 y 30 min, respectivamente (Figura 2C). Esto indicó una menor estabilidad gástrica (ambiente ácido) de los fagos libres. Curiosamente, la actividad de los fagos microencapsulados también disminuyó gradualmente, pero tardó más en alcanzar la inactivación que los fagos libres (60 y 180 min a pH 2.0 y 3.0, respectivamente) (Figura 2D). En general, estos datos indicaron que los fagos microencapsulados eran más estables en un ambiente ácido que los fagos libres. Además, no hubo cambios significativos en la actividad de los fagos libres y microencapsulados en el tampón SM.
Los fagos microencapsulados mostraron buena liberación en SIF
Las microesferas de fagos microencapsulados no solo deben mejorar la estabilidad gástrica, sino también permitir la liberación viable de fagos en el sitio deseado (por ejemplo, el intestino delgado). En consecuencia, probamos la liberación de fagos en SIF determinando la actividad de los fagos. Los resultados mostraron que la actividad de los fagos libres (que indica la tasa de liberación) no cambió significativamente en SIF y fue relativamente estable en el tiempo (Figura 3A). Cuando los fagos microencapsulados se colocaron en SIF, las microesferas comenzaron a hincharse y desintegrarse, y la velocidad de liberación se estabilizó después del efecto de explosión. El título de fagos aumentó gradualmente con el tiempo y después de 4 h se estabilizó (Figura 3B). Esto indica que todos los fagos microencapsulados fueron liberados en SIF.
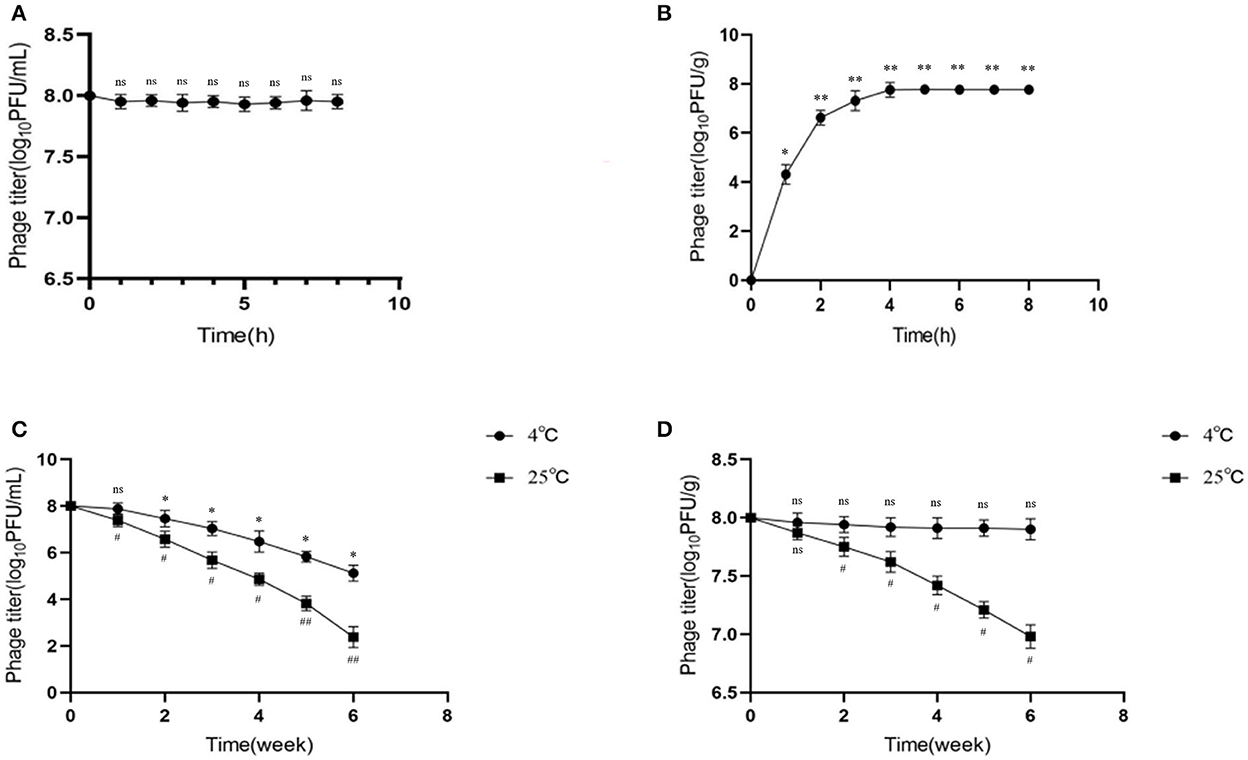 Figura 3. Comportamiento de liberación y estabilidad de almacenamiento de fagos microencapsulados en fluido intestinal simulado. (A) Estabilidad del fago libre en SIF. (B) Comportamiento de liberación de fagos microencapsulados en SIF. (C) Efectos de 4◦C y 25◦C sobre fagos libres. (D) Efectos de 4◦C y 25◦C sobre fagos microencapsulados. ns representa significativamente lo mismo (P > 0,05); *representa significativamente los diferentes (P < 0,05); **representa significativamente los diferentes (P < 0,01); representa significativamente las diferencias (P < 0,05); representa significativamente el diferente (P < 0,01). Cada valor de la figura representa la media ± SD (n = 3).###
Figura 3. Comportamiento de liberación y estabilidad de almacenamiento de fagos microencapsulados en fluido intestinal simulado. (A) Estabilidad del fago libre en SIF. (B) Comportamiento de liberación de fagos microencapsulados en SIF. (C) Efectos de 4◦C y 25◦C sobre fagos libres. (D) Efectos de 4◦C y 25◦C sobre fagos microencapsulados. ns representa significativamente lo mismo (P > 0,05); *representa significativamente los diferentes (P < 0,05); **representa significativamente los diferentes (P < 0,01); representa significativamente las diferencias (P < 0,05); representa significativamente el diferente (P < 0,01). Cada valor de la figura representa la media ± SD (n = 3).###
La microencapsulación mejoró la estabilidad de almacenamiento de los fagos
Una buena estabilidad de la temperatura de almacenamiento es necesaria para el almacenamiento a largo plazo y la aplicación de microesferas de fagos microencapsulados. En este estudio, se examinaron los fagos para determinar la estabilidad de almacenamiento a temperaturas de refrigeración (4 ° C) e incubación de la habitación (25 ° C). Los resultados mostraron que el título de fago libre disminuyó tanto a 4 como a 25◦C, en 2.88 y 5.62 log10UFP/ml, respectivamente (p < 0,05) (Figura 3C); la disminución fue más significativa a 25◦C. Por el contrario, la actividad de los fagos microencapsulados no cambió significativamente a 4◦C (p > 0,05), sino que disminuyó en 1,02 log10UFP/g a 25 ◦C (p < 0,05) (Figura 3D). Estos datos indicaron una mejor estabilidad de almacenamiento de fagos microencapsulados sobre fagos libres; 4◦C parece ser la buena temperatura de almacenamiento.
Cambios patológicos de órganos e intestinos en pollitos infectados con Salmonella
Los pollitos infectados con Salmonella mostraron síntomas obvios de salmonelosis. La necropsia mostró exudación fibrosa en la superficie del corazón (flecha azul), hígado agrandado, que era de color amarillo terroso, y lesión necrótica blanca grisácea (flecha amarilla) (Figura 4A). Hubo sangrado significativo en el intestino (flecha negra) (Figura 4B).
 Figura 4. Anatomía patológica de órganos e intestinos de pollitos infectados con Salmonella. (A) Anatomía patológica de los órganos. (B) Anatomía patológica del intestino. Flecha azul: exudación fibrosa en la superficie del corazón. Flecha amarilla: el hígado está hinchado, de color marrón amarillento, con focos necróticos de color blanco grisáceo. Flecha negra: hay manchas sangrantes obvias en el tracto intestinal.
Figura 4. Anatomía patológica de órganos e intestinos de pollitos infectados con Salmonella. (A) Anatomía patológica de los órganos. (B) Anatomía patológica del intestino. Flecha azul: exudación fibrosa en la superficie del corazón. Flecha amarilla: el hígado está hinchado, de color marrón amarillento, con focos necróticos de color blanco grisáceo. Flecha negra: hay manchas sangrantes obvias en el tracto intestinal.
La microencapsulación mejoró el efecto terapéutico de los fagos
Los fagos microencapsulados mostraron una mejor estabilidad de la temperatura, estabilidad gástrica, buena liberación de SIF y estabilidad de almacenamiento. A continuación, probamos su efecto terapéutico in vivo contra Salmonella en pollitos. Como se describe en la sección del método, los animales se dividieron en cuatro grupos: Grupo A (control: no infectados), Grupo B (infectados), Grupo C (infectados y tratados con fagos libres) y Grupo D (infectados y tratados con fagos microencapsulados). Desde S. Enteritidis invade principalmente el intestino, los intestinos de pollo (duodeno, yeyuno, íleon y tejidos colorrectales) de los respectivos grupos fueron examinados para el efecto terapéutico de los fagos. En comparación con el Grupo A, el número de colonización por Salmonella de las muestras de duodeno, yeyuno, íleon y colorrectal aumentó en 1,29, 1,13, 1,56 y 1,75 log10UFC/g en el Grupo B (p < 0,05). En comparación con el Grupo B disminuyó en 0,12, 0,13, 0,25 y 0,52 log10UFC/g después del tratamiento con fagos libres en el Grupo C (p < 0,05). En comparación con el Grupo B disminuyó en 0,55, 0,63, 0,66 y 1,24 log10UFC/g después del tratamiento con fagos microencapsulados en el Grupo D (p < 0,05). En comparación con el Grupo C disminuyó en 0,43, 0,50, 0,41 y 0,72 log10UFC/g tras tratamiento con fagos microencapsulados en el Grupo D (p < 0,05) (Figura 5). El efecto terapéutico del Grupo D es mejor que el del Grupo C. Estos resultados indicaron un mejor efecto terapéutico in vivo de los fagos microencapsulados contra la infección por Salmonella.
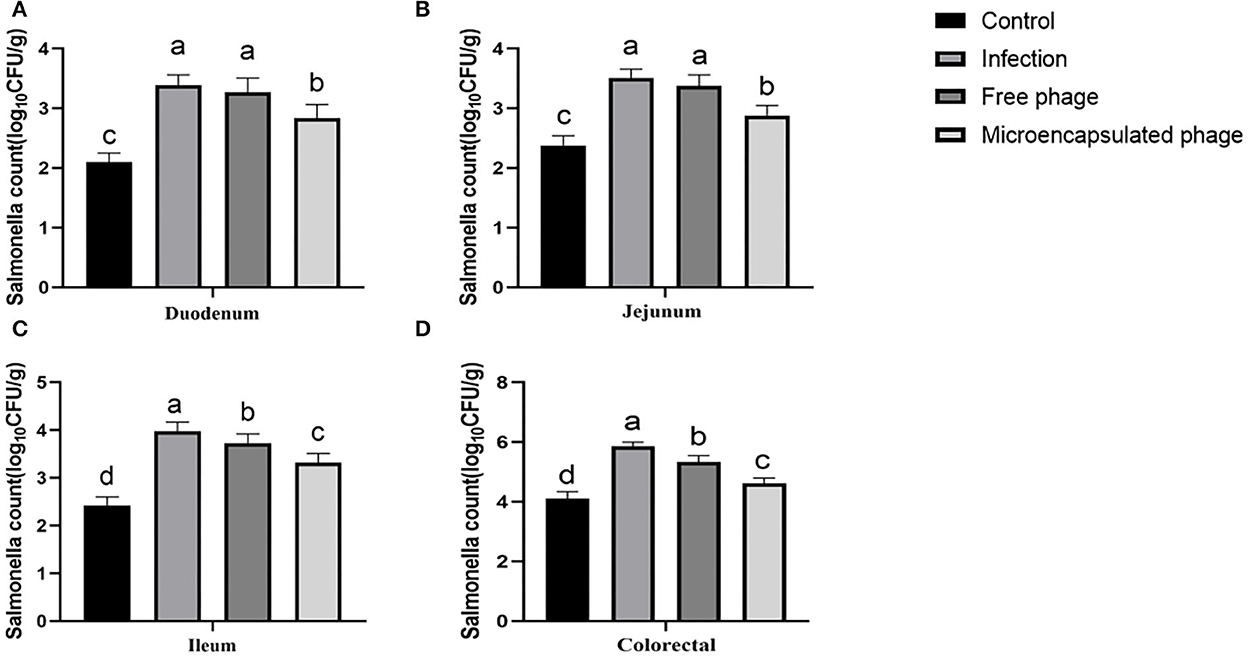 Figura 5. Efecto terapéutico de fagos microencapsulados en pollitos infectados. (A) Cambios en el número de colonización por Salmonella en el duodeno. (B) Cambios en el número de colonización por Salmonella en yeyuno. (C) Cambios en el número de colonización por Salmonella en íleon. (D) Cambios en el número de colonización por Salmonella en colorrectal. Las mismas letras inferiores no representan diferencia significativa (P > 0,05) entre los grupos, diferentes letras inferiores representan diferencias significativas (P < 0,05) entre los grupos. Cada valor de la figura representa la media ± SD (n = 3).
Figura 5. Efecto terapéutico de fagos microencapsulados en pollitos infectados. (A) Cambios en el número de colonización por Salmonella en el duodeno. (B) Cambios en el número de colonización por Salmonella en yeyuno. (C) Cambios en el número de colonización por Salmonella en íleon. (D) Cambios en el número de colonización por Salmonella en colorrectal. Las mismas letras inferiores no representan diferencia significativa (P > 0,05) entre los grupos, diferentes letras inferiores representan diferencias significativas (P < 0,05) entre los grupos. Cada valor de la figura representa la media ± SD (n = 3).
Discusión
La exposición a pH bajo, disolventes orgánicos, deshidratación y altas temperaturas puede dañar irreversiblemente los virus (34). Este estudio también mostró que la viabilidad de los fagos libres se perdió rápidamente después de la exposición al SGF. Por lo tanto, garantizar la estabilidad de los fagos es una consideración clave en el diseño de métodos eficientes de microencapsulación. Además, el proceso de microencapsulación debe emplear condiciones físicas suaves y utilizar materiales compatibles que no perjudiquen la actividad biológica de los fagos. Además, cuando el objetivo es entregar fagos vivos al intestino, el material encapsulante debe proteger a los fagos de los ácidos y enzimas presentes en el jugo gástrico y disolverse o hincharse fácilmente en medios intestinales débilmente alcalinos. El proceso de encapsulación en este estudio se realizó en un ambiente suave a base de agua y no redujo la viabilidad del fago. De acuerdo con un informe anterior sobre la encapsulación de probióticos (35), también logramos una alta eficiencia de carga de fagos del 85,62%. Cuando el CaCl2 Las gotitas se mezclaron con un medio de gel SA que contenía fagos, las gotitas formaron instantáneamente microesferas de gel formando una red tridimensional de alginato reticulado iónicamente. Además, nuestros fagos microencapsulados mostraron una excelente estabilidad cuando se almacenaron a 4 ° C. El alginato de espermina y el poli (D,L-lactida co glicólido) se han utilizado previamente para la microencapsulación del rotavirus, pero solo alrededor del 14 y el 30% de la cantidad inicial del virus pudo encapsularse, respectivamente (36). Por lo tanto, parece que la matriz de alginato de calcio (CA) es más adecuada para la encapsulación de fagos.
Los estudios han demostrado que el recubrimiento directo de fagos con SA no es un método ideal, y dicho recubrimiento da como resultado una baja eficiencia del envasado de fagos (37). Aquí, descubrimos que agregar XG mejoró efectivamente este fenómeno. XG tiene una buena estructura especial macromolecular y propiedades coloidales y se utiliza a menudo como material de microencapsulación (38). Microesferas preparadas a partir de SA y CaCl2 son propensos a los colas y a las formas irregulares (39). Con las buenas propiedades coloidales de XG, SA combinado con XG puede mejorar significativamente este problema y, por lo tanto, la eficiencia de encapsulación. SA, un polisacárido natural, tiene buena sensibilidad, biocompatibilidad y un proceso de emulsificación suave. A menudo se utiliza como material de recubrimiento y como agente terapéutico en el campo veterinario (40). El SA-CaCl2 el sistema puede realizar eficientemente la microencapsulación de fagos; SA reacciona con Ca2+ iones para formar el polímero CA, que tiene buena biodegradabilidad y biocompatibilidad. COS, los productos del procesamiento de quitosano, tienen buenas propiedades de compatibilidad, no toxicidad y formación de película (41). Los COS se utilizan a menudo como material formador de película y se han encontrado mejor que el quitosano. Después de que COS reaccione con CaCl2, fagos microencapsulados mejorando su estabilidad. Estos materiales de recubrimiento seleccionados son económicos, simples, fáciles de obtener y sin procesos de producción agresivos, lo que es adecuado para la producción industrial a gran escala.
Durante la microencapsulación, es importante controlar la concentración del material de recubrimiento. Una concentración de SA demasiado baja da como resultado una mezcla diluida. Por el contrario, una alta concentración de SA hace que la mezcla sea demasiado viscosa dificultando la formación de microesferas. La estabilidad del sistema puede disminuir después de la solución de SA mezclada con fagos. La combinación de SA-XG ayuda a formar microesferas de forma regular y mejora la eficiencia de encapsulación.
La técnica de microencapsulación para preparados biológicos está bien establecida (42). Yin et al. demostraron que la microencapsulación mejoró significativamente el tiempo de supervivencia ácida de los fagos, lo que es consistente con nuestros resultados (43). En este estudio, se utilizaron una variedad de materiales naturales con diferentes características en combinación, que superaron la deficiencia de fagos libres el efecto terapéutico antibacteriano. Aunque los fagos microencapsulados también se volvieron inactivos en SGF a pH 2.0 y 3.0, la microencapsulación prolongó efectivamente su tiempo de supervivencia en comparación con los fagos libres. La estabilidad térmica de los fagos libres es deficiente y son vulnerables a ambientes de alta temperatura, lo que no es propicio para el tratamiento y la preservación de los fagos libres (44). Demostramos que las microesferas de fagos microencapsulados tenían una mejor estabilidad térmica que los fagos libres. En particular, el título de fagos de las microesferas de fagos microencapsulados en agua desionizada permaneció sin cambios, lo que indica que no hay liberación en el agua desionizada. El gel de CA tiene propiedades sensibles al pH. En el ambiente gástrico ácido, los grupos carboxilo en las cadenas de azúcar de CA se protonan, y se produce un enlace de hidrógeno entre las cadenas de azúcar. Esto forma un gel de alginato insoluble en agua en la superficie de las microesferas, llamado cáscara de alginato. En el pH ácido, la estructura del gel CA no se hincha y protege los objetos incrustados del ácido gástrico y las enzimas digestivas; sin embargo, en un ambiente intestinal de pH neutro, el gel de CA se hincha y libera los objetos incrustados (45). Cuando los fagos microencapsulados se probaron para su liberación en SIF, no se liberaron completamente en poco tiempo. Esto puede deberse a que al principio solo una pequeña cantidad de partículas de fagos se desprendieron de la superficie de la microesfera. Sin embargo, en la etapa posterior, el material de recubrimiento de la microesfera reaccionó completamente con el líquido intestinal que condujo a un efecto de explosión, y todos los fagos se liberaron rápidamente. Para aplicaciones clínicas antibacterianas, los fagos deben sobrevivir al jugo gástrico y luego liberarse en el líquido intestinal. Demostramos que el material de recubrimiento químico elegido logró lo mismo y produjo microesferas de fagos microencapsuladas clínicamente efectivas.
Además, el efecto terapéutico in vivo de los fagos microencapsulados se probó contra la salmonelosis en pollitos. Los pollitos infectados con Salmonella fueron tratados con fagos libres y microencapsulados y luego se estimó la colonización por Salmonella a partir de los tejidos del tracto intestinal. Tanto los fagos libres como los fagos microencapsulados pueden reducir el número de colonización por Salmonella en el intestino del pollo. En comparación con los fagos libres, los fagos microencapsulados redujeron significativamente la infección por Salmonella en los pollitos, lo que indica su mayor eficiencia terapéutica antibacteriana. Ma et al. fagos microencapsulados mediante el uso de alginato de sodio, CaCl2 y quitosano. El experimento demostró que los fagos microencapsulados pueden tratar eficazmente la salmonelosis, lo que es consistente con los resultados de este experimento. La eficiencia de encapsulación de los fagos en este experimento es significativamente mayor que el experimento anterior (29). Yin et al. verificaron que los fagos libres y los fagos microencapsulados podrían reducir efectivamente la concentración bacteriana a través de experimentos in vivo en ratones, y el efecto de los fagos microencapsulados fue mejor que el de los fagos libres (43).
En conclusión, en comparación con el fago libre, XG-SA-CaCl2Las microesferas de fagos microencapsulados COS mostraron tasas de supervivencia significativamente mejoradas en condiciones gastrointestinales simuladas, y condiciones térmicas y de almacenamiento, y el fago microencapsulado puede liberar fagos en el fluido intestinal simulado. Más importante aún, su efecto terapéutico contra la salmonelosis también mejoró. El método de encapsulación actual puede mejorar la eficacia de los fagos para aplicaciones terapéuticas orales. Es posible que sea necesario trabajar en el futuro para explorar otros materiales de recubrimiento de superficies. Las microesferas fagas actuales permiten el almacenamiento a largo plazo de fagos encapsulados y su entrega directa al intestino protegiendo de las afecciones gástricas. La innovadora terapia con fagos microencapsulados puede ser una alternativa eficaz a los antibióticos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité Institucional de Cuidado y Uso de Animales y el Comité de Ética de Investigación Animal de la Universidad de Ingeniería de Hebei de China, el Esquema de Investigación es BER-YXY-2022027.
Contribuciones del autor
Conceptualización y redacción-revisión y edición: YS. Curación de datos: BZ y YW. Análisis formal: HH y XL. Investigación: FW y YZ. Supervisión: BZ y LH. Redacción—borrador original: BZ y YS. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este estudio fue apoyado por el Programa Clave de Investigación y Desarrollo de la Provincia de Hebei (20322904D) y la Fundación Provincial de Ciencias Naturales de Hebei (Número de subvención C2020402007).
Reconocimientos
Los autores desean agradecer a todos los revisores que participaron en la revisión, así como a otros miembros del equipo de YS.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.1101872/full#supplementary-material
Referencias
1. Xu H, Zhang W, Zhang K, Zhang Y, Wang Z, Zhang W, et al. Caracterización de los serotipos de Salmonella prevalentes en personas y pacientes asintomáticos. BMC Infect Dis. (2021) 21:632. DOI: 10.1186/S12879-021-06340-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Nair S, Patel V, Hickey T, Maguire C, Greig DR, Lee W, et al. Ensayo de PCR en tiempo real para la diferenciación de Salmonella tifoidea y no tifoidea. J Clin Microbiol. (2019) 57:E00167–19. doi: 10.1128/JCM.00167-19
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Powell MR, Crim SM, Hoekstra RM, Williams MS, Gu W. Patrones temporales en los principales serotipos de Salmonella en los Estados Unidos; 1996-2014. Epidemiol Infect. (2018) 146:437–41. doi: 10.1017/S0950268818000195
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Kurtz JR, Goggins JA, McLachlan JB. Infección por Salmonella: interacción entre la bacteria y el sistema inmune del huésped. Immunol Lett. (2017) 190:42–50. doi: 10.1016/j.imlet.2017.07.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Gut AM, Vasiljevic T, Yeager T, Donkor ON. Infección por Salmonella – prevención y tratamiento con antibióticos y levaduras probióticas: una revisión. Microbiología. (2018) 164:1327–44. doi: 10.1099/mic.0.000709
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Huang FC. Las interleucinas orquestan las respuestas inmunes de la mucosa a la infección por Salmonella en el intestino. Células. (2021) 10:3492. doi: 10.3390/celdas10123492
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Wemyss MA, Pearson JS. Respuestas de muerte de células huésped a la infección por Salmonella no tifoidea. Frente Immunol. (2019) 10:1758. doi: 10.3389/fimmu.2019.01758
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Wang L, Yan J, Niu H, Huang R, Wu S. Autofagia y ubiquitinación en la infección por Salmonella y las respuestas inflamatorias relacionadas. Las células frontales infectan microbiol. (2018) 8:78. DOI: 10.3389/fcimb.2018.00078
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Al KS, Al KA, Al NH. ¿Qué hay más allá de la gastroenteritis por Salmonella? Un caso de pancreatitis aguda que complica la infección por Salmonella en un niño: un informe de caso y revisión de la literatura. BMC Pediatr. (2021) 21:353. DOI: 10.1186/S12887-021-02814-W
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Lister SA. Infección por Salmonella enteritidis en pollos de engorde y reproductoras de pollos de engorde. Veterinario Rec. (1988) 123:350. DOI: 10.1136/VR.123.13.350
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. O’Brien JD. Infección por Salmonella enteritidis en pollos de engorde. Veterinario Rec. (1988) 122:214. DOI: 10.1136/VR.122.9.214-B
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Gast RK, Beard CW. Evaluación de un modelo de mortalidad de pollitos para predecir las consecuencias de las infecciones por Salmonella enteritidis en gallinas ponedoras. Poult Sci. (1992) 71:281–7. DOI: 10.3382/PS.0710281
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Suzuki S. Pathogenicity of Salmonella enteritidis in poultry. Int J Food Microbiol. (1994) 21:89–105. doi: 10.1016/0168-1605(94)90203-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Kortright KE, Chan BK, Koff JL, Turner PE. Terapia con fagos: un enfoque renovado para combatir las bacterias resistentes a los antibióticos. Microbio huésped celular. (2019) 25:219–32. doi: 10.1016/j.chom.2019.01.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Chang RYK, Wallin M, Lin Y, Leung SSY, Wang H, Morales S, et al. Terapia con fagos para infecciones respiratorias. Adv Drug Deliv Rev. (2018) 133: 76–86. doi: 10.1016/j.addr.2018.08.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Malik DJ, Sokolov IJ, Vinner GK, Mancuso F, Cinquerrui S, Vladisavljevic GT, et al. Formulación, estabilización y encapsulación de bacteriófagos para terapia con fagos. Adv Colloid Interface Sci. (2017) 249:100–33. doi: 10.1016/j.cis.2017.05.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Rehman S, Ali Z, Khan M, Bostan N, Naseem S. El amanecer de la terapia con fagos. Rev Med Virol. (2019) 29:e2041. doi: 10.1002/rmv.2041
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Lenneman BR, Fernbach J, Loessner MJ, Lu TK, Kilcher S. Enhancing phage therapy through synthetic biology and genome engineering. Curr Opin Biotechnol. (2021) 68:151–9. doi: 10.1016/j.copbio.2020.11.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Luong T, Salabarria AC, Edwards RA, Roach DR. Purificación estandarizada de bacteriófagos para terapia de fagos personalizada. Nat Protoc. (2020) 15:2867–90. DOI: 10.1038/S41596-020-0346-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Petsong K, Benjakul S, Vongkamjan K. Optimización del material de pared para la encapsulación de fagos mediante liofilización y eficacia antimicrobiana de fagos microencapsulados contra Salmonella. J Food Sci Technol. (2021) 58:1937–46. DOI: 10.1007/S13197-020-04705-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Javaudin F, Bémer P, Batard E, Montassier E. Impact of phage therapy on multidrug-resistant Escherichia coli intestinal carriage in a murine model. Microorganismos. (2021) 9:2580. doi: 10.3390/microorganismos9122580
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Petsong K, Benjakul S, Vongkamjan K. Evaluación de las condiciones de almacenamiento y eficiencia de un nuevo cóctel de fagos de Salmonella microencapsulado para controlar S. enteritidis y S. typhimurium in vitro y en alimentos frescos. Microbiol alimentario. (2019) 83:167–74. doi: 10.1016/j.fm.2019.05.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Lorenzo-Rebenaque L, Malik DJ, Catalá-Gregori P, Marin C, Sevilla-Navarro S. In vitro and in vivo gastrointestinal survival of non-encapsulated and microencapsulated Salmonella bacteriophages: implications for bacteriophage therapy in poultry. Productos farmacéuticos. (2021) 14:434. doi: 10.3390/ph14050434
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Saez AC, Zhang J, Rostagno MH, Ebner PD. Alimentación directa de bacteriófagos microencapsulados para reducir la colonización por Salmonella en cerdos. Foodborne Pathog Dis. (2011) 8:1269–74. DOI: 10.1089/FPD.2011.0905
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Lorenzo-Rebenaque L, Malik DJ, Catalá-Gregori P, Marin C, Sevilla-Navarro S. Gastrointestinal dynamics of non-encapsulated and microencapsulated Salmonella bacteriophages in broiler production. Animales. (2022) 12:144. doi: 10.3390/ani12020144
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Li J, Li Y, Ding Y, Huang C, Zhang Y, Wang J, et al. Caracterización de un nuevo bacteriófago de Salmonella T156 de Siphoviridae y su aplicación de microencapsulación en matriz alimentaria. Comida Res Int. (2021) 140:110004. doi: 10.1016/j.foodres.2020.110004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Wang J, Li J, Cui GL. El efecto de la mutación R91S en flic sobre la forma flagelar y la colonización de Salmonella enteritidis en ratones BALB/c. Acta Veterinaria y Zootecnia Sínica. (2022) 53:607–17. doi: 10.11843/j.issn.0366-6964.2022.02.027
28. Pelyuntha W, Ngasaman R, Yingkajorn M, Chukiatsiri K, Benjakul S, Vongkamjan K. Isolation and characterization of potential salmonella phages targeting multidrug-resistant and major serovars of salmonella derived from broiler production chain in Thailand. Microbiol frontal. (2021) 12:662461. DOI: 10.3389/fmicb.2021.662461
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Ma Y, Pacan JC, Wang Q, Xu Y, Huang X, Korenevsky A, et al. Microencapsulación del bacteriófago felix O1 en microesferas de quitosano-alginato para administración oral. Aplicación Environ Microbiol. (2008) 74:4799–805. doi: 10.1128/AEM.00246-08
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Perlemoine P, Marcoux PR, Picard E, Hadji E, Zelsmann M, Mugnier G, et al. Pruebas de susceptibilidad a fagos y determinación de títulos infecciosos a través del monitoreo sin lente de campo amplio del crecimiento de la placa de fagos. PLoS ONE. (2021) 16:E0248917. doi: 10.1371/journal.pone.0248917
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Malik DJ. Encapsulación de bacteriófagos mediante secado por atomización para terapia con fagos. Curr emite mol biol. (2021) 40:303–16. DOI: 10.21775/CIMB.040.303
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Wang X, Jia H, Gong H, Zhang Y, Mi R, Zhang Y, et al. Expresión y funcionalidad de genes alergénicos regulados por jugo gástrico simulado en Anisakis pegreffii. Parasitol Int. (2021) 80:102223. doi: 10.1016/j.parint.2020.102223
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Convención de la Farmacopea de los Estados Unidos. La Farmacopea de los Estados Unidos. 27ª ed. Rockville, MD: Convención de la Farmacopea de los Estados Unidos (2004). p. 2728.
34. Karayiannis P. Virus de la hepatitis B: virología, biología molecular, ciclo de vida y propagación intrahepática. Hepatol Int. (2017) 11:500–8. DOI: 10.1007/S12072-017-9829-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Navarro JB, Mashburn-Warren L, Bakaletz LO, Bailey MT, Goodman SD. Potencial probiótico mejorado de Lactobacillus reuteri cuando se administra como una biopelícula en microesferas dextranomer que contienen carga beneficiosa. Microbiol frontal. (2017) 8:489. DOI: 10.3389/fmicb.2017.00489
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Wang L, Yang S, Cao J, Zhao S, Wang W. Microencapsulación de aceite volátil de jengibre a base de complejo polielectrolito gelatina/alginato de sodio. Toro de farmacia química. (2016) 64:21–6. DOI: 10.1248/CPB.C15-00571
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Luong T, Salabarria AC, Roach DR. Terapia fágica en la era de la resistencia: ¿dónde estamos parados y hacia dónde vamos? Clin Ther. (2020) 42:1659–80. doi: 10.1016/j.clinthera.2020.07.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Shu G, He Y, Chen L, Song Y, Meng J, Chen H. Microencapsulation of Bifidobacterium bifidum BB01 by xanthan-chitosan: preparation and its stability in pure milk. Artif Cells Nanomed Biotechnol. (2018) 46:588–96. doi: 10.1080/21691401.2018.1431652
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Zhang R, Lei L, Song Q, Li X. Calcium ion cross-linking alginate/dexamethasone sodium phosphate hybrid hydrogel for extended drug release. Los coloides navegan por las biointerfaces B. (2019) 175:569–75. doi: 10.1016/j.colsurfb.2018.11.083
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Salachna P, Grzeszczuk M, Soból M. Effects of chitooligosaccharide coating combined with selected ionic polymers on the stimulation of ornithogalum saundersiae growth. Moléculas. (2017) 22:1903. doi: 10.3390/moléculas22111903
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Zhang X, Su L, Huang H, Jiang M, Liu S, Li Y, et al. El recubrimiento con quitooligosacáridos mejora la inducción de citoquinas de la cepa de vacuna basada en listeria ivanovii. J Pharm Sci. (2019) 108:2926–33. doi: 10.1016/j.xphs.2019.04.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Drozińska E, Kanclerz A, Kurek MA. Microencapsulación de aceite de espino cerval de mar con β-glucano de cebada como material de recubrimiento. Int J Biol Macromol. (2019) 131:1014–20. doi: 10.1016/j.ijbiomac.2019.03.150
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Yin H, Li J, Huang H, Wang Y, Qian X, Ren J, et al. Los fagos microencapsulados muestran una estabilidad prolongada en ambientes gastrointestinales y una alta eficiencia terapéutica para tratar la infección por Escherichia coli O157:H7. Vet Res. (2021) 52:118. DOI: 10.1186/S13567-021-00991-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Rosner D, Clark J. Formulaciones para la terapia con bacteriófagos y los usos potenciales de la inmovilización. Productos farmacéuticos. (2021) 14:359. DOI: 10.3390/PH14040359
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Xu C, Zeng X, Yang Z, Ji H. Efectos de protección solar mejorados a través del autoensamblaje capa por capa de quitosano/alginato de sodio/cloruro de calcio/EHA. Moléculas. (2022) 27:1148. doi: 10.3390/moléculas27031148
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Salmonella, fagos microencapsulados, compuestos, estabilidad, tratamiento
Cita: Zhang B, Wang Y, Wang F, Zhang Y, Hao H, Lv X, Hao L y Shi Y (2023) Compuestos de fagos microencapsulados con mayor estabilidad gastrointestinal para el tratamiento oral de la colonización por Salmonella en pollo. Frente. Vet. Sci. 9:1101872. doi: 10.3389/fvets.2022.1101872
Recibido: 18 de noviembre de 2022; Aprobado: 28 de diciembre de 2022;
Publicado: 11 enero 2023.
Editado por:
Kitiya Vongkamjan, Universidad de Kasetsart, Tailandia
Revisado por:
Rabindra Kumar Mandal, Universidad de Purdue Indianápolis, Estados Unidos
Wattana Pelyuntha, Universidad de Kasetsart, Tailandia
Derechos de autor © 2023 Zhang, Wang, Wang, Zhang, Hao, Lv, Hao y Shi. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Yuxiang Shi,  hbgcyzr@163.com
hbgcyzr@163.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía