Corpectomía y autoinjerto óseo de cresta ilíaca como tratamiento de un tumor de células plasmáticas vertebrales
Caso clínico: Corpectomía y autoinjerto óseo de cresta ilíaca como tratamiento de un tumor de células plasmáticas vertebrales en un perro salchicha
 Hannah R. Yoder*
Hannah R. Yoder*  Megan R. MacRae
Megan R. MacRae  Olivia M. Snead
Olivia M. Snead  Karl H. Kraus
Karl H. Kraus- Ciencias Clínicas Veterinarias, Facultad de Medicina Veterinaria, Universidad Estatal de Iowa, Ames, IA, Estados Unidos
Una perra salchicha esterilizada de 7 años y 7,5 kg se presentó en un hospital veterinario universitario después de haber sido remitida por cojera e incapacidad para orinar. El perro se presentó como parparético débilmente ambulatorio con la percepción del dolor intacta. Las imágenes de tomografía computarizada (TC) mostraron lisis ósea ventral y proliferación perióstica de la vértebra L3, compatible con un tumor de células plasmáticas. Se realizó una corpectomía de la vértebra L3 y posteriormente se estabilizó con duelas óseas autógenas cortico-esponjosas de la cresta ilíaca, hueso esponjoso autógeno y placas de bloqueo colocadas bilateralmente [String of Pearls (SOP), Orthomed]. El perro se recuperó bien, sin disminución del estado neurológico durante la noche, y continuó mejorando hasta el alta. Tras un nuevo examen a las 4 semanas después de la operación, el perro parecía neurológicamente mejorado con solo una leve ataxia propioceptiva ambulatoria de las extremidades traseras. Este caso demuestra que la transposición de un injerto óseo autógeno de cresta ilíaca no vascularizada con estabilización mediante placas SOP y tornillos puede utilizarse en el manejo de perros con tumores vertebrales de células plasmáticas y debe considerarse como una opción quirúrgica en casos afectados de manera similar.®®
1 Introducción
Los tumores vertebrales de células plasmáticas representan entre el 3 % y el 6 % de todos los tumores vertebrales en perros y pueden existir como un plasmocitoma solitario o como la enfermedad diseminada, el mieloma múltiple, y se ha informado que el primero tiene un mejor pronóstico (1, 2). En los seres humanos, el 50% de los plasmocitomas solitarios se convierten posteriormente en enfermedades diseminadas (3). Los tumores vertebrales de células plasmáticas pueden comprometer más de una vértebra, y a veces producen signos multifocales debido a la compresión de la médula espinal y a la inestabilidad vertebral secundaria. Estos signos pueden incluir hiperestesia espinal y déficits propioceptivos (4, 5). El diagnóstico de los tumores de células plasmáticas vertebrales se realiza mediante radiografía espinal, mielografía por TC y resonancia magnética (6). La radiografía se puede utilizar como una herramienta de detección de neoplasias vertebrales. Los cambios típicos incluyen lesiones líticas discretas y bien definidas sin esclerosis del hueso circundante (7). La TC se considera la modalidad de imagen de elección debido a su alta especificidad en la detección de lesiones óseas líticas, su utilidad en el proceso de estadificación y su capacidad para identificar el grado de afectación ósea (8). La hipercalcemia en la bioquímica sérica se observa a menudo junto con la lisis ósea en el diagnóstico por imagen (6). El diagnóstico de mieloma múltiple, a diferencia del plasmocitoma en perros, requiere que se cumplan dos o más de los siguientes criterios: evidencia radiográfica de lesiones osteolíticas; una biopsia de médula ósea con más del 5 % de células plasmáticas; gammapatía monoclonal en suero u orina; o proteinuria de cadenas ligeras (9).
Se propone la extirpación quirúrgica mediante corpectomía para algunos tumores vertebrales primarios y la citorreducción de tumores malignos (5). Durante una corpectomía, se extirpa la parte afectada del cuerpo vertebral. El hueso extirpado puede ser reemplazado por un espaciador hecho de polimetilmetacrilato o por un injerto que luego se ancla mediante construcciones de placas para estabilizar la médula espinal (2). La literatura cita aloinjertos femorales liofilizados, ilion, costilla y vértebras coxígeas como posibles fuentes de injertos óseos (2, 10-12). En neurocirugía humana, los autógrafos de la cresta ilíaca se utilizan en la cirugía de la columna cervical anterior y se ha informado que tienen las tasas de fusión más altas y las tasas de complicaciones más bajas en comparación con otros injertos (13). La estabilización de la columna vertebral no estabilizada después de la citorreducción de una neoplasia vertebral en humanos se considera paliativa, independientemente de la extensión de la enfermedad neoplásica. Esto se atribuye a la localización, irresecabilidad y potencial metastásico de los tumores vertebrales (14).
Este reporte tiene como objetivo describir el uso exitoso de un autoinjerto óseo de cresta ilíaca después de la extirpación de un tumor de células plasmáticas vertebrales mediante corpectomía en un perro.
2 Presentación del caso
2.1 Historia clínica
Un perro salchicha hembra esterilizado de 7 años y 7,5 kg con una puntuación de condición corporal de 5/9 se presentó a los Servicios de Emergencia de la Universidad Estatal de Iowa con un historial de 1 día de paraparesia y retención urinaria. Tres semanas antes, el perro fue tratado por el veterinario remitente por dolor de espalda y abdomen rígido con prednisona (0,6 mg/kg por vía oral cada 24 horas), gabapentina (5 mg/kg por vía oral cada 8-12 horas, aumentado a 10 mg/kg por vía oral cada 8-12 horas) y metocarbamol (1,5 mg/kg por vía oral cada 12 horas). Antes de la derivación, el paciente gozaba de buena salud.
2.2 Examen físico
Un examen neurológico reveló paresia leve de las extremidades posteriores al caminar e hiperestesia espinal lumbar a la palpación. Por lo demás, el examen clínico no tuvo nada de especial. El perro fue tratado con gabapentina (10 mg/kg por vía oral cada 8-12 horas), prednisona (0,6 mg/kg por vía oral cada 24 horas durante 5 días, luego 0,6 mg/kg cada 48 horas durante 10 días) y la recomendación de 4 a 6 semanas de reposo estricto en jaulas. A pesar de estos tratamientos, 4 días después, el perro se presentó en Cirugía Ortopédica de la Universidad Estatal de Iowa por la incapacidad de ponerse de pie el día anterior. Un examen neurológico reveló disminución de los reflejos propioceptivos en las extremidades pélvicas, que eran más exagerados en el lado izquierdo, hiperreflexia leve de los reflejos de las extremidades pélvicas, hiperestesia espinal en la región lumbar y dolor a la palpación del músculo iliopsoas. Se observó que el paciente tenía una puntuación de Frankel modificada de 2. El perro pudo pararse y orinar en ese momento. Un hemograma completo (CSC), un perfil bioquímico sérico y una SDMA no revelaron ninguna anomalía. El análisis de orina reveló proteinuria de 3+ y un peso específico de orina de 1,024. Un cociente proteína:creatinina (UPC) en orina de 9,34 indicó altos niveles de proteína en comparación con la creatinina, lo que confirma altos niveles de proteína en la orina del paciente no relacionados con la concentración urinaria. La electroforesis de proteínas de la orina reveló que la albúmina es la fuente de proteínas en la orina. No se apreció un pico monoclonal distintivo que sugiriera proteinuria de Bence-Jones.
2.3 Diagnóstico por imagen
Las radiografías de la columna toracolumbar revelaron un estrechamiento del espacio intervertebral T11-T12 en relación con los espacios discales adyacentes. No se identificó material de disco mineralizado. Hubo una reacción perióstica suave desde el margen ventral del cuerpo vertebral L3, así como un aumento de la opacidad mineral central con márgenes deficientes que fue compatible con la esclerosis. El cuerpo vertebral L3 tenía una lisis ligeramente apolillada y los márgenes laterales del canal espinal estaban mal marginados. La lisis no afectó a la lámina ni al pedículo de la vértebra (Figura 1). Se realizó una tomografía computarizada (TC) con un escáner Canon Aquilion de 16 cortes (TSX201A, Canon Medical Systems, Tustin, California). Las imágenes contiguas se reconstruyeron en planos transversal, coronal y sagital utilizando algoritmos óseos y de tejidos blandos antes y después de la administración intravenosa de 15 ml de contraste positivo para iohexol (Omnipaque, Penn Veterinary Supply Inc.). Las imágenes mostraban múltiples defectos hipoatenuantes punteados dentro del cuerpo vertebral L3 que se fusionaban caudalmente en una zona de lisis apolillado. Hubo una reacción perióstica esponjosa ventralmente, con múltiples regiones focales de pérdida cortical. En la exploración posterior al contraste, había una zona larga en forma de media luna de realce del contraste dentro del canal espinal ventral, dorsal a L3, lo que provocó una leve compresión extradural de la médula (Figura 2). Al día siguiente, el perro fue puesto bajo anestesia general para una biopsia ósea de la vértebra L3. Se obtuvieron dos muestras de aspirado con aguja fina (PAAF) de la vértebra L3 bajo guía fluoroscópica y se enviaron para citología. Se utilizó una aguja de Jamshidi para obtener tres biopsias óseas del cuerpo de la vértebra L3 después de confirmar primero la ubicación a través de una guía de alambre e imágenes de fluoroscopia. Las biopsias óseas revelaron una mezcla variable de huesos maduros y reactivos. En la histopatología no se observó una masa celular y no se pudo confirmar un proceso neoplásico.
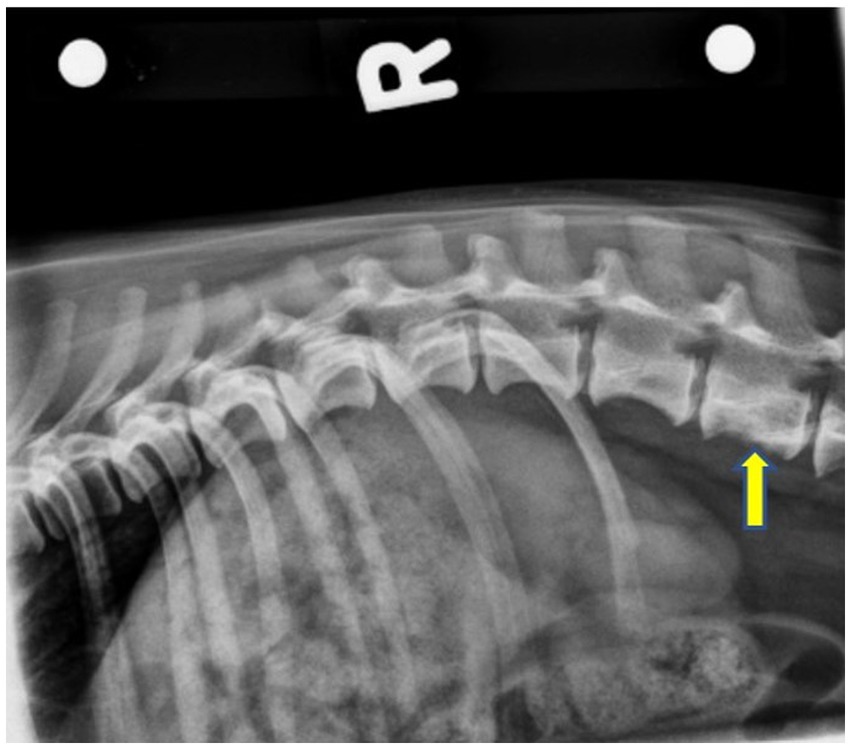 Figura 1. Radiografía preoperatoria lateral derecha que muestra una proliferación perióstica suave desde el margen ventral del cuerpo vertebral L3, así como un aumento mal definido de la opacidad mineral central. El cuerpo vertebral L3 tiene una lisis caudalmente ligeramente apolillada. La flecha amarilla indica L3.
Figura 1. Radiografía preoperatoria lateral derecha que muestra una proliferación perióstica suave desde el margen ventral del cuerpo vertebral L3, así como un aumento mal definido de la opacidad mineral central. El cuerpo vertebral L3 tiene una lisis caudalmente ligeramente apolillada. La flecha amarilla indica L3.
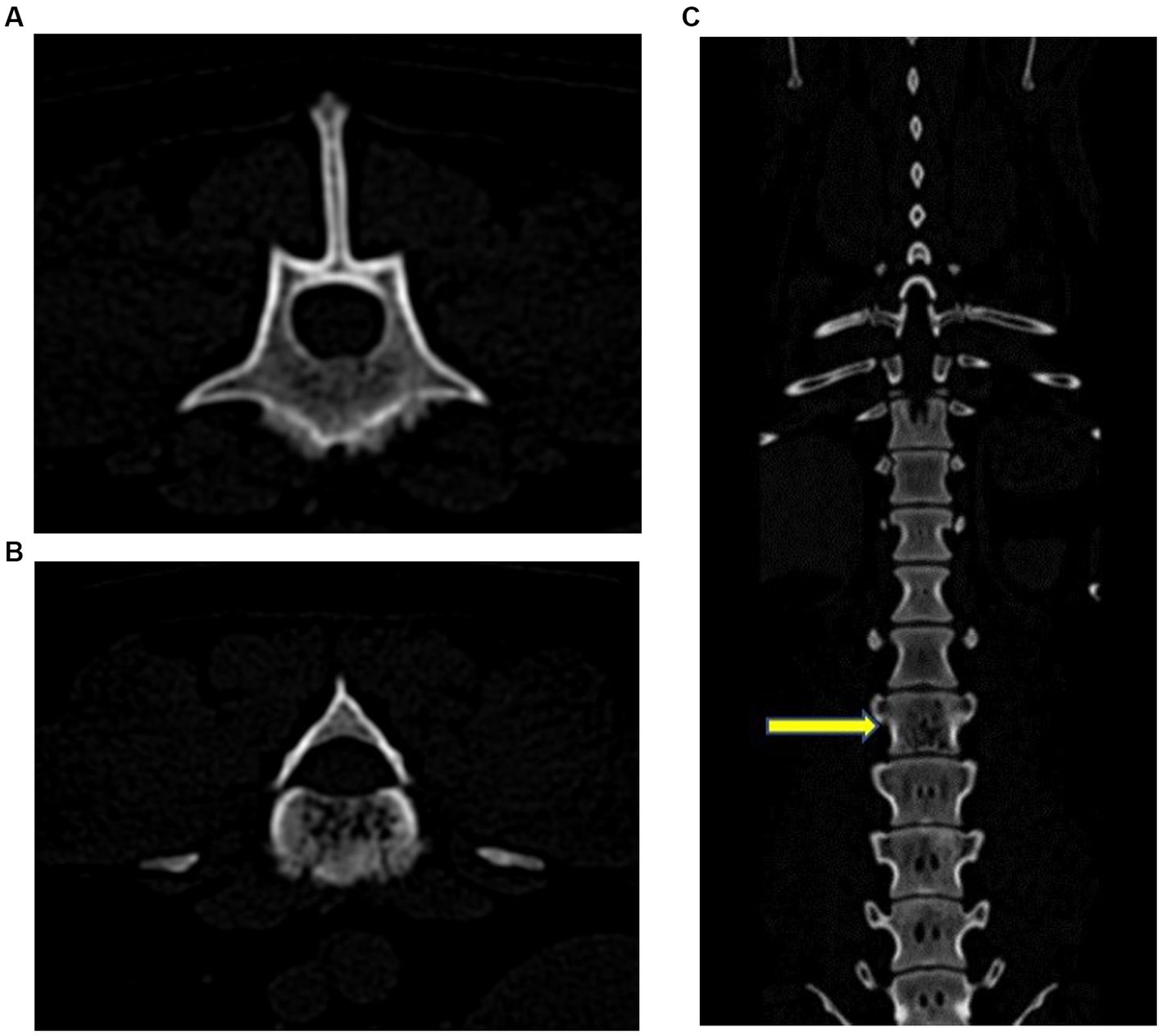
 Figura 2. Imágenes de TC transversales (A) y (B) y coronales (C). Había múltiples defectos hipoatenuantes punteados dentro del cuerpo vertebral L3 que se fusionaban caudalmente en una zona de lisis apolillado. Hubo una reacción perióstica esponjosa ventralmente, con múltiples regiones focales de pérdida cortical. La flecha amarilla indica L3.
Figura 2. Imágenes de TC transversales (A) y (B) y coronales (C). Había múltiples defectos hipoatenuantes punteados dentro del cuerpo vertebral L3 que se fusionaban caudalmente en una zona de lisis apolillado. Hubo una reacción perióstica esponjosa ventralmente, con múltiples regiones focales de pérdida cortical. La flecha amarilla indica L3.
2.4 Procedimiento quirúrgico
La cirugía para extirpar el cuerpo vertebral afectado se realizó 3 días después de la obtención de imágenes diagnósticas. El perro fue colocado bajo anestesia general de acuerdo con la preferencia del anestesiólogo, preparado para la cirugía y colocado en decúbito esternal. Se realizó una incisión justo dorsal a las alas del ilion sobre la cresta ilíaca izquierda, y se realizó una disección roma hasta el nivel de la espina ilíaca craneodorsal para recoger un injerto óseo autógeno. Se extirparon los tejidos blandos, los tejidos fibrosos y el fibrocartílago de la cresta ilíaca. Se utilizó una sierra oscilante para cortar el ala del ilion en tiras de 5 mm. A partir de entonces, se utilizó una cureta ósea para eliminar el hueso esponjoso del cuerpo del ilion. La cresta ilíaca, las duelas óseas corticoesponjosas y los injertos óseos esponjosos se guardaron para su uso posterior en el procedimiento. Se lavó la incisión y se cerró la capa hipodérmica con polidioxanona 3-0 (PDS, Ethicon) en un patrón continuo simple junto con grapas cutáneas. Este procedimiento se repitió entonces por vía contralateral. Una vez recuperados los injertos, se palparon los puntos de referencia vertebrales y costales, y se realizó un abordaje dorsal estándar de la columna lumbar. La incisión comenzó a nivel de T11 y se extendió hasta el nivel de L6, de aproximadamente 14 cm de longitud. La hemostasia se mantuvo con electrocauterización bipolar y hemostáticos. Se utilizó una hoja de bisturí #15 y tijeras Metzenbaum para incidir a través de los tejidos subcutáneos hasta el nivel de las apófisis espinosas dorsales, comenzando a lo largo de la línea media y moviéndose a lo largo del lado derecho de las apófisis espinosas dorsales. Los músculos epaxiales derechos se elevaron del hueso subyacente con un elevador perióstico Freer para exponer la lámina, las facetas articulares y los pedículos vertebrales. Las inserciones musculares epaxiales a las facetas articulares de esta región se eliminaron con tijeras curvas de Mayo y electrocauterización bipolar. Se utilizaron retractores Gelpi para maximizar la exposición al sitio quirúrgico. La localización se verificó mediante la palpación de la 13ª costilla y la apófisis transversa de L1. A continuación, se utilizó una pieza de mano neumática (Surgairtome Two-Powered Drill, Hall) para incidir el pedículo L3 izquierdo, ventral a las facetas. La disección de tejidos blandos se realizó lateral y ventral a la vértebra L3, intentando mantener una capa fascial fuera de la masa vertebral. La fibrosis anular de los discos intervertebrales L2 y L4 se hizo una incisión aguda con un bisturí de las placas terminales del disco adyacentes. El cuerpo de L3 se expuso desde el nivel de la faceta ventralmente y lo más lejos posible a través de la línea media. Se utilizaron Rongeurs para extirpar el resto del pedículo, la apófisis transversa, el anillo fibrosis y el cuerpo de la vértebra. Estos tejidos fueron sometidos a histopatología. Se utilizó una sonda con punta esférica para extirpar el endosteo y palpar la médula espinal. Se produjo una leve supuración de los senos venosos que se trató con succión intermitente. La hemostasia se logró con cauterización, ligadura y clips hemostáticos. Después de que se extirpó la mayor parte del pedículo vertebral y del cuerpo del lado izquierdo, las placas finales del defecto se escarificaron con una rebaba neumática. Se utilizó una placa de 10 orificios y 2,7 mm de collar de perlas (SOP®) para estabilizar el lado izquierdo. Un tornillo enganchó el cuerpo vertebral L1, dos engancharon el cuerpo vertebral L2, dos tornillos engancharon el cuerpo vertebral L4 y uno enganchó el cuerpo vertebral L5. El procedimiento se repitió en el lado derecho, retirando completamente la vértebra del nivel de la faceta ventralmente y manteniendo la mayor cantidad de tejidos blandos como sea posible. Se colocó una segunda placa a la derecha con idéntica colocación de tornillos, lo que resultó en un total de seis tornillos proximales y seis tornillos distales a la vértebra L3 extraída. Los sitios quirúrgicos izquierdo y derecho se lavaron minuciosamente, y el equipo quirúrgico cambió los guantes y la instrumentación. A partir de entonces, las secciones de las duelas de la cresta ilíaca se cortaron a medida y se colocaron en el defecto desde los lados izquierdo y derecho. Se utilizaron un total de cinco piezas de duela. A continuación, el injerto óseo esponjoso se empaquetó en cualquier defecto alrededor de las duelas corticoesponjosas. La fascia espinal dorsal se cerró con polidioxanona 3-0 (PDS, Ethicon) en un patrón continuo simple. La piel se cerró con poliglecaprona 3-0 (Monocryl, Ethicon) en un patrón de sutura intradérmica recubierto con grapas. Se realizaron radiografías laterales y dorsoventrales postoperatorias que mostraron la colocación del tornillo y la colocación del injerto óseo, como se muestra en la Figura 3. Se observó que el tornillo más proximal no encajaba en el cuerpo de L1. El resto de los tornillos se acoplaron adecuadamente a los cuerpos vertebrales. Se observó que la cara dorsal de las alas iliales era aplanada e irregular, lo que era consistente con la ostectomía. El paciente se recuperó sin complicaciones y fue trasladado a la UCI para su seguimiento nocturno.
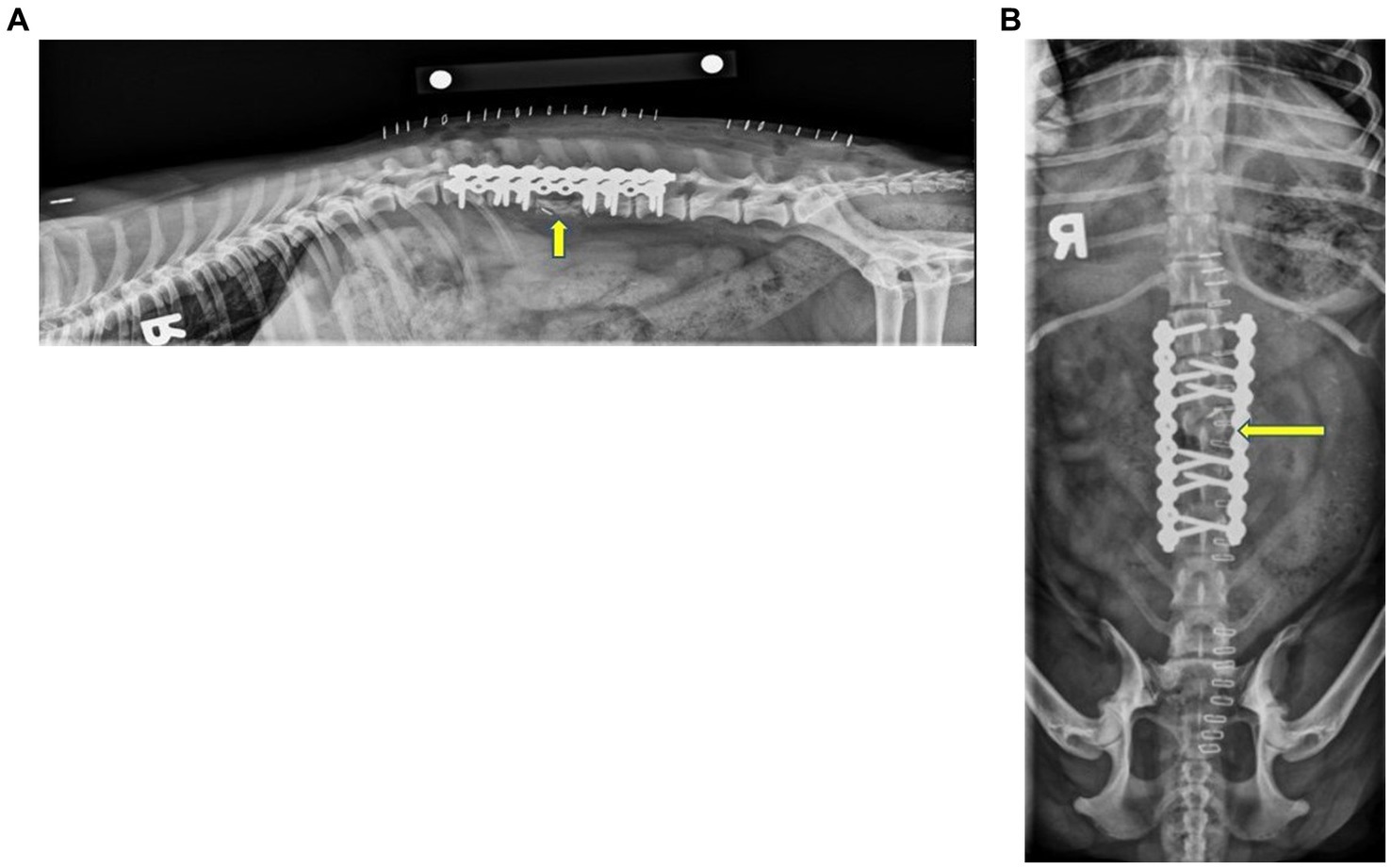 Figura 3. Postoperatorio inmediato radiografías laterales (A) y ventrodorsales (B) de columna toracolumbar. Las imágenes muestran que las dos placas de collar de perlas (SOP) de 10 orificios se aplicaron en los aspectos dorsolaterales derecho e izquierdo de los cuerpos vertebrales. Obsérvese que el primer tornillo de la placa izquierda no se enganchó en la corteza de L1. Esta configuración dio como resultado que un tornillo enganchara el cuerpo de L1, cuatro en los cuerpos de L2 y L4, y dos tornillos que engancharan el cuerpo de L5. Las facetas articulares y la apófisis espinosa de L3 permanecieron en la localización adecuada y permanecieron estáticas. Se superpuso un hemoclip metálico sobre el canal espinal sobre la proyección ventrodorsal a nivel de L3 craneal. Había un hueso nuevo curvilíneo de forma irregular donde se extirpó el cuerpo de L3. La cara dorsal de las alas ilíacas era irregular con márgenes irregulares aplanados, compatible con la ostectomía. La flecha amarilla indica L3.®
Figura 3. Postoperatorio inmediato radiografías laterales (A) y ventrodorsales (B) de columna toracolumbar. Las imágenes muestran que las dos placas de collar de perlas (SOP) de 10 orificios se aplicaron en los aspectos dorsolaterales derecho e izquierdo de los cuerpos vertebrales. Obsérvese que el primer tornillo de la placa izquierda no se enganchó en la corteza de L1. Esta configuración dio como resultado que un tornillo enganchara el cuerpo de L1, cuatro en los cuerpos de L2 y L4, y dos tornillos que engancharan el cuerpo de L5. Las facetas articulares y la apófisis espinosa de L3 permanecieron en la localización adecuada y permanecieron estáticas. Se superpuso un hemoclip metálico sobre el canal espinal sobre la proyección ventrodorsal a nivel de L3 craneal. Había un hueso nuevo curvilíneo de forma irregular donde se extirpó el cuerpo de L3. La cara dorsal de las alas ilíacas era irregular con márgenes irregulares aplanados, compatible con la ostectomía. La flecha amarilla indica L3.®
2.5 Cuidados postoperatorios
El paciente se recuperó de la anestesia sin complicaciones y fue paraparetico ambulatorio al día siguiente. Al paciente se le asignó un MFS de 2 en este momento. Dos días después de la operación, el perro fue trasladado al servicio de rehabilitación de ISU. Al alta, 6 días después de la operación, el perro estaba ambulatorio sin ataxia evidente. El examen neurológico en el momento del alta se consideró dentro de los límites normales, con solo hiperestesia espinal leve presente y una MFS de 1. Los hallazgos histopatológicos se recibieron 2 semanas después de la cirugía y fueron compatibles con una neoplasia de células plasmáticas. La quimioterapia se discutió con los propietarios en ese momento, pero se rechazó debido a la falta de signos clínicos del paciente.
2.6 Volver a comprobar el examen
En el examen de seguimiento 1 mes después de la cirugía, el perro caminaba con solo una leve ataxia propioceptiva ambulatoria de las extremidades posteriores y un MFS de 2. El paciente orinaba y defecaba con normalidad cuando se le observó. Dos meses después de la cirugía, el perro acudió a los Servicios de Emergencia de la Universidad Estatal de Iowa debido a un dolor y malestar abdominal o lumbar generalizado que aumentó en intensidad durante 2 semanas. El perro estaba clínicamente dentro de los límites normales y se le administraron líquidos y manejo del dolor. El perro fue trasladado a los Servicios Oncológicos de la Universidad Estatal de Iowa para una evaluación adicional. Las radiografías de la columna vertebral no mostraron evidencia de fracaso o aflojamiento del implante en este momento, y no se apreció evidencia de lisis ósea. En este momento se observó la integración ósea del autoinjerto cortico-esponjoso (Figura 4). No se atribuyeron anomalías al injerto o implante en este momento. El perro fue enviado a casa con gabapentina (6,6 mg/kg VO cada 8-12 h), Metacam (0,2 mg/kg VO cada 24 h) y un parche de fentanilo (25 mcg). Se observó que el perro mejoró con este manejo conservador. El perro acudió a otro veterinario 4 meses después de la cirugía debido a dolor abdominal. La bioquímica sérica mostró hipoalbuminemia, hipoglucemia limítrofe, FA elevada, azotemia y anemia leve. En ese momento se recomendaban tomografías computarizadas y radiografías, pero los propietarios optaron por la eutanasia humanitaria.
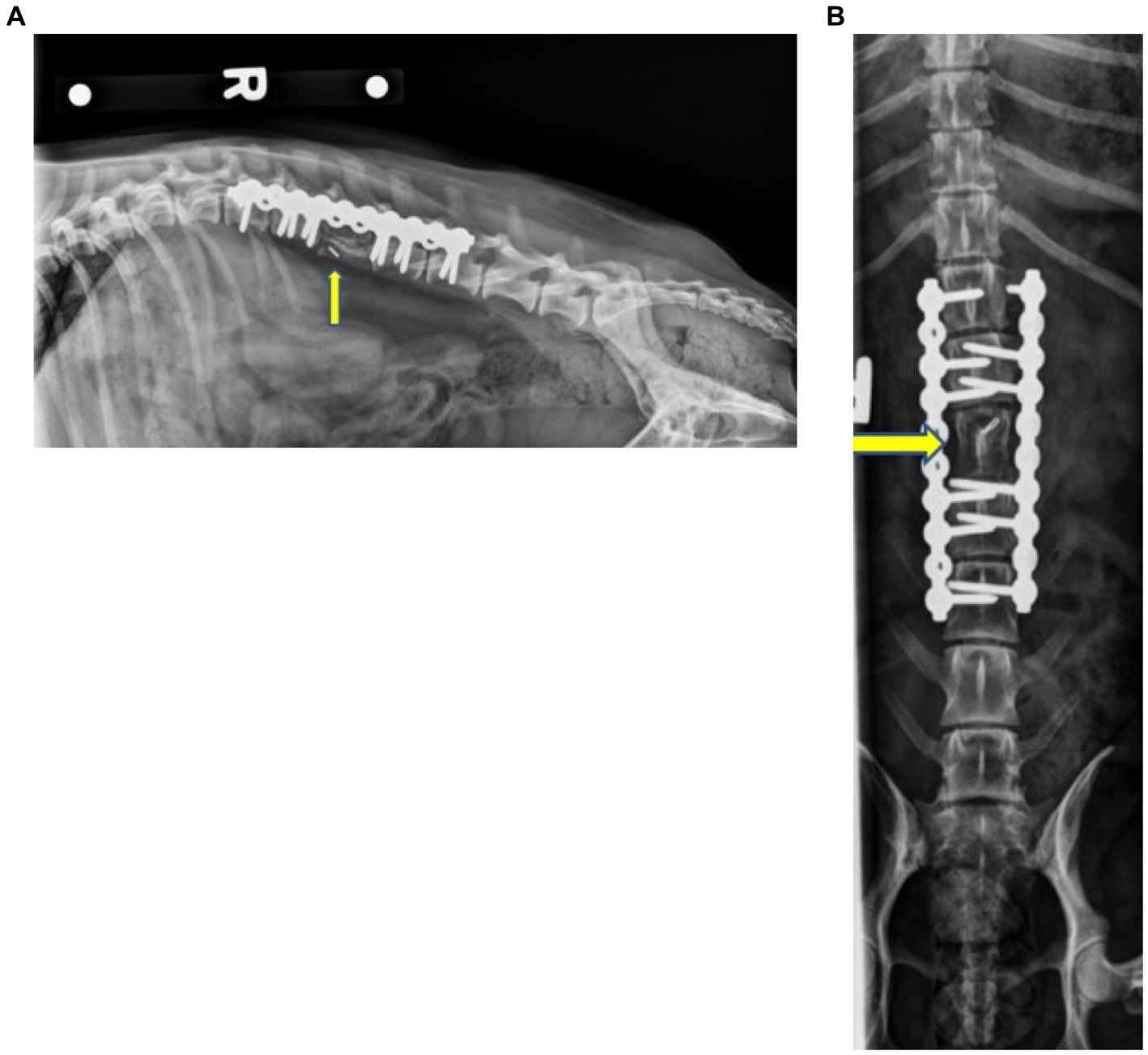 Figura 4. Radiografías laterales derechas (A) y ventrodorsales (B) de columna toracolumbar a los 2 meses del postoperatorio que muestran la corpectomía estática L3 con la estabilización de la columna mediante dos placas SOP y tornillos asociados. No se observaron evidencias de fracaso/aflojamiento del implante. La opacidad mineral en la localización de L3, así como la ostectomía de las alas ilíacas, fue compatible con un injerto óseo de remodelación. Las flechas amarillas indican L3.®
Figura 4. Radiografías laterales derechas (A) y ventrodorsales (B) de columna toracolumbar a los 2 meses del postoperatorio que muestran la corpectomía estática L3 con la estabilización de la columna mediante dos placas SOP y tornillos asociados. No se observaron evidencias de fracaso/aflojamiento del implante. La opacidad mineral en la localización de L3, así como la ostectomía de las alas ilíacas, fue compatible con un injerto óseo de remodelación. Las flechas amarillas indican L3.®
3 Discusión
Los tumores de células plasmáticas vertebrales solitarias rara vez se presentan en perros, y representan solo el 3-6% de todos los tumores vertebrales (1, 2). Sin embargo, su rareza no disminuye su importancia, ya que los plasmocitomas óseos solitarios pueden representar una etapa temprana del mieloma múltiple (2). Hasta donde saben los autores, este caso clínico es el primero en describir el uso de un injerto óseo corticoesponjoso extraído de la cresta ilíaca después de una corpectomía para extirpar un tumor de células plasmáticas vertebrales en un perro. En casos previamente reportados se han utilizado injertos de grasa libre o membranas de celulosa para rellenar defectos óseos después de la corpectomía (15-18). Sin embargo, los injertos de grasa libre se han asociado con déficits neurológicos y compresión de la médula espinal (19). Los productos de malla de celulosa pueden reducir la formación de hematomas epidurales; Sin embargo, se ha descubierto que estos productos causan un extenso tejido cicatricial que se adhiere a la duramadre y a las raíces nerviosas (20). Se han reportado aloinjertos ilíacos, pero no se utilizaron en este caso debido a la falta de propiedades de incorporación directa a través de la osteoconducción en comparación con la remodelación, incorporación y osteogénesis más completas de los autoinjertos de Havers (9, 21). Aunque el hueso esponjoso autógeno todavía se considera el material de injerto preeminente, el autoinjerto puede estar limitado por la cantidad de hueso esponjoso recuperable (22). La ventaja propuesta de utilizar un injerto óseo ilíaco es que los autoinjertos óseos corticales mantienen la resistencia estructural y confieren una histocompatibilidad completa, a la vez que poseen potenciales de cicatrización osteogénicos (23). Los osteoblastos totalmente diferenciados y las células madre indiferenciadas que componen el autoinjerto ilíaco, combinados con la matriz y las señales proporcionadas por los trozos óseos, producen una mezcla que conduce a la formación ósea reproducible cuando se colocan en el sitio quirúrgico (21). Además, las tasas de incorporación del injerto y el tiempo de fusión generalmente se consideran excelentes para la cresta ilíaca (24).
En este caso, no se inició la quimioterapia porque no había signos de enfermedad sistémica o local y el análisis de sangre estaba dentro de los límites normales en la repetición del control a los 2 meses. En ese momento, los implantes estaban estables y se observó la integración de las duelas óseas corticoesponjosas. En este caso, se utilizaron las placas óseas SOP® para evitar el riesgo de fallo de la fijación. En este estudio se utilizó la placa String of Pearls debido a su construcción de placa de bloqueo, que se ha asociado con una disminución del fracaso del implante (25). Además, se ha observado que la placa SOP® tiene mayores cargas finales y de falla en comparación con las placas acetabulares veterinarias o las construcciones de tornillo/alambre/polimetilmetacrilato (26).
4 Conclusión
Este informe detalla el manejo de un perro con un tumor de células plasmáticas vertebrales, donde el defecto después de la corpectomía se rellenó con un autoinjerto óseo de cresta ilíaca no vascular. Descubrimos que era relativamente fácil acceder a la cresta ilíaca, y la forma del hueso se consideró adecuada para el propósito. Las imágenes postoperatorias confirmaron que la placa y los tornillos permanecieron radiográficamente inalterados y estables un mes después de la cirugía. Aunque el perro experimentó signos clínicos de deterioro 2 meses después de la cirugía, estos síntomas se asociaron con signos gastrointestinales graves. En conclusión, hemos descrito el manejo quirúrgico de un tumor de células plasmáticas vertebrales de la vértebra L3. La transposición de un injerto óseo autógeno ilíaco no vascularizado estabilizado con una placa de bloqueo SOP y tornillos puede considerarse una opción quirúrgica en casos afectados de manera similar.®
Entre las limitaciones de este informe se encuentran el caso único y su carácter retrospectivo. Se necesitan más estudios prospectivos y evaluaciones biomecánicas de esta técnica para corroborar lo que demostró este caso. Además, la evaluación de la interfase ósea de los autoinjertos y los sitios defectuosos después de la cirugía mediante TC podría proporcionar resultados más profundos. Las posibles deficiencias de este enfoque incluyen el costo asociado con los procedimientos diagnósticos y quirúrgicos, la dependencia del tamaño del paciente y el riesgo de daño iatrogénico a la médula espinal.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió revisión ética ni aprobación para el estudio con animales de acuerdo con la legislación local y los requisitos institucionales. El propietario de este paciente había firmado un formulario de consentimiento general para dar a conocer los detalles de este caso para su uso en la investigación, ya que el paciente fue remitido a un hospital universitario de la facultad de veterinaria.
Contribuciones de los autores
HY: Escritura – borrador original. MM: Escritura – revisión y edición. OS: Escritura – revisión y edición. KK: Escritura – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Los autores desean agradecer a Stephanie Canon por obtener las imágenes de tomografía computarizada necesarias para este informe.
Conflicto de intereses
KK tiene un interés financiero en el implante utilizado en este caso.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Liu, SK, Dorfman, HD, Hurvitz, AI y Patnaik, AK. Tumores óseos primarios y secundarios en el perro. J Pequeña Anim Pract. (1997) 18:313–26. doi: 10.1111/j.1748-5827.1977.tb05890
2. Sharp, NJH, y Wheeler, SJ. Trastornos de la columna vertebral de pequeños animales. Londres, Inglaterra: Mosby-Wolfe (1994). 249 págs.
3. Rusbridge, C, Wheeler, SJ, Lamb, CR, Page, RL, Carmichael, S, Brearley, MJ, et al. Tumores vertebrales de células plasmáticas en 8 perros. J Veterinario Pasante Med. (2008) 13:126–33. doi: 10.1111/j.1939-1676.1999.tb01140
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. McLain, RF, y Weinstein, JN. Plasmocitomas solitarios de la columna vertebral: revisión de 84 casos. J Disord espinal. (1989) 2:69??? 74–4. doi: 10.1097/00002517-198906000-00001
5. Lorenz, MD, Coates, JR y Kent, M. Manual de neurología veterinaria. 5ª ed. St. Louis (Missouri: Saunders, un sello de Elsevier Inc.): Elsevier Saunders; C2012. Capítulo 6, Paresia, parálisis o ataxia de las extremidades pélvicas; (2012). págs. 109-161.
6. Platt, SR, y Olby, NJ. Manual BSAVA de neurología canina y felina. 3ª ed. Quedgeley, Inglaterra: Asociación Británica de Veterinarios de Pequeños Animales (2004). 318 págs.
7. Jaggy, A, and Platt, SR. Small animal neurology: An illustrated text. Hannover, Germany: Schlutersche (2010). 117 p.
8. Hõim, S, Fitzgerald, E, Mapletoft, E, and Purzycka, K. Computed tomographic findings in dogs with multiple myeloma. Vet Med Sci. (2023) 9:660–9. doi: 10.1002/vms3.1019
9. Hanna, F. Multiple myelomas in cats. J Feline Med Surg. (2005) 7:275–87. doi: 10.1016/j.jfms.2004.12.005
10. Lukash, FN, Tenenbaum, NS, and Moskowitz, G. Long-term fate of the vascularized iliac crest bone graft for mandibular reconstruction. Am J Surg. (1990) 160:399–401. doi: 10.1016/S0002-9610(05)80552-5
11. Daniel, RK. Free rib transfer by microvascular anastomoses. Plast Reconstr Surg. (1977) 59:737–8. doi: 10.1097/00006534-197705000-00020
12. Yeh, LS, and Hou, SM. Repair of a mandibular defect with a free vascularized coccygeal vertebra transfer in a dog. Vet Surg. (1994) 23:281–5. doi: 10.1111/j.1532-950X.1994.tb00483
13. Epstein, NE. Iliac crest autograft versus alternative constructs for anterior cervical spine surgery: pros, cons, and costs. Surg Neurol Int. (2012) 3:143–56. doi: 10.4103/2152-7806.98575
14. Chauvet, AE, Hogge, GS, Sandin, JA, and Lipsitz, D. Vertebrectomy, bone allograft fusion, and antitumor vaccination for the treatment of vertebral Fibrosarcoma in a dog. Vet Surg. (2004) 28:480–8. doi: 10.1111/j.1532-950X.1999.00480
15. O’Malley, NT, and Kates, SL. Advances on the Masquelet technique using a cage and nail construct. Arch Orthop Trauma Surg. (2011) 132:245–8. doi: 10.1007/s00402-011-1417-z
16. Reinisch, KB, Zuk, G, Raptis, DA, Bueter, M, Guggenheim, M, Stasch, T, et al. Lipotransferencia autóloga para defectos óseos secundarios a osteomielitis: reporte de un método novedoso y revisión sistemática de la literatura. Herida int J. (2020) 16:916–24. doi: 10.1111/iwj.13119
17. Elliott, RC, Moon, C, Zeiler, G y Lobetti, R. Resultados clínicos a corto plazo de 220 perros con discopatía toracolumbar tratados mediante minihemilaminectomía. J S Afr Vet Assoc. (2020) 91:e1–8. doi: 10.4102/jsava.v91i0.2008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Bismuto, C, Ferrand, FX, Millet, M, Buttin, P, Fau, D, Cachon, T, et al. Tratamiento quirúrgico original de quistes subaracnoideos toracolumbares en seis perros condrodistróficos. Acta Vet Scand. (2014) 56:32. doi: 10.1186/1751-0147-56-32
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. da Costa, RC, Pippi, NL, Graça, DL, Fialho, SA, Alves, A, Groff, AC, et al. Los efectos del injerto de grasa libre o los implantes de membrana de celulosa en la formación de membranas de laminectomía en perros. Veterinario J. (2006) 171:491–9. doi: 10.1016/j.tvjl.2004.12.011
20. Fingeroth, JM, y Thomas, WB. Avances en la discopatía intervertebral en perros y gatos. Iowa: Colegio Americano de Cirujanos Veterinarios y Wiley-Blackwell (2015). 256 págs.
21. Laurencin, C, Khan, Y y El-Amin, SF. Sustitutos de injertos óseos. Experto Rev Med Devices. (2006) 3:49–57. doi: 10.1586/17434440.3.1.49
22. Younger, EM, y Chapman, MW. Morbilidad en los sitios donantes de injertos óseos. J Traumatismo ortopédico. (1989) 3:192–5. doi: 10.1097/00005131-198909000-00002
23. Roberts, TT, y Rosenbaum, AJ. Injertos óseos, sustitutos óseos y productos ortobiológicos: el puente entre la ciencia básica y los avances clínicos en la curación de fracturas. Organogénesis. (2012) 8:114–24. doi: 10.4161/org.23306
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Vaz, K, Verma, K, Protopsaltis, T, Schwab, F, Lonner, B y Errico, T. Opciones de injerto óseo para la cirugía de la columna lumbar: una revisión que examina la eficacia clínica y las complicaciones. SASJ. (2010) 4:75–86. doi: 10.1016/j.esas.2010.01.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Petrovsky, B, Knuth, T, Aponte-Colón, C, Hoefle, W, Kraus, K, Naiman, J, et al. Resultados a corto plazo de 59 perros tratados por fracturas del cuerpo ilial con placas de bloqueo o no de bloqueo. Cirugía veterinaria. (2021) 50:1076–86. doi: 10.1111/vsu.13656
26. Blakely, JA, Butler, JR, Priddy, LB, McCabe, EM, Avendaño, JN, Elder, SH, et al. Comparación biomecánica ex vivo de una placa de collar de perlas de 2,7 mm frente a una fijación compuesta de tornillo/alambre/polimetilmetacrilato y una placa acetabular veterinaria de 2,7 mm para la reparación de fracturas acetabulares caninas simuladas. BMC Vet Res. (2019) 15:287. doi: 10.1186/s12917-019-2024-4
Palabras clave: ilion, autoinjerto, corpectomía, célula plasmática, mieloma múltiple, reporte de caso
Cita: Yoder HR, MacRae MR, Snead OM y Kraus KH (2023) Informe de caso: Corpectomía y autoinjerto óseo de cresta ilíaca como tratamiento para un tumor de células plasmáticas vertebrales en un perro salchicha. Frente. Vet. Sci. 10:1281063. doi: 10.3389/fvets.2023.1281063
Recibido: 21 de agosto de 2023; Aceptado: 20 de noviembre de 2023;
Publicado: 11 diciembre 2023.
Editado por:
Gerardo Fatone, Universidad de Nápoles Federico II, Italia
Revisado por:
Ross Elliott, Universidad de Pretoria, Sudáfrica
Amani Hassan, Universidad McGill, Canadá
Lauren K. Dobson, Universidad de Texas A y M, Estados Unidos
Derechos de autor © 2023 Yoder, MacRae, Snead y Kraus. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Hannah R. Yoder, hryoder@iastate.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía