Deparasitación responsable del ganado
Deparasitación responsable del ganado
Neil Sargison discute los principios de control, así como los desafíos frente a la adaptación de la lombriz intestinal gastrointestinal y la adaptación de la lombriz pulmonar.
- Este artículo fue publicado originalmente en Vet Times 49.36 (9 de septiembre de 2019).
Los nematodos gastrointestinales y los gusanos pulmonares son las principales causas de pérdida de producción en el ganado, dondequiera que las condiciones climáticas estacionalmente cálidas y húmedas, y la gestión agrícola, proporcionen diversas oportunidades para la supervivencia y el desarrollo de sus etapas de vida libre, y la finalización de los ciclos de vida parásitos.
Su impacto, que resulta en muertes de animales, diarrea, enfermedades respiratorias, reducción de la producción de leche y derrocha, es mayor bajo sistemas intensivos de gestión pastoral que conducen a altos niveles de desafío larvario infeccioso.
Por lo tanto, el control de estos parásitos es un requisito previo para una producción ganadera eficiente, y ofrece un método pragmático de compromiso con los agricultores comerciales sobre el tema más amplio de la mejora de la eficiencia de la producción a través de la gestión planificada de la salud animal.
¿Cómo se aplican los principios del control de gusanos al ganado británico e irlandés?
La principal especie de nematodos gastrointestinales que causan enfermedades y pérdida de producción en el ganado mantenido en ambientes templados es Ostertagia ostertagi; mientras que los parásitos de nematodos pertenecientes a los géneros Cooperia, Trichostrongylus, Haemonchus y Nematodirus pueden ser importantes en escenarios específicos.
O ostertagi es específico del huésped para los bívidos y causa patología al evocar las respuestas inmunitarias del huésped, principalmente a medida que las etapas larvarias invaden o dejan las glándulas abomasales.
El gusano pulmonar es causado por Dictyocaulus viviparus que evoca respuestas de hipersensibilidad del huésped a medida que las etapas parasitarias migran a través de los pulmones, antes de residir en las principales vías respiratorias.
La inmunidad protectora del huésped requiere exposición a larvas infecciosas (L3) en particular, y es lenta de inicio, pero duradera, en el caso de O ostertagi; y se adquiere rápidamente, pero requiere un refuerzo regular en el caso de D viviparus.
Los terneros lácteos y la mayoría de los terneros nodrieros de ternera nacidos en otoño generalmente son destetados de sus presas antes de ser convertidos en hierba por primera vez, mientras que los terneros becerros de ternera nacidos en primavera pasan su primera temporada de pastoreo junto a sus presas.
A falta de medidas de control, la inmunidad a O ostertagi no se adquiere hasta el final de la primera temporada de pastoreo de los terneros de ternera lecheros o nacidos en otoño. En el caso de los terneros de ternera nacidos en primavera, el lactante limita la posibilidad de exposición a L3 durante la primera mitad de la primera temporada de pastoreo, mientras que sus represas inmunitarias eliminan eficazmente cualquier contaminación L3 del pastizal sin desarrollar infecciones patentes epidemiológicamente importantes.
El inicio de la inmunidad a D viviparus depende del momento del primer desafío, que generalmente puede surgir a principios del verano en regiones más cálidas de la República de Irlanda, o durante el otoño en las partes más frías de Escocia.
Los nematodos gastrointestinales y los gusanos pulmonares tienen ciclos de vida directos (Figura 1), en los que los adultos son dioicos y se reproducen sexualmente, arrojando huevos que eclosionan y se desarrollan a través de etapas larvarias en el medio ambiente.
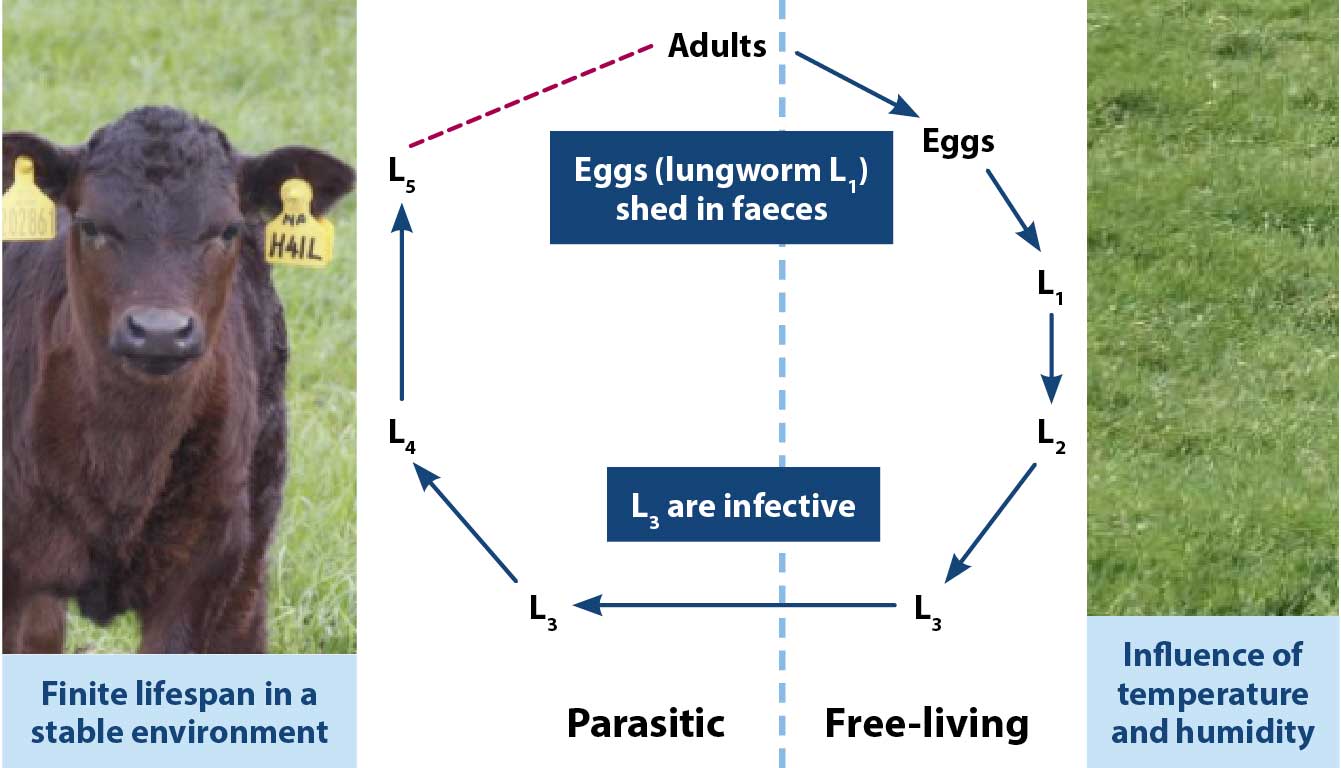
Las larvas de primera y segunda etapa (L1 y L2, respectivamente) se alimentan de bacterias fecales, mientras que L3 retiene la cutícula de la L2 como vaina protectora contra la desecación, pero no puede alimentarse. L3 migra a la hierba y es la etapa larvaria infecciosa. Una vez ingerida por el huésped, la vaina protectora se pierde y se producen más mudas en la cuarta etapa larvaria (L4), antes de llegar a la etapa adulta en su sitio de predilección en el tracto gastrointestinal o los pulmones.
Los gusanos pulmonares D viviparus también tienen ciclos de vida migratorios, por los que los L3 y L4 recién adquiridos se mueven del intestino a los alvéolos de los pulmones a través de linfáticos y sangre, mientras que los huevos derramados por hembras adultas en las grandes vías respiratorias se tosen, se tragan, eclosionan y se excretan en las heces como L1.
Las tasas de eclosión de huevos (gusanos redondos gastrointestinales) y desarrollo larvario, y supervivencia larvana, están influenciadas por la temperatura y la humedad, respectivamente. La eclosión de huevos y el desarrollo larvario solo ocurren cuando las temperaturas en sus biomas ambientales son superiores a 10 °C, siendo óptimas a unos 20 °C. Las larvas se desarrollan más rápido a temperaturas más altas, pero necesitan más energía para el metabolismo y, por lo tanto, tienen altas tasas de mortalidad.
Los L3 mueren por desecación, pero pueden protegerse durante períodos de clima cálido y seco dentro de sus biomas fecales, o por la humedad retenida dentro de densas espadas de pastos.
La carga de lombriz intestinal gastrointestinal L3 en los pastos está determinada por los niveles anteriores de desprendimiento de huevos y las influencias de la temperatura y la humedad.
El invernado L3 es la principal fuente de infección para los terneros que resultó en primavera. El tamaño de este desafío está determinado por el momento del pastoreo por parte del ganado durante el año anterior, sus cargas y las condiciones climáticas invernales, en particular las que dan lugar a la desecación y muerte.
Después de 17 días, conocido como el período de prepatente, el L3 invernado ingerido por terneros ingenuos llega a la edad adulta, se aparea y comienza a derramar huevos. A medida que aumentan las temperaturas de finales de primavera y verano, y dada la humedad adecuada en los biomas fecales, la tasa de desarrollo de estos huevos a L3aumenta, lo que potencialmente tardará solo unas pocas semanas. Se requieren precipitaciones para liberar el L3 de las heces y para su migración a la hierba.
Cada hembra adulta O ostertagi arroja cientos de huevos al día; por lo tanto, un pequeño número de L3 invernada puede dar lugar rápidamente a altos niveles de desafío. En el caso de los terneros nodrieros lácteos o de ternera nacidos en otoño durante su primera temporada de pastoreo, esto puede dar lugar a enfermedades que limitan la producción a los pocos meses de la participación.
En el caso de los terneros de ternera nacidos en primavera, la mayoría de los L3invernados son ingeridos por sus represas inmunitarias y no completan su desarrollo hasta la permeabilidad. En consecuencia, estos terneros no están expuestos a suficientes desafíos durante su primera temporada de pastoreo para desarrollar inmunidad protectora y permanecer ingenuos cuando se presentan para una segunda temporada de pastoreo durante la primavera siguiente.
Las condiciones climáticas secas durante todo el verano, seguidas de las lluvias en otoño, pueden resultar en la liberación masiva de L3 que se había desarrollado y protegido dentro de las heces.
Los nematodos femeninos adultos solo pueden producir un cierto número de huevos durante su vida útil finita, mientras que los huevos derramados cuando las temperaturas son inferiores a 10 °C, o cuando las condiciones son cálidas y secas, no eclosionarán ni sobrevivirán.
O ostertagi se ha adaptado para someterse a un paro del desarrollo como larvas hipobióticas de cuarta etapa temprana (EL4) en las glándulas abomasales durante esos períodos fríos, o calientes y secos, que no son propicios para la eclosión de huevos o la supervivencia larvaria. En climas templados, la aparición de la hipobiosis generalmente ocurre a finales de otoño, mientras que el EL4 emerge de las glándulas abomasales en masa en primavera, causando diarrea severa y desequilibrio de líquidos y electrolitos; conocido como ostertagiosis tipo dos. Esta enfermedad se observa más comúnmente después de los veranos secos y los otoños húmedos antes mencionados.
La epidemiología de D viviparus es mucho menos clara debido a las influencias adicionales en la disponibilidad de L3, como:
- rápido desarrollo a L3 de L1 cobertizo en las heces
- roles desconocidos de los vectores de vida silvestre
- niveles relativamente bajos de desafío L3 requeridos para causar enfermedad
- transmisión aérea junto con esporas fúngicas Pilobolus
- la aparición de larvas hipobióticas previamente a largo plazo de los estratos del suelo
Por lo tanto, los brotes de gusanos pulmonares pueden ser impredecibles y a veces ocurren en pastos que no han sido pastados por ganado en años anteriores, o en campos recientemente arados.
Los principios establecidos del control de la lombriz intestinal gastrointestinal y el gusano pulmonar son reducir la exposición del huésped a L3 a niveles que permitan el desarrollo de inmunidad protectora, al tiempo que permitan manejar las cargas de la etapa parasitaria.
Esto requiere la integración del manejo evasivo del huésped, pastando animales en campos que se prevé que alberguen bajos niveles de desafío L3; y tratamientos farmacológicos antihelmínticos para interrumpir la historia de vida de los parásitos, suprimiendo el desprendimiento de huevos o L1 por parte del ganado infectado, reduciendo así el potencial de desarrollo larvario y acumulación de contaminación por pastos L3.
El momento de estos enfoques se rige por el ciclo de producción anual del huésped, lo que resulta en la presencia estacional de animales ingenuos o menos capaces de inmunológica, y las condiciones ambientales que favorecen el desarrollo y la supervivencia de larvas.
Los programas de control de nematodos más sostenibles para rebaños individuales de ganado se basan en la aplicación de la comprensión del sistema agrícola y el medio ambiente, y las inferencias sobre la relación entre la contaminación por pastos, la disponibilidad de L3 en los pastos y la acumulación de infecciones en los animales.
Sin embargo, la mayoría de los productores de ganado administran medicamentos antihelmínticos con el objetivo comprensible, pero irracional, de erradicar los parásitos de sus animales, con frecuencia confiando en un grupo único o activo conveniente de aplicar (Figura 2).
Se deben hacer preguntas sobre la responsabilidad de este enfoque, con referencia a las lagunas en la adquisición de inmunidad protectora y la adaptación de parásitos a los patrones cambiantes de gestión agrícola, clima y consumo de drogas antihelmínticas.

Lagunas en la adquisición de inmunidad protectora
La mayoría de los productores de ganado de todo el mundo utilizan medicamentos antihelmínticos en lugar de manejo del pastoreo, o control integrado para controlar los nematodos gastrointestinales y los gusanos pulmonares.
Esto es comprensible, porque los medicamentos antihelmínticos son relativamente baratos y cómodos de usar, mientras que la aplicación de estrategias de manejo evasiva es complicada y puede que no siempre encaje bien con otras actividades agrícolas.
Por el contrario, se percibe que los regímenes de control farmacéutico son sencillos debido a la disponibilidad de medicamentos macrocíclicos de lactona con larga persistencia contra la reinfección con Ostertagi y D viviparus.
Esta estrategia es altamente efectiva, lo que, en sí misma, da lugar a desafíos. Se han reportado brotes de enfermedades, que surgen como consecuencia de la persistencia de la actividad de medicamentos macrocíclicos de lactona contra la reinfección con O ostertagi, pero no Cooperia oncophora o Nematodirus helvetianus, creando oportunidades para el establecimiento de esta última especie en ausencia de influencias competitivas de la primera.
El uso de medicamentos antihelmínticos persistentes en terneros almacenados evita el establecimiento de L3 con invernada adquirida durante el período de persistencia, al tiempo que suprime la producción de huevos y previene la contaminación por pastizales L3 una vez que la actividad persistente ha terminado, eliminando así la exposición a O ostertagi por completo. Este escenario evita la adquisición de inmunidad protectora durante la primera temporada de pastoreo de los terneros lejos de sus presas, y requiere medidas de control en las temporadas de pastoreo posteriores para evitar brotes de enfermedades y pérdida de producción en terneros mayores y ganado adulto. Esto se vuelve caro y posiblemente aumenta las presiones de selección para la aparición de resistencia antihelmíntica.
Desafío emergente de la prevención de gusanos pulmonares
La incidencia clínica de gusano pulmonar en terneros mayores y ganado adulto en el Reino Unido e Irlanda ha aumentado recientemente.
El uso de medicamentos antihelmínticos persistentes en terneros almacenados puede no prevenir la exposición al gusano pulmonar L3 que puede emerger del suelo, o ser transportado por el viento durante la última parte de la temporada de pastoreo una vez que haya terminado la persistencia del medicamento. Esta exposición puede ser suficiente para evocar respuestas del huésped que causan enfermedad, pero insuficiente para mantener la inmunidad adquirida de corta duración; por lo tanto, el ganado puede permanecer susceptible al gusano pulmonar en temporadas de pastoreo posteriores.
La infección por gusanos pulmonares en bovinos mayores previamente expuestos, a veces conocida como síndrome de reinfección, puede resultar en signos clínicos de enfermedad respiratoria, drástica reducción de la producción de leche, pérdida de peso y, a veces, la muerte, dependiendo de los niveles de desafío y de inmunidad del huésped.
En la década de 1950 se desarrolló una vacuna contra el gusano pulmonar altamente efectiva en la Escuela Veterinaria de la Universidad de Glasgow como la primera vacuna del mundo contra una infección parasitaria. Hoy en día, la naturaleza impredecible del D vivíparus, y la gravedad potencial de la enfermedad, proporciona un argumento convincente para revertir la actual infrautilización de la vacunación contra el gusano pulmonar y desarrollar nuevas estrategias para su uso.
D viviparus L3 irradiado gamma se administra por vía oral para imitar la infección natural sin completar su ciclo de vida y causar enfermedad clínica. A los terneros mayores de dos meses se les dan dos dosis, separadas por cuatro semanas, y la segunda dosis se administra antes de la participación en la hierba. Se necesita cuidado para evitar matar la vacuna L3 o prevenir el aumento de la inmunidad mediante el uso de medicamentos antihelmínticos persistentes.
Se ha sugerido que los bolos de oxfendazol de liberación de pulso pueden proporcionar oportunidades de exposición al viviparo D entre pulsos suficientes para aumentar la inmunidad al gusano pulmonar, pero existe poca evidencia empírica en apoyo de esta estrategia.
Adaptabilidad genética de los nematodos parásitos
Los nematodos parásitos tienen altas tasas reproductivas, grandes genomas con un gran número de genes y altos niveles de polimorfismo.
Por ejemplo, el ensamblaje del genoma a escala cromosómica de Haemonchus contortus es de aproximadamente 280 millones de pares de bases con alrededor de 22.000 genes codificadores de proteínas, mientras que una sola hembra puede eliminar más de 4.000 huevos por día cuando las condiciones son adecuadas para su desarrollo.
Mientras tanto, el ensamblaje del genoma de Teladorsagia circumcincta, que está estrechamente relacionado filogenéticamente con O ostertagi, es menos refinado, pero se sabe que es más grande y polimórfico.
Por lo tanto, el concepto de sostenibilidad con respecto al control de lombrices intestinales y gusanos pulmonares debe considerar la inevitabilidad de la adaptación de parásitos en respuesta a condiciones favorables y desfavorables. Estos pueden ser causados por el cambio de los efectos ambientales climáticos, de estilo de vida humano o de manejo ganadero en las etapas de vida libre, y la exposición de las etapas parasitarias a los medicamentos antihelmínticos.
Hemos descrito varios ejemplos de adaptación evolutiva o epigenética de nematodos parásitos al cambio ambiental, y hemos informado de resistencia a cada uno de los grupos antihelmínticos de amplio activo en los nematodos gastrointestinales de ovejas escocesas. Hemos investigado los factores que pueden haber dado lugar a su aparición.
A nivel mundial, la resistencia al benzimidazol, el imidazotiazol y la lactona macrocíclícmica antilmíntica está generalizada en la mayoría de las principales especies de trichostrongyle que infectan a pequeños rumiantes, mientras que la resistencia antihelmíntica multigenérica al fármaco derivado del nitrato de amino acetil, el monepantel, está surgiendo.
La resistencia a la salicilanilida está generalizada en el pequeño rumiante H contortus, se ha informado de resistencia al benzimidazol y a los medicamentos de lactona macrocíclica en especies de nematodos gastrointestinales que infectan al ganado, y se sospecha resistencia a la mayoría de los antihelmínticos en varias especies de parásitos del helmintos humanos.
Por lo tanto, existe la necesidad de estrategias prácticas de control de la lombriz intestinal gastrointestinal del ganado y el gusano pulmonar, integrando el manejo del pastoreo y el uso de medicamentos antihelmínticos en contextos agrícolas y ambientales específicos, aprovechando la experiencia adquirida en el trabajo de pequeños rumiantes para incorporar la mitigación de la resistencia antihelmíntica y explorar la explotación
Referencias
- David GP (1999). Estrategias para el control de la bronquitis parasitaria en el ganado, En la Práctica 21(2): 62-68.
- Laing R, Kikuchi T, Martinelli A y otros (2013). El genoma y el transcriptoma de Haemonchus contortus, un parásito modelo clave para el descubrimiento de fármacos y vacunas, Genome Biology 14(8): R88.
- Höglund J, Gånheim C y Alenius S (2003). El efecto del tratamiento con eprinomectina sobre los gusanos pulmonares a la permeabilidad temprana en el desarrollo de inmunidad en bovinos jóvenes, Parasitología Veterinaria 114(3): 205-214.
- Sargison ND (2016). La epidemiología impredecible de la infección por el gusano pulmonar Dictyocaulus viviparus en el ganado, Veterinary Ireland Journal 6(7): 387-391.
- Sargison ND, Wilson DJ, Penny CD and Bartley DJ (2010). Unexpected production loss caused by helminth parasites in weaned beef calves, Veterinary Record167(19): 752-754.
- Van Dijk J (2004). La epidemiología y el control de la dictiocaulosis en el ganado, Práctica del ganado 12(2): 133-145.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

