Desarrollo de un modelo tridimensional de tumor hepático canino basado en angiografía
 Desarrollo de un modelo tridimensional de tumor hepático canino basado en angiografía por tomografía computarizada para la simulación de la embolización transarterial
Desarrollo de un modelo tridimensional de tumor hepático canino basado en angiografía por tomografía computarizada para la simulación de la embolización transarterial
 Miju Oh1
Miju Oh1  Jiyoung Ban1
Jiyoung Ban1  Yooyoung Lee1
Yooyoung Lee1  Minju Lee1
Minju Lee1  Sojin Kim1
Sojin Kim1  Uhjin Kim1
Uhjin Kim1  Parque Jiwoon1
Parque Jiwoon1  Jaepung Han1
Jaepung Han1  Jinhwa Chang2
Jinhwa Chang2  Byungjin Kim3
Byungjin Kim3  Hyeongrok Yun4
Hyeongrok Yun4  Namsoon Lee1
Namsoon Lee1  Dongwoo Chang1*
Dongwoo Chang1*- 1Sección de Imágenes Veterinarias, Centro Médico Veterinario, Facultad de Medicina Veterinaria, Universidad Nacional de Chungbuk, Cheongju, República de Corea
- 2Centro Médico Animal de Corea, Cheongju, República de Corea
- 3Centro Médico Bon Animal, Suwon, República de Corea
- 4SKY Animal Medical Center, Cheonan, República de Corea
Introducción: La embolización transarterial (TAE) es una de las opciones de tratamiento para las masas hepáticas que no son aptas para la cirugía y se han aplicado en medicina veterinaria durante unos 20 años, pero la resección quirúrgica se considera como la primera opción de tratamiento, y solo se han publicado unos pocos informes de casos y artículos sobre TAE en perros. Aunque la comprensión de la anatomía vascular para el procedimiento es importante, los estudios previos carecen de información sobre la anatomía de la arteria hepática en perros pequeños y de razas toy. Debido a la introducción de la impresión 3D en la medicina veterinaria, ahora es posible hacer modelos 3D para la planificación preoperatoria. El propósito de este estudio es comprender la estructura vascular arterial hepática de varios tamaños y razas de perros, y desarrollar modelos de arterias caninas impresas en 3D con y sin tumores hepáticos para simular el procedimiento TAE.
Métodos: Se analizaron imágenes de TC de un total de 84 perros con arterias hepáticas normales, y el valor medio y la desviación estándar del peso corporal, el tamaño de la arteria celíaca y el tamaño de la arteria hepática fueron de 6,47 ± 4,44 kg, 3,28 ± 0,77 mm y 2,14 ± 0,43 mm, respectivamente.
Resultados: Se estableció que el tipo 2-2-1, que tiene dos ramas hepáticas separadas, la rama medial derecha y la rama izquierda y la rama lateral derecha que corre hacia el lóbulo lateral derecho y la apófisis caudada, es el más prevalente de los tipos de ramas de la arteria hepática, como lo fue en el estudio anterior. La revisión de 65 imágenes de TC de perros con tumores hepáticos mostró que el 44,6% (29/65) presentaba lesiones multifocales en múltiples lóbulos, por lo que se puede recomendar la EAT.
Discusión: Con base en los resultados, se realizó un modelo 3D de la arteria hepática canina normal y el tumor hepático utilizando un caso representativo de cada grupo, y a pesar de que los modelos tenían algunas limitaciones para reflejar el tacto y la velocidad exactos de los vasos sanguíneos, el procedimiento de TAE se simuló con éxito utilizando ambos modelos.
1 Introducción
A diferencia del flujo sanguíneo normal hacia el parénquima hepático, que se deriva principalmente de las venas portas (1), alrededor del 90% del flujo sanguíneo hacia los tumores hepáticos depende de la arteria hepática (2). Utilizando la vasculatura y las características morfológicas del tumor, en pacientes humanos que no cumplen con la indicación quirúrgica o esperan un trasplante hepático, se realiza una embolización transarterial (TAE) para evitar el flujo sanguíneo hacia el tumor, o se realiza una quimioembolización transarterial (TACE) para aumentar las concentraciones locales de quimioterapia y los tiempos de permanencia dentro del tumor y reducir las toxicidades sistémicas posteriores (3, 4).
La embolización transarterial (TAE) también se introdujo en la medicina veterinaria hace aproximadamente 2 décadas (5). Sin embargo, los tumores hepáticos primarios más frecuentes en perros son las masas hepatocelulares y la morfología macroscópica más frecuente de los mismos es de tipo masivo, lo que significa una lesión solitaria en un solo lóbulo hepático (6, 7), cuyo pronóstico se sabe que es bueno cuando se realiza una resección completa (6, 7), se sigue optando por la cirugía como tratamiento de primera línea (8 ). Sin embargo, en el caso de las lesiones multifocales que afectan a dos o más lóbulos hepáticos, la resección quirúrgica se dificulta aunque el tamaño de la masa sea pequeño (7, 9-12). Además, la eficacia de la quimioterapia sistémica de rutina es limitada, por lo que cuando se observan lesiones multifocales en múltiples lóbulos, se sabe que el pronóstico es malo (13). A pesar de que solo existe una sola masa hepática, el tratamiento quirúrgico no es susceptible cuando la adhesión tumoral a otras estructuras como el diafragma, los vasos sanguíneos grandes y otros órganos adyacentes, se puede intentar la quimioterapia sistémica tradicional, pero solo la quimioterapia sistémica sin resección quirúrgica generalmente no se satisface debido a la resistencia de las células tumorales a los fármacos quimioterapéuticos (11). En estos casos, la EAT puede ser un tratamiento eficaz para perros con tumores hepáticos irresecables (5, 10, 14-16), pero dado que el hígado consta de varios lóbulos, requiere mucha práctica para realizar procedimientos precisos en pacientes reales.
Para los procedimientos de TAE, también es importante comprender la estructura vascular de la arteria hepática. De acuerdo con estudios previos sobre el sistema vascular hepático en perros (17-20), los tipos de arteria hepática se pueden clasificar según el número de ramas ramificadas de la arteria hepática principal, y en el estudio más reciente, el tipo más común fue la división en dos ramas principales (18). En otro estudio, el diámetro promedio de la arteria celíaca fue de 5,1 mm y el de la arteria hepática de 4,05 mm en perros beagle normales (20). Sin embargo, el peso de los perros incluidos en estos estudios fue de al menos 8 kg y hasta 30 kg (17-20), y la información sobre las características de la arteria hepática en perros toy y de razas pequeñas es insuficiente.
En la medicina veterinaria reciente, la impresión 3D se ha utilizado ampliamente para la planificación quirúrgica, la educación e incluso para la fabricación de sustitutos de injertos (21-24). En artículos anteriores se introdujeron modelos 3D de hígados de animales, como modelos vasculares y biliares 3D de hígado felino (25) y modelos 3D de vasos hepáticos para cirugía de derivación portosistémica intrahepática (IHPSS) en perros (26). En medicina humana, los modelos impresos en 3D también se utilizan en la terapia intervencionista, hay algunos informes de casos y artículos sobre modelos huecos impresos en 3D para intervenciones endovasculares como el enrollamiento del aneurisma de la arteria esplénica, el reemplazo de la válvula transcatéter y para la broncoscopia (27-29).
En este estudio, se esperaba la fabricación del modelo de impresión 3D de perros para la práctica de tratamiento intervencionista como en medicina humana, los procedimientos TAE sobre masas hepáticas. Nuestro objetivo era hacer dos modelos, el modelo hepático normal para adquirir experiencia con la anatomía normal antes de entrar en la complicada anatomía vascular de las masas y el modelo de masa hepática para la práctica real de la masa hepática. Analizamos la estructura de la arteria hepática de perros con hígados normales de varias razas y tamaños para reflejar la anatomía de la arteria hepática desde razas pequeñas y toy hasta perros de razas grandes hasta el modelo de arteria hepática normal y recopilamos los datos de la angiografía por TC de perros con masa hepática para el modelo de masa hepática.
2 Materiales y métodos
2.1 Animales
Los casos para el estudio fueron reclutados y analizados retrospectivamente en cuatro centros médicos veterinarios: el Hospital Docente Veterinario de la Universidad Nacional de Chungbuk, el Centro Médico Animal de Corea, el Centro Médico Bon Animal y el Centro Médico Animal Cheonan SKY. Tras los resultados del análisis de los casos, se seleccionaron los casos óptimos para fabricar los modelos 3D. Entre enero de 2016 y julio de 2022, los perros se sometieron a una tomografía computarizada (TC) de abdomen trifásica que incluía el área hepática general, y tenían registros médicos que consistían en al menos la raza, el peso y los motivos de la TC. Los perros se dividieron en dos grupos, los perros sin lesiones en el hígado en las imágenes previas y posteriores al contraste y sin problemas hepáticos se clasificaron como grupo de arteria hepática normal, y los perros con lesiones hepáticas se clasificaron como grupo de masa hepática. Se incluyeron los casos con fase arterial para la representación del volumen, y la fase arterial se adquirió por seguimiento del bolo y se excluyeron los casos con fase arterial inadecuada, como la contaminación de las venas hepática y porta por exposición tardía o el realce insuficiente de la arteria hepática por exposición temprana, o artefactos como el endurecimiento del haz y el artefacto de movimiento afectaron el área hepática.
2.2 Análisis de imágenes de TC
Los exámenes de TC se realizaron utilizando tres escáneres diferentes: dos tomógrafos helicoidales de 16 cortes (Revolution ACT, GE Medical Co., Milwaukee, WI, Estados Unidos), un escáner de tomografía computarizada helicoidal de 16 cortes (SOMATOM Scope; SIEMENS, Tokio, Japón) y un escáner de tomografía computarizada helicoidal de 64 cortes (Aquilion 64CFX, Toshiba Medical Systems, Otawara, Japón). Las tomografías computarizadas se realizaron bajo anestesia general y el grosor del corte de tres escáneres de TC fue de 1,0 a 2,0 mm con un paso de 0,75 a 1,5. Los parámetros de escaneo fueron voltaje de tubo de 100-150 kV, 100-200 mA, campo de visión de 250-500 mm y matriz de 512 × 512. Todas las imágenes se evaluaron utilizando el visor DICOM (RadiAnt DICOM Viewer 2022.1.1; Medixant, Poznan, Polonia). Se realizó una representación tridimensional del volumen utilizando las imágenes de fase arterial para analizar el patrón de ramificación de la arteria hepática, y en la imagen transversal se analizó la medición de los diámetros de las arterias hepáticas y las características de las lesiones hepáticas. Las evaluaciones fueron realizadas por dos estudiantes de posgrado (MO e YL) de medicina veterinaria en el CBNU-VTH, y los desacuerdos se resolvieron por consenso.
2.3 Grupo de arterias hepáticas normales
Los perros se sometieron a tomografías computarizadas por problemas no relacionados con el hígado y no se incluyeron lesiones significativas observadas en el parénquima hepático en el grupo de arteria hepática normal, y también se excluyeron los perros con lesiones que causaron desplazamiento o compresión del parénquima hepático y vasos hepáticos, como masas grandes originadas en órganos adyacentes y ascitis excesiva.
Se utilizaron imágenes de representación de volumen tridimensional para analizar el patrón de ramificación de la arteria hepática. De acuerdo con los estudios previos (17-20), los tipos de ramificación de la arteria hepática se dividieron en tres tipos principales en función del número de ramas principales que se ramifican de la arteria hepática. En el caso de la ramificación en un solo tronco común de la arteria hepática, se clasificó como tipo 1, la ramificación en dos ramas separadas se clasificó como tipo 2 y la ramificación en tres o más ramas se clasificó como tipo 3. El tipo 2 se subdividió en tipo 2-1 y tipo 2-2 según si las dos ramas se dividían en ramas izquierda y derecha o rama lateral derecha y rama media derecha e izquierda, respectivamente, y el tipo 2-2 se clasificó como tipo 2-2-1 cuando la rama lateral derecha se encuentra con el lóbulo lateral derecho y la apófisis caudada. y tipo 2-2-2 cuando la primera rama era una rama de proceso caudado. El tipo 3 se clasificó en tipo 3-3 cuando el número de ramas era 3, 3-4 por 4 y 3-5 cuando el número de ramas era 5 o más. En la Figura 1 se muestra una representación esquemática del tipo de rama de la arteria hepática de este estudio, y en la Figura 2 se muestran representaciones en 3D de cada tipo de rama de la arteria hepática.
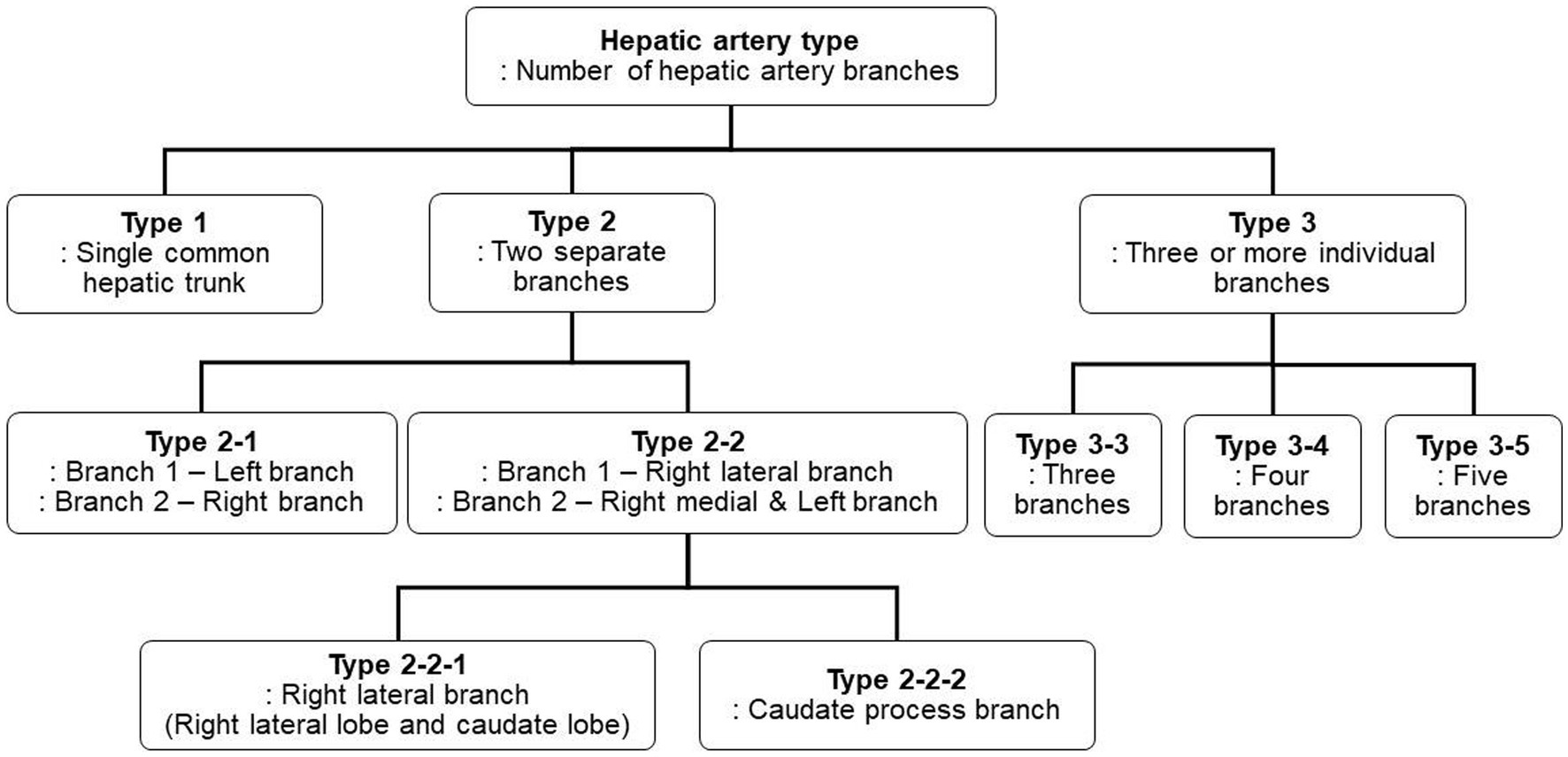 Figura 1. Diagrama esquemático de clasificación de los tipos de ramificación de la arteria hepática canina. De acuerdo con los estudios previos, los tipos de ramificación de la arteria hepática se clasificaron en tres tipos principales. El tipo 2 se subdividió a su vez en dos subtipos, el tipo 2-1 y el tipo 2-2, en función del lóbulo al que se dirige cada rama, y el tipo 2-2 se dividió a su vez en el tipo 2-2-1 y el tipo 2-2-2 en función de la presencia de la rama de proceso caudado. El tipo 3 se subdividió en tipo 3-3, tipo 3-4 y tipo 3-5 según el número de ramas.
Figura 1. Diagrama esquemático de clasificación de los tipos de ramificación de la arteria hepática canina. De acuerdo con los estudios previos, los tipos de ramificación de la arteria hepática se clasificaron en tres tipos principales. El tipo 2 se subdividió a su vez en dos subtipos, el tipo 2-1 y el tipo 2-2, en función del lóbulo al que se dirige cada rama, y el tipo 2-2 se dividió a su vez en el tipo 2-2-1 y el tipo 2-2-2 en función de la presencia de la rama de proceso caudado. El tipo 3 se subdividió en tipo 3-3, tipo 3-4 y tipo 3-5 según el número de ramas.
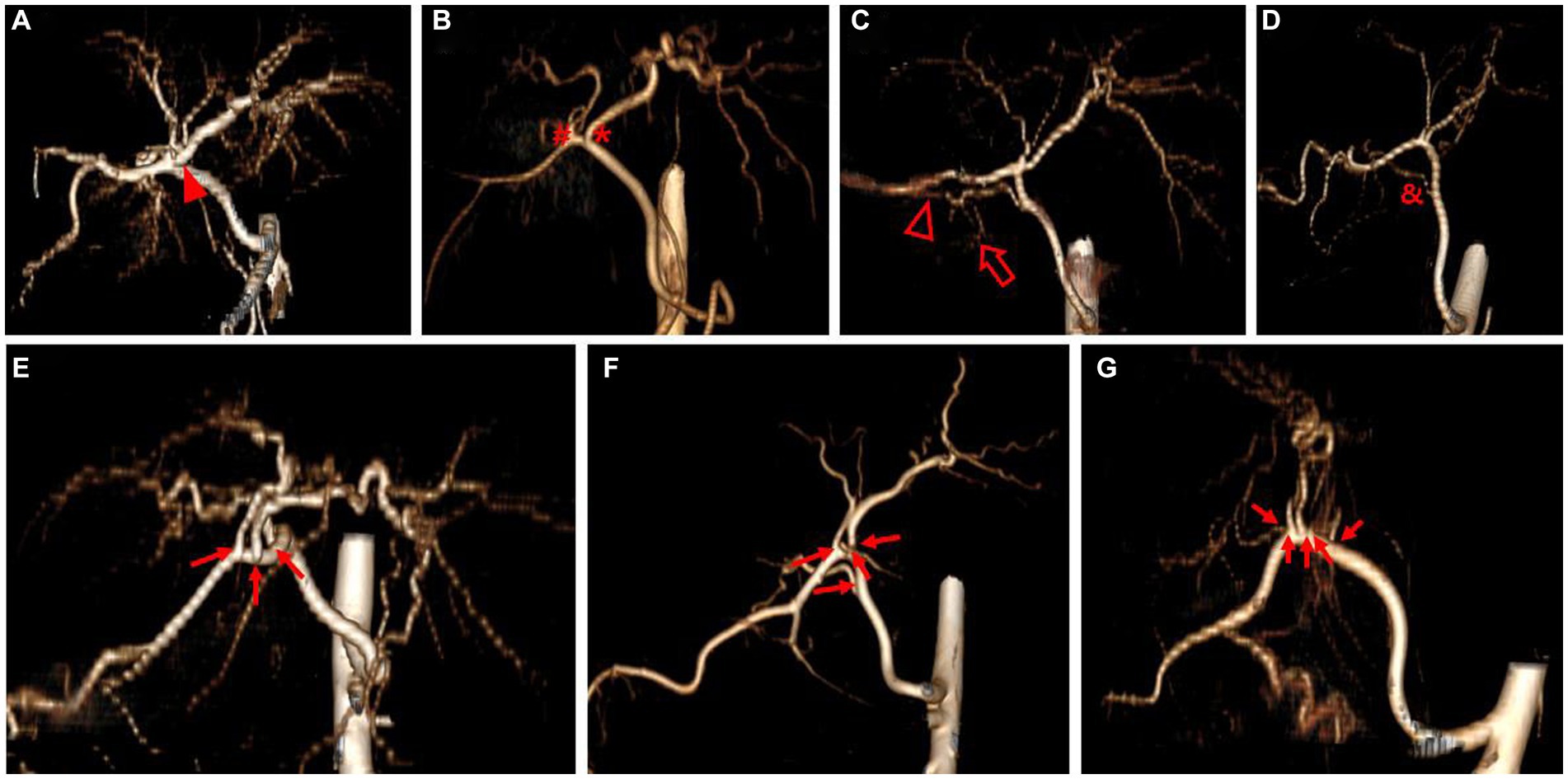 Figura 2. Imagen de representación de volumen 3D que representa cada tipo de rama de la arteria hepática. El tipo 1 (A) muestra un solo tronco común (punta de flecha). El tipo 2 (B-D) se divide en dos ramas separadas; El tipo 2-1 (B) consiste en la rama izquierda (asterisco) y la rama derecha (hashtag), el tipo 2-2-1 (C) tiene la rama lateral derecha que se extiende tanto al lóbulo lateral derecho (punta de flecha hueca) como a la apófisis caudada (flecha hueca), y el tipo 2-2-2 (D) tiene una rama de proceso caudado (ampersand). El tipo 3 (E-G) muestra más de tres ramas (flecha) que surgen de la arteria hepática; El tipo 3-3 (E) muestra tres ramas, el tipo 3-4 (F) muestra cuatro ramas y el tipo 3-5 (G) muestra cinco ramas. Para cada imagen se eligió el mejor lado para mostrar las ramas de la arteria hepática.
Figura 2. Imagen de representación de volumen 3D que representa cada tipo de rama de la arteria hepática. El tipo 1 (A) muestra un solo tronco común (punta de flecha). El tipo 2 (B-D) se divide en dos ramas separadas; El tipo 2-1 (B) consiste en la rama izquierda (asterisco) y la rama derecha (hashtag), el tipo 2-2-1 (C) tiene la rama lateral derecha que se extiende tanto al lóbulo lateral derecho (punta de flecha hueca) como a la apófisis caudada (flecha hueca), y el tipo 2-2-2 (D) tiene una rama de proceso caudado (ampersand). El tipo 3 (E-G) muestra más de tres ramas (flecha) que surgen de la arteria hepática; El tipo 3-3 (E) muestra tres ramas, el tipo 3-4 (F) muestra cuatro ramas y el tipo 3-5 (G) muestra cinco ramas. Para cada imagen se eligió el mejor lado para mostrar las ramas de la arteria hepática.
El diámetro de la arteria celíaca se midió inmediatamente después de la ramificación de la aorta y el diámetro de la arteria hepática se midió justo antes de la primera rama principal, con un ancho de ventana de 600 y un nivel de ventana de 300 en la imagen transversal.
2.4 Grupo de masas hepáticas
Los perros que se sometieron a tomografías computarizadas por problemas relacionados con el hígado y masas observadas en el parénquima hepático se incluyeron en el grupo de tumores hepáticos, y se excluyeron los perros con anomalías de los vasos hepáticos, como derivación portosistémica, o enfermedades hepáticas crónicas, como cirrosis que afectaba a todo el hígado. En el grupo de tumores hepáticos, se evaluaron el diámetro máximo y el número de masas, el número y la división de los lóbulos afectados, y si los vasos sanguíneos a la masa son visibles con un ancho de ventana de 400 y un nivel de ventana de 60 en la imagen transversal. Además, en los pacientes que se sometieron a las pruebas diagnósticas de las masas hepáticas, se recogió el método y el diagnóstico final.
2.5 Desarrollo de modelos 3D
Los modelos 3D fueron hechos a medida por la empresa de tecnología 3D (Medical IP company, Seúl, Corea), hechos de silicona de alta transparencia. Se seleccionó un perro de cada grupo como sujeto para los modelos 3D. Para la creación del modelo 3D de la arteria hepática canina normal se eligió el perro con los diámetros de las arterias celíacas y hepáticas más cercanos al valor medio y con el tipo de patrón vascular más común. Los recipientes de menos de 1 mm se consideraron de 1 mm, debido al diámetro mínimo factible de la impresión 3D. Para el modelo de masa hepática en 3D, se seleccionó un perro en el que las lesiones múltiples afectaban a múltiples lóbulos hepáticos, eran adyacentes al diafragma o a los vasos sanguíneos grandes donde la extirpación quirúrgica es difícil, y la entrada de arterias en el tumor se identificó claramente en la fase arterial de la TC.
2.6 Selección transarterial y simulación de embolización en modelos 3D
La simulación se realizó bajo guía fluoroscópica (Veradius Unity; Philips, Países Bajos). La parte de los modelos 3D que corresponde a la arteria femoral se puncionó con una aguja de 20G o un catéter intravenoso y se canuló con una vaina introductora de 5Fr. Se insertó en la aorta una guía angulada de 0,035 pulgadas y un catéter de punta de parachoques de 5Fr y se ancló en la arteria celíaca. Se retiró la guía y se insertaron la microguía de 0,018 pulgadas y el microcatéter de 2,4 Fr en la arteria hepática común a través del catéter de 5 Fr, y luego se colocaron en la arteria lobar objetivo. Partícula de esponja de gelatina (GSP, Spongostan Standard; Ethicon, Estados Unidos) se utilizó como material embolizante mezclado con medios de contraste, iohexol (Omnipaque, GE healthcare, Austria). Después de la embolización, se inyectó medio de contraste para identificar la oclusión de las arterias objetivo. Debido al amplio diámetro del vaso en el modelo de masa hepática, solo se empleó un catéter de punta de parachoques de 5Fr, sin microcatéter.
2.7 Análisis estadístico
La información del paciente y los datos medidos se registraron mediante una hoja de cálculo de Microsoft Excel (Microsoft Excel 2016, Microsoft Corporation, Redmond, WA, Estados Unidos), y se analizaron la media, la desviación estándar y el rango de los datos y se utilizaron como estadística descriptiva. Para todos los análisis estadísticos y cifras estadísticas se utilizaron dos programas estadísticos disponibles en el mercado, SPSS 21.0 (IBM SPSS Statistics, Chicago, IL, Estados Unidos) y Prism 9.0 (GraphPad Software Inc., San Diego, CA, Estados Unidos). La distribución normal de los datos medidos se comprobó mediante la prueba de Kolmogorov-Smirnov con el software SPSS. Se realizaron análisis de correlación para el peso y las arterias celíaca y hepática utilizando Prism 9.0, se aplicaron análisis de correlación de Pearson si los resultados se distribuyeron normalmente, y se utilizaron análisis de correlación de Spearman si los resultados no se distribuyeron normalmente. Se estableció p < 0,05 para la significación estadística.
3 Resultados
3.1 Grupo hepático normal
En el grupo hepático normal se incluyeron 84 perros y el peso corporal medio y la desviación estándar (DE) fueron de 6,47 ± 4,44 kg, variando de 1,6 a 25,0 kg. Las características de los perros se resumen en la Tabla 1. El diámetro medio y la DE de las arterias celíacas y hepáticas fue de 3,28 ± 0,77 mm (rango; 1,91-5,87 mm) y de 2,14 ± 0,43 mm (rango; 1,32-3,18 mm) para cada una. Ambos resultados no siguieron la distribución normal; Se adoptaron análisis de correlación de Spearman que demostraron la correlación significativa entre el peso corporal y el diámetro de la arteria celíaca (RS = 0,8107, p < 0,0001), y el peso corporal y el diámetro de la arteria hepática (RS = 0,7501, p < 0,0001; Figura 3).
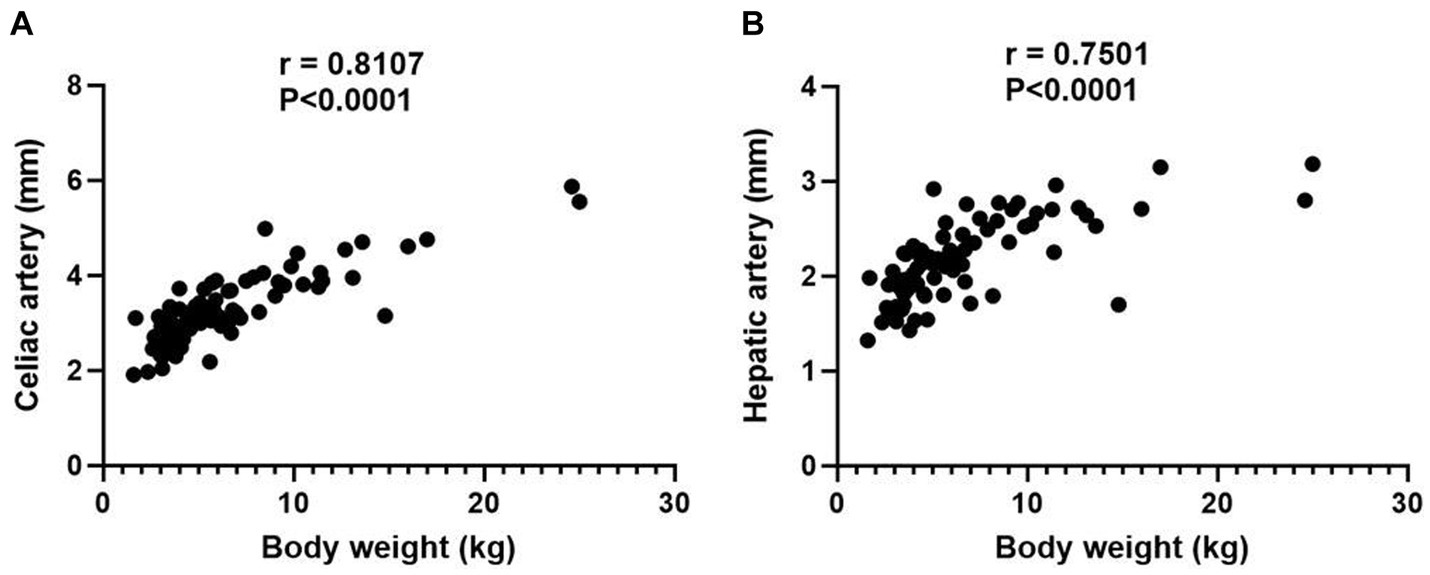 Figura 3. Diagrama de dispersión que ilustra la relación entre el peso corporal y los diámetros de la arteria celíaca (A) y la arteria hepática (B). El valor de p de 0,05 se consideró significativo, y ambos resultados demostraron significación estadística con p < 0,0001.
Figura 3. Diagrama de dispersión que ilustra la relación entre el peso corporal y los diámetros de la arteria celíaca (A) y la arteria hepática (B). El valor de p de 0,05 se consideró significativo, y ambos resultados demostraron significación estadística con p < 0,0001.
El tipo de arteria hepática más común fue el tipo 2-2-1, que incluyó a 36 perros, seguido por el tipo 2-1 con 15 perros. Había 14 perros con el tipo 3-3, 7 con el tipo 1 y el tipo 2-2-2 para cada uno, 3 con el tipo 3-4 y 2 con el tipo 3-5 (Tabla 2).
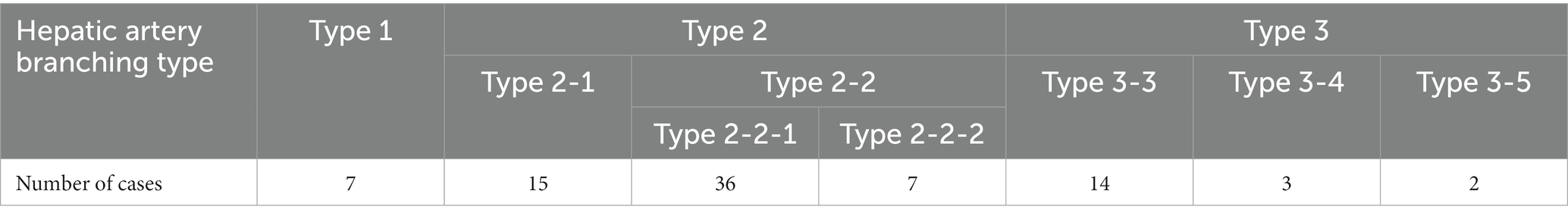 Tabla 2. Prevalencia de cada tipo de ramificación de la arteria hepática en 84 perros del grupo de arteria hepática normal.
Tabla 2. Prevalencia de cada tipo de ramificación de la arteria hepática en 84 perros del grupo de arteria hepática normal.
3.2 Grupo de masas hepáticas
Sesenta y cinco perros fueron incluidos en el grupo de masa hepática, y el diámetro medio de la masa máxima y la DE fue de 73,84 ± 38,03 mm, variando de 15,8 a 196,2 mm. Se identificó el flujo de las arterias hacia la masa en 58 perros. Las características detalladas se resumen en la Tabla 3.
Veinticinco de este grupo tenían lesiones solitarias y 11 tenían lesiones multifocales en el lóbulo único. Entre ellos, 17 tenían un tamaño máximo de lesión de 7 cm o más, y 19 tenían un tamaño menor de 7 cm. De los 29 perros con lesiones multifocales en lóbulos múltiples, 14 tenían lesiones en dos lóbulos, ocho en tres lóbulos y siete en cuatro o más lóbulos. Diecinueve de ellos tenían un tamaño máximo de lesión de 7 cm o más, y 10 tenían un tamaño menor de 7 cm. Cuando se dividieron en grupos en función de las tres divisiones de lóbulos hepáticos, 23 presentaron lesiones solo en la división izquierda, el lóbulo medial izquierdo y el lóbulo lateral izquierdo, por lo que se encontró que los 42 restantes tenían al menos una lesión en la división derecha y central, el lóbulo cuadrado y medial derecho, el lóbulo lateral derecho y caudado.
Del total, los diagnósticos histológicos se identificaron en 28 perros, los cuales fueron carcinoma hepatocelular (n = 13), adenoma hepatocelular (n = 8), hiperplasia nodular (n = 4) y hemangiosarcoma, adenoma de quiste biliar y linfoma (n = 1), y la mayoría de ellos fueron diagnosticados mediante biopsia quirúrgica (n = 20), seguida de biopsia y PAAF (n = 4).
3.3 Desarrollo de un modelo 3D de arteria canina con arteria hepática normal y masa hepática
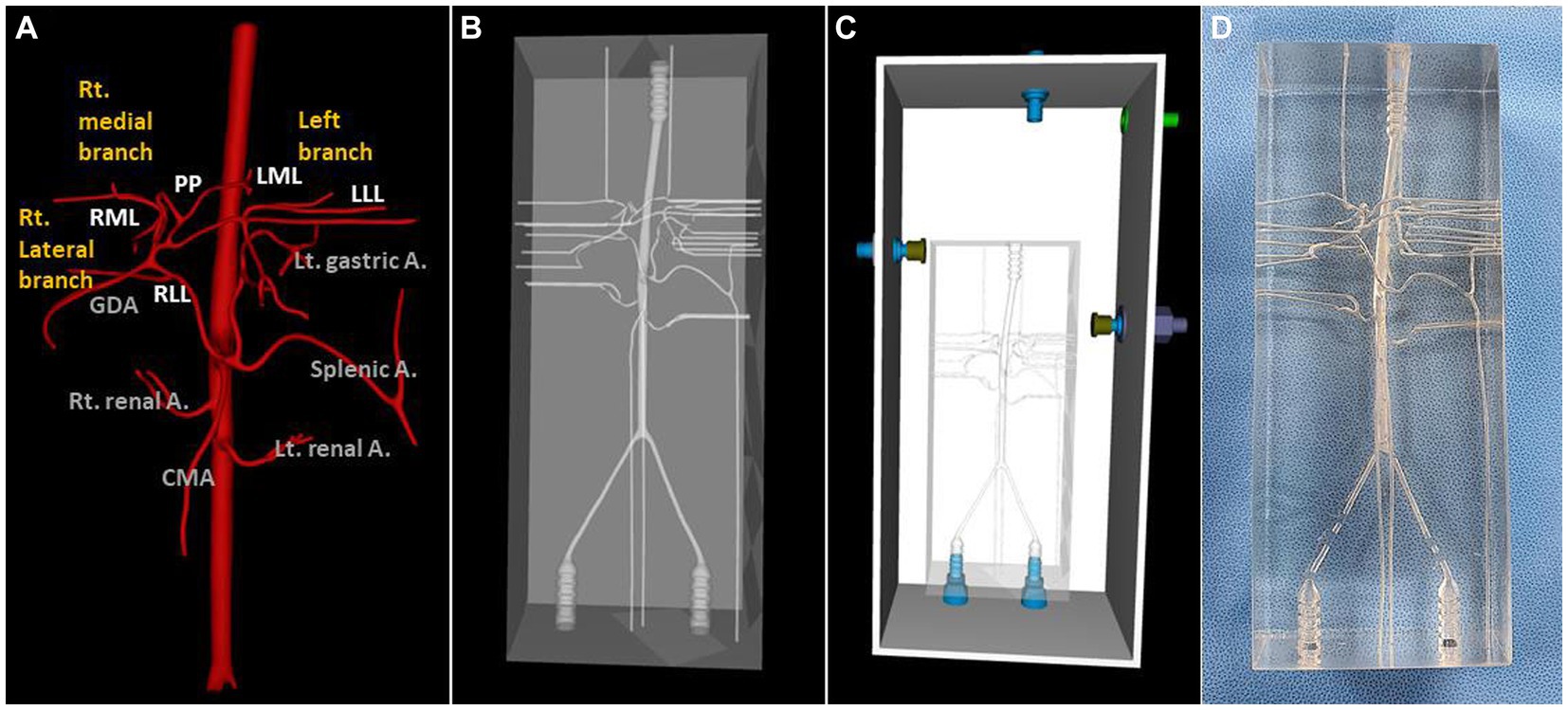
Se seleccionó un perro que pesaba 4,38 kg, tenía un diámetro de arteria celíaca y hepática de 3,21 y 2,21 mm para cada uno y tenía arteria tipo 2-2-1 que tenía TC para masa esplénica para la creación de un modelo 3D de arteria hepática normal. Todas las arterias hepáticas se reflejaron en el modelo real, excepto la arteria de proceso caudado, porque la conexión entre la arteria de proceso caudado y la arteria del lóbulo lateral derecho no se aplicó durante el modelado 3D. Las figuras 4 y 5 ilustran el proceso de modelado 3D y la imagen realista del modelo, y la figura 5 enfatiza la región de la arteria hepática.
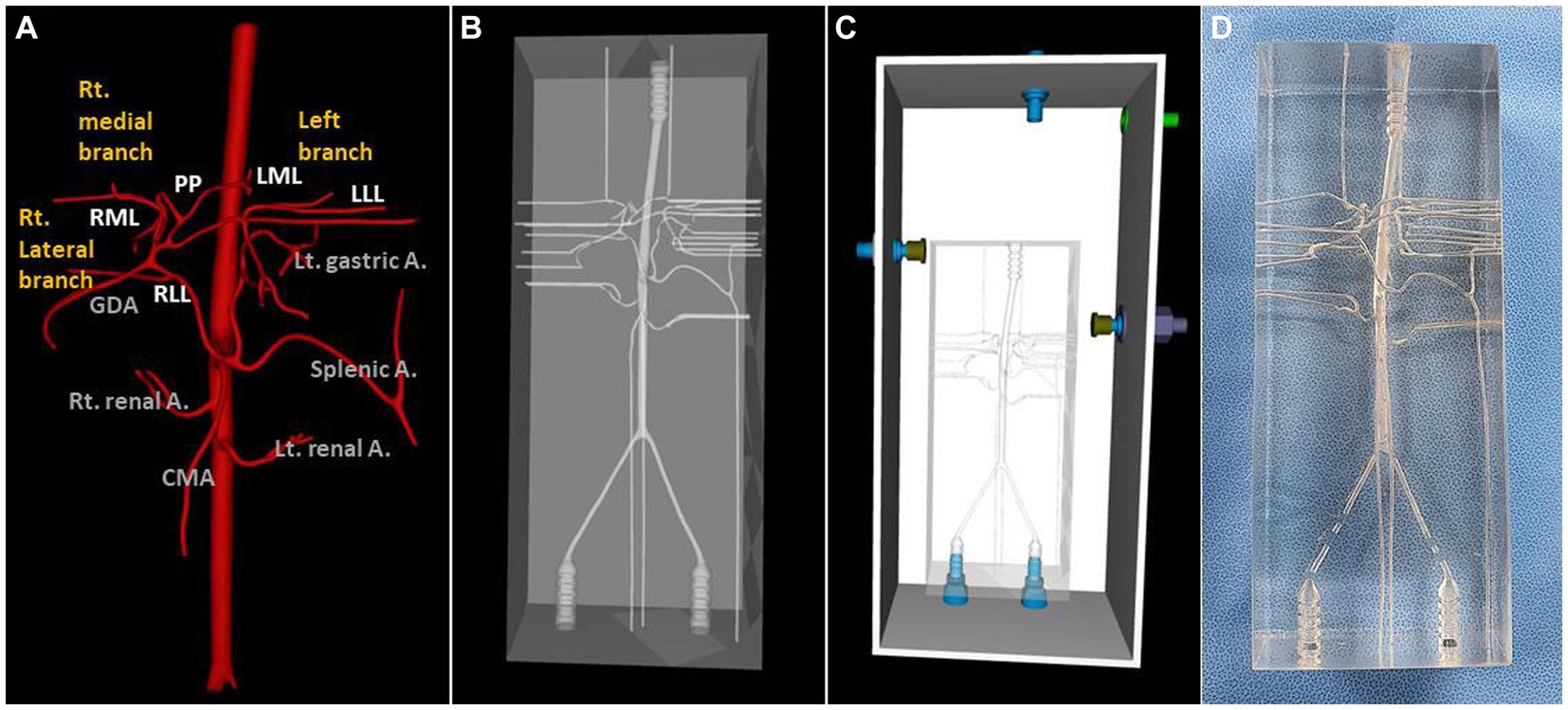 Figura 4. Prototipo virtual de modelado 3D (VP) y la imagen del modelo real de arterias caninas normales de tipo 2-2-1. Vista ventro-dorsal de la arteria hepática VP (A), modelo VP (B), modelo total VP incluyendo piscina acrílica externa (C) y el modelo real (D).
Figura 4. Prototipo virtual de modelado 3D (VP) y la imagen del modelo real de arterias caninas normales de tipo 2-2-1. Vista ventro-dorsal de la arteria hepática VP (A), modelo VP (B), modelo total VP incluyendo piscina acrílica externa (C) y el modelo real (D).
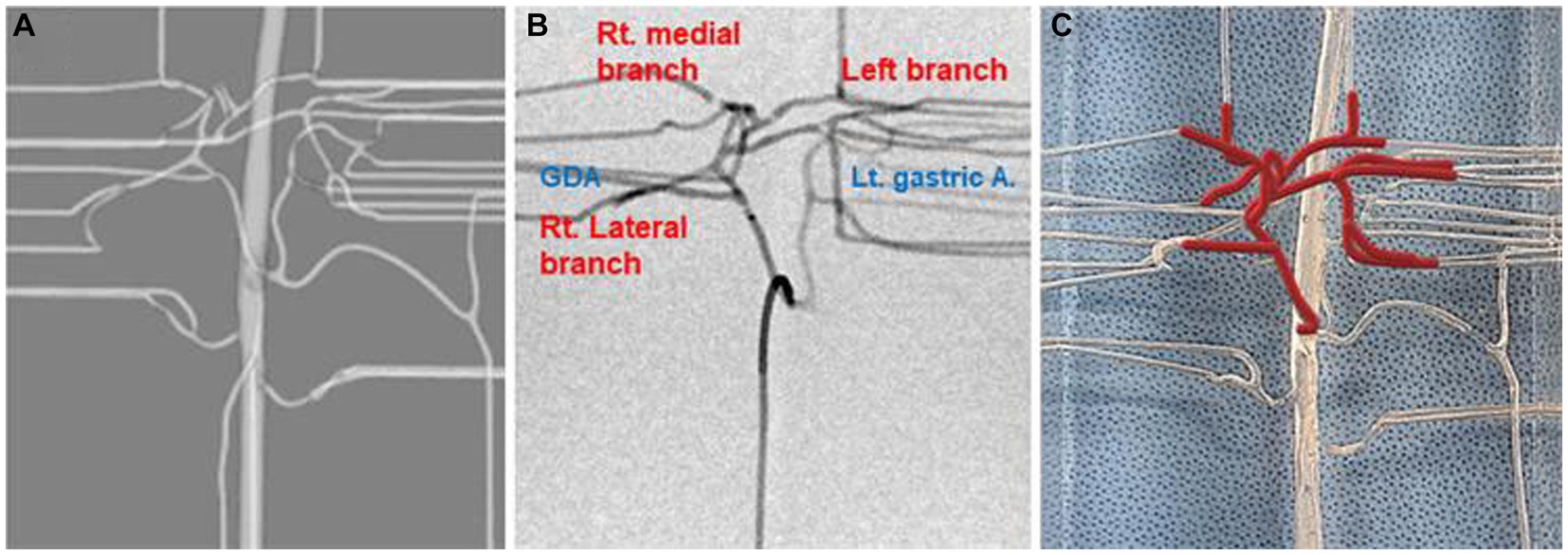 Figura 5. Imagen prototipo virtual de la arteria hepática (A), imagen fluoroscópica con contraste (B) y fotografía del modelo que ilustra las arterias hepáticas en líneas rojas (C).
Figura 5. Imagen prototipo virtual de la arteria hepática (A), imagen fluoroscópica con contraste (B) y fotografía del modelo que ilustra las arterias hepáticas en líneas rojas (C).
Para el modelo de masa hepática 3D, se seleccionó un perro con múltiples lesiones existentes en tres lóbulos hepáticos, de los cuales el tumor más grande se localizaba en el lóbulo medial izquierdo adyacente al diafragma con la entrada de arterias claramente observada, y solo se visualizó el tumor más grande en el modelo. La estructura vascular del tumor hepático era más complicada debido al desarrollo de las arterias, y la inserción del catéter se consideró difícil debido a la fuerza de fricción con la silicona de alta transparencia utilizada en el modelo 3D, por lo que el diámetro de todos los vasos sanguíneos se amplió al doble. La Figura 6 muestra una representación realista del modelo junto con el proceso de modelado 3D.
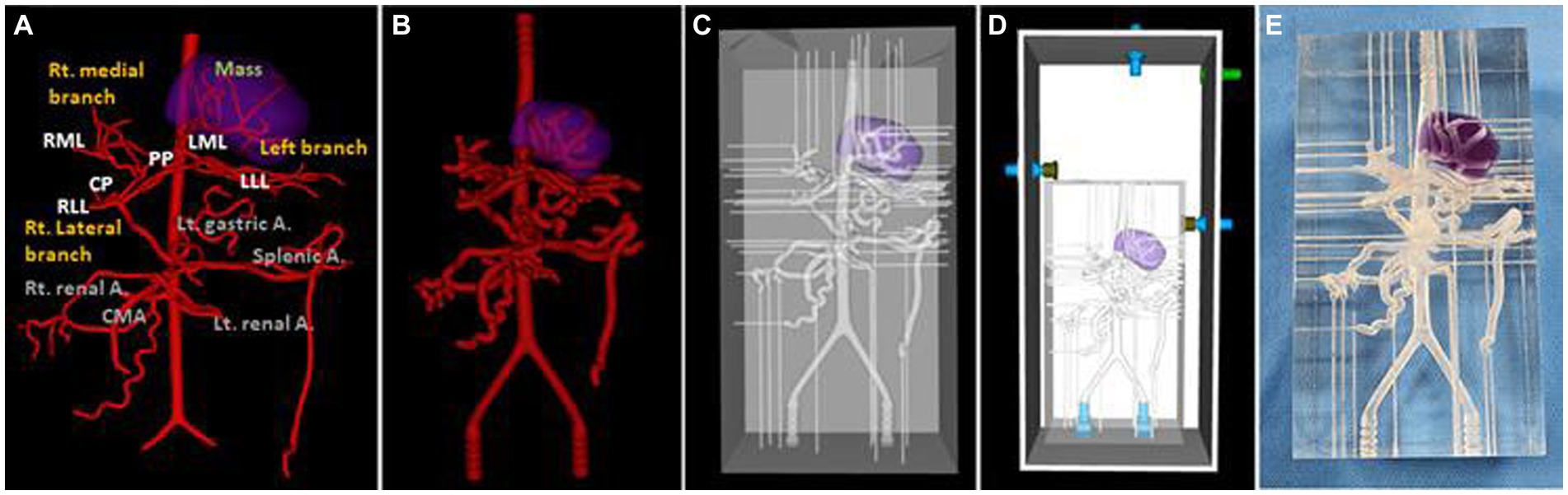 Figura 6. Vista ventro-dorsal del prototipo virtual (VP) de modelado 3D de la masa hepática canina y las arterias (A), VP de la arteria para el modelo real con el tamaño del vaso duplicado (B), modelo VP (C), VP total del modelo incluyendo la piscina acrílica exterior (D) y la fotografía del modelo (E). La lesión de la masa se indica con un área morada.
Figura 6. Vista ventro-dorsal del prototipo virtual (VP) de modelado 3D de la masa hepática canina y las arterias (A), VP de la arteria para el modelo real con el tamaño del vaso duplicado (B), modelo VP (C), VP total del modelo incluyendo la piscina acrílica exterior (D) y la fotografía del modelo (E). La lesión de la masa se indica con un área morada.
Los dos modelos compartían la misma piscina acrílica, y las mangueras de silicona estaban conectadas a una bomba externa para que el agua fluyera desde la aorta descendente hasta la dirección de la arteria ilíaca de la misma manera que el flujo sanguíneo real (Figura 7). Se instalaron canales de salida externos con un diámetro de aproximadamente 1 mm para cada vaso sanguíneo para descargar el flujo de agua en la arteria hacia la piscina exterior. El agua que fluye hacia la piscina se diseñó para entrar de nuevo en la bomba a través de una manguera de silicona.
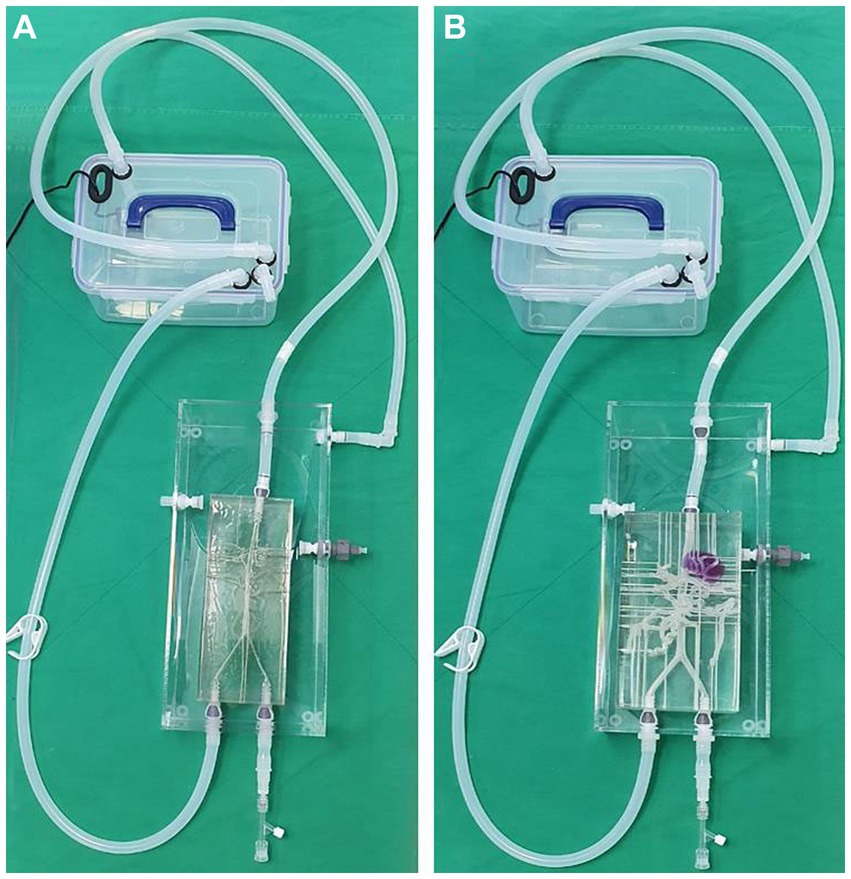 Figura 7. Fotografía del modelo de arteria canina normal (A) y modelo de masa hepática (B) impresos en 3D conectados a la piscina acrílica y combinados con la bomba de flujo mediante mangueras de silicona. Ambos modelos comparten la misma piscina acrílica, bomba de flujo y mangueras de silicona.
Figura 7. Fotografía del modelo de arteria canina normal (A) y modelo de masa hepática (B) impresos en 3D conectados a la piscina acrílica y combinados con la bomba de flujo mediante mangueras de silicona. Ambos modelos comparten la misma piscina acrílica, bomba de flujo y mangueras de silicona.
La inserción del catéter y la embolización se realizaron en todas las arterias hepáticas posibles en el modelo normal. Bajo guía fluoroscópica e inyección de medios de contraste, se verificó que se había seleccionado la arteria deseada, que el flujo sanguíneo era normal antes de la embolización y que las arterias sanguíneas se embolizaron con éxito (Figuras 8, 9). La misma simulación se realizó en el modelo de masa hepática y la embolización se realizó en la entrada de la arteria que ingresa al tumor (Figura 10).
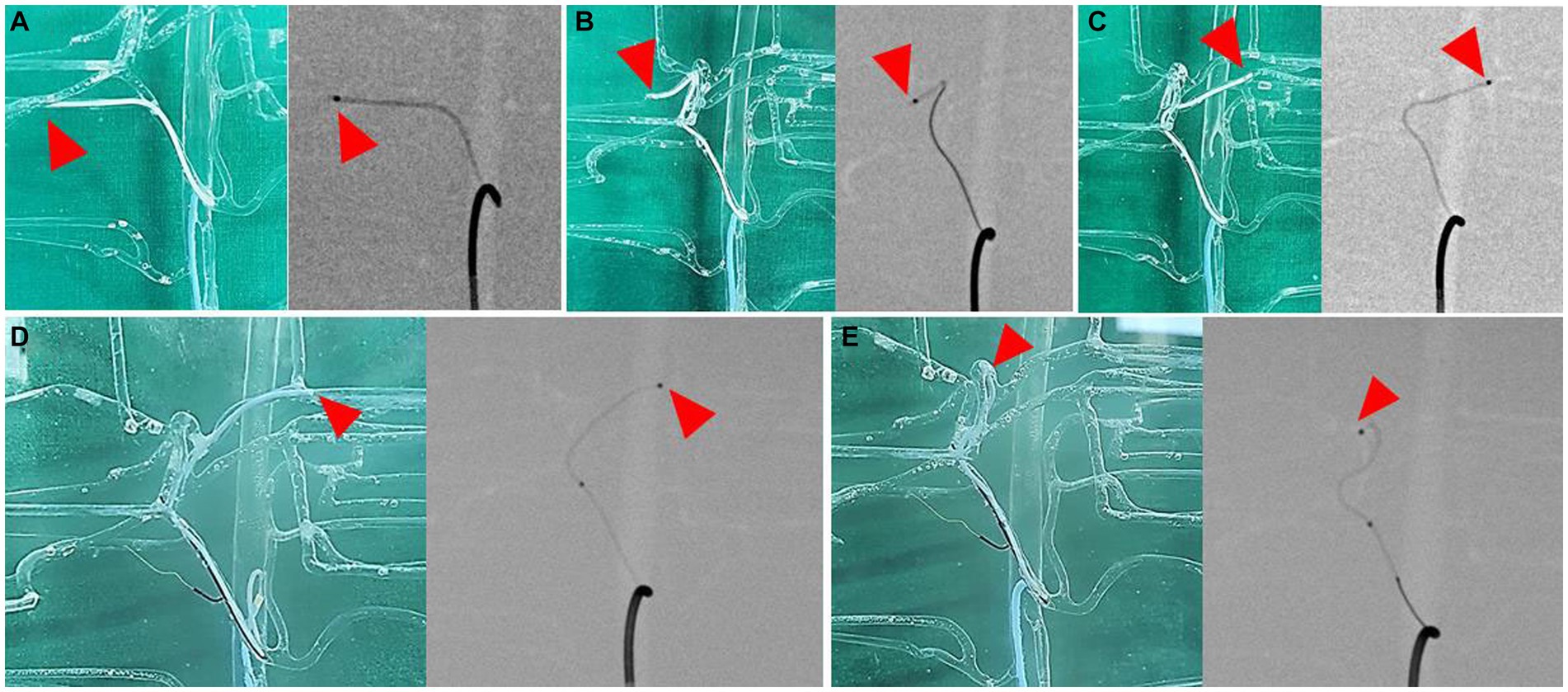 Figura 8. Selección de ramas de la arteria hepática, modelo impreso en 3D (izquierda) e imagen fluoroscópica (derecha) para cada imagen. Superselección de la arteria del lóbulo lateral derecho (A), la arteria del lóbulo medial derecho (B), la arteria del lóbulo lateral izquierdo (C), la arteria del lóbulo medial izquierdo (D) y la arteria de proceso papilar (E). La punta de flecha indica la punta del microcatéter.
Figura 8. Selección de ramas de la arteria hepática, modelo impreso en 3D (izquierda) e imagen fluoroscópica (derecha) para cada imagen. Superselección de la arteria del lóbulo lateral derecho (A), la arteria del lóbulo medial derecho (B), la arteria del lóbulo lateral izquierdo (C), la arteria del lóbulo medial izquierdo (D) y la arteria de proceso papilar (E). La punta de flecha indica la punta del microcatéter.
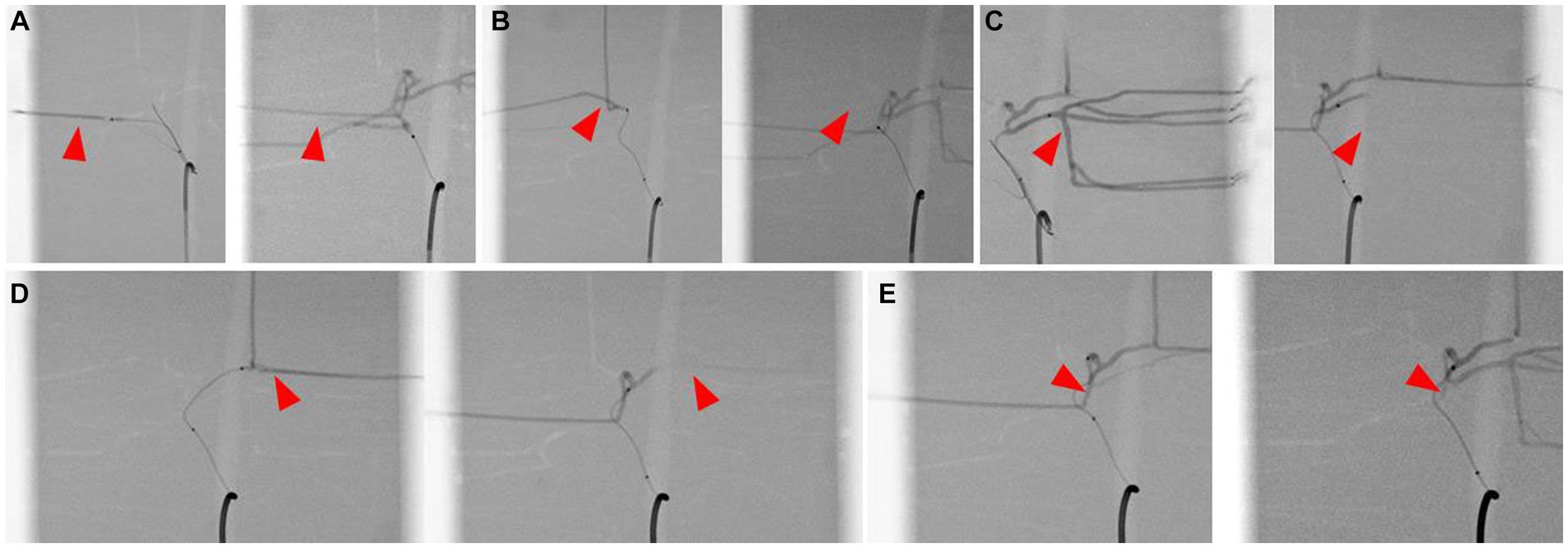 Figura 9. Simulación de la embolización de la arteria hepática de cada lóbulo, imagen fluoroscópica con contraste de la preembolización (izquierda) y la posembolización (derecha) de la arteria del lóbulo lateral derecho (A), la arteria del lóbulo medial derecho (B), la arteria del lóbulo lateral izquierdo (C), la arteria del lóbulo medial izquierdo (D) y la arteria de proceso papilar (E) . La punta de flecha indica la arteria lobar seleccionada, y la ausencia del agente de contraste en las imágenes posteriores a la embolización sugiere la embolización de la arteria.
Figura 9. Simulación de la embolización de la arteria hepática de cada lóbulo, imagen fluoroscópica con contraste de la preembolización (izquierda) y la posembolización (derecha) de la arteria del lóbulo lateral derecho (A), la arteria del lóbulo medial derecho (B), la arteria del lóbulo lateral izquierdo (C), la arteria del lóbulo medial izquierdo (D) y la arteria de proceso papilar (E) . La punta de flecha indica la arteria lobar seleccionada, y la ausencia del agente de contraste en las imágenes posteriores a la embolización sugiere la embolización de la arteria.
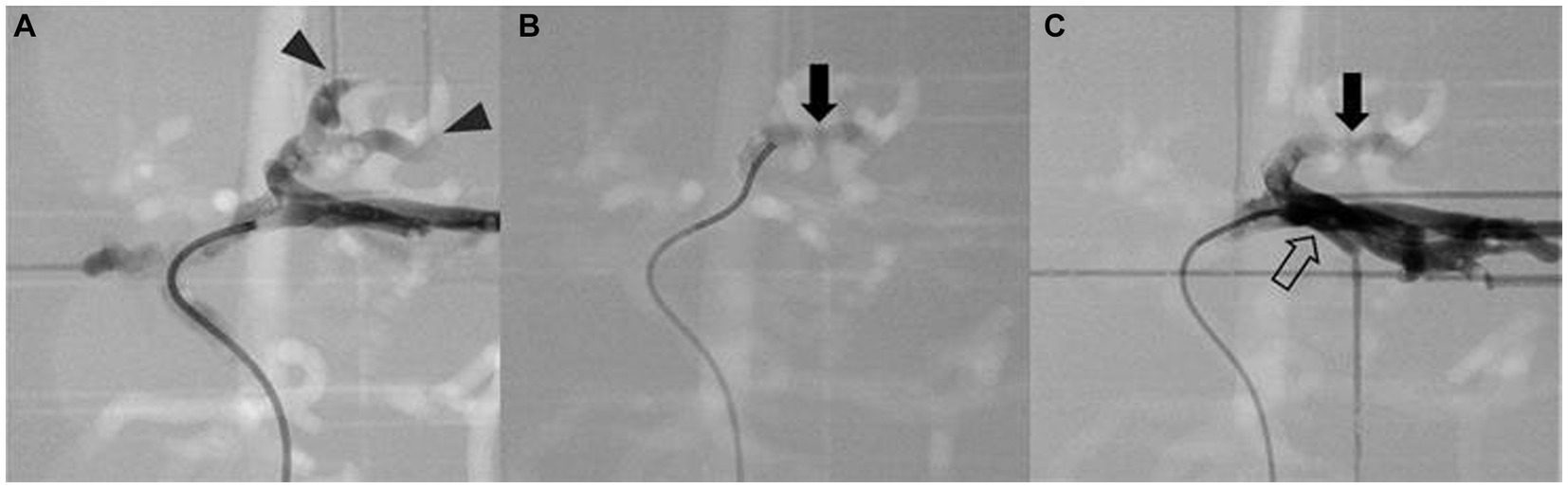 Figura 10. Simulación de embolización arterial de masa hepática. La imagen fluoroscópica con contraste de la preembolización (A) muestra el flujo de los medios de contraste hacia las arterias de masa (punta de flecha), el material de embolización mezclado con medio de contraste (flecha) se encuentra en la inserción de la masa (B), y la imagen posterior a la embolización (C) muestra que el medio de contraste no puede entrar en las arterias embolizadas del tumor y luego regresa a las arterias laterales izquierdas adyacentes (flecha hueca).
Figura 10. Simulación de embolización arterial de masa hepática. La imagen fluoroscópica con contraste de la preembolización (A) muestra el flujo de los medios de contraste hacia las arterias de masa (punta de flecha), el material de embolización mezclado con medio de contraste (flecha) se encuentra en la inserción de la masa (B), y la imagen posterior a la embolización (C) muestra que el medio de contraste no puede entrar en las arterias embolizadas del tumor y luego regresa a las arterias laterales izquierdas adyacentes (flecha hueca).
4 Discusión
En este estudio, se analizó la estructura normal de la arteria hepática de perros de diversos pesos y razas, y el tipo de arteria hepática más común fue el tipo 2-2-1, al igual que en los estudios anteriores (17-20). Los diámetros de las arterias celíaca y hepática se identificaron como 3,28 ± 0,77 y 2,14 ± 0,43 mm para cada una en este estudio, con un peso corporal que varió de 1,6 a 25,0 kg, y se encontró que las arterias celíaca y hepática tuvieron una correlación significativa con el peso. En el grupo de tumores hepáticos, el 44,6% (29/65) de los casos tenían tumores en lóbulos múltiples y el 64,6% (42/65) tenían al menos una lesión en división central o derecha. Se realizaron dos modelos 3D de arterias hepáticas para la simulación de TAE. En el grupo de arteria hepática normal, se seleccionó un perro con el diámetro de la arteria celíaca y la arteria hepática más cercano a los valores medios de 3,28 y 2,14 mm, respectivamente, y con un tipo de rama más común de la arteria hepática de 2-2-1 para el modelo de arteria hepática normal. En el grupo de tumores hepáticos, se seleccionó un perro con lesiones multifocales adyacentes al diafragma, que son difíciles de operar, con entrada arterial en los tumores claramente observadas en la fase arterial de TC para la producción del modelo 3D. Con el uso de estos modelos, la colocación de microcatéteres y la embolización de cada arteria lobar fue posible tanto en el modelo de arteria hepática normal como en el modelo de masa hepática, incluso cuando la angiogénesis y el efecto de masa complicaron aún más las arterias.
En este estudio, solo el 38,5% (25/65) del grupo de masa hepática tenía una lesión hepática solitaria, y el 44,6% (29/65) del grupo tenía lesiones multifocales en múltiples lóbulos, para las cuales no se recomienda la resección quirúrgica y la ETA puede ser la opción de tratamiento efectiva. Incluso con la lesión solitaria, que se sabe que el pronóstico es bueno con cirugía, la dificultad y el resultado de la lobectomía difieren de la división debido a la anatomía del hígado (30). La lobectomía de la división izquierda suele ser más sencilla, y la lobectomía de la división derecha o central muestra más complicaciones y mortalidades (8, 30), la ETA se puede aplicar a una masa hepática masiva solitaria en la división derecha y central de forma más eficaz que la cirugía. Por lo tanto, se buscó elegir un paciente con múltiples lesiones y la masa más grande localizada en la división derecha o central, sin embargo, para la implementación precisa de los vasos sanguíneos, se necesitaban imágenes de TC con arterias claramente obtenidas, por lo que elegimos al paciente con una lesión en el lóbulo medial izquierdo, pero cerca del diafragma, para el modelo de masa hepática. Del mismo modo, elegimos un paciente que se cree que es difícil de operar, ya que en medicina veterinaria se desconocen los criterios exactos en los que la ETA es más efectiva que la resección quirúrgica. En medicina humana, existen muchos criterios para la selección del tratamiento adecuado para la masa hepática, como el estadio BCLC, la puntuación de Child-Pugh y la puntuación ECOG (puntuación PS) (31-33). Pero las causas y los tipos de tumores hepáticos son diferentes entre humanos y perros, al igual que los tumores hepáticos son comúnmente impulsados por la cirrosis asociada con el virus de la hepatitis B y C, y el consumo excesivo de alcohol y los tipos nodulares y difusos son más comunes en humanos (34, 35), es difícil aplicar los mismos criterios en medicina veterinaria. Por ejemplo, las masas hepáticas de más de 7 cm se clasifican como una indicación de mal pronóstico de TACE en humanos (31-33), pero de acuerdo con informes de casos anteriores en perros, la TAE se aplicó con éxito en perros con un tamaño de masa máxima de más de 7 cm (36, 37). Por lo tanto, se necesitarán nuevos criterios TAE y TACE que sean adecuados para los perros.
Existen algunas limitaciones de los modelos de este estudio. En primer lugar, debido a la naturaleza de la silicona de alta transparencia utilizada para los modelos, la fuerza de fricción fue mayor que la de los vasos sanguíneos reales, y aunque se eligieron y utilizaron catéteres adecuados para el diámetro de los vasos sanguíneos durante la simulación, se necesitó más fuerza a medida que aumentaba el número de curvaturas de los vasos, lo que repercutió en el aumento de la fuerza de fricción. La decisión de utilizar el material para el modelo con esta restricción se tomó debido a la rentabilidad, así como a las limitaciones tecnológicas actuales, como las relacionadas con los procesos de fabricación y la imposibilidad de revestir el interior de pequeñas embarcaciones. En su lugar, fue posible utilizarlo de forma semipermanente mejorando la durabilidad para reflejar las propiedades elásticas de los vasos sanguíneos mediante la adopción del material de silicona actual. Para crear un modelo utilizando un material novedoso que refleje las propiedades del endotelio vascular real y que también tenga una buena durabilidad, se requerirá más investigación sobre los materiales recientemente desarrollados e intentos de actualizar los modelos.
En segundo lugar, en este estudio, la arteria de proceso caudado no se reflejó en el modelo de arteria hepática normal. La discontinuidad de la arteria de proceso caudado de la arteria del lóbulo lateral derecho se observó en la imagen DICOM de la fase arterial debido al pequeño ancho de los vasos sanguíneos y a las características de la posición terminal, que se pueden tener en cuenta hasta cierto punto al evaluar la imagen, pero no se reflejó con precisión en la creación del modelo 3D. Sin embargo, cuando se omiten los vasos sanguíneos, se puede mejorar proporcionando instrucciones claras y una observación cuidadosa de los vasos sanguíneos terminales que son propensos a la omisión al volver a fabricar el modelo.
Finalmente, se utilizó una bomba externa y mangueras con clips para determinar la dirección y velocidad del flujo sanguíneo. Sin embargo, se observó una circulación más deficiente cuanto más lejos estaban los vasos sanguíneos de la aorta, y en el modelo tumoral, esto se debió a la intrincada estructura de los vasos sanguíneos y al hecho de que los tractos de salida externos se hicieron a aproximadamente 1 mm para la embolización, que es relativamente pequeña y puede perturbar la descarga de agua fuera de los vasos. Al cambiar la forma en que la sangre sale de la arteria y reemplazar la bomba, se puede hacer que se parezca lo más posible al flujo sanguíneo real.
En conclusión, analizamos las estructuras de las arterias hepáticas en perros, incluidos perros de razas pequeñas y toy, que oscilaban entre 1,6 y 25,0 kg, que no se incluyeron en estudios previos, y el resultado mostró que el tipo de rama arterial más común era el mismo que en estudios anteriores. Además, los diámetros de las arterias celíacas y hepáticas, que son importantes para seleccionar el tamaño del catéter en el procedimiento de TAE, tienen una correlación positiva con el peso del perro. En el grupo de masa hepática, alrededor del 45% de ellos tenían lesiones multifocales en múltiples lóbulos hepáticos, cuyo procedimiento de TAE puede ser efectivo. A lo largo de este estudio, creamos modelos 3D de arterias caninas con y sin tumores que pueden simular procedimientos de TAE de forma repetible, ya sea necesario producir modelos actualizados mediante la optimización del material de los modelos, la reflexión precisa de la estructura vascular y el flujo sanguíneo real. Se prevé que el desarrollo de estos modelos permitirá una mayor activación de los procedimientos intervencionistas en medicina veterinaria. Esperamos que los profesionales puedan aumentar su competencia practicando la selección en los vasos sanguíneos hepáticos a través de los modelos creados en este estudio y considerando las características de los animales que necesitan anestesia general incluso para procedimientos intervencionistas, el aumento de la competencia también puede acortar la duración de la anestesia, que es crucial para el pronóstico postoperatorio. Además, puede ser la respuesta al dilema ético al reemplazar el uso de animales de experimentación para practicar procedimientos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió aprobación ética para el estudio con seres humanos de acuerdo con la legislación local y los requisitos institucionales. No se requirió el consentimiento informado por escrito para participar en este estudio de los participantes o de los tutores legales o familiares más cercanos de los participantes, de acuerdo con la legislación nacional y los requisitos institucionales. No se requirió aprobación ética para el estudio con animales de acuerdo con la legislación local y los requisitos institucionales, ya que este estudio se realizó como un estudio retrospectivo.
Contribuciones de los autores
MO: Escritura – borrador original. JB: Escritura, borrador original. YL: Escritura – borrador original. ML: Escritura – borrador original. SK: Escritura – borrador original. Reino Unido: Redacción – borrador original. JP: Escritura – borrador original. JH: Escritura, borrador original. JC: Escritura – borrador original. BK: Escritura – borrador original. HY: Escritura – borrador original. NL: Escritura-borrador original. DC: Escritura – borrador original.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo contó con el apoyo de una subvención del Instituto para la Promoción de las Tecnologías de la Información y las Comunicaciones (IITP) financiada por el gobierno de Corea (MSIP) (No. 2021-0-00490, Desarrollo de tecnología de análisis e imágenes de precisión para ondas de radio biológicas).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Molinos, PC . Un modelo para investigar la extracción hepática de oxígeno durante la anestesia en el perro. Res Vet Sci. (2003) 75:179–83. doi: 10.1016/S0034-5288(03)00140-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Breedis, C y Young, G . Irrigación sanguínea de neoplasias en el hígado. Am J Pathol. (1954) 30:969–77.
3. Colombo, M . Tratamiento del carcinoma hepatocelular. J Hepatía viral. (1997) 4:125–30. doi: 10.1111/j.1365-2893.1997.tb00173.x
4. Liu, L , Chen, H , Wang, M , Zhao, Y , Cai, G , Qi, X, et al. Terapia combinada de sorafenib y TACE para el CHC irresecable: una revisión sistemática y metanálisis. PLoS Uno. (2014) 9:e91124. doi: 10.1371/journal.pone.0091124
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Weisse, C , Clifford, CA , Holt, D y Salomón, J.A. . Embolización arterial percutánea y quimioembolización para el tratamiento de tumores benignos y malignos en tres perros y una cabra. JAVMA. (2002) 221:1430–6. doi: 10.2460/javma.2002.221.1430
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Liptak, JM , Dernell, WS y Withrow, SJ . Tumores hepáticos en perros y gatos. Compendio. (2004) 26:50–7. doi: 10.5555/20043033885
7. Kosovsky, JE , Manfra Marretta, S , Matthiesen, DT y Patnaik, AK . Resultados de la hepatectomía parcial en 18 perros con carcinoma hepatocelular. J Am Anim Hosp Assoc. (1989) 25:203–6.
8. Liptak, JM , Dernell, WS , Monnet, E , Poderes, SER , Bachand, AM , Kenney, JG, et al. Carcinoma hepatocelular masivo en perros: 48 casos (1992-2002). J Am Vet Med Assoc. (2004) 225:1225–30. doi: 10.2460/javma.2004.225.1225
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Patnaik, AK , Hurvitz, IA , Lieberman, PH y Johnson, GF . Carcinoma hepatocelular canino. Veterinario Pathol. (1981) 18:427–38. doi: 10.1177/030098588101800402
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Cullen, JM y Popp, JA . Tumores de hígado y vesícula biliar En: DJ Morris editor. Tumores en animales domésticos, Ames: Iowa State Press (2002). págs. 483-508.
11. Elpiner, AK , Brodsky, EM , Hazzah, TN y Post, GS . Quimioterapia con gemcitabina en monoterapia en perros con carcinomas hepatocelulares. Veterinario Comp Oncol. (2011) 9:260–8. doi: 10.1111/j.1476-5829.2011.00262.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Vail, DM , Thamm, DH y Liptak, JM . Tumores hepatobiliares. Withrow MacEwen’s Small Anim Clin Oncol. (2019) 23:454–60. ISBN: 978-0-323-59496-7.
13. Marconato, L , Sabattini, S , Marisi, G , Rossi, F , Leone, VF y Casadei-Gardini, A . Sorafenib para el tratamiento del carcinoma hepatocelular irresecable: datos preliminares de toxicidad y actividad en perros. Cáncer. (2020) 12:1272. doi: 10.3390/cancers12051272
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Fenner, J , Caín, A , Wray, J y Tappin, S . Quimioembolización arterial repetida en un perro con un carcinoma hepatocelular irresecable. Representante de casos de Vet Rec. (2017) 5:E000445. doi: 10.1136/vetreccr-2017-000445
15. Weisse, C y Berent, A . Tumores/metástasis hepáticas (TAE/cTACE/DEB-TACE). Imagen Veterinaria Interv. (2015) 23:238–46. doi: 10.1002/9781118910924.ch23
16. Kawamura, Y , Itou, H , Kida, A , Sunakawa, H , Suzuki, M y Kawamura, K . Respuesta terapéutica y factores pronósticos de 14 perros sometidos a embolización arterial transcatéter por masas hepatocelulares: un estudio retrospectivo. J Veterinario Pasante Med. (2023) 37:1455–65. doi: 10.1111/jvim.16746
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Schmidt, S , Lohse, CL y Suter, PF . Patrones de ramificación de la arteria hepática en el perro: estudio arteriográfico y anatómico. Am J Vet Res. (1980) 41:1090–7.
18. Úrsico, M , Ravnik, D , Hribernik, M , Pecar, J , Butinar, J y Fazarinc, G . Anatomía macroscópica de las ramificaciones de la vena porta y la arteria hepática en perros: estudio de moldes por corrosión. Anat Histol Embrionario. (2007) 36:83–7. doi: 10.1111/j.1439-0264.2006.00719.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Oishi, Y , Tani, K , Nakazawa, H , Itamoto, K , Haraguchi, T y Taura, Y . Evaluación anatómica del sistema vascular hepático en beagles sanos mediante tomografía computarizada con contraste de rayos X. J Vet Med Sci. (2015) 77:925–9. doi: 10.1292/jvms.14-0469
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Soochan, K , Seongmok, J , Heechun, L , Youngwon, L y Hojung, C . Anatomía tomográfica computarizada de la arteria hepática en perros beagle normales. Kor J Vet Res. (2019) 59:55–8. doi: 10.14405/kjvr.2019.59.2.55
21. Johnny Altwal, BS , Wilson, CH y Griffon, DJ . Aplicaciones de la impresión tridimensional en cirugía de pequeños animales: una revisión de las prácticas actuales. Cirugía veterinaria. (2022) 51:34–51. doi: 10.1111/vsu.13739
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Hespel, AM , Wilhite, R y Hudson, J . Solicitud de revisión invitada para impresoras 3D en medicina veterinaria. Ecografía Radiol Veterinaria. (2014):1–12. doi: 10.1111/vru.12176
23. Pınar, YH y Çağdaş, OTO . Impresión 3D en medicina veterinaria. Veterinario de la Universidad de Ankara, Fak Derg. (2022) 69:111–7. doi: 10.33988/auvfd.871913
24. Haleem, A , Javaid, M y Suman, R . Aplicaciones de impresión 3D para el campo veterinario. Indio J Anim Hlth. (2019) 58:171–3. doi: 10.36062/ijah.58.2.2019
25. Ríos, RD , Zarzosa, GR , Laguía, MS , Kilroy, D , Gomariz, FM , Collado, CS, et al. Creación de modelos anatómicos vasculares y biliares tridimensionales para el estudio del hígado felino (Felis silvestris catus L.): estudio comparativo de TAC, representación volumétrica (Vr), yeso e impresión 3D. Animales. (2023) 13:1573. doi: 10.3390/ani13101573
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Frymus, J , Trebacz, P , Kurkowska, A , Pawlik, M , Barteczko, A , Baranski, M, et al. Modelos tridimensionales de vasos hepáticos para la navegación durante la atenuación laparotómica de la derivación portosistémica intrahepática en perros. Animales. (2023) 13:2004. doi: 10.3390/ani13122004
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Itagaki, MW . Uso de modelos impresos en 3D para la planificación y el guiado durante la intervención endovascular: un avance técnico. Diagn Interv Radiol. (2015) 21:338–41. doi: 10.5152/dir.2015.14469
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Schmauss, D , Schmitz, C , Bigdeli, AK , Weber, S , Gerber, N , Beiras-Fernandez, A, et al. Impresión tridimensional de modelos para la planificación preoperatoria y simulación de reemplazo valvular transcatéter. Ann Thorac Surg. (2012) 93:e31-3. doi: 10.1016/j.athoracsur.2011.09.031
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Bustamante, S , Bose, S , Obispo, P , Klatte, R y Norris, F . Novedosa aplicación de prototipado rápido para la simulación de anatomía broncoscópica. J Cardiotorácico Vasc Anesth. (2014) 28:1122–5. doi: 10.1053/j.jvca.2013.08.015
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Linden, DS , Liptak, JM , Vinayak, A , Cappelle, K , Hoffman, C , Fan, S, et al. Resultados y variables pronósticas asociadas a lobectomías hepáticas por división central: 61 perros. Cirugía veterinaria. (2019) 48:309–14. doi: 10.1111/vsu.13164
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Bruix, J y Sherman, M . Manejo del carcinoma hepatocelular: una actualización. Hepatología. (2011) 53:1020–2. doi: 10.1002/hep.24199
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Gao, Q , Wang, X-Y , Zhou, J y Fan, J . La heterogeneidad del CHC en estadio intermedio requiere un tratamiento personalizado que incluya cirugía. Nat Rev Clin Oncol. (2015) 12:10. doi: 10.1038/nrclinonc.2014.122-c1
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Miyayama, S . Estrategia de tratamiento de la quimioembolización transarterial para el carcinoma hepatocelular. Appl Sci. (2020) 10:7337. doi: 10.3390/app10207337
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Singh, AK , Kumar, R y Abhay, K . Carcinoma hepatocelular de Pandey: causas, mecanismo de progresión y biomarcadores. Curr Chem Genom Transl Med. (2018) 12:9–26. doi: 10.2174/2213988501812010009
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Tarao, K , Nozaki, A , Ikeda, T , Sato, A , Komatsu, H , Komatsu, T, et al. Impacto real de la cirrosis hepática en el desarrollo de carcinoma hepatocelular en diversas enfermedades hepáticas: evaluación metaanalítica. Cancer Med. (2019) 8:1054–65. DOI: 10.1002/CAM4.1998
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Iwai, S , Okano, S , Chikazawa, S , Kakizaki, T , Sakonju, I y Salomón, J.A. . Embolización arterial transcatéter para el tratamiento del carcinoma hepatocelular en un gato. J Am Vet Med Assoc. (2015) 247:1299–302. doi: 10.2460/javma.247.11.1299
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Oishi, Y , Tani, K y Taura, Y . Embolización arterial transcatéter en cuatro perros con carcinoma hepatocelular. J Pequeña Anim Pract. (2019) 60:761–6. doi: 10.1111/jsap.12944
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: carcinoma hepatocelular, embolización transarterial, modelo de arteria hepática canina impreso en 3D, quimioembolización transarterial, intervención
Cita: Oh M, Ban J, Lee Y, Lee M, Kim S, Kim U, Park J, Han J, Chang J, Kim B, Yun H, Lee N y Chang D (2024) Desarrollo de un modelo tridimensional de tumor hepático canino basado en angiografía por tomografía computarizada para la simulación de la embolización transarterial. Frente. Vet. Sci. 10:1280028. doi: 10.3389/fvets.2023.1280028
Recibido: 19 de agosto de 2023; Aceptado: 13 de diciembre de 2023;
Publicado: 30 enero 2024.
Editado por:
Riccardo Inchingolo, Ospedale Generale Regionale F. Miulli, Italia
Revisado por:
Alessia Cordella, Universidad de Pensilvania, Estados
Unidos Antonio Rosario Pisani, Universidad de Bari Aldo Moro, Italia
Tereza Cristina Cardoso, Universidade Estadual de São Paulo, Brasil
Derechos de autor © 2024 Oh, Ban, Lee, Lee, Kim, Kim, Park, Han, Chang, Kim, Yun, Lee y Chang. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Dongwoo Chang, dwchang@cbnu.ac.kr
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía