Desarrollo y caracterización de una línea celular respiratoria porcina
 Desarrollo y caracterización de una línea celular respiratoria porcina inmortalizada para la investigación del virus de la influenza A
Desarrollo y caracterización de una línea celular respiratoria porcina inmortalizada para la investigación del virus de la influenza A
 Peter J. Neasham1,2
Peter J. Neasham1,2  Vasilis C. Pliasas1,2
Vasilis C. Pliasas1,2  J. Fletcher Norte1,2
J. Fletcher Norte1,2  Celeste Johnson1
Celeste Johnson1  S. Marcos Tompkins2,3
S. Marcos Tompkins2,3  Constantinos S. Kyriakis1,2,3*
Constantinos S. Kyriakis1,2,3*- 1Departamento de Patobiología, Facultad de Medicina Veterinaria, Universidad de Auburn, Auburn, AL, Estados Unidos
- 2Centro de Excelencia para la Investigación y Vigilancia de la Influenza (CEIRS) de Emory-UGA, Atlanta, GA, Estados Unidos
- 3Centro de Vacunas e Inmunología, Universidad de Georgia, Athens, GA, Estados Unidos
Introducción: Los cerdos son una importante especie huésped intermedia para generar nuevos virus de la influenza A (IAV) con potencial pandémico debido a la susceptibilidad del huésped a los IAV de origen porcino, humano y aviar. Las líneas celulares respiratorias primarias se utilizan en la investigación de IAV para modelar el tracto respiratorio superior del huésped in vitro. Sin embargo, las líneas celulares primarias están limitadas por su capacidad de paso y requieren mucho tiempo para su uso en la industria y las líneas de investigación. Estábamos interesados en desarrollar y caracterizar una línea celular respiratoria porcina inmortalizada biológicamente relevante que pudiera usarse para la propagación y caracterización eficiente de aislados de IAV porcinos.
Métodos: Se aisló tejido pulmonar para la generación de células respiratorias primarias de cerdo de los bronquios de un cerdo Yorkshire/Hampshire de 8 semanas de edad, que se inmortalizaron mediante la transducción del antígeno SV40 T utilizando un vector lentivirus. La transducción del antígeno SV40 T se confirmó mediante RT-PCR en tiempo real en células que pasaron más de veinte veces.
Resultados: Las células respiratorias porcinas inmortalizadas expresaron principalmente receptores de ácido siálico α2,6 y fueron susceptibles a los virus de la influenza aviar tanto porcina como humana, y los virus porcinos exhibieron tasas de replicación más altas. En particular, la infección con un aislado de H3N2 porcino provocó un aumento de la secreción de proteínas IL-6 e IL-1α en comparación con un virus H3N2 humano estacional. Incluso después de 20 pasadas, las células inmortalizadas mantuvieron el fenotipo de células respiratorias primarias y permanecieron permisivas a la infección por IAV sin tripsina exógena.
Discusión: En resumen, nuestra línea celular respiratoria porcina inmortalizada desarrollada ofrece un sustrato alternativo in vitro para estudiar la dinámica de replicación y transmisión del IAV en cerdos, superando las limitaciones de las células respiratorias primarias en términos de baja supervivencia de paso y costo.
Introducción
Los virus de la influenza A (IAV, por sus siglas en inglés) son virus de ARN con envoltura y detección negativa con un genoma monocatenario y segmentado, que pertenecen a la familia Orthomyxoviridae. Las aves silvestres sirven como reservorio natural del IAV. Sin embargo, el IAV tiene un rango de hospedadores relativamente amplio y se ha aislado en especies de aves y mamíferos, incluyendo: aves domesticadas, humanos, cerdos, caninos, equinos, felinos y mamíferos acuáticos. La capacidad del IAV para saltar las barreras de múltiples especies es posible gracias a la naturaleza segmentada del genoma del IAV, que permite la reorganización de segmentos de genes completos entre las cepas coinfectantes del IAV y la falta de un mecanismo de corrección que permita la rápida deriva de las glicoproteínas de la superficie del virus (1).
En los mamíferos huéspedes, se sabe que el IAV causa enfermedades respiratorias. El IAV entra en el tracto respiratorio y entra en las células epiteliales primariamente respiratorias que expresan receptores de glicoproteínas que terminan con ácidos siálicos (SA). El SA se une a una molécula de galactosa, que proporciona un sitio de reconocimiento para el dominio de unión al receptor (RBS) de la proteína hemaglutina (HA) del IAV, lo que facilita la endocitosis mediada por el receptor. La proteína HA puede unirse a los receptores SA en una confirmación ligada a 2,3 o 2,6. Las cepas de origen aviar se unen preferentemente a las células huésped en una configuración 2,3, mientras que las cepas de origen mamífero se unen preferentemente en una configuración 2,6 (2-6). La distribución de los receptores SA está implicada como un factor del rango del huésped que los IAV deben superar para cruzar las barreras de las especies.
En los huéspedes humanos y porcinos, la distribución de los AS ligados a α2,3 y α2,6 es similar en el tracto respiratorio (7-9). Sin embargo, los IAV que codifican únicamente un segmento de genes de origen humano (hu) se aíslan de los cerdos durante la vigilancia pasiva (10-13). Esto sugiere que la transmisión zoonótica inversa de los IAV en la interfaz humano/porcino no depende únicamente de la distribución de SA del huésped, sino que múltiples factores del huésped y virales están involucrados en la capacidad del IAV para transmitirse y replicarse de manera eficiente dentro del huésped porcino (14).
Las líneas celulares se utilizan a menudo en la investigación de IAV para propagar y evaluar el potencial de transmisión y replicación de nuevos aislados dentro de un huésped particular para la preparación ante pandemias. Las líneas celulares epiteliales respiratorias primarias son actualmente el modelo celular de referencia para evaluar las propiedades físicas de las cepas de IAV y pueden diferenciarse completamente en un sistema de interfaz aire-líquido (ALI) para producir un epitelio pseudoestratificado, que contiene células ciliadas y células caliciformes, que modela la estructura respiratoria y la arquitectura de los pulmones del huésped in vitro (3, 15-18). Sin embargo, las líneas celulares primarias están limitadas por el bajo número de pases antes de alcanzar la senescencia, la susceptibilidad a la contaminación y la verificación de la ausencia de patógenos, el alto costo de los reactivos necesarios para cultivar y mantener las células en ALI, la variabilidad de donante a donante, la disponibilidad de tejido huésped y el tiempo necesario para diferenciar completamente las células (3-4 semanas en ALI). En consecuencia, las líneas celulares respiratorias inmortalizadas se utilizan como un modelo celular alternativo para estudiar las propiedades de los aislados de IAV para un huésped susceptible. Sin embargo, las líneas celulares respiratorias inmortalizadas pueden haber alterado las propiedades físicas de la célula huésped primaria. Esto incluye la pérdida de la capacidad de secretar proteasas necesarias para la entrada del IAV en la célula huésped y diferenciarse. Las células traqueales y epiteliales nasales (siNEC) porcinas inmortalizadas se han desarrollado previamente mediante la transducción del antígeno SV40-T utilizando un vector lentivirus (19). Las líneas celulares siTEC y siNEC fueron permisibles para las cepas H1N1, H1N2 y H3N2 IAV y conservaron las características funcionales de las células primarias (19).
En este estudio, desarrollamos una línea celular epitelial bronquial porcina inmortalizada para la investigación de IAV mediante la introducción del antígeno del virus simio 40 (SV40-T) en células respiratorias porcinas primarias extraídas de los bronquios de un cerdo seronegativo para virus respiratorio y reproductivo porcino (PRRSv) e IAV de 8 semanas de edad. Las células epiteliales bronquiales porcinas (PBEC) han sido inmortalizadas mediante la administración de transcriptasa inversa de telomerasa humana (h-TERT), para extender la capacidad replicativa de las células a través de la extensión de la telomerasa (20). Sin embargo, nuestro objetivo principal fue establecer una línea celular epitelial bronquial porcina inmortalizada mediante la transducción del antígeno SV40-T.
Las células respiratorias porcinas inmortalizadas aparecieron en su mayoría de origen epitelial y conservaron características morfológicas de las células primarias porcinas. Además, tanto las células respiratorias porcinas primarias como las inmortalizadas fueron permisivas a los IAV humanos (huIAV) y porcinos (swIAV) de los subtipos H1N1, H1N2 y H3N2 que circulan más predominantemente en la interfaz humano/porcino y modelaron la restricción del huésped del H3N2 de origen totalmente humano observada en el huésped porcino. Nuestros resultados sugieren que las células respiratorias porcinas inmortalizadas podrían utilizarse como un modelo celular inmortalizado apropiado para el tracto respiratorio inferior del huésped porcino y pueden servir como herramienta para estudiar el potencial de transmisión y replicación de nuevas cepas de IAV.
Materiales y métodos
Cultivos celulares y existencias de virus
Las células de riñón canino de Madin-Darby (MDCK) se cultivaron en el medio modificado de Águilas (DMEM) de Dulbecco (Invitrogen), suplementado con un 10% de suero fetal bovino (FBS) y un 1% de penicilina-estreptomicina. Las celdas MDCK se mantuvieron a 37 °C en una atmósfera con un 5% de CO2. Los virus de la influenza A utilizados en este estudio se propagaron en células MDCK (ATCC). Los títulos de virus se cuantificaron mediante TCID50 y calculado mediante el método de Reed y Muench (21).
Recolección, aislamiento e inmortalización de células porcinas respiratorias primarias
Se recolectó tejido pulmonar para el aislamiento de células respiratorias porcinas de un cerdo Yorkshire/Hampshire de 8 semanas de edad. El tejido pulmonar se enjuagó con solución salina tamponada con fosfato (PBS) y las secciones de los bronquios se cortaron en trozos pequeños. El tejido bronquial cortado se incubó durante 2 h con colagenasa 800 U a 37°C y 5% CO2. Después de la digestión de la colagenasa, las células respiratorias se filtraron a través de un filtro celular de 70 μm y se centrifugaron. El gránulo celular se lavó dos veces con PBS y las células se sembraron en matraces recubiertos de colágeno. Las células se incubaron durante 24 h a 37 °C y 5% de CO2 en DMEM/F12 suplementado con FBS, ácido retinoico, extracto hipofisario bovino (BPE), factor de crecimiento epidérmico, toxina del cólera, transferrina, insulina y penicilina/estreptomicina (medio de crecimiento). Después de la incubación de 24 h, las células no adherentes se transfirieron a un matraz recubierto de colágeno de cola de rata (Corning) y se cultivaron hasta que confluyeron por completo.
En el cuarto paso, las células respiratorias primarias de cerdo se sembraron en medios de crecimiento en placas de 6 pocillos recubiertas de colágeno de cola de rata (1 × 105). Una vez que las células alcanzaron el 70% de confluencia, se eliminaron los medios de crecimiento y las células se lavaron con PBS. Las células respiratorias primarias de cerdos diana se infectaron y se incubaron durante la noche a 37 °C y 5% de CO2 con 107 Vector Lenti-SV40T (abm) en presencia de 10 μg/mL de polibreno. Después de la incubación durante la noche, se eliminó el sobrenadante de las células porcinas infectadas con lentivirus y las células se lavaron con PBS. Se añadieron nuevos medios de cultivo a las células, que se incubaron durante 72 h a 37 °C y 5% de CO2. Las células respiratorias porcinas inmortalizadas se hicieron pasar >20 veces y la transducción exitosa del gen del antígeno SV40 T en las células respiratorias porcinas inmortalizadas se confirmó mediante la reacción en cadena de la polimerasa con transcriptasa inversa cuantitativa (RT-qPCR) utilizando cebadores dirigidos al antígeno SV40 T 5′ ACTGAGGGGCCTGAAATGA, 5′ GACTCAGGGCATGAAAC AGG. Se confirmó el origen porcino de las células respiratorias porcinas utilizando GAPDH porcino dirigido a los cebadores 5′ ACCCAGAAGACTGTGGATGG y 5′ ACGCCTGCTTCACCACCTTC.
Tinción inmunoflurescente y microscopía confocal
Se sembraron células respiratorias porcinas inmortalizadas (P20) y primarias (P6) (1 × 105) en placas de 6 pocillos hasta una confluencia del 70-80% en cubreobjetos recubiertos con colágeno de cola de rata (Corning) e inoculados con control/PBS, A/TX/12/H3N2 o A/swine/MN/12/H3N2 a un MOI de 0,1 diluido en PBS (−/−). A 24 hpi, las células se lavaron dos veces y se fijaron con paraformaldehído al 4% y se permeabilizaron con TritonX/PBS al 0,5% durante 30 min. Las células se bloquearon en suero caprino al 10% con PBS/Tween20 durante 1 h antes de la tinción con los anticuerpos primarios:
Tinción de citoqueratina 18
Las células respiratorias porcinas inmortalizadas y primarias se incubaron durante 1 h con el anticuerpo monoclonal de ratón anticitoqueratina 18 (Abcam) (1.200).
Tinción de vimentina
Las células respiratorias porcinas inmortalizadas y primarias se incubaron durante 1 h con el anticuerpo monoclonal de conejo anti-vimentina (Abcam) (1:400).
Tinción de lectina
Las células respiratorias porcinas inmortalizadas y primarias se incubaron durante 1 h con lectina I y II biotiniladas de Maakia amurensis (Vector Laboratories) (1:800), para teñir los receptores de SA ligados a α2,3 o la aglutinina de Sambucus nigra conjugada con isotiocianato de fluoresceína (FITC) (Vector Laboratories) (1.200) para teñir los receptores de SA ligados a α2,6.®®
Tinción del virus de la influenza A
Las células respiratorias porcinas inmortalizadas se incubaron durante 45 min con nucleoproteína anti-alfa tubulina (1:800), anti-beta-tubulina (1:200) y anti-influenza A (1:500).
Después de la tinción con los anticuerpos primarios de apprapriato, las células se lavaron 3× con PBS/Tween20 y se tiñeron con anticuerpos secundarios: Alexa Fluor 546 (Invitrogen) (1:400), Alexa Fluor 488 (Invitrogen) (1:400) o FITC antiratón de cabra (1:400). Los cubreobjetos se transfirieron a portaobjetos y se montaron utilizando un medio de montaje de desvanecimiento lento (Invitrogen). Los portaobjetos se visualizaron utilizando el microscopio fluorescente giratorio ECHO (ECHO A Bico Company, San Diego, CA). Todas las imágenes capturadas fueron editadas y procesadas con el software FIJI (22).
Infecciones por el virus de la influenza A
Se sembraron células respiratorias porcinas inmortalizadas (P24) (1 × 105) en placas de 6 pocillos y cultivadas en medios de crecimiento en placas de 6 pocillos recubiertas de cola de rata (Corning) hasta un 80% de confluencia. A continuación, las células se lavaron en PBS y se inocularon con un panel de hu- y swIAV (Tabla 1) a un MOI de 0,1 diluido en PBS (−/−). Después de la inoculación de IAV, las células se incubaron durante 2 h a 37 °C y 5% de CO2 antes de lavar las células con PBS y reemplazar el inóculo con medios de crecimiento frescos libres de FBS. Las células inoculadas se incubaron a 37 °C y 5 % de CO2 hasta el punto final de recolección apropiado (0, 24, 48, 72 hpi). En este punto, se recolectó el sobrenadante celular y se cuantificó el IAV mediante TCID50 y se calculó utilizando el método de Reed y Muench como se describió anteriormente. Las muestras se analizaron utilizando tres réplicas biológicas de cada punto de tiempo.
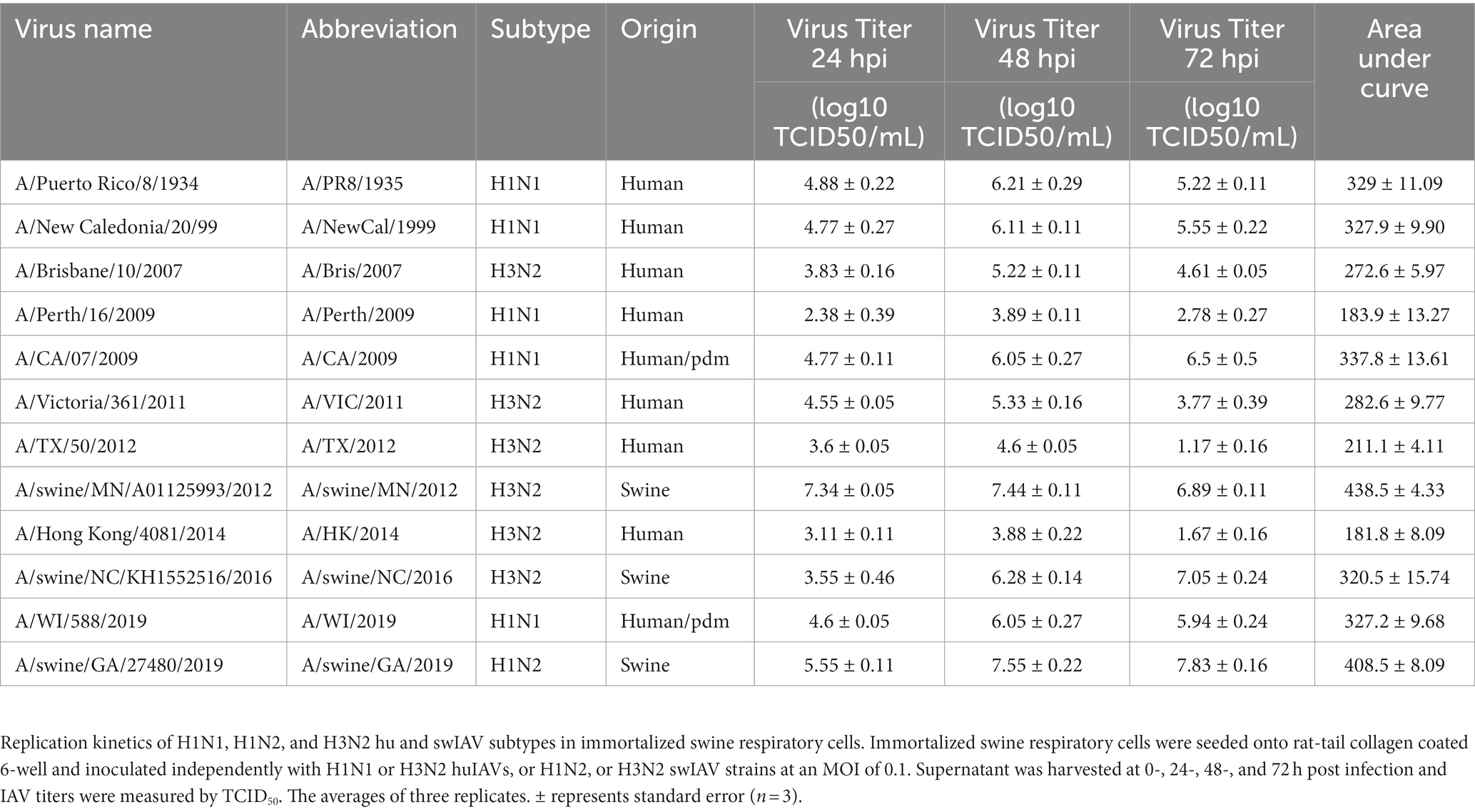 Tabla 1. Las células respiratorias porcinas inmortalizadas son permisibles para las cepas hu y swIAV de los subtipos H1N1, H1N2 y H3N2.
Tabla 1. Las células respiratorias porcinas inmortalizadas son permisibles para las cepas hu y swIAV de los subtipos H1N1, H1N2 y H3N2.
Cuantificación de la secreción de citoquinas/quimiocinas a partir de células respiratorias porcinas primarias e inmortalizadas
Se analizó el sobrenadante de células respiratorias porcinas primarias (P6) e inmortalizadas (P24) inoculadas con A/TX/12/H3N2 o A/swine/MN/12/H3N2 a un MOI de 0,1 cosechado a -24 y -48 hpi para la secreción de IL-1α, IL-6 e IL-8 utilizando el panel de perlas magnéticas de citoquinas/quimiocinas porcinas MILLIPLEX MAP según las instrucciones del fabricante (EMD Millipore Corporation, Billerica, MA).
Estadística
El análisis estadístico se realizó con GraphPad Prism 9.3.1. Se utilizó un ANOVA de dos vías para identificar diferencias de significación entre IL-1α, IL-6 e IL-8 secretadas por las células respiratorias porcinas inmortalizadas (P24) y primarias (P6) que fueron infectadas por simulación (PBS) o inoculadas independientemente con A/TX/12/H3N2 o A/swine/MN/12/H3N2. Para determinar el porcentaje de células positivas para vimentina en las líneas celulares respiratorias porcinas inmortalizadas (P20) y primarias (P6), se procesaron imágenes de FI tomadas en el microscopio fluorescente giratorio ECHO (ECHO A Bico Company, San Diego, CA) utilizando el software FIJI y se contaron las células positivas para vimentina y se restaron del número de células positivas para DAPI (n = 3).
Resultados
Las células respiratorias porcinas inmortalizadas mantienen las propiedades funcionales de sus homólogas celulares primarias
Se aislaron células respiratorias primarias de cerdo de los bronquios de un Yorkshire/Hampshire de 8 semanas de edad e inmortalizaron mediante la transducción del antígeno SV40-T después de 4 pasadas exitosas (Figura 1). Las células respiratorias porcinas inmortalizadas fueron pasadas con éxito >20 veces, mientras que las células respiratorias porcinas primarias no lograron proliferar en P16. La retención del antígeno SV40 T en las células respiratorias porcinas inmortalizadas se confirmó mediante rt-qPCR, con un valor medio de Cq del antígeno SV40-T de 27,7 (n = 3) en células pasadas 20 veces (Tabla suplementaria S1). Visualmente, las células respiratorias porcinas inmortalizadas mantuvieron las características morfológicas de las células epiteliales respiratorias porcinas primarias, tales como, poseer la capacidad de formar uniones estrechas y una apariencia similar a un adoquín (Figura 2). Las células respiratorias porcinas primarias e inmortalizadas expresaron receptores SA vinculados a α2,3 y α2,6, que son un factor importante de restricción del huésped para la entrada del IAV en la célula huésped (Figura 3). Tanto las líneas celulares primarias como las inmortalizadas expresaron receptores de SA ligados a α2,6 en mayor abundancia en comparación con los receptores de SA ligados a α2,3 (Figura 3). Además, las células respiratorias porcinas inmortalizadas parecían ser mayoritariamente de origen epitelial, lo que fue demostrado por la mayoría de las células visualizadas que expresan el marcador epitelial citoqueratina 18 (Figura 4). La tinción con la transición epitelio-mesenquimal y el marcador de fibroblastos vimentina, demostró que las células respiratorias primarias porcinas aisladas contenían un alto porcentaje (56,7%) de células contaminantes (Figura suplementaria S1). Sin embargo, tras el tratamiento con tripsina y la inmortalización mediante transducción del antígeno SV40-T, observamos una disminución en el porcentaje medio de células positivas a vimentina (32,08%), que se mantuvo hasta 20 pasadas (Figura suplementaria S1).
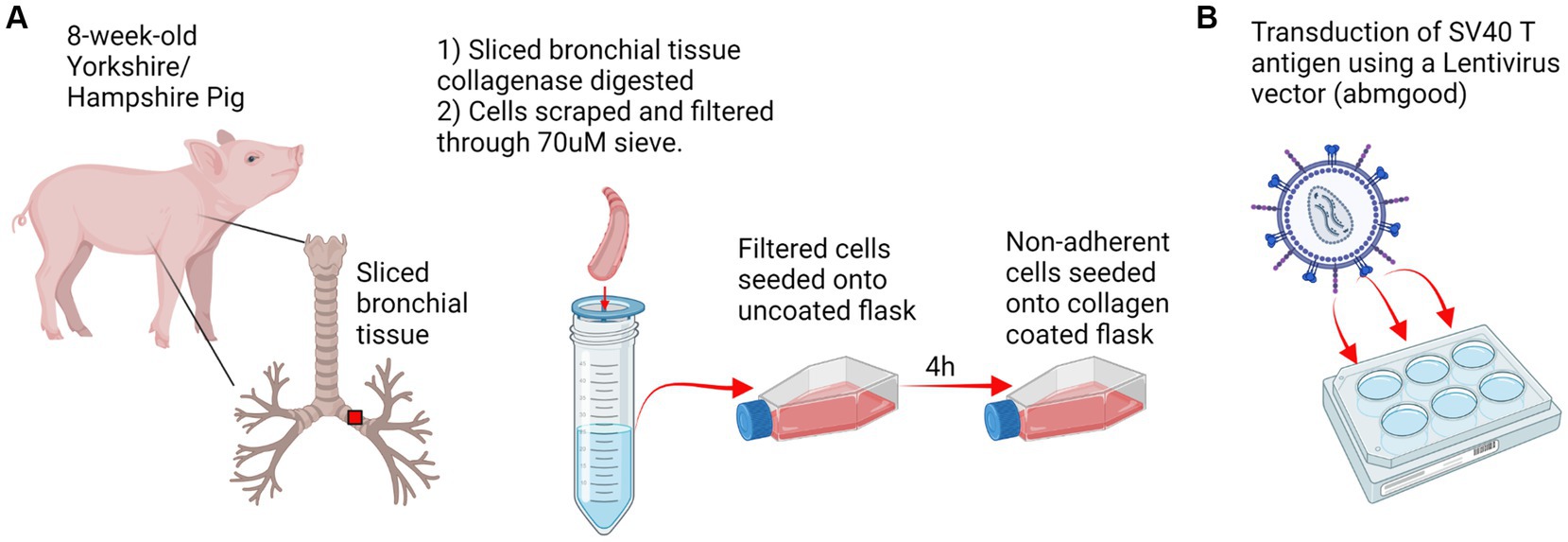 Figura 1. Diseño experimental. (A) Se extrajo tejido del tracto respiratorio de un cerdo Yorkshire/Hampshire de 8 semanas de edad. Se digierieron cortes de tejido bronquial de 1 cm de colagenasa durante 2 h a 37 °C y se rasparon células respiratorias porcinas y se filtraron a través de un tamiz de 70 μM. Las células respiratorias primarias de cerdo se sembraron en matraces no recubiertos y las células no adherentes se transfirieron a un matraz recubierto de colágeno después de 4 h de incubación. (B) Transducción del antígeno SV40 T. Las células respiratorias primarias de cerdo se sembraron en placas de 6 pocillos y se inocularon con 10^7 SV40-lentivirus en presencia de polibreno. La transducción positiva y la retención del antígeno SV40 T se confirmaron mediante RT-PCR en el paso 20. Creado con BioRender.com.
Figura 1. Diseño experimental. (A) Se extrajo tejido del tracto respiratorio de un cerdo Yorkshire/Hampshire de 8 semanas de edad. Se digierieron cortes de tejido bronquial de 1 cm de colagenasa durante 2 h a 37 °C y se rasparon células respiratorias porcinas y se filtraron a través de un tamiz de 70 μM. Las células respiratorias primarias de cerdo se sembraron en matraces no recubiertos y las células no adherentes se transfirieron a un matraz recubierto de colágeno después de 4 h de incubación. (B) Transducción del antígeno SV40 T. Las células respiratorias primarias de cerdo se sembraron en placas de 6 pocillos y se inocularon con 10^7 SV40-lentivirus en presencia de polibreno. La transducción positiva y la retención del antígeno SV40 T se confirmaron mediante RT-PCR en el paso 20. Creado con BioRender.com.
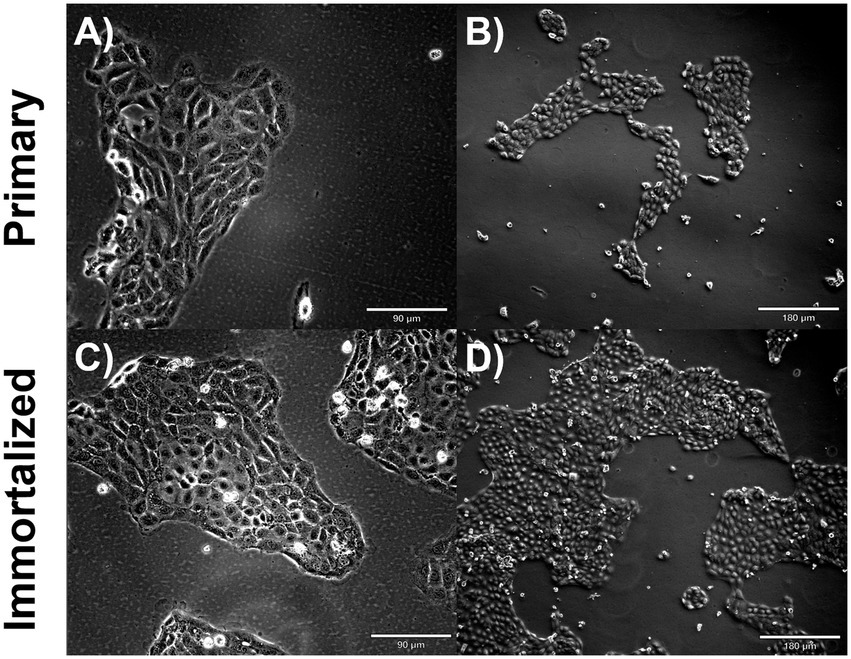
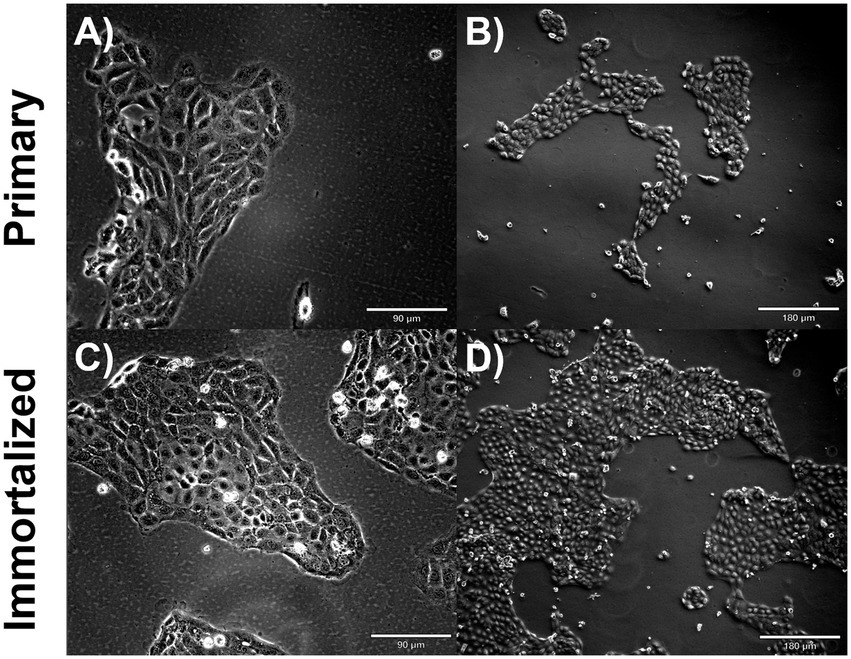 Figura 2. Fenotipo de células respiratorias porcinas inmortalizadas y primarias. Las células respiratorias porcinas inmortalizadas y primarias se sembraron en matraces recubiertos de colágeno y se incubaron a 37 °C y 5% de CO2 durante 2 días. Células respiratorias primarias de campo claro con un aumento de P6 (A) ×10, una barra de escala de 90 μm, un aumento de (B) ×20, una barra de escala de 180 μm. Células respiratorias porcinas primarias de campo claro a P20 (C) Aumento ×10, Barra de escala 90 μm (D) Aumento ×20, Barra de escala 180 μm.
Figura 2. Fenotipo de células respiratorias porcinas inmortalizadas y primarias. Las células respiratorias porcinas inmortalizadas y primarias se sembraron en matraces recubiertos de colágeno y se incubaron a 37 °C y 5% de CO2 durante 2 días. Células respiratorias primarias de campo claro con un aumento de P6 (A) ×10, una barra de escala de 90 μm, un aumento de (B) ×20, una barra de escala de 180 μm. Células respiratorias porcinas primarias de campo claro a P20 (C) Aumento ×10, Barra de escala 90 μm (D) Aumento ×20, Barra de escala 180 μm.
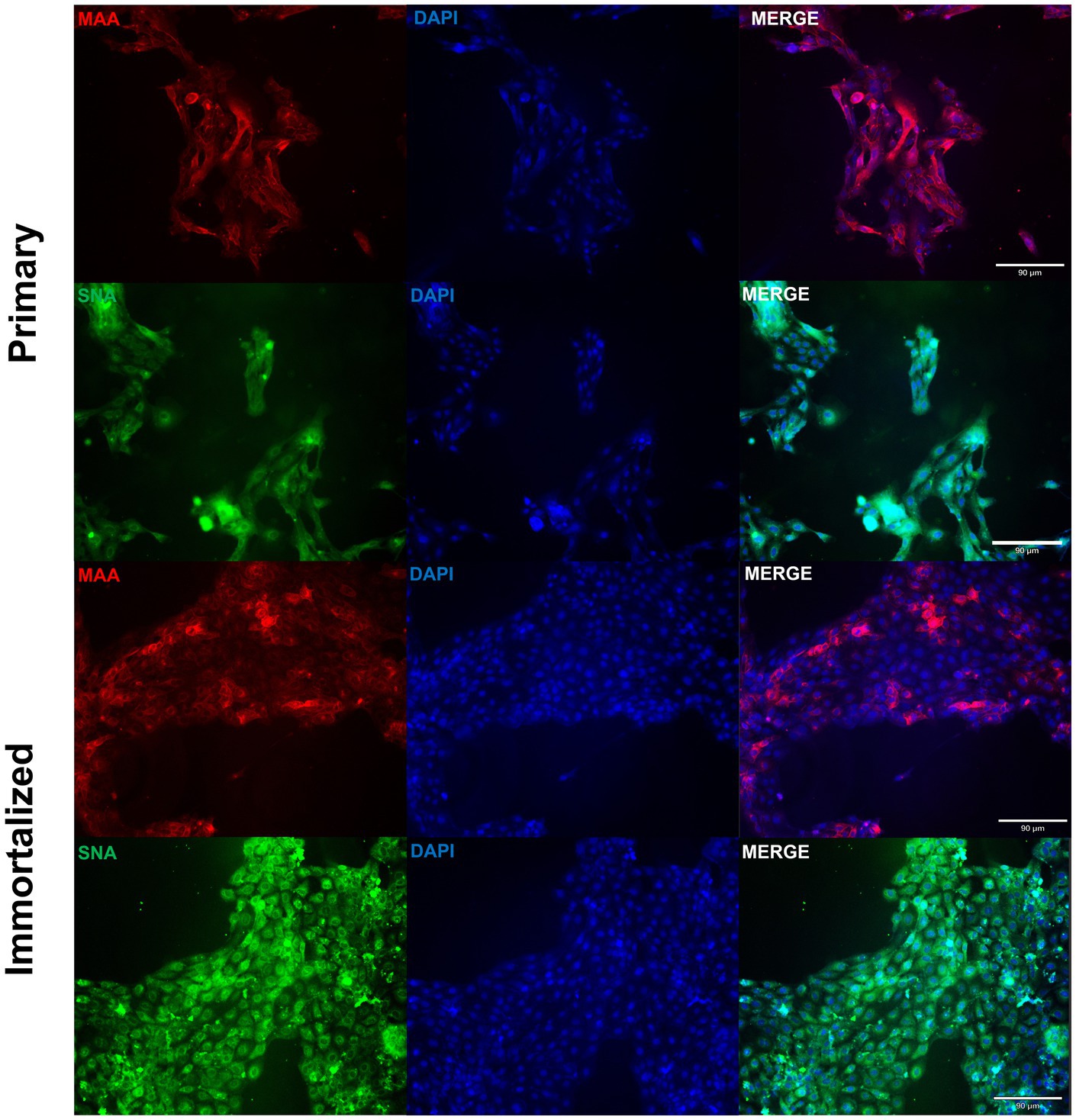 Figura 3. Las células respiratorias porcinas primarias e inmortalizadas expresan receptores de ácido siálico α2,6. Las células respiratorias primarias (P6) e inmortalizadas de cerdo (P20) se sembraron en cubreobjetos recubiertos de colágeno de cola de rata de 6 pocillos y se tiñeron con lectinas DAPI (azul) y Maackia amurensis (MAA, rojo) o aglutinina de Sambucus nigra (SNA, verde). Aumento ×10, Barra de escala 90 μm.
Figura 3. Las células respiratorias porcinas primarias e inmortalizadas expresan receptores de ácido siálico α2,6. Las células respiratorias primarias (P6) e inmortalizadas de cerdo (P20) se sembraron en cubreobjetos recubiertos de colágeno de cola de rata de 6 pocillos y se tiñeron con lectinas DAPI (azul) y Maackia amurensis (MAA, rojo) o aglutinina de Sambucus nigra (SNA, verde). Aumento ×10, Barra de escala 90 μm.
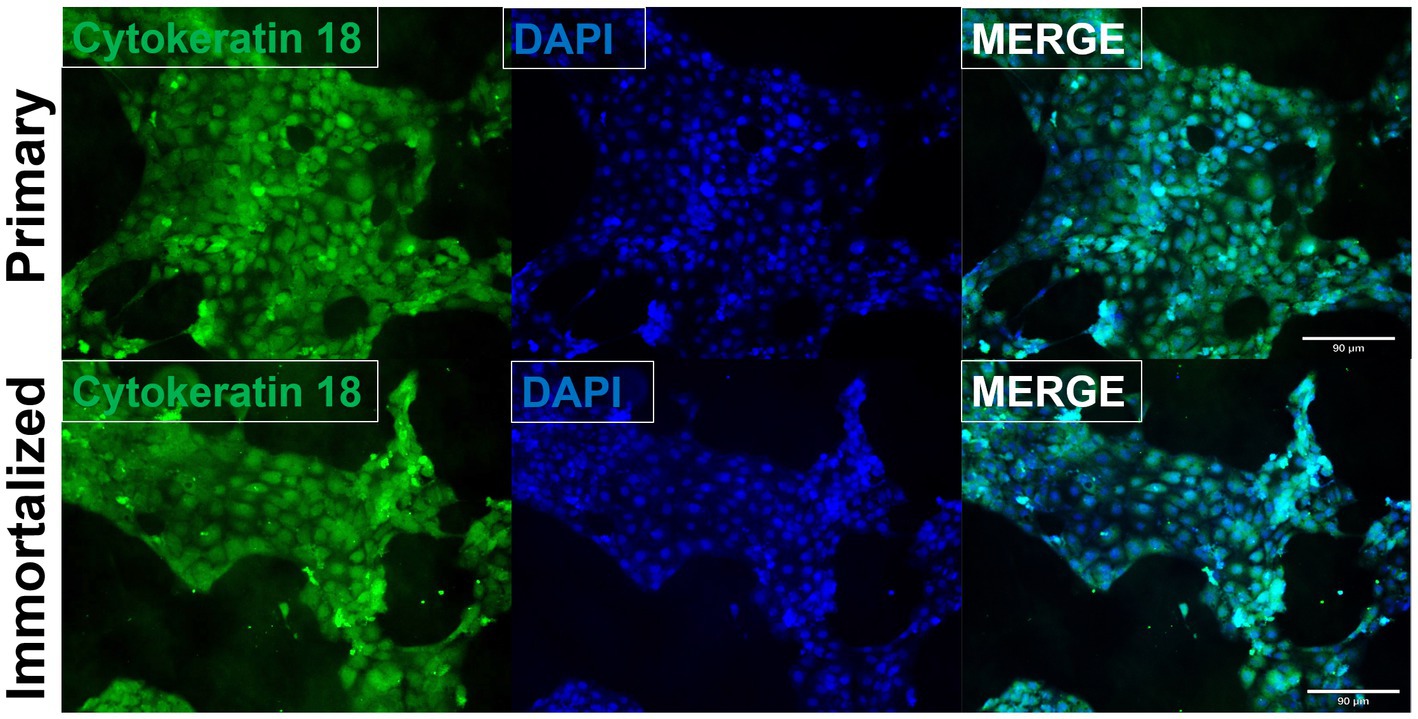 Figura 4. Las células respiratorias porcinas inmortalizadas son principalmente de origen epitelial. Después de la cosecha, el aislamiento y la inmortalización, tanto las células respiratorias porcinas primarias (P6) como las inmortalizadas (P20) se sembraron en 6 cubreobjetos recubiertos de colágeno de cola de rata y se tiñeron para citoqueratina 18 (verde) y DAPI (azul). Aumento ×10.
Figura 4. Las células respiratorias porcinas inmortalizadas son principalmente de origen epitelial. Después de la cosecha, el aislamiento y la inmortalización, tanto las células respiratorias porcinas primarias (P6) como las inmortalizadas (P20) se sembraron en 6 cubreobjetos recubiertos de colágeno de cola de rata y se tiñeron para citoqueratina 18 (verde) y DAPI (azul). Aumento ×10.
Evaluamos la permisibilidad de cualquiera de las líneas celulares a IAV’s de origen mamífero, dada la distribución similar de los receptores SA en el tracto respiratorio de los huéspedes porcinos. Tanto las líneas celulares respiratorias porcinas primarias como las inmortalizadas fueron permisivas a las cepas A/TX/2012/H3N2 (Figura 5A), pdm A/CA/2009/H1N1 (Figura 5B) huIAV, A/swine/GA/2019/H1N2 (Figura 5C) y A/swine/MN/2012/H3N2 swIAV (Figura 5D). Sin embargo, A/TX/2012/H3N2 se replicó a títulos más bajos en comparación con el otro panel de cepas de IAV, que fue más pronunciado a 72 hpi (Figura 5A). Esta tendencia se reflejó tanto en las líneas celulares respiratorias porcinas primarias como en las inmortalizadas, lo que sugiere que la especificidad del huésped de las células respiratorias porcinas no se vio afectada por la inmortalización a través de la transducción del antígeno SV40 T.
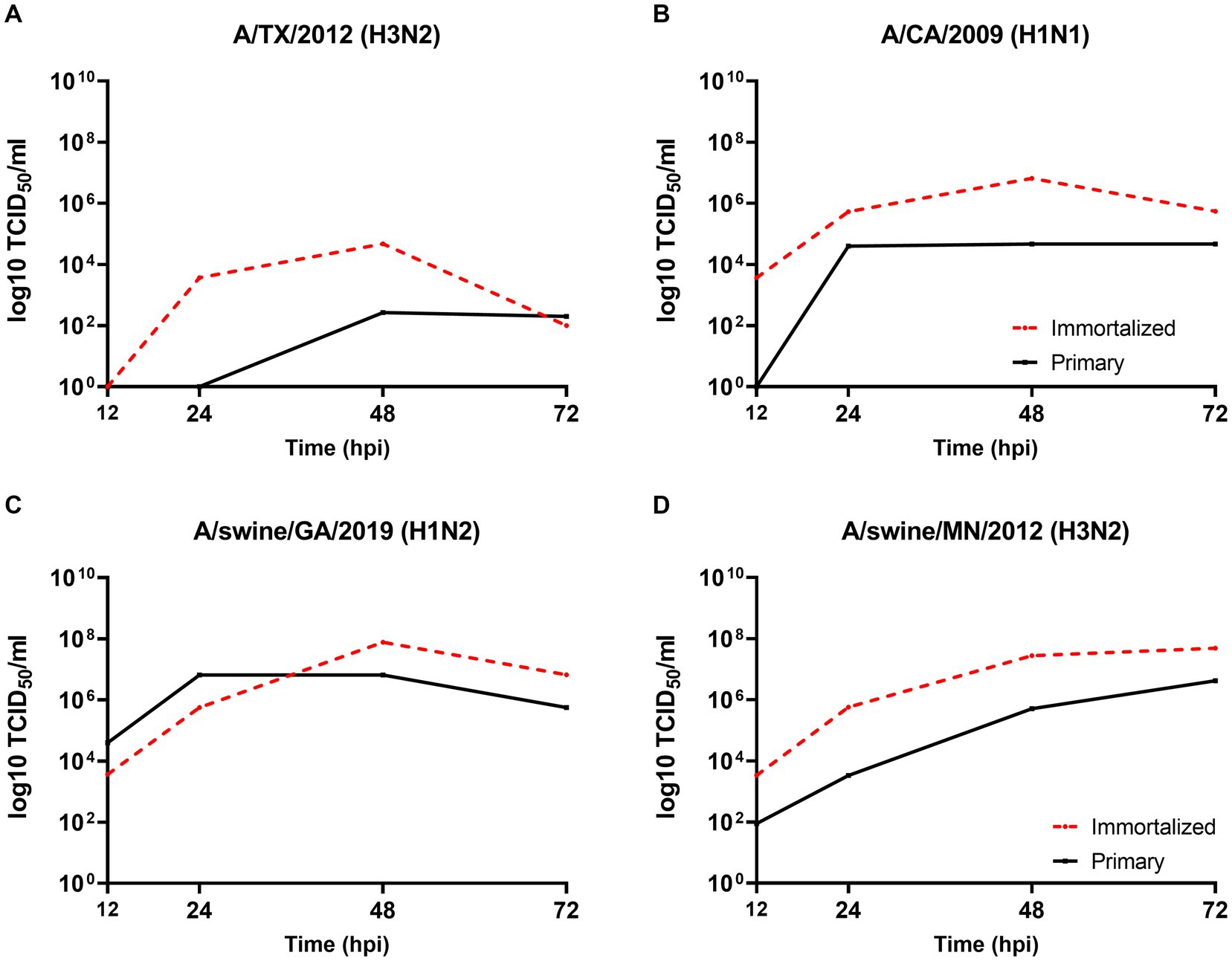 Figura 5. Las células respiratorias porcinas primarias e inmortalizadas son permisibles para los virus de la influenza aguda y la inmunoglobosidad intestinal. Las células porcinas respiratorias primarias (línea negra sólida) e inmortalizadas (línea roja discontinua) (P6 y P24 respectivamente), se sembraron en cubreobjetos recubiertos de colágeno de cola de rata de 6 pocillos e inoculados de forma independiente con A/TX/2012/H3N2 (A), A/CA/2009/H1N1 (B), A/swine/GA/2019/H1N2 (C) o A/swine/MN/2012/H3N2 (D) a un MOI de 0,1. Se recolectó sobrenadante, se cuantificaron títulos de 12, 24, 48 y 72 hpi y virales mediante TCID50.
Figura 5. Las células respiratorias porcinas primarias e inmortalizadas son permisibles para los virus de la influenza aguda y la inmunoglobosidad intestinal. Las células porcinas respiratorias primarias (línea negra sólida) e inmortalizadas (línea roja discontinua) (P6 y P24 respectivamente), se sembraron en cubreobjetos recubiertos de colágeno de cola de rata de 6 pocillos e inoculados de forma independiente con A/TX/2012/H3N2 (A), A/CA/2009/H1N1 (B), A/swine/GA/2019/H1N2 (C) o A/swine/MN/2012/H3N2 (D) a un MOI de 0,1. Se recolectó sobrenadante, se cuantificaron títulos de 12, 24, 48 y 72 hpi y virales mediante TCID50.
Las células respiratorias porcinas inmortalizadas son permisibles para las cepas IAV de los subtipos H1N1, H1N2 y H3N2 humanos y porcinos
Se evaluó la cinética de replicación viral de cepas humanas y de origen porcino para evaluar la permisividad de las células inmortalizadas a las cepas de IAV de los subtipos H1N1, H1N2 y H3N2. El panel de cepas se seleccionó para representar los subtipos de IAV que comúnmente circulan en la interfaz humano/porcino. Las células respiratorias porcinas inmortalizadas fueron permisibles para todo el panel de cepas de IAV, independientemente del origen o subtipo del huésped de IAV (Tabla 1). Sin embargo, sí medimos las diferencias en la capacidad de las cepas individuales para replicarse dentro de la línea celular inmortalizada. En general, las cepas de huIAV H3N2 se replicaron pobremente dentro de la célula respiratoria porcina inmortalizada en comparación con los swIAV. La mayor diferencia entre los títulos máximos se midió entre A/porcino/GA/2019/H1N2 (7,83 TCID50/mL) y A/TX/2012/H3N2 (1,17 TCID50/mL) a 72 hpi. Mientras que la mayor diferencia en el área bajo la curva (AUC) se observó entre A/swine/MN/2012/H3N2 (438.5) y la cepa A/HongKong/2014/H3N2 huIAV (181.8). En general, la cinética de replicación del panel de IAVs implica que los swIAVs se replican de manera más eficiente en las células respiratorias porcinas inmortalizadas, lo que proporciona evidencia de la especificidad del huésped porcino.
No observamos diferencias en los títulos virales y los valores de AUC entre A/CA/2009/H1N1 (cepa pdm), A/NewCal/1999/H1N1 (cepa prepandémica) y A/WI/2019/H1N1 (cepa similar a la pospandemia) a 24, 48 y 72 hpi (Tabla 1).
Las cepas H3N2 totalmente huIAV se replican mal y producen una leve respuesta de citoquinas proinflamatorias en células respiratorias porcinas inmortalizadas
Del panel de H1N1, H1N2 y H3N2 hu y IAVs de origen SW evaluados en las células respiratorias porcinas inmortalizadas (Tabla 1), seleccionamos las cepas A/TX/2012/H3N2 y A/swine/MN/2012/H3N2, que codifican el casete del gen interno de triple reordenamiento (TRIG), para comparar la replicación y las respuestas proinflamatorias entre las cepas H3N2 de huIAV y swIAV. Utilizando inmunohistoquímica, no pudimos visualizar la nucleoproteína (NP) A/TX/2012/H3N2 a 24 hpi (Figura 6). Sin embargo, tanto la proteína A/TX/2012/H3N2 como la proteína A/swine/MN/2012/H3N2 NP se visualizaron a 72 hpi (Figura 6). Esto demostró que había un retraso en la replicación de la cepa H3N2 de huIAV total, en comparación con la cepa TRIG swIAV H3N2 en las células respiratorias porcinas inmortalizadas.
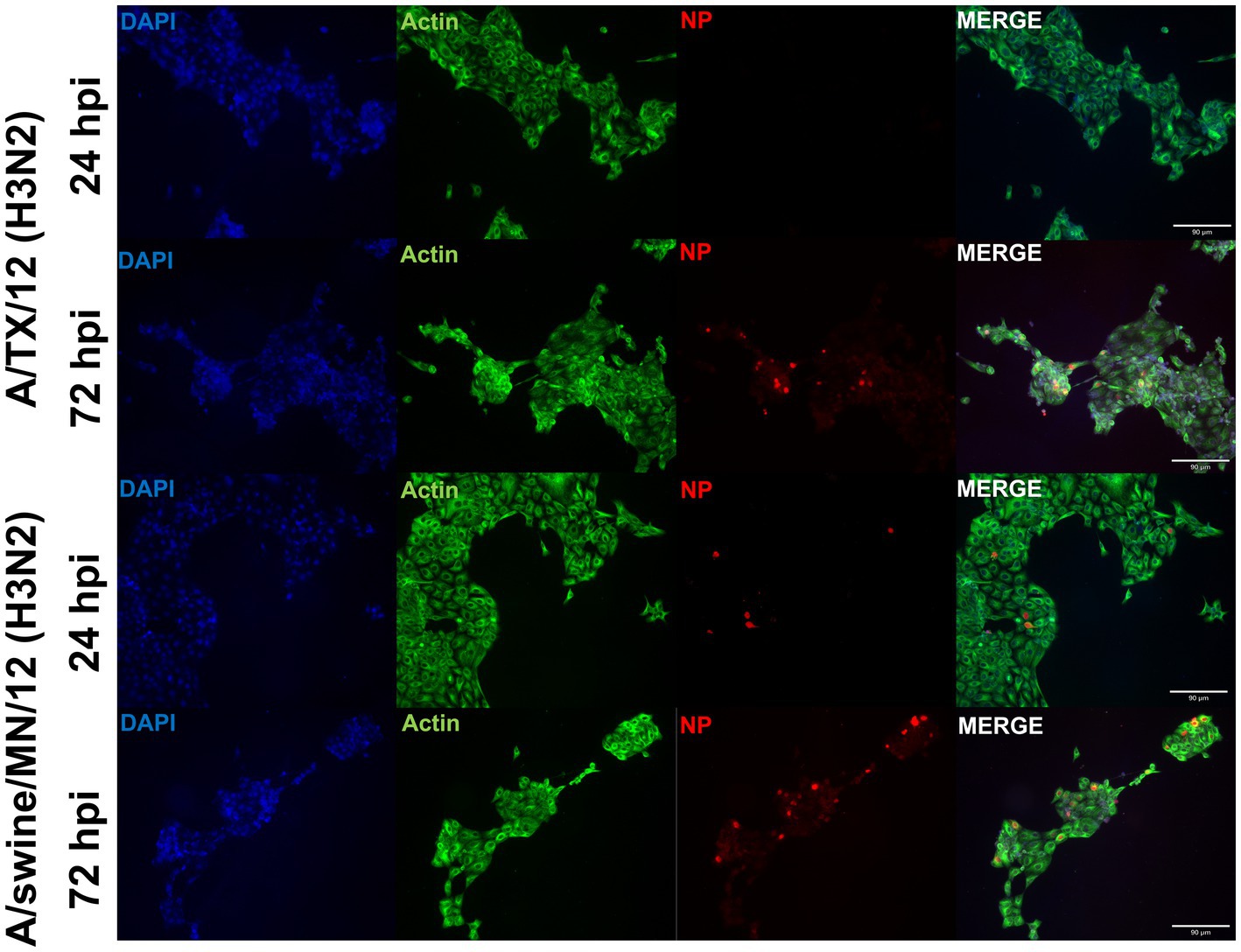 Figura 6. La cepa H3N2 de origen humano se replica mal en las células respiratorias porcinas inmortalizadas en comparación con su contraparte swIAV H3N2. Las células respiratorias porcinas inmortalizadas (P20) se sembraron en cubreobjetos recubiertos de colágeno de cola de rata de 6 pocillos e inoculados de forma independiente con A/swine/MN/12/H3N2 o A/TX/2012.H3N2 a un MOI de 0,1. A 24 hpi, los cubreobjetos se tiñeron con NP (rojo), alfa/beta actina (verde) y DAPI (azul). Aumento ×10, Barra de escala 90 μm.
Figura 6. La cepa H3N2 de origen humano se replica mal en las células respiratorias porcinas inmortalizadas en comparación con su contraparte swIAV H3N2. Las células respiratorias porcinas inmortalizadas (P20) se sembraron en cubreobjetos recubiertos de colágeno de cola de rata de 6 pocillos e inoculados de forma independiente con A/swine/MN/12/H3N2 o A/TX/2012.H3N2 a un MOI de 0,1. A 24 hpi, los cubreobjetos se tiñeron con NP (rojo), alfa/beta actina (verde) y DAPI (azul). Aumento ×10, Barra de escala 90 μm.
Evaluamos la producción de proteínas de citoquinas proinflamatorias IL-1α, IL-6 e IL-8 a partir de las células respiratorias porcinas inmortalizadas después de la inoculación independiente de A/TX/2012/H3N2 o A/swine/MN/2012/H3N2. No hubo diferencias significativas en la producción de IL-1α, IL-6 e IL-8 entre las células respiratorias de cerdos inmortalizadas infectadas con A/TX/2012/H3N2 y A/swine/MN/2012/H3N2 a 24 hpi (Figuras 7D-F). Mientras que la secreción de IL-1α e IL-6 fue significativamente mayor a 48 hpi cuando se infectó con A/swine/MN/2012/H3N2 (Figuras 7D,E). Además, la secreción de IL-6 e IL-8 fue significativamente mayor a 48 hpi después de la inoculación de A/TX/2012/H3N2 o A/swine/MN/2012/H3N2 en comparación con el control (Figuras 7E, F).
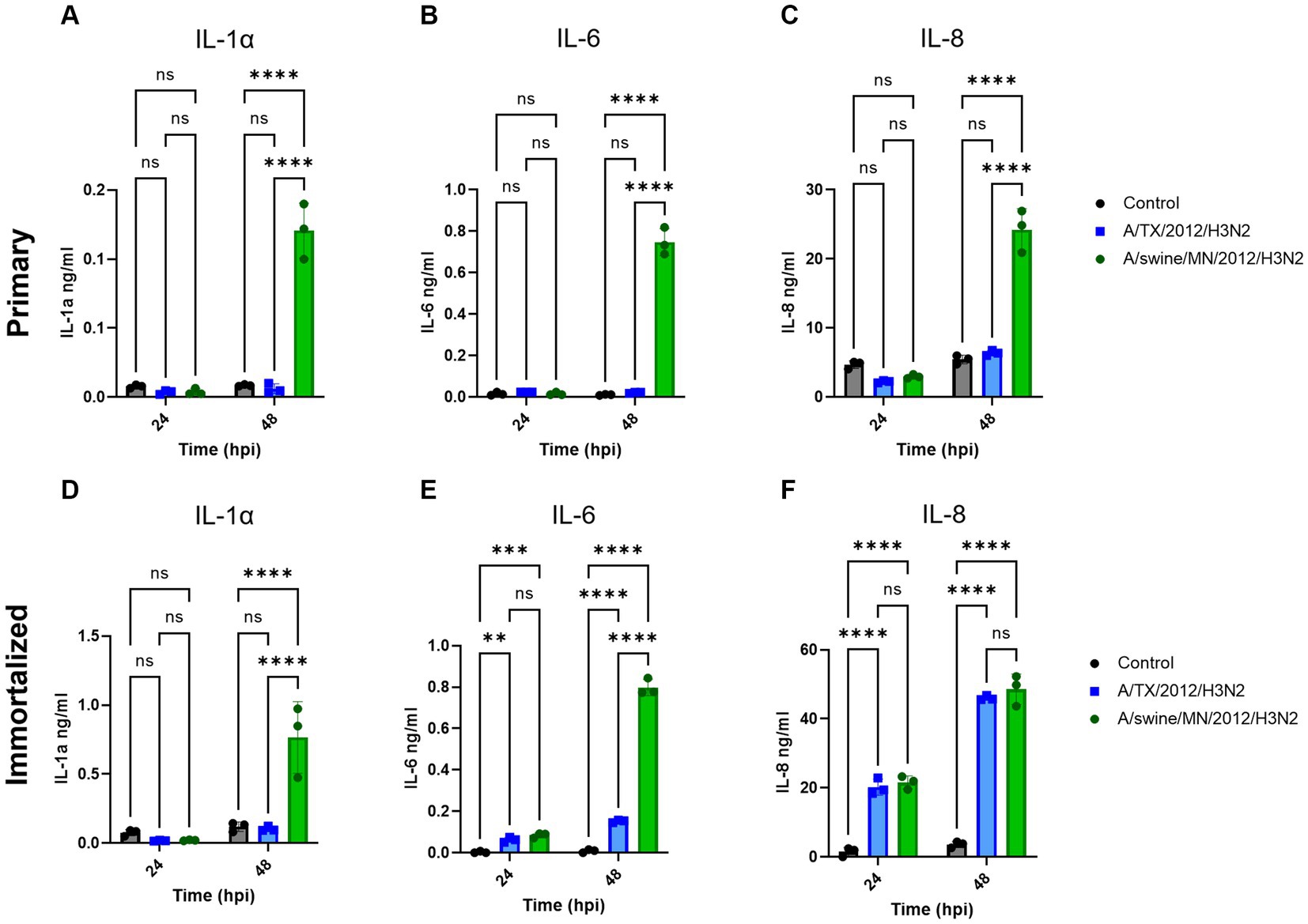 Figura 7. swIAV del subtipo H3N2 promueve una secreción robusta de citoquinas proinflamatorias en células respiratorias porcinas inmortalizadas y primarias. Las células respiratorias porcinas inmortalizadas (P24) y primarias (P6) se sembraron en placas recubiertas de colágeno de 6 pocillos y se inocularon de forma independiente con control/PBS (negro), A/TX/2012/H3N2 (azul) o A/swine/MN/2012/H3N2 (verde) a un MOI de 0,1. El sobrenadante recolectado de células primarias o inmortalizadas a −24 y −48 hpi se probó para la secreción de citocinas/quimiocinas (A,D) IL-1α, (B,E) IL-6 y (C,F) IL-8 con MILLIPLEX. El análisis estadístico se realizó mediante una prueba de ANOVA de dos vías. **, p < 0,01; , p = <0,001; , p < 0,0001; ns, no hay diferencia estadística. Las barras de error representan la desviación estándar (n = 3).
Figura 7. swIAV del subtipo H3N2 promueve una secreción robusta de citoquinas proinflamatorias en células respiratorias porcinas inmortalizadas y primarias. Las células respiratorias porcinas inmortalizadas (P24) y primarias (P6) se sembraron en placas recubiertas de colágeno de 6 pocillos y se inocularon de forma independiente con control/PBS (negro), A/TX/2012/H3N2 (azul) o A/swine/MN/2012/H3N2 (verde) a un MOI de 0,1. El sobrenadante recolectado de células primarias o inmortalizadas a −24 y −48 hpi se probó para la secreción de citocinas/quimiocinas (A,D) IL-1α, (B,E) IL-6 y (C,F) IL-8 con MILLIPLEX. El análisis estadístico se realizó mediante una prueba de ANOVA de dos vías. **, p < 0,01; , p = <0,001; , p < 0,0001; ns, no hay diferencia estadística. Las barras de error representan la desviación estándar (n = 3).
Discusión
El desarrollo de una línea celular respiratoria porcina inmortalizada es una herramienta útil para la evaluación de nuevos aislados de IAV en el campo. Los cerdos son una importante especie huésped natural e intermedia y se consideran el «recipiente de mezcla» para la recombinación de cepas coinfectantes de IAV en un huésped singular, lo que conduce a la generación de nuevas cepas que pueden representar una amenaza pandémica para los seres humanos. Esto se debe, en parte, a la gran diversidad de cepas de IAV que circulan actualmente en el huésped porcino, lo que aumenta las posibles combinaciones de nuevas cepas en evolución. Además, muchas de las cepas circulantes incorporan segmentos de genes IAV totalmente humanos en su genoma y generan nuevas cepas que poseen las herramientas moleculares para transmitirse y replicarse dentro del huésped humano. El modelo in vitro de referencia para evaluar el potencial pandémico de nuevos aislados en la interfaz humano/porcino incluye células epiteliales respiratorias primarias aisladas del huésped y totalmente diferenciadas en ALI. Sin embargo, dado el tiempo necesario para diferenciar completamente las líneas celulares primarias, estábamos interesados en desarrollar una línea celular epitelial respiratoria inmortalizada que mantuviera la característica del huésped porcino primario. Esto permitiría una línea más eficiente para identificar el éxito de transmisión y replicación de nuevos aislados de IAV dentro del huésped porcino y acelerar el desarrollo de vacunas contra cepas altamente virulentas.
En este estudio, recolectamos y aislamos células respiratorias de los bronquios de un cerdo Yorkshire/Hampshire de 8 semanas de edad e inmortalizamos la línea celular mediante la administración del antígeno SV40-T a las células primarias aisladas. Demostramos que las líneas celulares respiratorias porcinas inmortalizadas eran principalmente de origen epitelial, como se indica a través de la expresión de CK18, que se ha utilizado como marcador de células epiteliales respiratorias y epitelios simples (23). Además, la tinción de células potencialmente contaminantes, como fibroblastos y células de transición epitelio-mesenquimal (EMT), reveló que hubo una disminución en el porcentaje de células contaminantes después de la inmortalización a través de la transducción del antígeno SV40 T (Figura suplementaria S1). Sin embargo, no pudimos desarrollar una población pura de células epiteliales bronquiales porcinas inmortalizadas y nuestra línea celular respiratoria porcina inmortalizada mixta contenía aproximadamente un 30% de células fibroblásticas o EMT no deseadas.
Demostramos que tanto las células respiratorias porcinas primarias como las inmortalizadas expresaban los receptores α2,3 y α2,6 SA en una distribución similar a la observada en el tracto respiratorio inferior del huésped porcino (2, 4, 9). Dado que las células respiratorias porcinas primarias e inmortalizadas expresaron α2,6 SA, propusimos que tanto las líneas celulares primarias como las inmortalizadas serían permisibles para los IAV de mamíferos y serían un modelo apropiado para evaluar cepas aisladas en la interfaz humano/porcino. Medimos la cinética de replicación de cuatro aislados de IAV en las líneas celulares respiratorias porcinas primarias e inmortalizadas, que incluían los huIAV A/TX/12/H3N2 de origen totalmente humano, la cepa pandémica A/ca/09/H1N1 (pdm09) perteneciente al clado pandémico (1A.3.3.2), el clado A/swine/GA/19/H1N2 delta 2 (1B.2.1) y los swIAV A/swine/MN/12/H3N2 (Figura 4). Las células respiratorias primarias de cerdo fueron permisibles para todos los huIAV y swIAV analizados. Sin embargo, el A/TX/12/H3N2 huIAV se replicó a títulos más bajos y durante un tiempo reducido en comparación con cualquiera de los swIAV probados, o A/CA/09/H1N1 que se originó en el huésped porcino. Planteamos la hipótesis de que este fenómeno observado dentro de las células respiratorias primarias de los cerdos se debía a una falta de adaptación del huIAV a las células respiratorias de los cerdos, lo que conducía a una respuesta inmune innata robusta para evitar la replicación viral. Además, observamos una cinética de replicación similar de los cuatro IAV en las células respiratorias porcinas inmortalizadas. Sin embargo, las tendencias observadas con los títulos de IAV fueron en su mayoría exageradas en la línea celular respiratoria porcina inmortalizada, lo que teorizamos que podría ser causado por el proceso de inmortalización seleccionando una población celular más homogénea. En estudios futuros, sería interesante caracterizar aún más la población celular inmortalizada e identificar los determinantes moleculares que se seleccionan durante la inmortalización del antígeno SV40-T. Además, caracterizar las respuestas inmunes innatas dentro de subpoblaciones de células respiratorias porcinas inmortalizadas que permiten una mejor replicación de hu- y swIAV.
Evaluamos la cinética de replicación de un amplio panel de H1N1, H1N2 y H3N2 hu- y swIAV aislados entre 1999 y 2019 en las células respiratorias porcinas inmortalizadas. Todos los aislados utilizados en el estudio fueron permisibles en las células respiratorias porcinas inmortalizadas sin necesidad de tripsina proteasa para permitir la entrada del IAV en la célula huésped. Esto implica que la secreción de proteasa no se perdió después de la inmortalización del antígeno SV40-T. En su mayoría, los huIAV H3N2 se replicaron pobremente en las células respiratorias porcinas inmortalizadas en comparación con las cepas H1N1 o H3N2 que codifican segmentos genéticos de origen porcino. Esta pobre replicación de cepas H3N2 totalmente huIAV se ha observado experimentalmente en el huésped porcino y requiere más investigación tanto desde el punto de vista del huésped como del virus. Sorprendentemente, observamos títulos de replicación y valores de la curva de AUC total similares entre las cepas pre-pdm09 A/NewCal/99/H1N1, pdm09 A/CA/09/H1N1 y post-pdm09 A/WI/19/H1N1. La cepa pdm fue una nueva recombinación de segmentos del gen IAV de origen humano, porcino clásico y aviar, que se transmitió por primera vez al huésped humano a principios de 2009. La cepa A/CA/2009/H1N1 fue capaz de transmitirse eficientemente entre humanos, lo que provocó un brote pandémico mundial (24). En consecuencia, nos sorprendió observar que no había diferencias significativas entre la cinética de replicación de A/NewCal/99/H1N1 y A/CA/09/H1N1 en las células respiratorias porcinas inmortalizadas. Sin embargo, esta observación puede poner de relieve las limitaciones en la utilización únicamente de ensayos in vitro para modelar la compleja fisiología e inmunidad del huésped porcino, que incluye múltiples barreras físicas y tipos de células que determinan la infectividad del IAV dentro del huésped porcino. Además, estudios previos han investigado los efectos de la temperatura en la cinética de replicación de huIAVs y swIAVs dentro de las células hospedadoras porcinas, que no abordamos en este estudio (11, 25). Sería de interés evaluar la temperatura corporal del huésped y su papel como factor huésped que los IAV deben superar para replicarse de manera eficiente dentro de las células respiratorias porcinas primarias e inmortalizadas. Además, evaluar si la temperatura influye en la cinética de replicación de los IAV que poseen una disposición específica de constelaciones de genes internos.
Estábamos interesados en medir la respuesta proinflamatoria diferencial de la línea celular después de la inoculación de hu- o swIAV. Esto se debió a las diferencias observadas entre la cinética de replicación de los subtipos H3N2 en las células respiratorias porcinas inmortalizadas (Tabla 1). En este estudio, probamos y comparamos A/TX/12/H3N2 huIAV y A/swine/MN/12/H3N2 swIAV, aislados del mismo año y del mismo subtipo. Encontramos que hubo un aumento significativo en la producción de IL-1α e IL-6 después de la inoculación de A/swine/MN/12/H3N2 a 48 hpi, en comparación con la inoculación de A/TX/12/H3N2, y no hubo diferencias significativas en la secreción de IL-8 a 24 y 48 hpi (Figura 7). Anteriormente, se ha demostrado que los fibroblastos secretan IL-6 y, en condiciones específicas, IL-1α (26, 27). En consecuencia, es esencial tener en cuenta que el aumento observado de IL-6 e IL-1α después de la inoculación de IAV puede haber sido influenciado por la proporción de células contaminantes en las líneas celulares respiratorias porcinas primarias e inmortalizadas desarrolladas en este estudio. Sin embargo, a pesar de esta influencia potencial, observamos un aumento significativo en la producción de IL-1α e IL-6 después de la inoculación con la cepa swIAV H3N2 en comparación con su contraparte huIAV H3N2 (Figura 7). En el futuro, queremos evaluar más a fondo la producción de citoquinas de la línea celular respiratoria porcina inmortalizada inoculada con un panel más amplio de hu- y swIAV. Además, ampliar la evaluación de los puntos temporales para comparar la cinética de las citocinas secretadas (28, 29).
Conclusión
Hemos desarrollado una línea celular respiratoria porcina inmortalizada que conserva la mayoría de las características de su contraparte de células respiratorias porcinas primarias. La línea celular respiratoria porcina inmortalizada todavía era permisiva a los IAV en el pasaje 24 y no requirió la adición de tripsina exógena para la inoculación de IAV, que se observa principalmente en líneas celulares epiteliales primarias que han sido sometidas a transporte aéreo en un ALI (9, 30, 31). Es importante continuar identificando aplicaciones potenciales para la línea celular respiratoria porcina inmortalizada para la investigación de IAV. En este estudio, no evaluamos si las células respiratorias aisladas primarias e inmortalizadas de cerdo podían diferenciarse completamente en el sistema ALI, lo que justifica la investigación porque las células aisladas eran en su mayoría de origen epitelial. Esto proporcionaría más flexibilidad para que el investigador estudie la infectividad del IAV en un modelo apropiado que mantenga la funcionalidad biológica del tracto respiratorio inferior del huésped porcino.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
No se requirió aprobación ética para los estudios en seres humanos de acuerdo con la legislación local y los requisitos institucionales, ya que solo se utilizaron líneas celulares establecidas disponibles comercialmente. El estudio en animales fue aprobado por el Comité Institucional de Cuidado y Uso de Animales (IACUC, por sus siglas en inglés) de la Universidad de Auburn. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
PN: Conceptualización, Análisis formal, Investigación, Metodología, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. VP: Investigación, Metodología, Redacción – revisión y edición. JN: Investigación, Metodología, Redacción – Revisión y Edición. CJ: Investigación, Metodología, Redacción – revisión y edición. MT: Conceptualización, Supervisión, Redacción – Revisión y Edición. CK: Conceptualización, Curación de datos, Obtención de fondos, Investigación, Metodología, Recursos, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo fue financiado por los Centros de Excelencia para la Investigación y Vigilancia de la Influenza (CEIRS, por sus siglas en inglés) de los NIH/NIAID HHSN272201400004C y la Estación Experimental Agrícola de Alabama (AAES, por sus siglas en inglés) de la Universidad de Auburn.
Reconocimientos
Los autores desean agradecer a Madelyn Krunkosky, estudiante de posgrado en el laboratorio de Mark Tompkins (actualmente científico investigador sénior en Q2 Solutions) por compartir sus protocolos de cultivo celular primario. Este trabajo fue financiado por los Centros de Excelencia para la Investigación y Vigilancia de la Influenza (CEIRS, por sus siglas en inglés) de los NIH/NIAID HHSN272201400004C y la Estación Experimental Agrícola de Alabama (AAES, por sus siglas en inglés) de la Universidad de Auburn.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1258269/full#supplementary-material
Referencias
1. Shao, W, Li, X, Goraya, MU, Wang, S y Chen, JL. Evolución del virus de la influenza A por mutación y recombinación. Int J Mol Sci. (2017) 18:81650. doi: 10.3390/ijms18081650
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Nicholls, JM, Bourne, AJ, Chen, H, Guan, Y, y Peiris, JS. Detección de receptores de ácido siálico en el tracto respiratorio humano: evidencia de una amplia distribución de posibles sitios de unión para los virus de la influenza humana y aviar. Respir Res. (2007) 8:73. doi: 10.1186/1465-9921-8-73
3. Oshansky, CM, Pickens, JA, Bradley, KC, Jones, LP, Saavedra-Ebner, GM, Barber, JP, et al. Los virus de la influenza aviar infectan las células epiteliales bronquiales humanas primarias que no están limitadas por residuos de ácido siálico alfa2,3. PLoS Uno. (2011) 6:E21183. doi: 10.1371/journal.pone.0021183
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Trebbien, R, Larsen, LE, y Viuff, BM. Distribución de receptores de ácido siálico y virus de influenza A de origen aviar y porcino en cerdos infectados experimentalmente. Virol J. (2011) 8:434. doi: 10.1186/1743-422X-8-434
5. Baum, LG, y Paulson, JC. Sialiloligosacáridos del epitelio respiratorio en la selección de la especificidad del receptor del virus de la influenza humana. Acta Histochem Suppl. (1990) 40:35–8.
6. Imai, M, y Kawaoka, Y. El papel de la especificidad de unión al receptor en la transmisión entre especies de los virus de la influenza. Curr Opin Virol. (2012) 2:160–7. doi: 10.1016/j.coviro.2012.03.003
7. Scholtissek, CJMP . Práctica, los PIgs como «recipientes de mezcla» para la creación de una nueva gripe pandémica. Med Princ Pract. (2004) 2:65–71. doi: 10.1159/000157337
8. Ma, W, Kahn, RE, y Richt, J. AJJom, gmaijob de investigación. El cerdo como recipiente de mezcla de los virus de la gripe: implicaciones humanas y veterinarias. J Mol Genet Med. (2009) 3:158. doi: 10.4172/1747-0862.1000028
9. Nelli, RK, Kuchipudi, SV, White, GA, Pérez, BB, Dunham, SP y Chang, KC. Distribución comparativa de los receptores de influenza de ácido siálico de tipo humano y aviar en el cerdo. BMC Vet Res. (2010) 6:4. doi: 10.1186/1746-6148-6-4
10. Mo, JS, Abente, EJ, Cárdenas Pérez, M, Sutton, TC, Cowan, B, Ferreri, LM, et al. La transmisión del virus de la influenza A humana en cerdos selecciona mutaciones adaptativas en el gen HA. J Virol. (2022) 96:e0148022. doi: 10.1128/jvi.01480-22
11. Rajao, DS, Abente, EJ, Powell, JD, Bolton, MJ, Gauger, PC, Arruda, B, et al. Se necesitaron cambios en la hemaglutinina y en los segmentos genéticos internos para que el virus de la influenza A estacional H3 humana infectara y se replicara de manera eficiente en los cerdos. Patógenos. (2022) 11:90967. doi: 10.3390/pathogens11090967
12. Landolt, GA, Karasin, AI, Phillips, L, y Olsen, CW. Comparación de la patogénesis de dos virus de influenza A H3N2 genéticamente diferentes en cerdos. J Clin Microbiol. (2003) 41:1936–41. doi: 10.1128/JCM.41.5.1936-1941.2003
13. Nelson, MI, Wentworth, DE, Culhane, MR, Vincent, AL, Viboud, C, LaPointe, MP, et al. Introducción y evolución de los virus de la influenza estacional A de origen humano en poblaciones porcinas multinacionales. J Virol. (2014) 88:10110–9. doi: 10.1128/JVI.01080-14
14. Rajao, DS, Vincent, AL, y Pérez, DR. Adaptación de los virus de la influenza humana a los cerdos. Front Vet Sci. (2019) 5:347. doi: 10.3389/fvets.2018.00347
15. Bateman, AC, Karamanska, R, Busch, MG, Dell, A, Olsen, CW y Haslam, SM. Análisis de glicanos e infección por el virus de la influenza A de células epiteliales respiratorias primarias de cerdos: la importancia de los glicanos NeuAcalpha2-6. J Biol Chem. (2010) 285:34016–26. doi: 10.1074/jbc. M110.115998
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Bateman, AC, Busch, MG, Karasin, AI y Olsen, CW. Los fenotipos de infectividad de los virus de la influenza A H3N2 en las células epiteliales respiratorias primarias de cerdos están controlados por la unión al ácido siálico. Influenza Otros virus respiratorios. (2012) 6:424–33. doi: 10.1111/j.1750-2659.2012.00333.x
17. Ibricevic, A, Pekosz, A, Walter, MJ, Newby, C, Battaile, JT, Brown, EG, et al. Especificidad del receptor del virus de la influenza y tropismo celular en células epiteliales de las vías respiratorias humanas y de ratón. J Virol. (2006) 80:7469–80. doi: 10.1128/JVI.02677-05
18. Seo, SH, Goloubeva, O, Webby, R, y Webster, RG. Caracterización de una línea celular epitelial pulmonar porcina apta para estudios de virus de la gripe. J Virol. (2001) 75:9517–25. doi: 10.1128/JVI.75.19.9517-9525.2001
19. Meliopoulos, V, Cherry, S, Wohlgemuth, N, Honce, R, Barnard, K, Gauger, P, et al. Líneas celulares epiteliales respiratorias primarias de cerdos para el aislamiento y propagación eficientes de los virus de la influenza A. J Virol. (2020) 94:20. doi: 10.1128/JVI.01091-20
20. Xie, X, Gan, Y, Pang, M, Shao, G, Zhang, L, Liu, B, et al. Establecimiento y caracterización de una línea celular epitelial bronquial porcina inmortalizada con telomerasa. J Cell Physiol. (2018) 233:9763–76. doi: 10.1002/jcp.26942
21. Muench, HRJAJH . Un método sencillo para estimar el 50 por ciento de los puntos finales. Revista Americana de Epidemiología (1938) 27: 493-497. doi: 10.1093/oxfordjournals.aje.a118408
22. Schindelin, J, Arganda-Carreras, I, Frise, E, Kaynig, V, Longair, M, Pietzsch, T, et al. Fiji: una plataforma de código abierto para el análisis de imágenes biológicas. Métodos Nat. (2012) 9:676–82. doi: 10.1038/nmeth.2019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Kuburich, NA, den Hollander, P, Pietz, JT, y Mani, SA. Vimentina y citoqueratina: buena sola, mala junta. Semin Cancer Biol. (2022) 86:816–26. doi: 10.1016/j.semcancer.2021.12.006
24. Smith, GJ, Vijaykrishna, D, Bahl, J, Lycett, SJ, Worobey, M, Pybus, OG, et al. Orígenes y genómica evolutiva de la epidemia de influenza A H1N1 de origen porcino de 2009. Naturaleza. (2009) 459:1122–5. doi: 10.1038/nature08182
25. Massin, P, Kuntz-Simon, G, Barbezange, C, Deblanc, C, Oger, A, Marquet-Blouin, E, et al. Sensibilidad a la temperatura en el crecimiento y/o replicación de los virus de la influenza A H1N1, H1N2 y H3N2 aislados de cerdos y aves en células de mamíferos. Microbiol veterinario. (2010) 142:232–41. doi: 10.1016/j.vetmic.2009.10.012
26. Carty, SE, Buresh, CM, y Norton, JA. Disminución de la secreción de IL-6 por los fibroblastos después de dosis repetidas de TNF alfa o IL-1 alfa: regulación génica postranscripcional. J Surg Res. (1991) 51:24–32. doi: 10.1016/0022-4804(91)90065-t
27. Yang, ML, Wang, CT, Yang, SJ, Leu, CH, Chen, SH, Wu, CL, et al. La IL-6 mejora la lesión pulmonar aguda en la infección por el virus de la influenza. Sci Rep. (2017) 7:43829. doi: 10.1038/srep43829
28. Bakre, AA, Jones, LP, Murray, J, Reneer, ZB, Meliopoulos, VA, Cherry, S, et al. Respuesta innata de citocinas antivirales al virus de la influenza porcina por células epiteliales respiratorias porcinas. J Virol. (2021) 95:e0069221. doi: 10.1128/JVI.00692-21
29. Hauser, MJ, Dlugolenski, D, Culhane, MR, Wentworth, DE, Tompkins, SM y Tripp, RA. Las respuestas antivirales de las células broncoepiteliales primarias de cerdos son limitadas en comparación con las células broncoepiteliales humanas después de la infección por el virus de la influenza. PLoS Uno. (2013) 8:E70251. doi: 10.1371/journal.pone.0070251
30. Bottcher, E, Matrosovich, T, Beyerle, M, Klenk, HD, Garten, W y Matrosovich, M. Activación proteolítica de los virus de la influenza por serina proteasas TMPRSS2 y HAT del epitelio de las vías respiratorias humanas. J Virol. (2006) 80:9896–8. doi: 10.1128/JVI.01118-06
Palabras clave: porcinos, virus de la influenza A, células respiratorias primarias, células respiratorias inmortalizadas, caracterización celular
Cita: Neasham PJ, Pliasas VC, North JF, Johnson C, Tompkins SM y Kyriakis CS (2023) Desarrollo y caracterización de una línea celular respiratoria porcina inmortalizada para la investigación del virus de la influenza A. Frente. Vet. Sci. 10:1258269. doi: 10.3389/fvets.2023.1258269
Recibido: 13 de julio de 2023; Aceptado: 16 de noviembre de 2023;
Publicado: 18 diciembre 2023.
Editado por:
Sarah J. Edwards, Organización de Investigación Científica e Industrial de la Commonwealth (CSIRO), Australia
Revisado por:
Hong Dong, Universidad Estatal de Ohio, Estados
Unidos Enric M. Mateu, Universidad Autónoma de Barcelona, España
Derechos de autor © 2023 Neasham, Pliasas, North, Johnson, Tompkins y Kyriakis. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Constantinos S. Kyriakis, csk@auburn.edu
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.

