Efecto del plasma alogénico puro rico en plaquetas, cloxacilina sódica y su combinación para el tratamiento de la mastitis
 Catalina López1
Catalina López1 Paulo Cesar Duque-Madrid2
Paulo Cesar Duque-Madrid2 Alejandro Ceballos-Márquez2
Alejandro Ceballos-Márquez2 Jorge U. Carmona3*
Jorge U. Carmona3*- 1Grupo de Investigación Patología Clínica Veterinaria, Departamento de Salud Animal, Universidad de Caldas, Manizales, Colombia
- número arábigoGrupo de Investigación Calidad de Leche y Epidemiología Veterinaria, Departamento de Producción Agropecuaria, Universidad de Caldas, Manizales, Colombia
- 3Grupo de Investigación Terapia Regenerativa, Departamento de Salud Animal, Universidad de Caldas, Manizales, Colombia
Introducción: La mastitis subclínica bovina (MSC) causada por bacterias grampositivas es una de las principales causas de pérdidas económicas en la industria láctea, que se agrava en situaciones en las que existe resistencia a los antimicrobianos. El plasma rico en plaquetas puras (P-PRP) puede ser una alternativa terapéutica para la MSC, cuando se usa solo o con antibióticos, como la cloxacilina sódica (SC). Este estudio tuvo como objetivo: 1) evaluar la eficacia terapéutica de P-PRP, SC alogénico y su combinación (P-PRP+SC) en vacas con MSC causada por Staphylococcus aureus y por estreptococos (Staphylococcus aureus y S. dysgalactiae); 2) determinar las concentraciones de células somáticas (CCE), interleucina 1 beta (IL-1β), factor de necrosis tumoral alfa (TNF-α) y TGF-β1 en muestras de leche de las vacas.
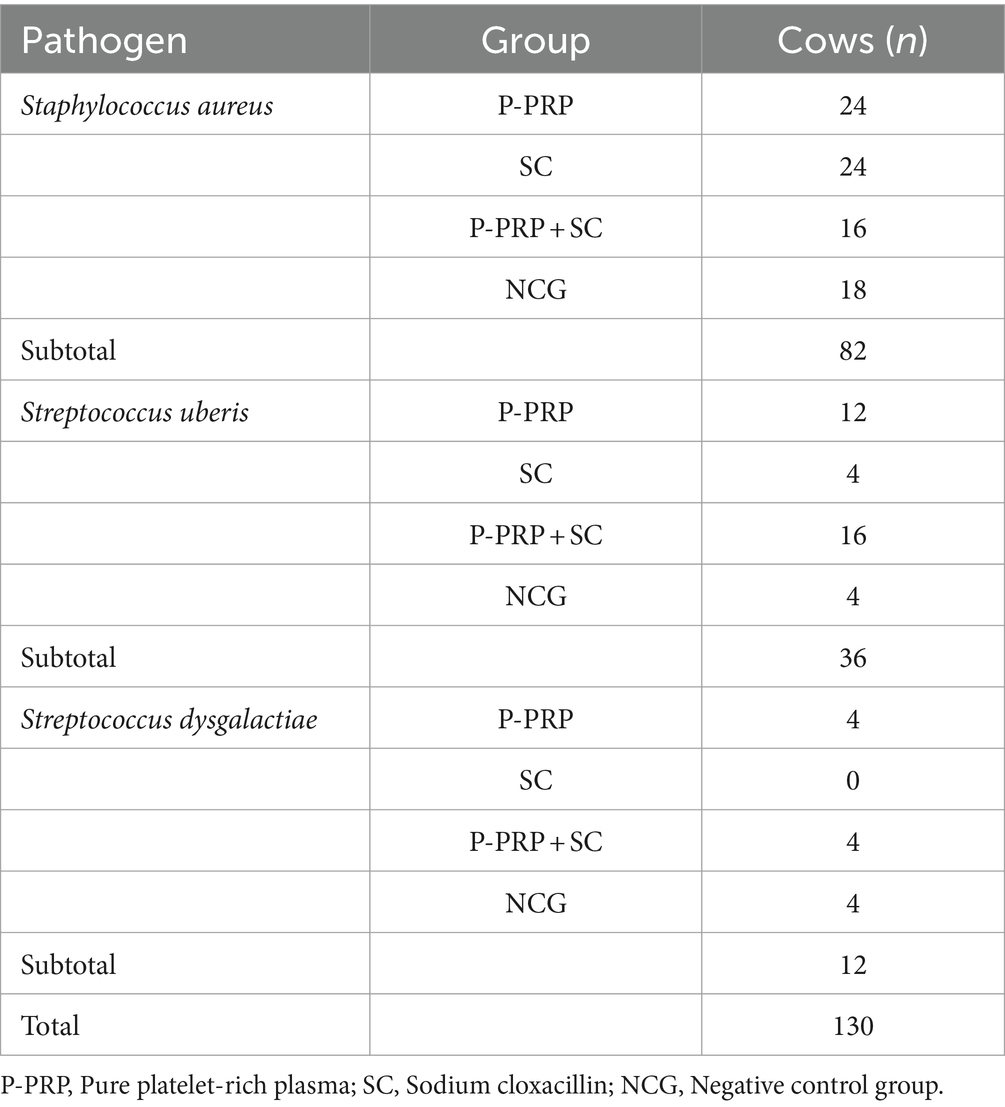
Métodos: 130 vacas de 4 rebaños lecheros completaron el estudio, de las cuales 40 vacas fueron tratadas con P-PRP (10 mL), 28 vacas con SC (5 g), 36 con P-PRP+SC (10 mL/5 g) y 26 no recibieron ningún tratamiento (grupo control negativo, NCG).
Resultados: La curación bacteriológica general se observó en 10/40 (25%) vacas en el grupo P-PRP, 9/28 (32,14%) animales en el grupo SC, 26/36 (72,22%) vacas en el grupo P-PRP+SC y 10/26 (38,46%) animales en el NCG. La MSC causada por S. aureus (82/130, 63,08%) se curó en 6/24 (25%) vacas tratadas con P-PRP, 7/24 (29,2%) vacas tratadas con SC, 8/16 (50%) animales tratados con P-PRP+SC y en 8/18 (44,4%) vacas en NCG. En el caso de la MSC causada por los estreptococos (48/130, 36,91%), la curación se logró en 4/12 (33,3%) vacas tratadas con P-PRP, 2/4 (50%) vacas tratadas con SC, 18/20 (90%) vacas tratadas con P-PRP+SC y en 2/8 (25%) vacas del NCG. El CCE se vio significativamente afectado (p < 0,001) por los factores de tratamiento, rebaño, cura, grupo de bacterias y número de partos. Las concentraciones de IL-1( en la leche fueron influenciadas significativamente (p < 0.001) por el tratamiento y los factores de la granja, y la interacción entre estos factores. Las concentraciones de TNF-α en leche fueron influenciadas significativamente (p < 0,001) por el factor tiempo. Las concentraciones de TGF-β1 en la leche se vieron significativamente afectadas por los factores de tiempo y curación.
Conclusión: La combinación de P-PRP y SC mostró la mejor respuesta terapéutica (90%) frente a la SCM bovina causada por estreptococos. Sin embargo, ninguno de los tratamientos mostró una respuesta terapéutica efectiva contra S. aureus.
Introducción
La mastitis subclínica (MSC) es una de las principales causas de pérdidas económicas para los productores de leche en todo el mundo. Cada año, los productores pierden ingresos debido a la reducción de la producción de leche de las vacas afectadas y a los cambios en la composición de la leche, en particular debido a un aumento significativo en el recuento de células somáticas (CCS) (1, 2). Además, cuando se detecta este tipo de problema, generalmente a través de un programa de calidad de la leche, los propietarios se ven obligados a tratar a las vacas afectadas con antibióticos, lo que resulta en costos adicionales para el tratamiento y el tiempo de retiro, y pérdidas adicionales debido a la leche descartada (3). Por otro lado, en muchos casos, el tratamiento con antibióticos no funciona, por lo que el esfuerzo del productor para tratar a las vacas resulta en pérdidas económicas adicionales (4).
En la actualidad, a pesar de las medidas destinadas a prevenir la MSC, esta enfermedad sigue ocurriendo constantemente en los rebaños lecheros, lo que plantea la cuestión de si se deben seguir utilizando antibióticos convencionales para tratar esta enfermedad (5-8). La respuesta no es sencilla, ya que existen políticas, especialmente en los Estados Unidos de América y Europa, que intentan eliminar gradualmente el uso de antibióticos para tratar la MSC en las vacas lecheras, pero esto no siempre es fácil (8, 9). Todavía no se han podido desarrollar alternativas terapéuticas tan efectivas como los antibióticos y al mismo tiempo libres de residuos y del desarrollo de resistencia microbiana a este tipo de fármacos (10). Estos dos últimos factores son motivo de gran preocupación para las autoridades de salud pública de todo el mundo (5-8). Por lo tanto, se deben realizar mayores esfuerzos para desarrollar nuevos productos que sustituyan a los antibióticos en el mercado lácteo (8) o para mejorar la eficacia terapéutica de los antibióticos aprobados utilizados para la mastitis bovina.
La cloxacilina sódica (SC) es un antibiótico β-lactámico comúnmente utilizado para tratar la mastitis clínica (MC) y la SCM en vacas durante la lactancia o para la terapia de secado al final de la lactancia. Este antibiótico es una isoxazoilpenicilina que es betalactamasa estable y, por lo tanto, puede ser eficaz contra las cepas de S. aureus que producen esta enzima (11). Aunque las penicilinas resistentes a la β-lactamasa, como la SC, se consideran los antimicrobianos de primera línea para el tratamiento de la mastitis bovina causada por S. aureus debido a la susceptibilidad de esta bacteria a este grupo de antibióticos (12), no se da una situación similar para los estreptococos causantes de mastitis, donde se ha reportado resistencia antimicrobiana a SC en el 53,8% de los aislados bacterianos causantes de SCM (13). Por lo tanto, se deben proponer nuevas alternativas terapéuticas que sustituyan a los antibióticos utilizados en el tratamiento de la mastitis bovina o que mejoren el efecto terapéutico de estas sustancias.
El plasma rico en plaquetas (PRP) es un hemocomponente rico en factores de crecimiento, como el factor de crecimiento transformante beta 1 (TGF-β1) y el factor de crecimiento derivado de plaquetas BB (PDGF-BB), citocinas y quimiocinas, como el factor plaquetario-4 (PF-4), que tienen varios efectos antiinflamatorios, regenerativos y bacteriostáticos. Según la literatura revisada, se han utilizado dos tipos de PRP para el tratamiento de la mastitis bovina. Uno de ellos fue un PRP puro (P-PRP), que se caracterizó por concentraciones insignificantes de glóbulos blancos (WBC) y concentraciones moderadas de plaquetas (14), el cual fue evaluado en vacas con SCM causado por bacterias Gram-positivas (15). Por otro lado, se evaluó un PRP rico en leucocitos (L-PRP) y con mayores concentraciones de plaquetas en vacas con mastitis clínica (MC) producida por bacterias Gram-positivas y Gram-negativas (16). Los resultados de ambos estudios fueron alentadores (15, 16); sin embargo, se necesita más investigación para comparar el efecto del PRP, solo o en combinación, con otros antibióticos más comúnmente utilizados para tratar la mastitis bovina, como la cloxacilina sódica (SC).
Presentamos los resultados de un ensayo clínico controlado aleatorizado que se llevó a cabo en vacas mestizas con SCM causadas por bacterias Gram-positivas, evaluando el efecto de una preparación intramamaria (IMM) de P-PRP frente a una suspensión de SC y una combinación de ambos productos (P-PRP + SC). Además, se incluyó un grupo de vacas con la misma enfermedad que no fueron tratadas para evaluar la curación espontánea de la infección por IM (IMMI). Los objetivos del estudio fueron (1) determinar el grado de curación bacteriológica en los grupos experimentales y (2) evaluar el efecto de estas sustancias sobre la concentración en leche de células somáticas, citocinas proinflamatorias [interleucina 1beta (IL-1b) y factor de necrosis tumoral alfa (TNF-α)] y factores de crecimiento (TGF-β1 y PDGF-BB).
Materiales y métodos
Este estudio fue aprobado por el Comité Institucional de Experimentación Animal. Los experimentos se llevaron a cabo de acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio del Consejo Nacional de Investigación, el Instituto de Investigación con Animales de Laboratorio de los Estados Unidos y las Directrices Colombianas de Bienestar Animal. Además, este estudio se llevó a cabo de acuerdo con las directrices ARRIVE. Es importante aclarar que los animales incluidos en este estudio provenían de granjas convencionales y nunca fueron sacrificados con fines de investigación.
Rebaños y animales
Inicialmente, se incluyeron en el estudio nueve rebaños ubicados en las regiones tropicales bajas del departamento de Caldas, Colombia. A partir de estos hatos, se realizó un tamizaje bacteriológico a 650 animales en ordeño para detectar al menos 160 vacas con SCM de acuerdo con los criterios de inclusión establecidos en el estudio. Los criterios de inclusión para las vacas fueron que no presentaban problemas de salud más que la MCS, tenían una ubre clínicamente normal sin pezones deformes o ciegos, estaban en el rango de 1 a 5 partos, no habían sido tratadas con antibióticos y antiinflamatorios en los 30 días anteriores y no habían sufrido un episodio de MC en la lactancia actual.
Extracción de sangre y preparación de P-PRP
El P-PRP utilizado en este estudio se obtuvo de seis vaquillonas Blanco Orejinegro de 24 a 36 meses de edad con un peso corporal promedio de 400 ± 40 kg. La sangre total de cada vaquilla se recolectó por venopunción aséptica y se colocó en bolsas dobles de transfusión (Terumo Double Bag CPDA-1, NJ, Estados Unidos) de acuerdo con los procedimientos descritos en un estudio previo (15). Todos los animales donantes de sangre fueron monitoreados de cerca para detectar anemia (mediante un hemograma semanal de células completas) y cualquier otro problema de salud. Las vaquillas de los grupos P-PRP y P-PRP + SC se sangraron cada 2 semanas hasta completar el tratamiento.
Las bolsas de sangre se centrifugaron inmediatamente en una centrífuga estacionaria (RotoSilenta 630 RS, Hettich, Tuttlingen, Alemania) a 698 g/6 min. A continuación, la fracción plasmática (P-PRP), incluida la capa de leucocitos, se transfirió de cada bolsa de sangre a la bolsa de plasma satélite. El P-PRP se dispensó en jeringas de 10 ml. Cada dosis de P-PRP iba acompañada de un tubo de reacción estéril que contenía 1 mL de gluconato de calcio, que se añadía al P-PRP inmediatamente antes de la infusión intramamaria (15).
Evaluación de células y mediadores en P-PRP
Se seleccionaron aleatoriamente un total de 30 jeringas P-PRP de 10 ml para el recuento automatizado de células totales (Celltac α MEK-6450, Nihon Kohden, Tokio, Japón). A continuación, las muestras se activaron con gluconato de calcio en una proporción de 1:10 y se incubaron a 37 °C durante 3 h para permitir la liberación de mediadores plaquetarios y la formación de gel plaquetario. Transcurrido este tiempo, se recogieron los sobrenadantes de P-PRP y se midieron los factores de crecimiento (TGF-β1 y PDGF-BB) y el factor plaquetario de quimiocinas-4 (PF-4).
Diseño del estudio y cálculo de la muestra de potencia
Este ensayo clínico aleatorizado fue diseñado para determinar el efecto de tres tratamientos (P-PRP, SC y P-PRP + SC) en vacas con MSC causada por bacterias Gram-positivas. También se incluyó un NCG compuesto por vacas que no fueron tratadas. Los grupos de tratamiento experimental fueron los siguientes: (a) P-PRP (10 mL, IMM), (b) SC (5 g, equivalente a 200 mg del antibiótico, IMM) y (c) P-PRP + SC (10 mL de P-PRP más 5 g de CS, IMM). Todos los tratamientos se administraron de forma ciega. El primer tratamiento se administró 4 días después del diagnóstico de IMIM. Cada cuarto de cada vaca, para cada uno de los grupos experimentales (P-PRP, Ab y P-PRP + Ab) fue tratado después del ordeño y la desinfección de los pezones con la administración de tres dosis de cada producto evaluado a intervalos de 24 h durante 3 días consecutivos.
El tamaño de la muestra para este ensayo clínico se calculó a priori teniendo en cuenta un valor de β de 0,8 y un valor de α de 0,05, que se basaron en los datos previos de otro ensayo clínico (15). En consecuencia, el n calculado para cada grupo fue de un mínimo de 28 vacas por grupo experimental y un total de 112 vacas para el estudio. Es importante aclarar que se seleccionaron 160 vacas al inicio del ensayo clínico para reducir el riesgo de retiro de animales (e incluso granjas) de cada uno de los grupos experimentales evaluados durante el desarrollo del estudio.
Flujo de trabajo bacteriológico y declaración de la infección intramamaria
Utilizando una técnica aséptica, se recogieron dos muestras de leche compuesta de cada vaca antes del ordeño en la primera visita a la granja (día 0) para seleccionar los animales potenciales para su inclusión en el estudio. Las muestras de leche se refrigeraron y se enviaron a nuestros laboratorios para su análisis. Se utilizó una muestra para el recuento automatizado de células somáticas (CCE) (Fossomatic, Foss, Hillerød, Dinamarca). Los resultados de SCC en leche se expresaron como una escala lineal (LSSCC) en miles/ml para normalizar la distribución de los datos.
Sobre la base de los resultados aritméticos de SCC (≥ 100.000 células/mL en vacas primíparas y ≥ 200.000 células/mL en vacas multíparas), la segunda muestra de leche se utilizó para cultivos bacteriológicos y para la determinación de citocinas lácteas mediante ELISA [IL-1b (Bovine IL-1β ELISA Reagent Kit, Thermo Fisher Scientific Inc., Waltham, MA, Estados Unidos) y TNF-a (Bovine TNF-alpha DuoSet ELISA, R&D Systems, Minneapolis, MN, Estados Unidos)] y GF [TGF-β1 (Human TGF-β1 DuoSet, DY240E, R&D Systems, Minneapolis, MN, Estados Unidos)] y PDGF-BB (Human PDGF-BB DuoSet, DY220, R&D Systems, Minneapolis, MN, Estados Unidos), tal como se realizaron en un estudio previo (15).
El flujo de trabajo microbiológico para la detección y declaración de infecciones estafilocócicas y estreptocócicas se realizó de acuerdo con los protocolos establecidos por el Consejo Nacional de Mastitis (). Los cultivos con más de dos especies bacterianas se consideraron contaminados y no indicativos de IMIM.
La infección intramamaria se declaró cuando una muestra de leche compuesta tenía un CCE por encima de los puntos de corte establecidos para vacas primíparas y multíparas y el cultivo microbiológico fue positivo para cualquier patógeno mamario grampositivo importante, como S. aureus, S. agalactiae, S. uberis y S. dysgalactiae (15).
Procedimiento de determinación de la cura
Tras el tratamiento de los animales, se recogieron muestras de leche agrupadas los días 21 y 22. Se realizaron análisis microbiológicos, ensayos de SCC, citocinas y GF en cada muestra de leche, como se describió anteriormente. La curación se definió en vacas infectadas al inicio del estudio y en las que no se aisló el microorganismo presente en las dos muestras posteriores al tratamiento.
La curación se definió a nivel de vaca y el riesgo de curación se evaluó estadísticamente para el grupo de tratamiento a los 22 días. Se definió una reducción de LSSCC (células/ml de leche) el día 22 como una posible curación para las dos muestras post-tratamiento (obtenidas en los días 21 y 22) en comparación con el primer valor obtenido el día 0, siempre que los cultivos bacteriológicos fueran negativos. Los cambios en las concentraciones de mediadores en la leche también se utilizaron como criterio para la curación y para evaluar la inflamación de la glándula mamaria.
Análisis estadístico
Los datos se analizaron utilizando el software estadístico JASP (JASP 0.17.1 (Intel) Universidad de Ámsterdam, Países Bajos). Los datos de cada variable se presentaron mediante estadística descriptiva. El análisis estadístico se realizó mediante modelos mixtos lineales generalizados (GLMMs) según el tipo de variable de respuesta (dicotómica o continua). Los principales factores clasificadores analizados para el GLMM dicotómico evaluando la curación de las vacas (0 = no curadas; 1 = curadas) fueron los siguientes: tratamiento (con cuatro niveles: P-PRP, SC, P-PRP + SC y NCG), rebaño (con cuatro niveles), número de partos (con cuatro niveles) y LSSCC/mL al día 0. Se utilizó una familia binomial GLMM y una función de enlace logit para determinar las diferencias entre la probabilidad de curación general (considerando todos los patógenos) (=1). Además, se realizaron GLMMs individuales para determinar la probabilidad de curación del NSQ causado por S. aureus y los estreptococos no agalactiae (S. uberis y S. dysgalactiae).
Para los GLMMs en los que las variables de respuesta eran de naturaleza numérica continua, se utilizaron distribuciones de familias gaussianas y funciones de enlace de identidad; además de los factores de clasificación mencionados anteriormente, se tuvo en cuenta el tiempo (con dos niveles: día 0 y día 22), curación (con dos niveles: 0 = no curado, 1 = curado) y tipo de bacteria (con dos niveles: S. aureus y grupo de estreptococos) para desarrollar los modelos estadísticos.
La vaca fue declarada como variable de efecto aleatorio en todos los modelos. Los mejores modelos se construyeron utilizando solo variables de respuesta estadísticamente significativas (p < 0,05). Del mismo modo, se seleccionaron los mejores modelos mediante el valor del criterio de información de Akaike (AIC) obtenido para cada modelo, evaluando el efecto individual de cada variable de respuesta según los criterios de Anderson y Burnham (18). A continuación, se realizaron GLMMs, incluyendo el estudio de las interacciones entre los factores altamente significativos previamente identificados. Cuando se encontraron diferencias estadísticamente significativas para los factores o la interacción entre ellos, se realizaron pruebas post-hoc de Scheffé. Se consideró estadísticamente significativo un p < 0,05 para todas las pruebas realizadas.
Resultados
Rebaños y animales
De las 160 vacas inscritas al comienzo del estudio, solo 130 vacas completaron el ensayo clínico. 30 vacas de cinco de los nueve rebaños inicialmente inscritos no completaron el ensayo clínico, dejando solo cuatro rebaños analizados en el estudio. Los grupos evaluados fueron los siguientes: P-PRP, SC, PRP + SC y NCG tuvieron 40, 28, 28, 36 y 26 vacas, respectivamente. Las vacas incluidas en el estudio tenían una edad media de 59,52 (±27,38) meses (rango 26,30-145,2 meses) con una producción media de leche de 15,55 (±5,46) L/día (rango 5-27 L/día) y 2,77 (±1,20) terneros en promedio.
Concentraciones celulares y mediadoras en P-PRP
El P-PRP utilizado en el ensayo clínico tenía una concentración de 260 (±40) ×10 3 plaquetas/μL y 0,23 (±0,012) leucocitos/μL. Después de la activación del P-PRP con sales de calcio, se midió una concentración promedio de 56.03 (±13.13) pg/mL de PDGF-BB, 9345.23 (±800.91) pg/mL de TGF-β1 y 5.10 (±1.66) pg/mL de PF-4 en los sobrenadantes derivados de este hemocomponente.
Infecciones intramamarias y asignación de tratamiento
Al inicio del estudio, 82 de 130 (63,06%) vacas tenían SCM causada por Staphylococcus aureus, 36 de 130 (27,68%) vacas estaban infectadas por Streptococcus uberis y 12 de 130 (9,22%) animales estaban infectados por Streptococcus dysgalactiae. El LSSCC basal en la leche fue de 15,97 (±1,58) células/mL. En la Tabla 1 se muestra la distribución de las vacas por agente etiológico y rebaño, y en la Tabla 2 se muestra la distribución de las vacas por grupo experimental asignado y agente etiológico de la MCS.
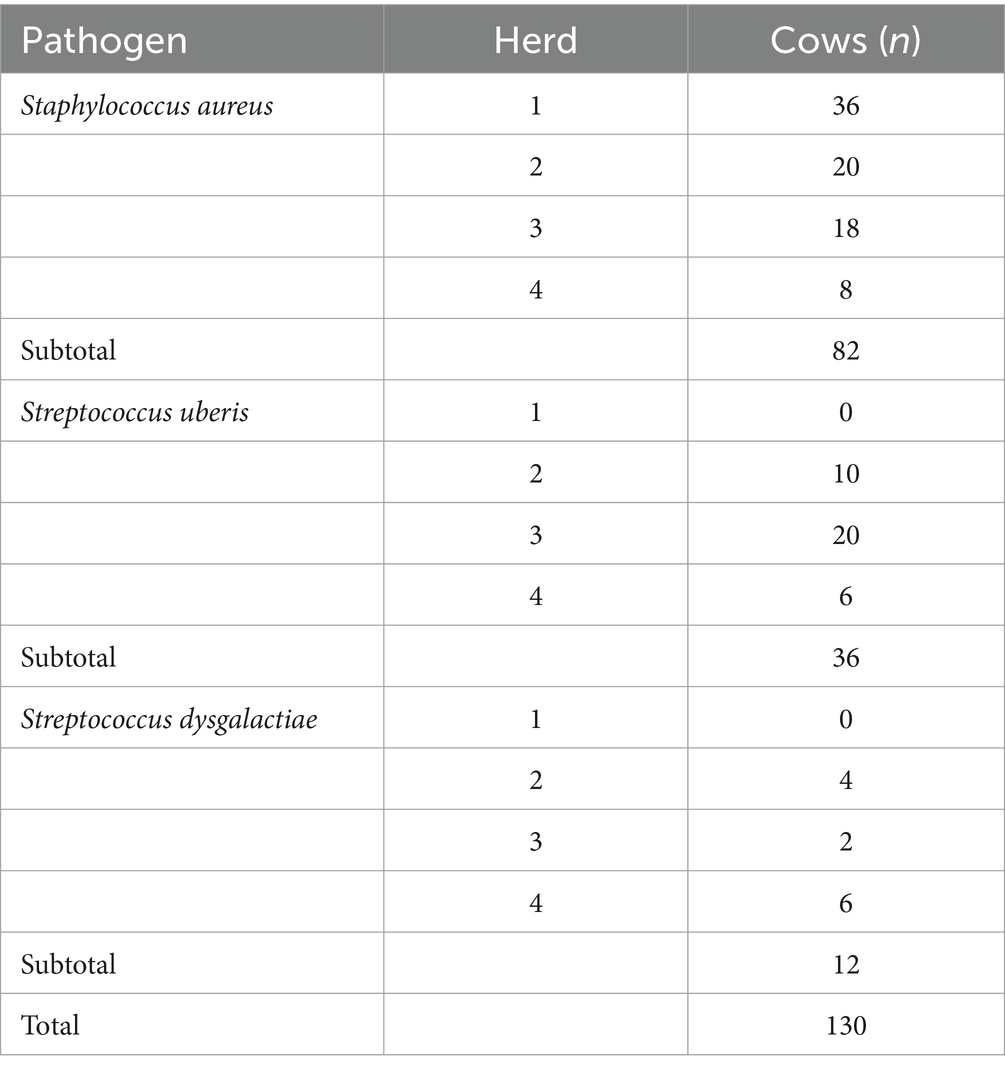
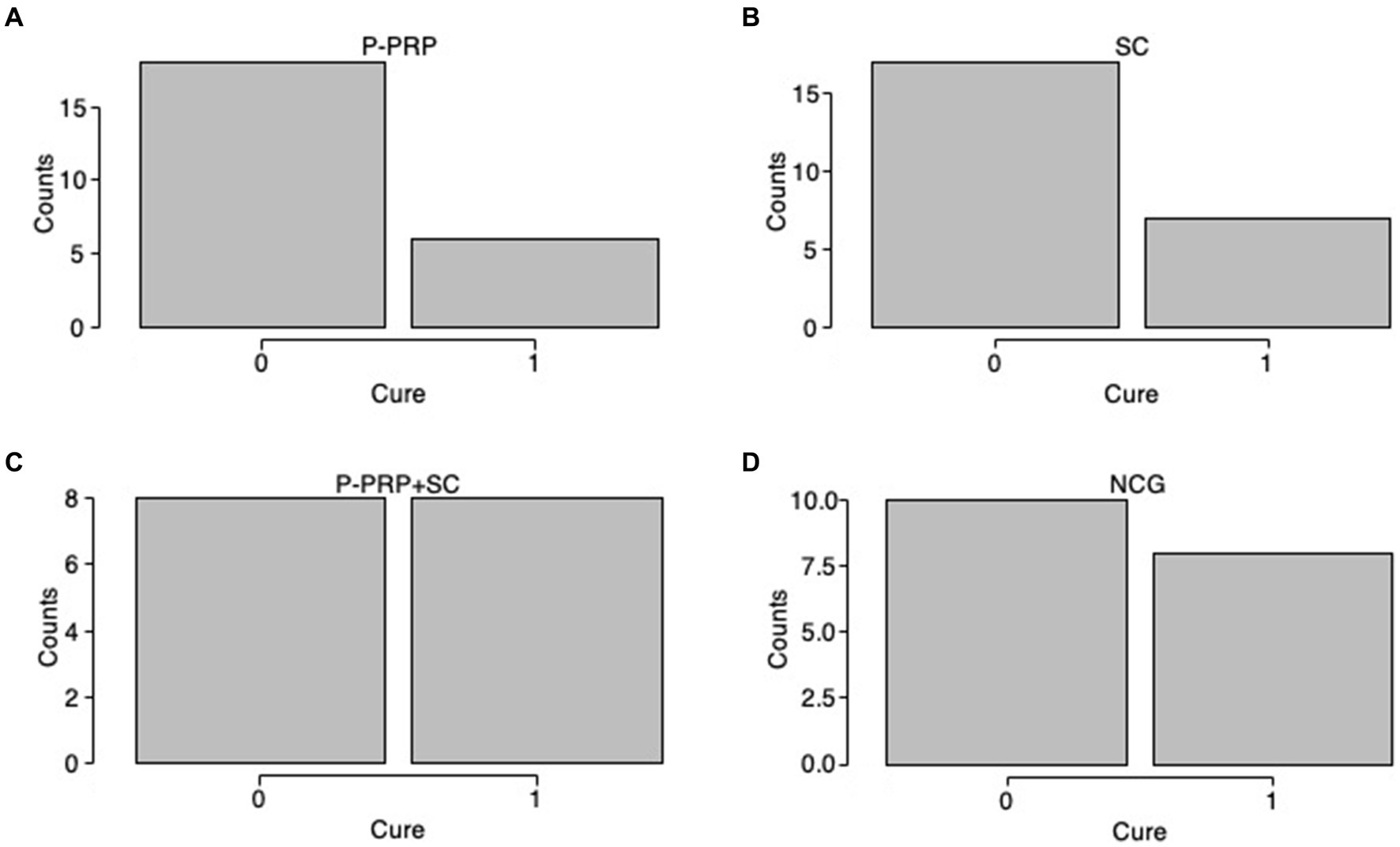
Cura bacteriológica general
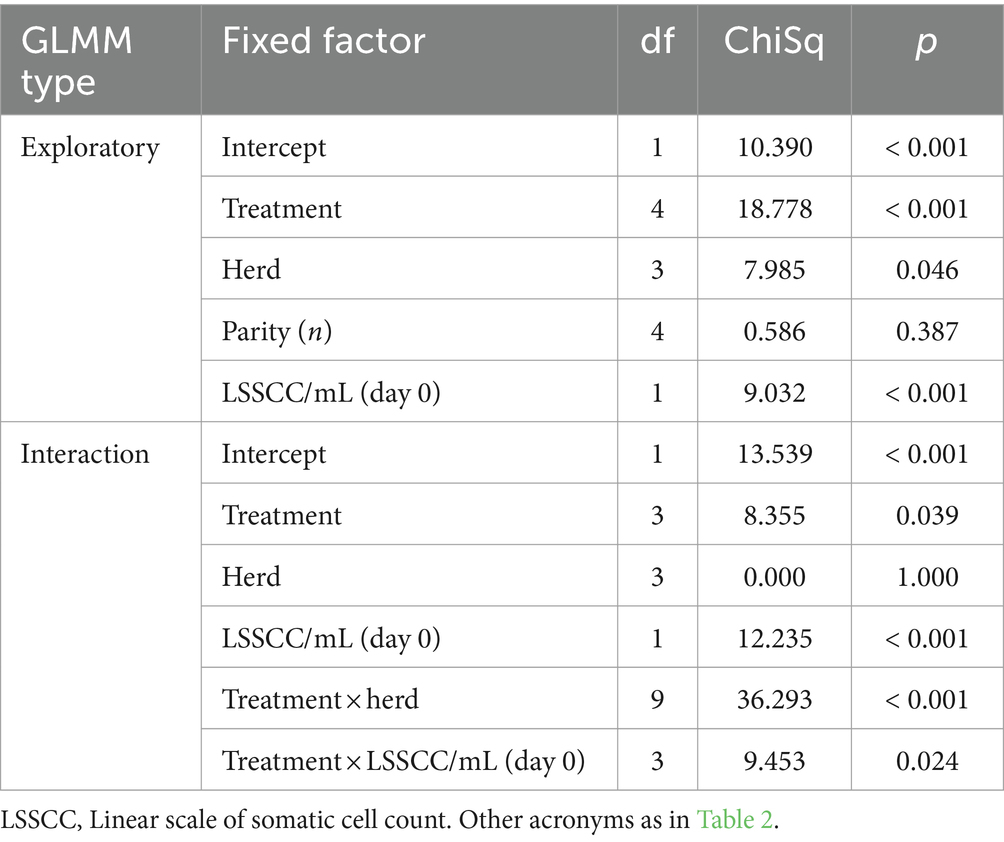
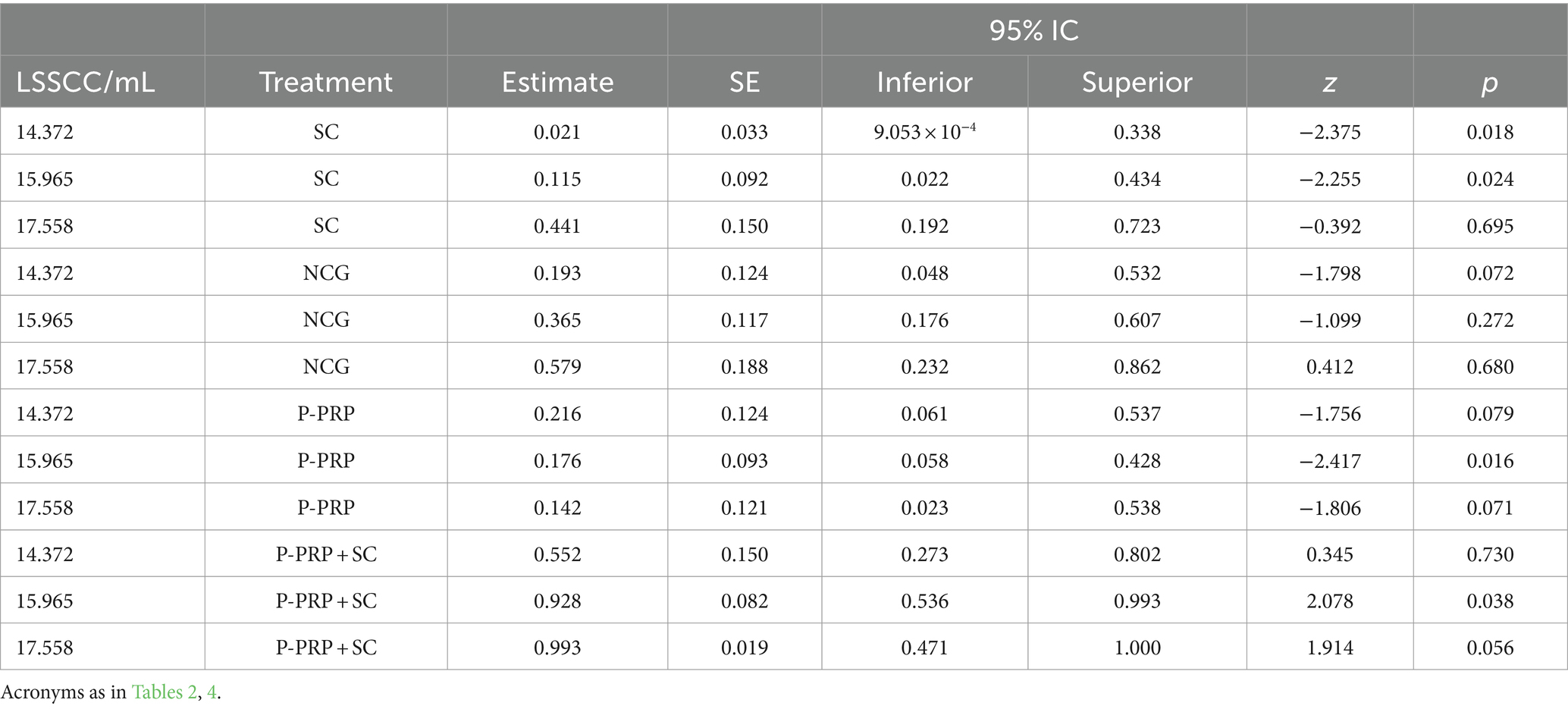
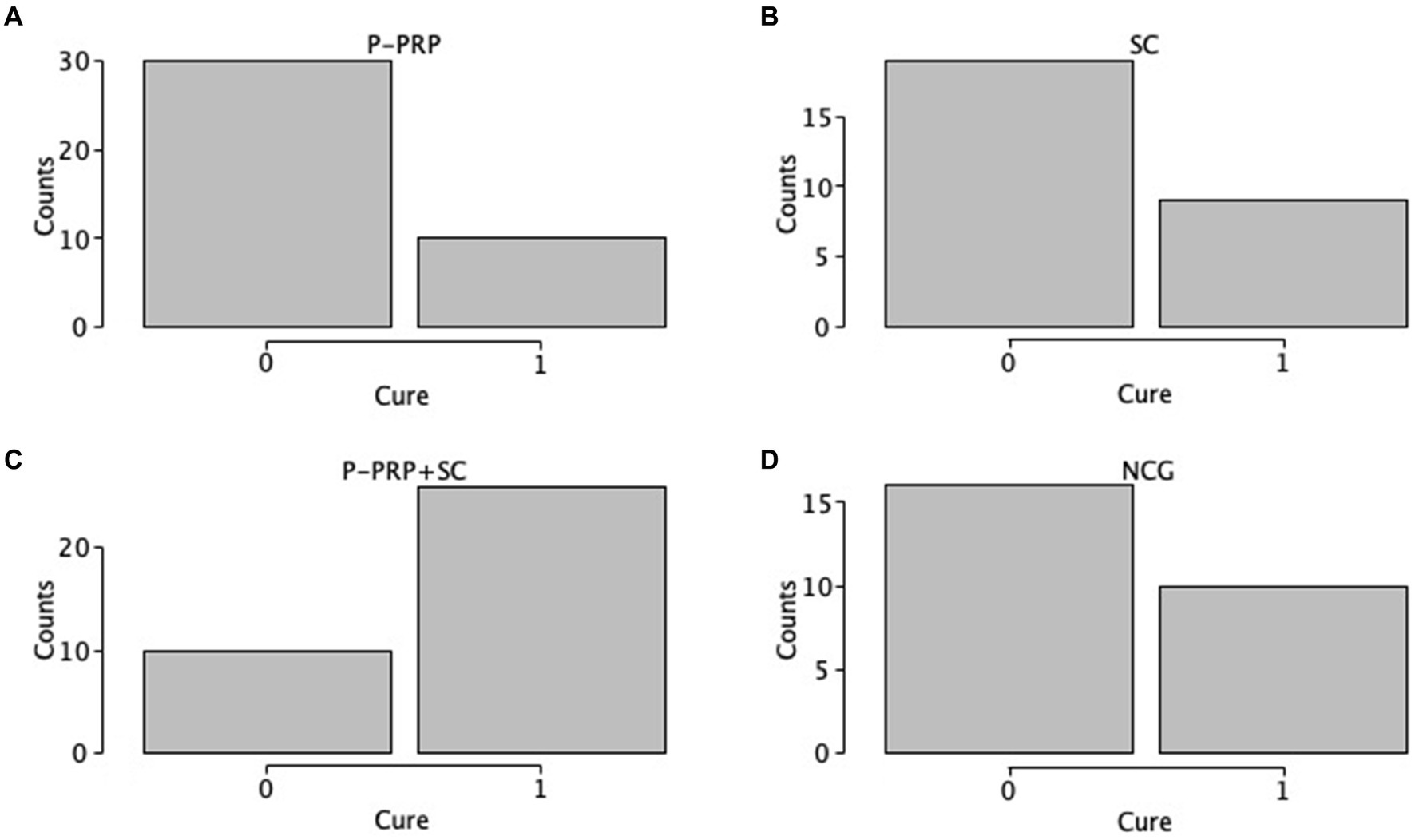
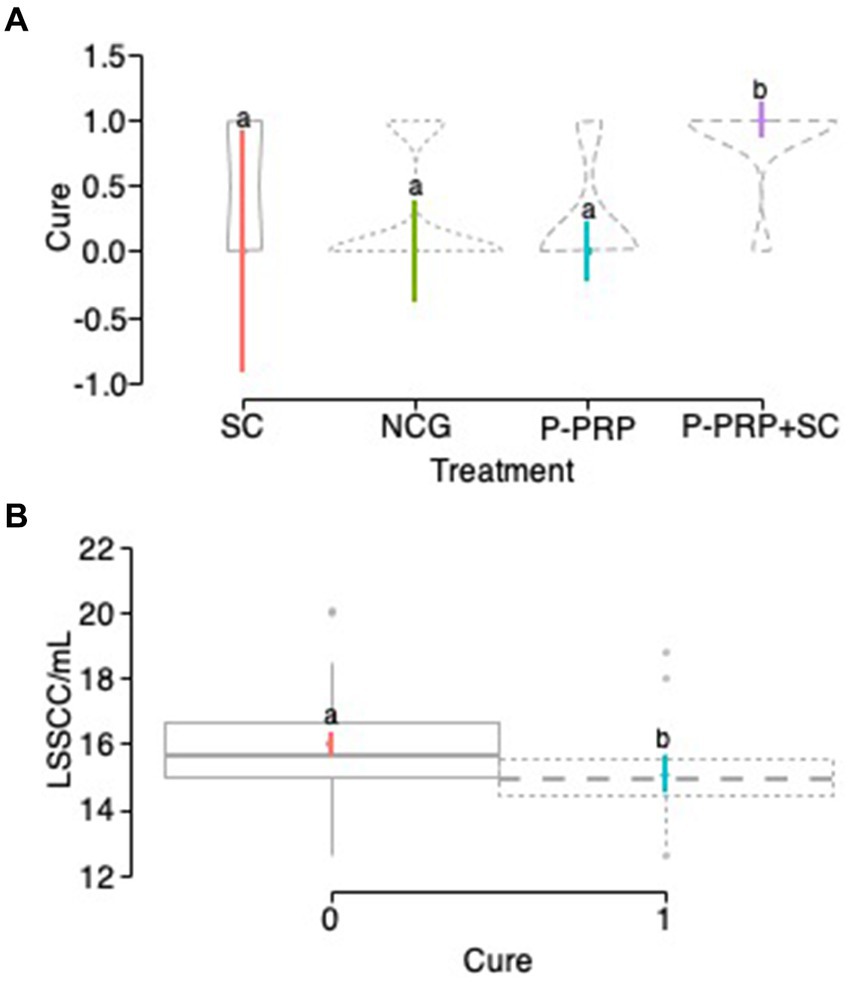
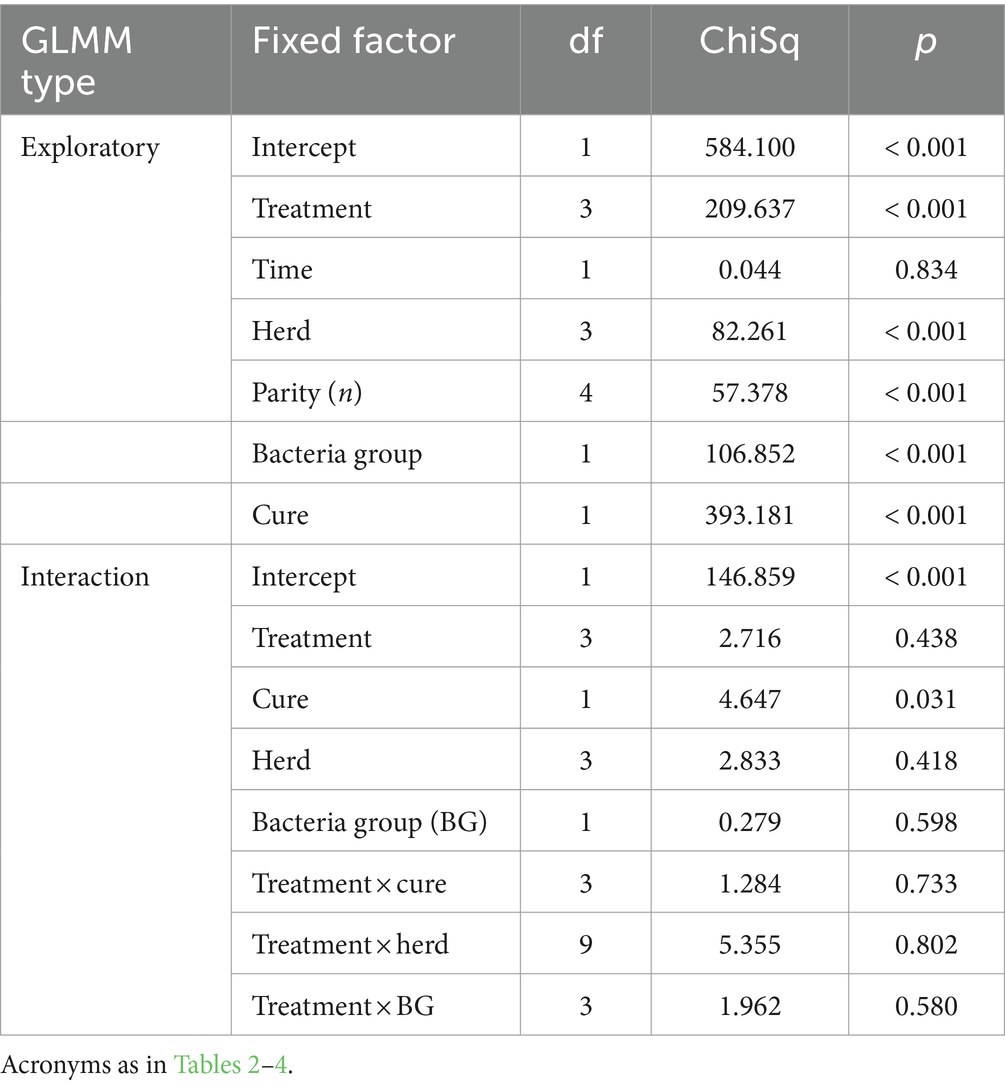
La curación bacteriológica general se observó en 10 de 40 (25%) vacas en el grupo P-PRP, nueve de 28 (32,14%) animales en el grupo SC, 26 de 36 (72,22%) vacas en el grupo P-PRP + SC y 10 de 26 (38,46%) animales en el grupo de control negativo (Figuras 1A-D). El GLMM exploratorio fue influenciado significativamente por el tratamiento de factores fijos, el rebaño y el LSSCC/mL al día 0 (Tabla 3). Posteriormente, el modelo de interacción se vio afectado significativamente por el tratamiento de factores fijos, el rebaño y el recuento de LSSCC/mL en el día 0 y por las interacciones entre el tratamiento × rebaño y el tratamiento × LSSCC/mL en el día 0 (Tabla 3).
En cuanto a la respuesta del tratamiento a la infección, se observó una respuesta terapéutica significativa (p = 0,001) en el grupo de vacas tratadas con la combinación P-PRP + SC en comparación con los otros dos tratamientos evaluados y con el NCG. Por otro lado, los resultados de curación del grupo de vacas tratadas con SC fueron similares a los de los grupos de vacas tratadas con P-PRP y NCG. Además, se observó una diferencia significativa (p = 0,021) entre el grupo control negativo de las vacas tratadas con P-PRP (Figura 2A).
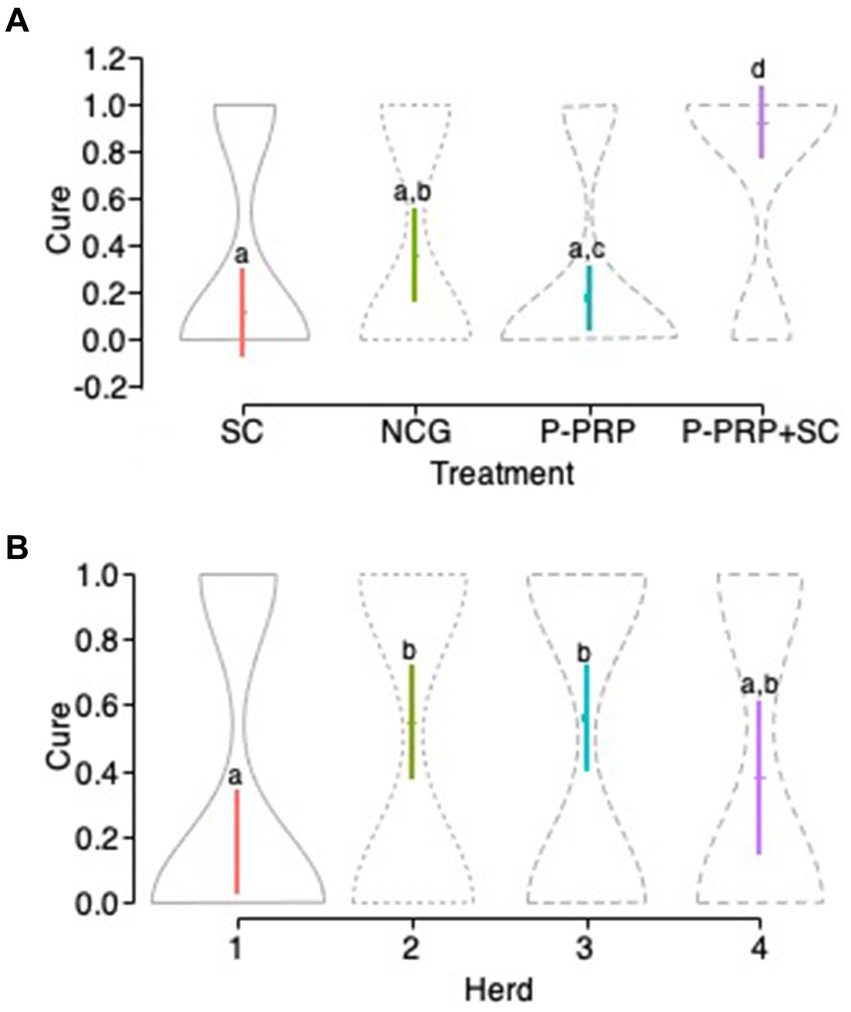
En cuanto al efecto del rebaño en el modelo de infección general, se observó que el rebaño 1 tuvo una probabilidad de curación significativamente menor que el rebaño 2 (p = 0,001) y 3 (p = 0,001) y no difirió del rebaño 4. Al analizar la interacción significativa entre el tratamiento y los factores del rebaño (Tabla 3), se observó en general que los grupos de animales tratados con P-PRP en los rebaños 2, 3 y 4 respondieron mejor que el grupo tratado con el mismo producto en el rebaño 1. De manera similar, las vacas tratadas con SC mostraron respuestas terapéuticas significativas en los rebaños 1, 2 y 3 y bajas tasas de curación en el rebaño 4 (Figura 2B).
Los rebaños 2 y 3 mostraron altas tasas de curación en los grupos P-PRP + SC, mientras que los rebaños 1 y 4 mostraron respuestas variables al mismo tratamiento. Con respecto a la NCG, las vacas del rebaño 2 tuvieron la menor cicatrización en comparación con las vacas de los otros rebaños, donde muchas de las cuales sanaron espontáneamente (ver Tabla 4 para diferencias estadísticamente significativas específicas).
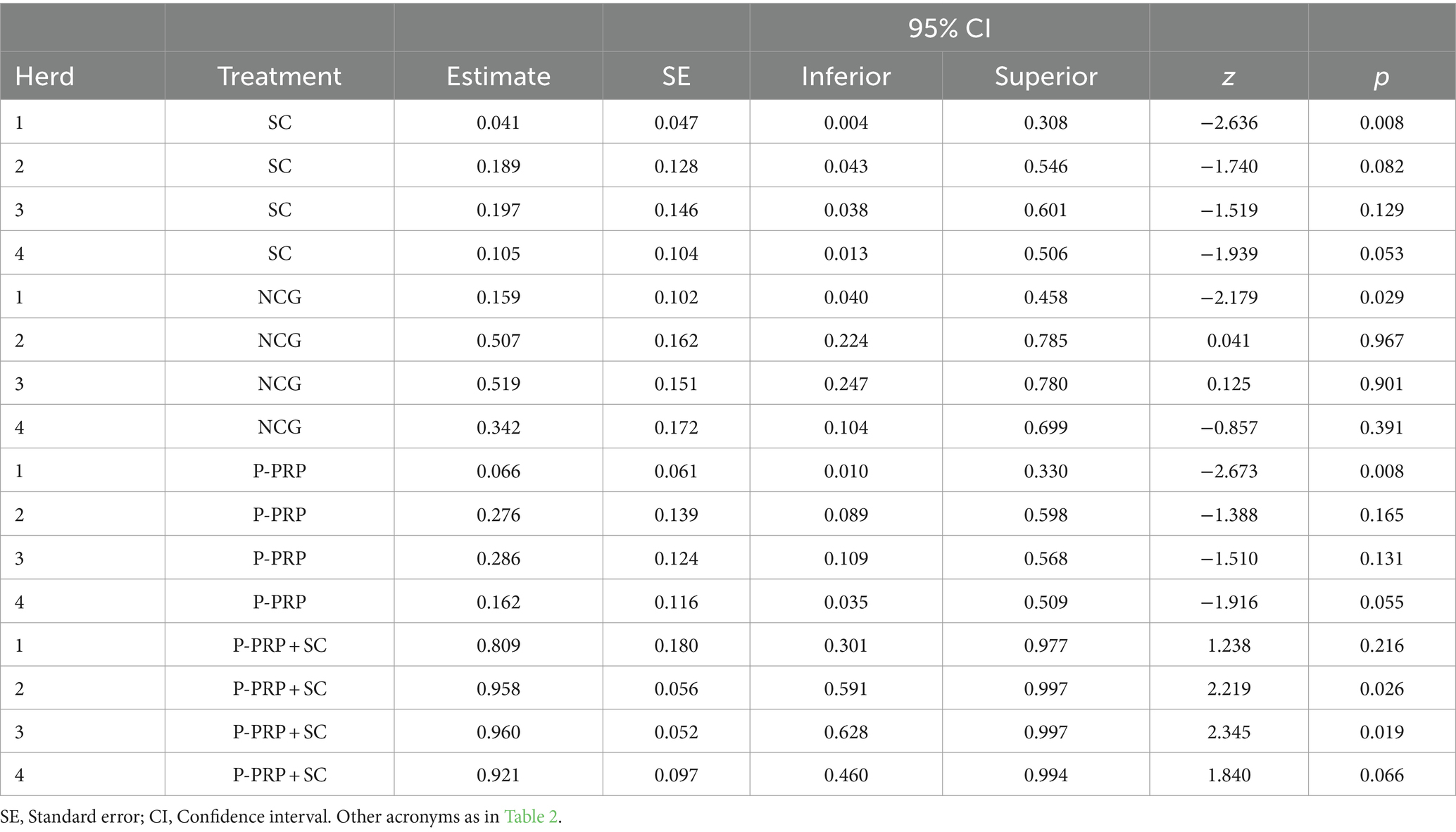
Tabla 4. Medias marginales estimadas para la curación general sobre la interacción entre el tratamiento y los factores del rebaño.
En cuanto a la interacción del tratamiento con factores fijos × LSSCC/mL en el día 0, se observó que las vacas que respondieron significativamente al tratamiento con P-PRP y P-PRP + SC presentaron LSSCC/mL en el día 0 igual o menor a 15.97 (células/mL), mientras que para el grupo de tratamiento con SC se observaron respuestas significativas para LSSCC/mL en el día 0 entre 14.36 y 15.97 células/mL. Por otro lado, las vacas en el NCG no se vieron afectadas por LSSCC/mL en el día 0 (ver Tabla 5 para conclusiones estadísticas exactas).
Cura bacteriológica específica
En cuanto a la respuesta a los diferentes grupos de tratamiento para cada una de las bacterias aisladas, se decidió analizar el efecto de estas frente a S. aureus y el grupo de estreptococos formado por S. uberis y S. dysgalactiae, ya que esta última bacteria tuvo una representación muy baja como agente etiológico de los casos de SCM (n = 12 de 130) encontrados en el estudio. e incluso en la manada 1, no se reportaron casos.
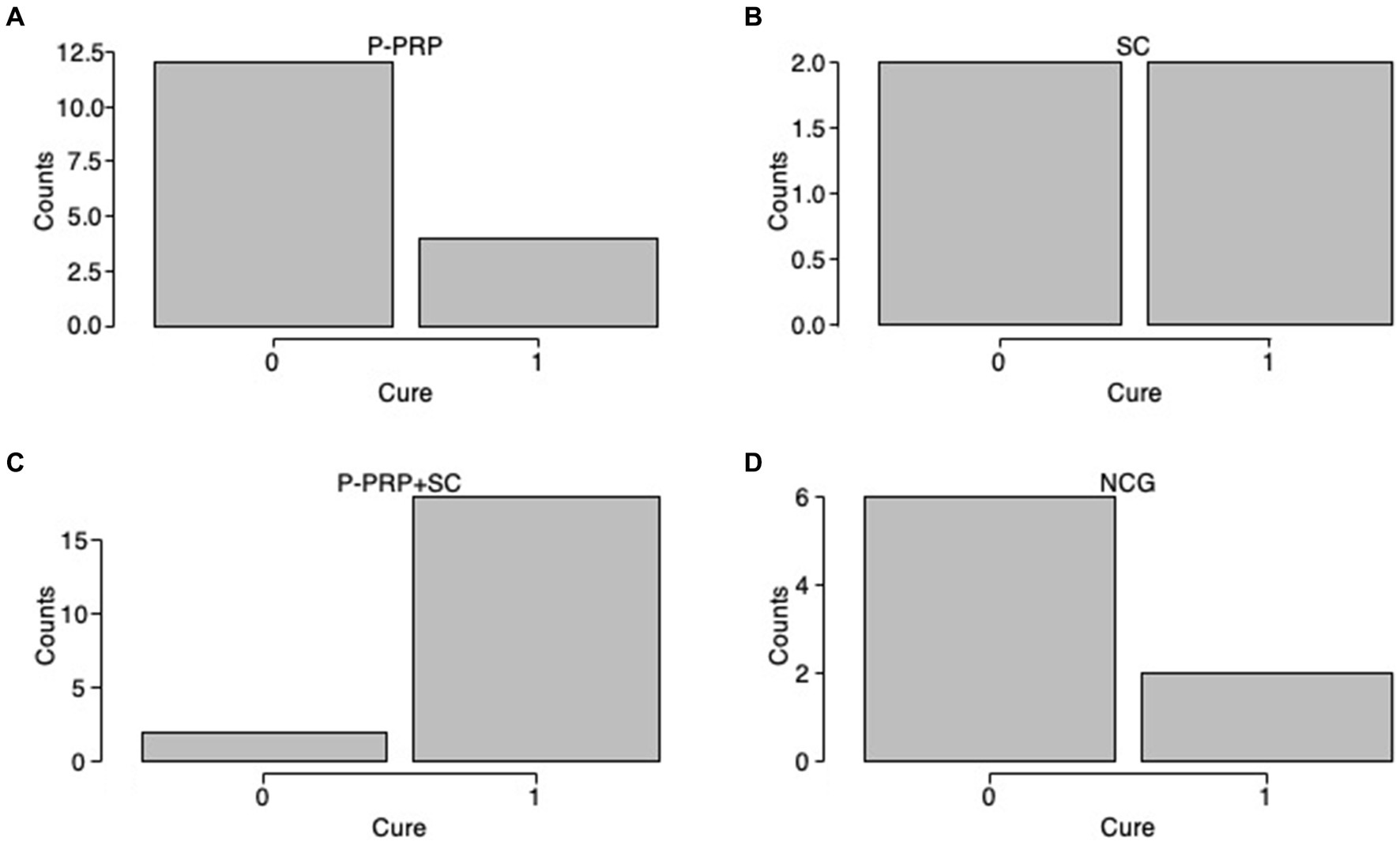
Para la SCM inducida por S. aureus (82 de 130, 63,08%), la curación se observó en seis de 24 (25%) vacas tratadas con P-PRP, siete de 24 (29,2%) vacas tratadas con SC, ocho de 16 (50%) animales tratados con P-PRP + SC y ocho de 18 (44,4%) vacas del NCG (Figuras 3A-D). Por otro lado, la SCM producida por el grupo de los estreptococos (48 de 130, 36,91%) se curó en cuatro de 12 (33,3%) vacas tratadas con P-PRP, dos de 4 (50%) animales tratados con SC, 18 de 20 (90%) vacas tratadas con P-PRP + SC y dos de 8 (25%) vacas del NCG (Figuras 4A-D).
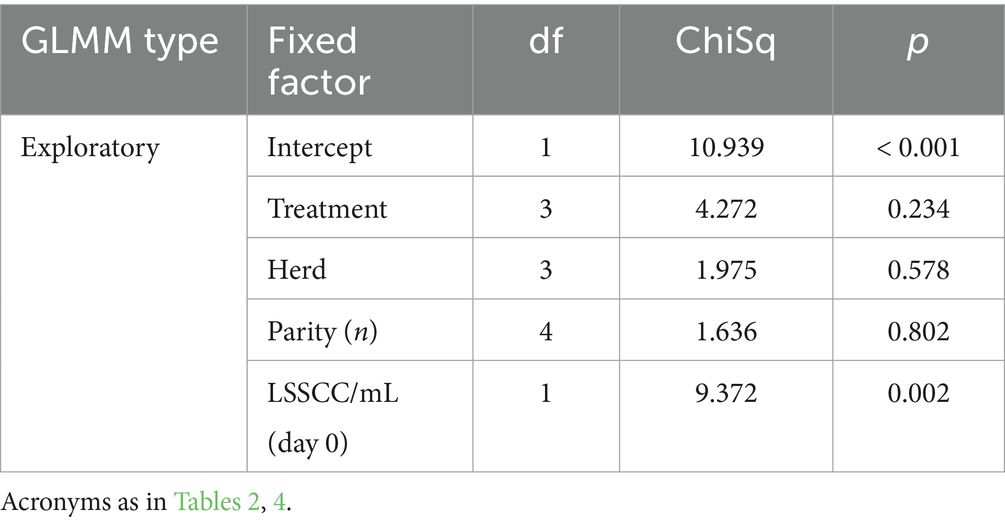
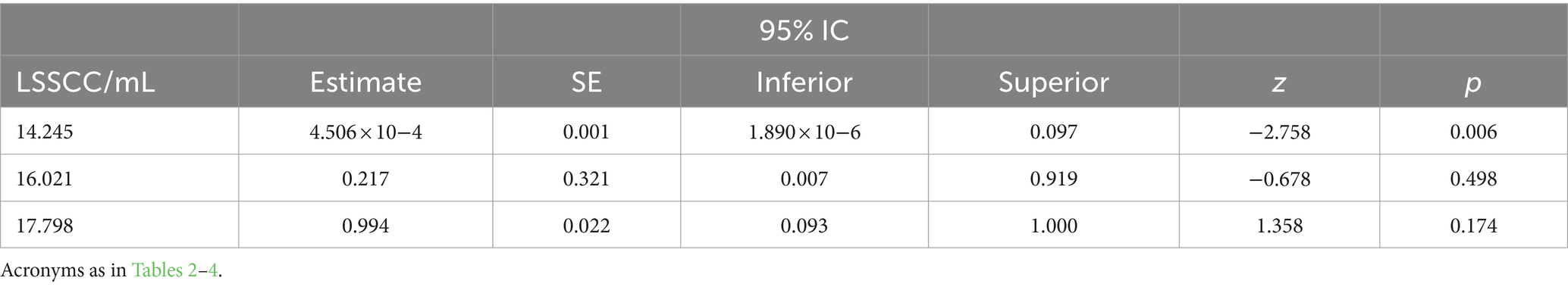
En cuanto a la respuesta al tratamiento, evaluando solo la población de vacas infectadas con S. aureus, el GLMM exploratorio reveló solo un efecto significativo de la LSSCC/mL en el día 0 como factor asociado a la curación de las vacas infectadas con esta bacteria (Tabla 6). En general, se observó que las vacas con LSSCC/mL en el día 0 igual o menos de 14,25 células/mL tuvieron una tasa de curación significativamente mayor que las vacas con LSSCC/mL por encima de esta concentración de células somáticas en la leche (Tabla 7).
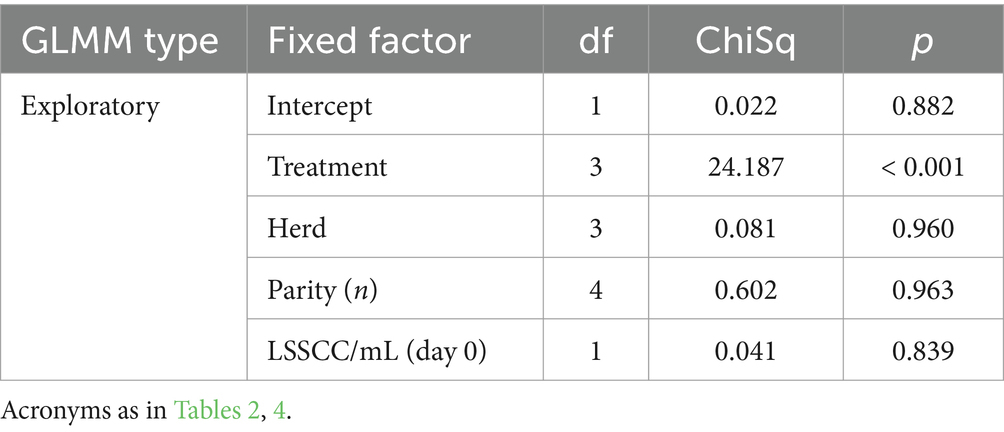
El GLMM exploratorio de efectos fijos individuales en el grupo de vacas infectadas con estreptococos mostró que solo el factor de tratamiento tuvo un efecto significativo en el modelo (Tabla 8). En cuanto al efecto del tratamiento, se observó que la combinación de P-PRP + SC aumentó significativamente (p = 0,005) la probabilidad de curación de la MSC producida por el grupo estreptocócico en comparación con los otros tratamientos. Del mismo modo, no se encontró diferencia significativa entre las vacas tratadas con SC y P-PRP y los animales del NCG en cuanto a la probabilidad de curación de este tipo de SCM (Figura 5A).
Cambios celulares y bioquímicos en la leche
Recuentos de células somáticas
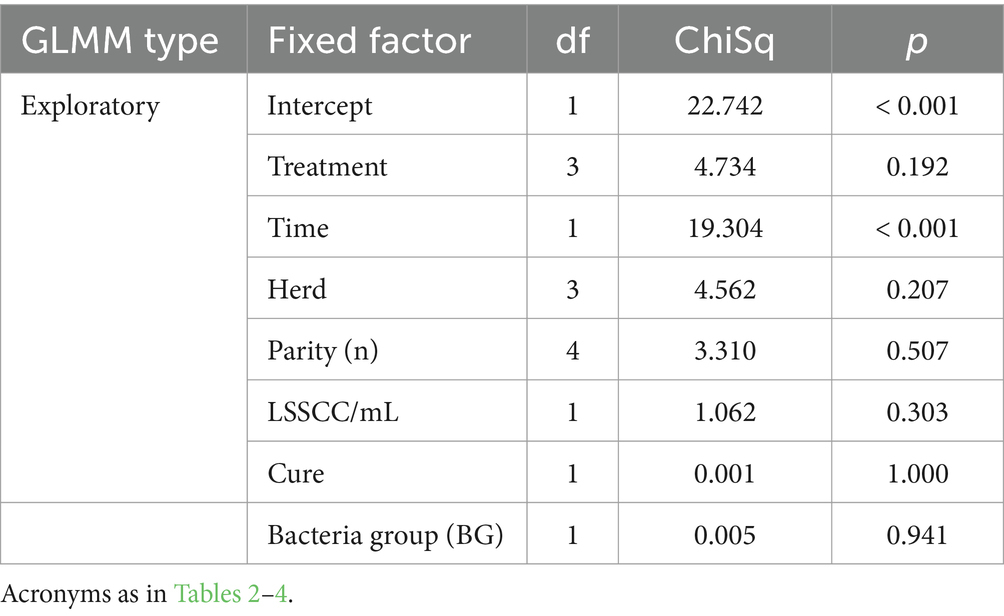
En el modelo exploratorio, el LSSCC/mL se vio significativamente afectado por los efectos fijos del tratamiento, el rebaño, la cura, el grupo de bacterias y el número de partos, mientras que el factor tiempo no afectó esta variable de respuesta (Tabla 9). Sin embargo, en el modelo de interacción, no hubo un efecto significativo del tratamiento, pero sí un efecto significativo del factor de curación (Tabla 9; Figura 5B).
Concentración de mediadores en la leche
Las concentraciones de IL-1β en la leche se vieron significativamente influenciadas en el modelo exploratorio por el tratamiento de factores fijos, el rebaño y el LSSCC/mL, mientras que factores como el tiempo, el número de partos, la curación y el tipo de bacteria no influyeron en el modelo (Tabla 10). Posteriormente, en el modelo de interacción, se observó un efecto significativo para el tratamiento, los factores de la granja y la interacción entre el tratamiento y los factores del rebaño, mientras que el factor LSSCC/mL no afectó el modelo (Tabla 10).
Al evaluar el efecto del tratamiento sobre las concentraciones totales de IL-1β (pg/mL) en leche, se observó que las vacas tratadas con SC y P-PRP + SC presentaron las concentraciones más bajas de esta citocina inflamatoria que los otros grupos evaluados. Sin embargo, las concentraciones de IL-1β fueron similares entre los grupos tratados con CS y P-PRP, mientras que las concentraciones de este mediador fueron significativamente mayores en los grupos NCG que en los grupos SC (p = 0,004) y P-PRP + SC (p = 0,001). Las concentraciones de mediadores fueron significativamente (p = 0,029) más altas en la leche del grupo de vacas tratadas con P-PRP que en la de las vacas tratadas con P-PRP + SC (Figura 6A). Por otro lado, cuando se evaluó el efecto rebaño, se observó que las concentraciones de IL-1β en la leche fueron significativamente mayores (p = 0,001) en los rebaños 2 que en los rebaños 1, 3 y 4 (Figura 6B).
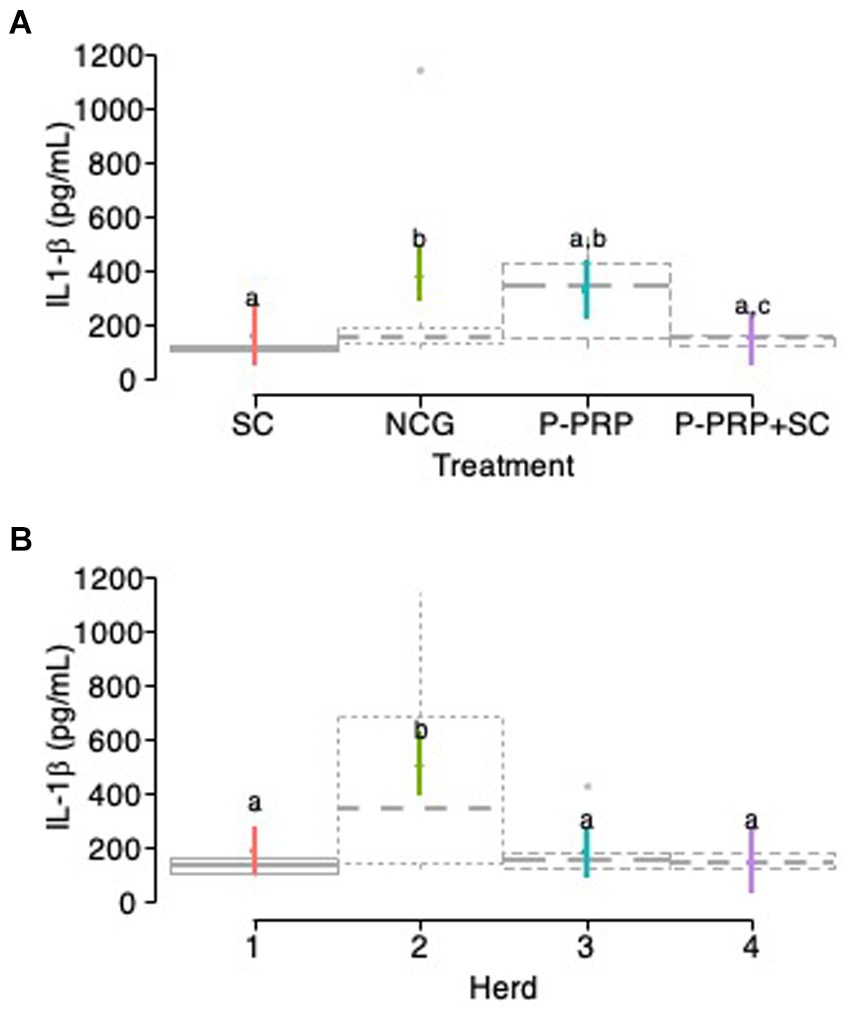
El análisis de la interacción entre el tratamiento y los factores de la granja mostró que las vacas tratadas con P-PRP y los animales de NCG del rebaño 2 tenían concentraciones significativamente (<0,001) más altas de IL-1β que las vacas de los otros grupos de tratamiento de los rebaños 1, 3 y 4. Por otro lado, las concentraciones en la leche de este mediador inflamatorio fueron significativamente mayores en las vacas NCG del rebaño 2 que en los animales tratados con P-PRP del mismo rebaño (Figura 7).

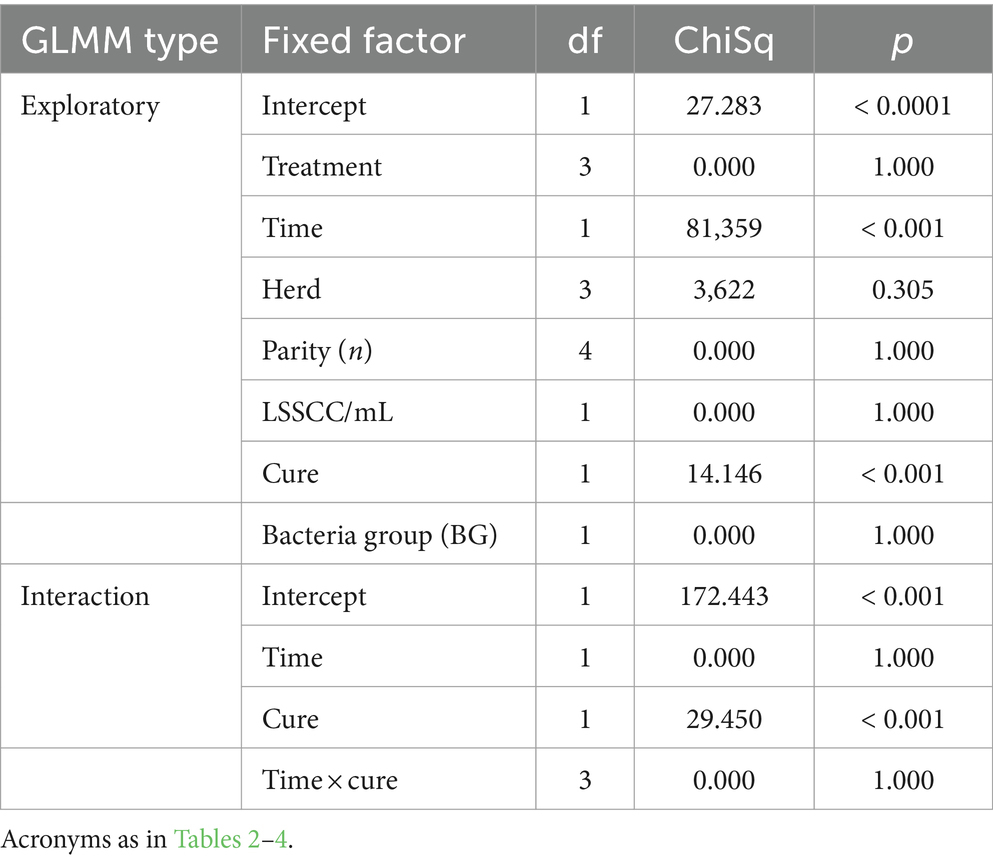
En cuanto a las concentraciones de TNF-α leche, se observó que en el modelo exploratorio, el tiempo del factor fijo influyó significativamente en la concentración de este mediador, mientras que otros factores fijadores evaluados no influyeron en el modelo (Tabla 11). En cuanto al factor tiempo, se observó que las concentraciones de leche con TNF-α fueron significativamente menores a los 22 días que al inicio (Figura 8A).

En el modelo exploratorio, las concentraciones de TGF-β1 en la leche se vieron significativamente afectadas por los factores de tiempo y curación, mientras que los demás factores no afectaron al modelo (Tabla 12). En el modelo de interacción, se pudo observar que el factor de curación fue el único factor fijo que influyó significativamente (p < 0,001) en el modelo (Tabla 12; Figura 8B).
Discusión
Los resultados del presente estudio proporcionan información novedosa sobre el potencial terapéutico del P-PRP y su combinación con antibióticos, como la cloxacilina sódica, para el tratamiento de la MCS bovina causada por los principales patógenos Gram-positivos, como S. aureus, S. uberis y S. dysgalactiae. Hasta donde sabe el autor, la presente investigación es probablemente la investigación más completa hasta la fecha que ha examinado el papel terapéutico de un hemocomponente alogénico técnicamente categorizado como un tipo de P-PRP (14).
Las características más importantes del presente estudio son su diseño metodológico, que incluyó un número adecuado de vacas para cada grupo terapéutico evaluado, así como la inclusión de un NCG. Estas características permitieron el desarrollo de una investigación con alto poder estadístico y bajo riesgo de sesgo. Por otro lado, este estudio aporta información importante sobre la respuesta biológica de la glándula mamaria a los patógenos causantes de la MSC y cómo responde a los diferentes tratamientos evaluados.
En línea con lo anterior, y aunque desde el punto de vista biológico no es posible estudiar un arreglo completo de eventos celulares y la producción de mediadores solubles en un evento dinámico de SCM bovino, esta investigación buscó conocer, en parte, conocer el comportamiento de algunas partes fundamentales en este proceso patológico y frente a la respuesta terapéutica generada en el mismo por el efecto de los tratamientos evaluados en el estudio. En este sentido, se decidió medir el CCS en leche, así como la concentración de IL-1β, TNF-α y TGF-β1.
Es importante destacar que la SSC es quizás el mejor biomarcador relacionado con la salud de la glándula mamaria y uno de los indicadores de la respuesta inmune a la infección de la glándula mamaria, por lo que su monitoreo constante es esencial dentro de los programas de salud mamaria de un rebaño lechero (19). En general, el CCE elevado por encima de los puntos de corte establecidos para las vacas primíparas (<100 × 103 SC/mL de leche) o multíparas (<200 × 103 SC/mL de leche) se asocian con una infección subclínica de la glándula mamaria de las vacas, y su reducción con el tiempo casi siempre se asocia con la curación o resolución de dicha patología (20, 21). Por otro lado, las citoquinas IL-1β y TNF-α son potentes mediadores proinflamatorios que podrían reflejar el grado de inflamación del tejido mamario antes y después del efecto de los diferentes tratamientos evaluados, mientras que el TGF-β1 es un factor de crecimiento pleiotrópico con un potente efecto antiinflamatorio y anabólico sobre células y tejidos (15, 22, 23).
Hasta donde saben los autores, este es el primer estudio clínico que se lleva a cabo en vacas lecheras cruzadas con SCM en condiciones ambientales tropicales. Como se mencionó en la sección de resultados de este informe, 30 vacas pertenecientes a cinco granjas fueron excluidas por diversas razones que no les permitieron completar el estudio. Este tipo de situaciones son uno de los problemas más comunes con los que se encuentran los investigadores clínicos, y una de las formas de prevenirla es aumentar el número de animales tratados por grupo para evitar la pérdida de potencia estadística del estudio (24).
La concentración de plaquetas y leucocitos, así como la concentración de TGF-β1, PDGF-BB y PF-4 por mL de este hemocomponente, se encontraban dentro de las concentraciones previamente descritas para este hemocomponente (14), lo cual fue evaluado previamente en un estudio clínico del mismo tipo (15). Típicamente, el hemocomponente evaluado en el presente estudio corresponde a un P-PRP que tiene una concentración de plaquetas similar o ligeramente aumentada en comparación con los recuentos de estos fragmentos citoplasmáticos en sangre total de animales donantes, así como una concentración extremadamente baja o insignificante de leucocitos (25).
En el presente estudio, el 25% de las vacas tratadas con P-PRP y el 32,14% de las vacas tratadas con SC mostraron una curación bacteriológica completa. Comparando estos resultados con nuestro estudio clínico previo (15), se observa una ligera disminución de la eficacia del PRP del 5% y una disminución drástica del efecto terapéutico del antibiótico del 38,36%. Respecto a este último aspecto, cabe aclarar que en nuestro primer estudio clínico utilizamos una cefalosporina de cuarta generación (sulfato de cefquinoma) (15), que es farmacológicamente más potente frente a bacterias resistentes a antibióticos β-lactámicos que el SC (4, 26). Sin embargo, a pesar de la alta eficacia terapéutica del sulfato de cefquinoma, las agencias reguladoras de medicamentos en algunos países, e incluso la Organización Mundial de la Salud, han recomendado que se prohíba su uso en animales de granja, argumentando que dichos antibióticos deben mantenerse en reserva terapéutica para su uso en humanos para reducir la posible resistencia cruzada microbiana a los antibióticos (27).
En consonancia con los resultados anteriores, se observó un dato contradictorio con respecto a la NCG, ya que el 38,46% de las vacas de este grupo mostraron cicatrización espontánea sin necesidad de recibir ningún tratamiento. Las vacas tratadas con P-PRP tenían una probabilidad de curación significativamente menor que las vacas en el NCG. Sobre este interesante aspecto, es posible pensar que el uso de este hemocomponente puede provocar una disminución de los mecanismos inmunológicos de la ubre y, por tanto, disminuir la probabilidad de curación frente a una infección causada por S. aureus de este órgano. Sin embargo, este hecho debe reservarse hasta que se puedan realizar estudios experimentales controlados en los que se puedan realizar infecciones mamarias en grupos homogéneos de vacas con patógenos específicos y del mismo patrón genético.
Por otro lado, el resultado más importante de nuestro estudio fue que la combinación de P-PRP con SC produjo un aumento significativo en la curación bacteriológica global (72,22%) en el grupo de vacas con SCM que fueron tratadas con esta mezcla terapéutica. Este resultado fue significativamente superior a los otros grupos evaluados en los que se obtuvo una diferencia porcentual de 47,22% vs. P-PRP, 40,08% vs. antibiótico y 33,76% vs. NCG. Cabe mencionar que en un estudio donde vacas fueron tratadas con MC (aguda y crónica), se observó un efecto terapéutico sinérgico similar (16).
Es posible que el P-PRP contenido en esta mezcla haya potenciado la capacidad del antibiótico para penetrar en las paredes celulares bacterianas o haya afectado a algún componente metabólico o estructural de las bacterias para permitir el efecto microbicida del antibiótico (26, 28), incluso en cepas bacterianas resistentes a él. Sin embargo, este último aspecto es una hipótesis plausible que debería ser abordada en futuros estudios.
Los resultados de los modelos estadísticos sobre la curación global nos permitieron demostrar, además del efecto significativo del tratamiento en el modelo exploratorio, los efectos asociados a la granja de factores fijos y al LSSCC/mL en el día 0 (29-31). El efecto rebaño puede influir en la curación de este tipo de patologías como las condiciones particulares de un rebaño pueden influir en los resultados; Las condiciones nutricionales de las vacas, las prácticas de manejo sanitario y la distribución ambiental de las cepas bacterianas, entre otras, podrían estar relacionadas con un rebaño en particular (31).
En nuestro caso, observamos una menor respuesta de curación en las vacas del rebaño 1 que en los animales de los rebaños 2 y 3, mientras que la cicatrización bacteriológica general del rebaño 4 fue similar a la de las otras granjas. Llegados a este punto, es necesario realizar estudios que permitan profundizar en las condiciones ambientales de estos rebaños para mejorar la respuesta a los tratamientos de SCM en sus vacas infectadas. Por otro lado, se observó que, independientemente del tratamiento asignado, los animales con LSSCC/mL en el día 0 por debajo de 15,96 células/mL tenían más probabilidades de mostrar curación bacteriológica que las vacas con LSSCC/mL más alto. Este último hallazgo ha sido reportado en estudios en los que se produjeron SCMs de S. aureus (1, 20, 31).
El análisis individual de la curación de la MSC inducida por S. aureus en los grupos de vacas tratadas con P-PRP, SC, P-PRP + SC y las no tratadas (NCG) fue de 25, 29,2, 44,4 y 50%, respectivamente. Desafortunadamente, estos resultados indican que ninguna terapia fue efectiva para controlar esta enfermedad, e incluso las vacas no tratadas pudieron eliminar la infección igual de bien sin incurrir en costos de tratamiento para estas infecciones reportadas por el productor (1, 20, 31). Por otro lado, se observó que las vacas con un día 0 de LSSCC de menos de 14,25 células/mL tenían significativamente más probabilidades de curarse que las vacas con mayores recuentos de estas células. Es importante aclarar que una de las principales causas de sacrificio en vacas lecheras son las infecciones clínicas y subclínicas por S. aureus, que muchas veces son refractarias a las terapias antibióticas convencionales (32, 33), ya que a nivel mamario este tipo de bacterias pueden colonizar el interior de las células epiteliales mamarias (34). A partir de los resultados presentados, es necesario desarrollar un estudio clínico adicional para determinar el grado de resistencia antibiótica de las cepas individualizadas de estas bacterias para cada vaca a tratar, de forma que solo se utilicen antibióticos con una probabilidad terapéutica efectiva y determinar su potencial efecto sinérgico contra las infecciones mamarias causadas por estas bacterias y cómo el PRP podría mejorar la capacidad de penetración celular del antibiótico (34).
En cuanto a la MSC causada por el grupo de estreptococos (S. uberis y S. dysgalactiae), se observó la curación en el 33,3% de las vacas tratadas con P-PRP, el 50% de los animales tratados con SC, el 90% de las vacas tratadas con la mezcla de P-PRP + SC, mientras que las vacas del NCG presentaron una curación espontánea en el 25% de los casos. Hay que aclarar que el tratamiento fue el único factor fijo que influyó en las vacas a curar. Los resultados del presente estudio, especialmente para el P-PRP, fueron inferiores (33%) a los obtenidos para el mismo hemocomponente en un estudio previo, donde el 50% de las vacas infectadas con este grupo de patógenos mostraron una curación bacteriológica (15). Además, una proporción de vacas tratadas con SC también tuvieron una tasa de curación más baja (50%) que las vacas tratadas con sulfato de cefquinoma (90%) (15).
Sin embargo, la combinación de SC y P-PRP tuvo un efecto terapéutico similar (90%) al sulfato de cefquinoma. Este último hallazgo es alentador porque el P-PRP puede mejorar el efecto de los antibióticos b-lactámicos en las bacterias que parecen ser resistentes a ellos. Es importante tener en cuenta que el PRP no redujo la cantidad de SC necesaria para producir la curación en las vacas tratadas con esta combinación. Sin embargo, parece que este hemocomponente actuó de forma sinérgica, potenciando la acción bactericida del SC.
Como se mencionó anteriormente, la capacidad de defensa innata de la glándula mamaria, particularmente relacionada con los leucocitos (células somáticas) excretados a través de la leche, representa uno de los mecanismos facilitadores más importantes para la resolución de infecciones mamarias clínicas y subclínicas y, como se observó anteriormente, para la resolución de SCMs producidas por S. aureus. En nuestro estudio, se observó que las vacas curadas tenían un LSSCC/mL significativamente más bajo que las vacas no curadas, independientemente del tratamiento utilizado. Este hallazgo es consistente con informes previos que muestran que los animales con SCC bajo tienen más probabilidades de curarse de episodios de SCM y MC que los animales con SCC alto (35, 36).
Tanto la IL-1b como el TNF-a podrían considerarse como los mediadores proinflamatorios más importantes en diversos procesos patológicos, incluyendo procesos inflamatorios de origen infeccioso, como la MSC (34, 37, 38). Estas citoquinas se activan a través de la vía del factor nuclear kappa B o de la proteína activadora 1 (AP-1) y, una vez liberadas, pueden autoperpetuar la inflamación al aumentar la expresión de las vías proinflamatorias antes mencionadas (34, 39-41).
En el presente estudio, se observó que las concentraciones de IL-1β en la leche fueron influenciadas significativamente por el factor tratamiento, y en particular, las vacas tratadas con SC o con la mezcla de P-PRP + SC presentaron las concentraciones más bajas de este mediador con respecto al NCG. Por otro lado, también se observó un efecto significativo del rebaño 2 en términos de aumento de las concentraciones de esta citoquina en la leche en comparación con las otras granjas. En este punto, es difícil establecer las causas asociadas a este incremento, pero una posible explicación del mismo podría estar relacionada con factores zootécnicos o higiénicos de los mismos, que podrían ser diferentes en comparación con los otros rebaños lecheros, o con el hecho de que la mayoría de las vacas de la NCG procedían de esta explotación lechera.
En cuanto al TNF-a, se observó que esta citocina solo se vio afectada por el tiempo, hecho que podría indicar un valor bajo para el diagnóstico o pronóstico de MSC en vacas ya que las concentraciones de esta citocina en la leche no se asociaron con la cicatrización de la MCS ni su respuesta al tratamiento. Los resultados actuales contradicen algunos estudios in vitro que han demostrado que esta citocina es clave para inducir la apoptosis de las células infectadas por S. aureus y, por lo tanto, promover la resolución de la infección (34, 42).
En el presente estudio, pudimos observar que las concentraciones de TGF-b1 en la leche se vieron significativamente afectadas por el factor de curación. Las vacas que se curaron de la infección, independientemente del tratamiento utilizado, tenían concentraciones significativamente más altas de este mediador que las vacas que no se curaron. Nuestros resultados son inconsistentes con otros estudios que no han demostrado un papel definitivo de esta citocina en el proceso fisiopatológico de la MSC (22) o que han observado que el aumento de esta citocina podría estar asociado con la exacerbación de la infección por S. aureus (43, 44). Llegados a este punto, y teniendo en cuenta los resultados del presente estudio, es posible pensar que el TGF-b1 podría actuar como una citoquina antiinflamatoria y anabólica que podría ser clave para la resolución de infecciones subclínicas naturales de la glándula mamaria producidas por S. aureus y estreptococos (45).
El ensayo clínico tuvo varias limitaciones. Uno de ellos fue el hecho de que solo se siguió a las vacas durante 22 días. Esta situación limitó la capacidad de conocer la tasa exacta de recurrencia de la infección para cada tratamiento específico. Además, no se realizaron antibiogramas para saber cuántas de las vacas tratadas con SC eran susceptibles a este antibiótico y si la adición de P-PRP podría aumentar la susceptibilidad bacteriana a SC en bacterias previamente resistentes a este antibiótico. Se necesitan más estudios para garantizar el seguimiento a largo plazo de las vacas y documentar la susceptibilidad antimicrobiana de las bacterias que causan la infección en las vacas inscritas.
Conclusión
Los resultados del presente estudio aportan nuevos datos sobre el efecto de la combinación de P-PRP y SC como tratamiento para la MSC bovina, especialmente la causada por estreptococos no agalactiae, donde la mezcla de ambas sustancias produjo una curación en el 90% de los casos tratados. Es importante señalar que el tratamiento fue la única forma de resolver este tipo de infección en las vacas del estudio.
Por otro lado, la MSC inducida por S. aureus sigue siendo un reto terapéutico importante ya que, en general, ninguno de los tratamientos evaluados mostró una respuesta terapéutica efectiva y solo las condiciones inmunológicas específicas de las vacas, es decir, tener recuentos bajos de CCE en leche al inicio del estudio, representan aspectos del sistema inmune innato que facilitan la curación de la CMS inducida por esta bacteria sin necesidad de ningún tratamiento.
Se necesitan más estudios controlados, tanto clínicos como experimentales, para mejorar el P-PRP como tratamiento único o como mezcla de antibióticos para el tratamiento de los SCM producidos por bacterias Gram-positivas.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración de ética
Los estudios con animales fueron aprobados por el Comité Institucional de Experimentación Animal de la Universidad de Caldas, Manizales, Colombia. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
CL: Conceptualización, Curación de datos, Investigación, Metodología, Validación, Redacción – borrador original, Redacción – revisión y edición, Análisis formal. PD-M: Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición, Análisis formal, Validación. AC-M: Conceptualización, Curación de datos, Análisis formal, Adquisición de fondos, Administración de proyectos, Redacción – borrador original, Redacción – revisión y edición, Investigación, Metodología, Supervisión, Validación. JC: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Esta investigación contó con el apoyo financiero del Sistema General de Regalías (SGR), Ministerio de Hacienda, Colombia, y de la Universidad de Caldas, Manizales, Colombia (Subvención No. 00F0336).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Gussmann, M, Steeneveld, W, Kirkeby, C, Hogeveen, H, Farre, M, y Halasa, T. Impacto económico y epidemiológico de diferentes estrategias de intervención para la mastitis subclínica y clínica. Ant: Vet Med. (2019) 166:78–85. doi: 10.1016/j.prevetmed.2019.03.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Guimarães, JLB, Brito, M, Lange, CC, Silva, MR, Ribeiro, JB, Mendonça, LC, et al. Estimación del impacto económico de la mastitis: un estudio de caso en un rebaño lechero Holstein en condiciones tropicales. Ant: Vet Med. (2017) 142:46–50. doi: 10.1016/j.prevetmed.2017.04.011
3. Hommels, NMC, Ferreira, FC, van den Borne, BHP y Hogeveen, H. Uso de antibióticos e impacto económico potencial de la implementación de la terapia selectiva de vacas secas en grandes lecherías de EE. UU. J Dairy Sci. (2021) 104:8931–46. DOI: 10.3168/jds.2020-20016
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Rossi, RS, Amarante, AF, Guerra, ST, Latosinski, GS, Rossi, BF, Rall, VLM, et al. Eficacia del cefquinoma y de una combinación de cloxacilina y ampicilina para el tratamiento de vacas lecheras con mastitis subclínica por Streptococcus agalactiae. PLoS Uno. (2019) 14:e0216091. doi: 10.1371/journal.pone.0216091
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Chen, J, Ying, GG y Deng, WJ. Residuos de antibióticos en los alimentos: extracción, análisis y problemas de salud humana. J Agric Food Chem. (2019) 67:7569–86. doi: 10.1021/acs.jafc.9b01334
6. Lu, G, Chen, Q, Li, Y, Liu, Y, Zhang, Y, Huang, Y, et al. Status of antibiotic residues and detection techniques used in Chinese milk: a systematic review based on cross-sectional surveillance data. Food Res Int. (2021) 147:110450. doi: 10.1016/j.foodres.2021.110450
7. Hassan, MM, El Zowalaty, ME, Lundkvist, Å, Järhult, JD, Khan Nayem, MR, Tanzin, AZ, et al. Residual antimicrobial agents in food originating from animals. Trends Food Sci Technol. (2021) 111:141–50. doi: 10.1016/j.tifs.2021.01.075
8. Krogh, MA, Nielsen, CL, and Sørensen, JT. Antimicrobial use in organic and conventional dairy herds. Animal. (2020) 14:2187–93. doi: 10.1017/S1751731120000920
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Sjöström, K, Hickman, RA, Tepper, V, Olmos Antillón, G, Järhult, JD, Emanuelson, U, et al. Patrones de resistencia a los antimicrobianos en rebaños lecheros orgánicos y convencionales en Suecia. Antibióticos. (2020) 9:1–17.. doi: 10.3390/antibióticos9110834
10. Deb, R, Kumar, A, Chakraborty, S, Verma, AK, Tiwari, R, Dhama, K, et al. Tendencias en el diagnóstico y control de la mastitis bovina: una revisión. Pak J Biol Sci. (2013) 16:1653–61. doi: 10.3923/pjbs.2013.1653.1661
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. McDougall, S, Clausen, LM, Hussein, HM, y Compton, CWR. Tratamiento de la mastitis subclínica durante la lactancia. Antibióticos. (2022) 11:1–13. doi: 10.3390/antibióticos11020209
12. Moroni, P, Pisoni, G, Antonini, M, Villa, R, Boettcher, P y Carli, S. Comunicación breve: susceptibilidad a los medicamentos antimicrobianos de Staphylococcus aureus de la mastitis bovina subclínica en Italia. J Dairy Sci. (2006) 89:2973–6. doi: 10.3168/jds. S0022-0302(06)72569-3
13. Demil, E, Teshome, L, Kerie, Y, Habtamu, A, Kumilachew, W, Andualem, T, et al. Prevalencia de mastitis subclínica, factores de riesgo asociados y susceptibilidad antimicrobiana de los patógenos aislados de muestras de leche de vacas lecheras en el noroeste de Etiopía. Ant: Vet Med. (2022) 205:105680. doi: 10.1016/j.prevetmed.2022.105680
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Carmona, JU, López, C, y Ceballos-Márquez, A. Liberación temporal y desnaturalización de varios mediadores en plasma puro rico en plaquetas y lisados de plaquetas inducidos por temperatura derivados de un concentrado de plaquetas bovinas similar. Vet Med Int. (2022) 2022:1–11. doi: 10.1155/2022/2609508
15. Duque-Madrid, PC, Velasco-Bolaños, J, Ceballos-Márquez, A, López, C, y Carmona, JU. Tratamiento intramamario con plasma alogénico puro rico en plaquetas en vacas con mastitis subclínica causada por bacterias grampositivas. Sci Rep. (2021) 11:23737. doi: 10.1038/s41598-021-03067-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Lange-Consiglio, A, Spelta, C, Garlappi, R, Luini, M, y Cremonesi, F. Administración intramamaria de concentrado de plaquetas como terapia no convencional en la mastitis bovina: primera aplicación clínica. J Dairy Sci. (2014) 97:6223–30. doi: 10.3168/jds.2014-7999
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Hogan, J, González, R, Harmon, R, Nickerson, S, Oliver, S, Pankey, J, et al. (1999). Manual de Laboratorio de Mastitis Bovina 78. Madison, WI: Consejo Nacional de Mastitis, 485–488.
18. Anderson, D, y Burnham, K. Selección de modelos e inferencia de modelos múltiples, vol. 2004. Nueva York, NY: Springer-Verlag (2020). 10 págs.
19. Schukken, YH, Wilson, DJ, Welcome, F, Garrison-Tikofsky, L, y Gonzalez, RN. Monitorización de la salud de la ubre y de la calidad de la leche mediante recuentos de células somáticas. Res. Veterinaria. (2003) 34:579–96. doi: 10.1051/vetres:2003028
20. Sumon, S, Parvin, MS, Ehsan, MA, e Islam, MT. Relación entre los recuentos de células somáticas y la mastitis subclínica en vacas lecheras lactantes. Mundo Veterinario. (2020) 13:1709–13. doi: 10.14202/vetworld.2020.1709-1713
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Fernandes, L, Guimaraes, I, Noyes, NR, Caixeta, LS, y Machado, VS. Efecto de la mastitis subclínica detectada en el primer mes de lactancia sobre las puntuaciones lineales del recuento de células somáticas, la producción de leche, la fertilidad y el sacrificio de vacas lecheras en rebaños orgánicos certificados. J Dairy Sci. (2021) 104:2140–50. doi: 10.3168/jds.2020-19153
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Gulbe, G, Pilmane, M, Saulīte, V, Doniņa, S, Jermolajevs, J, Peškova, L, et al. Células y citocinas en la leche de glándulas mamarias bovinas infectadas subclínicamente después del uso de la composición inmunomoduladora GLP 810. Inflamación media. (2020) 2020:1–12. doi: 10.1155/2020/8238029
23. Slebodziński, AB, Malinowski, E y Lipczak, W. Concentraciones de triyodotironina (T3), factor de necrosis tumoral alfa (TNF-alfa) e interleucina-6 (IL-6) en leche de cuartos de vacas sanos y naturalmente infectados. Res Vet Sci. (2002) 72:17–21. doi: 10.1053/rvsc.2001.0514
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Parmar, MK. Trampas y sesgos en la presentación e interpretación de los resultados de los ensayos clínicos. Cáncer de pulmón. (1994) 10:S143-50. doi: 10.1016/0169-5002(94)91676-4
25. Camargo Garbin, L, López, C, y Carmona, JU. Una visión crítica del uso del plasma rico en plaquetas en medicina equina durante la última década. Veterinario delantero Sci. (2021) 8:641818. doi: 10.3389/fvets.2021.641818
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Lima, LM, Silva, B, Barbosa, G, y Barreiro, EJ. Antibióticos β-lactámicos: una visión general desde la perspectiva de la química medicinal. Eur J Med Chem. (2020) 208:112829. doi: 10.1016/j.ejmech.2020.112829
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Tang, KL, Caffrey, NP, Nóbrega, DB, Cork, SC, Ronksley, PE, Barkema, HW, et al. Restricción del uso de antibióticos en animales productores de alimentos y sus asociaciones con la resistencia a los antibióticos en animales productores de alimentos y seres humanos: una revisión sistemática y metaanálisis. Lancet Planet Health. (2017) 1:E316-27. doi: 10.1016/S2542-5196(17)30141-9
28. López, C, Alvarez, ME, y Carmona, JU. Efecto bacteriostático temporal y pérdida de factor de crecimiento en componentes plaquetarios equinos y plasma cultivados con Staphylococcus aureus sensible y resistente a la meticilina: un estudio comparativo in vitro. Vet Med Int. (2014) 2014:525826. doi: 10.1155/2014/525826
29. Sol, J, Sampimon, OC, Snoep, JJ y Schukken, YH. Factores asociados a la curación bacteriológica tras el tratamiento en vacas secas de la mastitis estafilocócica subclínica con antibióticos. J Dairy Sci. (1994) 77:75–9. doi: 10.3168/jds. S0022-0302(94)76930-7
30. Pinzón-Sánchez, C, y Ruegg, PL. Factores de riesgo asociados con los resultados a corto plazo después del tratamiento de la mastitis clínica. J Dairy Sci. (2011) 94:3397–410. doi: 10.3168/jds.2010-3925
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. De Vliegher, S, Fox, LK, Piepers, S, McDougall, S, y Barkema, HW. Revisión invitada: mastitis en novillas lecheras: naturaleza de la enfermedad, impacto potencial, prevención y control. J Dairy Sci. (2012) 95:1025–40. doi: 10.3168/jds.2010-4074
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Whist, AC, Osterås, O, y Sølverød, L. Asociación entre el aislamiento de Staphylococcus aureus una semana después del parto y la producción de leche, el recuento de células somáticas, la mastitis clínica y el sacrificio durante la lactancia restante. J Lácteos Res. (2009) 76:24–35. doi: 10.1017/S0022029908003592
33. Richardet, M, Solari, HG, Cabrera, VE, Vissio, C, Agüero, D, Bartolomé, JA, et al. Evaluación económica de las estrategias de control de la mastitis en rebaños lecheros Holstein-Friesian. Animales. (2023) 13:1–16. doi: 10.3390/ani13101701
34. Oviedo-Boyso, J, Cardoso-Correa, BI, Cajero-Juárez, M, Bravo-Patiño, A, Valdez-Alarcón, JJ, y Baizabal-Aguirre, VM. La capacidad de las células endoteliales bovinas para eliminar Staphylococcus aureus y Staphylococcus epidermidis intracelulares se ve incrementada por las citocinas proinflamatorias TNF-alfa e IL-1beta. FEMS Immunol Med Microbiol. (2008) 54:53–9. doi: 10.1111/j.1574-695X.2008.00447.x
35. Deluyker, HA, Van Oye, SN, y Boucher, JF. Factores que afectan la curación y el recuento de células somáticas después del tratamiento con pirlimycina de la mastitis subclínica en vacas lactantes. J Dairy Sci. (2005) 88:604–14. doi: 10.3168/jds. S0022-0302(05)72724-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Rosenberg, JB, Love, B, y Patterson, DL. Cura bacteriana y respuesta del recuento de células somáticas de vacas lecheras con una prueba de mastitis de California positiva en el momento del parto a la terapia con cefapirina sódica. Veterinario Ther. (2002) 3:381–6.
37. Sadek, K, Saleh, E y Ayoub, M. Biomarcadores selectivos y confiables de sangre y leche para el diagnóstico clínico y subclínico de la mastitis bovina. Trop Anim Salud Prod. (2017) 49:431–7. doi: 10.1007/s11250-016-1190-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Bhatt, VD, Shah, TM, Nauriyal, DS, Kunjadia, AP y Joshi, CG. Evaluación de un fármaco tópico a base de plantas por su efecto inmunomodulador in vivo sobre la producción de citocinas y la actividad antibacteriana en la mastitis subclínica bovina. Cosméticos AYU. (2014) 35:198–205. doi: 10.4103/0974-8520.146254
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Sundar, V, Vimal, S, Sai Mithlesh, MS, Dutta, A, Tamizhselvi, R y Manickam, V. Quinasas transcripcionales dependientes de ciclinas como mediadores de la inflamación: una revisión. Gen. (2021) 769:145200. doi: 10.1016/j.gene.2020.145200
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Tegeder, I, Niederberger, E, Israr, E, Gühring, H, Brune, K, Euchenhofer, C, et al. Inhibición de la activación de NF-kappaB y AP-1 por R-y S-flurbiprofeno. FASEB J. (2001) 15:2–4. doi: 10.1096/fasebj.15.1.2
41. Oviedo-Boyso, J, Barriga-Rivera, JG, Valdez-Alarcón, JJ, Bravo-Patiño, A, Cárabez-Trejo, A, Cajero-Juárez, M, et al. La internalización de Staphylococcus aureus por células endoteliales bovinas se asocia con el estado de actividad de NF-kappaB y modulada por las citocinas proinflamatorias TNF-alfa e IL-1beta. Scand J Immunol. (2008) 67:169–76. doi: 10.1111/j.1365-3083.2007.02056.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Park, WB, Lee, JH, Jeon, JH, Lee, SJ, Kim, SH, Kim, NJ, et al. Efecto del factor de necrosis tumoral alfa sobre el Staphylococcus aureus intracelular en células endoteliales vasculares. FEMS Immunol Med Microbiol. (2008) 52:247–52. doi: 10.1111/j.1574-695X.2007.00365.x
43. Zhao, S, Gao, Y, Xia, X, Che, Y, Wang, Y, Liu, H, et al. TGF-β1 promueve la adhesión e invasión de Staphylococcus aureus a los fibroblastos mamarios bovinos a través de la vía ERK. Microb Pathog. (2017) 106:25–9. doi: 10.1016/j.micpath.2017.01.044
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Kim, Y, Atalla, H, Mallard, B, Robert, C y Karrow, N. Cambios en la leche de vaca Holstein y las proteínas séricas durante la infección intramamaria con tres cepas diferentes de Staphylococcus aureus. BMC Vet Res. (2011) 7:51. doi: 10.1186/1746-6148-7-51
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Bannerman, DD, Paape, MJ y Chockalingam, A. La infección intramamaria por Staphylococcus aureus provoca un aumento de la producción de factor de crecimiento transformante alfa, beta1 y beta2. Veterinario Immunol Immunopathol. (2006) 112:309–15. doi: 10.1016/j.vetimm.2006.03.018
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: plasma rico en plaquetas, bovino, mastitis subclínica, bacterias grampositivas, factores de crecimiento, citocinas
Cita: López C, Duque-Madrid PC, Ceballos-Márquez A y Carmona JU (2024) Efecto del plasma alogénico puro rico en plaquetas, cloxacilina sódica y su combinación para el tratamiento de la mastitis subclínica en vacas cruzadas. Frente. Vet. Sci. 11:1432354. doi: 10.3389/fvets.2024.1432354
Recibido: 13 de mayo de 2024; Aceptado: 05 de agosto de 2024;
Publicado: 22 de agosto de 2024.
Editado por:
Eleonora Iacono, Universidad de Bolonia, Italia
Revisado por:
Neelesh Sharma, Universidad Sher-e-Kashmir de Ciencias y Tecnología Agrícolas de Jammu, India
Chen Chen, Universidad de Zhejiang, China
Elena Franco Robles, Universidad de Guanajuato, México
Copyright © 2024 López, Duque-Madrid, Ceballos-Márquez y Carmona. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Jorge U. Carmona, carmona@ucaldas.edu.co
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

