Efecto del zinc en el almacenamiento de líquido de esperma de verraco

Efecto del zinc en el almacenamiento de líquido de esperma de verraco
Por patricia marini1,2, Luciana Fernandez Beato1, fernando caña3 y Juan Manuel Teijeiro1,4 *
- 1 Laboratorio de Medicina Reproductiva, Facultad de Ciencias Bioquímicas y Farmacéuticas, Universidad Nacional de Rosario, Rosario, Argentina
- 2 Consejo de Investigaciones de la Universidad Nacional de Rosario (CIUNR), IBR-CONICET, Rosario, Argentina
- 3 Médax, Santa Fe, Argentina
- 4 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Chañar Ladeado, Argentina
El almacenamiento y transporte de semen líquido de verraco para inseminación artificial (IA) requiere la adición de soluciones denominadas diluyentes, que aumentan el volumen del eyaculado y ayudan a preservar sus características funcionales. Sin embargo, la calidad del esperma disminuye con el tiempo principalmente debido a la mayor producción de especies reactivas de oxígeno (ROS) que dañan la membrana plasmática. Muchos diluyentes comerciales se complementan con aditivos que mitigan este efecto. En el semen, el zinc se suministra en alta concentración en el plasma seminal y ayuda a proteger la membrana plasmática de los espermatozoides. Sin embargo, el zinc en el plasma seminal se diluye y se quela con la adición de diluyentes para el almacenamiento, lo que reduce potencialmente su efecto antioxidante. Aquí caracterizamos la viabilidad, la motilidad, la actividad mitocondrial,2 , a intervalos después de la dilución durante 3 días. También se probó la capacidad de los espermatozoides suplementados con ZnCl2 2 mM para fertilizar ovocitos in vivo . La viabilidad de los espermatozoides fue superior al 82% para todos los tratamientos. El análisis de la integridad mitocondrial, medida por la actividad del citocromo c, indicó un efecto protector de Zn, que se observó como un número reducido de espermatozoides con una gran pérdida de actividad mitocondrial. La integridad acrosómica mejoró mediante el tratamiento con todas las concentraciones de ZnCl2 ensayadas . La cinemática espermática se vio afectada por el tratamiento con ZnCl 2 , mostrando mayor porcentaje de espermatozoides progresivos y rápidos en dosis suplementadas con ZnCl 2 2mM . Los niveles de ROS y la integridad de la cromatina no mostraron diferencias entre ZnCl2 -dosis suplementadas y el control. La tasa de fecundación, el número total, los lechones vivos, mortinatos y momificados no cambiaron cuando los espermatozoides se diluyeron con diluyente que contenía ZnCl2 2 mM . La caracterización presentada indica que la adición de Zn al extensor de Sus tiene un efecto protector sobre la vaina mitocondrial y las membranas acrosomales; y proporciona la base para futuros estudios destinados a optimizar el rendimiento de los espermatozoides en la IA.
1. Introducción
La inseminación artificial (IA) en la reproducción moderna de cerdos requiere semen extendido almacenado en líquido. Los diluyentes proporcionan a los espermatozoides nutrientes para mantener los procesos metabólicos ( 1 ), prevenir el choque por frío ( 2 ), controlar la presión osmótica y el pH ( 3 ) y los antibióticos presentes en el diluyente inhiben el crecimiento bacteriano ( 4 ). A pesar de las mejoras sustanciales realizadas en las formulaciones de diluyentes en los últimos años, la calidad del esperma almacenado disminuye con el tiempo principalmente debido a la mayor producción de especies reactivas de oxígeno (ROS) durante la conservación ( 5 ). Tales especies oxidativas dañan la membrana plasmática de los espermatozoides al reaccionar con los ácidos grasos poliinsaturados altamente abundantes en la membrana ( 6), con la consiguiente inhibición de la respiración y fuga de enzimas celulares ( 7 ). Debido a que la integridad de la membrana plasmática es esencial para la interacción de los espermatozoides con el epitelio del oviducto ( 8 ) y para la fusión con el ovocito, es fundamental explorar vías para prevenir los efectos perjudiciales de las ERO en los espermatozoides almacenados.
En los eyaculados, los antioxidantes naturales son proporcionados por el plasma seminal, el cual está compuesto por las secreciones exocrinas de los testículos, el epidídimo y las glándulas sexuales accesorias masculinas ( 9 ). El plasma seminal es particularmente rico en zinc ( 10 ). En el esperma, el zinc realiza numerosas funciones, incluida la regulación de la capacitación ( 11 ) y la regulación de las interacciones espermatozoide-oviducto y espermatozoide-zona pelúcida ( 12 ). La concentración de zinc también es particularmente alta en las membranas de los espermatozoides ( 13 ), y su eliminación por albúmina, histidina o EDTA provoca defectos de membrana ( 14). Una gran cantidad de evidencia indica que el zinc ayuda a mantener las membranas biológicas funcionales al interactuar con enzimas que controlan su integridad ( 15 ). Además, se ha demostrado que el zinc interactúa con los complejos de proteínas en las membranas, cambiando su conformación o su especificidad de sustrato, disminuyendo la peroxidación lipídica catalizada por metales ( 16 ). El zinc también es un eliminador eficaz de los aniones superóxido producidos por los espermatozoides dañados en los eyaculados humanos ( 17 ), y se ha postulado que la alta concentración de zinc presente en el plasma seminal protege a los espermatozoides de los efectos perjudiciales de los aniones superóxido ( 18). De acuerdo con los hallazgos mencionados anteriormente, en humanos, la adición de zinc (como sulfato de zinc) a los eyaculados antes de la crioconservación previene el daño del ADN inducido por la congelación y descongelación y ayuda a preservar el esperma funcional ( 19 ). Esto permite especular que la adición de zinc (como sal) tendría beneficios para la conservación del esperma en otras especies. En verracos, las dosis seminales líquidas se preparan después de la recolección de la fracción rica en espermatozoides del eyaculado por dilución en diluyente y, por lo tanto, se diluyen los componentes del plasma seminal, incluido el zinc. Además, la mayoría de los diluyentes contienen EDTA ( 3 ) que reduce aún más el zinc del esperma ( 20). Aunque el plasma seminal contiene muchos constituyentes que son cruciales para la fisiología del esperma, debido a las funciones propuestas del zinc como un potente antioxidante, planteamos la hipótesis de que complementar el diluyente con zinc podría mejorar la calidad del esperma tras la conservación del líquido al reducir el efecto de las moléculas oxidativas y estabilizar la membrana plasmática. Para probar esta hipótesis, caracterizamos ampliamente los efectos específicos del zinc agregado al diluyente (sin otras variables que interfieran) sobre la viabilidad, motilidad, actividad mitocondrial, integridad del ADN y ROS del semen de verraco almacenado y sus parámetros reproductivos en la IA.
2. Materiales y métodos
2.1. animales
Los verracos utilizados en este estudio fueron Sire Line PIC 337 y 415 (PIC ® , Pig Improvement Company, Pasig City, Filipinas), Large White (La Botica Genética Porcina SA, Buenos Aires, Argentina); Pietrain (Cooperativa Marcos Juárez, Córdoba, Argentina); y Landrance (Topigs Norsvin, Buenos Aires, Argentina). Se utilizaron un total de 250 dosis seminales de 13 verracos (consulte la Tabla complementaria 1 para ver la distribución de las dosis seminales utilizadas). Para la IA se utilizaron 250 cerdas Large White/Landrace, con paridad promedio de 2.1. No se incluyeron cerdas nulíparas. La aprobación ética de la investigación con animales fue otorgada por el Comité Institucional para el Cuidado y Uso de Animales de Laboratorio (CICUAL-FCByF), Universidad Nacional de Rosario (Expediente N° 6060/316).
2.2. Diseño experimental
Las muestras de semen fueron recolectadas de verracos adultos fértiles por el método mano-guante por la empresa productora de dosis seminales Medax (Chañar Ladeado, Santa Fe, Argentina). La frecuencia de recolección fue cada 7-10 días por verraco. Todas las muestras se ajustaron a los parámetros seminales normales para cerdos, como motilidad > 80 % (por CASA, consulte la descripción completa en la siguiente sección), esperma total en el eyaculado determinado por dilución y conteo en cámara de Neubauer > 20 × 10 9 , y defectos morfológicos [por tinción de Wells-Awa ( 21 )] < 15%. Las fracciones ricas en esperma de los eyaculados se diluyeron de 20 a 30 veces para alcanzar una concentración de 3 × 10 7esperma/ml en extensor Sus: compuesto por sustrato energético monosacárido, sales iónicas, tris (hidroximetil) etano, antibiótico de amplio espectro y sal disódica EDTA al 4 % (registro CAS 6381-92-6) (Medi Nova, Reggio Emilia, Italia) , luego se complementaron alícuotas de cada dosis seminal con 0 (control), 0,5, 1, 2 y 3 mM de ZnCl 2 (Merck KGaA, Darmstadt, Alemania) y se conservaron a 16 °C hasta su uso (hasta 3 días). Para los análisis in vitro , las dosis se dividieron en cinco alícuotas y se suplementaron con ZnCl 2 en las concentraciones mencionadas y se tomaron muestras de estas alícuotas para su análisis cada 24 h durante 3 días. Se probaron ocho dosis individuales de ocho verracos individuales para análisis in vitro .
Considerando que el valor medio reportado de concentración de zinc en plasma seminal de verracos es de 1927,5 μg/dL (2,96 mM de Zn + 2 ) ( 22 ); usamos las siguientes concentraciones finales: 0.5, 1, 2 y 3 mM de ZnCl 2 para diluyentes. Las dosis se mantuvieron a 16°C tras la dilución y se tomaron muestras para análisis cada 24 h durante 3 días.
2.3. Viabilidad del esperma, integridad del acrosoma y motilidad.
La viabilidad ( n = 8, ocho dosis seminales individuales de ocho verracos diferentes) se midió mediante la prueba de exclusión de eosina ( 23 ). Brevemente, se mezclaron 5 μl de suspensión de esperma con 5 μl de solución de eosina-nigrosina y se untaron en un portaobjetos.
La integridad del acrosoma ( n = 8, ocho dosis seminales individuales de ocho verracos diferentes) se evaluó mediante tinción de Wells-Awa de acuerdo con caracterizaciones de alteraciones del acrosoma en trabajos anteriores ( 24 ). Los espermatozoides se observaron con un aumento de 100x mediante microscopía de campo claro. Se consideró que los espermatozoides con acrosoma intacto eran aquellos que tenían una región azul verdosa engrosada en el ápice de la cabeza, una capa azul verdosa que cubría los dos tercios anteriores de la cabeza y un color rosado en el tercio posterior de la cabeza. También se observaron gotitas citoplasmáticas y morfología de flagelos. Para los análisis de viabilidad, defectos morfológicos e integridad del acrosoma se contaron al menos 200 espermatozoides.
Las trayectorias de los espermatozoides se examinaron utilizando el sistema de análisis de semen asistido por computadora (CASA) (IVOS I Sperm Analyzer, Hamilton Thorne) ( n = 8, ocho dosis seminales individuales de ocho verracos diferentes). Se colocaron alícuotas de 8 μl de dosis seminales que contenían 3 × 10 7 espermatozoides/ml entre portaobjetos y cubreobjetos de 18 × 18 mm. Como se esperan variaciones usando portaobjetos y cubreobjetos en lugar de cámaras comerciales, comparamos el sistema Hamilton Thorne y el Proiser usando la cámara ISAS® D4C20 ( Tabla complementaria 2). No se encontraron diferencias entre los dos métodos. Se adquirieron treinta fotogramas a 60 Hz. La configuración del software para el IVOS I fue: contraste mínimo 18, tamaño de celda mínimo (pix) 7, tamaño de celda (pix) 9, intensidad de celda 125, celdas estáticas lentas con corte de velocidad de trayectoria promedio (VAP) (lm/s ) 20, y corte de velocidad en línea recta (VSL) (lm/s) 5, puertas de intensidad estática mínima 0,5, puertas de intensidad estática máxima 2,5, puertas de tamaño estático mínimo 0,65, puertas de tamaño estático máximo 2,6, puertas de elongación mínima 20 y puertas de alargamiento máximo 85 según Vyt et al. ( 25). Se midieron los siguientes parámetros de la motilidad de los espermatozoides: velocidad de trayectoria media (VAP, μm/s), velocidad curvilínea (VCL, μm/s), velocidad en línea recta (VSL, μm/s), linealidad (LIN, %), amplitud de desplazamiento lateral de la cabeza (ALH, μm) y rectitud (STR, %). Esperma con velocidades < 15 μm/s. se consideraron lentos, entre 16 y 35 μm/s se entendieron como espermatozoides de velocidad media y aquellos con una velocidad >35 μm/s se consideraron espermatozoides rápidos.
2.4. Mitocondrias e integridad del ADN
Las mitocondrias y la integridad del ADN se evaluaron simultáneamente en las mismas muestras ( n = 8, 8 dosis seminales individuales de 8 verracos diferentes) mediante el análisis de la actividad de la citocromo oxidasa C ( 26 ) y la dispersión de la cromatina espermática ( 27 ), respectivamente. Brevemente, 100 μl de dosis seminales que contienen 3 × 10 6los espermatozoides se incubaron durante 30 min a 37°C con 100 μl de solución diluyente que contenía 100 μg de 3,3′-diaminobencidina (DAB, D-5637 Sigma, Buenos Aires, Argentina). Después de la incubación, se mezclaron 30 μl de suspensión con 70 μl de agarosa de bajo punto de fusión al 1 % precalentada a 37 °C. Se pipetearon quince microlitros de suspensión en portaobjetos recubiertos previamente con agarosa al 0,65 %, enfriado previamente a 4 °C, y se taparon. La preparación se incubó durante 8 min a 4°C, se retiraron los cubreobjetos y los espermatozoides se incubaron durante 8 min con solución de lisis ácida (HCl 0,084 N) a 22°C. Después de lavar la solución de lisis ácida, las muestras se incubaron durante 25 min con solución de lisis (Tris-HCl 0,4 M, pH 7,5, NaCl 2 M, SDS al 1 %, EDTA 0,05 M, β-mercaptoetanol al 5 %) a 22 °C. Los portaobjetos se lavaron durante 5 min, se deshidrataron en baños secuenciales de etanol al 70, 90 y 100 %. y se tiñeron con solución de Wright durante 15 min con agitación suave. Las muestras se observaron utilizando un microscopio Olympus BX40 (Japón) con un aumento de 400x. Para la evaluación de la integridad de las mitocondrias, los espermatozoides se clasificaron según Fariello et al. (28 ) de la siguiente manera: patrón I (100 % de la pieza intermedia teñida), patrón II (>50 % de la pieza intermedia teñida), patrón III (<50 % de la pieza intermedia teñida) y patrón IV (sin tinción de la pieza intermedia) ( Figura complementaria 1A). Según esta clasificación, los espermatozoides con patrón I mantuvieron actividad mitocondrial completa; con el patrón II, pierde algo de actividad mitocondrial sin afectar la motilidad celular y la capacidad de fertilización; con patrón III, presentó pérdida extensa de actividad mitocondrial; y con el patrón IV estaban muertos o tenían una producción de energía mínima. Para probar la fragmentación del ADN, observamos los halos de difusión de 200 espermatozoides teñidos con Wright. Las células con halos de difusión grandes, medianos o pequeños correspondían a núcleos espermáticos que contenían ADN fragmentado. Los núcleos espermáticos sin fragmentación del ADN no mostraron halos. Como control del daño en el ADN, incubamos alícuotas de esperma durante 1, 2 y 3 días con 300 μM de H 2 O 2 , pero no observamos los efectos descritos para el esperma humano (29 ). En cambio, tuvimos que almacenar esperma a -80 ° C para producir daño en el ADN ( Figura complementaria 1B ). Se contaron al menos 200 espermatozoides individuales.
2.5. determinación de ROS
La determinación de ROS se realizó de acuerdo con Benjamin et al. ( 30 ) ( n = 8, ocho dosis seminales individuales de ocho verracos diferentes). Este método midió una variedad de ROS intra y extracelulares, incluyendoO• −2O2•-, H 2 O 2 y OH • . Los resultados se expresaron como unidades relativas de luz (URL) por 1,2 × 10 6 espermatozoides. Se usaron células suplementadas con H 2 O 2 como control positivo para el daño oxidativo.
2.6. Inseminación artificial
La inseminación artificial se realizó como se informó previamente ( 31) en una finca local ubicada en Monte Maíz, Córdoba, Argentina (coordenadas GPS: −33.206561, −62.600330). Para tener una aproximación más allá de las condiciones de laboratorio y no sesgar las observaciones, configuramos las condiciones de trabajo con las menores modificaciones posibles a las operaciones diarias de la finca. Por lo tanto, en nuestro trabajo tratamos de explorar el efecto del zinc en un contexto consuetudinario en lugar de condiciones de laboratorio. Las IA se realizaron al día 3 de almacenamiento para tener información de los exámenes de laboratorio. Por lo tanto, la viabilidad, la integridad acrosomal y la motilidad se evaluaron antes de la IA. Como ninguno de estos parámetros estaba comprometido, se llevó a cabo la IA. El personal que realizó la IA desconocía las dosis seminales con zinc agregado. La lactancia en la granja es de 21 días de duración. El juicio se llevó a cabo entre el 15 de noviembre y el 20 de julio de 2017. Brevemente, el estro se controló diariamente en presencia de un verraco maduro. La ocurrencia del estro se definió por el reflejo de estar de pie frente a un verraco y la prueba de presión en la espalda. Las inseminaciones se realizaron mediante catéteres en espiral (Magapor® , Zaragoza, España) y se depositaron 3 × 10 9 espermatozoides en dosis de 100 mL en el cuello uterino de la cerda. Todas las cerdas fueron inseminadas en celo permanente en presencia de un verraco. Ochenta y seis cerdas elegidas al azar fueron asignadas para ser inseminadas con dosis suplementadas con ZnCl 2 2 mM y 164 fueron inseminadas con dosis no tratadas como control. Se utilizaron dosis seminales de 13 verracos. Cada eyaculado individual se dividió en partes; una parte se diluyó con diluyente suplementado con ZnCl 2 2 mM y la otra con diluyente sin suplementar, y ambos se usaron para la IA. La distribución de eyaculados por verraco utilizados en la IA se presenta en la Tabla complementaria 1 .
Se observó un efecto protector sobre la integridad de las mitocondrias y un mayor porcentaje de espermatozoides progresivos y rápidos en dosis suplementadas con ZnCl 2 2 mM . Asimismo, el porcentaje de rectitud y linealidad fue mayor en las dosis suplementadas con ZnCl2 2 mM al tercer día de almacenamiento. Considerando que los parámetros cinemáticos mencionados son un factor clave para la IA, realizamos la IA con dosis seminales suplementadas con ZnCl 2 2 mM .
2.7. Análisis estadístico
Para viabilidad, motilidad, acrosoma e integridad del ADN, y niveles de ROS, los datos se analizaron para normalidad mediante la prueba de Shapiro-Wilks ( 32) y la prueba de Bartlett para homogeneidad de varianzas. Luego, se aplicó el análisis de varianza de una vía (ANOVA) para datos normalmente distribuidos. Cuando los resultados de la prueba F fueron significativos en ANOVA, las medias individuales se probaron más mediante la prueba de rango múltiple de Tukey. Se aplicó la prueba de Kruskal-Wallis para datos sin distribución normal. La evaluación de los parámetros espermáticos se realizó utilizando ocho réplicas biológicas. Los datos de motilidad progresiva, VAP, VSL, VCL, ALH, BFC, STR e integridad del acrosoma no mostraron una distribución normal. Los datos sobre la integridad de las mitocondrias se analizaron mediante modelos mixtos lineales generalizados que contemplan la interacción entre los días y el tratamiento. A cada variable se le ajustó un modelo lineal general mixto para datos longitudinales considerando efecto fijo para tiempo y tratamiento, y efecto aleatorio para verracos. Mediante análisis de residuos del modelo y prueba de Bondad de Ajuste por criterio de información bayesiano (BIC) y criterio de información de Akaike (AIC), se determinó la variabilidad intra e interindividual. No hubo interacción entre el tiempo y el tratamiento. Además, se consideró la heterogeneidad de la varianza. Para la prueba de IA, la tasa de parto se analizó mediante un modelo de regresión logística y los datos sobre el número de lechones mediante una regresión de Poisson. Se aplicó el modelo estadístico que incluye el factor verraco y las correcciones realizadas por distribución desigual de dosis seminales. Se incluyó un efecto aleatorio para el verraco para dar cuenta de la variabilidad y correlación producida por el uso de diferentes donantes. Se determinó la variabilidad intra e interindividual. No hubo interacción entre el tiempo y el tratamiento. Además, se consideró la heterogeneidad de la varianza. Para la prueba de IA, la tasa de parto se analizó mediante un modelo de regresión logística y los datos sobre el número de lechones mediante una regresión de Poisson. Se aplicó el modelo estadístico que incluye el factor verraco y las correcciones realizadas por distribución desigual de dosis seminales. Se incluyó un efecto aleatorio para el verraco para dar cuenta de la variabilidad y correlación producida por el uso de diferentes donantes. Se determinó la variabilidad intra e interindividual. No hubo interacción entre el tiempo y el tratamiento. Además, se consideró la heterogeneidad de la varianza. Para la prueba de IA, la tasa de parto se analizó mediante un modelo de regresión logística y los datos sobre el número de lechones mediante una regresión de Poisson. Se aplicó el modelo estadístico que incluye el factor verraco y las correcciones realizadas por distribución desigual de dosis seminales. Se incluyó un efecto aleatorio para el verraco para dar cuenta de la variabilidad y correlación producida por el uso de diferentes donantes. Se aplicó el modelo estadístico que incluye el factor verraco y las correcciones realizadas por distribución desigual de dosis seminales. Se incluyó un efecto aleatorio para el verraco para dar cuenta de la variabilidad y correlación producida por el uso de diferentes donantes. Se aplicó el modelo estadístico que incluye el factor verraco y las correcciones realizadas por distribución desigual de dosis seminales. Se incluyó un efecto aleatorio para el verraco para dar cuenta de la variabilidad y correlación producida por el uso de diferentes donantes.
3. Resultados
3.1. La adición de ZnCl 2 al diluyente afecta la integridad acrosomal y la motilidad de los espermatozoides durante el almacenamiento
La adición de ZnCl 2 al diluyente no afectó la viabilidad celular en función de la integridad de la membrana, independientemente de la concentración de zinc o el tiempo transcurrido después de la dilución ( Figura 1 ). Sin embargo, todas las dosis suplementadas con ZnCl 2 mostraron un mayor porcentaje de espermatozoides con acrosomas inalterados en comparación con el control sin zinc añadido ( Figura 2 ).
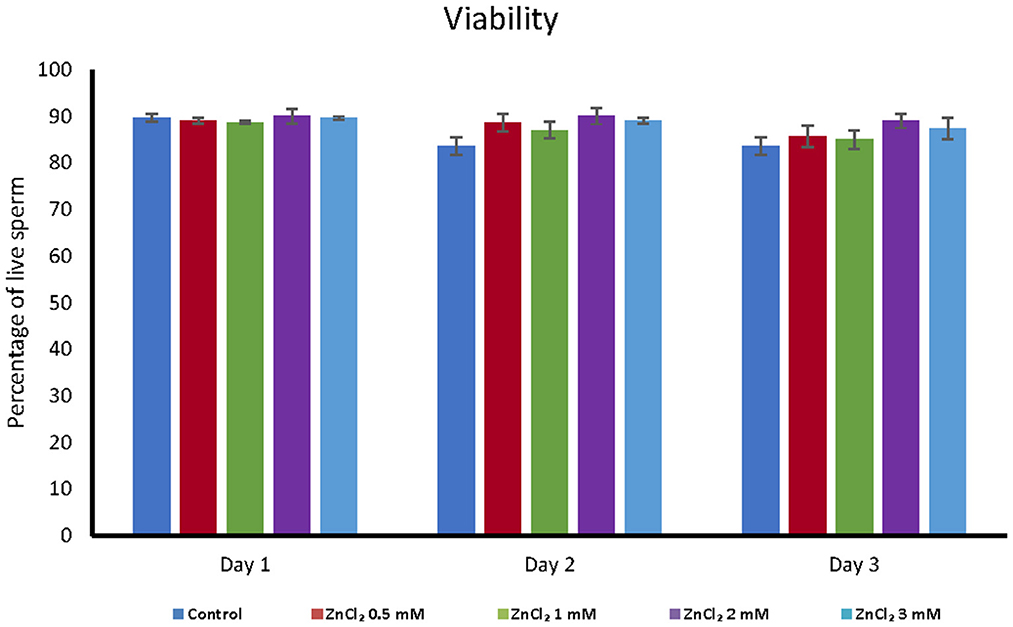 Figura 1 . Análisis de viabilidad. La viabilidad se analizó mediante la prueba de exclusión de eosina en dosis seminales suplementadas con las cantidades indicadas de ZnCl 2 durante 1, 2 y 3 días. Los resultados se expresan como porcentaje medio de espermatozoides vivos ± error estándar ( n = 8).
Figura 1 . Análisis de viabilidad. La viabilidad se analizó mediante la prueba de exclusión de eosina en dosis seminales suplementadas con las cantidades indicadas de ZnCl 2 durante 1, 2 y 3 días. Los resultados se expresan como porcentaje medio de espermatozoides vivos ± error estándar ( n = 8).
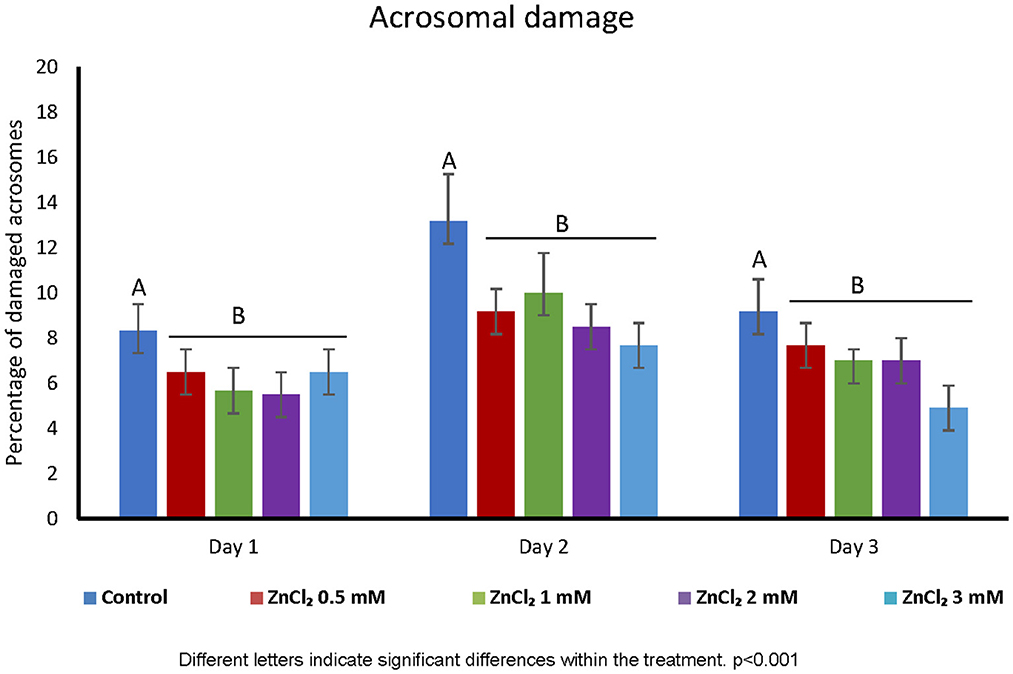 Figura 2 . Integridad del acrosoma. Porcentaje de acrosomas dañados en espermatozoides diluidos con diluyente que contiene ZnCl 2 . La integridad acrosomal se evaluó mediante la técnica de Wells-Awa en dosis seminales suplementadas con las cantidades indicadas de ZnCl 2 durante 1, 2 y 3 días. Las letras indican diferencias significativas entre tratamientos. p < 0,001; ( n = 8).
Figura 2 . Integridad del acrosoma. Porcentaje de acrosomas dañados en espermatozoides diluidos con diluyente que contiene ZnCl 2 . La integridad acrosomal se evaluó mediante la técnica de Wells-Awa en dosis seminales suplementadas con las cantidades indicadas de ZnCl 2 durante 1, 2 y 3 días. Las letras indican diferencias significativas entre tratamientos. p < 0,001; ( n = 8).
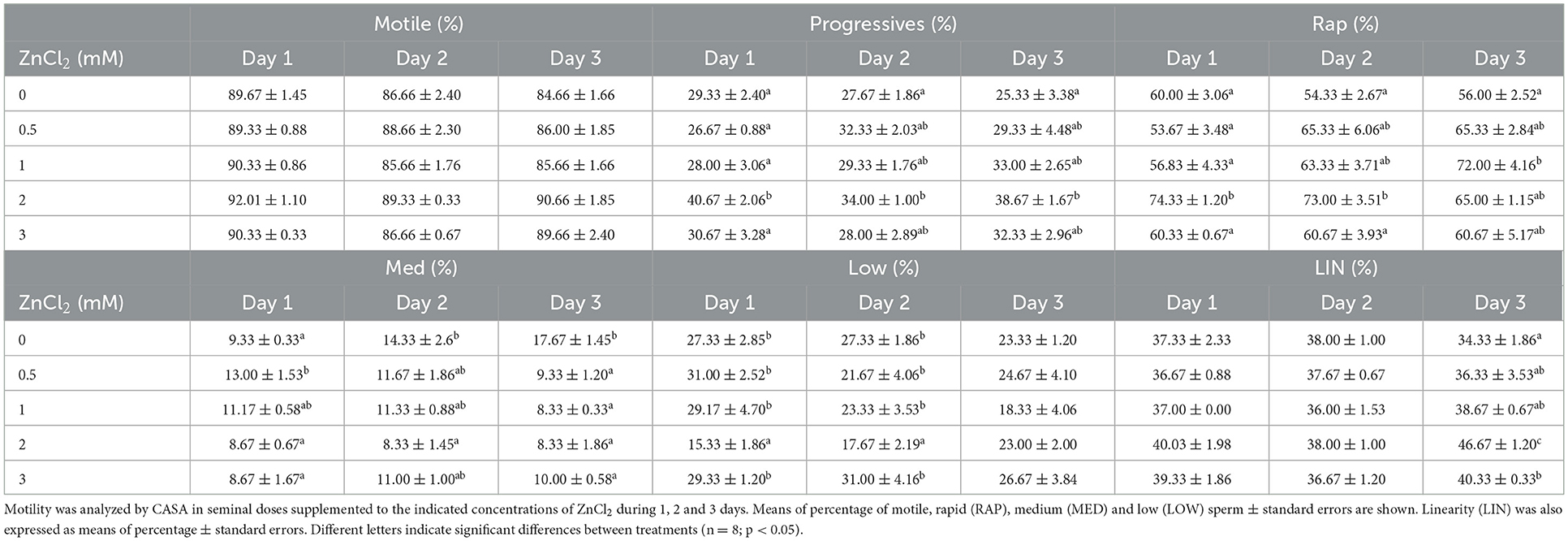
La Tabla 1 muestra la cuantificación de la motilidad de los espermatozoides medida mediante el examen de las trayectorias de las células individuales. Los espermatozoides con velocidades lentas y medias mostraron diferencias significativas entre tratamientos y diferentes parámetros cinemáticos que cambiaron a lo largo de los días en respuesta al ZnCl 2 agregado . Sin embargo, el porcentaje de espermatozoides progresivos y rápidos en las muestras se conservó principalmente en el tiempo en dosis suplementadas con ZnCl 2 2 mM , excepto el día 3 cuando se observó un mayor porcentaje de espermatozoides rápidos en dosis suplementadas con ZnCl 2 1 mM .
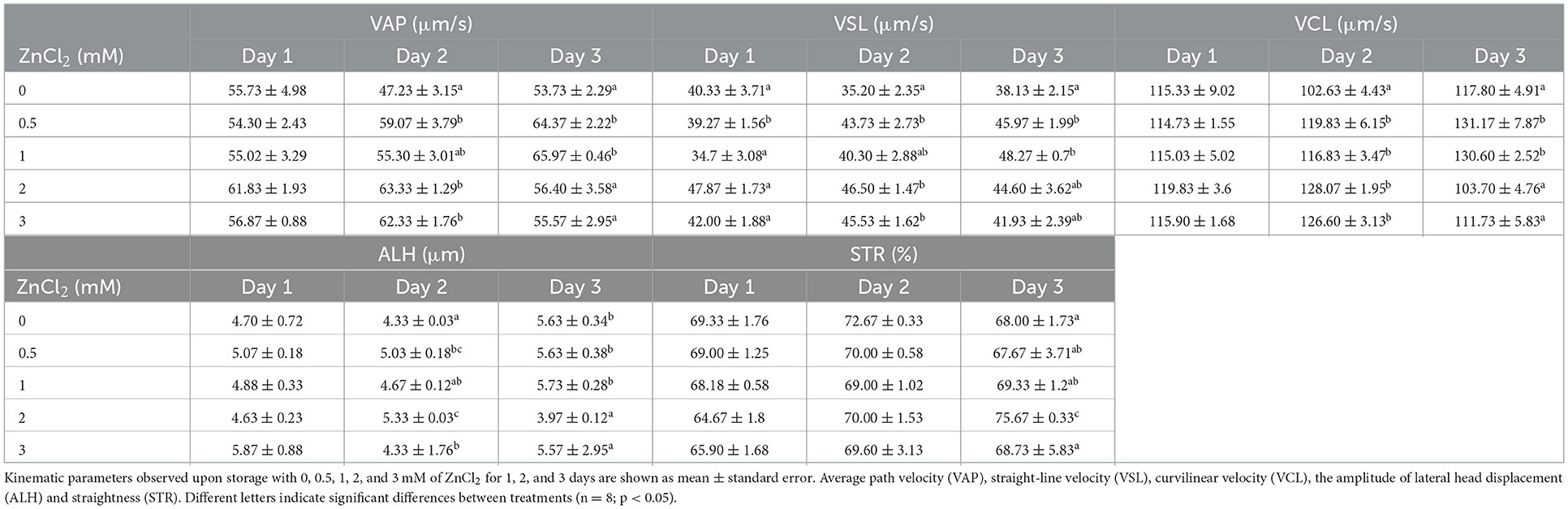
Si bien el porcentaje de espermatozoides móviles no mostró diferencias significativas entre tratamientos, VAP, VCL, VSL, LIN, ALH y STR cambiaron después del día 1 ( Tabla 2 ). Para el día 2, VAP, VSL y ALH mostraron los valores más altos, mientras que BCF mostró los valores más bajos en las dosis suplementadas con 2 y 3 mM de ZnCl 2 . En este momento, VCL fue mayor en los tratamientos en todas las concentraciones de ZnCl 2 . Para el día 3, VAP, VSL, VCL, mostraron los valores más altos a 0.5 y 1 mM de ZnCl 2 , y ALH no mostró diferencias con el control. Las muestras suplementadas con zinc mostraron los valores más altos de LIN a 2 mM de ZnCl 2 y el valor más bajo de BCF en el día 3. Estos resultados indican que la adición de ZnCl 2al extensor afecta los parámetros cinéticos de los espermatozoides.
3.2. El zinc agregado protege las mitocondrias en los espermatozoides almacenados
La Figura 3 muestra el porcentaje de espermatozoides que muestran diferentes patrones de tinción de la pieza intermedia (I a IV), desde 100 % de tinción (actividad mitocondrial completa) hasta ninguna tinción (células muertas o células sin actividad mitocondrial) ( Figura complementaria 1A ). Se observó una disminución en el número de células que mostraban el patrón I y II en todos los tiempos analizados después de la dilución, con un aumento asociado de células con el patrón III. Pero el aumento de espermatozoides que muestran el patrón III (células que presentan una gran pérdida de actividad mitocondrial) en el control fue significativamente mayor que el de las muestras que contenían ZnCl 2 añadido (en todas las concentraciones). Se observó un efecto de interacción entre el día y el tratamiento para el patrón III ( p= 0,0149). El número de células que mostraban el patrón IV no se vio afectado ni por el tiempo ni por el tratamiento.
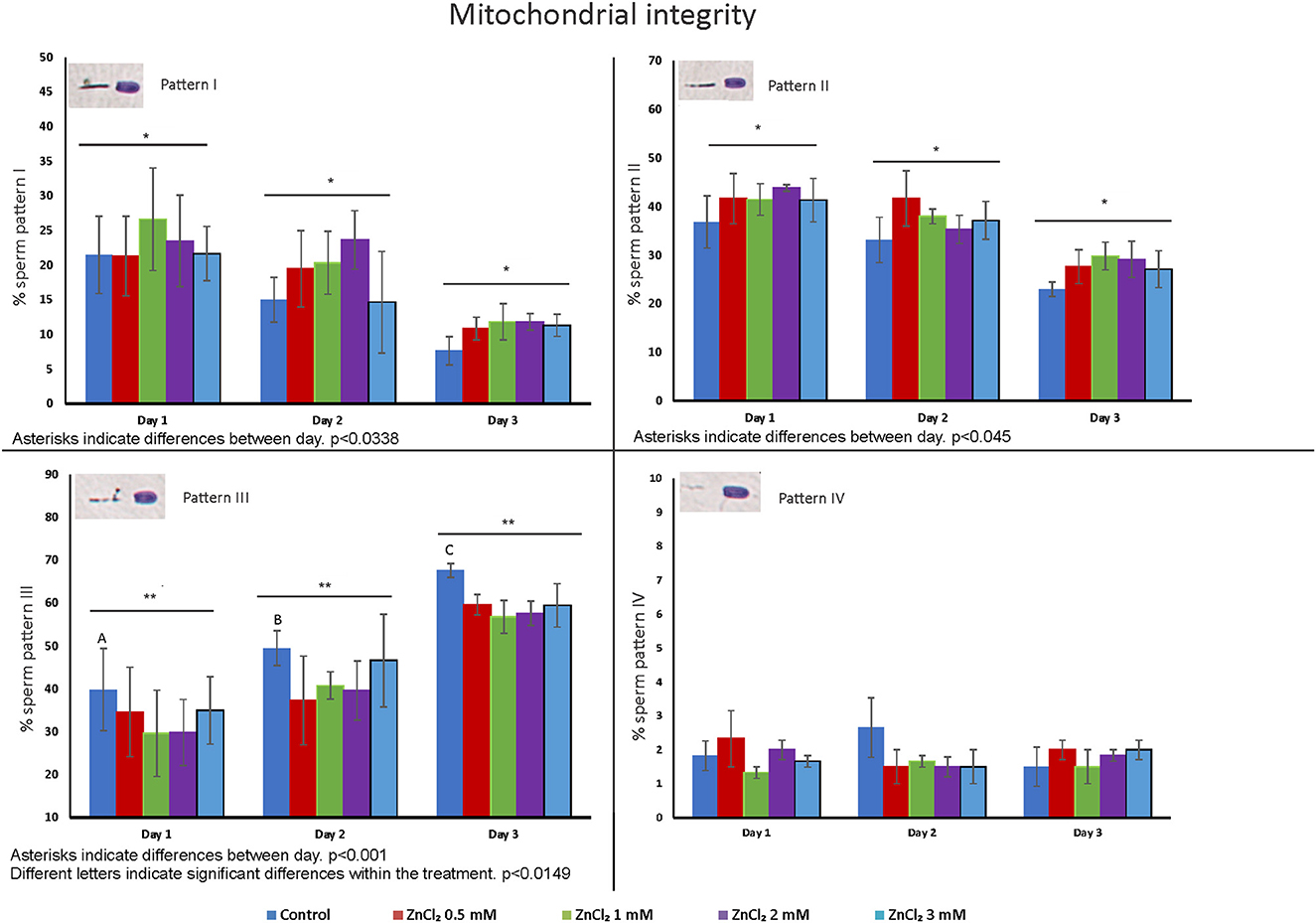 Figura 3 . Distribución de células con patrones de tinción que informan sobre la actividad mitocondrial. Las dosis seminales se complementaron con ZnCl 2 y se almacenaron durante 1, 2 y 3 días. Los gráficos muestran las medias de porcentaje de cada patrón de tinción de la pieza intermedia en función de la actividad de la citocromo c oxidasa ± error estándar. Los asteriscos muestran diferencias significativas entre días ( p = 0.038, p = 0.045 y p = 0.001 para patrón I, II y III respectivamente) y las letras muestran diferencias significativas entre tratamientos ( p = 0.0149) ( n= 8). Las células que muestran el Patrón I mantienen una actividad mitocondrial completa. Las células que muestran el Patrón II tienen mitocondrias sin un deterioro grave de la motilidad y la capacidad de fertilización. Los espermatozoides con el Patrón III tienen una pérdida significativa de actividad mitocondrial y las células con el Patrón IV están muertas o tienen una producción de energía mínima.
Figura 3 . Distribución de células con patrones de tinción que informan sobre la actividad mitocondrial. Las dosis seminales se complementaron con ZnCl 2 y se almacenaron durante 1, 2 y 3 días. Los gráficos muestran las medias de porcentaje de cada patrón de tinción de la pieza intermedia en función de la actividad de la citocromo c oxidasa ± error estándar. Los asteriscos muestran diferencias significativas entre días ( p = 0.038, p = 0.045 y p = 0.001 para patrón I, II y III respectivamente) y las letras muestran diferencias significativas entre tratamientos ( p = 0.0149) ( n= 8). Las células que muestran el Patrón I mantienen una actividad mitocondrial completa. Las células que muestran el Patrón II tienen mitocondrias sin un deterioro grave de la motilidad y la capacidad de fertilización. Los espermatozoides con el Patrón III tienen una pérdida significativa de actividad mitocondrial y las células con el Patrón IV están muertas o tienen una producción de energía mínima.
La adición de ZnCl 2 no produjo diferencias significativas en la fragmentación del ADN (consulte la Figura 1B complementaria ), independientemente de la duración del almacenamiento ( Figura 4 ).
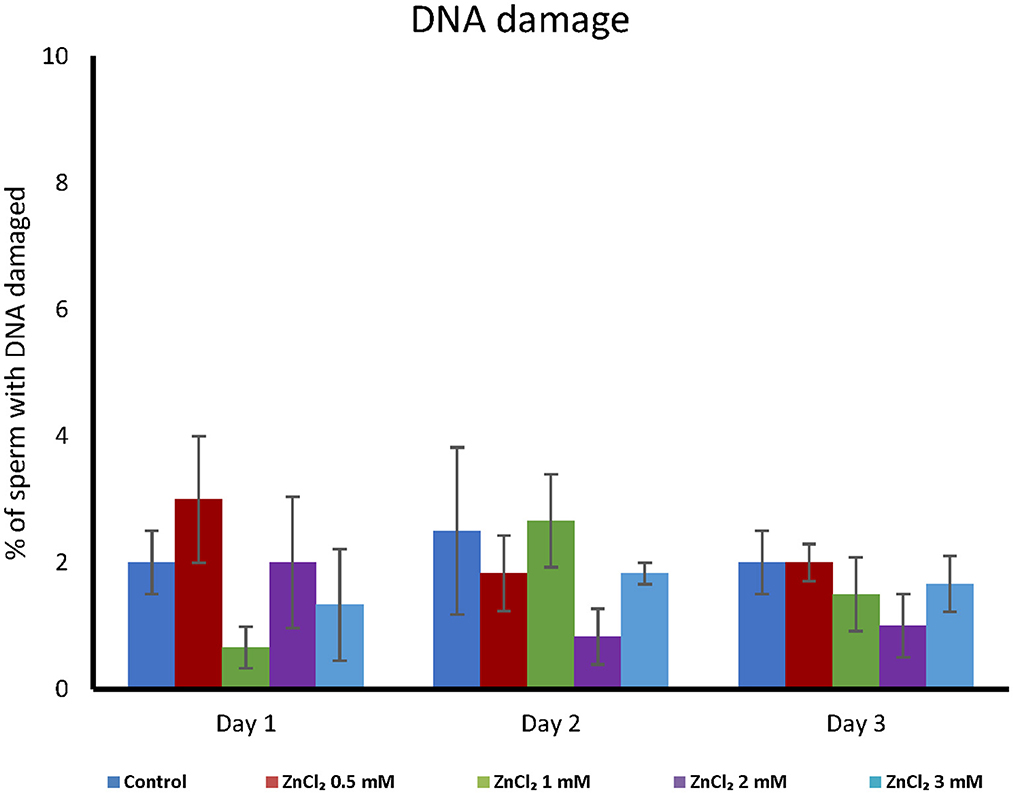 Figura 4 . Análisis de integridad del ADN. Las dosis seminales se complementaron con las concentraciones indicadas de ZnCl 2 y se analizaron durante 1, 2 y 3 días. La integridad del ADN se midió junto con el estado mitocondrial. La integridad de la cromatina no mostró diferencias entre tratamientos ni día de evaluación ( n = 8).
Figura 4 . Análisis de integridad del ADN. Las dosis seminales se complementaron con las concentraciones indicadas de ZnCl 2 y se analizaron durante 1, 2 y 3 días. La integridad del ADN se midió junto con el estado mitocondrial. La integridad de la cromatina no mostró diferencias entre tratamientos ni día de evaluación ( n = 8).
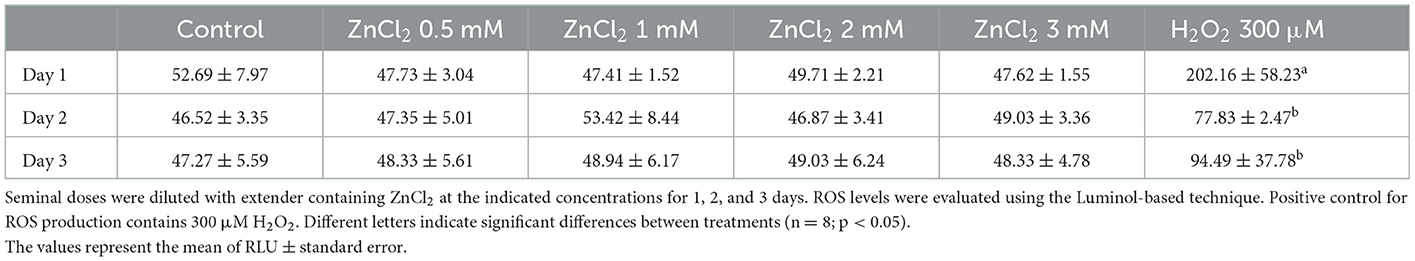
3.3. El zinc no afecta la producción de ROS en el esperma almacenado
La Tabla 3 muestra los niveles de ROS en los espermatozoides en presencia y ausencia de ZnCl 2 añadido , ya lo largo del tiempo, expresados como unidades relativas por 1,2 × 10 6 espermatozoides. Los resultados muestran que en todas las condiciones probadas, la adición de ZnCl 2 no provoca ningún efecto sobre la producción de ROS, en todos los tiempos probados.
3.4. Inseminación artificial con dosis suplementadas con ZnCl 2 2mM
De un total de 250 cerdas inseminadas en el ensayo, 204 quedaron preñadas. La tasa de partos utilizando dosis suplementadas con zinc fue del 85,7%, mientras que la tasa de partos sin suplementos de zinc fue del 79,5%. No se observaron diferencias estadísticas entre el control y el esperma suplementado con ZnCl 2 en la tasa de parto ( Tabla 4 ), el número y la distribución del número total de lechones, lechones vivos, mortinatos y fetos momificados ( Tabla 5 ).
 Tabla 4 . Porcentaje de cerdas gestantes tras la IA realizada con semen conservado en diluyente con 2 mM de ZnCl 2 y sin ZnCl 2 .
Tabla 4 . Porcentaje de cerdas gestantes tras la IA realizada con semen conservado en diluyente con 2 mM de ZnCl 2 y sin ZnCl 2 .
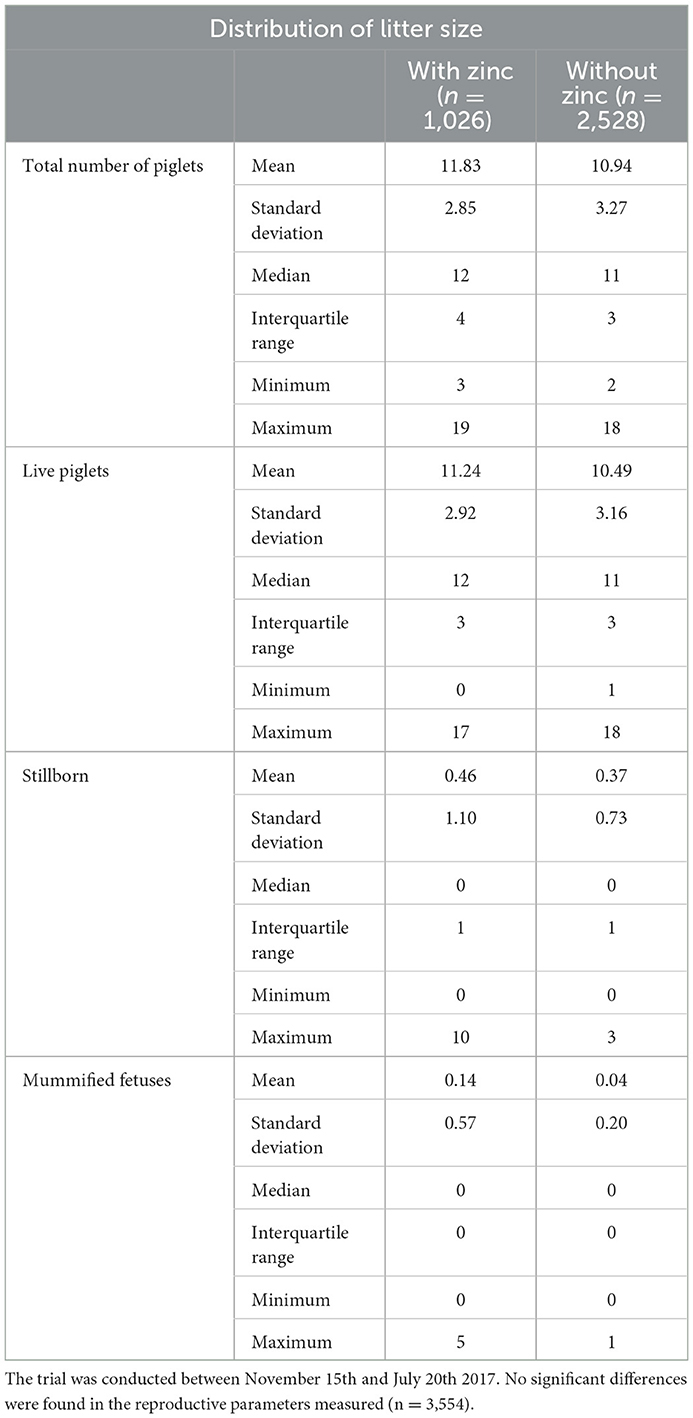 Tabla 5 . Datos recopilados de la IA realizada con esperma almacenado en presencia y ausencia de ZnCl 2 2 mM .
Tabla 5 . Datos recopilados de la IA realizada con esperma almacenado en presencia y ausencia de ZnCl 2 2 mM .
4. Discusión
Estudios recientes investigaron el papel del ion zinc en la fisiología del esperma de verraco ( 33 ). Estos estudios informaron la capacidad de los espermatozoides para incorporar zinc del medio, la redistribución de zinc en el espermatozoide durante la capacitación y el papel del zinc en la regulación de las interacciones de los espermatozoides con el oviducto y la zona pelúcida ( 11 , 12 ). Sin embargo, no se exploraron los efectos del zinc en la conservación de esperma de verraco líquido. Nuestro objetivo fue analizar las mejoras en la calidad del esperma mediante la adición de Zn en las mejores condiciones de conservación posibles. Pensamos que si se observa una mejora incluso en estas condiciones, cuando se utilizan diluyentes o muestras de menor calidad, la adición de zinc podría ser de mayor ayuda.
Con el fin de optimizar los diluyentes comerciales, se probaron suplementos con compuestos antioxidantes únicos. Se han informado estudios con antioxidantes exógenos como L-glutamina, albúmina de suero bovino (BSA), leche descremada, taurina, adenosina, clorhidrato de L-cisteína, ácido ascórbico y fumarato de magnesio ( 34 – 38 ), pero el efecto de agregar seminal compuestos antioxidantes endógenos del plasma, como Zn, al diluyente no se ha probado.
Aquí, nos propusimos caracterizar el efecto de la adición de zinc al extensor en diferentes concentraciones y a lo largo del tiempo durante 3 días después de la recolección y dilución de esperma. Al usar el método de mano enguantada, también se recolecta algo de plasma seminal junto con la fracción rica en espermatozoides, esto agrega más variación en la concentración de zinc de cada dosis seminal producida y restaurar la concentración original de zinc en el esperma requeriría medir su concentración en cada dosis. eyaculación, que es técnicamente desafiante. Por lo tanto, las concentraciones de zinc utilizadas en este estudio se eligieron teniendo en cuenta que: (1) la concentración de zinc en el plasma seminal generalmente se informa como la media de un grupo de animales. Por lo tanto, una sola eyaculación puede tener cantidades de zinc mucho más altas o más bajas que la media informada; (2) el ion zinc se agrega como ZnCl 2, y un exceso puede afectar la osmolalidad de los medios y provocar daño celular. Cabe señalar que el extensor Sus contiene EDTA, que quela el zinc. Como el EDTA está en exceso para garantizar que todos los iones de calcio se quelaron, esto afecta la disponibilidad de zinc para los espermatozoides. Aunque se desconoce la concentración exacta de zinc y EDTA presente en cada dosis seminal, los efectos del zinc pueden contrastarse con controles apropiados. Las concentraciones probadas no tuvieron un efecto adverso sobre la viabilidad después de 3 días de almacenamiento y se usaron para caracterizar aún más los espermatozoides almacenados.
La suplementación del diluyente con ZnCl 2 mostró un efecto protector sobre la estabilidad del acrosoma ( Figura 2 ) y esto es importante porque la estabilidad del acrosoma se ha asociado con un mayor tamaño de camada ( 39 ). El daño de la membrana tras la conservación de los espermatozoides a menudo está relacionado con la oxidación de los lípidos debido a la generación de ROS. Las ROS desempeñan una variedad de funciones en la fisiología de los espermatozoides, desde la espermatogénesis hasta la motilidad ( 40 ) y el zinc participa en la regulación de los niveles de ROS y es un cofactor de enzimas importantes involucradas en el sistema de defensa antioxidante ( 41 ). A pesar de estas funciones propuestas como eliminador de ROS, en nuestro estudio no corroboramos que el Zn actúe como antioxidante durante el almacenamiento de espermatozoides líquidos ( Tabla 3). Esto puede deberse a la presencia de plasma seminal en el semen extendido que actúa como eliminador de ROS ( 42 ). De acuerdo con esto, la integridad de la cromatina no se vio afectada por el almacenamiento. Por lo tanto, como la cromatina se mantuvo estable bajo la condición de control, el efecto estabilizador de zinc sobre la cromatina descrito anteriormente ( 43 ) no pudo observarse en nuestros experimentos. Esto coincide con el retraso o incluso la abolición de la fragmentación del ADN del esperma de verraco en el semen de verraco extendido ( 44 ). Curiosamente, H 2 O 2 300 μM es suficiente para producir daño al ADN en el esperma humano ( 29 ). Sin embargo, cuando usamos H 2 O 2300 μM como control positivo en las mediciones de niveles de ROS; no observamos fragmentación de ADN en esperma extendido de jabalí (datos no mostrados). En cambio, tuvimos que usar baja temperatura (-80 ° C) para inducir el daño y validar nuestra técnica de detección de fragmentación de ADN ( Figura complementaria 1B ).
Como la concentración de ROS no varió con el tratamiento, el efecto estabilizador del acrosoma difícilmente puede atribuirse a la propiedad antioxidante del zinc. Se ha demostrado previamente que las membranas celulares se estabilizan con zinc ( 16 ), y este efecto puede ser responsable de la mejor conservación de las membranas del acrosoma observada en muestras suplementadas con zinc. Además, se encontró una correlación interesante entre mayores concentraciones de zinc en el hígado con menos daño acrosomal en toros ( 45 ). La composición particular de la membrana que recubre el acrosoma ( 46) puede hacerlo más sensible a los daños durante el almacenamiento, beneficiándose así del efecto estabilizador del zinc. Además, la salida de zinc del esperma activa la metaloproteinasa de matriz 2 (MMP2) ubicada en la membrana acrosomal interna, y se sabe que el zinc disminuye la actividad proteolítica del proteasoma 26S y MMP2 ( 12 ). Este efecto también podría contribuir al aumento de la estabilidad acrosomal observado en presencia de zinc.
Como la adición de Zn mostró efectos sobre la motilidad de los espermatozoides conservados y esto está estrechamente relacionado con la función mitocondrial, evaluamos el estado mitocondrial en los espermatozoides conservados con Zn. El zinc ejerció un efecto protector sobre las mitocondrias, ya que observamos menos espermatozoides que mostraban el patrón III, con una gran pérdida de actividad mitocondrial, en dosis suplementadas con zinc en todas las concentraciones probadas ( Figura 3 ). Esto está de acuerdo con un efecto estabilizador del zinc sobre las vainas mitocondriales informado previamente ( 47 ) y puede tener una correlación con los cambios en los parámetros cinemáticos observados. Es interesante observar que las membranas mitocondriales y periacrosómicas parecen estabilizarse mediante la adición de Zn a los extensores.
El hallazgo de que el ZnCl 2 afecta los parámetros cinemáticos de los espermatozoides durante la conservación es significativo, ya que diferentes parámetros cinemáticos afectan los resultados en el desempeño de la fertilidad ( 39 , 48 ). Los eyaculados diluidos con diluyente suplementado con ZnCl 2 2 mM muestran el mayor porcentaje de espermatozoides progresivos ( Tabla 1 ) y dicho parámetro cinemático se correlaciona positivamente con la tasa de parto ( 49 ). Además, la adición de ZnCl 2 2 mM muestra una mayor población de espermatozoides rápidos hasta el día 2 que mantienen la rectitud en las trayectorias y la linealidad al día 3 ( Tabla 2 ), parámetros que se correlacionan positivamente con el número total de lechones nacidos ( 49 ,50 ). Por lo tanto, los parámetros cinemáticos afectados por ZnCl 2 2 mM se consideran deseables para los procedimientos de IA y se tuvieron en cuenta para realizar el ensayo de IA adicional.
Para probar la posibilidad de que la presencia de Zn en los extensores de Sus afecte el resultado reproductivo, las cerdas fueron inseminadas con esperma conservado en extensores suplementados con 2 mM de ZnCl 2,—la concentración que mostró la mejor motilidad progresiva y rápida. En esta investigación de prueba de principio, en la que el número de muestras es bajo, no encontramos diferencias estadísticas en los parámetros reproductivos porcinos. Sin embargo, cabe señalar que algunos parámetros mejorarían potencialmente con el tratamiento con zinc y merecerían ser estudiados en el futuro en una prueba de campo. Considerando una granja pequeña, como en este estudio, con 250 cerdas y una tasa de parto del 79,5%, hay 2,02 partos por cerda/año (contemplando 115 días de gestación + 21 días de destete + 7 días para volver al estro). Si el número total de lechones mejoraría en 0,89 para el tratamiento con zinc, como en este ensayo ( Tabla 5). Número total de lechones: 11,83 con zinc – 10,94 sin zinc = 0,89); entonces se ganarían 449 lechones más en la granja (250 × 2,02 × 0,89 = 449,45). Además, si consideráramos un aumento potencial de la tasa de parto (85,7%), entonces el parto por cerda/año sería de 2,18 y habría 485,05 lechones más (250 × 2,18 × 0,89 = 485,05). Esto produciría una ganancia en la producción porcina que merece ser más estudiada para los procedimientos de IA.
El efecto beneficioso de la adición de zinc al extensor de Sus sobre algunos parámetros de motilidad espermática, la estabilidad del acrosoma y la integridad de las mitocondrias sin efectos notables sobre la viabilidad, la producción de ROS y el resultado de la IA puede resultar de la combinación de varios efectos, como la interacción directa de este elemento con enzimas y proteínas asociado a membranas o a otros componentes de la membrana. La estabilización de las membranas acrosomales sensibles y las mitocondrias; y la mejora en los parámetros cinemáticos deseables mediante la adición de zinc, emergen como objetivos atractivos para futuros estudios para optimizar las técnicas de IA. Sin embargo, es de señalar que el estudio se ha realizado con verracos de alto mérito genético que muestran principalmente buena calidad de esperma. Sería interesante analizar este efecto en verracos con baja calidad seminal y realizar un nuevo ensayo de IA.
En conjunto, la adición de zinc al extensor de Sus mejora algunos parámetros de motilidad y la estabilidad de la membrana acrosomal, así como de las mitocondrias. Son necesarios estudios posteriores para analizar la mejora de la IA.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/ Material complementario , las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración de Ética
La aprobación ética de la investigación con animales fue otorgada por el Comité Institucional para el Cuidado y Uso de Animales de Laboratorio (CICUAL-FCByF), Universidad Nacional de Rosario (Expediente N° 6060/316).
Contribuciones de autor
PM concibió y diseñó el estudio y escribió el borrador del documento. LF realizó pruebas de integridad mitocondrial y de ADN. FC realizó inseminación artificial. JT concibió y diseñó el estudio, realizó análisis estadísticos, analizó datos, escribió el documento y revisó el contenido intelectual del artículo. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Fondos
Este trabajo fue apoyado por la Universidad Nacional de Rosario, 3 era Convocatoria Proyectos de Vinculación Tecnológica y Desarrollo Productivo. Vinculación inclusiva, 2016, y Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación FONCyT PICT 2017-1006.
Expresiones de gratitud
Agradecemos a la Dra. Carla Ritagliati por el apoyo con el análisis de semen asistido por computadora ya la Dra. Eugenia M. Clerico por la edición del manuscrito.
Conflicto de intereses
Los autores declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de interés.
nota del editor
Todas las afirmaciones expresadas en este artículo pertenecen únicamente a los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizada ni respaldada por el editor.
Material suplementario
El material complementario de este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1107929/full#supplementary-material
Figura complementaria 1. Patrones de tinción de piezas intermedias e integridad del ADN. (A) Imágenes microscópicas de espermatozoides que muestran diferentes patrones de tinción de la pieza intermedia según la actividad de la citocromo c oxidasa: patrón I, 100 % de la pieza intermedia teñida, patrón II, más del 50 % de la pieza intermedia teñida, patrón III, menos de 50 % de pieza intermedia manchada y patrón IV, sin mancha. (B) El color marrón es producto de la precipitación DAB. (B) Micrografía que muestra diferentes grados de daño en el ADN según la tinción con solución de Wright. Las células con halos de difusión grandes, medianos o pequeños corresponden a núcleos espermáticos que contienen ADN fragmentado. Se obtuvo daño severo en el ADN almacenando esperma a -80°C. En la micrografía se ven diferentes grados de daño (A).
Tabla complementaria 1. Distribución y origen de los verracos utilizados para la prueba de IA.
Tabla complementaria 2. Comparación entre dos sistemas CASA con dos soportes diferentes.
Referencias
1. Marin S, Chiang K, Bassilian S, Lee WNP, Boros LG, Fernández-Novell JM, et al. Estrategia metabólica de los espermatozoides de jabalí revelada por una caracterización metabolómica. FEBS Lett. (2003) 554:342–6. doi: 10.1016/S0014-5793(03)01185-2
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
2. van den Berg BM, Reesink J, Reesink W. TRIXcell+, un nuevo diluyente de semen porcino a largo plazo que contiene proteína de suero con mayor capacidad de conservación y tamaño de camada. Open Vet J. (2014) 4:20–5.
3. Gadea J. Revisión: diluyentes de semen utilizados en la inseminación artificial de cerdos. Español J Agric Res. (2003) 1:17–27. doi: 10.5424/sjar/2003012-17
4. Schulze M, Dathe M, Waberski D, Müller K. Almacenamiento líquido de semen porcino: perspectivas actuales y futuras sobre el uso de péptidos antimicrobianos catiónicos para reemplazar los antibióticos en los diluyentes de semen. Teriogenología. (2016) 85:39–46. doi: 10.1016/j.teriogenología.2015.07.016
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
5. Khoi HX, Shimizu K, Yoneda Y, Minagawa I, Abe Y, Kuwabara Y, et al. Monitoreo de las especies reactivas de oxígeno en los espermatozoides durante el almacenamiento líquido de semen porcino y su correlación con la motilidad de los espermatozoides, el contenido de tiol libre y la estacionalidad. Andrología. (2021) 6:e14237. doi: 10.1111/and.14237
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
6. Kumaresan A, Kadirvel G, Bujarbaruah KM, Bardoloi RK, Das A, Kumar S, et al. La conservación de semen de verraco a 18 °C induce peroxidación lipídica y cambios similares a la apoptosis en los espermatozoides. Anim Reprod Sci. (2009) doi: 10.1016/j.anireprosci.2008.01.006
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
7. IG blanco. Los lípidos y la absorción de calcio de los espermatozoides en relación con el choque por frío y la conservación: una revisión. Reprod Fértil Dev. (1993) 5:639–58. doi: 10.1071/RD9930639
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
8. Fazeli A, Duncan AE, Watson PF, Holt WV. Interacción espermatozoide-oviducto: inducción de capacitación y unión preferencial de espermatozoides incapacitados a células epiteliales oviductales en especies porcinas 1. Biol Reprod. (1999) 886:879–86.
9. Jonáková V, Manásková P, Tichá M. Separación, caracterización e identificación de proteínas de plasma seminal de jabalí. J Chromatogr B Anal Technol Biomed Life Sci. (2007) 849:307–14. doi: 10.1016/j.jchromb.2006.10.054
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
10. Chia SE, Ong CN, Chua LH, Ho LM, Tay SK. Comparación de las concentraciones de zinc en sangre y plasma seminal y los diversos parámetros espermáticos entre hombres fértiles e infértiles. JAndrol. (2000) 21:53–57. doi: 10.1002/j.1939-4640.2000.tb03275.x
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
11. Kerns K, Zigo M, Drobnis EZ, Sutovsky M, Sutovsky P. Flujo de iones de zinc durante la capacitación de espermatozoides de mamíferos. Nat Comun. (2018) 9:2061. doi: 10.1038/s41467-018-04523-y
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
12. Kerns K, Sharif M, Zigo M, Xu W, Hamilton LE, Sutovsky M, et al. La adquisición de la firma de zinc específica de la cohorte de esperma y el flujo de zinc inducido por la capacitación regulan las interacciones espermatozoide-oviducto y espermatozoide-zona pelúcida. Int J Mol Sci. (2020) 21:2121. doi: 10.3390/ijms21062121
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
13. Baccetti B, Pallini V, Burrini AG. Las fibras accesorias de la cola del espermatozoide. II. Su papel en la unión del zinc en mamíferos y cefalópodos. J Ultraestructura Res. (1976) 54:261–75. doi: 10.1016/S0022-5320(76)80155-4
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
14. Urgencias de Johnsen. Desestabilización de las membranas espermáticas humanas por albúmina, EDTA e histidina. Int J Androl. (1978) 1:485–8. doi: 10.1111/j.1365-2605.1978.tb00619.x
15. Bettger WJ, O’Dell BL. Un papel fisiológico crítico del zinc en la estructura y función de las biomembranas. Ciencias de la vida (1981) 28:1425–38. doi: 10.1016/0024-3205(81)90374-X
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
16. Chvapil M. Nuevos aspectos en el papel biológico del zinc: estabilizador de macromoléculas y membranas biológicas. Ciencias de la vida (1973) 13:1041–9. doi: 10.1016/0024-3205(73)90372-X
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
17. Plante M, De Lamirande E, Gagnon C. Las especies reactivas de oxígeno liberadas por los neutrófilos activados, pero no por los espermatozoides deficientes, son suficientes para afectar la motilidad normal de los espermatozoides. Fértil estéril. (1994) 62:387–93. doi: 10.1016/S0015-0282(16)56895-2
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
18. Gavella M, Lipovac V. In vitro . efecto del zinc sobre los cambios oxidativos en el semen humano. Andrología . (1998) 23:1. doi: 10.1111/j.1439-0272.1998.tb01177.x
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
19. Kotdawala AP, Kumar S, Salian SR, Thankachan P, Govindraj K, Kumar P, et al. La adición de zinc al eyaculado humano antes de la crioconservación previene el daño del ADN inducido por congelación y descongelación y preserva la función del esperma. J Ayudar a Reprod Genet. (2012) 29:1447–53. doi: 10.1007/s10815-012-9894-8
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
20. Roomans GM, Lundevall E, Björndahl L, Kvist U. Eliminación de zinc de regiones subcelulares de espermatozoides humanos mediante tratamiento con EDTA estudiado mediante microanálisis de rayos X. Int J Androl. (1982) 5478–86. doi: 10.1111/j.1365-2605.1982.tb00279.x
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
21. Wells ME, Awa OA. Nueva técnica para evaluar las características acrosomales de los espermatozoides. J ciencia lechera. (1970) 53:227–32. doi: 10.3168/jds.S0022-0302(70)86184-7
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
22. Rodríguez AL, Rijsselaere T, Beek J, Vyt P, Van Soom A, Maes D. Componentes del plasma seminal de jabalí y su relación con la calidad del semen. Syst Biol Reprod Med. (2013) 59:5–12. doi: 10.3109/19396368.2012.725120
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
23. Organización Mundial de la Salud. Manual de laboratorio para el examen y procesamiento de semen humano. Prensa de la Universidad de Cambridge Cambridge . (2010) 12:59–63. doi: 10.1038/aja.2008.57
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
24. Teijeiro JM, Cabada MO, Marini PE. La glucoproteína de unión a espermatozoides (SBG) produce alteraciones dependientes de calcio y bicarbonato de la morfología del acrosoma y la fosforilación de la proteína tirosina en los espermatozoides de verraco. J Cell Biochem. (2008) 103:1413–23. doi: 10.1002/jcb.21524
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
25. Vyt P, Maes D, Rijsselaere T, Dejonckheere E, Castryck F, Van Soom A. Evaluación de la motilidad de los espermatozoides porcinos: una comparación de métodos. Reprod Domest Anim . (2004) 39:447–53. doi: 10.1111/j.1439-0531.2004.00538.x
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
26. Hrudka F. Demostración citoquímica y ultracitoquímica de la citocromo c oxidasa en los espermatozoides y la dinámica de sus cambios que acompañan al envejecimiento o inducidos por el estrés. Int J Androl . (1987) 10: 809–28. doi: 10.1111/j.1365-2605.1987.tb00385.x
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
27. Fernández JL, Cajigal D, López-Fernández C, Gosálvez J. Evaluación de la fragmentación del ADN espermático con la prueba de dispersión de la cromatina espermática. Métodos Mol Biol. (2011) 682:291–301. doi: 10.1007/978-1-60327-409-8_21
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
28. Fariello RM, Del Giudice PT, Spaine DM, Fraietta R, Bertolla RP, Cedenho AP. Efecto de la leucocitospermia y el procesamiento por gradiente de densidad discontinuo sobre la fragmentación del ADN nuclear espermático y la actividad mitocondrial. J Ayudar a Reprod Genet . (2009) 26:151–7. doi: 10.1007/s10815-008-9288-0
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
29. Cicaré J, Caille A, Zumoffen C, Ghersevich S, Bahamondes L, Munuce MJ. La incubación in vitro de espermatozoides humanos promueve la generación de especies reactivas de oxígeno y la fragmentación del ADN. Andrología. (2015) 54:358–68. doi: 10.1111/and.12337
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
30. Agarwal A, Aitken RJ, Álvarez JG. Estudios sobre Salud y Fertilidad Masculina, Estrés Oxidativo en Investigación Básica Aplicada y Práctica Clínica . Springer (2012). pag. 257–73. doi: 10.1007/978-1-61779-776-7_13
31. Cane F, Pereyra N, Cane V, Patricia M, Teijeiro JM. Mejora de la tasa de parto mediante inseminación intrauterina en cerdas. Rev Mex Ciencias Pecu. (2019) 10. doi: 10.22319/rmcp.v10i3.4772
32. Shapiro SS, Wilk MB. Una prueba de análisis de varianza para la normalidad (muestras completas). Biometrika . (1965) 52:591–611. doi: 10.1093/biomet/52.3-4.591
33. Kerns K, Zigo M, Sutovsky P. Zinc: un ion necesario para la competencia de fertilización del esperma de mamíferos. Int J Mol Sci. (2018) 19:4097. doi: 10.3390/ijms19124097
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
34. Wang S, Sun M, Wang N, Yang K, Guo H, Wang J, Zhang Y, Yue S, Zhou J. Efectos de la L-glutamina en la calidad del esperma de jabalí durante el almacenamiento líquido a 17 °C. Anim Reprod Sci. (2018) 191:76–84. doi: 10.1016/j.anireprosci.2018.02.011
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
35. Zhang XG, Yan GJ, Hong JY, Su ZZ, Yang GS, Li QW, Hu JH. Efectos de la albúmina sérica bovina sobre la calidad del esperma de verraco durante el almacenamiento líquido a 17 °C. Reprod Doméstico Anim. (2015) 50:263–9. doi: 10.1111/rda.12481
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
36. Fu J, Li Y, Wang L, Zhen L, Yang Q, Li P, Li X. La albúmina sérica bovina y la leche descremada mejoran la motilidad del esperma de jabalí al mejorar el metabolismo energético y las modificaciones de proteínas durante el almacenamiento líquido a 17 °C. Teriogenología. (2017) 102:87–97. doi: 10.1016/j.teriogenología.2017.07.020
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
37. Li H, Zhang XG, Fang Q, Liu Q, Du RR, Yang GS, Wang LQ, Hu JH. Efecto suplementario de diferentes niveles de taurina en Módena sobre la calidad del semen porcino durante la conservación líquida a 17°C. Anim Sci J. (2017) 88:1692–9. doi: 10.1111/asj.12865
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
38. Szcześniak-Fabiańczyk B, Bochenek M, Smorag Z, Ryszka F. Efecto de los antioxidantes agregados al diluyente de semen de jabalí sobre el tiempo de supervivencia del semen y la estructura de la cromatina espermática. Reprod Biol. (2003) 3:81–7.
39. Holt C, Holt W V., Moore HDM, Reed HCB, Curnock RM. Los parámetros de motilidad del esperma de verraco medidos objetivamente se correlacionan con los resultados de las inseminaciones en la granja: resultados de dos ensayos de fertilidad. JAndrol. (1997) 18:312–23. doi: 10.1002/j.1939-4640.1997.tb01925.x
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
40. Baskaran S, Finelli R, Agarwal A, Henkel R. Especies reactivas de oxígeno en la reproducción masculina: ¿una bendición o una perdición? Andrología. (2021) 53:e13577. doi: 10.1111/and.13577
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
41. Yang X, Wang H, Huang C, He X, Xu W, Luo Y, Huang K. El zinc mejora el suministro de energía celular para mejorar la motilidad celular y restaurar el metabolismo energético deteriorado en un entorno tóxico inducido por OTA. Sci Rep. (2017) 7:14669. doi: 10.1038/s41598-017-14868-x
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
42. Barranco I, Tvarijonavicute A, Perez-Patinõ C, Parrilla I, Ceron JJ, Martinez EA, Rodriguez-Martinez H, Roca J. La alta capacidad antioxidante total del plasma seminal porcino (SP-TAC) se relaciona con la supervivencia y fertilidad de los espermatozoides . Sci Rep. (2015) 5:18538. doi: 10.1038/srep18538
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
43. KVIST U. Importancia del zinc de los espermatozoides como inhibidor temporal de la capacidad de descondensación de la cromatina nuclear de los espermatozoides en el hombre. Análisis Acta Physiol. (1980) 109:79–84. doi: 10.1111/j.1748-1716.1980.tb06567.x
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
44. Pérez-Llano B, Enciso M, García-Casado P, Sala R, Gosálvez J. La fragmentación del ADN espermático en verracos se retrasa o elimina mediante el uso de extensores de esperma. Teriogenología. (2006) 66:2137–43. doi: 10.1016/j.teriogenología.2006.01.066
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
45. Geary TW, Waterman RC, Van Emon ML, Ratzburg CR, Lake S, Eik BA, Armstrong DR, Zezeski AL, Heldt JS. Efecto de los minerales traza suplementarios en las medidas estándar y novedosas de la fertilidad del toro. Teriogenología. (2021) 172:307–14. doi: 10.1016/j.teriogenología.2021.07.006
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
46. Si W, Benson JD, Men H, Critser JK. Límites de tolerancia osmótica y efectos de los crioprotectores sobre la motilidad, la integridad de la membrana plasmática y la integridad acrosomal del esperma de rata. Criobiología. (2006) 53:336–48. doi: 10.1016/j.cryobiol.2006.09.001
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
47. Kumari D, Nair N, Bedwal RS. Apoptosis testicular después de la deficiencia de zinc en la dieta: estudios ultraestructurales y TUNEL. Syst Biol Reprod Med. (2011) 57:233–43. doi: 10.3109/19396368.2011.584500
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
48. Barquero V, Roldan ERS, Soler C, Vargas-Leitón B, Sevilla F, Camacho M, et al. Relación entre los rasgos de fertilidad y la cinemática en grupos de eyaculados de verracos. Biología (Basilea) . (2021) 10:595. doi: 10.3390/biología10070595
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
49. Broekhuijse MLWJ, Šoštarić E, Feitsma H, Gadella BM. Aplicación del análisis de semen asistido por computadora para explicar las variaciones en la fertilidad del cerdo. J Anim Sci. (2012) 90:779–89. doi: 10.2527/jas.2011-4311
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
50. Tremoen NH, Gaustad AH, Andersen-Ranberg I, van Son M, Zeremichael TT, Frydenlund K, et al. Relación entre las características de motilidad de los espermatozoides y las concentraciones de ATP, y asociación con la fertilidad en dos razas de cerdos diferentes. Anim Reprod Sci. (2018) 193:226–34. doi: 10.1016/j.anireprosci.2018.04.075
Resumen de PubMed | Texto completo de referencia cruzada | Google Académico
Palabras clave: porcino, espermatozoides, zinc, diluyente, inseminación artificial
Cita: Marini P, Fernández Beato L, Cane F y Teijeiro JM (2023) Effect of zinc on boar sperm liquid storage. Parte delantera. Veterinario. ciencia 10:1107929. doi: 10.3389/fvets.2023.1107929
Recibido: 25 de noviembre de 2022; Aceptado: 18 de enero de 2023;
Publicado: 02 febrero 2023.
Editado por:
Jordi Roca , Universidad de Murcia, España
Revisado por:
Alfonso Bolarin Guillen , Fast Genetics, Canadá
Maria Jose Martinez-Alborcia , Topigs Norsvin Research Center, Países Bajos
Copyright © 2023 Marini, Fernández Beato, Cane y Teijeiro. Este es un artículo de acceso abierto distribuido bajo los términos de Creative Commons Attribution License (CC BY) .
*Correspondencia: Juan Manuel Teijeiro,  jteijeiro@fbioyf.unr.edu.ar
jteijeiro@fbioyf.unr.edu.ar
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo pertenecen únicamente a los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía