Efectos de diferentes tasas de propofol con o sin S-ketamina sobre la función ventricular en gatos
Efectos de diferentes tasas de propofol con o sin S-ketamina sobre la función ventricular en gatos sanos: un estudio aleatorizado
 Sabrine Marangoni1*
Sabrine Marangoni1*  Matheus Ubiali1
Matheus Ubiali1  Francieli Ambrosini1
Francieli Ambrosini1  Larissa Jahnel1
Larissa Jahnel1  Julia M. Vilani1
Julia M. Vilani1  Paulo V. Steagall2,3
Paulo V. Steagall2,3  Ricardo Guilherme D’Otaviano de Castro Vilani1
Ricardo Guilherme D’Otaviano de Castro Vilani1- 1Departamento de Medicina Veterinaria, Universidad Federal de Paraná, Juvevê, Curitiba, PR, Brasil
- 2Departamento de Ciencias Clínicas Veterinarias y Centro de Salud y Bienestar de los Animales de Compañía, Facultad de Medicina Veterinaria y Ciencias de la Vida del Jockey Club, Universidad de la Ciudad de Hong Kong, Kowloon, RAE de Hong Kong, China
- 3Departamento de Ciencias Clínicas, Facultad de Medicina Veterinaria, Universidad de Montreal, Saint-Hyacinthe, QC, Canadá
El propofol se utiliza para la inducción anestésica en gatos y la sedación durante el procedimiento en países donde no se dispone de alfaxalone. Los estudios han reportado efectos relacionados con el propofol en variables de ecocardiografía en perros y humanos. Sin embargo, hay una falta de estudios ecocardiográficos que investiguen los efectos relacionados con el propofol en los gatos. El objetivo de este estudio fue investigar los cambios ecocardiográficos en tres protocolos que utilizaron propofol: propofol lento (2 mg/kg/min, PS); propofol rápido (8 mg/kg/min, PF); propofol-ketamina (bolo de S-ketamina 2 mg/kg seguido de propofol 2 mg/kg/min; PK) en gatos sanos premedicados (gabapentina-buprenorfina-acepromazina; 200 mg/gato, 0,4 y 0,1 mg/kg, respectivamente), no intubados. Las mediciones ecocardiográficas se obtuvieron en tres momentos: basal (antes de la administración de propofol), final de la titulación de propofol (punto final, T0) y 15 min después de T0 (T15). El propofol a una tasa más baja continuó de T0 a T15. Las variables ecocardiográficas y fisiológicas incluyeron acortamiento fraccional (FS%), fracción de eyección (EF%), FC, PA y otras. Los requerimientos de propofol en T0 para los grupos PF, PS y PK fueron de 5,0 ± 0,9, 3,8 ± 0,7 y 2,4 ± 0,5 mg/kg, respectivamente. El porcentaje de FE no cambia con el tiempo ni entre grupos. PF y PK mostraron una reducción del FS% en T0 (47 ± 6 a 34 ± 6 y 42 ± 6 a 36 ± 5, respectivamente). La PA se redujo significativamente en los grupos PF y PS (136 ± 26 a 105 ± 13 y 137 ± 22 a 115 ± 15 mmHg, respectivamente). No está claro si los cambios en las variables de la ecocardiografía fueron de relevancia clínica relacionados con los grupos de tratamiento o como resultado de las respuestas individuales dentro del grupo.
1 Introducción
El propofol es un fármaco hipnótico utilizado para la inducción y el mantenimiento de la anestesia en medicina veterinaria. El fármaco también se utiliza para la sedación de procedimientos en animales pequeños durante procedimientos no invasivos a corto plazo (p. ej., procedimientos de diagnóstico, colocación de sondas de alimentación nasoesofágica, cambios de vendajes y limpieza de heridas) (1). El uso de propofol para la sedación durante el procedimiento da como resultado la activación de los receptores inhibidores del ácido gamma-aminobutírico (GABAA), promoviendo la inconsciencia con pérdida de reflejos protectores mientras disminuye el volumen sistólico y, por lo tanto, reduce el gasto cardíaco (GC) de una manera dependiente de la dosis (2-5). El propofol también disminuye la frecuencia cardíaca (FC), la contractilidad miocárdica y la presión arterial en gatos y humanos (6, 7). La disminución de la presión arterial y los efectos inotrópicos negativos directos están estrechamente relacionados con las concentraciones plasmáticas de propofol (8). Además, el propofol causa hipoventilación, hipercapnia e hipoxemia que pueden conducir a otros cambios hemodinámicos secundarios y activación simpática (9). Estos cambios pueden estar influenciados tanto por la dosis como por la velocidad de administración (8, 9). La ketamina, un anestésico disociativo comúnmente utilizado en muchas especies, está disponible como una mezcla racémica o S-ketamina. A menudo se menciona que la S-ketamina es dos veces más potente que la ketamina racémica con efectos antihiperalgésicos mejorados y menores efectos adversos (1). De hecho, algunos autores sugieren que una tasa de administración más lenta y/o el uso del propofol en combinación con ketamina (para disminuir la dosis de propofol) puede reducir los efectos cardiovasculares adversos relacionados con el propofol (9-11). En perros sanos, la administración rápida de propofol redujo la presión arterial, mientras que el gasto cardíaco se mantuvo por una respuesta cronotrópica compensatoria (8). Sin embargo, no hay pruebas concluyentes de estos beneficios en los gatos. La experiencia clínica muestra que no es raro observar depresión cardiorrespiratoria con la administración de propofol para la sedación del procedimiento en gatos. Una «sedación rápida» puede ser perjudicial para el paciente, especialmente cuando no se realiza la intubación y hay hipoventilación en gatos con monitorización anestésica subóptima (1).
La función sistólica cardíaca depende de varios factores, como la precarga y la poscarga, la contractilidad miocárdica, la distensibilidad (contracción y relajación), el ritmo y la frecuencia cardíaca, que en última instancia se ven afectados por la edad, la administración de fármacos, los estados de enfermedad y el volumen circulante (12). Para garantizar una sedación o anestesia seguras, es esencial evaluar la influencia de los anestésicos en estas variables, incluido el propofol. La ecocardiografía se ha convertido en una técnica diagnóstica importante para detectar cambios hemodinámicos relacionados con la inducción de la anestesia con propofol en perros (8, 13) y los protocolos inyectables de sedación en gatos (14, 15). Sin embargo, hay una falta de estudios ecocardiográficos que investiguen los efectos del propofol administrado a diferentes velocidades en gatos y que imiten particularmente la sedación del procedimiento.
El objetivo de este estudio fue utilizar la ecocardiografía transtorácica para investigar los cambios ecocardiográficos y sus posibles efectos hemodinámicos en algunas variables cardiovasculares (p. ej., presión arterial no invasiva y FC) de tres protocolos que utilizaron propofol en gatos sanos premedicados y no intubados. La hipótesis era que la administración de propofol a una velocidad de infusión rápida daría lugar a mayores cambios sistólicos adversos en el ventrículo izquierdo que una velocidad de infusión lenta con o sin S-ketamina en estos gatos.
2 Materiales y métodos
2.1 Animales
Este estudio está aprobado por el comité de ética (n.º 024/021) y se informa de acuerdo con las directrices del CONSORT.1 El estudio experimental se realizó en el hospital de enseñanza veterinaria de la Universidad Federal de Paraná (UFPR, Curitiba, Brasil) de abril a julio de 2021.
Un total de 24 gatos machos domésticos sanos de pelo corto de un solo refugio de animales, programados para orquiectomía, se inscribieron en un ensayo experimental prospectivo, aleatorizado, enmascarado después de recibir el consentimiento por escrito. Al final del estudio, los gatos fueron devueltos a los refugios para su adopción. Las estimaciones del tamaño de la muestra se derivaron de los cálculos de potencia utilizando G*Power2 basado en la mediana y el tamaño del efecto con el objetivo de alcanzar una potencia del 80% y una tasa de error alfa de 0,05 (bilateral) obtenida a partir de los resultados (es decir, el FS% utilizado como resultado de interés) después de los primeros ocho episodios anestésicos (es decir, tres para dos grupos y dos para un grupo).
Los criterios de inclusión incluyeron gatos machos sanos de cualquier raza, > 2 kg de peso corporal, > 1 año de edad y el estado I de la Sociedad Americana de Anestesiología (ASA). Los gatos se consideraron sanos en función de la anamnesis, el examen físico, un hemograma completo (CSC), el perfil químico sérico (glucosa, nitrógeno ureico en sangre, creatinina, proteína total sérica, fosfatasa alcalina sérica, alanina aminotransferasa, y aspartato aminotransferasa) dentro de los valores de referencia, y la ausencia de ruidos cardíacos anormales (p. ej., sonido de galope) o soplos durante la auscultación torácica. Los criterios de exclusión incluían comportamientos salvajes (es decir, que afectarían el manejo de los gatos), obesidad (puntuación de condición corporal > 7 en una escala del 1 al 9) o signos clínicos de enfermedad. Los gatos con sospecha de anomalías cardíacas estructurales o funcionales, incluida la miocardiopatía hipertrófica y el grosor del tabique interventricular al final de la sístole y la diástole final (IVS y IVSd) de ≥6 mm (16), se excluyeron después de las mediciones basales.
Los animales fueron admitidos y colocados en jaulas individuales que contenían agua, comedero, cajas de cartón, caja de arena y mantas y se sometieron a un período de aclimatación de aproximadamente 12 h antes del estudio. Los gatos fueron alojados y manejados de acuerdo con técnicas interactivas y de manejo amigables para los felinos (17). Se administró gabapentina oral (100 mg, Drogavet, PR, Brasil) aproximadamente 12 h y 1 h antes del procedimiento (18), para reducir el estrés y el miedo (17, 18). Se realizó un examen físico completo aproximadamente 90 minutos después de la primera dosis de gabapentina, y se cortó el pelo de la extremidad torácica derecha (para el acceso venoso), de la extremidad pélvica izquierda por encima de la almohadilla metatarsiana (para la presión arterial no invasiva) y de ambos lados del tórax (para la ecocardiografía transtorácica; TTE). La comida y el agua se retuvieron durante 6 y 2 h, respectivamente, antes de la premedicación (ver más abajo). La segunda dosis de gabapentina se administró después de la extracción de agua.
2.2 Grupos y procedimientos
Todos los gatos fueron premedicados con butorfanol (0,4 mg/kg; Torbugesic, 10 mg mL; Pfizer, Estados Unidos) y acepromazina (0,1 mg/kg, Acepran 0,2%, Vetnil, Brasil) mezclados en la misma jeringa y administrados por vía intramuscular en los músculos lumbares epaxiales. Después de 30 minutos, los gatos se colocaron suavemente en decúbito lateral derecho y se envolvieron en una toalla para la colocación de un catéter sobre la aguja en la vena cefálica derecha. Un solo investigador (SM) fue responsable de interactuar con los gatos (es decir, manejo y alojamiento, administración de gabapentina, premedicación y colocación de catéteres venosos), para mitigar la respuesta de miedo-ansiedad-estrés relacionada con interacciones impredecibles.
Las mediciones estandarizadas de la ETT se realizaron utilizando una técnica consistente, de modo que se obtuvieron las mismas imágenes ecocardiográficas utilizando la misma secuencia de eventos. Todas las variables se midieron de acuerdo con las recomendaciones del Colegio Americano de Medicina Interna Veterinaria (19). Las mediciones de ecocardiografía transtorácica se registraron en tres momentos: basal (inmediatamente antes de la administración de propofol), inmediatamente al final de la titulación de propofol (T0) y 15 min después de T0 (T15). Un veterinario con experiencia en cardiología (AF) realizó todas las mediciones utilizando un transductor de sector de 12 MHz conectado a una máquina estadounidense (Affiniti 50, Philips, WA, EE. UU.). Las variables fisiológicas registradas fueron: frecuencia respiratoria (FR) por observación de excursiones torácicas, saturación capilar periférica de oxígeno (SpO)2), y la monitorización electrocardiográfica (ECG) mediante un monitor multiparamétrico (LifeWindow, Multi-Parameter Physiologic Monitor LW9x, Digicare Animal Health, RJ, Brasil). La presión arterial (PA) no invasiva se midió mediante una ecografía Doppler (Doppler 811-B, Parks Medical Electronics, Inc., Oregón, Estados Unidos). Las mediciones se recogieron por triplicado en todos los puntos de tiempo y se registraron cada 5 minutos. A continuación, se calculó y registró el valor medio. Se colocó un manguito (manguito NIBP, Digicare Animal Health, RJ, UAS) con un ancho de aproximadamente el 40% de la circunferencia de la extremidad por encima del tarso. Se aplicó gel conductor (Carbogel ULT, Ind., SP, Brasil) antes de colocar la sonda de cristal piezoeléctrico plano (8,2 MHz) por encima de la almohadilla metatarsiana y sobre la arteria plantar medial. La FC se midió mediante monitorización de ECG y se registró en el momento de la medición del CO. La temperatura rectal (RT) se midió en T0 y T15 con un termómetro digital. El oxígeno se administró a través de un sistema de respiración Mapleson D modificado conectado a una máscara facial con un flujo de gas fresco a 400 ml/kg/min durante todo el procedimiento.
Todos los investigadores fueron enmascarados para la asignación de grupos, excepto el individuo que realizó la aleatorización, la preparación y la administración de fármacos (JV), que no participó en los pasos posteriores del estudio. Una jeringa de 60 ml que contenía propofol (Propotil 1%, Midpharma, Dongkook Pharm. Co., Corea del Sur) se conectó a una bomba de infusión (SYS3010, Medcaptain Medical Technology Co., China) con su pantalla electrónica cubierta con papel para ocultar la asignación del tratamiento (es decir, cegamiento). A cada gato se le asignó un número (del 1 al 24) según su orden de llegada y al azar3 dividido en uno de tres tratamientos: velocidad de infusión de propofol de 2 mg/kg/min (propofol lento; grupo PS); 8 mg/kg/min (propofol en ayunas; grupo PF); o un solo bolo de S-ketamina (2 mg/kg; Ketamin, Cristália, Brasil) inyectado manualmente durante 15 s seguido de 2 mg/kg/min (propofol-ketamina; grupo PK). Las jeringas con S-ketamina se diluyeron con solución salina al 0,9% hasta un volumen final de 0,5 mL. Los grupos PF y PS recibieron 0,5 mL de solución salina al 0,9% antes de la infusión de propofol.
Después de las mediciones basales, los tratamientos se administraron como se indicó anteriormente hasta que se alcanzó un punto final (T0) de acuerdo con un investigador (RV), con el fin de imitar la sedación del procedimiento en el entorno clínico. El punto final se consideró de la siguiente manera: la ausencia de reflejo palpebral lateral, la conciencia reducida, la disminución del tono de la mandíbula y la capacidad de sacar la lengua del gato suavemente sin resistencia. Los gatos no fueron intubados. Sin embargo, en caso de apnea se disponía de un tubo endotraqueal con manguito y de un laringoscopio. Una vez alcanzado el T0, la infusión de propofol se redujo a 0,4 mg/kg/min en todos los grupos y disminuyó progresivamente en 0,1 mg/kg/min cada 5 min para mantener un nivel constante de sedación dentro de cada grupo. Después de 15 min (T15), se registraron nuevamente los valores de TTE, FC, FR y RT. Se registró la cantidad total de propofol necesaria para mantener la anestesia (es decir, propofol administrado desde T0 hasta el final de la ecocardiografía en T15). Posteriormente, el gato fue preparado para la cirugía y la orquiectomía fue realizada por un veterinario (LJ) utilizando un bloqueo intratesticular combinado con lidocaína incisional subcutánea (3 mg/kg; 20 mg/mL, Xylestesin, Cristália, Brasil). Para el procedimiento quirúrgico, se administraron tasas de infusión de propofol para proporcionar profundidad quirúrgica de la anestesia. El meloxicam (0,2 mg/kg; 2 mg/ml, Maxicam, Ourofino, Brasil) se inyectó por vía subcutánea después de la cirugía. No se administró fluidoterapia a menos que el gato estuviera hipotenso con presión arterial sistólica inferior a 90 mmHg. Se monitorizó la recuperación anestésica y se ofreció comida húmeda 1-2 h después de la recuperación anestésica.
2.3 Mediciones y técnicas ecocardiográficas
El tamaño del ventrículo izquierdo (VI) y la función sistólica se midieron utilizando la vista estándar del eje corto paraesternal derecho (PSAx) y la vista del eje largo (PLAx) y una vista apical izquierda. Las variables ecocardiográficas incluyeron la dimensión del VI al final de la sístole (VIVI) y al final de la diástole (VIDd), a nivel de las cuerdas tendinosas a partir de imágenes de eje corto paraesternal derecho. La fracción de eyección del ventrículo izquierdo (FE%) se determinó mediante el método de Simpson desde una vista del eje largo paraesternal derecho. Se calculó el acortamiento fraccionario (FS% = [LVIDd-LVIDs]/LVIDd × 100%). Después de analizar el flujo aórtico a partir de imágenes apicales izquierdas, se calculó el CO (L/min) a partir de los espectros de velocidad aórtica mediante la ecuación: (CO = VTI x área de la sección transversal aórtica x FC) (20). Además, la excursión sistólica del plano anular tricuspídeo (TAPSE) y la excursión sistólica del plano anular mitral (MAPSE) se evaluaron mediante el modo M desde la vista apical izquierda de cuatro cámaras. Se midieron y registraron la frecuencia cardíaca y la PA (20).
3 Análisis estadístico
Los datos se analizaron con el software R versión 4.1.0 (https://www.r-project.org; dplyr, rstatix, reshep, stats, PMCMRplus y ggplot2). Se calculó la media de las mediciones por triplicado y se utilizó para los resultados de la ecocardiografía durante el análisis de los datos. Se realizó un análisis estadístico descriptivo con media, mediana, desviación estándar y percentil 25 y 75% de las variables cuantitativas, según puntos temporales y grupos. La distribución de los datos se analizó mediante la prueba de Shapiro-Wilk. Para las variables con distribución normal, la diferencia entre los grupos se analizó mediante ANOVA seguido de la prueba de Tukey post-hoc (LVIDd, LVIDs y PA). Para los datos sin distribución normal, los grupos se compararon mediante la prueba de Kruskal-Wallis seguida de la prueba de Dunn (GC, EF% Simpson, HR, SpO2, MAPSE y TAPSE). Los cambios temporales se analizaron mediante ANOVA de medidas repetidas seguido de la prueba t pareada con corrección de Bonferroni para variables paramétricas o la prueba de Friedman seguida de la prueba de Nemenyi para variables no paramétricas. Los análisis se consideraron significativos cuando p < 0,05.
4 Resultados
De los 24 gatos inscritos, 23 fueron incluidos en el estudio (Figura 1). Un gato fue excluido del grupo PK por evidencia de miocardiopatía hipertrófica asintomática identificada en el momento de la primera ecocardiografía (Tabla 1).
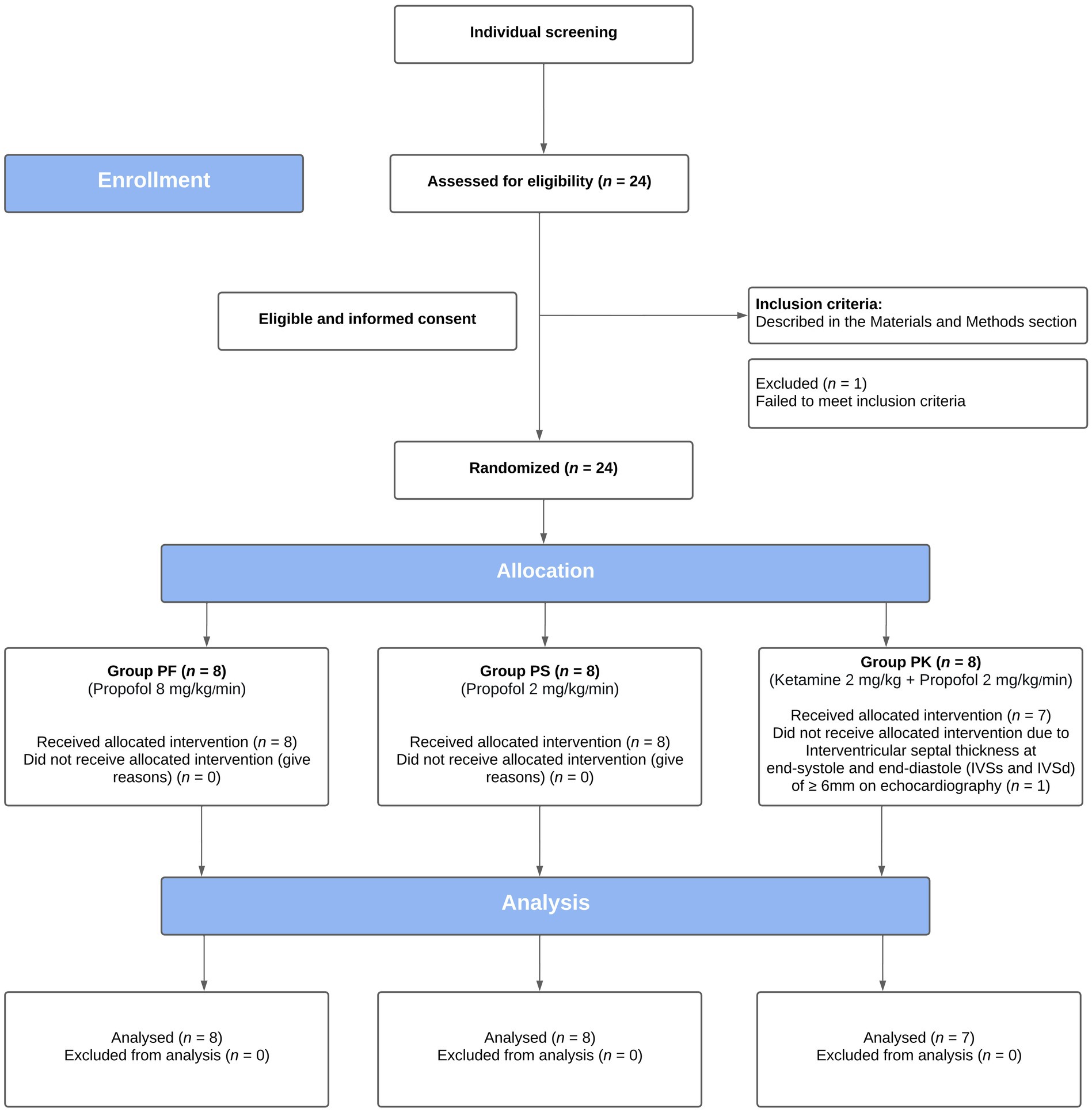 Figura 1. Diagrama de flujo CONSORT de un ensayo clínico prospectivo, ciego y aleatorizado, en el que se compararon los efectos ecocardiográficos de tres protocolos de sedación premedicada con gabapentina-butorfanol-acepromazina (200 mg/gato, 0,4 y 0,1 mg/kg, respectivamente; basal). Los gatos fueron asignados aleatoriamente a tres grupos (PF, 8 mg/kg/min; PS: 2 mg/kg/min; y PK, S-ketamina 2 mg/kg seguida de propofol 2 mg/kg/min).
Figura 1. Diagrama de flujo CONSORT de un ensayo clínico prospectivo, ciego y aleatorizado, en el que se compararon los efectos ecocardiográficos de tres protocolos de sedación premedicada con gabapentina-butorfanol-acepromazina (200 mg/gato, 0,4 y 0,1 mg/kg, respectivamente; basal). Los gatos fueron asignados aleatoriamente a tres grupos (PF, 8 mg/kg/min; PS: 2 mg/kg/min; y PK, S-ketamina 2 mg/kg seguida de propofol 2 mg/kg/min).
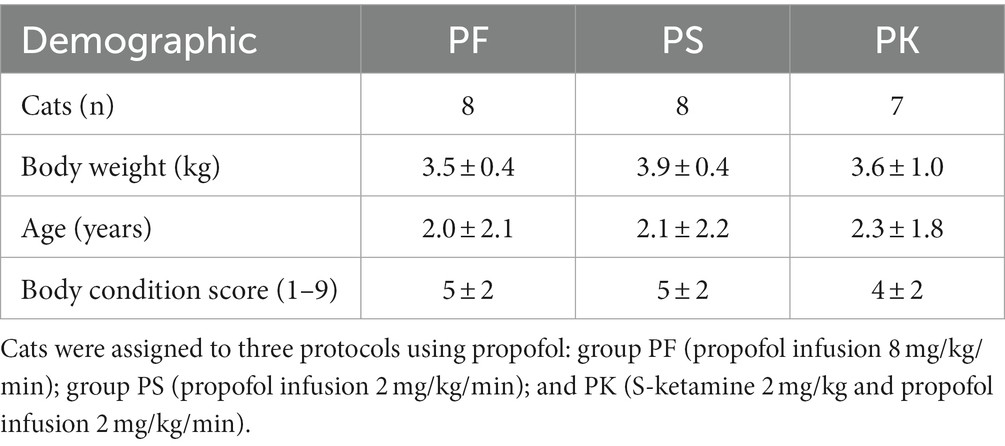 Tabla 1. Información demográfica de 23 gatos domésticos machos de pelo corto inscritos en un estudio en el que se compararon los efectos ecocardiográficos de tres protocolos de sedación premedicados con gabapentina-butorfanol-acepromazina (200 mg/gato, 0,4 y 0,1 mg/kg, respectivamente; valor basal).
Tabla 1. Información demográfica de 23 gatos domésticos machos de pelo corto inscritos en un estudio en el que se compararon los efectos ecocardiográficos de tres protocolos de sedación premedicados con gabapentina-butorfanol-acepromazina (200 mg/gato, 0,4 y 0,1 mg/kg, respectivamente; valor basal).
Se observaron cambios significativos dentro del grupo para FS%, HR y PA en PF; para LVIDd, FS%, CO y HR en PK; y para RRHH y BP en PS. No hubo diferencias estadísticamente significativas en MAPSE/TAPSE dentro de los grupos en ningún momento. No se observaron diferencias significativas en las comparaciones de tratamiento para las variables ecocardiográficas en ningún momento. Aunque los requerimientos de propofol en T0 fueron significativamente diferentes entre los grupos, no hubo diferencia en la cantidad total de infusión de propofol requerida para mantener la anestesia. En las Tablas 2 y 3 se presentan análisis inferenciales para diversas variables. No se observó apnea durante el estudio. Dos gatos tenían un porcentaje de FS cercano o inferior a los valores de referencia publicados (28 a 62%) (21, 22): un gato en PF (es decir, 26%) y otro en PK (es decir, 29%) en T0. Los valores de FS% se devolvieron a valores normales en todos los individuos en T15. Sin embargo, la PF causó bradicardia (< 100 lpm) (23) en cinco gatos. Todos los gatos se recuperaron sin complicaciones de la cirugía.
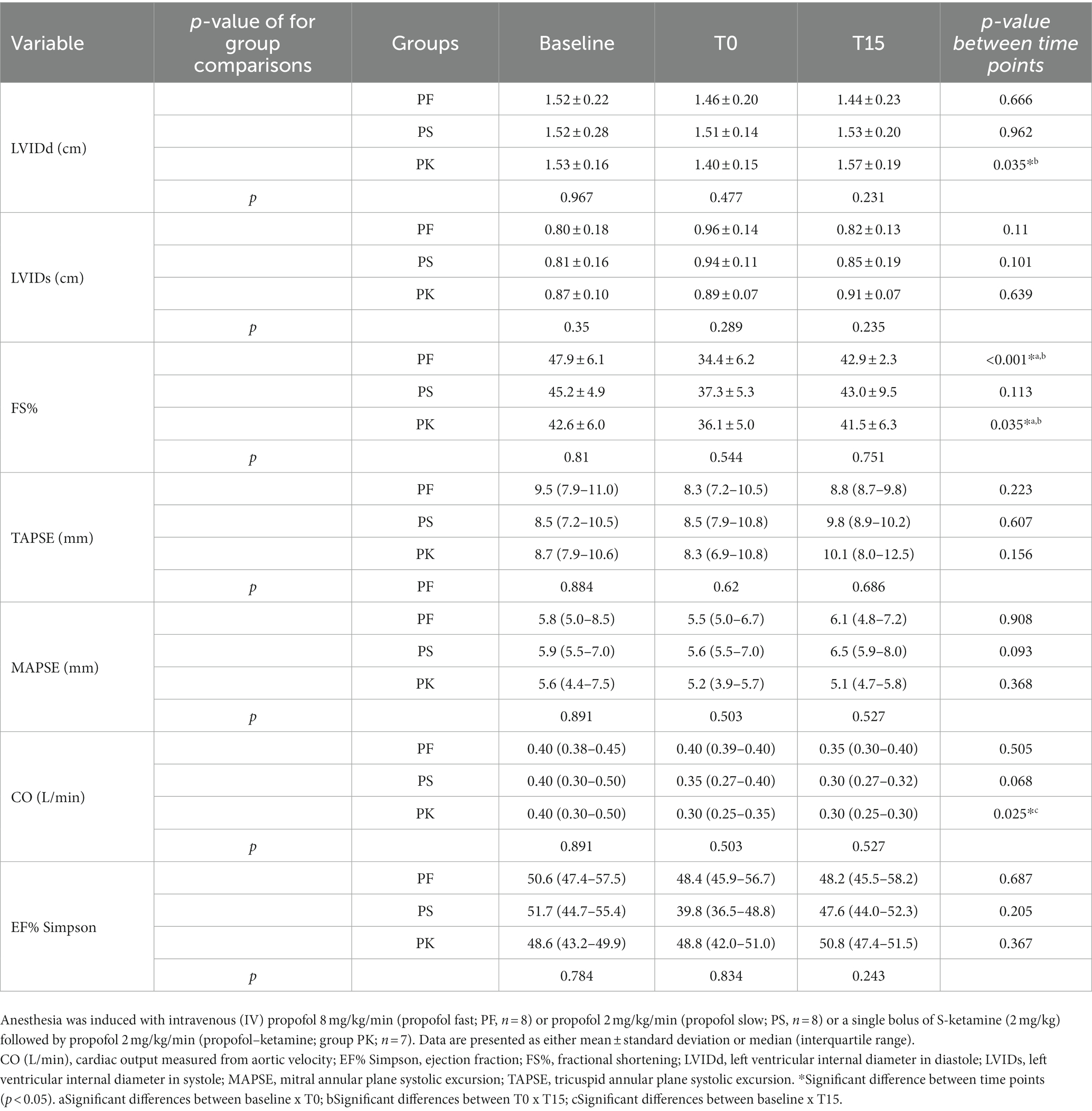 Tabla 2. Variables ecocardiográficas de gatos machos sanos premedicados con gabapentina-butorfanol-acepromazina (200 mg/gato, 0,4 y 0,1 mg/kg, respectivamente; basal) en el punto final (T0) y después de 15 min del punto final (T15).
Tabla 2. Variables ecocardiográficas de gatos machos sanos premedicados con gabapentina-butorfanol-acepromazina (200 mg/gato, 0,4 y 0,1 mg/kg, respectivamente; basal) en el punto final (T0) y después de 15 min del punto final (T15).
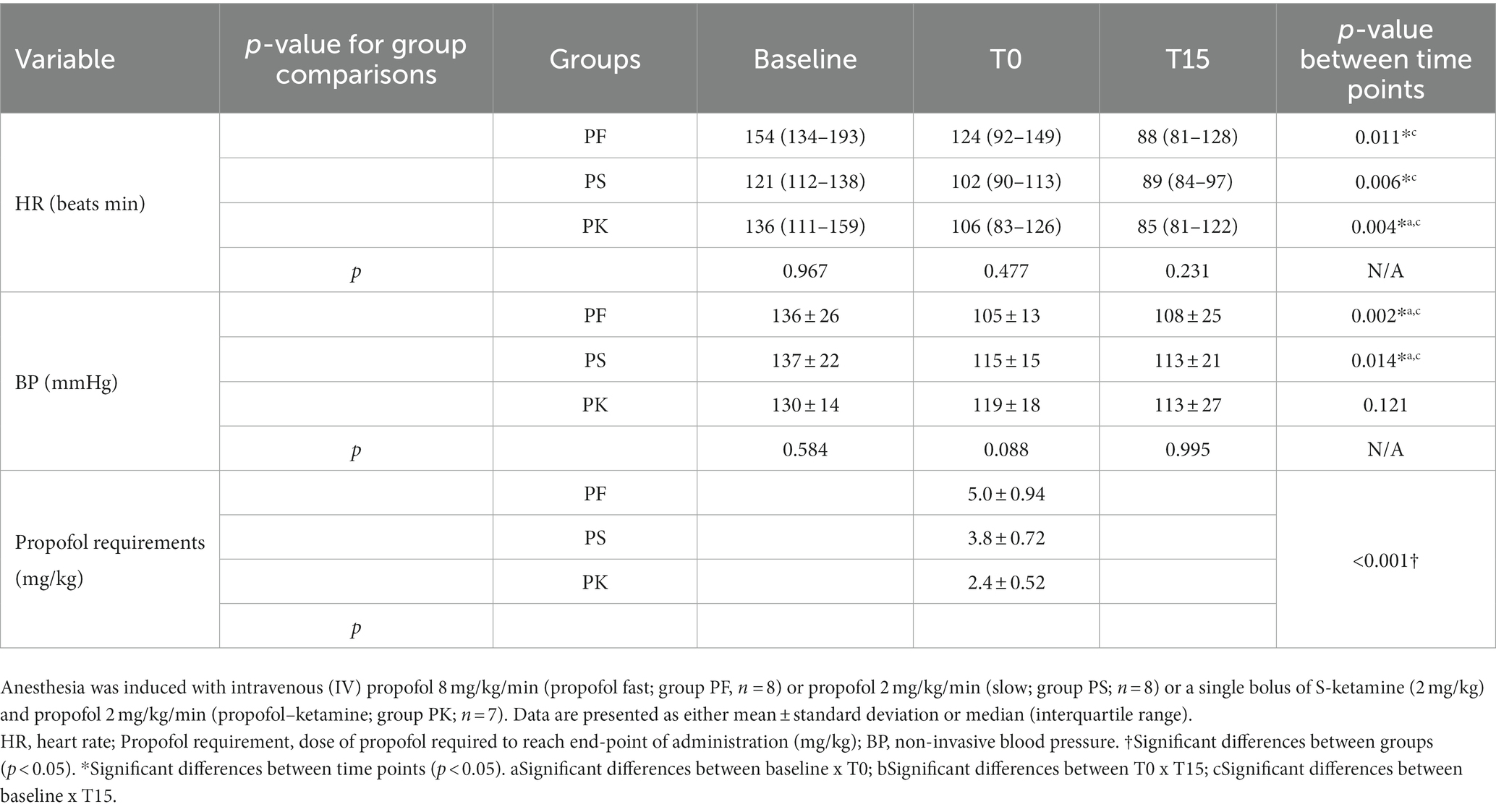 Tabla 3. Frecuencia cardíaca (FC), presión arterial no invasiva (PA) y necesidades de propofol de gatos machos sanos premedicados con gabapentina-butorfanol-acepromazina (200 mg/gato, 0,4 y 0,1 mg/kg, respectivamente; valor basal), en el punto final (T0) y después de 15 min del punto final (T15).
Tabla 3. Frecuencia cardíaca (FC), presión arterial no invasiva (PA) y necesidades de propofol de gatos machos sanos premedicados con gabapentina-butorfanol-acepromazina (200 mg/gato, 0,4 y 0,1 mg/kg, respectivamente; valor basal), en el punto final (T0) y después de 15 min del punto final (T15).
5 Discusión
Este estudio mostró que, cuando se realizaron comparaciones dentro del grupo, la administración de propofol a una frecuencia rápida o en combinación con S-ketamina produjo cambios significativos en algunas variables ecocardiográficas de la función ventricular izquierda en gatos machos sanos (p. ej., LVIDd, FS%, CO y FC), lo que no fue estadísticamente significativo con el grupo de tasa lenta de propofol. Sin embargo, las comparaciones entre los tratamientos no fueron significativamente diferentes en ningún momento, lo que puede mostrar que los cambios observados en este estudio podrían deberse a variaciones individuales dentro de cada grupo. En otras palabras, no se sabe si los cambios significativos en las variables ecocardiográficas fueron realmente de relevancia clínica en relación con los grupos de tratamiento o como resultado de las respuestas individuales al tratamiento dentro del grupo.
La cantidad de propofol requerida para alcanzar un punto final definido (T0) difirió significativamente entre los tres grupos. En particular, los requerimientos de propofol en PF (5,0 ± 0,9 mg/kg) fueron mayores que los de PS (3,8 ± 0,7 mg/kg), como mostraron previamente Bauquier et al. (2017) (24) y Raillard & Murison (2018) (25), en gatos y perros, respectivamente. Estos hallazgos confirman que la tasa de administración es importante para disminuir los requerimientos de propofol y probablemente sus efectos adversos relacionados con el fármaco, incluso cuando se dirige al mismo punto final. La razón principal de este mayor requerimiento de propofol en la PF es que el tiempo de administración es más corto que el tiempo para alcanzar el equilibrio entre las concentraciones plasmáticas y cerebrales (8). Como consecuencia, se produce un retraso en los efectos clínicos de la anestesia, con impacto en las dosis administradas con propofol en T0. Aunque la coadministración de S-ketamina mostró el menor requerimiento de dosis de propofol (2,4 ± 0,5 mg/kg) de todos los tratamientos, como lo demostraron previamente Ilkiw et al. (2003) (9), este efecto ahorrador de dosis no fue suficiente para atenuar los cambios en las variables ecocardiográficas. No hubo diferencias en la cantidad total requerida de infusión de propofol a lo largo del estudio entre los protocolos de PF, PS y PK (2,0 ± 0,3 ml; 2,2 ± 0,8 ml; y 2,1 ± 0,5 ml, respectivamente).
El volumen telediastólico está determinado por la precarga, la distensibilidad y el tiempo de llenado diastólico (12). La precarga se asocia con la tensión de la pared del ventrículo izquierdo al final de la diástole y la relación presión-volumen (12). Nuestros hallazgos demuestran que el LVIDd no cambió significativamente con el tiempo con la administración rápida o lenta de propofol. Sin embargo, se observó un aumento en el LVIDd cuando el propofol se combinó con S-ketamina. En resumen, la relación entre la FC, el tiempo de llenado diastólico y el volumen diastólico final está relacionada y puede variar en función de diferentes factores (12). Por ejemplo, una disminución de la FC aumenta potencialmente el tiempo de llenado diastólico y el volumen diastólico final, lo que podría explicar algunos de nuestros hallazgos (12). Se ha informado que la ketamina tiene efectos simpaticomiméticos, lo que resulta en un aumento de la FC, el CO, la presión venosa central y la presión arterial media (26). Sin embargo, la depresión hemodinámica puede ocurrir después de la administración de ketamina en animales con tono simpático reducido (27). Cabe destacar que el bloqueo de los receptores adrenérgicos puede contrarrestar los efectos simpaticomiméticos indirectos de la ketamina. La evidencia in vitro sugiere que los efectos inotrópicos positivos de la ketamina están mediados por la activación de los receptores cardíacos β-adrenérgicos, y la ketamina parece tener un efecto depresor sobre el músculo cardíaco denervado (28). Según Ward et al. (2012) (14), se notificó una leve disminución de la LVIDd (14) en gatos sedados con acepromazina (0,1 mg/kg), en combinación con butorfanol (0,25 mg/kg) con o sin ketamina (1,5 mg/kg). Los hallazgos del presente estudio indicaron que los cambios observados al usar propofol en combinación con S-ketamina podrían deberse a un bloqueo inespecífico de los receptores adrenérgicos potencialmente causado por la premedicación con acepromazina y/o a la reducción del tono simpático causado por la gabapentina, como lo muestran Allen et al. (2021) (29). La acepromazina antagoniza los receptores adrenérgicos α-1, lo que conduce a una disminución de la resistencia vascular periférica, hipotensión e hipotermia, incluso sin producir cambios significativos en las mediciones ecocardiográficas en gatos (30). Los gatos de todos los grupos de nuestro estudio recibieron gabapentina-acepromazina-butorfanol; Sin embargo, debido al diseño del estudio, no es posible aislar los efectos específicos de cada uno de estos fármacos, ya que es probable que se produzcan interacciones.
El acortamiento fraccional (FS%) es una medida ecocardiográfica ampliamente utilizada para la evaluación de la función ventricular izquierda (31). Es un sustituto de la función sistólica y no una medida de la contractilidad (32). La contractilidad radial, la precarga, la poscarga (32) y la FC contribuyen al FS% (31). La infusión lenta de propofol no produjo cambios estadísticamente significativos en el FS%. Se observó una reducción estadísticamente significativa del FS% en T0 en PF (47 a 34%) y PK (42 a 36%), pero no en PS (45 a 37%). El PS tuvo un mayor efecto sobre el FS% que el PK; sin embargo, la prueba estadística no logró rechazar la hipótesis nula. Este efecto podría deberse a una reducción del volumen telediastólico ventricular como resultado de la disminución de la resistencia vascular sistémica (RVS) causada por el propofol, lo que resultaría en una disminución de la precarga y, en consecuencia, una reducción del FS%. La función ventricular también puede evaluarse mediante el porcentaje de EF, que representa la diferencia fraccional entre los volúmenes telediastólico y telesistólico, es decir, el volumen sistólico fraccionado. En cuanto a FS%, EF% depende en gran medida de la contractilidad, la precarga y la poscarga. En nuestro estudio, el FE% se mantuvo dentro del rango normal y no cambió con el tiempo ni entre los grupos. Estos hallazgos sugieren una estabilidad razonable en los determinantes del volumen sistólico. Cabe destacar que si una reducción en el retorno venoso disminuye la PA y no se percibe una disminución en el volumen telesistólico, como se observa en ambos grupos de propofol, es probable que se presente un efecto inotrópico negativo; Sin embargo, esto no puede confirmarse sin una investigación más profunda (33). El análisis de la deformación miocárdica mediante ecocardiografía de seguimiento de manchas podría detectar la insuficiencia miocárdica local (34) y debe considerarse en futuros estudios para futuras investigaciones sobre el efecto inotrópico negativo del propofol.
La presión arterial no invasiva se redujo estadísticamente con tasas rápidas y lentas de propofol, pero no cuando el fármaco se administró conjuntamente con S-ketamina. Por lo tanto, todavía se observó una ligera disminución de la PA en la PK. Esto contrasta con un estudio en el que los gatos bajo anestesia con propofol-ketamina mostraron una mejora en la presión arterial media, mientras que otras variables cardiovasculares permanecen sin cambios (9). El efecto simpaticomimético de la ketamina aumenta la resistencia vascular periférica (9), contrarrestando teóricamente los efectos vasodilatadores del propofol y su impacto sobre la PA. Independientemente de la velocidad de infusión de propofol, la reducción transitoria de la PA observada en este estudio sugiere que el propofol reduce la precarga del VI por vasodilatación. En perros, la resistencia vascular sistémica disminuyó inmediatamente después de la inducción de la anestesia con propofol-ketamina, y la presión arterial media se mantiene estable (35). Los estudios sugieren que el propofol bloquea el Ca2+ induciendo aún más la liberación de óxido nítrico endotelial y la activación de la proteína quinasa C (36). A pesar de la reducción de la presión arterial, la lenta administración de propofol no hizo que la PA disminuyera por debajo de 90 mmHg en gatos (23).
El gasto cardíaco es una parte fundamental del rendimiento cardíaco y de la función ventricular (20). Dado que el CO involucra el producto de la FC y el volumen sistólico, puede verse influenciado por el inotropismo, la lusiotropía, la precarga y la poscarga. A pesar de que la termodilución se considera el estándar de oro para la obtención de CO, la evaluación Doppler del flujo pulmonar ha sido validada en perros anestesiados con propofol (20). A pesar de la reducción del CO observada en la administración rápida de propofol en T15, solo fue estadísticamente significativa cuando se utilizó S-ketamina en combinación con propofol. Cabe destacar que se observaron comparaciones dentro de los grupos, pero no entre los grupos. Por lo tanto, la posibilidad de un error de tipo II podría atribuirse a una muestra sin alimentación. Además, esta técnica no está validada en gatos, lo que disminuye la fiabilidad al no tener valores de referencia. A diferencia de los cambios en el FS% que fueron transitorios, se observaron disminuciones en la FC hasta el T15. Se observó bradicardia pronunciada (< 100 lpm) después de la administración rápida de propofol e incluso cuando el fármaco se administró en combinación con S-ketamina; sin embargo, hubo una marcada variabilidad de la FC entre los protocolos de este estudio que podría haber interferido con los resultados. De hecho, es de alguna manera sorprendente que la S-ketamina no aumentara la FC y previniera la bradicardia debido a la estimulación simpática. Se puede observar bradicardia después de la administración de propofol, ya que el fármaco disminuye la precarga principalmente debido a la inhibición simpática y a la disminución de la actividad de los barorreceptores y de los mecanismos compensatorios fisiológicos, incluida la taquicardia refleja (3, 10). Aunque se identificaron algunas diferencias significativas dentro de los grupos y se observó variabilidad individual en algunos gatos que presentaban un alto tono simpático, es imperativo evaluar la relevancia clínica de estos hallazgos, ya que la mayoría de ellos fueron transitorios y probablemente no perjudiciales para esta población de estudio. Sin embargo, estos efectos podrían haber sido relevantes en gatos con comorbilidades y/o deshidratación e hipovolemia durante el procedimiento de sedación. Además, otros factores pueden influir en la FC (y en el sistema cardiovascular), como el tono autónomo, el volumen circulante, la temperatura y la edad (37).
La gabapentina, un análogo del neurotransmisor ácido γ-aminobutírico (GABA), es recomendada por la Sociedad Internacional de Medicina Felina y la Asociación Americana de Practicantes Felinos en interacciones veterinarias previas, para reducir las respuestas de miedo y ansiedad en gatos con problemas emocionales (17). La catecolamina liberada debido al estrés puede conducir a la vasoconstricción y aumentar el tono simpático, aumentando los requerimientos de propofol (38). En este estudio, se evitó la manipulación excesiva y la medición de los valores ecocardiográficos basales antes de la premedicación, y se administró gabapentina. El uso de gabapentina antes de la manipulación reduce los comportamientos similares al miedo y la agresividad, al tiempo que mejora las puntuaciones de cumplimiento (39). El fármaco reduce el tono simpático (con FS% reducido), pero los parámetros sistólicos se mantienen dentro de los rangos normales de referencia (29). Los autores utilizaron gabapentina para reducir el comportamiento inducido por el miedo y evitar mayores variaciones en la liberación de catecolaminas durante la manipulación.
Este estudio tiene limitaciones. El tamaño de la muestra fue pequeño y no se pudo realizar un ensayo cruzado ya que los gatos formaban parte de un programa de esterilización y castración. La ecocardiografía basal antes de la gabapentina habría sido relevante para el estudio; sin embargo, esto se vio impedido por el posible estrés adicional inducido por la manipulación. La inclusión de puntuaciones de sedación habría sido beneficiosa para discriminar los efectos del estrés sobre las variables hemodinámicas. La presión arterial no invasiva se controló mediante ecografía Doppler. En este caso, los valores de la presión arterial sistólica pueden no ser precisos y pueden ser inferiores a los valores obtenidos mediante técnicas invasivas (40). Los gatos no fueron intubados, ya que esta no es una práctica común durante el procedimiento de sedación. Sin embargo, el propofol embota los reflejos laríngeos y faríngeos; Es posible que la regurgitación con aspiración ocurra cuando las vías aéreas no están protegidas, y esta suele ser una de las principales críticas con el uso de dosis «de recarga» de propofol durante la sedación del procedimiento. Se administró oxigenoterapia para prevenir la hipoxemia causada por la hipoventilación, pero esto nunca se confirmó con gasometría arterial. La hipoxemia es poco probable con la suplementación de oxígeno a través de una mascarilla facial ajustada. Por ejemplo, no se observó cianosis ni respuestas simpáticas claras a la desaturación. La falta de monitorización del dióxido de carbono al final de la espiración es una limitación importante en este estudio y no puede excluir la presencia de hipoventilación e hipercapnia con un efecto final en los hallazgos ecocardiográficos. El propofol produce depresión respiratoria dependiente de la dosis al atenuar las respuestas ventilatorias hipóxicas y reducir el volumen corriente, el volumen minuto y la frecuencia respiratoria (7). Por esta razón, cuando se reduce la saturación periférica de oxígeno, la monitorización anestésica básica, el soporte ventilatorio y la oxigenoterapia son importantes para mitigar los efectos adversos inducidos por el propofol en el entorno clínico. Cabe destacar que la infusión de propofol se mantuvo después de T0, lo que podría alterar las lecturas de T15 debido a la redistribución de propofol y al mantenimiento de las concentraciones plasmáticas. Por último, el estudio incluyó protocolos específicos y definidos de administración de fármacos utilizando tasas de infusión en gatos sanos. No se sabe cómo cambiarían las variables ecocardiográficas con bolos de propofol de tasas desconocidas utilizando diferentes dosis y regímenes farmacológicos (incluida la sustitución de S-ketamina por ketamina racémica), puntos finales o poblaciones de gatos con comorbilidades y de diferente edad y sexo. La falta de oxigenación también podría afectar los resultados.
La rápida tasa de administración aumentó los requerimientos de propofol y afectó las variables transitorias de la función sistólica del ventrículo izquierdo en gatos machos sanos. Tanto la administración rápida como lenta de propofol con S-ketamina indujeron cambios en las variables relacionadas con la función ventricular. Estos cambios dentro del grupo no se observaron con la tasa lenta de administración de propofol solo, lo que sugiere un beneficio potencial con el enfoque «lento y constante» durante el procedimiento de sedación. Algunos de estos cambios en las variables ecocardiográficas se mantuvieron dentro de los valores de referencia normales, y todos los protocolos fueron bien tolerados en gatos sanos. La adición de S-ketamina pareció prevenir la disminución de la presión arterial, pero no la bradicardia o la depresión de la función ventricular en gatos que recibieron una administración lenta de propofol.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios con animales fueron aprobados por el Comité de Ética del Hospital Veterinario Docente de la Universidad Federal de Paraná (UFPR, Curitiba, Brasil, nº 024/021). Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
SM: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Recursos, Visualización, Redacción – borrador original, Redacción – revisión y edición. Curación de datos. MU: Curación de datos, Investigación, Software, Redacción – revisión y edición. FA: Investigación, Redacción – Revisión y Edición. LJ: Investigación, Escritura – Revisión y Edición. JV: Investigación, Redacción – Revisión y Edición. PD: Redacción – revisión y edición. RV: Conceptualización, Curación de datos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Validación, Redacción, revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Notas
Referencias
1. Simon, BT, y Steagall, PV. Sedación y analgesia felina: cuándo, por qué y cómo. J Feline Med Surg. (2020) 22:1029–45. doi: 10.1177/1098612X20965830
2. Terrenos, RM, Twigley, AJ, Carli, F, Whitwam, JG y Morgan, M. Los efectos hemodinámicos de la inducción intravenosa. Anestesia. (1985) 40:735–40. doi: 10.1111/j.1365-2044.1985.tb10996.x
3. Sellgren, J, Biber, B, Henriksson, BÅ, Martner, J, y Pontén, J. Los efectos del propofol, la metoexitona y el isoflurano sobre el reflejo barorreceptor en el gato. Acta Anaesthesiol Scand. (1992) 36:784–90. doi: 10.1111/j.1399-6576.1992.tb03565.x
4. Ebert, TJ. Efectos simpáticos y hemodinámicos de la sedación moderada y profunda con Propofol en humanos. Anestesiología. (2005) 103:20–4. doi: 10.1097/00000542-200507000-00007
5. Hino, H, Matsuura, T, Kihara, Y, Tsujikawa, S, Mori, T y Nishikawa, K. Comparación entre los efectos hemodinámicos del propofol y el tiopental durante la inducción de la anestesia general con infusión de remifentanilo: un estudio aleatorizado, estratificado por edad y doble ciego. J Anesth. (2019) 33:509–15. doi: 10.1007/s00540-019-02657-x
6. Yang, C-Y, Luk, H-N, Chen, S-Y, Wu, W-C y Chai, C-Y. El propofol inhibe los mecanismos presores medulares en gatos. Can J Anaesth. (1997) 44:775–81. doi: 10.1007/BF03013394
7. Sahinovic, MM, Struys, MMRF y Absalom, AR. Farmacocinética clínica y farmacodinamia del propofol. Clin Pharmacokinet. (2018) 57:1539–58. doi: 10.1007/s40262-018-0672-3
8. Cattai, A, Rabozzi, R, Ferasin, H, Isola, M y Franci, P. Cambios hemodinámicos durante la inducción de propofol en perros: nuevos hallazgos y enfoque de monitoreo. BMC Vet Res. (2018) 14:1–8. doi: 10.1186/s12917-018-1608-8
9. Ilkiw, JE, Pascoe, PJ y Tripp, LD. Efecto del propofol en dosis variable solo y en combinación con dos dosis fijas de ketamina para la anestesia intravenosa total en gatos. Am J Vet Res. (2003) 64:907–12. doi: 10.2460/ajvr.2003.64.907
10. Ilkiw, JE, y Pascoe, PJ. Efectos cardiovasculares del propofol solo y en combinación con ketamina para la anestesia intravenosa total en gatos. Am J Vet Res. (2003) 64:913–7. doi: 10.2460/ajvr.2003.64.913
11. Zonca, A, Ravasio, G, Gallo, M, Montesissa, C, Carli, S, Villa, R, et al. Farmacocinética de la combinación de ketamina y propofol administrada como ketofol mediante infusión continua en gatos. J Vet Pharmacol Ther. (2012) 35:580–7. doi: 10.1111/j.1365-2885.2012.01377.x
12. Fukuta, H, y Little, WC. El ciclo cardíaco y las bases fisiológicas de la contracción, eyección, relajación y llenado del ventrículo izquierdo. A Clin le falla el corazón. (2008) 4:1–11. doi: 10.1016/j.hfc.2007.10.004
13. Cardoso, HM, Tocheto, R, Padilha, VS, Silva, G, Comassetto, F, de Andrade, JNBM, et al. Evaluación ecocardiográfica de perros sometidos a diferentes protocolos de inducción anestésica. Cienc Rural. (2018) 48:e20170659. doi: 10.1590/0103-8478cr2
14. Ward, JL, Schober, KE, Fuentes, VL, y Bonagura, JD. Efectos de la sedación sobre las variables ecocardiográficas de la función auricular izquierda y ventricular izquierda en gatos sanos. J Feline Med Surg. (2012) 14:678–85. doi: 10.1177/1098612X12447729
15. Lazzarini, E, Martinelli, E, Brioschi, FA, Gioeni, D, Corneliani, RT, y Carotenuto, AM. Alfaxalona intramuscular y metadona con o sin ketamina en gatos sanos: efectos sobre la sedación y las mediciones ecocardiográficas. Veterinario Anaesth Analg. (2020) 47:621–30. doi: 10.1016/j.vaa.2020.02.010
16. Luis Fuentes, V, Abbott, J, Chetboul, V, Côté, E, Fox, PR, Häggström, J, et al. Directrices de declaración de consenso de ACVIM para la clasificación, el diagnóstico y el tratamiento de las miocardiopatías en gatos. J Veterinario Pasante Med. (2020) 34:1062–77. doi: 10.1111/jvim.15745
17. Rodan, I, Dowgray, N, Carney, HC, Carozza, E, Ellis, SL, Heath, S, et al. 2022 AAFP/ISFM cat friendly veterinary interaction guidelines: approach and handling techniques. J Feline Med Surg. (2022) 24:1093–132. doi: 10.1177/1098612X221128760
18. Steagall, PV, Benito, J, Monteiro, BP, Doodnaught, GM, Beauchamp, G, y Evangelista, MC. Efectos analgésicos de la gabapentina y la buprenorfina en gatos sometidos a ovariohisterectomía utilizando dos sistemas de puntuación del dolor: un ensayo clínico aleatorizado. J Feline Med Surg. (2018) 20:741–8. doi: 10.1177/1098612X17730173
19. Thomas, WP, Gaber, CE, Jacobs, GJ, Kaplan, PM, Lombard, CW, Vet, M, et al. Recomendaciones para los estándares en ecocardiografía transtorácica bidimensional en perro y gato. J Veterinario Pasante Med. (1993) 7:247–52. doi: 10.1111/j.1939-1676.1993.tb01015.x
20. Lopes, PCF, Sousa, MG, Camacho, AA, Carareto, R, Nishimori, CT, Santos, PS, et al. Comparación entre dos métodos para la medición del gasto cardíaco en perros anestesiados con propofol: termodilución y Doppler. Veterinario Anaesth Analg. (2010) 37:401–8. doi: 10.1111/j.1467-2995.2010.00552.x
21. Chetboul, V, Sampedrano, CC, Tissier, R, Gouni, V, Saponaro, V, Nicolle, AP, et al. Evaluación cuantitativa de las velocidades del anillo de la válvula auriculoventricular izquierda y de la pared libre del ventrículo izquierdo en gatos sanos mediante el uso de imágenes Doppler tisulares bidimensionales en color. Am J Vet Res. (2006) 67:250–8. doi: 10.2460/ajvr.67.2.250
22. Häggström, J, Andersson, O, Falk, T, Nilsfors, L, Oisson, U, Kresken, JG, et al. Efecto del peso corporal en las mediciones ecocardiográficas en 19.866 gatos de raza pura con o sin cardiopatía. J Veterinario Pasante Med. (2016) 30:1601–11. doi: 10.1111/jvim.14569
23. Robertson, SA, Gogolski, SM, Pascoe, P, Shafford, HL, Sager, J y Griffenhagen, GM. Pautas de anestesia felina de la AAFP. J Feline Med Surg. (2018) 20:602–34. doi: 10.1177/1098612X18781391
24. Bauquier, SH, Bayldon, W, Warne, LN, Carter, JE, y Beths, T. Influencia de dos tasas de administración de propofol en la inducción de la anestesia en su potencia relativa en gatos: un estudio piloto. J Feline Med Surg. (2017) 19:1297–301. doi: 10.1177/1098612X16689175
25. Raillard, M, Love, EJ, y Murison, PJ. Efecto de la predosificación versus la administración lenta de propofol sobre la dosis requerida para la inducción anestésica y sobre las variables fisiológicas en perros sanos. Veterinario Anaesth Analg. (2018) 45:414–22. doi: 10.1016/j.vaa.2018.02.004
26. Mazzeffi, M, Johnson, K y Paciullo, C. Ketamina en cirugía cardíaca de adultos y la unidad de cuidados intensivos de cirugía cardíaca: una revisión clínica basada en la evidencia. Ann Card Anaesth. (2015) 18:202. doi: 10.4103/0971-9784.154478
27. Basagan-Mogo, E, Goren, S, Korfali, G, Turker, G, y Kaya, FN. Inducción de la anestesia en la cirugía de injerto de derivación de la arteria coronaria: los efectos hemodinámicos y analgésicos de la ketamina. Clínicas. (2010) 65:133–8. doi: 10.1590/S1807-59322010000200003
28. Cook, DJ, Carton, EG, y Housmans, PR. Mecanismo del efecto inotrópico positivo de la ketamina en el músculo papilar ventricular aislado del hurón. Anestesiología. (1991) 74:880–8. doi: 10.1097/00000542-199105000-00013
29. Allen, ME, LeBlanc, NL, y Scollan, KF. Efectos hemodinámicos, ecocardiográficos y sedantes de la gabapentina oral en gatos sanos. J Am Anim Hosp Assoc. (2021) 57:278–84. doi: 10.5326/jaaha-ms-7081
30. Kim, B, Jang, M, Sohn, J, Oh, H, Jo, S, Choi, M, et al. Efectos de la alfaxalona/acepromazina intramuscular en las mediciones ecocardiográficas, bioquímicas y de gases en sangre en gatos sanos. J Am Anim Hosp Assoc. (2019) 55:70–7. doi: 10.5326/JAAHA-MS-6630
31. Carvalho, ER, Champion, T, Ambrosini, F, da Silva, GA, Freitas, GC, de Castro, D’O, et al. Dosis baja de dexmedetomidina seguida de infusión de velocidad constante y antagonismo por atipamezol en gatos anestesiados con isoflurano: un estudio ecocardiográfico. Veterinario Anaesth Analg. (2019) 46:43–54. doi: 10.1016/j.vaa.2018.09.040
32. Borow, KM, Green, LH, Grossman, W y Braunwald, E. Relaciones entre el acortamiento del estrés telesistólico y la longitud del estrés en humanos. Am J Cardiol. (1982) 50:1301–8. doi: 10.1016/0002-9149(82)90467-2
33. Yang, HS, Song, BG, Kim, JY, Kim, S-N y Kim, T-Y. Impacto de la inducción de la anestesia con propofol en la función cardíaca en pacientes de bajo riesgo, medido por imágenes tisulares Doppler intraoperatorias. J Am Soc Ecocardiogr. (2013) 26:727–35. doi: 10.1016/j.echo.2013.03.016
34. Takano, H, Isogai, T, Aoki, T, Wakao, Y y Fujii, Y. Viabilidad del análisis de deformación radial y circunferencial mediante ecocardiografía de seguimiento de motas 2D en gatos. J Vet Med Sci. (2015) 77:193–201. doi: 10.1292/jvms.13-0241
35. Henao-Guerrero, N, y Riccó, CH. Comparación de los efectos cardiorrespiratorios de una combinación de ketamina y propofol, propofol solo, o una combinación de ketamina y diazepam antes y después de la inducción de la anestesia en perros sedados con acepromazina y oximorfona. Am J Vet Res. (2014) 75:231–9. doi: 10.2460/ajvr.75.3.231
36. Larsen, JR, Torp, P, Norrild, K y Sloth, E. El propofol reduce los marcadores Doppler tisulares de la función del ventrículo izquierdo: un estudio ecocardiográfico transtorácico. Hno. J Anaesth. (2007) 98:183–8. doi: 10.1093/bja/ael345
37. Tilley, LP, Smith, FWK, Oyama, MA, y Sleeper, MM. Manual de cardiología canina y felina. Elsevier Inc. 4ª Edn. (2008):78–98. doi: 10.1016/B978-1-4160-2398-2. X0032-0
38. Argüelles, J, Echaniz, M, Bowen, J, y Fatjó, J. Impacto de un protocolo de reducción del estrés en la calidad de la preanestesia en gatos. Rec. Veterinario (2021) 188:E138. DOI: 10.1002/VTR.138
39. Kruszka, M, Graff, E, Medam, T y Masson, S. Evaluación clínica de los efectos de una dosis oral única de gabapentina sobre los comportamientos agresivos basados en el miedo en gatos durante los exámenes veterinarios. J Am Vet Med Assoc. (2021) 259:1–7. doi: 10.2460/javma.20.06.0307
Palabras clave: felino, propofol, sedación procedimental, S-ketamina, cardiovascular
Cita: Marangoni S, Ubiali M, Ambrosini F, Jahnel L, Vilani JM, Steagall PV y Vilani RGD’OC (2023) Efectos de diferentes tasas de propofol con o sin S-ketamina sobre la función ventricular en gatos sanos: un estudio aleatorizado. Frente. Vet. Sci. 10:1272949. doi: 10.3389/fvets.2023.1272949
Recibido: 04 de agosto de 2023; Aceptado: 24 de noviembre de 2023;
Publicado: 11 diciembre 2023.
Editado por:
Ryou Tanaka, Universidad de Agricultura y Tecnología de Tokio, Japón
Revisado por:
Gregg Mitchell Griffenhagen, Universidad Estatal de Colorado, Estados Unidos Daniel Sakai, Universidad de Georgia, Estados
Unidos
Derechos de autor © 2023 Marangoni, Ubiali, Ambrosini, Jahnel, Vilani, Steagall y Vilani. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Sabrine Marangoni, sabrine.marangoni@umontreal.ca
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


