Efectos de la adición de Sophora alopecuroides a la dieta alta en concentrados

Efectos de la adición de Sophora alopecuroides a la dieta alta en concentrados sobre los parámetros de fermentación ruminal y la diversidad microbiana de las ovejas
 Yawen An1
Yawen An1  Hairong Wang1,2*
Hairong Wang1,2*  Zichao Zong1
Zichao Zong1  Zhixiong Gao1
Zhixiong Gao1  Caixia Shi1,2
Caixia Shi1,2  Shufang Li1
Shufang Li1  Khas-Erdene1,2
Khas-Erdene1,2- 1Facultad de Ciencia Animal, Universidad Agrícola de Mongolia Interior, Hohhot, Mongolia Interior, China
- 2Laboratorio clave de nutrición animal, nutrición animal y ciencia de la alimentación, Hohhot, Mongolia Interior, China
Objetivo: El propósito de este estudio fue investigar los efectos de diferentes dosis de Sophora alopecuroides (SA) sobre la fermentación ruminal y la diversidad microbiana de las ovejas.
Métodos: Un total de 32 corderos machos mestizos Dumont sanos que pesaban 25,73 ± 2,17 kg fueron asignados aleatoriamente a 4 grupos de tratamiento con 8 réplicas cada uno: un grupo de control (GC) alimentado con una dieta basal con una relación concentrado-forraje de 7:3 y tres grupos experimentales: el grupo 0,1% (TG1), el grupo 0,3% (TG2) y el grupo 0,5% (TG3), que fueron alimentados con la misma dieta basal pero suplementados con dosis crecientes de SA.
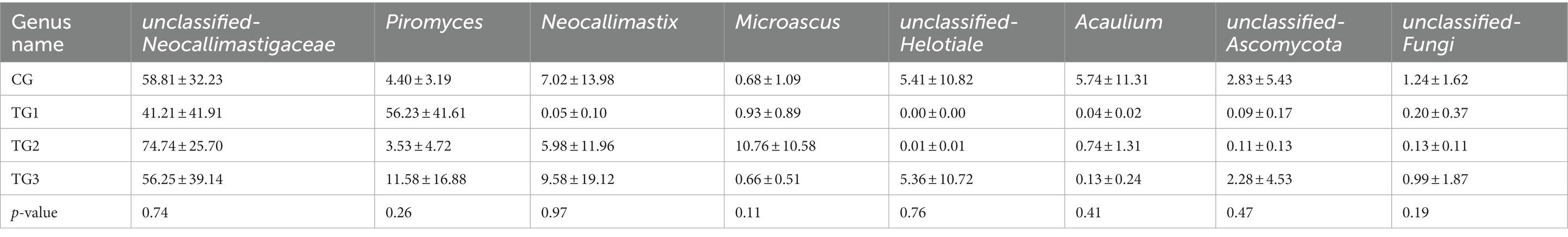
Resultados: (1) El aumento de la dosis de SA condujo a un aumento lineal significativo (p-< 0,05) en las concentraciones de acetato, propionato, butirato y ácido graso volátil total (AGTV) en el rumen, así como un efecto cuadrático significativo (p-< 0,05) sobre la concentración de propionato. En contraste, hubo una disminución lineal significativa (p-< 0,05) en el NH3-Concentración de N en el rumen. (2) A nivel de los filos bacterianos ruminales, la abundancia de Bacteroidetes en el rumen aumentó, y la de Firmicutes disminuyó (p = 0,08). A nivel de género, las abundancias ruminales de Ruminococcus y Phocaeicola de ovejas en los tres grupos experimentales fueron significativamente mayores que en el grupo control (p-< 0,05), y las abundancias de Clostridiales y Candidatus-Hepatincola aumentaron significativamente en los grupos 0,1% y 0,3% (p < 0,05). (3) Con respecto a los hongos anaerobios ruminales, las diferencias entre el grupo control y los grupos experimentales a nivel de filo y género no fueron significativas (p > 0,05), pero las abundancias relativas de Neocallimastigomycota y Piromyces en el grupo 0,1% fueron significativamente mayores que en el grupo control.
Conclusión: La adición de SA a una dieta alta en granos podría aumentar la concentración de AGV y el pH en el rumen de las ovejas, reducir el NH3-Concentración de N en el rumen y mejorar la función de fermentación ruminal. Aunque no hubo cambios significativos en la diversidad bacteriana o fúngica ruminal, la adición de SA aumentó la abundancia ruminal de Bacteroidetes, Ruminococcus, Phocaeicola, Clostridiales, Neocallimastigomycota y Piromyces, disminuyó la abundancia ruminal de Firmicutes y tuvo un efecto positivo en la microbiota ruminal para mejorar la salud de las ovejas
1. Introducción
La condición necesaria para mejorar el rendimiento de los rumiantes y mantener su salud del organismo es mantener el equilibrio de la microecología ruminal, mientras que el equilibrio del microecosistema ruminal depende principalmente de la dieta. En los últimos años, con el fin de acortar el ciclo de alimentación, acelerar la rotación y maximizar los beneficios económicos, los agricultores han comenzado a alimentar con dietas altas en concentrados a ovejas de engorde y vacas de alto rendimiento. Según informes relevantes, la fermentación de dietas altas en granos en el rumen podría causar fácilmente la acumulación de ácidos grasos volátiles de cadena corta en el rumen, lo que resulta en una disminución del pH, lo que a su vez podría conducir a cambios en la microbiota ruminal y acidosis ruminal subaguda (SARA) en casos graves (1, 2), afectando así la salud del organismo. Aunque la alimentación con antibióticos puede proporcionar cierto alivio, han sido prohibidos debido a su capacidad para causar resistencia a los medicamentos en los animales y residuos en los productos pecuarios, que son perjudiciales para la salud humana (3). Por lo tanto, encontrar sustitutos de los antibióticos para mantener a los animales sanos se ha convertido en un punto caliente de investigación en los últimos años.
Sophora alopecuroides, una medicina herbal china, pertenece al género Sophora de Leguminosae, que se distribuye principalmente en áreas desérticas como Mongolia Interior y Ningxia (4). Es rico en alcaloides, flavonoides, aminoácidos, ácidos grasos y otros componentes (5). Entre ellos, los alcaloides son sus principales principios activos, con efectos antiinflamatorios e hipolipidémicos, inmunomoduladores (6). Y se utiliza principalmente para el tratamiento de hemorragias gastrointestinales en animales monogástricos (7). Algunos estudios han encontrado que los alcaloides pueden inhibir eficazmente el crecimiento de bacterias dañinas, promover la proliferación de bacterias beneficiosas, mejorar la microflora en el tracto intestinal de los pollos de engorde y promover el desarrollo de la estructura de las vellosidades del intestino delgado en pollos de engorde, y mejorar la función de absorción del intestino delgado (8). Jia et al. (9) demostraron que 75-300 mg/kg de alcaloides SA mejoraron significativamente la colitis inducida por sulfato de sodio de dextrano (DSS) en ratones, inhibieron la expresión de IL-1β y TGF-β1 y regularon al alza la expresión de IL-10. Además, los experimentos in vivo con ratones para establecer modelos de gastritis por Helicobacter pylori mostraron que los alcaloides totales de Sophora alopecuroides (TASA) combinados con pectina de bismuto u omeprazol podrían reducir efectivamente los niveles de expresión de IL-8, COX-2 y NF-κB en la mucosa gástrica infectada con Helicobacter pylori, aliviando así la inflamación de la mucosa gástrica (10). Li et al. (11) utilizaron 60 mg/kg de TASA para la perfusión intraperitoneal en ratas con colitis ulcerosa (CU) y encontraron que los alcaloides de S. alopecuroides pueden mantener un equilibrio entre los factores proinflamatorios y antiinflamatorios al aumentar los niveles de proteínas protectoras, aliviando así el grado de inflamación y regulando la respuesta inmune local en el intestino. Los resultados de estudios previos revelaron que los estudios limitados de SA y sus extractos sobre la salud gastrointestinal se centraron principalmente en animales monogástricos, mientras que se informaron pocos estudios en rumiantes. Los experimentos in vitro preliminares del grupo mostraron que agregar 0.1-0% de SA a la dieta tuvo efectos positivos sobre la fermentación ruminal en ovejas bajo dietas altas en concentrados (4), pero los efectos específicos, las cantidades adecuadas de aditivos y los mecanismos de acción no estaban claros y necesitaban más estudio.
Por lo tanto, planteamos la hipótesis de que la adición de diferentes dosis de SA a las dietas de alta concentración para ovejas mitigaría los peligros producidos por las dietas altas en concentrados en el organismo animal a través de los patrones cambiantes del entorno ruminal y la diversidad microbiana (bacterias y hongos ruminales). Nuestro objetivo fue revelar el efecto y el mecanismo de acción de SA sobre la función de fermentación ruminal, y proporcionar una base teórica para la prevención y el tratamiento de la acidosis ruminal subaguda y la mejora de la salud corporal de los rumiantes en condiciones de alto concentrado mediante el uso de SA como aditivo para piensos.
2. Materiales y métodos
Todos los procedimientos experimentales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Agrícola de Mongolia Interior y se ajustaron a las regulaciones nacionales de bienestar animal.
2.1. Diseño experimental y composición de la dieta
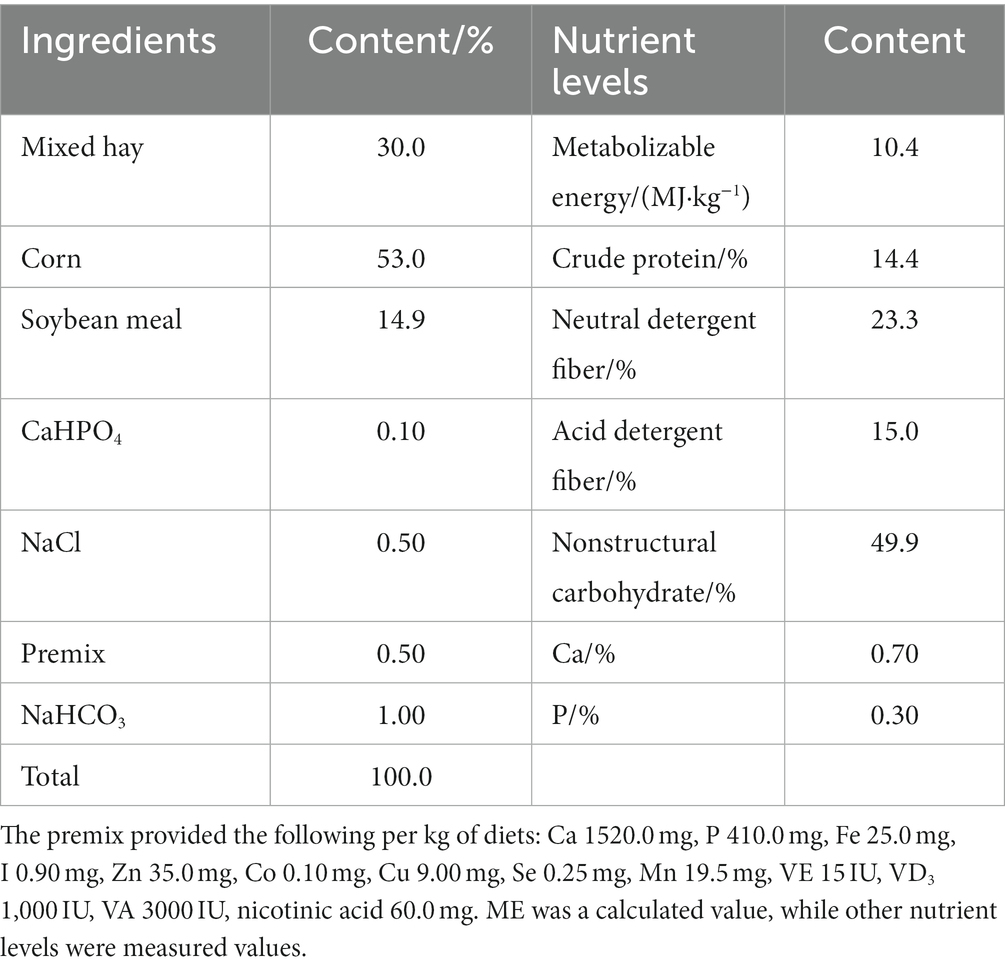
En este experimento, treinta y dos corderos machos cruzados de Dumont de 3 meses de edad (25,73 ± 2,17 kg) se dividieron en 4 grupos de 8 corderos cada uno para la inmunización y la desparasitación en un diseño de ensayo completamente aleatorizado unidireccional. El período de prueba fue de 15 días para la prueba preliminar y 60 días para la prueba principal, en la que el grupo control (GC) fue alimentado con la dieta basal; el grupo TG1 fue alimentado con la dieta basal +0,1% SA; el grupo TG2 fue alimentado con la dieta basal +0,3% SA; y el grupo TG3 fue alimentado con la dieta basal +0,5% SA. La dieta experimental se diseñó de acuerdo con la tabla de ingredientes comunes de alimentos y valor nutricional de las ovejas chinas (NY/T 816-2004), y la fórmula de la dieta y los ingredientes nutricionales se muestran en la Tabla 1.
Fuente y método de aplicación de SA: Fue comprado a Yanchi, Ningxia. Después de ser pulverizado y tamizado, se mezcló con el suplemento concentrado en la proporción de adición correspondiente para la alimentación y la cantidad de adición se seleccionó en base a la prueba in vitro preliminar realizada por nuestro grupo de investigación (12). El contenido de alcaloides totales (principales sustancias activas) en SA es del 5,75% por espectrofotometría de colorante ácido, y la tasa de recuperación es del 95,95%.
2.2. Gestión de la alimentación
El experimento de alimentación se llevó a cabo en el pasto experimental de enseñanza de la Universidad Agrícola de Mongolia Interior. El cobertizo de ovejas fue desinfectado a fondo antes del experimento. Durante el experimento, las ovejas experimentales fueron asignadas aleatoriamente a jaulas de hierro de 1,5 × 1 × 1 m para la alimentación en jaula única de acuerdo con el principio de no diferencia significativa en el peso corporal entre los grupos. La temperatura y la humedad del cobertizo de ovejas se mantuvieron a 15-20 ° C y 50-60%, respectivamente, con ventilación natural. Las ovejas experimentales fueron alimentadas dos veces al día a las 08:00 y 18:00, con acceso gratuito a alimento y agua.
2.3. Índice de recogida y determinación de muestras
2.3.1. Indicadores del entorno ruminal
En la última etapa de la alimentación formal, el líquido ruminal se recolectó 0 h antes de la ingesta, 2 h, 4 h, 6 h, 8 h y 10 h después de la ingesta utilizando el método de muestreo oral, y el líquido ruminal se filtró a través de cuatro capas de gasa, midió el pH ruminal del líquido ruminal, que luego se colocó en un tubo de centrífuga y se almacenó a -20 ° C para la determinación de ácidos grasos volátiles (AGV) y amoníaco nitrógeno (NH3-N) contenidos.
2.3.2. Diversidad microbiana ruminal
Después de la prueba principal, cinco ovejas de peso corporal similar en cada grupo fueron seleccionadas para el sacrificio y recolectaron el quimo ruminal, dividido en tubos centrífugos estériles libres de enzimas y almacenados en nitrógeno líquido. La secuenciación de alto rendimiento de ADNr 16S e ITS rDNA fue analizada por Shanghai Meiji Biological Technology Co., Ltd., y la plataforma de secuenciación MiSeq PE300 detectó la diversidad microbiana para analizar la composición y abundancia de especies de la comunidad a nivel de filo y género. Hemos cargado los datos de secuenciación de 16S rDNA e ITS rDNA en Sequence Read Archive (SRA) en NCBI (BioProject id: PRJNA963087).
2.4. Proceso de secuenciación
En primer lugar, se extrajo el ADN de la muestra, se sintetizaron cebadores específicos con código de barras en la región del ensayo y se utilizó el ADN total de las muestras extraídas como plantilla para seleccionar cebadores específicos para regiones de alta variación de ARNr 16S bacteriano e ITS fúngico para amplificación por PCR utilizando un instrumento de PCR ABI GeneAmp® 9700. Los productos de PCR de las mismas muestras se mezclaron y se detectaron mediante electroforesis en gel de agarosa al 2% para detectar los productos de PCR, y los productos de PCR se recuperaron cortando el gel utilizando el kit de recuperación de gel AxyPrepDNA (AXYGEN) y se eluyó con Tris-HCl; Se utilizó electroforesis de agarosa al 2% para detectar los productos de PCR. Los productos de PCR fueron detectados y cuantificados por QuantiFluor-ST™ Blue Fluorescence Quantification System (Promega), y luego las muestras fueron secuenciadas utilizando la plataforma de secuenciación Illumina MiSeq.
2.5. Análisis bioinformático
Las lecturas de PE obtenidas de la secuenciación de Miseq se empalmaron primero de acuerdo con la relación de superposición, mientras que los datos brutos se filtraron y se eliminaron las quimeras, etc. Después de eso, las secuencias resultantes se agruparon OTU utilizando la plataforma de software Usearch, y las secuencias se agruparon de acuerdo con una similitud del 97% para las secuencias no repetidas (excluyendo secuencias individuales) se agruparon en OTU, y se seleccionaron secuencias con 97% o más de similitud con secuencias representativas de OTU para generar tablas OTU. Las secuencias representativas de OUT se compararon con la base de datos de referencia microbiana, se realizó la anotación de especies, se analizó la diversidad de α y se trazaron curvas de dilución y gráficos de Veen utilizando herramientas del lenguaje R. El software QIIME se utilizó para analizar la diversidad β y dibujar el diagrama del análisis de coordenadas principales (PCoA). De acuerdo con los resultados del análisis taxonómico, podemos saber qué tipo de microorganismos están contenidos en las muestras y el número de secuencia de cada microorganismo en la muestra, es decir, la abundancia relativa de cada microorganismo. Los datos son analizados y ordenados por la plataforma Qiime.
2.6. Análisis estadístico de los datos
Todos los datos registrados se introdujeron en una tabla de Excel para su recopilación preliminar. Se utilizó el software estadístico MIXED PROC en SAS 9.2 para el análisis bifactorial de varianza y análisis de regresión de los parámetros de fermentación ruminal. El análisis de varianza de dos factores incluyó la dosis de SA, el tiempo de muestreo y la interacción (SA × Time). La dependencia de la dosis de SA se analizó mediante análisis polinómico ortogonal (lineal y cuadrático); El índice de diversidad alfa de bacterias y hongos ruminales fue una prueba de diferencia de dos colas utilizando la prueba t de Student; se utilizó la prueba H no paramétrica de Kruskal-Wallis para comparar las diferencias de la flora microbiana ruminal en ovejas. p < 0,05 indicaron una diferencia significativa o una relación de regresión significativa, y 0,05 < p < 0,10 indicaron una tendencia ascendente o descendente.
3. Resultados
3.1. Efecto del SA sobre los parámetros de fermentación ruminal en ovinos
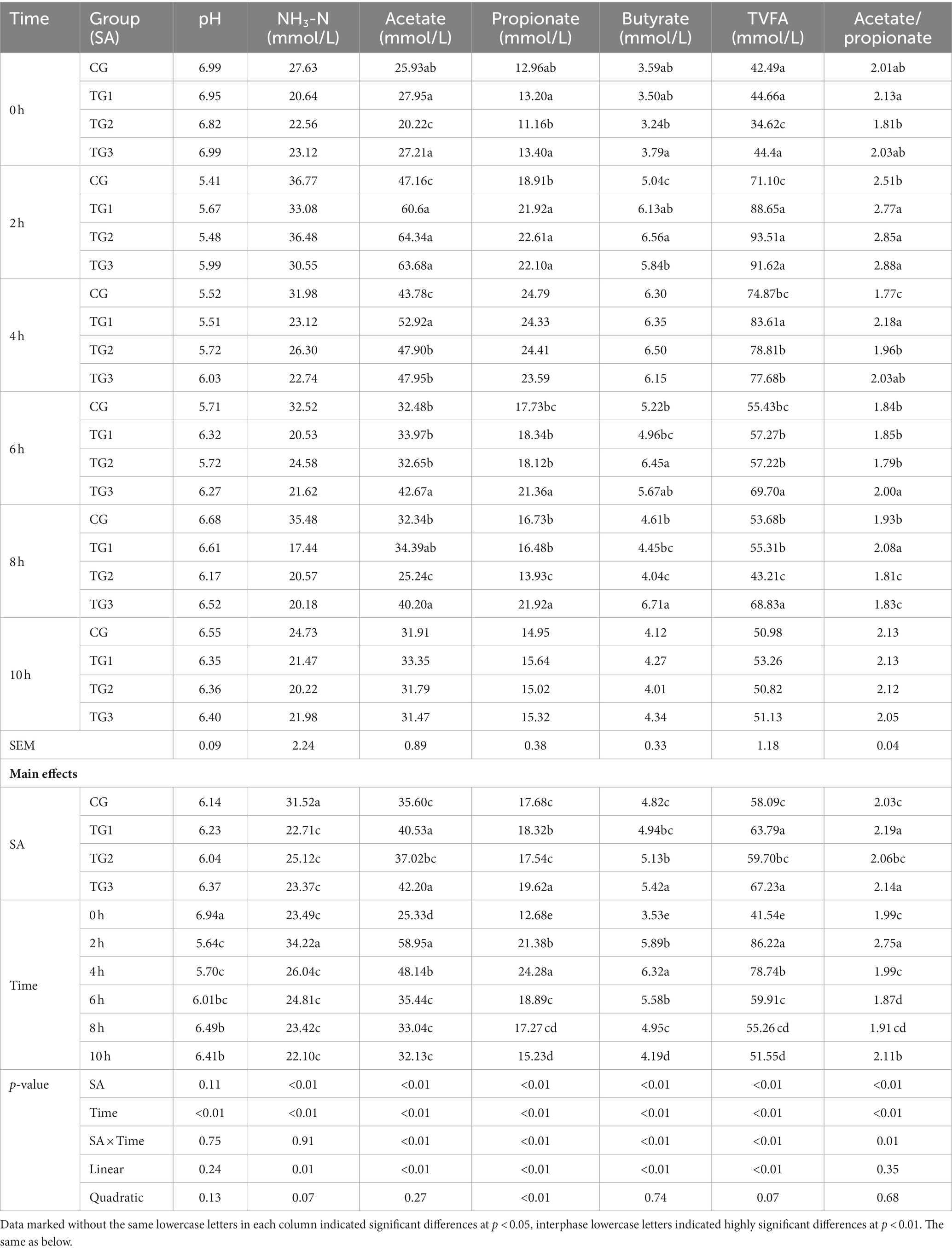
Como se muestra en la Tabla 2, después de que se agregaron diferentes dosis de SA, el pH ruminal del grupo TG3 fue significativamente mayor que el de los grupos CG y TG2 a las 2 h de alimentación (p < 0,01), el pH ruminal del grupo TG3 fue significativamente mayor que el de los grupos CG y TG1 a las 4 h de alimentación (p < 0,05), el pH ruminal de los grupos TG1 y TG3 fue significativamente mayor que el de los grupos CG y TG2 a las 6 h de alimentación (p < 0,05). En comparación con el CG, NH ruminal3-Las concentraciones de N fueron significativamente o muy significativamente más bajas en los grupos TG1, TG2 y TG3 a las 4-8 h de alimentación (p < 0,05 o p < 0,01), y no hubo diferencias significativas en NH3-Concentraciones de N entre los grupos en los otros puntos temporales (p > 0,05). Con el aumento de la dosis de SA, la concentración de NH3-N en el rumen presentó una disminución lineal significativa (p < 0,05), y la curva cuadrática mostró una tendencia de disminución (p = 0,07). Con la prolongación del tiempo de muestreo, la concentración de NH3-N en el rumen presentó una regla de cambio de aumento primero y luego disminución, y alcanzó el pico a las 2 h.
A las 0 h antes de la alimentación, las concentraciones de acetato y AGVT en el grupo TG2 fueron significativamente más bajas que en los otros grupos (p < 0,01), la concentración de propionato y la proporción de acetato a propionato en el grupo TG2 fue significativamente menor que en el grupo TG1 (p < 0,05), la concentración de butirato en el grupo TG3 fue significativamente mayor que en el grupo TG2 (p < 0,05). A las 2 h después de la alimentación, las concentraciones de acetato, propionato, butirato y AGVT en el rumen de los tres grupos experimentales fueron significativa o extremadamente significativamente mayores que las del grupo control (p < 0,05 o p < 0,01). A las 4 h después de la alimentación, las concentraciones de acetato ruminal, TVFA y la proporción de acetato a propionato en los grupos TG1, TG2 y TG3 fueron significativamente o extremadamente significativamente más altas que el grupo CG (p < 0,05 o p < 0,01), y el grupo TG1 fue el más alto. A las 6 h después de la alimentación, las concentraciones de acetato, propionato y AGVT en el rumen del grupo TG3 fueron significativa o extremadamente significativamente más altas que las de los otros tres grupos (p < 0,05 o p < 0,01), mientras que las concentraciones de butirato en el grupo rumen de TG2 fueron significativamente o extremadamente significativamente más altas que el grupo GC y TG1 (p < 0,05 o p < 0,01). A las 8 h después de la alimentación, la concentración de acetato ruminal en el grupo TG3 fue significativamente mayor que en el grupo control (p < 0,05), mientras que en los grupos TG1 y TG3 fue significativamente mayor que en el grupo TG2 (p < 0,01). Las concentraciones de propionato ruminal, butirato y TVFA en el grupo TG3 fueron significativa o extremadamente altas que las de los otros tres grupos (p < 0,05 o p < 0,01). La concentración de butirato en el grupo TG2 fue significativamente menor que en el grupo control (p < 0,05), y la proporción de acetato a propionato en el grupo TG1 fue significativa o extremadamente significativamente mayor que en los otros tres grupos (p < 0,05 o p < 0,01). A las 10 h después de la alimentación, no hubo diferencia significativa en cada índice de todos los grupos (p > 0,05).
Con el aumento de la dosis de SA, las concentraciones de acetato, propionato, butirato y AGVT en el rumen aumentaron linealmente (p < 0,05), la concentración de propionato en el rumen mostró un efecto de curva cuadrática significativo (p < 0,05), y la concentración de butirato en el rumen mostró un efecto de curva cuadrática (p = 0,07). El tiempo de muestreo está estrechamente relacionado con varios parámetros de la fermentación ruminal. Con la extensión del tiempo de muestreo, las concentraciones de acetato, propionato, butirato y AGVT en el rumen mostraron una tendencia a aumentar primero y luego disminuir, y las concentraciones de acetato y AGVP alcanzaron el pico a las 2 h, mientras que las de propionato y butirato alcanzaron el pico a las 4 h.
3.2. Efecto del SA sobre la diversidad de bacterias ruminales en ovejas
3.2.1. Análisis de la diversidad alfa de las bacterias ruminales
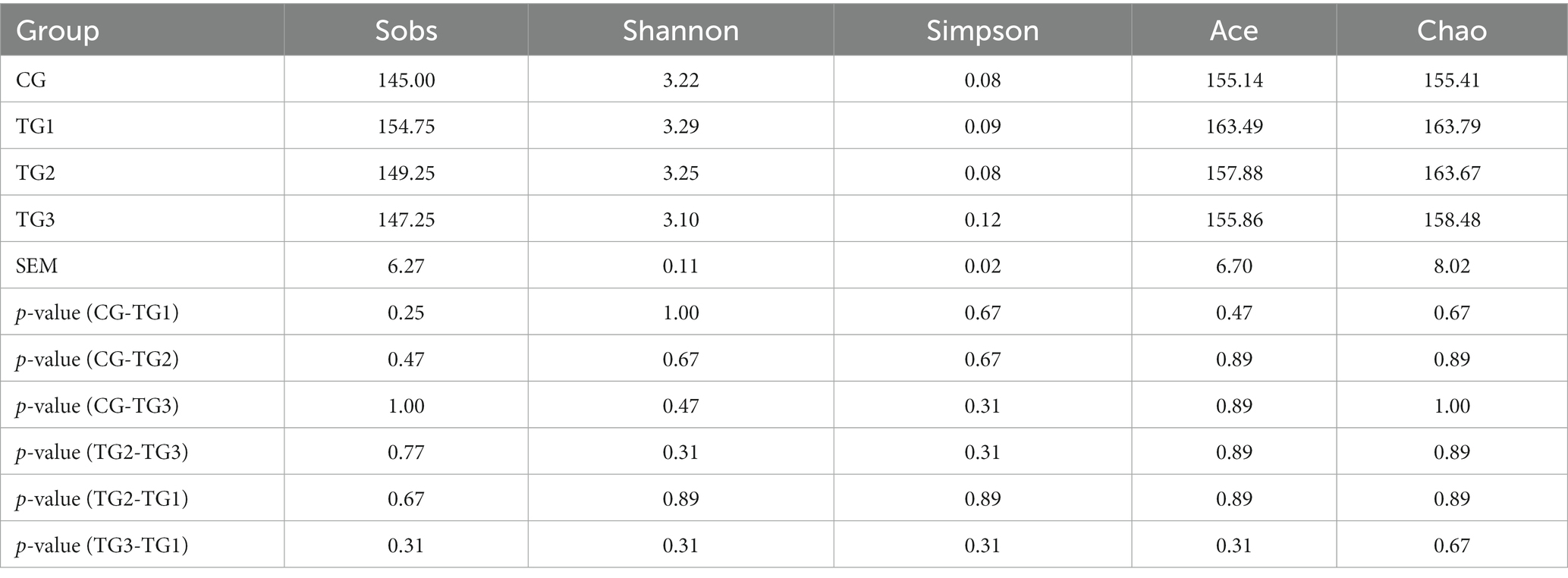
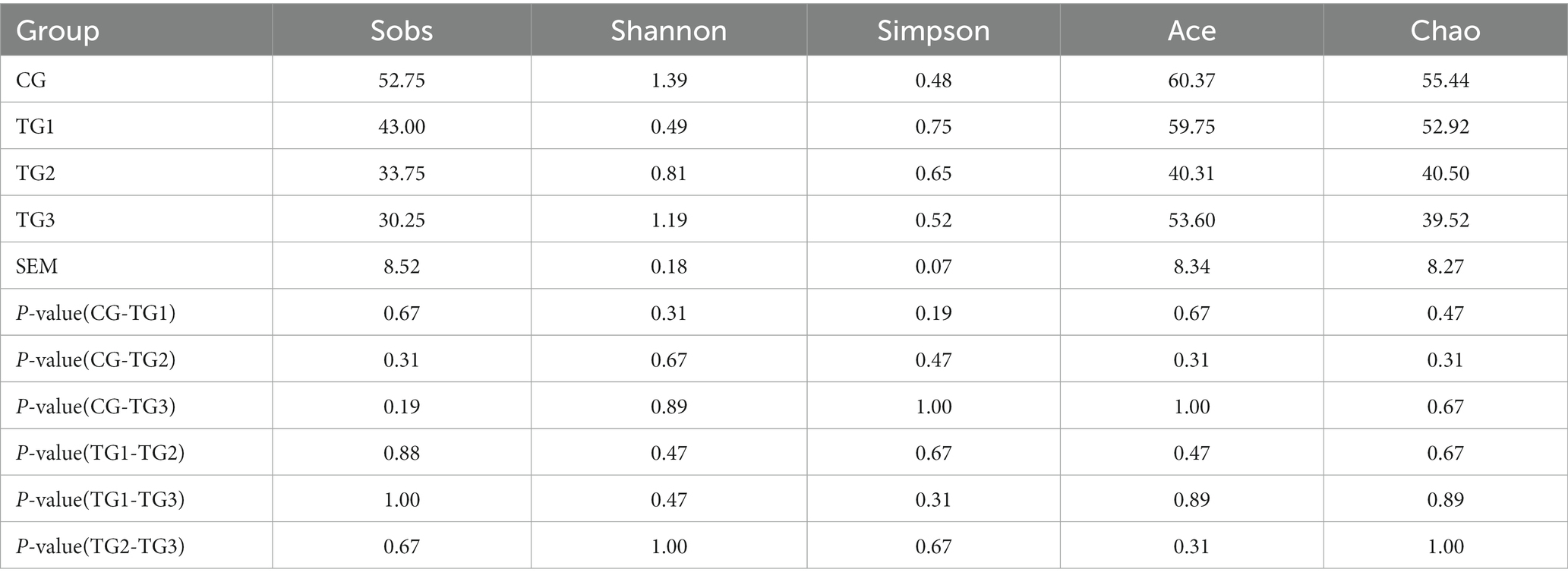
Sobs se refiere al número de OTU realmente observadas, Shannon y Simpson reflejan principalmente la diversidad de especies, y Ace y Chao miden la riqueza de especies. Se puede observar en la Tabla 3 que Shannon fue TG1 > TG2 > CG > TG3, y Simpson fue TG3 > TG1 > CG = TG2, pero la diferencia no fue significativa (p > 0,05), lo que mostró que la diversidad de bacterias ruminales con diferentes dosis de SA en la dieta alta en concentrados fue similar. Sobs, Ace y Chao en los tres grupos experimentales fueron todos más altos que los del grupo control, y no hubo diferencia significativa entre los grupos (p > 0,05), lo que indica que la riqueza de especies de los cuatro grupos fue básicamente la misma.
3.2.2. Composición de las bacterias ruminales
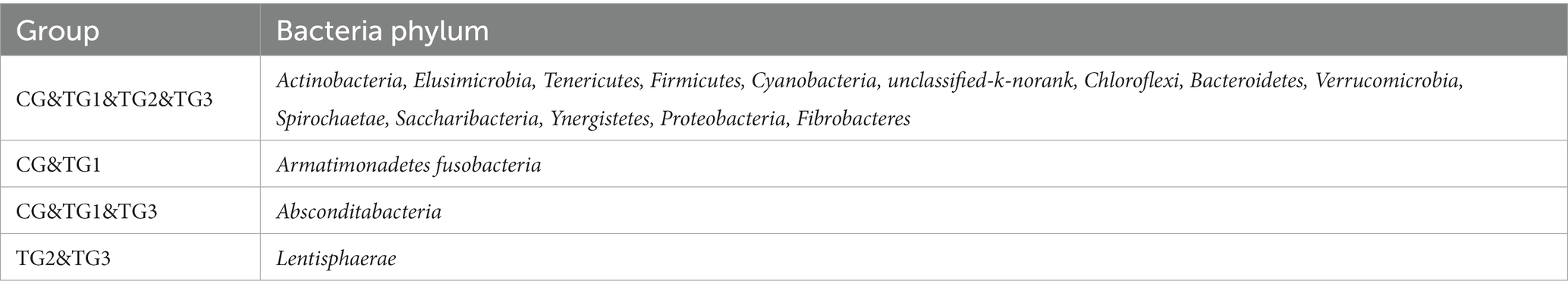
Como se muestra en la Figura 1 y la Tabla 4 a continuación, a nivel de filo, hubo 17 filos en los grupos CG y TG1, 15 filos en el grupo TG2 y 16 filos en el grupo TG3, de los cuales 14 filos fueron compartidos por el grupo control y el grupo experimental. Principalmente Actinobacterias, Firmicutes, Chloroflexi, etc. El filo común del grupo CG y el grupo TG1 fueron Armatimonadetes y Fusobacterias, el filo común del grupo CG y el grupo TG1 y TG3 fueron Absconditabacteria, y el filo común del grupo TG2 y TG3 fueron Lentisphaerae.
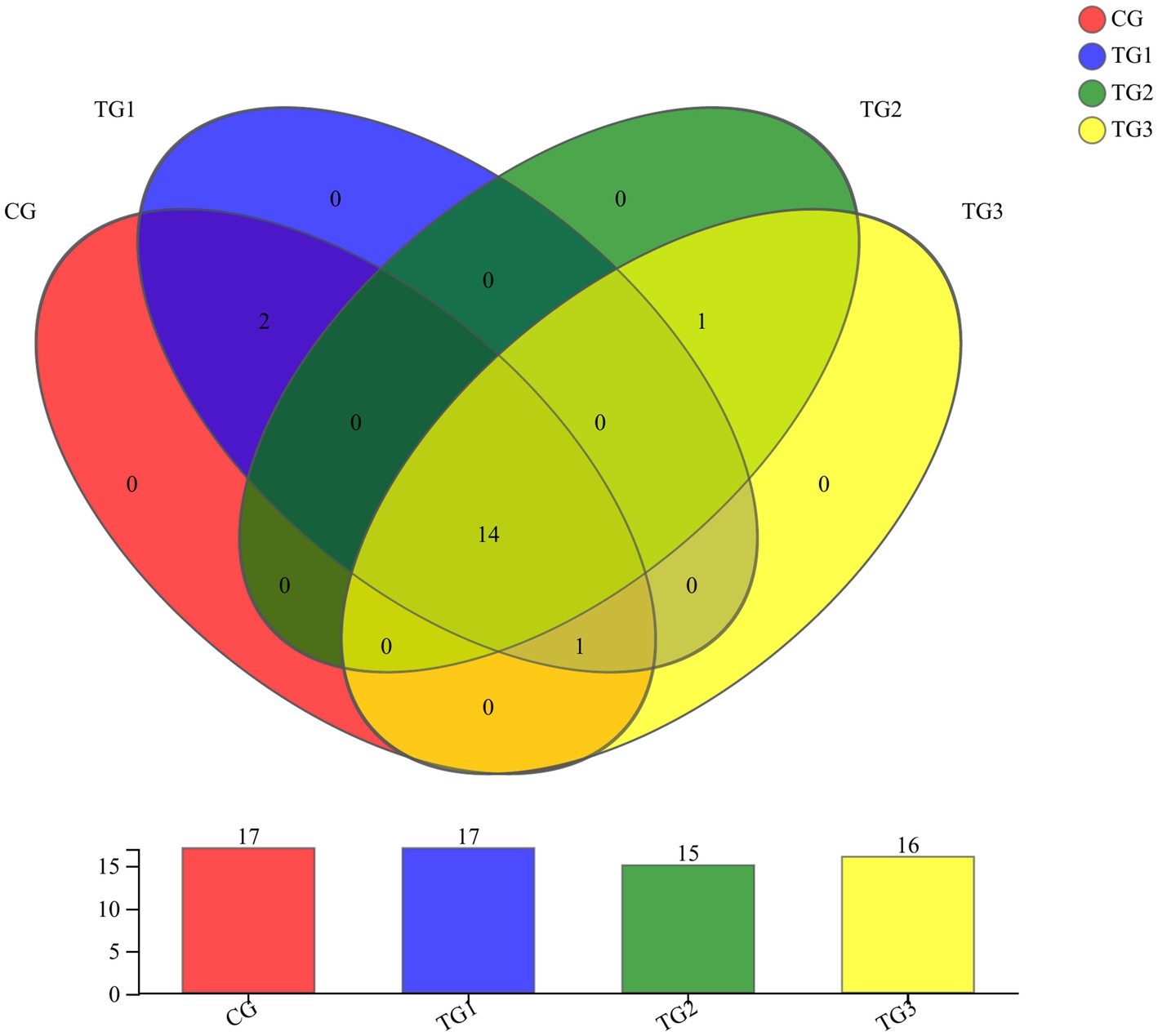 Figura 1. Diagrama de Venn de bacterias ruminales a niveles de filo. Diferentes colores representan diferentes grupos, los números en partes superpuestas representan el número de especies comunes a la pluralidad de grupos, y los números en partes no superpuestas representan el número de especies específicas del grupo correspondiente.
Figura 1. Diagrama de Venn de bacterias ruminales a niveles de filo. Diferentes colores representan diferentes grupos, los números en partes superpuestas representan el número de especies comunes a la pluralidad de grupos, y los números en partes no superpuestas representan el número de especies específicas del grupo correspondiente.
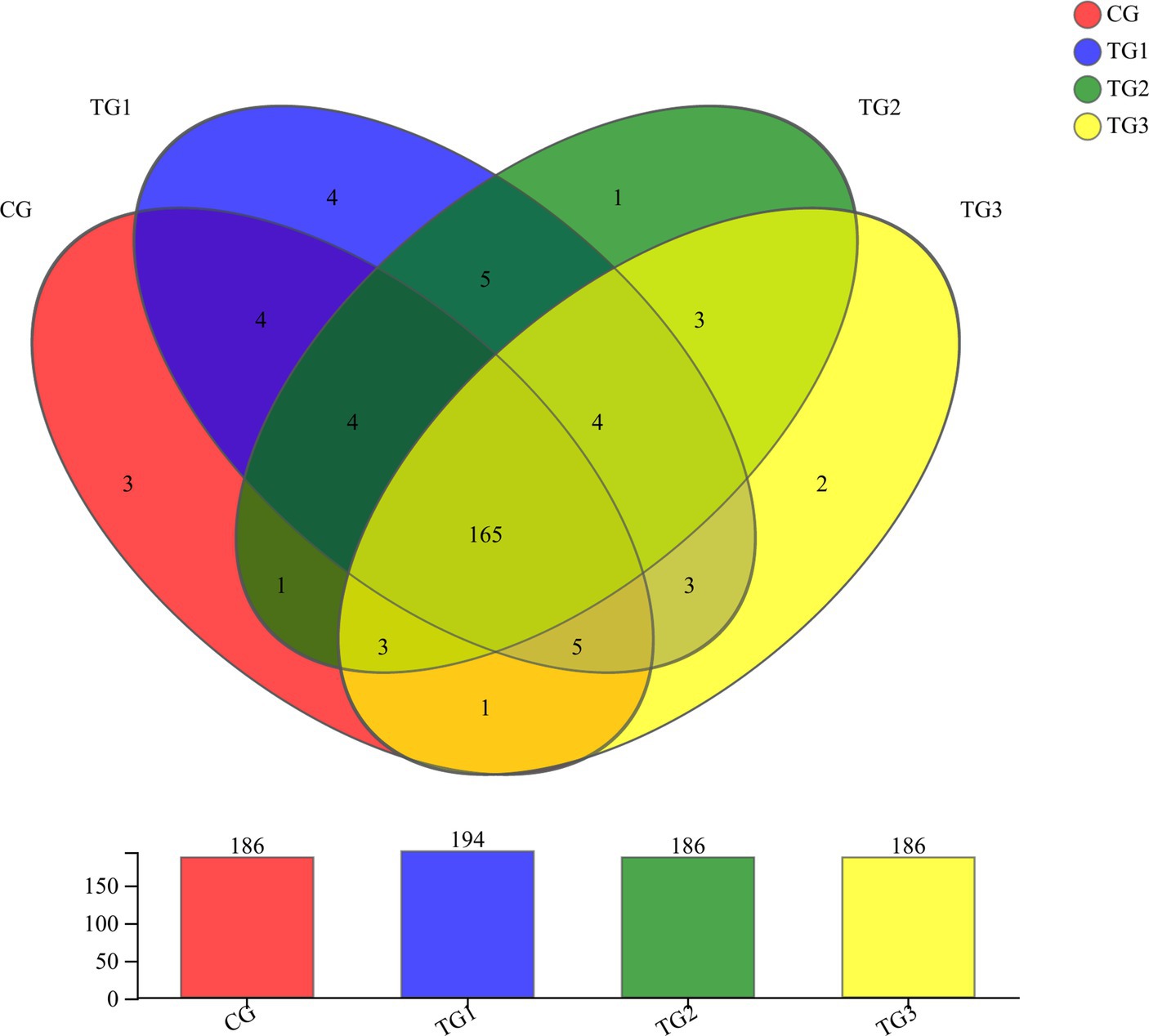
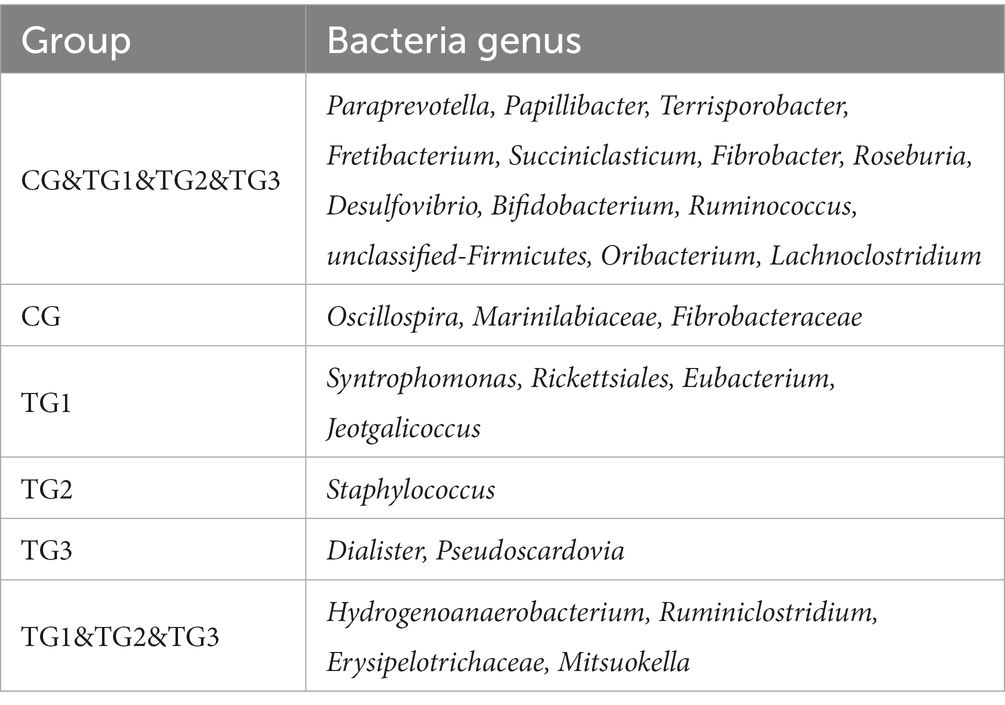
Como se muestra en la Figura 2 y la Tabla 5 a continuación, a nivel de género, había 186 géneros en los grupos CG, TG2 y TG3. 194 géneros en el grupo TG1, y 165 géneros en común en el grupo control y los grupos experimentales. Principalmente incluyen Paraprevotella, Papillibacter, Terrisporobacter, Succiniclasticum, etc. Los géneros endémicos en el grupo CG fueron Oscillospira, Marinilabiaceae y Fibrobacteriaceae. Los géneros específicos de TG1 fueron Syntrophomonas, Rickettsiales, Jeotgalicoccus y Eubacterium; el género específico en el grupo TG2 fue Staphylococcus. Los géneros endémicos del grupo TG3 fueron Pseudoscardovia y Dialister. Los géneros comunes en los grupos TG1, TG2 y TG3 fueron Hydrogenoanaerobacterium, Ruminiclostridium, Erysipelotrichaceae y Mitsuokella.
3.2.3. Riqueza de especies a nivel del filo bacteriano ruminal y del género
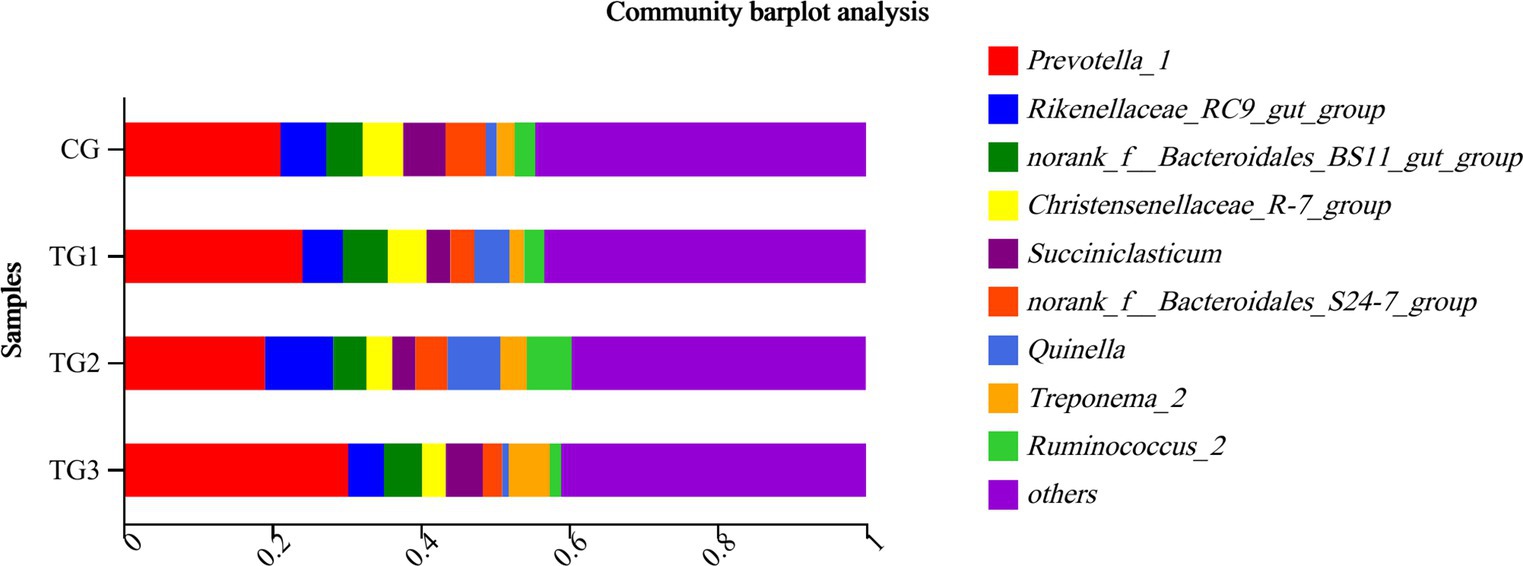
Como se muestra en la Tabla 6 y la Figura 3, Bacteroidetes y Firmicutes fueron los filos dominantes en cada grupo. En comparación con el grupo control, Bacteroidetes tuvo una tendencia a aumentar el porcentaje del grupo TG3 (p = 0,08), mientras que Firmicutes tuvo una tendencia a disminuir en el grupo TG3 (p = 0,07). No hubo diferencias significativas en otros filos entre los grupos (p > 0,05).
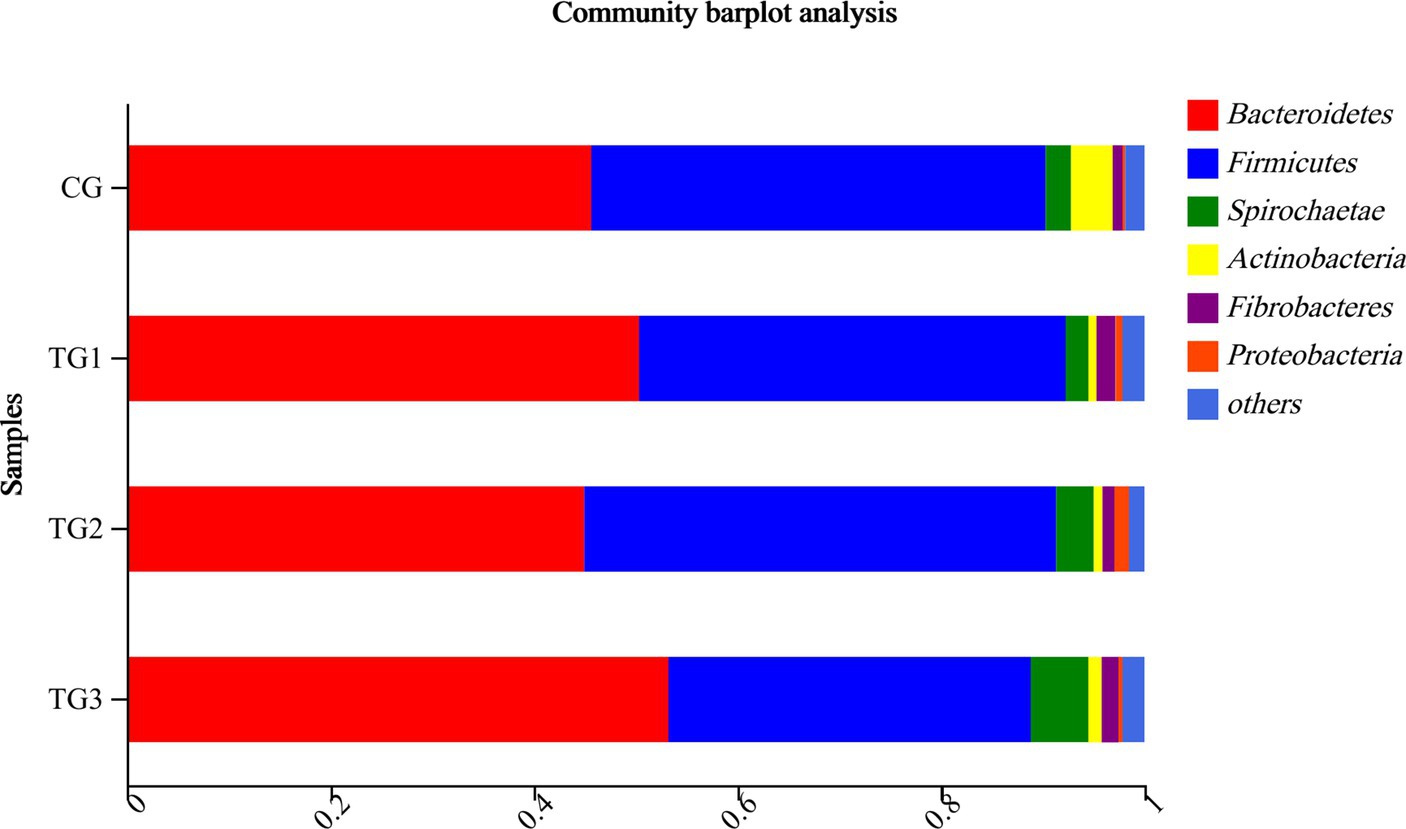 Figura 3. Gráfico de columnas horizontales de bacterias ruminales a nivel de filo. La ordenada indica la agrupación, la abscisa es la proporción de especies en el grupo, diferentes colores representan diferentes especies y la longitud representa la proporción de la especie.
Figura 3. Gráfico de columnas horizontales de bacterias ruminales a nivel de filo. La ordenada indica la agrupación, la abscisa es la proporción de especies en el grupo, diferentes colores representan diferentes especies y la longitud representa la proporción de la especie.
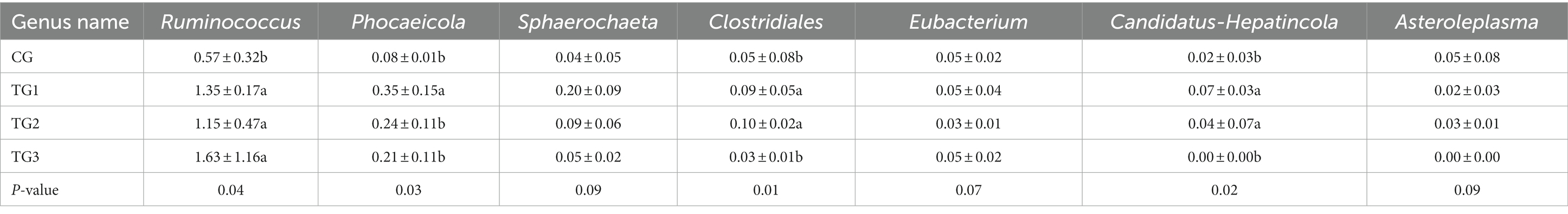
Como se muestra en la Figura 4 y la Tabla 7 a continuación, las bacterias del rumen se sometieron a estadísticas taxonómicas a nivel de género, y se obtuvieron 7 tipos de bacterias ruminales con diferencia significativa o tendencia a la diferencia. La proporción de Ruminococcus y Phocaeicola en los grupos experimentales fue significativamente mayor que en el grupo GC, especialmente en el grupo TG1. La proporción de Sphaerochaeta, Clostridiales y Candidatus-Hepatincola en los grupos TG1 y TG2 fue mayor que en el grupo GC (p = 0,09 o p < 0,05). La proporción de Eubacterium en el grupo TG2 fue menor que en el grupo GC (p = 0,07). Los porcentajes de asterolemia en los grupos TG1, TG2 y TG3 fueron menores que en el grupo GC (p = 0,09).
Tabla 7. Diferencias de abundancia de especies de bacterias ruminales a nivel de género/%.
3.3. Efecto de la adición de SA en una dieta alta en concentrados sobre la diversidad de hongos ruminales en ovejas
3.3.1. Análisis de la diversidad alfa de los hongos ruminales
Como se muestra en la Tabla 8, Simpson clasificó en el orden de TG1 > TG2 > TG3 > GC, pero las diferencias no fueron significativas (p > 0,05). Los índices de Sobs, Shanon, Ace y Chao del grupo control fueron ligeramente superiores a los de los tres grupos experimentales en valor numérico, pero las diferencias no fueron significativas entre los diferentes grupos. Estos resultados indicaron que la diversidad y abundancia de hongos ruminales cuando se agregaron diferentes dosis de SA en dietas altas en concentrados fueron similares.
Tabla 8. Prueba de diferencia del índice de diversidad alfa de hongos ruminales entre grupos.
3.3.2. Composición fúngica ruminal
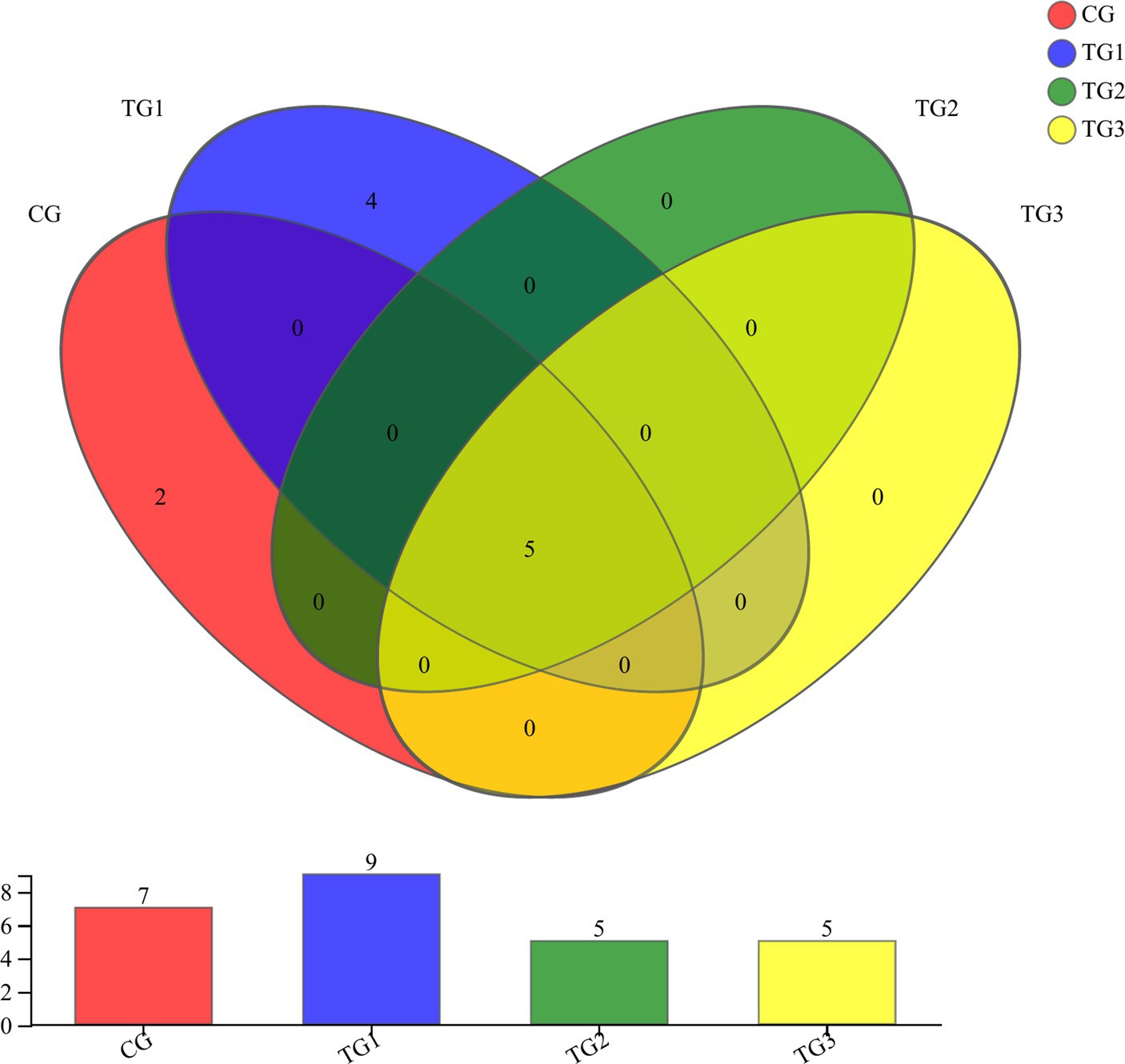
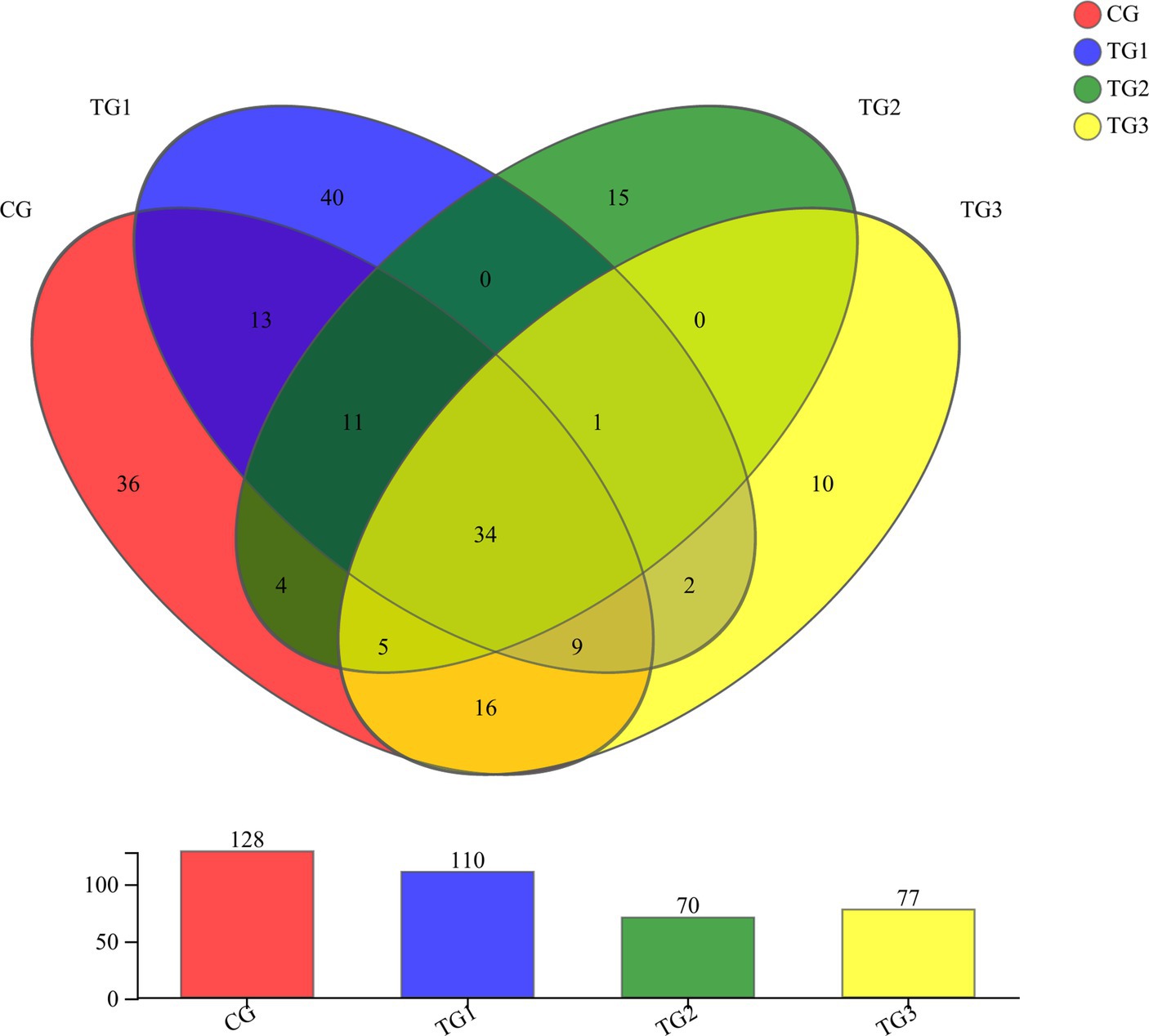
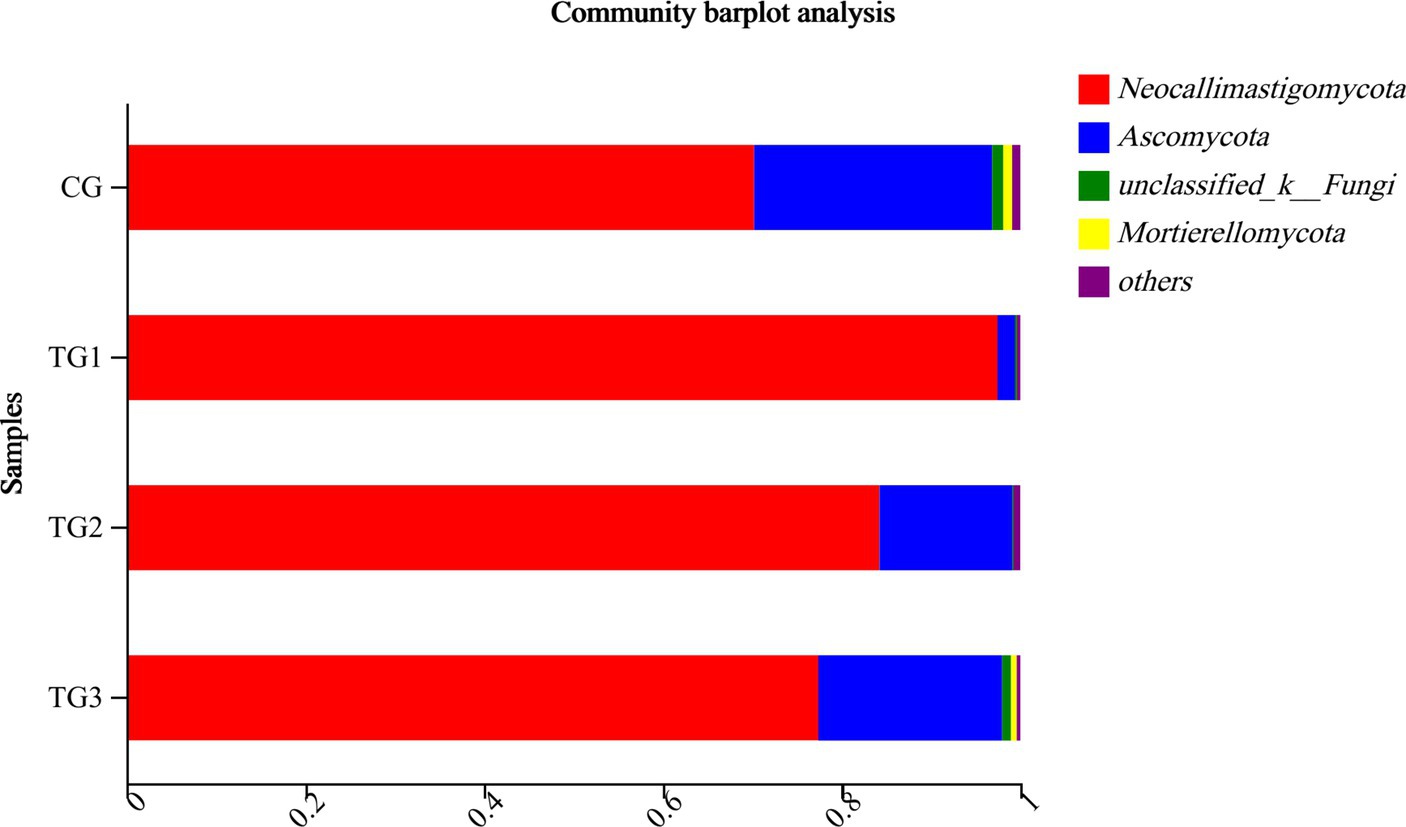
Como se muestra en la Figura 5 y la Tabla 9 a continuación, a nivel de filo, el grupo GC tenía 7 filos, el grupo TG1 tenía 9 filos, los grupos TG2 y TG3 tenían cada uno 5 filos, entre los cuales 5 filos fueron compartidos por el grupo control y los tres grupos experimentales. Eran Ascomycota, Neocallimastigomycota, etc. Los hongos anaerobios únicos en el grupo CG fueron Cercozoa y Glomeromycota, y los únicos hongos anaeróbicos en el grupo TG1 fueron Chytridiomycota, Mucoromycota, etc.
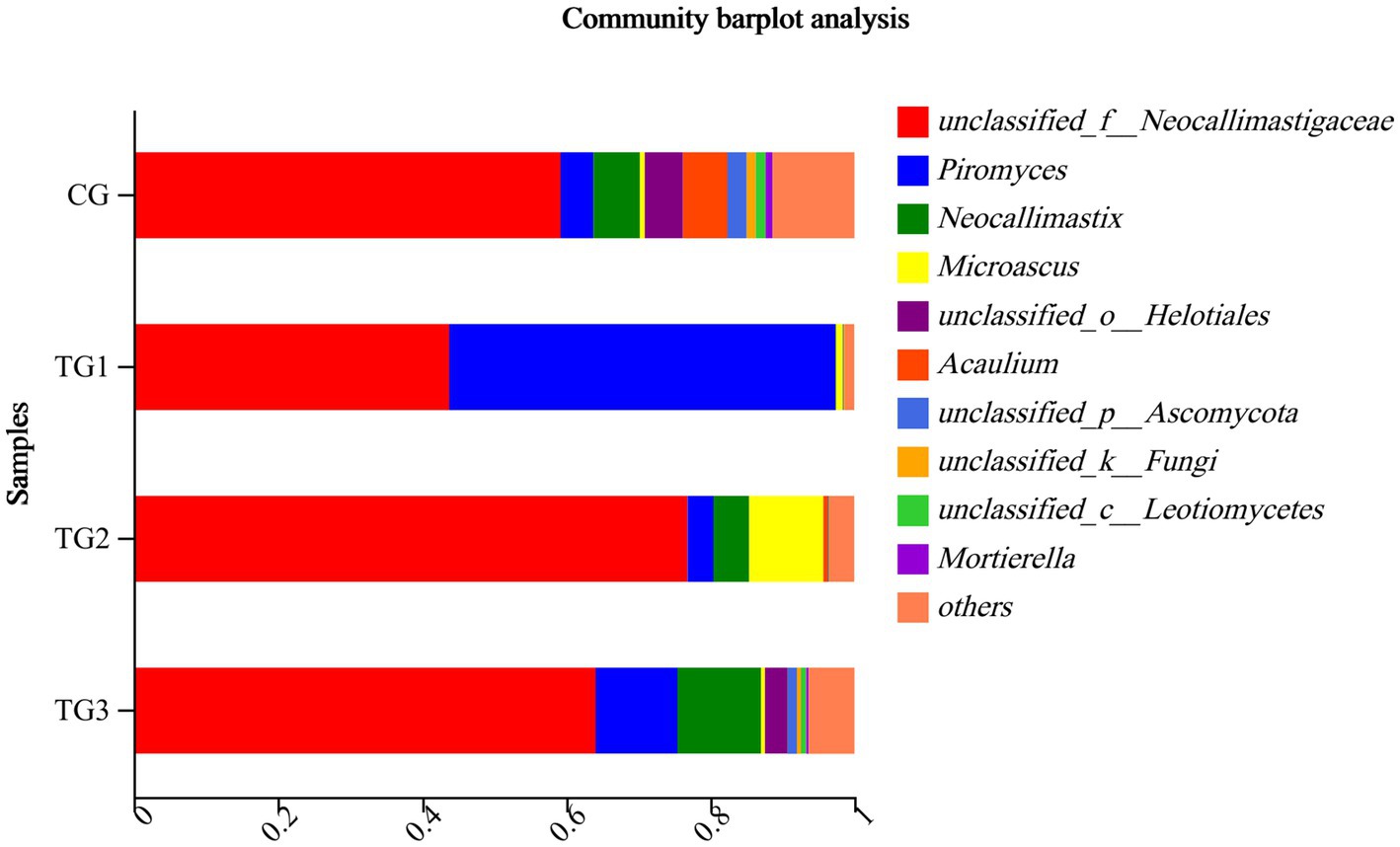
Como se muestra en la Figura 6 y la Tabla 10 a continuación, a nivel de género, había 128 géneros en el grupo CG, 110 géneros en el grupo TG1, 70 géneros en el grupo TG2, 77 géneros en el grupo TG3 y 34 géneros comunes a los grupos control y experimental, incluyendo principalmente Unclassified-Chaetomiaceae, Filobasidium, Unclassified-Didymellaceae, etc. Había 40 especies de géneros fúngicos endémicos del grupo TG1, principalmente Ramularia, Geminibasidium, Cordyceps, etc. Hubo 15 géneros de hongos endémicos del grupo TG2, principalmente Phialemonium, Cotylidia, Thanatephorus, etc. Había 10 géneros fúngicos endémicos en el grupo TG3, principalmente Mrakia, Uwebraunia, Lectera, etc. Los géneros fúngicos compartidos por los grupos TG1, TG2 y TG3 fueron Sarocladium.
3.3.3. Riqueza de especies a nivel del filo y género fúngico ruminal
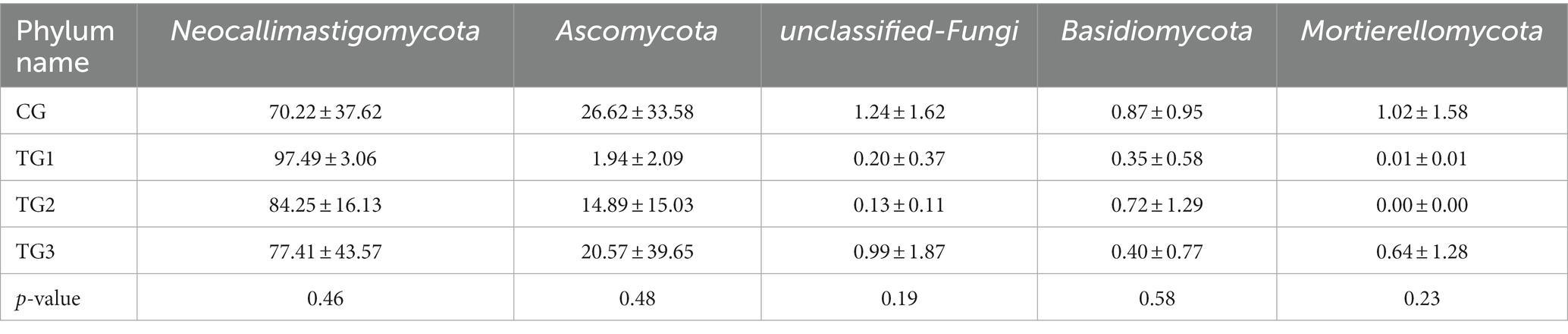
Como se puede observar en la Tabla 11 y su Figura 7, los grupos control y experimental de Neocallimastigomycota, Ascomycota, Unclassified-Fungi, Basidiomycota y Mortierellomycota no fueron significativamente diferentes a nivel de filo (p > 0,05).
Como se muestra en la Tabla 12 y la Figura 8, los grupos control y experimental de Neocallimastigaceae, Piromyces, Neocallimastix no fueron significativamente diferentes a nivel de género (p > 0,05).
4. Discusión
4.1. Efecto de la adición de SA en la dieta alta en concentrados sobre los parámetros de fermentación ruminal de las ovejas
El pH ruminal es un indicador importante para mantener la fermentación ruminal normal de los animales. El rango de pH normal del rumen es 6.0-7.5. El pH ruminal (5.2-5.6) superior a 3 h a menudo se reconoce como la causa de SARA, y la acidosis aguda ocurre cuando el pH está por debajo de 5.0 (13). El valor de pH se ve afectado por el método de alimentación, la relación concentrado-forraje y el nivel de materia seca. Muchos estudios han encontrado que la ingesta frecuente de dietas altas en granos por parte de los animales conducirá a una disminución en el pH del rumen. Cuando el pH cae a 6.0, se presentará una ligera disminución en la tasa de descomposición de la fibra, pero el número de bacterias de descomposición de la fibra generalmente no se ve afectado. Cuando cae a 5.5 o 5.0, conducirá a una disminución tanto en la tasa de descomposición de la fibra como en las bacterias de descomposición de la fibra, e incluso puede inhibir completamente la digestión de la fibra, cambiando así la función de fermentación ruminal (14). Este estudio mostró que el pH ruminal del grupo control fue de 5,4, 5,5 y 5,7 cuando los animales fueron alimentados durante 2 h, 4 h y 6 h, respectivamente, lo que indica que hubo una tendencia de SARA en el grupo control. Mientras que el pH ruminal del grupo TG3 fue de aproximadamente 6.0 durante este tiempo, significativamente más alto que el del grupo control, e indicando que el SA agregado en la dieta alta en concentrados fue propicio para mejorar el pH ruminal bajo dietas altas en concentrados, y podría desempeñar un papel importante en la utilización de celulosa por microorganismos para cambiar las funciones de fermentación ruminal. Además, los valores de pH en el rumen de los otros tres grupos experimentales fueron relativamente estables, lo que tuvo un efecto positivo en el mantenimiento de la homeostasis del ambiente ruminal, que fue similar al resultado de Gu et al. (15) que agregaron aditivos de hierbas medicinales chinas en la dieta para mejorar el pH del rumen y mantener la estabilidad del ambiente intragástrico.
La concentración de nitrógeno amoniacal es un indicador dinámico de la degradación de las fuentes de amoníaco y nitrógeno por microorganismos ruminales, que puede reflejar la tasa de degradación microbiana y la síntesis de sustancias que contienen nitrógeno, así como la utilización de nitrógeno amoniacal por microorganismos (16). Los microorganismos del rumen pueden utilizar nitrógeno amoniacal para sintetizar proteínas y la concentración adecuada de NH3-N es beneficioso para la síntesis de proteínas bacterianas para su uso por el organismo animal. Pablo et al. (17) encontraron que con el aumento de la dosis de la medicina herbal compuesta, las concentraciones de NH3-N y TVFA en el rumen de corderos tendían a aumentar primero y luego disminuir, lo que podría estar relacionado con el efecto sinérgico de los componentes activos en la medicina herbal compuesta. Sin embargo, Vera et al. (18) encontraron que tanto el extracto de corteza de pino como el extracto de mignonette podrían reducir la concentración de NH3-N en el rumen, lo que podría deberse al hecho de que el tanino polifenol en la corteza de pino y el extracto de mignonette podría inhibir las actividades de la proteasa y la desaminasa microbiana, y así formar complejo de taninos para reducir el NH3-Producción de N a pH ruminal = 6–7. Los resultados de este experimento mostraron que las concentraciones de nitrógeno amoniacal en los tres grupos experimentales se redujeron significativamente 4-8 h después de la ingesta, y el NH3-La concentración de N en el grupo TG1 fue la más baja. Los resultados anteriores de aumento de peso de nuestro grupo de investigación también mostraron que el aumento de peso diario promedio y F / G del grupo de 0.1% SA aumentaron significativamente (19), lo que indica que la adición de diferentes dosis de SA en la dieta de alta precisión podría mejorar la tasa de utilización de nitrógeno amoniacal por microorganismos ruminales, promover la fermentación ruminal y desempeñar un papel en la promoción del crecimiento. y el efecto de la adición del 0,1% fue mejor.
Los AGV producidos por la fermentación de rumiantes incluyen principalmente acetato, propionato y butirato, etc. Son la principal fuente de energía para el crecimiento, la producción y la reproducción de rumiantes, y pueden proporcionar del 70 al 80% de la energía total para que los animales la utilicen. Tian et al. (20) mostraron un aumento significativo en los niveles de propionato ruminal, butirato e isobutirato después de la adición de inulina a las raciones de ganado de carne de engorde. Wei et al. (21) encontraron que las concentraciones de acetato y TVFA en el grupo de polvo de astrágalo fueron más altas que las de los grupos control y antibiótico en un estudio in vitro. Aunque los tipos y dosis de aditivos, así como las especies animales fueron diferentes, los resultados de las pruebas fueron similares, lo que indica que los aditivos herbales facilitan la degradación del alimento por microorganismos del rumen, promoviendo una fermentación rápida y brindando la oportunidad de mantener el metabolismo animal. Los resultados de este estudio mostraron que las concentraciones de acetato, propionato y AGVT en el rumen de los grupos TG1, TG2 y TG3 fueron más altas que las del grupo CG a las 2 h de alimentación, y las concentraciones de acetato disminuyeron rápidamente 2-6 h después de alcanzar el pico, y el propionato en el grupo experimental comenzó a disminuir lentamente después de alcanzar el pico a las 4 h de alimentación. Indicó que la medicina herbal china SA podría comenzar a funcionar 2 h después de que las ovejas la comieran. Los estudios han encontrado que Ruminococcus era la principal bacteria degradadora de fibra en el rumen, que podría participar en el metabolismo del acetato, lo que resultó en una disminución en la concentración de acetato, lo que promovió la fermentación ruminal para tender al tipo propionato (22). Si bien el propionato era una sustancia glicogénica, la mayor concentración de propionato en el líquido ruminal indicaba la mayor energía disponible para el aumento de peso, que era similar a los resultados de nuestra siguiente diversidad bacteriana ruminal. Estos resultados indicaron que la adición de SA podría mejorar la función de fermentación ruminal en condiciones de alto concentrado por la composición y estructura de la microflora ruminal, cambiar la proporción de AGV en el rumen y afectar aún más la digestión y absorción de nutrientes dietéticos por parte del huésped, promoviendo así el crecimiento de animales sanos.
4.2. Efecto del SA añadido a las dietas de alta concentración sobre la diversidad bacteriana ruminal en ovejas
Los microorganismos ruminales proporcionan energía a los rumiantes al convertir los nutrientes contenidos en el alimento en AGV, así como proteínas microbianas a través de una serie de reacciones bioquímicas complejas (23). Los estudios de diversidad microbiana se realizaron principalmente en regiones conservadas de secuencias de ácido nucleico de ARNr y las bacterias se basaron principalmente en la región 16S. Shannon y Simpson reflejan principalmente la diversidad de especies, mientras que Ace y Chao miden la riqueza de especies. Encontramos que los índices de Shannon y Simpson no fueron significativamente diferentes entre los grupos según la diversidad alfa bacteriana del rumen. Esto indica que la diversidad bacteriana ruminal de SA añadida a diferentes dosis en dietas altas en concentrados tiene cierta similitud. El índice Ace y el índice Chao fueron mayores que el grupo control en los tres grupos experimentales, pero la diferencia entre los grupos no fue significativa, lo que indica que la abundancia de especies también fue básicamente la misma en los cuatro grupos. En este experimento, se encontró que Ruminiclostridium es un género común en los grupos TG1, TG2 y TG3, y Clostridium butyricum en Ruminiclostridium tiene la capacidad de mejorar la flora intestinal y mejorar la función inmune animal y mejorar la resistencia a las enfermedades al aumentar el nivel de inmunidad humoral, mejorar la barrera mucosa intestinal e inhibir la inflamación (24, 25). Esto fue verificado por nuestros hallazgos previos de que SA podría mejorar las funciones inmunes y antioxidantes en el suero, aliviar el daño ruminal causado por dietas de alta concentración a través de la producción y liberación de factores inflamatorios relacionados con la vía de señalización inflamatoria, y mejorar la función de barrera epitelial ruminal al promover la expresión de proteínas de unión estrecha epitelial ruminal en corderos (19, 26).
A nivel de phylum, los estudios han encontrado que, después de que las cabras fueron inyectadas con LPS, el número de bacterias Firmicutes-no clasificadas y Spirochaetes-no clasificadas en el rumen aumentó significativamente, mientras que el número de Bacteroidetes-unclassfied, Paraprevotella y Centipeda wcomo disminuyó significativamente (27). Zened et al. (28) encontraron que las bacterias dominantes en el rumen de las vacas lecheras no cambiarían con el cambio de dieta, y todavía eran Bacteroidetes y Firmicutes. Los resultados de este estudio mostraron que Bacteroidetes y Firmicutes fueron los filos dominantes en cada grupo, y en comparación con el grupo control, el grupo SA al 0,5% aumentó la abundancia de Bacteroidetes ruminales y disminuyó la abundancia de Firmicutes. Prevotella fue la especie más dominante de Bacteroidetes, que puede degradar polisacáridos como el almidón, el xilano y la pectina en el rumen, pero no puede degradar la celulosa (29). Se sugiere que la adición de SA a las dietas altas en concentrados mejoró la degradación de los carbohidratos no fibrosos, lo que ayudó a aliviar el daño causado por el exceso de LPS en ovejas a microorganismos ruminales e influyó positivamente en la estructura comunitaria de la flora microbiana ruminal en condiciones de dietas altas en concentrados. Además, se informa que el aumento de la proporción de Firmicutes a Bacteroidetes podría conducir a la deposición de grasa (30). En este experimento, la proporción de Firmicutes a Bacteroidetes TG1 y TG3 fue menor que la del grupo control, lo que solo demuestra que nuestro estudio anterior encontró que el grupo SA podría reducir la concentración de triglicéridos en suero (19), lo que explica mejor que la razón de la promoción del crecimiento de SA podría ser que la descomposición de los triglicéridos proporciona una gran cantidad de energía para el crecimiento animal. Sin embargo, Wei et al. (21) encontraron estudios in vitro que los yaks del grupo Astrágalo tuvieron una disminución significativa de Bacteroidetes y un aumento significativo de Firmicutes, lo que puede deberse a la proporción de concentrado dietético, los principales ingredientes activos y raza animal que difieren de los resultados de este experimento.
A nivel de género, Ruminococcus es un tipo de bacteria vatal para que los rumiantes utilicen material de fibra en el rumen. En este experimento, el número de Ruminococcus en el grupo CG fue significativamente menor que en los grupos experimentales, lo que indica que la adición de SA en la dieta aumentó el número de bacterias de utilización de fibra ruminal y promovió la fermentación del material de fibra, que fue similar a la regla de cambio mencionada anteriormente del valor de pH en el rumen. Al mismo tiempo, también demostramos mediante resultados de qPCR que el número de Ruminococcus albicans en grupos experimentales aumentó significativamente en comparación con el grupo control. Sin embargo, Zhou et al. (31) encontraron que la abundancia relativa de Ruminococcus se correlacionó positivamente con la liberación de IL-1β en el cuerpo, lo que podría aumentar el riesgo de daño a órganos y tejidos. Nuestros resultados experimentales anteriores encontraron que la diferencia de IL-1β en suero entre el grupo experimental y el grupo control no era significativa, lo que puede ser causado por la diferencia de especies animales y sitios de detección, y su mecanismo específico necesita una verificación adicional. Liu et al. (32) encontraron que la biochanina A aumentó significativamente la abundancia de la bacteria ruminal dominante Prevotella ruminicola proteína hidrolizante. P. ruminicola sintetiza proteasas y desaminasas para generar amoníaco a partir de proteínas dietéticas para su uso por los cuerpos. Emma et al. (33) encontraron que Clostridiaceae mostró una alta correlación positiva con el contenido de proteína cruda, digestibilidad de proteínas y energía total, y una correlación positiva más débil con la digestibilidad de las grasas. El porcentaje de Clostridiaceae fue significativamente mayor en los grupos TG1 y TG2 en este experimento, lo que indica que la adición de 0.1-0.3% de SA a las dietas podría mejorar el número de bacterias que usan proteínas, asegurando así una mejor absorción de nutrientes en corderos en condiciones de alto concentrado.
4.3. Efecto del SA añadido a las dietas de alta concentración sobre la diversidad de hongos ruminales en ovejas
Los hongos anaeróbicos que colonizan el tracto digestivo de los rumiantes producen y secretan una serie de enzimas degradadoras de polisacáridos, incluyendo glucósidos hidrolasas, celulasas y xilanasas, que pueden facilitar mejor la utilización de la celulosa dietética por el rumen (34). La mayoría de los estudios han demostrado que las prácticas de alimentación, la proporción de concentrado de alimento a forraje y los niveles de nutrientes de la dieta pueden afectar la diversidad bacteriana y la composición de la flora dominante en el rumen (35, 36), mientras que hay menos informes sobre hongos ruminales en ovejas. Ye et al. (37) encontraron que la adición de fructanos a la ración podría afectar el índice Ace, Shannon y Simpson de hongos ruminales en vacas Holstein, pero no afectó significativamente la diversidad general y la abundancia de la flora fúngica ruminal. Encontramos que Simpson mostró TG1 > TG2 > TG3 > CG entre los grupos por diversidad de hongos ruminales de ovejas Alfa, y los grupos control de índice Sobs, Shanon, Ace y Chao fueron ligeramente superiores a los tres grupos experimentales, pero ninguna de las diferencias fue significativa (p > 0,05), que fue similar a los resultados de Wang et al. (38) sugiriendo que la adición de SA en la dieta alta en concentrados tenía diferentes grados de diversidad y abundancia de hongos ruminales de oveja, pero también tenían ciertas similitudes. En este experimento, se encontró que la composición fúngica ruminal del rumen de oveja era más abundante en el grupo TG1 tanto a nivel de filo como de género, y la composición fúngica a nivel de género ruminal en este experimento reveló que Sarocladium era un género exclusivo de los grupos TG1, TG2 y TG3, y Sarocladium puede degradar celulosa y xilano (39 ), lo que también indica además que la adición de SA a dietas de alta concentración podría enriquecer las especies de bacterias degradantes fibrosas.
A nivel de filo, Li et al. (40) encontraron que el filo dominante de hongos ruminales en las dietas de ovejas Han de cola pequeña que consumían dietas con diferentes niveles de proteína era principalmente Ascomycota, Basidiomycota y Neocallimastigomycota. Han (41) encontró en el estudio de cabras de cachemira Shaanxi que el filo dominante de hongos ruminales en diferentes grupos de dietas de proporción concentrado-forraje era Ascomycota, y estaba involucrado principalmente en la degradación de nutrientes recalcitrantes en el alimento. En contraste, Peng et al. (42) agregaron semillas de uva a la dieta de ovejas y encontraron que los hongos ruminales dominantes de las ovejas Dorang eran Neocallimastigomycota y Ascomycota, que eran consistentes con los resultados experimentales. De ello se deduce que las diferentes especies y prácticas de alimentación, así como las diferencias en las principales sustancias activas podrían alterar la abundancia relativa del filo ruminal dominante. Neocallimastigomycota era un hongo funcional ampliamente presente en el tracto digestivo de rumiantes herbívoros, y desempeñaba un papel importante en la degradación de la celulosa lignificada (43), y también podía proporcionar al huésped los nutrientes necesarios para actividades vitales al consumir proteínas degradables del rumen (44). La abundancia relativa de Neocallimastigomycota en los tres grupos experimentales en este experimento fue numéricamente mayor que la del grupo control, y la más alta en el grupo TG1, lo que indica que la adición de cantidades apropiadas de SA a las dietas de alta concentración mejoraría la degradación de la celulosa y proporcionaría energía para el metabolismo animal. En este experimento, la abundancia relativa de Neocallimastigomycota fue numéricamente mayor en los tres grupos de prueba que en el grupo control, y fue más alta en el grupo TG1, lo que indica que la adición de SA a dietas de alta concentración mejoraría la degradación de la celulosa y proporcionaría energía para el metabolismo animal.
A nivel de género, Wang et al. (45) demostraron que los inoculantes fúngicos de Piromyces aumentaron la digestibilidad in vitro de la materia seca y la fibra detergente neutra del ensilaje después de 30 días de fermentación. Piromyces, Unclassified-Neocallimastigaceae y Neocallimastix pertenecen a Neocallimastigomycota, que tenía la capacidad de digerir la celulosa de manera eficiente. Los resultados de este experimento mostraron un nivel relativamente alto de estos tres géneros de hongos, lo que sugiere que la adición de SA en dietas de alta concentración mejoraría la utilización de celulosa, que también se verificó en los resultados anteriores de la diversidad bacteriana ruminal. La proporción de concentrado dietético a forraje tiene un gran efecto sobre las características de los hongos ruminales. Yang et al. (46) encontraron que alimentar a una dieta granulada de alto concentrado a precio completo inhibió la actividad de hongos anaeróbicos y bacterias degradadoras de fibra ruminal en terneros. Zhu et al. (47) informaron que los concentrados inhibieron la producción de xilán isomerasa fúngica, que podría estar relacionada con la inducción de sustratos similares a fibras crudas, mientras que Piromyces puede producir xilano isomerasa y aumentar el número de bacterias degradadoras de celulosa (48, 49). En este experimento, la abundancia relativa de Piromyces en el grupo TG1 fue mucho mayor en valor que en el grupo control, lo que sugiere que la adición de SA a dietas altas en concentrados podría aumentar la actividad de la xilano isomerasa y promover la proliferación de bacterias degradadoras de fibra en el rumen de las ovejas, lo que ayudó a mantener el equilibrio microecológico ruminal de los corderos en condiciones de alta concentración.
5. Conclusión
En este estudio, la adición de SA a la dieta alta en granos podría aumentar la concentración de acetato, propionato, butirato, TVFA y pH en el rumen de las ovejas, y reducir la concentración de NH3-N en el rumen. Las bacterias ruminales dominantes después de agregar SA a la dieta alta en granos fueron Bacteroidetes y Firmicutes, que aumentaron la abundancia relativa de Ruminococcus, Phocaeicola y Clostridiales en el grupo rumen de SA. Y el filo dominante de los hongos ruminales de oveja fue Neocalymastigomycota, y el género dominante fue Neocalymastigaceae sin clasificar, lo que aumentó la abundancia relativa de Neocalymastigomycota y Piromyces en el grupo de 0.1% SA hasta cierto punto. Esto tiene un efecto positivo en la promoción de la fermentación ruminal y el ajuste fino del ecosistema microbiano del rumen para mejorar la salud de las ovejas.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio o repositorios y los números de acceso se pueden encontrar en: https://www.ncbi.nlm.nih.gov/bioproject; PRJNA963087.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Agrícola de Mongolia Interior. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
Todos los autores participaron en el diseño del estudio, la adquisición y el análisis de los datos y la preparación del manuscrito.
Financiación
Este trabajo fue apoyado financieramente por la Fundación Nacional de Ciencias Naturales de China (31860658).
Reconocimientos
Los autores agradecen al personal de Pastos Experimentales de la Universidad Agrícola de Mongolia Interior por su asistencia.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Plaizier, JC, Khafipour, E, Li, S, Gozho, GN y Krause, DO. Acidosis ruminal subaguda (SARA), endotoxinas y consecuencias para la salud. Anim Feed Sci Technol. (2012) 172:9–21. doi: 10.1016/j.anifeedsci.2011.12.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Oetzel, GR. Diagnóstico y manejo de la acidosis ruminal subaguda en rebaños lecheros. Veterinario Clin N am Food Anim Pract. (2017) 33:463–80. doi: 10.1016/j.cvfa.2017.06.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Liu, YH, Espinosa, CD, Abelilla, JJ, Casas, GA, Lagos, LV, Lee, SA, et al. Aditivos para piensos no antibióticos en dietas para cerdos: una revisión. Anim Nutr. (2018) 4:113–25. doi: 10.1016/j.aninu.2018.01.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Wang, RZ, Deng, XX, Gao, QX, Wu, XL, Han, L, Gao, XJ, et al. Sophora alopecuroides L.: una revisión etnofarmacológica, fitoquímica y farmacológica. J Etnofarmacol. (2020) 248:112172. doi: 10.1016/j.jep.2019.112172
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Tú, JJ, Li, YY, Sha, BY y Yin, XY. Avances en los estudios sobre el alcaloide de Sophora alopecuroides L. J Jiangxi Univ Tradit Chin Med. (2015) 27:109–16.
6. Haroon, UR, Shagufta, R, Yousaf, A, Kamin, K, y Marco, AUM. Potencial anticancerígeno de la soforidina y sus derivados: progreso reciente y perspectivas futuras. Bioorg Chem. (2020) 99:103863. doi: 10.1016/j.bioorg.2020.103863
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Rong, ZJ, Hu, GS, Lin, SY, Yan, T, Li, N, Zhao, Y, et al. Constituyentes de las semillas de Sophora alopecuroides L. Moléculas. (2020) 25:1–8. doi: 10.3390/moléculas25020411
8. Hu, GL, Liu, J, Tian, S, Song, ZH, Fan, ZY, Zhang, SR, et al. Efectos del polisacárido de semilla de té y alcaloides de Macleaya cordata sobre la flora intestinal de pollos de engorde de plumas amarillas y actividad antimicrobiana de Macleaya cordata sanguinarine. Chin J Anim Nutr. (2018) 30:4619–25. doi: 10.3969/j.issn.1006-267x.2018.11.038
9. Jia, YQ, Yuan, ZW, Zhang, XS, Dong, JQ, Liu, XN, Peng, XT, et al. Los alcaloides totales de Sophora alopecuroides L. mejoraron la colitis murina mediante la regulación del metabolismo de los ácidos biliares y la microbiota intestinal. J Etnofarmacol. (2020) 255:112775. doi: 10.1016/j.jep.2020.112775
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Tian, AP, Xu, T, Liu, KY, Zou, QM, y Yan, X. Anti-helicobacter pylori efecto de alcaloides totales de Sophora alopecuroides in vivo. Chin Med J. (2014) 127:2484–91. doi: 10.3760/cma.j.issn.0366-6999.20140615
11. Li, H, Luo, WT, Chen, ZW, Zheng, WW, Xie, WY, Long, YQ, et al. Efectos de los alcaloides totales de Sophora alopecuroides sobre HSP70 en ratas con colitis ulcerosa. Laboratorio Med Clin. (2018) 15:3428–30. doi: 10.3969/j.issn.1672-9455.2018.22.030
12. Xie, MX. Efecto de Sophora alopecuroides L. sobre los parámetros de fermentación ruminal, la población microbiana ruminal y los índices fisiológico-bioquímicos sanguíneos del cordero mongol. Hohhot: Universidad Agrícola de Mongolia Interior (2018).
13. Abdela, N. Sub-acute ruminal acidosis (SARA) and its consequence in dairy cattle: a review of past and recent research at global prospective. Achiev Life Sci. (2016) 10:187–96. doi: 10.1016/j.als.2016.11.006
14. Bach, A, Iglesias, C, and Devant, M. Daily rumen pH pattern of loose-housed dairy cattle as affected by feeding pattern and live yeast supplementation. Anim Feed Sci Technol. (2007) 136:146–53. doi: 10.1016/j.anifeedsci.2006.09.011
15. Gu, XW, Zhao, GQ, Jin, XJ, and Guo, P. Effects of feeding herbal additives on dry matter intake and the ruminal environment in dairy cows. China Ganado lechero. (2010) 4:18–21. doi: 10.3969/j.issn.1004-4264.2010.04.009
16. Yang, DL, Tong, JJ, Zhang, J, Guo, Q, Guo, QH, Jiang, SL, et al. Efectos de la procianidina de semilla de uva sobre los parámetros de fermentación ruminal y microflora de vacas lecheras in vitro. Chin J Anim Nutr. (2018) 30:324–32. doi: 10.3969/j.issn.1006-267x.2018.02.037
17. Pablo, BRO, German, DMM, Gabriela, VS, Amada, IOS, José, FGS, Pedro, AHG, et al. Aditivo para piensos poliherbario para corderos: efectos sobre el rendimiento, la bioquímica de la sangre y la biometría. J Appl Anim Res. (2020) 48:419–24. doi: 10.1080/09712119.2020.1814786
18. Vera, N, Gutiérrez-Gómez, C, Williams, P, Allende, R, Fuentealba, C, and Ávila-Stagno, J. Comparing the effects of a pine (Pinus radiata D. Don) bark extract with a Quebracho (Schinopsis balansae Engl.) extract on methane production and in vitro rumen fermentation parameters. Animales. (2022) 12:1080. DOI: 10.3390/ANI12091080
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. An, YW, Yang, XD, Gao, ZX, Guo, SQ, Gao, AW, Yang, JL, et al. Efectos de la adición de Sophora alopecuroides a la dieta alta en granos sobre el crecimiento y los índices bioquímicos séricos de los corderos. Acta Agriculturae Zhejiangensis. (2022) 34:908–14. doi: 10.3969/j.issn.1004-1524.2022.05.04
20. Tian, K, Liu, JH, Sun, YW, Wu, YJ, Chen, JC, Zhang, RM, et al. Efectos de la suplementación dietética de inulina sobre la fermentación ruminal y la microbiota bacteriana, la respuesta inflamatoria y el rendimiento del crecimiento en novillos de carne de res de engorde alimentados con una dieta alta o baja en concentrados. Anim Feed Sci Technol. (2019) 258:114299. doi: 10.1016/j.anifeedsci.2019.114299
21. Wei, HY, Wang, XJ, Yan, Q, Jiang, CX, Ding, LM y Zhao, SN. Efecto del polvo superfino de astrágalo y antibióticos sobre la fermentación ruminal in vitro. J Domest Anim Ecol. (2020) 41:23–30. doi: 10.3969/j.issn.1673-1182.2020.07.005
22. Xu, W, Lin, L, Liu, A, Zhang, T, Zhang, S, Li, YH, et al. La L-teanina afecta la inmunidad de la mucosa intestinal mediante la regulación del metabolismo de los ácidos grasos de cadena corta bajo la alimentación con fibra dietética. Función de alimentos. (2020) 11:8369–79. doi: 10.1039/D0FO01069C
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Caporaso, JG, Lauber, CL, Walters, WA, Berg-Lyons, D, Lozupone, CA, Turnbaugh, PJ, et al. Patrones globales de diversidad de ARNr 16S a una profundidad de millones de secuencias por muestra. Proc Natl Acad Sci U S A. (2011) 108:4516–22. DOI: 10.1073/PNAS.1000080107
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. He, JJ, Wu, HK, Yang, XJ, Li, L, Zhao, GQ, Meng, QX, et al. Efectos de Clostridium butyricum sobre el rendimiento de crecimiento, bioquímica sérica, antioxidante, índices inmunes y número de microorganismos fecales de terneros. Chin J Anim Nutr. (2021) 33:5076–85. doi: 10.3969/j.issn.1006-267x.2021.09.028
25. Dai, JJ, Liao, CS, Tan, XW, Hu, JP, Huang, X y Gong, FY. Efectos de diferentes aditivos alimentarios en el rendimiento del crecimiento, la inmunidad y la salud intestinal de los pollos de engorde de plumas blancas. Alimentación de China. (2022) 9:146–50. doi: 10.15906/j.cnki.cn11-2975/s.20220928
26. Li, SF, Ma, T, Yang, JL, An, YW, Zhang, Y, Yang, XD, et al. Efectos de Sophora alopecuroides L. en la vía de señalización de la proteína quinasa activada por mitógenos c-Jun N-terminal / p38 y la expresión de proteínas de unión estrecha en epitelio ruminal de corderos de engorde alimentados con dieta alta en concentrados. Revista china de animales. Nutrición. (2022) 6:3940–52. doi: 10.3969/j.issn.1006-267x.2022.06.053
27. Liu, ZL. Regulation of different dietary concentrare-roughness ratio and yugular vein perfusion lipopolysacharide treatment on rumen microflora of dairy goats. Tai’an: Universidad Agrícola de Shandong (2020).
28. Zened, A, Combes, S, Cauquil, L, Mariette, J, Klopp, C, Bouchez, O, et al. La ecología microbiana del rumen evaluada por la pirosecuenciación 454 GS FLX se ve afectada por la suplementación de almidón y aceite de las dietas. FEMS Microbiol Ecol. (2013) 83:504–14. doi: 10.1111/1574-6941.12011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Karnati, SKR, Yu, Z, Sylvester, JT, Dehority, BA, Morrison, M, y Firkinset, JL. Nota técnica: amplificación específica por PCR de secuencias de ADNr protozoario 18S a partir de ADN extraído de muestras ruminales de vacas. J Anim Sci. (2003) 81:812–25. doi: 10.2527/2003.813812x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Li, H, Wang, Y, Gao, J, y Qi, ZL. Efectos del estrés por calor en la microbiota ruminal y su relación con el rendimiento de las vacas lecheras. Chin J Anim Nutr. (2019) 31:4458–63. doi: 10.3969/j.issn.1006-267x.2019.10.007
31. Zhou, Y, Zhang, MH, Liu, QX y Feng, JH. Las alteraciones de la microbiota traqueal y la inflamación causada por diferentes niveles de exposición al amoníaco en pollos de engorde. Poult Sci. (2020) 100:685–96. doi: 10.1016/j.psj.2020.11.026
32. Liu, SJ, Zhang, ZY, Hailemariam, S, Zheng, N, Wang, M, Zhao, SA, et al. Biochanin a inhibe las bacterias ruminales metabolizadoras de nitrógeno y alivia la descomposición de aminoácidos y urea in vitro. Animales. (2020) 10:368. DOI: 10.3390/ANI10030368
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Bermingham, EN, Maclean, P, Thomas, DG, Cave, NJ, y Young, W. Las familias bacterianas clave (Clostridiaceae, Erysipelotrichaceae y Bacteroidaceae) están relacionadas con la digestión de proteínas y energía en perros. PeerJ. (2017) 5:E3019. doi: 10.7717/peerj.3019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Wang, TY, Chen, HL, Lu, MY, Chen, YC, Sung, HM, Mao, CT, et al. Caracterización funcional de celulasas identificadas a partir del hongo ruminal vacuno Neocallimastix patriciarum W5 mediante análisis transcriptómicos y secretomos. Biotecnol Biocombustibles. (2011) 4:24. doi: 10.1186/1754-6834-4-24
35. Liu, H, Xu, T, Xu, S, Mao, L, and Zhao, X. Effect of dietary concentrate to forage ratio on growth, rumen fermentation and bacterial diversity of Tibetan sheep under barn feeding on Qinghai-Tibetan plateau. PeerJ. (2019) 7:E7462. doi: 10.7287/peerj.preprints.27807v2
36. Bi, YL, Zeng, SQ, Zhang, R, Diao, QY, and Tu, Y. Effects of dietary energy levels on rumen bacterial community composition in Holstein novillas under the same forage to concentrate ratio condition. BMC Microbiol. (2018) 18:69. DOI: 10.1186/S12866-018-1213-9
37. Ye, WX, Zhang, J, Li, N, Zhang, LL y Xu, XF. Efecto del fructooligosacárido sobre la flora de hongos ruminales de vacas lecheras mediante la tecnología de secuenciación de alto rendimiento ITS. J Yunnan Agric Univ (Nat Sci). (2019) 34:965–70. doi: 10.12101/j.issn.1004-390X(n).201903052
38. Wang, XG, Zhang, XL, Xu, TW, Geng, YY, Hu, LY, Zhao, N, et al. Efectos de los niveles de proteína dietética sobre la estructura y función de la comunidad fúngica ruminal en ovejas tibetanas. Acta Pratacul Sin. (2022) 31:182–91. doi: 10.11686/cyxb2020545
39. Tarayre, C, Bauwens, J, Brasseur, C, Mattéotti, C, Millet, C, Guiot, PA, et al. Aislamiento y cultivo de xilanolíticos y celulolíticos Sarocladium kiliense y Trichoderma virens del intestino de la termita Reticulitermes santonensis. Environ Sci Pollut Res Int. (2015) 22:4369–82. DOI: 10.1007/S11356-014-3681-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Li, HQ, Jia, JL, Hou, SZ, and Wei, T. Effects of different protein levels dietary on diversity and structure of rumen fungal community in small tail Han sheep lambs. Chin J Vet Sci. (2021) 41:2256–62. doi: 10.16303/j.cnki.1005-4545.2021.11.26
41. Han, XF, Li, BB, Wang, XL, Chen, YL y Yang, YX. Efecto de las proporciones de concentrado dietético a forraje en las poblaciones de hongos bacterianos ruminales y anaeróbicos de cabras de cachemira. Anaerobio. (2019) 59:118–25. doi: 10.1016/j.anaerobe.2019.06.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Peng, WW, Ma, ZJ, Wang, Y, Gao, F, y Xu, GS. Efectos de suplementos de diferentes proporciones de semillas de uva a dietas ruminales sobre la flora de hongos en ovejas Duolang. J Tarim Univ. (2020) 32:7–16. doi: 10.3969/j.issn.1009-0568.2020.04.002
43. Gruninger, RJ, Puniya, AK, Callaghan, TM, Edwards, JE, Youssef, N, Dagar, SS, et al. Hongos anaerobios (phylum neocallimastigomycota): avances en la comprensión de su taxonomía, ciclo de vida, ecología, papel y potencial biotecnológico. FEMS Microbiol Ecol (2015) 90: 1-17. doi: 10.1111/1574-6941.12383
44. Belanche, A, Doreau, M, Edwards, JE, Moorby, JM, Pinloche, E, y Newbold, CJ. Los cambios en la microbiota ruminal debido al tipo de carbohidrato y al nivel de proteína ingerida por el ganado lechero se asocian con cambios en la fermentación ruminal. J Nutr. (2012) 142:1684–92. DOI: 10.3945/JN.112.159574
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Wang, DD, Zhao, CC, Liu, SM, Zhang, T, Yao, JH y Cao, YC. Efectos de Piromyces sp. CN6 CGMCC 14449 sobre la calidad de la fermentación, la composición de nutrientes y la tasa de degradación in vitro del ensilaje de maíz de cultivo entero. AMB Express. (2019) 9:121. DOI: 10.1186/S13568-019-0846-X
46. Yang, HB, Liu, H, Zhan, JS, Li, M, y Zhao, GQ. Efectos de pellets dietéticos con diferentes proporciones concentrado-forraje sobre los parámetros de fermentación ruminal y la abundancia de microorganismos en terneros destetados. Acta Pratacul Sin. (2015) 24:131–8. doi: 10.11686/cyxb2015022
47. Zhu, CS, Mao, SY, Sun, YZ, y Zhu, WY. Cribado de hongos anaeróbicos y su modificación del medio para la producción de xilanasa. Microbiol China. (2004) 31:11–5. doi: 10.13344/j.microbiol.china.2004.03.003
48. Dagar, SS, Kumar, S, Mudgil, P, and Puniya, KM. Evaluación comparativa de actividades lignocelulolíticas de cultivos filamentosos de hongos anaerobios monocéntricos y policéntricos. Anaerobio. (2018) 50:76–9. doi: 10.1016/j.anaerobe.2018.02.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Hijo, HF, Lee, SM, y Kim, KJ. Estructura cristalina y caracterización bioquímica de la xilosa isomerasa de piromyces sp. E2. J Microbiol Biotechnol. (2018) 28:571–8. doi: 10.4014/jmb.1711.11026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Sophora alopecuroides, dieta alta en concentrados, fermentación ruminal, bacterias ruminales, hongos ruminales, corderos
Cita: An Y, Wang H, Zong Z, Gao Z, Shi C, Li S y Khas-Erdene (2023) Efectos de agregar Sophora alopecuroides a la dieta alta en concentrados sobre los parámetros de fermentación ruminal y la diversidad microbiana de las ovejas. Frente. Vet. Sci. 10:1200272. doi: 10.3389/fvets.2023.1200272
Recibido: 04 Abril 2023; Aprobado: 21 de julio de 2023;
Publicado: 07 agosto 2023.
Editado por:
Vivian Fischer, Universidad Federal de Rio Grande do Sul, Brasil
Revisado por:
Zhiyuan Ma, Universidad de Lanzhou, China
Halima Sultana, Universidad de Florida, Estados Unidos
Derechos de autor © 2023 An, Wang, Zong, Gao, Shi, Li y Khas-Erdene. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Hairong Wang, wanghairong97@163.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía